Похідні бензолсульфонамідів, спосіб їх одержання і їх застосування для лікування запальних захворювань та вгамування болю
Номер патенту: 83821
Опубліковано: 26.08.2008
Автори: Барт Мартен, Тома Дідьє, Люккаріні Жан-Мішель, Додей П'єр, Бонду Мішель, Массардьє Крістін
Формула / Реферат
1. Похідна бензолсульфонаміду, яка відрізняється тим, що вибрана з групи, яка складається з:
а) сполук формули:
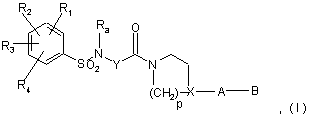
де:
кожний з радикалів R1, R2, R3, R4 незалежно являє собою один або декілька атомів або груп атомів, вибраних з атома водню, атомів галогенів, С1-С3 алкільних груп, С1-С3 алкоксильних груп, CF3 або OCF3 груп,
Ra являє собою С1-С4 алкільну групу,
Y являє собою насичену С2-С5 алкіленову групу, у ланцюг якої може бути включений атом кисню, ненасичену С2-С4 алкіленову групу або -CH2-CO-NH-CH2-групу,
X являє собою СН-групу або атом азоту,
р дорівнює 2 або 3,
А являє собою одинарний зв'язок, атом азоту, що може бути заміщений метильною групою, або лінійну або розгалужену С1-С5 алкіленову групу, що може бути гідроксильована, або в якій один з атомів вуглецю окислений до кетонової групи, за умови, що А і X не є одночасно атомами азоту, В являє собою азотовмісний гетероцикл або аміногрупу, що може бути заміщена однією або двома С1-С4 алкільними групами,
б) кислотних адитивних солей сполук формули І.
2. Похідна за п. 1, яка відрізняється тим, що Y являє собою С3-С5 алкіленову групу, у ланцюг якої включений атом кисню, переважно -СН2-СН2-О-СН2-групу.
3. Похідна за пп. 1 або 2, яка відрізняється тим, що R2 і R3 являють собою метильні групи в положенні 2,6 ароматичного кільця.
4. Спосіб одержання похідної бензолсульфонаміду формули І, охарактеризованої в п. 1, і її адитивних солей, в якому проводять:
а) реакцію кислоти формули:
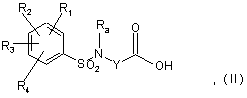
де кожний з радикалів R1, R2, R3, R4 незалежно являє собою один або декілька атомів або груп атомів, вибраних з атома водню, атомів галогенів, С1-С3 алкільних груп, С1-С3 алкоксильних груп, CF3 або OCF3 груп,
Ra являє собою С1-С4алкільну групу,
Y являє собою насичену С2-С5 алкіленову групу, у ланцюг якої може бути включений атом кисню, ненасичену С2-С4 алкіленову групу або -CH2-CO-NH-CH2-групу,
з азотовмісним гетероциклом формули:
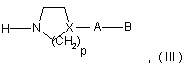
де:
X являє собою СН або атом азоту,
р дорівнює 2 або 3,
А являє собою одинарний зв'язок, атом азоту, що може бути заміщений метильною групою, за умови, що X не є атомом азоту, або лінійну або розгалужену С1-С5 алкіленову групу, що може бути гідроксильована, або в якій один з атомів вуглецю окислений до кетонової групи,
В являє собою азотовмісний гетероцикл або аміногрупу, що може бути заміщена однією або двома С1-С4 алкільними групами, за умови, що, якщо є незаміщений атом азоту, цей атом азоту захищений амінозахисною групою,
у розчиннику, в присутності активаторів, при температурі в діапазоні між температурою навколишнього середовища і температурою кипіння розчинника, протягом приблизно 2-15 годин, з одержанням аміду формули:

де R1, R2, R3, R4, Ra, Y, p, X, А і В мають такі ж значення, як і у вихідних продуктів,
б) при необхідності, видалення амінозахисних груп,
в) при необхідності, одержання адитивної солі з мінеральною або органічною кислотою сполуки формули І.
5. Спосіб одержання похідної бензолсульфонаміду формули І, охарактеризованої в п. 1, і її адитивних солей, в якому проводять:
а) реакцію кислоти формули:

де:
кожний з радикалів R1, R2, R3, R4 незалежно являє собою атом водню або атом галогену, С1-С3 алкільну групу, С1-С3 алкоксильну групу, CF3 aбo OCF3 групу,
Ra являє собою С1-С4 алкільну групу,
Y являє собою насичену С2-С5 алкіленову групу, у ланцюг якої може бути включений атом кисню, ненасичену С2-С4 алкіленову групу або -CH2-CO-NH-CH2-групу, з хлоруючим агентом,
з одержанням хлорангідриду кислоти формули:
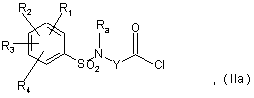
де R1, R2, R3, R4, Ra і Y мають ті ж значення, що й у вихідній сполуці,
б) реакцію хлорангідриду кислоти формули ІІа з аміном формули III, визначеної в п. 4, з одержанням сполуки формули І,
в) при необхідності, одержання адитивної солі з мінеральною або органічною кислотою сполуки формули І.
6. Спосіб одержання похідної бензолсульфонаміду формули І, охарактеризованої в п. 1, та її адитивних солей, в якому проводять:
а) реакцію кислотної сполуки формули:
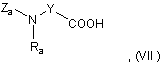
де Ra являє собою С1-С4 алкільну групу,
Y являє собою насичену С2-С5 алкіленову групу, у ланцюг якої може бути включений атом кисню, a Za являє собою амінозахисну групу, з азотовмісним гетероциклом формули:

де:
X являє собою СН або атом азоту,
р дорівнює 2 або 3,
А являє собою одинарний зв'язок, атом азоту, що може бути заміщений метильною групою, за умови, що X не є атомом азоту, або лінійну або розгалужену С1-С5 алкіленову групу, що може бути гідроксильована, або у якій один з атомів вуглецю окислений до кетонової групи,
В являє собою азотовмісний гетероцикл або аміногрупу, що може бути заміщена однією або двома С1-С4 алкільними групами, за умови, що, якщо є незаміщений атом азоту, цей атом азоту захищений амінозахисною групою, що відрізняється від амінозахисної групи, використаної для захисту кислотної сполуки VII, у розчиннику, у присутності активаторів, при температурі, як правило, в межах між температурою навколишнього середовища і температурою кипіння розчинника, протягом приблизно 2-15 годин, з одержанням аміду формули:
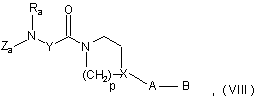
де Za, Ra, Y, p, X, А і В мають такі ж значення, як у вихідних сполуках,
б) видалення амінозахисної групи Za з одержанням вторинного аміну формули:
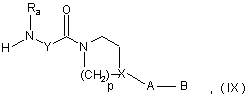
де Ra, Y, р, X, А і В мають такі ж значення, як у попередній сполуці,
в) реакцію отриманого вторинного аміну формули IX з бензолсульфонілхлоридом формули:
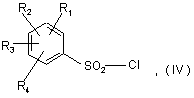
де кожний з радикалів R1, R2, R3, R4 незалежно являє собою атом водню або галогену, С1-С3 алкільну групу або С1-С3 алкоксигрупу, CF3 або OCF3 групу,
у розчиннику, у присутності апротонної органічної основи, при температурі в межах між приблизно 0 і 50°С, протягом приблизно 1-3 годин, з одержанням сульфонаміду формули:

де R1, R2, R3, R4, Ra, Y, p, X, А і В мають такі ж значення, як у вихідних сполуках,
г) якщо необхідно, видалення амінозахисних груп,
д) якщо необхідно, одержання адитивної солі з мінеральною або органічною кислотою похідної формули І.
7. Терапевтична композиція, яка відрізняється тим, що містить щонайменше одну похідну бензолсульфонаміду формули І, охарактеризовану в будь-якому з пп. 1-3, або щонайменше одну з її фармацевтично прийнятних кислотних адитивних солей, у комбінації щонайменше з одним фізіологічно прийнятним наповнювачем.
8. Застосування похідної бензолсульфонаміду формули І, охарактеризованої в будь-якому з пп. 1-3, або однієї з його фармацевтично прийнятних кислотних адитивних солей для приготування лікарського засобу, призначеного для лікування болю.
9. Застосування похідної бензолсульфонаміду формули І, охарактеризованої в будь-якому з пп. 1-3, або однієї з її фармацевтично прийнятних кислотних адитивних солей для приготування лікарського засобу, призначеного для лікування запальних захворювань.
Текст
1. Похідна бензолсульфонаміду, яка відрізняється тим, що вибрана з групи, яка складається з: а) сполук формули: C2 2 (19) 1 3 N H A X (CH2 ) p 83821 B , ( III ) де: X являє собою СН або атом азоту, р дорівнює 2 або 3, А являє собою одинарний зв'язок, атом азоту, що може бути заміщений метильною групою, за умови, що X не є атомом азоту, або лінійну або розгалужену С 1-С5 алкіленову гр уп у, що може бути гідроксильована, або в якій один з атомів вуглецю окислений до кетонової групи, В явля є собою азо то вмісни й ге теро цикл або аміногр уп у, що може бути замі щена одні єю або двома С1-С4 алкільними гр упами, за умо ви, що, якщо є незаміщений атом азоту, цей атом азоту захищений амінозахисною групою, у розчиннику, в присутності активаторів, при температурі в діапазоні між температурою навколишнього середовища і температурою кипіння розчинника, протягом приблизно 2-15 годин, з одержанням аміду формули: R2 R1 Ra R3 O N S O2 Y N R4 (CH2) X p A B , (I) де R 1 , R 2 , R 3 , R 4 , R a, Y, p , X, А і В ма ють такі ж зна че ння , як і у ви хідн и х продуктів, б) при необхідності, видалення амінозахисних груп, в) при необхідності, одержання адитивної солі з мінеральною або органічною кислотою сполуки формули І. 5 . С по сі б о держ ан ня по хі дн о ї бе нз о л суль фо н ам і ду фо р м ули І, охарактеризованої в п.1, і її адитивних солей, в якому проводять: а) реакцію кислоти формули: R2 R1 Ra R3 O N S O2 Y OH R4 R1 Ra R3 N SO2 Y R4 б) реакцію хлорангідриду кислоти формули ІІа з аміном формули III, визначеної в п.4, з одержанням сполуки формули І, в) при необхідності, одержання адитивної солі з мінеральною або органічною кислотою сполуки формули І. 6. Спосіб одержання похідної бензолсульфонаміду формули І, о характеризованої в п.1, та її адитивних солей, в якому проводять: а) реакцію кислотної сполуки формули: Za O Cl , ( IIa ) де R1, R2, R3, R4, Ra і Y мають ті ж значення, що й у вихідній сполуці, Y N COOH Ra , (VII ) де Ra являє собою С 1-С4 алкільну групу, Y являє собою насичену С2-С5 алкіленову групу, у ланцюг якої може бути включений атом кисню, a Za являє собою амінозахисну гр уп у, з азотовмісним гетероциклом формули: H N X (CH 2) A B p , ( III ) де: X являє собою СН або атом азоту, р дорівнює 2 або 3, А являє собою одинарний зв'язок, атом азоту, що може бути заміщений метильною групою, за умови, що X не є атомом азоту, або лінійну або розгалужену С 1-С 5 алкіленову гр упу, що може бути гідроксильована, або у якій один з атомів вуглецю окислений до кетонової групи, В явля є собою азо то вмісни й ге теро цикл або аміногр уп у, що може бути заміщена однією або двома С1-С4 алкільними групами, за умови, що, якщо є незаміщений атом азоту, цей атом азоту захищений амінозахисною групою, що відрізняється від амінозахисної групи, використаної для захисту кислотної сполуки VII, у розчиннику, у присутності активаторів, при температурі, як правило, в межах між температурою навколишнього середовища і температурою кипіння розчинника, протягом приблизно 2-15 годин, з одержанням аміду формули: Ra , ( II ) де: кожний з радикалів R1, R2, R 3, R4 незалежно являє собою атом водню або атом галогену, С1-С3 алкільну групу, С1-С3 алкоксильну групу, CF3 aбo OCF3 гр упу, Ra являє собою С1-С4 алкільну групу, Y являє собою насичену С2-С5 алкіленову групу, у ланцюг якої може бути включений атом кисню, ненасичену С2-С4 алкіленову групу або -CH2-CO-NHCH2-групу, з хлоруючим агентом, з одержанням хлорангідриду кислоти формули: R2 4 Za N O Y N (CH2 ) X p A B , ( VIII ) де Za, Ra, Y, p, X, А і В мають такі ж значення, як у вихідних сполуках, б) видалення амінозахисної гр упи Z a з одержанням вторинного аміну формули: Ra H N O Y N (CH2 ) X p A B , ( IX ) де Ra, Y, р, X, А і В мають такі ж значення, як у попередній сполуці, в) реакцію отриманого вторинного аміну формули IX з бензолсульфонілхлоридом формули: 5 R2 83821 R1 R3 SO2 Cl , ( IV ) R4 де кожний з радикалів R1, R2, R3, R4 незалежно являє собою атом водню або галогену, С1-С3 алкільну гр уп у або С 1-С3 алкоксигруп у, CF 3 або OC F3 груп у, у розчиннику, у присутності апротонної органічної основи, при температурі в межах між приблизно 0 і 50°С, протягом приблизно 1-3 годин, з одержанням сульфонаміду формули: R2 R1 Ra R3 N S O2 Y R4 O N (CH2) X p A B , (I) де R 1 , R 2 , R 3 , R 4 , R a , Y, p , X, А і В ма ють такі ж зн аченн я , як у ви хідни х сполуках, г) якщо необхідно, видалення амінозахисних гр уп, Даний винахід відноситься до нових сполук бензолсульфонамідного типу, способу їхнього одержання і їхнього застосування для одержання фармацевтичних композицій. Ці нові сполуки можуть мати терапевтичне застосування, зокрема, для лікування болю. В даний час відомі сполуки, структура яких містить у собі груп у бензолсульфонамідного типу. Наприклад, базуючись на [EP 236 163 і EP 236 164], можна згадати похідні N-αарилсульфоніламіноацил-пара-амідино-фенілаланінаміду, що є виборчими інгібіторами тромбіну і можуть бути використані як антитромботичні засоби. Також, з [EP 614 911] відомі сполуки, що мають структур у, досить близьку до структури ви щезгаданих сполук, яка одночасно містить арилсульфамоїльну гр упу і заміщену феніламідинову гр упу, що мають здатність до зв'язування з рецепторами нейропептиду Y і можуть бути використані для лікування гіпертонії, стенокардії, атеросклерозу, депресії, тривожних станів, запалення, алергії або ожиріння. В [EP 558 961] також пропонується використовувати сполуки заміщених амінокислот арилсульфонамідного типу для лікування тромбозу на основі їх антикоагулянтних властивостей. Дослідження антитромботичних властивостей сполук, що містять у своїй стр уктурі арилсульфонамідну груп у і феніламідинову гр упу, також опубліковані [в журналі Pharmazie, 1984, том 39 (5), сторінки 315-317, і в журналі Pharmazie, 1986, том 41 (4), сторінки 233-235]. У тій же області фармакологічної активності в заявці [WO 92/16549 А1] описані похідні фенілаланіну, що містять арилсульфонамідну групу, що є інгібіторами протеїнази, більш конкретно - інгібіторами тромбіну. Також, з [WO 97/25315], відомі сполуки, що мають структуру N-(арилсульфоніл)амінокислоти, 6 д) якщо необхідно, одержання адитивної солі з мінеральною або органічною кислотою похідної формули І. 7. Терапевтична композиція, яка відрізняється тим, що містить щонайменше одну по хідну бензолсуль фонаміду формули І, о характеризовану в будь-якому з пп.1-3 , а бо щона ймен ше одн у з її фа рма це вти чн о п рий ня тни х к исло тни х а ди тивн и х солей, у комбінації щонайменше з одним фізіологічно прийнятним наповнювачем. 8. Застосування похідної бензолсульфонаміду формули І, о характеризованої в будь-яком у з пп .1 -3 , або о дні єї з й о го фарма це втично пр ий ня тни х ки сло тни х адитивних солей для приготування лікарського засобу, призначеного для лікування болю. 9. Застосування похідної бензолсульфонаміду формули І, охарактеризованої в будь-яком у з пп .1 -3 , а бо о дні єї з її фармаце втичн о при йнятни х ки сло тни х адитивних солей для приготування лікарського засобу, призначеного для лікування запальних захворювань. що можуть бути використані для лікування запальних захворювань. Серед публікацій попереднього рівня техніки, що пропонують структурні елементи арилсульфонамідного типу, можна вказати [WO 96/40639, WO 97/24349, WO 98/03503, WO 98/24783 і WO 99/00387], що відносяться до сполук-антагоністів Bi-рецептора брадикініну. Сполуки-антагоністи Biрецептора брадикініну, пептидні або не пептидні, відомі також з публікацій [WO 01/05783, WO 02/099388 і WO 97/09346]. Винахід відноситься до нових сполук, що містять заміщену бензолсульфонамідний ланцюг; вищевказані сполуки особливо добре підходять для використання як активні інгредієнти в лікарських засобах, призначених для лікування болю, більш конкретно - для лікування гіпералгезії і великої алгезії. Згідно з даним винаходом, як новий промисловий продукт пропонуються сполуки бензолсульфонамідного типу, що характеризуються тим, що вони обрані з групи, яка складається з: а) сполук формули: l у якій: кожний з радикалів R1, R2, R3, R4 незалежно являє собою один або кілька атомів або груп атомів, обраних з атома водню, атомів галогенів, С1С3 алкільних груп, C1-С3 алкоксильних груп, CF3 або OCF3 гр уп, R3 являє собою C1-C4 алкільну груп у, Y являє собою насичену C2-C5 алкіленову гр упу, у ланцюг якої може бути включений атом кисню, ненасичену C2-C4 алкіленову гр упу або CH2CO-NH-CH2-групу, 7 83821 X являє собою СН-груп у або атом азоту, р дорівнює 2 або 3, А являє собою одинарний зв'язок, атом азоту, що може бути заміщений метильною групою, або лінійну або розгалужену C1-C5 алкіленову гр упу, що може бути гідроксильована, або в якій один з атомів вуглецю окислений до кетонової групи, за умови, що А і X не є одночасно атомами азоту. В являє собою азотвмісний гетероцикл або аміногрупу, що може бути заміщена однією або двома C1-C4 алкільними групами, б) кислотних адитивних солей сполук з вищевказаною формулою І. Якщо сполуки формули І мають центр асиметрії, винахід також відноситься до всіх оптичних ізомерів, чистих або у ви гляді сумішей, і до відповідних їхніх солей або сумішей солей. Відповідно до винаходу пропонується також спосіб одержання сполук формули І і їх адитивних солей. Також пропонується застосування речовини, обраної з сполук формули І і їх нетоксичних адитивних солей, для одержання лікарського засобу, що може бути використаний для лікування людей або тварин, і який призначений для профілактики або лікування патологій, зв'язаних з болем, більш конкретно-гіпералгезією, що є наслідком запального стану, або важкої алгезії, зв'язаної з іншими патологічними станами, наприклад - такими, як рак. Дані, що підтверджують можливість здійснення винаходу У формулі І під алкільною групою розуміють лінійний, розгалужений або циклічний вуглеводневий ланцюг. C1-C3 алкільна група є, насамперед, метильною, етильною, пропільною, циклопропільною або 1-метилетильною групою. С1-С4 алкільна група, крім наведених вище прикладів, включає, насамперед, бутильну, 1-метилпропільну і 1,1диметилетильну групи. Під С1-С3 алкоксильною групою мають на увазі OR груп у, у якій R є С1-С3 алкільною групою, при цьому термін «алкіл» має значення, зазначене вище. Вищевказаною групою є, наприклад, метокси-, етокси-, пропокси- або 1-метилетоксигрупа. Під насиченою C2-C5 алкіленовою групою розуміють -(СН2)n- групу, у якій п дорівнює 2, 3, 4 або 5, якщо вона є лінійною групою, або, наприклад, СН(СН3)-СН2-CH2- або -С(СН3)2-СН2- групу, якщо вона є розгалуженою групою. Під алкіленовою групою, у ланцюг якої включений атом кисню, розуміють, наприклад, групи -CH2-CH2-O-CH2-, -CH2O-CH2-CH2-, або навіть -CH2-CH2-O-CH2-CH2-. Під ненасиченою C2-C4 алкіленовою групою розуміють груп у, що містить 2-4 атома вуглецю, з яких 2 послідовних атоми зв'язані етиленовим зв'язком, наприклад - групи -CH2-CH=CH-CH2-, -CH=CH-CH2, -СН=С(СН3)-СН2- або -CH=CH-CH(CH3)-. Під атомом галогену мають на увазі атом фтору, хлор у або брому, і переважно - атом фтор у або хлору. Під алкіламіно- або діалкіламіногрупами мають на увазі NH(R) або N(R)2 групи, у яких R є C1C4 алкільною групою, а термін «алкіл» має значення, зазначене вище. 8 Під азотвмісним гетероциклом насамперед мають на увазі азетидинове, піролидинове, морфолінове, піперидинове, піперазинове, N-(C1С4)алкілпіперидинове, N-(С1-С4)алкілпіперазинове, хінуклідинове, тропанове, N-(C1С4)алкілгомопіперазинове, амінопіридинове і N(C1-С4)алкілімідузольне кільце. Під адитивними солями розуміють солі, отримані за допомогою реакції сполуки формули І, що містить, принаймні, одну основну функціональну груп у, у його несольовій формі з мінеральною або органічною кислотою. Переважно ці адитивні солі є фармацевтично прийнятними. Серед мінеральних кислот, придатних для утворення солі основної сполуки формули І, перевага віддається хлористоводневій, бромистоводневій, фосфорній і сірчаній кислотам. Серед органічних кислот, придатних для одержання солі основної сполуки формули І, перевага віддається метансульфокислоті, бензолсульфокислоті, толуолсульфокислоті, малеїновій, фумаровій, щавлевій, лимонній, винній, молочній і трифтороцтовій кислоті. Серед сполук формули І перевага віддається таким сполукам, що задовольняють, принаймні, одній з наступних умов: R1 являє собою атом водню, атом галогену, С1-С3 алкільну груп у або С 1-С3 алкоксильну груп у; R2 являє собою атом галогену, С1-С3 алкільну груп у або CF3 груп у; R3 являє собою атом водню, атом галогену, С1-С3 алкільну груп у або С 1-С3 алкоксильну груп у; R4 являє собою атом водню або С1-С3 алкільну гр уп у; R3 являє собою метильну груп у; Y являє собою насичену C2-C5 алкіленову гр упу, у ланцюг якої може бути включений атом кисню; р дорівнює 2; А являє собою одинарний зв'язок або лінійну або розгалужену C1-C5 алкіленову гр уп у; В являє собою азетидинільну, піролідинільну, морфолінільну, піперидинільну, піперазинільну, N(С1-C4)алкіл піперидинільну, N-(С1С4)алкілпіперазинільну, хінуклідинільну, тропанільну, N-(С1-С4)алкілгомопіперазинільну гр упу. Особлива перевага віддається сполукам формули І, що задовольняють, принаймні, одній з наступних умов: R1 являє собою С 1-С3 алкоксильну груп у; кожний з R2 і R3 являє собою С1-С3 алкільну груп у, переважно - метильну групу в положені 2,6 на ароматичному кільці; R4 являє собою атом водню; Y являє собою C3-Cs алкіленову груп у, у ланцюг якої включений атом кисню, переважно –СН2СН2-О-СН2-групу; В являє собою піперидинільну, N-(C1С4)алкілпіперидинільну або N-(C1С4)алкілпіперазинільну груп у. Перевага віддається сполукам формули Ia: 9 83821 Ia 10 ню, ненасичену C2-C4 алкіленову гр упу або CH2CO-NH-CH2-групу, з азотвмісним гетероциклом формули: III у якій: кожний з радикалів R1, R2, R3 незалежно являє собою один або кілька атомів або груп атомів, обраних з атома водню, атомів галогенів, С1-С3 алкільних груп, C1-C 3 алкоксильних гр уп, CF3 або OCF3 груп, Y являє собою насичену C2-C5 алкіленову гр упу, у ланцюг якої може бути включений атом кисню, ненасичену C2-C4 алкіленову гр упу або CH2CO-NH-CH2-групу, А являє собою одинарний зв'язок або -(СН2)mгруп у, R являє собою насичений азотвмісний гетероцикл, переважно обраний з піролідинового, морфолінового, піперидинового, хінуклідинового, тропанового кілець, або третинну аміногрупу, переважно -діалкіламіногрупу, m і р незалежно рівні 2 або 3. Перевага також віддається сполукам формули Ib: Ib у якій: кожний з радикалів R1, R2, R3 незалежно являє собою один або кілька атомів або груп атомів, обраних з атома водню, атомів галогенів, С1-С3 алкільних груп, С1-С 3 алкоксильних гр уп, CF3 або OCF3 груп, Y являє собою насичену C2-C5 алкіленову гр упу, у ланцюг якої може бути включений атом кисню, ненасичену C2-C4 алкіленову гр упу або CH2CO-NH-CH2-групу, А являє собою одинарний зв'язок або насичену C1-C5 алкіленову гр упу, що може бути гідроксильована, R являє собою насичений азотвмісний гетероцикл, переважно обраний з Nметилпіперазинового, N-метилпіперидинового кілець, або третинну аміногрупу, переважно - діалкіламіногрупу. Згідно із запропонованим винаходом, пропонується загальний спосіб одержання сполук формули І або їх адитивни х солей, що включає: а) реакцію кислоти формули: II у якій кожний з радикалів R1, R2, R3, R4 незалежно являє собою один або кілька атомів або груп атомів, обраних з атома водню, атомів галогенів, С1С3 алкільних груп, С1-С3 алкоксильних груп, CF3 або OCF3 гр уп, Ra являє собою C1-C4 алкільну груп у, Y являє собою насичену C2-C5 алкіленову гр упу, у ланцюг якої може бути включений атом кис у якій X являє собою CH або атом азоту, р дорівнює 2 або 3, А являє собою одинарний зв'язок, атом азоту, що може бути заміщений метильною групою (якщо X не є також атомом азоту) або лінійну або розгалужену C1-C5 алкіленову груп у, що може бути гідроксильована, або в якій один з атомів вуглецю окислений до кетонової групи, В являє собою азотвмісний гетероцикл або аміногрупу, що може бути заміщена однією або двома C1-C4 алкільними групами, за умови, що якщо є незаміщений атом азоту, цей атом азоту захищений аміно-захисною групою, такою як, наприклад, Вос-група (1,1-диметилетокси карбоніл) або Cbz-групa (фенілметоксикарбоніл), у розчиннику, наприклад, такому як тетрагідрофуран, дихлорметан або диметилформамід, у присутності активаторів, таких як EDCI (1-(3диметиламінопропіл)-3-етилкарбодіімід), DIC (діізопропілкарбодіімід) або HOAT (1-гідрокси-7азабензотриазол), при температурі, у загальному випадку в діапазоні між температурою навколишнього середовища і температурою кипіння розчинника, протягом приблизно 2-15 годин, з одержанням аміду формули: І у якій R1, R2, R3, R4, Ra, Y, р, X, А і В мають такі ж значення, як і у ви хідних продуктів, б) при необхідності - видалення амінозахисних груп, наприклад - під дією трифтороцтовою кислоти в присутності анізолу, якщо вищевказана аміно-захисна група є Вос-групою, або за допомогою каталітичної гідрогенізації, якщо захисна група є Cbz-гр упою, в) при необхідності - одержання адитивної солі з мінеральною або органічною кислотою сполуки формули І з використанням стандартних методів, відомих фа хівцям у даній області техніки. Цей загальний спосіб одержання аміду, з використанням як вихідних речовин карбонової кислоти й аміну, можна модифікувати за рахунок використання активаторів, іммобілізованих на нерозчинній смолі, наприклад - на смолах, що мають полістирольну основу, що несе карбодіімідні функціональні групи. Як варіант описаного вище загального способу кислоту формули Il можна перетворити в її хлорангідрид формули lla, ІІа переважно шляхом взаємодії з хлоруючим агентом, таким як оксалілхлорид або тіонілхлорид, 11 83821 а потім провести реакцію отриманого хлорангідриду з азотвмісним гетероциклом формули III, використовуючи стандартну реакцію, яку проводять в розчиннику і, переважно, у присутності апротонної органічної основи, наприклад, такої як триетиламін або піридин, з одержанням сполуки формули І. Кислоти формули II, у якій Y означает-СН2СН2-О-СН2- груп у, можуть бути отримані способом, що включає в себе: а) реакцію бензолсульфонілхлориду формули: IV у якій кожний з радикалів R1, R2, R3 і R4 незалежно являє собою атом водню або атом галогену, С1-С3 алкільну групу, С1-С3 алкоксильну групу, CF3 або OCF3 груп у, з аміноспиртом формули HN(Ra)-CH2-CH2-OH у якій R3 являє собою C1-C4 алкільну груп у, у розчиннику, наприклад, у такому як дихлорметан, у присутності апротонної органічної основи, наприклад, такої як триетиламін або піридин, протягом приблизно 1-3 годин з одержанням сульфонаміду формули: V у якій R1, R2, R3, R4 і Ra мають такі ж значення, як і у ви хідних продуктів, б) реакцію отриманої сполуки формули V з ефіром бромоцтової кислоти, переважно - із третбутиловим ефіром, у присутності основи, такої як, наприклад, гідроксид натрію, і в середовищі, що сприяє фазовому переходу, що містить солі четвертинного амонію, у суміші розчинників, таких як вода і толуол, при температурі, що лежить у діапазоні між приблизно 0°C і 40°C, протягом приблизно 1-5 годин з одержанням ефіру формули: VI в) гідроліз ефіру формули Vl, наприклад, шляхом взаємодії з трифтороцтовою кислотою, у розчиннику, такому як дихлорметан, при температурі, що лежить у діапазоні між приблизно 0°C і 50°C, протягом приблизно 1-6 годин з одержанням кислоти формули II: II у якій R1, R2, R3, R4 і Ra мають такі ж значення, як і у ви хідних продуктів, a Y означає -CH2-CH2-OCH2- груп у. Як варіант загального способу сполуки формули І можуть бути отримані способом, що включає: а) реакцію кислотної сполуки формули: 12 VII у якій R3 являє собою C1-C4 алкільну груп у, Y являє собою насичену C2-C5 алкіленову гр упу, у ланцюг якої може бути включений атом кисню, a Za являє собою аміно-захисну гр упу, таку як, наприклад, бензильна група, с азотвмісним гетероциклом формули: III у якій X являє собою CH або атом азоту, р дорівнює 2 або 3, А являє собою одинарний зв'язок, атом азоту, що може бути заміщений метильною групою (якщо X не є також атомом азоту), або лінійну або розгалужену C1-C5 алкіленову груп у, що може бути гідроксильована, або у якій один з атомів вуглецю окислений до кетонової групи, В являє собою азотвмісний гетероцикл або аміногрупу, що може бути заміщена однією або двома C1-C4 алкільними групами, за умови, що, якщо є незаміщений атом азоту, цей атом азоту повинний бути захищений іншою аміно-захисною групою, тобто такою, що відрізняється від амінозахисної групи, яку використовують для кислотної сполуки VII, наприклад - Вос-групою (1,1диметилетоксикарбонілом), у розчиннику, наприклад, у такому, як тетрагідрофуран або дихлорметан, або диметилформамід, у присутності активаторів, наприклад, таких, як EDCI (1-(3-диметиламінопропіл)-3етилкарбодіімід), DIC (діізопропілкарбодіімід) або HOAT (1-гідрокси-7-азабензотриазол), при температурі, у типовому випадку, яка знаходиться в проміжку між температурою навколишнього середовища і температурою кипіння розчинника, протягом приблизно 2-15 годин, з одержанням аміду формули: VIII у якій Za, Ra, Y, р, X, А і В мають такі ж значення, як у вихідних сполуках, б) видалення аміно-захисної групи Za, наприклад, за допомогою каталітичної гідрогенізації, якщо Za є бензильною групою, з одержанням вторинного аміну формули: IX у якій Ra, Y, р, X, А і В мають такі ж значення, як і в попередній сполуці, в) реакцію отриманого вторинного аміну IX з бензолсульфонілхлоридом формули: IV у якій кожний з радикалів R1, R2, R3, R4 незалежно являє собою атом водню або атом галоге 13 83821 ну, C1-C 3 алкільну гр упу або C1-C3 алкоксильну груп у, CF3 або OCF3 гр уп у, у розчиннику, наприклад, такому як дихлорметан, у присутності апротонної органічної основи, наприклад, такої, як триетиламін або піридин, при температурі, що знаходиться в проміжку між приблизно 0°C і 50°C, протягом приблизно 1-3 годин, з одержанням сульфонаміду формули: I у якій R1, R2, R3, R4, Ra, Y, р, X, А і В мають такі ж значення, як і у ви хідних сполуках, г) якщо необхідно, видалення аміно-захисної групи, наприклад, шляхом взаємодії з трифтороцтовою кислотою в присутності анізолу, якщо вищевказана аміно-захисна група є Вос-групою, д) якщо необхідно, одержання адитивної солі з мінеральною або органічною кислотою сполуки формули І. Як варіант вищевказаного способу стадію а) з утворенням амідного зв'язку можна провести, спочатку одержавши хлорангідрид кислоти формули VII, наприклад, шляхом взаємодії з оксалілхлоридом або тіонілхлоридом у безводному апротонному розчиннику, з наступною реакцією отриманого хлорангідриду кислоти з аміном формули III, як описано вище, у розчиннику і, наприклад, у присутності апротонного розчинника, такого як триетиламін. Гетероциклічні похідні формули III є добре відомими сполуками, що є в продажі або описаними в літературі, або їх можна одержати з використанням способів, відомих фахівцям у даній області техніки, наприклад - за допомогою реакції відновного амінування між піперазином або гомопіперазином і кетоном, наприклад, у присутності ізопропоксиду титану, з подальшою реакцією з відновником, таким як ціаноборгідрид натрію, або, якщо використовуються похідні піперидину, за допомогою каталітичного гідрування гомологічних піридинових сполук. Винахід буде більш зрозумілим на основі прикладів одержання сполук і результатів фармакологічних іспитів, що демонструють терапевтичне застосування цих сполук. Ці приклади не є обмежуючими, і їх не можна інтерпретувати як обмежуючий обсяг винаходу. Серед абревіатур, використаних в описі винаходу,г означає «моль», мМ означає «мілімоль» (10-3моля).ТГФ означає «тетрагідрофуран», ДХМ означає «дихлорметан», ДМФ означає «диметилформамід», ТФОК означає «трифтороцтова кислота». Для сполук, що мають центр асиметрії, відсутність якої-небудь особливої вказівки означає, що сполука знаходиться у формі рацемичної суміші. У спектральних даних ядерного магнітного резонансу хімічні зрушення зазначені відносно ТУС (тетраметилсилану). Препарат I N-(2-гідроксіетил)-4-метокси-N,2,6триметилбензол-сульфонамїд 14 Був приготовлений розчин 1,76г (23,4мМ) 2(метиламіно)етанолу в 100мл ДХМ, і до розчину було додано 5,4г (53мМ) триетиламіну. Суміш остудили до 0°С, і до неї поступово додали розчин 5г (21,3мМ) 2,6-диметил-4метоксибензолсульфонілхлориду в 50мл ДХМ. Після цього суміш збовтували протягом 3 годин при температурі навколишнього середовища, а потім вилили її в 50мл 0,5 N хлористоводневої кислоти. Органічну фаз у відокремили, потім промили водою, висушили над сульфатом магнію і сконцентрували при зниженому тиску. У результаті було отримано 5,8г потрібної сполуки у вигляді безбарвного масла (вихід =100%). 1 H ЯМР (300МГц, ДМСО) δ: 6,80 (s, 2Н); 4,70 (t, 1H); 3,80 (s, 3H); 3,48 (q, 2H); 3,09 (t, 2H); 2,69 (s, 3H); 2,54 (s, 6H). Препарат II [2-[[(4-метокси-2,6диметилфеніл)сульфоніл]метиламіно]етокси]оцтової кислоти 1,1-диметилетиловий ефір Був приготовлений розчин 4,85г (17,7мМ) сполуки, отриманої відповідно до процедури одержання Препарату І, у 100мл толуолу, і до нього було додано 1,62г тетрабутиламонійхлориду. Суміш остудили до 0°C і додали до неї 100мл 35% розчину гідроксиду натрію, потім поступово додали 3,95мл (26,6мл) трет-бутилбромацетату. С уміш збовтували при температурі навколишнього середовища протягом 2 годин, потім органічну фазу відокремили за допомогою декантування, промили водою з нейтральним рН, після чого висушили над сульфатом натрію. Після концентрування при зниженому тиску було отримано масло, яке було очищено за допомогою хроматографії на силікагелі з елююванням сумішшю циклогексану/етилацетату (75/25; об'єм/об'єм). У результаті було отримано 6,5г потрібної сполуки у вигляді безбарвного масла (вихід =94%). 1 H ЯМР (250МГц, ДМСО) δ: 6,80 (s, 2H); 3,89 (s, 2H); 3,80 (s, 3H); 3,56 (t, 2H); 3,21 (t, 2Н); 2,71 (s, 3H); 2,53 (s, 3H); 1,41 (s, 9H). Препарат III [2-[[(4-метоісси-2,6диметилфеніл)сульфоніл]метиламіно]етокси]оцтова кислота 6,4г (16,5мМ) ефіру, отриманого відповідно до процедури одержання Препарату II, розчинили в 80мл ДХМ і додали 8мл трифтороцтової кислоти. Суміш збовтували при температурі навколишнього середовища протягом 4 годин, а потім сконцентрували при зниженому тиску. Залишок від випаровування розчинили в 100мл 1N гідроксиду натрію, отриманий розчин промили два рази 30мл етилацетату, після чого підкислили 1N розчином хлористоводневої кислоти і два рази екстрагували етилацетатом. Органічну фазу промили водою, висушили над сульфатом натрію і сконцентрували при зниженому тиску. У результаті була отримана потрібна кислота у ви гляді масла, що кристалізувалося (вихід =95%). Температура топлення =82°C. 15 83821 Приклад 1 1-[[2-[[4-метокси-2,6диметилфеніл)сульфоніл]метиламіно]стокси]ацетил]-4-[2-{1піролідиніл)етил]піперазину біс-трифторацетат 482мг полістирольної смоли, приприщепленої циклогексилдіімідом, помістили на 20 хвилин у 5мл ТГФ, а потім додали 100мг (0,31мМ) кислоти, отриманої відповідно до процедури одержання Препарату III, у вигляді розчину в 2мл ТГФ, 37мг (0,20мМ) 1-[2-(1-піролідиніл)етил]піперазину і 2мг HOAT (1-гідрокси-7-азабензотриазолу). С уміш збовтували протягом 4 годин при температурі навколишнього середовища, а потім профільтрували. Смолу промили 4мл ТГФ, що був доданий до фільтрату. Потім фільтрат збовтували з 50мг смоли Amberlite IRA 400 (як OH-) протягом 3 годин. Після фільтрації смолу промили 3мл ТГФ, який додали до фільтрату. Потім цей фільтрат обробили 100мг полістирольної смоли, прищепленої ізоціанатом, протягом 1 години. Смолу відокремили за допомогою фільтрації, і розчин сконцентрували при зниженому тиску. Залишок (63мг) очистили за допомогою зворотнофазної хроматографії на колонці X Terra Prep MS C18 (елюент А: вода +0,05% ТФОК, елюент В: ацетонітрил +0,05% ТФОК, градієнт: 10% В (t= з 0 до 2 хвилин), 60% В (t= з 2 до 17 хвилин), 100% В (t= з 17 хвилини до 18 хвилин); об'ємна швидкість =25мл/хв; УФ-детекція в діапазоні від 120 до 260нм. Очищений продукт перенесли в 1мл ацетонітрилу і змішали з 6мл 1% розчину три фтороцтової кислоти у воді. Отриманий розчин висушили сублімаційним сушінням, і було отримано 19мг необхідної солі у вигляді жовтого масла (вихід =13%). 1 H ЯМР (300МГц, CD3CN) δ: 6,74 (s, 2H); 4,09 (s, 2H); 3,96 (s, 3H); 3,70 (m, 1H); 3,59 (t, 2H); 3,48 (t, 2H); 3,33 (m, 5H); 3,19 (t, 2H); 3,00 (m, 4H); 2,72 (s; 3H); 2,56 (s, 6H); 2,04 (m, 4H). Препарaт IV [2-[[(2,4,6триметилфеніл)сульфонал]метиламіно]стокси]оцтової кислоти 1,1-диметилетиловий eфір Способом, аналогічним процедурі одержання Препарату II, використовуючи як вихідну сполуку N-(2-гідроксіетил)-N,2,4,6тетраметилбензолсульфонамід, був отриманий необхідний складний ефір у вигляді бежевого масла (вихід =98%). 1 H ЯМР (250МГц, ДМСО) δ: 7,06 (s, 2H); 4,01 (s, 2H); 3,58 (t, 2H); 3,25 (t, 2H); 2,72 (s, 3H); 2,51 (s, 6Н); 2,27 (s, 3H); 1,43 (s, 9H). Препарат V [2-[[{2,4,6триметилфеніл)сульфоніл]метиламіно]стокси]оцтова кислота Способом, аналогічним процедурі одержання Препарату III, використовуючи сублімаційним відповідно до процедури одержання Препарату IV, був отриманий необхідний продукт у вигляді бежевої твердої речовини (вихід =83%). Температура топлення =58°С. Препарат VI 16 N-етил-N-(2-гідроксіетил)-4-метоісси-2,8диметилбензолсульфонамід Способом, аналогічним процедурі одержання Препарату l, використовуючи як вихідну сполуку 2(етиламіно)етанол, був отриманий необхідний продукт у вигляді жовтого масла (вихід =99%). 1 H ЯМР (250МГц, ДМСО) δ: 6,80 (s, 2H); 4,69 (t, 1H); 3,80 (s, 3H); 3,38 (m, 2H); 3,14 (s, 2Н). Препарат VII [2-[[(4-метокси-2,6диметилфеніл)сульфоніл]етиламіно]стокси]оцтової кислоти 1,1-диіуієтияєтйловий ефір Способом, аналогічним процедурі одержання Препарату II, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату Vl, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =79%). 1 H ЯМР (250МГц, ДМСО) δ: 6,79 (s, 2H); 3,86 (s, 2H); 3,79 (s, 3H); 3,47 (t, 2H); 3,24 (m, 4Н); 2,53 (s, 6H); 1,40 (s, 9H); 1,00 (t, 3H). Препарат VIII [2-[[(4-метокси-2,6диметилфеніл)сульфоніл]етиламіно]етокси]оцтова кислота Способом, аналогічним процедурі одержання Препарату III використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату VII був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =88%). 1 H ЯМР (250МГц, ДМСО) δ: 6,79 (s, 2H); 3,89 (s, 2H); 3,79 (s, 3H); 3,48 (t, 2H); 3.24 (q, 2H); 3,21 (t, 2H); 2,53 (s, 6H); 1,00 (t, 3H). Препарат IX N-(2-гiдpoксіетил)-4-мeтoкcи-2,6-димeтил-N-(1мeтилeтил)бeнзoлcyльфoнaмід Способом, аналогічним процедурі одержання Препарату І, використовуючи як вихідну сполуку 2[(1-метилетил)аміно]етанол, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =58%). 1 H ЯМР (300МГц, ДМСО) δ: 6,80 (s, 2H); 4,68 (t, 1H); 3,80 (s, 3H); 3,73 (quin, 1H); 3,27 (dt, 2H); 3,20 (q, 2H); 3,12 (t, 2H); 2,53 (s, 6H); 1,06 (d, 6H); 0,99 (t, 3H). Препарат X [2-[[[4-метокси-2,6дметилетилфеніл)сульфоніл](1метилетил)аміно]етокси] оцтової кислоти 1,1диметиловий ефір Способом, аналогічним процедурі одержання Препарату IІ, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату IX, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =95%). 1 H ЯМР (250МГц, ДМСО) δ: 6,80 (s, 2H); 3,88 (s, 2H); 3,80 (s, 3H); 3,74 (quin, 1H); 3,82 (m, 2H); 3,26 (m, 2H); 2,53 (s, 6H); 140 (s, 9H); 1,07 (d, 6H). Препарат Xl [2-[[(4-метокси-2,6-диметилфеніл)сульфоніл](1-метилетил)аміно]етокси] оцтова кислота Способом, аналогічним процедурі одержання Препарату III, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання 17 83821 Препарату X, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =85%). Температура топлення =96°С. Препарат ХІІ N-циклопропіл-N-(2-гідроксіетил)-4-метокси2,6-диметилбензолсульфонамід Способом, аналогічним процедурі одержання Препарату І, використовуючи як вихідну сполуку 2(циклопропіламіно)етанол, був отриманий необхідний продукт у вигляді твердої білої речовини (вихід =77%). Температура топлення =58°С. Препарат ХІІІ [2-[циклопропіл[(4-,си-256диметилфеніл)сульфоніл]аміно]етокси]оцтової кислоти 1,1-диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату Ii, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XIl, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =84%). 1 H ЯМР (300МГц, ДМСО) δ: 6,80 (s, 2H); 3,98 (s, 2H); 3,80 (s, 3H); 3,69 (t, 2H); 3,44 (t, 2Н); 2,50 (s, 6Н); 2,47 (m, 1H); 1,42 (s, 9H); 0,48 (m, 2Н); 0,16 (m, 2Н). Препарат XIV [2-[циклопропіл[(4-мeтокси-2,6диметилфеніл)сульфоніл]аміно|стокси]оцтова кислота Способом, аналогічним процедурі одержання Препарату III, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату ХIIІ, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =85%). Температура топлення =100°C. Препарат XV 2,6-дихлор-4-метоксибензолсульфонілхлорид і 2,4-дихлор-6-метоксибензол-сульфонілхлорид Був приготовлений розчин 15г (84,7мМ) 3,5дихлоранізолу в 8мл тіонілхлориду, що був о холоджений до -10°C, потім до нього по краплях було додано 6мл (90мМ) хлорсульфокислоти. Після цього реакційну суміш збовтували протягом 3 годин при температурі навколишнього середовища, а потім долили до суміші льоду і етилацетату. Органічну фазу відокремили, висушили над сульфатом магнію і сконцентрували при зниженому тиску. Залишок від випаровування використовували на наступній стадії без додаткового очищення. Препарат XVIa 2,6-Дихлор-М-{2-гідроіссіетил)4-метокси-Н-метміпбензолсульфонамїд Препарат ХУІб 2,4-дихлор-Н-(2-гідроксіетил)-6мето8сси-М-метилбензолсульфонамід Способом, аналогічним процедурі одержання Препарату і, використовуючи як вихідну сполуку сполуку, отриману відповідно до процедури одержання Препарату XV, необхідні продукти у вигляді білих твердих речовин були отримані після виділення речовин і їхнього очищення за допомогою хроматографії на силікагелі при елююванні за допомогою суміші толуолу/ізопропанолу (95/5; об'єм/об'єм). Препарат XVIa (вихід =13%): Температура топлення =47°С. Препарат ХVІб (вихід =48%): Температура топлення =100°C. 18 Препарат XVII [2-[[(2,6-дихлор-4метоксифеніл)сульфоніл]метиламіно]етокси]оцтової кислоти 1,1-диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату ІІ, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XVIa, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =52%). 1 H ЯМР (300МГц, ДМСО) δ: 7,24 (s, 2H); 3,94 (s, 2H); 3,87 (s, 3H); 3,60 (t, 2H); 3,39 (t, 2Н); 2,90 (s,3H); 1,41 (s,9H). Препарат XVIIІ [2-[[2,6-дихлор-4метоксифеніл)сульфоніл]метиламіно]етокси]оцтова кислота Способом, аналогічним процедурі одержання Препарату ІІІ, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XVІб, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =94%). Температура топлення =95°С. Препарат XlX [2-[[(2,4-дихлор-6метоксифеніл)сульфонал]метиламіно]етокси]оцтової кислоти 1,1-диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату II, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XVIб, був отриманий необхідний продукт у вигляді масла, що без додаткового очищення було використано на наступній стадії. Препарат XX [2-[[(2,4-дихлор-6метоксифеніл)сульфонал]метиламіно]етокси]оцтова кислота Способом, аналогічним процедурі одержання Препарату III, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XIX, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =76%). Температура топлення =74°C. Препарат XXI 2,4-дихлор-N-(2-гідроксіетил)-3,Nдиметилбензолсульфонамід Способом, аналогічним процедурі одержання Препарату І, використовуючи як вихідну сполуку 2,4-дихлор-3-метилбензолсульфонілхлорид, був отриманий необхідний продукт у вигляді безбарвного масла. Препарат. ХХll [2-[[(2,4-дихлор-3метилфеніл)сульфонал]метиламіно]стокси]оцтової кислоти 1,1-диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату II, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XXI, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =87%) 1 H ЯМР (300МГц, ДМСО) δ: 7,83 (d, 1H); 7,63 (d, 1Н); 3,93 (s, 2H); 3,59 (t, 2H); 3,39 (t, 2H); 2,91 (s, 3H); 2.49 (s, 3H); 1,41 (s, 9H). 19 Препарат XXIII [2-[[(2,4-дихлор-3метилфеніл)сульфонал]метиламіно]стокси]оцтова кислота Способом, аналогічним процедурі одержання Препарату III, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XXII, був о триманий необхідний продукт у вигляді безбарвного масла (вихід =100%). 1 H ЯМР (300МГц, ДМСО) δ: 7,83 (d, 1H); 7,63 (d, 1H); 3,93 (s, 2H); 3,59 (t, 2H); 3,39 (t, 2H); 2,91 (s, 3H); 2,49 (s, 3H); 1,41 (s, 9H). Препарат XXl V N-(2-гідроксіетил)-N-метил-2(трифторметил)бензолсульфонамід Способом, аналогічним процедурі одержання Препарату І, використовуючи як вихідну сполуку 2(трифторметил)бензолсульфонілхлорид, був отриманий необхідний продукт у вигляді жовтого масла (вихід =99%). 1 H ЯМР (250МГц, ДМСО) δ: 8,02 (m, 2H); 7,88 (m, 2Н); 4,84 (t, 1H); 3,55 (q, 2H); 3,30 (t, 2H); 2,93 (s, 3H). Препарат XXV [2-[[[(2(трифторметил)феніл]суль фоніл]метиламіно]етокси]оцтової кислоти 1,1-диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату II, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XXIV, був отриманий необхідний продукт у вигляді жовтого масла (вихід =67%). 1 H ЯМР (250МГц, ДМСО) δ: 8,02 (m, 2H); 7,98 (m, 2H); 3,97 (s, 2H); 3,63 (t, 2H); 3,44 (t, 2H); 2,95 (s, 3H); 1,42 (s, 9H). Препарат XXVl [2-[[[(2(трифторметил)феніл]суль фоніл]метиламіно]етокси]оцтова кислота Способом, аналогічним процедурі одержання Препарату III, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XXV, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =78%). 1 H ЯМР (250МГц, ДМСО) δ: 8,02 (m, 2H); 7,86 (m, 2Н); 4,01 (s, 2H); 3,65 (t, 2H); 3,45 (t, 2Н); 2,95 (s, 3H). Препарат XXVII [2-[[[4-метокси-2(трифторметил)феніл]суль фонал]метиламіно]eтокси]оцтова кислота Була приготовлена суспензія 8г (60мМ) 2-(2метиламіноетокси)оцтової кислоти в 100мл хлороформу і 20мл ацетонітрилу, і при температурі навколишнього середовища до неї було додано 17мл (120мМ) триетиламіну, а потім, по краплях, 7,63мл (60мМ) хлортриметилсилану. Суміш збовтували при 60°С протягом 2 годин, а потім остудили до температури навколишнього середовища і повільно додали 17мл (120мМ) триетиламіну, а потім 16,48г (60мМ) 4-метокси-2 83821 20 (трифторметил)бензосульфонілхлориду, розчиненого в 60мл хлороформу. Реакційну суміш витримали при збовтуванні при 5°С протягом 16 годин, а потім сконцентрували при зниженому тиску. Залишок перенесли в 150мл дихлорметану й обробили 40мл N розчину хлористоводневої кислоти. Органічну фазу відокремили, промили водою, а потім екстрагували два рази 120мл N гідроксиду натрію. Лужну водну фазу відокремили, промили 100мл дихлорметану. а потім підкислили 5N розчином хлористоводневої кислоти. Осад, що утворився, екстрагували два рази 80мл дихлорметану; отриману органічну фазу промили водою, а потім висушили над сульфатом магнію і сконцентрували при зниженому тиску. Отриманий залишок кристалізували з ізопропіловому ефірі, відокремили і висушили. У результаті було отримано 6,32г потрібної сполуки у вигляді білої твердої речовини (вихід =28%). Температура топлення =60°C. Препарат XXVIII 4-(3-хінуюіідиніл)піперазин-1-карбоновой кислоти 1,1-диметилетиловий ефір 1г (8мМ) хінуклідинону, 1,63г (8,75мМ) 1піперазинкарбонової кислоти трет-бутилового ефіру (1-Вос-піперазину) і 2,71мл (9,1мМ) ізопропоксиду титану змішали, і цю суміш витримали при збовтуванні протягом 1 години. Потім додали 5мл етанолу, а після цього - 460мг (7,3мМ) ціаноборгідриду натрії, і цю суміш збовтували протягом 24 годин при температурі навколишнього середовища. Додали 25мл води і продовжили збовтування протягом 15 хвилин. Осад, що утворився, відокремили за допомогою фільтрації, і фільтрат сконцентрували при зниженому тиску. Залишок очистили за допомогою хроматографії на МН 2-силікагелі з елююванням сумішшю толуолу/ізопропанолу (95/5; об'єм/об'єм). У результаті був отриманий 1г потрібної сполуки у вигляді білої твердої речовини (вихід =42%). Температура топлення =174°С. Препарат XXIX (3RS)-3-(1-піперазиніл)-1азабіцикло[2.2.2]октан або (3RS)-3-(1піперазиніл)хінуклідин) Був приготовлений розчин 990мг (3,35мМ) сполуки, отриманої відповідно до процедури одержання Препарату XXVІІI, у 10мл трифтороцтової кислоти, і суміш збовтували протягом 30 хвилин при 10°C. Потім додали 30мл толуолу і провели концентрування при зниженому тиску. Залишок перенесли в 25мл метанолу, і розчин збовтували з 20г смоли Amberlite IRA 400 (OH-) протягом 1 години при температурі навколишнього середовища. Смолу відокремили за допомогою фільтрації, промили 15мл метанолу й об'єднані фільтрати сконцентрували при зниженому тиску. У результаті було отримано 530мг потрібного продукту у вигляді білої пасти (вихід =80%). 1 H ЯМР (300МГц, ДМСО) δ: 2,79 (m, 1H); 2,67 (m, 7Н); 2,50 (m, 2Н): 2,22 (m, 4Н); 1,91 (m, 1Н); 1,85 (m, 1Н); 1,58 (m, 2Н); 1,32 (m, 1H); 1,22 (m, 1Н). N-[2-[2-[4-[(3RS)-1-азабіцикло[2.2.2]окт-3-ил]-1піперазиніл]-2-оксоетокси]етил]-N,2,4,6 21 83821 тетраметилбензолсульфонаміду бістрифторацетат 250мг (0,32мМ) полістирольної смоли, прищепленої ТФФ (тетрафторфенолом), помістили в 4мл ДМФ на 15 хвилин, а потім додали 4мг (0,03мМ) 4(диметиламіно)піридину. 103мг (0,32мМ) кислоти, отриманої відповідно до процедури одержання Препарату V, і 76мкл (0,48мМ) діізопропілкарбодііміду. Суміш витримали при збовтуванні протягом 18 годин, а потім смолу відокремили за допомогою фільтрації, двічі промили 3мл ДМФ і провели реакцію з 44мг (0,225мМ) аміну, отриманого відповідно до процедури одержання Препарату XXIX, у 3мл ДМФ. Суміш збовтували протягом 1 години при температурі навколишнього середовища, після чого смолу відокремили фільтрацією і двічі промили 3мл ДМФ. Фільтрати об'єднали й обробили 20мг смоли Amberlite ІRA 400 (OH-). а потім 20мг смоли, прищепленої ізоціанатом, після чого сконцентрували при зниженому тиску. Залишок очистили за допомогою напівпрепаративної хроматографії (умови аналогічні умовам Приклада 1). У результаті було отримано 16мг потрібної сполуки у вигляді білої твердої речовини (вихід =8%). Температура топлення =78-80°C. Приклад 3 N-[2-[2-[4-[(3RS)-1-азабiцикло[2.2.21окт-3-ил]1-піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонамід 500мг (1,51мМ) кислоти, отриманої відповідно до процедури одержання Препарату III, 319мг (1,65мМ) EDCI, 2,26мг (1,65мМ) HOAT і 233мкл триетиламіну перемішали в 10мл ДМФ, і цю реакційну суміш витримали при перемішуванні при кімнатній температурі протягом 30 хвилин. Потім додали 334мг аміну, отриманого відповідно до процедури одержання Препарату XXIX, і провели перемішування протягом 20 годин при кімнатній температурі. Реакційну суміш вилили у воду при температурі танення льоду й екстрагували ДХМ. Органічну фаз у висушили над сульфатом магнію і сконцентрували при зниженому тиску. Залишок очистили за допомогою хроматографії на силікагелі, прищепленому NН2, з елююванням сумішшю толуолу/ізопропанолу (95/5; об'єм/об'єм). У результаті було отримано 140мг потрібного продукту у вигляді безбарвного масла (вихід =18%). 1H ЯМР (300МГц, ДМСО) δ: 6,80 (s, 2H); 4,05 (s, 2H); 3,80 (s, 3H); 3,53 (t, 2H); 3,41 (m, 2H); 3,31 (m, 2Н); 3,22 (t, 2H); 2,85 (m, 1Н); 2,70 (s, 3H); 2,57 (m, 5Н); 2,53 (s, 6H); 2,27 (m, 4Н); 1,90 (m, 2Н); 1,60 (m, 2Н); 1,35 (m, 1Н); 1,20 (m, 1Н). Приклад 4 N-[2-[2-[4-[(3RS)-1-азабіцикло[2.2.2]окт-3-ил]-1піперазиніл]-2-оксоетокси]eтил]-4-метокси-N,2,6триметилбензолcульфонаміду дифумарат Був приготовлений розчин 137мг (0,269мМ) сполуки, отриманої відповідно до Приклада 3, у 3мл метанолу, і до розчину було додано 62,5мг (0,538мМ) фумарової кислоти. Суміш збовтували протягом 30 хвилин, а потім сконцентрували при зниженому тиску. Залишок перенесли в 5мл води і висушили за допомогою сублімаційного сушіння. У результаті було отримано 200мг шуканої солі у 22 вигляді білого порошку (кількісний вихід). Температура топлення =86-90°C. Приклад 5 N-[2-[2-[4-[(3S)-1-азабіцикло[2.2.2]окт-3-ил]-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонамід 840мг (2,53мМ) кислоти, отриманої відповідно до процедури одержання Препарату III. змішали з 8мл безводного толуолу і 0,1мл ДМФ. Повільно додали 0,245мл (2,81мМ) оксалілхлориду. Реакційну суміш збовтували протягом години при температурі навколишнього середовища, а потім сконцентрували при зниженому тиску. Залишок перенесли в 10мл толуолу і по краплях додали до розчину 0,5г (2,56мМ) 3(3)-(1піперазиніл)хінуклідине і 0,39мл (2,81мМ) триетиламіну в 10мл толуолу. Реакційну суміш збовтували протягом години при температурі навколишнього середовища, після чого додали 2мл етанолу і 10г силікагелю для хроматографії. Розчинники видалили при зниженому тиску, а продукт, що адсорбувався на силікагель, очистили за допомогою хроматографії на силікагелі з елююванням сумішшю етилацетату/етанолу/водного розчину аміаку (6/3/1; об'єм/об'єм/об'єм). Чисті фракції сконцентрували при зниженому тиску, розчинили в етилацетаті, висушили над сульфатом магнію і сконцентрували. У результаті був отриманий необхідний продукт у вигляді безбарвного масла (вихід =71%). 1 H ЯМР (300МГц, ДМСО) δ: 6,80 (s. 2H); 4,06 (t, 2H); 3,80 (s, 3H); 3,53 (t, 2H); 3,41 (m, 2H); 3,31 (m, 2Н); 3,22 (t, 2H); 2,85 (m, 1Н); 2,69 (s, 3H); 2,57 (m, 5Н); 2,53 (s, 6H); 2,27 (m, 4Н); 1,90 (m, 2Н); 1,60 (m, 2Н): 1,35 (т. 1Н); 1,20 (m, 1Н). N-[2-[2-[4-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-1піперазиніл]-2-oксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду фумарат 0,84г (1,65мМ) сполуки, отриманої відповідно до Приклада 5, розчинили в 50мл метанолу і додали 0,192г (1,64мМ) фумарової кислоти. Суміш збовтали до повного розчинення і сконцентрували при зниженому тиску. Залишок розчинили в 40мл води, розчин профільтрували і висушили за допомогою сублімаційного сушіння. У результаті був отриманий 1г шуканої солі у вигляді білого порошку (ви хід =97%). Температура топлення =86°C. [α]25D=-6,5° (C=0,31; CH 3OH) Приклад 7 N-[2-[2-[4-[{3R)-1-азабіцикло[2.2.2]окт-3-іл]-1піперазиніл]-2-оксоетокси]етил]-4-уетокси-N,2,6триметилбензолсульфонаміду фумарат Рацемичну суміш, отриману відповідно до Приклада 3, розділили за допомогою хроматографії на колонку з хіральною фазою (колонка Chiralpack AD) при елююванні сумішшю гексану/етанолу/ізопропанолу/трифтороцтовою кислотою (60/25/15/0,05). Використовуючи як вихідну сполуку 500мг рацемічної суміші, було отримано 260мг енантіомера S і 100мг енантіомера R. Кожний з енантіомерів розчинили в метанолі та обробили 1г смоли Amberlite ІRA 400 (OH-). Оброблений розчин профільтрували і сконцентрували при зниженому тиску, а з отриманих основних сполук одержали солі в реакції з фумаровою кислотою, аналогічно операції, описаної в Прикладі 6. У ре 23 83821 зультаті було отримано 143мг енантіомера S і 68мг енантіомера R. Температура топлення =84°С. [α]25D=7,2° (C=0,31; CH 3OH) Препарат ХХХ 4-(8-метил-8-азабіцикло[3.2.1]окт-3-іл)-1піперазинкарбонової кислоти 1,1диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату XXVIІІ, використовуючи як вихідну сполуку 8-метил-8-азабіцикло[3.2.1]октан-3-ону (тропінону), був отриманий необхідний складний ефір у вигляді білої твердої речовини (вихід =53%). 1 H ЯМР (300МГц, ДМСО) δ: 3,25 (m, 4H); 3,15 (m, 2Н); 2,51 (m, 2Н); 2,35 (m, 4Н); 2,20 (S, 3H); 1,92 (m, 3H); 1,53 (m, 4Н); 1,38 (s, 9H). Препарат ХХХІ 8-метил-3-(1-піперазиніл)-8азабіцикло[3.2.1]октан Способом, аналогічним процедурі одержання Препарату XXIX, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XXX, був о триманий необхідний продукт у вигляді жовтого масла (вихід =99%). 1 H ЯМР (300МГц, ДМСО) δ: 3,70 (m, 2H); 3,03 (m, 4Н); 2,75 (m, 1Н); 2,61 (m, 4Н); 2,53 (s, 3H); 2,10 (m, 2H); 1,75 (m, 6Н). Препарат XXXII 4-(1-азабіцикло[2.2.2]окт-3-іл)гекcагідро-1Н1,4-діазoпин-1-карбонової кислоти 1,1диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату XXVIII, використовуючи як вихідну сполуку 1-гомопіперазинкарбонову кислоти третбутиловий ефір, був отриманий необхідний продукт у вигляді безбарвної пасти (вихід =67%). 1 H ЯМР (300МГц, ДМСО) δ: 3,34 (m, 4H); 2,812,35 (m, 11Н); 1,88 (m, 1Н); 1,65 (m, 4Н); 1,39 (S, 9Н): 1,34 (m, 1Н); 1,18 (m,1Н). Препарат XXXlII 3-(гексагідрo-1Н-1,4-дiазепин-1-іл)-1азабіцикло[2.2.2]октан Способом, аналогічним процедурі одержання Препарату XXIX, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XXXH, був отриманий необхідний продукт у вигляді жовтого масла (вихід =98%). 1 H ЯМР (250МГц, ДМСО) δ: 3,41 (m, 1H); 3,11 (m, 8Н); 2,96 (m, 1Н); 2,78 (m, 4Н); 2,52 (m, 1Н); 2,24 (m, 1Н); 1,89 (m, 4Н); 1,85 (m, 1Н); 1,62 (m, 1Н). З використанням процедури, аналогічної Прикладу І, використовуючи як вихідні сполуки похідні піперазину, відомі з літератури або описані вище, були отримані наступні сполуки: Приклад 8 1-[[2-[[(4-метокси-2,6диметилфеніл)сульфоніл]метиламіно]етокси]ацетил]-4-[3-(1піролідиніл)пропіл]піперазину біс-трифторацетат Вихід =90% (безбарвна паста). 1 H ЯМР (300МГц, CD3CN) δ: 6,74 (s, 2H); 4,12 (s, 2H); 3,81 (s, 3H); 3,78 (m, 4H); 3,62 (t,2H); 3,34 (t, 2H); 3,27 (m, 12Н); 2,73 (s, 3H); 2,57 (s, 6H); 2,22 (m, 2H); 2,03 (m, 4Н). Приклад 9 24 1-[[2-[[(4-метокси-2,6диметилфеніл)сульфоніл]метиламіно]етокси]ацетил]-4-[2-(4морфолїнил)етил]піперазину біс-трифторацетат Вихід =51% (безбарвна паста). 1 H ЯМР (300МГц, CD3CN) δ: 6,75 (s, 2H); 4,11 (s, 2H); 3,92 (m, 4H); 3,81 (s, 3H); 3,76 (m, Н); 3,61 (t, 2H); 3,48 (m, 4Н); 3,35 (t, 2H); 3,27 (m, 8Н); 2,72 (s, 3H); 2,57 (s, 6H). 1-[[2-[[4-метокси-2,6диметилфеніл)сульфоніл]метиламіно]етокси]ацетил]-4-[2-(1піперидиніл)етил]піперазину біс-трифторацетат Вихід =92% (безбарвна паста). 1 H ЯМР (300МГц, CD3CN) δ: 6,74 (s, 2Н); 4,10 (s, 2H); 3,81 (s, 3H); 3,81 (m, 4H); 3,61 (t, 2H); 3,40 (m, 2H); 3,34 (m, 4H); 3,24 (m, 4H), 3,09 (m, 4H); 2,74 (s, 3H); 2,57 (s, 6H); 1,90 (m, 4H); 1,64 (m, 2H). Приклад 11 1-[[2-[[(4-метокси-2,6диметилфoніл)сульфоніл]метиламіно]етоксм]ацетил]-4[3-(1-піперидмніл)пропіл]піперазину бістрифторацетат Вихід =85% (безбарвна паста). 1 H ЯМР (300МГц, CD3CN) δ: 6,74 (s, 2H); 4,10 (s, 2H); 3,96 (s, 3H); 3,80 (m, 2H); 3,60 (t, 2H); 3,50 (m, 4H); 3,30 (t, 2H); 3,15 (m, 2H); 3,10 (m, 4H); 2,80 (m, 4H); 2,75 (s; 3H); 2,55 (s, 6Н); 2,20 (m, 2H); 1,93 (m, 5H); 1,37 (m, 1H). Приклад 12 1-[[2-[[(4-метокси-2,6диметилфеніл)сульфоніл]метиламіно]етокси]ацетил]-4-[3(диметиламіно)пропіл]піперазину бістрифторацетат Вихід =74% (безбарвна паста). 1 H ЯМР (300МГц, CD3CN) δ: 6,74 (s, 2H); 4,11 (s, 2H); 3,81 (s, 3H); 3,78 (m, 4H); 3,63 (t, 2H); 3,31 (і 2Н); 3,22 (m, 4H); 3.15 (m, 4Н); 2,81 (s, 6H); 2,74 (s, 3H); 2,57 (s, 6H); 2,23 (m, 2Н). З використанням процедури, аналогічній Прикладам 3 і 4, використовуючи як вихідні сполуки похідні піперазину або гомопіперазину, описані вище, були отримані наступні сполуки: Приклад 13 4-метокси-N,2,8-триметил-N-[2-[2-[4-(1-метил4-піперидиніл)-1-піперазиніл]-2оксоетокси]етил]бензолсульфонаміду бістрифторацетат Вихід =74% (безбарвна паста). 1 H ЯМР (300МГц, CD3CN) δ: 8,74 (s, 2H); 4,11 (s, 2H); 3,81 (s, 3H); 3,80 (m, 4H); 3,77 (d, 2Н); 3,64 (m, 2H); 3,55 (m, 1H); 3,34 (t, 2H); 3,26 (m, 4H); 3,01 (m, 2H); 2,79 (s, 3H); 2,74 (S, 3H); 2,57 (s, 6H); 2,29 (m, 4H). Приклад 14 4-метокси-N,2,6-триметил-N-[2-[2-[4-(8-метил8-азабіцикло[3.2.1]-окт-3-іл)-1-піперазиніл]-2оксоетокси]етил]бензолсульфонаміду фумарат Вихід =62% (біла тверда речовина). Температура топлення =88-90°C. Приклад 15 1-(1-азабіцикло[2.2.2]окт-3-іл)гексагідро-4-[[2[[(4-метокси-2,6 25 83821 диметилфеніл)сульфоніл]метиламіно]етокси]ацетил]-1Н-1,4діазепіну фумарат Вихід =47% (біла тверда речовина). Температура топлення =90°C. Препарат XXXl V 4-[1-(1,1-диметилетил)-4-піперидиніл]-1піперазbyкaрбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату XXVIII, використовуючи як вихідні сполуки 1-(1,1-диметилетил)-4-піперидинон і бензиловий ефір 1-піперазинкарбонової кислоти, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =56%). Температура топлення =70-72°C. Препарат XXXV 1-[1-{1,1-диметилетил)-4піперидиніл]піперазин Був приготовлений розчин 570мг (1,59мМ) сполуки, отриманої відповідно до процедури одержання Препарату XXXlV, у 20мл метанолу, і до нього було додано 114мг 10% паладію на вуглеці. Суміш збовтували в атмосфері азоту протягом 2 годин при температурі навколишнього середовища й атмосферному тиску. Каталізатор видалили за допомогою фільтрації, а фільтрат сконцентрували при зниженому тиску. Неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю ди хлорметану/метанолу/водного розчину аміаку (90/10/1; об'єм/об'єм/об'єм). У результаті було отримано 270мг потрібної речовини у вигляді білого порошку (вихід =75%). Температура топлення =106°C. Препарат XXXVI 4-(9-метил-9-азабіцикло[3.3.1]нон-3-іл)-1піперазинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату XXVIN, використовуючи як вихідні сполуки 9-метил-9-азабіцикло[3.3.1]нонан-3-он і бензиловий ефір 1-піперазинкарбонової кислоти, був отриманий необхідний продукт у вигляді ясножовтої твердої речовини (вихід =18%). Температура топлення =74°C. Препарат ХХХVII 1-{9-метил-9-азабіцикло[3.3.1]нон-3іл)піперазин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідні сполуки сполуки, отримані відповідно до процедури одержання Препарату XXXVI, був о триманий необхідний продукт у вигляді жовтої олії (вихід =100%). 1 H ЯМР (300МГц, D2O) δ: 3,74 (m, 2H); 3,59 (m, 1H); 3,43 (m, 4H); 3,15 (m, 4H); 3.01 і 2,97 (2s, 3H); 2,46 (dd, 1H); 2,30 (m, 2H); 2,10 (m, 4H); 1,83 (m, 3H). Препарат XXXVІІІ 4-{1,2,2,6,6-пентаметил-4-піпермдиніл}-1піперазинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату XXVIII, використовуючи як вихідні спо 26 луки 1,2,2.6,6-пентаметил-4-піперидинон і бензиловий ефір 1-піперазинкарбонової кислота, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =52%). 1 H ЯМР (300МГц, ДМСО) δ: 7,36 (m, 5H); 5,07 (s, 2H); 3,37 (m, 4Н); 2,85 (m, 1Н); 2,50 (m, 7Н); 1,80 (m, 2Н); 1,48 (m, 2Н); 1,28 (s, 6H); 1,21 (s, 6H). Препарат ХХХІХ 1-(1,2,2,6,6-пентаметил-4піперидиніл)піперазин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідні сполуки, отримані відповідно до процедури одержання Препарату XXXVІІl, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =35%). Температура топлення =65°С. Препарат XL 4-[1-(1-метилетил)-4-піперидиніл]-1піперазинкарбонової кислоти 1,1-диметил етиловий ефір Способом, аналогічним процедурі одержання Препарату XXVІІI, використовуючи як вихідні сполуки 1-(1-метилетил)-4-піперидинон, був отриманий необхідний продукт у вигляді жовтої твердої речовини (вихід =31%). Температура топлення =53°С. Препарат XLl 1-[1-(1-метилетил)-4-піперидиніл]піперазину тригідрохлорид Був приготовлений розчин 247мг (0,79мМ) сполуки, отриманої відповідно до процедури одержання Препарату XL, у 1мл метанолу, і до розчину було додано 15мл 2,3N розчину хлористого водню в етилацетаті. Суміш збовтували протягом 4 годин при температурі навколишнього середовища. Реакційну суміш сконцентрували при зниженому тиску. У результаті було отримано 239мг потрібної сполуки у вигляді білого порошку (ви хід =75%). Температура топлення =262°С. Препарат ХLII 4-(1-циклопропіл-4-піперидиніл)-1піперазинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату XXVIII, використовуючи як вихідні сполуки 1-циклопропіл)-4-піперидинон, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =67%). Температура топлення =88°С. Препарат XLІII 1-(1-циклопропіл-4-піперидиніл)-піперазин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідні сполуки, отримані відповідно до процедури одержання Препарату XLІІ, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =92%). Температура топлення =58°C. Препарат XLIV 4-(1-метил-4-піперидиніл)гексагідро-1Н-1,4діазепiн-1-карбонової кислоти 1,1-диметил етиловий ефір Способом, аналогічним процедурі одержання Препарату XXXII, використовуючи як вихідні спо 27 83821 луки 1-метил-4-піперидинон, був отриманий необхідний продукт у вигляді жовтої олії (вихід =78%). 1 H ЯМР (250МГц, CDCI3) δ: 3,43 (m, 4H); 3,10 (dm, 2H); 2,70 (m, 4Н); 2,61 (m, 1Н); 2,44 (s, 3H); 2,28 (m, 2H); 1,86 (m, 6Н); 1,45 (s, 9H). Препарат XLV 1-(1-метил-4-піперидиніл)гексагідро-1Н-1,4дiазепiну тригідрохлорид Способом, аналогічним процедурі одержання Препарату XLI, використовуючи як вихідні сполуки, отримані відповідно до процедури одержання Препарату XLIV, був отриманий необхідний продукт у вигляді бежевої твердої речовини (вихід =99%). Температура топлення =186°С. Препарат XLVI 4-{8-циклопропіл-8-азабіцикло[3.2.1]окт-3-іл)-1піпeазинкарбонової кислоти 1,1-диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату XXVlIІ, використовуючи як вихідні сполуки 8-циклопропіл-8-азабіцикло[3.2.1]октан-3-он, був отриманий необхідний складний ефір у вигляді білої пасти (вихід =45%). 1 H ЯМР (300МГц, ДМСО) δ: 3,24 (m, 6H); 2,50 (m, 5Н); 2,34 (t, 4 H); 1,87 (m, 3H); 1,48 (dd, 6H); 1,38 (s, 9H); 0,36 (m, 2Н); 0,25 (m, 2H). Препарат XLVІI 8-циклопропіл-3-(1-піперазиніл)-8азабіцикло[3.2.1]октан Способом, аналогічним процедурі одержання Препарату XXІX, використовуючи як вихідні сполуки сполуку, отриману відповідно до процедури одержання Препарату XL VI, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =95%). 1 H ЯМР (250МГц, CDCI3) δ: 3,37 (m, 2H); 2,94 (t, 2H); 2,58 (m, 4H); 2,51 (m, 1H); 1,96 (m, 3H); 1,74 (t, 2H); 1,54 (m, 4H); 0,43 (d, 4H). Препарат XLVIІІ 4-[1-[(1,1-диметилетокси)карбоніл]-4піперидиніл]-1-піперазинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату XXXІV, використовуючи як вихідну сполуку трет-бутиловий е фір 4-оксо-1піперидинкарбонової кислоти,був отриманий необхідний продукт у вигляді жовтої олії (вихід =30%). 1 H ЯМР (250МГц, ДМСО) δ: 7,35 (m, 5H); 5,06 (s, 2H); 3,93 (d, 2H); 3,36 (m, 4Н); 2,68 (t, 2H); 2,44 (t, 4H); 2,37 (m, 1Н); 1,66 (m, 2Н); 1,38 (s, 9H); 1,26 (m, 2Н). Препарат ІL 4-(4-піперидиніл)-1-піперазинкарбонової кислота феніл метиловий ефір Способом, аналогічним процедурі одержання Препарату XXIX, використовуючи в якості вихідної сполуки сполуку, отриману відповідно до процедури одержання Препарату XL VIІІ, був отриманий необхідний продукт у вигляді жовтої олії (вихід =100%). 1 H ЯМР (250МГц, ДМСО) δ : 8,91 (m широка, h); 8,63 (m широка, 1Н); 7,36 (m, 5Н); 5,11 (s, 2Н); 3,80 28 (m, 2Н); 3,45 (m, 4Н); 3,22 (m, 5Н); 2,92 (q, 2H); 2,20 (d, 2H); 1,82 (dq, 2H). Препарат L 4-(1-етил-4-піперидиніл)-1піперазинбсарбонової кислоти феніл метиловий ефір Способом, аналогічним процедурі одержання Препарату XXXIV, використовуючи як вихідні сполуки ацетальдегід і сполуку, отриману відповідно до процедури одержання Препарату IL, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =72%). 1 H ЯМР (250МГц, ДМСО) δ: 7,34 (m, 5H); 5,07 (s, 2H); 3,90 (m, 7H); 3,02 (q, 2H); 2,84 (m, 2Н); 2,45 (t, 4H); 1,91 (m, 2Н); 1,63 (m, 2Н); 1,19 (t, 3H). Препарат LI 1-(1-етил-4-піперидиніл)піперазин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідні сполуки сполуку, отриману відповідно до процедури одержання Препарату L, був о триманий необхідний продукт у вигляді жовтої олії (ви хід =71%). 1 H ЯМР (250МГц, ДМСО) δ: 2,90 (m, 6H); 2,52 (m, 4Н); 2,30 (q, 2H); 2,17 (tt, 1H); 1,85 (dt, 2H); 1,69 (m, 2Н); 1,38 (dq, 2H); 0,97 (t, 3H). Препарат LII 4-[8-[(1,1-диметилетокси)карбоніл]-8азабіцикло[3.2.1]окт-3-іл]-1-піперазинкарбонової кислоти фенілeтиловий ефір Способом, аналогічним процедурі одержання Препарату XXVIII, використовуючи як вихідні сполуки трет-бутиловий ефір 3-оксо-8азабіцикло[3.2,1]октан-8-карбонової кислоти, був отриманий необхідний ефір у вигляді білої твердої речовини (вихід =40%). 1 H ЯМР (250МГц, CD3CN) δ: 7,33 (m, 5Н); 5,07 (s, 2Н); 4,13 (m, 2H); 3,37 (t, 4H); 2,80 (hep, 1H); 2,43 (t, 4Н); 1,87 (m, 2H); 1,62 (m, 6H); 1,42 (s, 9H). Препарат LIlI 4-(8-азабіцикло[3.2.1]окт-3-іл)-1піперазинкарбонової кислоти фенілметилового ефіру гідрохлорид Способом, аналогічним процедурі одержання Препарату XLI, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату LII, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =96%). 1 H ЯМР (250МГц, ДМСО) δ: 11,78 (m широка, 1H); 9,45 (s, 2H); 7,38 (m, 5H); 5,11 (s, 3H); 4,09 (m, 4H); 3,95 (m, 1H); 3,43 (m, 4H); 3,07 (m, 2H); 2,22 (m, 4H); 1,92 (m, 4H). Препарат LIV 4-(8-етил-8-азабіцикло[3.2.1]окт-3-іл)-1піперазинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату XXXl V, використовуючи як вихідні сполуки ацетальдегід і сполуку, отриману відповідно до процедури одержання Препарату LIII, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =99%). 1 H ЯМР (250МГц, CD3CN) δ: 7,33 (m, 5H); 5,07 (s, 2H); 3,39 (m, 6Н); 2,63 (m, 1Н); 2,56 (q, 2H); 2,42 (t, 4H); 1,93 (m, 2Н); 1,61 (m, 6Н); 1,06 (t, 3H). 29 83821 Препарат LV 1-(8-етил-8-азабіцикло[3.2.1]окт-3-іл)піперазин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату LlV, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =78%). 1 H ЯМР (300МГц, CDCI3) δ: 3,57 (m. 2H); 2,94 (t, 2H); 2,71 (q, 2H); 2,59 (m, 4H); 2,52 (m, 1H); 1,99 (m, 4H); 1,64 (m , 4Н). Препарат LVI 4-[8-(1-метилетил)-8-азабіцикло[3.2.1]окт-3-іл]1-піперазинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату XXXIV, використовуючи як вихідні сполуки ацетон і сполуку, отриману відповідно до процедури одержання Препарату LIII, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =77%). 1 H ЯМР (250МГц, CDCI3) δ: 7,32 (m, 5H); 5,12 (s, 2H); 3,64 (m, 2H); 3,49 (t, 4H); 2,92 (quin, 1H); 2,59 (hep, 1H); 2,47 (m, 4H); 1,99 (m, 2H); 1,82 (dt, 2H); 1,63 (m, 2H); 1,48 (m, 2H); 1,14 (d, 6H). Препарат LVII 1-[8-(1-метилетил)-8-азабіцикло[3.2,1]окт-3-іл]1-піперазин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату L VI, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =82%). 1 H ЯМР (250МГц, CDCl3) δ: 3,79 (m, 2H); 3,05 (quin, 1H); 2,98 (m, 4H); 2,71 (hep, 1H); 2,61 (m, 4H); 2,13 (m, 2H); 1,95 (m, 2H); 1,65 (m, 4H); 1,29 (d, 6H). Препарат LVІІI Гексагідро-1-метил-4-(1-окco-2-пропеніл)-1Н1,4-діазепін Був приготовлений розчин 20г (175мМ) Nметилгомопіперазину в 100мл дихлорметану, до якого по краплях при 0°C додали розчин 15,85г (175мМ) акрилоїлхлориду в 20мл дихлорметану. Реакційну суміш збовтували протягом 1 години при 0°C, а потім - 2 години при температурі навколишнього середовища, після чого гідролізували розчином 12г карбонату натрію в 20мл води. Суміш декантували, органічну фазу один раз промили водою, а потім висушили над суль фатом магнію і сконцентрували при зниженому тиску. У результаті було отримано 23г необхідної сполуки у вигляді жовтогарячої олії, що без додаткового очищення було використано на наступній стадії. Препарат LIX 4-[3-(гeксагідро-4-метил-1Н-1,4-діазепін-1-іл)3-оксопропіл]-1-піперазинкарбонової кислоти фенілметиловий ефір Був приготовлений розчин 7г (41мМ) сполуки, отриманої відповідно до процедури одержання Препарату LVІІІ, у 100мл толуолу, до якого було додано 11г (50мМ) бензилового ефіру 1піперазинкарбонової кислоти. Реакційну суміш збовтували протягом 16 годин при кипінні розчинника, а потім сконцентрували при зниженому тиску. Залишок перенесли в етилацетат, а органічну 30 фазу один раз промили водою, потім висушили над сульфатом магнію і сконцентрували при зниженому тиску. Неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю толуолу/ізопропанолу/водного розчину аміаку (80/20/1; об'єм/об'єм/об'єм). У результаті було отримано 4,1 потрібної сполуки у вигляді жовтої олії (вихід =26%). 1 H ЯМР (250МГц, ДМСО) δ: 7,36 (m, 5H); 5,06 (s, 2H); 3,47 (m, 4Н); 3,37 (m, 4Н); 2,50 (m, 8Н); 2,35 (m, 4Н); 2,24 і 2,21 (2s, 3H); 1,75 (m, 2Н). Препарат LX 1-[3-(гексагідро-4-метил-1Н-1,4-діазепін-1-іл)3-оксопропіл]піперазин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату LIX, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =65%). 1 H ЯМР (250МГц, ДМСО) δ: 3,48 (m, 4H); 2,67 (t, 4H); 2,48 (m, 8Н); 2,30 (t, 4H); 2,25 і 2,22 (2s, 3H); 1,73 (m, 2Н). Препарат LXІ 1-[3-(гексагідро-4-метил-1Н-1,4-діазепін-1іл)пропіл]піперазин Була приготовлена суспензія 120мг (3,1мМ) алюмогідриду літію в 3мл тетрагідрофурану (ТГФ), і до неї був доданий розчин 800мг (3,1мМ) сполуки, отриманої відповідно до процедури одержання Препарату LX, у 10мл ТГФ. Реакційну суміш нагрівали при слабкому кипінні розчинника протягом 4 годин, а потім остудили до температури навколишнього середовища. До реакційної суміші додали 200мг глауберової солі, а потім, приблизно через 15 хвилин, додали 50мл етилацетату. Отриману суспензію профільтрували, а фільтрат сконцентрували при зниженому тиску. Неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю ди хлорметану/метанолу/водного розчину аміаку (80/20/1; об'єм/об'єм/об'єм). У результаті був отриманий необхідний продукт у вигляді безбарвної олії (вихід =34%). 1 H ЯМР (250МГц, ДМСО) δ: 2,64 (t, 4H); 2,57 (m, 4H); 2,49 (m, 4Н); 2,38 (t, 2H); 2,23 (m, 6Н); 2,21 (s, 3H); 1,66 (quirt, 2H); 1,52 (quin, 2H). Препарат LXІІ 4-[2-(гексагідро-4-метил-1Н-1,4-діазепін-1-іл)2-оксоетил]-1-піперазинкарбонової кислоти фенілметиловий ефір Був приготовлений розчин 10г (87,5мМ) Nметилгомопіперазину в 200мл дихлорметану, до якого додали 36,6мл триетиламіну. Суміш остудили до -78°С и по краплях додали до неї 6,97мл хлорацетилхлориду. Реакційну суміш збовтували протягом 1,5 годин при -78°C, а потім додали до неї розчин 19,3г (87,6мМ) бензилового ефіру 1піперазинкарбонової кислоти в 10мл дихлорметану. Потім суміш залишили до повернення до кімнатної температури, і продовжили збовтування протягом 15 годин. Далі середовище гідролізували розчином карбонату натрію. Суміш декантували, органічну фазу один раз промили водою, а потім висушили над сульфатом магнію і сконцентрували 31 83821 при зниженому тиску. Неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю дихлорметану/метанолу/водного розчину аміаку (90/10/5; об'єм/об'єм/об'єм). У результаті був отриманий необхідний продукт у вигляді жовтої олії (вихід =43%). 1 H ЯМР (250МГц, ДМСО) δ: 7,36 (m, 5H); 5,07 (s, 2H); 3,55 (m, 2Н); 3,44 (m, 2Н); 3,38 (m, 4Н); 3,16 (d, 2H); 2,60 (m, 2Н); 2,44 (m, 6Н); 2,24 і 2,22 (2s, 3H); 1,76 (m, 2Н). Препарат LXIII 1-[2-(гексагідро-4-метил-1Н-1,4-діазепін-1-іл)2-оксоетил]піперазин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату LXII, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =60%). 1 H ЯМР (250МГц, ДМСО) δ: 3,56 (m, 2H); 3,44 (m, 2Н); 3,10 (d, 2H); 2,74 (dd, 4H); 2,61 (m, 1Н); 2,44 (m, 4Н); 2,39 (m, 3H); 2,25 і 2,22 (2s, 3H); 1,78 (m, 2Н). Препарат LXIV 1-[2-(гексагідро-4-метил-1Н-1,4-діазепін-1іл)етил]піперазин Способом, аналогічним процедурі одержання Препарату LXI, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату LXlII, був отриманий необхідний продукт у вигляді жовтої олії (вихід =21%). 1 H ЯМР (300МГц, ДМСО) δ: 2,63 (m, 8H); 2,49 (m, 5Н); 2,28 (m, 7Н); 2,21 (s, 3H); 1,66 (quin, 2H). Препарат LXV 1-{1-оксо-2-пропеніл)азетидин Способом, аналогічним процедурі одержання Препарату LVIII, використовуючи як вихідну сполуку азетидин, був отриманий необхідний продукт у вигляді жовтої олії, що без подальшого очищення була використана в реакції при одержанні наступного Препарату. Препарат XLXVІ 4-[3-(1-азетидиніл)-3-оксопропіл]-1піперазинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату LIX, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату LXV, був о триманий необхідний продукт у вигляді жовтої олії (вихід =14%). 1 H ЯМР (250МГц, ДМСО) δ: 7,34 (m, 5H); 5,06 (s, 2H); 4,09 (t, 2H); 3,80 (t, 2H); 3,35 (т. 4Н); 2,48 (t, 2H); 2,33 (t, 4H); 2,16 (m, 4Н). Препарат LXVII 1-[3-{1-азетидиніл)-3-оксопропіл]піперазин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату L XVI, був отриманий необхідний продукт у вигляді жовтої твердої речовини (вихід =100%). Температура топлення =50°C. Препарат LXVlII 1-[3-(1-азетидиніл)пропіл]піперазин 32 Способом, аналогічним процедурі одержання Препарату LXI, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату LXVIl, був отриманий необхідний продукт у вигляді жовтої олії (вихід =30%). 1 H ЯМР (300МГц, ДМСО) δ: 3,19 (m широка, 1Н); 3,02 (t, 4H); 2,66 (t, 4H); 2,25 (m, 8Н); 1,93 (quin, 2H); 1,36 (quin, 2H). Препарат LXlX α-[(диметиламіно)метил]-4-піперидинметанол 20г (83,6мМ) 2-[(диметиламіно)метил]-4піридинметанолу дигідрохлориду розчинили в 200мл метанолу при 50°C. Потім в атмосфері азоту додали 2г оксиду платини, і суміш збовтували в атмосфері азоту під тиском 300гПа (3 бари) при 50°C протягом 7 годин. Потім каталізатор видалили за допомогою фільтрації, а фільтрат сконцентрували при зниженому тиску. Твердий залишок розчинили в 10мл 10N розчину гідроксиду натрію і 150мл хлороформу. Органічну фазу відокремили і промили розчином хлориду натрію, висушили над сульфатом магнію і сконцентрували при зниженому тиску. У результаті був отриманий необхідний продукт у вигляді олії, що кристалізувалася (вихід =87%). Температура топлення =98°C. Препарат LXX 4-(1-піролідиніл метил)піперидин Способом, аналогічним процедурі одержання Препарату LXIX, використовуючи як вихідну сполуку 4-(1-піролідинілметил)піридин, був отриманий необхідний продукт у вигляді жовтої олії. Препарат LXXl 4-[(4-(1-метилетил)-1-піперазиніл]-1піперидинкарбонової кислоти фенілметиловий ефір Приготували суміш 827мг (3,54мМ) бензилового ефіру 4-оксо-1-піперидинкарбонової кислоти, 500мг (3,9мМ) N-ізопропілпіперазину і 1,2г (4,25мМ) ізопропоксиду титан у в 10мл метанолу. При перемішуванні при кімнатній температурі було додано 148мг борогідриду натрію. Реакційну суміш витримали при перемішуванні протягом 16 годин, а потім розбавили 20мл води. Отриману суспензію профільтрували, а осад промили 30мл етилацетату, що потім використовували для екстракції фільтрату. Отриману органічну фазу промили водою, а потім висушили над сульфатом магнію і сконцентрували при зниженому тиску. Отриману жовту олію очистили за допомогою хроматографії на силікагелі з елююванням сумішшю ди хлорметану/метанолу (9/1; об'єм/ об'єм). У результаті було отримано 235мг потрібного продукту у вигляді білої твердої речовини (вихід =19%). Температура топлення =55°C. Препарат LXXlI 4-[4-{1-метилетил)-1-піперазиніл]піперидмн Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку ефір, отриманий відповідно до процедури одержання Препарату L XXI, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =98%). Температура топлення =65°C. 33 83821 Препарат LXXllI 4-[(4-метии-1-піперазиніл)метил]-1піперидинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату LXXІ, використовуючи як вихідні сполуки N-метилпіперазин і бензиловий ефір 4-форміл1-піперидинкарбонової кислота, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =52%). 1 H ЯМР (250МГц, ДМСО) δ: 7,34 (m, 5H); 5,05 (s, 2H); 3,98 (m, 2Н); 2,77 (m, 2Н); 2,29 (m, 8Н); 2,19 (s, 3H); 2,08 (d, 2H); 1,67 (m, 3H); 0,95 (m, 2Н). Препарат LXXl V 4-[|4-метил-1-піперазиніл)метил]піперидин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку складний ефір, отриманий відповідно до процедури одержання Препарату LXXIH, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =77%). 1 H ЯМР (250МГц, ДМСО) δ: 2,89 (m, 2H); 2,51 (m, 2Н); 2,28 (m, 8Н); 2,12 (s, 3H); 2,05 (d, 2H); 1,55 (m, 3H); 1,02 (m, 2Н). Препарат LXXV 4-[(1-азетидиніл)метил]-1-піперидинкарбонової кислоти феніл метиловий ефір Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку азетидин, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =69%). 1 H ЯМР (300МГц, ДМСО) δ: 7,34 (гп, 5Н); 5,04 (s, 2H); 3,95 (m, 2H); 3,06 (t, 4H); 2,75 (m, 2Н); 2,18 (d, 2H)] 1,94 (quin, 2H); 1,61 (m, 2Н); 1,38 (m, 1Н); 0,94 (m, 2Н). ПрепаратХХVI 4-[(1-азетидиніл)метил]піперидин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи в якості вихідної сполуки ефір, отриманий відповідно до процедури одержання Препарату LXXV, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =93%). 1 H ЯМР (250МГц, ДМСО) δ: 3,06 (t, 4H); 2,92 (m, 2H); 2,50 (m, 2Н); 2,15 (d, 2H); 1,91 (quin, 2H); 1,59 (m, 2Н); 1,30 (m, 1H); 1,00 (m, 2Н). Препарат LXXVlI 4-[{диметиламіно)метил]-1піперидинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату LXXIlI, використовуючи як вихідну сполуку діетиламін, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =78%). 1 H ЯМР (300МГц, ДМСО) δ: 7,35 (m, 5H); 5,05 (s, 2H); 3,97 т, 2Н); 2,79 (m, 2Н); 2,09 (S, 6Н); 2,02 (d, 2НУ, 1,68 (d, 2H); 1,61 (m, 1Н): 0,96 (m, 2Н). Препарат LXXVlII 4-[(диметиламіно)метил]піперидин Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату LXXlll, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =90%). 34 1 H ЯМР (300МГц, ДМСО) δ: 2,91 (m, 2H); 2,43 (m, 2H); 2,08 (s, 6H); 2,01 (d, 2H); 1,59 (m, 2Н); 1,49 (m, 1Н); 0,96 (dq, 2H). Препарат LXXIX 4-[{4-етил-1-піперазиніл)метил]-1піперидинкарбонової кислоти 1,1диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату LXXIІІ, використовуючи як вихідну сполуку N-етилпіперазин і трет-бутиловий ефір 4форміл-1-піперидинкарбонової кислоти, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =78%). 1 H ЯМР (300МГц, ДМСО) δ: 3.90 (m, 2H); 2,67 (m, 2Н); 2,29 (m, 10Н); 2,09 (d, 2H); 1,63 (m, 3H); 1,38 (s, 9H); 0,96 (t, 3H); 0,85 (m, 2Н). Препарат LXXX 4-[(4-етил-1-піперазиніл)метил]піперидин Способом, аналогічним процедурі одержання Препарату XXIX, використовуючи в якості вихідної сполуки ефір, отриманий відповідно до процедури одержання Препарату L XXIX, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =76%). 1 H ЯМР (250МГц, ДМСО) δ: 2,95 (m, 2H); 2,51 (m, 2H); 2,42 (m, 20H); 2,05 (d, 2H); 1,54 (m, 3H); 1,03 (m, 2H); 0,99 (t, 3H). Препарат LXXXІ 4-[(гексагідро-4-метил-1Н-1,4-діазепін-1іл)метил]-1-піперидинкарбонової кислоти 1,1диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату LXXIX, використовуючи як вихідну сполуку N-метил-гомопіперазин, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =83%). 1 H ЯМР (300МГц, ДМСО) δ: немає результатів 1 H ЯМР. Препарат LXXXII 4-[(гексагідро-4-метил-1Н-1,4-діазепін-1іл)метил]піперидин Способом, аналогічним процедурі одержання Препарату XXIX, використовуючи як вихідну сполуку ефір, отриманий відповідно до процедури одержання Препарату L XXXI, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =23%). 1 H ЯМР (250МГц, ДМСО) δ: 3,03 (m, 2H); 2,57 (m, 5Н); 2,50 (m, 5Н); 2,25 (s, 2H); 2,22 (s,3H); 1,68 (m, 4Н); 1,63 (m, 1Н); 1,08 (m, 2Н). Препарат LXXXIII 4-(гексагідро-4-метил-1Н-1,4-діазепін-1-іл)-1піперидинкарбонової кислоти 1,1диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату LXXI, використовуючи як вихідні сполуки N-метил-гомопіперазин і трет-бутиловий ефір 4оксо-1-піперидинкарбонової кислоти, був отриманий необхідний продукт у вигляді жовтої олії (вихід =36%). 1 H ЯМР (250МГц, CDCI3) δ: 4,15 (m, 2H); 2,82 (m, 4H); 2,70 (m, 7H); 2,42 (s, 3H); 1,87 (m, 2H); 1,98 (m, 2H); 1,45 (s, 9H); 1,40 (m, 2H). 35 83821 Препарат LXXXIV 4-(гекеагідро-4-метал-1Н-1,4-діазепін-1іл)піперидину тригідрохлорид 409мг (1,37мМ) сполуки, отриманої відповідно до процедури одержання Препарату LXXXIII, розчинили в 1мл метанолу і додали 27мл 2,3N розчину хлористого водню в етилацетаті. Суміш збовтували при температурі навколишнього середовища протягом 12 годин, а потім сконцентрували при зниженому тиску. У результаті був о триманий необхідний продукт у вигляді бежевої піни (вихід =99%). 1H ЯМР (250МГц, ДМСО) δ: 3,88 (m, 4H); 3,62 (m, 1Н); 3,43 (m, 6Н); 2,94 (m, 2Н); 2,82 (S, 3H); 2,31 (m, 4H); 2,10 (m, 2Н). Препарат LXXXV 4-(4-циклопропіл-1-піперазиніл)-1піперидинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату LXXІ, використовуючи як вихідну сполуку N-циклопропілпіперазин, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =62%). Температура топлення =64°С. Препарат LXXXVІ 4-(4-циклопропіл-1-піперазиніл)пігіеридин Способом, аналогічним процедурі одержання Препарату LXXІІ, використовуючи як вихідн у сполуку ефір, отриманий відповідно до процедури одержання Препарату L XXXV, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =90%). Температура топлення =1070C. Препарат LXXXVII 4-[4-(1,1-диметилетил)-1-піперазиніл]-1піперидинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату LXXI, використовуючи як вихідну сполуку N-трет-бутилпіперазин, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =50%). Температура топлення =84°С. Препарат LXXXVIІІ 4-[4-(1,1-диметилбтил)-1піперазиніл]піперидин Способом, аналогічним процедурі одержання Препарату LXXII, використовуючи як вихідн у сполуку ефір, отриманий відповідно до процедури одержання Препарату L XXXVІІ, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =75%). Температура топлення =82°С. ПрепаратLXXXIX 4-(4-піперидиніл)-1-піперидинкарбонової кислоти 1,1-диметилетиловий ефір Був приготовлений розчин 41г (0,17 M) 4,4'біпіперидину дигідрохлориду в 250мл етанолу і 250мл 2N розчину гідроксиду натрію. Повільно, при 0°C, був доданий розчин 18,5г (0,085M) третбутилдикарбонату в 100мл етанолу. Реакційну суміш збовтували протягом 1 години при 10°C, а потім видалили етанол у випарнику при зниженому тиску. Залишок водної фази наситили хлоридом натрію й екстрагували етилацетатом. Отриману органічну фазу висушили над сульфатом 36 магнію і сконцентрували при зниженому тиску. Неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю дихлорметану/метанолу/водного розчину аміаку (8/2/0,4; об'єм/об'єм/об'єм). У результаті було отримано 16,5г потрібної сполуки у вигляді білої твердої речовини (вихід =72%). Температура топлення: 70-71°С. Препарат ХС 4-(1-етил-4-піперидиніл)-1піперидинкарбонової кислота 1,1-диметиловий ефір Способом, аналогічним процедурі одержання Препарату LXXl, використовуючи як вихідні сполуки ефір, отриманий відповідно до процедури одержання Препарату L XXXIX, і ацетальдегід, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =87%). Температура топлення =68-70°C. Препарат XCl 4-(1-етил-4-піперидиніл)піперидину дигідрохлорид Способом, аналогічним процедурі одержання Препарату LXXXIV, використовуючи як вихідну сполуку ефір, отриманий відповідно до процедури одержання Препарату XC, був о триманий необхідний продукт у вигляді білої твердої речовини (вихід =100%). Температура топлення =280°C. Препарат XCll 4-[1-{1-метилетил)-4-піпeридиніл]-1піперидинкарбонової кислоти 1,1-диметиловий ефір Способом, аналогічним процедурі одержання Препарату XC, використовуючи як ви хідні сполуки ефір, отриманий відповідно до процедури одержання Препарату LXXXIX, і ацетон, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =69%). 1 H ЯМР (250МГц, CDCI3) δ: 4,10 (m, 2H); 3,52 (m, 1H); 3,47 (m, 2H); 2,55 (m, 4H); 1,88 (m, 4H); 1,85 (m, 4H); 1,45 (s, 9H); 1,30 (d, 6H); 1,12 (m, 2H). Препарат XClII 4-[1-(1-метилетил)-4-піперидиніл]піперидину дигідрохлорид Способом, аналогічним процедурі одержання Препарату LXXXl V, використовуючи як вихідну сполуку складний ефір, отриманий відповідно до процедури одержання Препарату XCIl, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =89%). Температура топлення =250°C. Препарат ХСІV 4-(1-циклопропіл-4-піперидиніл)-1піперидинкарбонової кислоти 1,1диметилетиловий ефір 150мг (0,56мМ) сполуки, отриманої відповідно до процедури одержання Препарату LXXXIX, розчинили в 5мл метанолу і додали 320мл оцтової кислоти, 200мг молекулярного сита (3Å), а потім 562мкл (2,79мМ) 1-етокси-1-(триметилсилілокси)циклопропану і 141мг (2,23мМ) борогідриду натрію. Реакційну суміш нагрівали при слабкому кипінні протягом 20 годин, а потім остудили і профільтрували. Фільтрат сконцентрували при 37 83821 зниженому тиску, а залишок від випару розчинили в 20мл етилацетату. Цю органічну фазу промили 2N розчином гідроксиду натрію, а потім - насиченим розчином хлориду натрію, висушили над сульфатом магнію і сконцентрували при зниженому тиску. Неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю дихлорметану/метанолу (95/5; об'єм/об'єм). У результаті було отримано 110мг потрібної сполуки у вигляді білого порошку (ви хід =64%). 1 H ЯМР (250 УГц, CDCi3) δ: 4,10 (m, 2H); 3,05 (m, 4Н); 2,65 (t, 2H); 2,09 (t, 2H); 1,67 (m, 4Н); 1,55 (m, 1Н); 1,45 (s, 9H); 1,22 (m, 6Н); 0,47 (m, 4Н). ПрепаратХСV 4-(1-циклопропіл-4-піперидиніл)піперидину дигідрохлорид Способом, аналогічним процедурі одержання Препарату LXXXІV, використовуючи як вихідну сполуку ефір, отриманий відповідно до процедури одержання Препарату XCІ, був отриманий необхідний продукт у вигляді білої пасти (вихід =99%). 1 H ЯМР (250МГц, ДМСО) δ: 10,50 (m широка, 1Н); 8,80 (m широка, 2Н); 3,45 (m, 2Н); 3,16 (m, 2Н); 2,81 (m, 2Н); 2,73 (m, 3H); 1,90 (m, 4Н); 1,60 (m, 2H); 1,35 (m, 4H); 1,10 (m, 2Н); 0,78 (m, 2Н). Препарат XCVI 4-[2-(4-піперидиніл)етил]-1піперидинкарбонової кислота 1,1диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату LXXXIX, використовуючи як вихідну сполуку 4,4'-етилендипіперидину гідрохлорид, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =39%). Температура топлення =92-94°С. Препарат XCVІІ 4-[2-(1-метил-4-піперидиніл)етил]піперидин Був приготовлений розчин 307мг (1,04мМ) складного ефіру, отриманого відповідно до процедури одержання Препарату XC VІ, у 20мл безводного тетрагідрофурану (ТГФ), і до нього порціями було додано 157мг (4,14мМ) алюмогідриду літію. Реакційну суміш збовтували протягом 10 годин при 70°С, а потім остудили і розбавили 30мл ТГФ. Додали 200мг глауберової солі, і суміш залишили в умовах збовтування при температурі навколишнього середовища на ніч, після чого профільтрували. Фільтрат сконцентрували при зниженому тиску з одержанням 235мг потрібного продукту у вигляді білої пасти (вихід =99%). 1 H ЯМР (300МГц, ДМСО) δ: 3,16 (s, 2H); 2,80 (m, 2H); 2,70 (m, 2Н); 2,38 (t, 2H); 2,10 (S, 3H); 1,76 (m, 2Н); 1,58 (m, 3H); 1,42 (m, 1Н); 1,11 (m, 8H); 0,94 (m, 2H). Препарат ХСVIII 4-[2-(4-метил-1-піперазиніл)етил]піридин У пробірці змішали 2мл (19мМ) 4вінілпіридину, 3,16мл (28,5мМ) N-метилпіперазину і 200мкл оцтової кислоти з 12мл етанолу. Пробірку закрили і нагрівали протягом 10 хвилин при 160°C в мікрохвильовій печі. Після охолодження повільно додали 20мл 0.5N гідроксиду натрію й екстрагували суміш ди хлорметаном. Відділену органічну фазу висушили над суль фатом магнію і сконцентру 38 вали при зниженому тиску. У результаті був отриманий необхідний продукт у вигляді жовтої олії (вихід =86%). 1 H ЯМР (250МГц, ДМСО) δ: 8,43 (del, 2H); 7,25 (dd, 2H); 2,73 (t, 2H); 2,52 (m, 2H); 2,48 (m, 4H); 2,30 (m, 4H); 2,13 (s, 3H). У ході виконання процедур, аналогічних процедурі одержання Препарату XCVIll, були отримані наступні похідні піридину: Препарат IC 4-[2-(1-піперидиніл)етил]піридин Жовта олія (вихід =52%). 1 H ЯМР (250МГц, ДМСО) δ: 8,43 (dd, 2H); 7,24 (dd, 2H); 2,73 (t, 2H); 2S49 (m, 2H); 2,37 (t, 2H);1,43 (m, 6H). Препарат С 4-[2-[(метил)(1-метилетил)аміно]етил]піридин Жовта олія (вихід =10%). 1 H ЯМР (250МГц, ДМСО) δ: 8,49 (d, 2H): 7,16 (d, 2H); 2,76 (hep, 1H); 2,65 (t, 2H); 2,56 (d, 2H); 2,15 (s, 3H); 0,90 (d, 6H). Препарат CI 4-[2-(4-морфолін)етил]піридин Жовта олія (вихід =72%). 1 H ЯМР (250МГц, ДМСО) δ: 8,44 (dd, 2H); 7,26 (dd, 2H); 3,05 (dd, 4H); 2,75 (t, 2H); 2,53 (m, 2H); 2,41 (dd, 2H). Препарат СІІ 4-[2-(1-ацетинідил)етил]піридин Жовта олія (вихід =62%). 1 H ЯМР (300МГц, ДМСО) δ: 8,43 (d, 2H); 7,22 (d, 2H); 3,07 (t, 4H); 2,53 (m, 4H); 1,91 (quin, 2H). Препарат СІІІ (Метил)[2-(4-піридиніл)етил]карбамінової кислоти 1,1-диметилетиловий ефір Жовта олія (вихід =83%). 1 H ЯМР (300МГц, ДМСО) δ: 8,45 (d, 2H); 7,21 (d, 2H); 3,42 (t, 2H); 2,76 (t, 2H); 2,75 (s, 3H); 1,23 (s, 9H). Препарат CIV 4-[2-[(метил)(етил)аміно]етил]піридин Безбарвна олія (вихід =51%). 1 H ЯМР (300МГц, ДМСО) δ: 8,50 (d, 2H); 7,25 (d, 2H); 2,73 (t, 2H); 2,55 (t, 2H); 2,43 (q, 2H); 2,23 (s, 3H); 0,90 (t; 3H). Препарат СV 4-[2-(діетиламіно)етил]піридин Жовта олія (вихід =30%). 1 H ЯМР (250МГц, ДМСО) δ: 8,43 (dd, 2H); 7,24 (dd, 2H); 2,65 (m, 4H); 2,40 (q, 4H); 0,93 (t, 6H). Препарат CVI 4-[2-(гексагідро-4-метил-1Н-1,4-діазепiн-1іл}етил]піридин Жовта олія (вихід =52%). 1 H ЯМР (250МГц, ДМСО) δ: 8,43 (d, 2H); 7,25 (d, 2H); 2,71 (m, 8H); 2,50 (m, 4Н); 2,22 (s, 3H);1,68 (m, 2H). Препарат CVII 4-[2-(4-метил-1-піперазиніл)етил]піперидин Способом, аналогічним процедурі одержання Препарату LXІX, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату XCVІІІ, був отриманий необхідний продукт у вигляді жовтої твердої речовини (вихід =80%). 39 83821 Температура топлення =111-112°С. Препарат СVIII 4-[2-{диметиламіно)етил]піперидин Способом, аналогічним процедурі одержання Препарату CVII, використовуючи як вихідну сполуку 4-[2-(диметиламіно)етил]піридин, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =96%). 1 H ЯМР (300МГц, ДМСО) δ: 2,86 (2Н); 2,39 (dt, 2H); 2,18 (dd, 2H); 2,08 (s, 6H); 1,54 (dm, 2H); 1,27 (m, 3H); 0,96 (m, 2H). Препарат ClX 4-[2-(1-піролідиніл)етил]піперидин Способом, аналогічним процедурі одержання Препарату CVll, використовуючи як ви хідну сполуку 4-[2-(1-піролідиніл)етил]піридин, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =88%). 1 H ЯМР (300МГц, ДМСО) δ: 2,86 (dm, 2H); 2,38 (m, 8H); 1,64 (m, 4H); 1,54 (dm, 2H); 1,32 (m, 3H); 0,96 (dq, 2H). Способом, аналогічним процедурі одержання Препарату CVII, використовуючи як вихідні сполуки, отримані відповідно до процедур одержання препаратів IC-CVI, були отримані наступні похідні піперидину: Препарат CX 4-[2-(1-піперидиніл}етил]піперидин Жовта олія (вихід =92%). 1 H ЯМР (300МГц, ДМСО) δ: 3,10 (dm, 2H); 2,67 (dt, 2H); 2,27 (m, 6H); 1,70 (m, 2H); 1,47 (m, 5H); 1,35 (m, 4H); 1,23 (m, 2H). Препарат CXl 4-[2-[(метил)(1метилетил)аміно]етил]піперидин Жовта олія (вихід =96%). 1 H ЯМР (250МГц, ДМСО) δ: 3,10 (d, 2H); 2,77 (m, 1H); 2,60 (m, 2Н); 2,35 (t, 2H); 2,10 (s.3H); 1,72 (m, 2Н); 1,34 (m, 1Н); 1,29 (t, 2H); 1,23 (m, 2Н); 0,91 (d, 6H). Препарат CXll 4-[2-(4-морфолініл)етил]піперидин Безбарвна олія (вихід =98%). 1 H ЯМР (300МГц, ДМСО) δ: 3,54 (t, 4H); 2,86 (dt, 2H); 2,39 (dt, 2H); 2,28 (m, 4H); 2,25 (t, 2H); 1,54 (dm, 2H); 1,31 (m, 3H); 0,97 (m, 2Н). Препарат CXIlІ 4-[2-(1-азетидиніл)етил]піперидин Безбарвна олія (вихід =74%). 1 H ЯМР (250МГц, ДМСО) δ: 3,16 (t, 4H); 3,12 (m, 2H); 2,65 (m, 2Н); 2,35 (t, 2H); 1,94 (quin, 2H); 1,85 (m, 2Н); 1,35 (m, 1Н); 1,23 (t, 2H); 1,15 (m, 2Н). Препарат CXІV (Метил)[2-(4-піперидиніл)етил]карбамінової кислоти 1,1-диметилетиловий ефір Безбарвна олія (вихід =64%). 1 H ЯМР (300МГц, ДМСО) δ: 3,16 (t, 2H); 2,89 (dm, 2H); 2,73 (s, 3H); 2,40 (t, 2H); 1,38 (s, 9H); 1,35 (m, 2H); 0,96 (m, 2H). Препарат СХV 4-[2-[(метил)(етил)аміно]етил]піперидин Безбарвна олія (вихід =98%). 1 H ЯМР (300МГц, ДМСО) δ: 3,13 (m, 2H); 2,68 (m, 2Н); 2,32 (m, 4Н); 2,11 (s, 3H); 1,85 (m, 2Н); 1,51 (m, 1Н); 1,34 (t, 2H); 1,24 (m, 2Н); 0,96 (t, 3H). 40 Препарат СХVl 4-[2-(діетиламіно)етил]піперидин Жовта олія (вихід =87%). 1 H ЯМР (250МГц, ДМСО) δ: 2,87 (dm, 2H); 2,40 (m, 8H); 1,54 (dm, 2H); 1,26 (m, 3H); 0,98 (m, 2H); 0,91 (t, 6H). Препарат CXVll 4-[2-(гексагідро-4-метил-1Н-1,4-дiазепін-1іл)етил]піперидин Жовта олія (вихід =79%). 1 H ЯМР (250МГц, ДМСО) δ: 2.89 (d, 2H); 3,05 (m, 2H); 2,58 (m, 4Н); 2,49 (m, 4Н); 2,46 (m, 4Н); 2,21 (s, 3H); 1,66 (m, 2H); 1,64 (m, 2Н); 1,28 (m, 3H); 0,99 (m, 2Н). Препарат СХVlll 4-{2-гідрокси-1,1-диметилетил)-1піперидинкарбонової кислоти 1,1диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату LXXXIX, використовуючи як вихідну сполуку (β,β-диметил-4-піперидинетанол, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =96%). 1 H ЯМР (300МГц, ДМСО) δ: 4,41 (t, 1H); 3,98 (d, 2Н); 3,13 (d, 2H); 2,51 (m, 2H); 1,50 (d, 2H); 1,38 (s, 9Н); 1,33 (m, 1Н); 1,04 (m, 2Н); 0,93 (s, 6H). Препарат СХlХ 4-(1,1-диметил-2-оксоетил)-1піперидинкарбонової кислоти 1,1диметилетиловий ефір Був приготовлений розчин 68мкл (0,77мМ) оксалілхлориду в 6мл безводного дихлорметана. При -70°C було додано 82,5мкл диметилсульфоксиду, а потім, через 15 хвилин, 100мг (0,39мМ) було додано 100мг (0,39мМ) спирту, о триманого відповідно до процедури одержання Препарату CXVllI, розчиненого в 4мл дихлорметану. Потім, через 5 хвилин, додали 270мкл триетиламіну. Суміш збовтували протягом 5 хвилин при -70°C, а потім залишили до досягнення температури навколишнього середовища. Після додавання 25мл етилацетату цю органічну фазу промили 10%-ним розчином бікарбонату натрію, висушили над сульфатом магнію і сконцентрували при зниженому тиску. Неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю ди хлорметану/етилацетату (85/15; об'єм/об'єм). У результаті було отримано 80мг потрібної сполуки у вигляді безбарвної олії (вихід =80%). 1 H ЯМР (250МГц, ДМСО) δ: 9,44 (s, 1H); 3,96 (d, 2H); 2,59 (m, 2H); 1,69 (m, 1Н); 1,50 (m, 2Н); 1,38 (s, 9H); 1,07 (m, 2Н); 0,93 (s, 6H). Препарат СХХ 4-[2-(1-азетидиніл)-1,1-диметилетил]-1піперидинкарбонової кислоти 1,1диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату LXXI, використовуючи як вихідні сполуки сполуку, отриману відповідно до процедури одержання Препарату CXIX, і азетидин, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =65%). 1 H ЯМР (300МГц, ДМСО) δ: 3,96 (d, 2H); 3,13 (t, 4H); 2,51 (m, 2H); 2,16 (s, 2H); 1,92 (quin, 2H); 41 83821 1,55 (d, 2H); 1,39 (s, 9H); 135 (m, IH); 1,05 (m, 2Н); 0,70 (s, 6H). Препарат CXXI 4-[2-(1-азетидиніл)-1,1диметилетил]піперидину біс(трифторацетат) 520мг (1,75мМ) сполуки, отриманої відповідно до процедури одержання Препарату CXX, змішали з 3мл трифтороцтової кислоти і 380мкл анізолу в 3мл дихлорметану. Суміш збовтували протягом ночі при температурі навколишнього середовища, а потім сконцентрували при зниженому тиску. Залишок розчинили в 20мл толуолу і знову сконцентрували при зниженому тиску. Неочищений продукт розтерли в 4мл етилового ефіру з одержанням твердої речовини, що відокремили за допомогою фільтрації і висушили. У результаті було отримано 683мг потрібної сполуки (вихід =92%). Температура топлення =138-140°C. Препарат CXXII 4-[2-(4-морфолІніл)-1,1-диметилетил]-1піперидмнкарбонової кислота 1,1-діметилетиловий ефір Способом, аналогічним процедурі одержання Препарату CXX, використовуючи як вихідну сполуку морфолін, був о триманий необхідний продукт у вигляді безбарвної олії (вихід =12%). 1 H ЯМР (300МГц, ДМСО) δ: 3,97 (d, 2H); 3,53 (t, 4H); 2,57 (m, 2H); 2,41 (t, 4H); 2,10 (s, 2Н); 1,60 (d, 2Н); 1,38 (s, 9H); 1,29 (m, 1Н); 1,05 (m, 2Н); 0,77 (s, 6H). Препарат CXXIIl 4-[2-(4-морфолініл)-1,1диметилетил]піперидину біс(трифторацетат) Способом, аналогічним процедурі одержання Препарату CXXl, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату C XXІІ, був отриманий необхідний продукт у вигляді ясно-жовтої твердої речовини (вихід =69%). Температура топлення =158-160°C. Препарат CXXl V 4-[2-(1-піперидиніл)1,1-диметилетил]піридин Суспензію 70г (0,58M) 4-ізопропілпіридину, 250г (2M) піперидину гідрохлорид і 85г параформальдегиду в 600мл 95%-ного етанолу витримували при кип'ятінні протягом 48 годин. Потім реакційну суміш сконцентрували при зниженому тиску, а залишок розчинили в 650мл 3N розчину гідроксиду натрію і тричі екстрагували 250мл етилацетату. Об'єднані органічні фази промили розчином хлориду натрію, висушили і сконцентрували при зниженому тиску, Неочищений продукт перегнали під вакуумом при 1мМ рт.ст., і фракцію, зібрану між 80 і 125°C, очистили за допомогою хроматографії на силікагелі з елююванням сумішшю толуолу/ізопропанолу (9/1; об'єм/об'єм). У результаті було отримано 21,4г потрібної сполуки у вигляді прозорої жовтої олії (вихід =17%). 1 H ЯМР (300МГц, ДМСО) δ: 8,49 (d, 2H); 7,32 (d, 2H); 2,53 (s, 2H); 2,20 (t, 4H); 1,39 (m, 4H); 1,36 (m, 2Н); 1,29 (s, 6H). Препарат CXXV 4-[2-(1-піперидиніл)-1,1диметилетил]піперидин 42 Способом, аналогічним процедурі одержання Препарату CVІІ, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату CXXIV, був отриманий необхідний продукт у вигляді жовтої олії (вихід =33%). 1 H ЯМР (300МГц, ДМСО) δ: 2,94 (dm, 2H); 2,37 (m, 6H); 2,03 (s, 2H); 1,45 (m, 6H); 1,32 (m, 2H); 1,18 (m, 1H); 1,05 (m, 2H); 0,74 (s, 6H). Способом, аналогічним процедурі одержання препаратів CXXIV і CXXV, було отримано два наступні сполуки: Препарат CXXVl 4-[2-(1-піролідиніл)-1,1-диметилетил]піперидин Жовта олія (вихід =72%). 1 H ЯМР (250МГц, ДМСО) δ: 2,97 (d, 2H); 2,55 (m, 4H); 2,48 (m, 2Н); 2,26 (s, 2H); 1,66 (m, 4Н); 1,62 (d, 2H); 1,29 (m, 1Н); 1,03 (m, 2Н); 0,77 (s, 6H). Препарат СХХVІІ 4-[2-(діетиламіно)-1,1-диметилетил]піперидин Безбарвна олія (вихід =79%). 1 H ЯМР (300МГц, ДМСО) δ: немає результатів 1 H ЯМР. Препарат CXXVlll N,1-диметил-N-[1-(фeнілметил)-4-піперидиніл]4-піперидинамін Способом, аналогічним процедурі одержання Препарату LXXI, використовуючи як вихідні сполуки N-метил-4-піперидинон і 1-бензил-4(метиламіно)піперидин, був отриманий необхідний продукт у вигляді жовтої олії (вихід =66%). 1 H ЯМР (300МГц, ДМСО) δ: 7,28 (m, 5H); 3,41 (s, 2H); 2,76 (m, 4Н); 2,40 (m, 2Н); 2,12 (S, 3H); 2,10 (s, 3H); 1,90 (dt, 2H); 1,81 (dt, 2H); 1,57 (dm, 4H); 1,44 (m, 4Н). Препарат CXXl X N,1-диметил-N-{4-піперидиніл)-4пiперидинамін Був приготовлений розчин 980мг (3,25мМ) сполуки, отриманої відповідно до процедури одержання Препарату CXXVIІI, у 60мл метанолу і до нього було додано 150мг 10%-ного паладію на вуглеці. Суміш збовтували в атмосфері водню під тиском 50 фунтів на кв. дюйм (3,5 бари або 3450гПа) при температурі навколишнього середовища протягом 10 годин. Каталізатор видалили за допомогою фільтрації, а фільтрат сконцентрували при зниженому тиску. Отриманий неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю дихлорметану/метанолу/водного розчину аміаку (97/3/0,3; об'єм/об'єм/об'єм). Необхідний продукт був отриманий у вигляді жовтої олії (ви хід =29%). 1 H ЯМР (250МГц, ДМСО) δ: 2,94 (d, 2H); 2,76 (d, 2H); 2,43 (m, 4H); 2,12 (s, 3H); 2,10 (s, 3H); 1,81 (m, 2Н); 1,76 (m, 4Н); 1,45 (m, 2H); 1,30 (m, 2H). Препарат CXXX 4-[2-оксо-2-(4-метил-1піперазиніл)етил]піридин Був приготовлений розчин 3г (17,3мМ) (4піридиніл)оцтової кислоти в 50мл тетрагідрофурану (ТГФ), і до нього по краплях при температурі навколишнього середовища додали розчин 3,4г (20,7мМ) карбонілдіімідазолу в 50мл ТГФ. Реакційну суміш збовтували протягом 8 годин, після чого додали розчин 1,73г (17,3мМ) N 43 83821 метилпіперазину в 20мл ТГФ. Реакційну суміш кип'ятили протягом 2 годин, а потім сконцентрували при зниженому тиску. Залишок від випару розчинили в 80мл 3N розчину гідроксиду натрію й екстрагували етилацетатом. Органічну фазу висушили над сульфатом магнію і сконцентрували при зниженому тиску. Неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю дихлорметану/метанолу (99/1; об'єм/об'єм). Необхідний продукт був отриманий у вигляді безбарвної олії (вихід =28%). 1 H ЯМР (250МГц, ДМСО) δ: 8,47 (dd, 2H); 7,23 (dd, 2H); 3,75 (s, 2H); 3,46 (t, 2H); 2,23 (t, 4Н); 2,15 (3Н). Препарат CXXXІ 4-[2-оксо-2-(4-метил-1піперазиніл)етил]піперидин Способом, аналогічним процедурі одержання Препарату CVІI, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату CXXX, був о триманий необхідний продукт у вигляді безбарвної олії (вихід =59%). 1 H ЯМР (250МГц, ДМСО) δ: 3,42 (t, 4H); 3,28 (m, 2H); 2,87 (dt, 2H); 2,41 (dt, 2H); 2,24 (m, 6Н); 2,16 (s, 3H); 1,71 (m, 1Н); 1,54 (dm, 2H); 1,06 (dq, 2H). Способами, аналогічними Прикладам 3 і 4, використовуючи як вихідні сполуки кислоти й аміни, отримані вище (або аміни, відомі з літератури), були отримані наступні сполуки згідно з даним винаходом: Приклад 16 N-[2-[2-[4-[3-(1-азетидиніл)пропіл]-1піперазиніл]-2-оксо-етокси]етил]-4-метокси-N,2,6триметилбензолcульфонамiду дифумарат Бежева тверда речовина (вихід =34%). Температура топлення =82°С. Приклад 17 N-[2-[2-[4-(1-метил-3-піперидиніл)-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбeнзолсульфонаміде дифумарат Біла тверда речовина (вихід =36%). Температура топлення =60-65°C. Приклад 18 N-[2-[2-[4-{1-метил-4-піперидиніл}-1пiперазиніл]-2-оксоетокси]етил]-4-метокси-Nциклопропiл-2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =51%). Температура топлення =185°C. Приклад 19 N-[2-|2-[4-[2-(1-піролідиніл)етил]-1піперазиніл]-2-оксоетокси]етил]-4-метокси-Nциклопропіл-2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =42%). Температура топлення =141°C. Приклад 20 N-[2-[2-[4-[(1-метил-2-імідазоліл)метил]-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =45%). Температура топлення =60-65°C. 44 Приклад 21 N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N-етил2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =48%). Температура топлення =206°C. Приклад 22 N-[2-|2-[4-[3-(диметиламіно)пропiл]-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N-етил2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =26%). Температура топлення =60°C. Приклад 23 N-[2-[2-[4-(9-метил-9-азабіцикло[3.3.1]нон-3іл)-1-піперазиніл]-2-оксоетокси]етил]-4-метоксиN,2,6-триметилбензолсульфонаміду фумарат Біла тверда речовина (вихід =73%). Температура топлення =96°С. N-[2-[2-[4-[3-(1-піролідиніл)пропіл]-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N-етил2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =63%). Температура топлення =65°С. Приклад 25 N-[2-[2-[4-[3-(1-піролідиніл)пропіл]-1піперазиніл]-2-оксоетокси]етил]-4-метокси-Nциклопропіл-2,6-диметилбензолсульфонаміду дифумарат Тверда речовина кольору суворої полотнини (вихід =61%). Температура топлення =55°C. Приклад 26 N-[2-[2-[4-(8-циклопропіл-8азабіцикло[3.2,1]окт-3-ил)-1-піперазиніл]-2оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду фумарат Біла тверда речовина (вихід =81%). Температура топлення =75°С. Приклад 27 N-[2-[2-[4-(8-мeтил-8-aзaбiциклo[3.2.1]oкт-3ил)-1-пiпepaзиніл]-2-oкcoeтoкcи]етил]-4-метокси-Nетил-2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =64%). Температура топлення =185°С. Приклад. 28 N-[2-[2-[4-(8-метил-8-азабіцикло[3.2.1]окт-3ил)-1-піперазиніл]-2-оксоетокси]етил]-4-метокси-Nциклопропіл-2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =51%). Температура топлення =160°C. Приклад 29 N-[2-[2-[4-(1-циклопропіл-4-піперидиніл)-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =60%). Температура топлення =112-114°С. N-[2-[2-[4-(8-метил-8-азабіцикло[3.2.1]окт-3ил}-1-піперазиніл]-2-oксоетокси]тил]-4-метокси-N(1-метилетил)-2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =60%). Температура топлення =168°С. 45 Приклад 31 N-[2-[2-[4-(1-етил-4-піперидиніл)-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду фумарат Бежева тверда речовина (вихід =48%). 1 H ЯМР (250МГц, ДМСО) δ: 6,80 (s, 2Н); 6,53 (s, 2H); 4,05 (s, 2H); 3,80 (s, 3H); 3,53 (t, 2H); 3,39 (m, 2H); 3,29 (m, 2Н); 3,22 (t, 2H); 3,12 (m, 2Н); 2,70 (s, 3H); 2,62 (q, 2H); 2,53 (s, 6Н); 2,48 (m, 4Н); 2,29 (m, 3H); 1,77 (m, 2H); 1,52 (m, 2Н); 1,07 (t, 2H). Приклад 32 N-[2-[2-[4-[1-(1,1-диметилетил)-4-піперидиніл]1-піперазиніл]-2-оксоетокси]тил]-4-метокси-N,2,6триметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =41%). Температура топлення =230°C. Приклад 33 N-[2-[2-[4-[(1-метил-4-піперидиніл)метил]-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду фумарат Жовта тверда речовина (вихід =62%). Температура топлення =50°C. Приклад 34 N-[2-[2-[4-[3-(диметиламіно)пропіл]-1піперазиніл]-2-оксоетокси]етил]-2,6-дихлор-4метокси-N-метил-бензолсульфонаміду дифумарат Біла тверда речовина (вихід =78%). Температура топлення =60°C. Приклад 35 N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксоетокси]етил]-2,6-дихлор-4метокси-N-метил-бензолсульфонаміду дифумарат Біла тверда речовина (вихід =69%). Температура топлення =125°C. Приклад 36 N-[2-[2-[4-[2-(1-метил-4-піперидиніл)етил]-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триуетилбензолсульфонаміду дифумарат Тверда речовина кольору суворої полотнини (вихід =62%). Температура топлення =90°С. Приклад 37 N-[2-[2-[4-(1-метил-4-піперидиніл)гексагідро1Н-1,4-діазепін-1-іл]-3-оксоетокси]тил]-4-метоксиN,2,6-триметилбензолсульфонаміду фумарат Біла тверда речовина (вихід =56%). Температура топлення =53°C. Приклад 38 N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N-(1метилетил)-2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =41%). Температура топлення =170°С. Приклад 39 N-[2-[2-[4-[1-{1-метилетил)-4-піперидиніл]-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду фумарат Біла тверда речовина (вихід =81%). Температура топлення =130°C. Приклад 40 N-[2-[2-[4-[3-(1-піперидиніл)пропіл]-1піперазиніл]-2-оксоетокси]етил]-4-метокcи-N-етил2,6-диметилбензолсульфонаміду дифумарат 83821 46 Тверда речовина кольору суворої полотнини (вихід =60%). Температура топлення =65°C. Приклад 41 N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксоетокси]етил]-2,4-дихлор-6метокси-N-метил-бензол-сульфонаміду дифумарат Біла тверда речовина (вихід =46%). Температура топлення =202°C. N-[2-[2-[4-(1-етил-4-піперидиніл)-1піперазиніл]-2-оксоетокси]етил]-2,6-дихлор-4метокси-N-метил-бензол-сульфонаміду фумарат Біла тверда речовина (вихід =68%). Температура топлення =96-98°C. Приклад 43 N-[2-[2-[4-((3S)-1-азабіцикло[2.2.2]окт-3-ил)-1піперазиніл]-2-оксоетокси]етил]-4-метокси-Nметил-2,6-дихлорбeнзолсульфонаміду фумарат Біла тверда речовина (вихід =36%). Температура топлення =75-79°C. Способами, аналогічними Прикладові 2, використовуючи як вихідні сполуки кислоти й аміни, отримані вище (або аміни, відомі з літератури), і з використанням кислоти, придатної для утворення солі очищеної основної сполуки, були отримані наступні сполуки згідно із даним винаходом: Приклад 44 N-[2-[2-[4-(1,2,2,6,6-пентаметил-4-піперидиніл)1-піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбензол-сульфонаміду біс(трифторацетат) Безбарвна олія (вихід =37%). 1 H ЯМР (300МГц, CD3CN) δ: 8,70 (m широка, 1Н); 6,75 (s, 2H); 4,10 (s, 2H); 3,80 (s, 3H); 3,76 (m, 4H); 3,70 (t, 1H); 3,61 (t, 2H); 3,28 (m, 4Н); 2,27 (s, 6H); 2,57 (s, 6H); 2,28 (dm, 4H); 1,47 (s, 6H); 1,38 (s, 6H). Приклад 45 N-[2-[2-[4-[3-(4-метил-1-піперазиніл)пропіл]-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміда дифумарат Біла тверда речовина (вихід =30%). Температура топлення =204°C. Приклад 46 N-[2-[2-[4-(8-етил-8-азабіцикло[3.2.1]окт-3-ил)1-піперазиніл]-2-оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =27%). Температура топлення =132°С. Приклад 47 N-[2-[2-[4-[3-(4-метил-гексагідро-1Н-1,4діазепін-1-іл)пропіл]-1-піперазиніл]-2оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =45%). Температура топлення =169°С. Приклад 48 N-[2-[2-[4-[8-(1-мeтилeтил)-8aзaбiцикло[3.2.1]oкт-3-ил]-1-піпepaзинiл]-2оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =35%). Температура топлення =132°С. 47 83821 Приклад 49 N-[2-[2-[4-[3-(4-метилгексагідро-1Н-1,4діазепін-1-ил)-3-оксо-пропіл]-1-піперазиніл]-2оксоетокси]етил]-4-метокси-N,2,6-триметилбензолсульфонаміду біс(трифторацетат) Безбарвна олія (вихід =35%). 1 H ЯМР (300МГц, CD3CN) δ: 6,76 (s, 2H); 4,15 (s, 2H); 3,84 (s, 3H); 3,82 (m, 6H); 3,65 (t, 2H); 3,62 (m, 2H); 3,44 (t, 2H); 3,36 (m, 10Н); 2,90 (t, 2H); 2,87 (s, 3H); 2,77 (s, 3H); 2,61 (s, 6Н); 2,18 (m, 2Н). Приклад 50 N-[2-[2-[4-[2-(4-метил-гексагідро-1Н-1,4діазепін-1-іл)етил]-1-піперазиніл]-2оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду три фумарат Біла тверда речовина (вихід =8%). Температура топлення =176°С. Способами, аналогічними Прикладам 5 і 4, використовуючи як вихідні сполуки кислоти, отримані вище, були отримані дві наступні сполуки згідно із даним винаходом: Приклад 51 N-[2-[2-[4-((3S)-1-азабіцикло[2.2.2]окт-3-іл)-1піперазиніл]-2-оксоетокси]етил]-4-метокси-Nциклопропіл-2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =37%). Температура топлення =72°C. [αD25]=-11,4 °(с=0,5; СН3ОН) Приклад 52 N-[2-[2-[4-{(3S)-1-азабіцикло[2.2.2]окт-3-іл)-1піперазиніл]-2-оксоетокси]етил]-4-метокси-N-етил2,6-диметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =32%). Температура топлення =70°C. [αD25]=-11,4 °(с=0,5; СН3ОН) Способами, аналогічними Прикладові 1, використовуючи як вихідні сполуки кислоту, отриману відповідно до процедури одержання Препарату lll, і 1-[2-(діетиламіно)етил]піперазин, було отримано наступну сполук у згідно із даним винаходом: Приклад 53 N-[2-[2-[4-[2-(діетиламіно)етил]-1-піперазиніл]2-оксоетокси]етил]-4-метокси-N,2,6триметилбензолсульфонаміду фумарат Біла пастообразна тверда речовина (вихід =77%). 1 H ЯМР (300МГц, CD3CN) δ: 6,74 (s, 2H); 6,60 (s, 2H); 4,02 (s, 2H); 3,80 (s, 3H); 3,54 (t, 2H); 3,46 (m, 2H); 3,32 (m, 2H); 3,26 (t, 2H); 2,96 (m, 6H); 2,74 (s, 3H); 2,62 (t, 2H); 2,57 (s, 6H); 2,41 (m, 4H);1,16 (t, 6H). Препарат СХХХll [2-[метил(фенілметил)аміно]етокси]оцтової кислоти 1,1-диметил етиловий ефір Способом, аналогічним способові одержання Препарату II, використовуючи як вихідну сполуку 2-[метил(фенілметил)аміно]етанол, був отриманий необхідний продукт у вигляді безбарвної олії (вихід =35%). 1 H ЯМР (250МГц, ДМСО) δ: 7,26 (m, 5H); 3,96 (s, 2H); 3,57 (t, 2H); 3,49 (s, 2H); 2,49 (m, 2H); 2.14 (s,3H); 1,40 (s,9H). Препарат CXXXlll 48 [2-[метил(фенілметил)аміно]етокси]оцтової кмслоти літієва сіль Розчин 1г (3,58мМ) сполуки, отриманої відповідно до процедури одержання Препарату CXXXIl, у 10мл тетрагідрофурану кип'ятили в присутності 165мг літину і 3мл води протягом 8 годин. Потім реакційну суміш сконцентрували при зниженому тиску з одержанням потрібного продукту у вигляді безбарвної піни (вихід =99%). 1 H ЯМР (250МГц, ДМСО) δ: 7,26 (m, 5H); 3,59 (s. 2H); 3,53 (t, 2H); 3,48 (s, 2Н); 2,50 (t, 2H); 2,12 (s, 3H). N-метил-N-[2-[2-[4-(1-метил-4-піперидинiл)-1піперазиніл]-2-оксоетокси]етил]бензолметанамін Способом, аналогічним Прикладові 5, використовуючи як вихідну сполуку солі, отриманої відповідно до процедури одержання Препарату CXXXlll, і 1-(1-метил-4-піперидиніл)піперазину, було отримано сполуку у вигляді жовтої олії (вихід =24%). 1 H ЯМР (250МГц, ДМСО) δ: 7,26 (m, 5H); 4,09 (s, 2Н); 3,54 (t, 2H); 3,49 (s, 2H); 3,37 (m, 4Н); 2,78 (m, 2Н); 2,53 (t, 2H); 2,43 (m, 4Н); 2,41 (s, 3H); 2,11 (s, 3H); 2,07 (m, 1Н); 1,80 (dt, 2H); 1,65 (dm, 2H); 1,39 (dq, 2H). Препарат CXXXV N-метил-2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксоетокси]етанамін Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату CXXXIV, був о триманий необхідний продукт у вигляді жовтої олії (вихід =80%). 1 H ЯМР (300МГц, ДМСО) δ: 4,16 (s, 2H); 3,55 (t, 2H); 3,49 (m, 1H); 3,39 (m, 2Н); 3,33 (m, 2Н); 2,77 (t, 4Н); 2,43 (m, 2Н); 2,38 (s, 3H); 2,16 (m, 2Н); 2,12 (s, 3H); 1,82 (dt, 2H); 1,67 (dm, 2H); 1,38 (dq, 2H). Препарат CXXXVl 2,6-дихлор-4-фторбензолсульфонілхлорид Розчин 4,75г (25мМ) 2,6-дихлор-4-фтораміну в 50мл дихлорметану був доданий при -15°C до 4,75мл ефірату трифториду бору. Для розчинення осаду, що утворився, було додано 5мл тетрагідрофурану, потім було повільно додано 3,6мл трибутил нітриту, розчиненого в 25мл дихлорметану. Реакційну суміш збовтували протягом 10 хвилин при -15°С, а потім - 20 хвилин при +5°C. Було додано 200мл пентану, збовтування продовжили при 0°C протягом 30хв., після чого осад відфільтрували. Після просушування було отримано 7,2г діазонієвої солі. Цю сіль розчинили в 30мл ацетонітрилу і додали при 10°C до суміші розчину діоксиду сірки в 90мл оцтової кислоти, до якого було додано 1,4г безводного хлориду міді (ІI) і 23мл концентрованої хлористоводневої кислота. Реакційну суміш збовтували протягом 30 хвилин при температурі навколишнього середовища, а потім сконцентрували при зниженому тиску. Залишок від випару розчинили в 60мл дихлорметану, а нерозчинні солі видалили за допомогою фільтрації. Фільтрат сконцентрували при зниженому тиску з одержанням 4,71г потрібного продукту у вигляді жовтогарячих кристалів (вихід =71%). Температура топлення =57°C. 49 83821 Приклад 54 N-[2-[2-[4-(1-метил-4-піперидиніп)-1піперазиніл]-2оксоетокси]етил]-2,6-дихлор-4-фторN-метилбензолсульфонамід Способом, аналогічним процедурі одержання Препарату І, використовуючи як вихідні сполуки, отримані відповідно до Препаратів CXXXV і CXXXVl, був о триманий необхідний продукт у вигляді ясно-жовтої олії (ви хід =73%). 1 H ЯМР (250МГц, ДМСО) δ: 7,73 (d, 2H); 4,08 (s, 2H); 3,58 (t, 2H); 3,45 (t, 2H); 3,40 (m, 2H); 3,30 (m, 2Н); 2,93 (s, 3H); 2J8 (m, 2Н); 2,41 (m, 4H); 2,13 (m, 1H); 2,11 (s, 3H); 1,81 (t, 2H); 1,75 (m, 2Н); 1,40 (m, 2Н). Приклад 55 N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксоетокси]етил]-2,6-дихлор-4фтор-N-метилбензолсульфонаміду дифумарат Способом, аналогічним Прикладові 4. використовуючи як вихідну сполуку сполуку, отриману відповідно до Приклада 54, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =78%). Температура топлення =152-155°С. Способами, аналогічними Прикладам 54 і 55, використовуючи як вихідні сполуки бензолсульфонілхлориди, що мають різні замісники, були отримані наступні сполуки згідно із даним винаходом; N-[2-[2-[4-{1-метил-4-піперидинiл)-1пiперазиніл]-2-оксоетокси]етил]-4-бром-2,6дихлор-N-метил-бензолсульфонамід Безбарвна олія (вихід =37%). 1 H ЯМР (300МГц, ДМСО) δ: 7,97 (s, 2H); 4,07 (s, 2H); 3,58 (t, 2H); 3,45 (t, 2H); 3,43 (m, 2H); 2,99 (s, 3H); 2,74 (m, 2Н); 2,42 (m, 4H); 2,14 (m, 1H); 2,13 (s, 3H); 1,81 (t, 2H); 1,76 (m, 2Н);1,44 (m, 2Н). Приклад 57 N-[2-[2-Е4-{1-метил-4-піперидиніл)-1піперазиніл]-2-оксоетоісси]етил]-4-бром-2,8дихлор-N-метил-бензолсульфонаміду дифумарат Біла тверда речовина (вихід =87%). Температура топлення =194°C. Приклад 58 N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксо-етоксі]етил]-2,4,8-трихлор-Nметилбензолсульфонамід Безбарвне масло (вихід =64%). 1 H ЯМР (300МГц, ДМСО) δ: 7,88 (s, 2Н); 4,08 (s, 2H); 3,58 (t, 2H); 3,44 (t, 2H); 3,38 (m, 4H); 2,94 (s, 3H); 2,78 (m, 2H); 2,42 (m, 4Н); 2,17 (m, 1Н); 2,11 (s, 3H); 1,81 (t, 2H); 1,76 (m, 2Н); 1,44 (m, 2Н). Приклад 59 N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксо-етоксі]етил]-2,4,6-трихлор-Nметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =82%). Температура топлення =194°С. Приклад 60 N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксо-етоксі]етил]-2,4-дихлор-6метил-N-метил-бензолсульфонамід Безбарвне масло (вихід =61%). 1 H ЯМР (300МГц, ДМСО) δ: 7,70 (d, 1H); 7,56 (d, 1H); 4,07 (s, 2H); 3,57 (t, 2H); 3,37 (m, 2H); 3,30 (s, 4H); 2,85 (s, 3H); 2,74 (m, 2Н); 2,62 (s, 3H); 2,42 50 (m, 4H); 2,13 (m, 1Н); 2,11 (s, 3H); 1,81 (t, 2H); 1,77 (m, 2Н); 1,43 (m, 2Н). Приклад 61 N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксо-етоксі]етил]-2,4-дихлор-6метил-N-метил-бензолсульфонаміду дифумарат Біла тверда речовина (вихід =87%). Температура топлення =190°C. Приклад 62 N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперазиніл]-2-оксо-етоксі]етил]-4-метокси-2,3,6триметил-N-метилбензолсульфонамід Безбарвне масло (вихід =34%). 1 H ЯМР (250МГц, ДМСО) δ: 6,83 (s, 1H); 4,03 (s, 2H); 3,84 (s, 3H); 3,52 (t, 2H); 3,35 (m, 2H); 3,35 (m, 2Н); 3,18 (t, 2H); 2,73 (m, 2Н); 2,69 (s, 3H); 2,57 (s, 3H); 2,42 (s, 3H); 2,41 (t, 4H); 2,12 (s,3H); 2,10 (m, 1Н); 2,08 (s, 3H); 1,81 (m, 2H); 1,66 (m, 2Н); 1,38 (m, 2Н). Приклад 63 4-мєтокси-N,2,3,6-тетраметил-N-[2-[2-[4-(1метил-4-піперидиніл)-1-піперазиніл]-2-оксоетокеі]eтил]бензолсульфонаміду дифумарат Біла тверда речовина (вихід =71%). Температура топлення =180°C. Предарат СХХХVII 4-[[2-[[(4-метокси-2,6диметилфеніл)сульфоніл]метиламіно]етоксі]ацетил]-1піперазинкарбонової кислоти 1,1диметилетиловий ефір Способом, аналогічним Прикладу 5, використовуючи як вихідну сполуку N-Вос-піперазин, був отриманий необхідний продукт, який використовували на наступній стадії без спеціального очищення. Препарат CXXXVIll 4-метокси-N,2,6-триметил-N-[2-[2-оксо-2-(1піперазиніл)стоксі]етил]-бензолсульфонамід Способом, аналогічним процедурі одержання Препарату XXIX, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату C XXXVIl, був отриманий необхідний продукт у вигляді жовтого масла (вихід =98%). 1 H ЯМР (250МГц, ДМСО) δ: 6,80 (s, 2H); 4,04 (s, 2H); 3,80 (s, 3H); 3,53 (t, 2H); 3,30 (m, 2H); 3,23 (t, 4H); 2,70 (s, 3H); 2,60 (t, 4H); 2,53 (s, 6H). Препарат CXXXIX 4-(3-оксопропіл)-1-піперидинкарбонової кислоти феніл метиловий ефір 0,81мл диметилсульфоксиду, розчиненого в 10мл дихлорметану (ДХМ), охолоджували до 50°C та додали 0,42мл (4,8мМ) оксалілхлориду, розчиненого в 1,5мл ДХМ. Суміш збовтували протягом 10 хвилин при -60°C, а потім, при тій же температурі, до неї додали по краплях 1,21г (4,4мМ) бензилового ефіру 4-(3гідроксипропіл)піперидинкарбонової кислоти, розчиненої в 6мл ДХМ. Реакційну суміш збовтували протягом 30 хвилин при – 50°C, потім додали по краплях 3мл триетиламіну і температурі дали можливість підвищитися до температури навколишнього середовища протягом 2 годин. Суміш гідролізували 25мл N хлористоводневої кислоти та екстрагували ДХМ. Органічну фазу промивали 51 83821 водою, сушили над сульфатом магнію і концентрували при зниженому тиску. Неочищений продукт очищали за допомогою хроматографії на силікагелі з елююванням сумішшю циклогексану/етилацетату (75/25; об'єм/об'єм). В результаті був отриманий необхідний продукт у вигляді жовтого масла (вихід =83%). 1 H ЯМР (300МГц, ДМСО) δ: 9,66 (s. 1H); 7,35 (m, 5H); 5,05 (s, 2H); 3,98 (m, 2Н); 2,75 (m, 2Н); 2,44 (m, 2H); 1,64 (q, 2H); 1,63 (m, 2Н); 1,37 (m, 1Н); 1,02 (m, 2Н). Препарат CXL 4-[3-[4-[[2-[[(4-метокси-2,6диметилфеніл)сульфоніл]метиламіно]етоксі]ацетил]-1-1піперазиніл]пропіл]-1-піперидинкарбонової кислоти фенілметиловий ефір Способом, аналогічним процедурі одержання Препарату XXVIІІ, використовуючи як вихідні сполуки, отримані методами, що описані для одержання Препаратів CXXXVIII і CXXXIX, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =51%). 1 H ЯМР (300МГц, ДМСО) δ: 7,40 (m, 5H); 6,81 (s, 2H); 5,05 (s, 2H); 4,33 (s, 2H); 3,96 (m, 2H); 3,79 (s, 3H); 3,55 (t, 2H); 3,37 (m, 2Н), 3.30 (m, 2Н); 3,19 (t, 2H); 2,71 (m, 2Н); 2,69 (s, 3H); 2,52 (s, 6H); 2,25 (m, 6Н); 1,65 (m, 2Н); 1,42 (m, 3H); 1,20 (m, 2Н); 1,00 (m, 2Н). Приклад 64 4-метокси-N,2,6-триметил-N-[2-[2-оксо-2-[4-[3(4-піперидиніл)пропіл]-1піперазиніл]етоксі]етил]бензолсульфонамід Способом, аналогічним процедурі одержання Препарату XXXV, використовуючи як вихідну сполуку, отриману відповідно до Препаратів CXL, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =62%). 1 H ЯМР (250МГц, ДМСО) δ: 6,80 (s, 2H); 4,05 (s, 2H); 3,80 (s, 3H); 3,53 (і, 2Н); 3,30 (m, 4H); 3,19 (t, 2Н); 2,88 (m, 2Н); 2,69 (s, 3H); 2,50 (s, 6H); 2,44 (m, 2Н); 2,27 (m, 6Н); 1,57 (m, 2Н); 1,41 (m, 3H); 1,17 (m, 2H); 0,97 (m, 2Н), Приклад 65 4-метокси-N,2,6-триметил-N-[2-[2-оксо-2-[4-[3(1-метил-4-піперидиніл)пропіл]-1піперазиніл]етоксі]етил]бензолсульфонамід Способом, аналогічним процедурі одержання Препарату XXVIII, використовуючи як вихідну сполуку, отриману відповідно до Прикладу 64, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =90%). 1 H ЯМР (250МГц, ДМСО) δ: 6,80 (s, 2H); 4,05 (s, 2Н); 3,80 (s, 3H); 3,53 (t, 2H); 3,38 (m, 2H); 3,24 (t, 2H); 3,18 (m, 2Н); 2,72 (m, 2Н); 2,69 (s, 3H); 2,50 (s, 6H); 2,28 (m, 6Н); 2,11 (S, 2Н); 1,78 (m, 2Н); 1,60 (m, 2Н); 1,45 (m, 2Н); 1,15 (m, 5Н). Приклад 66 4-метокси-N,2,6-триметил-N-[2-[2-оксо-2-[4-[3(1-метил-4-піперидиніл)пропіл]-1піперазиніл]етоксі]етил]бензолсульфонаміду дифумарат Способом, аналогічним Прикладу 4 використовуючи як вихідну сполуку, отриману відповідно 52 до Приклада 65, був отриманий необхідний продукт у вигляді білої твердої речовини (вихід =98%). Температура топлення =50°C. Препарат CXLІ 4-[4-(фенілметил)-1-піперазиніл]-1піперидинкарбонової кислоти 1,1диметилетиловий ефір Способом, аналогічним процедурі одержання Препарату XXVІІІ, використовуючи як вихідні сполуки N-бензилпіперазин і N-Boc-4-піперидинон, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =60%). 1 H ЯМР (300МГц, CDCI3) δ: 7,27 (m, 5H); 4,15 (m, 2H); 3,52 (s, 2H); 2,61 (m, 11Н); 1,81 (m, 2Н); 1,44 (s, 9H); 1,41 (m, 2Н). Препарат CXLlI 4-(1-піперазиніл)-1-піперидинкарбонової кислоти 1,1-диметилетиловий ефір Був приготовлений розчин 15,5г (43,1мМ) сполуки, отриманої відповідно до процедури одержання Препарату CXLl, у 46мл етанолу, до нього було додано 3,1г гідроксиду паладію, а потім, після завершення реакції, було додано 17,7г (215мМ) циклогексану. Реакційну суміш збовтували при 50°C протягом 6 годин, потім охолоджували і відфільтровували. Фільтрат концентрували при зниженому тиску, у результаті було отримано 10,02г потрібного продукту у вигляді безбарвного масла (вихід =86%). 1 H ЯМР (300МГц, CDCІ3) δ: 4,12 (m, 2H); 2,92 (m. 4H); 2,69 (m, 2H); 2,55 (t, 4H); 2,36 (m, 1H): 1,79 (m, 2H); 1,45 (s, 9H); 1,38 (m, 2H). Препарат CXLIII 4-[4-[[2-[[(4-метокси-2,6диметилфеніл)сульфоніл]метиламіноетоксі]ацетил]-1-піперазиніл]-1піперидинкарбонової кислоти 1,1диметилетиловий ефір Способом, аналогічним Прикладу 3, використовуючи як вихідну сполуку, отриману відповідно до Препаратів IIІ і C XLII, був отриманий необхідний продукт у вигляді безбарвного масла (вихід =32%). 1 H ЯМР (300 МГц, CD3CN) δ: 6,74 (s, 2H); 4,07 (m, 2H); 4,00 (s, 2H); 3,80 (s, 3H); 3,54 (t, 2H); 3,43 (m, 2Н); 3,26 (m, 4Н); 2,74 (s, 3H); 2,69 (m, 2Н); 2,57 (s, 6H); 2,44 (m, 4Н); 2,34 (m, 1H); 1,71 (m, 2Н); 1,41 (s, 9H); 1,29 (m, 2Н). Приклад 67 4-метокси-N,2,6-триметил-N-[2-[2-оксо-2-[4-(4піперидиніл)-1піперазиніл]стоксі]етил]бензолсульфонаміду біс(трифторацетат) Була приготовлена суміш 140мг (0.24мМ) сполуки, отриманої відповідно до процедури одержання Препарату CXLIІl, у 1мл дихлорметану і 0,7мл трифтороцтової кислоти. Реакційну суміш збовтували при температурі навколишнього середовища протягом 2 годин, а потім концентрували при зниженому тиску. Залишок від випарювання переносили в 3мл води і висушили за допомогою сублімаційного сушіння. В результаті було отримано 160мг потрібного продукту у вигляді білої твердої речовини (вихід =95%). Температура топлення =62°С. 53 83821 Препарат CXLIV 4-(6-нітро-3-піридиніл)-1-піперазинкарбонової кислоти 1,1-діметилетиловий ефір Був приготовлений розчин 1г (4,9мМ) 2-нітро5-бромпіридину і 917мг (4,9мМ) N-Boc-піперазину в 10мл диметилформаміду, і до нього було додано 1,02г (7,4мМ) карбонату кальцію. Реакційну суміш збовтували при 120°C протягом 36 годин, а потім охолоджували. Потім до неї додали 50мл води і провели екстракцію етилацетатом. Отриману органічну фаз у промили водою, висушили і сконцентрували при зниженому тиску. Неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю толуолу/ізопропанолу (98/2; об'єм/об'єм). В результаті був отриманий необхідний продукт у вигляді жовтої твердої речовини (вихід =33%). 1 H ЯМР (250МГц, ДМСО) δ: 8,24 (d, 1H); 8,17 (d, 1H); 7,46 (del, IH); 3,50 (m, 8H); 1,42(s, 9H). Препарат CXLV 1-(6-нітро-3-піридиніл)піперазину біс(трифторацетат) Способом, аналогічним Прикладу 67, використовуючи як вихідну сполуку сполук у, отриману відповідно до процедури одержання Препарату CXLІV, був отриманий необхідний продукт у вигляді жовтої твердої речовини (вихід =97%). Температура топлення =188-190°C. Препарат СХLVI 4-метокси-N,2,6-триметил-N-[2-[2-оксо-2-[4-(6нітро-3-піридиніл)-1піперазиніл]етоксі]етил]бензолсульфонамід Способом, аналогічним Прикладу 3, використовуючи як вихідну сполуку сполук у, отриману відповідно до процедури одержання Препаратів llI і CXLV, був отриманий необхідний продукт у вигляді жовтої твердої речовини (вихід =82%). Температура топлення =118-120°C. Приклад 88 4-метокси-N,2,6-триметил-N-[2-[2-оксо-2-[4-|6аміно-3-піридиніл)-1піперазиніл]етоксі]етил]бензолсульфонамід Була приготовлена суспензія 580мг (1,11мМ) сполуки, отриманої відповідно до процедури одержання Препарату CXL VI, у 20мл метанолу, і до неї було додано 58мг 10%-ого паладію на вугіллі. Реакційну суміш збовтували протягом 6 годин при температурі навколишнього середовища в атмосфері водню при атмосферному тиску, а потім відфільтрували і концентрували при зниженому тиску. Неочищений продукт очистили за допомогою хроматографії на силікагелі з елююванням сумішшю дихлорметану/метанолу (97/3; об'єм/об'єм). В результаті був о триманий необхідний продукт у вигляді жовтої пастоподібної твердої речовини (вихід =81%). 1 H ЯМР (300МГц, ДМСО) δ: 7,61 (d, 1H); 7,17 (dd, 1H); 6,80 (s, 2H); 6,40 (dd, 1H); 5,43 (s, 2Н); 4,11 (s, 2H); 3,79 (s, 3H) 3,55 (m, 4H); 3,44 (m, 2Н); 3,24 (t, 2H); 2,87 (m, 4Н); 2,70 (s, 3H); 2,53 (s, 6H). Приклад 69 4-метокси-N,2,6-триметил-N-[2-[2-оксо-2-[4-(6аміно-3-піридиніл)-1піперазиніл]стоксі]етил]бензолсульфонаміду фумарат 54 Способом, аналогічним Прикладу 4, використовуючи як вихідну сполуку, отриману відповідно до Прикладу 68, був отриманий необхідний продукт у вигляді бежевої твердої речовини (вихід =97%). Температура топлення =194-196°C. Приклад 70 N-[2-[2-[4-[2-(диметиламіно)-1,1-диметилетил]1-піперидиніл]-2-оксоетоксі]етил]-4-метокси-N,2,6триметилбензолсульфонаміду три фторацетат 460мг полістирольної смоли з привитими циклогексилкарбодіімідними групами помістили в 5мл ДХМ на 20 хвилин Розчинник видалили за допомогою фільтрації, а потім додали 100мг (0,31мМ) [2[[(4-метокси-2,6-диметилфеніл)сульфоніл]метиламіно]етоксі]оцтової кислоти у вигляді розчину в 3мл ДХМ, 37мг (0,20мМ) 4-[2(диметиламіно)-1,1-диметилетил]піперидину і 2мг HOAT(1-гідроксі-7-азабензотриазолу). Суміш збовтували протягом 4 годин, а потім смолу відокремили за допомогою фільтрації і промили 4мл ДХМ. Об'єднані органічні фази обробили 50мг смоли Amberiite IRA 400 (OH-), а потім - полістирольною смолою, привитою ізоціанатом, протягом 1 години. Смолу видалили за допомогою фільтрації, а фільтрат сконцентрували при зниженому тиску. Отриманий продукт перенесли в 0,5мл ацетонітрилу і додали 6мл 1%-ного розчину трифтороцтової кислоти. Суміш профільтрували і висушили за допомогою сублімаційного сушіння. В результаті було отримано 59мг потрібно сполуки у вигляді аморфної твердої речовини (вихід =48%). Температура топлення =60°C. 1 H ЯМР (250МГц, CD3CN) δ: 6,74 (s, 2H); 4,50 (m, 1H); 4,06 (m, 2H); 3,80 (s, 3H); 3,78 (m, 1H); 3,57 (t, 2H); 3,31 (t, 2H); 3,04 (s, 2H); 2,85 (s, 6H); 2,83 (m, 1H); 2,73 (s, 3H); 2,56 (s, 6H); 2,55 (m, 1H); 1,65 (m, 2H); 1,45 (m, 1H), 1,20 (m, 2H); 0,99 (s, 6H). Приклад 71 N-[2-[2-[4-[2-(диметиламіно)-1-гідроксіетил]-1піперидиніл]-2-оксоетоксі]eтил]-4-метокcи-N,2,6триметилбензолсульфонаміду три фторацетат Способом, аналогічним Прикладу 70, використовуючи як вихідну сполуку, отриману відповідно до процедури одержання Препарату LXIX, був отриманий необхідний продукту вигляді безбарвної пасти (вихід =45%). 1 H ЯМР (250МГц, CD3CN) δ: 6,74 (s, 2H); 4,45 (m, 1H); 4,05 (m, 2Н); 3,80 (s, 3H); 3,75 (m, 2Н); 3,59 (t, 2H); 3,28 (t, 2H): 3,06 (m, 2Н); 2,90 (m, 1Н); 2,84 (s, 3H); 2,80 (s, 3H); 2,77 (s, 3H); 2,56 (s, 6H); 2,50 (m, 1 H); 1,80 (m, 1 H); 1,60 (m, 2Н); 1,20 (m, 2Н). Приклад 72 4-метокси-N,2,6-триметил-2-[2-[2-[4-(4-метил1-піперазиніл)-1-піперадиніл]-2оксоетоксi]етил]бeнзолсульфонамід Була приготовлена суспензія 350мг (1,06мМ) кислоти, отриманої відповідно до процедури одержання Препарату III, у 3мл ДХМ, до якої було додано 243мг (1,27мМ) EDCI (1-(3диметиламінопропіл)-3-етилкарбодііміду гідрохлориду) і 173мг (1,27мМ) HOAT. С уміш збовтували протягом 30 хвилин при температурі навколишнього середовища, а потім долили до 10мл води та екстрагували ДХМ. Органічну фазу промили во 55 83821 дою, висушили і сконцентрували при зниженому тиску. Залишок очистили за допомогою хроматографії на силікагелі з елююванням сумішшю ДХМ/метанолу (90/10; об'єм/об'єм). В результаті було отримано 449мг потрібного продукту у вигляді жовтого масла (вихід =86%). 1 H ЯМР (300МГц, CD3CN) δ: 6,74 (s, 2H); 4,35 (d, 1H); 4,01 (q, 2H): 3,81 (s, 3H); 3,69 (d, 1H); 3,56 (t, 2H); 3,26 (t, 2H); 2,89 (t, 1H); 2,75 (s, 3H); 2,58 (s, 6H); 2,40 (m, 10Н); 2,17 (s, 3H); 1,75 (m, 2H); 1,27 (m, 2H). Приклад 73 4-метокси-N,2,6-триметил-N-[2-[2-[4-{4-метил1-піперазиніл)-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат 404мг (0,814мМ) сполуки, отриманої відповідно до Прикладу 72, розчинили в 5мл метанолу і додали 95мг (0,815мМ) фумарової кислоти. Суміш збовтували протягом 10 хвилин, після чого сконцентрували при зниженому тиску. Залишок перенесли в 10мл води, і розчин висушили за допомогою сублімаційного сушіння. В результаті була отримана необхідна сіль (474 мг) у вигляді білого порошку (ви хід =95%). Температура топлення =90°C. Способами, аналогічними Прикладам 72 і 73, використовуючи як вихідні сполуки кислоти і похідні піперидину, описані вище або відомі з літератури, були отримані наступні сполуки відповідно до винаходу: Приклад 74 4-метокси-N,2,6-триметил-N-[2-[2-[4-(1-метил4-піперидиніл)-1-піперидиніл]-2оксоетоксі]етил]бензолеульфонаміду фумарат Біла тверда речовина (вихід =44%). Температура топлення =88-89°C. Приклад 75 N-циклопропіл-4-метокси-2,6-диметил-N-[2-[2[4-(4-метил-1-піперазиніл)-1-піперидиніл]-2оксоетоксі]eтил]бензолсульфонаміду дифумарат Біла тверда речовина (вихід =76%). Температура топлення =148°С. Приклад 76 4-метокси-N,2,6-триметил-N-[2-[2-[4-[2-(1піролідиніл)етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =87%). Температура топлення =55°С. 1 H ЯМР (300МГц, CD3CN) δ: 8,50 (m ушир., 1Н); 6,74 (s, 2H); 4,38 (m, 1Н); 4,10 (d, 2Н); 3,80 (s, 3H); 3,75 (m, 1H); 3,57 (m, 4Н); 3,27 (t, 2H); 3,13 (m, 2Н); 2,95 (m, 3H); 2,74 (s, 3H); 2,57 (s, 6H); 2,50 (m, 1Н): 2.06 (m, 4Н); 1,65 (m, 5H); 1,07 (m, 2H). Приклад 77 4-метокси-N,2,6-триметил-N-[2-[2-[4-[4-(1метилетил)-1-піперазиніл]-1-піперидинiл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =92%). Температура топлення =145°C. Приклад 78 N-eтил-4-метокси-2,8-диметил-N-[2-[2-[4-[2-(1піролідиніл)етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =50%). Температура топлення =50°C. 56 Приклад 79 N-циклопропіл-4-метокси-2,6-диметил-N-[2-[2[4-[2-(1-піролідиніл)етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =96%). Температура топлення =50°C. Приклад 80 N-[2-[2-[4-[2-(гексагідро-4-метил-1Н-1,4діазепін-1-іл)етил]-1-піперидиніл]-2оксоетоксі]етил]-4-метокси-N,2,6-триметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =54%). Температура топлення =60°C. Приклад 81 4-метокси-N,2,6-триметил-N-[2-[2-[4-[2[метил(1-метилетил)аміно]етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =64%). Температура топлення =60°C. Приклад 82 4-метокси-N,2,6-триметил-N-[2-[2-[4-[метил(1метил-4-піперидиніл)аміно]-1-пiперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =66%). Температура топлення =72°С. Приклад 83 4-метокси-N,2,6-триметил-N-[2-[2-[4-[1-(1метилетил)-4-піперидиніл]-1-пiперидиніл]-2оксоeтоксi]етил]бензолсульфонамiду фумарат Біла тверда речовина (вихід =84%). Температура топлення =62-64°C. Приклад 84 4-метокси-N,2,6-триметил-N-[2-[2-[4-(1-етил-4піперидиніл)-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Безбарвне масло (вихід =35%), 1 H ЯМР (300МГц, ДМСО) δ: 6,80 (s, 2H); 6,51 (s, 2H); 4,32 (m, 1H); 4,06 (q, 2H); 3,80 (s, 3H); 3,67 (m, 1Н); 3,53 (m, 2H); 3,22 (m, 2H); 3,15 (d, 2H); 2,86 (m, 1Н); 2,69 (s, 3H); 2,61 (q, 2H); 2,53 (s, 6H); 2,45 (m, 1Н); 2,27 (t, 2H); 1,66 (m, 4Н); 1,30 (m, 3H); 1,07 (t, 3H); 0,96 (m, 3H). Приклад 85 4-метокси-N,2,6-триметил-N-[2-[2-[4-(1циклопропіл-4-піперидиніл)-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Безбарвне масло (вихід =63%). 1 H ЯМР (300МГц, ДМСО) δ: 6,80 (s, 2Н); 6,66 (S1 2Н); 4,34 (m, 1H); 4,01 (q, 2H); 3,79 (s, 3H); 3,66 (m, 1Н); 3,54 (t, 2H); 3,21 (і 2Н); 2,98 (d, 2H); 2,82 (m, 1Н); 2,69 (s, 3H); 2,53 (s, 6Н): 2,43 (m, 1Н); 2,10 (t, 2H); 1,60 (m, 5Н); 1,23 (m, 1Н); 1,03 (m, 5Н); 0,38 (m, 2Н); 0,29 (m, 2Н). 4-метокси-N,2,6-триметил-N-[2-[2-[4-[2-(4морфолініл)етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =73%). Температура топлення =50°C. Приклад 87. 4-метокси-N,2,6-триметил-N-[2-[2-[4-[1,1диметил-2-(1-азетидиніл)етил]-1-піперидиніл]-2оксоетоксі]етилібензолсульфонаміду фумарат Біла тверда речовина (вихід =67%). Температура топлення =60-62°C. 57 83821 Приклад 88 N-етил-4-метокси-2,6-диметил-N-[2-[2-[4-(1метил-4-піперидиніл)-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =67%). Температура топлення =65°С. Приклад 89 N-[2-[2-[4-(гексагідро-4-метил-1Н-1,4-діазепін1іл)-1-піперидиніл]-2-оксоетоксі]етил]-4-метоксиN,2,6-триметил-бензолсульфонаміду фумарат Жовте масло (вихід =61%). 1 H ЯМР (300МГц, ДМСО) δ: 6,80 (s, 2H); 6,50 (s, 2H); 4,36 (m, 1H); 4,11 (m, 2Н); 3,80 (s, 3H); 3,73 (m, 1Н), 3,55 (t, 2H); 3.24 (t, 2H); 2,87 (m, 2Н); 2,85 (m, 6Н); 2,69 (s, 3H); 2,67 (m, 1Н); 2,53 (s, 6H); 2,46 (s, 3H); 2,42 (m, 1H); 1,81 (m, 2Н); 1,69 (m, 2Н); 1,21 (m, 2Н). Приклад90 N-циклопропіл-4-метокси-2,6-диметил-N-[2-[2[4-(1-метил-4-пiперидиніл)-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =60%). Температура топлення =80°C. Приклад 91 2,4-дихлор-N,3-диметил-N-[2-[2-[4-(1-метил-4піперидиніл)-1-піперидиніл}-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =39%). Температура топлення =86-88°С Приклад 92 4-метокси-N,2,6-триметил-N-[2-[2-[4-[2-(1азетидиніл)етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =40%). 1 H ЯМР (300МГц, ДМСО) δ: 6,80 (s, 2H); 6,52 (s, 2H); 4,28 (m, 1H); 4,05 (m, 2Н); 3,80 (s, 3H); 3,67 (m, 1H); 3,57 (m, 6Н); 3,20 (t 2H); 2,85 (m, 1Н); 2,78 (t, 2H); 2,69 (s, 3H); 2,53 (s, 6Н); 2,49 (m, 1Н); 2,17 (quin 2H); 1,59 (m,2Н); 1,50 (m, 1Н); 1,30 (m, 2Н); 0,93 (m, 2Н). Приклад 93 2,6-дихлор-4-метокси-N-метил-N-[2-[2-[4-[2(диметиламіно)етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фууарат Біла тверда речовина (вихід =39%). Температура топлення =70°C. Приклад 94 2,6-дихлор-4-метокси-N-метил-N-[2-[2-[4-(1метил-4-піперидиніл)-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =70%). Температура топлення =67°C. Приклад 95 4-метокси-N,2,6-триметил-N-[2-[2-[4-[(1піролідиніл)метил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Безбарвне масло (вихід =30%). 1 H ЯМР (250МГц, D MSO) δ: 6,80 (s, 2H); 6,54 (s, 2H); 4,29 (m, 1H); 4,15 (m, 2H); 3,80 (s, 3H); 3,63 (m, 1H); 3,53 (t, 2H); 3,22 (t, 2H); 2,89 (m, 1H); 2,80 (m, 4H); 270 (s, 3H); 2,56 (m, 1H); 2,53 (s, 6H); 2,51 (m, 2H); 1,81 (m, 7H); 0,91 (m, 2H). Приклад 96 58 4-метокси-N,2,6-триметил-N-[2-[2-[4-[(4-етил-1піперазиніл)метил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =31%). Температура топлення =120°C. Приклад 97 N-циклопропіл-4-метокси-2,6-диметил-N-[2-[2[4-[(4-метил-1-піперазиніл)метил]-1-піперидиніл]-2оксоетокси]етил]бензолсульфонаміду дифумарат Біла тверда речовина (вихід =44%). Температура топлення =160°C. Приклад 98 N-етил-4-метокси-2,6-диметил-N-[2-[2-[4-[(4метил-1-піперазиніл)метил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду дифумарат Біла тверда речовина (вихід =49%). Температура топлення =98°C. Приклад 99 N-метил-4-метокси-2,6-дихлор-N-[2-[2-[4-[(4метил-1-піперазиніл)метил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду дифумарат Біла тверда речовина (вихід =50%). Температура топлення =103°C. Приклад 100 4-метокси-N,2,6-триметил-N-[2-[2-[4-[1,1диметил-2-(1-піперидинiл)етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду трифторацетат Безбарвне масло (вихід =47%). 1 H ЯМР (300МГц, CD3CN) δ: 7,50 (m ушир., 1Н); 6,74 (s, 2H); 4,49 (m, 1H); 4,01 (q, 2Н); 3,81 (s, 3H); 3,78 (m, 1Н); 3,57 (t, 2H); 3,43 (m, 2Н); 3,28 (t, 2H); 3,01 (m, 2Н); 2,98 (s, 2Н); 2,90 (m, 1Н); 2,74 (s, 3H); 2,63 (s, 6H); 2,45 (m, 1Н); 1,85 (m, 3H); 1,66 (m, 3H); 1,51 (m, 2Н); 1,19 (m, 3H); 1,00 (s, 6H). Приклад 101 4-метокси-N,2,6-триметил-N-[2-[2-[4-[1,1диметил-2-(1-піролідиніл)етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =61%). Температура топлення =50°C. Приклад 102 N-[2-[2-[4-[2-(етилметиламіно)етил]-1піперидиніл]-2-оксоетоксі]етил]-4-метокси-N,2,6триметилбензолсульфонаміду фумарат Біла тверда речовина (вихід =46%). 1 H ЯМР (300МГц, ДМСО) δ: 6,80 (s, 2H); 6,51 (s, 2H); 4,27 (m, 1H); 4,03 (q, 2H); 3,80 (s, 3H); 3,55 (m, 1Н); 3,24 (t, 2H); 3,22 (t, 2H); 2,86 (m, 1Н); 2,70 (s, 3H); 2,62 (m, 4Н); 2,53 (s, 6Н); 2,48 (m, 1Н); 2,46 (s, 3H); 1,66 (m, 2Н); 1,52 (m, 1H); 1,45 (m, 2H); 1,38 (t, 3H); 0,97 (m, 2Н). Приклад 103 N-[2-[2-[4-[2-(дieтилaмінo)eтил]-1-пiпepидинiл]2-oкcoeтoкc]eтил]-4-метокси-N,2,6триметилбензолсульфонамiду фумарат Біла тверда речовина (вихід =52%). Температура топлення =60°C. Приклад 104 4-метокси-N-{1-метилетил)-2,6-диметил-N-[2[2-[4-[2-(1-піролідиніл)етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =61%). Температура топлення =56°C. 59 83821 Приклад 105 4-метокси-N,2,6-триметил-N-[2-[2-[4-[1,1диметил-2-{4-морфолініл)етил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла паста (вихід =50%). 1 H ЯМР (300МГц, ДМСО) δ: 6,80 (s, 2Н); 6,62 (s, 2H); 4,38 (m, 1H); 4,04 (q, 2H); 3,79 (s, 3H); 3,55 (m, 1Н); 3,52 (m, 6Н); 3,21 (m, 2H); 2,81 (m, 1H); 2,70 (s, 3H); 2,53 (s, 6H); 2,49 (m, 4Н); 2,47 (m, 1Н); 2,09 (s, 2H); 1,60 (m, 2Н); 1,43 (m, 1Н); 1,10 (m, 2Н); 0,76 (s, 6Н). Приклад 108 N-[2-[2-[4-[2-(гeкcaгiдpo-4-мeтил-7H-1,4діaзeпін-1-iл)eтил]-1-пiпepидинiл]-2оксоетоксі]етил]-4-метокси-N,2,6триметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =36%). Температура топлення =125°С. Приклад 107 N-[2-[2-[4-[(гексагідро-4-метил-1Н-1,4-діазепін1-іл)метил]-1-піперидиніл]-2-оксоетоксі]етил]-4метокси-N,2,6-триметилбензолсульфонаміду дифумарат Біла тверда речовина (вихід =31%). Температура топлення =100-102°C. Приклад 108 4-метокси-N-[2-[2-[4-[2-(1-метил-4піперидиніл)етил]-1-піперидиніл]-2оксоетоксі]етил]-N,2,6триметилбензолсульфонаміду фумарат Біла тверда речовина (вихід =24%). Температура топлення =70°C. Способами, аналогічними Прикладу 70, використовуючи як вихідні сполуки кислоти і похідні піперидину, описані вище або відомі з літератури, були отримані наступні сполуки відповідно до даного винаходу: Приклад 109 4-метоксй-N-[2-[2-[4-[2-(1-піперидиніл)етил]-1піперидиніл]-2-оксоетоксі]етил]-N,2,6триметилбензолсульфонаміду фумарат Біла тверда речовина (вихід =69%). Температура топлення =50°C. Приклад 110 4-метокси-N-[2-[2-[4-[2-(1-піролідиніл)етил]-1піперидиніл]-2-оксоетоксі]етил]-N-метил-2трифторметил-бензолсульфонаміду трифторацетат Безбарвне масло (вихід =99%). 1 H ЯМР (300МГц, CD3CN) δ: 8,20 (m ушир., 1Н); 7,95 (d, 1H); 7,41 (d, 1H); 7,25 (dd, 1Н); 4,43 (m. 1H); 4,10 (q, 2H); 3,91 (s, 3H); 3,63 (m, 1Н); 3,63 (m, 4Н); 3,43 (t, 2H); 3,13 (m, 2Н); 2,96 (m, 2Н); 2,90 (s, 3H); 2,60 (!, 1Н); 2,06 (m, 6Н); 1,71 (m, 4H); 1,60 (m, 2H). Приклад 111 4-метокси-N-[2-[2-[4-[2-(1-метил-4піперазинид)-2-оксоетил]-1-піперидиніл]-2оксоетоксі]етил]-N,2,6триметилбензолсульфонаміду фумарат Біла тверда речовина (вихід =33%). Температура топлення =60°C. Приклад 112 4чметокси-N,2,6-триметил-N-[2-[2-[4-[1,1диметил-2-(діетиламіно)етил]-1-піперидиніл]-2 60 оксоетоксі]етил]бензолсульфонаміду трифторацетат Безбарвне масло (вихід =26%). 1 H ЯМР (300МГц, ДМСО) δ: 8,12 (m ушир,, 1Н); 6,81 (s, 2H); 4,40 (m, 1Н); 4,09 (q, 2Н); 3,80 (s, 3H); 3,78 (m, 1Н); 3,54 (t, 2H); 3,24 (t, 2H); 3,15 (m, 4Н); 2,97 (сі, 2Н); 2,84 (t, 1H); 2,70 (s, 3H); 2,53 (s, 6H); 2,41 (m, 1Н); 1,64 (m, 2Н); 1,42 (m, 1H); 1,25 (m, 2H); 1,22 (t, 6H); 0,96 (s, 6Н). Приклад 113 4-метокси-N,2,6-триметил-N-[2-[2-[4(диметиламіно)метил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =63%). Температура топлення =65°С. Приклад 114 4-метокси-N,2,6-триметил-N-[2-[2-[4-[(1азетидинил)метил]-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду фумарат Біла тверда речовина (вихід =60%). Температура топлення =75°С. Приклад 115 N,2,4,6-тeтpaмeтил-N-[2-[2-[4-(1-метил-4піперидиніл)-1-піперидиніл]-2оксоетоксі]етил]бензолсульфонаміду трифторацетат Безбарвне масло (вихід =97%), 1 H ЯМР (250МГц, CD3CN) δ: 9,40 (m ушир., 1Н); 8,97 (s, 2H); 4,98 (m, 1H); 4,09 (q, 2Н); (m, 1Н); 3,57 (t, 2H); 3,45 (d, 2H); 3,28 (t, 2H); 2,85 (m, 1Н); 2,80 (m, 2Н); 2,77 (s 1 3H); (d, 3H); 2,56 (s, 6H); 2,45 (m, 1Н); 2,28 (s, 3H); 1,92 (m, 2H); 1,71 (m, 2Н); 1,50 (m, 2Н); 1,34 (m, 2Н); 1,09 (m, 2Н). Приклад 116 N-метил-N-[2-[2-[4-(1-метил-4-піперидиніл)-1піперидиніл]-2-оксоетоксі]етил]-2-трифторметилбензолсульфонаміду три фторацетат Безбарвне масло (вихід =98%). 1 H ЯМР (300МГц, CD3CN) δ: 8,50 (m ушир., 1Н); 7,97 (m, 2H); 7,77 (m, 2Н); 4,48 (m, 1Н); 4,13 (q, 2H); 3,80 (m, 1Н); 3,64 (m, 2Н); 3,49 (t, 2H); 3,42 (m, 2Н); 2,96 (s, 3H); 2,90 (m, 1Н); 2,78 (m, 2Н); 2,72 (d, 3H); 2,50 (m, 1Н), 1,93 (m, 2H); 1,73 (m, 2H); 1,38 (m, 4Н); 1,36 (m, 2Н). Приклад 117 4-метокси-N-метил-N-[2-[2-[4-(1-метил-4піперидиніл)-1-піперидиніл]-2-оксоетоксі]етил]-2трифторметил-бензолсульфонаміду трифторацетат Безбарвне масло (вихід =95%). 1 H ЯМР (300МГц, CD3CN) δ: 8,41 (m ушир., 1H); 7,96 (d, 1H); 7,40 (d, 1H); 7,25 (dd, 1H); 4,45 (m, 1H); 4,10 (q, 2H); 3,91 (s, 3H); 3,80 (m, 1H); 3,61 (t, 2H); 3,42 (m, 4H); 2,90 (s, 3H); 2,89 (m, 1H); 2,79 (m, 2H); 2,73 (d, 3H); 2,50 (m, 1H); 1,92 (m, 2H); 1,73 (m, 2H); 1,37 (m, 4H); 1,07 (m, 2H). Приклад 118 N,2,4,6-тeтpaмeтил-N-[2-[2-[4-[2-(1пipoлідиніл)етил]-1-пiпepидинiл]-2оксоетоксі]етил]бензолсульфонаміду трифторацетат Безбарвне масло (вихід =99%). 1 H ЯМР (300МГц, CD3CN) δ: 8,40 (m ушир., 1Н); 7,03 (s, 2H); 4,37 (m, 1Н); 4,02 (q, 2Н); 3,75 (m, 1Н); 3,58 (m, 4Н); 3,31 (t, 2H)1 3,10 (m, 2Н); 2,91 (m,
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzenesulphonamide derivatives, method for production and use thereof for treatment of pain
Автори англійськоюBarth Martine, Bondoux Michel, Dodey Pierre, Massardier Christine, Thomas Didier, Luccarini Jean-Michel
Назва патенту російськоюПроизводные бензолсульфонамидов, способ их получения и их применение для лечения воспалительных заболеваний и утоления боли
Автори російськоюБарт Мартен, Бонду Мишель, Додей Пьер, Массардье Кристин, Тома Дидье, Люккарини Жан-Мишель
МПК / Мітки
МПК: C07D 211/26, C07D 295/185, C07D 211/58, C07D 453/00, C07D 451/02
Мітки: одержання, вгамування, запальних, спосіб, захворювань, бензолсульфонамідів, застосування, болю, похідні, лікування
Код посилання
<a href="https://ua.patents.su/42-83821-pokhidni-benzolsulfonamidiv-sposib-kh-oderzhannya-i-kh-zastosuvannya-dlya-likuvannya-zapalnikh-zakhvoryuvan-ta-vgamuvannya-bolyu.html" target="_blank" rel="follow" title="База патентів України">Похідні бензолсульфонамідів, спосіб їх одержання і їх застосування для лікування запальних захворювань та вгамування болю</a>
Попередній патент: Екраноплан і його злітно-посадковий комплекс
Наступний патент: Пристрій для прицілювання для вогнепальної зброї і вогнепальна зброя з можливістю встановлення пристрою для прицілювання
Випадковий патент: Прес для гарячого пресування волокнистих матеріалів












