Агоністи змішаної дії на основі глюкозозалежного інсулінотропного пептиду для лікування порушень обміну речовин і ожиріння
Формула / Реферат
1. Аналог глюкагону (послідовність SEQ ID NO: 1), який має активність агоніста GIP, з такими модифікаціями:
(a) модифікація амінокислоти в положенні 1, яка надає активність агоніста GIP, причому факультативно амінокислотою в положенні 1 є амінокислота, яка не має імідазольного бічного ланцюга;
(b) одна, дві або три з амінокислот в положеннях 16, 20, 21 і 24 даного аналога, або всі ці амінокислоти, замінені α,α-дизаміщеною амінокислотою,
(c) модифікації амінокислот в одному або двох з положень 27, 28 і 29, або в усіх цих положеннях, і
(d) 1-9 інших модифікацій амінокислот порівняно з послідовністю глюкагону (послідовність SEQ ID NO: 1),
причому значення EC50 для даного аналога стосовно активації GIP-рецептора становить приблизно 10 нМ або менше, і причому значення ЕС50 для даного аналога на GIP-рецепторі відрізняється в не більше ніж приблизно 50 разів від значення ЕС50 для нього на GLP-1-рецепторі, факультативно GIP-ефективність даного аналога відрізняється в не більше ніж приблизно 15 разів від GLP-1-ефективності даного аналога.
2. Аналог глюкагону (послідовність SEQ ID NO: 1), який має активність агоніста GIP, з такими модифікаціями:
(a) модифікація амінокислоти в положенні 1, яка надає активність агоніста GIP, причому факультативно амінокислотою в положенні 1 є амінокислота, яка не має імідазольного бічного ланцюга;
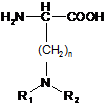
(b) заміна амінокислоти Ser в положенні 16 амінокислотою Формули IV:
 ,
,
[Формула IV]
де n - число від 1 до 7, кожен з R1 і R2 незалежно вибраний з групи, яку складають Н, C1-C18-алкіл, (C1-C18-алкіл)ОН, (C1-C18-aлкiл)NH2, (C1-C18-алкіл)SН, (С0-С4-алкіл)(С3-С6)циклоалкіл, (С0-С4-алкіл)(С2-С5-гетероцикл), (С0-С4-алкіл)(С6-С10-арил)R7 та (С1-С4-алкіл)(С3-С9-гетероарил), R7 - Н або ОН, і бічний ланцюг амінокислоти Формули IV містить вільну аміногрупу, причому факультативно амінокислотою Формули IV є гомоLys, Lys, Оrn або 2,4-діаміномасляна кислота (Dab),
(c) заміна амінокислоти Gln в положенні 20 α,α-дизаміщеною амінокислотою, факультативно АІВ,
(d) модифікації амінокислоти в одному або двох з положень 27, 28 і 29, або в усіх цих положеннях, і
(е) 1-9 інших модифікацій амінокислот порівняно з послідовністю глюкагону (послідовність SEQ ID NO: 1),
причому значення EC50 для даного аналога стосовно активації GIP-рецептора становить приблизно 10 нМ або менше, і причому значення EC50 для даного аналога на GIP-рецепторі відрізняється в не більше ніж приблизно 50 разів від значення EC50 для нього на GLP-1-рецепторі, факультативно GIP-ефективність даного аналога відрізняється в не більше ніж приблизно 15 разів від GLP-1-ефективності даного аналога.
3. Аналог за п. 1 або п. 2, причому (а) амінокислотою в положенні 1 є велика ароматична амінокислота, факультативно Tyr, і (b) причому (і) Met в положенні 27 замінений на велику аліфатичну амінокислоту, факультативно Leu, (іі) Asn в положенні 28 замінений на невелику аліфатичну амінокислоту, факультативно Ala, або (ііі) Thr в положенні 29 замінений на невелику аліфатичну амінокислоту, факультативно Gly, або ж аналог характеризується комбінацією з (і), (іі) і (ііі).
4. Аналог за будь-яким із пп. 1-3, який додатково містить амінокислотну послідовність GPSSGAPPPS (послідовність SEQ ID NO: 95) або XGPSSGAPPPS (послідовність SEQ ID NO: 96) в С-кінцевому напрямі відносно амінокислоти в положенні 29.
5. Аналог за будь-яким із пп. 1-4, який містить одну або декілька з таких модифікацій:
(a) Ser в положенні 2 замінений на D-Ser, Ala, D-Ala, Gly, N-methyl-Ser, AIB, Val або α-аміно-N-масляну кислоту;
(b) Gln в положенні 3 замінений на Glu;
(c) заміна амінокислоти Туr в положенні 10 амінокислотою, факультативно амінокислотою Формули І, яка містить бічний ланцюг, ковалентно зв'язаний з ацильною групою або алкільною групою;
(d) додавання амінокислоти, факультативно амінокислоти Формули І, яка містить бічний ланцюг, ковалентно зв'язаний з ацильною групою або алкільною групою, як С-кінцевої амінокислоти даного аналога;
(е) Lys в положенні 12 замінений на Ilе;
(f) Arg в положенні 17 замінений на Gln;
(g) Arg в положенні 18 замінений на Ala;
(h) Asp в положенні 21 замінений на Glu;
(і) Gln в положенні 24 замінений на Asn, і
(j) заміна карбонової кислоти С-кінцевої амінокислоти групою з нейтральним зарядом, факультативно амідною.
6. Аналог за будь-яким з пп. 1-5, який має (а) модифікацію амінокислоти в положенні 2, яка надає резистентність до DDP-IV, і (b) амінокислоту в положенні 40, ковалентно зв'язану з ацильною групою або алкільною групою.
7. Аналог за будь-яким з пп. 1-6, який містить гідрофільний складник, зв'язаний з амінокислотою в положенні 24.
8. Аналог за п. 2, який містить амінокислотну послідовність будь-якої з послідовностей SEQ ID NО:227, 228, 229 або 230 і подовжувальний сегмент з 1-21 амінокислоти в С-кінцевому напрямі відносно амінокислоти в положенні 29, причому факультативно він додатково має до 6 інших модифікацій амінокислот.
9. Аналог за п. 8, причому подовжувальний сегмент з 1-21 амінокислоти містить амінокислотну послідовність GPSSGAPPPS (послідовність SEQ ID NО:95) або XGPSSGAPPPS (послідовність SEQ ID NО:96), де X - будь-яка амінокислота або амінокислотна послідовність, яка має одну або декілька консервативних замін порівняно з послідовностями SEQ ID NО:95 або 96.
10. Аналог за будь-яким із пп. 7-8, причому щонайменше одна з амінокислот подовжувального сегмента в положенні, яке відповідає будь-якому з положень 37-43, факультативно амінокислота Формули І в положенні 40, ацилована або алкілована.
11. Аналог за п. 1, який містить амінокислотну послідовність, вибрану з групи, яку складають послідовності SEQ ID NО:99-141, 144-164, 166, 192-207, 209-221 та 223.
12. Аналог за п. 1, який містить амінокислотну послідовність, вибрану з групи,
яку складають послідовності SEQ ID NО:18, 28, 29, 34, 35, 38, 39, 42-65, 68, 69, 71, 75, 76, 84, 85, 87, 89-94, 99-111, 113, 114, 116-119, 121-146, 148-149, 153-164, 166, 167, 168, 175-178, 232, 234-237, 260 та 261.
13. Пептид, який містить послідовність SEQ ID NО:105.
14. Пептид за п. 13, який складається з послідовності SEQ ID NО:105.
15. Пептид, який містить послідовність SEQ ID NО:146.
16. Пептид за п. 15, який складається з послідовності SEQ ID NО:146.
17. Пептид, який містить послідовність SEQ ID NО:109.
18. Пептид за п. 17, який ковалентно зв'язаний з гідрофільним складником в будь-якому з положень 19, 20, 23, 24, 27, 32, 43 амінокислотної послідовності або на С-кінці.
19. Аналог за будь-яким із пп. 1-9, який містить ацильну групу або алкільну групу, яка зв'язана з бічним ланцюгом амінокислоти через спейсер, причому факультативно спейсером є дипептид, і факультативно спейсер містить дві негативно заряджені амінокислоти.
20. Аналог за п. 19, причому ацильною групою є ацильна група С12-С18 жирної кислоти, факультативно ацильна група С14 або С16 жирної кислоти.
21. Аналог за будь-яким одним із пп. 1-12, 19 або 20 або пептид за будь-яким одним із пп. 13-18, який ковалентно зв'язаний з гідрофільним складником, факультативно поліетиленгліколем (PEG), в будь-якому з положень 19, 20, 23, 24, 27, 32, 43 амінокислотної послідовності або на С-кінці, причому факультативно гідрофільний складник ковалентно зв'язаний з Lys, Cys, Orn, гомоцистеїном або ацетилфенілаланіном.
22. Аналог або пептид за п. 21, причому PEG має молекулярну масу від приблизно 20000 Да до приблизно 40000 Да.
23. Аналог глюкагону (послідовність SEQ ID NO: 1), який має активність агоніста GIP, з такими модифікаціями:
(a) модифікація амінокислоти в положенні 1, яка надає активність агоніста GIP, причому факультативно модифікація амінокислоти в положенні 1 є заміною His амінокислотою, яка не має імідазольного бічного ланцюга,
(b) лактамовий місток між бічними ланцюгами амінокислот в положеннях і та і+4 або між бічними ланцюгами амінокислот в положеннях j та j+3, де і - 12, 13, 16, 17, 20 або 24, і де j - 17,
(c) модифікації амінокислот в одному або двох з положень 27, 28 і 29, або в усіх цих положеннях, і
(d) 1-9 інших модифікацій амінокислот,
причому значення ЕС50 для даного аналога стосовно активації GIP-рецептора становить приблизно 10 нМ або менше, і причому значення ЕС50 для даного аналога на GIP-рецепторі відрізняється в не більше ніж приблизно 50 разів від значення ЕС50 для нього на GLP-1-рецепторі.
24. Аналог за п. 1, який містить амінокислотну послідовність, вибрану з групи, яку складають послідовності SEQ ID NО: 167-169, 173-178 та 225.
25. Аналог за п. 1, який містить амінокислотну послідовність, вибрану з групи, яку складають послідовності SEQ ID NO: 5-94.
26. Кон'югат, димер або гібридний пептид, який містить аналог або пептид за будь-яким з пп. 1-25.
27. Фармацевтична композиція, яка містить аналог або пептид за будь-яким із пп. 1-25, кон'югат, димер або гібридний пептид за п. 26 або їх комбінацію і фармацевтично прийнятний носій.
28. Набір, який включає в себе фармацевтичну композицію за п. 27 і пристрій для введення згаданої фармацевтичної композиції в організм пацієнта, причому згаданий пристрій включає в себе шприц, який вміщує згадану фармацевтичну композицію.
29. Застосування фармацевтичної композиції за п. 27 для зниження маси тіла або стимулювання зменшення маси тіла.
30. Застосування фармацевтичної композиції за п. 27 для лікування діабету або ожиріння.
Текст
Реферат: Винахід стосується аналогів глюкагону, які демонструють активність агоніста GIP на додаток до глюкагонової та/або GLP-1 активності. Запропоновані також фармацевтичні композиції, які містять такі аналоги глюкагону, і терапевтичні способи їх застосування. UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на споріднені заявки Ця заявка претендує на пріоритет за попередньою заявкою на патент США № 61/073,274, поданою 17 червня 2008 року, попередньою заявкою на патент США № 61/078,171, поданою 3 липня 2008 року, попередньою заявкою на патент США № 61/090,448, поданою 20 серпня 2008 року, і попередньою заявкою на патент США № 61/151,349, поданою 10 лютого 2009 року. Зміст кожної заявки включений в цей опис в повному обсязі шляхом посилання. Передумови створення винаходу Препроглюкагон являє собою поліпептид-попередник, що складається зі 158 амінокислот, який піддається процесингу в різних тканинах з утворенням ряду різних проглюкагонових пептидів, у тому числі глюкагону, глюкагоноподібного пептиду-1 (GLP-1), глюкагоноподібного пептиду-2 (GLP-2) і оксинтомодуліну (OXM), які беруть участь у різноманітних фізіологічних процесах, у тому числі глюкозному гомеостазі, секреції інсуліну, випорожненні шлунка, розвитку кишечнику, а також регулюванні споживання їжі. Глюкагон являє собою пептид, який складається з 29 амінокислот, які відповідають амінокислотам 33-61 препроглюкагону, в той час як GLP-1 продукується у вигляді пептиду, який складається з 37 амінокислот, які відповідають амінокислотам 72-108 препроглюкагону. У тому випадку, коли рівень глюкози в крові починає спадати, глюкагон, який є гормоном, що продукується підшлунковою залозою, сигналізує печінці про необхідність розщеплювання глікогену і виділення глюкози, що спричиняє підвищення вмісту глюкози в крові до нормального рівня. GLP-1 має інші види біологічної активності в порівнянні з глюкагоном. Його дії включають стимулювання синтезу і секретування інсуліну, інгібування секреції глюкагону і зниження споживання їжі. Було показано, що GLP-1 знижує гіперглікемію (підвищені рівні глюкози) у хворих на діабет. Екзендін-4, пептид з отрути ящірки, який має приблизно 50% ідентичність амінокислотного складу з GLP-1, активує GLP-1-рецептор, і було показано, що він подібним чином знижує гіперглікемію у хворих на діабет. Глюкозозалежний інсулінотропний пептид (GIP) є регуляторним пептидом шлунковокишкового тракту, що складається з 42 амінокислот, який стимулює секрецію інсуліну бетаклітинами підшлункової залози у присутності глюкози. Він утворюється в процесі протеолітичного процесингу з попередника, який складається з 133 амінокислот, препроGIP. Суть винаходу Як описано нижче, в цьому описі запропоновані глюкагонові пептиди, що є аналогами нативного глюкагону (послідовність SEQ ID NO: 1), які демонструють активність GIP. Цим винаходом запропоновані також способи застосування таких пептидів. Нативний глюкагон не активує GIP-рецептор і, при звичайних обставинах, має приблизно 1% активності нативного GLP-1 на GLP-1-рецепторі. В результаті описаних у цій заявці модифікацій послідовності нативного глюкагону отримують глюкагонові пептиди, які можуть виявляти високу глюкагонову активність, еквівалентну активності нативного глюкагону або вищу за неї (послідовність SEQ ID NO: 1), високу активність на GIP-рецепторі, еквівалентну активності нативного GIP або вищу за неї (послідовність SEQ ID NO: 4), та/або високу активність на GLP-1рецепторі, еквівалентну активності нативного GLP-1 або вищу за неї. GLP-1(7-36) амід (послідовність SEQ ID NO: 3) або GLP-1(7-37) (кисла форма) (послідовність SEQ ID NO: 2) є біологічно активними формами GLP-1, які демонструють по суті еквівалентну активність на GLP1-рецепторі. Дані, наведені в цьому описі, показують, що пептиди, які мають активність як на GIPрецепторі, так і на GLP-1-рецепторі, є особливо корисними для стимулювання зменшення маси тіла або запобігання збільшенню маси тіла, а також для лікування гіперглікемії, у тому числі діабету. In vivo дані, наведені в цьому описі, демонструють, що комбінація агоністичної активності на GIP-рецепторі з агоністичною активністю на GLP-1-рецепторі впливає на зниження маси тіла більше, ніж активність на GLP-1-рецепторі сама по собі. Ця активність особливо несподівана, беручи до уваги принципи, визнані в цій галузі, суть яких полягає в тому, що антагонізування GIP є бажаним для зниження добового споживання їжі і маси тіла, а також підвищення чутливості до інсуліну і витрати енергії. (Irwin et al., Diabetologia 50: 1532-1540 (2007); і Althage et al., J. Biol. Chem., електронна публікація від 17 квітня, 2008). Таким чином, за одним з аспектів цей винахід пропонує способи стимулювання зменшення маси тіла або запобігання збільшенню маси тіла, які включають введення в організм пацієнта, який потребує цього, ефективної кількості сполуки, наприклад, глюкагонового пептиду, яка демонструє активність як на GIP-рецепторі, так і на GLP-1-рецепторі, і яка факультативно також демонструє активність на глюкагоновому рецепторі. До таких сполук належать описувані в цій заявці коагоністи GIP-рецептора/GLP-1-рецептора і триагоністи глюкагонового рецептора/GIPрецептора/GLP-1-рецептора. 1 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 Підвищена активність на GIP-рецепторі забезпечується модифікацією амінокислоти в положенні 1. Наприклад, His в положенні 1 замінюють великою ароматичною амінокислотою, факультативно Tyr, Phe, Trp, аміно-Phe, нітро-Phe, хлоро-Phe, сульфо-Phe, 4-піридил-Ala, метил-Tyr або 3-аміно-Tyr. Підвищена активність на GIP-рецепторі забезпечується модифікаціями, які стабілізують альфа-спіральну структуру C-кінцевої ділянки (амінокислоти 12-29) глюкагонового пептиду або його аналога. Наприклад, внутрішньомолекулярний місток може бути утворений ковалентним зв'язком між бічними ланцюгами двох амінокислот в положеннях i та i+4, або між положеннями j та j+3, або між положеннями k та k+7. В певних варіантах здійснення цього винаходу згаданий місток знаходиться між положеннями 12 та 16, 16 та 20, 20 та 24, 24 та 28 або 17 та 20. В інших варіантах здійснення цього винаходу в цих положеннях між позитивно і негативно зарядженими амінокислотами можуть утворюватися нековалентні взаємодії, такі як сольові містки. Альтернативно, наприклад, стабілізація альфа-спіральної структури на C-кінцевій ділянці глюкагонового пептиду (поблизу амінокислот 12-29) забезпечується спрямованим введенням однієї або декількох α,α-дизаміщених амінокислот в положення, які зберігають необхідну активність. В деяких варіантах здійснення цього винаходу одне, два, три, чотири або більше положень 16, 17, 18, 19, 20, 21, 24 або 29 глюкагонового пептиду або його аналога замінюють α,α-дизаміщеною амінокислотою. Наприклад, заміна амінокислоти в положенні 16 глюкагонового пептиду або його аналога на аміноізомасляну кислоту (AIB) забезпечує стабілізовану альфа-спіраль за відсутності сольового містка або лактаму. Такі пептиди розглядаються в цьому описі як пептиди, які не мають внутрішньомолекулярного містка. За конкретними аспектами цього винаходу стабілізація альфа-спіралі здійснюється шляхом введення однієї або декількох ,-дизаміщених амінокислот без введення ковалентного внутрішньомолекулярного містка, наприклад, лактамового містка, дисульфідного містка. Такі пептиди розглядаються в цьому описі як пептиди, які не мають ковалентного внутрішньомолекулярного містка. В деяких варіантах здійснення цього винаходу амінокислоту в одному, двох, трьох або декількох положеннях 16, 20, 21 або 24 замінюють на AIB. Підвищена активність на GIP-рецепторі забезпечується модифікаціями амінокислот в положеннях 27 та/або 28, і факультативно в положенні 29. Наприклад, Met в положенні 27 замінюють великою аліфатичною амінокислотою, факультативно Leu, Asn в положенні 28 замінюють невеликою аліфатичною амінокислотою, факультативно Ala, і Thr в положенні 29 замінюють невеликою аліфатичною амінокислотою, факультативно Gly. Підвищена активність на GIP-рецепторі забезпечується також модифікацією амінокислоти в положенні 12. Наприклад, амінокислоту в положенні 12 замінюють великою аліфатичною неполярною амінокислотою, факультативно Ile. Підвищена активність на GIP-рецепторі забезпечується також модифікацією амінокислоти в положеннях 17 та/або 18. Наприклад, амінокислоту в положенні 17 замінюють полярною амінокислотою, факультативно Gln, та амінокислоту в положенні 18 замінюють невеликою аліфатичною амінокислотою, факультативно Ala. Підвищена активність на глюкагоновому рецепторі забезпечується модифікацією амінокислоти в положенні 16 нативного глюкагону (послідовність SEQ ID NO:1) як описано в цій заявці. Знижена, підтримувана на однаковому рівні або підвищена активність на глюкагоновому рецепторі забезпечується, наприклад, модифікацією амінокислоти в положенні 3, як описано в цій заявці. Відновлення глюкагонової активності, яка була знижена модифікаціями амінокислот в положеннях 1 та/або 2, забезпечується модифікаціями, які стабілізують альфа-спіральну структуру C-кінцевої ділянки (амінокислоти 12-29) глюкагонового пептиду або його аналога. Наприклад, внутрішньомолекулярний місток може бути утворений ковалентним зв'язком між бічними ланцюгами двох амінокислот в положеннях i та i+4, або між положеннями j та j+3, або між положеннями k та k+7. В інших варіантах здійснення цього винаходу в цих положеннях між позитивно і негативно зарядженими амінокислотами можуть утворюватися нековалентні взаємодії, такі як сольові містки. В інших варіантах здійснення цього винаходу одну або декілька α,α-дизаміщених амінокислот використовують для заміни або вводять на згадану С-кінцеву ділянку (амінокислоти 12-29) в положення, які зберігають необхідну активність. Наприклад, одне, два, три або всі положення 16, 20, 21 або 24 замінюють α,α-дизаміщеною амінокислотою, наприклад, AIB. Підвищена активність на GLP-1-рецепторі забезпечується заміною карбонової кислоти Скінцевої амінокислоти групою з нейтральним зарядом, такою як амідна або складноефірна група. 2 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 Підвищена активність на GLP-1-рецепторі забезпечується модифікаціями, які стабілізують альфа-спіральну структуру C-кінцевої ділянки (поблизу амінокислот 12-29) глюкагонового пептиду або його аналога. В деяких варіантах здійснення цього винаходу внутрішньомолекулярний місток може бути утворений ковалентним зв'язком між бічними ланцюгами двох амінокислот в положеннях i та i+4, або між положеннями j та j+3, або між положеннями k та k+7. В інших варіантах здійснення цього винаходу в цих положеннях між позитивно і негативно зарядженими амінокислотами можуть утворюватися нековалентні взаємодії, такі як сольові містки. В інших варіантах здійснення цього винаходу одну або декілька α,α-дизаміщених амінокислот використовують для заміни або вводять на згадану C-кінцеву ділянку (амінокислоти 12-29) в положення, які зберігають бажану активність. Наприклад, амінокислоту в одному, двох, трьох або всіх положеннях 16, 20, 21 або 24 замінюють α,αдизаміщеною амінокислотою, наприклад, AIB. Підвищена активність на GLP-1-рецепторі забезпечується модифікацією амінокислоти в положенні 20 як описано у цій заявці. Підвищена активність на GLP-1-рецепторі забезпечується доданням С-кінцевого подовжувального пептиду, такого як GPSSGAPPPS (послідовність SEQ ID NO: 95) або XGPSSGAPPPS (послідовність SEQ ID NO: 96), до С-кінця. Активність на GLP-1-рецепторі в таких аналогів може бути також підвищена модифікуванням амінокислот в положенні 18, 28 або 29 чи в положеннях 18 та 29 як описано в цій заявці. Подальше незначне підвищення ефективності на GLP-1-рецепторі забезпечується модифікуванням амінокислоти в положенні 10 з перетворенням її на велику ароматичну амінокислоту, факультативно – Trp. Знижена активність на GLP-1-рецепторі забезпечується, наприклад, модифікацією амінокислоти в положенні 7, делецією амінокислоти(амінокислот), розташованої(-их) в Cкінцевому напрямі відносно амінокислоти в положенні 27 або 28, із одержанням пептиду з 27 або 28 амінокислот, або комбінацією цих модифікацій як описано в цій заявці. Збереження активності після пегілювання забезпечується доданням GPSSGAPPPS (послідовність SEQ ID NO: 95) до C-кінця. Як показано в цій заявці, збереження на постійному рівні або підвищення активності на кожному з рецепторів (глюкагоновому рецепторі, GLP-1-рецепторі і GIP-рецепторі) (в порівнянні з лактамвмісним активним по відношенню до GIP-рецептора аналогом на основі глюкагону) забезпечується (i) заміною амінокислоти Ser в положенні 16 амінокислотою Формули IV: , [Формула IV] де n становить від 1 до 16, або від 1 до 10, або від 1 до 7, або від 1 до 6, або від 2 до 6, або 2, або 3, або 4, або 5, кожен з R1 і R2 незалежно вибраний з групи, яку складають H, C1-C18алкіл, (C1-C18-алкіл)OH, (C1-C18-алкіл)NH2, (C1-C18-алкіл)SH, (C0-C4-алкіл)(C3-C6)циклоалкіл, (C0C4-алкіл)(C2-C5-гетероцикл), (C0-C4-алкіл)(C6-C10-арил)R7 та (C1-C4-алкіл)(C3-C9-гетероарил), де R7 – H або OH, і бічний ланцюг амінокислоти Формули IV містить вільну аміногрупу, та (ii) заміною амінокислоти Gln в положенні 20 α,α-дизаміщеною амінокислотою, наприклад, AIB. В деяких варіантах здійснення цього винаходу амінокислотою в положенні 16 є Lys, а амінокислотою в положенні 20 є AIB. Активність аналога, який містить амінокислоту Формули IV в положенні 16 і α,α-дизаміщену амінокислоту в положенні 20, на кожному з рецепторів (глюкагоновому рецепторі, GLP-1рецепторі і GIP-рецепторі) може також бути підвищена збільшенням довжини пептиду, наприклад, приєднанням C-кінцевого подовжувального пептиду, наприклад, завдовжки приблизно 1-21 амінокислота, приблизно 9-21 амінокислота, приблизно 6-18 амінокислот, приблизно 9-12 амінокислот або приблизно 10 амінокислот або 11 амінокислот. В деяких варіантах здійснення цього винаходу C-кінець подовжують шляхом приєднання GPSSGAPPPS (послідовність SEQ ID NO: 95) або XGPSSGAPPРS (послідовність SEQ ID NO: 96), де X – Gly або невелика аліфатична або неполярна чи слабополярна амінокислота. В альтернативних варіантах здійснення цього винаходу C-кінець подовжують шляхом приєднання GPSSGAPPPS (послідовність SEQ ID NO: 95), і 1-11 амінокислот (наприклад, 1-5 амінокислот або 3 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 1 амінокислоту, 2 амінокислоти, 3 амінокислоти, 4 амінокислоти, 5 амінокислот, 6 амінокислот, 7 амінокислот, 8 амінокислот, 9 амінокислот, 10 амінокислот, 11 амінокислот) приєднують до Cкінця GPSSGAPPPS (послідовність SEQ ID NO: 95). Згадані 1-11 амінокислот на C-кінці GPSSGAPPPS (послідовність SEQ ID NO: 95) можуть включати, наприклад, одну або декілька невеликих аліфатичних амінокислот, таких як Ala або Gly. В цьому сенсі, С-кінцевим подовжувальним сегментом може бути, наприклад, GPSSGAPPPSXm, де m становить від 1 до 11 (наприклад, від 1 до 5), а X – Ala або Gly. Альтернативно 1-11 амінокислот (наприклад, від 1 амінокислоти до 5 амінокислот), приєднаних до C-кінця послідовності SEQ ID NO: 95, можуть бути комбінацією різних невеликих аліфатичних амінокислот. Наприклад, згадані 111 амінокислот (наприклад, від 1 амінокислоти до 5 амінокислот) можуть бути комбінацією амінокислот Ala і Gly. Підвищення активності на кожному з рецепторів (глюкагоновому рецепторі, GLP-1-рецепторі і GIP-рецепторі) аналога на основі глюкагону, який має активність по відношенню до GIPрецептора, включаючи аналог, який містить амінокислоту Формули IV в положенні 16 та α,αдизаміщену амінокислоту в положенні 20, крім того, може забезпечуватися шляхом ацилування або алкілування амінокислоти, розташованої в межах C-кінцевого подовжувального сегмента або C-кінцевої амінокислоти (наприклад, амінокислоти, доданої до C-кінця C-кінцевого подовжувального сегмента). Ацилуванню або алкілуванню може бути піддана амінокислота, розташована, наприклад, в будь-якому з положень 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 та 50. В деяких варіантах здійснення цього винаходу амінокислота, яку піддають ацилуванню або алкілуванню, розміщена в положенні 37, 38, 39, 40, 41, 42 або 43. В деяких варіантах здійснення цього винаходу ацильованою або алкілованою амінокислотою є Lys, приєднаний до ацильної або алкільної групи, наприклад, C10-C22. В деяких варіантах здійснення цього винаходу Lys розташований в C-кінцевому напрямі відносно C-кінцевого подовжувального сегмента, який містить амінокислотну послідовність SEQ ID NO: 95, так що Lys займає положення 40 аналога. Факультативно ацильовані пептиди, подовжені на C-кінці, також пегілюють, наприклад, в положенні 24. Підвищення активності на кожному з рецепторів (глюкагоновому рецепторі, GLP-1-рецепторі і GIP-рецепторі) аналога на основі глюкагону, який має активність по відношенню до GIPрецептора, може також забезпечуватися ацилуванням або алкілуванням амінокислоти через спейсер (наприклад, амінокислоту, дипептид, трипептид, гідрофільний біфункціональний спейсер, гідрофобний біфункціональний спейсер). В деяких варіантах здійснення цього винаходу до складу аналога на основі глюкагону, який має активність по відношенню до GIPрецептора, вводять ацильну або алкільну групу через спейсер, який приєднують до бічного ланцюга амінокислоти в положенні 10 або в положенні 40 аналога. В інших варіантах здійснення цього винаходу аналог містить C-кінцевий подовжувальний сегмент із 1-21 амінокислоти, розташований в C-кінцевому напрямі відносно амінокислоти в положенні 29, і спейсер, ковалентно приєднаний до ацильної або алкільної групи, приєднують до амінокислоти подовжувального сегмента в положенні, яке відповідає одному з положень 37-43 відносно послідовності SEQ ID NO: 1. В деяких варіантах здійснення цього винаходу довжина спейсера становить від 3 атомів до 10 атомів. В окремих аспектах цього винаходу загальна довжина спейсера і ацильної або алкільної групи становить від приблизно 14 атомів до приблизно 28 атомів. У цій заявці також наведений опис спейсерів, прийнятних для підвищення активності на одному або декількох рецепторах з-посеред глюкагонового рецептора, GLP-1-рецептора і GIP-рецептора. Будь-яка з описаних вище модифікацій, яка підвищує або знижує активність на GIPрецепторі, яка підвищує або знижує активність на глюкагоновому рецепторі і яка підвищує або знижує активність на GLP-1-рецепторі, може застосовуватися окремо або в комбінації. Будь-яку з описаних вище модифікацій можна також комбінувати з іншими модифікаціями, які надають інші бажані властивості, такі як підвищена розчинність, та/або стабільність, та/або тривалість дії. Альтернативно будь-яку з описаних вище модифікацій можна комбінувати з іншими модифікаціями, які не чинять істотного впливу на розчинність, стабільність або активність. До прикладів модифікацій належать (але без обмеження ними): (A) Поліпшення розчинності, наприклад, шляхом введення однієї зарядженої амінокислоти, двох, трьох або більше заряджених амінокислот до складу C-кінцевої ділянки нативного глюкагону, за варіантом, якому віддається перевага, в положенні, орієнтованому в C-кінцевому напрямку відносно положення 27. Таку заряджену амінокислоту можна вводити шляхом заміни нативної амінокислоти на заряджену амінокислоту, наприклад, в положеннях 28 або 29, або ж альтернативно – шляхом додавання зарядженої амінокислоти, наприклад, після положення 27, 28 або 29. В певних варіантах здійснення цього винаходу одна, дві, три або всі заряджені 4 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислоти мають негативний заряд. В інших варіантах здійснення цього винаходу одна, дві, три або всі заряджені амінокислоти мають позитивний заряд. Такі модифікації підвищують розчинність, наприклад, забезпечують підвищення розчинності у щонайменше 2 рази, 5 разів, 10 разів, 15 разів, 25 разів, 30 разів або більше в порівнянні з нативним глюкагоном при значенні рН, яке становить від приблизно 5,5 до 8, наприклад, рН 7, при визначенні через 24 год при температурі 25C. (B) Підвищення розчинності і тривалості дії або напівперіоду існування в системі кровообігу шляхом додавання гідрофільного складника, такого як поліетиленгліколевий ланцюг, як описано в цій заявці, наприклад, в положенні 16, 17, 20, 21, 24 або 29, в межах C-кінцевого подовжувального сегмента або на C-кінцевій амінокислоті пептиду. (C) Підвищення розчинності та/або тривалості дії або напівперіоду існування в системі кровообігу та/або відстрочення початку дії шляхом ацилування або алкілування глюкагонового пептиду як описано у цій заявці. (D) Підвищення тривалості дії або напівперіоду існування в системі кровообігу введенням резистентності до розщеплювання дипептидилпептидазою IV (DPP IV) шляхом модифікування амінокислоти в положенні 1 або 2 як описано у цій заявці. (E) Підвищення стабільності модифікуванням Asp в положенні 15, наприклад, шляхом делеції або заміни глутаміновою кислотою, гомоглутаміновою кислотою, цистеїновою кислотою або гомоцистеїновою кислотою. Такі модифікації можуть зменшити деградацію або розщеплювання при значенні рН в межах від 5,5 до 8, наприклад, збереження щонайменше 75%, 80%, 90%, 95%, 96%, 97%, 98% або від 99% до 100% початкового пептиду через 24 год при температурі 25C. Такі модифікації зменшують розщеплення пептидного зв'язку Asp15Ser16. (F) Підвищення стабільності модифікуванням Ser в положенні 16, наприклад, шляхом заміни на Thr або AIB. Такі модифікації також зменшують розщеплення пептидного зв'язку Asp15Ser16. (G) Підвищення стабільності модифікуванням метіоніну в положенні 27, наприклад, шляхом заміни на лейцин або норлейцин. Такі модифікації можуть зменшити окиснювальну деградацію. Стабільність може бути також підвищена модифікуванням Gln в положенні 20 або 24, наприклад, шляхом заміни на Ala, Ser, Thr або AIB. Такі модифікації можуть зменшити деградацію, обумовлену деамідуванням Gln. Стабільність може бути підвищена модифікуванням Asp в положенні 21, наприклад, шляхом заміни на Glu. Такі модифікації можуть зменшити деградацію, обумовлену дегідратацією Asp, яка призводить до утворення циклічної сукцинімідної проміжної сполуки, та подальшою ізомеризацією до ізоаспартату. (H) Неконсервативні або консервативні заміни, додання або делеції, які не чинять істотного впливу на активність, наприклад, консервативні заміни в одному або декількох положеннях 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 27, 28 або 29; заміна амінокислоти в одному або декількох із цих положень на Ala; делеція амінокислот в одному або декількох положеннях 27, 28 або 29; або делеція амінокислоти 29, факультативно об'єднаної із Cкінцевою амідною або складноефірною групою замість C-кінцевої карбоксильної групи; заміна Lys в положенні 12 на Arg; заміна Tyr в положенні 10 на Val або Phe. За деякими варіантами здійснення цього винаходу глюкагонові пептиди, описані в цій заявці, демонструють EC50 для активації GIP-рецептора, величина якої становить приблизно 100 нМ або менше або приблизно 75 нМ, 50 нМ, 25 нМ, 10 нМ, 8 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ чи 1 нМ або менше. В деяких варіантах здійснення цього винаходу глюкагонові пептиди, описані в цій заявці, демонструють EC50 на GIP-рецепторі, величина якої становить приблизно 0,001 нМ, 0,01 нМ або 0,1 нМ. В деяких варіантах здійснення цього винаходу глюкагонові пептиди, описані в цій заявці, демонструють EC50 на GIP-рецепторі, величина якої не перевищує приблизно 1 нМ, 2 нМ, 3 нМ, 4 нМ, 5 нМ, 6 нМ, 8 нМ, 10 нМ, 15 нМ, 20 нМ, 25 нМ, 30 нМ, 40 нМ, 50 нМ, 75 нМ або 100 нМ. В деяких варіантах здійснення цього винаходу глюкагонові пептиди демонструють EC50 для активації глюкагонового рецептора, величина якої становить приблизно 100 нМ або менше або приблизно 75 нМ, 50 нМ, 25 нМ, 10 нМ, 8 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ чи 1 нМ або менше. В деяких варіантах здійснення цього винаходу глюкагонові пептиди, описані в цій заявці, демонструють EC50 на глюкагоновому рецепторі, величина якої становить приблизно 0,001 нМ, 0,01 нМ або 0,1 нМ. За деякими варіантами здійснення цього винаходу величина EC50 на глюкагоновому рецепторі не перевищує приблизно 1 нМ, 2 нМ, 3 нМ, 4 нМ, 5 нМ, 6 нМ, 8 нМ, 10 нМ, 15 нМ, 20 нМ, 25 нМ, 30 нМ, 40 нМ, 50 нМ, 75 нМ або 100 нМ. В деяких варіантах здійснення цього винаходу глюкагонові пептиди демонструють EC 50 для активації GLP-1рецептора, величина якої становить приблизно 100 нМ або менше або приблизно 75 нМ, 50 нМ, 25 нМ, 10 нМ, 8 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ чи 1 нМ або менше. В деяких варіантах 5 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 здійснення цього винаходу глюкагонові пептиди, описані в цій заявці, демонструють EC50 на GLP-1-рецепторі, величина якої становить приблизно 0,001 нМ, 0,01 нМ або 0,1 нМ. В деяких варіантах здійснення цього винаходу величина EC50 на GLP-1-рецепторі не перевищує приблизно 1 нМ, 2 нМ, 3 нМ, 4 нМ, 5 нМ, 6 нМ, 8 нМ, 10 нМ, 15 нМ, 20 нМ, 25 нМ, 30 нМ, 40 нМ, 50 нМ, 75 нМ або 100 нМ. Активація рецептора може бути визначена за допомогою in vitro ’ ' аналізів, в ході яких визначають індукцію cAMP (цАМФ, аденозин-3 ,5 -циклофосфат) в клітинах лінії HEK293, які надпродукують рецептор, наприклад, шляхом дослідження клітин лінії HEK293, котрансфікованих ДНК, яка кодує рецептор і ген люциферази, пов'язаної з cAMP-реактивним елементом, як описано в Прикладі 16. В деяких варіантах здійснення цього винаходу глюкагонові пептиди демонструють щонайменше приблизно 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175%, 200% або вищу активність на GIPрецепторі в порівнянні з нативним GIP (GIP ефективність). В деяких варіантах здійснення цього винаходу глюкагонові пептиди, описані в цій заявці, демонструють не більше ніж 1000%, 10000%, 100000% або 1000000% активності на GIP-рецепторі в порівнянні з нативним GIP. В деяких варіантах здійснення цього винаходу глюкагонові пептиди демонструють щонайменше приблизно 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175%, 200%, 250%, 300%, 350%, 400%, 450%, 500% або вищу активність на глюкагоновому рецепторі в порівнянні з нативним глюкагоном (глюкагонова ефективність). В деяких варіантах здійснення цього винаходу глюкагонові пептиди, описані в цій заявці, демонструють не більше ніж 1000%, 10000%, 100000% або 1000000% активності на глюкагоновому рецепторі в порівнянні з нативним глюкагоном. В деяких варіантах здійснення цього винаходу глюкагонові пептиди демонструють щонайменше приблизно 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 75%, 100%, 125%, 150%, 175%, 200% або вищу активність на GLP-1-рецепторі в порівнянні з нативним GLP-1 (GLP-1 ефективність). В деяких варіантах здійснення цього винаходу глюкагонові пептиди, описані в цій заявці, демонструють не більше ніж 1000%, 10000%, 100000% або 1000000% активності на GLP-1-рецепторі в порівнянні з нативним GLP-1. Активність глюкагонового пептиду на рецепторі відносно нативного ліганду згаданого рецептора обчислюють як обернене відношення значень EC50 для глюкагонового пептиду в зіставленні з нативним лігандом. Таким чином, в одному з аспектів цього винаходу запропоновані глюкагонові пептиди, які демонструють активність як на глюкагоновому рецепторі, так і на GIP-рецепторі ("коагоністи глюкагонового рецептора/GIP-рецептора"). Ці глюкагонові пептиди втратили селективність нативного глюкагону щодо глюкагонового рецептора в порівнянні з GIP-рецептором. В деяких варіантах здійснення цього винаходу величина EC50 глюкагонового пептиду на GIP-рецепторі відрізняється в менше ніж приблизно 50 разів, 40 разів, 30 разів або 20 разів (у бік збільшення або бік зменшення) від величини його EC50 на глюкагоновому рецепторі. В деяких варіантах здійснення цього винаходу GIP ефективність глюкагонового пептиду відрізняється в менш ніж приблизно 500 разів, 450 разів, 400 разів, 350 разів, 300 разів, 250 разів, 200 разів, 150 разів, 100 разів, 75 разів, 50 разів, 25 разів, 20 разів, 15 разів, 10 разів або 5 разів (у бік збільшення або бік зменшення) від його глюкагонової ефективності. В деяких варіантах здійснення цього винаходу відношення EC50 глюкагонового пептиду на GIP-рецепторі до EC50 глюкагонового пептиду на глюкагоновому рецепторі становить менш ніж приблизно 100, 75, 60, 50, 40, 30, 20, 15, 10 або 5. В деяких варіантах здійснення цього винаходу відношення EC50 на GIP-рецепторі до EC50 на глюкагоновому рецепторі становить приблизно 1 або менше ніж приблизно 1 (наприклад, приблизно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В деяких варіантах здійснення цього винаходу відношення GIP ефективності глюкагонового пептиду в порівнянні з глюкагоновою ефективністю глюкагонового пептиду, становить менш ніж приблизно 500, 450, 400, 350, 300, 250, 200, 150, 100, 75, 60, 50, 40, 30, 20, 15, 10 або 5. В деяких варіантах здійснення цього винаходу відношення ефективності на GIP-рецепторі до ефективності на глюкагоновому рецепторі становить приблизно 1 або менше ніж приблизно 1 (наприклад, приблизно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В деяких варіантах здійснення цього винаходу активність на GLP-1-рецепторі була значно знижена або ліквідована, наприклад, модифікацією амінокислоти в положенні 7, делецією амінокислоти(амінокислот), розташованої(-их) в C-кінцевому напрямку відносно амінокислоти в положенні 27 або 28, з утворенням пептиду довжиною 27 амінокислот або 28 амінокислот, або комбінацією цих модифікацій. За іншим аспектом цього винаходу запропоновані глюкагонові пептиди, які демонструють активність на глюкагоновому рецепторі, GIP-рецепторі і GLP-1-рецепторі ("триагоністи глюкагонового рецептора/GIP-рецептора/GLP-1-рецептора"). Ці глюкагонові пептиди втратили 6 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 селективність нативного глюкагону щодо глюкагонового рецептора у порівнянні як з GLP-1рецептором, так і з GIP-рецептором. В деяких варіантах здійснення цього винаходу величина EC50 глюкагонового пептиду на GIP-рецепторі відрізняється в менше ніж приблизно 50 разів, 40 разів, 30 разів або 20 разів (у бік збільшення або бік зменшення) від відповідної величини його EC50 на глюкагоновому рецепторі і на GLP-1-рецепторі. В деяких варіантах здійснення цього винаходу GIP ефективність глюкагонового пептиду відрізняється в менш ніж приблизно 500 разів, 450 разів, 400 разів, 350 разів, 300 разів, 250 разів, 200 разів, 150 разів, 100 разів, 75 разів, 50 разів, 25 разів, 20 разів, 15 разів, 10 разів або 5 разів (у бік збільшення або бік зменшення) від його глюкагонової і GLP-1 ефективності. В деяких варіантах здійснення цього винаходу відношення EC50 триагоніста на GIP-рецепторі до EC50 триагоніста на GLP-1рецепторі становить менше ніж приблизно 100, 75, 60, 50, 40, 30, 20, 15, 10 або 5. В деяких варіантах здійснення цього винаходу відношення EC50 на GIP-рецепторі до EC50 на GLP-1рецепторі становить приблизно 1 або менше ніж приблизно 1 (наприклад, приблизно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В деяких варіантах здійснення цього винаходу відношення GIP ефективності триагоніста в порівнянні з GLP-1 ефективністю триагоніста становить менше ніж приблизно 100, 75, 60, 50, 40, 30, 20, 15, 10 або 5. В деяких варіантах здійснення цього винаходу відношення ефективності на GIP-рецепторі до ефективності на GLP-1-рецепторі становить приблизно 1 або менше ніж приблизно 1 (наприклад, приблизно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). У відповідних варіантах здійснення цього винаходу відношення EC50 триагоніста на GIP-рецепторі до EC50 триагоніста на глюкагоновому рецепторі становить менше ніж приблизно 100, 75, 60, 50, 40, 30, 20, 15, 10 або 5. В деяких варіантах здійснення цього винаходу відношення EC50 на GIPрецепторі до EC50 на глюкагоновому рецепторі становить приблизно 1 або менше ніж приблизно 1 (наприклад, приблизно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В деяких варіантах здійснення цього винаходу відношення GIP ефективності триагоніста в порівнянні з глюкагоновою ефективністю триагоніста становить менше ніж приблизно 500, 450, 400, 350, 300, 250, 200, 150, 100, 75, 60, 50, 40, 30, 20, 15, 10 або 5. В деяких варіантах здійснення цього винаходу відношення ефективності на GIP-рецепторі до ефективності на глюкагоновому рецепторі становить приблизно 1 або менше ніж приблизно 1 (наприклад, приблизно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В деяких варіантах здійснення цього винаходу відношення EC50 триагоніста на GLP-1-рецепторі до EC50 триагоніста на глюкагоновому рецепторі становить менше ніж приблизно 100, 75, 60, 50, 40, 30, 20, 15, 10 або 5. В деяких варіантах здійснення цього винаходу відношення EC 50 на GLP-1-рецепторі до EC50 на глюкагоновому рецепторі становить приблизно 1 або менше ніж приблизно 1 (наприклад, приблизно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). В деяких варіантах здійснення цього винаходу відношення GLP-1 ефективності триагоніста в порівнянні з глюкагоновою ефективністю триагоніста становить менше ніж приблизно 100, 75, 60, 50, 40, 30, 20, 15, 10 або 5. В деяких варіантах здійснення цього винаходу відношення ефективності на GLP-1-рецепторі до ефективності на глюкагоновому рецепторі становить приблизно 1 або менше ніж приблизно 1 (наприклад, приблизно 0,01, 0,013, 0,0167, 0,02, 0,025, 0,03, 0,05, 0,067, 0,1, 0,2). За іншим аспектом цей винахід пропонує глюкагонові пептиди, які демонструють активність на GLP-1- і GIP-рецепторах, але глюкагонова активність яких була значно понижена або ліквідована ("коагоністи GIP-рецептора/GLP-1-рецептора"), наприклад, модифікацією амінокислоти в положенні 3. Наприклад, заміна в цьому положенні на кислу, основну або гідрофобну амінокислоту (глутамінова кислота, орнітин, норлейцин) знижує глюкагонову активність. В деяких варіантах здійснення цього винаходу величина EC50 глюкагонового пептиду на GIP-рецепторі відрізняється в менше ніж приблизно 50 разів, 40 разів, 30 разів або 20 разів (у бік збільшення або бік зменшення) від величини його EC50 на GLP-1-рецепторі. В деяких варіантах здійснення цього винаходу GIP ефективність глюкагонового пептиду відрізняється в менше ніж приблизно 25 разів, 20 разів, 15 разів, 10 разів або 5 разів (у бік збільшення або бік зменшення) від його GLP-1 ефективності. В деяких варіантах здійснення цього винаходу ці глюкагонові пептиди мають приблизно 10% або менше активності нативного глюкагону на глюкагоновому рецепторі, наприклад, приблизно 1-10%, або приблизно 0,1-10%, або більш ніж приблизно 0,1%, але менш ніж приблизно 10%. В деяких варіантах здійснення цього винаходу відношення EC50 глюкагонового пептиду на GIP-рецепторі до EC50 глюкагонового пептиду на GLP-1-рецепторі становить менше ніж приблизно 100, 75, 60, 50, 40, 30, 20, 15, 10 або 5 і не менше ніж 1. В деяких варіантах здійснення цього винаходу відношення GIP ефективності глюкагонового пептиду в порівнянні з GLP-1 ефективністю глюкагонового пептиду становить менше ніж приблизно 100, 75, 60, 50, 40, 30, 20, 15, 10 або 5 і не менше ніж 1. 7 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 За ще одним аспектом цей винахід пропонує глюкагонові пептиди, які демонструють активність на GIP-рецепторі, але в яких активність на глюкагоновому рецепторі і GLP-1рецепторі була значно понижена або ліквідована ("глюкагонові пептиди-агоністи GIPрецептора"), наприклад, модифікаціями амінокислот в положеннях 3 та 7. В деяких варіантах здійснення цього винаходу ці глюкагонові пептиди мають приблизно 10% або менше активності нативного глюкагону на глюкагоновому рецепторі, наприклад, приблизно 1-10%, або приблизно 0,1-10%, або більш ніж приблизно 0,1%, 0,5% або 1%, але менш ніж приблизно 1%, 5% або 10%. В деяких варіантах здійснення цього винаходу ці глюкагонові пептиди мають також приблизно 10% або менше активності нативного GLP-1 на GLP-1-рецепторі, наприклад, приблизно 1-10%, або приблизно 0,1-10%, або більш ніж приблизно 0,1%, 0,5% або 1%, але менш ніж приблизно 1%, 5% або 10%. В деяких варіантах здійснення цього винаходу аналог глюкагону (послідовність SEQ ID NO: 1), який має активність агоніста GIP, містить послідовність SEQ ID NO: 1 з (a) модифікацією амінокислоти в положенні 1, яка надає активність агоніста GIP, (b) модифікацією, яка стабілізує альфа-спіральну структуру C-кінцевої ділянки (амінокислоти 12-29) аналога, і (c) факультативно з 1-10 (наприклад, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10) іншими модифікаціями амінокислот. У деяких варіантах здійснення цього винаходу аналог демонструє щонайменше приблизно 1% активності нативного GIP на GIP-рецепторі або будь-який інший рівень активності на GIP-рецепторі, описаний в цій заявці. Згаданою модифікацією, яка стабілізує альфа-спіральну структуру, може бути будь-яка з модифікацій, відомих в цій галузі, наприклад, будь-яка з модифікацій, опис якої наведений в цій заявці. Див. опис в розділі "Стабілізація альфа-спіральної структури". В деяких варіантах здійснення цього винаходу модифікацією, яка стабілізує альфа-спіральну структуру, є модифікація, вибрана з групи, яку складають: (i) лактамовий місток між бічними ланцюгами амінокислот в положеннях i та i+4 або між бічними ланцюгами амінокислот в положеннях j та j+3, де i – 12, 13, 16, 17, 20 або 24, та де j – 17, та (ii) одна, дві, три або всі амінокислоти в положеннях 16, 20, 21 та 24 аналога замінені α,α-дизаміщеною амінокислотою. Такі аналоги глюкагону, які мають активність агоніста GIP, також описані в цій заявці. В деяких варіантах здійснення цей винахід пропонує аналог глюкагону (послідовність SEQ ID NO: 1): який має активність агоніста GIP, з такими модифікаціями: (a) модифікація амінокислоти в положенні 1, (b) (i) лактамовий місток між бічними ланцюгами амінокислот в положеннях i та i+4 або між бічними ланцюгами амінокислот в положеннях j та j+3, де i – 12, 13, 16, 17, 20 або 24, і де j – 17, або (ii) заміна амінокислоти α,α-дизаміщеною амінокислотою в одному, двох, трьох або всіх положеннях 16, 20, 21 або 24, (c) модифікації амінокислот в одному, двох або всіх положеннях 27, 28 та 29, і (d) 1, 2, 3, 4, 5, 6 або 8 інших модифікацій амінокислот, де величина EC50 аналога для активації GIP-рецептора становить приблизно 100 нМ або менше. В ілюстративних варіантах здійснення цього винаходу (a) модифікація амінокислоти в положенні 1 є заміною His в положенні 1 великою ароматичною амінокислотою, факультативно Tyr, Phe, Trp, аміно-Phe, нітро-Phe, хлоро-Phe, сульфо-Phe, 4-піридил-Ala, метил-Tyr або 3-аміно-Tyr, (b) (i) лактамовий місток розташований між амінокислотами в положеннях 16 та 20, де одна з амінокислот в положеннях 16 та 20 замінена на Glu, а інша з амінокислот в положеннях 16 та 20 замінена на Lys, або (ii) α,α-дизаміщеною амінокислотою є AIB, (c) Met в положенні 27 замінений на велику аліфатичну амінокислоту, факультативно Leu, (d) Asn в положенні 28 замінений на невелику аліфатичну амінокислоту, факультативно Ala, та (e) Thr в положенні 29 замінений на невелику аліфатичну амінокислоту, факультативно Gly. Аналог може містити інші модифікації, у тому числі без обмеження: (a) модифікацію амінокислоти в положенні 12, факультативно заміненої на Ile, (b) модифікації амінокислот в положеннях 17 та 18, факультативно замінених на Q в положенні 17 та на A в положенні 18, (c) додавання GPSSGAPPPS (послідовність SEQ ID NO: 95) до C-кінця, або будь-яку їх комбінацію. Згаданий аналог може, альтернативно або на додаток, містити інші модифікації, в тому числі без обмеження: (a) Ser в положенні 2, замінений на D-Ser, Ala, D-Ala, Gly, N-метил-Ser, AIB, Val або α-аміноN-масляну кислоту; (b) Tyr в положенні 10, замінений на Trp, Lys, Orn, Glu, Phe або Val; 8 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 (c) Зв'язок ацильної групи з Lys в положенні 10; (d) Lys в положенні 12, замінений на Arg; (e) Ser в положенні 16, замінений на Glu, Gln, гомоглутамінову кислоту, гомоцистеїнову кислоту, Thr, Gly або AIB; (f) Arg в положенні 17, замінений на Gln, Lys або Glu; (g) Arg в положенні 18, замінений на Ala, Ser, Thr або Gly; (h) Gln в положенні 20, замінений на Ala, Ser, Thr, Lys, цитрулін, Arg, Orn або AIB; (i) Asp в положенні 21, замінений на Glu, гомоглутамінову кислоту, гомоцистеїнову кислоту; (j) Val в положенні 23, замінений на Ile; (k) Gln в положенні 24, замінений на Asn, Ala, Ser, Thr, Glu, Lys або AIB; та (l) консервативну заміну в будь-якому з положень 2, 5, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 24, 27, 28 і 29, або будь-яку їх комбінацію. В деяких варіантах здійснення цього винаходу, у разі, коли глюкагоновий пептид не пегільований, величина EC50 аналога для активації GIP-рецептора становить приблизно 4 нМ, 2 нМ, 1 нМ або менше, або аналог має щонайменше приблизно 1%, 2%, 3%, 4% або 5% активності нативного GIP на GIP-рецепторі. У відповідних варіантах здійснення цього винаходу величина EC50 непегільованого аналога для активації GLP-1-рецептора становить приблизно 4 нМ, 2 нМ, 1 нМ або менше, або аналог має щонайменше приблизно 1%, 2%, 3%, 4% або 5% активності нативного GLP-1 на GLP-1-рецепторі. В інших відповідних варіантах здійснення цього винаходу величина EC50 непегільованого аналога для активації глюкагонового рецептора становить приблизно 4 нМ, 2 нМ, 1 нМ або менше, або аналог має щонайменше приблизно 5%, 10%, 15% або 20% активності нативного глюкагону на глюкагоновому рецепторі. В деяких варіантах здійснення цього винаходу непегільований аналог має менше ніж приблизно 1% активності нативного глюкагону на глюкагоновому рецепторі. В інших варіантах здійснення цього винаходу непегільований аналог має менше ніж приблизно 10%, 5% або 1% активності нативного GLP-1 на GLP-1-рецепторі. В деяких варіантах здійснення цього винаходу глюкагоновий пептид ковалентно зв'язаний з гідрофільним складником в будь-якому з амінокислотних положень 16, 17, 20, 21, 24 або 29, після положення 29 на доданій амінокислоті (наприклад, положення 30) в межах C-кінцевого подовжувального сегмента або на C-кінцевій амінокислоті. В інших варіантах здійснення цього винаходу цей гідрофільний складник ковалентно зв’язаний з Lys, Cys, Orn, гомоцистеїном або ацетилфенілаланіновим залишком в будь-якому із цих положень. До прикладів гідрофільних складників належать поліетиленгліколь (PEG), наприклад, з молекулярною масою від приблизно 1000 Да до приблизно 40000 Да або від приблизно 20000 Да до приблизно 40000 Да. У тих варіантах здійснення цього винаходу, в яких аналоги зв’язані з гідрофільними складниками, такими як PEG, відносні значення EC50 на одному або декількох рецепторах можуть бути більш високими, наприклад, приблизно в 10 разів більш високими, в порівнянні з аналогом з відсутнім гідрофільним складником. Наприклад, EC50 пегільованого аналога для активації GIP-рецептора становить приблизно 10 нМ або менше, або ж аналог має щонайменше приблизно 0,1%, 0,2%, 0,3%, 0,4% або 0,5% активності нативного GIP на GIP-рецепторі. У відповідних варіантах здійснення цього винаходу EC50 пегільованого аналога для активації GLP1-рецептора становить приблизно 10 нМ або менше, або ж аналог має щонайменше приблизно 0,1%, 0,2%, 0,3%, 0,4% або 0,5% активності нативного GLP-1 на GLP-1-рецепторі. У інших варіантах здійснення цього винаходу EC50 пегільованого аналога для активації глюкагонового рецептора становить приблизно 10 нМ або менше, або ж аналог має щонайменше приблизно 0,5%, 1%, 1,5% або 2% активності нативного глюкагону на глюкагоновому рецепторі. В деяких варіантах здійснення цього винаходу аналог має менш ніж приблизно 1% активності нативного глюкагону на глюкагоновому рецепторі. В інших варіантах здійснення цього винаходу аналог має менш ніж приблизно 10%, 5% або 1% активності нативного GLP-1 на GLP-1-рецепторі. Глюкагоновий пептид може бути частиною димера, тримера або мультимера вищого порядку, який містить щонайменше два, три або більше пептидів, зв'язаних лінкером, де щонайменше один або обоє пептиди є глюкагоновим пептидом. Згаданий димер може бути гомодимером або гетеродимером. В деяких варіантах здійснення цього винаходу лінкер вибраний з групи, яка включає біфункціональний тіоловий крос-лінкер і біфункціональний крослінкер аміну. В деяких варіантах здійснення цього винаходу згаданим лінкером є PEG, наприклад, 5 кДа PEG, 20 кДа PEG. В деяких варіантах здійснення цього винаходу згаданим лінкером є дисульфідний зв'язок. Наприклад, кожен мономер димера може містити Cys залишок (наприклад, кінцевий Cys або Cys, що займає внутрішнє положення), і атом сірки кожного Cys залишку бере участь в утворенні дисульфідного зв'язку. За деякими аспектами цього винаходу 9 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 мономери з'єднуються кінцевими амінокислотами (наприклад, N-кінцевими або C-кінцевими), внутрішніми амінокислотами або кінцевою амінокислотою щонайменше одного мономера і внутрішньою амінокислотою щонайменше одного іншого мономера. За конкретними аспектами цього винаходу мономери не з'єднуються N-кінцевою амінокислотою. За деякими аспектами цього винаходу мономери мультимера з'єднуються між собою з орієнтацією "хвіст до хвоста", при якій між собою з'єднуються C-кінцеві амінокислоти кожного мономера. Кон'югатний складник може бути ковалентно зв’язаний з будь-яким із глюкагонових пептидів, опис яких наведений в цій заявці, включаючи димер, тример або мультимер вищого порядку. Будь-яка з модифікацій, опис якої наведений в цій заявці, яка підвищує активність глюкагонового рецептора, частково зберігає активність глюкагонового рецептора, покращує розчинність, підвищує стабільність або знижує деградацію, може застосовуватися до глюкагонових пептидів в індивідуальному порядку або в комбінації. В деяких варіантах здійснення цього винаходу глюкагонові пептиди є розчинними з концентрацією щонайменше 1 мг/мл при величині рН від 6 до 8, або від 6 до 9, або від 7 до 9 (наприклад, рН 7), і факультативно зберігають щонайменше 95% вихідного пептиду (наприклад, 5% або менше вихідного пептиду деградують або розщеплюються) через 24 год при температурі 25C. Запропоновані стерильні фармацевтичні композиції, які містять фармацевтично прийнятний носій або розчинник, і набори, які включають в себе відповідні пристрої. Запропоновані способи зменшення приросту або стимулювання зменшення маси тіла, які включають введення в організм пацієнта, який потребує цього, таких фармацевтичних композицій в кількості, ефективній для зменшення приросту або стимулювання зменшення маси тіла. Запропоновані способи лікування діабету, які включають введення пацієнту, який потребує цього, таких фармацевтичних композицій в кількості, ефективній для зниження рівнів глюкози в крові. Всі терапевтичні способи, фармацевтичні композиції, набори і інші подібні варіанти здійснення цього винаходу, описані в цій заявці, передбачають, що вживання термінів "пептиди", "агоністи", "коагоністи", "триагоністи" або "аналоги" охоплює всі їхні фармацевтично прийнятні солі або складні ефіри. Наведений вище короткий виклад суті винаходу не призначений для визначення кожного аспекту цього винаходу, і подальші варіанти здійснення цього винаходу описані в інших розділах, наприклад, в розділі "Детальний опис". Документ в цілому призначений для розгляду як комплексний опис, і слід мати на увазі, що можуть бути передбачені всі можливі комбінації відмітних особливостей, описаних в цій заявці, навіть якщо комбінація відмітних особливостей не знаходиться разом в одному і тому самому реченні, параграфі або розділі цього документа. Більш того, цей винахід охоплює будь-який з або всі варіанти здійснення цього винаходу, які мають більш вузький в якому-небудь відношенні обсяг в порівнянні з варіантами, які визначені конкретними фрагментами тексту цієї заявки. Наприклад, якщо певні аспекти цього винаходу описані в родовому відношенні, слід мати на увазі, що кожен член роду, окремо, є варіантом здійснення цього винаходу і що комбінації двох або декількох членів роду є варіантами здійснення цього винаходу. Короткий опис фігур Фіг. 1 являє собою графік відсотка (%) зміни маси тіла мишей в залежності від часу (дні) після введення лише носія (світлі перевернуті трикутники), препарату химера 2 AIB2 Cys24 (40K PEG) (темні квадрати), антагоніста GIP, Pro3 Cys24 GIP-NH2 (1-42) 40K PEG (світлі ромби), агоніста GIP, AIB2 Cys24 GIP (1-42) 40K PEG (світлі трикутники з пунктирною лінією) або неспорідненого пептидного гормону (темні перевернуті трикутники). Фіг. 2 являє собою графік споживання корму (у грамах) мишами в залежності від часу після введення лише носія (світлі перевернуті трикутники), препарату химера 2 AIB2 Cys24 40K PEG (темні квадрати), антагоніста GIP, Pro3 Cys24 GIP-NH2 (1-42) 40K PEG (світлі ромби), агоніста GIP, AIB2 Cys24 GIP (1-42) 40K PEG (світлі трикутники з пунктирною лінією) або неспорідненого пептидного гормону (темні перевернуті трикутники). Фіг. 3 являє собою діаграму зміни рівнів глюкози в крові (мг/дл) у мишей на 7 день після введення лише носія (темний стовпчик), препарату химера 2 AIB2 Cys24 (40K PEG) (світлий стовпчик), антагоніста GIP, Pro3 Cys24 GIP-NH2 (1-42) 40K PEG (затушований стовпчик), агоніста GIP, AIB2 Cys24 GIP (1-42) 40K PEG (стовпчик з горизонтальним штрихуванням) або неспорідненого пептидного гормону (стовпчик з вертикальним штрихуванням). Фіг. 4 являє собою графік відсотка (%) зміни маси тіла мишей в залежності від часу (дні) після введення лише носія (світлі перевернуті трикутники), препарату химера 2 AIB2 (світлі ромби), препарату химера 2 AIB2 лактам (світлі трикутники), пептиду-триагоніста MT-170 (світлі квадрати), пептиду-коагоніста GIP/глюкагону MT-182 (темні ромби), пептиду-коагоніста GLP 10 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 1/GIP МТ-178 (затушовані трикутники з пунктирною лінією) або пептиду-коагоніста GIP/глюкагону (темні квадрати). Слід мати на увазі, що пегільований МТ-179 діє як триагоніст. Фіг. 5 являє собою графік відсотка (%) зміни маси тіла мишей в залежності від часу (дні) після введення лише носія (темні трикутники), агоніста GLP-1 Е 16 в дозі 10 нмоль/кг (темні перевернуті трикутники) або в дозі 35 нмоль/кг (світлі квадрати), пептиду-триагоніста МТ-170 в дозі 10 нмоль/кг (світлі перевернуті трикутники) або в дозі 35 нмоль/кг (темні ромби) чи пептидукоагоніста GLP-1/GIP МТ-178 в дозі 10 нмоль/кг (сірі перевернуті трикутники) або в дозі 35 нмоль/кг (сірі квадрати). Фіг. 6 являє собою діаграму зміни рівнів глюкози в крові (мг/дл) у мишей на 7 день після введення лише носія (темний стовпчик), агоніста GLP-1 Е 16 в дозі 10 нмоль/кг (світлий стовпчик) або в дозі 35 нмоль/кг (сірий стовпчик), пептиду-триагоніста МТ-170 в дозі 10 нмоль/кг (стовпчик із горизонтальним штрихуванням) або в дозі 35 нмоль/кг (стовпчик із вертикальним штрихуванням) чи пептиду-коагоніста GLP-1/GIP МТ-178 в дозі 10 нмоль/кг (стовпчик із діагональним штрихуванням справа наліво) або в дозі 35 нмоль/кг (стовпчик із діагональним штрихуванням зліва направо). Фіг. 7 являє собою графік рівнів глюкози в крові (мг/дл) в залежності від часу перед і після введення (введення в момент часу 0) глюкози мишам, яким ввели (в момент часу -60) контрольний носій, контрольний пептид-агоніст GLP-1, пегільований GIP-активний аналог глюкагону, що містить лактам (циклічний) ("mt-178"), або пегільований GIP-активний аналог глюкагону, що не містить лактаму (лінійний) ("mt-274"), в дозі 1 нмоль/кг/тиждень, 3 нмоль/кг/тиждень або 10 нмоль/кг/тиждень. З даних, наведених на цій фігурі, виключені дані щодо чотирьох мишей, оскільки у цих мишей спостерігалася агресивна поведінка і значне зменшення маси тіла. Фіг. 8 являє собою графік рівнів глюкози в крові (мг/дл) в залежності від часу перед і після введення (введення в момент часу 0) глюкози мишам, яким ввели (за 24 год до введення глюкози) контрольний носій, контрольний пептид-агоніст GLP-1, mt-178 або mt-274 в дозі 1 нмоль/кг/тиждень, 3 нмоль/кг/тиждень або 10 нмоль/кг/тиждень. З даних, наведених на цій фігурі, виключені дані щодо чотирьох мишей, оскільки у цих мишей спостерігалася агресивна поведінка і значне зменшення маси тіла. Фіг. 9 являє собою діаграму рівнів глюкози в крові (мг/дл) мишей через 0 днів або 7 днів після введення контрольного носія, контрольного пептиду-агоніста GLP-1, mt-178 або mt-274 в дозі 1 нмоль/кг/тиждень, 3 нмоль/кг/тиждень або 10 нмоль/кг/тиждень. З даних, наведених на цій фігурі, виключені дані щодо чотирьох мишей, оскільки у цих мишей спостерігалася агресивна поведінка і значне зменшення маси тіла. Фіг. 10 являє собою графік процентної зміни маси тіла мишей через 0 днів, 1 день, 3 дні, 5 днів і 7 днів після введення контрольного носія, контрольного пептиду-агоніста GLP-1, mt-178 або mt-274 в дозі 1 нмоль/кг/тиждень, 3 нмоль/кг/тиждень або 10 нмоль/кг/тиждень. З даних, наведених на цій фігурі, виключені дані щодо чотирьох мишей, оскільки у цих мишей спостерігалася агресивна поведінка і значне зменшення маси тіла. Фіг. 11 являє собою діаграму рівнів глюкози в крові (мг/дл) мишей через 0 днів або 7 днів після введення контрольного носія, контрольного пептиду-агоніста GLP-1, mt-178, mt-178(TE), mt-274 або mt-274(TE) в дозі 10 нмоль/кг/тиждень або 35 нмоль/кг/тиждень. "TE" означає PEGгрупу, приєднану до Cys в положенні 40. Фіг. 12 являє собою діаграму зміни рівнів глюкози в крові (мг/дл) мишей через 7 днів після введення контрольного носія, контрольного пептиду-агоніста GLP-1, mt-178, mt-178(TE), mt-274 або mt-274(TE) в дозі 10 нмоль/кг/тиждень або 35 нмоль/кг/тиждень. "TE" означає PEG-групу, приєднану до Cys в положенні 40. Фіг. 13 являє собою графік процентної зміни маси тіла мишей через 0 днів, 1 день, 3 дні, 5 днів, 7 днів і 10 днів після введення контрольного носія, контрольного пептиду-агоніста GLP-1, mt-178, mt-178(TE), mt-274 або mt-274(TE) в дозі 10 нмоль/кг/тиждень або 35 нмоль/кг/тиждень. "TE" означає PEG-групу, приєднану до Cys в положенні 40. Фіг. 14 являє собою діаграму процентної зміни маси тіла мишей через 7 днів після введення контрольного носія, контрольного пептиду-агоніста GLP-1, mt-178, mt-178(TE), mt-274 або mt274(TE) в дозі 10 нмоль/кг/тиждень або 35 нмоль/кг/тиждень. "TE" означає PEG-групу, приєднану до Cys в положенні 40. Фіг. 15 являє собою діаграму рівнів глюкози в крові (мг/дл) мишей через 0 днів або 7 днів після введення контрольного носія, контрольного пептиду-агоніста GLP-1, mt-178, mt-274, лінійного непегільованого неацильованого пептиду ("mt-311"), ацильованого С14 жирною кислотою лінійного пептиду ("mt-309"), ацильованого С16 жирною кислотою лінійного пептиду 11 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 ("mt-298") або ацильованого С18 жирною кислотою лінійного пептиду ("mt-310"), в дозі 10 нмоль/кг. Фіг. 16 являє собою графік процентної зміни маси тіла мишей через 0 днів, 1 день, 3 дні, 5 днів і 7 днів після введення контрольного носія, контрольного пептиду-агоніста GLP-1, mt-178, mt-274, mt-311, mt-309, mt-298 або mt-310 в дозі 10 нмоль/кг. Фіг. 17 являє собою діаграму процентної зміни маси тіла мишей через 7 днів після введення контрольного носія, контрольного пептиду-агоніста GLP-1, mt-178, mt-274, mt-311, mt-309, mt298 або mt-310 в дозі 10 нмоль/кг. Фіг. 18 являє собою діаграму зміни рівнів глюкози в крові (мг/дл) мишей через 0 днів і 7 днів після введення один раз на день протягом 7 днів контрольного носія, ліраглутиду (ацильований аналог GLP-1), ацильованого С14 жирною кислотою непегільованого лінійного пептиду ("mt260"), ацильованого С16 жирною кислотою непегільованого лінійного пептиду ("mt-261") або ацильованого С18 жирною кислотою непегільованого лінійного пептиду ("mt-262"), в дозі 25 нмоль/кг або 125 нмоль/кг. Фіг. 19 являє собою графік процентної зміни маси тіла мишей через 0 днів, 1 день, 3 дні, 5 днів і 7 днів після введення контрольного носія, ліраглутиду, mt-260, mt-261 або mt-262 в дозі 25 нмоль/кг або 125 нмоль/кг. Фіг. 20 являє собою діаграму процентної зміни маси тіла мишей через 7 днів після введення контрольного носія, ліраглутиду, mt-260, mt-261 або mt-262 в дозі 25 нмоль/кг або 125 нмоль/кг. Фіг. 21 являє собою графік зміни маси тіла (г) мишей через 0 днів, 1 день, 3 дні, 5 днів і 7 днів після першого введення контрольного носія, ліраглутиду (у дозі 30 нмоль/кг/доба) або mt261 (у дозі 0,3 нмоль/кг/доба, 1 нмоль/кг/доба, 3 нмоль/кг/доба, 10 нмоль/кг або 30 нмоль/кг/доба). Фіг. 22 являє собою діаграму жирової маси мишей через 7 днів після першого введення контрольного носія, ліраглутиду (у дозі 30 нмоль/кг/доба) або mt-261 (у дозі 0,3 нмоль/кг/доба, 1 нмоль/кг/доба, 3 нмоль/кг/доба, 10 нмоль/кг або 30 нмоль/кг/доба). Фіг. 23 являє собою діаграму рівнів глюкози в крові (мг/дл) мишей через 0 днів і 7 днів після першого введення контрольного носія, ліраглутиду (у дозі 30 нмоль/кг/доба) або mt-261 (у дозі 0,3 нмоль/кг/доба, 1 нмоль/кг/доба, 3 нмоль/кг/доба, 10 нмоль/кг або 30 нмоль/кг/доба). Фіг. 24 являє собою лінійний графік зміни маси тіла (% зміна) в залежності від часу у мишей, яким був введений mt-263, екзендин-4 або контрольний носій в дозах (нмоль/кг/доба), вказаних в круглих дужках. Фіг. 25 являє собою стовпчикову діаграму загальної зміни маси тіла (%) (визначеної на 7 день, в порівнянні з 0 днем) у мишей, яким був введений mt-263, екзендин-4 або контрольний носій в дозах (нмоль/кг/доба), вказаних в круглих дужках. Фіг. 26 являє собою стовпчикову діаграму зміни рівнів глюкози в крові (мг/дл) (визначеної на 7 день, в порівнянні з 0 днем) у мишей, яким був введений mt-263, екзендин-4 або контрольний носій в дозах (нмоль/кг/доба), вказанихв круглих дужках. Фіг. 27 являє собою графік зміни маси тіла (%) мишей через 0 днів, 1 день, 3 дні, 5 днів і 7 днів після першого введення контрольного носія, ліраглутиду, mt-277, mt-278 або mt-279. Фіг. 28 являє собою діаграму рівнів глюкози в крові (мг/дл) мишей через 0 днів і 7 днів після першого введення контрольного носія, ліраглутиду, mt-277, mt-278 або mt-279. Фіг. 29 являє собою діаграму загальної зміни маси тіла (%) мишей через 7 днів після введення mt-331, mt-311 або контрольного носія. Дози (нмоль/кг) вказані в круглих дужках. Фіг. 30 являє собою діаграму загального споживання корму (г) мишами через 7 днів після введення mt-331, mt-311 або контрольного носія. Дози (нмоль/кг) вказані в круглих дужках. Фіг. 31 являє собою діаграму загальної зміни рівнів глюкози в крові мишей через 7 днів після введення mt-331, mt-311 або контрольного носія. Дози (нмоль/кг) вказані в круглих дужках. Фіг. 32 являє собою діаграму загальної зміни маси тіла мишей через 7 днів після введення mt-331, mt-353 або контрольного носія у вказаній дозі (нмоль/кг), представленій в круглих дужках. Фіг. 33 являє собою діаграму загального споживання корму (г) мишами через 7 днів після введення mt-331, mt-353 або контрольного носія у вказаній дозі (нмоль/кг), представленій в круглих дужках. Фіг. 34 являє собою діаграму зміни рівнів глюкози (мг/дл) в крові мишей через 7 днів після введення mt-331, mt-353 або контрольного носія у вказаній дозі (нмоль/кг), представленій в круглих дужках. Фіг. 35 являє собою діаграму загальної зміни маси тіла (%) мишей через 7 днів після першого введення mt-277, mt-278, mt-279 або контрольного носія. 12 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 Фіг. 36 являє собою діаграму загальної зміни маси тіла (%) мишей через 6 днів після першого введення mt-261, mt-309 або контрольного носія. Фіг. 37 являє собою діаграму рівнів глюкози (мг/дл) в крові мишей через 6 днів після першого введення mt-261, mt-309 або контрольного носія. Перший стовпчик кожної пари стовпчиків однакового забарвлення позначає рівні глюкози в крові на 0 день, а другий стовпчик кожної пари позначає рівні на 6 день. Фіг. 38 являє собою стовпчикову діаграму загальної зміни маси тіла (%) через 6 днів після першого введення mt-261 (порівняно з масою тіла, визначеною в перший день введення) у мишей, яким був введений контрольний носій або mt-261, як описано нижче в цій заявці. Детальний опис Визначення В описі і формулі винаходу буде вживатися термінологія, яка відповідає визначенням, наведеним нижче. Термін "приблизно", вживаний в цьому описі, означає, що значення або діапазон значень більше або менше вказаного на десять відсотків, проте він не призначений для обмеження будь-якого значення або діапазону значень лише цим ширшим визначенням. Кожне значення або діапазон значень, яким передує термін "приблизно", охоплюють також конкретно вказане абсолютне значення або діапазон значень. Термін "фармацевтично прийнятний носій", вживаний в цьому описі, охоплює будь-який зі звичайних фармацевтичних носіїв, таких як забуферений фосфатом сольовий розчин, вода, емульсії, такі як емульсія масла у воді або емульсія води в маслі, і зволожувальні засоби різних типів. Згаданий термін охоплює також будь-який з агентів, схвалених органом регулювання федерального уряду США або наведених в Фармакопеї США для застосування на тваринах, включаючи людей. Термін "фармацевтично прийнятна сіль", вживаний в цьому описі, означає солі сполук, які зберігають біологічну активність початкової сполуки і які не є небажаними ні в біологічному, ні в інших відношеннях. Багато які сполуки, розкриті в цьому описі, здатні утворювати кислі та/або основні солі завдяки присутності аміногруп та/або карбоксильних груп або груп, до них подібних. Фармацевтично прийнятні солі з основами можуть бути одержані з неорганічних і органічних основ. До солей, похідних неорганічних основ, належать (тільки як приклад) солі натрію, калію, літію, амонію, кальцію і магнію. До солей, похідних органічних основ, належать (але ними не обмежуються) солі первинних, вторинних і третинних амінів. Фармацевтично прийнятні солі з кислотами можуть бути одержані з неорганічних і органічних кислот. До солей, похідних неорганічних кислот, належать солі хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, азотної кислоти, фосфорної кислоти тощо. До солей, похідних органічних кислот, належать солі оцтової кислоти, пропіонової кислоти, гліколевої кислоти, піровіноградної кислоти, щавлевої кислоти, яблучної кислоти, малонової кислоти, бурштинової кислоти, малеїнової кислоти, фумарової кислоти, винної кислоти, лимонної кислоти, бензойної кислоти, коричної кислоти, мигдалевої кислоти, метансульфонової кислоти, етансульфонової кислоти, п-толуолсульфонової кислоти, саліцилової кислоти тощо. Термін "лікування", вживаний в цьому описі, охоплює профілактику певного розладу або стану або полегшення важкості симптомів, пов'язаних із певним розладом або станом, та/або запобігання або ліквідацію згаданих симптомів. Наприклад, термін "лікування діабету", вживаний в цьому описі, буде загалом відноситися до зміни рівня глюкози в крові в напрямі нормального рівня і може включати підвищення або зниження рівня глюкози в крові, в залежності від конкретної ситуації. Термін "ефективна" кількість або "терапевтично ефективна кількість" глюкагонового пептиду, вживане в цьому описі, означає нетоксичну, але достатню для забезпечення досягнення бажаного ефекту кількість пептиду. Наприклад, одним із бажаних ефектів було б запобігання або лікування гіпоглікемії, дієвість якого визначають, наприклад, за підвищенням рівня глюкози в крові. Альтернативним бажаним ефектом для аналогів коагоністів, розкритих в цьому описі, було б також лікування гіперглікемії, дієвість якого визначають, наприклад, за незначним відхиленням рівня глюкози в крові від нормального, або ініціювання зниження маси тіла/запобігання приросту маси тіла, дієвість яких визначають, наприклад, за зменшенням маси тіла, або запобігання чи зниження приросту маси тіла, або нормалізація розподілення жирового компонента тіла. Кількість, яка є "ефективною", буде відрізнятися від суб'єкта до суб'єкта в залежності від віку і загального стану індивіда, способу введення тощо. Таким чином, не завжди можливо визначити точну "ефективну кількість". Однак, відповідна "ефективна" кількість в будь 13 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 якому окремому випадку може бути визначена фахівцем в цій галузі із використанням загальноприйнятої практики експериментування. Термін "парентерально" означає введення не через травний тракт, а яким-небудь іншим шляхом, наприклад, підшкірним, внутрішньом'язовим, інтраспінальним або внутрішньовенним. Термін "очищений" і подібні терміни, вживані в цьому описі, стосуються виділення молекули або сполуки в формі, яка є по суті вільною від домішок, які, як правило, зв'язуються з молекулою або сполукою в нативному або природному оточенні. Термін "очищений", вживаний в цьому описі, не означає абсолютної чистоти; цей термін, швидше, вживається як відносне визначення. Словосполучення "очищений поліпептид" вживається тут для опису поліпептиду, який був відділений від інших сполук, в тому числі (але без обмеження) від молекул нуклеїнових кислот, ліпідів і вуглеводів. Термін "виділений" означає видалення еталонного матеріалу з його природного оточення (наприклад, природного оточення, якщо він зустрічається в природних умовах). Наприклад, полінуклеотид, який природно зустрічається, присутній в живій тварині, не є виділеним, але той самий полінуклеотид, відділений від певної частини або всіх співіснуючих в природній системі матеріалів, є виділеним. Термін "пептид", вживаний в цьому описі, означає послідовність з 3 або більше амінокислот, як правило, менше ніж 50 амінокислот, де згадані амінокислоти є природними або штучними амінокислотами. Штучні амінокислоти означають амінокислоти, які не зустрічаються in vivo в природних умовах, але які, проте, можуть бути включені в пептидні структури, опис яких наведений у цій заявці. Терміни "поліпептид" і "білок", вживані в цьому описі, являють собою терміни, які вживаються взаємозамінно для позначення полімеру амінокислот, незалежно від довжини згаданого полімеру. Довжина поліпептидних і білкових полімерів, як правило, перевищує довжину "пептидів". Словосполучення "глюкагоновий пептид", вживане в цьому описі, означає будь-який пептид, який містить амінокислотну послідовність SEQ ID NO: 1 або будь-який аналог амінокислотної послідовності SEQ ID NO: 1, включаючи заміни амінокислот, додання, делеції або посттрансляційні модифікації (наприклад, метилування, ацилування, алкілування, убіквітування, внутрішньомолекулярне ковалентне сполучання, таке як утворення лактамних містків, пегілування тощо) пептиду, де згаданий аналог стимулює активність глюкагонового рецептора, GLP-1-рецептора або GIP-рецептора, яка визначається, наприклад, за рівнем продукування цАМФ за допомогою аналізу, опис якого наведений в Прикладі 16. Словосполучення "агоніст глюкагону" означає комплексну сполуку, яка містить глюкагоновий пептид, який стимулює активність глюкагонового рецептора, яка визначається, наприклад, за рівнем продукування цАМФ за допомогою аналізу, опис якого наведений в Прикладі 16. Термін "модифікація" амінокислоти, вживаний в цьому описі, означає заміну, додання або делецію амінокислоти і охоплює заміну будь-якої з 20 амінокислот або додання будь-якої з 20 амінокислот, які звичайно входять до складу людських білків, а також атипових або штучних амінокислот. Всі посилання в описі на конкретні номери положень амінокислоти (наприклад, положення 28) відносяться до амінокислоти в цьому положенні в нативному глюкагоні (послідовність SEQ ID NO: 1) або до положення відповідної амінокислоти в будь-якому з його аналогів. Наприклад, посилання в описі на "положення 28" буде означати відповідне положення 27 для аналога глюкагону, в якому перша амінокислота послідовності SEQ ID NO: 1 була видалена. Подібним чином, посилання в описі на "положення 28" буде означати відповідне положення 29 для аналога глюкагону, у якого перед N-кінцем послідовності SEQ ID NO: 1 була додана одна амінокислота. До наявних на ринку джерел атипових амінокислот належать компанія Sigma-Aldrich (Milwaukee, штат Вісконсін), компанія ChemPep Inc. (Miami, штат Флоріда) і компанія Genzyme Pharmaceuticals (Cambridge, штат Массачусетс). Атипові амінокислоти можуть бути закуплені від комерційних постачальників, синтезовані de novo, хімічно модифіковані або одержані з інших амінокислот. Термін "нативний глюкагон", вживаний в цьому описі, означає пептид, який містить послідовність SEQ ID NO: 1, термін "нативний GIP" означає пептид, який містить послідовність SEQ ID NO: 4, і термін "нативний GLP-1" являє собою узагальнюючий термін, який означає GLP1(7-36) амід (який містить послідовність SEQ ID NO: 3), GLP-1(7-37) (кислу форму) (яка містить послідовність SEQ ID NO: 2) або суміш двох цих сполук. Загальне посилання в цьому описі на "глюкагон", "GIP" або "GLP-1", за відсутності будь-яких додаткових визначень, означає нативний глюкагон, нативний GIP або нативний GLP-1, відповідно. Термін "заміна амінокислоти", вживаний в цьому описі, означає заміну одного залишку амінокислоти іншим залишком амінокислоти. 14 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 Словосполучення "консервативна заміна амінокислоти", вживане в цьому описі, визначається як заміна в межах однієї з п'яти наведених нижче груп: I. Невеликі аліфатичні, неполярні або трохи полярні залишки: Ala, Ser, Thr, Pro, Gly; II. Полярні, негативно заряджені залишки і їхні аміди і складні ефіри: Asp, Asn, Glu, Gln, цистеїнова кислота і гомоцистеїнова кислота; III. Полярні, позитивно заряджені залишки: His, Arg, Lys; орнітин (Orn); IV. Великі аліфатичні, неполярні залишки: Met, Leu, Ile, Val, Cys, норлейцин (Nle), гомоцистеїн; V. Великі ароматичні залишки: Phe, Tyr, Trp, ацетилфенілаланін. Узагальнююче словосполучення "поліетиленгліколевий ланцюг" або "PEG ланцюг", вживане в цьому описі, означає суміші конденсаційних полімерів етиленоксиду і води, у вигляді розгалуженого або нерозгалуженого ланцюга, представленого загальною формулою H(OCH2CH2)nOH, де n дорівнює щонайменше 9. При відсутності будь-яких додаткових визначень, згадане словосполучення означає полімери етиленгліколю з усередненим значенням молекулярної маси, вибраним в межах від 500 Да до 40000 Да. Словосполучення "поліетиленгліколевий ланцюг" або "PEG ланцюг" вживається в поєднанні з числовим індексом для позначення його приблизної середньої молекулярної маси. Наприклад, PEG-5000 означає поліетиленгліколевий ланцюг, який має усереднене значення молекулярної маси приблизно 5000 Да. Термін "пегільований" і подібні терміни, вживані в цьому описі, стосуються сполуки, яка була модифікована в порівнянні з її нативним станом шляхом приєднання до згаданої сполуки поліетиленгліколевого ланцюга. "Пегільований глюкагоновий пептид" являє собою глюкагоновий пептид, який має поліетиленгліколевий ланцюг, ковалентно приєднаний до згаданого глюкагонового пептиду. Термін пептид, який вживається в цьому описі, охоплює пептиди, які мають модифіковані аміно- і карбоксильні кінці. Наприклад, амінокислотний ланцюг, який містить амідну групу замість кінцевої карбоксильної групи, визначається амінокислотною послідовністю, яка складається зі стандартних амінокислот. Термін "лінкер", вживаний в цьому описі, означає зв'язок, молекулу або групу молекул, яка сполучає два окремі складники один з одним. Лінкери можуть визначати оптимальне просторове розміщення двох складників або ж можуть додатково забезпечувати лабільний зв'язок, який уможливлює взаємне розділення двох складників. До лабільних зв'язків належать фоторозщеплювані групи, нестійкі до впливу кислот групи, нестійкі до впливу основ групи і розщеплювані ферментами групи. Термін "димер", вживаний в цьому описі, означає комплексну сполуку, яка включає дві субодиниці, ковалентно приєднані одна до іншої за допомогою лінкера. Термін "димер", у разі його вживання без яких-небудь визначень, означає як гомодимери, так і гетеродимери. Гомодимер містить дві ідентичні субодиниці, в той час як гетеродимер містить дві субодиниці, які розрізнюються, незважаючи на те, що дві згадані субодиниці є по суті подібними одна до іншої. Словосполучення "заряджена амінокислота", вживане в цьому описі, означає амінокислоту, яка містить бічний ланцюг, негативно заряджений (тобто депротонований) або позитивно заряджений (тобто протонований), у водному розчині при фізіологічному рН. Наприклад, до негативно заряджених амінокислот належать аспарагінова кислота, глутамінова кислота, цистеїнова кислота, гомоцистеїнова кислота і гомоглутамінова кислота, в той час як до позитивно заряджених амінокислот належать аргінін, лізин і гістидин. До заряджених амінокислот належать заряджені амінокислоти з-посеред 20 амінокислот, які звичайно виявляються в людських білках, а також атипові або штучні амінокислоти. Словосполучення "кисла амінокислота", вживане в цьому описі, означає амінокислоту, яка містить другий кислий складник, включаючи, наприклад, карбоксильну або сульфокислотну групи. Вживаний в цьому описі термін "селективність" молекули до першого рецептора відносно другого рецептора означає відношення EC50 молекули на другому рецепторі до EC50 молекули на першому рецепторі. Наприклад, молекула, яка має на першому рецепторі EC50, що дорівнює 1 нм, і на другому рецепторі EC50, що дорівнює 100 нМ, має в 100 разів більшу селективність відносно першого рецептора в порівнянні з другим рецептором. 15 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 Словосполучення "глюкагонова ефективність" молекули, вживане в цьому описі, означає відношення EC50 молекули на глюкагоновому рецепторі до EC50 нативного глюкагону на глюкагоновому рецепторі. Словосполучення "GIP ефективність" молекули, вживане в цьому описі, означає відношення EC50 молекули на GIP-рецепторі до EC50 нативного GIP на GIP-рецепторі. Словосполучення "GLP-1 ефективність" молекули, вживане в цьому описі, означає відношення EC50 молекули на GLP-1-рецепторі до EC50 нативного GLP-1 на GLP-1-рецепторі. Термін "алкіл", вживаний в цьому описі, означає лінійний або розгалужений вуглеводень, який містить конкретно вказану кількість атомів вуглецю. До прикладів алкілів належить метил, етил і лінійні пропілові групи. Термін "гетероалкіл", вживаний в цьому описі, означає лінійний або розгалужений вуглеводень, який містить конкретно вказану кількість атомів вуглецю і щонайменше один гетероатом в каркасі структури. До прийнятних для цілей цього опису гетероатомів належать (але без обмеження ними) N, S і O. Термін "циклоалкіл", вживаний в цьому описі, означає циклічну вуглеводневу групу, яка містить конкретно вказану кількість атомів вуглецю, наприклад, циклопропіл, циклобутил, циклогексил і циклопентил. Термін "гетероцикл", вживаний в цьому описі, означає циклічну вуглеводневу групу, яка містить конкретно вказану кількість атомів вуглецю і від одного гетероатому до трьох гетероатомів, незалежно один від одного вибраних з групи, яку складають кисень, азот і сірка. Необмежувальними варіантами гетероциклоалкільних груп є піперидин, тетрагідрофуран, тетрагідропіран, дигідрофуран, морфолін, тіофен тощо. Термін "арил", вживаний в цьому описі, означає моноциклічну або поліциклічну ароматичну групу, за варіантом, якому віддається перевага, моноциклічну або біциклічну ароматичну групу, наприклад, феніл або нафтил, що містить конкретно вказану кількість атомів вуглецю. Якщо не вказане інше, арильна група може бути незаміщеною або заміщеною. Термін "гетероарил", вживаний в цьому описі, означає моноциклічну або поліциклічну ароматичну групу, яка містить конкретно вказану кількість атомів вуглецю і щонайменше один гетероатом, вибраний з групи, яку складають кисень, азот і сірка. Якщо не вказане інше, арильна група може бути незаміщеною або заміщеною. Варіанти здійснення Модифікації, розкриті в цьому описі, дозволяють здійснювати маніпуляції глюкагоном (послідовність SEQ ID NO: 1) для одержання глюкагонових пептидів, які демонструють підвищену активність на GIP-рецепторі, на глюкагоновому рецепторі та/або на GLP-1-рецепторі. Інші модифікації, розкриті в цьому описі, збільшують напівперіод існування в плазмі крові, підвищують розчинність або підвищують стабільність отриманого пептиду. Певні модифікації, розкриті в цьому описі, не впливають на активність або можуть бути одержані без ліквідування необхідної активності або активностей. Будь-яка з комбінацій, яку застосовують для однієї мети (наприклад, для підвищення активності на GIP-рецепторі), може застосовуватися в індивідуальному порядку або в комбінації. Будь-яка з одиночних комбінацій або наборів комбінацій, яка забезпечує набуття покращених (посилених) властивостей, може застосовуватися в індивідуальному порядку або в комбінації, наприклад, підвищення активності на GIP-рецепторі та/або GLP-1-рецепторі може комбінуватися зі збільшенням напівперіоду існування в плазмі крові. В певних варіантах здійснення цього винаходу глюкагоновий пептид може містити в загальній кількості від 1 до 2, до 3, до 4, до 5, до 6, до 7, до 8, до 9 або до 10 модифікацій амінокислот в порівнянні з послідовністю нативного глюкагону. В деяких варіантах здійснення цього винаходу такі глюкагонові пептиди зберігають щонайменше 22, 23, 24, 25, 26, 27 або 28 природних амінокислот у відповідних положеннях в нативному глюкагоні (наприклад, мають 1-7, 1-5 або 1-3 модифікації в порівнянні з природним глюкагоном). У відповідних варіантах здійснення цього винаходу 1, 2, 3, 4, 5, 6 або більше модифікацій амінокислот можуть бути неконсервативними замінами, доданнями або делеціями. В деяких варіантах здійснення цього винаходу 1, 2, 3, 4, 5, 6 або більше модифікацій амінокислот можуть бути консервативними замінами. В деяких варіантах здійснення цього винаходу 1, 2, 3, 4 або 5 неконсервативних замін виконують в будь-якому з положень 2, 5, 7, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 або 29, і, крім того, до 5 консервативних замін виконують в будь-якому з цих положень. В деяких варіантах здійснення цього винаходу 1, 2 або 3 модифікації амінокислот виконують в межах амінокислот в положеннях 1-16, та 1, 2 або 3 модифікації амінокислот виконують в межах амінокислот в положеннях 17-26. Модифікації, які впливають на активність на GIP-рецепторі 16 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 Посилена активність на GIP-рецепторі забезпечується модифікацією амінокислоти в положенні 1. Наприклад, His в положенні 1 замінюють великою ароматичною амінокислотою, факультативно Tyr, Phe, Trp, аміно-Phe, нітро-Phe, хлоро-Phe, сульфо-Phe, 4-піридил-Ala, метил-Tyr або 3-аміно-Tyr. Несподівано комбінація Tyr в положенні 1 зі стабілізацією альфаспіралі в межах ділянки, яка відповідає амінокислотам 12-29, забезпечила одержання глюкагонового пептиду, який активує GIP-рецептор, а також GLP-1-рецептор і глюкагоновий рецептор. Альфа-спіральна структура може бути стабілізована, наприклад, утворенням ковалентного або нековалентного внутрішньомолекулярного містка або заміною та/або вставкою амінокислот поблизу положень 12-29, наприклад, амінокислоти, яка стабілізує альфаспіраль (наприклад α,α-дизаміщеної амінокислоти). Посилена активність на GIP-рецепторі забезпечується також модифікаціями амінокислот в положеннях 27 та/або 28 і факультативно в положенні 29. Наприклад, Met в положенні 27 замінюють великою аліфатичною амінокислотою, факультативно Leu, Asn в положенні 28 замінюють невеликою аліфатичною амінокислотою, факультативно Ala, і Thr в положенні 29 замінюють невеликою аліфатичною амінокислотою, факультативно Gly. Заміна на LAG в положеннях 27-29 забезпечує посилену активність на GIP-рецепторі в порівнянні з нативною послідовністю MNT в цих положеннях. Посилена активність на GIP-рецепторі забезпечується також модифікацією амінокислоти в положенні 12. Наприклад, амінокислоту в положенні 12 замінюють великою аліфатичною неполярною амінокислотою, факультативно Ile. Посилена активність на GIP-рецепторі забезпечується також модифікацією амінокислоти в положеннях 17 та/або 18. Наприклад, амінокислоту в положенн 17 замінюють полярним залишком, факультативно Gln, а амінокислоту в положенні 18 замінюють невеликою аліфатичною амінокислотою, факультативно Ala. Заміна на QA в положеннях 17 і 18 забезпечує підвищену активність на GIP-рецепторі в порівнянні з нативною послідовністю RR в цих положеннях. Будь-яка з вищеописаних модифікацій, яка посилює активність на GIP-рецепторі, може застосовуватися в індивідуальному порядку або в комбінації. Комбінації модифікацій, які посилюють активність на GIP-рецепторі, як правило, забезпечують більш високу активність на GIP-рецепторі, ніж будь-яка з таких модифікацій окремо. Модифікації, що впливають на активність на глюкагоновому рецепторі В деяких варіантах здійснення цього винаходу запропоновані аналоги глюкагону, які мають підвищену ефективність і факультативно підвищену розчинність і стабільність. В одному з варіантів здійснення цього винаходу підвищену глюкагонову ефективність забезпечують модифікацією амінокислоти в положенні 16 нативного глюкагону (послідовність SEQ ID NO: 1). Як необмежувальний приклад така підвищена ефективність може бути забезпечена заміною природного серину в положенні 16 глутаміновою кислотою або іншою негативно зарядженою амінокислотою, яка має бічний ланцюг завдовжки в 4 атоми, або альтернативно будь-якою амінокислотою з групи, яку складають глутамін, гомоглутамінова кислота та гомоцистеїнова кислота, або зарядженою амінокислотою, яка має бічний ланцюг, який містить щонайменше один гетероатом (наприклад, N, O, S, P), де довжина згаданого бічного ланцюга становить приблизно 4 (або 3-5) атоми (атомів). В деяких варіантах здійснення цього винаходу глюкагоновий пептид зберігає свою вихідну селективність відносно глюкагонового рецептора в порівнянні з GLP-1-рецепторами. Активність на глюкагоновому рецепторі може бути понижена модифікацією амінокислоти в положенні 3, наприклад, заміною природного глутаміну в положенні 3 кислою, основною або гідрофобною амінокислотою. Наприклад, заміна амінокислоти в положенні 3 глутаміновою кислотою, орнітином або норлейцином істотно знижує або ліквідовує активність на глюкагоновому рецепторі. Підтримувана на відповідному рівні або підвищена активність на глюкагоновому рецепторі може забезпечуватися шляхом модифікування Gln в положенні 3 аналогом глутаміну. Наприклад, глюкагоновий пептид, який містить аналог глутаміну в положенні 3, може демонструвати приблизно 5%, приблизно 10%, приблизно 20%, приблизно 50%, приблизно 85% або більшу активність нативного глюкагону (послідовність SEQ ID NO: 1) на глюкагоновому рецепторі. В деяких варіантах здійснення цього винаходу глюкагоновий пептид, який містить аналог глутаміну в положенні 3, може демонструвати приблизно 20%, приблизно 50%, приблизно 75%, приблизно 100%, приблизно 200%, приблизно 500% або більшу активність відповідного глюкагонового пептиду, який має таку саму амінокислотну послідовність, що і пептид, містить аналог глутаміну, за виключенням модифікованої амінокислоти в положенні 3 (наприклад, послідовність SEQ ID NO: 250 або послідовність SEQ ID NO: 251) на глюкагоновому 17 UA 104000 C2 5 рецепторі. В деяких варіантах здійснення цього винаходу глюкагоновий пептид, який містить аналог глутаміну в положенні 3, демонструє підвищену активність на глюкагоновому рецепторі, проте згадана підвищена активність становить не більше ніж 1000%, 10000%, 100000% або 1000000% активності нативного глюкагону або відповідного глюкагонового пептиду, який має таку саму амінокислотну послідовність, що і пептид, який містить аналог глутаміну, за виключенням модифікованої амінокислоти в положенні 3. В деяких варіантах здійснення цього винаходу аналог глутаміну є природною або штучною амінокислотою, яка містить бічний ланцюг Структури I, Структури II або Структури III: , 10 Структура I , Структура II 15 20 25 30 35 40 45 50 , Структура III 1 2 4 3 4 де R – C0-C3-алкіл або C0-C3-гетероалкіл; R – NHR або C1-C3-алкіл; R – C1-C3-алкіл; R – H 4 3 3 або C1-C3-алкіл; X – NH, O або S; і Y – NHR , SR або OR . В деяких варіантах здійснення цього 4 1 винаходу X – NH або Y – NHR . В деяких варіантах здійснення цього винаходу R – C0-C2-алкіл 2 4 або C1-гетероалкіл. В деяких варіантах здійснення цього винаходу R – NHR або C1-алкіл. В 4 деяких варіантах здійснення цього винаходу R – H або C1-алкіл. В деяких варіантах здійснення 1 цього винаходу запропонована амінокислота, яка містить бічний ланцюг Структури I, де R – 2 1 2 CH2-S, X – NH і R – CH3 (ацетамідометилцистеїн, C(Acm)); R – CH2, X – NH і R – CH3 1 2 4 4 (ацетилдіамінобутанова кислота, Dab(Ac)); R – C0-алкіл, X – NH, R – NHR і R – H 1 2 (карбамоїлдіамінопропанова кислота, Dap(сечовина)); або R – CH2-CH2, X – NH і R – CH3 (ацетилорнітин, Orn(Ac)). В певних варіантах здійснення цього винаходу запропонована 1 4 4 амінокислота, яка містить бічний ланцюг Структури II, де R – CH2, Y – NHR і R – CH3 (метилглутамін, Q(Me)); в певних варіантах здійснення цього винаходу запропонована 1 4 амінокислота, яка містить бічний ланцюг Структури III, де R – CH2 і R – H (метіонінсульфоксид, M(O)); в конкретних варіантах здійснення цього винаходу амінокислоту в положенні 3 замінюють на Dab(Ac). Наприклад, агоністи глюкагону можуть містити амінокислотну послідовність, представлену будь-якою послідовністю SEQ ID NO: 243-248, 250, 251 і 253-256. Модифікації, які впливають на активність на GLP-1-рецепторі Підвищена активність на GLP-1-рецепторі забезпечується заміною карбонової кислоти Cкінцевої амінокислоти групою з нейтральним зарядом, такою як амідна або складноефірна. Підвищена активність на GLP-1-рецепторі забезпечується також шляхом стабілізації альфаспіральної структури на C-кінцевій ділянці глюкагону (поблизу амінокислот 12-29), наприклад, шляхом утворення внутрішньомолекулярного містка між бічними ланцюгами двох амінокислот або шляхом заміни та/або вставки амінокислот поблизу положень 12-29, наприклад, амінокислоти, яка стабілізує альфа-спіраль (наприклад α,α-дизаміщеної амінокислоти). Бічні ланцюги цих амінокислот можуть зв'язуватися між собою водневими зв'язками або іонними взаємодіями, такими як утворення сольових містків, або ковалентними зв'язками. В деяких варіантах здійснення цього винаходу згаданий місток утворюється між амінокислотами, відокремленими трьома розташованими між ними амінокислотами, тобто амінокислотою в положенні "i" та амінокислотою в положенні "i+4", де i є будь-яким цілим числом від 12 до 25 (наприклад, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 або 25). В певних варіантах здійснення цього винаходу бічні ланцюги амінокислотних пар 12 та 16, 13 та 17, 16 та 20, 17 та 21, 20 та 24 або 24 та 28 (амінокислотні пари, в яких i=12, 16, 20 або 24) утворюють зв'язок між собою і, тим самим, стабілізують альфа-спіраль глюкагону. В інших варіантах здійснення цього винаходу згаданий місток утворюється між амінокислотами, відокремленими двома розташованими між ними амінокислотами, тобто амінокислотою в положенні "j" та амінокислотою в положенні "j+3", де j є будь-яким цілим числом від 12 до 26 (наприклад, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 або 26). В певних варіантах здійснення цього винаходу j=17. В інших варіантах здійснення цього винаходу згаданий місток утворюється між амінокислотами, відокремленими шістьма розташованими між ними амінокислотами, тобто амінокислотою в положенні "k" та амінокислотою в положенні "k+7", 18 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 де k є будь-яким цілим числом від 12 до 22 (наприклад, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 або 22). В одному з варіантів здійснення цього винаходу k=17. В деяких варіантах здійснення цього винаходу довжина згаданого містка або лінкера становить приблизно 8 (або приблизно 7-9) атомів, зокрема, у разі, коли місток розташований між положеннями i та i+4. В деяких варіантах здійснення цього винаходу довжина згаданого містка або лінкера становить приблизно 6 (або приблизно 5-7) атомів, зокрема, у разі, коли місток розташований між положеннями j та j+3. В деяких варіантах здійснення цього винаходу внутрішньомолекулярні містки утворюються шляхом (а) заміни природного серину в положенні 16 глутаміновою кислотою або іншою негативно зарядженою амінокислотою, яка має бічний ланцюг завдовжки 4 атоми, або альтернативно будь-якою амінокислотою з групи, яку складають глутамін, гомоглутамінова кислота та гомоцистеїнова кислота, або зарядженою амінокислотою, яка має бічний ланцюг, який містить щонайменше один гетероатом (наприклад, N, O, S, P), довжина якого становить приблизно 4 (або 3-5) атоми (атомів), і (b) заміни природного глутаміну в положенні 20 іншою гідрофільною амінокислотою, яка має бічний ланцюг, який або заряджений, або може утворювати водневий зв’язок і має в довжину щонайменше 5 (або приблизно 4-6) атомів, наприклад, лізином, цитруліном, аргініном або орнітином. Бічні ланцюги таких амінокислот в положеннях 16 та 20 можуть утворювати сольовий місток або можуть утворювати ковалентний зв’язок. В одному з варіантів здійснення цього винаходу дві амінокислоти зв'язані між собою з утворенням лактамового циклу. Величина згаданого лактамового циклу може змінюватися залежно від довжини бічних ланцюгів амінокислот, і в одному з варіантів здійснення цього винаходу лактам утворюється шляхом з'єднання бічних ланцюгів амінокислоти – лізину – з бічним ланцюгом глутамінової кислоти. Порядок амідного зв'язку в лактамовому циклі може бути обернений (наприклад, лактамовий цикл може бути утворений між бічними ланцюгами Lis12 і Glu16 або альтернативно між Glu12 і Lys16). В деяких варіантах здійснення цього винаходу стабілізація альфа-спіральної структури Cкінцевої частини глюкагонового пептиду забезпечується шляхом утворення внутрішньомолекулярного містка, який відрізняється від лактамового містка. Наприклад, для стабілізації альфа-спіралі застосовуються прийнятні способи утворення ковалентного зв’язку, які включають будь-який один або декілька способів із групи, яку складають олефіновий метатезис, циклізація на основі лантіоніну, утворення дисульфідного містка або модифікованого сіркавмісного містка, застосування α,ω-діаміноалканових зв'язків, утворення місткових зв'язків між атомами металу і інші способи пептидної циклізації. Ефективність на GLP-1-рецепторі може бути також збільшена шляхомзаміни нативного аргініну в положенні 18 аланіном. Будь-яка з вищеописаних модифікацій, яка посилює активність на GLP-1-рецепторі, може застосовуватися в індивідуальному порядку або в комбінації. Комбінації модифікацій, які посилюють активність на GLP-1-рецепторі, як правило, забезпечують вищу активність на GLP-1рецепторі, ніж будь-яка з таких модифікацій окремо. Наприклад, цей винахід пропонує глюкагонові пептиди, які містять модифікації в положенні 16, в положенні 20 і в C-кінцевій карбоксильній групі, факультативно з ковалентним зв'язком між амінокислотами в положеннях 16 та 20; глюкагонові пептиди, які містять модифікації в положенні 16 і в C-кінцевій карбоксильній групі; глюкагонові пептиди, які містять модифікації в положеннях 16 та 20, факультативно з ковалентним зв'язком між амінокислотами в положеннях 16 та 20; і глюкагонові пептиди, які містять модифікації в положенні 20 і в C-кінцевій карбоксильній групі. Активність на GLP-1-рецепторі може бути понижена шляхом (i) введення C-кінцевої альфакарбоксилатної групи, (ii) заміни Thr в положенні 7 амінокислотою, яка не містить гідроксильної групи, наприклад, Abu або Ile, (iii) делеції амінокислоти (амінокислот), орієнтованої(-х) в Cкінцевому напрямі відносно амінокислоти в положенні 27 або 28 (наприклад, делеції амінокислоти в положенні 28, делеції амінокислоти в положеннях 28 і 29) з утворенням пептиду довжиною 27 або 28 амінокислот, або (iv) їх комбінації. Модифікації, які впливають на активність на кожному з рецепторів (глюкагоновому рецепторі, GLP-1-рецепторі і GIP-рецепторі) Підвищена активність на кожному з рецепторів (глюкагоновому рецепторі, GLP-1-рецепторі і GIP-рецепторі) забезпечується (i) заміною амінокислоти Ser в положенні 16 амінокислотою Формули IV: 19 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 , [Формула IV] де n становить від 1 до 16, або від 1 до 10, або від 1 до 7, або від 1 до 6, або від 2 до 6, або 2, або 3, або 4, або 5, кожен з R1 і R2 незалежно вибраний з групи, яку складають H, C1-C18алкіл, (C1-C18-алкіл)OH, (C1-C18-алкіл)NH2, (C1-C18-алкіл)SH, (C0-C4-алкіл)(C3-C6)циклоалкіл, (C0C4-алкіл)(C2-C5-гетероцикл), (C0-C4-алкіл)(C6-C10-арил)R7 і (C1-C4-алкіл)(C3-C9-гетероарил), де R7 – H або OH, і бічний ланцюг амінокислоти Формули IV містить вільну аміногрупу, та (ii) заміною амінокислоти Gln в положенні 20 α,α-дизаміщеною амінокислотою, наприклад, AIB. В деяких варіантах здійснення цього винаходу амінокислотою в положенні 16 є Orn, Dab, Lys або гомо-Lys, а амінокислотою в положенні 20 є AIB. В конкретних варіантах здійснення цього винаходу амінокислотою в положенні 16 є Lys, а амінокислотою в положенні 20 є AIB. Активність аналога, який містить амінокислоту Формули IV в положенні 16 і α,α-дизаміщену амінокислоту в положенні 20, на кожному з рецепторів (глюкагоновому рецепторі, GLP-1рецепторі і GIP-рецепторі) можна також підвищувати шляхом збільшення довжини пептиду, наприклад, шляхом приєднання C-кінцевого подовжувального пептиду, наприклад, завдовжки приблизно 1-21 амінокислота, приблизно 9-21 амінокислота, приблизно 6-18 амінокислот, приблизно 9-12 амінокислот, або приблизно 10 амінокислот чи 11 амінокислот. В деяких варіантах здійснення цього винаходу C-кінець подовжують шляхом приєднання GPSSGAPPPS (послідовність SEQ ID NO: 95) або XGPSSGAPPРS (послідовність SEQ ID NO: 96), де X – Gly або невелика аліфатична або неполярна або слабополярна амінокислота. В альтернативних варіантах здійснення цього винаходу C-кінець подовжують шляхом приєднання GPSSGAPPPS (послідовність SEQ ID NO: 95), і 1-11 амінокислот приєднують до C-кінця GPSSGAPPPS (послідовність SEQ ID NO: 95). Наприклад, C-кінцевий подовжувальний сегмент аналога може містити GPSSGAPPPS (послідовність SEQ ID NO: 95), за якою йдуть 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 або 11 додаткових амінокислот на C-кінці послідовності SEQ ID NO: 95. Згадані 1-11 додаткових амінокислот можуть бути, наприклад, невеликими аліфатичними амінокислотами, наприклад, Ala. В цьому відношенні, C-кінцевий подовжувальний сегмент може містити, наприклад, амінокислотну послідовність GPSSGAPPPSAm, де m становить від 1 до 11. Підвищення активності на кожному з рецепторів (глюкагоновому рецепторі, GLP-1-рецепторі і GIP-рецепторі) аналога на основі глюкагону, який має активність по відношенню до GIPрецептора, включаючи аналог, який містить амінокислоту Формули IV в положенні 16 і α,αдизаміщену амінокислоту в положенні 20, можна також забезпечувати шляхом ацилування або алкілування амінокислоти, розташованої в межах C-кінцевого подовжувального сегмента або Cкінцевої амінокислоти (наприклад, амінокислоти, доданої до C-кінця C-кінцевого подовжувального сегмента). Ацилуванню або алкілуванню може бути піддана амінокислота, розташована, наприклад, в будь-якому з положень 30, 31, 32, 33, 34, 35, 36, 37, 38, 39,40, 41, 42, 43, 44, 45, 46, 47, 48, 49 і 50 аналога, подовженого на C-кінці. В деяких варіантах здійснення цього винаходу амінокислота, яку піддають ацилуванню або алкілуванню, розміщена в положенні 37, 38, 39, 40, 41, 42 або 43 аналога, подовженого на C-кінці. В деяких варіантах здійснення цього винаходу амінокислотою, ацильованою або алкілованою, є амінокислота Формули I, Формули II або Формули III, наприклад, Lys, яка приєднана до ацильної або алкільної групи, наприклад, C10-C22. В деяких варіантах здійснення цього винаходу Lys розташований в C-кінцевому напрямі відносно C-кінцевого подовжувального сегмента, який містить послідовність SEQ ID NO: 95, завдяки чому Lys, Dab, Orn або гомо-Lys займає положення 40 аналога. Факультативно подовжені на C-кінці пептиди також пегілюють, наприклад, в будь-якому з положень, описаних в цій заявці (наприклад, в положенні 24). Підвищення активності на кожному з рецепторів (глюкагоновому рецепторі, GLP-1-рецепторі і GIP-рецепторі) аналога на основі глюкагону, який має активність щодо GIP-рецептора, можна також забезпечувати шляхом ацилування або алкілування амінокислоти через спейсер (наприклад, амінокислоту, дипептид, трипептид, гідрофільний біфункціональний спейсер, гідрофобний біфункціональний спейсер). В деяких варіантах здійснення цього винаходу до складу аналога на основі глюкагону, який має активність по відношенню до GIP-рецептора, вводять ацильну або алкільну групу через спейсер, де згаданий спейсер приєднують до бічного 20 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 ланцюга амінокислоти в положенні 10 аналога. У іншому варіанті здійснення цього винаходу аналог містить C-кінцевий подовжувальний сегмент з 1-21 амінокислоти (наприклад, подовжувальний сегмент, який містить амінокислотну послідовність SEQ ID NO: 95 або SEQ ID NO: 96), розташований в С-кінцевому напрямі відносно амінокислоти в положенні 29, і спейсер, ковалентно приєднаний до ацильної або алкільної групи, приєднують до амінокислоти подовжувального сегмента в положенні, яке відповідає одному з положень 37-43 відносно послідовності SEQ ID NO: 1. В конкретних варіантах здійснення цього винаходу спейсер приєднують до амінокислоти в положенні 40 відносно послідовності SEQ ID NO: 1. В конкретних варіантах здійснення цього винаходу довжина спейсера становить від 3 атомів до 10 атомів. За конкретними аспектами цього винаходу загальна довжина спейсера і ацильної або алкільної групи становить від приблизно 14 атомів до приблизно 28 атомів. Наприклад, згаданим спейсером може бути амінокислота, включаючи будь-яку з тих, які описані в цій заявці (але без обмеження ними). Згаданим спейсером може бути також, наприклад, дипептид або трипептид, який містить амінокислоти, опис яких наведений в цій заявці. За конкретними аспектами цього винаходу спейсером є один з таких дипептидів: Ala-Ala, βAla-βAla або γGlu-γGlu. Крім того, у цій заявці наведений опис додаткових спейсерів, прийнятних для підвищення активності на одному або декількох рецепторах з-посеред глюкагонового рецептора, GLP-1-рецептора і GIPрецептора. Модифікації, що підвищують резистентність до DDP-IV Модифікації в положенні 1 та/або положенні 2 можуть підвищувати резистентність пептиду до розщеплювання дипептидилпептидазою IV (DDP-IV). Наприклад, амінокислота в положенні 2 може бути замінена D-серином, D-аланіном, валіном, гліцином, N-метилсерином, Nметилаланіном або аміноізомасляною кислотою. В деяких варіантах здійснення цього винаходу амінокислота в положенні 1 може бути замінена D-гістидином, дезаміногістидином, гідроксигістидином, ацетилгістидином, гомогістидином, N-метилгістидином, альфаметилгістидином, імідазолоцтовою кислотою або α,α-диметилімідазолоцтовою кислотою (DMIA). Експериментально було виявлено, що модифікації в положенні 2 (наприклад, AIB в положенні 2) і, в деяких випадках, модифікації в положенні 1 (наприклад, DMIA в положенні 1) можуть знижувати активність на глюкагоновому рецепторі, інколи істотно; несподіванно було виявлено, що це зниження активності на глюкагоновому рецепторі може бути відновлене шляхом стабілізування альфа-спіральної структури на C-кінцевій ділянці глюкагону (поблизу амінокислот 12-29), наприклад, шляхом утворення ковалентного зв'язку між бічними ланцюгами двох амінокислот як описано в цій заявці. В деяких варіантах здійснення цього винаходу ковалентний зв'язок розташований між амінокислотами в положеннях "i" та "i+4" або положеннях "j" та "j+3", наприклад, між положеннями 12 та 16, 16 та 20, 20 та 24, 24 та 28 або 17 та 20. В деяких варіантах здійснення цього винаходу цим ковалентним зв'язком є лактамовий місток між глутаміновою кислотою в положенні 16 та лізином в положенні 20. В деяких варіантах здійснення цього винаходу цим ковалентним зв'язком є внутрішньомолекулярний місток, який відрізняється від лактамового містка. Наприклад, до прийнятних способів утворення ковалентного зв’язку (тобто способів утворення ковалентного внутрішньомолекулярного містка) належить будь-який один або декілька способів з групи, яку складають олефіновий метатезис, циклізація на основі лантіоніну, утворення дисульфідного містка або модифікованого сіркавмісного містка, використання α,ω-діаміноалканових зв'язків, утворення місткових зв'язків між атомами металу і інші способи пептидної циклізації. Модифікації, що зменшують деградацію В інших варіантах здійснення цього винаходу будь-який з глюкагонових пептидів може бути підданий модифікуванню для підвищення стабільності шляхом модифікування амінокислоти в положенні 15 та/або 16 послідовності SEQ ID NO: 1 для зменшення деградації пептиду з часом, особливо в кислих або лужних буферних розчинах. Такі модифікації зменшують розщеплення пептидного зв'язку Asp15-Ser16. В деяких варіантах здійснення цього винаходу модифікацією амінокислоти в положенні 15 є делеція або заміна Asp глутаміновою кислотою, гомоглутаміновою кислотою, цистеїновою кислотою або гомоцистеїновою кислотою. В інших варіантах здійснення цього винаходу модифікацією амінокислоти в положенні 16 є делеція або заміна Ser на Thr або AIB. В інших варіантах здійснення цього винаходу Ser в положенні 16 замінюють глутаміновою кислотою або іншою негативно зарядженою амінокислотою, яка має бічний ланцюг завдовжки в 4 атоми, або альтернативно будь-якою амінокислотою, вибраною з глутаміну, гомоглутамінової кислоти або гомоцистеїнової кислоти. В деяких варіантах здійснення цього винаходу метіоніновий залишок, присутній в положенні 27 нативного пептиду, модифікують, наприклад, виконують делецію або заміну. Такі модифікації можуть запобігти окиснювальній деградації пептиду. В деяких варіантах здійснення 21 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 цього винаходу Met в положенні 27 замінюють лейцином, ізолейцином або норлейцином. В деяких конкретних варіантах здійснення цього винаходу Met в положенні 27 замінюють лейцином або норлейцином. В деяких варіантах здійснення цього винаходу Gln в положенні 20 та/або положенні 24 модифікують, наприклад, виконуючи делецію або заміну. Такі модифікації можуть знижувати деградацію, яка є наслідком деамідування Gln. В деяких варіантах здійснення цього винаходу Gln в положенні 20 та/або положенні 24 замінюють на Ala або AIB. В деяких варіантах здійснення цього винаходу Gln в положенні 20 та/або положенні 24 замінюють на Lys, Arg, Orn або цитрулін. В деяких варіантах здійснення цього винаходу Asp в положенні 21 модифікують, наприклад, виконуючи делецію або заміну. Такі модифікації можуть знижувати деградацію, яка є наслідком дегідратації Asp з утворенням циклічної сукцинімідної проміжної сполуки з подальшою ізомеризацією до ізоаспартату. В деяких варіантах здійснення цього винаходу амінокислоту в положенні 21 замінюють на Glu, гомоглутамінову кислоту або гомоцистеїнову кислоту. В деяких конкретних варіантах здійснення цього винаходу амінокислоту в положенні 21 замінюють на Glu. Iнші модифікації Деякі положення нативного глюкагонового пептиду можуть бути модифіковані з одночасним збереженням принаймні деяких активностей вихідного пептиду. Відповідно, заявникивинахідники припускають, що одна або декілька амінокислот, розташованих в положеннях 2, 5, 10, 11, 12, 13, 14, 17, 18, 19, 20, 21, 24, 27, 28 або 29, можуть бути замінені амінокислотою, яка відрізняється від кислоти, присутньої в нативному глюкагоновому пептиді зі збереженням при цьому активності на глюкагоновому рецепторі. В деяких варіантах здійснення цього винаходу амінокислоту в положенні 18 замінюють амінокислотою, вибраною з групи, яку складають Ala, Ser та Thr. В деяких варіантах здійснення цього винаходу амінокислоту в положенні 20 замінюють на Ser, Thr, Lys, Arg, Orn, цитрулін або AIB. В деяких варіантах здійснення цього винаходу амінокислоту в положенні 21 замінюють на Glu, гомоглутамінову кислоту або гомоцистеїнову кислоту. В деяких варіантах здійснення цього винаходу глюкагоновий пептид містить від 1 до 10 модифікацій амінокислот, вибраних із положень 16, 17, 18, 20, 21, 23, 24, 27, 28 та 29. В деяких варіантах здійснення цього винаходу модифікації являють собою одну або декілька замін амінокислот, вибраних з групи, яку складають Gln17, Ala18, Glu21, Ile23, Ala24, Val27 та Gly29. В деяких варіантах здійснення цього винаходу 1-2 амінокислоти, вибрані з положень 17-26, відрізняються від вихідного пептиду. В інших варіантах здійснення цього винаходу 1-2 амінокислоти, вибрані з положень 17-22, відрізняються від вихідного пептиду. В інших варіантах здійснення цього винаходу модифікаціями є Gln17, Ala18, Glu21, Ile23 та Ala24. В деяких варіантах здійснення цього винаходу до карбоксильного кінця глюкагонового пептиду додають одну або декілька амінокислот. Амінокислотою, як правило, є одна з 20 звичайних амінокислот, і в деяких варіантах здійснення цього винаходу амінокислота має амідну групу замість карбонової кислоти нативної амінокислоти. В деяких варіантах здійснення цього винаходу додана амінокислота вибрана з групи, яку складають глутамінова кислота, аспарагінова кислота і гліцин. До інших модифікацій, які не знищують активності, належать W10 та R20. В деяких варіантах здійснення цього винаходу глюкагонові пептиди, описані в цій заявці, модифікують шляхом укорочення C-кінця на один або два амінокислотні залишки, але зі збереженням однакової активності і ефективності на глюкагоновому рецепторі, GLP-1-рецепторі і GIP-рецепторі. Таким чином може бути видалена амінокислота в положенні 29 та/або 28. Стабілізація альфа-спіральної структури Стабілізація альфа-спіральної структури на C-кінцевій ділянці глюкагонового пептиду (поблизу амінокислот 12-29) забезпечує підвищену активність на GLP-1-рецепторі та/або GIPрецепторі і відновлює активність на глюкагоновому рецепторі, яка була понижена модифікаціями амінокислот в положеннях 1 та/або 2. Альфа-спіральна структура може бути стабілізована, наприклад, утворенням ковалентного або нековалентного внутрішньомолекулярного містка або заміною та/або вставкою амінокислот (амінокислоти, яка стабілізує альфа-спіраль) поблизу положень 12-29 (наприклад α,α-дизаміщеної амінокислоти). В деяких варіантах здійснення цього винаходу внутрішньомолекулярний місток утворюють між двома бічними ланцюгами амінокислот для стабілізації об'ємної структури карбоксикінцевої ділянки (наприклад, амінокислот 12-29) глюкагонового пептиду. Два бічні ланцюги амінокислот можуть бути з'єднані між собою через нековалентні зв'язки, наприклад, водневі зв'язки, іонні взаємодії, такі як утворення сольових містків, або через ковалентні зв'язки. Коли два бічні ланцюги амінокислот з'єднуються між собою через один або декілька ковалентних зв'язків, 22 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 пептид може розглядатися в контексті цієї заявки як пептид, який містить ковалентний внутрішньомолекулярний місток. Коли два бічні ланцюги амінокислот з'єднуються між собою через нековалентні зв'язки, наприклад, водневі зв'язки, іонні взаємодії, пептид може розглядатися в контексті цієї заявки як пептид, який містить нековалентний внутрішньомолекулярний місток. В деяких варіантах здійснення цього винаходу внутрішньомолекулярний місток утворюють між двома амінокислотами, розділеними 3 розташованими між ними амінокислотами, наприклад, між амінокислотами в положеннях "i" та "i+4", де i є будь-яким цілим числом від 12 до 25 (наприклад, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 та 25). Більш конкретно, бічні ланцюги амінокислотних пар 12 та 16, 16 та 20, 20 та 24 або 24 та 28 (амінокислотні пари, в яких i=12, 16, 20 або 24) зв'язуються між собою і, тим самим, стабілізують альфа-спіраль глюкагону. Альтернативно i може дорівнювати 17. В деяких конкретних варіантах здійснення цього винаходу у разі, якщо амінокислоти в положеннях "i" та "i+4" з'єднані внутрішньомолекулярним містком, величина лінкера становить приблизно 8 атомів або приблизно 7-9 атомів. В інших варіантах здійснення цього винаходу внутрішньомолекулярний місток утворений між двома амінокислотами, відокремленими двома розташованими між ними амінокислотами, наприклад, амінокислотами в положеннях "j" та "j+3", де j є будь-яким цілим числом від 12 до 26 (наприклад, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 і 26). В деяких конкретних варіантах здійснення цього винаходу j=17. В деяких конкретних варіантах здійснення цього винаходу у разі, якщо амінокислоти в положеннях "j" та "j+3" з'єднані внутрішньомолекулярним містком, величина лінкера становить приблизно 6 атомів або від приблизно 5 атомів до 7 атомів. В інших варіантах здійснення цього винаходу внутрішньомолекулярний місток утворюють між двома амінокислотами, відокремленими 6 розташованими між ними амінокислотами, тобто амінокислотами в положеннях "k" та "k+7", де k є будь-яким цілим числом від 12 до 22 (наприклад, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 і 22). В деяких конкретних варіантах здійснення цього винаходу k дорівнює 12, 13 або 17. В конкретному варіанті здійснення цього винаходу k=17. Прикладами амінокислотних пар, здатних до ковалентного зв'язування з утворенням шестиатомного лінкерного містка, є Orn та Asp, Glu та амінокислота Формули I, де n – 2, й гомоглутамінова кислота та амінокислота Формули I, де n – I, та де Формула I має такий вигляд: , де n – від 1 до 4 [Формула I] Прикладами амінокислотних пар, здатних до ковалентного зв'язування з утворенням семиатомного лінкерного містка, є Orn-Glu (лактамовий цикл); Lys-Asp (лактам); або гомо-Serгомо-Glu (лактон). Прикладами амінокислотних пар, які можуть утворювати восьмиатомний лінкер, є Lys-Glu (лактам); гомо-Lys-Asp (лактам); Orn-гомо-Glu (лактам); 4-аміно-Phe-Asp (лактам); та Tyr-Asp (лактон). Прикладами амінокислотних пар, які можуть утворювати дев'ятиатомний лінкер, є гомо-Lys-Glu (лактам); Lys-гомо-Glu (лактам); 4-аміно-Phe-Glu (лактам); та Tyr-Glu (лактон). Будь-який з бічних ланцюгів цих амінокислот можна додатково заміщати додатковими хімічними групами доти, доки не буде зруйнована об'ємна структура альфа-спіралі. Фахівець в цій галузі може уявити альтернативні пари або альтернативні аналоги амінокислот, включаючи хімічно модифіковані похідні, які могли б утворити стабілізувальну структуру подібного розміру і необхідної дії. Наприклад, дисульфідний місток гомоцистеїн-гомоцистеїн, який має в довжину 6 атомів, для забезпечення необхідної дії може бути додатково модифікований. Навіть без утворення ковалентного зв’язку, вищеописані амінокислотні пари або подібні пари, які може уявити фахівець в цій галузі, також можуть забезпечити додаткову стабільність альфа-спіралі завдяки нековалентним зв'язкам, наприклад, шляхом утворення сольових містків або взаємодій водневих зв'язків. Величина лактамового циклу може змінюватися залежно від довжини бічних ланцюгів амінокислот, і в одному з варіантів здійснення цього винаходу лактам утворюється шляхом з'єднання бічних ланцюгів амінокислоти – лізину – з бічним ланцюгом глутамінової кислоти. Інші варіанти здійснення цього винаходу включають перелічені нижче пари, факультативно з 23 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 лактамовим містком: Glu в положенні 12 з Lys в положенні 16; нативний Lys в положенні 12 з Glu в положенні 16; Glu в положенні 16 з Lys в положенні 20; Lys в положенні 16 з Glu в положенні 20; Glu в положенні 20 з Lys в положенні 24; Lys в положенні 20 з Glu в положенні 24; Glu в положенні 24 з Lys в положенні 28; Lys в положенні 24 з Glu в положенні 28. Альтернативно порядок амідного зв'язку в лактамовому циклі може бути обернений (наприклад, лактамовий цикл може бути утворений між бічними ланцюгами Lis12 і Glu16 або альтернативно між Glu12 і Lys16). Для стабілізації альфа-спіралі пептидів, які є аналогами глюкагону, можуть використовуватися інші внутрішньомолекулярні містки, які відрізняються від лактамового містка. В одному з варіантів здійснення цього винаходу внутрішньомолекулярним містком є гідрофобний місток. В цьому випадку внутрішньомолекулярний місток факультативно може розташовуватися між бічними ланцюгами двох амінокислот, які є частиною гідрофобної ділянки альфа-спіралі пептиду – аналога глюкагону. Наприклад, одною з амінокислот, приєднаних гідрофобним містком, може бути амінокислота в положенні 10, 14 і 18. За одним із конкретних аспектів цього винаходу олефіновий метатезис застосовують для зшивання одного або двох витків альфа-спіралі глюкагонового пептиду із застосуванням системи суцільного перехресного зв'язування всіх вуглеводнів. Глюкагоновий пептид в цьому випадку може містити α-метильовані амінокислоти, які несуть олефінові бічні ланцюги різної довжини, конфігурація яких обумовлена R- або S- стереохімією в положеннях i, i+4 або i+7. Наприклад, олефіновий бічний ланцюг може містити (CH2)n, де n є будь-яким цілим числом від 1 до 6. В одному з варіантів здійснення цього винаходу n дорівнює 3 для утворення поперечного міжмолекулярного зв'язку довжиною 8 атомів. Прийнятні способи утворення таких внутрішньомолекулярних містків відомі в цій галузі. Див., наприклад, Schafmeister et al., J. Am. Chem. Soc. 122:5891-5892 (2000) та Walensky et al., Science 305: 1466-1470 (2004). Альтернативно глюкагоновий пептид може містити O-аліл Ser залишки, розташовані на прилеглих витках спіралі, які з'єднують між собою містком шляхом каталізованого рутенієм метатезису із замиканням циклу. Подібні методики утворення поперечних міжмолекулярних зв'язків описані, наприклад, в Blackwell et al., Angew. Chem. Int. Ed. 37:3281-3284 (1998). За іншим конкретним аспектом цього винаходу штучна тіодіаланінова амінокислота, лантіонін, яка знайшла широке застосування як пептидоміметик цистину, використовується для перехресного зв'язування одного витка альфа-спіралі. Прийнятні способи побудованої на лантіоніні циклізації відомі в цій галузі. Див., наприклад, Matteucci et al., Tetrahedron Letters 45: 1399-1401 (2004); Mayer et al., J. Peptide Res. 51:432-436 (1998); Polinsky et al., J. Med. Chem. 35: 4185-4194 (1992); Osapay et al., J. Med. Chem. 40:2241-2251 (1997); Fukase et al., Bull. Chem. Soc. Jpn. 65: 2227-2240 (1992); Harpp et al., J. Org. Chem. 36:73-80 (1971); Goodman and Shao, Pure Appl. Chem. 68: 1303-1308 (1996); і Osapay and Goodman, J. Chem. Soc. Chem. Commun. 1599-1600 (1993). В деяких варіантах здійснення цього винаходу α,ω-діаміноалканові зв'язки, наприклад, 1,4діамінопропан і 1,5-діамінопентан, між двома Glu залишками в положеннях i та i+7 застосовують для стабілізації альфа-спіралі глюкагонового пептиду. Такі зв'язки призводять до утворення містка довжиною в 9 або більше атомів, залежно від довжини діаміноалканового зв'язку. Прийнятні способи продукування пептидів, зшитих такими зв'язками, описані в цій галузі. Див., наприклад, Phelan et al., J. Am. Chem. Soc. 119: 455-460 (1997). В ще одному варіанті здійснення цього винаходу дисульфідний місток застосовують для зшивання одного або двох витків альфа-спіралі глюкагонового пептиду. Альтернативно модифікований дисульфідний місток, в якому один або обидва атоми сірки замінені метиленовою групою, результатом чого є макроциклізація стереомерів, застосовують для стабілізації альфа-спіралі глюкагонового пептиду. Прийнятні способи модифікування пептидів дисульфідними містками або циклізацією на основі сірки описані, наприклад, Jackson et al., J. Am. Chem. Soc. 113: 9391-9392 (1991) та Rudinger and Jost, Experientia 20: 570-571 (1964). В ще одному варіанті здійснення цього винаходу альфа-спіраль глюкагонового пептиду стабілізують шляхом зв'язування атома металу двома His залишками або парою His-Сys в положеннях i та i+4. Згаданим атомом металу може бути, наприклад, Ru(III), Cu(II), Zn(II) або Cd(II). Подібні способи стабілізації альфа-спіралі на основі зв'язування металу відомі в цій галузі. Див., наприклад, Andrews and Tabor, Tetrahedron 55: 11711-11743 (1999); Ghadiri et al., J. Am. Chem. Soc. 112:1630-1632 (1990); і Ghadiri et al., J. Am. Chem. Soc. 119: 9063-9064 (1997). Альфа-спираль глюкагонового пептиду альтернативно може бути стабілізована іншими способами циклізації пептидів, огляд яких наведений в Davies, J. Peptide. Sci. 9:471-501 (2003). Альфа-спіраль може бути стабілізована шляхом утворення амідного містка, тіоефірного містка, складного тіоефірного містка, сечовинного містка, карбаматного містка, сульфонамідного містка 24 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 тощо. Наприклад, складний тіоефірний місток може бути утворений між С-кінцем і бічним ланцюгом Cys залишку. Альтернативно складний тіоефірний місток може бути утворений через бічні ланцюги амінокислот, які мають тіол (Cys) і карбонову кислоту (наприклад, Asp, Glu). За іншим способом агент зшивання, такий як дикарбонова кислота, наприклад, суберинова кислота (октандіоєва кислота), та подібні кислоти, може вводити зв'язок між двома функціональними групами бічного ланцюга амінокислоти, такими як вільна аміногрупа, гідроксильна група, тіолова група і їх комбінації. В одному з варіантів здійснення цього винаходу альфа-спіраль глюкагонового пептиду стабілізують шляхом включення гідрофобної амінокислоти в положеннях i та i+4. Наприклад, i може бути Tyr, а i+4 може бути Val або Leu; i може бути Phe, а i+4 може бути Cys або Met; i може бути Cys, а i+4 може бути Met; або i може бути Phe, а i+4 може бути Ile. Слід мати на увазі, що в цій заявці розташування вищезазначених амінокислотних пар можна змінювати на протилежне, так що амінокислота, вказана в положенні i, може альтернативно бути розміщена в положенні i+4, тоді як амінокислота, вказана в положенні i+4, може бути розміщена в положенні i. В інших варіантах здійснення цього винаходу альфа-спіраль стабілізують шляхом включення (заміною або введенням амінокислоти) однієї або декількох амінокислот, що стабілізують альфа-спіраль, на C-кінцевій ділянці глюкагонового пептиду (поблизу амінокислот 12-29). В конкретному варіанті здійснення цього винаходу амінокислотою, яка стабілізує альфа-спіраль, є α,α-дизаміщена амінокислота, у тому числі, але без обмеження, будь-яка аміноізомасляна кислота (AIB), амінокислота, дизаміщена тією самою або іншою групою, вибраною з-посеред метилової, етилової, пропілової і н-бутилової груп, або циклооктаном або циклогептаном (наприклад, 1-аміноциклооктан-1-карбоновою кислотою). В деяких варіантах здійснення цього винаходу амінокислоту в одному, двох, трьох, чотирьох або більше положеннях 16, 17, 18, 19, 20, 21, 24 або 29 глюкагонового пептиду замінюють α,αдизаміщеною амінокислотою. В конкретному варіанті здійснення цього винаходу амінокислоту в одному, двох, трьох або всіх положеннях 16, 20, 21 та 24 замінюються α,α-дизаміщеною амінокислотою, наприклад, AIB. Наприклад, амінокислота в положенні 16 глюкагонового пептиду може бути замінена на AIB за відсутності внутрішньомолекулярного містка, наприклад, нековалентного внутрішньомолекулярного містка (наприклад, сольового містка) або ковалентного внутрішньомолекулярного містка (наприклад, лактаму). Такі пептиди, що не містять внутрішньомолекулярного містка, винятково легкі в одержанні. В деяких варіантах здійснення цього винаходу глюкагоновий пептид, що не містить внутрішньомолекулярного містка, має одну або декілька замін амінокислот в положеннях 12-29 на α,α-дизаміщену амінокислоту і ацильну або алкільну групу, ковалентно приєднану до бічного ланцюга амінокислоти глюкагонового пептиду, наприклад, амінокислоти в положеннях 10 або 40 глюкагонового пептиду. В конкретних варіантах здійснення цього винаходу ацильна або алкільна група не є нативною для природної амінокислоти. За певними аспектами цього винаходу ацильна або алкільна група не є нативною для амінокислоти в положенні 10. Подібні ацильовані або алкіловані глюкагонові пептиди, що не містять внутрішньомолекулярного містка, демонструють підвищену активність на GLP-1-рецепторі і глюкагоновому рецепторі в порівнянні з аналогічними неацильованими пептидами. Подальшого посилення активності на GLP-1рецепторі і глюкагоновому рецепторі можна досягти за допомогою ацильованих глюкагонових пептидів, що не містять внутрішньомолекулярного містка, шляхом введення спейсера між ацильною або алкільною групою та бічним ланцюгом амінокислоти в положеннях 10 або 40 пептиду. У цій заявці нижче описане ацилування і алкілування з введенням спейсерів або без нього. В конкретних варіантах здійснення цього винаходу ацильований або алкілований глюкагоновий пептид або його аналог також містить модифікацію, яка селективно знижує активність на GLP-1-рецепторі. Наприклад, ацильований або алкілований глюкагоновий пептид або його аналог містить одну або комбінацію таких модифікацій як C-кінцевий альфакарбоксилат, делеція амінокислот в C-кінцевому напрямі відносно амінокислоти в положенні 27 або 28 (наприклад, делеція амінокислоти в положенні 29, делеція амінокислот в положеннях 28 і 29), заміна Thr в положенні 7 великою аліфатичною неполярною амінокислотою, наприклад, Ile. В деяких варіантах здійснення цього винаходу амінокислоту в положенні 16 або амінокислоту в положенні 20 замінюють α,α-дизаміщеною амінокислотою, наприклад, AIB. В деяких варіантах здійснення цього винаходу амінокислоту в положенні 20 замінюють α,αдизаміщеною амінокислотою, наприклад, AIB. В певних варіантах здійснення цього винаходу амінокислоту в положенні 20 замінюють α,α-дизаміщеною амінокислотою, наприклад, AIB, а амінокислоту в положенні 16 замінюють амінокислотою Формули IV 25 UA 104000 C2 5 10 15 20 25 30 35 40 45 , [Формула IV] де n становить від 1 до 16, або від 1 до 10, або від 1 до 7, або від 1 до 6, або від 2 до 6, або 2, або 3, або 4, або 5, кожен з R1 і R2 незалежно вибраний з групи, яку складають H, C1-C18алкіл, (C1-C18-алкіл)OH, (C1-C18-алкіл)NH2, (C1-C18-алкіл)SH, (C0-C4-алкіл)(C3-C6)-циклоалкіл, (C0C4-алкіл)(C2-C5-гетероцикл), (C0-C4-алкіл)(C6-C10-арил)R7 та (C1-C4-алкіл)(C3-C9-гетероарил), де R7 – H або OH, та бічний ланцюг амінокислоти Формули IV містить вільну аміногрупу. В конкретних варіантах здійснення цього винаходу амінокислотою Формули IV є 2,3діамінопропіонова кислота (DAP), 2,4-діаміномасляна кислота (DAB), Orn, Lys або гомо-Lys. Комбінація амінокислоти Формули IV в положенні 16 та α,α-дизаміщеної амінокислоти як правило забезпечує покращувану активність на кожному рецепторі, а саме на глюкагоновому рецепторі, GLP-1-рецепторі і GIP-рецепторі. З'єднання гідрофільних складників В іншому варіанті здійснення цього винаходу розчинність розкритих в цьому описі глюкагонових пептидів підвищують шляхом ковалентного приєднання гідрофільного складника до пептиду. Гідрофільні складники можуть бути приєднані до глюкагонових пептидів за будьяких прийнятних умов, використовуваних для здійснення реакції білка з активованою полімерною молекулою. Можуть використовуватися будь-які способи, відомі в цій галузі, у тому числі ацилування, гідроалкілування, реакція Міхаеля, алкілування тіолів або інші методи хемоселективного сполучення/лігування через реакційноспроможну групу PEG складника (наприклад, альдегідну групу, аміногрупу, складноефірну групу, тіолову групу, αгалогенацетильну групу, малеімідогрупу або гідразиногрупу) з реакційноспроможною групою сполуки-мішені (наприклад, альдегідною групою, аміногрупою, складноефірною групою, тіоловою групою, α-галогенацетильною групою, малеімідогрупою або гідразиногрупою). До активувальних груп, які можуть застосовуватися для з'єднання водорозчинного полімеру з одним або декількома білками, належать (без обмеження) сульфонова група, малеімідна група, сульфгідрильна група, тіолова група, трифлатна група, трезилатна група, азидиринова група, оксиранова група, 5-піридильна група та альфа-галогенована ацильна група (наприклад, альфа-йодооцтова кислота, альфа-бромоцтова кислота, альфа-хлороцтова кислота). В разі приєднання до пептиду шляхом гідроалкілування, вибраний полімер повинен мати одну реакційноспроможну альдегідну групу для контролю ступеня полімеризації. Див., наприклад, Kinstler et al., Adv. Drug. Delivery Rev. 54:477-485 (2002); Roberts et al., Adv. Drug Delivery Rev. 54:459-476 (2002); та Zalipsky et al., Adv. Drug Delivery Rev. 16:157-182 (1995). За конкретним аспектом цього винаходу амінокислотний залишок на глюкагоновому пептиді, який має тіолову групу, модифікують гідрофільним складником, таким як PEG. В деяких варіантах здійснення цього винаходу тіолову групу модифікують малеімід-активованим PEG в реакції Міхаеля з одержанням пегільованого пептиду, який містить тіоефірний зв'язок, показаний нижче: В деяких варіантах здійснення цього винаходу тіолову групу модифікують галогенацетилактивованим PEG в реакції нуклеофільного заміщення з одержанням пегільованого пептиду, який містить тіоефірний зв'язок, показаний нижче: До прийнятних гідрофільних складових належать поліетиленгліколь (PEG), поліпропіленгліколь, поліоксіетильовані поліоли (наприклад, POG), поліоксіетильований сорбіт, поліоксіетильована глюкоза, поліоксіетильований гліцерин (POG), поліоксіалкілени, 26 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 пропіональдегід поліетиленгліколю, співполімери етиленгліколю/пропіленгліколю, монометоксиполіетиленгліколь, моно-(C1-C10)алкоксиабо арилоксиполіетиленгліколь, карбоксиметилцелюлоза, поліацеталі, полівініловий спирт (PVA), полівінілпіролідон, полі-1,3діоксолан, полі-1,3,6-триоксан, співполімер етилену/малеїнового ангідриду, полі(бетаамінокислоти) (гомополімери або статистичні співполімери), полі(нвінілпіролідон)поліетиленгліколь, гомополімери пропропіленгліколю (PPG) і інші поліалкіленоксиди, співполімери поліпропіленоксиду/етиленоксиду, жирні кислоти товстої кишки і інші полісахаридні полімери, фікол або декстран і їх суміші. Гідрофільний складник, наприклад, поліетиленгліколевий ланцюг, в деяких варіантах здійснення цього винаходу має молекулярну масу, вибрану в діапазоні від приблизно 500 Да до приблизно 40000 Да. В одному з варіантів здійснення цього винаходу гідрофільний складник, наприклад, PEG, має молекулярну масу, вибрану в діапазоні від приблизно 500 Да до приблизно 5000 Да або від приблизно 1000 Да до приблизно 5000 Да. В іншому варіанті здійснення цього винаходу гідрофільний складник, наприклад, PEG, має молекулярну масу від приблизно 10000 Да до приблизно 20000 Да. В ще одному варіанті здійснення цього винаходу гідрофільний складник, наприклад, PEG, має молекулярну масу від приблизно 20000 Да до приблизно 40000 Да. В одному з варіантів здійснення цього винаходу декстрани використовують як гідрофільний складник. Декстрани є полісахаридними полімерами, які складаються з субодиниць глюкози, з'єднаних між собою, головним чином, α1-6 зв'язками. Декстрани доступні в різних діапазонах молекулярних мас, наприклад, від приблизно 1 кДа до приблизно 100 кДа або від приблизно 5 кДа, 10 кДа, 15 кДа або 20 кДа до приблизно 20 кДа, 30 кДа, 40 кДа, 50 кДа, 60 кДа, 70 кДа, 80 кДа або 90 кДа. Полімери можуть бути лінійними або розгалуженими. Одержані препарати кон'югатів можуть бути по суті монодисперсними або полідисперсними і можуть мати приблизно 0,5, 0,7, 1, 1,2, 1,5 або 2 полімерні складники на пептид. В одному з варіантів здійснення цього винаходу гідрофільний складник є поліетиленгліколевим (PEG) ланцюгом, факультативно приєднаним до пептиду в одному або декількох із положень 16, 17, 21, 24, 29, в положенні в межах C-кінцевого подовжувального сегмента, наприклад, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, або на C-кінцевій амінокислоті (наприклад, 40). В деяких варіантах здійснення цього винаходу нативну амінокислоту в цьому положенні замінюють амінокислотою, яка має бічний ланцюг, прийнятний для зшивання з гідрофільними складниками, для полегшення приєднання гідрофільного складника до пептиду. В деяких варіантах здійснення цього винаходу нативну амінокислоту в цьому положенні замінюють на Lys, Cys, Orn, гомоцистеїновий або ацетил-фенілаланіновий залишок. В інших варіантах здійснення цього винаходу амінокислоту, модифіковану для включення гідрофільної групи, додають до пептиду на C-кінці. Iнші модифікації, що підвищують розчинність В іншому варіанті здійснення цього винаходу розчинність будь-якого з глюкагонових пептидів може бути підвищена за допомогою замін амінокислотних залишків та/або додавань амінокислотних залишків, які вводять заряджену амінокислоту на C-кінцеву ділянку пептиду, за варіантом, якому віддається перевага, в положення, орієнтоване в C-кінцевому напрямі відносно положення 27 послідовності SEQ ID NO: 1. Факультативно одна, дві або три заряджені амінокислоти можуть бути вставлені в межах C-кінцевої ділянки, за варіантом, якому віддається перевага, із C-кінцевою орієнтацією відносно положення 27. В деяких варіантах здійснення цього винаходу нативну(-і) амінокислоту(-и) в положеннях 28 та/або 29 замінюють однією або двома зарядженими амінокислотами, та/або в іншому варіанті здійснення цього винаходу від однієї до трьох заряджених амінокислот також додають до C-кінця пептиду. В деяких варіантах здійснення цього винаходу одна, дві або всі заряджені амінокислоти мають негативний заряд. В деяких варіантах здійснення цього винаходу негативно зарядженою (кислою амінокислотою) є аспарагінова кислота або глутамінова кислота. На глюкагоновому пептиді можна здійснювати додаткові модифікації, наприклад, консервативні заміни, які, однак, дозволяють йому зберігати активність на GIP-рецепторі (і факультативно активність на GLP-1-рецепторі та/або глюкагоновому рецепторі). Кон'югати і гібриди Цій опис стосується також інших кон'югатів, в яких глюкагонові пептиди, які відповідають цьому винаходу, приєднані до кон'югатного складника, факультативно через ковалентні зв'язки і факультативно через лінкер. Приєднання може здійснюватися за допомогою ковалентних хімічних зв'язків, фізичних сил, наприклад, електростатичних, водневих, іонних, ван-дерваальсових, гідрофобних або гідрофільних взаємодій. Можуть бути використані різні системи 27 UA 104000 C2 5 10 15 20 25 30 35 40 45 50 55 60 нековалентної взаємодії, включаючи біотин-авідин, ліганд/рецептор, фермент/субстрат, нуклеїнова кислота/білок, що зв'язує нуклеїнові кислоти, ліпід/білок, що зв'язує ліпіди, молекулипартнери клітинної адгезії, або будь-які зв'язувальні партнери або їхні фрагменти, які мають взаємну спорідненість. Пептид можна з'єднувати з кон’югатними складниками шляхом прямого ковалентного приєднання при введенні в реакцію цільових амінокислотних залишків пептиду з органічним дериватизатором, який може реагувати з вибраними бічними ланцюгами або N- або Cкінцевими залишками цих цільових амінокислот. До реакційноспроможних груп пептиду або кон’югата належать, наприклад, альдегідна група, аміногрупа, складноефірна група, тіолова група, α-галогенацетильна група, малеімідогрупа або гідразиногрупа До дериватизаторів належать, наприклад, малеімідобензоїлсульфосукцинімідний складний ефір (сполучення через цистеїнові залишки), N-гідроксисукцинімід (через лізинові залишки), глутаральдегід, сукцинангідрид і інші дериватизатори, відомі в цій галузі. Альтернативно кон'югатні складники можуть приєднуватися до пептиду опосередковано через проміжні носії, такі як полісахаридні або поліпептидні носії. Прикладом полісахаридного носія є амінодекстран. Прикладами прийнятних поліпептидних носіїв є полілізин, поліглутамінова кислота, поліаспарагінова кислота, їхні співполімери і змішані полімери цих і інших амінокислот, наприклад, серину, для додання необхідних властивостей розчинності одержуваним в результаті навантаженим носіям. Цистеїнілові залишки найчастіше взаємодіють з α-галогенацетатами (та відповідними амінами), такими як хлороцтова кислота, хлорацетамід, із одержанням карбоксиметилових або карбоксіамідометилових похідних. Цистеїнілові залишки дериватизують також в ході реакції з бромтрифторацетоном, альфа-бромо-β-(5-імідазоїл)пропіоновою кислотою, хлорацетилфосфатом, N-алкілмалеімідами, 3-нітро-2-піридилдисульфідом, метил-2піридилдисульфідом, п-хлормеркурбензоатом, 2-хлормеркур-4-нітрофенолом або хлоро-7нітробензо-2-окса-1,3-діазолом. Гістидилові залишки дериватизують шляхом введення в реакцію з діетилпірокарбонатом при рН 5,5-7,0, оскільки цей агент має відносну специфічність до бічного ланцюга гістидилу. Прийнятний також пара-бромфенацетилбромід; реакцію за варіантом, якому віддається перевага, проводять в 0,1 М розчині какодилату натрію при рН 6,0. Лізиніловий і амінокінцевий залишки реагують з бурштиновим або іншими ангідридами карбонової кислоти. Дериватизація цими агентами змінює на протилежний заряд лізинілових залишків. До інших прийнятних реактивів для дериватизації альфа-аміновмісних залишків належать складні імідоефіри, такі як метилпіколінімідат, піридоксал-фосфат, піридоксаль, хлорборогідрид, тринітробензолсульфокислота, О-метилізосечовина, 2,4-пентандіон і продукт каталізованої трансаміназою реакції з гліоксилатом. Аргінілові залишки модифікують за допомогою реакції з одним або декількома звичайними реагентами, до яких належать фенілгліоксаль, 2,3-бутандіон, 1,2-циклогександіон і нігідрин. Для дериватизації залишків аргініну потрібно, щоб згадана реакція здійснювалася в лужних середовищах через високу рКа гуанідинової функціональної групи. Крім того, такі реагенти можуть взаємодіяти з групами лізину, а також аргінін-епсилон-аміногрупою. Тирозилові залишки можна піддавати специфічному модифікуванню, причому особливий інтерес в цьому випадку становить введення спектральних міток в тирозилові залишки шляхом введення в реакцію з ароматичними сполуками – діазонієм або тетранітрометаном. Найчастіше для одержання різних О-ацетилтирозилових залишків і 3-нітропохідних застосовують Nацетилімідазол та тетранітрометан, відповідно. Карбоксильні бічні групи (аспартил або глутаміл) селективно модифікують шляхом введення в реакцію з карбодіімідами (R-N=C=N=R'), де R та R' є різними алкільними групами, такими як 1циклогексил-3-(2-морфолініл-4-етил)карбодіімід або 1-етил-3-(4-азоніа-4,4диметилфеніл)карбодіімід. Крім того, аспартилові і глутамілові залишки перетворюють на аспарагініловий і глутамініловий залишки шляхом проведення реакції з іонами амонію. Інші модифікації включають гідроксилювання проліну і лізину, фосфорилування гідроксильних груп серилових або треоніловіх залишків, метилування альфа-аміногруп бічних ланцюгів лізину, аргініну і гістидину (T.E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, (1983), стор. 79-86), деамідування аспарагінів або глутаміну, ацетилювання N-кінцевого аміну та/або амідування або естерифікацію C-кінцевої карбоксильної групи. Ковалентною модифікацією іншого типу є хімічне або ферментативне приєднання глікозидів до пептиду. Цукор (цукри) може (можуть) приєднуватися до (a) аргініну і гістидину, (b) вільних карбоксильних груп, (c) вільних сульфгідрильних груп, таких як сульфгідрильні групи цистеїну, (d) вільних гідроксильних груп, таких як гідроксильні групи серину, треоніну або гідроксипроліну, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюGip-based mixed agonists for treatment of metabolic disorders and obesity
Автори англійськоюDimarchi Richard Dennis, Tao, Ma
Автори російськоюДимарчи Ричард Деннис, Тао Ма
МПК / Мітки
МПК: A61P 3/10, C07K 14/605, A61K 38/26, A61P 3/04
Мітки: лікування, змішаної, пептиду, дії, основі, глюкозозалежного, речовин, обміну, ожиріння, порушень, агоністи, інсулінотропного
Код посилання
<a href="https://ua.patents.su/266-104000-agonisti-zmishano-di-na-osnovi-glyukozozalezhnogo-insulinotropnogo-peptidu-dlya-likuvannya-porushen-obminu-rechovin-i-ozhirinnya.html" target="_blank" rel="follow" title="База патентів України">Агоністи змішаної дії на основі глюкозозалежного інсулінотропного пептиду для лікування порушень обміну речовин і ожиріння</a>
Попередній патент: Діоксид титану з покриттям та його застосування в композиціях
Наступний патент: Гранульований молочний продукт
Випадковий патент: Герметизатор устя свердловини












