Пробіотична композиція для застосування в лікуванні запалення кишечнику
Формула / Реферат
1. Композиція, що містить ефективну кількість щонайменше одного штаму, який вибраний з групи, яка складається з Lactobacillus plantarum, депонованого в Іспанській Колекції Типових Культур під номером доступу CECT 7484, Lactobacillus plantarum, депонованого в Іспанській Колекції Типових Культур під номером доступу CECT 7485 і Pediococcus acidilactici, депонованого в Іспанській Колекції Типових Культур під номером доступу CECT 7483, всі з яких мають протизапальну активність, імуномодулюючу активність, активність відносно IBS або активність відносно здуття живота, або їх мутантні штами, де мутантні штами отримують при використанні депонованого штаму як вихідного матеріалу та застосування мутагенезу, де мутантні штами зберігають або підсилюють протизапальну активність, імуномодулюючу активність, активність відносно IBS або активність відносно здуття живота батьківського депонованого штаму.
2. Композиція за п. 1, яка містить ефективну кількість щонайменше одного штаму, вибраного з групи, що складається з Lactobacillus plantarum CECT 7484, Lactobacillus plantarum CECT 7485 і Pediococcus acidilactici CECT 7483.
3. Композиція за п. 1, яка містить ефективну кількість щонайменше одного штаму, який вибраний з групи, що складається з Lactobacillus plantarum CECT 7484, Lactobacillus plantarum CECT 7485 і Pediococcus acidilactici CECT 7483 або їх мутантних штамів, де мутантні штами отримують при використанні депонованого штаму як вихідного матеріалу та застосування мутагенезу, і де мутантні штами зберігають або підсилюють протизапальну активність, імуномодулюючу активність, активність відносно IBS або активність відносно здуття живота батьківського депонованого штаму.
4. Композиція за п. 1, яка містить ефективну кількість штамів Lactobacillus plantarum CECT 7484, Lactobacillus plantarum CECT 7485 і Pediococcus acidilactici CECT 7483.
5. Композиція за будь-яким з пп. 1-4, для застосування як пробіотика.
6. Композиція за будь-яким з пп. 1-4, для застосування як лікарського препарату.
7. Композиція за будь-яким з пп. 1-4, для застосування як імуномодулюючого засобу.
8. Композиція за будь-яким з пп. 1-4, для профілактики і/або лікування запалення кишечнику.
9. Композиція за будь-яким з пп. 1-4 для профілактики і/або лікування запального захворювання кишечнику.
10. Композиція за будь-яким з пп. 1-4 для профілактики і/або лікування синдрому подразненого кишечнику.
11. Композиція за будь-яким з пп. 1-4 для профілактики і/або лікування здуття і розтягнення живота.
12. Композиція за будь-яким з пп. 1-4, де композиція знаходиться у формі фармацевтичного продукту.
13. Композиція за будь-яким з пп. 1-4, де композиція знаходиться у формі ветеринарного продукту разом з прийнятними у ветеринарній практиці наповнювачами.
14. Композиція за будь-яким з пп. 1-4, де композиція знаходиться у формі харчового продукту разом з харчовими інгредієнтами.
15. Композиція за п. 14, яка є дієтичною добавкою.
16. Штам, який виявляє протизапальну активність, імуномодулюючу активність, активність відносно IBS або активність відносно здуття живота, що вибраний з групи, яка складається з Lactobacillus plantarum CECT 7484, Lactobacillus plantarum CECT 7485 і Pediococcus acidilactici CECT 7483.
Текст
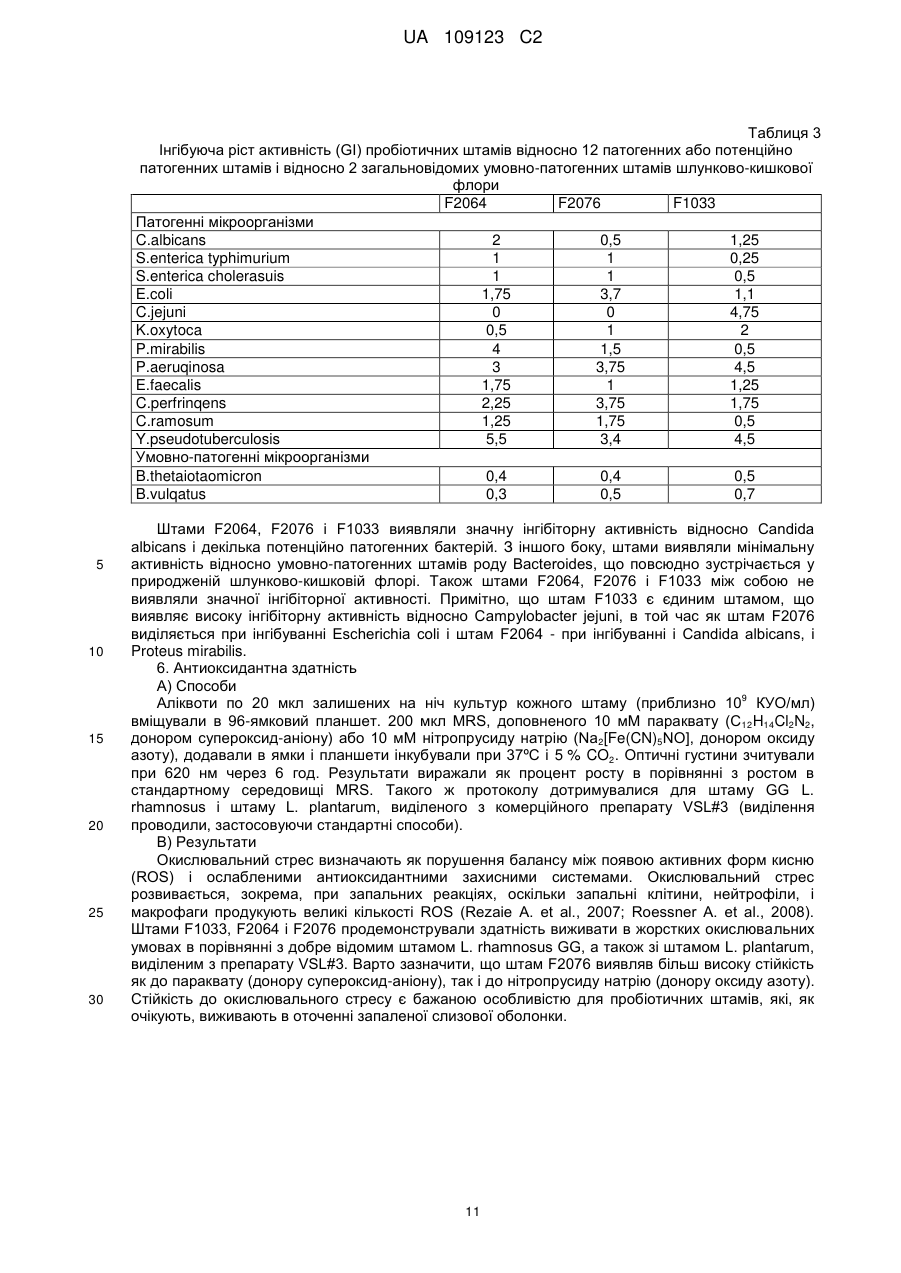
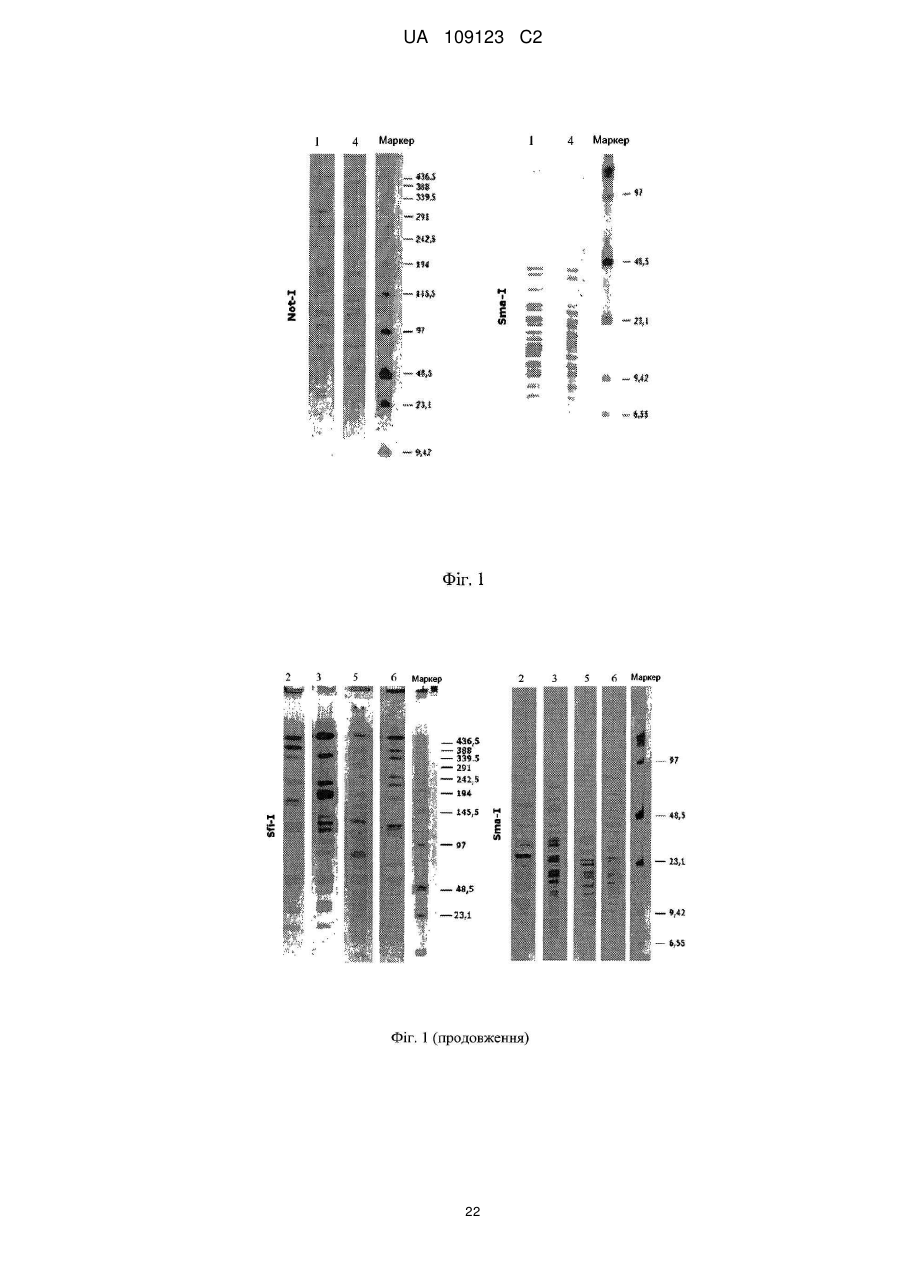
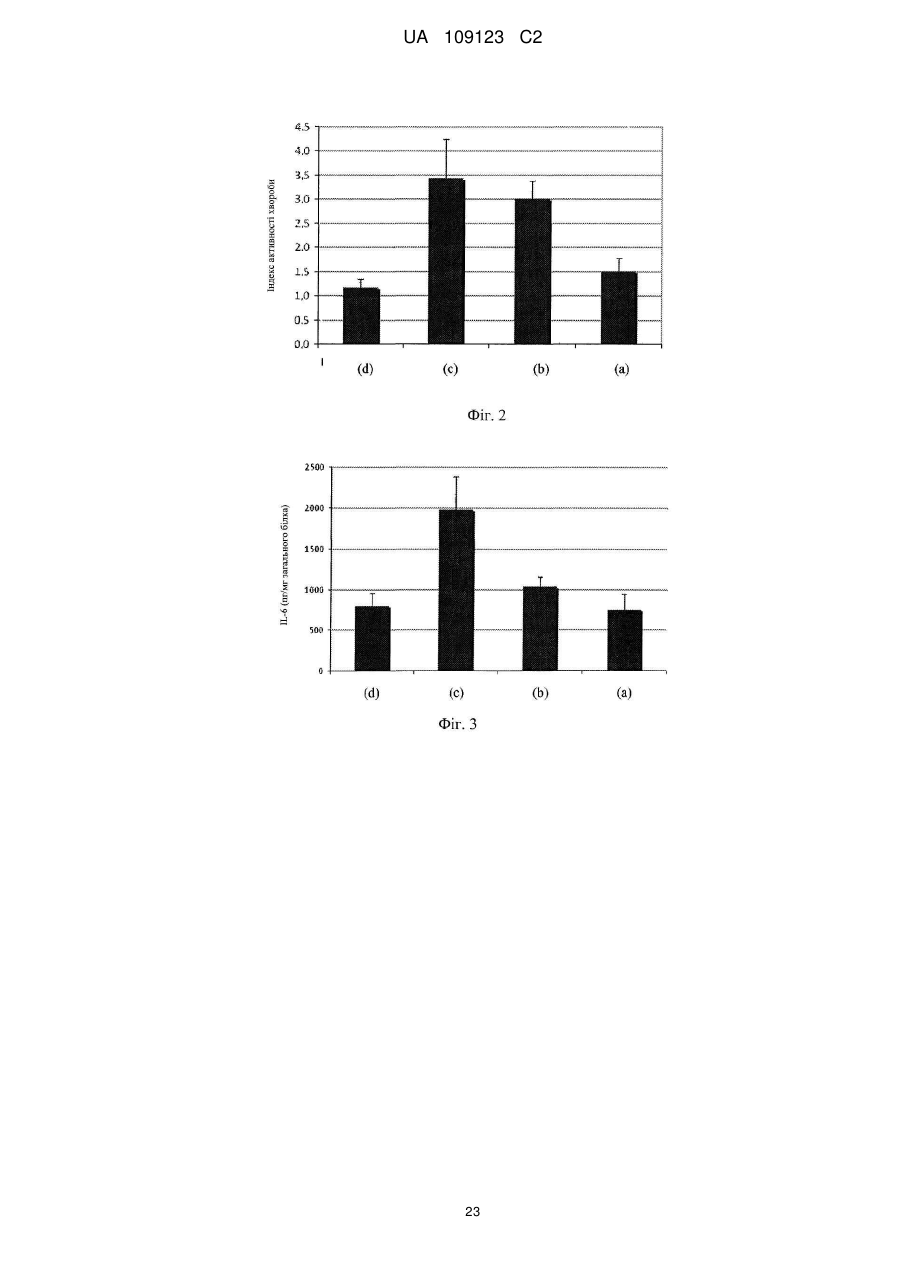
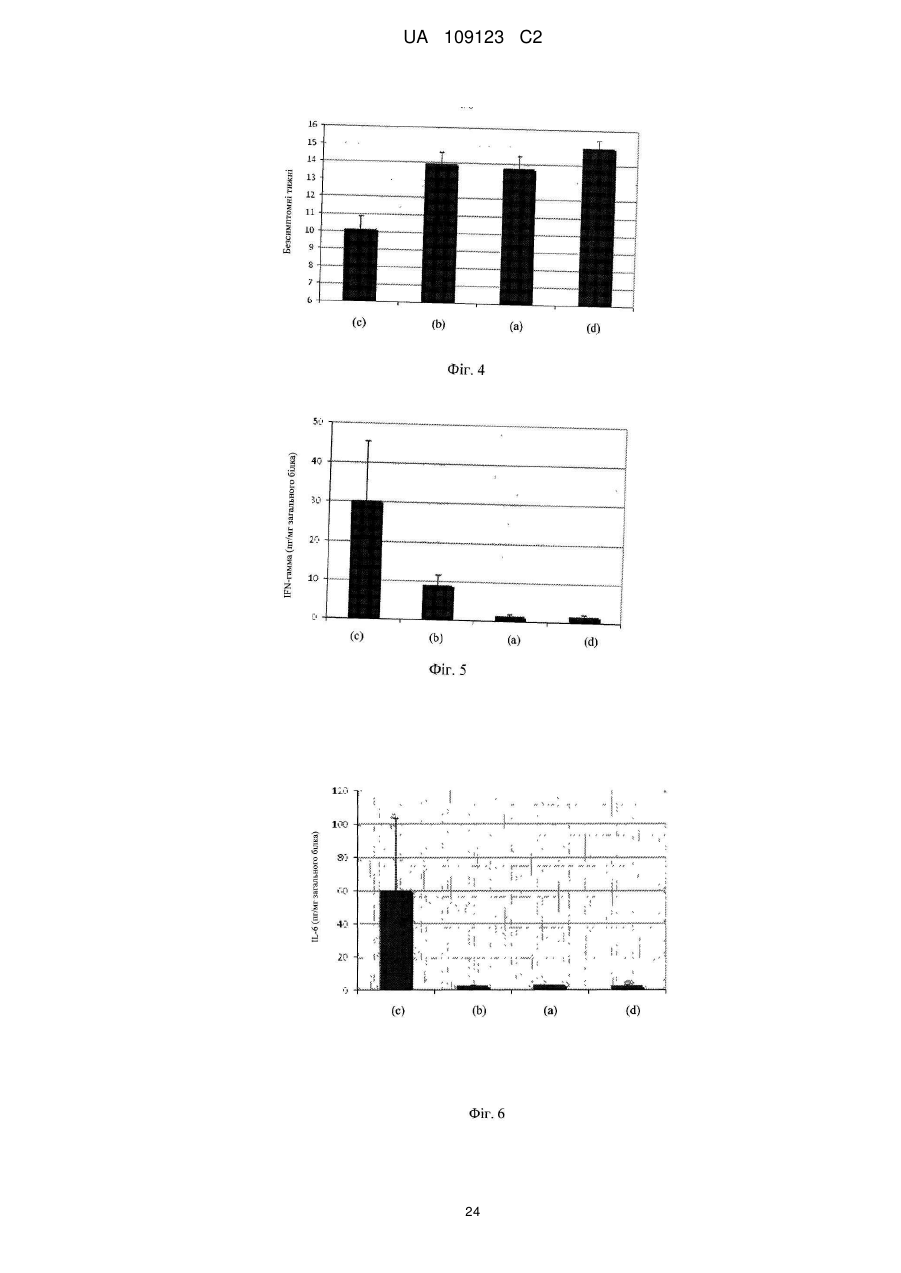
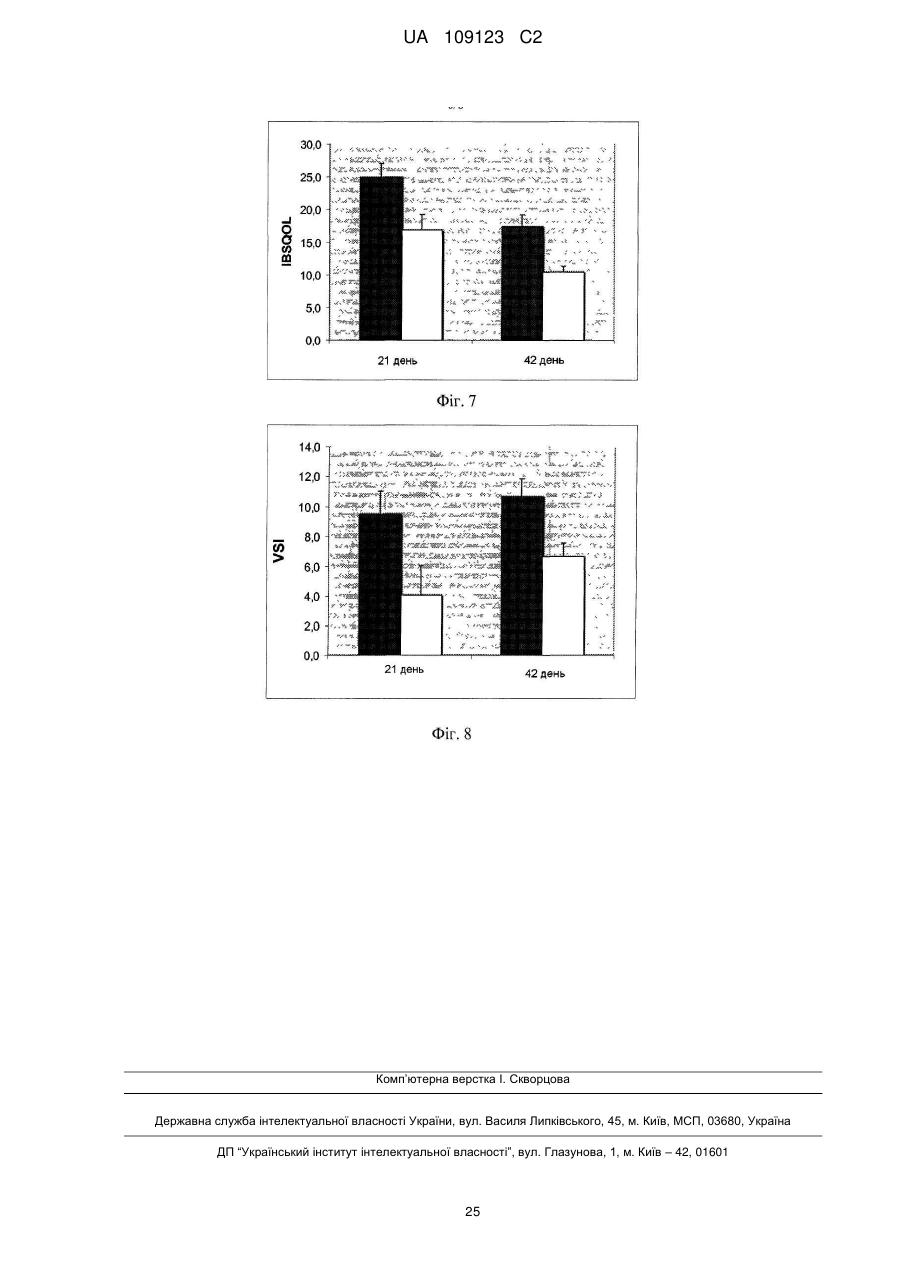
Реферат: UA 109123 C2 (12) UA 109123 C2 Винахід належить до композиції, що містить ефективну кількість щонайменше одного штаму, який вибраний з групи, яка складається з Lactobacillus plantarum CECT 7484, Lactobacillus plantarum CECT 7485 і Pediococcus acidilactici CECT 7483, всі з яких мають протизапальну активність, імуномодулюючу активність, активність відносно IBS або активність відносно здуття живота. UA 109123 C2 5 10 15 20 25 30 35 40 45 50 55 60 По даній заявці заявляється пріоритет по попередній заявці на патент США № 61/299116 і європейській патентній заявці EP10151998, одночасно поданій 28 січня 2010 року, і які включені в цей документ як посилання. Даний винахід стосується галузей медицини, мікробіології і харчування і, зокрема, нової пробіотичної композиції. Зокрема, нові штами Lactobacillus plantarum і Pediococcus acidilactici були виділені і об'єднані в препарат, застосовний для лікування шлунково-кишкових захворювань, таких як запалення кишечнику (наприклад, запальне захворювання кишечнику) і синдром подразненого кишечнику. РІВЕНЬ ТЕХНІКИ ВИНАХОДУ Виразковий коліт (UC), паучит і хвороба Крона є прикладами запальних захворювань кишечнику (IBD), що характеризуються хронічним запаленням в кишечнику. Клінічними симптомами є діарея, біль в животі, періодична кровотеча з прямої кишки, втрата ваги, стомлюваність і в ряді випадків пропасниця. IBD, хоч зустрічається в будь-якому віці, найбільш поширене у підлітків і молоді, які, таким чином, можуть страждати на відставання в розвитку і затримку росту. Частота трапляння захворювання схожа з частотою для діабету 1 типу в Європі і США. Протікання хвороби IBD значно варіює. Пацієнтів з симптомами від легкого до помірного ступеня можна лікувати без госпіталізації. Однак, 10-15 % пацієнтів схильні до тяжкого протікання хвороби, яка в багатьох випадках супроводжується хірургічним втручанням. IBD лікують, з медичної точки зору, зменшуючи запалення і, внаслідок цього, борючись з шлунково-кишковими симптомами. Однак, в цей час не існує ніякого медичного лікування IBD. Колектомія може усунути UC, але знижує якість життя і збільшує ризик виникнення ускладнень. Доступне терапевтичне лікування включає в себе застосування 5-аміносаліцилової кислоти (5ASA), кортикостероїдів і імуномодулюючих лікарських препаратів. Тривале лікування від легких до помірних симптомів IBD звичайно проводять з використанням 5-ASA, в той час як кортикостероїди і імуномодулюючі лікарські препарати застосовують для лікування тяжких симптомів. Діарея або біль в животі виявляються як побічні ефекти 5-ASA, тоді як при довготривалому використанні кортикостероїдів часто з'являються серйозні побічні ефекти, що включають в себе втрату кісткової маси, інфекції, діабет, м'язову атрофію і психіатричні порушення. Імуномодулюючі лікарські препарати придушують імунну систему, яка контролює симптоми IBD. Однак, стан з ослабленим імунітетом, що виходить в результаті, робить пацієнта сприйнятливим до великої кількості захворювань. Синдром подразненого кишечнику (IBS) являє собою стан, що характеризується болем в животі і/або дискомфортом, який асоційований із зміненим ритмом випорожнення кишечнику або дефекації, де симптоми не пояснюються структурними або біохімічними відхиленнями. Імперативні позиви, здуття живота і відчуття недостатніх випорожнень кишечнику також поширені при IBS. Тому, дане захворювання класифікують в числі функціональних порушень з боку шлунково-кишкового тракту, які включають в себе такі захворювання, як функціональне здуття живота, некардіальний біль в грудній клітці, невиразкова диспепсія і хронічний запор або діарея (Longstreth G. H. et al., 2006). Відмітно, що IBS впливає істотним чином на захворюваність і якість життя, не кажучи про біль в животі і дискомфорті, оскільки асоційовані симптоми позначаються як на почутті благополуччя хворого, так і на здатності нормально функціонувати (Dean B. B. et al., 2005). Величезна активність має місце в області розробки лікарського засобу для лікування IBS. У цьому відношенні завоювали популярність різні антидепресанти, хоч ефективність їх в клінічних випробуваннях була невеликою і їх клінічне застосування обмежене несприятливими побічними ефектами. Серотонергічні засоби продемонстрували ефективність при загальних симптомах IBS. Однак побоювання, що нещодавно виникли з приводу безпеки сильно обмежили їх застосування. Отже, розробка нових способів лікування IBS представляє дуже великий інтерес. Пробіотики визначають як "живі мікроорганізми, які при прийомі в їжу в певних кількостях надають користь для здоров'я крім початкового основного харчування" (Araya M. et al., 2002; Guarner F. et al., 1998). Декілька молочнокислих бактерій і видів з роду Bifidobacterium є пробіотиками, що означає, що вони, як показано, забезпечують специфічний вплив на здоров'я. Пробіотичні бактерії повинні відповідати декільком вимогам, що стосуються відсутності токсичності, життєздатності, адгезії і позитивних впливів. Такі пробіотичні характеристики є залежними від штаму, навіть серед бактерій одного і того ж виду. Отже, важливо виявити такі штами, які мають кращі якості відносно всіх вимог до пробіотиків. Були проведені клінічні випробування на людях з використанням одних тільки пробіотиків або в поєднанні з антибіотиками для того, щоб визначити штами і/або препарати для лікування пацієнтів з IBD або IBS, або для того, щоб вже підтримати ремісію у пацієнтів з IBD, які отримують лікування. 1 UA 109123 C2 5 10 15 20 25 30 35 40 45 50 55 60 У WO 96/29083 і EP 554418 описані два штами Lactobacillus, які заселяють кишечник, що включають в себе Lactobacillus plantarum 299v (DSM 6595) і Lactobacillus casei ssp. rhamnosus 271 (DSM 6594). У EP 415941 описані способи отримання поживної композиції, що включають обробку рідкої вівсяної каші ферментами до змішування з лактобацилами. У патенті США 7195906 описаний штам Bifidobacterium, виділений з резекційованого і промитого шлунковокишкового тракту людини, для лікування запальних захворювань, особливо, шлунковокишкового запального процесу, такого як IBD, і IBS. Незважаючи на багатообіцяючий потенціал, потрібне значне удосконалення впливу пробіотиків для застосування в лікуванні запальних захворювань кишечнику (таких як IBD), а також інших шлунково-кишкових захворювань (таких як IBS). СУТЬ ВИНАХОДУ Автори даного винаходу виявили, що композиція, яка містить штами Lactobacillus і Pediococcus, ефективна при лікуванні запалень кишечнику. Зокрема, виділили три нових пробіотичних штами, що належать роду Lactobacillus plantarum і роду Pediococcus acidilactici, причому вказані штами дозволяють здійснювати ефективне лікування запалення кишечнику при об'єднанні у вигляді одного препарату. Таким чином, в першому аспекті даний винахід стосується композиції, що містить ефективну кількість Lactobacillus plantarum CECT 7484, Lactobacillus plantarum CECT 7485 і Pediococcus acidilactici CECT 7483 або їх мутантів або варіантів. Штами Lactobacillus plantarum CECT 7485 і CECT 7484 і штам Pediococcus acidilactici CECT 7483 депонували в Іспанській колекції типових культур (Валенсія, Іспанія) 04.02.2009. Всі три депонованих штами життєздатні і зберігають всі свої характеристики, пов'язані з їх депонуванням. Термін "ефективна кількість", як застосовують в цьому документі, означає кількість активної речовини достатньо високої для того, щоб забезпечувати позитивний вплив, але достатньо низької для того, щоб уникнути серйозних побічних ефектів в рамках медичної оцінки. Ясно, що використовуючи депоновані штами як вихідний матеріал, фахівець в даній галузі може звичайним способом за допомогою загальноприйнятих методик мутагенезу або повторного виділення отримати додаткові мутанти або їх похідні, в яких збережені або посилені описані в цьому документі відповідні характеристики і переваги штамів, що складають композицію за винаходом. Фахівець в даній галузі прийме рішення про відповідний спосіб, який необхідно застосувати для визначення протизапальної, імуномодулюючої активності штамів або відносно IBS, або відносно здуття живота. Приклади можливих способів для визначення такої активності показані нижче в прикладах. У одному з варіантів здійснення мутант являє собою генетично модифікований мутант. У іншому варіанті здійснення першого аспекту за винаходом варіант являє собою варіант, що зустрічається в природі. Штами, що становлять частину композиції по першому аспекту винаходу, можуть знаходитися у вигляді життєздатних клітин. Альтернативно, штам може знаходитися у вигляді нежиттєздатних клітин. Основне застосування штамів Р. acidilactici CECT 7483, а також L. plantarum CECT 7484 і CECT 7485 має місце у вигляді життєздатних клітин. Проте, застосування можна також розширити на нежиттєздатні клітини, такі як інактивовані культури або композиції, що містять корисні фактори, продуковані Р. acidilactici CECT 7483, а також L. plantarum CECT 7484 і CECT 7485. Вони можуть включати в себе термоінактивовані мікроорганізми або мікроорганізми, інактивовані під впливом зміненої величини pH, ультразвуку, радіації або при застосуванні тиску. З нежиттєздатними клітинами отримання продукту є більш простим, клітини можна легко вводити до складу фармацевтичних препаратів, і вимоги до їх зберігання набагато менш обмежені, ніж для життєздатних клітин. При застосуванні у вигляді композиції за винаходом штами знаходяться, переважно, в співвідношенні концентрацій 1:1:1. Штами CECT 7483, CECT 7484 і CECT 7485 виявляють значну інгібіторну активність відносно декількох патогенних і потенційно патогенних бактеріальних штамів, в також час, виявляючи мінімальний антагонізм відносно загальновідомих умовно-патогенних штамів шлунково-кишкової флори людини. Крім того, дані три штами демонструють відсутність значної інгібіторної активності між ними, таким чином, дозволяючи здійснювати їх спільне застосування в одному препараті. Це є доречним, оскільки означає, що композиція, як визначено в першому аспекті за винаходом, виявляє позитивний вплив в кишечнику в результаті "інтактної" дії кожного з трьох штамів. Об'єднання даних штамів в один препарат (тобто, в композицію за винаходом) демонструє здатність пом'якшити клінічні симптоми (такі як втрата ваги і діарея) в 2 UA 109123 C2 5 10 15 20 25 30 35 40 45 50 55 60 різних моделях запалення кишечнику у тварин. Відповідно до даних результатів, композиція за винаходом демонструє унікальну здатність значно знижувати цитокіни гострої (IL-6) і хронічної (IFNγ) фази. Велика кількість видів молочнокислих бактерій має тривалий досвід безперечного безпечного застосування. Європейське відомство по безпеці харчових продуктів розробило систему, що надає статус "кваліфікованої презумпції безпеки" (QPS) таксономічним одиницям з підтвердженим тривалим досвідом безперечного безпечного застосування. Штами CECT 7483, CECT 7484 і CECT 7485 належать до бактеріальних видів, які мають статус QPS (Andreoletti O. et al., 2008). Штами за даним винаходом мають перевагу, що вони особливо придатні як пробіотики. Як указано вище, пробіотичні бактерії повинні відповідати декільком вимогам, що стосуються відсутності токсичності, життєздатності, адгезії і позитивного впливу. Такі пробіотичні характеристики є залежними від штаму, навіть серед бактерій одного і того ж виду. Отже, важливо виявити такі штами, які мають кращі якості відносно всіх вимог до пробіотиків. У прикладах, приведених нижче, представлені (як приклад) протоколи для визначення кожної з пробіотичних характеристик і також продемонстровано, що вказані штами мають чудові пробіотичні характеристики. Поява і поширення стійкості до антибактеріальних препаратів у бактерій ставлять під загрозу здоров'я людини і тварин і представляють великі фінансові і соціальні витрати. Коли стійкість до антибактеріального препарату у бактеріального виду є природженою, її, як правило, позначають як "первинна стійкість" (яка іноді називається "природна стійкість"). Первинна стійкість, як передбачають, являє собою мінімальний потенціал для горизонтального поширення, тоді як набуту стійкість, опосередковану додатковими генами, розглядають як таку, що має великий потенціал для широкого поширення. Автори даного винаходу виявили, що штами, які складають композицію за винаходом, не виявляють ніякої значної стійкості до антибіотиків людської і/або ветеринарної значущості (ампіциліну, гентаміцину, стрептоміцину, еритроміцину, тетрацикліну, кліндаміцину і хлорамфеніколу) згідно з нормативами Європейського відомства по безпеці харчових продуктів (Anadon A. et al., 2005; Bories G. et al., 2008), таким чином усуваючи ризик можливої передачі патогенному виду стійкості до антибіотика. Додатково, автори даного винаходу виявили, що штами CECT 7483, CECT 7484 і CECT 7485 можна вводити спільно з іншими лікарськими препаратами, що застосовуються для лікування IBD (такими як месалазин). Як показано нижче, ріст вказаних штамів повністю не інгібувався навіть при використанні насичених концентрацій месалазину. Іншими словами, навіть при застосуванні високих концентрацій месалазину ефективність композиції за винаходом, яка містить пробіотичні штами, не знижувалася і, отже, вона може виявляти як пробіотичні, так і протизапальні функції. Штами за винаходом, як продемонстрували, високо стійкі до умов шлунково-кишкового середовища у ссавців (кисле середовище, солі жовчних кислот і високий вміст лізоциму і концентрації перекису кисню), таким чином, будучи здатними витримувати проходження через шлунково-кишковий тракт (що надалі також позначається як "ШКТ"). Штами також мають хорошу адгезію до кишкового епітелію, яка дозволяє їм залишатися в кишечнику і виявляти їх пробіотичні впливи. Додатково, дані штами мають декілька позитивних впливів на хазяя. У доповнення до протизапальної активності в кишечнику, вони надають позитивний вплив на баланс мікрофлори кишечнику внаслідок їх антагоністичної активності. Термін "антагоністична активність" стосується інгібування росту шлунково-кишкових некорисних бактерій за допомогою активності пробіотичних бактерій. Стан при наявності невідповідного шлунково-кишкового балансу мікрофлори відомий як дисбіоз і має велику кількість негативних наслідків для здоров'я людини. Нижче буде показано, що штами мають велику здатність інгібувати ріст патогенних штамів, коли їх порівнюють з іншими комерційними штамами. Додатково, як указано вище, автори винаходу виявили, що нові штами за винаходом не виявляють значної інгібіторної активності один серед одного. Додатково, було виявлено, що штами, які складають композицію по першому аспекту винаходу, продукують великі кількості коротколанцюжкових жирних кислот (SCFA). Продукція SCFA з неперетравлюваної клітковини є цікавою особливістю пробіотика. Дана особливість бажана у пробіотика, оскільки продукована SCFA виявляє декілька сприятливих властивостей для хазяя. Серед їх різних властивостей, SCFA, особливо масляна кислота, з легкістю всмоктуються слизовою оболонкою кишечнику, стимулюють всмоктування натрію і води в товстій кишці, і є тропними до слизової оболонки кишечнику (D'Argenio G. et al., 1999; Tedelind S. 3 UA 109123 C2 5 10 15 20 25 30 35 40 45 50 55 et al., 2007). Крім того, масляна кислота використовується колоноцитами як паливо. Кожний штам в препараті є суворим продуцентом різної SCFA, або оцтової, або пропіонової, або масляної, які являють собою три основні SCFA, виявлені в кишечнику. Краще розуміння того, як коротколанцюжкові жирні кислоти діють при запальному процесі, може сприяти удосконаленню ефективності сучасного лікування запалення кишечнику. Відносно цього, було докладено про взаємозв'язок між SCFA і регуляцією запальних станів через спряжені з G-білком рецептори (Maslowski K. M. et al., 2009). Крім того, штами CECT 7483, CECT 7484 і CECT 7485 стимулюють імуномодулюючі ефекти у хазяя, оскільки вони спричиняють появу нормалізованого цитокінового патерна в слизовій оболонці кишечнику. Такі імуномодулюючі ефекти є сприятливими для хазяя, оскільки вони допомагають досягнути підвищеної опірності до захворювання і зниженого ризику виникнення алергій. Відомо, що грамнегативні бактерії в ШКТ експонують молекулу ліпополісахариду (LPS) на їх поверхні, які індукують продукцію прозапальних сигналів клітинами слизової оболонки кишечнику. Пробіотична добавка може змінити дану ситуацію, щоб сприяти ще більшій присутності грампозитивних бактерій в ШКТ (об'єднаних в групу молочнокислих бактерій) з кращою екологічною пристосовуваністю або з антагоністичними властивостями відносно деяких грамнегативних мікроорганізмів. Незважаючи на це, деякі пробіотичні мікроорганізми демонструють здатність модулювати per se продукцію цитокінів, які є сигналізуючими молекулами, які регулюють запалення і імунні реакції в організмі. Зокрема, деякі пробіотичні бактерії індукують появу більш збалансованого патерна між про/антизапальною передачею сигналів в слизовій оболонці кишечнику (незалежно від впливу на грамнегативні бактерії). Як буде проілюстровано нижче, було виявлено, що штами композиції за винаходом сприяють зниженню рівнів запальних цитокінів (IFN-γ і IL-6), таким чином, індукуючи появу нормалізованого патерна цитокінів в слизовій оболонці кишечнику. Такий імуномодулюючий ефект доповнений антагоністичними властивостями штаму відносно зниження присутності патогенних грамнегативних бактерій в ШКТ. Відомо, що нежиттєздатні бактерії, так само як бактеріальні компоненти можуть мати імуномодулюючі ефекти per se. Наприклад, клітинні компоненти виду Lactobacilli, як повідомили, індукували протизапальні цитокіни (Pathmakanthan S. et al., 2004) або знижували прозапальні цитокіни (Zhang L. et al., 2005). При виділенні таких компонентів передбачається операція фармацевтичної категорії. Беручи до уваги показані нижче результати, ясно, що штами CECT 7483, CECT 7484 і CECT 7485, що складають композицію по першому аспекту винаходу, характеризуються певними особливостями, такими як: виживання при проходженні в шлунково-кишковому тракті, адгезія до слизової оболонки кишечнику, стійкість до окислювального стресу, продукція метаболітів з протизапальною активністю (або коротколанцюжкових жирних кислот, або інших продуктів з вказаною активністю) і відсутність антагонізму між ними. Композиція і виділені штами за даним винаходом, очевидно, не походять з відомого рівня техніки, оскільки вони є результатом комплексного дослідження, і результати, які були отримані відносно дії на запалення кишечнику, є несподіваними. Протоколи визначення кожної з вказаних особливостей приведені нижче. Зі змісту даної заявки фахівець в даній галузі може виявити інші штами, що належать Lactobacillus і роду Pediococcus, і, більш конкретно, до виду Lactobacillus plantarum і Pediococcus acidilactici, яких при введенні окремо або спільно в одній композиції виявляють такі ж пробіотичні і терапевтичні ефекти, що і штами, які описуються в даній заявці. У другому аспекті, винахід стосується композиції, що містить ефективну кількість штамів за винаходом або їх мутантних штамів для застосування як лікарського препарату. Зокрема, було виявлено, що композиція, яка містить штами CECT 7483, CECT 7484 і CECT 7485 має протизапальну активність в кишечнику в моделях IBD. Як пояснювалося вище, запалення кишечнику являє собою одну з основних характеристик IBD. Таким чином, композиція по першому аспекту винаходу застосовна для профілактики або лікування вказаного захворювання. Отже, в третьому аспекті, винахід стосується композиції, як визначено в першому аспекті винаходу, для застосування в профілактиці або лікуванні запалення кишечнику у тварини, включаючи людину. Даний аспект можна альтернативно сформулювати як застосування композиції, як визначено в першому аспекті винаходу, для отримання лікарського препарату для профілактики лікування запалення кишечнику. Даний аспект можна альтернативно сформулювати як спосіб профілактики і/або лікування запалення кишечнику у тварини, включаючи людину, що включає введення вказаній тварині при необхідності ефективної кількості композиції, як визначено в першому аспекті винаходу. 4 UA 109123 C2 5 10 15 20 25 30 35 40 45 50 55 60 У одному з варіантів здійснення третього аспекту за винаходом, композицію застосовують для лікування або профілактики запального захворювання кишечнику. З даних, отриманих при використанні моделей IBD, описаних в прикладах (дивись нижче), виходить, що введення штамів за винаходом, які ефективні при лікуванні станів, що характеризуються запаленням кишечнику і діареєю, також може бути застосовне для лікування інших станів, що характеризуються запаленням слизової оболонки або підслизової оболонки кишечнику і де переважаючою є діарея, таких як ентерит, викликаний променевою терапією або хіміотерапією. Ентерит є поширеним побічним ефектом при променевій терапії черевної порожнини і таза, вражаючи 60-70 % пацієнтів. Ентерит може змусити змінити графік в режимі променевої терапії для зменшення побічних ефектів, потенційно приводячи до недостатньо оптимальної протипухлинної ефективності лікування. У даний момент не існує превентивних стратегій викликаного променевою терапією ентериту. Однак, деякі пробіотики, як було показано, є дуже перспективними в рандомізованих клінічних випробуваннях (RCT). Пробіотична композиція, така як за даним винаходом, що поєднує сприяючі зміцненню здоров'я ефекти продукції SCFA, здатність протистояти активним формам кисню і азоту, виявленим в запаленій слизовій оболонці, і протимікробну активність відносно умовно-патогенних мікроорганізмів, може бути застосовна для лікування викликаного променевою терапією і хіміотерапією ентериту. З іншого боку, автори даного винаходу виявили, що штами за даним винаходом ефективні в лікуванні IBS. Як показано нижче, композиція по першому аспекту винаходу застосовна для лікування IBS, як оцінено в рандомізованому подвійному сліпому контрольованому плацебо інтервенційному дослідженні. Отже, в четвертому аспекті даний винахід стосується композиції по першому аспекту винаходу для застосування в профілактиці і/або лікуванні IBS. Даний аспект можна альтернативно сформулювати як застосування композиції, як визначено в першому аспекті винаходу, для отримання лікарського препарату для профілактики і/або лікування IBS. Даний аспект можна альтернативно сформулювати як спосіб профілактики і/або лікування IBS у тварини, включаючи людину, що включає введення вказаній тварині, потребуючій цього, ефективної кількості композиції, як визначено в першому аспекті винаходу. Крім того, автори даного винаходу виявили, що завдяки характеристикам штамів композиція по першому аспекту винаходу застосовна для лікування здуття і розтягнення живота. Як показано нижче, коли композицію за винаходом вводять людям, які страждають на здуття і розтягнення живота, спостерігають несподіване поліпшення. Отже, в п'ятому аспекті даний винахід стосується композиції по першому аспекту винаходу для застосування в лікуванні здуття і розтягнення живота. Даний аспект можна альтернативно сформулювати як застосування композиції, як визначено в першому аспекті винаходу, для отримання лікарського препарату для лікування здуття і розтягнення живота. Даний аспект можна альтернативно сформулювати як спосіб лікування здуття і розтягнення живота у тварини, включаючи людину, що включає введення вказаній потребуючій цього тварині ефективної кількості композиції, як визначено в першому аспекті винаходу. Несподіваний позитивний вплив, що спостерігається у людей, які страждають IBS і/або на здуття і розтягнення живота, може бути наслідком факту, що штами за винаходом CECT 7483, CECT 7484 і CECT 7485 мають здатність продукувати SCFA, перераховані в таблиці 6, і антагоністичну активність, показану в таблиці 3. На існуючому рівні техніки добре відомо, що SCFA модулюють перистальтику кишечнику. Зокрема, SCFA, як відомо, стимулюють вивільнення серотоніну (5-HT) в товстій кишці щура (Fukumoto S. et al., 2003; Tazoe H. et al., 2008), який відіграє основну роль в регуляції як перистальтики, так і чутливості кишечнику. Схожим чином, масляна кислота, як було описано, знижує вісцеральну чутливість кишечнику у людей-добровольців (Vanhoutvin S. A. et al., 2009). З цього можна зробити висновок, що штами, які складають композицію за винаходом, можна застосовувати для лікування не тільки IBS або болю в животі, але також інших станів, пов'язаних з шлунково-кишковою перистальтикою і/або шлунково-кишковим болем, таких як функціональний запор або функціональна діарея. Композиція і виділені штами за даним винаходом, очевидно, не походять з відомого рівня техніки, оскільки вони є результатом комплексного дослідження, і результати, які були отримані відносно ефективності при лікуванні IBS і здуття і розтягнення живота є несподіваними. На подив, автори даного винаходу уперше виявили штам Pediococcus acidilactici зі здатністю лікування IBD і IBS. Вказана здатність, як вважають, не будучи пов'язаною з теорією, є наслідком певних властивостей виділеного штаму Pediococcus, на які вказується протягом всьому опису. У світлі ідей і протоколів, що пропонуються в даному описі, фахівець в даній 5 UA 109123 C2 5 10 15 20 25 30 35 40 45 50 55 галузі зможе виявити додаткові штами Р. acidilactici з такими ж пробіотичними і терапевтичними характеристиками, що і об'єкт даної заявки. Композиції за винаходом, які містять ефективну кількість штамів за винаходом або їх мутантів, можна приготувати як придатні до вживання в їжу, фармацевтичні або ветеринарні продукти, в яких вказані штами являють собою єдині активні речовини або які змішані з однією або декількома іншими активними речовинами і/або змішані з фармацевтично прийнятними або прийнятними у ветеринарній практиці наповнювачі (у випадку фармацевтичного або ветеринарного продукту) або відповідними добавками (у випадку придатного до вживання в їжу продукту). У конкретному варіанті здійснення винаходу продукти додатково містять одну або декілька додаткових активних речовин. Переважно, додаткова активна речовина або речовини являють собою інші пробіотичні бактерії, які не є антагоністичними штамам, що складає композицію за винаходом. Залежно від препарату штами можна додавати як очищені бактерії, як бактеріальну культуру, як частину бактеріальної культури, як бактеріальну культуру, яка піддавалась обробці, і як такі або спільно з відповідними носіями або інгредієнтами. Також можна додавати пребіотики. У інших аспектах винахід стосується фармацевтичних і ветеринарних продуктів, які містять ефективну кількість композиції за винаходом спільно з відповідною кількістю фармацевтично прийнятних або прийнятних у ветеринарній практиці наповнювачів. У цьому відношенні, фармацевтичний препарат можна отримувати в будь-якому відповідному вигляді, який не впливає негативно на біодоступність штамів, що складають композицію за винаходом. Таким чином, композицію за винаходом, яку будуть вводити перорально, можна приготувати, наприклад, у вигляді ліофілізованого порошку, капсул, рідких препаратів і так далі. Вибір наповнювачів і найбільш відповідних способів для препарату, беручи до уваги конкретну мету композиції, знаходиться в рамках компетенції звичайних фахівців в даній галузі фармацевтичної технології. Хоч пероральне введення є переважним, можливі інші форми, такі як ін'єкційні, ректальні або місцеві. Термін "фармацевтично прийнятний" як застосовують в цьому документі стосується сполук, речовин, композицій і/або лікарських форм, які в рамках ретельної медичної оцінки, придатні для використання в контакті з тканинами пацієнта (наприклад, людини) без надмірної токсичності, подразнення, алергічної реакції або іншої проблеми або ускладнення, відповідно до доцільного співвідношення сприятливий вплив/ризик. Кожнийносій, наповнювач і так далі також повинен бути "прийнятним" в сенсі того, щоб бути сумісним з іншими інгредієнтами препарату. Прийнятні носії, наповнювачі і так далі можна знайти в стандартному фармацевтичному посібнику. Аналогічно, термін "прийнятний у ветеринарній практиці" означає придатний для використання в контакті з тканинами тварини, що не належить людині. Штами за винаходом можуть також входити до складу різних продуктів харчування, таких як молочні продукти, йогурт, домашній сир, сир (наприклад, кварк, вершковий, плавлений, м'який і твердий), сквашене молоко, сухе молоко, продукт на основі сквашеного молока, морозиво, продукт на основі збродженої злакової культури, порошок на основі молока, напій, соус і корм для тварин. Термін "продукт харчування" застосовується в цьому документі в своєму найбільш широкому значенні, що включає будь-який тип продукту, у будь-якому вигляді представлення, який може проковтнути тварина, але, виключаючи фармацевтичні і ветеринарні продукти. Приклади інших продуктів харчування являють собою м'ясні продукти (наприклад, паштет з печінки, сосиски і ковбаса типу салямі або м'ясна паста), шоколадну пасту, начинки (наприклад, трюфель, вершки) і глазур, шоколад, кондитерські вироби (наприклад, карамель, помадки або іриска), хлібобулочні вироби (пироги, печива), соуси і супи, фруктові соки і вершки для кави. Особливо цікаві харчові продукти являють собою дієтичні добавки і дитячі суміші. У значенні даного винаходу дієтичні добавки також включають в себе нутріцевтики, які, як відомо, є екстрактами продуктів харчування, які мають медичний ефект на здоров'я людини. Корми для харчування тварин також включені в об'єм винаходу. Композиції за винаходом можна також використовувати як інгредієнти в інших харчових продуктах. Відповідно, в іншому аспекті за винаходом, описаний продукт харчування, який містить композицію за винаходом спільно з відповідними кількостями придатних до вживання в їжу інгредієнтів. Переважно, композиція за винаходом являє собою дієтичну добавку. Ефективна кількість колонієутворювальних одиниць (КУО) для кожного штаму в композиції буде визначатися фахівцем в даній галузі і буде залежати від готового препарату. Наприклад, в 5 продуктах харчування штам або штами присутні в кількості приблизно від 10 КУО/г до 12 7 12 приблизно 10 КУО/г, переважно, в кількості приблизно від 10 КУО/г до приблизно 10 КУО/г, згідно з чинним законодавством. Термін "колонієутворювальні одиниці" ("КУО") визначається як 6 UA 109123 C2 5 10 15 20 25 30 35 40 45 50 55 кількість бактеріальних клітин, як виявляється при мікробіологічному підрахунку на чашці з агаровим середовищем. 7 12 Дієтичні добавки звичайно містять пробіотичні штами в кількості в діапазоні від 10 і 10 КУО/г. У конкретному варіанті здійснення композиція за винаходом являє собою дієтичну 9 11 добавку, що містить в діапазоні 10 -10 КУО/г. Штами за винаходом отримують культивуванням бактерій у прийнятному середовищі і при відповідних умовах. Штами можна культивувати окремо для отримання чистої культури або як змішану культуру спільно з іншими мікроорганізмами або, культивуючи бактерії різних типів окремо і потім об'єднуючи їх в необхідних співвідношеннях. Після культивування клітинну суспензію відбирають і використовують як таку або обробляють бажаним чином, наприклад, концентруючи або ліофілізуючи, щоб далі застосовувати в приготуванні фармацевтичних продуктів або продуктів харчування. Іноді пробіотичні препарати піддають способу іммобілізування або інкапсулювання для того, щоб збільшити термін придатності. Декілька методик для іммобілізування або інкапсулювання бактерій відомі в даній галузі. Якщо композицію за винаходом застосовують як дієтичну добавку, її можна вводити як таку, можна змішувати з відповідною придатною для питва рідиною, такою як вода, йогурт, молоко або фруктовий сік, або можна змішувати з твердою або рідкою їжею. У даному контексті дієтична добавка може знаходитися у вигляді таблеток, драже, капсул, гранул, порошків, суспензій, саше, пастилок, цукерок, пластинок, сиропів і відповідних форм введення, звичайно у вигляді однократної дози. Переважно, композицію за винаходом вводять у вигляді таблеток, капсул або порошків, отриманих загальноприйнятими способами отримання фармацевтичних препаратів. Протягом всьому опису і формули винаходу слово "містити" і його варіанти не призначені для того, щоб виключити інші технічні характеристики, добавки, компоненти або стадії. Додаткові об'єкти, переваги і особливості винаходу стануть очевидними для фахівців в даній галузі при вивченні опису або їх можна дізнатися при практичному застосуванні винаходу. Крім того, даний винахід охоплює всі можливі комбінації особливих і переважних варіантів здійснення, що описуються в цьому документі. КОРОТКИЙ ОПИС КРЕСЛЕНЬ На фіг. 1 представлені патерни розщепленої Not-I або Sfi-I (зліва) і Sma-I (праворуч) геномною ДНК при гель-електрофорезі в пульсуючому полі для: 1, Pediococcus acidilactici CECT 7483; 2, Lactobacillus plantarum CECT 7484; 3, Lactobacillus plantarum CECT 7485. Як контроль: 4, комерційний штам Р. acidilactici Rossell1001 (Institut Rossell, Канада); 5, L. plantarum 299v (Probi AB, Швеція); і 6, штам L. plantarum, виділений з комерційного продукту VSL#3 (VSL Pharmaceuticals, США). Дана фігура стосується розділу "генотипування штаму". На фіг. 2 представлений індекс активності хвороби (Y-вісь) в групі мишей, які страждають на викликане DSS запалення кишечнику. На X-осі представлено введення: a, пробіотичного препарату за винаходом в групі мишей, які страждають на викликане DSS запалення кишечнику; b, комерційного пробіотичного препарату (VSL#3) в групі мишей, які страждають на викликане DSS запалення кишечнику; с, носія в групі мишей, які страждають на викликане DSS запалення кишечнику; і d, носія в здоровій контрольній групі. Дана фігура стосується розділу "Вплив in vivo на хімічно викликане запалення кишечнику". На фіг. 3 представлені рівні IL-6 (Y-вісь) в групі мишей, які страждають на викликане DSS запалення кишечнику. По X-осі представлені: a, пробіотичний препарат за винаходом, що вводиться групі мишей, які страждають на викликане DSS запалення кишечнику; b, комерційний пробіотичний препарат (VSL#3), що вводиться групі мишей, які страждають на викликане DSS запалення кишечнику; с, носій, що вводиться групі мишей, які страждають на викликане DSS запалення кишечнику; і d, носій в здоровій контрольній групі. Дана фігура стосується розділу "Вплив in vivo на хімічно викликане запалення кишечнику". На фіг. 4 представлена кількість безсимптомних тижнів (тобто, кількість тижнів до появи першого симптому, таким чином, при індексі активності хвороби, який дорівнює нулю) (Y-вісь) в моделі миші, нокаутованій по гену IL-10. На X-осі представлено введення: a, пробіотичного препарату за винаходом групі мишей, нокаутованих по гену IL-10; b, комерційного пробіотичного препарату VSL#3 групі мишей, нокаутованих по гену IL-10; с, PBS групі мишей, нокаутованих по гену IL-10; і d, носія в здоровій контрольній групі. Дана фігура стосується розділу "Вплив in vivo на спонтанне запалення кишечнику". На фіг. 5 представлені рівні IFN-γ (Y-вісь) в моделі мишей, нокаутованих по гену IL-10. На Xосі представлений: a, пробіотичний препарат за винаходом в групі мишей, нокаутованих по гену IL-10; b, комерційний пробіотичний препарат VSL#3 в групі мишей, нокаутованих по гену IL-10; 7 UA 109123 C2 5 10 15 20 25 30 35 40 45 50 с, носій в групі мишей, нокаутованих по гену IL-10; і d, носій в здоровій контрольній групі. Дана фігура стосується розділу "Вплив in vivo на хімічно викликане запалення кишечнику". На фіг. 6 представлені рівні IL-6 (Y-вісь) в моделі мишей, нокаутованих по гену IL-10. На Xосі представлений: a, пробіотичний препарат за винаходом в групі мишей, нокаутованих по гену IL-10; b, комерційний пробіотичний препарат VSL#3 в групі мишей, нокаутованих по гену IL-10; с, носій в групі мишей, нокаутованих по гену IL-10; і d, носій в здоровій контрольній групі. Дана фігура стосується розділу "Вплив in vivo на хімічно викликане запалення кишечнику". На фіг. 7 представлена зміна оцінки IBSQoL в порівнянні з вихідним рівнем (Y-вісь) у добровольців, що отримували капсули, які містять композицію (чорний прямокутник) або плацебо (білий прямокутник). На X-осі представлена зміна оцінки на 21 день і через 42 дні лікування. Дана фігура стосується частини "Поліпшення пов'язаної зі станом здоров'я якості життя" в розділі "Ефективність in vivo у пацієнтів з IBS". На фіг. 8 представлена зміна оцінки VSI в порівнянні з вихідним рівнем (Y-вісь) у добровольців, що отримували капсули, які містять композицію (чорний прямокутник) або плацебо (білий прямокутник). На X-осі представлена зміна оцінки після трьох тижнів і після шести тижнів лікування. Дана фігура стосується частини "Поліпшення вісцеральної чутливості" в розділі "Ефективність in vivo у пацієнтів з IBS". ПРИКЛАДИ У наступних нижче розділах описані характеристики штамів за винаходом, їх специфічні пробіотичні особливості і їх фізіологічні впливи на шлунково-кишкову і імунну системи. Як застосовують надалі, штам F1033 відповідає CETC 7483 Pediococcus acidilactici, штам F2064 відповідає CECT 7484 Lactobacillus plantarum і штам F2076 відповідає CECT 7485 Lactobacillus plantarum. 1. Виділення мікроорганізмів A) Способи Для виділення мікроорганізмів збирали свіжі випорожнення і слину (Daniel C. et al., 2006) у дітей у віці 0-5 років і розчиняли в буфері PBS (pH 7,4), ділили на аліквоти і вміщували в MRS, доповнене різними комбінаціями антибіотиків. Штами культивували в умовах, сприятливих для мікроаерофілів (5 % CO2) при 37ºC. Час інкубації залежав від швидкості росту, але нормально проходив від 24 год. до 3 днів. Фарбування по Граму проводили для того, щоб отримати першу ідентифікацію. Як тільки вони зростали, виділені штами зберігали при ліофілізації в PBS 0,1Х з 15 % сухим знежиреним молоком. B) Результати Нові штами F2064, F2076 і F1033 вирощували на агарі MRS, доповненому ванкоміцином в кількості 10 г/мл. Мікроскопічне дослідження показало, що штами F2064 і F2076 є грампозитивними бацилами, в той час як штам F1033 є грампозитивним з морфологією, властивою коковим мікроорганізмам. 2. Ідентифікація A) Способи Геномну ДНК витягували, використовуючи набір для очищення геномної ДНК Wizard (Promega). Для кожного штаму, що виділяється, ген 16S ампліфікували за допомогою ПЛР, застосовуючи універсальні праймери 27f, 357f, 907r і 1492r (Weisburg W.G. et al., 1991), які дозволяють отримати майже повнорозмірний фрагмент рРНК 16S (1465 п.н.). ДНК відмивали, використовуючи набір Quiaquick kit (Quiagene, GmbH, Хільден, Німеччина) і чотири реакції секвенування на зразок проводили, використовуючи набір BigDye v.3.1, на аналізаторі Genetic Analyzer 3130 (Applied Biosystems). Програмне забезпечення для вибраних праймерів для секвенування DNA Sequence Analysis v.5.2 (Applied Biosystems) застосовували для збору даних і побудови хроматограм, які аналізували за допомогою програмного забезпечення Chromas (Technelysium Pty Ltd.) і BioEdit (Ibis Biosciencies). Ідентифікацію роду і виду проводили, порівнюючи отриману послідовність з послідовностями 16S відомих організмів як з бази даних RefSeq (http://www.ncbi.nlm.nih.gov/RefSeq/) за допомогою пошуку BLASTN (Altschul S.F. et al., 1990), так і з Ribosomal Database Project (Wang Q. et al., 2007). 8 UA 109123 C2 Таблиця 1 Праймери, використані для ампліфікації і секвенування гена 16S Стадія Праймер Напрямок Послідовність 5'3' 27f прямий AGAGTTTGATCCTGGCTCAG (SEQ ID NO:1) Ампліфікація 1492r зворотний GGTTACCTTGTTACGACTT (SEQ ID NO:2) 27f прямий AGAGTTTGATCCTGGCTCAG (SEQ ID NO:1) CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCCCCGCCCCCCTACGGGAGGCAGCAG 357f прямий (SEQ ID NO:3) Секвенування 907r зворотний CCGTCAATTCCTTTGAGTTT (SEQ ID NO:4) 1492r зворотний GGTTACCTTGTTACGACTT (SEQ ID NO:2) 5 10 15 20 25 30 35 40 45 50 B) Результати Штами F2064 і F2076 ідентифікували як представники групи Lactobacillus plantarum. Штам F1033 ідентифікували як Pediococcus acidilactici. 3. Виживаність в ШТ тракті A) Способи Для того щоб оцінити стійкість до кислого середовища, аліквоти по 20 мкл культури кожного бактеріального штаму вміщували в 96-ямкові планшети разом з аліквотами по 200 мкл середовища MRS, доведеного за допомогою HCl до величини pH 2 і 3 (Panreac). Планшети тримали при 37ºC протягом 1 год. і вимірювали оптичну густину при 620 нм. У кінці, життєздатні клітини визначали, підраховуючи мікроорганізми на чашках і порівнюючи з кількістю життєздатних клітин в інокуляті. Для того щоб оцінити стійкість до солей жовчних кислот, аліквоти по 20 мкл культури кожного бактеріального штаму вміщували в 96-ямковий планшет разом з аліквотами по 200 мкл середовища MRS, доповненого 0,5 % Oxgall (Sigma). Планшети інкубували при 37ºC і 5 % CO2 протягом 3 годин і потім вимірювали оптичну густину. У кінці, життєздатні клітини визначали, підраховуючи мікроорганізми на чашках і порівнюючи з кількістю життєздатних клітин в інокуляті. B) Результати Всі три штами показали хорошу здатність виживати в кислому середовищі при зниженні менше ніж на одиницю по логарифмічній шкалі через 1 год. інкубації в MRS при величині pH=2 або pH=3. Штами також мали виражену стійкість до солей жовчних кислот при зниженні числа життєздатних клітин менше ніж на 50 % через 3 год. інкубації в MRS, доповненому 0,5 % солями жовчних кислот. 4. Адгезія A) Способи Кишечник свині промивали PBS з величиною pH 7,4, що містить 0,01 % желатин і суміш інгібіторів протеаз (Completeо, Sigma). Слизову оболонку розрізали на дрібні шматки і розчиняли в буфері HEPES-Hank (10 мМ HEPES, pH 7,4) (Collado M. et al., 2007), який містить вказані вище інгібітори. Потім, слиз центрифугували при 13000 об./хв. протягом 10 хв., використовуючи той же самий буфер. Надосадові рідини витягували і визначали вміст білка по протоколу Бредфорда. За 24 год. до аналізу 1 мл розчину слизу в концентрації 0,5 мг/мл інкубували в ямках 24-ямкового планшета для ELISA. Кожний штам, який будуть тестувати, вирощували протягом ночі в середовищі MRS, доповненому міченим тритієм тимідином (5 мкл в 3 мл MRS). Культури центрифугували і 8 доводили до 10 КУО/мл в PBS, підраховуючи в камері з сіткою Нейбауера, і зразки кожної культури забирали, щоб визначити кількість вбудованого міченого тритієм тимідину, за допомогою сцинтиляційного пристрою для зчитування. Потім 0,5 мл додавали до ямок 24ямкового планшета, які містять слиз, і інкубували при 37ºC протягом 60 хв. Надосадову рідину в кожній ямці видаляли і ямки двічі промивали середовищем MEM Alpha (Gibco), щоб видалити слабко прилиплі бактерії. У кінці, ямки розламувала, щоб отримати слиз разом з прилиплими бактеріями, і вимірювали радіоактивність. Специфічну активність (імп/хв/КУО) кожної культури 8 обчислювали із загальної радіоактивності, включеної в суспензію PBS, доведеного до 10 КУО/мл. Lactobacillus rhamnosus GG (Valio Ltd, Фінляндія) застосовували як позитивний контроль через його незвичайно високу адгезію до епітелію кишечнику (Jacobsen C. N. et al., 1999). Клітини Caco-2 були отримані з ATCC (ECACC № 86010202). Клітини висівали в 24-ямкові планшети і дозволяли їм рости в DMEM до злиття (37ºC, 5 % CO2). Експериментальна процедура для отримання кількості бактерій, які прилипають на одиницю площі клітин caco-2, є по суті такою ж як приведена вище для адгезії до слизу. B) Результати 9 UA 109123 C2 5 10 Здатність до адгезії штамів F1033, F2064 і F2076 вимірювали по сцинтиляції міченого тритієм тимідину і порівнювали з сцинтиляцією для комерційного штаму GG L. rhamnosus. Адгезія до епітеліальних клітин з використанням моделі Caco-2 є поширеним аналізом для пробіотичних штамів. У порівнянні з L. rhamnosus GG штами F2064 і F2076 показали на 60 % меншу афінність до епітеліальних клітин. Однак, беручи до уваги високу афінність L. rhamnosus GG до епітеліальних клітин, такі значення порівнянні з іншими добре відомими пробіотиками, такими як L. plantarum 299v, і вища, ніж для множини інших пробіотичних штамів (Jacobsen C. N. et al., 1999). З іншого боку, адгезія штаму F1033 до епітеліальних клітин в 2,5 рази вища, ніж у L. rhamnosus GG. Крім того, штами F2076 і F2064 виявили набагато більш високу афінність до слизу кишечнику, ніж для епітеліальних клітин, в той час як штам F1033 продемонстрував протилежну поведінку. Результати показані в наступній нижче таблиці. Таблиця 2 8 Адгезія до слизу пробіотичних бактеріальних штамів. [*Від загальної концентрації бактерій 10 КУО] 2 2 Штам Caco-2 (КУО/см ) Слиз (КУО/см ) 5 4 F1033 1,21±0,1710 КУО 6,06±0,7310 КУО 4 6 F2064 1,89±0,1210 КУО 2,25±0,1210 КУО 4 5 F2076 1,71±0,1610 КУО 5,91±0,0310 КУО 4 6 L.rhamnosus GG 4,41±0,2210 КУО 3,29±0,5710 КУО 15 20 25 30 5. Антагоністична здатність А) Способи Застосовували індикаторні штами, які йдуть нижче: Р. mirabilis CECT 4557, K. oxytoca CIP 103434, С. perfrinqens ATCC 13124, С. ramosum ATCC 25582, Е. faecalis CETC 795, Y. pseudotuberculosis ATCC29833, В. vulqatus ATCC 8482 і В. thetaiotaomicron ATCC2079 являли собою колекційні штами. С. albicans, S. enterica thyphimurium, S. enterica cholerasuis, С. jejuni, Е. coli і P. aeruginosa являли собою лабораторні ізоляти. Індикаторні штами одноманітно наносили тампоном в планшети, що містять відповідне середовище (Oxoid) і вирощували до злиття при відповідній температурі в умовах, сприятливих для мікроаерофілів (5 % CO2). Потім, циліндричні ділянки по 6 мм (в діаметрі) агарових пластин з F1033 F2064 або F2076, що злилися, вміщували вгору дном на пластини з індикаторним штамом і інкубували протягом ночі при 37ºC. На наступний день вимірювали зони інгібуючої дії, розміщуючи агарову пластину за правилом плоскої поверхні. Інгібуючу ріст активність (GI) обчислювали, як зазначено нижче: , де IZD являє собою діаметр зони інгібуючої дії і CD являє собою діаметр циліндра, виміряний в міліметрах. B) Результати 10 UA 109123 C2 Таблиця 3 Інгібуюча ріст активність (GI) пробіотичних штамів відносно 12 патогенних або потенційно патогенних штамів і відносно 2 загальновідомих умовно-патогенних штамів шлунково-кишкової флори F2064 F2076 F1033 Патогенні мікроорганізми C.albicans 2 0,5 1,25 S.enterica typhimurium 1 1 0,25 S.enterica cholerasuis 1 1 0,5 E.coli 1,75 3,7 1,1 C.jejuni 0 0 4,75 K.oxytoca 0,5 1 2 P.mirabilis 4 1,5 0,5 P.aeruqinosa 3 3,75 4,5 E.faecalis 1,75 1 1,25 C.perfrinqens 2,25 3,75 1,75 C.ramosum 1,25 1,75 0,5 Y.pseudotuberculosis 5,5 3,4 4,5 Умовно-патогенні мікроорганізми B.thetaiotaomicron 0,4 0,4 0,5 B.vulqatus 0,3 0,5 0,7 5 10 15 20 25 30 Штами F2064, F2076 і F1033 виявляли значну інгібіторну активність відносно Candida albicans і декілька потенційно патогенних бактерій. З іншого боку, штами виявляли мінімальну активність відносно умовно-патогенних штамів роду Bacteroides, що повсюдно зустрічається у природженій шлунково-кишковій флорі. Також штами F2064, F2076 і F1033 між собою не виявляли значної інгібіторної активності. Примітно, що штам F1033 є єдиним штамом, що виявляє високу інгібіторну активність відносно Campylobacter jejuni, в той час як штам F2076 виділяється при інгібуванні Escherichia coli і штам F2064 - при інгібуванні і Candida albicans, і Proteus mirabilis. 6. Антиоксидантна здатність A) Способи 9 Аліквоти по 20 мкл залишених на ніч культур кожного штаму (приблизно 10 КУО/мл) вміщували в 96-ямковий планшет. 200 мкл MRS, доповненого 10 мМ параквату (C 12H14Cl2N2, донором супероксид-аніону) або 10 мМ нітропрусиду натрію (Na2[Fe(CN)5NO], донором оксиду азоту), додавали в ямки і планшети інкубували при 37ºC і 5 % CO2. Оптичні густини зчитували при 620 нм через 6 год. Результати виражали як процент росту в порівнянні з ростом в стандартному середовищі MRS. Такого ж протоколу дотримувалися для штаму GG L. rhamnosus і штаму L. plantarum, виділеного з комерційного препарату VSL#3 (виділення проводили, застосовуючи стандартні способи). B) Результати Окислювальний стрес визначають як порушення балансу між появою активних форм кисню (ROS) і ослабленими антиоксидантними захисними системами. Окислювальний стрес розвивається, зокрема, при запальних реакціях, оскільки запальні клітини, нейтрофіли, і макрофаги продукують великі кількості ROS (Rezaie A. et al., 2007; Roessner A. et al., 2008). Штами F1033, F2064 і F2076 продемонстрували здатність виживати в жорстких окислювальних умовах в порівнянні з добре відомим штамом L. rhamnosus GG, а також зі штамом L. plantarum, виділеним з препарату VSL#3. Варто зазначити, що штам F2076 виявляв більш високу стійкість як до параквату (донору супероксид-аніону), так і до нітропрусиду натрію (донору оксиду азоту). Стійкість до окислювального стресу є бажаною особливістю для пробіотичних штамів, які, як очікують, виживають в оточенні запаленої слизової оболонки. 11 UA 109123 C2 Таблиця 4 Процент росту в середовищі, що містить 10 мМ параквату або нітропрусиду натрію, в порівнянні зі стандартним середовищем MRS Штам % ріст в паракваті % ріст в нітропрусиді натрію L.rhamnosus GG 70±10 99±17 L.plantarum VSL#3 61±4 88±10 F1033 67±9 76±22 F2064 61±18 67±8 F2076 72±1 104±19 5 10 15 20 25 30 35 7. Генотування штаму A) Способи Штами F1033, F2064 і F2076 піддавались обробці по раніше описаному протоколу (Rodas A. M. et al., 2005) з незначними модифікаціями. Штами ростили на чашках з агаровим середовищем MRS і інкубували при 37ºC 5 % CO2 протягом 18 год. Клітини збирали і 3 рази промивали в 8 мл PET (10 мМ Tris pH 7,6, 1M NaCl), потім 10 хв. центрифугували при 6000 об./хв. Осади ресуспендували в 700 мл лізуючого буфера (6 мМ Tris, 1M NaCl, 0,1 M ЕДТА, 0,5 % SLS, 0,2 % дезоксихолева кислота; лізоцим 1 мг/мл; мутанолізин 40 од/мл; 20 мг/мл RNase). Однаковий об'єм 1,6 % агарози з низькою температурою плавлення (FMC BioProducts, Рокленд, ME, США) додавали до ресуспендованих клітин і дозволяли статися твердінню при 4ºC протягом 1 год. Вставки переносили до 2 мл лізуючого буфера II (0,5 M ЕДТА pH 9,2, 1 % Nлаурилсаркозин і 1 мг/мл пронази) і інкубували при 50ºC протягом 48 год. Потім вставки промивали при кімнатній температурі буфером TE (10 мМ Tris, 1 мМ ЕДТА pH 8,0). Розщеплення повної ДНК проводили окремо рестрикційними ферментами Sfi-I і Sma-I (Roche Diagnostics). Електрофорез в пульсуючому полі проводили, застосовуючи пристрій CHEF DRIII (BioRad Laboratories). Вставки завантажували в 1 % агарозний гель (агароза SeaKem ME, FMC BioProducts, ME, США). ДНК-маркери MW являли собою Lambda ladder PFG Marker і Low Range PFG Marker (New England Biolabs). Після електрофорезу гелі забарвлювали бромистий етидієм і УФ, використовуючи систему GelDoc (BioRad). B) Результати На фіг. 1 показані отримані профілі на електрофорезі в пульсуючому полі. Для штаму F1033 показаний геномний рестрикційний профіль схожий з Р. acidilactici R1001 після розщеплення з використанням Sma-I. Однак, геномний профіль, що отримується після розщеплення з використанням ферменту Not-I, явно відрізняється. З іншого боку, геномні рестрикційні профілі штамів F2064 і F2076 явно розрізнюються між собою і також в порівнянні і з L. plantarum 299v, і зі штамом L. plantarum, що міститься в препараті VSL#3. 8. Продукція коротколанцюжкових жирних кислот A) Способи Штами інкубували протягом ночі в мінімальному середовищі (дивись таблицю 5), доповненому різними волокнами, кожне (інулін, пектин і FOS) в певній кількості, в умовах, сприятливих для мікроаерофілів (5 % CO2) при 37ºC. Далі, клітини видаляли за допомогою центрифугування при 12000 об./хв. протягом 10 хв. і надосадові рідини фільтрували і заморожували в рідкому азоті і зберігали при -80ºC до аналізу за допомогою газової хроматографії, звертаючи особливу увагу на кількість оцтових, пропіонових і масляних кислот. Таблиця 5 Сполука Пептон Дріжджовий екстракт NaCl K2HPO4 KH2PO4 MgSO4·7H2O CaCl2·6H2O NaHCO3 Гемін HCl цистеїн Сіль жовчної кислоти Концентрація 2 г/л 2 г/л 0,1 г/л 0,04 г/л 0,04 г/л 0,01 г/л 0,01 г/л 2 г/л 0,05 г/л 0,5 г/л 0,5 г/л 12 UA 109123 C2 2 г/л 10 мкл 10 г/л 10 г/л 10 г/л Tween 80 Вітамін К1 Інулін Пектин FOS 5 10 B) Результати Коротколанцюжкові жирні кислоти (SCFA) є кінцевими продуктами розщеплення вуглеводів анаеробними бактеріями в товстій кишці. SCFA, в основному, ацетат, пропіонат і бутират становлять приблизно 80 % концентрації аніонів в товстій кишці і продукуються в майже постійному молярному співвідношенні 62:22:15. Серед їх різних властивостей, SCFA, особливо, масляна кислота, але також і оцтова і пропіонова кислота, легко всмоктуються слизовою оболонкою кишечнику, з відносно високим вмістомкалорій, метаболізуються колоноцитами і гепатоцитами, стимулюють всмоктування натрію і води в товстій кишці і тропні до слизової оболонки кишечнику (D'Argenio G. et al., 1999). З іншого боку, високі кількості оцтової кислоти, як тривалий час було відомо, подразнюють слизову оболонку кишечнику (Yamada Y. et al., 1992). Штами F1033, F2064 і F2076 є потужними продуцентами або оцтової, або пропіонової, або масляної кислоти. Таблиця 6 Продукування оцтовою, пропіоновою і масляною кислот штамами, вирощеними на мінімальному середовищі, збагаченому інуліном, пектином і FOS Пропіонова кислота Масляна кислота Штам Оцтова кислота (мг/мл) (мг/мл) (мг/мл) L.rhamnosus GG n.d. n.d. 7,7 F1033 n.d. n.d. 21,4 F2064 n.d. 30,2 9,7 F2076 46,5 n.d. n.d. (n.d.=не визначено) 15 20 25 30 9. Сумісність з препаратами для лікування IBD A) Спосіб Бульйон з добавками готували, розчиняючи 5-аміносаліцилову кислоту (Pentasa®, Ferring Pharmaceuticals) в максимально розчинній концентрації (0,84 г/л) і в половині від даної концентрації (0,42 г/л) в рідкому бульйоні MRS. Штами за винаходом вирощували в стандартному бульйоні MRS або в бульйоні, доповненому 5-аміносаліциловою кислотою, протягом 4 год. при 37ºC в умовах, сприятливих для мікроаерофілів (5 % CO2) і ріст оцінювали, вимірюючи оптичну густину при 620 нм. Результати виражали як процент росту в стандартному середовищі MRS. B) Результати Тривале лікування від легких до помірних симптомів IBD звичайно проводять, застосовуючи аміносаліцилати (похідні 5-ASA) для перорального застосування (Katz J.A., 2007). Отже, цікаво оцінити, чи можна пробіотичні штами за винаходом вводити спільно з похідними 5-ASA. Беручи до уваги, що ріст жодного з вказаних штамів повністю не інгібується, незважаючи на високу суворість умов, автори заявки можуть укласти, що спільне введення месалазину, ймовірно, не зменшує ефективність пробіотика, навіть при використанні насиченої концентрації месалазину (0,84 г/л), як показано в таблиці 7: VSL#3 F1033 F2064 F2076 35 4 год. (% росту) 0,42 г/л 0,84 г/л 56,2 38,1 72,7 60,6 59,7 48,0 51,6 22,1 Таблиця 7 8 год. (% росту) 0,42 г/л 0,84 г/л 43,2 35,1 51,8 42,3 62,3 55,1 50,2 22,5 10. Вплив in vivo на хімічно викликане запалення кишечнику A) Способи Терапевтичний ефект композиції за винаходом на легкий ступінь запалення кишечнику досліджували при 5-денному багаторазовому пероральному введення декстрану сульфату 13 UA 109123 C2 5 10 15 20 25 30 натрію (DSS) миші (Okayasu I. et al., 1990). При застосуванні в низькій дозі (2,5-3 %) протягом короткого періоду часу (5 днів) DSS викликає легкий коліт з кишковим запаленням на гістологічному рівні, але без значних макроскопічних змін (наприклад, укорочення товстої кишки, мезентеріального злипання). Зовнішні симптоми включають в себе втрату ваги і діарею з рідкими випадками крові в калі. Отже, дана модель є репрезентативною для виразкового коліту в легкій формі. Штами F1033, F2064 і F2076 ліофілізували в стерильній воді із 15 % знежиреним молоком і 4 % сахарозою як кріопротектори і змішували в однакових кількостях (співвідношення в концентрації 1:1:1). Мишей Balb/с у віці восьми тижнів (Charles River, Барселона, Іспанія), що важать 20-25 г, утримували в безпатогенних (SPF) умовах в ізоляторі (Harlan Iberica, Барселона, Іспанія) при постійній температурі (22ºC) з 12-годинним циклом чергування світла/темряви. Дві миші виступали як однопометні тварини. Миші мали вільний доступ до стерильної їжі (стандартна дієта для лабораторії; Harlan Iberica, Барселона, Іспанія) і до питної рідини. Мишей протягом 7 днів утримували у віварії до початку експерименту (карантин). Мишей розподіляли в одну з чотирьох груп: a) пробіотична композиція за винаходом + DSS (n=8); b) VSL#3 (VSL Pharmaceuticals, США) + DSS (n=8); c) носій + DSS (n=8); і d) носій + здорові контролі (n=6). Пробіотики (або носій) вводили за допомогою перорального примусового харчування протягом десяти днів (день - 10) до початку введення DSS (день 0). Кожна миша щодня 8 отримувала 2,5×10 КУО пробіотика в 0,1 мл стерильної води (носій) за допомогою примусового харчування. Миші, які не отримували пробіотика, отримували такий же об'єм носія (дистильована вода із 15 % знежиреним молоком і 4 % сахарозою). Мишам давали 3 % (мас./об.) DSS (мол. в. 40 кДа, Applichem Lifescience, VWR, Барселона) в їх питній воді протягом 5 днів (дні з 0 по 4, після чого йшло три дні без DSS) згідно з раніше описаним протоколом з невеликими модифікаціями (Okayasu I, et al. Gastroenterol 1990). Здорові контролі ніколи не отримували DSS. Клінічні симптоми відстежували щодня. Індекс активності хвороби обчислювали по наступній нижче формулі і таблиці інтерпретації даних: DAI = Оцінкавтрата ваги+Оцінкакров в калі+Оцінкаконсистенція калу Результати показані в таблиці 8: Втрата ваги 15 % Кров в калі Відсутність Рясна кровотеча 4 Консистенція калу Оформлений і твердий Оформлений, але м'який Рідке випорожнення Легка форма діареї (водяниста) Сильна діарея Таблиця 8 Оцінка 0 1 2 3 4 Оцінка індексу активності хвороби, що застосовується в цьому документі, уперше описана Cooper et al. і об'єднує декілька клінічних симптомів в одну нормалізовану оцінку (Cooper H.S. et al., 1993). Максимальна оцінка становить 12 одиниць. Дана оцінка широко використовувалася для оцінки ефективності експериментальних терапій - пробіотиками серед них - в моделях IBD на тваринах (Fitzpatrick L.R. et al., 2007; Grabig A. et al., 2006; Sasaki M. et al., 2005). Після умертвіння передозуванням анестезуючого засобу вдихуваного галотану (Fluotane®, Zeneca Ltd, Великобританія), зразки товстої кишки тварин збирали і промивали в холодному PBS. Реєстрували співвідношення ваги/довжини товстої кишки. Зразки для визначення цитокінів заморожували в рідкому азоті і гомогенізували в 1 мл холодного PBS зі сумішшю інгібіторів протеаз (Sigma-Aldrich Chem., Іспанія) і центрифугували (15000×g, 10 хв.). Концентрації IL-6, IL10, IL23p19, IFN-γ і TNF-α вимірювали в надосадових рідинах товстої кишки, застосовуючи Cytokine 6-Plex Assay (Procarta™ Cytokine Profiling Kit, PANOMICS, Іспанія) для платформи Luminex® (Luminex® Co, Остін, США). Намистини з флуоресцентними мікрочастинками із заздалегідь нанесеними специфічними для цитокінів антитілами інкубували з 50 мкл розбавленої в співвідношенні 1:5 надосадової рідини. Послідовно додавали специфічно біотинільовані вторинні антитіла і стрептавідин-фікоеритрин (S-PE). Дані виражали як пг цитокіну на мг білка (Quick Start Bradford Protein Assay, BIO-RAD, CA, США). Всі вимірювання проводили в двох повторах. B) Результати Індекс активності хвороби 14 UA 109123 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як показано на фіг. 2, група, що отримувала пробіотичний препарат за винаходом, продемонструвала значне поліпшення клінічних симптомів при порівнянні з DSS контролями, що отримували, як оцінювали по індексу активності хвороби (р0,05). IL-6 являє собою маркер гострого запалення (фіг. 3). Як очікували, рівні IL-6 у здорових контролів були також значно нижчими, ніж у контролів, що отримували DSS (р
ДивитисяДодаткова інформація
Назва патенту англійськоюProbiotic composition for use in the treatment of bowel inflammation
Автори англійськоюEspadaler Mazo, Jordi, Cune Castellana, Jordi
Автори російськоюЭспадалер Масо Хорди, Кунье Кастельяна Хорди
МПК / Мітки
МПК: C12R 1/01, C12R 1/25, A61K 35/747, A61P 1/06, A61K 35/744, C12N 1/20
Мітки: композиція, запалення, пробіотична, лікуванні, застосування, кишечнику
Код посилання
<a href="https://ua.patents.su/27-109123-probiotichna-kompoziciya-dlya-zastosuvannya-v-likuvanni-zapalennya-kishechniku.html" target="_blank" rel="follow" title="База патентів України">Пробіотична композиція для застосування в лікуванні запалення кишечнику</a>
Попередній патент: Синергічна гербіцидна композиція, яка містить амінопіралід і 2,4-дихлорфеноксіоцтову кислоту
Наступний патент: Ревізійний люк, що закривається, для повноскладального будівництва
Випадковий патент: Генератор інертного газу