Похідна бензилпіперазину, її застосування при лікуванні різних розладів та фармацевтична композиція, що її містить
Номер патенту: 93878
Опубліковано: 25.03.2011
Автори: Джонсон Крістофер Норберт, МакФерсон Девід Тімоті, Стемп Джеффрі, Стенвей Стівен Джеймс, Томсон Мервін, Вестевей Сьюзен Марі
Формула / Реферат
1. Сполука формули (І) або її фармацевтично прийнятна сіль:
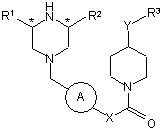 , (І)
, (І)
де:
А являє собою феніл або піридил;
R1 являє собою водень або метил,
R2 являє собою водень або метил,
R3 є необов'язково заміщеним фенілом,
Y являє собою NH або О;
X являє собою (CR4R5)n;
n дорівнює 1 або 2; та
R4 і R5 незалежно вибрані з водню або метилу, та, коли R3 означає заміщений феніл, він може бути заміщеним одним-двома замісниками, вибраними з фтору, ціано, трифторметилу та метокси.
2. Сполука за п. 1, де (піперазиніл)метиленовий замісник і X знаходяться в пара-положенні по відношенню один до одного в кільці А.
3. Сполука за будь-яким з пп. 1, 2, де R1 і R2 є відмінними від водню, й піперазинові С*-атоми вуглецю мають 3R,5S-кoнфiгypaцiю.
4. Сполука за п. 1, вибрана з:
1-[(4-{[(3R,5S)-3,5-димeтил-1-пiпepaзинiл]мeтил}фeнiл)aцeтил]-N-(4-фтopфeнiл)-4-піперидинаміну;
N-(3-фторфеніл)-1-[(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидинаміну;
N-(4-фторфеніл)-1-[(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидинаміну;
3-({1-[(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидиніл}аміно)-бензонітрилу;
4-({1-[(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидиніл}аміно)-бензонітрилу;
N-(3,4-дифторфеніл)-1-[(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидинаміну;
N-[4-фтор-3-(метилокси)феніл]-1-[(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)-ацетил]-4-піперидинаміну;
(3S)-1-(2-{4-[(4-фторфеніл)окси]-1-піперидиніл}-2-оксоетил)феніл]метил}-3-метилпіперазину;
(3S)-1-{[4-(2-{4-[(3-фторфеніл)окси]-1-піперидиніл}-2-оксоетил)феніл]метил}-3-метилпіперазину;
1-[(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)ацетил]-N-[3-(трифторметил)феніл]-4-піперидинаміну;
1-[(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)ацетил]-N-[4-(трифторметил)феніл]-4-піперидинаміну;
N-(3-фторфеніл)-1-{[4-(1-піперазинілметил)феніл]ацетил}-4-піперидинаміну;
N-(3-фторфеніл)-1-[(4-{[(3R)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидинаміну;
N-(3,4-дифторфеніл)-1-[(4-{[(3R)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидинаміну;
(3R)-1-{[4-(2-{4-[(4-фторфеніл)окси]-1-піперидиніл}-2-оксоетил)феніл]метил}-3-метилпіперазину;
(3R)-1-{[4-(2-{4-[(3-фторфеніл)окси]-1-піперидиніл}-2-оксоетил)феніл]метил}-3-метилпіперазину;
4-({1-[(4-{[(3R)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидиніл}окси)-бензонітрилу;
4-({1-[(4-{[(3R)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидиніл}аміно)-бензонітрилу;
3-({1-[(4-{[(3R)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидиніл}аміно)-бензонітрилу;
1-[(4-{[(3R)-3-метил-1-піперазиніл]метил}феніл)ацетил]-N-[3-(трифторметил)феніл]-4-піперидинаміну;
N-(3-фторфеніл)-1-[(3-(метилокси)-4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)-ацетил]-4-піперидинаміну;
2-фтор-5-({1-[(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидиніл}-аміно)бензонітрилу;
1-[3-(4-{[(3R,5S)-3,5-диметил-1-піперазиніл]метил}феніл)пропаноїл]-N-(4-фторфеніл)-4-піперидинаміну;
1-[3-(4-{[(3R,5S)-3,5-диметил-1-піперазиніл]метил}феніл)пропаноїл]-N-(3-фторфеніл)-4-піперидинаміну;
N-(4-фторфеніл)-1-[3-(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)пропаноїл]-4-піперидинаміну;
N-(3-фторфеніл)-1-[3-(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)пропаноїл]-4-піперидинаміну;
1-[2-(4-{[(3R,5S)-3,5-димедил-1-піперазиніл]метил}феніл)пропаноїл]-N-(4-фторфеніл)-4-піперидинаміну;
1-[2-(4-{[(3R,5S)-3,5-диметил-1-піперазиніл]метил}феніл)пропаноїл]-N-(3-фторфеніл)-4-піперидинаміну;
1-[2-(4-{[(3R,5S)-3,5-диметил-1-піперазиніл]метил}феніл)-2-метилпропаноїл]-N-(4-фторфеніл)-4-піперидинаміну;
1-[2-(4-{[(3R,5S)-3,5-диметил-1-піперазиніл]метил}феніл)-2-метилпропаноїл]-N-(3-фторфеніл)-4-піперидинаміну;
(3R,5S)-1-{[4-(2-{4-[(4-фторфеніл)окси]-1-піперидиніл)-1,1-диметил-2-оксоетил)феніл]метил}-3,5-диметилпіперазину;
N-(3-фторфеніл)-1-[3-(5-{[(3S)-3-метил-1-піперазиніл]метил}-2-піридиніл)пропаноїл]-4-піперидинаміну;
1-[(3-хлор-4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)ацетил]-N-(3-фторфеніл)-4-піперидинаміну;
N-(2-фторфеніл)-1-[(4-{[(3R)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидинаміну;
N-(3-фторфеніл)-1-[(5-{[(3S)-3-метил-1-піперазиніл]метил}-2-піридиніл)ацетил]-4-піперидинаміну;
2-({1-[(4-{[(3R)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидиніл}аміно)бензонітрилу;
гідрохлориду 2-фтор-4-({1-[(4-{[(3S)-3-метил-1-іперазиніл]метил}феніл)ацетил]-4-піперидиніл}аміно)бензонітрилу.
5. Сполука за п. 1 або п. 4, яка являє собою
N-(3-фторфеніл)-1-[(4-{[(3S)-3-метил-1-піперазиніл]метил}феніл)ацетил]-4-піперидинамін.
6. Застосування сполуки за будь-яким з пп. 1-5 для лікування станів або розладів, опосередкованих GPR38-рецепторами.
7. Застосування за п. 6, у якому стан або розлад являє собою розлади типу гастроезофагеального рефлюксу, функціональну диспепсію, синдром подразненої кишки, запор, кишкову псевдонепрохідність, паралітичну непрохідність кишечнику після хірургічного втручання або іншої маніпуляції, блювання, шлунковий застій або гіпокінезію, викликану різними хворобами, такими як діабет, і/або введенням інших ліків, хворобу Крона, коліт, кахексію, асоційовану з задавненими захворюваннями, такими як рак і/або наслідки його лікування, порушення апетиту/метаболізму, пов'язане з кахексією, та інші розлади, як-от нетримання.
8. Застосування сполуки за будь-яким з пп. 1-5 для приготування лікарського засобу для лікування станів або розладів, опосередкованих GРR38-рецепторами.
9. Застосування за п. 8, у якому стан або розлад являють собою розлади типу гастроезофагеального рефлюксу, функціональну диспепсію, синдром подразненої кишки, запор, кишкову псевдонепрохідність, паралітичну непрохідність кишечнику після хірургічного втручання або іншої маніпуляції, блювання, шлунковий застій або гіпокінезію, викликану різними захворюваннями, такими як діабет, і/або введенням інших ліків, хворобу Крона, коліт, кахексію, асоційовану з задавненими захворюваннями, такими як рак і/або наслідки його лікування, порушення апетиту/метаболізму, пов'язане з кахексією, та інші розлади, як-от нетримання.
10. Фармацевтична композиція, що містить як активний інгредієнт сполуку за будь-яким з пп. 1-5.
Текст
УКРАЇНА (19) UA (11) 93878 (13) C2 (51) МПК (2011.01) C07D 401/10 (2006.01) A61K 31/496 A61P 1/08 (2006.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) ПОХІДНА БЕНЗИЛПІПЕРАЗИНУ, ЇЇ ЗАСТОСУВАННЯ ПРИ ЛІКУВАННІ РІЗНИХ РОЗЛАДІВ ТА ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ, ЩО ЇЇ МІСТИТЬ X O , (І) де: А являє собою феніл або піридил; R1 являє собою водень або метил, R2 являє собою водень або метил, R3 є необов'язково заміщеним фенілом, Y являє собою NH або О; X являє собою (CR4R5)n; n дорівнює 1 або 2; та 4 5 R і R незалежно вибрані з водню або метилу, та, коли R3 означає заміщений феніл, він може бути заміщеним одним-двома замісниками, вибраними з фтору, ціано, трифторметилу та метокси. 2. Сполука за п. 1, де (піперазиніл)метиленовий замісник і X знаходяться в пара-положенні по відношенню один до одного в кільці А. C2 (13) 93878 N A (11) N 3. Сполука за будь-яким з пп. 1, 2, де R1 і R2 є відмінними від водню, й піперазинові С*-атоми вуглецю мають 3R,5S-кoнфiгypaцiю. 4. Сполука за п. 1, вибрана з: 1-[(4-{[(3R,5S)-3,5-димeтил-1пiпepaзинiл]мeтил}фeнiл)aцeтил]-N-(4-фтopфeнiл)4-піперидинаміну; N-(3-фторфеніл)-1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидинаміну; N-(4-фторфеніл)-1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидинаміну; 3-({1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)-бензонітрилу; 4-({1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)-бензонітрилу; N-(3,4-дифторфеніл)-1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидинаміну; N-[4-фтор-3-(метилокси)феніл]-1-[(4-{[(3S)-3метил-1-піперазиніл]метил}феніл)-ацетил]-4піперидинаміну; (3S)-1-(2-{4-[(4-фторфеніл)окси]-1-піперидиніл}-2оксоетил)феніл]метил}-3-метилпіперазину; (3S)-1-{[4-(2-{4-[(3-фторфеніл)окси]-1-піперидиніл}2-оксоетил)феніл]метил}-3-метилпіперазину; 1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-N-[3(трифторметил)феніл]-4-піперидинаміну; 1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-N-[4(трифторметил)феніл]-4-піперидинаміну; N-(3-фторфеніл)-1-{[4-(1піперазинілметил)феніл]ацетил}-4-піперидинаміну; N-(3-фторфеніл)-1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидинаміну; N-(3,4-дифторфеніл)-1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидинаміну; (3R)-1-{[4-(2-{4-[(4-фторфеніл)окси]-1-піперидиніл}2-оксоетил)феніл]метил}-3-метилпіперазину; UA (21) a200800922 (22) 24.07.2006 (24) 25.03.2011 (86) PCT/EP2006/007390, 24.07.2006 (31) 0515381.2 (32) 26.07.2005 (33) GB (31) 0611469.8 (32) 09.06.2006 (33) GB (46) 25.03.2011, Бюл.№ 6, 2011 р. (72) ДЖОНСОН КРІСТОФЕР НОРБЕРТ, GB, МАКФЕРСОН ДЕВІД ТІМОТІ, GB, СТЕНВЕЙ СТІВЕН ДЖЕЙМС, GB, СТЕМП ДЖЕФФРІ, GB, ТОМСОН МЕРВІН, GB, ВЕСТЕВЕЙ СЬЮЗЕН МАРІ, GB (73) ГЛАКСО ГРУП ЛІМІТЕД, GB (56) WO 01/85694 A (ORTHO MCNEIL PHARM INC [US]), 15.11.2001 (57) 1. Сполука формули (І) або її фармацевтично прийнятна сіль: H R3 R1 R2 N * * Y 2 (19) 1 3 93878 4 (3R)-1-{[4-(2-{4-[(3-фторфеніл)окси]-1-піперидиніл}2-оксоетил)феніл]метил}-3-метилпіперазину; 4-({1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}окси)-бензонітрилу; 4-({1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)-бензонітрилу; 3-({1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)-бензонітрилу; 1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-N-[3(трифторметил)феніл]-4-піперидинаміну; N-(3-фторфеніл)-1-[(3-(метилокси)-4-{[(3S)-3метил-1-піперазиніл]метил}феніл)-ацетил]-4піперидинаміну; 2-фтор-5-({1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидиніл}аміно)бензонітрилу; 1-[3-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)пропаноїл]-N-(4фторфеніл)-4-піперидинаміну; 1-[3-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)пропаноїл]-N-(3фторфеніл)-4-піперидинаміну; N-(4-фторфеніл)-1-[3-(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)пропаноїл]-4піперидинаміну; N-(3-фторфеніл)-1-[3-(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)пропаноїл]-4піперидинаміну; 1-[2-(4-{[(3R,5S)-3,5-димедил-1піперазиніл]метил}феніл)пропаноїл]-N-(4фторфеніл)-4-піперидинаміну; 1-[2-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)пропаноїл]-N-(3фторфеніл)-4-піперидинаміну; 1-[2-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)-2-метилпропаноїл]-N-(4фторфеніл)-4-піперидинаміну; 1-[2-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)-2-метилпропаноїл]-N-(3фторфеніл)-4-піперидинаміну; (3R,5S)-1-{[4-(2-{4-[(4-фторфеніл)окси]-1піперидиніл)-1,1-диметил-2оксоетил)феніл]метил}-3,5-диметилпіперазину; N-(3-фторфеніл)-1-[3-(5-{[(3S)-3-метил-1піперазиніл]метил}-2-піридиніл)пропаноїл]-4піперидинаміну; 1-[(3-хлор-4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-N-(3-фторфеніл)4-піперидинаміну; N-(2-фторфеніл)-1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидинаміну; N-(3-фторфеніл)-1-[(5-{[(3S)-3-метил-1піперазиніл]метил}-2-піридиніл)ацетил]-4піперидинаміну; 2-({1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)бензонітрилу; гідрохлориду 2-фтор-4-({1-[(4-{[(3S)-3-метил-1іперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)бензонітрилу. 5. Сполука за п. 1 або п. 4, яка являє собою N-(3-фторфеніл)-1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін. 6. Застосування сполуки за будь-яким з пп. 1-5 для лікування станів або розладів, опосередкованих GPR38-рецепторами. 7. Застосування за п. 6, у якому стан або розлад являє собою розлади типу гастроезофагеального рефлюксу, функціональну диспепсію, синдром подразненої кишки, запор, кишкову псевдонепрохідність, паралітичну непрохідність кишечнику після хірургічного втручання або іншої маніпуляції, блювання, шлунковий застій або гіпокінезію, викликану різними хворобами, такими як діабет, і/або введенням інших ліків, хворобу Крона, коліт, кахексію, асоційовану з задавненими захворюваннями, такими як рак і/або наслідки його лікування, порушення апетиту/метаболізму, пов'язане з кахексією, та інші розлади, як-от нетримання. 8. Застосування сполуки за будь-яким з пп. 1-5 для приготування лікарського засобу для лікування станів або розладів, опосередкованих GРR38рецепторами. 9. Застосування за п. 8, у якому стан або розлад являють собою розлади типу гастроезофагеального рефлюксу, функціональну диспепсію, синдром подразненої кишки, запор, кишкову псевдонепрохідність, паралітичну непрохідність кишечнику після хірургічного втручання або іншої маніпуляції, блювання, шлунковий застій або гіпокінезію, викликану різними захворюваннями, такими як діабет, і/або введенням інших ліків, хворобу Крона, коліт, кахексію, асоційовану з задавненими захворюваннями, такими як рак і/або наслідки його лікування, порушення апетиту/метаболізму, пов'язане з кахексією, та інші розлади, як-от нетримання. 10. Фармацевтична композиція, що містить як активний інгредієнт сполуку за будь-яким з пп. 1-5. Даний винахід відноситься до нових похідних бензилпіперазину, що володіють фармакологічною активністю, до способів їх одержання, фармацевтичних композицій, що містять їх, і їх застосування при лікуванні різних розладів. GPR38 являє собою 7-трансмембранний, спарений з G-білком рецептор, з високою спорідненістю до пептиду мотиліну [Feighner et al., Science 1999, 284, 2184], що дозволяє припускати, що вся або велика частина ендогенного мотиліну опосередкована через цей рецептор. Мотилін являє собою пептид, що складається з 22 амінокислот, знайдений у великих кількостях у межах ендокриноподібних клітин шлунковокишкового тракту, і особливо в межах дванадцятипалої кишки-порожньої кишки. За відсутності їжі пептид, як відомо, пов'язаний з початком активності комплексу фази III, що переміщається, у межах 5 шлунку [Boivin et al., Dig. Dis. Sci. 1992, 37, 1562], що дозволяє припускати роль у механізмах прокінетичної активності. Мотилін також вивільняється з кишки в процесі їжі, мнимої годівлі, розтягання шлунку або шляхом перорального або внутрішньовенного введення живильної речовини [Christofides et al., Gut 1979, 20, 102; Bormans et al., Scand. J. Gastroenterol. 1987, 22, 781], що припускає додаткові функції цього пептиду при модуляції режимів перистальтики протягом годівлі. У тварин або у людини мотилін, як давно відомо, підвищує шлунково-кишкову перистальтику і сприяє спорожнюванню шлунку і кишковому поступальному руху в напрямку заднього проходу, під час як станів відсутності їжі, так і їжі. Ця активність, як думають, виявляється, головним чином, завдяки полегшенню щонайменше холінергічної збудливої функції кишки [Van Assche et al., Eur. J. Pharmacol. 1997, 337, 267], можливо також включаючи активацію блукаючого нерву [Mathis & Malbert, Am. J. Physiol. 1998, 274, G80]. Крім того, більш високі концентрації мотиліну безпосередньо індукують невелике скорочення м'яза [Van Assche et al., Eur. J. Pharmacol. 1997, 337, 267]. Антибіотик еритроміцин, як було показано, імітує шлунково-кишкову активність мотиліну, на додаток до його описаних раніше антибіотичних властивостей [див. Peeters, in Problems of the Gastrointestinal Tract in Anaesthesia Ed., Herbert MK et al. Springer- Verlag, Berlin, Heidelberg 1999, pp 39-51]. He дуже давно було показано, що еритроміцин активує СРР38-рецептор, підтверджуючи його здатність імітувати функцію мотиліну [Carreras et al., Analyt. Biochem. 2002, 300, 146]. Крім того, приступність цього непептидного агоніста мотилінового рецептора дозволила почати щонайменше деякі клінічні дослідження для того, щоб вивчити клінічний потенціал агоністів мотилінового рецептора. Ці дослідження узгоджено продемонстрували здатність підвищувати спорожнювання шлунку в різних станах, асоційованих з парезом шлунку, таким як функціональна диспепсія і діабетичний парез шлунку. Крім того, еритроміцин, як було показано, збільшує тиск нижнього стравохідного сфінктера у людини, що, разом із прискоренням спорожнювання шлунку, допускає роль при лікуванні розладу типу гастроезофагеального рефлюксу (GERD). У кінцевому рахунку, еритроміцин був використаний для промотування кишкової просуваючої активності, знайшовши клінічне застосування при лікуванні псевдо-непрохідності та при станах з порушеною перистальтикою товстої кишки [Peeters, in Problems of the Gastrointestinal Tract in Anaesthesia Ed., Herbert MK et al. SpringerVerlag, Berlin, Heidelberg 1999, pp. 39-51]. Отже, очікується, що агоністи GPR38рецептора будуть імітувати активність мотиліну і знаходити клінічне застосування при лікуванні шлунково-кишкових розладів, асоційованих з гіпокінезією, особливо функціональних кишкових розладів, таких як GERD, функціональна диспепсія (FD) і синдром подразненої кишки (IBS). Також сполуки будуть застосовні для лікування інших GI станів, де причина відома і в яких Gl-моторика знижена. Такі стани включають запор, викликаний 93878 6 різними хворобами, такими як ті, що асоційовані з невропатією, і/або введенням інших ліків, кишковою псевдо-непрохідністю, паралітичною непрохідністю кишечнику після хірургічного втручання або деяких інших маніпуляцій, шлункового застою або гіпокінезії, викликаної різними хворобами, такими як діабет, і/або введенням інших ліків. Цікаво, що здатність мотиліну або еритроміцину активувати блукаючий нерв, асоціація цього нерву зі змінами в харчовій поведінці [наприклад, Fumess et al., Auton. Neurosci. 2001, 92, 28] і хромосомному положенні GPR38 [ґрунтуючись на Ensembl: 13q21.1 (58,46-59,46 Mb)] у межах маркерів (D13S25713q14.11 до D13S258 при 13q21.33) локусу, асоційованого з ожирінням [Feitosa et al., Am. J. Hum. Genet. 2002, 70, 72] також допускає, що агоністи, активні у відношенні GPR38-peцeптopa, будуть, на додаток до промотування шлунково-кишкової рухливості, полегшувати поведінку під час їжі щонайменше у тих пацієнтів, у яких є присутнім деякий ступінь придушення апетиту або кахексії. Така активність указує, що агоністи цього рецептора знайдуть клінічне застосування при лікуванні симптомів, асоційованих, наприклад, з лікуванням раку або присутністю раку як такого. Крім здатності агоністів мотилінового рецептора промотувати шлунково-кишкову рухливість, зв'язок поліморфізму мотилінового гену з хворобою Крона [Annese et al., Dig. Dis. Sci. 1998, 43, 715-710] і зміни в щільності мотилінового рецептора під час коліту [Depoortere et al., Neurogastroenterol. Motil. 2001, 13, 55] припускає застосування агоністів мотилінового рецептора для лікування запальних кишкових станів взагалі. Нарешті, GPR38 також був знайдений в ділянках поза шлунково-кишковим трактом. Ці ділянки включають гіпофіз, жирову тканину, сечовий міхур і визначені ділянки мозку. Попередні дані припускають клінічне застосування при стимуляції функції гіпофізу, такої як вивільнення агентів, що активують секрецію гормону росту, присутність у межах жирової тканини також припускає роль у контролі маси тіла, і присутність у межах сечового міхура припускає значимість агоністів цього рецептора при лікуванні нетримання. Присутність GPR38 у межах мозку підтримує вже згадані шлунково-кишкові функції і функції харчування, але, крім того, припускає залучення рецептора у великий спектр вагусно-гіпоталамічних функцій. У WO9410185, ЕР838469, WO9823629, DE19805822 і US6165985 заявлені похідні еритроміцину, спрямовані на GPR38 для застосування при розладах, пов'язаних зі шлунково-кишковою рухливістю. У WO9921846, WO0185694, WO0168620, WO0168621 і WO0168622 розкриті серії низькомолекулярних антагоністів GPR38рецептора. У JP07138284 і ЕР807639 розкриті пептидні агоністи. У JP09249620, WO02092592, WO05027637, US2005065156 і Li et al., (2004, Journal of Medicinal Chemistry, 47(7) p. 1704-1708) розкриті серії низькомолекулярних агоністів. В даний час знайдений структурно новий клас сполук, що є частковими або повними агоністами GPR38-рецептора. 7 Таким чином, даний винахід представляє сполуки формули (І) або їх фармацевтично прийнятні солі або сольвати: де: А являє собою феніл або 6-членне гетероарильне кільце, необов'язково заміщене галогеном, С1-4алкілом або С1-4алкокси; R1 і R2 незалежно являють собою Η або С14алкіл; R3 являє собою необов'язково заміщений феніл або необов'язково заміщений 5- або 6-членний гетероарил; X являє собою (CR4R5)n; n дорівнює 1 або 2; Υ являє собою ΝΗ, О або СН2; R4 і R5 незалежно вибрані з водню і С1-4алкілу. Коли R3 є заміщеним, він може мати 1, 2 або 3 замісника, кожен незалежно вибраний з галогену, С1-4алкілу, С1-4алкокси, С3-7циклоалкілу, гідрокси, трифторметокси, трифторметилу, нітро, ціано, 8 8 9 8 8 фенілу, NH2, NHR , NR R , NHCOR , NHSO2R , C(O)CF3, С(О)С1-4алкілу, С(О)С3-7циклоалкілу, С(О)ОС1-4алкілу, С(О)ОС3-7циклоалкілу, ОС(О)С1-4алкілу, ОС(О)С3-7циклоалкілу, CONH2, CONHR8, CONR8R9, SOR9, SO2R9, OSO2R9, OSO2CF3, SO2NH2, SO2NHR8, SO2NR8R9, де R8 і R9 можуть бути однаковими або різними і являти собою С1-4алкіл, феніл, необов'язково заміщений галогеном або 5- або 6-членним гетероарилом, необов'язково заміщеним галогеном. Термін "алкіл" у вигляді групи або частини групи, наприклад, алкокси або гідроксіалкіл, відноситься до лінійної або розгалуженої алкільної групи у всіх ізомерних формах. Термін "С1-4алкіл" відноситься до алкільної групи, як визначено вище, що містить щонайменше 1 і щонайбільше 4 атоми вуглецю. Приклади таких алкільних груп включають метил, етил, пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил або трет-бутил. Приклади таких алкоксигруп включають метокси, етокси, пропокси, ізопропокси, бутокси, ізобутокси, вторбутокси і трет-бутокси. Використовуваний у даному описі термін "галоген" відноситься до фтору (F), хлору (СІ), брому (Вr) або йоду (І); і термін "галоїд" відноситься до галогенів: фтору (-F), хлору (-СІ), брому (-Вr) і йоду (-І). Термін "гетероарил" представляє 5- або 6членне ненасичене кільце, що включає один або декілька гетероатомів. Коли термін гетероарил представляє 5-членну групу, вона містить гетероатом, вибраний з О, N або S, і може необов'язково містити додатково від 1 до 3 атомів азоту. Коли гетероарил представляє 6-членну групу, вона міс 93878 8 тить від 1 до 3 атомів азоту. Приклади таких 5- або 6-членних гетероарильних кілець включають пірроліл, триазоліл, тіадіазоліл, тетразоліл, імідазоліл, піразоліл, ізотіазоліл, тіазоліл, ізоксазоліл, оксазоліл, оксадіазоліл, фуразаніл, фураніл, тієніл, піридил, піримідиніл, піразиніл, піридазиніл і триазиніл. В одному варіанті здійснення винаходу А являє собою феніл або піридил; R1 являє собою водень або метил; R2 являє собою водень або метил; R3 являє собою необов'язково заміщений феніл; Υ являє собою ΝΗ або О; X являє собою (CR4R5)n; n дорівнює 1 або 2; і R4 і R5 незалежно являють собою водень або метил. В іншому варіанті здійснення винаходу А являє собою феніл; R1 являє собою водень або метил; R2 являє собою водень або метил; R3 являє собою необов'язково заміщений феніл; Υ являє собою ΝΗ або О; і X являє собою (CR4R5)n; n дорівнює 1 або 2; і R4 і R5 обоє являють собою водень. Коли R3 являє собою заміщений феніл, він може бути заміщений одним-двома замісниками, вибраними з фтору, ціано, трифторметилу і метокси. У наступному варіанті здійснення винаходу (піперазиніл) метиленовий замісник і X розташовані в пара-положенні по відношенню один до одного в кільці А. У визначених сполуках формули (І), у залежності від природи замісника, є хіральні атоми вуглецю, такі як атом вуглецю, позначений символом "*", і, отже, сполуки формули (І) можуть існувати у вигляді стереоізомерів. Винахід поширюється на всі оптичні ізомери, такі як стереоізомерні форми сполук формули (І) включаючи енантіомери, діастереоізомери і їх суміші, такі як рацемати. Різні стереоізомерні форми можуть бути розділені або розщеплені одна від одної традиційними способами, або будь-який даний ізомер може бути отриманий традиційними стереоселективними або асиметричними синтезами. Кращі сполуки формули (І), де R1 і R2 обоє являють собою метил, є сполуками, у яких піперазинові С* атоми вуглецю мають цис-конфігурацію. Відповідно до винаходу визначені сполуки можуть існувати в різних таутомерних формах, і буде зрозуміло, що винахід охоплює всі такі таутомерні форми. Придатні сполуки за винаходом являють собою: 1-[(4-{[(3R,5S)-3,5-димeтил-1пiпepaзинiл]мeтил}фeнiл)aцeтил]-N-(4-фторфеніл)4-піперидинамін (Е1); N-(3-фторфеніл)-1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін (Е2); 9 N-(4-фторфеніл)-1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін (Е3); 3-({1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)бензонітрил (Е4); 4-({1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)бензонітрил (Е5); N-(3,4-дифторфеніл)-1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін (Е6); N-[4-фтор-3-(метилокси)феніл]-1-[(4-{[(3S)-3метил-1-піперазиніл]метил}феніл)ацетил]-4піперидинамін (Е7); (3S)-1-{[4-(2-{4-[(4-фторфеніл)окси]-1піперидиніл}-2-оксоетил)феніл]метил}-3метилпіперазин (Е8); (3S)-1-{[4-(2-{4-[(3-фторфеніл)окси]-1піперидиніл}-2-оксоетил)феніл]метил}-3метилпіперазин (Е9); 1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-N-[3(трифторметил)феніл]-4-піперидинамін (Е10); 1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-N-[4(трифторметил)феніл]-4-піперидинамін (Е11); N-(3-фторфеніл)-1-{[4-(1піперазинілметил)феніл]ацетил}-4-піперидинамін (Е12); N-(3-фторфеніл)-1-[(4-{[(3Р)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін (Е13); N-(3,4-дифторфеніл)-1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін (Е14); (3R)-1-{[4-(2-{4-[(4-фторфеніл)окси]-1піперидиніл}-2-оксоетил)феніл]метил}-3метилпіперазин (Е15); (3R)-1-{[4-(2-{4-[(3-фторфеніл)окси]-1піперидиніл}-2-оксоетил)феніл]метил}-3метилпіперазин (Е16); 4-({1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}окси)бензонітрил (Е17); 4-({1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)бензонітрил (Е18); 3-({1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)бензонітрил Е19); 1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-N-[3(трифторметил)феніл]-4-піперидинамін (Е20); N-(3-фторфен1л)-1-[(3-(метилокси)-4-{[(3S)-3метил-1-піперазиніл]метил}феніл)ацетил]-4піперидинамін (Е21); 2-фтор-5-({1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)бензонітрил (Е22); 1-[3-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)пропаноїл]-N-(4фторфеніл)-4-піперидинамін (Е23); 93878 10 1-[3-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)пропаноїл]-N-(3фторфеніл)-4-піперидинамін (Е24); N-(4-фторфеніл)-1-[3-(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)пропаноїл]-4піперидинамін (Е25); N-(3-фторфеніл)-1-[3-(4-{[(3S)-3-метил-1піперазинил]метил}феніл)пропаноїл]-4піперидинамін (Е26); 1-[2-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)пропаноїл]-N-(4фторфеніл)-4-піперидинамін (Е27); 1-[2-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)пропаноїл]-N-(3фторфеніл)-4-піперидинамін (Е28); 1-[2-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)-2-метилпропаноїл]-N-(4фторфеніл)-4-піперидинамін (Е29); 1-[2-(4-{[(3R,5S)-3,5-диметил-1піперазиніл]метил}феніл)-2-метилпропаноїл]-N-(3фторфеніл)-4-піперидинамін (Е30); (3R,5S)-1-{[4-(2-{4-[(4-фторфеніл)окси]-1піперидиніл}-1,1-диметил-2оксоетил)феніл]метил}-3,5-диметилпіперазин (Е31); N-(3-фторфеніл)-1-[3-(5-{[(3S)-3-метил-1піперазиніл]метил}-2-піридиніл)пропаноїл]-4піперидинамін (Е32); 1-[(3-хлор-4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-N-(3-фторфеніл)4-піперидинамін (Е33); N-(2-фторфеніл)-1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін; N-(3-фторфеніл)-1-[(5-{[(3S)-3-метил-1піперазиніл]метил}-2-піридиніл)ацетил]-4піперидинамін; 2-({1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)бензонітрил; гідрохлорид 2-фтор-4-({1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)бензонітрилу. Сполуки формули (І) можуть утворювати відповідні кислотно-адитивні солі. Зрозуміло, що для застосування в медицині солі сполук формули (І) повинні бути фармацевтично прийнятними. Придатні фармацевтично прийнятні солі будуть очевидні для фахівців у даній галузі і включають ті, що описано в J. Pharm. Sci, 1977, 66, 1-19, такі як кислотно-адитивні солі, утворені з неорганічними кислотами, наприклад, хлористоводневою, бромистоводневою, сірчаною, азотною або фосфорною кислотою; і органічними кислотами, наприклад, бурштиновою, малеїновою, оцтовою, фумаровою, лимонною, винною, бензойною, птолуолсульфоновою, метансульфоновою або нафталінсульфоновою кислотою. Визначені сполуки формули (І) можуть утворювати кислотно-адитивні солі з одним або декількома еквівалентами кислоти. Даний винахід включає в межах його обсягу всі можливі стехіометричні і нестехіометричні форми. Сполуки формули (І) можуть бути отримані в кристалічній або некристалічній формі, і, у випадку виділення в кристалічній формі, можуть необов'язково бути гідратованими або сольватованими. 11 93878 12 Даний винахід включає в межах його обсягу стехіометричні гідрати або сольвати, а також сполуки, що містять перемінні кількості води і/або розчинника. У наступному аспекті даний винахід надає способи одержання сполуки формули (І) де R3 і Υ такі, як визначено у формулі (І), зі сполукою формули (V) де А являє собою феніл і X являє собою СН2, або її фармацевтично прийнятної солі або сольвату, причому способи включають взаємодію сполуки формули (II) де R1 і R2 такі, як визначено у формулі (І), і Q являє собою водень або придатну захисну групу азоту, таку як трет-бутилокси карбоніл (ВОС) або бензилоксикарбоніл (CBZ), зі сполукою формули (III) де Υ і R3 такі, як визначено у формулі (І), із застосуванням умов реакції, придатних для відновного алкілування, наприклад, у присутності відновлювального агента, такого як три(ацетокси)боргідрид натрію, у придатному розчиннику, такому як дихлорметан або 1,2-дихлоретан. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Сполуки формули (III) можуть бути отримані шляхом взаємодії сполуки формули (IV) у присутності придатного реагенту сполучення, такого як 1-(3-диметиламінопропіл)-3етилкарбодіімід (EDC) або Ν,Ν'-дициклогексилкарбодіімід (DCC), у придатному розчиннику, такому як дихлорметан, диметилформамід або їх суміші. Альтернативно, сполука формули(III) може бути отримана шляхом взаємодії сполуки формули (IV) з активованою похідною сполуки формули (V), такою як хлорангідрид, із застосуванням загальних способів, описаних у J.March, Advanced Organic Chemistry, 4th Edition, J Wiley & Sons, 1992, p. 417-418. Сполуки формули (IV), у яких Y=NH, можуть бути отримані по реакції відновного алкілування, що включає взаємодію придатного похідного аніліну з придатним чином захищеним піперидин-4оном, таким як 1-(трет-бутоксикарбоніл)піперидин4-он, у присутності відновлювального агента, такого як три(ацетокси)боргідрид натрію, у розчиннику, такому як дихлоретан, з наступним видаленням захисної групи азоту традиційними способами, як описано нижче. Сполуки формули (IV), де Y=NH, також можуть бути отримані по реакції арилування, що включає взаємодію придатного арилгалогеніду з придатним чином захищеним 4-амінопіперидином, таким як (1-трет-бутоксикарбоніл)-4-амінопіперидин, у присутності придатної каталітичної системи, таким як ацетат паладію(ІІ)/ВІМАР, у розчиннику, такому як 1,4-діоксан, з наступним видаленням захисної групи азоту традиційними способами, як описано нижче. Сполуки формули (IV), де Y=O, можуть бути отримані по реакції алкілування, що включає взаємодію придатного похідного фенолу з придатним чином захищеним 4-гідроксипіперидином, таким як 1-(трет-бутоксикарбоніл)-4-гідроксипіперидин, у присутності трифенілфосфіну і діізопропілазодикарбоксилату, у розчиннику, такому як тетрагідрофуран, з наступним видаленням захисної групи азоту традиційними способами, як описано нижче. Сполуки формули (V) є відомими або можуть бути отримані з застосуванням традиційних способів. Наприклад, для 4-формілфенілоцтової кислоти, обробка 4-бромметилфенілоцтової кислоти гексаметилентетраміном із застосуванням спосо 13 93878 14 бів, подібних тим, що описано в J.March, Advanced Organic Chemistry, 4th Edition, J Wiley & Sons, 1992. p.1194. Даний винахід надає додатковий спосіб одержання сполуки формули (І), де А являє собою феніл і X являє собою СН2, або її фармацевтично прийнятної солі або сольвату, причому спосіб включає взаємодію сполуки формули (VI) де R1 і R2 такі, як визначено у формулі (І), і Q являє собою водень або придатну захисну групу азоту, таку як трет-бутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), зі сполукою формули (IV) у присутності придатного реагенту сполучення, такого як 1-(3-диметиламінопропіл)-3етилкарбодіімід (EDC) або Ν,Ν'-дициклогексилкарбодіімід (DCC), у придатному розчиннику, такому як дихлорметан, диметилформамід або їх суміші. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Альтернативно, сполука формули (І), де А являє собою феніл і X являє собою СН2, або її фармацевтично прийнятна сіль або сольват можуть бути отримані способом, що включає взаємодію активованого похідного сполуки формули (VI), такого як хлорангідрид, зі сполукою формули (IV) із застосуванням загальних способів, описаних у J.March, Advanced Organic Chemistry, 4th Edition, J Wiley & Sons, 1992, p.417-418. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Сполуки формули (VI) можуть бути отримані традиційним гідролізом і декарбоксилюванням сполуки формули (VII) де R1 і R2 такі, як визначено у формулі (І), Q являє собою водень або придатну захисну групу азоту, таку як трет-бутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), і Ρ являє собою придатну алкільну групу, таку як метил або етил, з використанням водного гідроксиду натрію в прийнятному розчиннику, такому як 1,4-діоксан, з наступним підкисленням і декарбоксилюванням шляхом нагрівання в придатному розчиннику, такому як толуол. Сполуки формули (VII) можуть бути отримані шляхом взаємодії сполуки формули (VIII) де R1 і R2 такі, як визначено у формулі (І), L є придатною групою, що іде, такою як галоген, наприклад, бром, і Q являє собою водень або придатну захисну групу азоту, таку як третбутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), з придатним діалкілмалонатом, таким як діетилмалонат, в умовах паладієвого каталізу в придатному розчиннику, такому як 1,4-діоксан, при кипінні зі зворотним холодильником із застосуванням способу, подібного тому, що описано в S.L. Buchwald et al., J. Am. Chem. Soc, 2000, vol. 122, p.1360-1370. Сполуки формули (VIII) можуть бути отримані шляхом взаємодії сполуки формули (IX) де L являє собою галоген, зі сполукою формули (II), із застосуванням умов реакції, що підходять для відновного амінування, наприклад, у присутності відновлювального агента, такого як три(ацетокси)боргідрид натрію, у придатному розчиннику, такому як дихлорметан або 1,2дихлоретан. 15 93878 16 Сполуки формули (VI) також можуть бути отримані традиційним гідролізом сполуки формули (X) де R1 і R2 такі, як визначено у формулі (І), Q являє собою водень або придатну захисну групу азоту, таку як трет-бутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), і Ρ являє собою придатну алкільну групу, таку як метил, з використанням придатної основи, такої як водний гідроксид натрію, у придатному розчиннику, такому як тетрагідрофуран або 1,4-діоксан. Сполуки формули (X) можуть бути отримані шляхом взаємодії сполуки формули (II) зі сполукою формули (XI) де Ρ являє собою придатну алкільну групу, таку як метил, і L являє собою придатну групу, що іде, таку як галоген, наприклад, бром, у присутності придатної основи, такої як діізопропілетиламін, у придатному розчиннику, такому як диметилформамід. Сполуки формули (XI), де Ρ являє собою метил, можуть бути отримані шляхом взаємодії сполуки формули (XII) де R1 і R2 такі, як визначено у формулі (І), Ζ являє собою С1-4алкокси і Q являє собою водень або придатну захисну групу азоту, таку як третбутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), зі сполукою формули (IV) у присутності придатного реагенту сполучення, такого як 1-(3диметиламінопропіл)-3-етилкарбодіімід (EDC) або Ν,Ν'-дициклогексилкарбодіімід (DCC), у придатному розчиннику, такому як дихлорметан, диметилформамід або їх суміші. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Альтернативно, сполука формули (І), де А є заміщеним фенілом і X являє собою СН2, або її фармацевтично прийнятна сіль або сольват можуть бути отримані способом, що включає взаємодію активованого похідного сполуки формули (XIII), такого як хлорангідрид, зі сполукою формули (IV) із застосуванням загальних способів, описаних у J.March, Advanced Organic Chemistry, 4th Edition, J Wiley & Sons, 1992. p. 417-418. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Сполуки формули (XIII) можуть бути отримані традиційним гідролізом і декарбоксилюванням сполуки формули (XIV) де L являє собою галоген, такий як бром, з метанолом у присутності триметилсилілхлориду. Сполуки формули (XII) є комерційно доступними. Даний винахід надає спосіб одержання сполуки формули (І), де А являє собою заміщений феніл і X являє собою СН2, або її фармацевтично прийнятної солі або сольвату, причому спосіб включає взаємодію сполуки формули (XIII) де R1 і R2 такі, як визначено у формулі (І), Q являє собою водень або придатну захисну групу азоту, таку як трет-бутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), Ζ являє собою 17 С1-4алкокси і Ρ являє собою придатну алкільну групу, таку як метил або етил, з використанням водного гідроксиду натрію, з наступним підкисленням і декарбоксилюванням шляхом нагрівання в придатному розчиннику, такому як тетрагідрофуран або 1,4-діоксан. Сполуки формули (XIV) можуть бути отримані шляхом взаємодії сполуки формули (XV) де Ζ являє собою С1-4алкокси і Ρ являє собою придатну алкільну групу, таку як метил або етил, зі сполукою формули (II), із застосуванням умов реакції, придатних для відновного амінування, наприклад, у присутності відновлювального агента, такого як три(ацетокси)боргідрид натрію, у придатному розчиннику, такому як дихлорметан або 1,2-дихлоретан. Сполуки формули (XV) можуть бути отримані традиційним гідролізом сполуки формули (XVI) де Ζ являє собою С1-4алкокси і Ρ являє собою алкіл, такий як етил, з використанням придатної водної кислоти, такої як розведена соляна кислота, у придатному розчиннику, такому як тетрагідрофуран. Сполуки формули (XVI) можуть бути отримані взаємодією сполуки формули (XVII) де L являє собою галоген, такий як бром, і Ζ являє собою С1-4алкокси, з придатним діалкілмалонатом, таким як діетилмалонат, в умовах паладієвого каталізу в придатному розчиннику, такому як 1,4-діоксан, при кипінні зі зворотним холодильником із застосуваннямспособу, подібного тому, що описано в S.L. Buchwald et al., J. Am. Chem. Soc., 2000, vol. 122, p.1360-1370. Сполуки формули (XVII) можуть бути отримані відповідно до методики, описаної в А. Tromelin et al., European Journal of Medicinal Chemistry, 1986, vol. 21(5), p.397-402. 93878 18 Даний винахід представляє спосіб одержання сполуки формули (І), де А являє собою феніл і X являє собою СМе2, або її фармацевтично прийнятної солі або сольвату, причому спосіб включає взаємодію сполуки формули (XVIII) де R1 і R2 такі, як визначено у формулі (І), і Q являє собою водень або придатну захисну групу азоту, таку як трет-бутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), зі сполукою формули (IV) у присутності придатного реагенту сполучення, такого як 1-(3-диметиламінопропіл)-3етилкарбодіімід (EDC) або Ν,Ν'дициклогексилкарбодіімід (DCC), у придатному розчиннику, такому як дихлорметан, диметилформамід або їх суміші. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Альтернативно, сполука формули (І), де А являє собою феніл і X являє собою СМе2, або її фармацевтично прийнятна сіль або сольват можуть бути отримані способом, що включає взаємодію активованого похідного сполуки формули (XVIII), такого як хлорангідрид, зі сполукою формули (IV) із застосуванням загальних способів, описаних у J.March, Advanced Organic Chemistry, 4th Edition, J Wiley & Sons, 1992. p. 417-418. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Сполуки формули (XVIII) можуть бути отримані традиційним гідролізом сполуки формули (XIX) де R1 і R2 такі, як визначено у формулі (І), Q являє собою водень або придатну захисну групу 19 азоту, таку як трет-бутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), і Ρ являє собою придатну алкільну групу, таку як метил, з використанням придатної основи, такої як водний гідроксид літію, у придатному розчиннику, такому як 1,4-діоксан. Сполуки формули (XIX) можуть бути отримані шляхом взаємодії сполуки формули (VIII) зі сполукою формули (XX) де Ρ являє собою придатну алкільну групу, таку як метил, з використанням методики, аналогічній тій, що описана в J.F. Hartwig et al., J. Am. Chem. Soc, 2002, vol. 124, p. 12557-12565. Реакція може бути проведена в присутності придатної основи, такої як ди(циклогексил)амід літію, придатної каталітичної системи, такої як біс(дибензиліден)паладій(o)/три(тербутил)фосфін, і в придатному розчиннику, такому як толуол. Даний винахід надає спосіб одержання сполуки формули (І), де А являє собою феніл і X являє собою СНМе, або її фармацевтично прийнятної солі або сольвату, причому спосіб включає взаємодію сполуки формули (XXI) де R1 і R2 такі, як визначено у формулі (І), і Q являє собою водень або придатну захисну групу азоту, таку як трет-бутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), зі сполукою формули (IV) у присутності придатного реагенту сполучення, такого як 1-(3-диметиламінопропіл)-3етилкарбодіімід (EDC) або Ν,Ν'-дициклогексилкарбодіімід (DCC), у придатному розчиннику, такому як дихлорметан, диметилформамід або їх суміші. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Альтернативно, сполуку формули (І), де А являє собою феніл і X являє собою СНМе, або її фармацевтично прийнятну сіль або сольват можна одержати способом, що включає взаємодію акти 93878 20 вованого похідного сполуки формули (XXI), такого як хлорангідрид, зі сполукою формули (IV) із застосуванням загальних способів, описаних у J.March, Advanced Organic Chemistry, 4th Edition, J Wiley & Sons, 1992, p. 417-418. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Сполуки формули (XXI) можуть бути отримані традиційним гідролізом і декарбоксилюванням сполуки формули (XXII) де R1 і R2 такі, як визначено у формулі (І), Q являє собою водень або придатну захисну групу азоту, таку як трет-бутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), і Ρ являє собою придатну алкільну групу, таку як метил або етил, з використанням водного гідроксиду натрію, з наступним підкисленням і декарбоксилюванням шляхом нагрівання в придатному розчиннику, такому як 1,4діоксан або тетрагідрофуран. Сполуки формули (XXII) можуть бути отримані зі сполуки формули (VII) де R1 і R2 такі, як визначено у формулі (І), Q являє собою водень або придатну захисну групу азоту, таку як трет-бутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), і Ρ являє собою придатну алкільну групу, таку як метил або етил, із застосуванням стандартних умов алкілування. Наприклад, реакція з придатною основою, такою як гідрид натрію, разом з придатним метилюючим агентом, таким як йодметан, у придатному розчиннику, наприклад, диметилформамід. Даний винахід надає спосіб одержання сполуки формули (І), де А являє собою феніл і X являє собою СН2СН2, або її фармацевтично прийнятної 21 солі або сольвату, причому спосіб включає взаємодію сполуки формули (XXIII) де Υ і R3 такі, як визначено у формулі (І), зі сполукою формули (II), із застосуванням умов реакції, придатних для відновного амінування, наприклад, у присутності відновлювального агента, такого як три(ацетокси)боргідрид натрію, у придатному розчиннику, такому як дихлорметан або 1,2-дихлоретан. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Сполуки формули (XXIII) можуть бути отримані взаємодією сполуки формули (XXIV) зі сполукою формули (IV) у присутності придатного реагенту сполучення, такого як 1-(3диметиламінопропіл)-3-етилкарбодіімід (EDC) або Ν,Ν'-дициклогексилкарбодіімід (DCC), у придатному розчиннику, такому як дихлорметан, диметилформамід або їх суміші. Альтернативно, сполука формули (XXIII) може бути отримана взаємодією сполуки формули (IV) з активованим похідним сполуки формули (XXIV), таким як хлорангідрид, із застосуванням загальних способів, описаних у J.March, Advanced Organic Chemistry, 4th Edition, J Wiley & Sons, 1992, p. 417418. Даний винахід надає спосіб одержання сполуки формули (І), де А являє собою 2,5-піридил і X являє собою СН2СН2, або її фармацевтично прийнятної солі або сольвату, причому спосіб включає гідрування сполуки формули (XXV) 93878 22 де R1 і R2 такі, як визначено у формулі (І), і Q являє собою придатну захисну групу, таку як третбутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), у присутності придатного каталізатора, такого як паладієва чернь, і в придатному розчиннику, такому як метанол. І наступне необов'язкове проведення однієї або декількох з наступних реакцій: 1. перетворення однієї сполуки формули (І) в іншу сполуку формули (І); 2. видалення будь-якої захисної групи; 3. утворення придатної фармацевтично прийнятної солі або сольвату отриманої в такий спосіб сполуки. Сполуки формули (XXV) можуть бути отримані взаємодією сполуки формули (XXVI) де R1 і R2 такі, як визначено у формулі (І), і Q є придатною захисною групою, такою як третбутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), зі сполукою формули (IV) у присутності придатного реагенту сполучення, такого як 1-(3диметиламінопропіл)-3-етилкарбодіімід (EDC) або Ν,Ν'-дициклогексилкарбодіімід (DCC), у придатному розчиннику, такому як дихлорметан, диметилформамід або їх суміші. Альтернативно, сполука формули (XXV) може бути отримана взаємодією сполуки формули (IV) з активованим похідним сполуки формули (XXVI), таким як хлорангідрид, із застосуванням загальних способів, описаних у J. March, Advanced Organic Chemistry, 4th Edition, J Wiley & Sons, 1992, p. 417418. Сполуки формули (XXVI) можуть бути отримані традиційним гідролізом сполуки формули (XXVII) де R1 і R2 такі, як визначено у формулі (І), Q являє собою придатну захисну групу, таку як третбутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), і Ρ являє собою придатну алкільну групу, таку як метил, з використанням придатної основи, такої як водний гідроксид літію, у придатному розчиннику, такому як 1,4-діоксан. 23 Сполуки формули (XXVII) можуть бути отримані взаємодією сполуки формули (XXVIII) де Ρ являє собою придатну алкільну групу, таку як метил, зі сполукою формули (II), із застосуванням умов реакції, придатних для відновного амінування, наприклад, у присутності відновлювального агента, такого як три(ацетокси)боргідрид натрію, у придатному розчиннику, такому як дихлорметан або 1,2-дихлоретан. Сполуки формули (XXVIII) можуть бути отримані взаємодією сполуки формули (XXIX) з придатним алкілакрилатом, таким як метилакрилат, при підвищеній температурі, наприклад, в умовах мікрохвильового опромінення, у присутності придатної каталітичної системи, такої як димер хлориду алілпаладію(ІІ)/три(о-толіл)фосфін, і придатної основи, такої як ацетат натрію. Придатним розчинником є диметилформамід. Фахівцям в даній галузі буде зрозуміло, що може бути необхідно захищати визначені реакційноздатні замісники в процесі деяких зі згаданих вище методик. Можуть бути використані стандартні методики введення і зняття захисту, такі як ті, що описані в Greene T.W. Protective groups in organic synthesis, New York, Wiley (1981). Наприклад, первинні аміни можуть бути захищені у вигляді фталімідних, трифторацетильних, бензильних, трет-бутилоксикарбонільних, бензилоксикарбонільних або тритильних похідних. Групи карбонової кислоти можуть бути захищені у вигляді складних ефірів. Альдегідні або кетонні групи можуть бути захищені у вигляді ацеталей, кеталей, тіоацеталей або тіокеталей. Зняття захисту таких груп досягають, використовуючи традиційні методики, добре відомі в даній галузі. Наприклад, захисні групи, такі як третбутилоксикарбоніл, можуть бути вилучені дією кислоти, такої як соляна або трифтороцтова кислота, у придатному розчиннику, такому як дихлорметан, діетиловий ефір, 1,4-діоксан, ізопропанол або їх суміші. Фармацевтично прийнятні солі можуть бути звичайно отримані шляхом взаємодії з відповідною кислотою або похідним кислоти. Даний винахід також надає сполуки формули (III), (VI), (VII), (X), (XIII), (XIV), (XVIII), (XIX), (XXI), (XXII), (XXIII), (XXV), (XXVI) і (XXVII), як представлено вище, де Y, R1, R2 і R3 такі, як визначено для формули (І), Q являє собою водень або придатну захисну групу, таку як трет-бутилоксикарбоніл (ВОС) або бензилоксикарбоніл (CBZ), і Ρ являє 93878 24 собою придатну алкільну групу, таку як етил. Ці сполуки застосовні як проміжні сполуки при одержанні сполук за даним винаходом. Активності й ефективності сполук за даним винаходом у відношенні GPR38 можуть бути визначені дослідженням FLIPR, проведеному на клонованому людському рецепторі, як тут описано. Сполуки формули (І) демонстрували активність часткового або повного агоніста у відношенні GPR38-рецептора при використанні описаного тут функціонального дослідження FLIPR (Планшети зі зчитувальним пристроєм для флюорометричного зображення). Отже, сполуки формули (І) і їх фармацевтично прийнятні солі застосовні при лікуванні станів або розладів, опосередкованих через GPR38рецептор. Зокрема, сполуки формули (І) і їх фармацевтично прийнятні солі застосовні при лікуванні визначених шлунково-кишкових розладів, таких як розладу типу гастроезофагеального рефлюксу, функціональної диспепсії, синдрому подразненої кишки, запору, кишкової псевдо-непрохідності, паралітичної непрохідності кишечнику після хірургічного втручання або інших маніпуляцій, блювоти, шлункового застою або гіпокінезії, викликаної різними захворюваннями, такими як діабет, і/або введенням інших ліків, хвороби Крона, коліту, кахексії, асоційованої із задавненими хворобами, такими як рак і/або наслідки його лікування, порушення апетиту/метаболізму, пов'язані з кахексією, і інших розладів, таких як нетримання (тут і далі позначених як "Розлади за винаходом"). Буде зрозуміло, що використовуваний у даному описі термін "лікування" включає профілактику, а також пом'якшення встановлених симптомів. Таким чином, винахід також надає сполуку формули (І) або її фармацевтично прийнятну сіль для застосування як терапевтичного засобу, зокрема, при лікуванні станів або розладів, опосередкованих через GРR38-рецептор. Зокрема, винахід надає сполуку формули (І) або її фармацевтично прийнятну сіль для застосування як терапевтичного засобу при лікуванні шлунково-кишкових розладів, таких як розладу типу гастроезофагеального рефлюксу, функціональної диспепсії, синдрому подразненої кишки, запору, кишкової псевдонепрохідності, паралітичної непрохідності кишечнику після хірургічного втручання або інших маніпуляцій, блювоти, шлункового застою або гіпокінезії, викликаної різними хворобами, такими як діабет, і/або введенням інших ліків, хвороби Крона, коліту, кахексії, асоційованої з задавненими хворобами, такими як рак і/або наслідки його лікування, порушення апетиту/метаболізму, пов'язаного з кахексією, та інших розладів, таких як нетримання. Винахід додатково надає спосіб лікування станів або розладів у ссавців, включаючи людей, що можуть бути опосередковані через GРR38рецептор, який включає введення пацієнту терапевтично безпечної й ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. В іншому аспекті винахід передбачає застосування сполуки формули (І) або її фармацевтично прийнятної солі для лікування станів або розладів, опосередкованих через GPR38-рецептор. 25 Для застосування сполук формули (І) у терапії, звичайно вони повинні бути включені до складу фармацевтичної композиції відповідно до стандартної фармацевтичної практики. Даний винахід також надає фармацевтичну композицію, що включає сполуку формули (І), або її фармацевтично прийнятну сіль, і фармацевтично прийнятний носій або ексципієнт. У наступному аспекті даний винахід надає спосіб одержання фармацевтичної композиції, причому спосіб включає змішування сполуки формули (І), або її фармацевтично прийнятної солі, і фармацевтично прийнятного носія або ексципієнта. Фармацевтична композиція за винаходом, яка може бути отримана шляхом змішування, переважно при температурі навколишнього середовища й атмосферному тиску, звичайно адаптована для перорального, парентерального або ректального введення і, як така, може знаходитися у формі таблеток, капсул, оральних рідких препаратів, порошків, гранул, пастилок, порошків для відновлення вологовмісту, ін'єкційних або інфузійних розчинів або суспензій або супозиторіїв. Композиції, що вводяться перорально, як правило, є кращими. Таблетки і капсули для перорального введення можуть бути у формі стандартної дози і можуть містити традиційні ексципієнти, такі як сполучні агенти (наприклад, пептизований кукурудзяний крохмаль, полівінілпіролідон або гідроксипропілметилцелюлоза); наповнювачі (наприклад, лактоза, мікрокристалічна целюлоза або вторинний кислий фосфат кальцію); таблетизуючі мастила (наприклад, стеарат магнію, тальк або діоксид кремнію); дезінтегруючі агенти (наприклад, картопляний крохмаль або натрієвий гліколят крохмалю); і прийнятні змочувальні агенти (наприклад, лаурилсульфат натрію). Таблетки можуть бути покриті способами, добре відомими в звичайній фармацевтичній практиці. Пероральні рідкі препарати можуть бути у формі, наприклад, водної або масляної суспензії, розчинів, емульсій, сиропів або еліксирів, або можуть бути у формі сухого продукту для відновлення, перед застосуванням, вологовмісту водою або іншим прийнятним носієм. Такі рідкі препарати можуть містити традиційні добавки, такі як суспендуючі агенти (наприклад, сироп сорбіту, похідні целюлози або гідровані харчові жири), емульгуючі агенти (наприклад, лецитин або камедь), неводні носії (які можуть включати харчові олії, наприклад, мигдальну олію, масляні ефіри, етиловий спирт або ректифіковані рослинні олії), консерванти (наприклад, метил або пропіл-п-гідроксибензоати або сорбінова кислота) і, якщо потрібно, традиційні коригенти або барвники, буферні солі і підсолоджувачі, за необхідності. Препарати для перорального введення можуть бути відповідним чином складені для контрольованого вивільнення активної сполуки. Для парентерального введення рідкі форми стандартної дози готують, використовуючи сполуку за винаходом або її фармацевтично прийнятну сіль і стерильний носій. Рецептури для ін'єкції можуть бути представлені у формі стандартної дози, 93878 26 наприклад, в ампулах, або у вигляді множинних доз, з використанням сполуки за винаходом або її фармацевтично прийнятної солі і стерильного носія, необов'язково з доданим консервантом. Композиції можуть приймати такі форми, як суспензії, розчини або емульсії в масляних або водних носіях, і можуть містити складові агенти, такі як суспендуючі, стабілізуючі і/або диспергуючі агенти. Альтернативно, активний інгредієнт може бути у формі порошку для відновлення, перед застосуванням, з придатним носієм, наприклад, стерильною, вільною від пірогену водою. Сполука, залежно від носія і використовуваної концентрації, може бути або суспендована, або розчинена в носії. В отриманих розчинах сполука може бути розчинена для ін'єкції і стерилізована через фільтр, перед приміщенням у придатну пляшечку або ампулу, і запаяна. Переважно, у носії розчиняються ад'юванти, такі як місцеві анестетики, консерванти і буферизуючі агенти. Для підвищення стабільності композицію можна заморозити після поміщення в пляшечку і воду видалити у вакуумі. Парентеральні суспензії готують власне кажучи в такий же спосіб, за винятком того, що сполуку суспендують у носії, замість розчинення, і стерилізація не може бути виконана фільтруванням. Сполуку можна стерилізувати дією етиленоксиду на суспензію в стерильному носії. Переважно, поверхневоактивну речовину або змочувальний агент включають у композицію для полегшення рівномірного розподілу сполуки. Лосьйони можуть бути складені з водною або масляною основою і будуть, як правило, також містити один або декілька емульгуючих агентів, стабілізуючих агентів, диспергуючих агентів, суспендуючих агентів, загусників або барвників. Краплі можуть бути складені з водною або неводною основою, що також включає один або декілька диспергуючих агентів, стабілізуючих агентів, солюбілізуючих агентів або суспендуючих агентів. Вони також можуть містити консервант. Сполуки за винаходом також можуть бути включені в ректальні композиції, такі як супозиторії або утримуючі клізми, наприклад, що містять традиційні основи для супозиторію, такі як олія какао або інші гліцериди. Сполуки за винаходом також можуть бути включені до складу депо-препаратів. Такі довгостроково діючі препарати можуть бути введені шляхом імплантації (наприклад, підшкірно або внутрішньом'язово) або шляхом внутрішньом'язової ін'єкції. Так, наприклад, сполуки за винаходом можуть бути складені з придатними полімерними або гідрофобними матеріалами (наприклад, у вигляді емульсії в прийнятній олії) або іонообмінними смолами, або у вигляді малорозчинних похідних, наприклад, у вигляді малорозчинної солі. Для інтраназального введення сполуки за винаходом можуть бути складені у вигляді розчинів для введення через придатний відміряючий пристрій, або стандартний дозуючий пристрій, або, альтернативно, у вигляді порошкової суміші з придатним носієм для введення з застосуванням придатного пристрою доставки. Так, сполуки формули (І) можуть бути включені в сполуки для перораль 27 ного, букального, парентерального, місцевого (включаючи очне і назальне), у формі депо або ректального введення, або у формі, придатній для введення шляхом інгаляції або інфузії (або через рот, або через ніс). Сполуки за винаходом можуть бути включені в препарати для місцевого призначення у формі мазей, кремів, гелів, лосьйонів, песаріїв, аерозолей або крапель (наприклад, очних, вушних або носових крапель). Мазі і креми можуть, наприклад, бути складені з водною або масляною основою з додаванням придатних загусників і/або гелеутворюючих агентів. Мазі для очного призначення можна робити стерильним способом із застосуванням стерилізуючих компонентів. Композиція може містити від 0,1% до 99% за масою, переважно від 10 до 60% за масою активної речовини, у залежності від способу введення. Доза сполуки, застосовуваної при лікуванні вищезгаданих розладів, буде варіювати звичайним чином у залежності від серйозності розладів, маси пацієнта й інших подібних факторів. Однак, як загальне керівництво, прийнятні стандартні дози можуть складати від 0,05 до 1000 мг, від 1,0 до 500 мг або від 1,0 до 200 мг, і такі стандартні дози можуть бути призначені більше ніж один раз на день, наприклад, два або три рази на день. Така терапія може продовжуватися протягом ряду тижнів або місяців. Сполуки за даним винаходом можуть бути використані в комбінаційних препаратах. Наприклад, сполуки за винаходом можуть бути використані в комбінації з одною або декількома сполуками, що володіють активністю зниження шлункової кислотності; з одною або декількома сполуками, що володіють активністю у відношенні ослаблення гастроезофагеального рефлюкса; з одною або декількома сполуками, що володіють активністю у відношенні зменшення езофаго-шлункового подразнення або запалення, особливо при використанні для полегшення ерозивного або неерозивного езофагіту; з одною або декількома сполуками, що володіють аналгезуючою активністю; і/або з одною або декількома сполуками, що володіють змішаною активністю на рухливість і біль. Приклади сполук, що зменшують шлункову кислотність, включають антагоністи Н2-рецептора, антагоністи кислотного насосу й інгібітори протонного насосу. Приклади сполук, що послабляють гастроезофагеальний рефлюкс, включають агоністи GABA-B. Приклади сполук, що володіють аналгезуючою активністю, включають сполуки, активні у відношенні рецепторів нейрокініну (NK1, 2, 3), TRPV1 і натрієвих каналів. Приклади сполук, що володіють змішаною активністю на рухливість і біль, включають антагоністи CRF2, антагоністи 5НТЗ або октреотид, або інші молекули, активні у відношенні рецепторів sst2. Усі публікації, включаючи, без обмеження, патенти і заявки на патент, цитовані в даному описі, включені в опис за допомогою посилання, як якби кожна індивідуальна публікація була спеціально й індивідуально зазначена як включена за допомогою посилання, навіть якщо цілком викладена в даному описі. 93878 28 Наступні описи і приклади ілюструють одержання сполук за винаходом. Умови, обладнання і програмне забезпечення для аналітичних LCMS систем Обладнання Градієнтний насос Agilent 1100 Автоматичний пробовідбірник Agilent 1100 DAD-детектор Agilent 1100 Дегазатор Agilent 1100 Піч Agilent 1100 Контролер Agilent 1100 Мас-спектрометр Waters ZQ Sedere Sedex 55, Sedere Sedex 85 або Polymer Labs PL-ELS-2100 Програмне забезпечення Waters MassLynx, версія 4.0 SP2 Колонка Використовуваною колонкою була Waters Atlantis, розміри якої складали 4,6 мм 50 мм. Розмір частинок стаціонарної фази складав 3 мкм. Розчинники А: Водний розчинник=вода+0,05 % мурашиної кислоти В: Органічний розчинник=ацетонітрил+0,05 % мурашиної кислоти Спосіб Стандартно використовуваний спосіб мав 5хвилинний час прогону. Час/хвилини %В 0 3 0,1 3 4 97 4,8 97 4,9 3 5,0 3 Швидкість потоку Згаданий спосіб мав швидкість потоку 3 мл/хвилину Патентна інформація у відношенні автоматичної препаративної системи відкритого доступу з мас-детекторним контролем (MDAP) Обладнання Апарати автоматичної препаративної системи відкритого доступу з мас-детекторним контролем складалися з наступних: 1 градієнтний насос Waters 600 1 інжектор/колектор Waters 2767 1 система керування реагентами Waters 1 мас-спектрометр MicroMass ZQ 1 колектор зливів Gilson Aspec 1 постфракційний УФ детектор Gilson 115 1 комп'ютерна система Програмне забезпечення MicroMass MassLynx v4.0 Колонка Використовувана колонка звичайно являла собою колонку Supelco LCABZ++, чиї розміри складали: внутрішній діаметр 20 мм; довжина 100 мм. Розмір частинок стаціонарної фази складав 5 мкм. Розчинники А: Водний розчинник=вода+0,1 % мурашиної кислоти 29 В: Органічний розчинник=МеСN :вода 95:5+0,05 % мурашина кислота Промивний розчинник=МеОН:вода 80:20+50 ммоль ацетату амонію Розчинник для промивання голки=МеОН:вода:ДМСО 80:10:10 Способи Може бути використаний один з п'яти способів, у залежності від аналітичного часу утримування сполуки, яка представляє інтерес. Усі мають 15-хвилинний час прогону, що включає 10-хвилинний градієнт, з наступним 5хвилинним промиванням колонки і стадією рееквілібрації. MDP 1,5-2,2=0-30% В MDP 2,0-2,8=5-30 % В MDP 2,5-3,0=15-55% В MDP 2,8-4,0=30-80 % В MDP 3,8-5,5=50-90 % В Швидкість потоку Усі згадані способи мали швидкість потоку 20 мл/хв. Умови, використані для ЯМР Обладнання Ультразахисний Bruker 400МГц Автоматичний пробовідбірник Bruker B-ACS60 Консоль Bruker Advance 400 Bruker DPX250 Bruker AVANCE 500 Bruker DRX600 Програмне забезпечення Користувальницький інтерфейс - NMR Kiosk Контролююче програмне забезпечення - Xwin NMR version 3.0 Хроматографія Поки не зазначене інше, усі хроматографічні розділення проводили, використовуючи колонки з діоксидом кремнію. Скорочення НСІ - соляна кислота, хлористий водень NaHCO3 - бікарбонат натрію Na2SO - сульфат натрію 1,2-DCE -1,2-дихлоретан NaOH - гідроксид натрію DCM - дихлорметан ДМФА - Ν,Ν-диметилформамід ТГФ - тетрагідрофуран МеОН - метанол EtOAc - етилацетат MgSO4 - сульфат магнію NН3 - аміак ТФОК - трифтороцтова кислота Et2O - діетиловий ефір CDCI3 - дейтерохлорформ DCC - Ν,Ν'-дициклогексилкарбодіімід BINAP (±)-2,2'-біс(дифенілфосфіно)-1,1'бінафталін Опис 1 1,1-Диметилетил 4-[(4-фторфеніл)аміно]-1піперидинкарбоксилат (D1) Розчин 1,1-диметилетил 4-оксо-1піперидинкарбоксилату (1 г, 5 ммоль), 4фтораніліну (0,56 г, 5 ммоль) і оцтової кислоти (0,26 мл, 5 ммоль) в 1,2-DCE (30 мл) перемішували при кімнатній температурі протягом 24 годин. 93878 30 Потім додавали три(ацетокси)боргідрид натрію (1,48 г, 7 ммоль) і перемішування продовжували протягом 24 годин. Реакційну суміш промивали водою, висушували (MgSO4) і потім концентрували у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді неочищеної твердої речовини (1,6 г), δΗ (CDCI3, 250МГц) 6,88 (2Н, т), 6,54 (2Н, дд), 4,04 (2Н, м), 3,35 (1Н, м), 2,91 (2Н, м), 2,02 (2Н, м), 1,46 (9Н, с), 1,30 (2Н, м). Опис 2 N-(4-Фторфеніл)-4-піперидинамін (D2) Розчин D1 (1,6 г) у 2М НСІ (5 мл) і 1,4-діоксані (20 мл) нагрівали при 60°С протягом 24 годин. Після охолодження розчин розбавляли водою, підлужували 2М розчином NaOH і екстрагували EtOAc (3). Об'єднані органічні фракції висушували (MgSO4) і концентрували у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді жовтої олії (0,71 г), δΗ (CDCI3, 250МГц) 6,88 (2Н, т), 6,54 (2Н, дд), 3,30 (1Н, м), 3,20 (2Н, м), 2,70 (2Н, м), 2,05 (2Н, м), 1,62 (2Н, шир.), 1,29 (2Н, м). Опис 3 (4-Формілфеніл)оцтова кислота (D3) Зазначенеу в заголовку сполуку одержували з [4-(бромметил)феніл]оцтової кислоти і гексаметилентетраміну, використовуючи спосіб, аналогічний описаному J. March, Advanced Organic Chemistry, 4th Edition, J Wiley & Sons, 1992, p.1194. Опис 4 4-(2-{4-[(4-Фторфеніл)аміно]-1-піперидиніл}-2оксоетил)бензальдегід (D4) Суміш D3 (87 мг, 0,53 ммоль), D2 (102 мг, 0,53 ммоль), гідрохлориду 1-(3-диметиламінопропіл)-3етилкарбодііміду (123 мг, 0,64 ммоль) і 1гідроксибензотриазолу (98 мг, 0,64 ммоль)в ДМФА (2 мл) перемішували при кімнатній температурі протягом ночі. ДМФА видаляли у вакуумі, потім додавали ЕtOАс і воду. Продукт екстрагували в ЕtOАс і об'єднані органічні шари промивали насиченим водним розчином NаНСО3 (2) і насиченим розчином солі, потім висушували (Na2SO4). Розчинник видаляли у вакуумі й отриманий залишок очищали хроматографією, елюючи градієнтом ЕtOАс/петролейний ефір, з одержанням зазначеної в заголовку сполуки (149 мг). MS (ES): MH+ 341. Опис 5а 1,1-Диметилетил 4-[(3-фторфеніл)аміно]-1піперидинкарбоксилат (D5a) Розчин 1,1-диметилетил-4-оксо-1-піперидинкарбоксилату (1,91 г, 9,53 ммоль), 3-фтораніліну (1,06, 9,53 ммоль) і оцтової кислоти (0,55 мл, 9,53 ммоль) в 1,2-DCE (50 мл) перемішували при кімнатній температурі протягом ночі. Потім додавали три(ацетокси)боргідрид натрію (2,82 г, 13,3 ммоль), перемішували протягом 8 годин і потім давали стояти при кімнатній температурі. Реакційну суміш розбавляли DCM і промивали розчином NаНСО3, висушували над MgSO4 і потім концентрували з одержанням продукту, який очищали колоночною хроматографією. Елюювання сумішшю 0-40% ЕtOАс/пентан давало зазначену в заголовку сполуку у вигляді білої твердої речовини (2,3 г), δΗ (CDCI3, 250МГц) 7,08 (1Н, кв.), 6,35 (3Н, м), 4,04 31 (1Н, шир. с), 3,65 (1Н, шир. с), 3,38 (1Н, м), 2,92 (2Н, м), 2,02 (2Н, м), 1,47 (9Н, с), 1,34 (2Н, м). Опис 5b N-(3-Фторфеніл)-4-піперидинамін (D5b) Розчин D5a (2,91 г) у 2М НСІ (5 мл) і 1,4діоксані (40 мл) нагрівали при 70°С при перемішуванні протягом ночі. Після охолодження розчинник видаляли у вакуумі і залишок розбавляли 2М розчином NaOH і екстрагували сумішшю 9:1 ЕtOАс/тре-ВuОН (2). Органічні фракції висушували (MgSO4) і концентрували у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді жовтої твердої речовини (1,33 г), δΗ (CDCI3, 250МГц) 7,07 (1Н, кв.), 6,33 (3Н, м), 3,83 (1Н, шир. с), 3,33 (1Н, шир. с), 3,12 (2Н, м), 2,71 (2Н, м), 2,04 (2Н, м), 1,30 (2Н, м). Опис 6 Феніл метил (25)-4-[(4-бромфеніл)метил]-2метил-1-піперазинкарбоксилат (D6) Суміш 4-бромбензальдегіду (1,19 г, 6,42 ммоль), феніл метил (25)-2-метил-1піперазинкарбоксилату (1,505 г, 6,42 ммоль) і триацетоксиборгідриду натрію (2,04 г, 9,63 ммоль) в 1,2-DCE (15 мл) перемішували при кімнатній температурі протягом ночі. Додавали насичений водний розчин NaHCO3 і суміш перемішували протягом 30 хвилин. Продукт екстрагували й екстракти висушували (Nа2SO4). Хроматографія (0-30% ЕtOАс у пентані) давала зазначену в заголовку сполуку (2,18 г). MS (ES): MH+ 403/405. Опис 7 Діетил {4-[((3S)-3-метил-4-{[(фенілметил)окси]карбоніл}-1піперазиніл)метил]феніл}пропандіоат (D7) Суміш D6 (1,62 г, 4 ммоль), діетил малонату (0,73 мл, 4,8 ммоль), ацетату паладію(ІІ) (27 мг, 0,12 ммоль), фосфату калію (1,95 г, 2,3 ммоль) і біс(1,1-диметилетил)(2'-метил-2біфеніліл)фосфану (83 мг, 0,264 ммоль) в 1,4діоксані (20 мл) кип'ятили разом зі зворотним холодильником в атмосфері аргону протягом -20 годин. Суміш фільтрували через Целіт® і концентрували. Хроматографія (0-40% ЕtOАс/гексан) давала зазначену в заголовку сполуку у вигляді прозорої олії (1,165 г). MS (ES): MH+ 483. Опис 8 {4-[((3S)-3-метил-4-{[(феніл метил)окси]карбоніл}-1-піперазиніл)метил]феніл}оцтова кислота (D8) Суміш D7 (761 мг, 1,58 ммоль), 2М розчину NaOH (6 мл) і 1,4-діоксану (6 мл) перемішували при кімнатній температурі протягом 2 годин. Розчинники видаляли, залишок розчиняли у воді і pH доводили до 4 за допомогою 2М НСІ. Продукт екстрагували ЕtOАс і об'єднані екстракти висушували і концентрували. Продукт кип'ятили зі зворотним холодильником у толуолі (-20 мл) протягом 2 годин і розчинник випарювали, одержуючи зазначену в заголовку сполуку у вигляді жовтої піни (505 мг). MS (ES): MH+ 383, (М-Н)- 381. Опис 9а 1,1-Ди метилетил 4-[(3,4-дифторфеніл)аміно]1-піперидинкарбоксилат (D9a) Зазначену в заголовку сполуку одержували з 1,1-диметилетил 4-оксо-1-піперидинкарбоксилату і 93878 32 3,4-дифтораніліну з використанням способу, аналогічного описаному для D1, але неочищений продукт очищали хроматографією. Опис 9b N-(3,4-Дифторфеніл)-4-піперидинамін (D9b) Зазначену в заголовку сполуку одержували з D9a з використанням способу, аналогічного описаному для D2, але реакційну суміш нагрівали при 80°С. Опис 10а 1,1-Диметилетил 4-[(3-ціанофеніл)аміно]-1піперидинкарбоксилат (D10а) Суміш BINAP (560 мг, 0,9 ммоль), ацетату паладію (135 мг, 0,9 ммоль) і карбонату цезію (2,932г, 9 ммоль) в 1,4-діоксані (10 мл) опромінювали ультразвуком протягом 50 хвилин. Додавали 1,1-диметилетил 4-аміно-1-піперидинкарбоксилат (1,2г, 6 ммоль) і 3-бромбензонітрил (1,638 г, 9 ммоль) і суміш нагрівали до 105°С протягом ночі в атмосфері аргону. Після охолодження розчинник видаляли у вакуумі і залишок розподіляли між водою (100 мл) і ЕtOАс (100 мл). Органічний шар відокремлювали, висушували і концентрували, неочищений продукт очищали хроматографією. Елюювання градієнтом 0-50% Еt2О/петролейний ефір давало зазначену в заголовку сполуку у вигляді білої твердої речовини (1,49 г). Н (CDCl3, 250МГц) (CDCI3, 250МГц) 7,22 (2Н, т), 6,95 (1Н, дд), 6,77 (2Н, м), 4,07 (2Н, м), 3,77 (1Н, м), 3,41 (1Н, м), 3,20 (1Н, м), 2,93 (2Н, м), 2,03 (2Н, м), 1,47 (9Н, с), 1,34 (2Н, м). MS (ES): MH+ 302. Опис10b 3-(4-Піперидиніламіно)бензонітрил (D10b) Розчин D10a (750 мг, 2,43 ммоль) в DCM (30мл) прохолоджували в крижаній бані і додавали ТФОК (6 мл). Потім реакційну суміш перемішували при кімнатній температурі протягом 1 години. Розчинник видаляли у вакуумі і залишок завантажували на картридж Isolute SCX. Елюювання МеОН (100 мл) з наступним 2М NH3 в МеОН (100 мл) давало зазначену в заголовку сполуку у вигляді білої твердої речовини (613 мг). δΗ (CDCI3, 250МГц) 7,21 (2Н, т), 6,93 (1Н, м), 6,77 (2Н, м), 3,78 (1Н, м), 3,35 (1Н, м), 3,14 (2Н, м), 2,73 (2Н, м), 2,06 (2Н, м), 1,34 (2Н, м). MS (ES): MH+ 202. Опис 11а 1,1-Диметилетил [(4-ціанофеніл)аміно]-1піперидинкарбоксилат (D11а) Зазначену в заголовку сполуку одержували з 1,1-диметилетил 4-аміно-1-піперидинкарбоксилату і 4-бромбензонітрилу з використанням способу, аналогічного описаному для D10a. Опис 11b 4-(4-Піперидиніламіно)бензонітрил (D11b) Зазначену в заголовку сполуку одержували з D11a з використанням способу, аналогічного описаному для D10b, але також проводили очищення хроматографією. Опис 12а 1,1-Диметилетил 4-{[4-фтор-3-(метилокси)феніл]аміно}-1-піперидинкарбоксилат (D12a) Зазначену в заголовку сполуку одержували з 1,1-диметилетил 4-оксо-1-піперидинкарбоксилату і 4-фтор-3-метоксианіліну з використанням способу, аналогічного описаному для D1. 33 Опис 12b N-[4-фтор-3-(метилокси)феніл]-4піперидинамін (D12b) Зазначену в заголовку сполуку одержували з D12a з використанням способу, аналогічного описаному для D2, але реакційну суміш нагрівали при 80°С. Опис 13 1,1-Диметилетил 4-[(3-фторфеніл)окси]-1піперидинкарбоксилат (D13) До розчину 1,1-диметилетил 4-гідрокси-1піперидинкарбоксилату (24 г, 112 ммоль), 3фторфенолу (5,6 г, 59 ммоль) і трифенілфосфіну (31,4 г, 118 ммоль) в ТГФ (100 мл) додавали діізопропілазодикарбоксилат (23,3 мл, 118 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 3 днів і потім розчинник видаляли у вакуумі. Залишок розбавляли DCM, додавали гексан і відфільтровували отриманий білий осад. Фільтрат концентрували у вакуумі й очищали хроматографією. Елюювання DCM давало зазначену в заголовку сполуку (16,4 г, 87% чистий). δΗ (CDCI3, 250МГц) 1,47 (9Н, с), 1,76 (2Н, м), 1,92 (2Н, м), 3,35 (2Н, ддд), 3,69 (2Н, ддд), 4,44 (1Н, м), 6,65 (3Н, м), 7,20 (1Н, м). Опис 14 4-[(3-Фторфеніл)окси]піперидин (D14) Розчин D13 (16,4 г, 55 ммоль) в DCM (200 мл) при 0°С обробляли по краплинах ТФОК (17 мл). Реакційну суміш нагрівали до кімнатної температури протягом 2,5 годин і залишали на ніч. Потім розчинник видаляли у вакуумі і залишок розподіляли між DCM і 2М розчином NaOH. Водний шар потім екстрагували DCM (2) і об'єднані органічні фракції концентрували у вакуумі. Залишок повторно розчиняли в DCM і екстрагували 2М НСІ (2), потім підлужували і повторно екстрагували DCM. Об'єднані органічні фракції концентрували у вакуумі, одержуючи зазначену в заголовку сполуку (12 г). δΗ (CDCI3, 250МГц) 1,66 (2Н, м), 2,01 (2Н, м), 2,73 (2Н, м), 3,14 (2Н, м), 4,34 (1Н, м), 6,68 (3Н, м), 7,19 (1Н, м). MS (ES): MH+ 196. Цю речовину цілком розбавляли МеОН і обробляли 1М НСІ в Et2O з одержанням гідрохлоридної солі зазначеної в заголовку сполуки (8,0 г). Опис 15 4-[(4-Фторфеніл)окси]піперидин (D15) Зазначена в заголовку сполука може бути отримана з використанням способу, аналогічного описаному в L.C.Blumberg, Μ.F. Brown, Μ.Μ. Hayward and CS. Poss, PCT Int. Appl., WO 2004009550. Опис 16 Метил [4-(бромметил)феніл]ацетат (D16) До розчину 4-(бромметил)фенілоцтової кислоти (20 г, 87,3 ммоль) в МеОН (200 мл) додавали триметилсилілхлорид (2 мл) і реакційну суміш перемішували протягом 2 годин. Розчинник видаляли у вакуумі і залишок двічі повторно розчиняли в МеОН (200 мл) і повторно концентрували, одержуючи зазначену в заголовку сполуку (21,08 г). δΗ (CDCI3, 250МГц) 7,36 (2Н, д), 7,26 (2Н, д), 4,49 (2Н, с), 3,69 (3Н, с), 3,62 (2Н, с). Опис 17 93878 34 1,1-Диметилетил (2S)-2-метил-4-({4-[2(метилокси)-2-оксоетил]феніл}метил)-1піперазинкарбоксилат (D17) До розчину D16 (20,8 г, 85,6 ммоль) і діізопропілетиламіну (16,4 мл, 94,1 ммоль) у сухому ДМФА (100 мл) додавали розчин 1,1-диметилетил (2S)-2метил-1-піперазинкарбоксилату (18,8 г, 94,1 ммоль) у сухому ДМФА (75 мл) при охолодженні на крижаній бані. Реакційну суміш нагрівали до кімнатної температури і перемішували протягом 15 хвилин. Розчинник видаляли у вакуумі і залишок розподіляли між ЕtOАс і 2М розчином NaOH (400 мл, 1:1). Органічну фазу промивали водою (200 мл) і насиченим розчином солі (200 мл) і об'єднані промивні води назад екстрагували ЕtOАс (200 мл). ЕtOАс-екстракти поєднували, висушували (МgSО4) і концентрували у вакуумі, одержуючи неочищений продукт, що очищали хроматографією. Елюювання сумішшю 20-25% ЕtOАс/гексан давало зазначену в заголовку сполуку у вигляді безбарвної олії (29,3 г). Н (CDCl3, 250МГц) 7,29 (2Н, д), 7,22 (2Н, д), 4,18 (1Н, м), 3,74 (1Н, м), 3,69 (3Н, с), 3,62 (2Н, с), 3,51 (1Н, д), 3,39 (1Н, д), 3,10 (1Н, тд), 2,75 (1Н, м), 2,59 (1Н, м), 2,12 (1Н, дд), 1,99 (1Н, м), 1,45 (9Н, с), 1,24 (3Н, д). Опис 18 {4-[((3S)-4-{[(1,1-Диметилетил)окси]карбоніл}3-метил-1-піперазиніл)метил]феніл}оцтова кислота (D18) До розчину D17 (29,3 г, 80,9 ммоль) в ТГФ (200 мл) додавали 2М розчин NaOH (100 мл) і двофазну реакційну суміш перемішували при кімнатній температурі протягом 3 годин. Суміш концентрували у вакуумі для видалення ТГФ і водний розчин екстрагували ЕtOАс (2100 мл). Водну фазу підкислювали до pH 6 концентрованою НСІ і екстрагували DCM (3300 мл). Об'єднані органічні фракції промивали насиченим розчином солі (2), висушували і концентрували у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді безбарвної піни (27,8 г). н (CDCI3, 400МГц) 7,27 (2Н, д), 7,23 (2Н. д), 4,20 (1Н, м), 3,81 (1Н, м), 3,62 (2Н, с), 3,59 (1Н, д), 3,49 (1Н, д), 3,15 (1Н, м), 2,88 (1Н, м), 2,69 (1Н, м), 2,20 (1Н, дд), 2,05 (1Н, м), 1,45 (9Н, с), 1,25 (3Н, д). Опис 19 1,1-Диметилетил (2S)-4-{[4-(2-{4-[(3-фторфеніл)аміно]-1-піперидиніл}-2-оксоетил)феніл]метил}2-метил-1-піперазинкарбоксилат (D19) Суміш D18 (27,8 г, 79,8 ммоль), гідрохлориду N-[3-(диметиламіно)]-N'-етилкарбодііміду (22,9 г, 119,7 ммоль), гідрату 1-гідроксибензотриазолу (16,2 г, 119,7 ммоль), триетиламіну (45 мл, 319,1 ммоль) і гідрохлоридної солі D56b (18,4 г, 79,8 ммоль) у сухому ДМФА (400 мл) перемішували при кімнатній температурі протягом ночі. Розчинник видаляли у вакуумі і залишок повторно розчиняли в DCM (300 мл), промивали 2М NaOH (2200 мл), водою (200 мл) і насиченим розчином солі (200 мл). Усі промивні води поєднували і зворотно екстрагували DCM (2100 мл). Об'єднані органічні фракції висушували і концентрували, одержуючи тверду речовину, що очищали хроматографією (діоксид кремнію, попередньо промитий сумішшю 50% EtOAc/гексан). Елюювання сумішшю 70% 35 EtOAc/гексан давало зазначену в заголовку сполуку у вигляді білої твердої речовини (34,95 г). Н (CDCl3, 400МГц) 7,28 (2Н, д), 7,19 (2Н, д), 7,07 (1Н, т), 6,23-6,40 (3Н, м), 4,52 (1Н, м), 4,17 (1Н, м), 3,783,88 (2Н, м), 3,74 (2Н, с), 3,60 (1Н, д), 3,40 (1Н, д), 3,43 (1Н, м), 3,38 (1Н, д), 3,06-3,17 (2Н, м), 2,89 (1Н, м), 2,74 (1Н, м), 2,57 (1Н, м), 1,94-2,13 (4Н, м), 1,45 (9Н, с), 1,32 (1Н, м), 1,21 (3Н, д), 1,09 (1Н, м). MS (ES) MH+ 525. Опис 20 1,1-Диметилетил 4-{[3-(трифторметил)феніл]аміно}-1-піперидинкарбоксилат (D20) Розчин 1,1-диметилетил 4-оксо-1-піперидинкарбоксилату (0,5 г, 2,5 ммоль), 3(трифторметил)аніліну (0,402 г, 2,5 ммоль) і три(ацетокси)боргідриду натрію (0,80 г, 3,75 ммоль) в 1,2-DCE (5 мл) перемішували при кімнатній температурі в атмосфері аргону протягом ночі. Додавали насичений водний розчин NаНСО3 (15 мл) і перемішування продовжували протягом 1 години. Реакційну суміш екстрагували DCM і органічну фазу концентрували у вакуумі. Перекристалізація твердого залишку давала зазначену в заголовку сполуку у вигляді білої твердої речовини (0,86 г). Н (CDCI3, 250МГц) 7,25 (1H, т), 6,92 (1Н, д), 6,75 (2Н, м), 4,06 (2Н, м), 3,45 (1Н, м), 2,94 (2Н, м), 2,04 (2Н, м), 1,46 (9Н, с), 1,36 (2Н, м). Опис 21 N-[3-(Трифторметил)феніл]-4-піперидинамін (D21) Розчин із двох об'єднаних експериментів D20 (0,86 г, 2,5 ммоль) в DCM (40 мл) обробляли ТФОК (10 мл) і реакційну суміш перемішували при кімнатній температурі в атмосфері аргону протягом 2 годин. Розчинник видаляли у вакуумі і залишок розподіляли між DCM і водою. Водний шар підлужували до pH 14 2М розчином NaOH, потім екстрагували EtOAc (5). Об'єднані органічні фракції висушували (Na2SO4) і концентрували у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді прозорої олії (0,64 г). δΗ (CDCI3, 250МГц) 7,24 (1Н, т), 6,90 (1Н, д), 6,74 (2Н, м), 3,75 (1Н, м), 3,40 (1Н, м), 3,14 (2Н, м), 2,74 (2Н, м), 2,07 (2Н, м), 1,34 (2Н, м). Опис 22 1,1-Диметилетил 4-{[4-(трифторметил)феніл]аміно}-1-піперидинкарбоксилат (D18) Зазначену в заголовку сполуку одержували з 1,1-диметилетил 4-оксо-1-піперидинкарбоксилату і 4-трифторметиланіліну з використанням способу, аналогічного описаному для D20. Опис 23 N-[4-(Трифторметил)феніл]-4-піперидинамін (D23) Зазначену в заголовку сполуку одержували з D22 з використанням способу, аналогічного описаному для D21. Опис 24 Феніл метил 4-[(4-бромфеніл)метил]-1піперазинкарбоксилат (D24) Зазначену в заголовку сполуку одержували з фенілметил 1-піперазинкарбоксилату і 4бромбензальдегіду з використанням способу, аналогічного описаному для D6. Опис 25 93878 36 Діетил {4-[(4-{[(фенілметил)окси]карбоніл}-1піперазиніл)метил]феніл}пропандіоат (D25) Зазначену в заголовку сполуку одержували з D24 з використанням способу, аналогічного описаному для D7. Опис 26 {4-[(4-{[(Фенілметил)окси]карбоніл}-1піперазиніл)метил]феніл}оцтова кислота (D26) Розчин D25 (304 мг, 0,65 ммоль) в 2М розчині NaOH (10 мл) і ТГФ (10 мл) перемішували при кімнатній температурі протягом 1 години, потім при 40°С протягом 1 години. Додавали 2М НСІ, доводячи розчин до pH 6, з наступним нагріванням до 60°С протягом ночі. Розчинник видаляли у вакуумі і залишок розподіляли між водою і EtOAc. Органічний екстракт висушували і концентрували, одержуючи зазначену в заголовку сполуку (145 мг). MS (ES): MH+ 369, (М-Н)- 367. Опис 27 Фенілметил (2R)-2-метил-4-({4-[2-(метилокси)2-оксоетил]феніл}метил)-1-піперазинкарбоксилат (D27) Суміш D16 (243 мг, 1 ммоль), діізопропілетиламіну (174 мкл, 1 ммоль) 1,1-диметилетил (2R)-2метил-1-піперазинкарбоксилату (234 мг, 1 ммоль) в ДМФА перемішували при кімнатній температурі протягом 1 години, потім залишали стояти протягом ночі. Розчинник видаляли у вакуумі, потім залишок розбавляли водою (20 мл) і екстрагували EtOAc (220 мл). Об'єднані органічні екстракти висушували (MgSO4) і концентрували у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді жовтої олії (383 мг). δΗ (CDCI3, 250МГц) 7,217,40 (9Н, м), 5,13 (2Н, AB), 4,29 (1Н, м), 3,91 (1Н, м), 3,70 (3Н, с), 3,62 (2Н, с), 3,43 (2Н, м), 3,20 (1Н, м), 2,78 (1Н, м), 2,62 (1Н, м), 2,05-2,18 (2Н, м), 1,29 (3Н, д). Опис 28 {4-[((3R)-3-метил-4{[(фенілметил)окси]карбоніл}-1-піперазиніл)метил]феніл}оцтова кислота (D28) Розчин D27 (380 мг, 0,96 ммоль) в ТГФ (4 мл) і 2М розчині NaOH (1 мл) перемішували при кімнатній температурі протягом ночі. Додавали воду (10 мл) і розчин промивали EtOAc (20 мл). Водну фазу доводили до pH 6 і екстрагували EtOAc (220 мл). Об'єднані екстракти промивали насиченим розчином солі, висушували (MgSO4) і концентрували у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді безбарвної смоли (255 мг). δΗ (CDCI3, 250МГц) 7,20-7,40 (9Н, м), 5,12 (2Н, AB) 4,29 (1Н, м), 3,91 (1Н, д), 3,61 (2Н, с), 3,51 (2Н, AB), 3,20 (1Н, м), 2,85 (1Н, д), 2,69 (1Н, д), 2,20 (1Н, м), 2,10 (1Н, м), 1,29 (3Н, м). Опис 29 Фенілметил (2R)-4-{[4-(2-{4-[(3-фторфеніл)аміно]-1-піперидиніл}-2-оксоетил)феніл]метил}2-метил-1-піперазинкарбоксилат (D29) Суміш D28 (100 мг, 0,261 ммоль), гідрохлориду N-[3-(диметиламіно)пропіл]-N'-етилкарбодііміду (75 мг, 0,392 ммоль), 1-гідроксибензотриазолу (53 мг, 0,392 ммоль), триетиламіну (110 мкл, 0,784 ммоль) і гідрохлоридної солі D5b (60 мг, 0,261 ммоль) в ДМФА (2 мл) перемішували при кімнатній температурі протягом 3 днів. Розчинник видаляли у ва 37 куумі і залишок очищали хроматографією. Елюювання сумішшю 0-10% MeOH/DCM давало зазначену в заголовку сполуку у вигляді безбарвної олії (136 мг). δΗ (CDCI3, 400МГц) 7,31-7,38 (5Н, м), 7,28 (2Н, д), 7,19 (2Н, д), 7,07 (1Н, т), 6,23-6,39 (3Н, м), 5,13 (2Н, AB), 4,52 (1Н, м), 4,27 (1Н, шир.с), 3,88 (2Н, м), 3,74 (2Н, с), 3,62 (1Н, шир.с), 3,44 (3Н, м), 3,16 (2Н, м), 2,88 (1Н, м), 2,76 (1Н, д), 2,59 (1Н, д), 1,94-2,15 (4Н, м), 1,32 (1Н, м), 1,26 (3Н, м), 1,08 (1Н, м). MS (ES): MH+ 559. Опис 30 1,1-Диметилетил 4-[(4-ціанофеніл)окси]-1піперидинкарбоксилат (D30) Зазначену в заголовку сполуку одержували з 4-гідроксибензонітрилу і 1,1-диметилетил 4гідрокси-1-піперидинкарбоксилату з використанням способу, аналогічного описаному для D13. Опис 31 4-(4-Піперидинілокси)бензонітрил (D31) Зазначену в заголовку сполуку одержували з D30 з використанням способу, аналогічного описаному для D14. Опис 32 2-[4-бром-2-(метилокси)феніл]-1,3-діоксолан (D32) Зазначена в заголовку сполука може бути отримана з використанням способу, описаного в A. Tromelin, P. Demerseman, R. Royer, P. Gayral and J. Fourniat, European Journal of Medicinal Chemistry 1986, 21(5), 397-402. Опис 33 Діетил [4-(1,3-діоксолан-2-іл)-3-(метилокси)феніл]пропандіоат (D33) Суміш D32 (200 мг, 0,81 ммоль), діетил малонату (155 мг, 0,97 ммоль), ацетату паладію(ІІ) (5,4 мг, 0,024 ммоль), фосфату калію (395 мг, 2 ммоль) і біс(1,1-диметилетил)(2'-метил-2-біфеніліл)фосфану (16,6 мг, 0,053 ммоль) у сухому 1,4-діоксані (10 мл) нагрівали при 120°С в атмосфері аргону протягом 7 годин. Водна обробка (вода/EtOAc) з наступним очищенням хроматографією (50% Еt2О/петролейний ефір) давала зазначену в заголовку сполуку (191 мг). Н (CDCI3, 400МГц) 7,51 (1Н, д), 6,99 (2Н, м), 6,14 (1Н, с), 4,60 (1Н, с), 4,23 (4Н, м), 4,12 (2Н, м), 4,04 (4Н, м), 3,88 (3Н, с), 1,24 (6Н, т). MS (ES): MH+ 339. Опис 34 Діетил [4-форміл-3-(метилокси)феніл]пропандіоат (D34) Розчин D33 (191 мг, 0,56 ммоль) в ТГФ (5 мл) і 2М НСІ (5 мл) перемішували при кімнатній температурі протягом 1 години. Розчинник видаляли у вакуумі і після водної обробки (вода/EtOAc) одержували зазначену в заголовку сполуку (149 мг). Н (CDCI3, 400МГц) 10,45 (1Н, с), 7,81 (1Н, д), 7,11 (1Н, с), 7,04 (1Н, д), 4,64 (1Н, с), 4,23 (4Н, м), 3,95 (3Н, с), 1,27 (6Н, т). MS (ES): MH+ 295. Опис 35 Діетил [4-[((3S)-4-{[(1,1-диметилетил)окси]карбоніл}-3-метил-1-піперазиніл)метил]-3(метилокси)феніл]пропандіоат (D35) Зазначену в заголовку сполуку одержували з D34 і 1,1-диметилетил (2S)-2-метил-1піперазинкарбоксилату з використанням способу, аналогічного описаному для D6. 93878 38 Опис 36 [4-[((3S)-4-{[(1,1-Диметилетил)окси]карбоніл}3-метил-1-піперазиніл)метил]-3(метилокси)феніл]оцтова кислота (D36) Зазначену в заголовку сполуку одержували з D35 з використанням способу, аналогічного описаному для D26. Опис 37 1,1-Диметилетил(2S)-4-{[4-(2-{4-[(3фторфеніл)аміно]-1-піперидиніл}-2-оксоетил)-2(метилокси)феніл]метил}-2-метил-1піперазинкарбоксилат (D37) Суміш D36 (90 мг, 0,24 ммоль), DCC на полімерній підкладці (225 мг, 1,6 ммоль/г, 0,36 ммоль), D5b (46 мг, 0,24 ммоль) і 1-гідроксибензотриазолу (49 мг, 0,36 ммоль) в ДМФА (9 мл) і DCM (3 мл) перемішували при кімнатній температурі протягом ночі. Додавали поглинаючі смоли (PS-трисамін, PS-ізоціанат і МР-карбонат) і суміш перемішували протягом 2 годин, потім фільтрували. Очищення хроматографією давала зазначену в заголовку сполуку (42 мг). MS (ES): MH+ 555. Опис 38 1,1-Диметилетил 4-[(3-ціано-4-фторфеніл)аміно]-1-піперидинкарбоксилат (D38) Зазначену в заголовку сполуку одержували з 5-бром-2-фторбензонітрилу і 1,1-диметилетил 4аміно-1-піперидинкарбоксилату з використанням способу, аналогічного описаному для D10a. Опис 39 2-фтор-5-(4-піперидиніламіно)бензонітрил (D39) Зазначену в заголовку сполуку одержували з D38 з використанням способу, аналогічного описаному для D10b. Опис 40 1,1-Диметилетил (2S)-4-{[4-(2-{4-[(3-ціано-4фторфеніл)аміно]-1-піперидиніл}-2оксоетил)феніл]метил}-2-метил-1піперазинкарбоксилат (D40) Зазначену в заголовку сполуку одержували з D8 і D39 з використанням способу, аналогічного описаному для D29, але реакція протікала протягом ночі і водну обробку (DCM/вода) проводили перед хроматографією. Опис 41 4-(3-{4-[(4-Фторфеніл)аміно]-1-піперидиніл}-3оксопропіл)бензальдегід (D41) Стадія 1: (2Е)-3-(4-формілфеніл)-2-пропенову кислоту (2,55 г) розчиняли в ЕtOН (250 мл) і гідрували при атмосферному тиску над 10% Pd/C (0,8 г) як каталізатор. Через 5 годин реакційну суміш фільтрували і концентрували, одержуючи суміш 1:1 3-[4-(гідроксиметил)феніл]пропанової кислоти і 3(4-метилфеніл)пропанової кислоти (2,43 г). Стадія 2: кислотну суміш зі стадії 1 (500 мг), гідрохлорид N-[3-(диметиламіно)пропіл]-N'етилкарбодііміду (723 мг, 3,78 ммоль), 1гідроксибензотриазол (578 мг, 3,78 ммоль) в ДМФА (10 мл) обробляли D2 (561 мг, 2,9 ммоль) і суміш перемішували при кімнатній температурі протягом 2 годин. ДМФА видаляли у вакуумі і додавали EtOAc і воду. Водний шар екстрагували EtOAc і об'єднані органічні фракції промивали насиченим водним розчином NаНСО3 і насиченим 39 розчином солі, потім висушували (Na2SO4) і концентрували з одержанням суміші [4-(3-{4-[(4фторфеніл)аміно]-1-піперидиніл}-3оксопропіл)феніл]метанолу і N-(4-фторфеніл)-1-[3(4-метилфеніл)пропаноїл]-4-піперидинаміну (1,1 г). Стадія 3: речовину цілком розчиняли в DCM (20 мл) і обробляли діоксидом марганцю (2 г). Після перемішування протягом ночі додавали додатково діоксид марганцю (5 г) і перемішування продовжували протягом 30 хвилин. Суміш фільтрували, концентрували й очищали хроматографією (10-90% EtOAc/пентан), одержуючи зазначену в заголовку сполуку у вигляді жовтої смоли (282 мг). MS (ES): МН+ 355. Опис 42 4-(3-{4-[(3-Фторфеніл)аміно]-1-піперидиніл}-3оксопропіл)бензальдегід (D42) Зазначену в заголовку сполуку одержували з D5b з використанням способу, аналогічного описаному для D41. Опис 43 1,1-Диметилетил (2R,6S)-4-[(4-бромфеніл)метил]-2,6-диметил-1-піперазинкарбоксилат (D43) Суміш 4-бромбензальдегіду (1,85 г, 10 ммоль), 1,1-диметилетил (2R,6S)-2,6-диметил-1-піперазинкарбоксилату (2,15 г, 10 ммоль) і триацетоксиборгідриду натрію (3,18 г) в 1,2-DCE (35 мл) перемішували при кімнатній температурі протягом 3 днів. Додавали насичений водний розчин NаНСО3 і суміш перемішували протягом 30 хвилин. Продукт екстрагували в EtOAc і екстракти висушували (Na2SO4) і концентрували. Залишок розчиняли в DCM і обробляли PS-гідразиновою смолою при перемішуванні протягом 2 годин. Смолу видаляли фільтруванням і розчинник видаляли у вакуумі. Хроматографія (0-40% EtOAc/гексан) давала зазначену в заголовку сполуку (3,52 г). MS (ES): MH+ 383/385. Опис 44 Діетил {4-[((3S)-4-{[(1,1-диметилетил)окси]карбоніл}-3-метил-1-піперазиніл)метил]феніл}пропандіоат (D44) Зазначену в заголовку сполуку одержували з D43 з використанням способу, аналогічного описаному для D7. Опис 45 Діетил {4-[((3S)-4-{[(1,1-диметилетил)окси]карбоніл}-3-метил-1-піперазиніл)метил]феніл}(метил)пропандіоат (D45) Розчин D44 (538 мг, 1,16 ммоль) в ДМФА (10 мл) додавали по краплинах до гідриду натрію (61 мг, 60% мас/мас, в олії, 1,51 ммоль) в ДМФА (2 мл) при 0°С в атмосфері аргону. Після перемішування протягом 10 хвилин додавали метилйодид (0,144 мл, 2,32 ммоль) і реакційній суміші давали нагрітися до кімнатної температури за 1 годину. Додавали розчин хлориду амонію і суміш екстрагували EtOAc. Екстракти промивали насиченим водним розчином NаНСО3 і водою, потім висушували (Na2SO4) і концентрували у вакуумі. Хроматографія з елююванням сумішшю 0-10% EtOAc/гексан давала зазначену в заголовку сполуку у вигляді прозорої смоли (356 мг). MS (ES): MH+ 477. Опис 46 93878 40 2-{4-[((3S)-4-{[(1,1-Диметилетил)окси]карбоніл}-3-метил-1-піперазиніл)метил]феніл}пропанова кислота (D46) Розчин D45 (356 мг, 1,34 ммоль) у 2М розчині NaOH (3 мл) і 1,4-діоксані (3 мл) перемішували при кімнатній температурі протягом 1 години, потім при 80°С протягом 3 годин. Розчинники видаляли у вакуумі, додавали воду і суміш доводили до pH 4 за допомогою 2М НСІ. Продукт екстрагували в EtOAc і екстракти промивали насиченим розчином солі, потім висушували (Na2SO4) і концентрували, одержуючи зазначену в заголовку сполуку (256 мг). δΗ (CDCI3, 400МГц) 7,32 (2Н, д), 7,27 (2Н, д), 4,10 (2Н, м), 3,74 (1Н, кв.), 3,49 (2Н, шир. с), 2,64 (2Н, м), 2,14 (2Н, м), 1,52 (3Н, д), 1,46 (9Н, с), 1,30 (6Н, д). MS (ES): MH+ 377. (М-Н+) 375. Опис 47 1,1-Диметилетил (2R,6S)-4-({4-[1,1-диметил-2(метилокси)-2-оксоетил]феніл}метил)-2,6-диметил1-піперазинкарбоксилат (D47) Розчин метил 2-метилпропаноату (188 мкл, 1,64 ммоль) в толуолі (3 мл) додавали до дициклогексиламіду літію (362 мг, 1,93 ммоль) в умовах сухого боксу з рукавичками. Суспензію перемішували протягом 10 хвилин, потім додавали до суміші D43 (570 мг, 1,49 ммоль) і біс(дибензиліденацетон)паладію (0) (43 мг, 0,074 ммоль). Додавали три(трет-бутил)фосфін (18 мкл, 0,074 ммоль) і реакційну суміш перемішували при кімнатній температурі протягом ночі. Розчинник видаляли у вакуумі і хроматографували, елюючи сумішшю 0-90% EtOAc/петролейний ефір, з одержанням зазначеної в заголовку сполуки у вигляді жовтої олії (395 мг). Н (CDCI3, 250МГц) 7,29 (4Н, м), 4,07 (2Н, м), 3,66 (3Н, с), 3,46 (2Н, с), 2,61 (2Н, м), 2,12 (2Н, дд), 1,58 (6Н, с), 1,46 (9Н, с), 1,29 (6Н, д). MS (ES): MH+405. Опис 48 2-{4-[((3R,5S)-4-{[(1,1-Диметилетил)окси]карбоніл}-3,5-диметил-1-піперазиніл)метил]феніл}-2метилпропанова кислота (D48) Суміш D47 (395 мг, 0,978 ммоль) і моногідрату гідроксиду літію (82 мг, 1,95 ммоль) у воді (5 мл) і 1,4-діоксані (10 мл) перемішували при кімнатній температурі протягом 3 днів. Розчинники видаляли у вакуумі і залишок розчиняли у воді. Розчин промивали ефіром, підкислювали до pH 4 1М НСІ, потім екстрагували DCM (2). Об'єднані органічні фракції висушували (Na2SO4) і концентрували у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді жовтої піни (316 мг). Н (CDCl3, 250МГц) 7,35 (4Н, м), 4,11 (2Н, шир.), 3,71 (2Н, шир.), 2,67 (2Н, шир.), 2,17 (2Н, шир.), 1,61 (6Н, с), 1,46 (9Н, с), 1,33 (6Н, шир. д). MS (ES): MH+ 391, (М-Н+) 389. Опис 49 Етил (2Е)-3-(5-форміл-2-піридиніл)-2пропеноат (D49) Суміш 2-бром-5-формілпіридину (500 мг, 2,6 ммоль), метилакрилату (0,6 мл, 6,5 ммоль), три-(отоліл)фосфіну (80 мг, 0,26 ммоль), димеру хлориду алілпаладію(ІІ) (47 мг, 0,13 ммоль) і ацетату натрію (1,08 г, 8 ммоль) в ДМФА (10 мл) нагрівали при 170°С у мікрохвильовому реакторі протягом 0,75 години. Реакційну суміш фільтрували через Целіт®, потім розбавляли DCM і водою. Органічну 41 фазу висушували, концентрували у вакуумі й очищали хроматографією, одержуючи зазначену в заголовку сполуку у вигляді білої твердої речовини (50 мг). Н (CDCl3, 250МГц) 10,14 (1Н, с), 9,09 (1Н, д), 8,19 (1Н, дд), 7,72 (1Н, д), 7,57 (1Н, д), 7,08 (1Н, д), 3,85 (3Н, с). MS (ES): MH+ 192. Опис 50 Феніл метил (2S)-4-({6-[(1Е)-3-(етилокси)-3оксо-1-пропен-1-іл]-3-піридиніл}метил)-2-метил-1піперазинкарбоксилат (D50) Зазначену в заголовку сполуку одержували з D49 і фенілметил (2S)-2-метил-1-піперазинкарбоксилату з використанням способу, аналогічного описаному для D6. Опис 51 (2Е)-3-{5-[((3S)-3-метил-4{[(фенілметил)окси]карбоніл}-1-піперазиніл)метил]2-піридиніл}-2-пропенова кислота (D51) Зазначену в заголовку сполуку одержували з D50 з використанням способу, аналогічного описаному для D48, але час реакції складав 3 години. Опис 52 Фенілметил (2S)-4-{[6-((1Е)-3-{4-[(3фторфеніл)аміно]-1-піперидиніл}-3-оксо-1-пропен1-іл)-3-піридиніл]метил}-2-метил-1піперазинкарбоксилат (D52) Зазначену в заголовку сполуку одержували з D51 і D5b з використанням способу, аналогічного описаному для D37. Опис 53 1,1-Диметилетил (2S)-4-({2-хлор-4-[2(метилокси)-2-оксоетил]феніл}метил)-2-метил-1піперазинкарбоксилат (D53) Зазначену в заголовку сполуку одержували з метил (3-хлор-4-формілфеніл)ацетату (Epple, R. et al., PCT Int. Appl. WO2005116000) і гідрохлориду 1,1-диметилетил (2S)-2-метил-1-піперазинкарбоксилату з використанням способу, аналогічного описаному для D6, з додаванням до реакційної суміші триетиламіну (1,1 екв.) і часом реакції приблизно 3 дні. Опис 54 {3-хлор-4-[((3S)-4-{[(1,1диметилетил)окси]карбоніл}-3-метил-1піперазиніл)метил]феніл}оцтова кислота (D54) Зазначену в заголовку сполуку одержували з D53 з використанням способу, аналогічного описаному для D48, з часом реакції 4 години. Опис 55 1,1-Диметилетил (2S)-4-{[2-хлор-4-(2-{4-[(3фторфеніл)аміно]-1-піперидиніл}-2оксоетил)феніл]метил}-2-метил-1піперазинкарбоксилат (D55) Зазначену в заголовку сполуку одержували з D54 і D5b, використовуючи методику, аналогічну описаній для D37, і реакцію проводили в атмосфері аргону. Опис 56 Гідрохлорид N-(3-фторфеніл)-4-піперидинаміну (D56) 3-Фторанілін (28,38 мл, 0,296 моль) додавали до розчину 4-оксо-1-піперидинкарбоксилату (60 г, 0,302 моль) в 1,2-DCE (600 мл) і суміш перемішували протягом 15 хвилин. Поступово додавали три(ацетокси)боргідрид натрію (83 г, 0,392 моль) 93878 42 протягом 5 хвилин і суміш перемішували протягом 5,5 годин, потім виливали в суміш 2М НСІ (100 мл), води (200 мл) і льоду (1 л). Фази розділяли і водну фазу екстрагували DCM (200 мл). Об'єднані органічні фази висушували над MgSO4 і концентрували, одержуючи ясно-жовту тверду речовину, що розчиняли в МеОН (400 мл) і обробляли 2М НСІ (100 мл). Отриманий розчин перемішували при 60°С протягом ночі. Додавали 5М НСІ (100 мл) і нагрівання продовжували ще протягом 7 годин. Реакційну суміш концентрували у вакуумі, одержуючи жовту масляну тверду речовину. Її перекристалізовували із суміші МеОН/EtOAc, одержуючи дві порції зазначеної в заголовку сполуки (42,6 г і 17,0 г). Ці порції потім перекристалізовували із суміші IMS/EtOAc і отримані порції висушували у вакуумі при 50°С з одержанням зазначеної в заголовку сполуки (загальний вихід 49,0 г). Н (MeOD, 250МГц) 7,54 (1Н, кв.), 7,24 (2Н, м), 7,15 (1Н, т), 3,89 (1Н, м), 3,54 (2Н, д), 3,11 (2Н, т), 2,24 (2Н, д), 2,01 (2Н, м). Опис 57 1,1-Диметилетил 4-[(3-фторфеніл)аміно]-1піперидинкарбоксилат (D57) Триацетоксиборгідрид натрію (NаВН(ОАс)3 74 г, 0,35 моль) додавали до перемішуваного розчину 1,1-диметилетил 4-оксо-1-піперидинкарбоксилату (50 г, 0,25 моль) і 3-фтораніліну (24 мл, 0,25 моль) в ізопропілацетаті (і-РrОАс, 500 мл) і суспензію перемішували протягом ночі. Опис 58 N-(3-Фторфеніл)-4-піперидинамін (D58) До суспензії, отриманої в D57, додавали воду (250 мл), суміш перемішували і нагрівали до 3035°С і шари розділяли. Додавали 5М водну сірчану кислоту (75 мл) і суміш перемішували при 50-55°С протягом 5 годин. Додавали воду (250 мл), суміш прохолоджували до 30-35°С і шари розділяли. Водний розчин розбавляли третбутилметиловим ефіром (ТВМЕ, 250 мл), суміш перемішували протягом 1 хв. і підлужували до pH 12-14 обережним додаванням 32% мас./мас. водного NaOH (140 г, 100 мол), підтримуючи температуру між 30 і 35°С. Шари розділяли і водний шар екстрагували свіжим ТВМЕ (250 мл). Об'єднані органічні екстракти промивали при 25-35°С 20% мас./об. водним NaCI (200 мл). Водний шар відкидали й органічний розчин переганяли при атмосферному тиску до кінцевого об'єму близько 200 мл і прохолоджували до 50°С. Повільно додавали ізооктан (250 мл) при 4550°С, видаляли нагріваючу баню і реакційну суміш прохолоджували до 20-25°С. Розчин перемішували при 20-25°С протягом ночі. Додавали ізооктан (250 мл), суспензію нагрівали до 40°С і відганяли у вакуумі до кінцевого об'єму 250 мл, підтримуючи температуру між 30 і 40°С. Кінцеву суспензію прохолоджували до 0-5°С (у крижаній воді), перемішували протягом 40 хв., фільтрували, твердий залишок промивали ізооктаном (2100 мл) і висушували у вакуумі при 44°С протягом 3 годин, одержуючи зазначений у заголовку продукт (33,5 г). δΗ (ДМСО-d6, 400МГц) 7,04 (1Н, кв.), 6,40 (1Н, м), 6,31 (1Н, м), 6,23 (1Н, м), 5,77 (1Н, д), 3,50-2,60 (1Н 43 шир. с), 3,23 (1Н, м), 2,93 (2Н, м), 2,55 (2Н, м), 1,85 (2Н, м), 1,20 (2Н, м). Опис 59 {4-[((3S)-4-{[(1,1-Диметилетил)окси]карбоніл}3-метил-1-піперазиніл)метил]феніл}оцтова кислота (D59) [4-(Бромметил)феніл]оцтову кислоту (75 г, 0,33 моль) додавали до 4-метил-2-пентанону (МІВК, 750 мл), охолодженого до 7°С, і додавали хіральний піперазин (1,1-диметилетил (2S)-2метил-1-піперазинкарбоксилат, 72 г, 0,36 моль) одною порцією. Суспензію прохолоджували до 5°С і по краплинах додавали діізопропілетиламін (DIPEA, 112 мл, 0,64 моль) протягом 21 хв., підтримуючи температуру нижче 5°С. Після цього додавання суспензію перемішували при 3°С протягом ночі. Додавали гідроксид натрію (1М, 750 мл), реакційну суміш доводили до 21 °С і шарам давали розділитися. Реакційну ємкість промивали водою (250 мл) і водний шар повертали в реакційну ємкість. Додавали свіжий МІВК (375 мл) і суміш, що перемішується, підкислювали приблизно до pH 5 додаванням концентрованої соляної кислоти. Вміст ємкості інтенсивно перемішували протягом 5 хв., фази розділяли і водну фазу екстрагували додатковою кількістю МІВК (2375 мл), щораз доводячи pH водного шару до 5,1-5,3. Органічні фази поєднували (приблизно 1,5 літра) і видаляли 500 мл розчинника. Потім реакційну суміш прохолоджували до кімнатної температури протягом ночі і видаляли ще 500 мл розчинника, залишаючи кінцевий об'єм 600 мл (8 об'ємів), з одержанням безводного розчину зазначеного в заголовку продукту. Опис 60 1,1-Диметилетил (2S)-4-{[4-(2-{4-[(3фторфеніл)аміно]-1-піперидиніл}-2оксоетил)феніл]метил}-2-метил-1піперазинкарбоксилат Карбонілдиімідазол (CDI, 53 г, 0,33 моль) додавали до безводного розчину D59 (охолодженого до кімнатної температури) двома порціями з інтервалом 15 хв. після кожного додавання. Отриману суміш нагрівали до 62°С і перемішували протягом 15 хв. Одною порцією додавали D58 (63,5 г, 0,33 моль), викликаючи слабку екзотермічну реакцію, що нагріває вміст до 68°С. Суміш прохолоджували до 62°С і перемішували протягом 2 годин, потім прохолоджували до 0°С протягом 2 годин і витримували при 0°С протягом ночі. Кінцеву суспензію фільтрували, тверду речовину промивали охолодженим льодом МІВК (375 мл), висушували у вакуумі при 50°С протягом ночі, одержуючи зазначений у заголовку продукт (142 г). Н (CDCl3, 500МГц) 1,08 (1Н, м), 1,23 (3Н, д), 1,35 (1Н, м), 1,45 (9Н, с), 1,95 (1Н, м), 2,05 (2Н, м), 2,10 (1Н, м), 2,57 (1Н, д), 2,73 (1Н, д), 2,89 (1Н, м), 3,10 (2Н, м), 3,37 (1Н, д), 3,40 (1Н, м), 3,50 (1Н, д), 3,60 (1Н, шир. с), 3,73 (2Н, с), 3,77 (1Н, м), 3,85 (1Н, м), 4,15 (1Н, м), 4,51 (1Н, м), 6,24 (1Н, м), 6,31 (1Н, м), 6,38 (1Н, м), 7,06 (1Н, м), 7,19 (2Н, м), 7,27 (2Н, м). Приклад 1 1-[(4-{[(3R,5S)-3,5-Диметил-1піперазиніл]метил}феніл)ацетил]-N-(4-фторфеніл)4-піперидинамін (Е1) 93878 44 Суміш D4 (149 мг, 0,438 ммоль) і 1,1диметилетил (2R,6S)-2,6-диметил-1піперазинкарбоксилату (94 мг, 0,438 ммоль) в 1,2DCE (3 мл) перемішували протягом 5 хвилин при кімнатній температурі. Додавали три(ацетокси)боргідрид натрію (139 мг, 0,66 ммоль) і суміш перемішували протягом 3 годин, потім додавали насичений водний розчин NаНСО3. Суміш перемішували протягом 15 хвилин, потім екстрагували EtOAc. Об'єднані екстракти висушували (Na2SO4) і концентрували у вакуумі, одержуючи неочищений продукт, який очищали хроматографією. Елюювання сумішшю 20-90% EtOAc/пентан давало 1,1-диметилетил (2R,6S)-4{[4-(2-{4-[(4-фторфеніл)аміно]-1-піперидиніл}-2оксоетил)феніл]метил}-2,6-диметил-1піперазинкарбоксилат (143 мг). δΗ (CDCI3, 400МГц) 1,06 (1Н, м), 1,27 (6Н, д), 1,30 (1Н, м), 1,46 (9Η, с), 1,93 (1Н, м), 2,05 (1Н, м), 2,12 (2Н, дд), 2,59 (2Н, д), 2,88 (1Н, м), 3,13 (1Н, м), 3,29 (1Н, м), 3,38 (1Н, м), 3,45 (2Н, с), 3,74 (2Н, с), 3,86 (1Н, м), 4,07 (2Н, м), 4,50 (1Н, м), 6,50 (2Н, м), 6,87 (2Н, т), 7,20 (2Н, м), 7,31 (2Н, д). MS (ES): MH+ 539. Речовину цілком розчиняли в суміші 2:1 DCM/ΤΦΟΚ і перемішували протягом 1 години. Суміш концентрували і вільну основу зазначеної в заголовку сполуки виділяли з використанням картриджу Isolute SCX. Н (CDCl3, 400МГц) 1,01 (6Н, д), 1,06 (1Н, м), 1,29 (1Н, м), 1,62 (2Н, т), 1,93 (1Н, м), 2,04 (1Н, м), 2,74 (2Н, д), 2,83-2,94 (3Н, м), 3,12 (1Н, м), 3,36 (2Н, м), 3,46 (2Н, с), 3,73 (2Н, с), 3,86 (1Н, м), 4,51 (1Н, м), 6,55 (2Н, м), 6,86 (2Н, т), 7,20 (2Н, м), 7,26 (2Н, д). MS (ES): MH+ 439. Цю речовину цілком перетворювали в дигідрохлоридну сіль зазначеної в заголовку сполуки (104 мг). Приклад 2 N-(3-Фторфеніл)-1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін (Е2) Суміш D8 (115 мг, 0,3 ммоль), DCC на полімерній підкладці (270 мг, 1,7 ммоль/г, 0,45 ммоль) і 1гідроксибензотриазолу (55 мг, 0,36 ммоль) у суміші 2:1 ДМФА/DCM (3 мл) обробляли D5b (58 мг, 0,3 ммоль) і перемішували протягом ночі. Поглинаючі 45 смоли (РS-трисамін, PS-ізоціанат та Si-карбонат) додавали разом з DCM (-3 мл). Суміш перемішували протягом приблизно 2 годин і потім фільтрували і концентрували. Хроматографія (0-60% EtOAc/пентан) давала фенілметил (2S)-4-{[4-(2-{4[(3-фторфеніл)аміно]-1-піперидиніл}-2оксоетил)феніл]метил}-2-метил-1піперазинкарбоксилат (81,6 мг). MS (ES): MH+ 559. Цю речовину цілком гідрували в МеОН (5 мл) з каталізатором 10% Pd/C (~20 мг) протягом 2 годин. Хроматографія (0-20% MeOH/DCM) давала зазначену в заголовку сполуку (29,6 мг). δΗ (CDCI3, 400МГц) 7,26 (2Н, д), 7,20 (2Н, м), 7,06 (1Н, кв.), 6,36 (1Н, м), 6,31 (1Н, м), 6,25 (1Н, м), 4,52 (1Н, м), 3,86 (1Н, м), 3,73 (2Н, с), 3,66 (1Н, м), 3,48 (2Н, с), 3,41 (1Н, м), 2,84-3,16 (6Н, м), 2,76 (2Н, д), 2,032,13 (2Н, м), 1,94 (1Н, м), 1,78 (1Н, т), 1,34 (1Н, м), 1,05 (4Н, м). MS (ES): MH+ 425. Цю речовину цілком обробляли 1,1 екв. 1М НСІ у Еt2О, одержуючи гідрохлоридну сіль зазначеної в заголовку сполуки (25 мг). MS (ES): MH+ 425. Приклад 2: Альтернативний спосіб (А) N-(3-Фторфеніл)-1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін (Е2) Розчин D19 (83,01 г, 0,158 моль) в DCM (900 мл) розділяли на дві порції і кожну прохолоджували до 0°С і обробляли ТФОК (100 мл). Після перемішування протягом 0,5 години при 0°С реакційні суміші нагрівали до кімнатної температури і перемішували протягом 3,25 годин. Розчинник видаляли у вакуумі, залишки поєднували і розподіляли між DCM і 2М розчином NaOH. Водну фазу повторно екстрагували DCM (2) і об'єднані органічні фракції потім промивали 2М NaOH і насиченим розчином солі. Органічні фракції висушували і концентрували у вакуумі з одержанням не зовсім білої твердої речовини. NaOH-фази повторно екстрагували DCM, що висушували і концентрували, одержуючи додаткову порцію білої піни. Дві порції поєднували, одержуючи зазначену в заголовку сполуку у вигляді не зовсім білої твердої речовини (66,94 г). MS (ES): MH+ 425. Цю речовину (66,22 г, 0,156 ммоль) розчиняли в EtOAc (1,7 л) при 45-50°С з одержанням гомогенного ясно-жовтого розчину, що потім прохолоджували до кімнатної температури і продували аргоном. При інтенсивному перемішуванні додавали 1М НСІ в Et2O (156 мл, 0,156М) і після ще 15 хвилин отриманий світло-кремовий осад збирали фільтруванням в атмосфері аргону. Речовину промивали додатково EtOAc (0,8 л) і частково висушували на фільтрі в атмосфері аргону протягом 15 хвилин. Тверду речовину потім висушували при 80°С у вакуумі, одержуючи гідрохлоридну сіль зазначеної в заголовку сполуки (58,95 г). MS (ES): MH+ 425. 93878 46 Приклад 2: Альтернативний спосіб (В) N-(3-фторфеніл)-1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін (Е2) Суміш D60 (20 г, 0,038 моль) і 1М сірчаної кислоти (80 мл, 4 об'єми) нагрівали до 55°С±3°С і суспензію перемішували протягом 90 хв. Розчин прохолоджували до 25°С і екстрагували і-РrOАс (100 мл, 5 об'ємів). Розчин сірчаної кислоти розбавляли свіжим і-РrOАс (100 мл, 5 об'ємів) і суміш підлужували до pH 12-14 повільним додаванням 32% мас./мас. гідроксиду натрію (23 г, 1,15 за масою), підтримуючи температуру між 20°С і 30°С. Водний шар відокремлювали, екстрагували ще двічі і-РrOАс (2100 мл) і об'єднані органічні екстракти промивали 20% мас./об. водним розчином NaCI (60 мл, 3 об'єми). Органічний розчин відганяли при атмосферному тиску до кінцевого об'єму 200 мл і розбавляли свіжим і-РrOАс (100 мл, 5 об'ємів). Розчин нагрівали при кипінні зі зворотним холодильником, фільтрували гарячим через фільтрувальний папір і відганяли при атмосферному тиску до кінцевого об'єму 200 мл. Потім розчин повільно прохолоджували протягом 1 години до 30°С і отриману суспензію прохолоджували до 5°С і перемішували протягом 45 хв. Залишок збирали фільтруванням, промивали охолодженим і-РrOАс (22 об'єми) і висушували у вакуумі протягом ночі, одержуючи зазначений у заголовку продукт (12,63 г). 6н (CDCI3, 400МГц) 7,27 (2Н, д), 7,20 (2Н, м), 7,06 (1Н, кв.), 6,37 (1Н, м), 6,32 (1Н, м), 6,25 (1Н, м), 4,52 (1Н, м), 3,86 (1Н, м), 3,74 (2Н, с), 3,61 (1Н, м), 3,46 (2Н, с), 3,41 (1Н, м), 3,12 (1Н, м), 2,81-2,94 (4Н, м), 2,73 (2Н, м), 1,92-2,06 (3Н, м), 1,65 (1Н, м), 1,30 (1Н, м), 1,07 (1Н, м), 0,99 (3Н, д). Наступні приклади, Е3-Е11, одержували з D8 і амінів, зазначених у таблиці, з використанням способів, аналогічних описаному способу для прикладу 2, але МР-карбонат використовували замість Si-карбонату на стадії утворення аміду і паладієву чернь використовували замість 10%Pd/C на стадії зняття захисту. Сполуки мають загальну структуру: де YR3 представлений прикладами в таблиці нижче 47 Наступний приклад, Е12, одержували з D26 і аміну, зазначеного в таблиці, з використанням способу, аналогічного описаному для прикладу 2, але МР-карбонат використовували замість Siкарбонату на стадії утворення аміду і паладієву чернь використовували замість 10%Pd/C на стадії зняття захисту. Сполуки мають загальну структуру: 93878 48 де YR3 представлений прикладами в таблиці нижче. 49 Приклад 13 N-(3-Фторфеніл)-1-[(4-{[(3R)-3-метил-1піперазиніл]метил}феніл)ацетил]-4-піперидинамін (Е13) Розчин D29 (136 мг, 0,24 ммоль) гідрували в МеОН (5 мл) з каталізатором, паладієвою черню (68 мг), протягом 0,75 години. Реакційну суміш концентрували у вакуумі з одержанням ясножовтої неочищеної олії, що очищали хроматографією. Елюювання 0-10% (2М NН3 в MeOH)/DCM давало зазначену в заголовку сполуку у вигляді безбарвної олії (38 мг). δΗ (CDCI3, 400МГц) 7,27 (2Н, д), 7,20 (2Н, д), 7,07 (1Н, кв.), 6,37 (1Н, м), 6,31 (1Н, м), 6,25 (1Н, д), 4,52 (1Н, м), 3,86 (1Н, м), 3,74 (2Н, с), 3,62 (1Н, м), 3,47 (2Н, с), 3,42 (1Н, м), 3,13 (1Н, м), 2,90 (4Н, м), 2,75 (2Н, м), 2,00 (4Н, м), 93878 50 1,69 (1Н, т), 1,30 (1Н, м), 1,06 (1Н, м), 1,02 (3Н, д). MS (ES): MH+ 425. Цю речовину цілком обробляли 1,1 екв. 1М НСІ в Еt2О, одержуючи гідрохлоридну сіль зазначеної в заголовку сполуки (41 мг). MS (ES): MH+ 425. Наступні приклади, Е14-Е20, одержували з D28 і амінів, зазначених у таблиці, з використанням способів, аналогічних описаному способу для прикладу 2, але МР-карбонат використовували замість Si-карбонату на стадії утворення аміду і паладієву чернь використовували замість 10%Pd/C на стадії зняття захисту. Сполуки мають загальну структуру: де YR3 представлений прикладами в таблиці нижче. 51 Приклад 21 N-(3-Фторфеніл)-1-[(3-(метилокси)-4-{[(3S)-3метил-1-піперазиніл]метил}феніл)ацетил]-4піперидинамін (Е21) Розчин D37 (42 мг, 0,075 ммоль) в DCM (5 мл) обробляли ТФОК (1,3 мл) і реакційну суміш перемішували при кімнатній температурі в атмосфері аргону. Розчинник видаляли у вакуумі і залишок розподіляли між DCM і водою. Водну фазу підлужували до рН14 2М розчином NaOH, потім екстрагували EtOAc (3). Об'єднані органічні фракції висушували і концентрували у вакуумі, одержуючи зазначену в заголовку сполуку у вигляді безбарвної олії (20 мг). Н (CDCl3, 250МГц) 7,27 (1Н, д), 7,07 (1Н, кв.), 6,79 (2Н, м), 6,22-6,41 (3Н, м), 4,52 (1Н, м), 3,87 (1Н, м), 3,81 (3Н, с), 3,74 (2Н, с), 3,65 (1Н, м), 3,54 (2Н, с), 3,40 (1Н, м), 3,14 (1Н, м), 2,792,97 (6Н, м), 1,92-2,22 (4Н, м), 1,77 (1Н, м), 1,27 (1Н, м), 1,07 (1Н, м), 1,02 (3Н, д). MS (ES): MH+ 455. Цю речовину цілком обробляли 1М НСІ в Еt2О (40 мкл), одержуючи гідрохлоридну сіль зазначеної в заголовку сполуки у вигляді кремової твердої речовини (14 мг). MS (ES): MH+ 455. Приклад 22 2-фтор-5-({1-[(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-4піперидиніл}аміно)бензонітрил (Е22) До розчину D40 (133 мг, 0,24 ммоль) в DCM (4 мл), охолодженого в бані з льодом, додавали ТФОК (1 мл). Суміш перемішували протягом 1 години, потім нагрівали до кімнатної температури і перемішували протягом 2 годин. Розчинник видаляли у вакуумі, і очищення хроматографією з елююванням 0-10% (2М NH3 в MeOH)/DCM, потім MDAP давали зазначену в заголовку сполуку у вигляді прозорої твердої речовини (58,5 мг). δΗ 93878 52 (CDCI3, 400МГц) 7,31 (2Н, д), 7,21 (2Н, д), 7,07 (2Н, м), 7,00 (1Н, м), 5,38 (1Н, д), 3,94 (1Н, м), 3,55 (2Н, с), 3,49 (4Н, м), 2,81-2,98 (5Н, м), 2,75 (2Н, м), 2,02 (3Н, м), 1,69 (1Н, т), 1,46 (2Н, м), 1,00 (3Н, д). MS (ES): MH+ 450. Цю речовину цілком розчиняли в DCM і обробляли 1М НСІ в Еt2О (143 мкл), одержуючи гідрохлоридну сіль зазначеної в заголовку сполуки (75 мг). MS (ES): MH+ 450. Приклад 23 1-[3-(4-{[(3R,5S)-3,5-Диметил-1піперазиніл]метил}феніл)пропаноїл]-N-(4фторфеніл)-4-піперидинамін (Е23) До суміші D41 (100 мг, 0,282 ммоль) і 1,1Диметилетил (2R,6S)-2,6-диметил-1піперазинкарбоксилату (61 мг, 0,283 ммоль) в 1,2DCE (5 мл) додавали три(ацетокси)боргідрид натрію (90 мг, 0,423 ммоль) і суміш перемішували при кімнатній температурі протягом ночі. Додавали насичений водний розчин NаНСО3, суміш перемішували протягом 15 хвилин і потім екстрагували EtOAc. Об'єднані екстракти висушували (Na2SO4) і концентрували у вакуумі з одержанням неочищеного продукту, що очищали хроматографією з елююванням сумішшю 0-100% EtOAc/пентан, одержуючи 1,1-диметилетил (2R,6S)-4-{[4-(3-{4-[(4-фторфеніл)аміно]-1піперидиніл}-3-оксопропіл)феніл]метил}-2,6диметил-1-піперазинкарбоксилат. MS (ES): MH+ 553. Речовину цілком розчиняли в суміші 2:1 DCM/ΤΦΟΚ (3 мл) і перемішували протягом 1,5 годин. Суміш концентрували і зазначену в заголовку сполуку (100 мг) виділяли з використанням картриджу Isolute SCX. Н (CDCI3, 400МГц) 7,23 (2Н, д), 7,17 (2Н, д), 6,88 (2Н, т), 6,53 (2Н, м), 4,52 (1Н, м), 3,79 (1Н, м), 3,42 (4Н, м), 3,09 (1Н, м), 2,94 (4Н, м), 2,83 (1Н, м), 2,75 (2Н, м), 2,63 (2Н, м), 2,03 (2Н, м), 1,59 (2Н, т), 1,29 (1Н, м), 1,17 (1Н, м), 1,02 (6Н, д). MS (ES): MH+ 453. Цю речовину цілком розчиняли в DCM і обробляли 1М НСІ в Еt2О (243 мкл), одержуючи гідрохлоридну сіль зазначеної в заголовку сполуки (98 мг). MS (ES): MH+ 453. Наступний приклад, Е24, одержували з D42 з використанням способу, аналогічного описаному для прикладу 23. Сполуки мають загальну структуру: 53 93878 54 де YR3 представлений прикладом у таблиці нижче. Приклад 25 Ν-(4-Φторфеніл)-1-[3-(4-{[(3S)-3-метил-1піперазиніл]метил}феніл)пропаноїл]-4піперидинамін (Е25) До суміші D41 (100 мг, 0,282 ммоль) і фенілметил (2S)-2-метил-1-піперазинкарбоксилату (66 мг, 0,281 ммоль) в 1,2-DCE (5 мл) додавали три(ацетокси)боргідрид натрію (90 мг, 0,423 ммоль) і суміш перемішували при кімнатній температурі протягом ночі. Додавали насичений водний розчин NаНСО3, суміш перемішували протягом 15 хвилин і потім екстрагували EtOAc. Об'єднані екстракти висушували (Na2SO4) і концентрували у вакуумі з одержанням неочищеного продукту, що очищали хроматографією, елюючи сумішшю 0100% EtOAc/пентан, з одержанням фенілметил (2S)-4-{[4-(3-{4-[(4-фторфеніл)аміно]-1піперидиніл}-3-оксопропіл)феніл]метил}-2-метил-1піперазинкарбоксилату. MS (ES): МН+ 572. Речовину цілком гідрували в МеОН (5 мл) з каталізатором 10% Pd/C (20 мг) протягом 2,5 годин. Суміш фільтрували, концентрували й очищали MDAP, одержуючи зазначену в заголовку сполуку (69 мг). δΗ (CDCI3, 400МГц) 7,24 (2Н, д), 7,17 (2Н, с), 6,88 (2Н, т), 6,53 (2Н, м), 4,51 (1Н, м), 3,79 (1Н, м), 3,43 (4Н, м), 3,09 (1Н, м), 2,73-2,98 (8Н, м), 2,63 (2Н, т), 1,96-2,06 (5Н, м), 1,27 (1Н, м), 1,15 (1Н, м), 1,00 (3Н, д). MS (ES): MH+ 439. Цю речовину цілком обробляли 1М НСІ в Et2O (174 мкл), одержуючи гідрохлоридну сіль зазначеної в заголовку сполуки (69 мг). MS (ES): MH+ 439. Наступний приклад, Е26, одержували з D42 з використанням способу, аналогічного описаному для прикладу 25. Сполуки мають загальну структуру: де YR3 представлений прикладом у таблиці нижче Приклад 27 1-[2-(4-{[(3R,5S)-3,5-Диметил-1піперазиніл]метил}феніл)пропаноїл]-N-(4фторфеніл)-4-піперидинамін (Е27) Суміш D46 (100 мг, 0,27 ммоль), DCC на полімерній підкладці (310 мг, 1,3 ммоль/г, 0,40 ммоль) і 55 93878 56 1-гідроксибензотриазолу (50 мг, 0,324 ммоль) у суміші 2:1 ДМФА/DCM (3 мл) обробляли D2 (51 мг, 0,26 ммоль) і суміш перемішували протягом ночі. Разом з DCM додавали поглинаючі смоли (PSтрисамін, PS-ізоціанат і Si-карбонат) (~3 мл). Суміш перемішували протягом приблизно 3 годин, потім фільтрували і концентрували, одержуючи 1,1-диметилетил (2R,6S)-4-{[4-(2-{4-[(4фторфеніл)аміно]-1-піперидиніл}-1-метил-2оксоетил)феніл]метил}-2,6-диметил-1піперазинкарбоксилат. MS (ES): MH+ 553. Цю речовину цілком розчиняли в DCM (2 мл) і ТФОК (1 мл), потім перемішували протягом 1,5 годин. Розчинники видаляли у вакуумі і залишок повторно упарювали з толуолу і простого ефіру. Очищенням з використанням картриджу Isolute SCX, елюючи МеОН, потім 2М NH3 в МеОН, одержували зазначену в заголовку сполуку. MS (ES): MH+ 453. Цю речовину цілком розчиняли в DCM і обробляли 1,1 екв. 1М НСІ в ефірі з одержанням гідрохлоридної солі зазначеної в заголовку сполуки (122 мг). MS (ES): MH+ 453. Наступний приклад, Е28, одержували з D46 і D5b з використанням способу, аналогічного описаному для прикладу 27. Сполуки мають загальну структуру: Приклад 29 1-[2-(4-{[(3R,5S)-3,5-Диметил-1піперазиніл]метил}феніл)-2-метилпропаноїл1-N-(4фторфеніл)-4-піперидинамін (Е29) піперазинкарбоксилат, MS (ES): МН+ 567. Цю речовину цілком обробляли 4M НСІ в 1,4-діоксані (2 мл) протягом 1 години. Розчинники видаляли у вакуумі з одержанням дигідрохлоридної солі зазначеної в заголовку сполуки (115 мг). MS(ES): MH+ 467. Наступні приклади, Е30-Е31, одержували з D48 і аміну-попереднику, зазначеного в таблиці, з використанням способів, аналогічних описаному способу в прикладі 29. Сполуки мають загальну структуру: Суміш D48 (100 мг, 0,256 ммоль), DCC на полімерній підкладці (296 мг, 1,3 ммоль/г, 0,385 ммоль) і 1-гідроксибензотриазолу (18 мг, 0,128 ммоль) у суміші 1:4 ДМФА/DCM (5 мл) обробляли D2 (50 мг, 0,256 ммоль) і суміш перемішували протягом ночі. Додавали поглинаючі смоли (PSтрисамін, PS-ізоціанат і Si-карбонат), суміш струшували протягом 2 годин і потім фільтрували і концентрували, одержуючи 1,1-диметилетил (2R,6S)-4-{[4-(2-{4-[(4-фторфеніл)аміно]-1піперидиніл}-1,1-диметил-2оксоетил)феніл]метил}-2,6-диметил-1 де YR3 представлений прикладом у таблиці нижче. де YR3 представлений прикладами в таблиці нижче. 57 Приклад 32 N-(3-Фторфеніл)-1-[3-(5-{[(3S)-3-метил-1піперазиніл]метил}-2-піридиніл)пропаноїл]-4піперидинамін (Е32) Розчин D52 (47 мг, 0,082 ммоль) гідрували в МеОН (4 мл) з каталізатором, паладієвою черню (23 мг), протягом 1,5 годин. Реакційну суміш обробляли й очищали хроматографією, одержуючи зазначену в заголовку сполуку (4 мг). Н (CDCI3, 400МГц) 8,42 (1Н, д), 7,57 (1Н, дд), 7,20 (1Н, д), 7,08 (1Н, кв.), 6,26-6,41 (3Н, м), 4,50 (1Н, м), 3,92 (1Н, м), 3,67 (1Н, м), 3,46 (2Н, м), 3,15 (3Н, м), 2,812,98 (6Н, м), 2,73 (2Н, д), 2,05 (3Н, м), 1,67 (2Н, м), 1,39 (2Н, м), 1,06 (1Н, м), 1,02 (3Н, д). MS (ES): МН+ 440. Цю речовину цілком перетворювали в гідрохлоридну сіль зазначеної в заголовку сполуки (4 мг). Приклад 33 1-[(3-хлор-4-{[(3S)-3-метил-1піперазиніл]метил}феніл)ацетил]-N-(3-фторфеніл)4-піперидинамін (ЕЗЗ) До розчину D55 (156 мг, 0,28 ммоль) в DCM (20 мл) додавали ТФОК (5 мл). Суміш перемішували при кімнатній температурі протягом 6 годин. Розчинник видаляли у вакуумі і залишок розподі 93878 58 ляли між DCM і водою. Водний шар підлужували до pH 14 концентрованим розчином NaOH, потім екстрагували DCM (3). Об'єднані органічні фракції висушували (MgSO4) і концентрували, одержуючи зазначену в заголовку сполуку у вигляді безбарвної олії (118 мг). Н (CDCl3, 400МГц) 7,43 (1Н, д), 7,25 (1Н, с), 7,09 (2Н, м), 6,38 (1Н, тд), 6,33 (1Н, дд), 6,26 (1Н, м), 4,52 (1Н, м), 3,85 (1Н, м), 3,70 (2Н, с), 3,62 (1Н, м), 3,57 (2Н, с), 3,44 (1Н, м), 3,16 (1Н, м), 2,91 (4Н, м), 2,77 (2Н, м), 2,07 (3Н, м), 1,78 (1Н, т), 1,33 (1Н, м), 1,15 (1Н, м), 1,02 (3Н, д). MS (ES): MH+ 459/461. Цю речовину цілком розчиняли в МеОН і обробляли 1М НСІ в Еt2О (0,28 мл), одержуючи гідрохлоридну сіль зазначеної в заголовку сполуки (106 мг). MS (ES): MH+ 459/461. Протокол FLIPR дослідження функціонального GPR38 агоністу За 24 години перед дослідженням СНО-K1 клітини, стабільно експресуючі GPR38-рецептор, висівали (10000 клітин/лунку) у покриті полі-Dлізином 384-лункові мікротитрувальні планшети з чорними стінками і прозорим дном (Greiner). У день дослідження середовище видаляли з клітинних планшетів з використанням апарата для промивання клітин (залишаючи 10 мкл середовища). До клітин негайно додавали буфер завантаження [Tyrodes (вода Elga + 145мМ NaCI + 5мМ KСІ + 20мМ HEPES + 10мМ глюкози + 1мМ МgСІ2) + 1,5мМ СаСІ2 + 0,714 мг/мл пробенециду (попередньо розчиненого в 1М NaOH) + 0,25мМ діамантового чорного + 2 мкМ барвники Fluo 4] та інкубували при 37,5°С протягом 1 години. Потім планшети досліджували за допомогою пристрою для зчитування флюорометричного зображення (FLIPR, Molecular Devices). Основні планшети зі сполукою готували в 100% ДМСО. Використовували вищу концентрацію в 3 мМ (яка дає кінцеву концентрацію в дослідженні 12мкМ) і цей розчин серійно розбавляли 1:4. Переносили 1 мкл з основного планшета в дочірній планшет, до якого додавали 50 мкл буфера для розведення сполуки (Tyrodes + 1 мг/мл BSA + 1,5мМ СаСІ2). У FLIPR додавали до клітин 10 мкл випробуваної сполуки і зміни у флуоресценції вимірювали протягом виділеного інтервалу часу в 1 хвилину. Максимум зміни у флуоресценції в порівнянні з нульовою лінією використовували 59 93878 для визначення кривих відгуку агоністу і концентраційний відгук розраховували з застосуванням 4параметричного логістичного рівняння. Комп’ютерна верстка Л.Литвиненко 60 Наведені як приклад сполуки за винаходом мали рЕС50>6,5 у дослідженні FLIPR. Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzylpiperazine derivative, use thereof in the treatment of various disorders and pharmaceutical composition containing thereof
Автори англійськоюJohnson Christopher Norbert, Macpherson David Timothy, Stanway Steven James, Stemp Geoffrey, Thompson Mervyn, Westaway Susan Marie
Назва патенту російськоюПроизводная бензилпиперазина, ee применение при лечении разных расстройств и фармацевтическая композиция, которая ee содержит
Автори російськоюДжонсон Кристофер Норберт, МакФерсон Девид Тимоти, Стенвей Стивен Джеймс, Стемп Джеффри, Томсон Мервин, Вестевей Сьюзен Мари
МПК / Мітки
МПК: A61P 1/08, C07D 401/10, A61K 31/496
Мітки: бензилпіперазину, різних, містить, фармацевтична, застосування, композиція, розладів, лікуванні, похідна
Код посилання
<a href="https://ua.patents.su/30-93878-pokhidna-benzilpiperazinu-zastosuvannya-pri-likuvanni-riznikh-rozladiv-ta-farmacevtichna-kompoziciya-shho-mistit.html" target="_blank" rel="follow" title="База патентів України">Похідна бензилпіперазину, її застосування при лікуванні різних розладів та фармацевтична композиція, що її містить</a>
Попередній патент: Спосіб і пристрій для використання теплоти реакції, що виділяється при одержанні 1,2-дихлоретану
Наступний патент: Гербіцидна композиція з однією рідкою фазою
Випадковий патент: Універсальна корабельна лафетна установка












