Аналоги рапаміцину та їх застосування у лікуванні неврологічних, проліферативних та запальних розладів
Номер патенту: 94034
Опубліковано: 11.04.2011
Автори: Скотніцкі Джераульд, Понг Кевін, Граціані Едмунд Ідріс
Формула / Реферат
1. Сполука формули І:
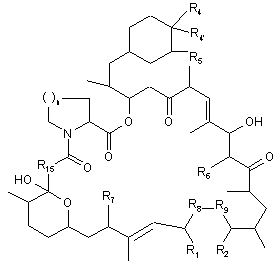 , І
, І
у якій:
R1 та R2 разом являють собою -O-N(R3)-; або
R1 являє собою ОН, a R2 являє собою N(H)R3;
R3 являє собою феніл, необов'язково заміщений галогеном та/або алкілом;
R4 та R4', незалежно, являють собою Н, ОН або О(ацил), причому ацил являє собою С(О)-алкіл, що містить замісник піридил;
R5, R6 та R7 являють собою ОСН3;
R8 та R9 зв'язані через (і) простий зв'язок та являють собою СН2 або (іі) подвійний зв'язок та являють собою СН;
R15 являє собою С=О;
n являє собою 1 або 2;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, у якій R8 та R9 зв'язані через простий зв'язок.
3. Сполука за п. 1, у якій R8 та R9 зв'язані через подвійний зв'язок.
4. Сполука за п. 1, у якій n являє собою 2.
5. Сполука за п. 1, у якій ацил являє собою:
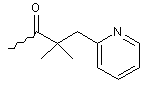 .
.
6. Сполука за п. 1, вибрана з групи, що включає такі як:
9,27-дигідрокси-3-{2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-37-феніл-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)пентон;
9,27-дигідрокси-3-{2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-37-феніл-4,9,10,12,13,14,15,16,17,18,21,22,23,24,25,26,27,32,33,34,34а-генікозагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)пентон;
37-(4-хлор-3-метилфеніл)-9,27-дигідрокси-3-{-2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34.34а-нонадекагідро-3Н-23,27-епокси-18,15-(епоксиіміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6H,31Н)пентон;
37-(2,6-дихлорфеніл)-9,27-дигідрокси-3-{2[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)пентон;
9,27-дигідрокси-3-{-2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-37-феніл-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6H,31Н)пентоновий складний ефір з -2,2-диметил-3-(піридин-2-іл)-пропіоновою кислотою та
37-(2,6-дихлорфеніл)-9,27-дигідрокси-3-{-2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)пентон;
або їх фармацевтично прийнятні солі.
7. Сполука за п. 1, у якій R4 являє собою ОН; і R8 та R9 являють собою НС=СН.
8. Сполука за п. 1, у якій R4 являє собою ОН; і R8 та R9 являють собою H2С-СH2.
9. Сполука за п. 1, у якій R4 являє собою ОН; R8 та R9 являють собою НC=СН; та R3 являє собою
 .
.
10. Сполука за п. 1, у якій R4 являє собою ОН; R8 та R9 являють собою НС=СН; та R3 являє собою
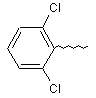 .
.
11. Сполука за п. 1, у якій R8 та R9 являють собою НС=СН; та R4 являє собою
 .
.
12. Сполука за п. 1, у якій R4 являє собою ОН; R8 та R9 являють собою Н2С-СН2; та R3 являє собою
 .
.
13. Сполука за п. 1, вибрана з групи, що включає:
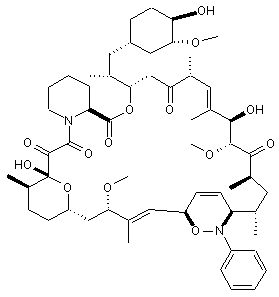 ,
, 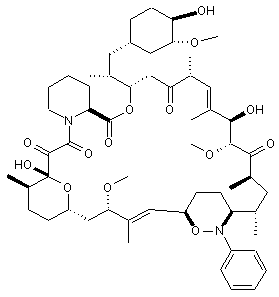 ,
, 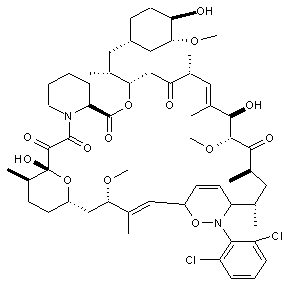 ,
, 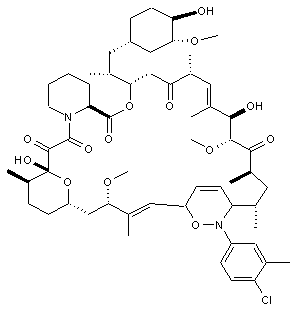 ,
, 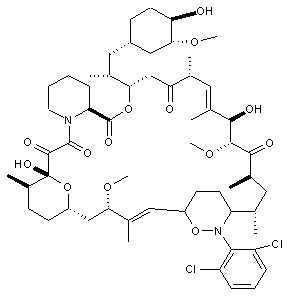 та
та 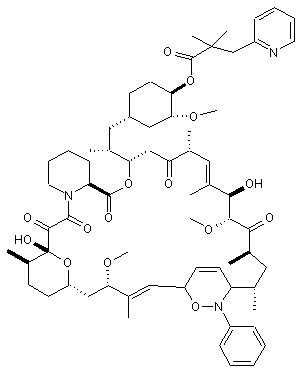 .
.
14. Сполука формули Іа:
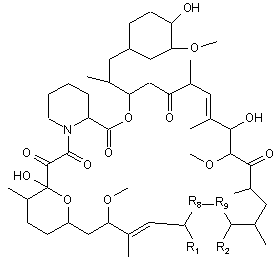 , Ia
, Ia
у якій:
R1 та R2 разом являють собою -О-N(R3)-; або
R1 являє собою ОН, a R2 являє собою N(H)R3;
R3 являє собою феніл, необов'язково заміщений галогеном та/або алкілом;
R8 та R9 зв'язані через (і) простий зв'язок та являють собою СН2 або (іі) подвійний зв’язок та являють собою СН;
або її фармацевтично прийнятна сіль.
15. Сполука формули Іb:
 , Ib
, Ib
у якій:
R незалежно вибирають з групи, що включає Н, С1-С6алкіл та галоген; і
m являє собою від 1 до 5.
16. Сполука за будь-яким з пп. 1-15, яка являє собою нейропротективний агент.
17. Сполука за будь-яким з пп. 1-16 для застосування як лікарського засобу.
18. Застосування сполуки за будь-яким з пп. 1-16 у одержанні лікарського засобу для лікування неврологічних розладів у пацієнта, якому це необхідно.
19. Застосування за п. 18, у якому зазначений неврологічний розлад вибирають з групи, що включає такі як: хвороба Альцгеймера; епілепсія; хвороба Хантінгтона; хвороба Паркінсона; інсульт; ураження спинного мозку; травматичне ураження мозку; деменція тіла Леві; хвороба Піка; хвороба Німанна-Піка; амілоїдна ангіопатія; церебральна амілоїдна ангіопатія; системний амілоїдоз; спадковий геморагічний інсульт з амілоїдозом голландського типу; міозит з включеними тільцями; легка когнітивна недостатність; синдром Дауна; бічний аміотрофічний склероз (ALS); розсіяний склероз; псевдогіпертрофічна міопатія Дюшена; м'язова дистрофія Беккера; плечолопатково-лицьова (Ландузі-Дежерина) дистрофія та кінцівково-попекова м'язова дистрофія (LGMD).
20. Застосування сполуки за будь-яким з пп. 1-16 у одержанні лікарського засобу для лікування ускладнень, викликаних інсультом або травмою голови, у пацієнта, якому це необхідно, або для лікування запальних розладів у пацієнта, якому це необхідно.
21. Застосування за п. 20, у якому зазначений запальний розлад вибирають з групи, що включає такі як: вовчак, ревматоїдний артрит, псоріатичний артрит, остеоартрит, анкілозуючий спондиліт, псоріаз, дерматит, склеродерма, запальна хвороба кишок, хвороба Крона та виразковий коліт.
22. Застосування сполуки за будь-яким з пп. 1-16 у одержанні лікарського засобу для лікування розладу, вибраного з групи, що включає такі як: злоякісна гіпертермія; вроджена міопатія з ураженням серцевини м'язових волокон; катеколамінергічна поліморфна шлуночкова тахікардія та аритмогенна дисплазія правого шлуночка типу 2 (ARVD-2); у пацієнта, якому це необхідно, або лікування серцево-судинного розладу, вибраного з групи, що включає такі як: застійна серцева недостатність; аритмогенні синдроми, включаючи такі як пароксизмальна тахікардія, уповільнені слідові деполяризації, шлуночкова тахікардія, раптова тахікардія, аритмії, викликані фізичними навантаженнями, синдроми подовження від інтервалу QT та двостороння тахікардія; артеріальні тромбоемболічні розлади, венозні серцево-судинні тромбоемболічні розлади та тромбоемболічні розлади у камерах серця; атеросклероз; рестеноз; периферична артеріальна хвороба; операція коронарного шунтування; хвороба сонної артерії; артеріїт; міокардит; серцево-судинне запалення; судинне запалення; коронарна хвороба (CHD); нестабільна стенокардія (UA); нестабільна рефрактерна стенокардія; стабільна стенокардія (SA); хронічна стабільна стенокардія; гострий коронарний синдром (ACS); перший або повторний рецидив інфаркту міокарда; гострий інфаркт міокарда (AMI); інфаркт міокарда; нe-Q-зубцевий інфаркт міокарда; не-STE інфаркт міокарда; хвороба коронарної артерії; ішемічна хвороба серця; серцева ішемія; ішемія; ішемічна несподівана смерть; транзиторна ішемічна атака; інсульт; периферична оклюзивна артеріальна хвороба; венозний тромбоз; тромбоз глибоких вен; тромбофлебіт; артеріальна емболія; тромбоз коронарної артерії; церебральний артеріальний тромбоз; церебральна емболія; ниркова емболія; легенева емболія; тромбоз; суправентикулярні аритмії, передсердні аритмії, тремтіння передсердь, фібриляція передсердь; у пацієнта, якому це необхідно.
23. Спосіб одержання сполуки за будь-яким з пп. 1-16, при якому здійснюють такі стадії:
(і) змішування рапаміцину або його аналога з необов'язково заміщеним нітрозобензолом;
та
(іі) виділення продукту стадії (і).
24. Спосіб за п. 23, у якому зазначений аналог рапаміцину являє собою наррапаміцин, деоксорапаміцин або десметилрапаміцин.
25. Спосіб за п. 23 або 24, у якому стадію (і) проводять при підвищених температурах.
26. Спосіб за будь-яким з пп. 23-25, у якому стадію (іі) проводять, використовуючи хроматографію.
27. Спосіб за будь-яким з пп. 23-26, у якому продукт стадії (і) вибраний з групи, що включає такі як:
9,27-дигідрокси-3-{2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-37-феніл-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6H,31H)пентон;
9,27-дигідрокси-3-{2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-37-феніл-4,9,10,12,13,14,15,16,17,18,21,22,23,24,25,26,27,32,33,34,34а-генікозагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)пентон;
37-(4-хлор-3-метилфеніл)-9,27-дигідрокси-3-{-2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6H,31Н)пентон;
37-(2,6-дихлорфеніл)-9,27-дигідрокси-3-{2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)пентон;
9,27-дигідрокси-3-{-2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-37-феніл-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)-пентоновий складний ефір з -2,2-диметил-3-(піридин-2-іл)пропіоновою кислотою та
37-(2,6-дихлорфеніл)-9,27-дигідрокси-3-{-2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)пентон.
28. Спосіб за будь-яким з пп. 23-27, у якому зазначений необов'язково заміщений нітрозобензол вибирають з групи, що включає нітрозобензол, 2,6-дихлорнітрозобензол та 1-хлор-2-метил-4-нітрозобензол.
29. Спосіб за будь-яким з пп. 23-28, який додатково включає: (ііі) змішування продукту стадії (іі) з агентом гідрогенування; та (iv) виділення продукту стадії (ііі).
30. Спосіб за п. 29, у якому зазначений агент гідрогенування включає Pd/C каталізатор та газоподібний водень.
31. Спосіб за п. 29 або 30, у якому продукт (ііі) являє собою:
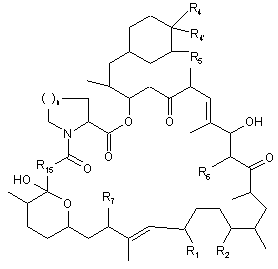 ;
;
або її фармацевтично прийнятну сіль.
32. Застосування сполуки, вибраної з таких як
(і) 9,27-дигідрокси-3-{2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-37-феніл-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)-пентон та
(іі) 37-(4-хлор-3-метилфеніл)-9,27-дигідрокси-3-{-2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)пентон;
у одержанні лікарського засобу для лікування доброякісної або злоякісної неопластичної хвороби у пацієнта, якому це необхідно.
33. Застосування сполуки, вибраної з таких як
(і) 9,27-дигідрокси-3-{2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-37-феніл-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)пентон та
(іі) 37-(4-хлор-3-метилфеніл)-9,27-дигідрокси-3-{-2-[4-гідрокси-3-метоксициклогексил]-1-метилетил}-10,21-диметокси-6,8,12,14,20,26-гексаметил-4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34,34а-нонадекагідро-3Н-23,27-епоксі-18,15-(епоксііміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)-пентон;
у одержанні лікарського засобу для лікування карцином та аденокарцином у пацієнта, якому це необхідно.
34. Застосування за п. 33, у якому зазначені карциноми або аденокарциноми являють собою карциноми або аденокарциноми ендометрія, яєчника, молочної залози, кишечнику, простати, гіпофізу, менінгіому або інші гормонозалежні пухлини.
Текст
1. Сполука формули І: C2 2 (19) 1 3 4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34. 34а-нонадекагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6H,31Н)пентон; 37-(2,6-дихлорфеніл)-9,27-дигідрокси-3-{2[4гідрокси-3-метоксициклогексил]-1-метилетил}10,21-диметокси-6,8,12,14,20,26-гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)пентон; 9,27-дигідрокси-3-{-2-[4-гідрокси-3метоксициклогексил]-1-метилетил}-10,21диметокси-6,8,12,14,20,26-гексаметил-37-феніл4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6H,31Н)пентоновий складний ефір з 2,2-диметил-3-(піридин-2-іл)-пропіоновою кислотою та 37-(2,6-дихлорфеніл)-9,27-дигідрокси-3-{-2-[4гідрокси-3-метоксициклогексил]-1-метилетил}10,21-диметокси-6,8,12,14,20,26-гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)пентон; або їх фармацевтично прийнятні солі. 7. Сполука за п.1, у якій R4 являє собою ОН; і R8 та R9 являють собою НС=СН. 8. Сполука за п.1, у якій R4 являє собою ОН; і R8 та R9 являють собою H2С-СH2. 9. Сполука за п.1, у якій R4 являє собою ОН; R8 та R9 являють собою НC=СН; та R3 являє собою Cl 94034 4 OH O O N O O HO O O OH O O O O O N , OH O O N O O HO O O OH O O O O O N , OH O O N O O HO O O OH O O O O . 10. Сполука за п.1, у якій R4 являє собою ОН; R8 та R9 являють собою НС=СН; та R3 являє собою O N Cl Cl Cl , OH Cl . 11. Сполука за п.1, у якій R8 та R9 являють собою НС=СН; та R4 являє собою O O N O . 12. Сполука за п.1, у якій R4 являє собою ОН; R8 та R9 являють собою Н2С-СН2; та R3 являє собою O N O HO O O OH O O O O Cl O Cl . 13. Сполука за п.1, вибрана з групи, що включає: N Cl , 5 94034 6 OH OH O O N O O HO O O O OH O O O O O HO O O O O N O OH O O O N O O N Cl Cl та O N O O O N O O HO O O OH O O O O O N . 14. Сполука формули Іа: OH O O N O O HO O O OH O O O O R8 R9 R1 R2 , Ia у якій: R1 та R2 разом являють собою -О-N(R3)-; або R1 являє собою ОН, a R2 являє собою N(H)R3; R3 являє собою феніл, необов'язково заміщений галогеном та/або алкілом; R8 та R9 зв'язані через (і) простий зв'язок та являють собою СН2 або (іі) подвійний зв’язок та являють собою СН; або її фармацевтично прийнятна сіль. 15. Сполука формули Іb: Rm , Ib у якій: R незалежно вибирають з групи, що включає Н, С1-С6алкіл та галоген; і m являє собою від 1 до 5. 16. Сполука за будь-яким з пп.1-15, яка являє собою нейропротективний агент. 17. Сполука за будь-яким з пп.1-16 для застосування як лікарського засобу. 18. Застосування сполуки за будь-яким з пп.1-16 у одержанні лікарського засобу для лікування неврологічних розладів у пацієнта, якому це необхідно. 19. Застосування за п.18, у якому зазначений неврологічний розлад вибирають з групи, що включає такі як: хвороба Альцгеймера; епілепсія; хвороба Хантінгтона; хвороба Паркінсона; інсульт; ураження спинного мозку; травматичне ураження мозку; деменція тіла Леві; хвороба Піка; хвороба Німанна-Піка; амілоїдна ангіопатія; церебральна амілоїдна ангіопатія; системний амілоїдоз; спадковий геморагічний інсульт з амілоїдозом голландського типу; міозит з включеними тільцями; легка когнітивна недостатність; синдром Дауна; бічний аміотрофічний склероз (ALS); розсіяний склероз; псевдогіпертрофічна міопатія Дюшена; м'язова дистрофія Беккера; плечолопатково-лицьова (Ландузі-Дежерина) дистрофія та кінцівковопоперекова м'язова дистрофія (LGMD). 20. Застосування сполуки за будь-яким з пп.1-16 у одержанні лікарського засобу для лікування ускладнень, викликаних інсультом або травмою голови, у пацієнта, якому це необхідно, або для лікування запальних розладів у пацієнта, якому це необхідно. 21. Застосування за п.20, у якому зазначений запальний розлад вибирають з групи, що включає такі як: вовчак, ревматоїдний артрит, псоріатичний артрит, остеоартрит, анкілозуючий спондиліт, псоріаз, дерматит, склеродерма, запальна хвороба кишок, хвороба Крона та виразковий коліт. 22. Застосування сполуки за будь-яким з пп.1-16 у одержанні лікарського засобу для лікування розладу, вибраного з групи, що включає такі як: злоякісна гіпертермія; вроджена міопатія з ураженням серцевини м'язових волокон; катеколамінергічна поліморфна шлуночкова тахікардія та аритмогенна дисплазія правого шлуночка типу 2 (ARVD-2); у пацієнта, якому це необхідно, або лікування серцево-судинного розладу, вибраного з групи, що включає такі як: застійна серцева недостатність; 7 аритмогенні синдроми, включаючи такі як пароксизмальна тахікардія, уповільнені слідові деполяризації, шлуночкова тахікардія, раптова тахікардія, аритмії, викликані фізичними навантаженнями, синдроми подовження від інтервалу QT та двостороння тахікардія; артеріальні тромбоемболічні розлади, венозні серцево-судинні тромбоемболічні розлади та тромбоемболічні розлади у камерах серця; атеросклероз; рестеноз; периферична артеріальна хвороба; операція коронарного шунтування; хвороба сонної артерії; артеріїт; міокардит; серцево-судинне запалення; судинне запалення; коронарна хвороба (CHD); нестабільна стенокардія (UA); нестабільна рефрактерна стенокардія; стабільна стенокардія (SA); хронічна стабільна стенокардія; гострий коронарний синдром (ACS); перший або повторний рецидив інфаркту міокарда; гострий інфаркт міокарда (AMI); інфаркт міокарда; нe-Q-зубцевий інфаркт міокарда; не-STE інфаркт міокарда; хвороба коронарної артерії; ішемічна хвороба серця; серцева ішемія; ішемія; ішемічна несподівана смерть; транзиторна ішемічна атака; інсульт; периферична оклюзивна артеріальна хвороба; венозний тромбоз; тромбоз глибоких вен; тромбофлебіт; артеріальна емболія; тромбоз коронарної артерії; церебральний артеріальний тромбоз; церебральна емболія; ниркова емболія; легенева емболія; тромбоз; суправентикулярні аритмії, передсердні аритмії, тремтіння передсердь, фібриляція передсердь; у пацієнта, якому це необхідно. 23. Спосіб одержання сполуки за будь-яким з пп.116, при якому здійснюють такі стадії: (і) змішування рапаміцину або його аналога з необов'язково заміщеним нітрозобензолом; та (іі) виділення продукту стадії (і). 24. Спосіб за п.23, у якому зазначений аналог рапаміцину являє собою наррапаміцин, деоксорапаміцин або десметилрапаміцин. 25. Спосіб за п.23 або 24, у якому стадію (і) проводять при підвищених температурах. 26. Спосіб за будь-яким з пп.23-25, у якому стадію (іі) проводять, використовуючи хроматографію. 27. Спосіб за будь-яким з пп.23-26, у якому продукт стадії (і) вибраний з групи, що включає такі як: 9,27-дигідрокси-3-{2-[4-гідрокси-3метоксициклогексил]-1-метилетил}-10,21диметокси-6,8,12,14,20,26-гексаметил-37-феніл4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6H,31H)пентон; 9,27-дигідрокси-3-{2-[4-гідрокси-3метоксициклогексил]-1-метилетил}-10,21диметокси-6,8,12,14,20,26-гексаметил-37-феніл4,9,10,12,13,14,15,16,17,18,21,22,23,24,25,26,27,32, 33,34,34а-генікозагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)пентон; 37-(4-хлор-3-метилфеніл)-9,27-дигідрокси-3-{-2-[4гідрокси-3-метоксициклогексил]-1-метилетил}10,21-диметокси-6,8,12,14,20,26-гексаметил 94034 8 4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6H,31Н)пентон; 37-(2,6-дихлорфеніл)-9,27-дигідрокси-3-{2-[4гідрокси-3-метоксициклогексил]-1-метилетил}10,21-диметокси-6,8,12,14,20,26-гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)пентон; 9,27-дигідрокси-3-{-2-[4-гідрокси-3метоксициклогексил]-1-метилетил}-10,21диметокси-6,8,12,14,20,26-гексаметил-37-феніл4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентоновий складний ефір з 2,2-диметил-3-(піридин-2-іл)пропіоновою кислотою та 37-(2,6-дихлорфеніл)-9,27-дигідрокси-3-{-2-[4гідрокси-3-метоксициклогексил]-1-метилетил}10,21-диметокси-6,8,12,14,20,26-гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)пентон. 28. Спосіб за будь-яким з пп.23-27, у якому зазначений необов'язково заміщений нітрозобензол вибирають з групи, що включає нітрозобензол, 2,6дихлорнітрозобензол та 1-хлор-2-метил-4нітрозобензол. 29. Спосіб за будь-яким з пп.23-28, який додатково включає: (ііі) змішування продукту стадії (іі) з агентом гідрогенування; та (iv) виділення продукту стадії (ііі). 30. Спосіб за п.29, у якому зазначений агент гідрогенування включає Pd/C каталізатор та газоподібний водень. 31. Спосіб за п.29 або 30, у якому продукт (ііі) являє собою: R4 R4' R5 ( )n O N HO R15 O O O OH O O R6 R7 R1 R2 ; або її фармацевтично прийнятну сіль. 32. Застосування сполуки, вибраної з таких як (і) 9,27-дигідрокси-3-{2-[4-гідрокси-3метоксициклогексил]-1-метилетил}-10,21диметокси-6,8,12,14,20,26-гексаметил-37-феніл4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 9 94034 10 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентон та (іі) 37-(4-хлор-3-метилфеніл)-9,27-дигідрокси-3-{-2[4-гідрокси-3-метоксициклогексил]-1-метилетил}10,21-диметокси-6,8,12,14,20,26-гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)пентон; у одержанні лікарського засобу для лікування доброякісної або злоякісної неопластичної хвороби у пацієнта, якому це необхідно. 33. Застосування сполуки, вибраної з таких як (і) 9,27-дигідрокси-3-{2-[4-гідрокси-3метоксициклогексил]-1-метилетил}-10,21диметокси-6,8,12,14,20,26-гексаметил-37-феніл4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)пентон та (іі) 37-(4-хлор-3-метилфеніл)-9,27-дигідрокси-3-{-2[4-гідрокси-3-метоксициклогексил]-1-метилетил}10,21-диметокси-6,8,12,14,20,26-гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епоксі-18,15(епоксііміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентон; у одержанні лікарського засобу для лікування карцином та аденокарцином у пацієнта, якому це необхідно. 34. Застосування за п.33, у якому зазначені карциноми або аденокарциноми являють собою карциноми або аденокарциноми ендометрія, яєчника, молочної залози, кишечнику, простати, гіпофізу, менінгіому або інші гормонозалежні пухлини. Даний винахід забезпечує аналоги рапаміцину та їх застосування у лікуванні неврологічних, проліферативних та запальних розладів. Ішемічний інсульт, який є причиною 83% всіх випадків інсультів (інші, що залишилися, 17% є геморагічного типу), відбувається у приблизно 700.000 американців кожного року, що дорівнює приблизно 1 інсульту кожні 45 секунд. Ішемічні інсульти відбуваються як результат обструкції у кров'яній судині, що поставляє кров до мозку. Основною умовою для цього типу обструкції є розвиток жирових відкладень, що устелюють стінки судини, що називається атеросклерозом. Зазначені жирові відкладення можуть спричиняти два типи обструкції: 1) тромбоз судин головного мозку, який відноситься до тромбу (згусток крові), який розвивається у закупореній частині судини, та 2) церебральна емболія, яка в основному відноситься до згустку крові, який утворюється у іншому місці у кровоносній системі, як правило, у серці та великих артеріях верхньої частини грудної клітини та шиї. Частина кров'яного згустку відривається, входить у кровоток та рухається через кров'яні судини мозку поки не досягне судин, занадто малих для того, щоб пройти через них. Поточна терапія для лікування ішемічного інсульту обмежена. Наразі, єдиним схваленим лікарським засобом для ішемічного інсульту є активатор плазміногену рекомбінантних тканин (rt-PA). rt-PA, який діє як тромболітичний засіб, має обмежений період можливості дії (3 години), тому дозволяє одержати лікування тільки 1-2% всіх пацієнтів з інсультом. Не існує більше ніяких нейропротективних агентів для ішемічного інсульту. Хвороба Паркінсона (ХП) являє собою нейродегенеративну хворобу, яка нейропатологічно характеризується селективною дегенерацією допамінергічних (DAergic) нейронів чорної субстанції. ХП являє собою прогресивну хворобу з середнім віком появи перших симптомів 55 років, хоча у 15% пацієнтів діагностують цю хворобу до 50 років. Приблизно підраховано, що 1,5 мільйони аме риканців мають ХП. Деякими з класичних ознак ХП є тремор у спокої на одному боці тіла, генералізована уповільненість руху (брадикінезія), нерухливість кінцівок (ригідність), проблеми ходи або рівноваги (постуральна дисфункція). Поточні медикаментозні лікування ХП лікують симптоми, в той час як жодне з них не попереджає або уповільнює DAergic нейронну дегенерацію. Дана їх клінічна важливість змушує ретельно шукати прототипічні молекули, які ясно показують нейропротективні та/або нейродегенеративні активності. Нейротрофіни являють собою сімейство білків, які мають надзвичайні терапевтичні властивості у передклінічних моделях нейродегенерації. Хоча вони є експериментально багатообіцяючими, клінічний розвиток нейротрофінів стикнувся з серйозними перешкодами та невдачами, такими як нездатність доставити ці великі білки до цільової популяції нейронів, нестабільність цих білків, та неспецифічна активність. У даній галузі техніки необхідні додаткові сполуки, корисні у лікуванні неврологічних, проліферативних та запальних розладів. У одному аспекті, даний винахід забезпечує нові сполуки, корисні у лікуванні, та у одержанні лікарських засобів, корисних у лікуванні неврологічних, проліферативних та запальних розладів. У іншому аспекті, даний винахід забезпечує нові нейропротективні, антипроліферативні та протизапальні агенти. У додатковому аспекті, даний винахід забезпечує нові сполуки, корисні у лікуванні, та у одержанні лікарських засобів, корисних у лікуванні доброякісної або злоякісної неопластичної хвороби, карцином та аденокарцином. У іншому аспекті, даний винахід забезпечує нові сполуки, корисні у лікуванні, та у одержанні лікарських засобів, корисних у лікуванні запальних розладів, включаючи, без обмеження, аутоімунні розлади (наприклад, такі як вовчанка), запальні захворювання шкіри, кишкові запальні розлади, 11 астми та атопічні розлади, та відторгнення трансплантату / пересаджених тканин. У ще одному додатковому аспекті, даний винахід забезпечує аналоги рапаміцину, та їх фармацевтично прийнятні солі, проліки та метаболіти. У іншому аспекті, даний винахід забезпечує способи одержання аналогів рапаміцину. У додатковому аспекті, даний винахід забезпечує способи лікування неврологічних, проліферативних, серцево-судинних та запальних розладів. У ще одному іншому аспекті, даний винахід забезпечує способи лікування ускладнень, спричинених інсультом або травмою голови. У ще одному додатковому аспекті, даний винахід забезпечує способи лікування доброякісної або злоякісної неопластичної хвороби, карцином та аденокарцином. У ще одному іншому аспекті, даний винахід забезпечує способи лікування запальних розладів, включаючи, без обмеження, аутоімунні розлади (наприклад, такі як вовчанка), запальні захворювання шкіри, кишкові запальні розлади, астми та атопічні розлади, та відторгнення трансплантату / пересаджених тканин. У іншому аспекті, даний винахід забезпечує судинний стент або шунт, який покритий або імпрегнований сполукою винаходу. Інші аспекти та переваги даного винаходу додатково описані у наступному детальному описі їх кращих втілень. На Фіг.1 забезпечений спектр ядерного магнітного резонансу (ЯМР) для сполуки Прикладу 1. ЯМР спектр одержаний у сіз-ацетонітрилі, використовуючи 400МГц спектрометр. На Фіг.2 забезпечений ЯМР спектр для сполуки Прикладу 2. ЯМР спектр одержаний у d3ацетонітрилі, використовуючи 400МГц спектрометр. На Фіг.3 забезпечений ЯМР спектр для сполуки Прикладу 3. ЯМР спектр одержаний у d3ацетонітрилі, використовуючи 400МГц спектрометр. На Фіг.4 забезпечений ЯМР спектр для сполуки Прикладу 4. ЯМР спектр одержаний у d3ацетонітрилі, використовуючи 400МГц спектрометр. На Фіг.5 забезпечений ЯМР спектр для сполуки Прикладу 5. ЯМР спектр одержаний у d3ацетонітрилі, використовуючи 400МГц спектрометр. На Фіг.6 забезпечений ЯМР спектр для сполуки Прикладу 6. ЯМР спектр одержаний у d3ацетонітрилі, використовуючи 400МГц спектрометр. Даний винахід забезпечує нові аналоги рапаміцину, які є корисними як нейропротективні, антипроліферативні, та/або протизапальні агенти. Нові аналоги рапаміцину мають гетероатомні замісники у 1 та 4 положеннях рапаміцинового структурного скелету. У іншому втіленні, даний винахід забезпечує аналоги рапаміцину, що мають циклічну структуру у 1,2, 3 та/або 4 положеннях рапаміцинового структурного скелету. 94034 12 Зазначені нові сполуки винаходу є корисними як нейропротективні агенти у композиціях для застосування у лікуванні неврологічних розладів. Неврологічний розлад, включаючи, наприклад, нейродегенеративний або нервово-м'язовий дегенеративний стан, може бути результатом генетичного розладу, присутнього при народженні, розладу, що розвинувся протягом життя індивіда, наприклад, такого як інсульт, та/або результатом фізичної травми, наприклад, голови, ураження спинного мозку, або ураження периферичної нервової системи. Таким чином, сполука даного винаходу може бути корисною у полегшенні симптомів передіснуючого неврологічного розладу, попереджаючи далі нейро- та/або нервово-м'язову дегенерацію. У деяких втіленнях, нейропротективні агенти винаходу можуть бути використані для призупинення початку симптомів, пов'язаних з неврологічним розладом. Ці нові сполуки даного винаходу також є корисними як антипроліферативні та протизапальні агенти і, таким чином, є корисними у лікуванні запальних розладів, включаючи аутоімунні розлади, артритичні розлади, запальні захворювання шкіри, кишкові запальні розлади, астми та атопічні розлади, та відторгнення трансплантату / пересаджених тканин. Неочікувано було знайдено, що принаймні дві сполуки винаходу, наприклад, 9,27-дигідрокси-3{2-[4-гідрокси-3-метоксициклогексил]-1метилетил}-10,21-диметокси-6,8,12,14,20,26гексаметил-37феніл4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33, 34,34а-нонадекагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентон та 37-(4-хлор-3метилфеніл)-9,27-дигідрокси-3-{-2-[4-гідрокси-3метоксициклогексил]-1-метилетил}-10,21диметокси-6,8,12,14,20,26-гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1-с] [1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентон; мають антипроліферативну та імунодепресивну активність. І. Сполуки винаходу Даний винахід забезпечує аналоги рапаміцину формули І: 13 R1 та R2 у зазначеній вище формулі являють собою різні, незалежні групи та вибрані з OR3 та N(R3')(R3'') або R1 та R2 є різними, зв'язаними через простий зв'язок, та вибраними з О та NR3. R3, R3', та R3'' незалежно вибирають з групи, що включає Н, С1-С6алкіл, С1-С6заміщений алкіл, С3С8циклоалкіл, заміщений С3-С8циклоалкіл, арил, заміщений арил, гетероарил, та заміщений гетероарил. R4 та R4' (а) незалежно вибирають з групи, що включає Н, ОН, О(С1-С6алкіл), О(заміщений С1С6алкіл), О(ацил), О(арил), О(заміщений арил), та галоген; або (b) взяті разом утворюють подвійний зв'язок з О. R5, R6, та R7 незалежно вибирають з Н, ОН, та ОСН3. R8 та R9 зв'язані через (і) простий зв'язок та являють собою СН2 або (іі) подвійний зв'язок та являють собою СН. R15 вибирають з С=О, СНОН, та СН2 та п являє собою 1 або 2; або їх фармацевтично прийнятні солі, проліки або метаболіти. У додаткових втіленнях, R1 та R2 зв'язані через простий зв'язок та вибрані з О та NR3. У ще одному додатковому втіленні, R1 являє собою О та R2 являє собою NR3. У одному втіленні, R3' або R3'' являє собою арил або заміщену арильну групу, або заміщене бензольне кільце. У іншому втіленні, заміщені бензольні групи при R3' або R3'' включають кільця наступної структури: R10, R11, R12, R13, та R14 незалежно вибирають з групи, що включає Н, С1-С6алкіл, заміщений С1С6алкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, галоген, ацил, ОН, О(алкіл), О(заміщений алкіл), О(арил), О(заміщеного арил), О(ацил), NH2, NН(алкіл), NH(заміщений алкіл), NН(арил), NH(заміщений арил), та NH(ацил). У додаткових втіленнях, R3, R3' або R3'' являють собою феніл, необов'язково заміщений за допомогою 1 або 2 замісників, вибраних з С1С6алкілу та галогену. У додаткових втіленнях, R3, R3' або R3'' являють собою феніл, необов'язково заміщений за допомогою 1 або 2 метильних або хлор-замісників, наприклад, феніл та 3-метил, 4хлорфеніл. У одному втіленні, R4 або R4' являють собою ОН або О(ацил), наприклад, коли ацил являє собою -С(О)- необов'язково заміщений алкіл, зокрема, коли алкіл може бути лінійним або розгалуженим та необов'язково заміщеним, наприклад, за допомогою гетероциклічної групи, такої як ароматична гетероциклічна група, така як піридил. Приклад являє собою: У інших втіленнях, аналоги рапаміцину формули І включають ті, у яких R5, R6 та R7 являють собою ОСН3, ті, у яких азот-вмісне кільце у положеннях 17-22 рапаміцинового структурного скеле 94034 14 ту являє собою піперидинове кільце, або у яких R15 являє собою карбоніл. У одному втіленні, даний винахід забезпечує сполуки наступної формули Іа: у якій R1, R2, R8, та R9 приймають значення, показані вище. У іншому втіленні, даний винахід забезпечує сполуки наступної формули Іb: У формулі Ib, R незалежно вибирають з групи, що включає Н, С1-С6алкіл, заміщений С1-С6алкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, галоген, ацил, ОН, О(алкіл), О(заміщений алкіл), О(арил), О(заміщений арил), О(ацил), NH2, NH(алкіл), NH(заміщений алкіл), NH(арил), NH(заміщений арил), та NH(ацил) та m являє собою від 1 до 5. Специфічні сполуки винаходу проілюстровані у цьому описі та включають 9,27-дигідрокси-3-{2-[4-гідрокси-3метоксициклогексил]-1-метилетил}-10,21диметокси-6,8,12,14,20,26-гексаметил-37-феніл4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентон; 9,27-дигідрокси-3-{2[4-гідрокси-3-метоксициклогексил]-1-метилетил}10,21-диметокси-6,8,12,14,20,26-гексаметил-37феніл4,9,10,12,13,14,15,16,17,18,21,22,23,24,25,26,27,32, 33,34,34а-генікозагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентон; 37-(4-хлор-3метилфеніл)-9,27-дигідрокси-3-{-2-[4-гідрокси-3метоксициклогексил]-1-метилетил}-10,21 15 94034 16 диметокси-6,8,12,14,20,26-гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентон; 37-(2,6дихлорфеніл)-9,27-дигідрокси-3-{2-[4-гідрокси-3метоксициклогексил]-1-метилетил}-10,21диметокси-6,8,12,14,20,26-гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентон; 9,27-дигідрокси-3-{-2[4-гідрокси-3-метоксициклогексил]-1-метилетил}10,21-диметокси-6,8,12,14,20,26-гексаметил-37феніл4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентоновий складний ефір з 2,2-диметил-3-(піридин-2-іл)-пропіоновою кислотою; 37-(2,6-дихлорфеніл)-9,27-дигідрокси-3-{-2-[4гідрокси-3-метоксициклогексил]-1-метилетил}10,21-диметокси-6,8,12,14,20,26-гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентон; або їх фармацевтично прийнятні солі, проліки або метаболіти. Даний винахід не обмежується до проілюстрованих сполук. У іншому втіленні, специфічні сполуки включають наступні: Даний винахід також забезпечує сполуку, у якій R1 та R2 зв'язані через простий зв'язок; R1 являє собою О; R2 являє собою NR3; R3 являє собою феніл; R4 являє собою ОН; R5-R7 являють собою ОСН3; та R8 та R9 являють собою НС=СН; сполуку, у якій R1 являє собою OR3 являє собою N(R3')(R3''); R3 являє собою Н; R3' являє собою Н; R3'' являє собою феніл; R4 являє собою ОН; R5-R7 являють собою ОСН3; та R8 та R9 являють собою Н2С-СН2; сполуку, у якій R1 та R2 зв'язані через простий зв'язок; R1 являє собою О; R2 являє собою NR3; R3 являє собою феніл; R4 являє собою ОН; R5-R7 являють собою ОСН3; та R8 та R9 являють собою Н2С-СН2; сполуку, у якій R1 та R2 зв'язані через простий зв'язок; R1 являє собою О; R2 являє собою NR3; R4 являє собою ОН; R5-R7 являють собою ОСН3; R8 та R9 являють собою НC=СН; та R3 являє собою сполуку, у якій R1 та R2 зв'язані через простий зв'язок; R1 являє собою О; R2 являє собою NR3; R4 являє собою ОН; R5-R7 являють собою ОСН3; R8 та R9 являють собою НС=СН; та R3 являє собою 17 сполуку, у якій R1 та R2 зв'язані через простий зв'язок; R1 являє собою О; R2 являє собою NR3; R3 являє собою феніл; R5-R7 являють собою ОСН3; R8 та R9 являють собою НС=СН; та R4 являє собою та сполуку, у якій R1 та R2 зв'язані через простий зв'язок; R1 являє собою О; R2 являє собою NR3; R4 являє собою ОН; R5-R7 являють собою ОСН3; R8 та R9 являють собою Н2С-СН2; та R3 являє собою Сполуки даного винаходу можуть містити один або більше асиметричних атомів вуглецю та деякі з цих сполук можуть містити один або більше асиметричних (хіральних) центрів і, таким чином, можуть приводити до одержання оптичних ізомерів та діастереомерів. Хоча показано не приймаючи до уваги стереохімію, коли сполуки можуть містити один або більше хіральних центрів, переважно принаймні один з хіральних центрів є Sстереохімічним. Таким чином, даний винахід включає такі оптичні ізомери та діастереомери; а також рацемічні та розділені, енантіомерно чисті стереоізомери; а також інші суміші R та S стереоізомерів, та їх фармацевтично прийнятні солі, гідрати, метаболіти, та проліки. Термін "алкіл", використаний у цьому описі, відноситься як до лінійно-, так і до розгалуженоланцюгових насичених аліфатичних вуглеводневих груп, що мають від 1 до 10 атомів вуглецю, та бажано приблизно від 1 до 8 атомів вуглецю. Термін "алкеніл", використаний у цьому описі, відноситься як до лінійно-, так і до розгалуженоланцюгових алкільних груп, які мають один або більше вуглець-вуглець подвійних зв'язків та містять від приблизно 2 до 10 атомів вуглецю. У одному втіленні, термін алкеніл відноситься до алкільних груп, що мають 1 або 2 вуглець-вуглець подвійних зв'язки та мають від 2 до приблизно 6 атомів вуглецю. Термін "алкінільна" група, використаний у цьому описі, відноситься як до лінійно-, так і до розгалужено-ланцюгових алкільних груп, що мають один або більше вуглець-вуглець потрійних зв'язки та мають від 2 до 8 атомів вуглецю. У іншому втіленні, термін алкініл відноситься до алкільної групи, що має 1 або 2 вуглець-вуглець потрійних зв'язки та має від 2 до 6 атомів вуглецю. Термін "циклоалкіл", використаний у цьому описі, відноситься до алкільної групи, як описано вище, яка є циклічною у структурі та має приблиз 94034 18 но від 4 до 10 атомів вуглецю, або приблизно від 5 до 8 атомів вуглецю. Терміни "заміщений алкіл", "заміщений алкеніл", та "заміщений алкініл" відносяться до алкільної, алкенільної, та алкінільної груп, відповідно, що мають один або більше замісників, включаючи, без обмеження, галоген, CN, OH, NO2, аміно групу, арил, гетероциклічну групу, алкокси групу, арилокси групу, алкілкарбоніл, алкілкарбокси групу, та арилтіо групу, де зазначені групи можуть бути необов'язково заміщеними, наприклад, за допомогою 1-4 замісників, включаючи галоген, CN, OH, NO2, аміно групу, алкіл, циклоалкіл, алкеніл, алкініл, алкокси групу, арилокси групу, алкілокси групу, алкілкарбоніл, алкілкарбокси, аміноалкіл, та арилтіо групу. Зазначені замісники можуть бути прикріплені до будь-якого атому вуглецю алкільної, алкенільної, або алкінільної групи, за умови, що прикріплення являє собою стабільний хімічний залишок. Термін "арил", як використано у цьому описі, відноситься до ароматичної системи, що складається, наприклад, з 6-20 атомів вуглецю, яка може включати одиничне кільце або множину ароматичних кілець, сполучених або зв'язаних разом (наприклад, два або три), де принаймні одна частина сполучених або зв'язаних кілець утворює коньюговану ароматичну систему. Арильні групи можуть включати, не обмежуючись наведеними, феніл, нафтил, біфеніл, антрил, тетрагідронафтил, фенантрил, інден, бензонафтил, флуореніл, та карбазоліл. Термін "заміщений арил" відноситься до арильної групи, яка заміщена одним або більше замісниками, включаючи галоген, CN, ОН, NO2, аміно групу, алкіл, циклоалкіл, алкеніл, алкініл, алкокси групу, арилокси групу, алкілокси групу, алкілкарбоніл, алкілкарбокси групу, аміноалкіл, та арилтіо групу, де зазначені групи можуть бути необов'язково заміщеними. У одному втіленні, заміщена арильна група є заміщеною за допомогою 1-4 замісників, включаючи галоген, CN, OH, NO2, аміно групу, алкіл, циклоалкіл, алкеніл, алкініл, алкокси групу, арилокси групу, алкілокси групу, алкілкарбоніл, алкілкарбокси групу, аміноалкіл, та арилтіо групу. Термін "гетероциклічна група", як використано у цьому описі, відноситься до стабільного 4- - 7членного моноциклічного або багатоциклічного гетероциклічного кільця, яке є насиченим, частково ненасиченим, або повністю ненасиченим, включаючи ароматичну групу, таку як піридил. Гетероциклічне кільце включає атоми вуглецю та один або більше гетероатомів, включаючи атоми азоту, кисню та сірки. У одному втіленні, гетероциклічне кільце має від 1 до 4 гетероатомів у структурному скелеті зазначеного кільця. Коли гетероциклічне кільце містить атоми азоту або сірки у структурному скелеті зазначеного кільця, атоми азоту або сірки можуть бути окисленими. Термін "гетероциклічна група" також відноситься до багатоциклічних кілець, що складаються, наприклад, з 9-20 кільцевих членів, у яких гетероциклічне кільце сполучене з арильним кільцем. Гетероциклічне кільце може бути прикріплене до арильного кільця 19 через гетероатом або атом вуглецю, за умови, що отримана гетероциклічна кільцева структура є хімічно стабільною. У даній галузі техніки відомий цілий ряд гетероциклічних груп та він включає, без обмеження наведеними, кисень-вмісні кільця, азот-вмісні кільця, сірко-вмісні кільця, змішані гетероатом-вмісні кільця, сполучені гетероатом-вмісні кільця, та їх комбінації. Кисень-вмісні кільця включають, не обмежуючись наведеними, фурильне, тетрагідрофуранільне, піранільне, піронільне та діоксинільне кільця. Азот-вмісні кільця включають, без обмеження наведеними, піролільне, піразолільне, імідазолільне, триазолільне, піридильне, піперидинільне, 2-оксопіперидинільне, піридазинільне, піримідинільне, піразинільне, піперазинільне, азепінільне, триазинільне, піролідинільне, та азепінільне кільця. Сірко-вмісні кільця включають, без обмеження наведеними, тієнільне та дитіолільне кільця. Змішані гетероатом-вмісні кільця включають, не обмежуючись наведеними, оксатіолільне, оксазолільне, тіазолільне, оксадіазолільне, оксатриазолільне, діоксазолільне, оксатіазолільне, оксатіолільне, оксазинільне, оксатіазинільне, морфолінільне, тіаморфолінільне, тіаморфолінілсульфоксидне, оксепінільне, тієпінільне, та діазепінільне кільця. Сполучені гетероатом-вмісні кільця включають, не обмежуючись наведеними, бензофуранільне, тіонафтенове, індолільне, беназазолільне, піриндинільне, піранопіролільне, ізоіндазолільне, індоксазинільне, бензоксазолільне, антранілільне, бензопіранільне, хінолінільне, ізохінолінільне, бензодіазонільне, нафтилридинільне, бензотієнільне, піридопіридинільне, бензоксазинільне, ксантенільне, акридинільне, та пуринільне кільця. Термін "заміщена гетероциклічна група", як використано у цьому описі, відноситься до гетероциклічної групи, що має один або більше замісників, включаючи галоген, CN, ОН, NO2, аміно групу, алкіл, циклоалкіл, алкеніл, алкініл, алкокси групу, арилокси групу, алкілокси групу, алкілкарбоніл, алкілкарбокси групу, аміноалкіл, та арилтіо групу, де зазначені групи можуть бути необов'язково заміщеними. У одному втіленні, заміщена гетероциклічна група є заміщеною за допомогою 1-4 замісників. Термін "ацил" відноситься до -С(O)- групи, яка є заміщеною на атомі вуглецю. Ацильна група може бути заміщеною або кінцевою ацильною групою, такою як НС(О)-група. Замісники можуть включати будь-які замісники, зазначені вище для алкільних груп, а саме один або більше замісників включаючи, без обмеження, галоген, CN, OH, NO2, аміно групу, арил, гетероциклічну групу, алкокси групу, арилокси групу, алкілкарбоніл, алкілкарбокси групу, та арилтіо групу, де зазначені групи можуть бути необов'язково заміщеними. Приклади включають -С(О)-алкокси групу (наприклад, -ОМе або -OEt) або -С(О)-алкіл, де алкіл може бути лінійним або розгалуженим та необов'язково заміщеним, наприклад, за допомогою гетероциклічної групи (такої як піридил). Термін "алкокси", як використано у цьому описі, відноситься до О(алкіл) групи, де точка прикріп 94034 20 лення відбувається через атом кисню та алкільна група є необов'язково заміщеною. Термін "арилокси", як використано у цьому описі, відноситься до О(арил) групи, де точка прикріплення відбувається через атом кисню та арильна група є необов'язково заміщеною. Термін "алкілокси", як використано у цьому описі, відноситься до алкілОН групи, де точка прикріплення відбувається через алкільну групу. Термін "арилтіо", як використано у цьому описі, відноситься до S(aprni) групи, де точка прикріплення відбувається через атом сірки та арильна група є необов'язково заміщеною. Термін "алкілкарбоніл", як використано у цьому описі, відноситься до С(О)(алкіл) групи, де точка прикріплення відбувається через атом вуглецю карбонільного залишку та алкільна група є необов'язково заміщеною. Термін "алкілкарбокси", як використано у цьому описі, відноситься до С(О)О(алкіл) групи, де точка прикріплення відбувається через атом вуглецю карбокси залишку та алкільна група є необов'язково заміщеною. Термін "аміноалкіл", як використано у цьому описі, відноситься як до вторинних, так і до третинних амінів, де точка прикріплення відбувається через атом азоту та алкільні групи є необов'язково заміщеними. Алкільні групи можуть бути однаковими або різними. Термін "галоген", як використано у цьому описі, відноситься до СІ, Br, F, або І груп. II. Способи одержання сполук даного винаходу Аналоги рапаміцину формули І даного винаходу одержують з рапаміцинового вихідного матеріалу. Переважно, рапаміциновий вихідний матеріал включає, без обмеження наведеними, рапаміцин, норрапаміцин, деоксорапаміцин, десметилрапаміцини, або десметоксирапаміцин, або їх фармацевтично прийнятні солі, проліки, або метаболіти. Однак, спеціаліст, кваліфікований у даній галузі техніки, буде здатний легко вибрати прийнятний рапаміциновий вихідний матеріал, який може бути використаний для одержання нових аналогів рапаміцину даного винаходу. Термін "десметилрапаміцин" відноситься до класу рапаміцинових сполук, у яких не вистачає однієї або більше метальних груп.Приклади десметилрапаміцинів, які можуть бути використані у відповідності з даним винаходом, включають 3десметилрапаміцин (US Patent No. 6,358,969), 7-Одесметилрапаміцин (US Patent No. 6,399,626), 17десметилрапаміцин (US Patent No. 6,670,168), та 32-О-десметилрапаміцин, серед інших. Термін "десметоксирапаміцин" відноситься до класу рапаміцинових сполук, у яких не вистачає однієї або більше метокси груп, та включає, без обмеження, 32-десметоксирапаміцин. Тому аналоги рапаміцину формули І даного винаходу одержують шляхом комбінування рапаміцинового вихідного матеріалу та дієнофілу. Термін "дієнофіл" відноситься до молекули, яка вступає у реакцію з 1,3-дієном, що приводить до одержання [4+2] продукту циклоприєднання. Переважно, дієнофіл, використаний у даному винаході, є необов'язково заміщеним нітрозобензолом. 21 Цілий ряд нітрозобензолів може бути використаний у даному винаході та включає нітрозобензол, 2,6-дихлорштрозобензол, та 1-хлор-2-метил-4нітрозобензол, серед інших. Спеціаліст, кваліфікований у даній галузі техніки, буде здатний легко вибрати кількість нітрозобензолу, яка буде ефективною у одержанні аналогів рапаміцину даного винаходу. Переважно використовують надлишок нітрозобензолу, та більш переважно у 5:1 співвідношенні нітрозобензолу до рапаміцинового вихідного матеріалу. Однак, може бути використане навіть 1:1, 2:1 або 3:1 співвідношення нітрозобензолу до рапаміцину, як визначено спеціалістом, кваліфікованим у даній галузі техніки. Нітрозобензол та рапаміциновий вихідний матеріал комбінують у розчиннику. Розчинник переважно розчиняє нітрозобензол та/або рапаміцин при контактуванні, або розчиняє нітрозобензол та рапаміцин при проходженні реакції. Розчинники, які можуть бути використані у даному винаході, включають, без обмеження наведеними, диметилформамід, діоксан, такий як п-діоксан, хлороформ, спирти, такі як метанол та етанол, етилацетат, воду, ацетонітрил, тетрагідрофуран, дихлорметан, та толуол, або їх комбінації. Однак, спеціаліст, кваліфікований у даній галузі техніки, буде здатний легко вибрати прийнятний розчинник на основі розчинності рапаміцинового вихідного матеріалу та нітрозобензолу, а також реакційної здатності розчинників з ними. Кількість розчиннику, що використовується, залежить від ступеню реакції та специфічно кількості рапаміцинового вихідного матеріалу та нітрозобензолу, присутнього у реакційній суміші. Спеціаліст, кваліфікований у даній галузі техніки, буде здатний легко визначити кількість необхідного розчиннику. Як правило, розчин, що містить нітрозобензол, рапаміциновий вихідний матеріал, та розчинник, підтримують при підвищених температурах, та переважно температурі, яка не сприяє розкладанню рапаміцину та нітрозобензолу. У одному втіленні, зазначений розчин підтримують при температурі від приблизно 30 до приблизно 70°С, та переважно при приблизно 50°С. Компоненти нагрівають впродовж часу, достатнього для проведення реакції між рапаміцином та нітрозобензолом. Спеціаліст, кваліфікований у даній галузі техніки, використовуючи відомі технології, буде здатний легко контролювати проходження реакції протягом нагрівання і, таким чином, визначити кількість часу, необхідного для проведення реакції. У одному кращому втіленні, рапаміцин та нітрозобензол змішують з п-діоксаном та підтримують при температурі приблизно 50°С. 94034 22 Виділення та очищення рапаміцинових аналогів добре відомо спеціалістам, кваліфікованим у даній галузі техніки, та включає хроматографію, включаючи, без обмеження, та перекристалізацію, високо ефективну рідинну хроматографію (HPLC), таку як обернено-фазна HPLC, та нормальнофазна HPLC, та ексклюзійна хроматографія. Після того як одержали аналог рапаміцину, він може бути відновлений з утворенням більш насиченого аналогу рапаміцину. Спеціаліст, кваліфікований у даній галузі техніки, буде здатний легко вибрати прийнятний відновлюючий агент для застосування у даному винаході. Переважно, на відновлення аналогу рапаміцину можна впливати, використовуючи гідрогенуючий агент. Спеціаліст, кваліфікований у даній галузі техніки, буде здатний легко вибрати прийнятний гідрогенуючий агент для застосування у даному винаході. Як правило, каталізатори з перехідних металів або перехідні метали на підложці, переважно вуглецевій підложці, серед інших, у присутності газоподібного водню, використовують для проведення відновлення. У кращому втіленні, відновлення проводять використовуючи метал паладій на вугіллі у присутності газоподібного водню. Відновлення рапаміцинового аналогу, як правило, проводять у розчиннику. У зазначеному відновленні може бути використаний цілий ряд розчинників та вони включають, без обмеження наведеними, спирти, такі як метанол. Однак, спеціаліст, кваліфікований у даній галузі техніки, буде здатний легко вибрати прийнятний розчинник для застосування у даному винаході та в залежності від каталізатору гідрогенування та рапаміцинового аналогу, який відновлюють. Кількість розчиннику залежить від ступеню реакції, та в особливості кількості рапаміцинового аналогу, який відновлюють. Кількість агенту гідрогенування, що використовують у даному винаході, може бути легко визначена спеціалістом, кваліфікованим у даній галузі техніки. Однак, спеціаліст, кваліфікований у даній галузі техніки, буде здатний визначити та відрегулювати кількість агенту гідрогенування, необхідну для проведення відновлення та для утворення більш насичених аналогів рапаміцину даного винаходу. Більш того, цілий ряд апаратів може бути використаний для проведення гідрогенування даного винаходу та включає, серед інших, апарати Парра. Вибір певного апарату для гідрогенування знаходиться у межах компетенції спеціалісту, кваліфікованого у даній галузі техніки. Кращий спосіб одержання аналогів рапаміцину даного винаходу підсумований у Схемі 1, показаній нижче: 23 у якій R1, R2, R4, R4', R6, R7, R15, та п приймають значення, представлені вище. Аналоги рапаміцину даного винаходу можуть бути використані в утворенні їх фармацевтично прийнятних солей, проліків, або метаболітів, одержаних з фармацевтично або фізіологічно прийнятних кислот або основ. Зазначені солі включають, не обмежуючись наведеними, наступні солі з мінеральними або неорганічними кислотами, такими як соляна кислота, сірчана кислота, азотна кислота, фосфорна кислота, та органічними кислотами, такими як оцтова кислота, щавлева кислота, бурштинова кислота, та малеїнова кислота. Інші солі включають солі з лужними металами або лужноземельними металами, такими як натрій, калій, кальцій або магній у формі складних ефірів, карбаматів та інших загальновідомих форм "проліків", які, при застосуванні у такій формі, перетворюються у активний залишок in vivo. III. Способи застосування сполук даного винаходу Аналоги рапаміцину формулІ, Іа, та Іb даного винаходу, включаючи більш та менш насичені аналоги рапаміцину, є корисними у застосуваннях, пов'язаних з неврологічними розладами (включаючи нервово-м'язові розлади) та серцевосудинними розладами, серед інших. Аналоги рапаміцину формул І, Іа, та Іb даного винаходу, включаючи більш та менш насичені аналоги рапа 94034 24 міцину, є корисними при розладах, що включають дисфункцію каналу іонів кальцію (Са2+), типу каналопатій ріанодинового рецептору (RyR1, RyR2, та Ryr3), включаючи, серед інших, такі як злоякісна гіпертермія, вроджена міопатія з ураженням серцевини м'язових волокон (central core disease), катеколамінергічна поліморфна шлуночкова тахікардія, та аритмогенна дисплазія правого шлуночку типу 2 (ARVD-2). Аналоги рапаміцину формул І, Іа, та Іb даного винаходу, включаючи більш або менш насичені аналоги рапаміцину, є також корисними при каналопатіях дигідропіридинового рецептору, включаючи ті, що є результатом активності ріанодинового рецептору через активність дигідропіридин-чутливих каналів іонів кальцію (Са2+). Як використано у цьому описі, термін "каналопатія" відноситься до хвороби або розладу, що включає дисфункцію іонного каналу. Хвороби та розлади, на які посилаються у цьому описі, згруповані у цьому описі під загальними назвами, наприклад, такими як неврологічні розлади та запальні розлади. Спеціаліст, кваліфікований у даній галузі техніки, зрозуміє, що хвороби або розлади, на які посилаються у цьому описі, можуть бути відповідно згруповані під різними загальними назвами або під множинними загальними назвами. Групування хвороб та/або розладів, на які посилаються у цьому описі, не є обмеженням даного винаходу. 25 Сполуки даного винаходу є корисними у лікуванні неврологічних розладів, включаючи такі як: хвороба Альцгеймера; епілепсія; хвороба Хантінгтона; хвороба Паркінсона; інсульт; ураження спинного мозку; травматичне ураження мозку; деменція тіла Леві; хвороба Піка; хвороба Німанна-Піка; амілоїдна ангіопатія; церебральна амілоїдна ангіопатія; системний амілоїдоз; спадковий геморагічний інсульт з амілоїдозом голандського типу; міозит з включеними тільцями; легка когнітивна недостатність; синдром Дауна; та нервово-м'язові розлади, включаючи такі як боковий аміотрофічний склероз (ALS), розсіяний склероз, та м'язові дистрофії, включаючи такі як: псевдогіпертрофічна міопатія Дюшена, м'язова дистрофія Беккера, плече-лопатково-лицьова (Ландузі-Дежерина) дистрофія, та кінцівково-поперечна м'язова дистрофія (LGMD); та у одержанні лікарських засобів для них. Аналоги рапаміцину є також корисними у лікуванні ускладнень, спричинених інсультом, травмою голови, або ураженням спинного мозку, або іншими ураженнями мозку, периферичної нервової, центральної нервової, або нервово-м'язової системи, та у одержанні лікарських засобів для них. Нові аналоги рапаміцину є також корисними як нейропротективні агенти. Аналоги рапаміцину даного винаходу також можуть бути корисними як нейрорегенеративні агенти, тобто відновлюючі деякі неврологічні та/або нервово-м'язові або інші функції після появи одного з описаних вище станів та/або ураження, інсульту, або іншої травми. Сполуки даного винаходу є корисними у лікуванні серцево-судинних розладів, включаючи, не обмежуючись наведеними, такі як: застійна серцева недостатність; аритмогенні синдроми, включаючи такі як пароксизмальна тахікардія, уповільнені слідові деполяризації, шлуночкова тахікардія, раптова тахікардія, аритмії, викликані фізичними навантаженнями, синдроми подовження від інтервалу QT, та двостороння тахікардія; тромбоемболічні розлади, включаючи артеріальні серцево-судинні тромбоемболічні розлади, венозні серцево-судинні тромбоемболічні розлади, та тромбоемболічні розлади у камерах серця; атеросклероз; рестеноз; периферична артеріальна хвороба; операція коронарного шунтування; хвороба сонної артерії; артеріїт; міокардит; серцево-судинне запалення; судинне запалення; коронарна хвороба (CHD); нестабільна стенокардія (UA); нестабільна рефрактерна стенокардія; стабільна стенокардія (SA); хронічна стабільна стенокардія; гострий коронарний синдром (ACS); перший або повторний рецидив інфаркту міокарда; гострий інфаркт міокарда (AMI); інфаркт міокарда; He-Q-зубцевий інфаркт міокарда; не-STE інфаркт міокарда; хвороба коронарної артерії; ішемічна хвороба серця; серцева ішемія; ішемія; ішемічна несподівана смерть; транзиторна ішемічна атака; інсульт; периферична оклюзивна артеріальна хвороба; венозний тромбоз; тромбоз глибоких вен; тромбофлебіт; артеріальна емболія; тромбоз коронарної артерії; церебральний артеріальний тромбоз; церебральна емболія; ниркова емболія; легенева емболія; тромбоз, що відбувається при застосуванні (а) штуч 94034 26 них клапанів або інших імплантів, (b) постійних катетерів, (с) ендопротезів судин, (d) екстракорпорального кровообігу, (e) гемодіалізу, або (f) інших процедур, у яких кров стикається зі штучною поверхнею, яка промотує тромбоз; тромбоз, що відбувається після таких як: атеросклероз, хірургічна операція або ускладнення хірургічної операції, пролонгована імобілізація, артеріальна фібриляція, вроджена тромбофілія, рак, діабет, ефекти лікарських засобів або гормонів, та ускладнення вагітності; серцеві аритмії, включаючи суправентикулярні аритмії, передсерцеві аритмії, тремтіння передсердій, фібриляцію передсердій; інші хвороби, перераховані у Heart Disease: A Textbook of Cardiovascular Medicine, 2 Volume Set, 6th Edition, 2001, Eugene Braunwald, Douglas P. Zipes, Peter Libby, Douglas D. Zipes; та у одержанні лікарських засобів для них. У додатковому втіленні, серцево-судинна хвороба являє собою таку як: атеросклероз; коронарна хвороба (CHD); рестеноз; периферична артеріальна хвороба; операція коронарного шунтування; хвороба сонної артерії; артеріїт; міокардит; серцево-судинне запалення; судинне запалення; нестабільна стенокардія (UA); нестабільна рефрактерна стенокардія; стабільна стенокардія (SA); хронічна стабільна стенокардія; гострий коронарний синдром (ACS); інфаркт міокарда; або гострий інфаркт міокарда (AMI), включаючи перший або повторний рецидив інфаркту міокарда, нe-Q-зубцевий інфаркт міокарда, інфаркт міокарда з нe-STсегментним підвищенням та інфаркт міокарда з ST-сегментним підвищенням. У ще одному додатковому втіленні, серцевосудинна хвороба являє собою таку як: атеросклероз; коронарна хвороба (CHD); нестабільна стенокардія (UA); нестабільна рефрактерна стенокардія; стабільна стенокардія (SA); хронічна стабільна стенокардія; гострий коронарний синдром (ACS); інфаркт міокарда; або гострий інфаркт міокарда (AMI), включаючи перший або повторний рецидив інфаркту міокарда, He-Q-зубцевий інфаркт міокарда, інфаркт міокарда з нe-ST-сегментним підвищенням та інфаркт міокарда з ST-сегментним підвищенням. Аналоги рапаміцину формул І, Іа, та Іb даного винаходу, як було показано, також мають імунодепресивну активність, і, таким чином, є корисними як протизапальні агенти для лікування таких як: запальні розлади, включаючи без обмеження, аутоімунні розлади (наприклад, такі як вовчанка), запальні захворювання шкіри, кишкові запальні розлади, астми та атопічні розлади, та відторгнення трансплантанту/пересаджених тканин. Тому, аналоги рапаміцину є корисними у лікуванні запальних розладів, та у одержанні лікарських засобів для них, включаючи без обмеження, аутоімунні розлади, наприклад, такі як системна еритематозна вовчанка (SLE), артритичні хвороби (наприклад, ревматоїдний артрит, псоріатичний артрит, остеоартрит, анкілозуючий спондиліт), діабет (типу І), розсіяний склероз, бульбоспінальний параліч, васкуліт; запальних захворювань шкіри (наприклад, таких як псоріаз, дерматит та склеродерма); кишкових запальних розладів (наприклад, таких як 27 запальна хвороба кишок (EBD), хвороба Крона та виразковий коліт); астми та атопічних розладів (наприклад, алергії); та відторгнення трансплантанту/пересаджених тканин та хвороби "трансплантат проти хазяїна". Зазначені сполуки формул І, Іа, та Іb є також корисними у лікуванні або запобіганні доброякісної або злоякісної неопластичної хвороби або карцином та аденокарцином, та у одержанні лікарських засобів для них. Однією з таких сполук є 9,27дигідрокси-3-{2-[4-гідрокси-3-метоксициклогексил]1-метилетил}-10,21-диметокси-6,8,12,14,20,26гексаметил-37-феніл4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1с][1,4]оксазациклохентріаконтин1,5,11,28,29(6Н,31Н)-пентон. Іншою такою сполукою є 37-(4-хлор-3-метилфеніл)-9,27-дигідрокси-3{-2-[4-гідрокси-3-метоксициклогексил]-1метилетил}-10,21-диметокси-6,8,12,14,20,26гексаметил4,9,10,12,13,14,15,18,21,22,23,24,25,26,27,32,33,34, 34а-нонадекагідро-3Н-23,27-епокси-18,15(епоксиіміно)піридо[2,1-с][1,4]оксазациклохентріаконтин-1,5,11,28,29(6Н,31Н)-пентон. Карциноми та аденокарциноми, які можуть лікуватися у відповідності з даним винаходом, включають, без обмеження наведеними, карциноми або аденокарциноми ендометрію, яєчнику, молочної залози, кишечнику, нирки, простати, гіпофізу, менінгіому або інші гормоно-залежні пухлини. Вимоги до дози аналогів рапаміцину даного винаходу можуть змінюватися в залежності від стану, серйозності присутніх симптомів та певного суб'єкта, якого лікують. Спеціаліст, кваліфікований у даній галузі техніки, буде здатний легко визначити необхідну кількість рапаміцинового аналогу. У одному втіленні, застосовують від приблизно 0,5 до 200мг. У додатковому втіленні, застосовують від приблизно 0,5 до 100мг. У іншому втіленні, застосовують від приблизно 0,5 до приблизно 75мг. У ще одному додатковому втіленні, застосовують від приблизно 1 до приблизно 25мг. У іншому втіленні, застосовують від приблизно 0,5 до приблизно 10мг, переважно при застосуванні у комбінації з іншим агентом. У ще одному додатковому втіленні, застосовують від приблизно 2 до приблизно 5мг. У ще одному іншому втіленні, застосовують від приблизно 5 до приблизно 15мг. Лікування може бути розпочате з дозами рапаміцинового аналогу меншими, ніж ті, які необхідні для створення бажаного ефекту, та в основному меншими, ніж оптимальна доза рапаміцинового аналогу. Відповідно, доза може бути підвищена до досягнення оптимального ефекту у зазначених умовах. Точні дози будуть визначені курируючим лікарем на основі досвіду з окремим суб'єктом, якого лікують. В основному, композиції даного винаходу найбільш бажано застосовують у концентрації, яка буде в основному забезпечувати ефективні результати без спричинення будь-яких шкідливих або негативних побічних ефектів. IV. Способи одержання придатних для введення композицій, які містять аналоги рапаміцину 94034 28 У одному аспекті, даний винахід включає способи одержання фармацевтичної композиції, що містить один або більше аналогів рапаміцину даного винаходу. Як використано у цьому описі, посилання до композицій, що містять "аналог рапаміцину" або "зазначений аналог рапаміцину" винаходу, як передбачається, включає композиції, що містять один або більше аналогів рапаміцину винаходу. Композиція може бути застосована до ссавця декількома різними шляхами та бажано застосовується перорально у твердій або рідкій формі. Тверді форми, включаючи таблетки, капсули, та каплети, що містять рапаміциновий аналог, можуть бути утворені шляхом змішування рапаміцинового аналогу з одним або більше компонентами, описаними вище. В одному варіанті втілення компоненти композиції піддають сухому або мокрому змішуванню. В іншому варіанті втілення компоненти піддають сухому гранулюванню. У ще одному варіанті втілення компоненти суспендують або розчиняють у рідині і додають до форми, придатної для введення ссавцеві. Рідкі форми, які містять рапаміциновий аналог, можуть бути утворені шляхом розчинення або суспендування рапаміцинового аналогу у рідині, придатній для введення ссавцеві. Композиції, що містять рапаміциновий аналог даного винаходу, можуть бути одержані у відповідності з даним винаходом шляхом змішування рапаміцинового аналогу та фармацевтично прийнятного носія. Композиції, представлені у цьому описі, що містять рапаміциновий аналог, можуть бути сформульовані у будь-якій формі, прийнятний для бажаного шляху доставки, використовуючи фармацевтично ефективну кількість рапаміцинового аналогу. Наприклад, композиції винаходу можуть бути доставлені за допомогою шляху, такого як пероральний, дермальний, трансдермальний, внутрішньобронхіальний, інтраназальний, внутрішньовенний, внутрішньом'язовий, підшкірний, парентеральний, внутрішньочеревинний, внутрішньоносовий, вагінальний, ректальний, під'язичний, внутрішньочерепний, епідуральний, внутрішньотрахеальний, або шляхом уповільненого вивільнення. У кращому варіанті, доставка відбувається пероральним шляхом. Пероральна лікарська композиція таблеток даного винаходу також може бути використана для одержання пероральних лікарських таблеток, що містять похідні рапаміцинового аналогу, включаючи, не обмежуючись наведеними, складні ефіри, карбамати, сульфати, ефіри, оксими, карбонати, та подібні, які відомі спеціалістам, кваліфікованим у даній галузі техніки. Фармацевтично ефективна кількість рапаміцинового аналогу може змінюватися в залежності від специфічної(их) сполуки(сполук), способу доставки, серйозності стану, який лікують, та будь-яких інших активних інгредієнтів, що використовують у композиції. Режим дозування також може бути пристосований для забезпечення оптимальної терапевтичної відповіді. Декілька розділених доз можуть дос 29 тавлятися щоденно, наприклад, у поділених дозах від 2 до 4 разів на день, або може бути доставлена одинична доза. Однак, доза може бути пропорційно знижена або підвищена, на що вказують потреби терапевтичної ситуації. У одному втіленні, доставка відбувається на щоденній, щотижневій, або щомісячній основі. У іншому втіленні, доставка являє собою щоденну доставку. Однак, щоденні дози можуть бути знижені або підвищені, базуючись на періодичній доставці. Аналоги рапаміцину даного винаходу можуть бути змішані з одним або більше фармацевтично прийнятними носіями або наповнювачами, включаючи, без обмеження, тверді та рідкі носії, які сумісні з композиціями даного винаходу. Такі носії включають, серед інших, допоміжні речовини, сиропи, еліксири, розріджувачі, зв'язуючі речовини, любриканти, поверхнево-активні речовини, гранулюючі агенти, дезінтегруючі агенти, пом'якшуючі засоби, хелатори металів, рН регулятори, поверхнево-активні речовини, наповнювачі, дезінтегранти, та їх комбінації. У одному втіленні, рапаміциновий аналог змішують з хелаторами металів, рН регуляторами, поверхнево-активними речовинами, наповнювачами, дезінтегрантамии, любрикантами та зв'язуючими речовинами. Допоміжні речовини можуть включати, без обмеження наведеними, ароматизуючі речовини, барвники, консерванти, та допоміжні антиоксиданти, які можуть включати вітамін Е, аскорбінову кислоту, бутильований гідрокситолуол (ВНТ) та бутильований гідроксианізол (ВНА). Зв'язуючі речовини можуть включати, без обмеження наведеними, такі як: целюлоза, метилцелюлоза, гідроксиметилцелюлоза, карбоксиметилцелюлоза кальцію, карбоксиметилцелюлоза натрію, гідроксипропілцелюлоза, фталат гідроксипропілметилцелюлози, мікрокристалічна целюлоза, некристалічна целюлоза, поліпропілпіролідон, полівінілпіролідон (повідон, PVP), желатин, аравійська камедь та гуміарабік, поліетиленгліколі, крохмаль, цукри, такі як сахароза, каолін, декстроза, та лактоза, холестерин, трагакант, стеаринова кислота, желатин, казеїн, лецитин (фосфатиди), цетостеариловий спирт, цетиловий спирт, цетилові складні ефіри воску, декстрати, декстрин, гліцерил-моноолеат, гліцерил-моностеарат, гліцерил-пальмітостеарат, поліоксиетилен-алкілові ефіри, поліоксиетиленові похідні касторового масла, поліоксиетилен стеарати, полівініловий спирт, та желатин, серед інших. У одному втіленні, зв'язуюча речовина являє собою повідон, гідроксипропілметилцелюлозу, карбоксиметилцелюлозу, або желатин. У іншому втіленні, зв'язуюча речовина являє собою повідон. Любриканти можуть включати стеарат магнію, легку безводну кремнієву кислоту, тальк, стеаринову кислоту, натрію лаурил-сульфат, та натрію стеарил фурамат, серед інших. У одному втіленні, любрикант являє собою стеарат магнію, стеаринову кислоту, або натрію стеарил фурамат. У іншому втіленні, любрикант являє собою стеарат магнію. Гранулюючі агенти можуть включати, без обмеження наведеними, серед інших, діоксид крем 94034 30 нію, мікрокристалічну целюлозу, крохмаль, кальцію карбонат, пектин, кросповідон, та поліпласдон. Дезінтегруючі агенти або дезінтегранти можуть включати кроскармелозу натрію, крохмаль, карбоксиметилцелюлозу, заміщену гідроксипропілцелюлозу, натрію бікарбонат, кальцію фосфат, кальцію цитрат, натрію крохмаль гліколят, пептизований крохмаль або кросповідон, серед інших. У одному втіленні, дезінтегрант являє собою кроскармелозу натрію. Пом'якшуючі речовини можуть включати, без обмеження наведеними, стеариловий спирт, норковий жир, цетиловий спирт, олеїловий спирт, ізопропіл-лаурат, поліетиленгліколь, оливкове масло, вазелін, пальмітинову кислоту, олеїнову кислоту та міристил-міристат. Поверхнево-активні речовини можуть включати полісорбати, складні ефіри сорбіту, полоксамер, або натрію лаурил-сульфат. У одному втіленні, поверхнево-активна речовина являє собою натрію лаурил-сульфат. Хелатори металів можуть включати фізіологічно прийнятні хелатуючі агенти, включаючи етилендіамінтетраоцтову кислоту, яблучну кислоту, або фумарову кислоту. У одному втіленні, хелатор металів являє собою етилендіамінтетраоцтову кислоту. рН регулятори також можуть бути використані для регулювання рН розчину, що містить рапаміциновий аналог, від приблизно 4 до приблизно 6. У одному втіленні, рН розчину, що містить рапаміциновий аналог, доводять до рН приблизно 4,6. рН регулятори можуть включати фізіологічно прийнятні агенти, включаючи лимонну кислоту, аскорбінову кислоту, фумарову кислоту або яблучну кислоту, та їх солі. У одному втіленні, рН регулятор являє собою лимонну кислоту. Наповнювачі, які можуть бути використані у відповідності з даним винаходом, включають безводну лактозу, мікрокристалічну целюлозу, манітол, кальцію фосфат, пептизований крохмаль, або сахарозу. У одному втіленні, наповнювач являє собою безводну лактозу. У іншому втіленні, наповнювач являє собою мікрокристалічну целюлозу. У одному втіленні, композиції, що містять рапаміциновий аналог даного винаходу, доставляють перорально за допомогою таблетки, каплету або капсули, мікрокапсул, дисперсного порошку, гранули, суспензії, сиропу, еліксиру, та аерозолю. Бажано, коли композиції, що містять рапаміциновий аналог, доставляються перорально, доставку здійснюють за допомогою таблеток та капсул, наповнених твердою речовиною або рідиною. У іншому втіленні, композиції, що містять рапаміциновий аналог, можуть бути доставлені внутрішньовенно, внутрішньом'язово, підшкірно, парентерально та внутрішньочеревинно у формі стерильних ін'єкційних розчинів, суспензій, дисперсій, та порошків, які є текучими до того ступеню, що забезпечує легку роботу шприцом. Такі ін'єкційні композиції є стерильними та стабільними в умовах виробництва та зберігання, та вільними від забруднюючої дії мікроорганізмів, таких як бактерії та гриби. 31 У додатковому втіленні, композиції, що містять рапаміциновий аналог, можуть бути доставлені ректально у формі звичайної супозиторії. У іншому втіленні, композиції, що містять рапаміциновий аналог, можуть бути доставлені вагінально у формі звичайної супозиторії, крему, гелю, кільця, або покритого внутрішньоматкового пристрою (IUD). У іншому втіленні, композиції, що містять рапаміциновий аналог, можуть бути доставлені за допомогою покриття або імпрегнування підложки, тобто основи, здатної містити несучий фармацевтично прийнятний носій або наповнювач, що містить сполуку винаходу, наприклад, васкулярні ендопротези судин або шунти, ендопротези коронарних судин, ендопротези периферичних судин, катетери, артеріо-венні трансплантати, обхідні трансплантати, та балони доставки лікарських засобів для застосування у судинній системі. У одному втіленні, покриття, прийнятні для застосування, включають, не обмежуючись наведеними, полімерні покриття, що складаються з будь-якого полімерного матеріалу, у якому сполука винаходу є розчинною у значному ступені. Підложки та способи покриття або імпрегнування, наприклад, ті, які описані у Патенті Сполучених Штатів No. 6,890,546, відомі спеціалістам, кваліфікованим у даній галузі техніки, та не обмежують даний винахід. У ще одному іншому втіленні, композиції, що містять рапаміциновий аналог, можуть бути доставлені інтраназально або внутрішньобронхіально у формі аерозолю. Аналоги рапаміцину застосовують перорально, також як і внутрішньовенним, внутрішньом'язовим або підшкірним шляхами. Тверді носії включають такі речовини як: крохмаль, лактоза, кальцію гідрофосфат, мікрокристалічна целюлоза, сахароза та каолін, в той час як рідкі носії включають такі речовини як: стерильна вода, поліетиленгліколі, не-іонні поверхнево-активні речовини та харчові масла, такі як кукурудзяне, арахісове та сезамове масла, які є прийнятними для природи активного інгредієнту та певної бажаної форми застосування. Переважно включають допоміжні речовини, що звичайно використовують у одержанні фармацевтичних композицій, такі як ароматизуючі речовини, барвники, консерванти, та антиоксиданти, наприклад, такі як вітамін Е, аскорбінова кислота, ВНТ та ВНА. Кращі фармацевтичні композиції з точки зору легкості одержання та застосування являють собою тверді композиції, в особливості таблетки та капсули, наповнені твердою речовиною або рідиною. Пероральне застосування сполук є кращим. Аналоги рапаміцину також застосовують парентерально або внутрішньочеревинно. Розчини або суспензії цих активних сполук, у вигляді вільної основи або фармакологічно прийнятної солі, одержують у воді, прийнятно змішаній з поверхневоактивною речовиною, такою як гідроксипропілцелюлоза. Дисперсії також одержують у. гліцерині, рідких поліетиленгліколях та їх сумішах у маслах. При звичайних умовах зберігання та застосування, 94034 32 зазначені препарати містять консервант для запобігання росту мікроорганізмів. Фармацевтичні форми, прийнятні ін'єкційного застосування, включають стерильні водні розчини або дисперсії та стерильні порошки для одержання стерильних ін'єкційних розчинів або дисперсій негайного застосування. У всіх випадках, зазначена форма є стерильною та текучою до того ступеню, що забезпечує легку роботу шприцом. Вона є стабільною в умовах виробництва та зберігання та захищена від забруднюючої дії мікроорганізмів, таких як бактерії та гриби. Носієм є розчинник або дисперсійне середовище, що містить, наприклад, воду, етанол (наприклад, гліцерин, пропіленгліколь та рідкий поліетиленгліколь), їх прийнятні суміші, та рослинне масло. V. Набори даного винаходу Даний винахід також забезпечує набори або упаковки, що містять аналоги рапаміцину. Набори даного винаходу можуть включати рапаміциновий аналог даного винаходу та носій, прийнятний для застосування до ссавця, як описано вище. Набори також можуть містити реагенти, що необхідні для одержання аналогів рапаміцину даного винаходу, та включають рапаміцин, необов'язково заміщений нітрозобензол, та розчинник. Набори можуть необов'язково включати інші реагенти для утворення інших аналогів рапаміцину та включають агенти гідрогенування. Набір може додатково містити інструкції для проведення реакцій даного винаходу. У наборі також може бути забезпечено інші прийнятні хімічні реагенти, одноразові рукавички, інструкції стосовно очистки, аплікаторні палички або контейнери, та чашки для одержання зразків. Наступні приклади забезпечені для ілюстрації даного винаходу та не обмежують його обсягу. Спеціаліст, кваліфікований у даній галузі техніки, зрозуміє, що хоча у наступних прикладах описані специфічні реагенти та умови, можуть бути зроблені модифікації, що, як розуміють, включені у суть та обсяг винаходу. ПРИКЛАДИ Приклад 1 У Таблиці 1 забезпечено дані мас-спектрів (MS) та на Фігурі 1 забезпечено спектр ядерного магнітного резонансу (ЯМР) для сполуки, одержаної за допомогою наступних двох альтернативних шляхів. Теоретична нейтральна маса: 1020,59226 33 94034 34 Таблиця 1 Точні результати мас-спектрометрії високого розділення Адукт 1+ [М+Н] 1+ [M+Na] 1+ [M+NH4] 2+ [М+2Н] 1+ [М+СН3ОН+Н] Експерим. 1021,59780 1043,57740 1038,62305 511,30109 1053,62596 Теоретичн. 1021,59954 1043,58148 1038,62608 511,30341 1053,62575 A. Шлях 1 Рапаміцин (2,5г, 2,73ммоль) розчиняють у 200мл п-діоксану. До зазначеного розчину додають, краплинним способом, розчин нітрозобензолу (1,50г, 5екв.) у 200мл п-діоксану. Реакційну суміш перемішують при 50°С впродовж 64 годин, та потім продукти хроматографують за допомогою обернено-фазної високо ефективної рідинної хроматографії (HPLC) (колонка: 200×50mm YMC ODS-A, рухома фаза: 80% метанолзода, лінійна зміна швидкості потоку від 10мл/хвил. до 35мл/хвил. впродовж 10 хвилин, потім тримають при 35мл/хвил. впродовж додаткових 65 хвилин), що приводить до одержання 1,22г продукту (44% вихід, tR=12,1хвил., умови аналітичної HPLC: колонка = YMC ODS-A S-3 120 А, рухома фаза/градієнт: від 95 % води (+0,025% мурашиної кислоти)/ацетонітрил (+0,025% мурашиної кислоти) до 5% води впродовж 6 хвилин, тримають при 5% впродовж 9 хвилин, потік = 0,30мл/хвил.). B. Шлях 2 - Альтернативний шлях Рапаміцин (0,3г, 0,328ммоль) розчиняють у 5мл толуолу з обережним нагріванням. До зазначеного розчину додають, краплинним способом, розчин нітрозобензолу (0,1г, 3екв.) у 5мл толуолу. Реакційну суміш перемішують при 70°С впродовж 16 годин, та потім продукти хроматографують за допомогою обернено-фазної високо ефективної рідинної хроматографії (HPLC) (колонка: 250×20mm YMC ODS-A з 50×20 захистом, рухома фаза: від 80 до 85% метанол:вода у 40 хвилин, потік = 20мл/хвил.), що приводить до одержання 0,139г продукту (42% вихід, tR=12,1хвил., умови аналітичної HPLC: колонка = YMC ODS-A S-3 120 А, рухома фаза/градієнт: від 95% води (+0,025% мурашиної кислоти)/ацетонітрил (+0,025% мурашиної кислоти) до 5% води впродовж 6 хвилин, тримають при 5% впродовж 9 хвилин, потік = 0,30мл/хвил.). Приклад 2 mmu -1,74 -4,08 -3,03 -2,32 0,21 ppm -1,70 -3,91 -2,92 -4,53 0,20 RI% 100,0 17,8 1,2 1,8 1,5 У Таблиці 2 забезпечено дані мас-спектрів (MS) та на Фігурі 2 забезпечено спектр ядерного магнітного резонансу (ЯМР) для сполуки, одержаної за допомогою наступних двох альтернативних шляхів. A. Шлях 1 Сполуку, одержану у відповідності з Прикладом 1 (0,29г, 0,284ммоль), розчиняють у 7мл метанолу у 18мм тестовій пробірці, та додають Pd/C каталізатора (Aldrich) на кінчику шпателя. Зазначену суміш гідрогенують на апараті Парра впродовж 15 хвилин при 2,0 атмосферах Н2. Продукти хроматографують за допомогою обернено-фазної HPLC (колонка: 250×20мм YMC ODS-A з 50×20 захистом, рухома фаза: 80% метанол:вода впродовж 15 хвилин, потім до 85% у 5 хвилин, потім тримають при 85% впродовж 20 хвилин, потік = 20мл/хвил.), що приводить до одержання 0,089 г продукту (31 % вихід, tR=12,6хвил., умови аналітичної HPLC: колонка = YMC ODS-A S-3 120 А, рухома фаза/градієнт: від 95% вода (+0,025 % мурашиної кислоти) /ацетонітрил (+0,025% мурашиної кислоти) до 5% води впродовж 6 хвилин, тримають при 5% впродовж 9 хвилин, потік = 0,30мл/хвил.) B. Шлях 2 - Альтернативний шлях Сполуку, одержану у відповідності з Прикладом 1 (9,85г, 9,65ммоль), розчиняють у 50мл метанолу, та 3 рази додають Pd/C каталізатор (Aldrich) на кінчику шпателя. Зазначену суміш гідрогенують на апараті Парра впродовж 2,5 годин при 2,5 атмосферах Н2. Продукти хроматографують за допомогою обернено-фазної HPLC (колонка: 250×50мм YMC ODS-A, рухома фаза: 80% метанол:вода впродовж 40 хвилин, потім до 85% впродовж 5 хвилин, потім тримають при 85% впродовж 35 хвилин, потік = 35мл/хвил.), що приводить до одержання 3,35г продукту (15% вихід, tR=12,2хвил., умови аналітичної HPLC: колонка = YMC ODS-A S-3 120 А, рухома фаза/градієнт: від 95% води (+0,025% мурашиної кислоти)/ацетонітрил (+0,025% мурашиної кислоти) до 5% води впродовж 6 хвилин, тримають при 5 % впродовж 9 хвилин, потік = 0,30мл/хвил.) Теоретична нейтральна маса: 1022,60791 35 94034 36 Таблиця 2 Точні результати мас-спектрометрії високого розділення І+ Адукт [М+Н] 1+ [M+Na] Експерим. 1023,61722 1045,59943 Теоретичн. 1023,61519 1045,59713 Приклад 3 Рапаміцин (0,25г, 0,274ммоль) розчиняють у 5 мл толуолу з обережним нагріванням. До зазначе mmu 2,03 2,30 ppm 1,99 2,20 RI% 100,0 10,5 ного розчину додають, краплинним способом, розчин 2,6-дихлорнітрозобензолу (0,144 г, 3 екв.) у 7 мл толуолу. Реакційну суміш перемішують при 80°С впродовж 36 годин, та потім продукти хроматографують за допомогою обернено-фазної HPLC (колонка: 250×20мм YMC ODS-A з 50×20 захистом, рухома фаза: від 80 до 85% метанол:вода у 40 хвилин, потік = 20мл/хвил.), що приводить до одержання 0,046г продукту (15% вихід, tR=13,0 хвилин, умови аналітичної HPLC: колонка = YMC ODS-A S-3 120 А, рухома фаза/градієнт: від 95% води (+0,025% мурашиної кислоти)/ацетонітрил (+ 0,025 % мурашиної кислоти) до 5 % води впродовж 6 хвилин, тримають при 5% впродовж 9 хвилин, потік = 0,30мл/хвил.). MS дані забезпечені у Таблиці 3 та Фігура 3 представляє ЯМР спектр. Теоретична нейтральна маса: 1088,51431 Таблиця 3 Точні результати мас-спектрометрії високого розділення Адукт 1+ [М+Н] 1+ [M+Na] 1+ [M+NH4] Експерим. 1089,52125 1111,50044 1106,54443 Теоретичн. 1089,52159 1111,50353 1106,54813 mmu -0,34 -3,09 -3,70 ppm -0,31 -2,78 -3,35 RI% 19,1 18,1 1,2 Приклад 4 Синтез даного прикладу проводять як описано у Прикладі 3 та застосовуючи 0,05г рапаміцину та 0,042г 1-хлор-2-метил-4-нітрозобензолу, що приводить до одержання 0,012г продукту (20% вихід, tR=12,8хвил.). MS дані забезпечені у Таблиці 4 та Фігура 4 представляє ЯМР спектр. Таблиця 4 Експериментальна маса 1091,55815 936,54361 Елементна формула (запропонована) 1+ C58H85ClN2O14Na 1+ C51H79NO13Na Вирахувана маса 1091,55815 936,54436 (mmu) 0,00 -0,75 (ppm) 0,00 -0,80 Іонне розподілення (запропоноване) 1+ [M+Na] 1+ [M+Na] -C7H6ClNO 37 94034 Приклад 5 Продукт з Прикладу 3 (0,046г, 0,0422ммоль) розчиняють у 5мл метанолу у 18мм тестовій пробірці, та додають Pd/C каталізатор (Aldrich) на кінці 38 шпателя. Зазначену суміш гідрогенують на апараті Парра впродовж 60 хвилин при 3 атмосферах Н2. Продукти хроматографують за допомогою обернено-фазної HPLC (колонка: 250×20мм YMC ODSА з 50×20 захистом, рухома фаза: від 85% метанол:вода до 90% впродовж 15 хвилин, потім тримають при 90% впродовж 25 хвилин, потік = 20мл/хвил.), що приводить до одержання 0,005 г продукту (11% вихід, tR=10,0 хвилин, умови аналітичної HPLC: колонка = YMC ODS-A S-3 120 А, рухома фаза/градієнт: від 95% води (+0,025% мурашиної кислоти)/ацетонітрил (+0,025% мурашиної кислоти) до 5% води впродовж 6 хвилин, тримають при 5% впродовж 9 хвилин, потік = 0,30мл/хвил.). MS дані забезпечені у Таблиці 5 та Фігура 5 представляє ЯМР спектр. Теоретична нейтральна маса: 1090,52996 Таблиця 5 Точні результати мас-спектрометрії високого розділення Адукт 1+ [М+Н] l+ [M+Na] 1+ [M+NH4] Експерим. 1091,53497 1113,52166 1108,56627 Теоретичн. 1091,53724 1113,51918 1108,56378 Приклад 6 у mmu -2,27 2,48 2,49 ppm -2,08 2,23 2,24 RI% 4,3 4,8 15,5 (0,099ммоль) рапаміцинового 42-складного ефіру з 2,2-диметил-3-(піридин-2-іл)-пропіоновою кислотою (одержаною у відповідності зі способом US 5,385,908) та 0,032г нітрозобензолу (0,297ммоль, 3екв.). Реакційну суміш перемішують при 70°С впродовж 40 годин та потім продукти хроматографують за допомогою обернено-фазної HPLC (колонка: 250×20мм YMC ODS-A з 50×20 захистом, рухома фаза: від 80 до 85% метанол:вода у 15 хвилин, потім до 90% метанолу впродовж 10 хвилин, потім тримають при 90% впродовж 15 хвилин, потік = 20мл/хвил.), що приводить до одержання 0,007 г продукту (6% вихід, tR=13,0хвилин). MS дані забезпечені у Таблиці 6 та Фігура 6 представляє ЯМР спектр. Теоретична нейтральна маса: 1181,67632 Синтез даного прикладу проводять як описано Прикладі 3 та використовуючи 0,108г Таблиця 6 Точні результати мас-спектрометрії високого розділення Адукт 1+ [М+Н] 2+ [М+2Н] 2+ [M+H+Na] Експерим. 1182,68360 591,84544 602,83641 Теоретичн. 1182,68747 591,84715 602,83743 mmu 3,87 1,71 1,02 ppm 3,28 2,90 1,70 RI% 23,2 79,6 34,1 39 94034 Приклад 7 Сполуку, одержану у відповідності з Прикладом 1 (0,031г, 0,03ммоль), розчиняють у 5мл метанолу у 18мм тестовій пробірці, та додають Pd/C 40 каталізатор (Aldrich) на кінці шпателя. Зазначену суміш гідрогенують на апараті Парра впродовж 30 хвилин при 2,0 атмосферах Н2. Продукти хроматографують за допомогою обернено-фазної HPLC (колонка: 250×20мм YMC ODS-A з 50×20 захистом, рухома фаза: 80% метанол:вода впродовж 15 хвилин, потім до 85% у 5 хвилин, потім тримають при 85% впродовж 20 хвилин, потік = 20 мл/хвил.), що приводить до одержання 0,016г продукту (55% вихід, tR=9,95хвил., умови аналітичної HPLC: колонка = YMC ODS-A S-3 120 А, рухома фаза/градієнт: від 95% води (+0,025% мурашиної кислоти) /ацетонітрил (+0,025% мурашиної кислоти) до 5% води впродовж 6 хвилин, тримають при 5% впродовж 9 хвилин, потік = 0,30мл/хвил.) MS дані забезпечені у Таблиці 7: Таблиця 7 Точні результати мас-спектрометрії високого розділення Адукт 1+ [М+Н] Експерим. 1025,62887 Теоретичн. 1025,63084 Приклад 8 Культури мезенцефалічного допамінергічного нейрону одержують як описано у Pong et ah, J. Neurochem. 69: 986-994, 1997, який включений у даний винахід шляхом посилання у всій його повноті. Ембріонні 15-денні (Е15) плоди шура збирають та розрізають у льодяному фосфатзабуференому сольовому розчині (PBS). Вентральну частину тканини, що містить мезенцефалічну допамінергічну область, вирізають. Вирізані частини тканини складають разом та переносять у середовище ферментативної дисоціації, що містить 20 IU/мл (де IU - міжнародні одиниці) папаїну у збалансованому сольовому розчині Ігла (Worthington Biochemical, Freehold, NJ, USA) та інкубують впродовж 60 хвилин при 37°С. Після ферментативної дисоціації, папаїновий розчин відкачують та тканину механічно розтирають за допомогою полірованої вогнем скляної пастерки у повному середовищі (рівні об'єми мінімального незамінного середовища (MEM) та F-12 поживного середовища (GibcoBRL), доповненого 0,1мг/мл апотрансферину та 2,5мкг/мл інсуліну), що містить 2,000 IU/мл ДНКази та 10мг/мл овомукоїдного протеазного інгібітору. Для експериментів поглинання допаміну, одноклітинні суспензії у повному середовищі висіюють на полі-L-орнітин- та ламінін-покриті 24лункові планшети. Зазначені культури підтримують впродовж семи днів до експериментування. Культури попередньо обробляють різними концентраціями сполуки впродовж 24 годин, потім піддають дії 10mM MPP+ вподовж 1 години. Через 1 годину інкубації, середовище змінюють три рази та свіжу сполуку додають ще на 48 години. Через 48 години росту культур мезенцефалічного допамінергічного нейрону, після МРР+ дії, проводять високо-афінне 3Н-допамінове погли mmu -1,97 ppm -1,92 RI% 38,0 нання, використовуючи модифікований спосіб, описаний Prochiantz et al, Nature 293: 570-572, 1981, який включений у даний винахід шляхом посилання. Культури промивають попередньо нагрітим PBS, що містить 5,6мМ глюкози та 1мМ аскорбінової кислоти. Потім культури інкубують впродовж 15 хвилин при 37°С з 50нМ 3Н-допаміну (31 Кюрі/ммоль, DuPont-NEN, Wilmington, DE, USA). Зазначені культури промивають двічі за допомогою буферу та лізують за допомогою 0,5 N NaOH. Лізат переносять у сцинтиляційну пробірку, що містить Ultima Gold сцинтиляційну суміш, та радіоактивність вимірюють за допомогою рідинного сцинтиляційного лічильника. Альтернативно, культуральні лізати можуть бути промиті двічі за допомогою буферу, інкубовані впродовж 2 годин при кімнатній температурі за допомогою сцинтиляційної суміші Optiphase Supermix (Wallac Scintillation Products, Gaithersburg, MD, USA), та радіоактивність вимірюють за допомогою рідинного сцинтиляційного лічильника. Дисоційовані коркові нейронні культури одержують як описано вище (Pong et ah, 2001). Коротко, ембріонні 15-денні плоди шура збирають та розрізають у льодяному PBS. Вирізані коркові шари складають разом та переносять у середовище ферментативної дисоціації, що містить папаїн. Через 30 хвилин, тканину механічно розтирають за допомогою полірованої вогнем скляної пастерки. Одноклітинні суспензії у повному середовищі висіюють на полі-L-орнітин- та ламінін-покриті 96лункові планшети. Через 24 години, культури обробляють різними концентраціями сполуки впродовж 72 годин. Потім зазначені культури фіксують та забарвлюють за допомогою анти-тубулін первинного антитіла (ТOJ-1) та флуоресцентно-міченого вторинного антитіла. Нейритовий відросток визначають 41 шляхом використання алгоритму Посиленого нейритового відростку (Enhanced Neurite Outgrowth ENO) за допомогою Cellomics ArrayScan та виражають як середню довжину нейриту або загальну довжину нейриту на клітину. Нейронні культури спинного мозку одержують з ембріонних 15-денних (Е15) плодів шура (Sprague-Dawley, Charles River Laboratories, Wilmington, MA). Зазначені ембріони збирають та їх спинний мозок видаляють у льодяному фосфатзабуференому сольовому розчині (PBS) без Са2+ та Mg2+ . Вирізані частини тканини спинного мозку збирають разом та переносять у середовище ферментативної дисоціації, що містить 20 IU/мл папаїну у збалансованому сольовому розчині Ігла (Worthington Biochemical, Freehold, NJ) та інкубують впродовж 30 хвилин при 37°С. Після ферментативної дисоціації, папаїновий розчин відкачують та тканину механічно розтирають за допомогою полірованої вогнем скляної пастерки у повному середовищі [Нейробазальне середовище з В-27 добавкою (Gibco, Grand Island, NY), 100 IU/мл пеніциліну, 100мкг/мл стрептоміцину, 3,3мкг/мл афідіколіну, 0,5мМ глутамату], що містить 2.000 IU/мл ДНКази та 10мг/мл овомукоїдного протеазного інгібітору. Одноклітинні суспензії у повному середовищі розміщають на попередньо покриті полі-Lорнітином та ламініном 96-лункові планшети (Becton-Dickinson, Bedford, MA) зі щільністю 1,0×104 клітин/лунку. Нейрони спинного мозку підтримують впродовж 24 годин, потім піддають дії наповнювача або різних концентрацій сполуки впродовж 72 годин. Всі сполуки Прикладів 1-3 є активними у дослідженнях коркових нейронів з ЕС50 менше, ніж 1мкМ. Сполуки Прикладів 1 та 6 були активними у дослідженнях допамінергічного поглинання з EC50 менше, ніж 1мкМ. Сполуки Прикладів 1-3 та 6 були активними у дослідженнях нейронів спинного мозку з ЕС50 менше, ніж 1мкМ. У порівнянні, ССІ-779 та рапаміцин вважаються неактивними у дослідженнях коркових нейронів та дослідженнях допамінергічного поглинання з ЕС50 значеннями більше, ніж 1мкМ. Рапаміцинфенілтриазоліндіон був активним у дослідженні допамінергічного поглинання з ЕС50 менше, ніж 1мкМ. Приклад 9 - Постійна оклюзія середньої мозкової артерії (рМСАО). Дорослих щурів Уістара чоловічої статі (Charles River, Wilmington, MA) 270-300г анестезують за допомогою 3% ізофлурану у 70% оксиду азоту та 30% кисню через носовий конус. Температуру підтримують при 37°С протягом всієї хірургічної операції, використовуючи нагрівальну лампу. Постійну оклюзію МСАО викликають за допомогою електрокаутеризації дистальної частини МСА (за допомогою краніотомії) з 90хвил. лігатуруванням обох сонних артерій для переривання колатерального кровообігу (Chen ST, Hsu CY, Hogan EL, Maricq H Balentine JD (1986) A model of focal ischemic stroke in the rat: reproducible extensive cortical infarction. Stroke 17:738-743). 10мг/кг сполуки застосовують внутрішньовенно через 1,5, 5,5, 24, 48, та 72 годин після ішемії. Щу 94034 42 рів тримають впродовж 21 дня для оцінки тривалого функціонального відновлення. Три поведінкові тести, модифіковані з більш ранніх тестів, описаних Bederson et al, (Bederson JB, Pitts LH, Tsuji M, Nishimura MC, Davis RL, Bartkowski H (1986) Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination. Stroke 17(3): 472-476) та DeRyck et al (DeRyck M, van Reempts J, Duytschaever H, van Deuren B, Clincke G (1992) Neocortical localization of tactile/proprioceptive limb placing reactions in the rat. Brain Res 573:44-60), були використані для оцінки сенсомоторної та рефлексної функції. Коротко, для ортостатичної проби, щурів підвішують за хвіст приблизно на 30 см над робочою поверхнею столу. Щурів, які витягнули обидві передні кінцівки у напрямку столу, оцінюють як 0, тих, які зігнули контралатеральну кінцівку у напрямку тіла та/або повертають контралатеральне плече та кінцівку всередину, оцінюють як 1, та тих, які звернули тіло у напрямку контралатерального боку та намагаються схопити хвіст, оцінюють як 2. Тест на положення передніх кінцівок складається з двох підтестів, тесту візуальної та тактильної опори. Для тесту візуальної опори, щурів тримають таким чином, що передні кінцівки висять вільно, та підносять близько спереду або збоку до поверхні столу. Для тесту тактильної опори, щурів тримають таким чином, що вони не можуть бачити поверхні столу. Тильна та бокова поверхня передньої кінцівки злегка торкається поверхні столу. Для кожного тесту дають оцінку 0, якщо реакція опори була миттєвою та нормальною; 1, якщо реакція опори була затримана (>2 секунд) або час від часу; 2, якщо не було ніякої реакції. Для тесту на положення задніх кінцівок, щурів тримають на краю поверхні робочого столу та контралатеральну задню кінцівку витягають за край та вивільнюють. Щурів, які повернули задню кінцівку назад на поверхню робочого столу відразу, оцінюють як 0, з затримкою (>2 секунд) оцінюють як 1, та тих, які не здатні підтягнути задню кінцівку назад, оцінюють як 2. Загальне число балів змінюється від 0 до 12. Сполука, одержана у Прикладі 2, показала статистично значне зниження балів поведінкової недостатності у щурів після внутрішньовенного застосування (10 мг/кг), після рМСАО. Приклад 10 - Т-лімфоцитарні дослідження У наступних дослідженнях, CD4+ Т-лімфоцити людини очищують шляхом негативного відбору від лімфоцитів периферичної крові, використовуючи RosetteSep за інструкціями виробника (StemCell Technologies, Inc. Vancouver, British Columbia). A. Дослідження aHTH-CD3/-CD28 стимуляції та IL-2 ре-стимуляції Тозил-активовані магнітні мікросфери (Dynal, Great Neck, NY) покривають за допомогою aHTHCD3 Ab (1мкг/107 мікросфер), та анти-СО28 Аb (0,5мкг/107мікросфер) як описано у Blair et al. J. Immunol., 160:12, 1998. Мишині IgG використовують для насичення зв'язуючої здатності мікросфер (загальний білок = 5мкг/107 мікросфер). Білокпокриті мікросфери додають до очищених CD4+ Тлімфоцитів (2×106 клітин/мл, співвідношення 1 сфера: 1 клітини) та активують впродовж 72 годин 43 у RPMI, 10% бичачої плідної сироватки, 2мМ глютамінового середовища. Клітини збирають, промивають, та культивують протягом ночі у свіжому середовищі та ре-стимулюють за допомогою IL-2 як описано у Bennett et al, J. Immunol. 170:711, 2003. Коротко, спочилі протягом ночі клітини перераховують, поміщають (105 клітин/лунку) у плоскодонні 96-лункові мікротитрові планшети та стимулюють за допомогою 1нг/мл IL-2 людини (R&D Systems, Minneapolis, MN) у присутності зростаючих концентрацій сполуки. Через сімдесят дві години після ре-стимуляції культури, планшети струшують вібруванням з 1мкКюрі/лунку міченого тритієм тимідину та інкубують впродовж 6-16 годин. Сполуки Прикладів 1 та 3 інгібують EL-2 вироблення з ІС50 менше, ніж приблизно 1мкМ, та переважно менше, ніж приблизно 200нМ. IL-2 вироблення сполук Прикладів 1 та 3 є порівнянним з IL-2 виробленням рапаміцину та ССІ-779. B. Форбол 12-міристат 13-ацетат (РМА)/іономіцин активаційне дослідження Проліферацію сполук визначають, використовуючи дане дослідження. CD4+ Т-лімфоцити (5×105 клітин/лунку) поміщають у плоскодонні 96лункові мікротитрові планшети у RPMI, 10% бичачої плідної сироватки, 2мМ глютамінового середовища та стимулюють за допомогою РМА (10нг/мл) та іономіцину (200нг/мл) у присутності зростаючих концентрацій сполуки. Через сімдесят дві години після активації, 100мкл культурального середовища збирають для IL-2 визначення, до кожної лунки додають додаткові 100мкл свіжого середовища та культури мітять міченим тритієм тимідином (1мкКюрі/лунку) впродовж 6 годин. Культури збирають та включення міченого тритієм тимідину (число імпульсів на хвилину, СРМ) оцінюють, використовуючи Trilux (Perkin Elmer, Shelton, CT). IL2 вироблення визначають, використовуючи ELISA за інструкціями виробника (R&D Systems, Minneapolis, MN). У цьому дослідженні, сполуки Прикладів 1 та 3 інгібують проліферацію з ЕС50 у інтервалі 4,90,2мкМ. Приклад 11 PTEN-пухлинний пригнічуючий ген (фосфатний та тензиновий гомолог, вилучений на хромосомі десять) кодує ліпідну фосфатазу, яка відіграє критичну роль у негативній регуляції РІЗК/АКТ шляхів сигналювання. Мутація або делеція PTEN гену була знайдена у пухлинах мозку, простати, ендометрію, щитовидної залози, молочної залози та лімфоїдних клітинах. Дивись, Cantley et al, Proc. Natl. Acad. Sci. USA. 96: 4240-4245,1999; Ali et al, J. Natl. Cancer Inst. 91: 1922-32,1999; Scott et al, Proc. Natl. Acad. Sci. USA. 95: 7772-7777, 1998; та Nave etal, Biochem. J. 344: 427-431,1999. У цьому дослідженні, дослідження проліферації на клітинній основі проводять для оцінки сполук винаходу у інгібуванні росту клітин, включаючи клітинну лінію пухлини молочної залози MDA468 (PTEN-мутована) АТСС No. HTB-132 або клітинну лінію пухлини простати LNCap (PTEN- мутована) АТСС CRL-1740. 94034 44 (і) У перший день, клітини поміщають у 96лункові культуральні планшети. (іі) У другий день, сполуки додають до клітин у попередньо визначеній концентрації. (ііі) У п'ятий день, клітинну проліферацію вимірюють за допомогою стандартного MTS протоколу дослідження, як описано у SA О'Тооіе et al, Cancer Detection and Prevention, 27(1), 2003. Результати записують за А490 абсорбцією, використовуючи 96-лунковий форматний рідер для планшетів. (iv) MTS результати (А490 одиниць) з оброблених сполукою лунок далі обраховують як % контрольного росту по відношенню до контрольних (необроблених) лунок на тому культуральному планшеті. Ці дані ілюструють, що сполука Прикладу 1 має ІС50 значення менше, ніж 0,01мкМ як для MDA468, так і для LNCap клітинних ліній. Приклад 12 - Модуляція потоків кальцію ріанодинового рецептору Сподіваються, що сполуки будуть модулювати потоки кальцію ріанодинового рецептору шляхом стабілізації FKBP12.6, прикріпленого до ріанодинового рецептору при тестуванні у наступних дослідженнях: А. Дослідження поглинання кальцію Поглинання кальцію (Са +) визначають за процедурами, описаними у (1) Т. Yamamoto, et al, Cardiovascular Research 44:146-155 (1999) або (2) M. Yano, et al, Circulation, 102: 2131-2136 (2000). Пухирці саркоплазматичного ретикулуму (SR) для застосування у цих дослідженнях одержують у відповідності зі способом Kranias, et ah, Biochem. Biophys. Ada., 709: 28-37 (1982). Ліві шлуночки, отримані від собак з викликаною серцевою недостатністю, гомогенізують у розчині, що містить 30мМ Tris-малату, 0,3М сахарози, 5мг/л лейпептину та 0,1мМ PMSF, при рН 7,0 (Розчин І). Зазначений гомогенат центрифугують при 5500g впродовж 10 хвилин та отриману надосадову рідину відфільтровують через чотири шари марлі перед центрифугуванням при 12,000 g впродовж 20 хвилин. Надосадову рідину знову відфільтровують через марлю та центрифугують при 143,000g впродовж 30 хвилин. Осад після центрифугування знову суспендують у розчині, що містить 0,6М КСl, 30мМ Tris-малату, 0,3М сахарози, 5мг/л лейпептину, 0,1мМ PMSF, при рН 7,0 (Розчин II). Зазначену суспензію центрифугують при 143,000g як описано вище. Осад після центрифугування суспендують у Розчині І та центрифугують при 143,000g. Таблетовану мікросомальну фракцію, що містить SR пухирці, суспендують у розчині, що містить 0,1 М КС1, 20 мМ Tris-малату, 0,3М сахарози, 5мг/л лейпептину, 0,1мМ PMSF, при рН 7,0, що приводить до одержання кінцевої концентрації білку 1020мг/мл. (1) SR пухирці, одержані як описано вище, (0,2мг/мл) інкубують у 2 мл розчину, що містить 0,15М КСl, 1мМ MgCl2, 30мкМ 45СаСl2 (1мСі/мл), 10мМ NaN3 та 20мМ MOPS, рН 7,1 (22°С). Са2+ поглинання ініціюють додаванням 1мМ АТР та визначають у змінні часові інтервали шляхом поміщення 2мл аліквоти на 0,45мкм Міlliроrе фільтр, та промивання його за допомогою 5мл промивного 45 буферу (0,15М КСl, 20мМ MOPS, рН 7,1 (22°С), що містить 30мМ EGTA та 15мкМ рутенію червоного). Радіоактивність, що залишилася на фільтрах, визначають за допомогою рідинного сцинтиляційного лічильника. (2) SR пухирці, одержані як описано вище, (0,2мг/мл) інкубують у 0,5мл розчину, що містить 0,15моль/л глюконату калію, 1ммоль/л MgCl2, 0,2ммоль/л EGTA-кальцієвого буферу (вільний [Са2+] 0,3мкМ), 10мМ NaN3, та 20мМ MOPS, рН 6,8. Са2+ поглинання ініціюють додаванням 0,5мМ АТР у кювету. Са2+ поглинання контролюють впродовж часу спектрофотометрично з fluo 3 як індикатором Са2+ (збудження при 480нм, випромінювання при 530нм). B. Дослідження витоку кальцію Поглинання кальцію (Са2+) визначають за процедурами, описаними у М. Yano, et al, Circulation, 102: 2131-2136 (2000). Після встановлення плато на кривій поглинання Са2+ у SR пухирцях відповідно до процедури, описаної у "А. Дослідження поглинання кальцію, (2)" вище, додають різні концентрації FK506 у присутності 1мкМ тапсігаргіну (thapsigargin) для інгібування SR Са2+-АТР активності, та контролюють отриманий Са2+ витік. C. Дослідження спів-локалізації Спів-локалізацію серцевого ріанодинового рецептору (RyR) до FKBP12 (або FKBP 12.6) визначають за процедурами, описаними у С. George, etal, Circulation Research, 93:531-540 (2003). HL-1 кардіоміоцити, що експресують серцеві ріанодинові 2 рецептори людини (hRyR2), культивують на желатиновій (0,02% [мас./об'єм]/фібронектин (10мг/мл) матриці та підтримують у Claycomb середовищі (JRH Biosciences), доповненому бичачою плідною сироваткою (10% [об'єм/об'єм], глутаміном (2мМ), норепінефрином (0,1мМ), пеніциліном (100од./мл), та стрептоміцином (100мкг/мл). FKBP12.6:hRyR2 взаємодію визначають, використовуючи дослідження співімунопреципітації, використовуючи рАb129 (aнти-RyR2) та анти-FKBP для імунопреципітації та імуноблотингу, відповідно. RyR2 імунолокалізують, використовуючи рАb129 та Аіеха488 коньюговані вторинні антитіла та FKBP співзабарвлюють, використовуючи N-19 (Santa Cruz Biotechnology) та Аіеха546 вторинні антитіла. D. Вестерн-блотинг Експресію та асоціацію між серцевим ріанодиновим рецептором (RyR) та FKBP 12 (або FKBP 12.6) визначають за процедурами, описаними у С. George, et al, Circulation Research, 93:531540(2003). Вестерн-блотинг мікросомальних фракцій, одержаних з HL-I кардіоміоцитів, культивованих як описано вище у "С. Дослідження спів-локалізації", може бути виконаний, використовуючи загальновідомі технології. Мікросомальні фракції (100 мкг) з HL-1 клітин приводять до утворення імунопреципітату, використовуючи aнти-RyR2 (рАb129), що супроводжується анти-FKBP імуноблотингом. Е. Електрофізіологічне визначення SR Са2+ витоку 94034 46 Витік Са2+ саркоплазматичного ретикулуму (SR) визначають за процедурами, описаними у Т. Shannon, et. al, Circ. Res., 93: 592-594 (2003). Вентрикулярні міоцити виділяють з новозеландських білих кроликів (Myrtle's Rabbitry, Inc., Thompson Station, Tenn., USA), у яких серцеву недостатність викликають за допомогою об'єднаних аортальної недостатності та стенозу. Діастолічний SR Са2+ вимірюють протягом клітинної стимуляції до стаціонарного стану при різних частотах для зміни навантаження. Рівні Са2+ витоку діастолічного ріанодинового рецептору (RyR) можуть бути оцінені за допомогою підвищеного загального Са2+ завантаження саркоплазматичного ретикулуму ([Са2+]SRT) при включенні тетракаїну (RyR блокер). Приклад 13 - Серцево-судинний ефект Здатність сполук даного винаходу лікувати або інгібувати серцево-судинну хворобу або хворобу периферичних судин підтверджується у стандартній фармакологічній тестовій процедурі, використовуючи ApoE knockout (EKO) мишей, яка являє собою популярну тваринну модель атеросклерозу людини. Використана процедура коротко підсумована нижче. ЕКО мишей чоловічої статі, 4-6 тижневого віку, поміщають у клітки розміром з коробки для взуття та дозволяють їм споживати їжу та воду за бажанням. Тварин рандомізують за масою у 5 груп (N=12-15 мишей на групу) та годують їжею Purina Rodent Chow впродовж першого тижня дослідження. Також протягом цього періоду, а також впродовж 12 тижнів дослідження, що залишилися, тваринам дають дозу кожні 2 дні 0, 1, 2, 4 або 8мг/кг рапаміцинового аналогу підшкірно (s.c), використовуючи 2% Tween-80, 1% карбоксиметил целюлозу як наповнювач та контроль. Дієту тварин змінюють на основану на казеїні Western Diet впродовж від 2 тижня до 13 тижня дослідження. Наприкінці періоду дослідження, тварин піддають евтаназії, одержують зразки плазми, та серця перфузують спочатку сольовим розчином, потім 10% формаліном. Загальний холестерин та тригліцериди визначають, використовуючи ферментативні способи з комерційно доступними наборами з Boehringer Mannheim та Wako Biochemicals, відповідно, та аналізатор Boehringer Mannheim Hitachii 911 (Boehringer Mannheim Diagnostic Laboratory Systems, Indianapolis, Ind.). Відділення та кількісне визначення ліпопротеїдів плазми проводять, використовуючи FPLC гранулометричну екстракцію. Коротко, 50-100 мл сироватки фільтрують та вводять у дві Superose 6 колонки (Amersham Pharmacia Biotech, UK, Ltd), з'єднані послідовно, та елююють при постійній швидкості потоку з 1мМ натрію EDTA та 0,15M NaCl. Площі кожної кривої, що представляють VLDL, LDL та HDL, інтегрують, використовуючи програмне забезпечення Millennium (Waters Technologies Corporation), та кожну фракцію ліпопротеїну кількісно визначають множенням загального значення холестерину на відносний відсоток площі кожного відповідного піку. Аорти обережно виділяють та залишають у формаліновому фіксаторі на 48-72 години перед обробкою. Атеросклеротичні ураження визначені забарвленням за допомогою ма 47 сляного червоного О, популярною процедурою для визначення акумулювання нейтральних ліпідів, таких як холестерини та тригліцериди. Судини знебарвлюють, та потім відображують, використовуючи Nikon SMU800 мікроскоп, оснащений системою Sony 3CCD відеокамери у поєднанні з EVIAQ Configuration Utility (National Instrument) як фіксуючим зображення програмним забезпеченням. Ураження кількісно оброблюють по дузі аорти, використовуючи звичайний пороговий обслуговуючий пакет програмного забезпечення, розроблений Робертом Колом (Coleman Technologies). Автоматизовану оцінку ураження проводять на судинах, використовуючи порогову функцію програми, в особливості на області, що міститься у дузі аорти від найближчого краю правої загальної сонної артерії до віддаленої лівої підключичної артерії. Дані аортичного атеросклерозу виражають як відсоток ураження (ліпід), залучений точно у цю визначену площу просвіту. Статистичну значимість між контролем та обробленими групами визначають, використовуючи Тест Данета при 1 % рівні значимості (р
ДивитисяДодаткова інформація
Назва патенту англійськоюRapamcyin analogues and the uses thereof in the treatment of neurologial proliferative and inflammatory disorders
Автори англійськоюGraziani Edmund Idris, Pong Kevin, Skotnicki Jerauld
Назва патенту російськоюАналоги рапамицина и их применение в лечении неврологических, пролиферативных и воспалительных расстройств
Автори російськоюГрациани Эдмунд Идрис, Понг Кевин, Скотницки Джераульд
МПК / Мітки
МПК: A61K 31/436, A61P 25/16, C07D 498/18, A61K 35/00
Мітки: запальних, застосування, розладів, аналоги, проліферативних, лікуванні, неврологічних, рапаміцину
Код посилання
<a href="https://ua.patents.su/27-94034-analogi-rapamicinu-ta-kh-zastosuvannya-u-likuvanni-nevrologichnikh-proliferativnikh-ta-zapalnikh-rozladiv.html" target="_blank" rel="follow" title="База патентів України">Аналоги рапаміцину та їх застосування у лікуванні неврологічних, проліферативних та запальних розладів</a>
Попередній патент: Застосування інгібітора фде3в
Наступний патент: Новий вірус рослин, позначений як томато торрадо вірус
Випадковий патент: Спосіб регулювання потоку металевого розплаву, а також донний випускний отвір для металургійної посудини