Мутеїн фактора viii та спосіб його одержання у клітинних лініях людини
Номер патенту: 76102
Опубліковано: 17.07.2006
Автори: Шрьодер Карола, Хьорстер Андреа, Ленерер Міхаель, Хаузер Шарлотте
Формула / Реферат
1. Мутеїн фактора VIII, в якому В-домен між положеннями Аrg740 і Glu1649 замінений Аrg-збагаченим лінкерним пептидом, що має щонайменше 3 Аrg залишки і містить від 10 до 25 амінокислотних залишків, в якому зазначений фактор VIII нумеровано відповідно до зрілої послідовності фактора VIII дикого типу, показаної в SEQ ID N0:2.
2. Мутеїн фактора VIII за п. 1, в якому мутеїн фактора VIII має
щонайменше одну з наступних допоміжних мутацій (а), (b), (с):
а) VаI в положенні 162 замінений нейтральним амінокислотним залишком, вибраним з GІу, АІа, Lеu, Ile, Меt і Рго;
b) Sег в положенні 2011 замінений гідрофільним амінокислотним залишком, вибраним з Аsn, Тhr і Gln; і
с) VаI в положенні 2223 замінений кислотним залишком амінокислоти, вибраним з Glu і Аsр.
3. Мутеїн фактора VIII за п. 2, який має щонайменше одну з мутацій (а) і (b).
4. Мутеїн фактора VIII за п. 2, який має всі три мутації (а), (b) і (с).
5. Мутеїн за одним з пп. 2-4, в якому в мутації (а) VаI в положенні 162 замінений АІа, в мутації (b) Sеr в положенні 2011 замінений Аsn і/або в мутації (с) VаI в положенні 2223 замінений Glu.
6. Мутеїн фактора VIII за одним з пп. 1-5, в якому Аrg-збагачений лінкерний пептид має від 14 до 20 амінокислотних залишків.
7. Мутеїн фактора VIII за одним з пп. 1-6, в якому лінкер містить:
амінокислотну послідовність SFSQNSRH і/або амінокислотну послідовність QAYRYRRG.
8. Мутеїн фактора VIII за п. 7, в якому лінкер має послідовність SFSQNSRHQAYRYRRG.
9. Мутеїн фактора VIII за п. 1, який містить амінокислоти від 1 до 1440 SEQ ID N0:4, 13 або 15.
10. Послідовність ДНК, що кодує мутеїн фактора VIII, як він визначений в одному з пп. 1-9.
11. Послідовність ДНК за п. 10, яка має щонайменше одну з мутацій Т485С, G6032А і Т6668А стосовно послідовності ДНК зрілого фактора VIII дикого типу, показаного в SEQ ID N0:1, переважно послідовність ДНК містить усі три зазначені мутації.
12. Вектор , що містить ДНК, як визначено в пп. 10 або 11.
13. Вектор за п. 12, який є вектором рТGF8-1, рТGT8-2-hyg-s або рТGF8-3, як показано в SEQ ID NO:3, 12 і 14 відповідно.
14. Вектор за п. 12, який являє собою транспортний вектор.
15. Транспортний вектор за п. 14, який призначений для виготовлення медичного препарату для лікування гемофілії, переважно гемофілії А.
16. Клітина-хазяїн, що трансформована вектором, як він визначений у п. 12, і/або містить послідовність ДНК, визначену у п. 10.
17. Спосіб одержання мутеїну фактора VIII, як визначено в одному з пп.1-9, який включає:
(а) культивування трансформованої клітини-хазяїна, як вона визначена в п.16; і
(b) виділення мутеїну фактора VIII з культуральної рідини.
18. Фармацевтична композиція, що містить мутеїн фактора VIII, визначений в одному з пп. 1-9, або транспортний вектор, як він визначений у п. 14.
19. Спосіб за п. 17, у якому стадія (а) включає культивування іморталізованої клітинної лінії людини, що стабільно експресує антиген Т вірусу Симіана та несе вектор, який має промотор СМV, функціонально зв'язаний з послідовністю ДНК, що кодує мутеїн фактора VIII.
20. Спосіб за п. 19, в якому іморталізована клітинна лінія людини є іморталізованою клітиною нирки, сечового міхура, печінки, легені, серцевого м'яза, гладкого м'яза, яєчника або клітиною шлунково-кишкового тракту.
21. Спосіб за п. 20, в якому іморталізована клітинна лінія людини є ембріональною клітиною нирки людини і, переважно, є клітинною лінією 293Т (DSM АСС2494).
22. Спосіб за одним з пп. 19-21, в якому вектор додатково містить маркер селекції і/або регуляторні послідовності.
23. Спосіб за одним з пп. 19-22, а якому культивування здійснюють за присутності фактора фон Віллібранда (vWF).
24. Спосіб за одним з пп. 17 та 19-23, який додатково включає:
c) очищення коагулюючого фактора крові, виділеного на стадії (b) і/або d), проведення вірусної інактивації коагулювального фактора крові, виділеного на стадії (b) або очищеного на стадії (с).
25. Іморталізована клітинна лінія людини, що стабільно експресує щонайменше один вірусний білок активатора транскрипції і несе вектор, який кодує мутеїн фактора VIII, як він визначений у будь-якому зі способів за пп. 19-21.
Текст
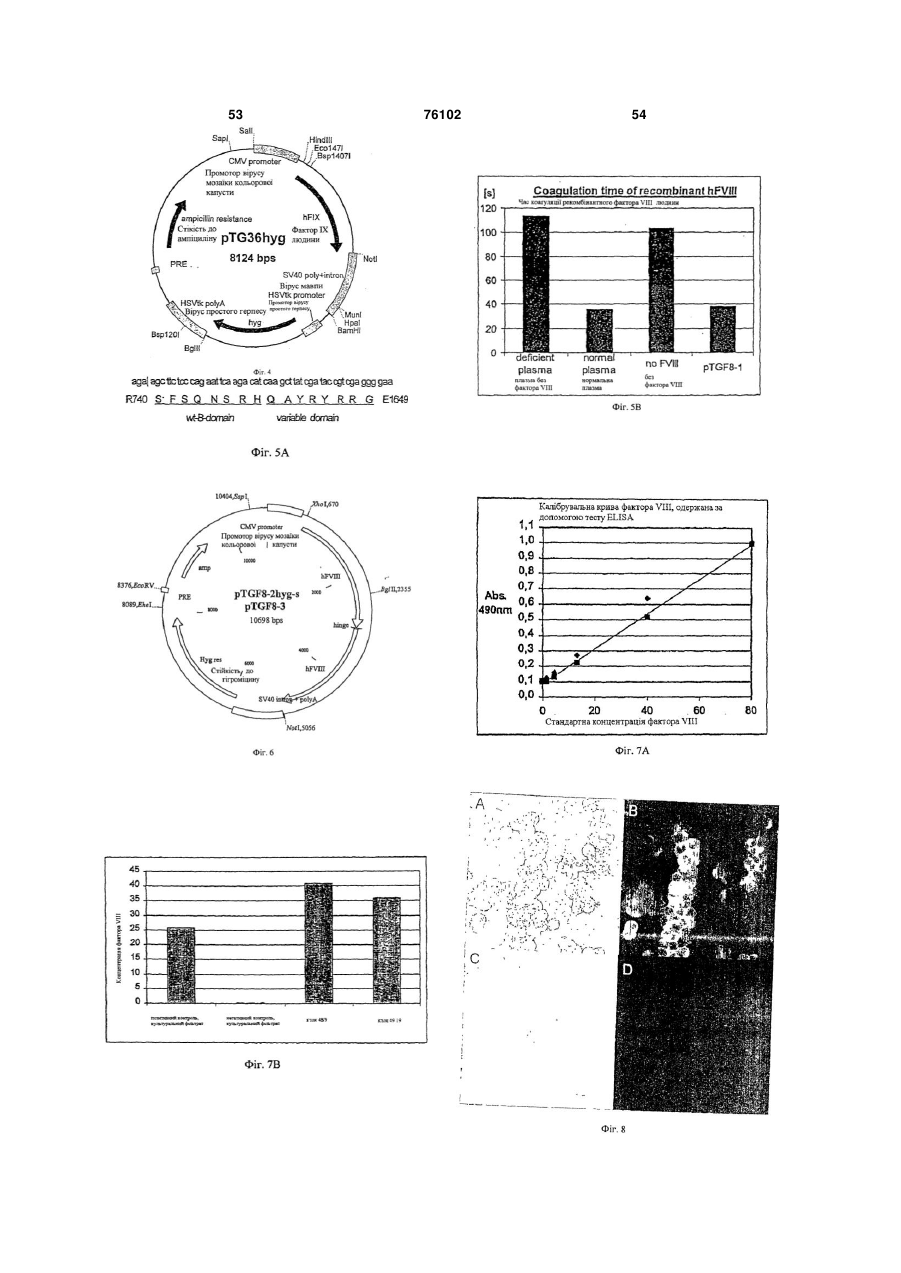
1. Мутеїн фактора VIII, в якому В-домен між положеннями Аrg740 і Glu1649 замінений Аrgзбагаченим лінкерним пептидом, що має щонайменше 3 Аrg залишки і містить від 10 до 25 амінокислотних залишків, в якому зазначений фактор VIII нумеровано відповідно до зрілої послідовності фактора VIII дикого типу, показаної в SEQ ID N0:2. 2. Мутеїн фактора VIII за п.1, в якому мутеїн фактора VIII має щонайменше одну з наступних допоміжних мутацій (а), (b), (с): 2 (19) 1 3 76102 4 13. Вектор за п.12, який є вектором рТGF8-1, 20. Спосіб за п.19, в якому іморталізована клітинна рТGT8-2-hyg-s або рТGF8-3, як показано в SEQ ID лінія людини є іморталізованою клітиною нирки, NO:3, 12 і 14 відповідно. сечового міхура, печінки, легені, серцевого м'яза, 14. Вектор за п.12, який являє собою транспортний гладкого м'яза, яєчника або клітиною шлункововектор. кишкового тракту. 15. Транспортний вектор за п.14, який призначений 21. Спосіб за п.20, в якому іморталізована клітинна для виготовлення медичного препарату для лікулінія людини є ембріональною клітиною нирки лювання гемофілії, переважно гемофілії А. дини і, переважно, є клітинною лінією 293Т (DSM 16. Клітина-хазяїн, що трансформована вектором, АСС2494). як він визначений у п.12, і/або містить послідов22. Спосіб за одним з пп.19-21, в якому вектор доність ДНК, визначену у п.10. датково містить маркер селекції і/або регуляторні 17. Спосіб одержання мутеїну фактора VIII, як випослідовності. значено в одному з пп.1-9, який включає: 23. Спосіб за одним з пп.19-22, а якому культиву(а) культивування трансформованої клітинивання здійснюють за присутності фактора фон Віхазяїна, як вона визначена в п.16; і ллібранда (vWF). (b) виділення мутеїну фактора VIII з культуральної 24. Спосіб за одним з пп.17 та 19-23, який додаткорідини. во включає: 18. Фармацевтична композиція, що містить мутеїн c) очищення коагулюючого фактора крові, виділефактора VIII, визначений в одному з пп.1-9, або ного на стадії (b) і/або d), проведення вірусної інактранспортний вектор, як він визначений у п.14. тивації коагулювального фактора крові, виділеного 19. Спосіб за п.17, у якому стадія (а) включає кульна стадії (b) або очищеного на стадії (с). тивування іморталізованої клітинної лінії людини, 25. Іморталізована клітинна лінія людини, що стабіщо стабільно експресує антиген Т вірусу Симіана льно експресує щонайменше один вірусний білок та несе вектор, який має промотор СМV, функціоактиватора транскрипції і несе вектор, який кодує нально зв'язаний з послідовністю ДНК, що кодує мутеїн фактора VIII, як він визначений у будь-якому зі мутеїн фактора VIII. способів за пп.19-21. Даний винахід стосується удосконаленого способу одержання рекомбінантних клонуючих факторів крові людини, зокрема фактора VIII і фактора IX, які використовують іморталізояану клітинну лінію людини, що стабільно експресує вірусні білки активатора транскрипції і несе вектор, який має промотор, функціонально зв'язаний з послідовністю ДНК, кодуючою коагулювальний фактор крові за умови, що зазначений промотор не є вірусним промотором, який стимулюється зазначеними вірусними білками активатора транскрипції; іморталізованої клітинної лінії людини, що несе зазначений вектор; змінених білків фактора VIII, які особливо придатні для вищезазначеного способу одержання; фармацевтичних композицій, що містять такі змінені білки фактора VIII, і використання таких змінених білків фактора VIII для виготовлення лікарського препарату для лікування гемофілії. Хворі на гемофілію страждають від кровотеч, викликаних порушеною функцією білкових компонентів каскаду коагулювання крові. В залежності від ураженого коагулювального фактора можна розрізняти два типи гемофілії. Спільним для обох типів є загальмована конверсія розчинного бриногена в нерозчинний фібрин-згусток. Вони являють собою рецесивні генетичні захворювання, до яких схильна в основному чоловіча частина населення. На гемофілію А хворіють 1-2 індивідууми на 10000 чоловіків. Вона викликана недостатністю або відсутністю фактора VIII, дуже великого глікопротеїну (відносна молекулярна маса приблизно 330kDa (кілодальтон) [Furie В., Furie B.C., Cell (1988) 53, 505-518)], який являє собою важливий елемент каскаду коагулювання крові. Поліпептидна послідовність може бути поділена на три ділянки, N-кінцеву ділянку, що складається з так званих А1 і А2-доменів. центральної ділянки В-домену і Скінцевої ділянки, складеної з A3, С1 і С2 доменів. У коагулюванні крові фактор VIII є неактивним попередником. Він міцно і нековалентно зв'язаний з фактором фон Віллібранда (vWF), який діє як стабілізуючий білок-носій. Протеолітичне розщеплення фактора VIII тромбіном у трьох певних положеннях (740, 372, 1689) призводить до його дисоціації з vWF і вивільняє функцію прокоагулянта усередині каскаду. У своїй активній формі фактор VIII діє як кофактор для фактора ІХа, у результаті чого на декілька порядків збільшується величина прискорення протеолітичної активності фактора X. Захворюваність на гемофілію В трапляється у одного з 25000 чоловіків. Вона характеризується дефіцитом фактора IX протеази серину (фактор Кристмаса). Цей поліпептид, утворений 415 амінокислотами, синтезується в печінці як глікопротеїн з відносною молекулярною масою 56kDa. Для того, щоб добитися властивої йому функції, потрібна стадія посттрансляційного карбоксилювання, яка відбувається тільки за присутності вітаміну К. Лікування обох типів порушення кровотечі традиційно включає інфузії концентратів білків фактора VIII або фактора IX, виділених із плазми людини. Хоча цей спосіб є ефективним терапевтичним методом лікування хворих на гемофілію, йому властивий ризик трансмісії різних інфекційних агентів, таких як віруси, що викликають гепатит чи СНІД, або тромбоемболічних факторів. Як альтернатива були описані декілька методів рекомбінантних ДНК для одержання коагулювальних факторів. З цією метою були виділені відповідні кДНК фактора VIII і фактора IX дикого типу та клоновані у придатні експресуючі вектори [ЕР-А160457; WO-A-86/01961, патенти США 4,770,999, 5 76102 6 5,521,070 і 5,521,070]. рів важливо оцінювати вплив глікозилювання з У випадку фактора VIII у даній галузі відома клітинних ліній нелюдського походження у порівекспресія рекомбінантних субодиниць для продунянні з клітинними лініями людини. Одним словом, кування комплексів, що показують згортальну акздається імовірним, що клітинні лінії людини більтивність [наприклад, ЕР-А-150735, ЕР-А-0500734, ше відповідають потребам одержання рекомбінанWO-91/07490, WO-95/13300, патенти США тних коагулювальних факторів, ніж клітинні лінії 5,045,455 і 5,789,203]. Більш того, була описана нелюдського походження. Причина цього припуекспресія укорочених кДНК-версій, у яких частково щення, можливо, полягає у тому, що сторонній або повністю відсутнє кодування послідовностей олігосахарид не впроваджується в олігосахаридну для глікозильованого у великій мірі В-домену [начастину під час синтезу рекомбінантних факторів. приклад, WO-86/06101, WO-87/04187, WOЗ іншого боку, були опубліковані основні спо87/07144, WO-88/00381, ЕР-А-251843, ЕР-Асоби високорівневої експресії білків необхідного 253455, ЕР-А-254076, патенти США 4,868,112 і гена, який містить іморталізовані стабільно транс4,980,456, ЕР-А-294910, ЕР-А-265778, ЕР-Афекційовані клітинні лінії молочної залози, що екс303540 і WO-91/09122]. Недавно був введений ряд пресують вірусні білки активатора транскрипції відібраних крапчастих мутацій для гальмування [наприклад, патент США 5,712,119]. Далі ці клітинпротеолітичної інактивації фактора VIII активовані лінії трансформуються векторною конструкцією, ним білком С або для зменшення імуногенності, у якій придатний вірусний промотор транскрипції яка призводить до утворення інгібіторних антитіл у оперативно зв'язаний з послідовністю ДНК, що пацієнтів, що проходять курс лікування [напривизначає ген, який становить інтерес, білки актиклад, патенти США 5,859,204, 5,422,260 і ватора транскрипції активують вірусний промотор 5,451,521, WO-97/49725 і WO-99/29848]. транскрипції і, отже, ініціюють експресію гена, який Рекомбінантні коагулювальні фактори звичайстановить інтерес. І знову викликав стурбованість но виділяли із середовища стабільно трансфекцітой факт, що білки активатора транскрипції, ексйованих еукаріотичних клітинних ліній і переважно пресовані цими клітинними лініями, можуть викликлітинних ліній молочної залози. Однак звичайною кати забруднення у білку, призначеному для терапрактикою у способах одержання зазначених факпевтичних цілей. торів, розкритих у посиланнях, що наводяться виВиходячи з вищевикладеного, як і раніше існуще, було застосування клітинних ліній нелюдськовала необхідність у створенні ефективного спосого походження для того, щоб виключити ризик бу для одержання коагулювальних факторів крові співочищення деяких інфекційних агентів, які молюдини. жуть знаходитися в клітинах людини та експресуНесподіваним чином було виявлено, що незаватися ними. бруднений коагулювальний фактор крові може Однак, особливо для фактора VIII, викорисбути отриманий за допомогою вищезгаданих імортання клітинних ліній нелюдського походження талізованих клітинних ліній людини. Зокрема, імомало певні недоліки. Наприклад, повідомлялося рталізовані клітинні лінії - якщо вони несуть векпро незадовільні рівні секреції експресованого тор, який має промотор, функціонально зв'язаний білка в середовище. Це може бути внаслідок нез послідовністю ДНК, що кодує коагулювальний значних відмінностей у межах різних типів клітин фактор крові, і незважаючи на той факт, що промолочної залози, що стосуються внутрішньоклімотор не є вірусним промотором, який стимулютинних шляхів для трансляції та модифікації білків, ється зазначеними вірусними білками активатора що також, можливо, чинить вплив на біологічну транскрипції, - здатні експресувати коагулювальактивність експресованого поліпептиду. Крім цьоний фактор крові. Разом з придатними методикаго, висловлювалася стурбованість, що використоми очищення білків та інактивації вірусу цей спосіб вувані для лікування білки, очищені від експресуявляє собою ефективну систему щодо одержання ючих систем нелюдського походження, забруднені безпечних і високоактивних рекомбінантних коагуклітинними компонентами, які можуть викликати лювальних факторів крові для терапевтичного антигенні реакції у пацієнтів. застосування при лікуванні людей. Більш того, Більш того, білки, експресовані експресуючибули виявлені певні змінені білки фактора VIII, які ми системами нелюдського походження, можуть винятково стабільні до протеолітичної інактивації і, мати картини глікозилювання нелюдського похотаким чином, можуть бути піддані способам інакдження, викликаючі антигенні реакції у пацієнтів. тивації сильного вірусу. Однак на біологічну стабільність і ефективність Відповідно до даного винаходу пропонується: коагулювальних факторів у значній мірі впливає (1) спосіб одержання рекомбінантного коагуїхній зразок N-глікозилювання. Особливо важливі лювального фактора крові людини, який включає периферійні та кінцеві моносахариди, тому що (a) культивування іморталізованої клітинної лівони захищені певними рецепторами з клітин, які нії людини, яка стабільно експресує щонайменше відповідальні за їх деградацію. Коагулювальні фаодин вірусний білок активатора транскрипції і несе ктори поводяться як кінцеві залишки моносахаривектор, що має промотор, функціонально зв'язадів сіалової кислоти. Модифікація у складі сіалоний з послідовністю ДНК, кодуючою коагулювальвих кислот в антені глікопротеїнів, наприклад, ний фактор крові людини за умови, що зазначений коагулювальних факторів, може призвести до гепромотор не є вірусним промотором, який стимутерогенних зразків глікозилювання. Таким чином, люється зазначеним щонайменше одним вірусним коли має місце модифікація, спостерігається біобілком активатора транскрипції, і логічна стабільність та ефективність. Отже, при (b) виділення коагулювального фактора крові з одержанні рекомбінантних коагулювальних фактокультуральної рідини; 7 76102 8 (2) більш прийнятний варіант способу, визнаФіг.3 - вектор pTGFG36, кільцева ДНК з чений у вищезазначеному пункті (1), у якому коа5753кп, точна послідовність ДНК вектора наведена гулювальний фактор крові людини є фактором VIII в SEQ ID NО:6 (основи 689-2071 в SEQ ID NО:6, або його зміненим білком; що кодує білок фактора IX). (3) більш прийнятний варіант способу, визнаФіг.4 - вектор pTG36hyg, кільцева ДНК з ченого у вищенаведеному пункті (2), у якому фак8124кп. тор VIII являє собою змінений білок, що має щоФіг.5А - більш прийнятна послідовність лінкеру найменше одну з наступних мутацій: згідно з даним винаходом (SEQ ID NО:9). (a) Val у положенні 162 замінений іншим нейтФіг.5В - час коагуляції рекомбінантного факторальним амінокислотним залишком, ра VIII людини, визначеного у прикладі 6. (b) Ser у положенні 2011 замінений іншим гідФіг.6 - звичайну молекулярну структуру рофільним амінокислотним залишком, pTGF8-2hyg-s і pTGF8-3, кільцеву ДНК з 10698кп, (c) Val у положенні 2223 замінений кислотним точну послідовності ДНК зазначених векторів наамінокислотним залишком і ведено в SEQ ID NО:12 і 14 (для білка фактора (d) В-домен між положеннями Arg740 і Glu1649 VIII, закодованого зазначеною послідовністю ДНК, замінений Arg-збагаченим лінкерним пептидом, що див. SEQ ID NО:13 і 15). містить від 10 до 25, переважно від 14 до 20, аміФіг.7А - калібровану криву фактора VIII, визнанокислотних залишків, у якому зазначений фактор чену за допомогою тесту ELISA, описаного у прикVIII розташований стосовно до зрілої послідовносладі 5. ті фактора VIII дикого типу, показаної в SEQ ID Фіг.7В - результати визначення концентрацій NО:2; рекомбінантного фактора VIII у різних культураль(4) більш прийнятний варіант способу, визнаних фільтратах, описаних у прикладі 5. ченого у вищенаведеному пункті (1), де коагулюФіг.8 - результати специфічного імунофлуоревальний фактор крові людини є фактором IX або сцентного аналізу фактора VIII, описаного у прикйого зміненим білком; ладі 9. Верхній ряд: клітини 293Т, стабільно трас(5) іморталізована клітинна лінія людини, що фектовані pTGF8, клон 49/19. Нижній ряд: несе вектор, кодуючий коагулювальний фактор негативний контроль: нетрансфектовані клітини крові людини, як він визначений у вищенаведених 293Т. А і С: біле світло, без фільтра; В і D: аналіз пунктах (1)-(4); фактора VIII за допомогою флуоресценції, фільтр (6) змінений білок фактора VIII, як він визначе550нм. ний у вищенаведеному пункті (3); Фіг.9 - вплив теплової обробки на активність (7) послідовність ДНК, що кодує змінений білок фактора IX у культурі фільтрату, описаній у прикфактора VIII, як він визначений у вищенаведеному ладі 10. пункті (6); Фіг.10 - залежність експресії рекомбінантного (8) вектор, що містить ДНК, як вона визначена фактора IX на додавання вітаміну К в культуральу вищенаведеному пункті (7); не середовище. (9) вектор, як він визначений у вищенаведеТермін «функціонально зв'язаний» стосується ному пункті (8), який є транспортним вектором; конфігурацій вектора, де промотор розташований (10) клітина-хазяїн, що трансформується векусередині вектора таким чином, що він може ститором, визначеним у вищенаведеному пункті (8), мулювати транскрипцію послідовності ДНК, що і/або містить послідовність ДНК, визначену у викодує коагулювальний фактор крові людини. Терщенаведеному пункті (7); мін «нефункціонально зв'язаний» стосується кон(11) фармацевтична композиція, що містить фігурації, де промотор розташований так далеко змінений білок фактора VIII, визначеного у вищевід послідовності експресованого гена коагулюванаведеному пункті (6), або транспортний вектор, льного фактора крові, що він не може стимулювавизначений у вищенаведеному пункті (9); ти її транскрипцію. (12) застосування зміненого білка фактора VIII, Термін «ген» стосується послідовності ДНК, визначеного у вищенаведеному пункті (6), або що кодує поліпептид, який необов'язково включає транспортного вектора, визначеного у вищенавелідерну і кінцеву послідовності та інтрони і екзони. деному пункті (9), для одержання медичного преТермін «вектор» стосується будь-якої генетичпарату для лікування гемофілії; і ної конструкції, такої як плазміда, фаг, косміда і (13) спосіб лікування гемофілії, який включає т.д., яка здатна до реплікації, коли вона зв'язана з введення людям, хворим на гемофілію, зміненого відповідними елементами керування. Цей термін білка фактора VIII, визначеного у вищенаведеному включає системи клонування та експресії. Термін пункті (6), або транспортного вектора, визначеного «нести вектор» стосується як стабільного, так і у вищенаведеному пункті (9). транзієнтного включення функціональних сегменДалі суть винаходу пояснюється більш доклатів ДНК в клітину-хазяїна. Однак стабільне вклюдно з посиланнями на креслення, на яких: чення є більш прийнятним. Фіг.1 представляє фрагменти, використовувані Термін «транспортний вектор», відповідно до для конструкції фактора VIII з делетованим Вданого винаходу, стосується вектора, що підходоменом (приклад 1). дить для генної терапії. Такий вектор містить фунФіг.2 - вектор pTGF8-l, кільцева ДНК з 8720 кціональні послідовності для необхідної мети, як комплементарними парами (кп), точна послідовце відомо у даній галузі. ність ДНК вектора наведена в SEQ ID NО:3 (для Термін «зрілий» стосується молекулярної білка фактора VIII, кодованого зазначеною посліструктури даного білка безпосередньо після його довністю ДНК, див. SEQ ID NО:4). клітинної секреції (наприклад, відсутність його N 9 76102 10 кінцевого сигнального поліпептиду). зазначений промотор). Термін «промотор» стосується галузі регуляЗгідно з винаходом, вектор може нести додатторних послідовностей ДНК для контролю трансккові вірусні промотори, які стимулюються зазначерипції гена, до якого прив'язані полімерази РНК. ними вірусними білками активатора транскрипції, Термін «терапевтично ефективна доза» фарале які функціонально не зв'язані з коагулювальмацевтичної композиції, згідно з винаходом, стоним фактором крові. Такі вірусні промотори обисується дози, ефективної для лікування або прорають з промоторів, одержаних з аденовірусів, філактики, наприклад, доза, що забезпечує вірусу саркоми Рауса і цитомегаловірусу. Вектор ефективне лікування чи зменшення симптомів може містити ще одну або більше функціональних гемофілії. Визначення терапевтично ефективної послідовностей: маркери селекції, регуляторні дози знаходиться в компетенції фахівців у даній послідовності (наприклад, PRE) і т.д. галузі. Коагулювальний фактор крові людини, відпоТермін «кодує» або «кодуючий» стосується відно до варіанта (1) виконання винаходу, вклювластивості послідовності нуклеїнових кислот трачає, але не обмежується цим, фактор IX, фактор нскрибуватися (у випадку ДНК) або транслюватися VIII, фактор VII, фактор V, фактор фон Віллібранда (у випадку мРНК) в поліпептид in vitro або in vivo, (vWF) тощо. коли вона перебуває під контролем відповідної У більш прийнятному варіанті (2) виконання регуляторної послідовності. винаходу вектор містить послідовність ДНК, що У контексті поданої заявки терміни «експресукодує фактор VIII або його змінений білок. У той вати», «експресуючий» або «експресія» стосуютьчас як рекомбінантний фактор IX загалом структуся транскрипції або трансляції гена, що кодує бірно ідентичний білку дикого типу, виділеному із лок. плазми крові, для рекомбінантної експресії були Даний винахід, як він характеризується у висконструйовані декілька модифікованих конструкщенаведених пунктах (1) - (13), більш детально цій експресії фактора VIII. описаний нижче. Згідно з варіантом (1) виконання Враховуючи структуру домену функціональновинаходу, описаного у даній заявці, промотор, фуго поліпептиду фактора VIII, важливі сайти взаєнкціонально зв'язаний з послідовністю ДНК, що модії з vWF розташовані в А3-домені (амінокислокодує коагулювальний фактор крові людини, не є ти з 1680 по 1689) і в С2-домені (Kaufman & Pipe, вірусним промотором, який стимулюється щонайHaemophilia (1998) 4, 370-379). Для виділення фаменше одним вірусним білком активатора транскктора VIII з vWF і для того, щоб дозволити фактору рипції, експресованим іморталізованою клітинною VIII взаємодіяти із зарядженими фосфоліпідами, лінією людини. було запропоновано розщеплення після позиції Іморталізована клітинна лінія людини перева1689. Було показано, що конструкції рекомбінантжно є іморталізованою клітиною нирки, сечового ного фактора VIII, у яких відсутній vWF-сайт зв'яміхура, печінки, легенів, серцевого м'яза, гладкого зування, у значній мірі схильні до протеолітичного м'яза, яєчника або клітиною шлунково-кишкового розщеплення при введенні в організм мишей, у тракту. Більш прийнятно, щоб іморталізована кліяких спостерігається нестача фактора VIII. Рекомтинна лінія людини була клітиною нирок людського бінантна експресія укорочених конструкцій фактоембріона, і найбільш прийнятно, щоб це була кліра VIII у культурах клітини молочної залози покатинна лінія 293Т (ЕСАСС: tsa201, ref. 96121229; зала, що повна делеція В-домену не змінила DSM ACC2494). біологічну активність відповідного білка, подібного Щонайменше один білок активатора транскридо фактора VIII (Eaton et al., Biochemistry (1986) 25, пції, експресований іморталізованою клітинною 8343-8347). Крім того, рівні експресії, що спостерілінією, включає антиген Τ вірусу Симіана, білки гаються, конструкцій з вилученим В-доменом були Е1А або Ε1В аденовірусу, білок, кодований ранзначно вище у порівнянні з фактором VIII дикого ньою ділянкою послідовності ДНК вірусу папіломи типу через підвищений рівень мРНК у клітинах теляти, і білки IE вірусу герпесу. Переважно імор(Pittman et al., Blood (1993) 81,2925-2935). Нині на талізована клітина експресує щонайменше два ринку є чотири продукти рекомбінантного фактора вірусних білки активатора транскрипції, наприклад, VIII (Recombinate Baxter HealthCare; Kogenate і термочутливий антиген Τ вірусу 40 мавпи (SV40) і Kogenate FS Bayer Corporation і Refacto Wyeth, білок E1A аденовірусу (такий, як вищезгадана кліІнститут Генетики). тинна лінія 293 Т). У більш прийнятному варіанті (3) виконання Промотор, функціонально зв'язаний з послідовинаходу змінений білок фактора VIII має щонайвністю ДНК, що кодує коагулювальний фактор менше одну з наступних мутацій від (а) до (d): крові людини, переважно включає: (a) Val у положенні 162 замінений на інший (і) вірусні промотори, що не стимулюються бінейтральний амінокислотний залишок; лком активатора, експресованим іморталізованою (b) Ser у положенні 2011 замінений іншим гідклітиною, як це визначено вище (такою як SV40 і рофільним амінокислотним залишком; CMV (вірус мозаїки кольорової капусти)); (c) Val у положенні 2223 замінений кислотним (іі) промотори генів домашнього господарства амінокислотним залишком; і (альбумін); і (d) В-домен між позиціями Arg740 і Glu149 замінений Arg-збагаченим лінкерним пептидом, що (ііі) тканинні специфічні промотори (такі як містить від 10 до 25, переважно 14-20, амінокислоантитрипсин для печінки). Найбільш прийнятним тних залишків, де зазначений фактор VIII розтапромотором, згідно з винаходом, є CMV промотор шований стосовно до амінокислотної послідовнос(тоді як білок активатора транскрипції, експресоті фактора VIII дикого типу, показаного в SEQ ID ваний іморталізованою клітиною, не стимулює 11 76102 12 NО:2 (будучи амінокислотною послідовністю зрілочи аналог, штучні пептиди (наприклад, оліго-Hisго пептиду, що не включає сигнальний пептид з 19 tags для високоафінного очищення) тощо. амінокислотами, а включає увесь В-домен [WO Найбільш прийнятним вектором для експресії 99/29848]). фактора VIII є вектор pTGF8-1, показаний на Фіг.2. Термін «інший нейтральний амінокислотний Послідовність ДНК зазначеного вектора показана залишок», згідно з даним винаходом, містить у в SEQ ID NO:3, вона охоплює всі п'ять мутацій, на собі Glu, Ala, Leu, He, Met і Pro і, переважно, Ala. які посилалися у даному описі вище (змінені білки Термін «інша гідрофільна амінокислота» включає Т485С, G6032A, Т6668А і Т6816С (тут: Т1217С, Asn, Thr і Gin і, переважно, Asn. Кислотний аміноG4088A, Т4724А і Т4872С), і послідовність ДНК, кислотний осад обирають з Glu і Asp і, переважно, що кодує лінкер В-домену послідовності SEQ ID він є Glu. NO:9) та кодує змінений білок фактора VIII, покаСеред змінених білків фактора VIII варіанта (3) заний у SEQ ID NO:4. виконання винаходу більш прийнятно, щоб змінеКрім того, більш прийнятними векторами є таний білок фактора VIII мав щонайменше одну з кож вектори pTGF8-2hyg-s і pTGF-3, звичайна момутацій (а), (b) і (с), більш переважно, щонайменлекулярна структура яких показана на Фіг.6. ше одну з мутацій (а) і (b), і найбільш прийнятно, Вектор pTGF8-2hys-s, показаний у послідовновсі три мутації від (а) до (с), як визначено вище. сті SEQ ID NO:12, містить тільки мутацію Т6816С, Особливо прийнятно, щоб змінений білок містив що мовчить, що призводить до зміненого білка усі три мутації V162A, S2011N і V2223E. фактора VIII, у якому В-домен замінений послідовЗа тією ж ознакою послідовність ДНК, що місністю SEQ ID NO:9 лінкєрного пептиду, але більше тить вектор згідно з варіантом (4) виконання винанемає ніяких змін у первісній структурі білка, що ходу, має мутації Т485С, G6032A і Т6668А стосовналежить до послідовності дикого типу SEQ ID но до послідовності ДНК зрілого фактора VIII NO:2. дикого типу, показаної в SEQ ID NO:1. У більш Вектор pTGF8-3, показаний у SEQ ID NO:14, прийнятному варіанті виконання винаходу послімістить мутації Т485С, Т6668А і Т6816С, що дає довність ДНК також містить мутацію, що мовчить, змінений білок фактора VIII, який показує амінокиТ6816С (і знову зазначене місце знаходиться у слотні заміни VI62А і V2223E, що стосуються поспослідовності ДНК зрілого фактора VIII дикого тилідовності SEQ ID NO:2, на додаток до заміни Впу). домену, про яку згадувалося вище. Серед змінених білків фактора VIII, згідно з У випадку одержання фактора VIII культивуваріантом (3), більш прийнятно, щоб змінений бівання здійснюють за присутності фактора фон лок фактора VIII мав мутацію (d), визначену вище. Віллібранда. Фактор фон Віллібранда переважно Більш прийнятна система експресії, згідно з використовують у кількості від 10 до 100, більш винаходом, використовує специфічний змінений переважно 50-60молів vWF на моль фактора VIII білок фактора VIII, у якого - крім крапчастої мутації (в культуральній рідині і/або в розчині фактора VIII (а)-(с), як визначено у даному описі вище, - частпід час процесу очищення (див. нижче). ково або повністю відсутній його В-домен, переваУ більш прийнятному варіанті (4) виконання жно змінений білок, у якому IB-домен між полоданого винаходу коагулювальний фактор крові женнями R740 і Ε1649 замінений типовим Argлюдини є фактором IX або його зміненим білком, збагаченим амінокислотним спейсером, як це випереважно є фактором IX дикого типу, показаним у значено в (d) вище. Термін «Arg-збагачений», відпослідовності SEQ ID NO:5. Придатні змінені білки повідно до даного винаходу, означає, що зазначефактора IX включають крапчасті мутовані та уконий спейсер містить щонайменше 3, переважно рочені форми фактора IX. Найбільш прийнятними щонайменше 4, Arg залишки. У більш прийнятному векторами експресії фактора IX є вектори варіанті виконання винаходу зазначений спейсер pTGFG36 і pTG36hyg, показані на Фіг.3 і 4, відповіскладається з восьми амінокислот В-домену дикодно. го типу, за якими йдуть вісім амінокислот перемінУ випадку одержання фактора IX культивуванного домену (див. Фіг.5А, SEQ ID NO:9). У такій ня переважно виконують за присутності вітаміну К, конструкції, що має модифікації В-домену, згадані який може знаходитися у кількості від 0,1 до у даному описі вище, запропонований vWF-сайт 100 г/мл культуральної рідини, більш переважно зв'язування залишається без зміни для запобіганвід 1 до 20 г/мл культуральної рідини. ня негайному протеолітичному розкладу секретоСпосіб, відповідно до варіанта (1) виконання ваного фактора VIII в культуральному середовищі винаходу, включає наступні операції: клітини або більш пізньому - в крові пацієнтів, що (c) очищення коагулювального фактора крові, пройшли курс лікування. Тільки після спеціальної виділеного на стадії (b), і/або активації розщепленням тромбіном фактор VIII (d) вірусну інактивацію коагулювального факвиділяється з vWF. КДНК для більш прийнятного тора крові, виділеного на стадії (b) або очищеного фактора VIII була сконструйована шляхом склана стадії (с). дання чотирьох фрагментів ДНК, наприклад, так, Придатні операції з очищення включають спояк це описано у прикладі 1. соби, які відомі у даній галузі для максимізації виБілок, відповідно до варіанта (3) виконання ходу чистого, стабільного і високоактивного продувинаходу, може містити додаткові N- або С-кінцеві кту, і їх обирають із способів імуноафінної послідовності, включаючи, але не обмежуючись хроматографії, аніонообмінної хроматографії, цим, природний сигнальний пептид (що відповідає хроматографії за розміром і т.д. та їх комбінацій. амінокислотним залишкам білків від -19 до -1, поЗокрема, детальні способи очищення коагулюваказаним у SEQ ID NO 4,13 і 15) або його фрагмент льних факторів із плазми крові людини розкриті, 13 76102 14 [наприклад, у заявках WO93/15105, ЕР0813597, 200,000 IU. Відповідну дозу звичайно вводять один WO96/40883 і WO96/15140/50. Їх можна легко приабо два рази на тиждень. стосувати до специфічних вимог, необхідних для Фармацевтичні композиції, медикаменти або виділення рекомбінантних факторів VIII і IX. Для препарати, застосовувані у способах лікування фактора IX був введений ефективний спосіб, що гемофілії, відповідно до варіантів (11)-(13), містять включає стадію осадження за допомогою сульфатерапевтично ефективну дозу зміненого білка фату амонію, за якою далі йде DEAE (діетиламіноектора VIII згідно з варіантом (6) або транспортного тил) і НІС хроматографія, а також гепаринафінна вектора згідно з варіантом (9). У першому випадку хроматографія (US5919909). Кількість та активу цій дозі можуть, крім того, міститися фармацевність очищеного білка під час і після операції очитично допустимі добавки, що включають сироватщення можуть регулюватися за допомогою тесту ковий альбумін людини (HAS; переважно 1мг/мл ELISA і коагуляційних проб. розчину); неорганічні солі, наприклад, СаСl2 (переДля вирішення проблем можливого інфекційважно 2-5mМ (міліграм-молекул)), амінокислоти, ного зараження зразків очищеного білка або протакі як гліцин, лізин і гістидин (переважно від 0,1 дукту, безпосередньо одержаного з надосадової до 1Μ на амінокислоту); дисахариди, такі як сахарідини клітинної культури, що містить секретовароза і/або трегалоза (переважно 0,4-1М); органічні ний рекомбінантний білок, зразки і/або надосадову солі, такі як Na-цитрат (переважно до 50mМ); і т.д. рідину клітинної культури можна обробляти метоПрепарати можуть бути водні або безводні. В дами вірусної інактивації, включаючи теплову обостанньому випадку основним компонентом с гліробку (у сухому або рідкому стані, з або без додацерин і/або поліетиленгліколь (наприклад, PEGвання хімічних речовин, що включають інгібітори 300). Препарати можуть бути у сухому вигляді (ропротеази). Після вірусної інактивації може бути зчинні у придатному розчиннику до їх використаннеобхідною подальша операція з очищення для ня). видалення хімічних речовин. Зокрема, для фактоЯк наведено вище, транспортний вектор, згідра VIII, виділеного з плазми крові, була описана но з варіантом (9) виконання винаходу, може тарегенерація високочистого, підданого вірусній інкож бути частиною фармацевтичних композицій, активації, білка методом аніонобмінної хроматогможе використовуватися для приготування медирафії [WO93/15105]. Крім того, було описано декікаментів для лікування гемофілії і його можна залька способів для одержання високочистих, стосовувати у способах для лікування гемофілії неінфекційних коагулювальних факторів з плазми (варіанти (11)-(13) виконання винаходу). Зазначені або крові інших біологічних джерел. Віруси з ліпідфармацевтичні композиції і медикаменти можуть, ною оболонкою ефективно інактивують шляхом крім того, містити придатні формули матриці, наобробки потенційно інфекційного матеріалу гідроприклад, ліпіди або гормони, як це зазначалося [у фобною фазою, що формує двофазову систему, з заявці WO00/49147], у даному описі цей винахід якої згодом видаляють водонерозчинну частину. наведений у вигляді посилання. Фармацевтична Крім того, вигідним виявилося одночасно або поскомпозиція або медикамент, що містить транспорлідовно доповнювати зазначену обробку гідрофотний вектор, згідно з даним винаходом, можуть бною фазою обробкою неіонними детергентами бути введені орально, внутрішньовенно, внутрішабо триалкілфосфатами. [WO 9636369, ньом'язово, підшкірно, через слизову оболонку ЕР0131740, п.США 6,007,979]. Віруси без ліпідної (включаючи трансбукальне, назальне розпилення) оболонки потребують застосування способів інакабо за допомогою розпилювача гена. Перевагу тивації, що полягають в обробці неіонними детернадають оральному введенню (наприклад, в кологентами, за якою йде стадія нагрівання (60-65°С) їдному розчині дуже тонко подрібненого гормону). протягом декількох годин [WO94/17834]. Змінений білок фактора VIII, згідно з варіантом Виходячи з вищенаведених результатів, вва(6) виконання винаходу, є таким, як він визначений жають, що комбінація ефективної системи експрез посиланням на вищенаведений варіант (3). Крім сії білка, заснована на клітинній лінії людини, ратого, зазначений змінений білок фактора VIII може зом з визнаними способами інактивації потенційно бути приготовлений за допомогою стандартних небезпечних інфекційних агентів служить безпечрекомбінантних способів, наприклад, способом, ною і легкою у використанні системою для одерщо включає: жання рекомбінантних коагулювальних факторів. (a) культивування клїтини-хазяїна, що трансБільш того, відповідно до варіанта (6) викоформована вектором згідно з варіантом (8) винанання винаходу, забезпечується переважаючий за ходу і/або містить ДНК згідно з варіантом (7), (яка своїми властивостями змінений білок фактора VIII. також включає іморталізовану клітинну лінію люЗазначений змінений білок фактора VIII може бути дини, що стабільно експресує щонайменше один частиною фармацевтичних композицій, може бути вірусний білок активатора транскрипції і несе веквикористаний для приготування медичних препатор, який має вірусний промотор транскрипції, фуратів для лікування гемофілії і може застосовуванкціонально зв'язаний з послідовністю ДНК, що тися у методах лікування хворих на гемофілію кодує коагулювальний фактор крові людини, у якій (варіанти (11)-(13) даного винаходу). Вищезгадані зазначений вірусний промотор стимулюється щофармацевтичні композиції і вищезгадані медичні найменше одним вірусним білком активатора трапрепарати можуть містити фактор VIII в терапевнскрипції); і (b) виділення коагулювального фактора крові з тично ефективній дозі, наприклад, від 50 до 500 г культуральної рідини. Усі придатні іморталізовані (фактор VIII вагою 200нг відповідає одній міжнароклітинні лінії людини, білки активатора транскрипдній одиниці (IU)). В залежності від типу гемофілії ції і вірусні промотори згадані вище у даному опипацієнт одержує річну дозу фактора VIII до 15 76102 16 сі. Іморталізована клітинна лінія людини, викорискторі phGFP-S65T (Clontech), зазначений вектор товувана у зазначеному способі, переважно ексбув розкладений за допомогою Xbal, оброблений пресує два вірусних білки активатора транскрипції, ферментом Кленова і повторно лігований, що прибільш переважно термочутливий антиген Τ SV40 і звело до одержання вектора pGFP/0. Фрагмент білок Е1А аденовірусу. Крім того, спосіб може 2,3kb, що містить GFP-ген, був виділений після включати операції з очищення та вірусної активації розкладу вектора pGFP/0 за допомогою Mlu1, об(с) і (d), згадані вище у даному описі. робляючи його ферментом Кленова і розщеплююНаявна у продажі клітинна лінія 293 Τ (ЕСАСС: чи його за допомогою ВатНІ. Цей фрагмент був tsa201, посилання 96121229) здана на зберігання у вставлений у множинний клонуючий сайт вектора фірму DMSZ (Deutsche Sammlung von pUC19/X, який був розщеплений за допомогою Mikroorganismen und Zellkulturen GmbH, Sall, оброблений ферментом Кленова і розщеплеMascheroder Weg lb, 38124, Брауншвейг, Німеччиний за допомогою ВатНІ. Отриманий вектор одерна) 20 лютого 2001, номер зберігання DSM жав позначення pTGFGl. АСС2494). Олігонуклеотиди (Metabion) PRE-S (5'-GGG Винахід ілюструється наступними прикладами: GTA CCA GCT TCG TAG СТА GAA CAT GTT CTG Приклад 1. Клонування фактора VIII GGA TAT CAG CTT CGT AGC TAG AAC АТС ATG Послідовність для рекомбінантного фактора TTC TGG TAC CCC-3'; SEQ ID N0:10) і VIII була одержана зворотною транскрипцією із PRE-AS (5'-GGG GTA CCA GAA CAT GAT GTT пула РНК з печінкових клітин людини. Потім чотиСТА GCT ACG AAG CTG ATA TCC CAG AAC ATG ри фрагменти (1/2, 3/4, 5/6, 7/8) були ампліфіковаATG TTC TAG СТА CGA AGC TGG TAC CCC-3'; ні за допомогою стандартного ПЦР, використовуSEQ ID NO:11) були гібридизовані і фосфорильоючи праймери, призначені для зберігання сайтів вані за допомогою реакції кінази, утворюючи встарестрикції. Для складання разом фрагментів 3/4 і вку PRE(ds). 5/6 фрагмент Smal/Sall з плазміди pBSFVIII3/4 був Вектор pTGFG1 був розкладений за допомовставлений наосліп в Sall-сайт плазміди гою Есо01091, оброблений ферментом Кленова і pBSFVII5/6 для одержання плазміди pBSFVIII3/6. дефосфорильований лужною фосфотазою. Потім Потім був одержаний фрагмент 3/6 шляхом розквін був лігований з вставкою PRE(ds), утворюючи ладу плазміди pBSFVIII3/6 за допомогою фрагменпри цьому вектор pTGFG5. та Xhol/BspHI і частково за допомогою фрагмента Вектор pUC19 (МВІ Fermentas) був розкладеAlw441. Цей фрагмент і фрагмент Pstl/Alw441 з ний за допомогою Sall, оброблений ферментом плазміди pBSFVIII1/2 були ліговані в один етап у Кленова і дефосфорильований лужною фосфатавектор плазміди pBSFVIII1/2, обробленої Pstl і зою. Він був лігований з Notl-лінкером Xhol, за допомогою чого була одержана плазміда GCGGCCGC (Biolabs #1045), утворюючи при цьоpBSFVIII1/6. Фрагмент 7/8 був одержаний шляхом му pUC19/N. розкладу плазміди pBSFVIII7/8 за допомогою фраКДНК фактора IX була ампліфікована з кДНК гмента Smal і частково за допомогою Mva12691 і печінки людини (Clontech), використовуючи два лігований у плазміду pBSFVIII1/6, розрізану за допраймера, що перекривають початковий і кінцевий помогою фрагментів Xhol і Mval2691, створюючи кодон відкритої рамки зчитування фактора IX, при цьому плазміду pBSFVIH1/8.1, зрештою, фраутворюючи при цьому фрагмент з 1387 кп, який гмент Smal/Xhol з плазміди pBSFVIII1/8 був вставмістить усю відкриту рамку зчитування. Сайти реслений у сайт Sall октагенного вектора pTGF67 трикції для EcoRI (верхній) і ВатНІ (нижній) були (одержання зазначеного вектора розкрите в включені наприкінці кожного праймера для полегРСТ/ЕР00/01368), що призвело до одержання еушення клонування. Ампліфікацію виконували з каріотичного вектора експресії для плазміди використанням Pwo ДНК-полімерази (Boehringer pTGF8-1 фактора VIII людини (див. Фіг.1 і 2). Mannheim) в обсязі, дорівнюючому 50 л [10mM Отриманий вектор кодує змінений білок фактора Tris HCl рН8.85, 25mМ KСl, 5mМ (NH4)2 SO4,2 VIII, що має мутації V162A, S2011N і V2223E. MgSCU4] протягом 30 інкубаційних циклів при 96°С Приклад 2. Клонування фактора IX (FIX) протягом 1хв., 60°С протягом 1хв., 72°С протягом Вектор pUC19 (МВІ Fermentas) був розкладедвох хвилин, за якими йшла фінальна стадія при ний за допомогою Xbal, оброблений ферментом 72°С протягом 10 хвилин. Кленова і повторно лігований. Потім зазначений Продукти реакції були ліговані в EcoRI- і виділений вектор Xbal був розкладений за допомоBamHI-сайти вектора pUC19 і трансформовані в гою EcoRI, оброблений ферментом Кленова і поЕ.соlі DH5- . Були обрані позитивні клони. Послівторно лігований для того, щоб виділити сайт довності були підтверджені циклічним секвенуванEcoRI. Для інсерції сайта Xbal у сайт Sacl цього ням (за Амершамом) з обох кінців з міченими вектора він був розкладений за допомогою Sacl, праймерами (IR-700) і проведенням автоматичнооброблений Т4-ДНК-полімеразою, дефосфориго аналізу на системі секвенуванняя LiCor (MWG, льований лужною фосфатазою і лігований з XbalBiotech.). лінкером CTCTAGAG (Biolabs #1032). Інший сайт Були використані наступні праймери: Xbal був вставлений шляхом розкладу удруге одеGGAATTCCGCAAAGGTTATGCAGCGCGTGAA ржаного вектора за допомогою Hindlll, піддаючи CATGATCATGGC (верхній; SEQ ID NO:16) його обробці ферментом Кленова, дефосфориCGCGGATCCATTAAGTGAGCTTTGTTTTTTCCTTA люючи його лужною фосфатазою і лігуючи його з ATCC (нижній; SEQ ID NO:17). Xbal-лінкером CTCTAGAG (Biolabs #1032). Цей Фрагмент 1.4 т.п.н., що містить відкриту зчитувектор отримав позначення pUC19/X. вальну рамку коагулювального фактора IX людиДля руйнування Xbal-сайта, що присутній у вени, виділений з бібліотеки кДНК людини, був вста 17 76102 18 влений у Pstl-сайт вектора pUC19/N, одержаного IX і VIII за допомогою тесту ELISA вищеописаним способом, який був розкладений за Фактор IX: Рівні рекомбінантного фактора IX допомогою Pstl, оброблений Т4-полімеразою і делюдини в надосадовій рідині трансфектованих фосфорильований лужною фосфатазою. З одерклітин 293Т визначали за допомогою тесту ELISA, жаного вектора pUC19/N-FIX шляхом подвійного використовуючи як іммобілізоване антитіло полікрозкладу за допомогою HindIII і Notl був вирізаний лональний антилюдський фактор IX козла (Enzyme фрагмент 1.4 т.п.н., що містить відкриту зчитуваResearch Laboratories).Bci інкубації здійснювали льну рамку коагулювального фактора IX людини. протягом двох годин у вологій камері при 22°С. Зазначений фрагмент був лігований з фрагментом Чашки (Dynex, Immulon-4) покривали 100 л покри4.3 т.п.н. вектора pTGFG5, одержаного подвійним вного буфера концентрацією 8.8 г антитіла/мл розкладом за допомогою HindIII і Notl з утворенням покривного буфера. При описаних умовах захист при цьому вектора pTGFG36, показаного на Фіг.3. не потрібний. Для блокування неспецифічних взаЦей вектор с більш прийнятним вектором для досємодій досить здійснювати чотириразове промитавки в клітину експресуючої касети, що кодує фавання чашки (Encore 2000, Merck) за допомогою ктор IX, її послідовність ДНК подана в SEQ ID PBS(фізіологічний розчин з фосфатним буфеNO:6. ром)-Tween (0,1% в об'ємному відношенні). Приклад 3. Клітинна лінія людини для експреПісля кожної наступної операції було потрібне сії білків промивання для виключення незв'язаних білків. У Більш прийнятною клітинною лінією є лінія кожну комірку додавали 100 л надосадової рідиtsA201 (ECACC, посилання 96121229), яка являє ни, обробленої 10 л 10mМ сульфонідфториду, і собою трансформовану клітинну лінію нирок лю10 л 0.11Μ цитрату натрію. Розведення для зраздини (293, ЕСАСС, номер 85120602), стабільно ків і стандарту (фактор IX людини, домашній станекспресуючу термочутливий антиген Τ SV40 (J. дарт, Octapharma) були зроблені у буфері розвеMembrane Biol., 1996; 152:39; Gene 1995; 156:235; дення (HBS-BSA-EDTA-Tween) та інкубовані при PNAS USA 1994; 91:12785; Pflugers Arch. 1994; концентрації 100 л/комірка. Детектуючим антиті427:136; J. Gen. Physiol., 1994; 104:507; лом був поліклональний антифактор IX козла, міBiotechniques, 1993; 15:906). Інші назви для цієї чений пероксидазою (Enzyme Research клітинної лінії включають 293tsA1609neo (Моl. Cell. Laboratories), у концентрації 1 г антитіла/мл буфеBiol., 1987, 7:379) і 293Т. Ця клітинна лінія, схожа з рного розчину, і інкубований в комірку 100 л. У епітеліальною, була використана у цілому ряді кожну комірку як субстрат додавали 150 л ABTS функціональних експресийних проб і, як повідом(Roche), через 1-2 години визначали колориметлялося, давала високі рівні рекомбінантних білків. ричну реакцію на хвилі 405nm. Результати, розраВони можуть бути культивовані в DMEM, доповнеховані за лінійною регресією стандартної концентної глутаміном (2mМ) і 10% навколоплідної сирорації проти стандартного поглинання, зведені у ватки теляти (FCS). Для ефективного одержання наступній таблиці: фактора IX середовище можна модифікувати шляхом додавання до 100 г/мл вітаміну K (US4770999). Для спрощення процесу очищення експресованого поліпептиду клітини можна культивувати у вільному від сироватки або білка середовищі, яке містить придатні добавки. З причин стабільності секретований фактор VIII потребує присутності vWF в середовищі [п.США 5198349]. Повідомлялося також про додавання ліпопротеїнів, фосфоліпідів, полігліколів, металів, гепарину, неіонних поверхнево-активних речовин або циклодекстрину [ЕР0254076, US5250421, US5576194, ЕР0872487, WO94/11525, US5378612]. Приклад 4. Трансфекція фосфатом кальцію клітин 293Т для транзієнтного продукування факторів VIII і IX Конфлюентні клітини 293Т були засіяні при низькому тиску на 10см чашках у 6мл DMEM/10% FCS (10 г/мл вітаміну K для фактора IX) за день до трансфекції. Трансфекцію здійснювали приблизно за Ченом та Окаямою (Моl. Cell. Biol., 7:2745 (1987)). 12 г плазміди pTGF8-1 були трасфектовані для одержання фактора VIII і pTGFG36 для одержання фактора IX. Через шість годин після трансфекції середовище замінили на свіже, а через три дні після трансфекції злили надосадову рідину і потім або очищали її, або аналізували без подальшого очищення за допомогою тесту ELISA чи коагулометрією (див. Приклади 5 і 6). Приклад 5. Визначення концентрації факторів Таблиця Кількість клітин [/mІ] 2,1x10 8,7x10 Концентрація фак- Час коагулювання тора IX [ng/ml] [s] 36 45 20 79 Нормальна плазма: 37-39с Плазма без фактора IX: 137-40с Фактор VIII: Рівні рекомбінантного фактора VIII людини в культуральному фільтраті трансфектованих клітин 293Τ визначали за допомогою тесту ELISA, використовуючи як іммобілізоване антитіло препарат поліклонального анти-FVIII:C вівці, підданий афінному очищенню (F8C-EIA-C, Affinity Biologicals). Покриття здійснювали протягом двох годин у вологій камері при температурі 22°С. Чашки (Dynex, Immulon-4) покривали 100 л стократно розведених антитіл у покривному буфері (50mМ карбонату натрію рН9.6). Чотириразове промивання чашок (Encore 2000, Merck) PBS-Tween (0,1% в об'ємному відношенні) було достатнім для блокування неспецифічних взаємодій. Після кожної наступної операції було потрібне промивання для виключення незв'язаних білків. Після 48 годин інкубування у кожну комірку додавали 100 л кожного зі зразків культурального фільтрату, видалених з різних клонів 293Т, стабільно трансфектованих плазмідою pTGF8-3. Розведення стандарту FVIII (домашній стандарт, Octapharma) 19 76102 20 були зроблені у буфері розведення (HBS-BSAльно експресуючих фактор VIII і фактор IX Більш прийнятні вектори pTGF8-1 і pTGFG36 EDTA-Tween) та інкубовані при концентрації 100 л містять конструкції для транзієнтної експресії факна комірку. Для визначення поліклонального антора VIII і фактора IX, відповідно, у клітинах молотифактора VIII, міченого пероксидазою (F8C-EIAчної залози. Для здійснення методу селекції для D, Affinity Biologicals), готове до вживання розвестабільно трансфектованого клітинного клону кадення інкубували протягом 60 хвилин при конценсету для гігроміцин-В-фосфотрансферази (HindIIIтрації 100 л на комірку. Для колориметричної реаMva 12601 фрагмент з TK-Hyg, Clontech) субклокції 5г таблетку О-фенілендіаміну (Р-6912, Sigma) нували у Smal-сайт, що присутній в обох векторах. розчиняли в 12мл буфера субстрату незадовго до У такому випадку конструкції (pTGF8-1-hyg і використання і доповнювали 12 л 30% Н2О2. pTG36hyg), які одержували у результаті цього, 150 л цього розчину субстрату додавали у кожну містять у положенні cis експресийні касети для комірку і колориметрували у MRX Reader (Dynex) фактора VIII або фактора IX людини з промотором на хвилі 490nm після 10 хвилин інкубації при кімвірусу мозаїки кольорової капусти (CMV) і сигнанатній температурі у темряві і припиняли реакцію лом поліаденілювання вірусу 40 мавпи (SV40) та додаванням у кожну комірку 50 л 2.5Μ H2SO4. експресуючу касету гігроміцин-ВРезультати, розраховані за лінійною регресією фосфотрансферази з тимідин-кіназним промотостандартних концентрацій проти стандартних погром вірусу герпесу людини (HSV) і тимідинлинань (Фіг.7А), показані на Фіг.7В. кіназний сигнал поліаденілювання HSV (див. Приклад 6. Визначення активності коагулюваФіг.4). льних факторів VIII і IX людини Вектори pTGF8-2hyg-s і pTGF8-3 (Фіг.6, SEQ ID Коагулювальна активність рекомбінантного NO:12 і 14) є похідними від вектора pTGF8-1hyg, у фактора VIII людини в надосадових рідинах клітин яких крапчасті мутації V162A, S2011N і V2223E 293Т клітинної культури (трансфектованих оса(pTGF8-2hyg-s) і S2011N (pTGF8-3) були повернуті дженням фосфатом кальцію з плазмідою pTGF8-1, у послідовність дикого типу за допомогою ПЦРяк описано у прикладі 4) визначали наступним залежного методу, використовуючи методику чином: QuikChange (Stratagene). Коагулювальну активність досліджували метоКодувальну послідовність для коагулювальних дом, що ґрунтується на дослідженні часу дії тромфакторів можна замінити будь-якою іншою генною бопластину, використовуючи активацію кефаліном послідовністю на вибір. Ці конструкції дозволяють (фосфатидил етаноламін) у ручному приладі для одержати стабільно експресуючі клітинні лінії тракоагуляції (ML-2, Instrumentation Laboratories). Для нсфекцією фосфатом кальцію і подальшою селекдослідження 100 л нерозведеної надосадової цією на стійкість до гігроміцину. Крім того, плазмірідини з трансфектованих клітин 293Т, 100 л плади містять елемент, що відповідає за прогестерон. зми без фактора VIII (Progen) і 100 л кефаліну В експериментах з транзієнтною трансфекцією (Instrumentation Laboratories) інкубували протягом плазмідою pTG36hyg продукування близько 40нг 5 хвилин при 37°С. Коагуляція починалася додаактивного фактора IX на мл культурального сереванням 100 л СаСl2. Час коагуляції зразка порівдовища може бути показане за допомогою тесту нювали з нормальною плазмою. Результати покаELISA і коагулометричної проби (див. приклади 5 і зані на Фіг.5В. Як можна побачити з Фіг.5В, 6). надосадова рідина з клітин, трансфектованих плаДля одержання фактора IX клітини 293Τ кульзмідою pTGF8-1, засвідчує активність коагуляції, тивували в DMEM, у яку додавали 10% FCS і порівнянну з нормальною плазмою, тоді як нетра10 г/мл вітаміну K (патент США 4,770,999; див. нсфектовані клітини дають величину, еквівалентну також Фіг.10). Спочатку необхідно було одержати плазмі без фактора VIII. критичну концентрацію антибіотиків для ефективПодібний спосіб використовували щодо факної селекції стабільно трансфектованих клітин тора IX. Результати показані у таблиці прикладу 5. 293Т. З цією метою клітини висівали на чашки при Залежність експресії від присутності вітаміну K низькому розведенні і вирощували їх за присутнодив. на Фіг.10. сті від 10 до 800 г/мл гігроміцину В. Через два Приклад 7. Вірусна інактивація тижні при концентрації 200 г/мл або більше не Вірусну інактивацію проводили відповідно до спостерігалося зростання клітин, так що ця концеспособу, описаного у патенті США 6,007,979. А нтрація була обрана для селекції стабільно трансаме, до потенційно інфекційного розчину білка, сфектованих клітин. помішуючи, додавали: Типову трансфекцію виконували у 10см чаш1) 0.2мл Tween 80 і 0.06мл TNBP додавали до ках з клітинами 293Т, розведеними за день до цьо19.74мл розчину або го при співвідношенні 1:15. Використовуючи метод 2) 0.2мл Triton Х-100 і 0.2мл TNBP додавали (Biotechniques, 1988 6:7 632-638), 12 г плазміди на до 19.6мл розчину. чашку трансфектували і через два дні середовище 1мл рицинової олії додавали до препаратів 1 і замінили на свіже, яке містило 200 г/мл гігроміци2, які далі інтенсивно екстрагували при кімнатній ну В. Через 2-3 тижні після селекції середовище температурі протягом однієї години. досліджували за допомогою тесту ELISA (див. У кожному випадку для фазового поділу викоприклад 5) на присутність фактора VIII або IX. Понували центрифугування. Для контролю на неінзитивні клони відокремили і перенесли на 24фекційність з водної фракції неодноразово брали коміркову плату. Після скринінгу за допомогою зразки, кожен обсягом 1мл. тесту ELISA і визначення активності позитивні Приклад 8. Одержання клітинних ліній, стабіклони піддали двом додатковим циклам субклону 21 76102 22 вання і аліквоти з них заморозили для подальшого вищеописаним способом. Потім інтенсивно провикористання та визначення особливостей. мивали предметне скло і покривали його шаром Приклад 9. Доказ фенотипічної однорідності 50% гліцерину та покривним склом. Клітини дослістабільно трансфектованих клітин за допомогою джували за допомогою світлової і флуоресцентної імунофлуоресцентного визначення in situ експресії мікроскопії (емісія на хвилі 570нм). фактора VIII Результати подані на Фіг.8. Приклад 10. Тест на теплову стабільність на Клітини 293Т у кількості 5 107, стабільно транрекомбінантному факторі IX у фільтраті культури сфектовані плазмідою pTGF8-3 (клон 49/19), і неФільтрат культури, зібраний з клітин 293Τ четрансфектовані клітини 293Т (негативний контрез 48 годин після транзієнтної трансфекції плазроль) з культур, що прикріпилися, у DMEM+9.1% мідою pTGFG36 за присутності 100 г/мл вітаміну FBS були вилучені з чашок для культивування трипсиназацією, декілька разів промиті і ресуспенK, який зберігали при температурі -80°С протягом довані у 5мл буфера PBS. 7 днів, швидко розморозили, розподілили в алікво2 л суспензії цих клітин перенесли на стерити 7500 л, які потім інкубували при наступних темльні предметні стекла і інкубували при кімнатній пературах: температурі доти, доки не випарувалася вся рідиЗразок Температура (°С) Час (хв.) на. Потім клітини фіксували у 70% етанолі протя1 0 240 гом 10 хвилин і висушували протягом 5 хвилин при 2 20 30 кімнатній температурі. Предметні стекла блокува3 20 60 ли від неспецифічного визначення інкубуванням у 4 20 240 10% розведенні сироватки плоду корови (FBS) у 5 37 30 6 37 60 фізіологічному розчині з фосфатним буфером 7 37 240 (PBS). Первинне антитіло (sh antiFVIII:C F8C-EIAC, Affinity Biologicals) стократно розводили PBS, Зразки охолоджували на льоді і визначали акщо містить 10% FBS і 0.1% сапоніну, і інкубували тивність фактора IX, як це описано у прикладі 6 протягом 60 хвилин при кімнатній температурі у (подвійне визначення). Результати показані на вологій інкубаційній камері. Після інтенсивного Фіг.9. Активність залишалася майже стабільною в промивання PBS готували 100-кратне розведення умовах інкубації до 240 хвилин при 37°С. вторинного антитіла (rb anti sh CY3 кон'югат 313165-003, Jackson ImmunoResearch), які інкубували 23 76102 24 25 76102 26 27 76102 28 29 76102 30 31 76102 32 33 76102 34 35 76102 36 37 76102 38 39 76102 40 41 76102 42 43 76102 44 45 76102 46 47 76102 48 49 76102 50 51 76102 52 53 76102 54 55 Комп’ютерна верстка Т. Чепелева 76102 Підписне 56 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюFactor viii mutein and a method for obtaining thereof in human cells lines
Назва патенту російськоюМутеин фактора viii и способ его получения в клеточных линиях человека
Автори російськоюSchroder, Carola, Lehnerer, Michael
МПК / Мітки
МПК: A61P 7/04, C07K 14/755, C12N 15/57, C07K 14/745, C12N 9/64, C12N 15/12
Мітки: клітинних, лініях, людини, спосіб, мутеїн, одержання, фактора
Код посилання
<a href="https://ua.patents.su/28-76102-muten-faktora-viii-ta-sposib-jjogo-oderzhannya-u-klitinnikh-liniyakh-lyudini.html" target="_blank" rel="follow" title="База патентів України">Мутеїн фактора viii та спосіб його одержання у клітинних лініях людини</a>
Попередній патент: Матеріал настилу підлоги, що складається з листових елементів підлоги, котрі з’єднуються з’єднувальними деталями
Наступний патент: Інгібітори фосфатидилінозит-3-кінази-дельта людини
Випадковий патент: Пестицидні сірковмісні сполуки, композиція на їх основі та спосіб боротьби з членистоногими