Пегільовані глікоформи фактора vii
Номер патенту: 86744
Опубліковано: 25.05.2009
Автори: Бехренс Карстен, Бйорн Сьорен, Клаусен Нільс Крістіан, Гарібей Патрік Вільям
Формула / Реферат
1. Кон'югат поліпептиду Фактора VII, що містить поліпептид Фактора VII з аспарагінзв'язаними та/або серинзв'язаними олігосахаридними ланцюгами, що включають сіаловокислотний компонент або галактозний компонент, причому принаймні одна олігосахаридна група є ковалентно зв'язаною з принаймні однією полімерною групою, вибраною з поліетиленгліколю з молекулярною масою в межах 300-100 000 дальтон.
2. Кон'югат поліпептиду Фактора VII за п. 1, який відрізняється тим, що полімерна група є приєднаною до сіаловокислотного компонента.
3. Кон'югат поліпептиду Фактора VII за п. 1 або п. 2, який відрізняється тим, що приблизно 94-100 % олігосахаридних ланцюгів включають принаймні один сіаловокислотний компонент.
4. Кон'югат поліпептиду Фактора VII за п. 3, який відрізняється тим, що приблизно 94-100 % олігосахаридних ланцюгів включають принаймні один сіаловокислотний компонент, і менше, ніж приблизно 25 % олігосахаридних ланцюгів містять принаймні одну незакриту антену.
5. Кон'югат поліпептиду Фактора VII за п. 4, який відрізняється тим, що менше, ніж приблизно 10 % олігосахаридних ланцюгів містять принаймні одну незакриту антену.
6. Кон'югат поліпептиду Фактора VII за п. 5, який відрізняється тим, що менше ніж приблизно 5, в оптимальному варіанті 2 % олігосахаридних ланцюгів містять принаймні одну незакриту антену.
7. Кон'югат поліпептиду Фактора VII за будь-яким з пп. 4-6, який відрізняється тим, що приблизно 96-100 % олігосахаридних ланцюгів включають принаймні один сіаловокислотний компонент.
8. Кон'югат поліпептиду Фактора VII за п. 7, який відрізняється тим, що приблизно 98-100 % олігосахаридних ланцюгів включають принаймні один сіаловокислотний компонент.
9. Кон'югат поліпептиду Фактора VII за будь-яким з попередніх пунктів, який відрізняється тим, що аспарагінзв'язані олігосахаридні ланцюги розташовуються у позиціях, які відповідають амінокислотним залишкам Asn-145 та Asn-322 людського FVIIa дикого типу (ФІГ. 1).
10. Кон'югат поліпептиду Фактора VІI за будь-яким з попередніх пунктів, який відрізняється тим, що серинзв'язані олігосахаридні ланцюги розташовуються у позиціях, які відповідають амінокислотним залишкам Ser-52 та Ser-60 людського FVIIa дикого типу (ФІГ. 1).
11. Кон'югат поліпептиду Фактора VII за будь-яким з пп. 1-10, який відрізняється тим, що поліпептид має амінокислотну послідовність людського Фактора VII дикого типу (ФІГ. 1).
12. Кон'югат поліпептиду Фактора VII за будь-яким з пп. 1-10, який відрізняється тим, що поліпептид є людським Фактором VІІa, що походить із плазми.
13. Кон'югат поліпептиду Фактора VII за будь-яким з пп. 1-12, який відрізняється тим, що поліпептиди Фактора VII вибирають із групи, яка складається з: S52А-Фактора VII, S60А-Фактора VII, Фактора VII, який було протеолітично розщеплено між залишками 290 та 291; Фактора VII, який було протеолітично розщеплено між залишками 315 та 316; Фактора VII, який було окиснено, L305V-FVII, L305V/M306D/D309S-FVII, L305I-FVII, L305T-FVII, F374P-FVII, V158T/M298Q-FVII, V158D/E296V/M298Q-FVII, K337A-FVII, M298Q-FVII, V158D/M298Q-FVII, L305V/K337A-FVII, V158D/E296V/M298Q/L305V-FVII, V158D/E296V/M298Q/K337A-FVII, V158D/E296V/M298Q/L305V/K337A-FVII, K157A-FVII, E296V-FVII, E296V/M298Q-FVII, V158D/E296V-FVII, V158D/M298K-FVII, S336G-FVII; варіантів послідовності Фактора VII, у яких амінокислотний залишок у позиціях 290 та/або 291, в оптимальному варіанті 290, було замінено, та варіантів послідовності Фактора VII, у яких амінокислотний залишок у позиціях 315 та/або 316, в оптимальному варіанті 315, було заміщено.
14. Кон'югат поліпептиду Фактора VII за будь-яким з пп. 1-12, який відрізняється тим, що поліпептиди Фактора VII вибирають із групи, яка складається з: L305V/K337A-FVII, L305V/V158D-FVII, L305V/E296V-FVII, L305V/M298Q-FVII, L305V/V158T-FVII, L305V/K337A/V158T-FVII, L305V/K337A/M298Q-FVII, L305V/K337A/E296V-FVII, L305V/K337A/V158D-FVII, L305V/V158D/M298Q-FVII, L305V/V158D/E296V-FVII, L305V/V158T/M298Q-FVII, L305V/V158T/E296V-FVII, L305V/E296V/M298Q-FVII, L305V/V158D/E296V/M298Q-FVII, L305V/V158T/E296V/M298Q-FVII, L305V/V158T/K337A/M298Q-FVII, L305V/V158T/E296V/K337A-FVII, L305V/V158D/K337A/M298Q-FVH, L305V/V158D/E296V/K337A-FVII, L305V/V158D/E296V/M298Q/K337A-FVII, L305V/V158T/E296V/M298Q/K337A-FVII, S314E/K316H-FVII, S314E/K316Q-FVII,
S314E/L305V-FVII, S314E/K337A-FVII, S314E/V158D-FVII, S314E/E296V-FVII, S314E/M298Q-FVII, S314E/V158T-FVII, K316H/L305V-FVII, K316H/K337A-FVII, K316H/V158D-FVII, K316H/E296V-FVII, K316H/M298Q-FVII, K316H/V158T-FVII, K316Q/L305V-FVII, K316Q/K337A-FVII, K316Q/V158D-FVII, K316Q/E296V-FVII, K316Q/M298Q-FVII, K316Q/V158T-FVII, S314E/L305V/K337A-FVII, S314E/L305V/V158D-FVII, S314E/L305V/E296V-FVII, S314E/L305V/M298Q-FVII, S314E/L305V/V158T-FVII, S314E/L305V/K337A/V158T-FVII, S314E/L305V/K337A/M298Q-FVII, S314E/L305V/K337A/E296V-FVII, S314E/L305V/K337A/V158D-FVII, S314E/L305V/V158D/M298Q-FVII, S314E/L305V/V158D/E296V-FVII, S314E/L305V/V158T/M298Q-FVII, S314E/L305V/V158T/E296V-FVII, S314E/L305V/E296V/M298Q-FVII, S314E/L305V/V158D/E296V/M298Q-FVII, S314E/L305V/V158T/E296V/M298Q-FVII, S314E/L305V/V158T/K337A/M298Q-FVII, S314E/L305V/V158T/E296V/K337A-FVII, S314E/L305V/V158D/K337A/M298Q-FVII, S314E/L305V/V158D/E296V/K337A-FVII, S314E/L305V/V158D/E296V/M298Q/K337A-FVII, S314E/L305V/V158T/E296V/M298Q/K337A-FVII, K316H/L305V/K337A-FVII, K316H/L305V/V158D-FVII, K316H/L305V/E296V-FVII, K316H/L305V/M298Q-FVII, K316H/L305V/V158T-FVII, K316H/L305V/K337A/V158T-FVII, K316H/L305V/K337A/M298Q-FVII, K316H/L305V/K337A/E296V-FVII, K316H/L305V/K337A/V158D-FVII, K316H/L305V/V158D/M298Q-FVII, К316H/L305V/V158D/E296V-FVII, К316H/L305V/V158T/M298Q-FVII, К316H/L305V/V158T/E296V-FVII, К316H/L305V/E296V/M298Q-FVII, K316H/L305V/V158D/E296V/M298Q-FVII, K316H/L305V/V158T/E296V/M298Q-FVII, K316H/L305V/V158T/K337A/M298Q-FVII, K316H/L305V/V158T/E296V/K337A-FVII, К316H/L305V/V158D/K337A/M298Q-FVII, K316H/L305V/V158D/E296V/K337A-FVII, K316H/L305V/V158D/E296V/M298Q/K337A-FVII, K316H/L305V/V158T/E296V/M298Q/K337A-FVII, K316Q/L305V/K337A-FVII, K316Q/L305V/V158D-FVII, K316Q/L305V/E296V-FVII, K316Q/L305V/M298Q-FVII, К316Q/L305V/V158T-FVII, К316Q/L305V/K337A/V158T-FVII, К316Q/L305V/K337A/M298Q-FVII, К316Q/L305V/K337A/E296V-FVII, K316Q/L305V/K337A/V158D-FVII, K316Q/L305V/V158D/M298Q-FVII, K316Q/L305V/V158D/E296V-FVII, K316Q/L305V/V158T/M298Q-FVII, K316Q/L305V/V158T/E296V-FVII, K316Q/L305V/E296V/M298Q-FVII, K316Q/L305V/V158D/E296V/M298Q-FVII, K316Q/L305V/V158T/E296V/M298Q-FVII, К316Q/L305V/V158T/K337A/M298Q-FVII, К316Q/L305V/V158T/E296V/K337A-FVII, K316Q/L305V/V158D/K337A/M298Q-FVII, K316Q/L305V/V158D/E296V/K337A-FVII, К316Q/L305V/V158D/E296V/M298Q/K337A-FVII, K316Q/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/K337A-FVII, F374Y/V158D-FVII, F374Y/E296V-FVII, F374Y/M298Q-FVII, F374Y/V158T-FVII, F374Y/S314E-FVII, F374Y/L305V-FVII, F374Y/L305V/K337A-FVII, F374Y/L305V/V158D-FVII, F374Y/L305V/E296V-FVII, F374Y/L305V/M298Q-FVII, F374Y/L305V/V158T-FVII, F374Y/L305V/S314E-FVII, F374Y/K337A/S314E-FVII, F374Y/K337A/V158T-FVII, F374Y/K337A/M298Q-FVII, F374Y/K337A/E296V-FVII, F374Y/K337A/V158D-FVII, F374Y/V158D/S314E-FVII, F374Y/V158D/M298Q-FVII, F374Y/V158D/E296V-FVII, F374Y/V158T/S314E-FVII, F374Y/V158T/M298Q-FVII, F374Y/V158T/E296V-FVII, F374Y/E296V/S314E-FVII, F374Y/S314E/M298Q-FVII, F374Y/E296V/M298Q-FVII, F374Y/L305V/K337A/V158D-FVII, F374Y/L305V/K337A/E296V-FVII, F374Y/L305V/K337A/M298Q-FVII, F374Y/L305V/K337A/V158T-FVH, F374Y/L305V/K337A/S314E-FVII, F374Y/L305V/V158D/E296V-FVII, F374Y/L305V/V158D/M298Q-FVII, F374Y/L305V/V158D/S314E-FVII, F374Y/L305V/E296V/M298Q-FVII, F374Y/L305V/E296V/V158T-FVII, F374Y/L305V/E296V/S314E-FVII, F374Y/L305V/M298Q/V158T-FVII, F374Y/L305V/M298Q/S314E-FVII, F374Y/L305V/V158T/S314E-FVII, F374Y/K337A/S314E/V158T-FVII, F374Y/K337A/S314E/M298Q-FVII, F374Y/K337A/S314E/E296V-FVII, F374Y/K337A/S314E/V158D-FVII, F374Y/K337A/V158T/M298Q-FVII, F374Y/K337A/V158T/E296V-FVII, F374Y/K337A/M298Q/E296V-FVII, F374Y/K337A/M298Q/V158D-FVII, F374Y/K337A/E296V/V158D-FVII, F374Y/V158D/S314E/M298Q-FVII, F374Y/V158D/S314E/E296V-FVII, F374Y/V158D/M298Q/E296V-FVII, F374Y/V158T/S314E/E296V-FVII, F374Y/V158T/S314E/M298Q-FVII, F374Y/V158T/M298Q/E296V-FVII, F374Y/E296V/S314E/M298Q-FVII, F374Y/L305V/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/K337A/S314E-FVII, F374Y/E296V/M298Q/K337A/S314E-FVII, F374Y/L305V/E296V/M298Q/K337A-FVII, F374Y/L305V/E296V/M298Q/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A-FVH, F374Y/V158D/E296V/M298Q/S314E-FVII, F374Y/L305V/V158D/K337A/S314E-FVII, F374Y/V158D/M298Q/K337A/S314E-FVII, F374Y/V158D/E296V/K337A/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q-FVII, F374Y/L305V/V158D/M298Q/K337A-FVII, F374Y/L305V/V158D/E296V/K337A-FVII, F374Y/L305V/V158D/M298Q/S314E-FVII, F374Y/L305V/V158D/E296V/S314E-FVII, F374Y/V158T/E296V/M298Q/K337A-FVII, F374Y/V158T/E296V/M298Q/S314E-FVII, F374Y/L305V/V158T/K337A/S314E-FVII, F374Y/V158T/M298Q/K337A/S314E-FVII, F374Y/V158T/E296V/K337A/S314E-FVII, F374Y/L305V/V158T/E296V/M298Q-FVII, F374Y/L305V/V158T/M298Q/K337A-FVII, F374Y/L305V/V158T/E296V/K337A-FVII, F374Y/L305V/V158T/M298Q/S314E-FVII, F374Y/L305V/V158T/E296V/S314E-FVII, F374Y/E296V/M298Q/K337A/V158T/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/S314E-FVII,
F374Y/L305V/E296V/M298Q/V158T/S314E-FVII,
F374Y/L305V/E296V/M298Q/K337A/V158T-FVII,
F374Y/L305V/E296V/K337A/V158T/S314E-FVII,
F374Y/L305V/M298Q/K337A/V158T/S314E-FVII,
F374Y/L305V/V158D/E296V/M298Q/K337A-FVII,
F374Y/L305V/V158D/E296V/K337A/S314E-FVII,
F374Y/L305V/V158D/M298Q/K337A/S314E-FVII,
F374Y/L305V/E296V/M298Q/K337A/V158T/S314E-FVII,
F374Y/L305V/V158D/E296V/M298Q/K337A/S314E-FVII, S52A-Фaктоpa VII, S60A-Фактора VII; та P11Q/K33E-FVII, T106N-FVII, K143N/N145T-FVII, V253N-FVH, R290N/A292T-FVII, G291N-FVH, R315N/V317T-FVII, K143N/N145T/R315N/V317T-FVII;
FVII, що має заміщення, включення або делеції в амінокислотній послідовності від 233 Thr до 240 Asn, FVII, що має заміщення, включення або делеції в амінокислотній послідовності від 304 Arg до 329 Cys, та FVII, що має заміщення, делеції, включення в амінокислотній послідовності Ile 153 – Arg 223.
15. Кон'югат поліпептиду Фактора VII за будь-яким з пп. 1-12, який відрізняється тим, що пов'язані з Фактором VII поліпептиди вибирають із групи, яка складається з: R152Е-Фактора VII, S344A-Фaктopa VІІ, FFR-Фактора VII та Фактора VІІa без Gla-домену.
16. Кон'югат поліпептиду Фактора VII за будь-яким з пп. 1-15, який відрізняється тим, що пов'язаний з Фактором VII поліпептид виявляє принаймні приблизно 25 %, краще принаймні приблизно 50 %, ще краще принаймні приблизно 75 %, і найкраще принаймні приблизно 90 % специфічної активності Фактора VІІa дикого типу, який вироблявся в тому самому типі клітин, при випробуванні в одному або кількох аналізах коагуляції, аналізі протеолізу або аналізі TF-зв'язування, як описано у представленому описі.
17. Кон'югат поліпептиду Фактора VII за будь-яким з пп. 1-15, який відрізняється тим, що пов'язаний з Фактором VII поліпептид виявляє менше, ніж приблизно 25 %, краще менше ніж приблизно 10 %, ще краще менше ніж приблизно 5 %, і найкраще менше ніж приблизно 1 % специфічної активності Фактора VІІa дикого типу, який вироблявся в тому самому типі клітин, при випробуванні в одному або кількох аналізах коагуляції, аналізі протеолізу або аналізі TF-зв'язування, як описано у представленому описі.
18. Кон'югат поліпептиду Фактора VII за будь-яким з пп. 1-15, який відрізняється тим, що він має біодоступність, яка становить принаймні приблизно 110 % біодоступності контрольного кон'югата, наприклад, принаймні приблизно 120 %, приблизно 130 % або принаймні приблизно 140 % біодоступності контрольного кон'югата.
19. Кон'югат поліпептиду Фактора VII за будь-яким з пп. 1-15, який відрізняється тим, що він має півперіод у сироватці, який становить принаймні приблизно 125 % півперіоду контрольного кон'югата, наприклад, приблизно 150 %, приблизно 200 % або принаймні приблизно 250 % півперіоду контрольного кон'югата.
20. Спосіб одержання кон'югата поліпептиду Фактора VII за пп. 1-19, який включає контактування поліпептидів Фактора VII з аспарагінзв'язаними та/або серинзв'язаними олігосахаридними ланцюгами, що включають сіаловокислотний компонент або галактозний компонент, причому принаймні одна олігосахаридна група є ковалентно зв'язаною з принаймні однією полімерною групою, вибраною з поліетиленгліколю з молекулярною масою в межах 300-100 000 дальтон.
21. Фармацевтична композиція, яка включає кон'югат поліпептиду Фактора VII за будь-яким з пунктів 1-19 та фармацевтично прийнятний носій або ад'ювант.
22. Спосіб лікування чутливого до Фактора VII синдрому, де спосіб включає введення фармацевтичної композиції, яку визначено у п. 21, пацієнтові, який потребує такого лікування, за умов, які в результаті забезпечують зниження кровотечі та/або збільшення коагуляції крові, причому композиція включає поліпептиди Фактора VII.
23. Спосіб за п. 22, який відрізняється тим, що синдром належить до групи, яка складається з гемофілії А, гемофілії В, дефіциту Фактора XI, дефіциту Фактора VII, тромбоцитопенії, хвороби фон Віллебранда, присутності інгібітора коагулюючого фактора, хірургічної операції, травми та антикоагулянтної терапії, включаючи дилюційну коагулопатію, крововилив у мозок, трансплантацію стовбурових клітин, кровотечу з верхніх відділів шлунково-кишкового тракту та хвороби печінки.
24. Застосування композиції, яка включає кон'югат поліпептиду Фактора VII за будь-якимз пп. 1-19 для виготовлення медикаменту для лікування чутливого до Фактора VII синдрому.
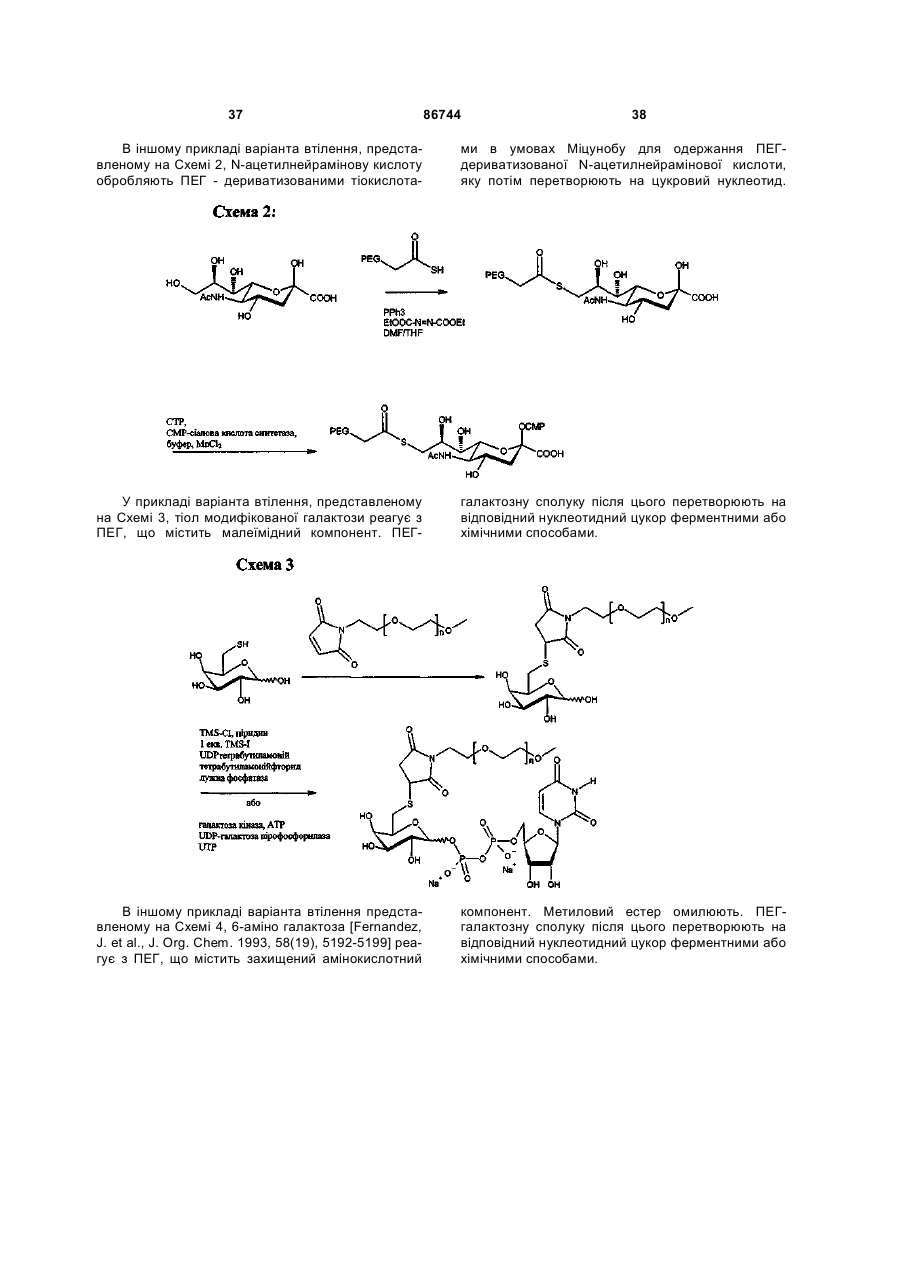
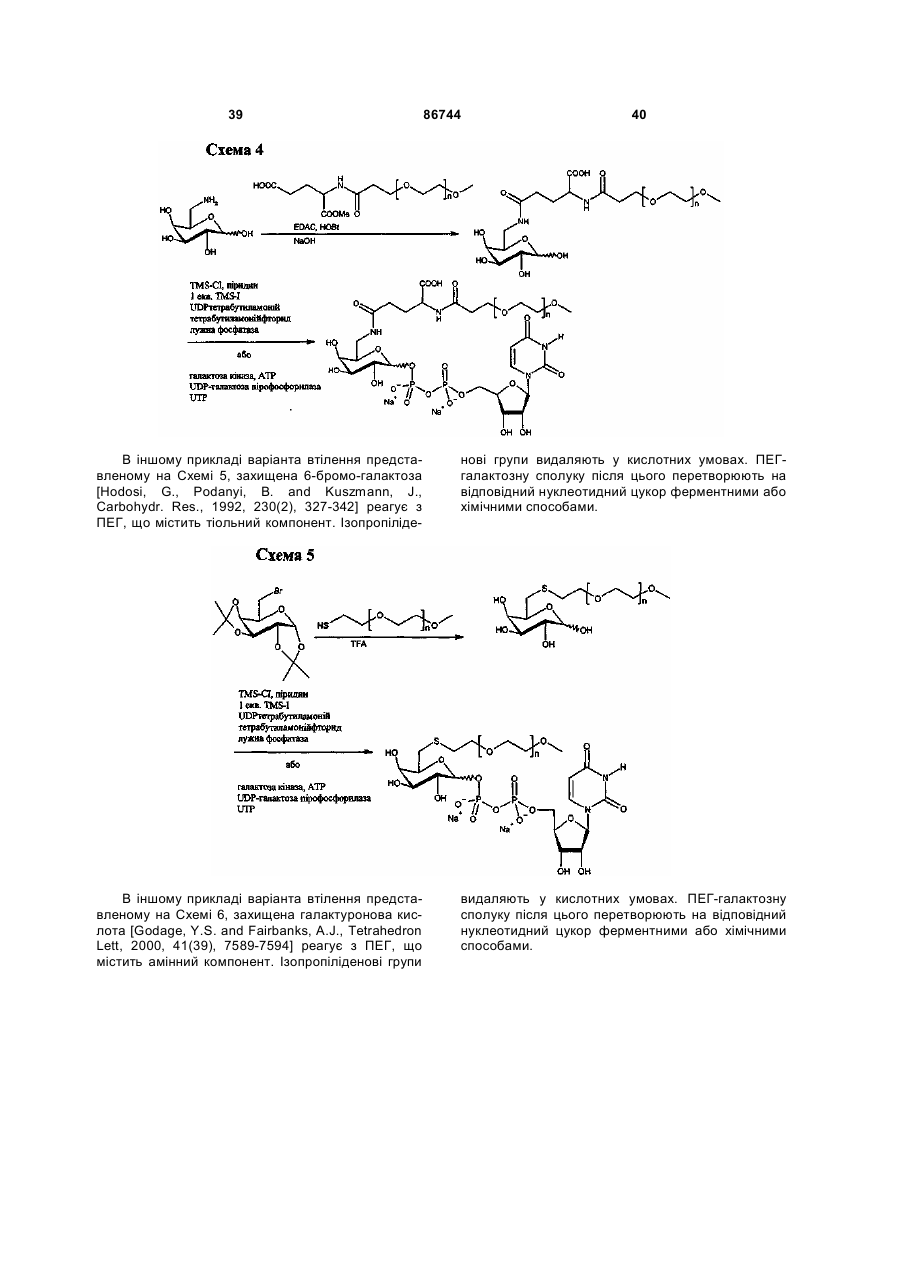
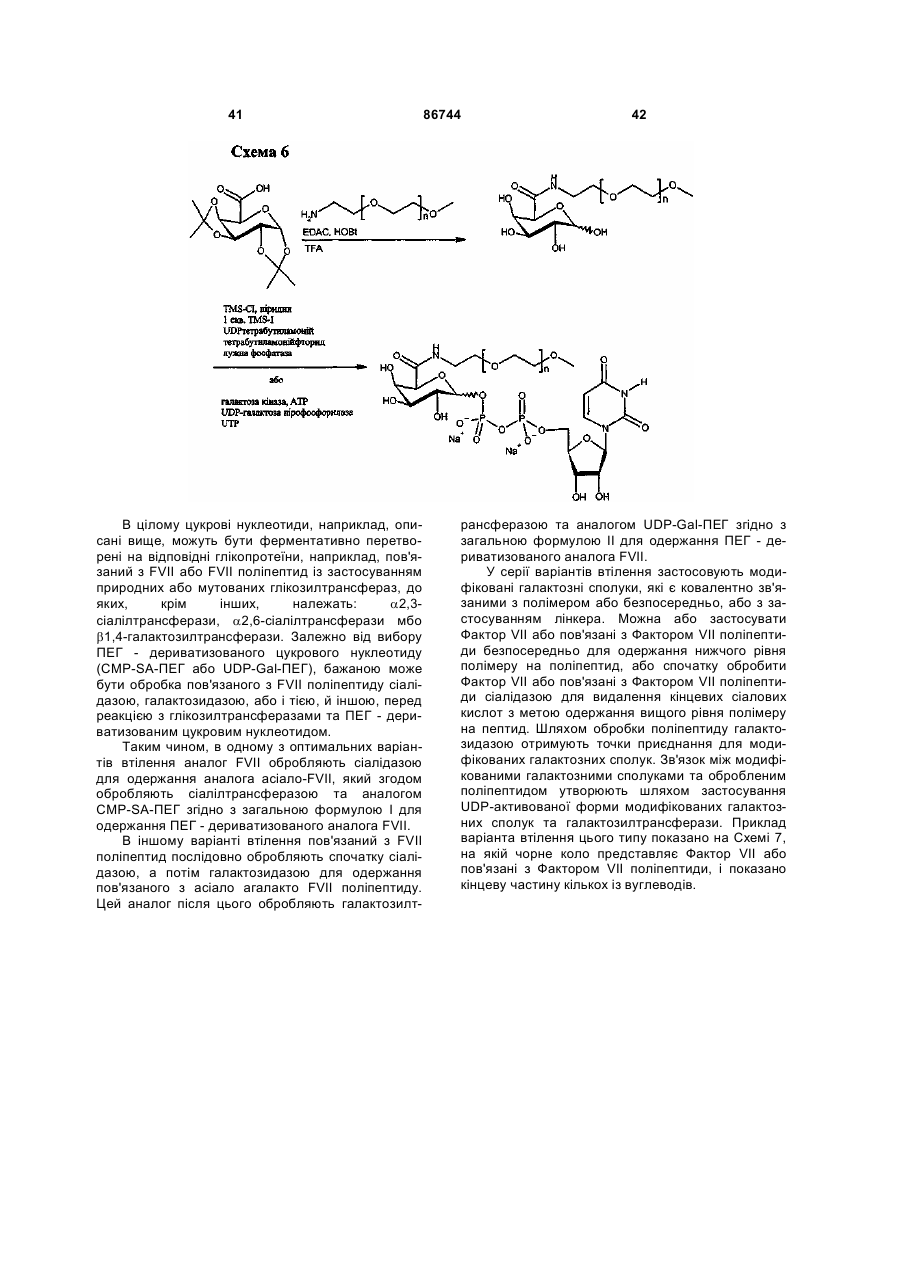
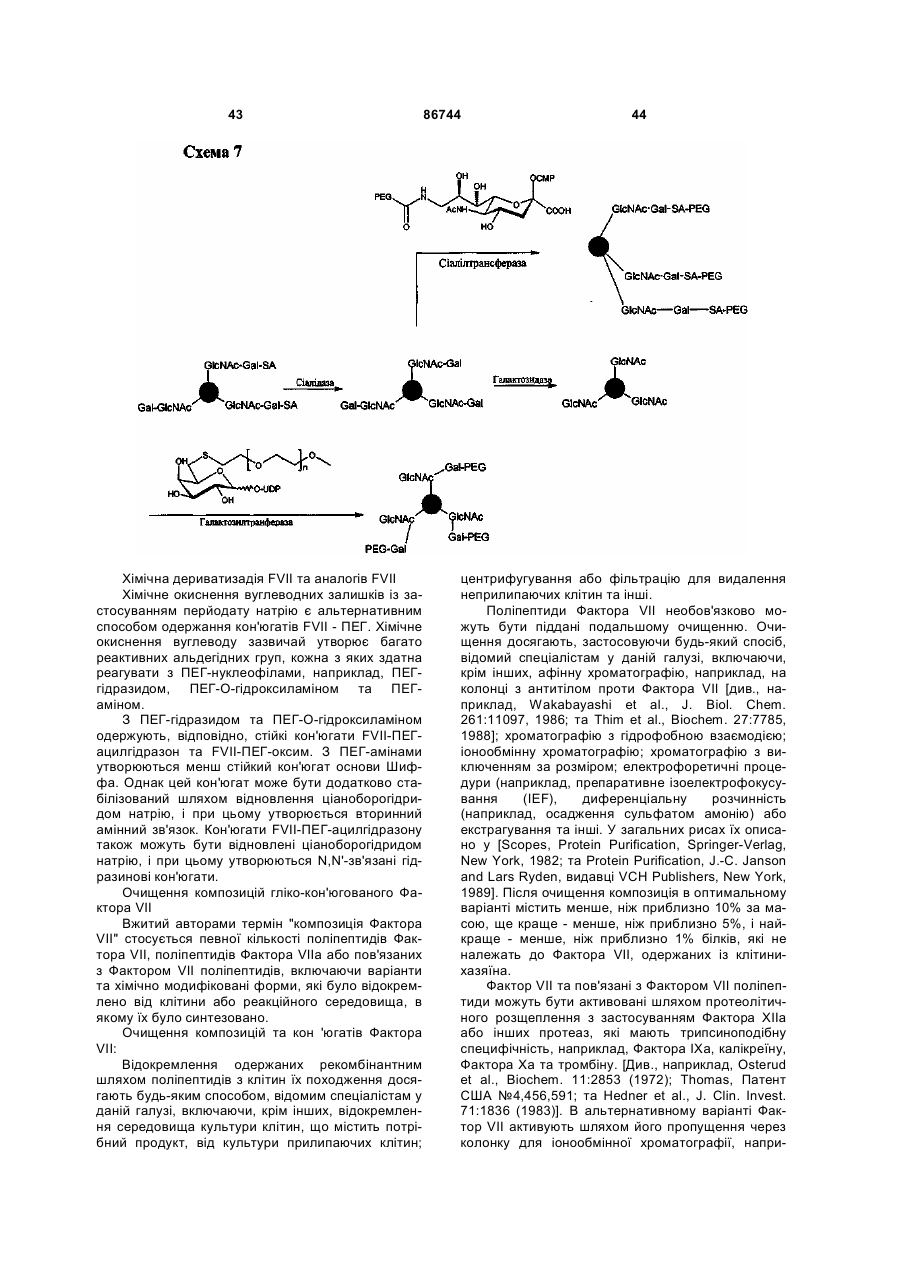
Текст
1. Кон'югат поліпептиду Фактора VII, що містить поліпептид Фактора VII з аспарагінзв'язаними та/або серинзв'язаними олігосахаридними ланцюгами, що включають сіаловокислотний компонент або галактозний компонент, причому принаймні одна олігосахаридна група є ковалентно зв'язаною з принаймні однією полімерною групою, вибраною з поліетиленгліколю з молекулярною масою в межах 300-100 000 дальтон. 2. Кон'югат поліпептиду Фактора VII за п. 1, який відрізняється тим, що полімерна група є приєднаною до сіаловокислотного компонента. 3. Кон'югат поліпептиду Фактора VII за п. 1 або п. 2, який відрізняється тим, що приблизно 94-100 % олігосахаридних ланцюгів включають принаймні один сіаловокислотний компонент. 4. Кон'югат поліпептиду Фактора VII за п. 3, який відрізняється тим, що приблизно 94-100 % олігосахаридних ланцюгів включають принаймні один сіаловокислотний компонент, і менше, ніж приблизно 25 % олігосахаридних ланцюгів містять принаймні одну незакриту антену. 5. Кон'югат поліпептиду Фактора VII за п. 4, який відрізняється тим, що менше, ніж приблизно 10 % олігосахаридних ланцюгів містять принаймні одну незакриту антену. 6. Кон'югат поліпептиду Фактора VII за п. 5, який відрізняється тим, що менше ніж приблизно 5, в оптимальному варіанті 2 % олігосахаридних ланцюгів містять принаймні одну незакриту антену. 2 (19) 1 3 86744 4 варіантів послідовності Фактора VII, у яких аміноК316H/L305V/E296V/M298Q-FVII, кислотний залишок у позиціях 290 та/або 291, в K316H/L305V/V158D/E296V/M298Q-FVII, оптимальному варіанті 290, було замінено, та ваK316H/L305V/V158T/E296V/M298Q-FVII, ріантів послідовності Фактора VII, у яких амінокисK316H/L305V/V158T/K337A/M298Q-FVII, лотний залишок у позиціях 315 та/або 316, в оптиK316H/L305V/V158T/E296V/K337A-FVII, мальному варіанті 315, було заміщено. К316H/L305V/V158D/K337A/M298Q-FVII, 14. Кон'югат поліпептиду Фактора VII за будь-яким K316H/L305V/V158D/E296V/K337A-FVII, з пп. 1-12, який відрізняється тим, що поліпептиK316H/L305V/V158D/E296V/M298Q/K337A-FVII, ди Фактора VII вибирають із групи, яка складаєтьK316H/L305V/V158T/E296V/M298Q/K337A-FVII, ся з: L305V/K337A-FVII, L305V/V158D-FVII, K316Q/L305V/K337A-FVII, K316Q/L305V/V158DL305V/E296V-FVII, L305V/M298Q-FVII, FVII, K316Q/L305V/E296V-FVII, L305V/V158T-FVII, L305V/K337A/V158T-FVII, K316Q/L305V/M298Q-FVII, К316Q/L305V/V158TL305V/K337A/M298Q-FVII, L305V/K337A/E296VFVII, К316Q/L305V/K337A/V158T-FVII, FVII, L305V/K337A/V158D-FVII, К316Q/L305V/K337A/M298Q-FVII, L305V/V158D/M298Q-FVII, L305V/V158D/E296VК316Q/L305V/K337A/E296V-FVII, FVII, L305V/V158T/M298Q-FVII, K316Q/L305V/K337A/V158D-FVII, L305V/V158T/E296V-FVII, L305V/E296V/M298QK316Q/L305V/V158D/M298Q-FVII, FVII, L305V/V158D/E296V/M298Q-FVII, K316Q/L305V/V158D/E296V-FVII, L305V/V158T/E296V/M298Q-FVII, K316Q/L305V/V158T/M298Q-FVII, L305V/V158T/K337A/M298Q-FVII, K316Q/L305V/V158T/E296V-FVII, L305V/V158T/E296V/K337A-FVII, K316Q/L305V/E296V/M298Q-FVII, L305V/V158D/K337A/M298Q-FVH, K316Q/L305V/V158D/E296V/M298Q-FVII, L305V/V158D/E296V/K337A-FVII, K316Q/L305V/V158T/E296V/M298Q-FVII, L305V/V158D/E296V/M298Q/K337A-FVII, К316Q/L305V/V158T/K337A/M298Q-FVII, L305V/V158T/E296V/M298Q/K337A-FVII, К316Q/L305V/V158T/E296V/K337A-FVII, S314E/K316H-FVII, S314E/K316Q-FVII, K316Q/L305V/V158D/K337A/M298Q-FVII, S314E/L305V-FVII, S314E/K337A-FVII, K316Q/L305V/V158D/E296V/K337A-FVII, S314E/V158D-FVII, S314E/E296V-FVII, К316Q/L305V/V158D/E296V/M298Q/K337A-FVII, S314E/M298Q-FVII, S314E/V158T-FVII, K316Q/L305V/V158T/E296V/M298Q/K337A-FVII, K316H/L305V-FVII, K316H/K337A-FVII, F374Y/K337A-FVII, F374Y/V158D-FVII, K316H/V158D-FVII, K316H/E296V-FVII, F374Y/E296V-FVII, F374Y/M298Q-FVII, K316H/M298Q-FVII, K316H/V158T-FVII, F374Y/V158T-FVII, F374Y/S314E-FVII, K316Q/L305V-FVII, K316Q/K337A-FVII, F374Y/L305V-FVII, F374Y/L305V/K337A-FVII, K316Q/V158D-FVII, K316Q/E296V-FVII, F374Y/L305V/V158D-FVII, F374Y/L305V/E296VK316Q/M298Q-FVII, K316Q/V158T-FVII, FVII, F374Y/L305V/M298Q-FVII, S314E/L305V/K337A-FVII, S314E/L305V/V158DF374Y/L305V/V158T-FVII, F374Y/L305V/S314E-FVII, FVII, S314E/L305V/E296V-FVII, F374Y/K337A/S314E-FVII, F374Y/K337A/V158TS314E/L305V/M298Q-FVII, S314E/L305V/V158TFVII, F374Y/K337A/M298Q-FVII, FVII, S314E/L305V/K337A/V158T-FVII, F374Y/K337A/E296V-FVII, F374Y/K337A/V158DS314E/L305V/K337A/M298Q-FVII, FVII, F374Y/V158D/S314E-FVII, S314E/L305V/K337A/E296V-FVII, F374Y/V158D/M298Q-FVII, F374Y/V158D/E296VS314E/L305V/K337A/V158D-FVII, FVII, F374Y/V158T/S314E-FVII, S314E/L305V/V158D/M298Q-FVII, F374Y/V158T/M298Q-FVII, F374Y/V158T/E296VS314E/L305V/V158D/E296V-FVII, FVII, F374Y/E296V/S314E-FVII, S314E/L305V/V158T/M298Q-FVII, F374Y/S314E/M298Q-FVII, F374Y/E296V/M298QS314E/L305V/V158T/E296V-FVII, FVII, F374Y/L305V/K337A/V158D-FVII, S314E/L305V/E296V/M298Q-FVII, F374Y/L305V/K337A/E296V-FVII, S314E/L305V/V158D/E296V/M298Q-FVII, F374Y/L305V/K337A/M298Q-FVII, S314E/L305V/V158T/E296V/M298Q-FVII, F374Y/L305V/K337A/V158T-FVH, S314E/L305V/V158T/K337A/M298Q-FVII, F374Y/L305V/K337A/S314E-FVII, S314E/L305V/V158T/E296V/K337A-FVII, F374Y/L305V/V158D/E296V-FVII, S314E/L305V/V158D/K337A/M298Q-FVII, F374Y/L305V/V158D/M298Q-FVII, S314E/L305V/V158D/E296V/K337A-FVII, F374Y/L305V/V158D/S314E-FVII, S314E/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/L305V/E296V/M298Q-FVII, S314E/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/L305V/E296V/V158T-FVII, K316H/L305V/K337A-FVII, K316H/L305V/V158DF374Y/L305V/E296V/S314E-FVII, FVII, K316H/L305V/E296V-FVII, F374Y/L305V/M298Q/V158T-FVII, K316H/L305V/M298Q-FVII, K316H/L305V/V158TF374Y/L305V/M298Q/S314E-FVII, FVII, K316H/L305V/K337A/V158T-FVII, F374Y/L305V/V158T/S314E-FVII, K316H/L305V/K337A/M298Q-FVII, F374Y/K337A/S314E/V158T-FVII, K316H/L305V/K337A/E296V-FVII, F374Y/K337A/S314E/M298Q-FVII, K316H/L305V/K337A/V158D-FVII, F374Y/K337A/S314E/E296V-FVII, K316H/L305V/V158D/M298Q-FVII, F374Y/K337A/S314E/V158D-FVII, К316H/L305V/V158D/E296V-FVII, F374Y/K337A/V158T/M298Q-FVII, К316H/L305V/V158T/M298Q-FVII, F374Y/K337A/V158T/E296V-FVII, К316H/L305V/V158T/E296V-FVII, F374Y/K337A/M298Q/E296V-FVII, 5 86744 6 F374Y/K337A/M298Q/V158D-FVII, 16. Кон'югат поліпептиду Фактора VII за будь-яким F374Y/K337A/E296V/V158D-FVII, з пп. 1-15, який відрізняється тим, що пов'язаний F374Y/V158D/S314E/M298Q-FVII, з Фактором VII поліпептид виявляє принаймні приF374Y/V158D/S314E/E296V-FVII, близно 25 %, краще принаймні приблизно 50 %, F374Y/V158D/M298Q/E296V-FVII, ще краще принаймні приблизно 75 %, і найкраще F374Y/V158T/S314E/E296V-FVII, принаймні приблизно 90 % специфічної активності F374Y/V158T/S314E/M298Q-FVII, Фактора VІІa дикого типу, який вироблявся в тому F374Y/V158T/M298Q/E296V-FVII, самому типі клітин, при випробуванні в одному або F374Y/E296V/S314E/M298Q-FVII, кількох аналізах коагуляції, аналізі протеолізу або F374Y/L305V/M298Q/K337A/S314E-FVII, аналізі TF-зв'язування, як описано у представлеF374Y/L305V/E296V/K337A/S314E-FVII, ному описі. F374Y/E296V/M298Q/K337A/S314E-FVII, 17. Кон'югат поліпептиду Фактора VII за будь-яким F374Y/L305V/E296V/M298Q/K337A-FVII, з пп. 1-15, який відрізняється тим, що пов'язаний F374Y/L305V/E296V/M298Q/S314E-FVII, з Фактором VII поліпептид виявляє менше, ніж F374Y/V158D/E296V/M298Q/K337A-FVH, приблизно 25 %, краще менше ніж приблизно 10 F374Y/V158D/E296V/M298Q/S314E-FVII, %, ще краще менше ніж приблизно 5 %, і найкраF374Y/L305V/V158D/K337A/S314E-FVII, ще менше ніж приблизно 1 % специфічної активF374Y/V158D/M298Q/K337A/S314E-FVII, ності Фактора VІІa дикого типу, який вироблявся в F374Y/V158D/E296V/K337A/S314E-FVII, тому самому типі клітин, при випробуванні в одноF374Y/L305V/V158D/E296V/M298Q-FVII, му або кількох аналізах коагуляції, аналізі протеоF374Y/L305V/V158D/M298Q/K337A-FVII, лізу або аналізі TF-зв'язування, як описано у предF374Y/L305V/V158D/E296V/K337A-FVII, ставленому описі. F374Y/L305V/V158D/M298Q/S314E-FVII, 18. Кон'югат поліпептиду Фактора VII за будь-яким F374Y/L305V/V158D/E296V/S314E-FVII, з пп. 1-15, який відрізняється тим, що він має F374Y/V158T/E296V/M298Q/K337A-FVII, біодоступність, яка становить принаймні приблизF374Y/V158T/E296V/M298Q/S314E-FVII, но 110 % біодоступності контрольного кон'югата, F374Y/L305V/V158T/K337A/S314E-FVII, наприклад, принаймні приблизно 120 %, приблизF374Y/V158T/M298Q/K337A/S314E-FVII, но 130 % або принаймні приблизно 140 % біодосF374Y/V158T/E296V/K337A/S314E-FVII, тупності контрольного кон'югата. F374Y/L305V/V158T/E296V/M298Q-FVII, 19. Кон'югат поліпептиду Фактора VII за будь-яким F374Y/L305V/V158T/M298Q/K337A-FVII, з пп. 1-15, який відрізняється тим, що він має F374Y/L305V/V158T/E296V/K337A-FVII, півперіод у сироватці, який становить принаймні F374Y/L305V/V158T/M298Q/S314E-FVII, приблизно 125 % півперіоду контрольного кон'югаF374Y/L305V/V158T/E296V/S314E-FVII, та, наприклад, приблизно 150 %, приблизно 200 % F374Y/E296V/M298Q/K337A/V158T/S314E-FVII, або принаймні приблизно 250 % півперіоду контF374Y/V158D/E296V/M298Q/K337A/S314E-FVII, рольного кон'югата. F374Y/L305V/V158D/E296V/M298Q/S314E-FVII, 20. Спосіб одержання кон'югата поліпептиду ФакF374Y/L305V/E296V/M298Q/V158T/S314E-FVII, тора VII за пп. 1-19, який включає контактування F374Y/L305V/E296V/M298Q/K337A/V158T-FVII, поліпептидів Фактора VII з аспарагінзв'язаними F374Y/L305V/E296V/K337A/V158T/S314E-FVII, та/або серинзв'язаними олігосахаридними ланцюF374Y/L305V/M298Q/K337A/V158T/S314E-FVII, гами, що включають сіаловокислотний компонент F374Y/L305V/V158D/E296V/M298Q/K337A-FVII, або галактозний компонент, причому принаймні F374Y/L305V/V158D/E296V/K337A/S314E-FVII, одна олігосахаридна група є ковалентно зв'язаною F374Y/L305V/V158D/M298Q/K337A/S314E-FVII, з принаймні однією полімерною групою, вибраною F374Y/L305V/E296V/M298Q/K337A/V158T/S314Eз поліетиленгліколю з молекулярною масою в меFVII, жах 300-100 000 дальтон. F374Y/L305V/V158D/E296V/M298Q/K337A/S314E21. Фармацевтична композиція, яка включає кон'юFVII, S52A-Фaктоpa VII, S60A-Фактора VII; та гат поліпептиду Фактора VII за будь-яким з пунктів P11Q/K33E-FVII, T106N-FVII, K143N/N145T-FVII, 1-19 та фармацевтично прийнятний носій або V253N-FVH, R290N/A292T-FVII, G291N-FVH, ад'ювант. R315N/V317T-FVII, K143N/N145T/R315N/V317T22. Спосіб лікування чутливого до Фактора VII сиFVII; ндрому, де спосіб включає введення фармацевтиFVII, що має заміщення, включення або делеції в чної композиції, яку визначено у п. 21, пацієнтові, амінокислотній послідовності від 233 Thr до 240 який потребує такого лікування, за умов, які в реAsn, FVII, що має заміщення, включення або дезультаті забезпечують зниження кровотечі та/або леції в амінокислотній послідовності від 304 Arg до збільшення коагуляції крові, причому композиція 329 Cys, та FVII, що має заміщення, делеції, вклювключає поліпептиди Фактора VII. чення в амінокислотній послідовності Ile 153 – Arg 23. Спосіб за п. 22, який відрізняється тим, що 223. синдром належить до групи, яка складається з 15. Кон'югат поліпептиду Фактора VII за будь-яким гемофілії А, гемофілії В, дефіциту Фактора XI, дез пп. 1-12, який відрізняється тим, що пов'язані з фіциту Фактора VII, тромбоцитопенії, хвороби фон Фактором VII поліпептиди вибирають із групи, яка Віллебранда, присутності інгібітора коагулюючого складається з: R152Е-Фактора VII, S344A-Фaктopa фактора, хірургічної операції, травми та антикоаVІІ, FFR-Фактора VII та Фактора VІІa без Glaгулянтної терапії, включаючи дилюційну коагулодомену. патію, крововилив у мозок, трансплантацію стов 7 86744 8 бурових клітин, кровотечу з верхніх відділів шлундля виготовлення медикаменту для лікування чутково-кишкового тракту та хвороби печінки. ливого до Фактора VII синдрому. 24. Застосування композиції, яка включає кон'югат поліпептиду Фактора VII за будь-яким з пп. 1-19 Даний винахід стосується композицій, які включають кон'югати Фактора VII, які мають заданий характер глікозилування. Фактор VII є вітамін K-залежним білком плазми, який синтезується у печінці й секретується у кров як одноланцюговий глікопротеїн з молекулярною масою приблизно 50кДа. Зимоген FVII перетворюється на активовану форму (FVIIa) шляхом протеолітичного розщеплення. FVIIa у комплексі з тканинним фактором (TF) може перетворювати і Фактор IX, і Фактор X на їх активовані форми, з наступними реакціями, які ведуть до швидкого вироблення тромбіну та утворення фібрину. Білки, які беруть участь у каскаді коагуляції, включаючи, наприклад, Фактор VII, Фактор VIII, Фактор IX, Фактор X та Протеїн С, виявили себе корисними терапевтичними засобами для лікування різних патологічних станів. Відповідним чином, існує зростаюча потреба в композиціях, які включають ці білки, які є фармацевтично прийнятними і виявляють рівномірну й заздалегідь задану клінічну ефективність. Через багато недоліків застосування людської плазми як джерела фармацевтичних продуктів перевагу віддають виробленню цих білків у рекомбінантних системах. Однак, коагулюючі білки піддаються різним ко- та посттрансляційним модифікаціям, включаючи, наприклад, аспарагін-зв'язане (N-зв'язане) глікозилування; О-зв'язане глікозилування; та g-карбоксилування glu- залишків. Ці модифікації можуть бути якісно або кількісно відмінними, коли застосовують гетерологічні клітини як хазяї для великомасштабного виробництва білків. Зокрема, вироблення у гетерологічних клітинах часто призводить до іншої групи глікоформ, які є ідентичними поліпептидами, що мають різні ковалентно зв'язані олігосахаридні структури. У різних системах зміни у структурі олігосахаридів терапевтичних білків пов'язується, крім іншого, зі змінами в імуногенності та in vivo кліренсі. Крім in vivo кліренсу, функціональний in vivo півперіод також має значення для періоду часу, протягом якого сполука є "терапевтично доступною" в організмі. Півперіод rFVIIa у системі кровообігу становить приблизно 2,3 години ("Summary Basis for Approval for NovoSevenÓ", реєстраційний номер FDA 96-0597). Композиції людського рекомбінантного FVIIa серійного виробництва реалізуються на ринку як NovoSevenÒ. NovoSevenÒ є єдиним присутнім на ринку rFVIIa для ефективного й надійного лікування від нападів кровотечі. Необхідні відносно високі дози та часте введення для досягнення та підтримання потрібного терапевтичного та профілактичного ефекту. Внаслідок цього регуляція належної дози ускладнюється, і потреба у частих внутріш ньовенних введеннях накладає обмеження на спосіб життя пацієнта. Молекула з довшим півперіодом у системі кровообігу знижує кількість необхідних введень. Якщо враховувати те, що нині існуючий продукт FVIIa є пов'язаним з частими ін'єкціями, стає зрозумілою потреба у поліпшених молекулах FVII. Одним зі шляхів поліпшення циркуляції є забезпечення зменшення швидкості виведення з організму. Як уже було сказано, зміни у структурі олігосахаридів терапевтичних білків є пов'язаними, крім іншого, з in vivo кліренсом. Крім того, приєднання хімічного компонента до поліпептиду може знизити нирковий кліренс поліпептиду. Повідомлялося про неактивні форми FVII. Інактивована форма здатна конкурувати з FVII або FVIIa дикого типу у зв'язуванні з тканинним фактором та інгібуванням коагулюючої активності. Пропонувалося застосовувати інактивовану форму FVIIa для лікування пацієнтів, які перебувають у стані, схильному до гіперкоагуляції, таких як пацієнти з сепсисом, піддані ризикові інфаркту міокарда або тромботичного удару. У WO 98/32466 вказується, що FVII, серед багатьох інших білків, може бути ПЕГільованим, але не містить ніякої іншої інформації в цьому відношенні. У WO 01/58935 заявлено кон'югати неполіпептидних компонентів (наприклад, ПЕГ) з поліпептидом, у яких амінокислотна послідовність відрізняється від послідовності FVII дикого типу тим, що принаймні один амінокислотний залишок, який включає з'єднувальну групу для непептидного компонента є включеним або видаленим. У US 4847325 вказано, що колонієстимулюючий фактор-1 (CSF-1) може бути приєднаний до ПЕГ шляхом реакції похідних ПЕГ з окисненим CSF-1. Таким чином, у галузі існує потреба в композиціях та способах, які забезпечують композиції коагулюючого білка, зокрема, композиції, які включають поліпшений рекомбінантний людський Фактор VII, модифікований Фактор VII або пов'язаний з Фактором VII поліпептид. Авторами було виявлено, що композиції поліпептидів Фактора VII, які мають структури глікоформи, які містять принаймні одну олігосахаридну групу, ковалентно зв'язану з принаймні однією полімерною групою, мають поліпшені функціональні властивості. Відповідним чином, даний винахід стосується способів та композицій, які забезпечують ці композиції кон'югованих білків. Відповідним чином, даний винахід у першому аспекті стосується композиції, яка включає певну кількість поліпептидів Фактора VII або пов'язаних з Фактором VII поліпептидів, у яких поліпептиди включають аспарагін-зв'язані та/або серин-зв'язані 9 86744 10 олігосахаридні ланцюги, і принаймні одна олігосаF374P-FVII, V158T/M298Q-FVII, харидна група є ковалентно зв'язаною з принаймні V158D/E296V/M298Q-FVII, K337A-FVII, M298Qоднією полімерною групою. FVII, V158D/M298Q-FVII, L305V/K337A-FVII, В одному варіанті втілення полімерна група є V158D/E296V/M298Q/L305V-FVII, ковалентно зв'язаною з сіаловокислотним компоV158D/E296V/M298Q/K337A-FVII, нентом. В іншому варіанті втілення полімерна груV158D/E296V/M298Q/L305V/K337A-FVII, К157Апа є ковалентно зв'язаною з галактозним компонеFVII, E296V-FVII, E296V/M298Q-FVII, нтом. V158D/E296V-FVII, V158D/M298K-FVII, S336G-FVII; В одному варіанті втілення приблизно 94варіантів послідовності Фактора VII, у яких аміно100% олігосахаридних ланцюгів включають прикислотний залишок у позиціях 290 та/або 291, в наймні один сіаловокислотний компонент. оптимальному варіанті - 290, було заміщено; та В одному варіанті втілення приблизно 94варіантів послідовності Фактора VII, у яких аміно100% олігосахаридних ланцюгів включають прикислотний залишок у позиціях 315 та/або 316, в наймні один сіаловокислотний компонент, і менше, оптимальному варіанті - 315, було заміщено. В ніж приблизно 25% олігосахаридних ланцюгів місіншому варіанті втілення поліпептиди Фактора VII тять принаймні одну незакриту антену. вибирають із переліку, який складається з: варіанВ одному варіанті втілення менше, ніж притів Фактора VII, які мають підвищену біологічну близно 10% олігосахаридних ланцюгів містять активність порівняно з FVIIa дикого типу, як описапринаймні одну незакриту антену. но у WO 01/83725, WO 02/22776, WO 02/77218, В одному варіанті втілення менше, ніж приWO 03/27147 та WO 03/37932; L305V/K337A-FVII, близно 5, в оптимальному варіанті - менше, ніж L305V/V158D-FVII, L305V/E296V-FVII, приблизно 2% олігосахаридних ланцюгів містять L305V/M298Q-FVII, L305V/V158T-FVII, принаймні одну незакриту антену. L305V/K337A/V158T-FVII, L305V/K337A/M298QВ одному варіанті втілення приблизно 96FVII, L305V/K337A/E296V-FVII, 100% олігосахаридних ланцюгів включають приL305V/K337A/V158D-FVII, L305V/V158D/M298Qнаймні один сіаловокислотний компонент. FVII, L305V/V158D/E296V-FVII, В одному варіанті втілення приблизно 98L305V/V158T/M298Q-FVII, L305V/V15817E296V100% олігосахаридних ланцюгів включають приFVII, L305V/E296V/M298Q-FVII, наймні один сіаловокислотний компонент. L305V/V158D/E296V/M298Q-FVII, В одному варіанті втілення аспарагін-зв'язані L305V/V158T/E296V/M298Q-FVII, олігосахаридні ланцюги розташовуються в позиціL305V/V158T/FG37A/M298Q-FVII, ях, які відповідають амінокислотним залишкам L305V/V158T/E296V/K337A-FVII, Asn-145 та Asn-322 людського FVIIa дикого типу L305V/V158D/K337A/M298Q-FVII, (Фіг.). L305V/V158D/E296V/K337A-FVII, В одному варіанті втілення серин-зв'язані оліL305V/V158D/E296V/M298Q/K337A-FVII, госахаридні ланцюги розташовуються в позиціях, L305V/V158T/E296V/M298Q/K337A-FVII, які відповідають амінокислотним залишкам Ser-52 S314E/K316H-FVII, S314E/K316Q-FVII, та Ser-60 людського FVIIa дикого типу (Фіг.). S314E/L305V-FVII, S314E/K337A-FVII, В одному варіанті втілення полімери вибираS314E/V158D-FVII, S314E/E296V-FVII, ють із групи, яка включає: поліалкіленоксид (РАО), S314E/M298Q-FVII, S314E/V158T-FVII, включаючи поліалкіленгліколь (PAG), такий як поK316H/L305V-FVII, K316H/K337A-FVII, ліетиленгліколь (ПЕГ) та поліпропіленгліколь K316H/V158D-FVII, K316H/E296V-FVII, (PPG), розгалужені ПЕГ, полівініловий спирт K316H/M298Q-FVII, K316H/V158T-FVII, (PVA), полікарбоксилат, полівінілпіролідон, поліK316Q/L305V-FVII, K316Q/K337A-FVII, етилен-ангідрид малеїнової кислоти, полістиролK316Q/V158D-FVII, K316Q/E296V-FVII, ангідрид малеїнової кислоти та декстран, включаK316Q/M298Q-FVII, K316Q/V158T-FVII, ючи карбоксиметил-декстран, поліуретан, поліесS314E/L305V/K337A-FVII, S314E/L305V/V158Dтер та поліамід. FVII, S314E/L305V/E296V-FVII, В одному варіанті втілення полімером є поліS314E/L305V/M298Q-FVII, S314E/L305V/V158Tетиленгліколь (ПЕГ); в одному варіанті втілення FVII, S314E/L305V/K337A/V158T-FVII, поліетиленгліколем є ПЕГ з молекулярною масою S314E/L305V/K337A/M298Q-FVII, 300-100000Да, наприклад, приблизно 500-20000Да S314E/L305V/K337A/E296V-FVII, або приблизно 500-15000Да, або 2-15кДа, або 3S314E/L305V/K337A/V158D-FVII, 15кДа, або 3-12кДа, або приблизно 10кДа. S314E/L305V/V158D/M298Q-FVII, В одному варіанті втілення поліпептид має S314E/L305V/V158D/E296V-FVII, амінокислотну послідовність Фактора VII дикого S314E/L305V/V158T/M298Q-FVII, типу (Фіг.). В одному варіанті втілення поліпептиди S314E/L305V/V158T/E296V-FVII, є Фактором VII дикого типу. S314E/L305V/E296V/M298Q-FVII, В одному варіанті втілення поліпептиди ФакS314E/L305V/V158D/E296V/M298Q-FVII, тора VII вибирають із групи, яка складається з: S314E/L305V/V158T/E296V/M298Q-FVII, S52А-Фактора VII, S60A-Фактора VII, Фактора VII, S314E/L305V/V158T/K337A/M298Q-FVII, який було протеолітично розщеплено між залишS314E/L305V/V158T/E296V/K337A-FVII, ками 290 та 291; Фактора VII, який було протеоліS314E/L305V/V158D/K337A/M298Q-FVII, тично розщеплено між залишками 315 та 316; ФаS314E/L305V/V158D/E296V/K337A-FVII, ктор VII, який було окиснено, L305V-FVII, S314E/L305V/V158D/E296V/M298Q/K337A-FVII, L305V/M306D/D309S-FVTI, L305I-FVII, L305T-FVII, S314E/L305V/V158T/E296V/M298Q/K337A-FVII, 11 86744 12 K316H/L305V/K337A-FVII, K316H/L305V/V158DF374Y/L305V/E296V/S314E-FVII, FVII, K16H/L305V/E296V-FVII, F374Y/L305V/M298Q/V158T-FVII, K316H/L305V/M298Q-FVII, K316H/L305V/V158TF374Y/L305V/M298Q/S314E-FVII, FVII, K316H/L305V/K337A/V58T-FVII, F374Y/L305V/V158T/S314E-FVII, K316H/L305V/K337A/M298Q-FVII, F374Y/K337A/S314E/V158T-FVII, K316H/L305V/K337A/E296V-FVII, F374Y/K337A/S314E/M298Q-FVII, K316H/L305V/K337A/V158D-FVII, F374Y/K337A/S314E/E296V-FVII, K316H/L305V/V158D/M298Q-FVII, F374Y/K337A/S314E/V158D-FVII, K316H/L305V/V158D/E296V-FVII, F374Y/K337A/V158T/M298Q-FVII, K316H/L305V/V158T/M298Q-FVII, F374Y/K337A/V158T/E296V-FVII, K316H/L305V/V158T/E296V-FVII, F374Y/K337A/M298Q/E296V-FVII, K316H/L305V/E296V/M298Q-FVII, F374Y/K337A/M298Q/V158D-FVII, K316H/L305V/V158D/E296V/M298Q-FVII, F374Y/K337A/E296V/V158D-FVII, K316H/L305V/V158T/E296V/M298Q-FVII, F374Y/V158D/S314E/M298Q-FVII, K316H/L305V/V158T/K337A/M298Q-FVII, F374Y/V158D/S314E/E296V-FVII, K316H/L305V/V158T/E296V/K337A-FVII, F374Y/V158D/M298Q/E296V-FVII, K316H/L305V/V158D/K337A/M298Q-FVII, F374Y/V158T/S314E/E296V-FVII, K316H/L305V/V158D/E296V/K337A-FVII, F374Y/V158T/S314E/M298Q-FVII, K316H/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/V158T/M298Q/E296V-FVII, K316H/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/E296V/S314E/M298Q-FVII, K316Q/L305V/K337A-FVII, K316Q/L305V/V158DF374Y/L305V/M298Q/K337A/S314E-FVII, FVII, K316Q/L305V/E296V-FVII, F374Y/L305V/E296V/K337A/S314E-FVII, K316Q/L305V/M298Q-FVII, K316Q/L305V/V158TF374Y/E296V/M298Q/K337A/S314E-FVII, FVII, K316Q/L305V/K337A/V158T-FVII, F374Y/L305V/E296V/M298Q/K337A-FVIl, K316Q/L305V/K337A/M298Q-FVII, F374Y/L305V/E296V/M298Q/S314E-FVII, K316Q/L305V/K337A/E296V-FVII, F374Y/V158D/E296V/M298Q/K337A-FVII, K316Q/L305V/K337A/V158D-FVII, F374Y/V158D/E296V/M298Q/S314E-FVII, K316Q/L305V/V158D/M298Q-FVII, F374Y/L305V/V158D/K337A/S314E-FVII, K316Q/L305V/V158D/E296V-FVII, F374Y/V158D/M298Q/K337A/S314E-FVII, K316Q/L305V/V158T/M298Q-FVII, F374Y/V158D/E296V/K337A/S314E-FVII, K316Q/L305V/V158T/E296V-FVII, F374Y/L305V/V158D/E296V/M298Q-FVII, K316Q/L305V/E296V/M298Q-FVII, F374Y/L305V/V158D/M298Q/K337A-FVII, K316Q/L305V/V158D/E296V/M298Q-FVII, F374Y/L305V/V158D/E296V/K337A-FVII, K316Q/L305V/V158T/E296V/M298Q-FVII, F374Y/L305V/V158D/M298Q/S314E-FVII, K316Q/L305V/V158T/K337A/M298Q-FVII, F374Y/L305V/V158D/E296V/S314E-FVII, K316Q/L305V/V158T/E296V/K337A-FVII, F374Y/V158T/E296V/M298Q/K337A-FVII, K316Q/L305V/V158D/K337A/M298Q-FVII, F374Y/V158T/E296V/M298Q/S314E-FVII, K316Q/L305V/V158D/E296V/K337A-FVII, F374Y/L305V/V158T/K337A/S314E-FVII, K316Q/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/V158T/M298Q/K337A/S314E-FVII, K316Q/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/V158T/E296V/K337A/S314E-FVII, F374Y/K337A-FVII, F374Y/V158D-FVII, F374Y/L305V/V158T/E296V/M298Q-FVII, F374Y/E296V-FVII, F374Y/M298Q-FVII, F374Y/L305V/V158T/M298Q/K337A-FVII, F374Y/V158T-FVII, F374Y/S314E-FVII, F374Y/L305V/V158T/E296V/K337A-FVII, F374Y/L305V-FVII, F374Y/L305V/K337A-FVII, F374Y/L305V/V158T/M298Q/S314E-FVII, F374Y/L305V/V158D-FVII, F374Y/L305V/E296VF374Y/L305V/V158T/E296V/S314E-FVII, FVII, F374Y/L305V/M298Q-FVII, F374Y/E296V/M298Q/K337A/V158T/S314E-FVII, F374Y/L305V/V158T-FVII, F374Y/L305V/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A/S314E-FVII, F374Y/K337A/S314E-FVII, F374Y/K337A/V158TF374Y/L305V/V158D/E296V/M298Q/S314E-FVII, FVII, F374Y/K337A/M298Q-FVII, F374Y/L305V/E296V/M298Q/V158T/S314E-FVII, F374Y/K337A/E296V-FVII, F374Y/K337A/V158DF374Y/L305V/E296V/M298Q/K337A/V158T-FVII, FVII, F374Y/V158D/S314E-FVII, F374Y/L305V/E296V/K337A/V158T/S314E-FVII, F374Y/V158D/M298Q-FVII, F374Y/V158D/E296VF374Y/L305V/M298Q/K337A/V158T/S314E-FVII, FVII, F374Y/V158T/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/V158T/M298Q-FVII, F374Y/V158T/E296VF374Y/L305V/V158D/E296V/K337A/S314E-FVII, FVII, F374Y/E296V/S314E-FVII, F374Y/L305V/V158D/M298Q/K337A/S314E-FVII, F374Y/S314E/M298Q-FVII, F374Y/E296V/M298QF374Y/L305V/E296V/M298Q/K337A/V158T/S314EFVII, F374Y/L305V/K337A/V158D-FVII, FVII, F374Y/L305V/K337A/E296V-FVII, F374Y/L305V/V158D/E296V/M298Q/K337A/S314EF374Y/L305V/K337A/M298Q-FVII, FVII, 852А-Фактора VII, S60A-Фактора VII; та F374Y/L305V/K337A/V158T-FVII, P11Q/K33E-FVII, T106N-FVII, K143N/N145T-FVII, F374Y/L305V/K337A/S314E-FVII, V253N-FVII, R290N/A292T-FVII, G291N-FVII, F374Y/L305V/V158D/E296V-FVII, R315N/V317T-FVII, K143N/N145T/R315N/V317TF374Y/L305V/V158D/M298Q-FVII, FVII; FVII, що має заміщення, включення або деF374Y/L305V/V158D/S314E-FVII, леції в амінокислотній послідовності від 233Thr до F374Y/L305V/E296V/M298Q-FVII, 240Asn, FVII, що має заміщення, включення або F374Y/L305V/E296V/V158T-FVII, делеції в амінокислотній послідовності від 304Arg 13 86744 14 до 329Cys, та FVII, що має заміщення, делеції, У ще одному аспекті винахід стосується сповключення в амінокислотній послідовності Ilel53собу лікування чутливого до Фактора VII синдрому, Arg223. спосіб включає введення фармацевтичної компоВ одному варіанті втілення пов'язані з Фактозиції, яка включає композицію, описану в пунктах ром VII поліпептиди вибирають із групи, яка скла1-22, пацієнтові, який потребує такого лікування, дається з: R152Е-Фактора VII, 8344А-Фактора VII, за умов, які в результаті забезпечують зниження FFR-Фактора VII та Фактора VIIa без Gla-домену. кровотечі та/або збільшення коагуляції крові. В одному варіанті втілення пов'язаний з ФакВ одному варіанті втілення синдром належить тором VII поліпептид виявляє принаймні приблиздо групи, яка складається з гемофілії А, гемофілії но 25%, в оптимальному варіанті - принаймні приВ, дефіциту Фактора XI, дефіциту Фактора VII, близно 50%, ще краще - принаймні приблизно тромбоцитопенії, хвороби фон Віллебранда, при75%, і найкраще - принаймні приблизно 90% спесутності інгібітора коагулюючого фактора, хірургічцифічної активності Фактора VIIa дикого тилу, який ної операції, травми, антикоагулянтної терапії, вироблявся в тому самому типі клітин, при випровключаючи дилюційну коагулопатію, крововиливу буванні в одному або кількох аналізах коагуляції, в мозок, трансплантації стовбурових клітин, кровоаналізі протеолізу або аналізі TF-зв'язування, як течі з верхніх відділів шлунково-кишкового тракту описано у представленому описі. та хвороби печінки. В одному варіанті втілення пов'язаний з ФакУ ще одному аспекті винахід стосується спотором VII поліпептид виявляє менше, ніж приблизсобу профілактики небажаної кровотечі, спосіб но 25%, в оптимальному варіанті - менше, ніж включає введення фармацевтичної композиції, яка приблизно 10%, ще краще - менше, ніж приблизно включає композицію, описану в пунктах 1-22, паці5%, і найкраще - менше, ніж приблизно 1% специєнтові, який потребує такого лікування, за умов, які фічної активності Фактора VIIa дикого типу, який в результаті забезпечують зниження кровотечі вироблявся в тому самому типі клітин, при випрота/або збільшення коагуляції крові. буванні в одному або кількох аналізах коагуляції, У ще одному аспекті винахід стосується споаналізі протеолізу або аналізі TF-зв'язування, як собу профілактики небажаної коагуляції крові, описано у представленому описі. спосіб включає введення фармацевтичної компоУ різних варіантах втілення кон'югований полізиції, яка включає композицію, описану в пунктах пептид виявляє біодоступність, яка становить при1-22, пацієнтові, який потребує такого лікування, наймні приблизно 110% біодоступності контрольза умов, ефективних для інгібування коагуляції. ної композиції, наприклад, принаймні приблизно В одному варіанті втілення небажана коагуля120%, або принаймні приблизно 130%, або приція крові є пов'язаною зі станом, який належить до наймні приблизно 140% біодоступності контрольгрупи, яка складається з: ангіопластики, тромбозу ної композиції. глибокої вени, легеневої емболії, інсульту, дисеміВ одному варіанті втілення кон'югований полінованої внутрішньосудинної коагуляції (DIC), відпептид виявляє півперіод у сироватці, який станокладення фібрину в легенях та нирках у зв'язку з вить принаймні приблизно 125% півперіоду контграм-негативною ендотоксемією, а також інфаркту рольної композиції, наприклад, принаймні міокарда. приблизно 150%, або принаймні приблизно 200%, У ще одному аспекті винахід стосується споабо принаймні приблизно 250% півперіоду контрособу профілактики опосередкованих тканинним льної композиції. фактором реакцій, спосіб включає введення фарВ одному варіанті втілення кон'югований полімацевтичної композиції, яка включає композицію, пептид одержують шляхом ферментної модифікаописану в пунктах 1-22, пацієнтові, який потребує ції сіалових або галактозних компонентів у поліпетакого лікування, за умов, ефективних для інгібуптиді. вання коагуляції. В іншому аспекті винахід стосується способу В одному варіанті втілення опосередковані одержання композиції за пунктом формули 1, спотканинним фактором реакції є пов'язаними зі стасіб включає етап контактування олігосахаридном, який належить до групи, яка складається з вмісного поліпептиду з молекулою полімеру за запалення, раку, росту пухлин, метастазу, ангіогеумов, у яких принаймні одна молекула полімеру є незу, SIRS, ALI, ARDS, MOF, HUS та ТТР. ковалентно зв'язаною з принаймні одним з олігоАвторами було виявлено, що композиції коасахаридних ланцюгів поліпептидів. гулюючих білків, які мають структури глікоформи, у У ще одному аспекті винахід стосується фаряких принаймні одна олігосахаридна груп є ковамацевтичної композиції, яка включає композицію, лентно зв'язаною з принаймні однією полімерною визначену в будь-якому з пунктів 1-22, та фармагрупою, такою як, наприклад, ПЕГ, мають поліпцевтично прийнятний носій або ад'ювант. шені функціональні властивості. Відповідним чиУ ще одному аспекті винахід стосується застоном, даний винахід стосується способів та компосування композиції, яка включає певну кількість зицій, які забезпечують ці композиції кон'югованих поліпептидів Фактора VII або пов'язаних з Фактобілків. Зокрема, винахід стосується композицій, які ром VII поліпептидів, у яких поліпептиди включавключають поліпептиди Фактора VII та пов'язані з ють аспарагін-зв'язані та/або серин-зв'язані олігоФактором VII поліпептиди, які мають структури сахаридні ланцюги, і принаймні одна аспарагін-зв'язаних (N-зв'язаних) та серинолігосахаридна група є ковалентно зв'язаною з зв'язаних (О-зв'язаних) олігосахаридів, ковалентно принаймні однією полімерною групою, для одерзв'язаних з принаймні однією полімерною групою. жання медикаменту для лікування чутливого до Композиції згідно з винаходом виявляють змінені Фактора VII синдрому. властивості, включаючи, крім інших, поліпшені 15 86744 16 фармакокінетичні властивості та поліпшену клініч[Див., наприклад, Vocadlo et al., In Вуглевод ну ефективність. Винахід також охоплює фармаChemistry and Biology, Vol 2, Wiley-VCH Verlag, цевтичні композиції, які включають ці композиції, а Germany (2000); Kodama et al., Tetrahedron Letters також терапевтичні способи, у яких застосовують 34:6419 (1993); Lougheed et al., J. Biol. Chem. ці композиції. 274:37717 (1999)]. Вжитий у даному контексті термін "ковалентне Способи та хімічні умови активації полімерів зв'язування" означає, що олігосахаридний компоописано в літературі. До загальновживаних спосонент та полімерна молекула є або прямо коваленбів активації полімерів належить активація функцітно зв'язаними одне з одним, або є непрямо коваональних груп ціаногенбромідом, перйодатом, лентно зв'язаними одне з одним через проміжний глутаральдегідом, біепоксидами, епіхлорогідрикомпонент або компоненти, наприклад, місток, ном, дивінілсульфоном, карбодиімідом, сульфоніспейсер або зв'язувальний компонент чи компонелгалідами, трихлоротриазином та ін. [див., напринти. клад, Taylor (1991), Protein Immobilization, Термін "кон'югат" або рівнозначний термін Fundamentals and Applications, Marcel Dekker, N.Y.; "кон'югатний поліпептид" означає гетерогенну Wong (1992), Chemistry of protein Conjugation and (композитну чи химерну) молекулу, утворену шляCrosslinking, CRC Press, Boca Raton; Hermanson et хом ковалентного зв'язування одного або кількох al., (1993), Immobilized Affinity Ligand Techniques, поліпептидів з однією або кількома молекулами Academic Press, N.Y.; Dunn et al., Eds. Polymeric полімеру. Drugs and Drug Delivery Systems, ACS Symposium Термін "полімерна молекула" або рівнозначні Series Vol. 469, American Chemical Society, 1991]. терміни "полімерна група" або "полімерний компоРеактивними групами та класами реакцій, які нент" або "молекула полімеру", охоплює молекулу, застосовують у практичному втіленні даного виназдатну з'єднуватися зі з'єднувальною групою поліходу, зазвичай є ті, які відбуваються за відносно пептиду. Вжитий у контексті кон'югату згідно з вим'яких умов. До них належать, крім інших, нуклеонаходом, він означає, що молекула (або компофільні заміщення (наприклад, реакція амінів та нент) полімеру є зв'язаним з поліпептидною спиртів з ацилгалідами, активними естерами), частиною кон'югату через з'єднувальну групу оліелектрофільні заміщення (наприклад, реакції енагосахаридного ланцюга глікопротеїну; в оптимальміну) та додавання до зв'язків вуглець-вуглець та ному варіанті молекула полімеру є приєднаною до вуглець-гетероатом (наприклад, реакція Майкла, сіаловокислотного компонента, який закриває олідодавання Дільса-Альдера). Ці та інші корисні регосахарид ("сіаловокислотної закриваючої групи"), акції описано, наприклад, у [публікаціях March, або до галактозного компонента. Advanced Organic Chemistry, 3rd edition, John Wiley Молекула полімеру є молекулою, утвореною & Sons, N.Y. 1985; Hermanson, Bioconjugate шляхом ковалентного зв'язування двох або кількох Techniques, Academic Press, San Diego, 1996; мономерів, причому жоден з мономерів не є аміFeeney et al., Modifications of Proteins, Advances in нокислотним залишком. Оптимальними полімераChemistry Series, Vol. 198, American Chemical ми є молекули полімерів, вибрані з групи, яка Society, 1982]. складається з поліалкіленоксиду (РАО), включаюРеактивні функціональні групи вибирають тачи поліалкіленгліколь (PAG), наприклад, поліетиким чином, щоб вони не брали участі й не заважаленгліколь (ПЕГ) та поліпропіленгліколь (PPG), ли реакціям, необхідним для з'єднання олігосахарозгалужені ПЕГ, полівініловий спирт (PVA), поліриду та полімерного компонента. В карбоксилат, полівінілпіролідон, поліетиленальтернативному варіанті реактивна функціональангідрид малеїнової кислоти, полістирол-ангідрид на група може бути захищена від участі у реакції малеїнової кислоти та декстран, включаючи карнаявністю захисної групи. Приклади корисних забоксиметил-декстран, причому особливу перевагу хисних груп див., наприклад, у [публікації Greene віддають ПЕГ. et al., Protective groups in Organic Synthesis, John Термін "з'єднувальна група" означає функціоWiley & Sons, N.Y, 1991]. нальну групу олігосахаридного компонента, здатну Загальні принципи зв'язування вуглеводів з приєднуватися до молекули полімеру. Корисними іншими молекулами є відомими з літератури [див., з'єднувальними групами є, наприклад, амін, гідронаприклад, Lee et al., Biochemistry 28:1856 (1989); ксил, карбоксил, альдегід, кетон, сульфгідрил, Bhatia et al., Anal. Biochem. 178:408 (1989); Janda сукцинімідил, малеїмід, вінілсульфон або галоацеet al., J.Am.Chem.Soc. 112:8886 (1990); та тат. Bednarski et al., WO 92/18135]. З'єднувальна група на олігосахаридному комТермін "природний сайт глікозилування" ознапоненті може бути активована перед реакцією з чає сайта глікозилування у позиціях Asn-145 полімером. В альтернативному варіанті група, (N145), Asn-322 (N322), Ser-52 (S52) та Ser-60 присутня на полімері, може бути активована перед (S60). Подібним чином, термін "природний in vivo реакцією з олігосахаридним компонентом. Активосайт О-глікозилування" охоплює позиції S52 та вана група, присутня на олігосахаридному або S60, тоді як термін "природний in vivo сайт Nполімерному компоненті, може бути у формі актиглікозилування" охоплює позиції N145 та N322. вованої відщеплюваної групи. Термін "функціональний in vivo півперіод" вжиТермін "активована відщеплювана група" оховають у його нормальному значенні, тобто він плює компоненти, які легко заміщуються в регуозначає час, протягом якого 50% біологічної актильованих органічними каталізаторами або фермевності поліпептиду або кон'югату зберігається в нтами реакціях заміщення. Активовані організмі/органі-мішені, або час, протягом якого відщеплювані групи є відомими спеціалістам. активність поліпептиду або кон'югату становить 17 86744 18 50% від початкового значення. Як альтернативу Термін "амінокислотні залишки, які відповідавизначенню функціонального in vivo півперіоду ють амінокислотним залишкам S52, S60, N145, визначають "півперіод у сироватці", тобто час, N322 з Фіг. (FVII wt.)" означає Asn та Ser амінокиспротягом якого 50% поліпептидних або кон'югатлотні залишки, які відповідають послідовності Факних молекул циркулюють у плазмі або потоці крові тора VII дикого типу (Фіг.), якщо послідовності виперш, ніж бути виведеними. Визначення півперіорівняти. Гомологію/ідентичність амінокислотних ду в плазмі часто буває простішим, ніж визначення послідовностей легко визначити за випрямленими функціонального півперіоду, і значення півперіоду послідовностями, застосовуючи відповідну комп'юв плазмі зазвичай дійсно відображає значення терну програму для випрямлення послідовностей, функціонального in vivo півперіоду. Альтернативнаприклад, програму ClustalW program, версія 1.8, ними термінами для півперіоду в сироватці є пів1999p. [Thompson et al., 1994, Nucleic Acid період у плазмі, циркуляційний півперіод, півперіод Research, 22: 4673-4680]. у системі кровообігу, кліренс із сироватки, кліренс Поліпептиди Фактора VIIта пов'язані з Фактоіз плазми та півперіод кліренсу. Поліпептид або ром VII поліпептиди кон'югат виводиться під дією однієї або кількох Даний винахід охоплює людські поліпептиди ретикулоендотеліальних систем (RES), нирки, сеФактора VII, наприклад, ті, що мають амінокислотлезінки або печінки, тканинним фактором, SECну послідовність, описану в патенті США рецептором або іншим опосередкованим рецепто№4,784,950 (Фактор VII дикого типу). Вжитий автором шляхом видалення, або специфічним чи нерами термін "Фактор VII" або "поліпептид Фактора специфічним протеолізом. Зазвичай кліренс залеVII" охоплює Фактор VII дикого типу, а також варіжить від розміру (відносно граничного значення анти Фактора VII, які виявляють практично таку для гломерулярної фільтрації), заряду, приєднасаму або поліпшену біологічну активність відносно них вуглеводних ланцюгів та присутності клітинних Фактора VII дикого типу. Термін "Фактор VII" охопрецепторів для білка. Функціональність, яка має лює поліпептиди Фактора VII у їхній нерозщеплезберігатися, зазвичай вибирають з-поміж прокоаній (зимогенній) формі, а також ті, які було протеогулянтної, протеолітичної, кофактор-зв'язувальної літично оброблено для одержання їх відповідних або рецептор-зв'язувальної активності. Функціонабіологічно активних форм, які можуть бути познальний in vivo півперіод та півперіод у сироватці чені як Фактор VIIa. Зазвичай Фактор VII розщепвизначають відповідним способом, відомим серед люють між залишками 152 та 153 для одержання спеціалістів, як детально обговорюється нижче Фактора VIIa. (див. Розділ Функціональні властивості композицій Вжитий авторами термін "пов'язані з Фактором Фактора VII). VII поліпептиди" охоплює поліпептиди, включаючи Термін "збільшений", вжитий стосовно функціваріанти, у яких біологічну активність Фактора VIIa онального in vivo півперіоду або півперіод у плазмі, було суттєво змінено або знижено відносно активзастосовують для позначення того, що відповідний ності Фактора VIIa дикого типу. До цих поліпептипівперіод поліпептиду або кон'югату є статистично дів належать, крім інших, Фактор VII або Фактор значно збільшеним відносно показника контрольVIIa, які були хімічно модифіковані, та варіанти ної молекули, наприклад, некон'югованого ФактоФактора VII, у які було введено зміни конкретних ра VIIa (наприклад, FVIIa дикого типу) при визнаамінокислотних послідовностей, які змінюють або ченні за порівнюваних умов. Наприклад, порушують біоактивність поліпептиду. відповідний півперіод може бути збільшений приБіологічна активність Фактора VIIa у коагуляції наймні на приблизно 25%, наприклад, принаймні походить від його здатності (і) зв'язуватися з ткана приблизно 50%, наприклад, принаймні на прининним фактором (TF) та (іі) каталізувати протеоблизно 100%, 150%, 200%, 250% або 500%. літичне розщеплення Фактора IX або Фактора X "Імуногенність" композиції стосується здатносдля вироблення активованого Фактора IX або X ті композиції, при введенні людині, викликати шкі(Фактора ІХа або Ха, відповідно). З точки зору видливу імунну реакцію, гуморальну, клітинну або й находу біологічна активність Фактора VIIa може ту, й іншу. Про поліпептиди Фактора VIIa та пов'ябути кількісно визначена шляхом вимірювання зані з Фактором VIIa поліпептиди не відомо, що здатності композиції сприяти коагуляції крові з вони викликають помітні імунні реакції в людини. застосуванням плазми без Фактора VII та тромбоНезважаючи на це, у будь-якій людській субпопупластину, як описано, наприклад, у патенті США ляції можуть існувати особи, які виявляють чутли№5,997,864. У цьому аналізі біологічну активність вість до конкретних введених білків. Імуногенність виражають як зменшення часу коагуляції відносно вимірюють шляхом кількісного визначення присутконтрольного зразка і перетворюють на "одиниці ності антитіл проти Фактора VII та/або чутливих до Фактора VII" шляхом порівняння з об'єднаним стаФактора VII Т-клітин у чутливої особи, застосовуюндартом людської сироватки, що містить 1од./мл чи традиційні способи, відомі спеціалістам у даній активності Фактора VII. В альтернативному варіангалузі. У деяких варіантах втілення композиції згіті біологічну активність Фактора VIIa кількісно видно з даним винаходом виявляють зменшення значають шляхом (і) вимірювання здатності Факімуногенності у чутливої особи принаймні приблитора VIIa виробляти Фактор Ха у системі, яка зно на 10%, в оптимальному варіанті - принаймні включає TF, вставлений у ліпідну мембрану та приблизно на 25%, ще краще - принаймні приблиФактор X. [Persson et al., J. Вiol. Chem. 272:19919зно на 40%, і найкраще - принаймні приблизно на 19924, 1997]; (іі) вимірювання гідролізу Фактора X 50% відносно імуногенності у цієї особи до конту водній системі (див. Приклад 5 нижче); (ііі) вимірольної композиції. рювання його фізичного зв'язування з TF з застосуванням інструмента на основі поверхневого пла 19 86744 20 змонного резонансу (Persson, FEBSLetts. 413:359було заміщено, та варіанти послідовності Фактора 363, 1997) (iv) вимірювання гідролізу синтетичного VII, у яких амінокислотний залишок у позиціях 315 субстрату (див. Приклад 4 нижче); та (ν) вимірюта/або 316 (з Фіг.), в оптимальному варіанті - 315, вання утворення тромбіну у TF-незалежній in vitro було заміщено. системі. Необмежувальними прикладами пов'язаних з До варіантів Фактора VII, які мають практично Фактором VII поліпептидів, які мають практично таку саму або поліпшену біологічну активність відтаку саму або поліпшену біологічну активність, що носно Фактора VII дикого типу, належать ті, що й Фактор VII дикого типу, також є: FVII варіанти, які виявляють принаймні приблизно 25%, в оптимамають збільшену біологічну активність порівняно з льному варіанті - принаймні приблизно 50%, ще FVIIa дикого типу, як описано у WO 01/83725, WO краще - принаймні приблизно 75%, і найкраще 02/22776, WO 02/77218, WO 03/27147 та WO принаймні приблизно 90% специфічної активності 03/37932, включаючи, крім інших, L305V-FVII, Фактора VIIa дикого типу, який вироблявся у тому L305V/M306D/D309S-FVII, L305I-FVII, L305T-FVII, самому типі клітин, при випробуванні в одному або F374P-FVII, V158T/M298Q-FVII, кількох аналізах коагуляції, аналізі протеолізу або V158D/E296V/M298Q-FVII, K337A-FVII, M298Qаналізі TF-зв'язування, як описано вище. ВаріанFVII, V158D/M298Q-FVII, L305V/K337A-FVII, тами Фактора VII, які мають значно знижену біолоV158D/E296V/M298Q/L305V-FVII, гічну активність відносно Фактора VII дикого типу, V158D/E296V/M298Q/K337A-FVII, є ті, що виявляють менше, ніж приблизно 25%, в V158D/E296V/M298Q/L305V/K337A-FVII, K157Аоптимальному варіанті - менше, ніж приблизно FVII, E296V-FVII, E296V/M298Q-FVII, 10%, ще краще - менше, ніж приблизно 5%, і найV158D/E296V-FVII, V158D/M298K-FVII, та S336Gкраще - менше, ніж приблизно 1% специфічної FVII, L305V/K337A-FVII, L305V/V158D-FVII, активності Фактора VIIa дикого типу, який виробL305V/E296V-FVII, L305V/M298Q-FVII, лявся у тому самому типі клітин, при випробуванні L305V/V158T-FVII, L305V/K337A/V158T-FVII, в одному або кількох аналізах коагуляції, аналізі L305V/K337AM298Q-FVII, L305V/K337A/E296Vпротеолізу або аналізі TF-зв'язування, як описано FVII, L305V/K337A/V158D-FVII, вище. До варіантів Фактора VII, які мають значно L305V/V158D/M298Q-FVII, L305V/V158D/E296Vзмінену біологічну активність відносно Фактора VII FVII, L305V/V158T/M298Q-FVII, дикого типу, належать, крім інших, варіанти ФактоL305V/V158T/E296V-FVII, L305V/E296V/M298Qра VII, які виявляють TF-незалежну протеолітичну FVII, L305V/V158D/E296V/M298Q-FVII, активність Фактора X, та ті, що зв'язуються з TF, L305V/V158T/E296V/M298Q-FVII, але не розщеплюють Фактор X. L305V/V158T/K337A/M298Q-FVII, До варіантів Фактора VII, які виявляють пракL305V/V158T/E296V/K337A-FVII, тично таку саму або кращу біоактивність, ніж у L305V/V158D/K337A/M298Q-FVII, Фактора VII дикого типу або, в альтернативному L305V/V158D/E296V/K337A-FVII, варіанті, виявляють суттєво змінену або знижену L305V/V158D/E296V/M298Q/K337A-FVII, біоактивність відносно Фактора VII дикого типу, L305V/V158T/E296V/M298Q/K337A-FVII, належать, крім інших, поліпептиди, які мають аміS314E/K316H-FVII, S314E/K316Q-FVII, нокислотну послідовність, яка відрізняється від S314E/L305V-FVII, S314E/K337A-FVII, послідовності Фактора VII дикого типу вставленS314E/V158D-FVII, S314E/E296V-FVII, ням, видаленням або заміщенням однієї або кільS314E/M298Q-FVII, S314E/V158T-FVII, кох амінокислот. K316H/L305V-FVII, K316H/K337A-FVII, Необмежувальними прикладами пов'язаних з K316H/V158D-FVII, K316H/E296V-FVII, Фактором VII поліпептидів, які мають практично K316H/M298Q-FVII, K316H/V158T-FVII, таку саму або поліпшену біологічну активність, що K316Q/L305V-FVII, K316Q/K337A-FVII, й Фактор VII дикого типу, є S52A-FVII, S60A-FVII K316Q/V158D-FVII, K316Q/E296V-FVII, [lino et al., Arch. Biochem. Biophys. 352: 182-192, K316Q/M298Q-FVII, K316Q/V158T-FVII, 1998]; L305V-FVII, L305V/M306D/D309S-FVII, S314E/L305V/K337A-FVII, S314E/L305V/V158DL355I-FVII, L305T-FVII, F374P-FVII, V158T/M298QFVII, S314E/L305V/E296V-FVII, FVII, V158D/E296V/M298Q-FVII, K337A-FVII, S314E/L305V/M298Q-FVII, S314E/L305V/Vl58TM298Q-FVII, V158D/M298Q-FVII, L305V/K337AFVII, S314E/L305V/K337A/V158T-FVII, FVII, V158D/E296V/M298Q/L305V-FVII, S314E/L305V/K337A/M298Q-FVII, V158D/E296V/M298Q/K337A-FVII, S314E/L305V/K337A/E296V-FVII, V158D/E296V/M298Q/L305V/K337A-FVII, K157AS314E/L305V/K337A/V158D-FVII, FVII, E296V-FVII, E296V/M298Q-FVII, S314E/L305V/V158D/M298Q-FVII, V158D/E296V-FVII, V158D/M298K-FVII та S336GS314E/L305V/V158D/E296V-FVII, FVII; FVIIa варіанти, які виявляють збільшену проS314E/L305V/V158T/M298Q-FVII, теолітичну стійкість, як описано у патенті США S314E/L305V/V158T/E296V-FVII, №5,580,560; Фактор VIIa, який було протеолітично S314E/L305V/E296V/M298Q-FVII, розщеплено між залишками 290 та 291 або між S314E/L305V/V158D/E296V/M298Q-FVII, залишками 315 та 316 [Mollerup et al., Biotechnol. S314E/L305V/V15817E296V/M298Q-FVII, Bioeng. 48:501-505, 1995]; окиснені форми Фактора S314E/L305V/V158T/K337A/M298Q-FVII, VIIa [Kornfelt et al., Arch. Biochem. Biophys. 363:43S314E/L305V/V158T/E296V/IG37A-FVII, 54, 1999], варіанти послідовності Фактора VII, у S314E/L305V/V158D/K337A/M298Qяких амінокислотний залишок у позиціях 290 FVII,S314E/L305V/V158D/E296V/K337A-FVII, та/або 291 (з Фіг.), в оптимальному варіанті - 290, S314E/L305V/V158D/E296V/M298Q/K337A-FVII, 21 86744 22 S314E/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/L305V/E296V/V158T-FVII, K316H/L305V/K337A-FVII, K316H/L305V/V158DF374Y/L305V/E296V/S314E-FVII, FVII, K316H/L305V/E296V-FVII, F374Y/L305V/M298Q/V158T-FVII, K316H/L305V/M298Q-FVII, K316H/L305V/V158TF374Y/L305V/M298Q/S314E-FVII, FVII, K316H/L305V/K337A/V158T-FVII, F374Y/L305V/V158T/S314E-FVII, K316H/L305V/K337A/M298Q-FVII, F374Y/K337A/S314E/V158T-FVII, K316H/L305V/K337A/E296V-FVII, F374Y/IC337A/S314E/M298Q-FVII, K316H/L305V/K337A/V158D-FVII, F374Y/K337A/S314E/E296V-FVII, K316H/L305V/V158D/M298Q-FVII, F374Y/K337A/S314E/V158D-FVII, K316H/L305V/V158D/E296V-FVII, F374Y/K337A/V158T/M298Q-FVII, K316H/L305V/V158T/M298Q-FVII, F374Y/K337A/V158T/E296V-FVII, K316H/L305V/V158T/E296V-FVII, F374Y/K337A/M298Q/E296V-FVII, K316H/L305V/E296V/M298Q-FVII, F374Y/K337A/M298Q/V158D-FVII, K316H/L305V/V158D/E296V/M298Q-FVII, F374Y/K337A/E296V/V158D-FVII, K316H/L305V/V158T/E296V/M298Q-FVII, F374Y/V158D/S314E/M298Q-FVII, K316H/L305V/V158T/K337A/M298Q-FVII, F374Y/V158D/S314E/E296V-FVII, K316H/L305V/V158T/E296V/K337A-FVII, F374Y/V158D/M298Q/E296V-FVII, K316H/L305V/V158D/K337A/M298Q-FVII, F374Y/V158T/S314E/E296V-FVII, K316H/L305V/V158D/E296V/K337A -FVII, F374Y/V158T/S314E/M298Q-FVII, K316H/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/V158T/M298Q/E296V-FVII, K316H/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/E296V/S314E/M298Q-FVII, K316Q/L305V/K337A-FVII, K316Q/L305V/V158DF374Y/L305V/M298Q/K337A/S314E-FVII, FVII, K316Q/L305V/E296V-FVII, F374Y/L305V/E296V/K337A/S314E-FVII, K316Q/L305V/M298Q-FVII, K316Q/L305V/V158TF374Y/E296V/M298Q/K337A/S314E-FVII, FVII, K316Q/L305V/K337A/V158T-FVII, F374Y/L305V/E296V/M298Q/K337A-FVII, K316Q/L305V/K337A/M298Q-FVII, F374Y/L305V/E296V/M298Q/S314E-FVII, K316Q/L305V/K337A/E296V-FVII, F374Y/V158D/E296V/M298Q/K337A-FVII, K316Q/L305V/K337A/V158D-FVII, F374Y/V158D/E296V/M298Q/S314E-FVII, K316Q/L305V/V158D/M298Q-FVII, F374Y/L305V/V158D/K337A/S314E-FVII, K316Q/L305V/V158D/E296V-FVII, F374Y/V158D/M298Q/K337A/S314E-FVII, K316Q/L305V/V158T/M298Q-FVII, F374Y/V158D/E296V/K337A/S314E-FVII, K316Q/L305V/V158T/E296V-FVII, F374Y/L305V/V158D/E296V/M298Q-FVII, K316Q/L305V/E296V/M298Q-FVII, F374Y/L305V/V158D/M298Q/K337A-FVII, K316Q/L305V/V158D/E296V/M298Q-FVII, F374Y/L305V/V158D/E296V/K337A-FVII, K316Q/L305V/V158T/E296V/M298Q-FVII, F374Y/L305V/V158D/M298Q/S314E-FVII, K316Q/L305V/V158T/K337A/M298Q-FVII, F374Y/L305V/V158D/E296V/S314E-FVII, K316Q/L305V/V158T/E296V/K337A-FVII, F374Y/V158T/E296V/M298Q/K337A-FVII, K316Q/L305V/V158D/K337A/M298Q-FVII, F374Y/V158T/E296V/M298Q/S314E-FVII, K316Q/L305V/V158D/E296V/K337A-FVIII, F374Y/L305V/V158T/K337A/S314E-FVII, K316Q/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/V158T/M298Q/K337A/S314E-FVII, K316Q/L305V/V158T/E296V/M298Q/K337A-FVII, F374Y/V158T/E296V/K337A/S314E-FVII, F374Y/K337A-FVII, F374Y/V158D-FVII, F374Y/L305V/V158T/E296V/M298Q-FVII, F374Y/E296V-FVII, F374Y/M298Q-FVII, F374Y/L305V/V158T/M298Q/K337A-FVII, F374Y/V158T-FVII, F374Y/S314E-FVII, F374Y/L305VAA158T/E296V/K337A-FVII, F374Y/L305V-FVII, F374Y/L305V/K337A-FVII, F374Y/L305V/V158T/M298Q/S314E-FVII, F374Y/L305V/V158D-FVII, F374Y/L305V/E296VF374Y/L305V/V158T/E296V/S314E-FVII, FVII, F374Y/L305V/M298Q-FVII, F374Y/E296V/M298Q/K337A/V158T/S314E-FVII, F374Y/L305V/V158T-FVII, F374Y/L305V/S314E-FVII, F374Y/V158D/E296V/M298Q/K337A/S314E-FVII, F374Y/K337A/S314E-FVII, F374Y/K337A/V158TF374Y/L305V/V158D/E296V/M298Q/S314E-FVII, FVII, F374Y/K337A/M298Q-FVII, F374Y/L305V/E296V/M298Q/V158T/S314E-FVII, F374Y/K337A/E296V-FVII, F374Y/K337A/V158DF374Y/L305V/E296V/M298Q/K337A/V158T-FVII, FVII, F374Y/V158D/S314E-FVII, F374Y/L305V/E296V/K337A/V158T/S314E-FVII, F374Y/V158D/M298Q-FVII, F374Y/V158D/E296VF374Y/L305V/M298Q/K337A/V158T/S314E-FVII, FVII, F374Y/V158T/S314E-FVII, F374Y/L305V/V158D/E296V/M298Q/K337A-FVII, F374Y/V158T/M298Q-FVII, F374Y/V158T/E296VF374Y/L305V/V158D/E296V/K337A/S314E-FVII, FVII, F374Y/E296V/S314E-FVII, F374Y/L305V/V158D/M298Q/K337A/S314E-FVII, F374Y/S314E/3/M298Q-FVII, F374Y/E296V/M298QF374Y/L305V/E296V/M298Q/K337A/V158T/S314EFVII, F374Y/L305V/K337A/V158D-FVII, FVII, F374Y/L305V/K337A/E296V-FVII, F374Y/L305V/V158D/E296V/M298Q/K337A/S314EF374Y/L305V/K337A/M298Q-FVII, FVII, S52A-Фактор VII, 860А-Фактор VII; та F374Y/L305V/K337A/V158T-FVII, P11Q/K33E-FVII, T106N-FVII, K143N/N145T-FVII, F374Y/L305V/K337A/S314E-FVII, V253N-FVII, R290N/A292T-FVII, G291N-FVII, F374Y/L305V/V158D/E296V-FVII, R315N/V317T-FVII, K143N/N145T/R315N/V317TF374Y/L305V/V158D/M298Q-FVII, FVII; FVII, що має заміщення, включення або деF374Y/L305V/V158D/S314E-FVII, леції в амінокислотній послідовності від 233Thr до F374Y/L305V/E296V/M298Q-FVII, 240Asn, FVII, що має заміщення, включення або 23 86744 24 ги не мають антенних фукозних залишків; і обидва делеції в амінокислотній послідовності від 304Arg з N-зв'язаних ланцюгів є майже повністю сіалілодо 329Cys, та FVII, що має заміщення, делеції, ваними, тобто кінцевий цукор кожної антени є Nвключення в амінокислотній послідовності Ilel53ацетилнейраміновою кислотою, зв'язаною з галакArg223. Необмежувальними прикладами пов'язаних з тозою через зв'язок a2->3 або a2->6. Фактором VII поліпептидів, які мають значно зниОднак, при виробленні за інших обставин Факжену або змінену біологічну активність відносно тор VII може містити олігосахаридні ланцюги, які Фактора VII дикого типу, є R152E-FVIIa [Wildgoose мають інші кінцеві структури на одній або кількох із et al., Biochem 29:3413-3420, 1990], S344A-FVIIa їх антен, наприклад, такі, що не мають сіаловокис[Kazama et al., J. Biol. Chem. 270:66-72, 1995], FFRлотних залишків; такі, що мають ΝFVIIa [Hoist et al., Eur. J. Vase. Endovasc. Surg. гліколілнейраміновокислотні (Neu5Gc) залишки; 15:515-520, 1998], Фактор VIIa без Gla-домену такі, що мають кінцевий N-ацетилгалактозамінний [Nicolaisen et al., FEBS Letts. 317:245-249, 1993] та (GalNAc) залишок замість галактози; та інші. При Фактор VII, у якому Lys341 було заміщено Ala. Невиробленні, наприклад, у ВНK-клітинах, культивообмежувальними прикладами хімічно модифіковаваних у присутності телячої сироватки, композиції них поліпептидів Фактора VII та варіанти послідовФактора VII мають такі олігосахаридні структури: ності описано, наприклад, у патенті США 87-93% олігосахаридних ланцюгів містять принай№5,997,864. мні один сіаловокислотний залишок; 7-13% є нейГлікозидування тральними (не мають ніякої сіалової кислоти); 9Вжиті авторами терміни "характер" глікозилу16% містять принаймні один кінцевий галактозний вання або "структура", "розподіл" або "спектр" глізалишок; 19-29% містять принаймні один кінцевий коформи стосується представлення конкретних N-ацетилгалактозамінний залишок; і 30-39% місолігосахаридних структур у даній популяції поліпетять принаймні одну незакриту антену, тобто місптидів Фактора VII або пов'язаних з Фактором VII тять принаймні один кінцевий галактозний або Nполіпептидів. Необмежувальними прикладами ацетилгалактозамінний залишок. таких структур є відносна пропорція олігосахаридПри вироблені в інших типах клітин або за інних ланцюгів, які (і) мають принаймні один сіалоших умов культивування (у вільному від сироватвокислотний залишок; (іі) не мають жодного сіалоки, повністю хімічно визначеному середовищі), вокислотного залишку (тобто мають нейтральний композиція Фактора VII може мати такі олігосахазаряд); (ііі) мають принаймні один кінцевий галакридні структури [як описано у WO 02/29025]: тозний залишок; (iv) мають принаймні одну "незак(і) Приблизно 94-100% олігосахаридних ланриту" антену, тобто мають принаймні один кінцецюгів містять принаймні один сіаловокислотний вий галактозний або N-ацетилгалактозамінний залишок, наприклад, приблизно 94-99%, приблиззалишок; або (vi) мають принаймні одну фукозу, но 95-98% або приблизно 96-97%. У різних варіанзв'язану a1->3 з антенним N-ацетилглюкозамінним тах втілення принаймні приблизно 94%, 95%, 96% або 97% олігосахаридних ланцюгів містять призалишком. наймні один сіаловокислотний залишок. Вжитий авторами термін "олігосахаридний ла(ii) 6% або менше олігосахаридних ланцюгів є нцюг" стосується всієї структури олігосахаридів, нейтральними, наприклад, приблизно 1,5-6% або яка є ковалентно зв'язаною з одним амінокислотприблизно 2-4%. ним залишком. Фактор VII зазвичай є глікозилова(ііі) Менше, ніж приблизно 16%, в оптимальноним у Asn 145 та Asn 322 (N-зв'язане глікозилуму варіанті - менше, ніж приблизно 10% олігосахавання) і Ser-52 та Ser-60 (О-зв'язане ридних ланцюгів містять принаймні одну кінцеву глікозилування). N-зв'язаний олігосахаридний лангалактозу, наприклад, приблизно 6-10% або прицюг, присутній у Факторі VII, який виробляється в близно 8-9%; людині in situ, може бути дво-, три- або чотириан(iv) Менше, ніж приблизно 25%, в оптимальтенним, причому кожна антена має структуру ному варіанті - менше, ніж приблизно 10% олігосаNeu5Ac(a2->3 або a2->6)Gal(b1->4) GlcNAc, зв'яхаридних ланцюгів містять принаймні один кінцезану (b1->2, 4 або 6) з Man-залишком, який є зв'явий GalNAc-залишок, наприклад, приблизно 6-9% заним (a1->3 або 6) з Man(b1->4)GlcNAc(b1або приблизно 7-8%; >4)GlcNAc-Asn. (Neu5Ac означає N(ν) Менше, ніж приблизно 30, в оптимальному ацетилнейрамінову кислоту (сіалову кислоту), Gal варіанті - менше, ніж приблизно 25% олігосахариозначає галактозу, GlcNAc означає Nдних ланцюгів містять принаймні одну незакриту ацетилглюкозамін, і Man означає манозу). Олігоантену, наприклад, приблизно 11-23% або присахаридні ланцюги також можуть включати фукозні близно 12-18%; і залишки, які можуть бути зв'язані a1->6 з GlcNAc. (vi) Принаймні приблизно 2%, в оптимальному О-зв'язаний олігосахаридний ланцюг, присутваріанті - принаймні приблизно 5%, ще краще ній у Факторі VII, який виробляється у людині in принаймні приблизно 10% або 20%; і найкраще situ, є одноантенним з антеною Ser-52, що має принаймні приблизно 40% олігосахаридних ланцюструктуру Xyl-Xyl-Glc-Ser або Glc-Ser, та антеною гів містять принаймні одн фукозу, зв'язану a1->3 з Ser-60, що має структуру Neu5Ac(a2->3 або a2антенним N-ацетилглюкозамінним залишком (тоб>6)Gal(b1->4)GlcNAc-Fuc-Ser або Fuc-Ser (Fuc то Ν-ацетилглюкозамінним залишком, який є зв'яозначає фукозу, Glc означає глюкозу, і Хуl означає заним b1->2, 4 або 6 з Man-залишком). ксилозу). Крім того, ступінь сіалілування (тобто кількість Коли Фактор VII виробляється у людині in situ, сіаловокислотних залишків, приєднаних до кожнодеякі з N-зв'язаних олігосахаридних ланцюгів не го олігосахаридного ланцюга) може бути поліпшемають центральних фукозних залишків; усі ланцю 25 86744 26 ний шляхом піддавання композиції експресованого находом, може бути описана більш, ніж одним з (i)Фактора VII або пов'язаного з Фактором VII поліпе(vi). птиду in vitro ферментній обробці сіалілтрансфеКрім того, композиція, яка охоплюється винаразою та донорною молекулою сіалової кислоти, ходом, може бути описана одним або кількома (i)наприклад, як описано у US 6,399,336. Таким чи(vi) у комбінації з однією або кількома структурнином практично всі антени на олігосахаридних ланми особливостями. Наприклад, винахід охоплює цюгах можуть бути сіалілованими (тобто "закритикомпозиції, які включають поліпептиди Фактора VII ми" сіаловокислотним залишком). У деяких або пов'язані з Фактором VII поліпептиди, у яких випадках N-глюкани на пов'язаному з FVII або FVII сіаловокислотні залишки (Neu5Ac або Neu5Gc) є поліпептиді також не є повністю галактозилованизв'язаними з галактозою виключно у a2->3 конфіми, і етап галактозилування з застосуванням галагурації. Винахід також охоплює композиції, які ктозилтрансферази та донорного субстрату UDPвключають поліпептиди Фактора VII або пов'язані з галактози перед етапом сіалілування поліпшує Фактором VII поліпептиди, які містять фукозу, зв'явміст сіалової кислоти у продукті. зану a1->6 з центральним Ν-ацетилглюкозаміном, Автори винаходу одержали композиції Фактота/або фукозу, зв'язану a1->3 з антенним Nра VII, які містять олігосахаридні структури, що ацетилглюкозаміном. В одній серії варіантів втімістять принаймні одну полімерну групу, коваленлення композиції згідно з винаходом включають тно зв'язану з принаймні однією олігосахаридною Фактор VII або пов'язані з Фактором VII поліпептигрупою. В одному варіанті втілення композиції ди, у яких понад 99% олігосахаридних ланцюгів включають поліпептиди Фактора VII або пов'язані з містять принаймні один сіаловокислотний залишок Фактором VII поліпептиди, які мають одну або кіі (а) сіаловокислотні залишки є зв'язаними виклюлька таких структур глікоформи: чно у a2->3 конфігурації, і/або (б) існують фукозні (і) Приблизно 94-100% олігосахаридних ланзалишки, зв'язані з центральними Nцюгів містять принаймні один сіаловокислотний ацетилглюкозамінами, і/або (в) певна кількість залишок, наприклад, приблизно 94-99%, приблизантен закінчується в Ν-ацетилгалактозаміні. В одно 95-98% або приблизно 96-97%. У різних варіанному варіанті втілення винахід охоплює композитах втілення принаймні приблизно 94%, 95%, 96%, ції, які включають Фактор VIIa дикого типу, у яких 97%, 98 або 99% олігосахаридних ланцюгів міспонад 99% олігосахаридних ланцюгів містять притять принаймні один сіаловокислотний залишок. наймні один сіаловокислотний залишок і сіалово(іі) 6% або менше олігосахаридних ланцюгів є кислотні залишки є зв'язаними з галактозою винейтральними, наприклад, приблизно 0,5-6% або ключно у a2->3 конфігурації. В іншому варіанті 1,5-6% або приблизно 2-4% або 0,5-4% або 0,5втілення винахід охоплює композиції, які включа2%. ють Фактор VIIa дикого типу, у якому понад 99% (ііі) Менше, ніж приблизно 16%, в оптимальноолігосахаридних ланцюгів містять принаймні один му варіанті - менше, ніж приблизно 10% олігосахасіаловокислотний залишок, і принаймні деякі оліридних ланцюгів містять принаймні одну кінцеву госахаридні ланцюги включають Nгалактозу, наприклад, приблизно 6-10% або приацетилгалактозамін. близно 8-9%; Структуру N-зв'язаних та/або О-зв'язаних олі(iv) Менше, ніж приблизно 25%, в оптимальгосахаридів визначають, застосовуючи будь-який ному варіанті - менше, ніж приблизно 10% олігосаспосіб, відомий спеціалістам у даній галузі, вклюхаридних ланцюгів містять принаймні один кінцечаючи, крім інших: високоефективну рідинну хровий GalNAc залишок, наприклад, приблизно 6-9% матографію (HPLC); капілярний електрофорез або приблизно 7-8%; (СЕ); ядерний магнітний резонанс (NMR); мас(ν) Менше, ніж приблизно 30, в оптимальному спектрометрію (MS) з застосуванням способів іоніваріанті - менше, ніж приблизно 25% олігосахаризації наприклад, бомбардування швидкими атодних ланцюгів містять принаймні одну незакриту мами, електророзпилення або матричну лазерну антену, наприклад, приблизно 11-23% або приіонізацію десорбцією (MALDI); газову хроматограблизно 12-18%; і фію (GC); та обробку екзоглікозидазами у поєд(vi) Принаймні приблизно 2%, в оптимальному нанні з аніонообмінною (AIE)-HPLC, хроматографіваріанті - принаймні приблизно 5%, ще краще єю з виключенням за розміром (SEC), маспринаймні приблизно 10% або 20%; і найкраще спектроскопією (MS), гелевим електрофорезом принаймні приблизно 40% олігосахаридних ланцю(SDS-PAGE, CE-PAGE), ізоелектрофокусуванням у гів містять принаймні одну фукозу, зв'язану a1->3 з гелях або капілярним електрофорезом з ізоелектантенним N-ацетилглюкозамінним залишком (тоброфокусуванням (CE-IEF). [Див., наприклад, Weber то Ν-ацетилглюкозамінним залишком, який є зв'яet al., Anal. Biochem. 225:135 (1995); Klausen et al., заним b1->2, 4 або 6 з Man-залишком). J. Chromatog. 718:195 (1995); Morris et al., Mass Слід розуміти, що кожен з (i)-(vi) може предSpectrometry of Biological Materials, McEwen et al., ставляти окрему структуру глікоформи, яка охопeds., Marcel Dekker, (1990), pp. 137-167; Conboy et люється варіантами втілення даного винаходу, al., Biol. Mass Spectrom. 21:397, 1992; Hellerqvist, тобто структура глікоформи композиції згідно з Meth. Enzymol. 193:554 (1990); Sutton et al., Anal. даним винаходом, у якій принаймні одна полімерBiohcem. 318:34 (1994); Harvey et al., Organic Mass на група є ковалентно зв'язаною з принаймні одSpectrometry 29:752 (1994)]. ним олігосахаридом, може бути описана лише Після розкладення похідних від Фактора VII одним з (i)-(vi). В альтернативному варіанті струколігосахаридних ланцюгів із застосуванням вищетура глікоформи композиції, яка охоплюється визазначених способів (або будь-якого іншого способу, який дозволяє виділяти олігосахаридні ланцю 27 86744 28 ги, які мають різні структури) виділені зразки відангідриду малеїнової кислоти, декстрану, включаносять, наприклад, до однієї з груп (i)-(vi). Відносючи карбоксиметил-декстран, поліуретан, поліесний вміст кожного з (i)-(vi) розраховують як суму тер та поліамід, або будь-який інший полімер, олігосахаридів, віднесених до даної групи відносно придатний для зниження імуногенності та/або збізагального вмісту олігосахаридних ланцюгів у зральшення функціонального in vivo півперіоду та/або зку. півперіоду в сироватці. Взагалі, похідні від поліалНаприклад, застосовуючи AIE-HPLC, із компокіленгліколю полімери є біосумісними, нетоксичзиції рекомбінантного Фактора VII, що виробляєтьними, неантигенними і неімуногенними, мають ся у ВНК-клітинах [див., наприклад, Klausen et al., різні властивості розчинності у воді й легко секреMol. Biotechnol. 9:195, 1998] можна виділити 13 туються з живих організмів. або більше N-зв'язаних олігосахаридних піків. ПЕГ є оптимальною молекулою полімеру, П'ять піків (позначених 1-5 у Klausen et al.) не місоскільки вона має лише кілька реактивних груп, тять сіалової кислоти, тоді як вісім піків (позначені здатних до зшивання, порівняно, наприклад, із 6, 7 та 10-15) містять сіалову кислоту. полісахаридами, наприклад, декстраном. Зокрема, Слід розуміти, що у даному аналізі кількість та монофункціональний ПЕГ, наприклад, метоксипорозподіл ланцюгів, які містять сіалову кислоту, та ліетиленгліколь (mPEG) викликає інтерес, оскільки ланцюгів, які не містять сіалової кислоти, може хімія його з'єднання є відносно простою (існує лизалежати від (а) поліпептиду, який експресується; ше одна реактивна група для кон'югації зі з'єдну(б) типу клітин та умов культури; (в) будь-якої мовальними групами на олігосахариді). Отже, ризик дифікації структури глікоформи шляхом хімічної зшивання усувається, і утворені в результаті політа/або ферментної обробки після експресії та (г) пептидні кон'югати є більш гомогенними, і реакцію застосованого способу аналізу, який в результаті молекул полімерів з поліпептидом легше контроможе відповідним чином змінити структуру. лювати. У будь-якому разі, відразу після відокремлення Для здійснення ковалентного зв'язування моолігосахаридів, що містять сіалову кислоту, від лекул(и) полімеру(ів) з поліпептидом гідроксильні неолігосахаридних сполук, що містять сіалову кискінцеві групи молекули полімеру повинні бути в лоту, застосовують традиційні програми аналізу активованій формі, тобто з реактивними функціоданих для розрахунку площі під кожним піком; занальними групами (прикладами яких є первинні гальну площу під піками; та відсоток від загальної аміно-групи, гідразид (HZ), тіол, сукцинат (SUC), площі під піками, представлений конкретним піком. сукцинімідилсукцинат (SS), сукцинімідилсукцинаТаким чином, для конкретної композиції сума мід (SSA), сукцинімідилпропіонат (SPA), сукциніміплощ піків, що містять сіалову кислоту/загальної дилкарбоксиметилат (SCM), бензотриазолкарбоплощі під піками X 100 дає % показник сіалілуваннат (ВТС), N-гідроксисукцинімід (NHS), альдегід, ня для композиції згідно з даним винаходом (тобто нітрофенілкарбонат (NPC) та трезилат (TRES)). пропорція олігосахаридних ланцюгів, що містять Прийнятними молекулами активованих полімерів є принаймні один сіаловокислотний залишок). Подіті, що виробляються серійно, наприклад, компанібним чином може бути розрахований % ланцюгів, ями Shearwater Polymers, Inc., Huntsville, AL, USA, які не мають сіалової кислоти або принаймні однієї або PolyMASC Pharmaceuticals pic, UK. В альтергалактози або N-ацетилглюкозаміну. нативному варіанті молекули полімерів можуть Полімери бути активовані традиційними способами, відомиМолекулою полімеру, яка має бути з'єднана з ми спеціалістам у даній галузі, наприклад, як опиполіпептидом, може бути будь-яка прийнятна мосано у WO 90/13540. Конкретні приклади активолекула, наприклад, природний або синтетичний ваних лінійних або розгалужених молекул гомополімер або гетерополімер, зазвичай з молеполімерів для застосування у даному винаході кулярною масою у межах приблизно 300описано у [публікації Shearwater Polymers, Inc. 100000Да, наприклад, приблизно 500-20000Да, 1997 and 2000 Catalogs (Functionalized або приблизно 500-15000Да, або 2-15кДа, або 3Biocompatible Polymers for Research and 15кДа, або 3-12кДа, або приблизно 10кДа. Якщо Pharmaceuticals, Polyethylene Glycol and вживається термін "приблизно" у зв'язку з певною Derivatives), включеній авторами шляхом посиланмолекулярною масою, то слово "приблизно" ознаня]. чає приблизний середній розподіл молекулярної Конкретними прикладами активованих ПЕГмаси у даній полімерній композиції. полімерів є такі лінійні ПЕГ: NHS-ΠΕΓ (наприклад, Прикладами гомополімерів є поліспирти (тобSPA-ПЕГ, SSPA-ΠΕΓ, SBA-ΠΕΓ, SS-ΠΕΓ, SSA-ΠΕΓ, то полі-ОН), поліаміни (тобто полі-NH2) та полікаSC-ΠΕΓ, SG-ΠΕΓ та SCM-ΠΕΓ) і NOR-ΠΕΓ, ВТСрбонові кислоти (тобто полі-СООН). ГетерополіПЕГ, ЕРОХ-ПЕГ, NCO-ΠΕΓ, NPC-ΠΕΓ, CDI-ΠΕΓ, мером є полімер, який включає різні з'єднувальні ALD-ΠΕΓ, TRES-ΠΕΓ, VS-ΠΕΓ, IODO-ΠΕΓ та MALгрупи, наприклад, гідроксильну групу та амінну ΠΕΓ і розгалужені ПЕГ наприклад, PEG2-NHS та групу. описані у US 5,932,462 та US 5,643,575, обидва з Прикладами прийнятних молекул полімерів є яких є включеними авторами шляхом посилання. молекули полімерів, вибрані з групи, яка складаКрім того, у нижчезазначених публікаціях, включеється з поліалкіленоксиду (РАО), включаючи поліних авторами шляхом посилання, описано корисні алкіленгліколь (PAG), наприклад, поліетиленглімолекули полімерів та/або хімічні способи ПЕГіколь (ПЕГ) та поліпропіленгліколь (PPG), лювання: US 5,824,778, US 5,476,653, WO розгалужених ПЕГ, полівінілового спирту (PVA), 97/32607, ЕР 229,108, ЕР 402,378, US 4,902,502, полікарбоксилату, полівінілпіролідону, поліетиленUS 5,281,698, US 5,122,614, US 5,219,564, WO ангідриду малеїнової кислоти, полістирол92/16555, WO 94/04193, WO 94/14758, WO 29 86744 30 94/17039, WO 94/18247, WO 94/28024, WO Слід розуміти, що залежно від обставин, на95/00162, WO 95/11924, W095/13090, WO приклад амінокислотної послідовності поліпепти95/33490, WO 96/00080, WO 97/18832, WO ду, характеристики застосовуваної активованої 98/41562, WO 98/48837, WO 99/32134, WO ПЕГ-сполуки та конкретних умов ПЕГілювання, 99/32139, WO 99/32140, WO 96/40791, WO включаючи молярне співвідношення ПЕГ з поліпе98/32466, WO 95/06058, EP 439508, WO 97/03106, птидом, можна досягати різних ступенів ПЕГілюWO 96/21469, WO 95/13312, EP 921131, US вання, причому більш високого ступеня ПЕГілю5,736,625, WO 98/05363, EP 809996, US 5,629,384, вання зазвичай досягають при вищому WO 96/41813, WO 96/07670, US 5,473,034, US співвідношенні ПЕГ з поліпептидом. Однак ПЕП5,516,673, EP 605963, US 30 5,382,657, EP 510356, льовані поліпептиди, які утворюються в результаті EP 400472, EP 183503 та ЕР 154316. будь-якого процесу ПЕГілювання, зазвичай мають Кон'югацію олігосахаридних ланцюгів поліпепстохастичний розподіл поліпептидних кон'югатів, тиду та активованих молекул полімерів здійснюякі мають дещо різні ступені ПЕГілювання. ють шляхом застосування будь-якого традиційного У цікавому варіанті втілення винаходу поліпеспособу. Традиційні способи є відомими спеціалісптидний кон'югат згідно з даним винаходом вклютам у даній галузі. чає молекулу полімеру, ковалентно зв'язану з одСпеціалістові у даній галузі відомо, що спосіб нією з сіаловокислотних груп, розташованих на активації та/або хімічні способи кон'югації, які макінці олігосахаридної групи поліпептиду Фактора ють застосовуватися, залежать від з'єднувальVII, причому вищезгадана молекула полімеру є ної(их) групи (груп) олігосахариду(ів), а також фунєдиною молекулою полімеру, приєднаною до полікціональних груп молекули полімеру (наприклад, пептиду. В іншому варіанті втілення дві молекули аміну, гідроксилу, карбоксилу, альдегіду, кетону, полімерів є ковалентно зв'язаними з однією або сульфгідрилу, сукцинімідилу, малеїміду, вінілсукількома олігосахаридними групами поліпептиду льфону або галоацетату). Фактора VII; в інших варіантах втілення три, чотиСлід розуміти, що кон'югацію полімеру сплари, п'ять, шість або сім молекул полімерів є ковановано таким чином, щоб утворилася оптимальна лентно зв'язаними з поліпептидом Фактора VII. молекула щодо кількості приєднаних молекул поВ одному варіанті втілення поліпептид Фактолімерів, розміру та форми таких молекул (наприра VII є поліпептидом FVU дикого типу або поліпеклад, чи є вони лінійними, чи розгалуженими) та птидом FVIIa, показаним на Фіг.; в іншому варіанті місця (місць) приєднання в олігосахаридному(их) втілення поліпептид Фактора VII є пов'язаним з ланцюгу(ах). Молекулярну масу застосовуваного Фактором VII поліпептидом; в одному варіанті втіполімеру вибирають, наприклад, на основі потріблення пов'язаний з Фактором VII поліпептид є ваного ефекту, який має бути досягнутий. Наприріантом амінокислотної послідовності Фактора VII. клад, якщо первісною метою кон'югації є досягВ оптимальному варіанті такими поліпептиднення кон'югату, який має високу молекулярну ними кон'югатами є ті, які включають єдину молемасу (наприклад, для зниження ниркового кліренкулу ПЕГ. Зокрема, перевагу віддають лінійній або су), зазвичай бажано кон'югувати якомога менше розгалуженій молекулі ПЕГ з молекулярною мамолекул полімерів високої молекулярної маси для сою принаймні приблизно 5кДа, зокрема, приблиздосягнення потрібної молекулярної маси. но 10-25кДа, наприклад, приблизно 15-25кДа, наВинахід також передбачає з'єднання молекул приклад, приблизно 20кДа або приблизно 10кДа. полімерів з поліпептидом через лінкер. Придатні В оптимальному варіанті у кон'югаті згідно з лінкери є загальновідомими серед спеціалістів. винаходом кількість та молекулярну масу полімеОптимальним прикладом є ціануриновий хлорид рної молекули вибирають таким чином, щоб зага[Abuchowski et al., (1977), J. Biol. Chem., 252, 3578льна молекулярна маса, складена полімерною 3581; US 4,179,337; Shafer et al., (1986), J. Polym. молекулою, була у межах 5-25кДа, наприклад, у Sci. Polym. Chem. Ed., 24, 375-378]. Після кон'югамежах 10-25кДа, приблизно 5кДа, приблизно ції залишкові молекули активованих полімерів 10кДа, приблизно 15кДа або приблизно 20кДа. блокують способами, відомими спеціалістам у даСпособи одержання полімер-зв'язаних компоній галузі, наприклад, шляхом додавання первинзицій Фактора VII, які мають задану структуру оліного аміну до реакційної суміші, і утворені в регосахаридів зультаті молекули інактивованих полімерів Способи одержання композицій Фактора VII: видаляють відповідним способом. Такі способи є Фактор VII, варіанти Фактора VII або пов'язані з загальновідомими серед спеціалістів; [див., наприФактором VII поліпептиди одержують, застосовуюклад, March, Advanced Organic Chemistry, 3rd чи будь-яку придатну клітину-хазяїн, яка експресує edition, John Wiley & Sons, N.Y. 1985; Greene et al., глікозилований Фактор VII або пов'язані з ФактоProtective groups in Organic Synthesis, John Wiley & ром VII поліпептиди (тобто клітини-хазяї, здатні Sons, N.Y., 1991; Taylor (1991), Protein приєднуватися до олігосахаридних групу в сайтах Immobilization, Fundamentals and Applications, глікозилування поліпептиду). Фактор VII також моMarcel Dekker, N.Y.; Wong (1992), Chemistry of же бути виділений з плазми людини або інших protein Conjugation and CrosslinMng, CRC Press, видів. Boca Raton; Hermanson et al., (1993), Immobilized У деяких варіантах втілення клітини-хазяї є Affinity Ligand Techniques, Academic Press, N.Y.; людськими клітинами, які експресують ендогенний Dunn et al., Eds. Polymeric Drugs and Drug Delivery ген Фактора VII. У цих клітинах ендогенний ген Systems, ACS Symposium Series Vol. 469, American може бути інтактним або може бути модифіковаChemical Society, 1991]. ним in situ, або послідовність за межами гена Фактора VII може бути модифікованою in situ для змі 31 86744 32 ни експресії ендогенного гена Фактора VII. Може (а) культивування клітини, яка експресує Факбути застосована будь-яка людська клітина, здаттор VII або пов'язані з Фактором VII поліпептиди за на експресувати ендогенний ген Фактора VII. першої групи заданих умов культури; В інших варіантах втілення гетерологічні клі(б) видобування Фактора VII або пов'язаних з тини-хазяї є запрограмованими на експресію людФактором VII поліпептидів з культури для одерського Фактора VII з рекомбінантного гена. Клітижання композиції, яка включає поліпептиди; і ни-хазяї можуть бути клітинами хребетних, комах (в) аналіз структури олігосахаридів, зв'язаних з або грибків. В оптимальному варіанті клітини є поліпептидами, для визначення структури глікоклітинами ссавців, здатними на повний спектр Nформи. зв'язаного глікозилування у ссавців; О-зв'язаного Способи також можуть включати: (г1) зміна умов культури етапу (а) для досягглікозилування; та g-карбоксилування. Див., нанення другої групи заданих умов культури; приклад, Патент США №4,784,950. До оптималь(д1) повторення етапів (б)-(г1) до досягнення них ліній клітин ссавців належать лінії клітин СНО потрібної структури глікоформи; (АТСС CCL 61), COS-1 (АТСС CRL 1650), нирок (e1) контактування Фактор VII або пов'язаних з новонароджених хом'яків (ВНК) та НЕК293 [АТСС Фактором VII поліпептидів з молекулою полімеру CRL 1573; Graham et al., J. Gen. Virol. 36:59-72, за умов, у яких молекула полімеру є ковалентно 1977]. Оптимальною лінією клітин ВHК є лінія клізв'язаною з олігосахаридною групою поліпептиду. тин tk- ts13 BHK [Waechter and Baserga, В альтернативному варіанті способи також Proc.Natl.Acad.Sci.USA 79:1106-1110, 1982], які можуть включати: далі називаються клітинами ВНК 570. Лінію клітин (г2) хімічну та/або ферментну обробку компоВНК 570 отримують від Американського зібрання зиції для зміни структури олігосахаридів; і типових культур [American Type Culture Collection, (д2) повторення етапів (б)-(г2) до досягнення 12301 Parklawn Dr., Rockville, MD 20852] під інвенпотрібної структуру глікоформи. тарним номером АТСС CRL 10314. Лінію клітин tkЦі способи також можуть включати етап піддаts13 ВНК також можна отримати від АТСС під інвання композицій, які мають задані структури глівентарним номером CRL 1632. Крім того, може коформи принаймні одному випробуванню біоакбути застосовано багато інших ліній клітин, вклютивності (включаючи, наприклад, коагуляцію, чаючи клітини Rat Hep І (гепатома щура; АТСС протеоліз Фактора X або TF-зв'язування) або іншої CRL 1600), Rat Hep II (гепатома щура; АТСС CRL функціональності (наприклад, фармакокінетичного 1548), ТСМК (АТСС CCL 139), легенів людини профілю або стійкості) та кореляції конкретних (АТСС НВ 8065), NCTC 1469 (АТСС CCL 9.1) та структур глікоформи з конкретними профілями клітини DUKX (лінія клітин СНО) [Urlaub and біоактивності або функціональності з метою розпіChasin, Proc. Natl. Acad. Sci. USA 77:4216-4220, знання потрібної структури глікоформи. 1980]. (клітини DUKX також називають клітинами До змінних умов культури, які можуть бути зміСХВ11) та DG44 (лінія клітин СНО) [Cell, 33:405, нені на етапі (г1), належать, крім інших: клітина 1983, та Somatic Cell and Molecular Genetics походження, наприклад, клітина, яка походить від 12:555, 1986]. Також застосовують клітини 3Т3, виду, відмінного від первісно застосованого; або клітини Namalwa, мієломи та злиття мієлом з інмутантна або рекомбінантна клітина, яка має зміни шими клітинами. У варіанті втілення, якому віддав одній або кількох глікозилтрансферазах або гліють особливу перевагу, клітинами-хазяями є клікозидазах або інших компонентах матеріалу глікотини ВНК 21, які було адаптовано до росту за зилування [див. Grabenhorst et al., Glycoconjugate відсутності сироватки і які є запрограмованими на J. 16:81, 1999; Bragonzi et al., Biochem. Biophys. експресію Фактора VII. У деяких варіантах втіленAda 1474:273, 2000; Weikert, Nature Biotechnol. ня клітини можуть бути мутантними або рекомбі17:1116, 1999]; рівень експресії поліпептиду; метанантними клітинами, які експресують якісно або болічні умови, такі як, наприклад, концентрація кількісно інший спектр ферментів глікозилування глюкози або глутаміну; відсутність або присутність (таких як, наприклад, глікозилтрансферази та/або сироватки; концентрація вітаміну K; гідролізати глікозидази) порівняно з типом клітин, від якого білка, гормони, слідові метали, солі, а також паравони походять. Клітини також можуть бути запрогметри процесу, такі як температура, рівень розчирамовані на експресію інших гетерологічних пепненого кисню та рН. тидів або білків, включаючи, наприклад, зрізані Ферментна обробка, яка може бути застосоваформи Фактора VII. В одному варіанті втілення на на етапі (г2) для зміни олігосахаридної структуклітинами-хазяями є клітини СНО, запрограмовані ри композиції, включає, крім інших, обробку однією на спільну експресію як потрібного поліпептиду або кількома з сіалідаз (нейрамінідаз), галактозиФактора VII (тобто Фактора VII або пов'язаного з даз, фукозидаз; галактозилтрансфераз, фукозилтФактором VII поліпептиду), так і іншого гетерологірансфераз та/або сіалілтрансфераз у послідовночного пептиду або поліпептиду, такого як, напристі й за умов, які дозволяють досягти потрібної клад, модифікований фермент або фрагмент Факзміни у розподілі олігосахаридних ланцюгів, які тора VII. мають конкретні кінцеві структури. ГлікозилтрансСпособи одержання композиції Фактора VII, ферази серійно випускаються компанією що включає будь-яку зі структур глікоформи, опиCalbiochem (La Jolla, СА), а глікозидази серійно сані вище як (i)-(vi), та способи оптимізації розповипускаються компанією Glyko, Inc., (Novato, CA). ділу глікоформи Фактора VII та пов'язаних з ФакВ одній серії варіантів втілення клітини-хазяї, тором VII поліпептидів здійснюють, застосовуючи які експресують Фактор VII або пов'язаний з ним етапи: поліпептид, піддають дії певних умов культури, у 33 86744 34 потрібні обидва зв'язки. Тобто, сіалілування глікояких вони секретують глікозиловані поліпептиди протеїну здійснюють, застосовуючи, наприклад, Фактора VII, які мають потрібні олігосахаридні сіалілтрансферазний цикл, який включає синтетаструктури, описані вище як будь-які з (i)-(vi). До зу СМР-сіалової кислоти. Система СМРтаких умов культури належать, крім інших, зменрегенерації у цьому циклі включає цитидинмоношення або повна відсутність сироватки. В оптимафосфат (СМР), нуклеозидний трифосфат, фосфальному варіанті клітини-хазяї адаптують до росту тний донор, кіназу, здатну переносити фосфат від за відсутності сироватки і культивують за відсутфосфатного донора до нуклеозидних дифосфатів, ності сироватки як у фазі росту, так і у фазі виробта кіназу нуклеозидного монофосфату, здатну пелення. Такі процедури адаптації описано, наприреносити кінцевий фосфат від нуклеозидного клад, у [Scharfenberg, et al., Animal Cell Technology трифосфату до СМР. У регенеруючій системі таDevelopments towards the 21st Century, E. C. кож бере участь синтетаза СМР-сіалової кислоти, Beuvery et al. (Eds.), Kluwer Academic Publishers, яка переносить сіалову кислоту до СМР. У циклі pp. 619-623, 1995 (клітини ВНК та СНО); Cruz, сіалілування, СМР перетворюють на CDP за доBiotechnol. Tech. 11:117-120, 1997 (клітини комах); помогою кінази нуклеозидного монофосфату в Keen, Cytotechnol. 17:203-211,1995 (клітини мієлоприсутності доданого ATP. ATP каталітично вироми); Berg et al., Biotechniques 14:972-978, 1993 бляється з його побічного продукту, ADP, піруват(клітини нирок людини 293)]. В оптимальному вакіназою (РK) у присутності доданого фосфоенолріанті втілення середовище росту, яке додають до пірувату (PEP). CDP далі перетворюють на СТР, і клітин, не містить білка або іншого компонента, це перетворення каталізується РK у присутності виділеного з тваринної тканини або тваринної PEP. СТР реагує з сіаловою кислотою для утвокультури клітин. Див., наприклад, Приклад 1 нижрення неорганічного пірофосфату (РРі) та СМРче. Зазвичай, додатково до традиційних компоненсіалової кислоти, і остання реакція каталізується тів, середовище, придатне для вироблення Фактосинтетазою СМР-сіалової кислоти. Після сіалілура VII, містить вітамін K у концентрації 0,1-50мг/л, вання галактозилглюкозиду вивільнений СМР знояка вимагається для g-карбоксилування глутамінову надходить до регенеруючої системи для утвових залишків у Факторі VII. рення CDP, СТР та СМР-сіалової кислоти. В іншій серії варіантів втілення глікоформи виУтворений РРі очищується і утворює неорганічний робляють шляхом піддавання композиції Фактора фосфат як побічний продукт. Піруват також є побіVII або пов'язаних з Фактором VII поліпептидів чним продуктом. Через ізольований і циклічний ферментній та/або хімічній модифікації Nхарактер способу, за наявності всіх реагентів та зв'язаних та/або О-зв'язаних олігосахаридів, які в ферментів реакція триває, доки не витратиться них містяться, наприклад, піддавання композиції перший із субстратів (наприклад, вільний NeuAc та модифікації сіалілтрансферазою або галактозилтPEP або акцептор). Сіалілтрансферазні цикли рансферазою, як описано, наприклад, у US описано наприклад, у US 5,374,541 та US 6,399,336. В оптимальному варіанті модифікують 6,399,336. N-зв'язані олігосахариди. Сіалілтрансфераза здаАкцептори для сіалілтрансферази мають бути тна сіалілувати високий відсоток акцепторних груп присутніми на глікопротеїні, який підлягає модифі(наприклад, кінцевої галактози) на глікопротеїні. кації. Прийнятними акцепторами є, наприклад, Потрібного результату зазвичай досягають, застоGal(b1->4)GlcNAc-, Gal(b1->4)GalNAc-, Gal(b1совуючи приблизно 50 mU сіалілтрансферази на мг глікопротеїну або менше. Зазвичай олігосаха>3)GalNAc-, Gal(b1->3)GlcNAc-, Gal(b1->6)GlcNAc-, ридні ланцюги на глікопротеїні, які мають змінені Gal(b1->4)Glc- та інші акцептори, відомі спеціалістаким способом структури глікоформи, в результатам [див., наприклад, Paulson et al. (1978) J. Biol. ті мають більший відсоток сіалілованих кінцевих Chem. 253: 5617-5624]. Зазвичай олігосахаридні галактозних залишків, ніж необробленого поліпепланцюги включають рецептори, які приєднуються тиду. Практично 100% кінцевих галактозних залидо аспарагінових, серинових або треонінових зашків можуть бути сіалілованими після застосуванлишків, присутніх у поліпептиді. ня цих способів. Ці способи зазвичай дозволяють Глікопротеїн може бути "підрізаний", повністю досягти потрібного рівня сіалілування за приблизабо частково, для відкриття або акцептора для но 48 годин або менше. В оптимальному варіанті сіалілтрансферази, компонента, до якого можуть для глікозилування N-зв'язаних вуглеводів глікопдодаватися один або кілька відповідних залишків, ротеїнів сіалілтрансфераза має бути здатною педля одержання відповідного акцептора. Ферменти, реносити сіалову кислоту до послідовності Gal(b1наприклад, глікозилтрансферази та ендоглікози4)GlcNAc- як акцепторванням білка сіалілтрансферазному циклові, або навіть далі до рівня N-ацетилглюкозаміну шляхом на група, є ST3Gal III, ST3Gal IV та ST3Gal V (приподальшої обробки галактозидазами. Див., наприєднання NeuAc за допомогою зв'язку a2->3) і клад, Патент США №5,272,066, у якому описано ST6Gal І та ST6Gal II (приєднання NeuAc за допоспособи одержання поліпептидів, які мають придамогою зв'язку a2->6) (див. US 6,399,336). [Перелік тні акцептори для сіалілування. сіалілтрансфераз описано в публікації Tsuji et al., Способи ковалентного зв'язування молекул Glycobiology 6:v-xiv (1996)]. полімерів з поліпептидами Фактора VII: Таким чином, суміш двох ферментів може мати велике значення, якщо у кінцевому продукті 35 86744 36 Різні хімічні компоненти, наприклад, молекули полімерів, які застосовують при здійсненні даного винаходу, можуть бути ковалентно зв'язані з олігосахаридами на поліпептиді Фактора VII або шляхом хімічного синтезу, або шляхом ферментної обробки поліпептиду, наприклад, модифікованою сіаловою кислотою. Молекула полімеру також може бути з'єднана з олігосахаридом через лінкер. Придатні лінкери є загальновідомими серед спеціалістів. Прикладами є, крім інших, N-(4ацетилфеніл)малімід, активовані сукцимідиловим естером малімідо-похідні, наприклад, серійного дe виробництва сукцимідил 4-малімідобутаноат, 1,6- X є членами, незалежно вибраними з-поміж бісмалімідогексани. S, О, NH, або валентним зв'язком; Різні хімічні компоненти, наприклад, молекули - R1, R2, R3, R4 та R5 є членами, незалежно полімерів, які застосовують при здійсненні даного вибраними з-поміж Н, молекулою полімеру та лінвинаходу, можуть бути ковалентно зв'язані з сіакера, ковалентно зв'язаною з полімером, ацилом ловою кислотою, і таким чином "модифікована" (включаючи ацетил та гідроксиацетил) та алкілом; (або кон'югована) сіалова кислота після цього - M+ є катіоном, вибраним з-поміж Na+, K+, включається у сіалілтрансферазний цикл, в реLi+, тетрабутиламонієм або іншим подібним катіозультаті чого утворюється молекула полімеру, ном. ковалентно зв'язаного з глікопротеїном. Кон'югоВ оптимальному варіанті втілення R1 та R2 вану сіалову кислоту одержують традиційними незалежно є полімером на основі ПЕГ з масою 1способами, відомими спеціалістам у даній галузі. 40000кДа. Молекула полімеру також може бути з'єднана з У ще кращому варіанті втілення R1 незалежно сіаловою кислотою через лінкер. є полімером на основі ПЕГ з масою 1-40000кДа. Хемоферментативна дериватизація аналогів У прикладі варіанта втілення, представленому FVII та FVII на Схемі 1, амін-, 2-гідрокси- та карбоксилФосфонуклеотиди модифікованих цукрів, які захищену нейрамінову кислоту спочатку перетвозастосовують при практичному втіленні даного рюють на її 9-аміно-похідну згідно з [Isecke, R.; винаходу, можуть бути заміщені згідно з загальBrossmer, R., Tetrahedron 1994, 50(25), 7445-7460], ною формулою І та II: яку далі дериватизують за допомогою ПЕГ-СООН, застосовуючи стандартні умови з'єднання. ПЕГдериватизований продукт після цього піддають депротекції у м'яких кислотних умовах і ферментативно перетворюють на відповідний нуклеотидний цукор. 37 86744 38 В іншому прикладі варіанта втілення, представленому на Схемі 2, N-ацетилнейрамінову кислоту обробляють ПЕГ - дериватизованими тіокислота ми в умовах Міцунобу для одержання ПЕГдериватизованої N-ацетилнейрамінової кислоти, яку потім перетворюють на цукровий нуклеотид. У прикладі варіанта втілення, представленому на Схемі 3, тіол модифікованої галактози реагує з ПЕГ, що містить малеїмідний компонент. ПЕГ галактозну сполуку після цього перетворюють на відповідний нуклеотидний цукор ферментними або хімічними способами. В іншому прикладі варіанта втілення представленому на Схемі 4, 6-аміно галактоза [Fernandez, J. et al., J. Org. Chem. 1993, 58(19), 5192-5199] реагує з ПЕГ, що містить захищений амінокислотний компонент. Метиловий естер омилюють. ПЕГгалактозну сполуку після цього перетворюють на відповідний нуклеотидний цукор ферментними або хімічними способами. 39 86744 40 В іншому прикладі варіанта втілення представленому на Схемі 5, захищена 6-бромо-галактоза [Hodosi, G., Podanyi, В. and Kuszmann, J., Carbohydr. Res., 1992, 230(2), 327-342] реагує з ПЕГ, що містить тіольний компонент. Ізопропіліде нові групи видаляють у кислотних умовах. ПЕГгалактозну сполуку після цього перетворюють на відповідний нуклеотидний цукор ферментними або хімічними способами. В іншому прикладі варіанта втілення представленому на Схемі 6, захищена галактуронова кислота [Godage, Y.S. and Fairbanks, A.J., Tetrahedron Lett, 2000, 41(39), 7589-7594] реагує з ПЕГ, що містить амінний компонент. Ізопропіліденові групи видаляють у кислотних умовах. ПЕГ-галактозну сполуку після цього перетворюють на відповідний нуклеотидний цукор ферментними або хімічними способами. 41 В цілому цукрові нуклеотиди, наприклад, описані вище, можуть бути ферментативно перетворені на відповідні глікопротеїни, наприклад, пов'язаний з FVII або FVII поліпептид із застосуванням природних або мутованих глікозилтрансфераз, до яких, крім інших, належать: a2,3сіалілтрансферази, a2,6-сіалілтрансферази мбо b1,4-галактозилтрансферази. Залежно від вибору ПЕГ - дериватизованого цукрового нуклеотиду (CMP-SA-ΠΕΓ або UDP-Gal-ΠΕΓ), бажаною може бути обробка пов'язаного з FVII поліпептиду сіалідазою, галактозидазою, або і тією, й іншою, перед реакцією з глікозилтрансферазами та ПЕГ - дериватизованим цукровим нуклеотидом. Таким чином, в одному з оптимальних варіантів втілення аналог FVII обробляють сіалідазою для одержання аналога асіало-FVII, який згодом обробляють сіалілтрансферазою та аналогом CMP-SA-ΠΕΓ згідно з загальною формулою І для одержання ПЕГ - дериватизованого аналога FVII. В іншому варіанті втілення пов'язаний з FVII поліпептид послідовно обробляють спочатку сіалідазою, а потім галактозидазою для одержання пов'язаного з асіало агалакто FVII поліпептиду. Цей аналог після цього обробляють галактозилт 86744 42 рансферазою та аналогом UDP-Gal-ΠΕΓ згідно з загальною формулою II для одержання ПЕГ - дериватизованого аналога FVII. У серії варіантів втілення застосовують модифіковані галактозні сполуки, які є ковалентно зв'язаними з полімером або безпосередньо, або з застосуванням лінкера. Можна або застосувати Фактор VII або пов'язані з Фактором VII поліпептиди безпосередньо для одержання нижчого рівня полімеру на поліпептид, або спочатку обробити Фактор VII або пов'язані з Фактором VII поліпептиди сіалідазою для видалення кінцевих сіалових кислот з метою одержання вищого рівня полімеру на пептид. Шляхом обробки поліпептиду галактозидазою отримують точки приєднання для модифікованих галактозних сполук. Зв'язок між модифікованими галактозними сполуками та обробленим поліпептидом утворюють шляхом застосування UDP-активованої форми модифікованих галактозних сполук та галактозилтрансферази. Приклад варіанта втілення цього типу показано на Схемі 7, на якій чорне коло представляє Фактор VII або пов'язані з Фактором VII поліпептиди, і показано кінцеву частину кількох із вуглеводів. 43 Хімічна дериватизадія FVII та аналогів FVII Хімічне окиснення вуглеводних залишків із застосуванням перйодату натрію є альтернативним способом одержання кон'югатів FVII - ПЕГ. Хімічне окиснення вуглеводу зазвичай утворює багато реактивних альдегідних груп, кожна з яких здатна реагувати з ПЕГ-нуклеофілами, наприклад, ПЕГгідразидом, ПЕГ-О-гідроксиламіном та ПЕГаміном. З ПЕГ-гідразидом та ПЕГ-О-гідроксиламіном одержують, відповідно, стійкі кон'югати FVII-ПЕГацилгідразон та FVII-ПЕГ-оксим. З ПЕГ-амінами утворюються менш стійкий кон'югат основи Шиффа. Однак цей кон'югат може бути додатково стабілізований шляхом відновлення ціаноборогідридом натрію, і при цьому утворюється вторинний амінний зв'язок. Кон'югати FVII-ПЕГ-ацилгідразону також можуть бути відновлені ціаноборогідридом натрію, і при цьому утворюються Ν,Ν'-зв'язані гідразинові кон'югати. Очищення композицій гліко-кон'югованого Фактора VII Вжитий авторами термін "композиція Фактора VII" стосується певної кількості поліпептидів Фактора VII, поліпептидів Фактора VIIa або пов'язаних з Фактором VII поліпептидів, включаючи варіанти та хімічно модифіковані форми, які було відокремлено від клітини або реакційного середовища, в якому їх було синтезовано. Очищення композицій та кон 'югатів Фактора VII: Відокремлення одержаних рекомбінантним шляхом поліпептидів з клітин їх походження досягають будь-яким способом, відомим спеціалістам у даній галузі, включаючи, крім інших, відокремлення середовища культури клітин, що містить потрібний продукт, від культури прилипаючих клітин; 86744 44 центрифугування або фільтрацію для видалення неприлипаючих клітин та інші. Поліпептиди Фактора VII необов'язково можуть бути піддані подальшому очищенню. Очищення досягають, застосовуючи будь-який спосіб, відомий спеціалістам у даній галузі, включаючи, крім інших, афінну хроматографію, наприклад, на колонці з антитілом проти Фактора VII [див., наприклад, Wakabayashi et al., J. Biol. Chem. 261:11097, 1986; та Thim et al., Biochem. 27:7785, 1988]; хроматографію з гідрофобною взаємодією; іонообмінну хроматографію; хроматографію з виключенням за розміром; електрофоретичні процедури (наприклад, препаративне ізоелектрофокусування (IEF), диференціальну розчинність (наприклад, осадження сульфатом амонію) або екстрагування та інші. У загальних рисах їх описано у [Scopes, Protein Purification, Springer-Verlag, New York, 1982; та Protein Purification, J.-C. Janson and Lars Ryden, видавці VCH Publishers, New York, 1989]. Після очищення композиція в оптимальному варіанті містить менше, ніж приблизно 10% за масою, ще краще - менше, ніж приблизно 5%, і найкраще - менше, ніж приблизно 1% білків, які не належать до Фактора VII, одержаних із клітинихазяїна. Фактор VII та пов'язані з Фактором VII поліпептиди можуть бути активовані шляхом протеолітичного розщеплення з застосуванням Фактора XIIa або інших протеаз, які мають трипсиноподібну специфічність, наприклад, Фактора IXа, калікреїну, Фактора Ха та тромбіну. [Див., наприклад, Osterud et al., Biochem. 11:2853 (1972); Thomas, Патент США №4,456,591; та Hedner et al., J. Clin. Invest. 71:1836 (1983)]. В альтернативному варіанті Фактор VII активують шляхом його пропущення через колонку для іонообмінної хроматографії, напри 45 86744 46 піком агрегатів Фактора VII/загальну площу піків клад, Mono QÒ (Pharmacia) або іншу подібну колоФактора VII (мономер та агрегати). нку. Одержаний в результаті активований Фактор "Біодоступність" стосується пропорції введеної VII рецептують і вводять, як описано нижче. дози Фактора VII або пов'язаної з Фактором VII Функціональні властивості композицій Фактора композиції, яка може бути визначена у плазмі у VII заданий час після введення. Зазвичай біодоступКомпозиції поліпептидів Фактора VII та пов'яність вимірюють у піддослідних тварин шляхом заних з Фактором VII поліпептидів, які мають задавведення дози приблизно 25-250мкг/кг композиції; ні олігосахаридні структури з ковалентно зв'язаниотримання зразків плазми у заданий час після ми молекулами полімерів згідно з винаходом введення; та визначення вмісту Фактора VII або мають поліпшені функціональні властивості порівпов'язаних з Фактором VII поліпептидів у зразках із няно з контрольними композиціями. До поліпшених застосуванням одного або кількох аналізів коагуфункціональних властивостей, крім інших, можуть ляції (або будь-якого біоаналізу), імунологічного належати а) фізичні властивості, наприклад, стійаналізу, або іншого рівноцінного аналізу. Дані закість при зберіганні; б) фармакокінетичні властизвичай відображають графічно як залежність [Факвості, наприклад, біодоступність та півперіод; і в) тора VII] від часу і біодоступність виражають як імуногенність у людському організмі. площу під кривою (AUC). Відносна біодоступність Контрольна композиція є композицією, яка випробуваної композиції стосується співвідношенвключає поліпептид, який має амінокислотну поня між AUC випробуваної композиції та AUC контслідовність, ідентичну тій, що міститься у композирольної композиції. ції згідно з винаходом, з якою її порівнюють (приУ деяких варіантах втілення композиції згідно з кладом можуть бути некон'юговані форми Фактора даним винаходом виявляють відносну біодоступVII дикого типу або конкретний варіант або хімічно ність, яка становить принаймні приблизно 110%, модифікована форма), але не є кон'югованою з краще - принаймні приблизно 120%, ще краще будь-якою(ими) молекулою(ами) полімер(ів), що принаймні приблизно 130%, і найкраще - принайміститься (містяться) у композиції згідно з винахомні приблизно 140% біодоступності контрольної дом. Наприклад, контрольні композиції зазвичай композиції. Біодоступність вимірюють у будь-якого включають некон'югований Фактор VII дикого типу виду ссавців, в оптимальному варіанті - у собак, і або некон'юговані пов'язані з Фактором VII поліпезаданий час, який беруть для розрахунку AUC, птиди. може включати різні інкременти від 10хв до 8год. Стійкість при зберіганні композиції Фактора VII "Півперіод" стосується часу, який вимагається визначають шляхом вимірювання (а) часу, який для зменшення концентрації у плазмі поліпептидів вимагається для 20% послаблення біоактивності Фактора VII або пов'язаних з Фактором VII поліпекомпозиції при зберіганні у вигляді сухого порошку птидів з певного значення до половини цього знапри 25°С та/або (б) часу, який вимагається для чення. Півперіод визначають, застосовуючи таку подвоєння пропорції агрегатів Фактора VIIa у комсаму процедуру, як для біодоступності. У деяких позиції. варіантах втілення композиції згідно з даним винаУ деяких варіантах втілення композиції згідно з ходом мають збільшення півперіоду принаймні винаходом виявляють збільшення принаймні приприблизно 0,25год, краще - принаймні приблизно близно на 30%, краще - принаймні приблизно на 0,5год, ще краще - принаймні приблизно 1год, і 60%, ще краще - принаймні приблизно на 100%, найкраще - принаймні приблизно 2год відносно часу, який вимагається для 20% послаблення біопівперіоду контрольної композиції. активності порівняно з часом, який вимагається "Імуногенність" композиції стосується здатносдля такого самого явища у контрольній композиції, ті композиції, при введенні людині, викликати шкіколи обидві композиції зберігаються у вигляді судливу імунну реакцію, гуморальну, клітинну, або і хого порошку при 25°С. Вимірювання біоактивності ту, й іншу. Поліпептиди Фактора VIIa та пов'язані з здійснюють, застосовуючи аналіз коагуляції, анаФактором VIIa поліпептиди не викликають помітної ліз протеолізу, аналіз TF-зв'язування або аналіз імунної реакції у людини. Незважаючи на це, у TF-незалежного вироблення тромбіну. будь-якій людській субпопуляції можуть існувати У деяких варіантах втілення композиції згідно з особи, які виявляють чутливість до певних введевинаходом виявляють збільшення принаймні приних білків. Імуногенність вимірюють шляхом кількіблизно на 30%, краще - принаймні приблизно на сного визначення присутності антитіл проти Фак60%, ще краще - принаймні приблизно 100%, часу, тора VII та/або чутливих до Фактора VII Т-клітин у який вимагається для подвоєння агрегатів порівчутливої особи, застосовуючи традиційні способи няно з контрольною композицією, коли обидві комвідомі спеціалістам у даній галузі. У деяких варіанпозиції зберігаються у вигляді сухого порошку при тах втілення композиції згідно з даним винаходом 25°С. Вміст агрегатів визначають шляхом HPLC з виявляють зниження імуногенності у чутливої осопроникненням гелю на колонці Protein Рак 300 SW би, яке становить принаймні приблизно 10%, кра(7,5x300мм) (Waters, 80013) так, як описано далі. ще - принаймні приблизно 25%, ще краще - приКолонку врівноважують елюентом А (0,2Μ сульнаймні приблизно 40%, і найкраще - принаймні фату амонію, 5% ізопропанолу, рН доводять до 2,5 приблизно 50% відносно імуногенності контрольфосфорною кислотою, а потім рН доводять до 7,0 ної композиції у цієї особи. триетиламіном), після чого 25мкг зразка подають Фармацевтичні композиції на колонку. Елюювання з Елюентом А зі швидкістю Композиції згідно з даним винаходом застосопотоку 0,5мл/хв протягом 30хв та виявлення досявують для лікування від будь-якого чутливого до гають шляхом вимірювання оптичної густини при Фактора VII синдрому, наприклад, порушень кро215нм. Вміст агрегатів розраховують як площу під 47 86744 48 вотечі, включаючи, крім інших, викликані дефіцибути різною в широких межах, тобто від меншої, том фактора коагуляції (наприклад, гемофілію А та ніж приблизно 0,5% за масою, зазвичай від приВ або дефіцит факторів коагуляції XI або VII); наймні приблизно 1% за масою до 15 або 20% за тромбоцитопенією або хворобою фон Віллебранмасою, і її вибирають, насамперед, за об'ємом да, або інгібіторами коагулюючого фактора, або рідини, в'язкістю, і т. ін., згідно з конкретним вибнадмірною кровотечею з будь-якої причини. Комраним режимом введення. позиції також можуть вводитись пацієнтам у зв'язТаким чином, типова фармацевтична компоку з хірургічною операцією або іншою травмою або зиція для внутрішньовенного вливання може склапацієнтам, які отримують антикоагулянтну терадатися з 250мл стерильного розчину Рингера та пію. 10мг композиції. Існуючі способи одержання комКомпозиції, які включають пов'язані з Фактопозицій для парентерального введення є відомими ром VII поліпептиди згідно з винаходом, що мають або зрозумілими спеціалістам у даній галузі, і їх значно знижену біоактивність відносно Фактора VII детальніше описано, наприклад, у [Remington's дикого типу, можуть застосовуватись як антикоаPharmaceutical Sciences, 18th ed., Mack Publishing гулянти, наприклад, для пацієнтів, яких піддають Company, Easton, PA (1990)]. ангіопластиці або іншим хірургічним процедурам, Композиції, які містять композиції згідно з даякі можуть збільшити ризик тромбозу або закупоним винаходом, вводять для профілактичного рювання кровоносних судин, як це трапляється, та/або терапевтичного лікування. При терапевтичнаприклад, при рестенозі. Іншими медичними поному застосуванні композиції вводять суб'єктові, казаннями, при яких рекомендуються антикоагуякий уже страждає від хвороби, як описано вище, у лянти, є, крім інших, тромбоз глибокої вени, легекількості, достатній для лікування, послаблення нева емболія, інсульт, дисемінована або часткового призупинення хвороби та її усклавнутрішньосудинна коагуляція (DIC), відкладення днень. Кількість, достатня для цього, визначається фібрину в легенях та нирках у зв'язку з грамяк "терапевтично ефективна кількість". Ефективна негативною ендотоксемією, інфаркт міокарда; сикількість у будь-якому разі залежить від тяжкості ндром гострої дихальної недостатності (ARDS), хвороби або ушкодження, а також маси та загальсиндром системної запальної реакції (SIRS), гемоного стану суб'єкта. Однак в цілому ефективна літико-уремічний синдром (HUS), MOF та ТТР. кількість становить від приблизно 0,05мг до приФармацевтичні композиції, які включають Факблизно 500мг композиції на день для 70тор VII та пов'язані з Фактором VII композиції згідкілограмового суб'єкта, причому найчастіше застоно з даним винаходом, призначаються, насампесовують дози від приблизно 1,0мг до приблизно ред, для парентерального введення з метою 200мг композиції на день. Слід розуміти, що випрофілактичного та/або терапевтичного лікування. значення відповідної дози може бути досягнуте з В оптимальному варіанті фармацевтичні композизастосуванням загальноприйнятих експериментів, ції вводять парентерально, тобто внутрішньовеншляхом побудови матриці значень та випробуванно, підшкірно або внутрішньом'язово. Вони можуть ня різних точок у цій матриці. вводитися шляхом безперервного або пульсуючоМісцеве доставлення композиції згідно з даго вливання. ним винаходом, наприклад, місцеве нанесення, Фармацевтичні композиції або препарати здійснюють, наприклад, за допомогою аерозолю, включають композицію згідно з винаходом у комбіперфузії, подвійних балонних катетерів, стента, її нації, в оптимальному варіанті - є розчиненими у включають у судинні трансплантати або стенти, фармацевтично прийнятному носії, в оптимальнозастосовують гідрогелі для вкривання балонних му варіанті - водному носії або розріджувачі. Закатетерів, або іншими традиційними способами. У стосовують різні водні носії, наприклад, воду, бубудь-якому разі фармацевтичні композиції мають феровану воду, 0,4% розсіл, 0,3% гліцин та інші. забезпечувати кількість композиції, достатню для Композиції згідно з винаходом також можуть бути ефективного лікування суб'єкта. рецептовані у ліпосомні композиції для доставФармацевтичні композиції згідно з винаходом лення або спрямування у місця ушкодження. Ліпотакож можуть включати інші біологічно активні сомні композиції в загальних рисах описано, наагенти, наприклад, не пов'язані з Фактором VII приклад, у патентах США №№ 4,837,028, коагулянти або антикоагулянти. 4,501,728 та 4,975,282. Композиції можуть бути Композиції уповільненого вивільнення стерилізовані традиційними, загальновідомими Прикладами композицій уповільненого вивільспособами стерилізації. Одержані в результаті нення є напівпроникні матрикси з твердих гідроводні розчини розфасовують для застосування фобних полімерів, які містять поліпептид або кон'або фільтрують в асептичних умовах і ліофілізуюгат, причому матрикси мають придатну форму, ють, і ліофілізовані композиції перед введенням наприклад, плівки або мікрокапсул. Прикладами комбінують зі стерильним водним розчином. матриксів уповільненого вивільнення є поліестери, Композиції можуть містити фармацевтично гідрогелі (наприклад, полі(2-гідроксіетилприйнятні додаткові речовини або ад'юванти, метакрилат) або полівініловий спирт)), полілактивключаючи, крім інших, агенти, які регулюють рН, ди, співполімери L-глутамінової кислоти та етил-Lта буферуючі агенти та/або агенти, які регулюють глутамату, нерозкладний етиленвінілацетат, розтонус, наприклад, ацетат натрію, лактат натрію, кладні співполімери молочної кислоти-гліколевої хлорид натрію, хлорид калію, хлорид кальцію та кислоти, наприклад, одержані за технологією інші. ProLeaseÒ абог Lupron Depot@ (мікросфери для Концентрація Фактора VII або пов'язаних з Фаін'єкцій, які складаються зі співполімеру молочної ктором VII поліпептидів у цих композиціях може кислоти-гліколевої кислоти та лейпролід ацетату), 49 86744 50 та полі-D-(-)-3-гідроксимасляна кислота. Хоча поПЕПльовану похідну цитидин 5'-монофосфолімери, наприклад, етиленвінілацетат та молочна сіалової кислоти (CMP-SA-ΠΕΓ): метиловий естер кислота-гліколева кислота забезпечують вивільN-Ацетил-О2-метил-9-аміно-9-дезоксинення молекул протягом тривалого періоду, нанейрамінової кислоти (10мг, 0,031ммоль, одержаприклад, до 100 днів або більше, деякі гідрогелі ний згідно з [Isecke, R.; Brossmer, R., Tetrahedron вивільнюють білки протягом коротших періодів 1994, 50(25), 7445-7460]) розчиняють у воді (2мл) і часу. Коли інкапсульовані поліпептиди залишадодають mPEG-SBA (170мг, 0,03ммоль, 5кДа, ються в організмі протягом тривалого періоду чаShearwater 2M450H01). Суміш перемішують при су, вони можуть денатурувати або агрегувати в навколишній температурі до завершення згідно з результаті дії вологи при 37°С, що призводить до TLC. Розчинник видаляють шляхом ліофілізації і втрати біологічної активності та можливих змін залишок повторно розчиняють у суміші 1:1 метаімуногенності. Можуть бути розроблені раціональні нолу та розчину 0,1Μ NaOH (5мл). Суміш переміметодики для стабілізації залежно від задіяного шують при кімнатній температурі протягом 1год, механізму. Наприклад, якщо виявлено, що механіпотім пропускають через колонку зі смолою Dowex змом агрегації є утворення міжмолекулярного зв'я50W-X8 (H+) при 4°С і ліофілізують. Залишок після зку S-S через тіо-дисульфідний взаємний обмін, цього повторно розчиняють у воді (5мл), додають стабілізація може бути досягнута шляхом модифісмолу Dowex 50W-X8 (Η+) і суміш перемішують до кації сульфгідрильних залишків, ліофілізації з кисзавершення згідно з TLC. лотних розчинів, контролювання вологовмісту, Цитидин 5'-монофосфо-аналоги похідних сіазастосування відповідних додатків та розробки лової кислоти загальної формули І в цілому одерспеціальних композицій полімерних матриксів. жують згідно з [E.S.Simon, M.D.Bednarski and Представлені нижче необмежувальні приклаG.M.Whitesides, J.Am.Chem.Soc, 1998, 110,7159ди пояснюють деякі аспекти винаходу. 7163], як описано далі: синтетазу цитидин 5'Приклади монофосфонейрамінової кислоти розчиняють у Приклад 1 розчині 9-ПЕГільованій N-ацетил-9-аміно-9ГлікоПЕГілювання продукту з високим сіалодезокси-нейраміновій кислоті (одержаній, як опивим вмістом сано вище) і додають до розчину СТР. Суміш доПоліетиленгліколь-СМР-сіалову кислоту (ΠΕΓводять до рН 8,5 і додають MgCl2.6H2O. Реакційну CMPSA) одержують шляхом ковалентного зв'язусуміш перемішують при кімнатній температурі й вання ПЕГ з молекулярною масою 10000Да з сіадодають 1N NaOH через перистальтичний насос ловою кислотою. для підтримання рН близько 8,5. Коли 1Н-ЯМР на Фактор VIIa з 87-99% вмістом сіалової кислоти аліквотній кількості показує завершення, продукт обробляють сіалідазою, наприклад, як описано у виділяють шляхом стандартної іонообмінної хропатенті США №5,272,066, і повторно сіалілують матографії. сіалілтрансферазою, застосовуючи ΠΕΓ-CMPSA як Приклад 4 донорну молекулу (наприклад, як описано у патенFVIIa (1мг), розчинений у 1мл 0,1Μ ацетату ті США №6,399,336). Після того, як реакція ПЕГінатрію, рН 5,5, окиснюють до рівня його гліканів лювання досягає свого максимального включення, при кімнатній температурі протягом 30хв за доподо реакційної суміші додають CMPSA для захисту могою 10мМ перйодату натрію. Розчин після цього будь-якої відкритої кінцевої галактози. діалізують із 100мМ ацетату натрію, рН 5,5. Після Включення ПЕГільованої сіалової кислоти діалізу ПЕГ-С(О)-NHNH2 (одержаний шляхом гіданалізують шляхом SDS-PAGE, СЕ-PAGE, ізоелеразинолізу mPEG-SBA (2мг, 5кДа, Shearwater ктрофокусування у гелях та CE-IEF. 2М450Н01)) змішують з окисненим FVIIa і залишаВключають 94-100% сіалову кислоту; включають для реакції до наступного дня при кімнатній ють у середньому 1-4 ПЕГ-групи. температурі з легким збовтуванням. Одержаний Приклад 2 таким чином розчин кон'югату FVIIa-ΠΕΓ діалізуГлікоПЕГілювання продукту з середнім сіалоють (мембрани для діалізу 10кДа) із 100мМ буфевим вмістом ра Tris-HCl, рН 7,5 і зберігають при 4°С. Поліетиленгліколь-СМР сіалову кислоту (ΠΕΓФармакологічні способи CMPSA) одержують шляхом ковалентного зв'язуПредставлені нижче аналізи застосовують для вання ПЕГ з молекулярною масою 10000Да з сіавизначення біологічної активності, півперіоду та ловою кислотою. біодоступності Фактора VII та пов'язаних з ФактоФактор VIIa з 87-93% вмістом сіалової кислоти ром VII поліпептидів. обробляють сіалілтрансферазою, застосовуючи Аналіз (І) ΠΕΓ-CMPSA як донорну молекулу (наприклад, як In Vitro аналіз гідролізу описано у патенті США №6,399,336). Після того, як Представлений нижче спосіб застосовують реакція ПЕГілювання досягає свого максимальнодля визначення біоактивності Фактора VIIa. Аналіз го включення, до реакційної суміші додають здійснюють у мікротитрувальному планшеті CMPSA для захисту будь-якої відкритої кінцевої (MaxiSorp, Nunc, Denmark). Хромогенний субстрат галактози. D-IIe-Pro-Arg-p-нітроанілід (S-2288, Chromogenix, Включення ПЕГільованої сіалової кислоти Sweden) у кінцевій концентрації 1мМ додають до аналізують шляхом SDS-PAGE, CE-PAGE, ізоелеФактора VIIa (кінцева концентрація 100нМ) у 50мМ ктрофокусування у гелях та CE-EBF. Hepes, рН 7,4, що містить 0,1Μ NaCl, 5мМ СаСl2 та Включають 87-100% сіалову кислоту; включа1мг/мл альбуміну сироватки великої рогатої худоють у середньому 0,1-0,5 ПЕГ групи. би. Оптичнугустину при 405нм вимірюють безпеПриклад 3 рервно у зчитувальному пристрої для планшетів 51 86744 52 Вимірювання in vivo біологічного півперіоду SpectraMaxÔ 340 (Molecular Devices, USA). Оптичздійснюють багатьма способами, як описано в ліну густину, отриману під час 20-хвилинної інкубатературі. Приклад аналізу для вимірювання in vivo ції, після віднімання оптичної густини у порожній півперіоду rFVIIa та його варіантів описано під релунці, яка не містила ферменту, використовують єстраційним номером FDA 96-0597. Тобто, коагудля розрахунку співвідношення між активністю люючу активність FVIIa вимірюють у плазмі, взятої випробуваного та контрольного Фактора VIIa. до та під час 24-годинного періоду після введення Аналіз (II) кон'югату, поліпептиду або композиції. Вимірюють In Vitro аналіз протеолізу видимий середній об'єм розподілу в стійкому стані Представлений нижче спосіб застосовують й визначають середній кліренс. для визначення біоактивності Фактора VIIa. Цей Аналіз (IV) аналіз здійснюють у мікротитрувальному планшеті Біодоступність поліпептидів Фактора VII (MaxiSorp, Nunc, Denmark). Фактор VIIa (10нМ) та Біодоступність вимірюють, наприклад, у модеФактор X (0,8мкМ) у 100мкл 50мМ Hepes, pH 7,4, лі собаки таким чином: експерименти здійснюють що містить 0,1Μ NaCl, 5мМ СаСl2 та 1мг/мл альяк перехресне дослідження чотирьох ніг у 12 собак буміну сироватки великої рогатої худоби, інкубупороди бігль, розподілених на чотири групи. Усі ють протягом 15хв. Розщеплення Фактора X після тварини отримували випробувану композицію А та цього припиняють шляхом додавання 50мкл 50мМ контрольну композицію В у дозі приблизно 90мкг/кг Hepes, pH 7,4, що містить 0,1Μ NaCl, 20мМ EDTA у гліцилгліциновому буфері (рН 5,5), що містить та 1мг/мл альбуміну сироватки великої рогатої хлорид натрію (2,92мг/мл), дигідрат хлориду кальхудоби. Кількість утвореного Фактора Ха вимірюцію (1,47мг/мл), маніт (30мг/мл) та полісорбат 80. ють шляхом додавання хромогенного субстрату ZЗразки крові беруть через 10, 30 та 60 хвилин і D-Arg-Gly-Arg-p-нітроаніліду (S-2765, Chromogenix, через 2, 3, 4, 6 та 8 годин після первісного введенSweden), кінцева концентрація 0,5мМ. Оптичну ня. Плазму одержують зі зразків і кількість Фактора густину при 405нм вимірюють безперервно у зчиVII визначають шляхом ELISA. тувальному пристрої для планшетів SpectraMaxÔ Біодоступність кожного зразка виражають як 340 (Molecular Devices, USA). Оптичну густину, відрегульовану до дози площу під кривою конценотриману протягом 10 хвилин, після віднімання трації у плазмі для Фактора VII (AUC/доза). Віднооптичної густини у порожній лунці, яка не містила сну біодоступність виражають як співвідношення FVIIa, використовують для розрахунку співвідноміж середнім значенням AUC/доза випробуваної шення між протеолітичною активністю випробувата контрольної композиції X 100 і розраховують ного та контрольного Фактора VIIa. 90% довірчу межу для відносної біодоступності. Аналіз (III) Вимірювання функціонального in vivo півперіоду 53 86744 54 55 Комп’ютерна верстка О. Гапоненко 86744 Підписне 56 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPegylated factor vii glycoforms
Автори англійськоюKlausen Niels Kristian, Bjoern Soeren, Behrens Carsten, Garibay Patrick William
Назва патенту російськоюПегилированные гликоформы фактора vii
Автори російськоюКлаусен Нильс Кристиан, Бйорн Сьёрен, Бехренс Карстен, Гарибей Патрик Вильям
МПК / Мітки
МПК: A61K 38/36, A61K 47/48, A61P 7/04, A61P 7/02
Мітки: фактора, пегільовані, глікоформи
Код посилання
<a href="https://ua.patents.su/28-86744-pegilovani-glikoformi-faktora-vii.html" target="_blank" rel="follow" title="База патентів України">Пегільовані глікоформи фактора vii</a>
Попередній патент: Обмотувальний провід з мінералополімерною ізоляцією
Наступний патент: Спосіб виробництва соєвого молока
Випадковий патент: Регулятор витрат