Похідні циклогексиламіду арилкарбонової кислоти
Номер патенту: 97389
Опубліковано: 10.02.2012
Автори: Мільтц Вольфганг, Херспергер Рене, Янсер Філіпп
Формула / Реферат
1. Сполука формули (І) або її фармацевтично прийнятна сіль, складний ефір або проліки:
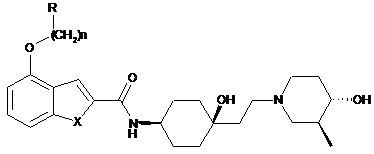 , (І)
, (І)
у якій:
X являє собою СН2 або NH;
n дорівнює 1 або 2;
R вибирають з групи, що включає С3-С18-циклоалкіл, С3-С18-гетероциклоалкіл, С3-C18-гетероарил, С3-С18-арил;
R включає необов'язково сконденсовану з ним групу В, вибрану з групи, що включає С3-С8-циклоалкіл, С3-С8-гетероциклоалкіл, С3-С8-арил та С3-С8-гетероарил;
та R та В обидві незалежно є незаміщеними або заміщені за допомогою R1, який являє собою одну або більшу кількість груп, незалежно вибраних з групи, що включає галоген, С1-С7-алкоксигрупу, оксогрупу, С1-С7-алкіл, С1-С7-алкоксі-С1-С7-алкоксигрупу, С2-С7-алкеніл, С2-С7-алкенілоксигрупу, аміногрупу, амінокарбоніл, карбамоїл, моно- або ді-С1-С7-алкіламіногрупу, гідроксигрупу, ціаногрупу, меркаптогрупу, С1-С7-алкоксикарбоніл, арил, гетероарил, карбоксигрупу, сульфаніл, сульфоніл; R1 в свою чергу є незаміщеним або заміщений однією або більшою кількістю груп, вибраних з групи, що включає галоген, гідроксигрупу, ціаногрупу, С1-С6-алкіл, С1-С6-алкоксигрупу, С2-С7-алкеніл, С2-С7-алкенілоксигрупу, аміногрупу, амінокарбоніл, карбамоїл, моно- або ді-С1-С7-алкіламіногрупу, гідроксигрупу, ціаногрупу, меркаптогрупу, С1-С7-алкоксикарбоніл, арил, гетероарил, карбоксигрупу.
2. Сполука за п. 1, у якій X являє собою NH.
3. Сполука за п. 1 або 2, у якій R являє собою С3-С18-гетероарил та R та В обидві незалежно є незаміщеними або заміщені за допомогою R1, як визначено в п. 1.
4. Сполука за будь-яким з попередніх пунктів, у якій R являє собою бензофураніл.
5. Сполука за будь-яким з попередніх пунктів, вибрана з групи, що включає:
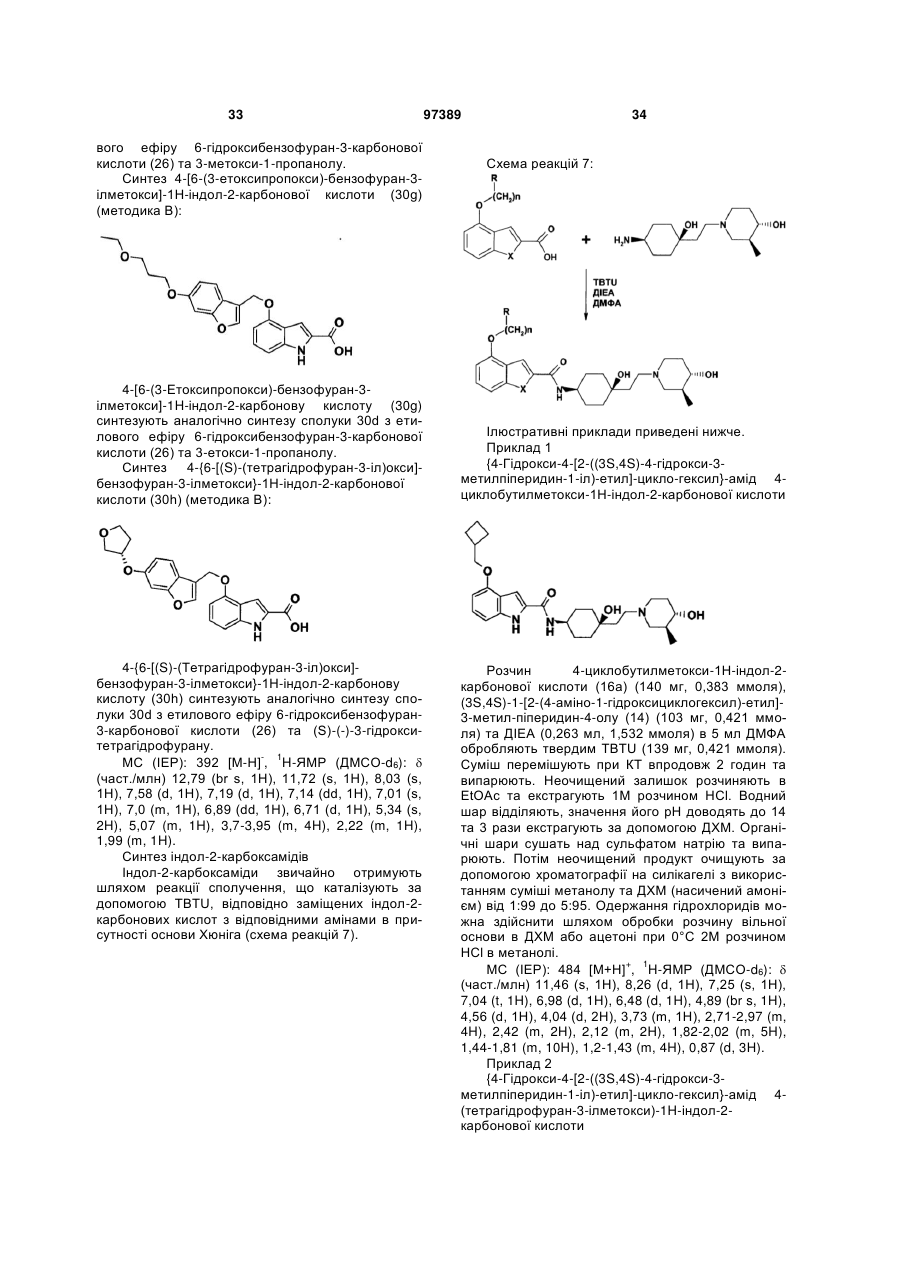
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-циклобутилметоксі-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(тетрагідрофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(фуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
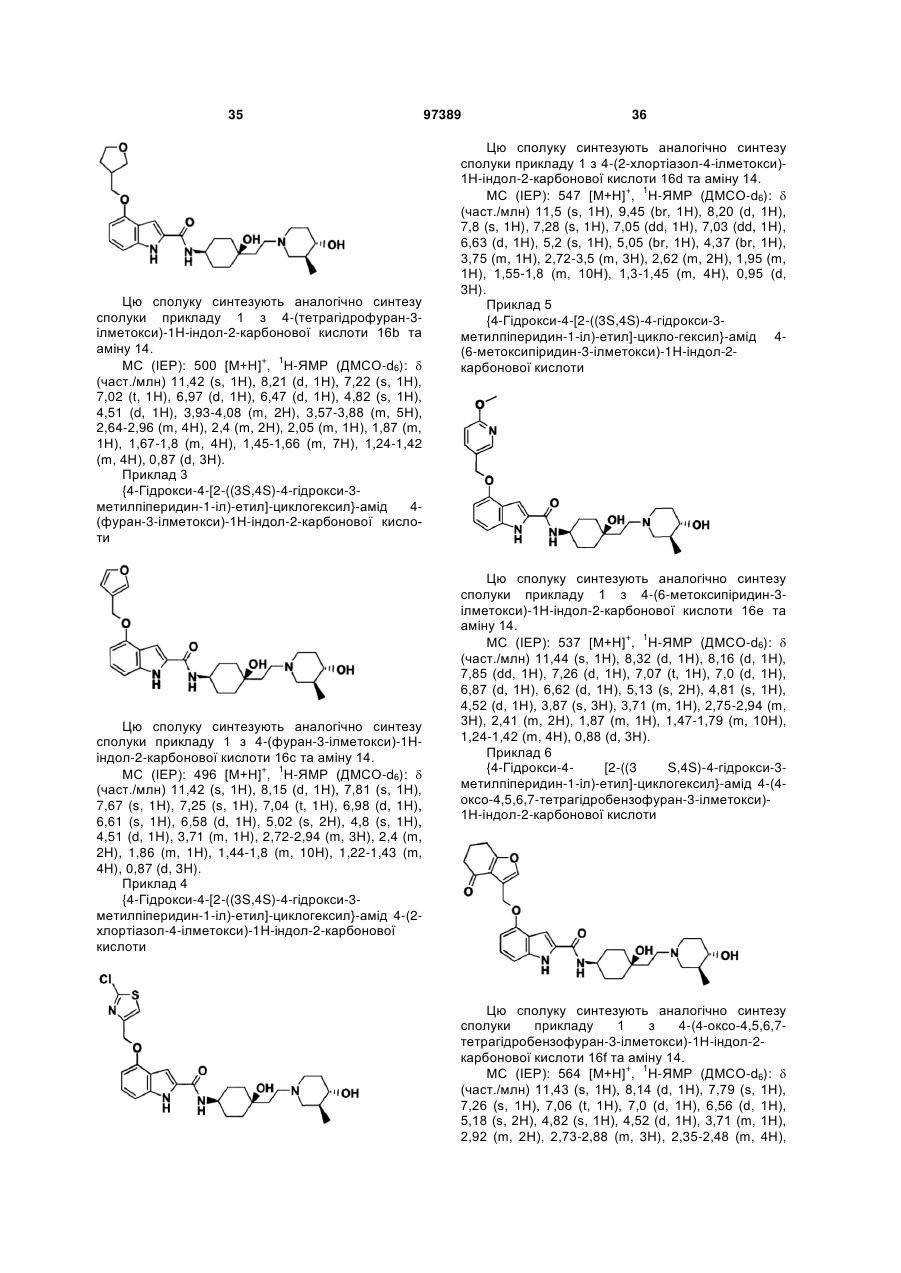
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(2-хлортіазол-4-ілметоксі)-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6-метоксипіридин-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
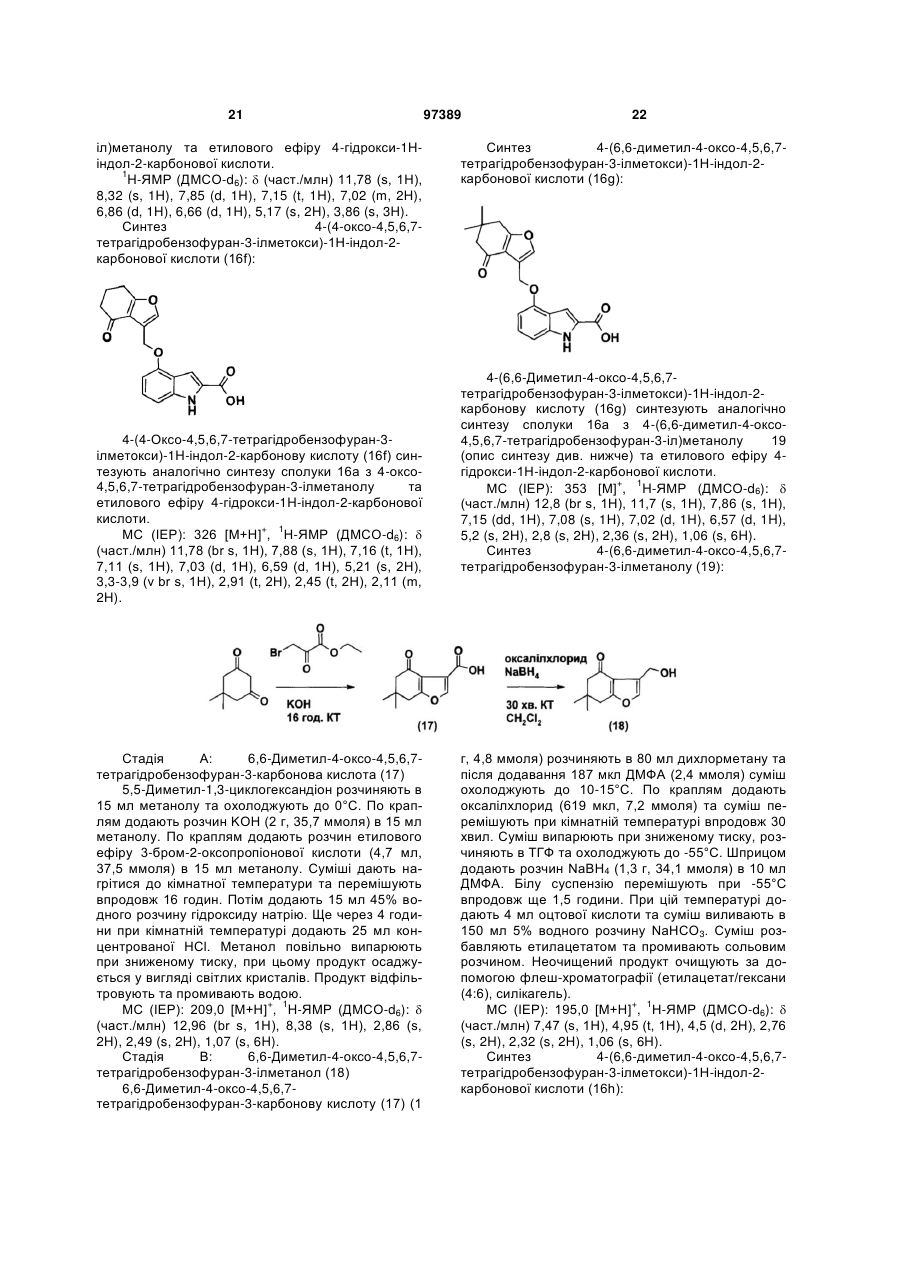
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(4-оксо-4,5,6,7-тетрагідробензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6,6-диметил-4-оксо-4,5,6,7-тетрагідробензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
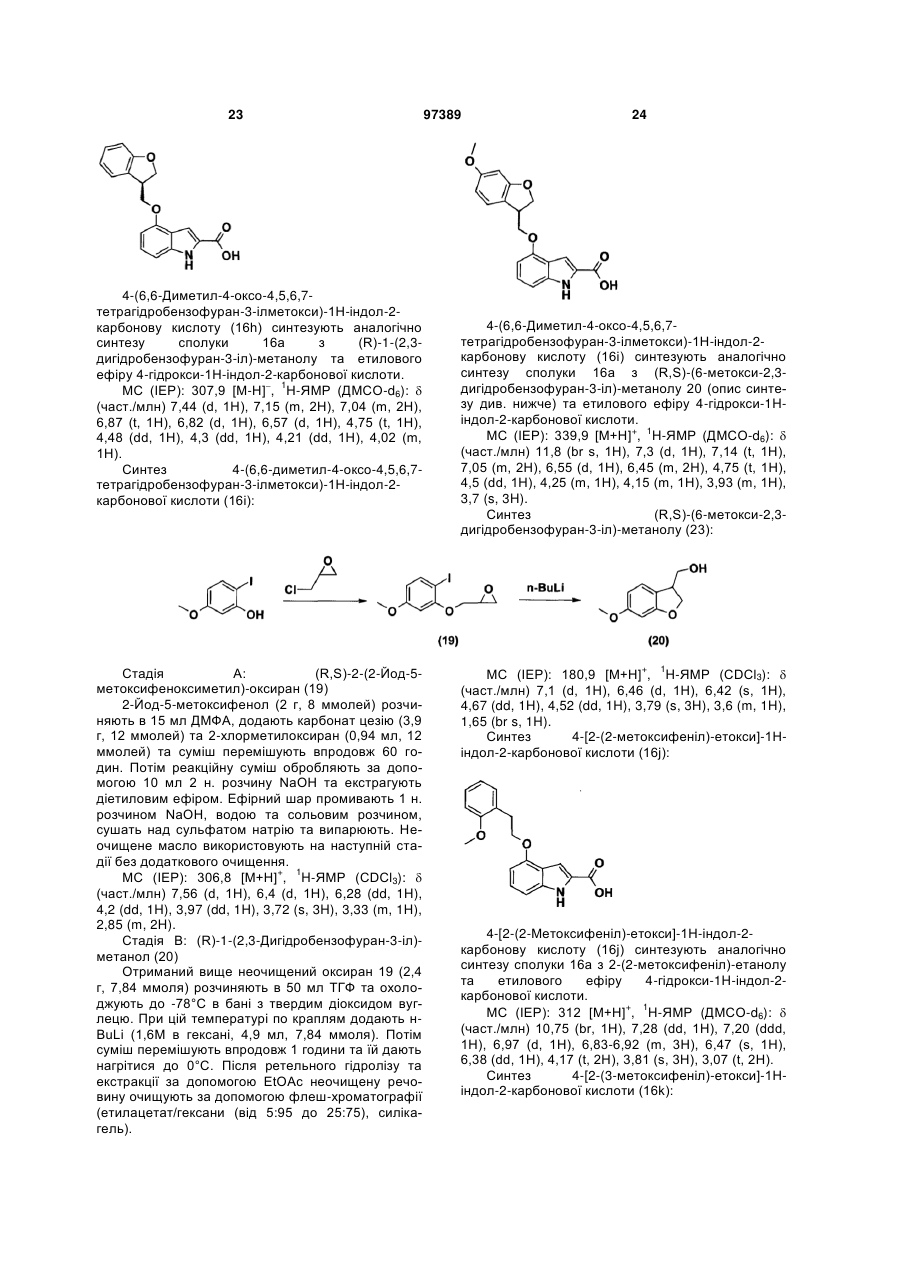
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[(S)-1-(2,3-дигідробензофуран-3-іл)метоксі]-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-((R,S)-6-метокси-2,3-дигідробензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(4-метоксибензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
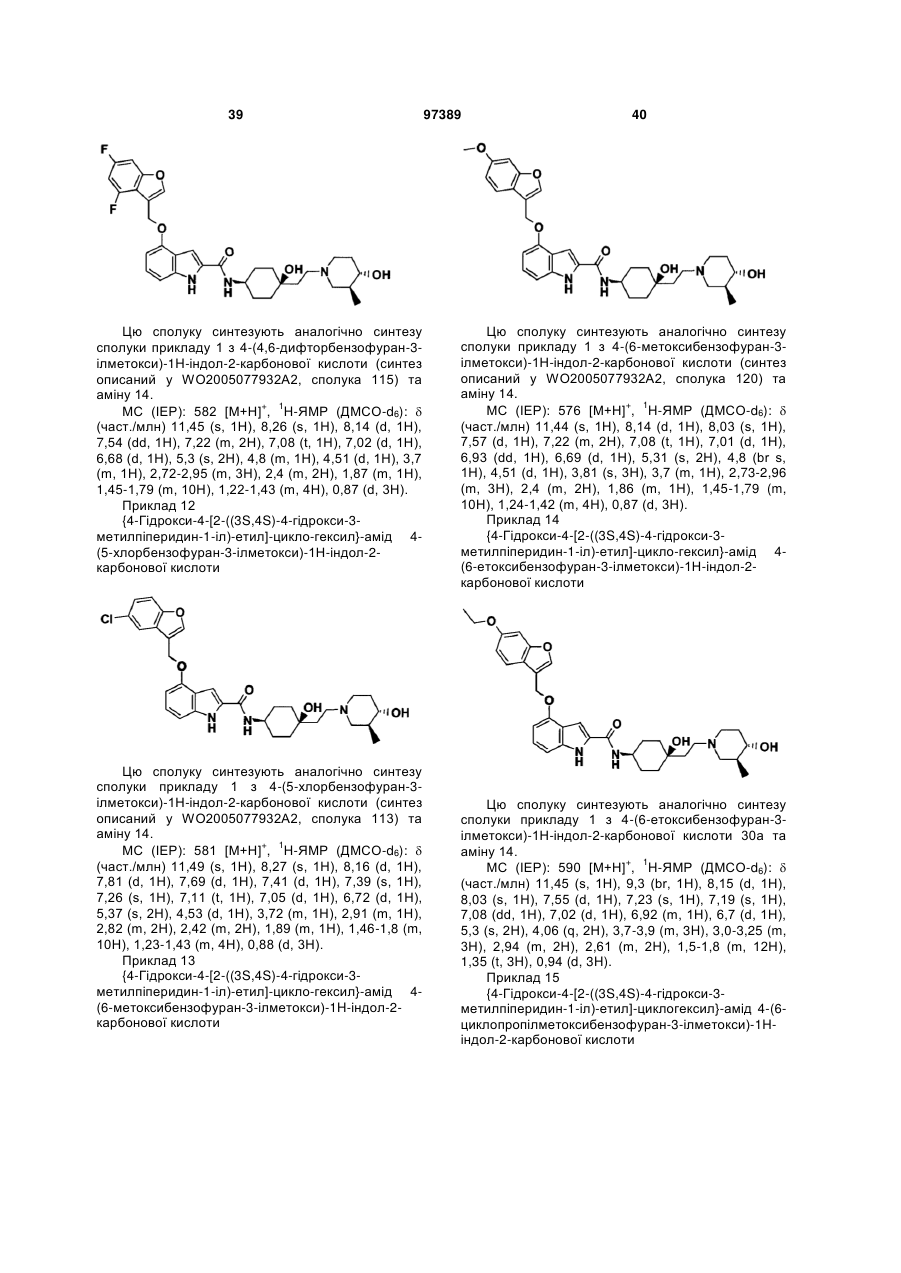
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(4,6-дифторбензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(5-хлорбензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6-метоксибензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6-етоксибензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
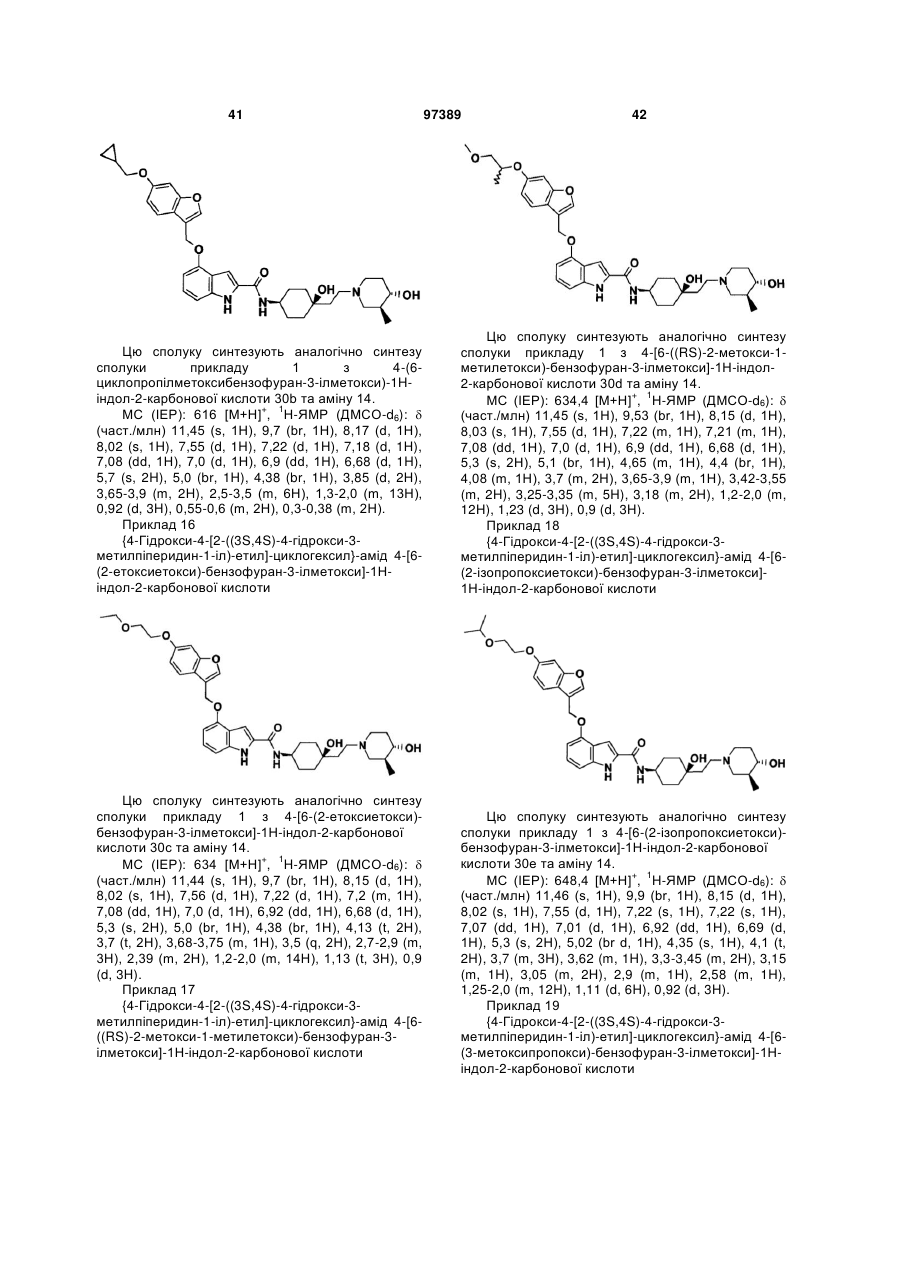
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6-циклопропілметоксибензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6-(2-етоксіетокси)-бензофуран-3-ілметоксі]-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6-((RS)-2-метокси-1-метилетокси)-бензофуран-3-ілметоксі]-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6-(2-ізопропоксіетокси)-бензофуран-3-ілметоксі]-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6-(3-метоксипропокси)-бензофуран-3-ілметоксі]-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6-(3-етоксипропокси)-бензофуран-3-ілметоксі]-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-{6-[(S)-(тетрагідрофуран-3-іл)окси]-бензофуран-3-ілметоксі}-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2--((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6-фторбензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(7-метоксибензофуран-3-ілметоксі)-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2-(2-метоксифеніл)-етоксі]-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2-(3-метоксифеніл)-етоксі]-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2-(4-метоксифеніл)-етоксі]-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2-(2-метоксипіридин-3-іл)-етоксі]-1Н-індол-2-карбонової кислоти,
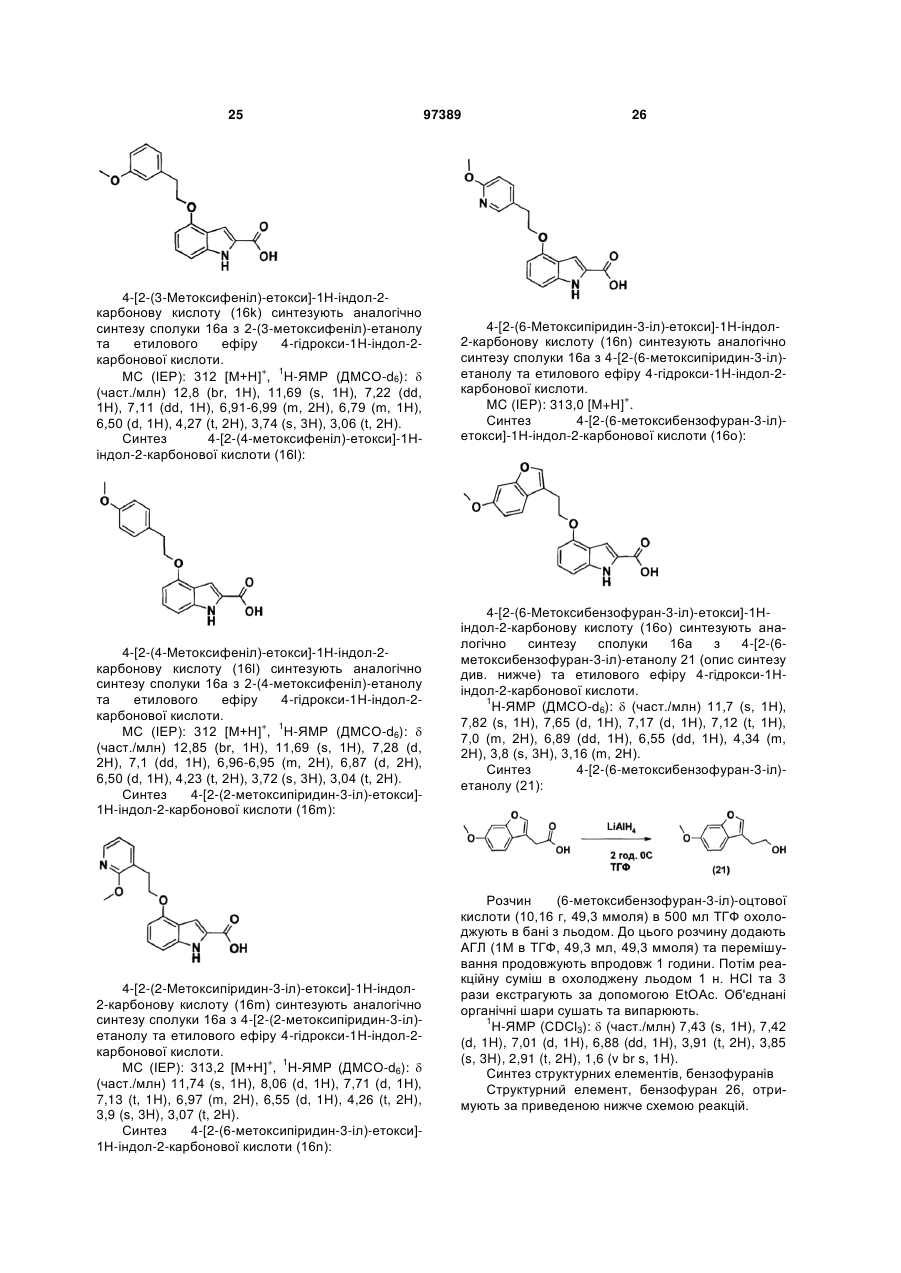
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2-(6-метоксипіридин-3-іл)-етоксі]-1Н-індол-2-карбонової кислоти,
{4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3-метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2-(6-метоксибензофуран-3-іл)-етоксі]-1Н-індол-2-карбонової кислоти.
6. Сполука за будь-яким з попередніх пунктів, призначена для застосування як лікарський засіб, призначений для попередження, полегшення протікання або лікування аутоімунного або запального захворювання або стану.
7. Сполука за будь-яким з попередніх пп. 1-3, призначена для застосування як лікарський засіб для попередження, полегшення протікання або лікування інфікування ВІЛ (вірус імунодефіциту людини) або СНІД (синдром набутого імунодефіциту).
8. Спосіб одержання сполуки формули (І) за п. 1, в якому здійснюють реакцію сполуки формули (III):
 , (III)
, (III)
у якій R" являє собою Н або С1-С7-алкільну групу,
зі сполукою формули (IV)
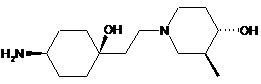 (IV)
(IV)
та виділення отриманої сполуки формули (І) у вільній формі або у формі солі.
9. Сполука, отримана способом за п. 8.
10. Фармацевтична композиція, що містить сполуку за п. 1 разом з фармацевтично прийнятним розріджувачем або носієм.
11. Застосування сполуки за п. 1 для приготування лікарського засобу, призначеного для лікування аутоімунного або запального захворювання або стану.
12. Застосування сполуки за п. 1 для приготування лікарського засобу, призначеного для лікування інфікування ВІЛ або СНІД.
13. Спосіб інгібування хемокінових рецепторів або макрофагального білка або послаблення запалення у суб'єкта, що потребує такого лікування, який включає введення зазначеному суб'єкту ефективної кількості сполуки за п. 1.
14. Спосіб лікування запального або аутоімунного захворювання або стану, що включає введення зазначеному суб'єкту ефективної кількості сполуки за п. 1.
15. Спосіб лікування інфікування ВІЛ або СНІД, що включає введення суб'єкту ефективної кількості сполуки за п. 1.
16. Застосування сполуки за п. 1 у комбінації з одним або більшою кількістю засобів, вибраних з групи, що включає: метотрексат, анти-TNF засіб, анти-IL-l засіб, нуклеозидний або ненуклеозидний інгібітор зворотної транскриптази, інгібітор протеази ВІЛ, інгібітор злиття та антиретровірусний засіб, для лікування запального або аутоімунного захворювання або стану або для лікування ВІЛ або СНІД.
Текст
1. Сполука формули (І) або її фармацевтично прийнятна сіль, складний ефір або проліки: C2 2 (19) 1 3 метоксипіридин-3-ілметоксі)-1Н-індол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(4оксо-4,5,6,7-тетрагідробензофуран-3-ілметоксі)1Н-індол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4(6,6-диметил-4-оксо-4,5,6,7-тетрагідробензофуран3-ілметоксі)-1Н-індол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4[(S)-1-(2,3-дигідробензофуран-3-іл)метоксі]-1Ніндол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4((R,S)-6-метокси-2,3-дигідробензофуран-3ілметоксі)-1Н-індол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(4метоксибензофуран-3-ілметоксі)-1Н-індол-2карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4(4,6-дифторбензофуран-3-ілметоксі)-1Н-індол-2карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(5хлорбензофуран-3-ілметоксі)-1Н-індол-2карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6метоксибензофуран-3-ілметоксі)-1Н-індол-2карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6етоксибензофуран-3-ілметоксі)-1Н-індол-2карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6циклопропілметоксибензофуран-3-ілметоксі)-1Ніндол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(2-етоксіетокси)-бензофуран-3-ілметоксі]-1Н-індол2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6((RS)-2-метокси-1-метилетокси)-бензофуран-3ілметоксі]-1Н-індол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(2-ізопропоксіетокси)-бензофуран-3-ілметоксі]-1Ніндол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(3-метоксипропокси)-бензофуран-3-ілметоксі]-1Ніндол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(3-етоксипропокси)-бензофуран-3-ілметоксі]-1Ніндол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-{6 97389 4 [(S)-(тетрагідрофуран-3-іл)окси]-бензофуран-3ілметоксі}-1Н-індол-2-карбонової кислоти, {4-гідрокси-4-[2--((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6фторбензофуран-3-ілметоксі)-1Н-індол-2карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(7метоксибензофуран-3-ілметоксі)-1Н-індол-2карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(2-метоксифеніл)-етоксі]-1Н-індол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(3-метоксифеніл)-етоксі]-1Н-індол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(4-метоксифеніл)-етоксі]-1Н-індол-2-карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(2-метоксипіридин-3-іл)-етоксі]-1Н-індол-2карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(6-метоксипіридин-3-іл)-етоксі]-1Н-індол-2карбонової кислоти, {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(6-метоксибензофуран-3-іл)-етоксі]-1Н-індол-2карбонової кислоти. 6. Сполука за будь-яким з попередніх пунктів, призначена для застосування як лікарський засіб, призначений для попередження, полегшення протікання або лікування аутоімунного або запального захворювання або стану. 7. Сполука за будь-яким з попередніх пп. 1-3, призначена для застосування як лікарський засіб для попередження, полегшення протікання або лікування інфікування ВІЛ (вірус імунодефіциту людини) або СНІД (синдром набутого імунодефіциту). 8. Спосіб одержання сполуки формули (І) за п. 1, в якому здійснюють реакцію сполуки формули (III): R O (CH2)n O X OR'' , (III) у якій R" являє собою Н або С1-С7-алкільну групу, зі сполукою формули (IV) OH N OH H2N (IV) 5 97389 6 та виділення отриманої сполуки формули (І) у вільній формі або у формі солі. 9. Сполука, отримана способом за п. 8. 10. Фармацевтична композиція, що містить сполуку за п. 1 разом з фармацевтично прийнятним розріджувачем або носієм. 11. Застосування сполуки за п. 1 для приготування лікарського засобу, призначеного для лікування аутоімунного або запального захворювання або стану. 12. Застосування сполуки за п. 1 для приготування лікарського засобу, призначеного для лікування інфікування ВІЛ або СНІД. 13. Спосіб інгібування хемокінових рецепторів або макрофагального білка або послаблення запалення у суб'єкта, що потребує такого лікування, який включає введення зазначеному суб'єкту ефективної кількості сполуки за п. 1. 14. Спосіб лікування запального або аутоімунного захворювання або стану, що включає введення зазначеному суб'єкту ефективної кількості сполуки за п. 1. 15. Спосіб лікування інфікування ВІЛ або СНІД, що включає введення суб'єкту ефективної кількості сполуки за п. 1. 16. Застосування сполуки за п. 1 у комбінації з одним або більшою кількістю засобів, вибраних з групи, що включає: метотрексат, анти-TNF засіб, анти-IL-l засіб, нуклеозидний або ненуклеозидний інгібітор зворотної транскриптази, інгібітор протеази ВІЛ, інгібітор злиття та антиретровірусний засіб, для лікування запального або аутоімунного захворювання або стану або для лікування ВІЛ або СНІД. Даний винахід відноситься до біциклічних карбоніламінопохідних, які є антагоністами хемокінового рецептору 2 (CCR-2) та хемокінового рецептору 5 (CCR-5), та до їх застосування для лікування захворювань та розладів, які включають міграцію та активацію моноцитів та Т-клітин, включаючи запальні захворювання. Першим об'єктом даного винаходу є сполука формули (І), або її фармацевтично прийнятна сіль, складний ефір або проліки: сульфаніл, сульфоніл; R1 є незаміщеним або заміщений однією або більшою кількістю груп, вибраних з групи, що включає галоген, гідроксигрупу, ціаногрупу, С1-С6-алкіл, С1-С6-алкоксигрупу, С2-С7алкеніл, С2-С7-алкенілоксигрупу, аміногрупу, амінокарбоніл, карбамоїл, моно- або ди-С1-С7алкіламіногрупу, гідроксигрупу, ціаногрупу, меркаптогрупу, С1-С7-алкоксикарбоніл, арил, гетероарил, карбоксигрупу. Для виключення сумнівів слід розуміти, що приведені нижче терміни мають зазначені значення у всьому описі та формулі винаходу: Термін "нижч." в назвах органічних радикалів та сполук означає сполуку або радикал, який може бути розгалуженим або нерозгалуженим та містить до 7 атомів вуглецю включно. Нижч. алкільна група може бути розгалуженою, нерозгалуженою або циклічною та містити від 1 до 7 атомів вуглецю, переважно - від 1 до 4 атомів вуглецю. Нижч. алкіл означає, наприклад: метил, етил, пропіл, бутил, ізопропіл, ізобутил, третбутил або 2,2-диметилпропіл. Нижч. алкоксигрупа може бути розгалуженою або нерозгалуженою та містити від 1 до 7 атомів вуглецю, переважно - від 1 до 6 атомів вуглецю. Нижч. алкоксигрупа означає, наприклад: метоксигрупу, етоксигрупу, пропоксигрупу, бутоксигрупу, ізопропоксигрупу, ізобутоксигрупу або третбутоксигрупу. Нижч. алкоксигрупа включає циклоалкілоксигрупу та циклоалкіл-нижч. алкілоксигрупу. Нижч. алкен, алкеніл або алкенілоксигрупа є розгалуженою або нерозгалуженою та містить від 2 до 7 атомів вуглецю, переважно - від 1 до 4 атомів вуглецю та містить не менше одного подвійного вуглець-вуглецевого зв'язку. Нижч. алкен, нижч. алкеніл або нижч. алкенілоксигрупа означає, наприклад, вініл, проп-1-еніл, аліл, бутеніл, ізопропініл або ізобутеніл та їх оксиеквіваленти. В даній заявці замісники, що містять кисень, наприклад, алкоксигрупа, алкенілоксигрупа, алкінілоксигрупа, карбоніл та т. п. включають їх сірковмісні гомологи, наприклад, тіоалкоксигрупу, тіоа у якій: X являє собою СН2 або NH; n дорівнює 1 або 2; R вибирають з групи, що включає С3-С18циклоалкіл, С3-С18-гетероциклоалкіл, С3-С18гетероарил, С3-С18-арил; R включає необов'язково сконденсовану з ним групу В, вибрану з групи, що включає С3-С8циклоалкіл, С3-С8-гетероциклоалкіл, С3-С8-арил та С3-С8-гетероарил; та R та В всі незалежно є незаміщеними або заміщені за допомогою R1, який являє собою одну або більшу кількість груп, незалежно вибраних з групи, що включає галоген, С1-С7-алкоксигрупу, оксогрупу, С1-С7-алкіл, С1-С7-алкокси-С1-С7алкоксигрупу, С2-С7-алкеніл, С2-С7алкенілоксигрупу, аміногрупу, амінокарбоніл, карбамоїл, моно- або ди-С1-С7-алкіламіногрупу, гідроксигрупу, ціаногрупу, меркаптогрупу, С1-С7алкоксикарбоніл, арил, гетероарил, карбоксигрупу, 7 лкенілоксигрупу, тіоалкінілоксигрупу, тіокарбоніл, сульфон, сульфоксид тощо. Галоген означає хлор, фтор, бром або йод. Арил означає карбоциклічний арил, гетероарил або біарил. Карбоциклічний арил означає ароматичний циклічний вуглеводень, що містить від 6 до 18 кільцевих атомів. Він може бути моноциклічним, біциклічним або трициклічним, наприклад, нафтил, феніл, або феніл, моно-, ди- або тризаміщений 1, 2 або 3 замісниками. Гетероарил означає ароматичний моноциклічний або бициклічний вуглеводень, що містить від 5 до 18 кільцевих атомів, один або більша кількість з яких є гетероатомами, вибраними з групи, що включає О, N та S. Переважно, якщо містяться 1 або 2 гетероатоми. Гетероарил означає, наприклад: піридил, індоліл, хіноксалініл, хінолініл, ізохінолініл, бензотієніл, бензофураніл, бензопіраніл, бензотіопіраніл, фураніл, піроліл, тіазоліл, оксазоліл, ізоксазоліл, триазоліл, тетразоліл, піразоліл, імідазоліл, тієніл, тіазоліл. Гетероарил також включає такі заміщені радикали. Циклоалкіл означає моно-, ди- або трициклічний вуглеводень, який може бути насиченим або ненасиченим та який містить від 3 до 18 кільцевих атомів, переважно - від З до 6 кільцевих атомів. Циклоалкіл включає місткові та сконденсовані кільцеві системи. Циклоалкіл означає, наприклад: циклопропіл, циклобутил, циклопентил або циклогексил. Циклоалкіл необов'язково може бути заміщеним. Гетероциклоалкіл означає моно-, ди- або трициклічний вуглеводень, який може бути насиченим або ненасиченим та який містить один або більшу кількість, переважно - від 1 до 3 гетероатомів, вибраних з групи, що включає О, N та S. Переважно, якщо він містить від 3 до 18 кільцевих атомів. Термін гетероциклоалкіл також включає місткові та сконденсовані гетероциклоалкільні групи, такі як, 3-гідрокси-8-азабіцикло[3.2.1]окт-8-ил. Фармацевтично прийнятні проліки-складні ефіри являють собою складноефірні похідні, які шляхом сольволізу або за фізіологічних умов здатні перетворюватися у вільну карбонову кислоту формули (І). Такі складні ефіри являють собою, наприклад, нижч. алкілові складні ефіри (такі як метилові або етилові складні ефіри), карбоксинижч. алкілові складні ефіри, такі як карбоксиметиловий складний ефір, нітроокси-нижч. алкілові складні ефіри (такі як 4-нітрооксибутиловий складний ефір). В формулі (І) переважно, якщо X являє собою NH. Переважно, якщо n дорівнює 1. R переважно вибирають з групи, що включає незаміщений або заміщений С3-С18-гетероарил, що необов'язково містить сконденсовану з ним групу В, вибрану з групи, що включає С3-С8циклоалкіл, С3-С8-гетероциклоалкіл, С3-С8-арил та С3-С8-гетероарил; R та В всі незалежно є незаміщеними або заміщені за допомогою R1, який визначений вище. Більш переважно, якщо R являє собою тіазоліл, піридиніл, бензофураніл, бензофураніл або 97389 8 4,5,6,7-тетрагідробензофураніл, який є незаміщеним або заміщеним за допомогою R1, який визначений вище. Ще більш переважно, якщо R являє собою бензофураніл, який є незаміщеним або заміщеним за допомогою R1, який визначений вище. Альтернативно, переважно, якщо R являє собою С3-С18-гетероциклоалкіл, що необов'язково містить сконденсовану з ним групу В, вибрану з групи, що включає С3-С8-циклоалкіл, С3-С8гетероциклоалкіл, С3-С8-арил та С3-С8-гетероарил; R та В всі незалежно є незаміщеними або заміщені за допомогою R1, який визначений вище. Ще більш переважно, якщо R являє собою тетрагідрофураніл або 2,3-дигідробензофураніл. В кожному випадку R є незаміщеним або заміщеним, як визначено вище. Кращими сполуками формули І є такі як: {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4циклобутилметокси-1H-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4(тетрагідрофуран-3-ілметокси)-1H-індол-2карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4(фуран-3-ілметокси)-1H-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(2хлортіазол-4-ілметокси)-1H-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6метоксипіридин-3-ілметокси)-1H-індол-2карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(4оксо-4,5,6,7-тетрагідробензофуран-3-ілметокси)1H-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4(6,6-диметил-4-оксо-4,5,6,7-тетрагідробензофуран3-ілметокси)-1Н-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4[(S)-1-(2,3-дигідробензофуран-3-іл)метокси]-1Hіндол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4((R,S)-6-мeтoкcи-2,3-дигiдpoбeнзoфypaн-3iлмeтoкcи)-1H-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-riдрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(4метоксибензофуран-3-ілметокси)-1H-індол-2карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4(4,6-дифторбензофуран-3-ілметокси)-1H-індол-2карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(5хлорбензофуран-3-ілметокси)-1H-індол-2карбонової кислоти 9 {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6метоксибензофуран-3-ілметокси)-1H-індол-2карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6етоксибензофуран-3-ілметокси)-1H-індол-2карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6циклопропілметоксибензофуран-3-ілметокси)-1Hіндол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(2-етоксиетокси)-бензофуран-3-ілметокси]-1Ніндол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6((RS)-2-метокси-1-метилетокси)-бензофуран-3ілметокси]-1H-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(2-ізопропоксиетокси)-бензофуран-3-ілметокси]1Н-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(3-метоксипропокси)-бензофуран-3-ілметокси]-1Ніндол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(3-етоксипропокси)-бензофуран-3-ілметокси]-1Hіндол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-{6[(S)-(тетрагідрофуран-3-іл)окси]-бензофуран-3ілметокси}-1Н-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6фторбензофуран-3-ілметокси)-1H-індол-2карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(7метоксибензофуран-3-ілметокси)-1H-індол-2карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(2-метоксифеніл)-етокси]-1H-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(3-метоксифеніл)-етокси]-1H-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(4-метоксифеніл)-етокси]-1H-індол-2-карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(2-метоксипіридин-3-іл)-етокси]-1H-індол-2карбонової кислоти {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(6-метоксипіридин-3-іл)-етокси]-1H-індол-2карбонової кислоти 97389 10 {4-гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(6-метоксибензофуран-3-іл)-етокси]-1H-індол-2карбонової кислоти. Другим об'єктом даного винаходу є сполука формули (І), призначена для застосування як лікарського засобу, призначеного для попередження, полегшення протікання або лікування аутоімунного або запального захворювання або патологічного стану. Третім об'єктом даного винаходу є спосіб одержання сполуки формули (І), що включає реакцію сполуки формули (III): у якій R" являє собою Η або С1-С7-алкільну групу, зі сполукою формули (IV) і добування отриманої сполуки формули (І) в вільній формі або в формі солі. Спосіб, запропонований в даному винаході, здійснюють звичайним чином. Спосіб являє собою реакцію конденсації між кислотою або складним ефіром та аміном. Його звичайно здійснюють шляхом реакції кислоти з аміном в присутності реагентів сполучення, наприклад, TBTU/ДІЕА в розчиннику, такому як ДМФАА, або за реакцією складного ефіру з аміном в присутності реагенту сполучення, такого як НОВТ/ЕДХ. Відповідну сполуку формули (III) можна отримати, як описано нижче, за схемою реакцій 4 з етилового ефіру 4-гідрокси-1Н-індол-2-карбонової кислоти, яку саму можна отримати, як показано на схемі 1. Сполуку формули (IV) можна отримати у відповідності зі схемами 2 та 3, приведеними нижче. Сполуки, запропоновані в даному винаході, можна виділити з реакційної суміші та очистити звичайним чином. Ізомери, такі як енантіомери, можна одержати звичайним чином, наприклад, за допомогою фракціонованої кристалізації або асиметричного синтезу з відповідних асиметрично заміщених, наприклад, оптично активних вихідних сполук. Вихідні сполуки та проміжні продукти є відомими або їх можна одержати за звичайними методиками або аналогічно, як це описано в прикладах. 11 97389 Четвертим об'єктом даного винаходу є сполука, яку одержують за однією з зазначених вище методик. П'ятим об'єктом даного винаходу є фармацевтична композиція, що включає сполуку формули (І) разом з фармацевтично прийнятним розріджувачем або носієм. Шостим об'єктом даного винаходу є застосування сполуки формули (І) для одержання лікарського засобу, призначеного для застосування для лікування аутоімунного або запального захворювання або патологічного стану. Сьомим об'єктом даного винаходу є спосіб інгібування хемокінових рецепторів або макрофага 12 льних білків або послаблення запалення у суб'єкта, що потребує такого лікування, який включає введення зазначеному суб'єкту ефективної кількості сполуки формули (І). Восьмим об'єктом даного винаходу є спосіб лікування запального або аутоімунного захворювання або патологічного стану, що включає введення зазначеному суб'єкту ефективної кількості сполуки формули (І). Засоби, запропоновані в даному винаході, можна одержати за описаним нижче методиками: Експериментальна частина Абревіатури ВОС: Вос2О: BuLi: ДХМ: ДЕАД: ДІЕА: ДМАП: ДМФА: ДМСО: ЕДХ: Ефір: EtOH: EtOAc: HCl: НОВТ: АГЛ: МеОН: NaOH: NMP: Pd/C: КT: TBTU трет-BuOH ТГФ: ТШХ: трет-Бутоксикарбоніл Ди-трет-бутилдикарбонат н-Бутиллітій Дихлорметан Діетилазадикарбоксилат Етилдіізопропіламін Диметилпіридин-4-іламін Ν,Ν-Диметилформамід Диметилсульфоксид (3-Диметиламінопропіл)-етилкарбодіімідгідрохлорид Етоксиетан Етанол Етиловий ефір оцтової кислоти Хлористоводнева кислота Бензотриазол-1-ол Алюмогідрид літію Метанол Гідроксид натрію 1-Метилпіролідин-2-он Паладій на вугіллі Кімнатна температура О-(1H-бензотриазол-1-іл)-N,N,N',Ν'-тетраметилуронійтетрафторборат 2-Метилпропан-2-ол Тетрагідрофуран Тонкошарова хроматографія 1 Спектри H-ЯМР знімають на ЯМР спектрометрі Varian Gemini 400 МГц. Основні піки приведені в наступному порядку: мультиплетність (s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет; br, широкий) та кількість протонів. Масспектри з іонізацією електророзпиленням (ІЕР) знімають на мас-спектрометрі Hewlett Packard 5989A. Дані мас-спектрометрії приведені у вигляді відношень маси до заряду. Очищення за допомогою препаративної ВЕРХ (високоефективна рідинна хроматографія) проводять на колонках XTerraTM RP18 19150 мм, використовуючи як елюенти суміші ацетонітрил/вода або МеОН/вода. Всі реагенти, вихідні речовини та проміжні продукти, що використовують у цих прикладах, є у продажу або їх можна легко одержати за методиками, відомими спеціалісту в даній галузі техніки. Синтез структурного елементу, індолу Структурний елемент, індол 2, отримують за приведеною нижче схемою реакцій. 13 97389 14 Схема реакцій 1: Стадія А: 1-трет-Бутиловий ефір,2-етиловий ефір 4-бензилоксиіндол-1,2-дикарбонової кислоти (1) Етиловий ефір 4-бензилокси-1Н-індол-2карбонової кислоти (50 г, 169 ммолей) та диметиламінопіридин (ДМАП) суспендують в 100 мл етилацетаті. По краплям додають розчин Вос2О (36,9 г, 169 ммолей) в етилацетаті та суміш перемішують при кімнатній температурі впродовж 5 годин. Суміш послідовно промивають водою та сольовим розчином . Органічний шар сушать над сульфатом натрію та випарюють при зниженому тиску. Жовту тверду речовину використовують на наступній стадії без додаткового очищення. + 1 МС (ІЕР): 396 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 7,5 (d, 1H), 7,48 (d, 2Н), 7,36 (d, 2Н), 7,34 (m, 1Н), 7,31 (m, 1Н), 7,22 (s, 1Н), 6,92 (d, 1Н), 5,26 (s, 2Н), 4,28 (q, 2Н), 1,56 (s, 9Н), 1,31 (t, 3H). Стадія В: 1-трет-Бутиловий ефір, 2-етиловий ефір 4-гідроксиіндол-1,2-дикарбонової кислоти (2) У кругло донну колбу в атмосфері аргону поміщають 10% паладій на вугіллі (1 г) та заливають за допомогою 50 мл етанолу. Додають розчин 1трет-бутилового ефіру, 2-етилового ефіру (4бензилоксиіндол-1,2-дикарбонової кислоти (1) (35 г, 88,5 ммоля) в 250 мл етанолу, потім додають форміат амонію (6,3 г, 97,4 ммоля). Суміш перемішують при КТ впродовж 30 хвил. (за проходженням реакції слідкують за допомогою ТШХ). Після закінчення реакції суміш фільтрують та випарювання суміші забезпечує одержання білої твердої речовини, яку потім очищують шляхом перекристалізації з суміші діетиловий ефір/гексани. + 1 МС (ІЕР): 208 [М] , H-ЯМР (ДМСО-d6): (част./млн) 10,2 (br, 1Н), 7,4 (d, 1Н), 7,28 (s, 1Н), 7,25 (dd, 1Н), 6,67 (d, 1Н), 4,3 (q, 2Н), 1,53 (s, 9Н), 1,3 (t, 3H). Синтез структурних елементів, амінів Структурні елементи, аміни 6 та 14, отримують за приведеною нижче схемою реакцій. Схема реакцій 2: Синтез (3S,4S)-3-метилпіперидин-4-ілового ефіру 2,2-диметилпропіонової кислоти (6): Стадія А: (1-RS,3-RS)-1-Бензил-3метилпіперидин-4-ол (3) 1-Бензил-3-метил-4-піперидон (25 г, 123 ммоля) розчиняють в 200 мл метанолу та перемішують при КТ. Впродовж 1 години невеликими порціями додають NaBH4 (2,3 г, 61,5 ммоля) (екзотермічна реакція, 30°С). Жовтий розчин перемішують при кімнатній температурі впродовж ще 30 хвил. Потім суміш випарюють при зниженому тиску, розчиняють в етилацетаті та промивають водою. + 1 МС (ІЕР): 205 [М] , H-ЯМР (CDCl3): (част./млн) 7,15-7,3 (m,5H), 4,5 та 4,3 (d, OH), 3,38 (s, 2Н), 3,55 та 2,89 (m, 1Н), 2,6-2,75 (m, 2Н), 1,9 (dt, 1Н), 1,7 (m, 1Н), 1,65 (m, 1Н), 1,3-1,5 (m, 2Н), 0,84 (d, 3H). Стадія В: (3RS,4RS)-1-Бензил-3метилпіперидин-4-іловий ефір 2,2диметилпропіонової кислоти (4) (1-RS,3-RS)-1-Бензил-3-метилпіперидин-4-ол (3) (24,9 г, 121 ммоль) розчиняють в 500 мл сухого ТГФ. Додають триетиламін (25,4 мл, 182 ммоля), потім повільно додають півалоїлхлорид (21,9 г, 182 ммоля). Реакційну суміш кип'ятять зі зворотним холодильником впродовж ночі (80°С). Суміш фільтрують та розбавляють діетиловим ефіром. Органічний шар промивають 1 н. водним розчином гідроксиду натрію та сольовим розчином, сушать над Na2SO4 та випарюють при зниженому тиску. Неочищений продукт (суміш цис/транс-ізомерів) очищують за допомогою флеш-хроматографії (силікагель, етилацетат/гексани 5:95) та отримують чистий транс-ізомер. + 1 МС (ІЕР): 290 [М+Н] , H-ЯМР (CDCl3): (част./млн) 7,28 (m, 5Н), 4,75 (m, 1Н), 3,42 (d, 2H), 2,5 (m, 2H), 1,9-2,2 (m, 3H), 1,7 (m, 2H), 1,15 (s, 9H), 0,78 (d, 3H). Стадія С: (3RS,4RS)-3-Метилпіперидин-4іловий ефір 2,2-диметил-пропіонової кислоти (5) У круглодонну колбу в атмосфері аргону поміщають гідроксид паладію (20% на вугіллі, 1,5 г) 15 та заливають метанолом. Додають розчин (3RS,4RS)-1-бензил-3-метилпіперидин-4-ілового ефіру 2,2-диметилпропіонової кислоти (4) (15 г, 51,8 ммоля) в 300 мл метанолу, потім додають 1,3М метанольний розчин HCl (62 мл, 78 ммолей). Потім суміш гідрують при атмосферному тиску впродовж 20 годин. Розчин фільтрують через целіт та випарюють при зниженому тиску. Залишок розчиняють в діетиловому ефірі та промивають 1 н. водним розчином гідроксиду натрію та сольовим розчином. Об'єднані органічні шари сушать над Na2SO4 та випарюють при зниженому тиску. + 1 МС (ІЕР): 200 [М+Н] , H-ЯМР (CDCl3): (част./млн) 4,32 (dt, 1Н), 3,3 (br, 1H), 2,85 (m, 2H), 97389 16 2,45 (dt, 1H), 2,15 (dd, 1Н), 1,75 (m, 1H), 1,55 (m, 1H), 1,27 (m, 1H), 1,13 (s, 9H), 0,78 (d, 3H). Стадія D: (3S,4S)-3-Метилпіперидин-4-іловий ефір (-)-дибензоїлтартрату 2,2диметилпропіонової кислоти (6) (3RS,4RS)-3-Метилпіперидин-4-іловий ефір 2,2-диметилпропіонової кислоти (5) (9,6 г, 48 ммолей) розчиняють в 50 мл етилацетату. По краплям додають розчин (-)-дибензоїлтартрату (8,6 г, 24 ммоля) в етилацетаті. Осад відфільтровують та промивають охолодженим етилацетатом та отримують безбарвні кристали. Схема реакцій 3: Синтез (3S,4S)-1-[2-(цис-4-аміно-1гідроксициклогексил)-етил]-3-метил-піперидин-4олу (14): Стадія А: (Циклогекс-2-енсульфоніл)-бензол (7) Бромциклогексен (35,9 мл, 310,5 ммоля) розчиняють віл ДМФА, охолоджують до 0°С та після додавання натрієвої солі бензолсульфінової кислоти (86,6 г, 527,8 ммоля) суміш перемішують при кімнатній температурі впродовж 17 год. Потім суміш випарюють у високому вакуумі. Залишок розбавляють ефіром, промивають водою, сушать над Na2SO4 та випарюють при зниженому тиску. Неочищений продукт очищують за допомогою флешхроматографії (етилацетат/гексани (1:9), 1 кг силікагелю). + 1 МС (ІЕР): 223,3 [М+Н] , H-ЯМР (CDCl3): (част./млн) 7,88 (d, 2Н), 7,65 (d, 1Н), 7,56 (dd, 2H), 6,1 (m, 1Н), 6,8 (m, 1H), 3,75 (m, 1H), 1,4-2,0 (m, 6H). Стадія В: [2-(1-Бензолсульфонілциклогекс-2еніл)-етоксиметил]-бензол (8) Циклогекс-2-енсульфонілбензол (7) (10 г, 45 ммолей) розчиняють в 450 мл сухого ТГФ та охолоджують до -20°С. Потім додають 1,6Μ BuLi в гексані (30,9 мл, 49,5 ммоля) та суміш перемішують впродовж 15 хвил. Після додавання бензил-2 брометилового ефіру (8,5 мл, 54 ммоля) суміш перемішують при 0°С впродовж 1 години. Потім суміш випарюють досуха. Залишок обробляють сумішшю лід/1M HCl та двічі екстрагують ефіром. Об'єднані органічні шари сушать над Na2SO4 та випарюють при зниженому тиску. Продукт використовують на наступній стадії без додаткового очищення. + 1 МС (ІЕР): 357,2 [М+Н] , H-ЯМР (CDCl3): (част./млн) 7,85 (d, 2Н), 7,85 (dd, 1Н), 7,55 (dd, 2H), 7,25-7,35 (m, 5H), 6,15 (m, 1Н), 5,65 (d, 1H), 4,45 (s, 2H), 3,5-3,8 (m, 3H), 1,4-2,3 (m, 7H). Стадія С: (2-Циклогекса-1,3дієнілетоксиметил)-бензол (9) [2-(1-Бензолсульфонілциклогекс-2-еніл)етоксиметил]-бензол (8) (16 г, 44,9 ммоля) розчиняють в трет-бутанолі (450 мл) та після додавання трет-бутоксиду калію (11,1 г, 98,7 ммоля) суміш перемішують при 80°С впродовж 32 год. Потім суміш виливають на лід та екстрагують пентаном. Органічний шар відділяють, промивають насиченим розчином NaCl та сушать над Na2SO4. Неочищений продукт очищують за допомогою флешхроматографії (етилацетат/гексани (1:9), силікагель). + 1 МС (ІЕР): 215 [М+Н] , H-ЯМР (CDCl3): (част./млн) 7,2-7,4 (m, 5Н), 5,84 (m, 1Н), 5,65 (m, 17 2H), 4,45 (m, 2H), 3,55 (t, 2H), 2,32 (t, 2H), 2,0-2,3 (m, 4H). Стадія D: трет-Бутиловий ефір (1S,4S)-1-(2бензилоксиетил)-2-окса-3-азабіцикло[2.2.2]окт-5ен-3-карбонової кислоти (10) (2-Циклогекса-1,3-дієнілетоксиметил)-бензол (9) (6 г, 28 ммолей) розчиняють в 280 мл сухого метиленхлориду та охолоджують до 0°С. Невеликими порціями додають молекулярні сита (6 г, UOP Туре 4А) та N-ВОС-гідроксиламін (5,6 г, 42 ммоля), потім невеликими порціями повільно додають тетрапропіламоній(мета)перйодат (10,8 г, 28 ммолей) та суміш перемішують впродовж 1 години. Потім суміш розбавляють за допомогою СН2СІ2 та охолоджують до -10°С. Повільно додають 2М розчин Na2S2O5 (екзотермічна реакція!). Суміш промивають водою, сушать над Na2SO4 та випарюють при зниженому тиску. Неочищений продукт очищують за допомогою флешхроматографії (етилацетат/гексани (1:9), силікагель). + 1 МС (ІЕР): 346 [М+Н] , H-ЯМР (CDCl3): (част./млн) 7,3 (m, 5Н), 6,53 (dd, 1Н), 6,44 (dd, 1Н), 4,56 (m, 1H), 4,45 (s, 2H), 3,62 (m, 1H), 1,5-2,1 (m, 6H), 1,34 (s, 9H). Стадія Ε: трет-Бутиловий ефір 1-(2гідроксиетил)-2-окса-3-азабіцикло[2.2.2]октан-3карбонової кислоти (11) У круглодонну колбу в атмосфері аргону поміщають 1 г Pd-C та заливають етанолом. Додають розчин трет-бутилового ефіру (1S,4S)-1-(2бензилоксиетил)-2-окса-3-азабіцикло[2.2.2]окт-5ен-3-карбонової кислоти (10) (2 г, 5,8 ммоля) в 58 мл етанолу та суміш гідрують при КТ впродовж 6 годин. Потім суміш фільтрують через целіт та випарюють при зниженому тиску. Продукт використовують на наступній стадії без додаткового очищення. + 1 МС (ІЕР): 258 [М+Н] , Н-ЯМР (CDCl3): (част./млн) 4,28 (t, 1Н), 3,86 (m, 1Н), 3,49 (dt, 2H), 1,6-1,95 (m, 8H), 1,56 (t, 2H), 1,41 (s, 9H). Стадія F: трет-Бутиловий ефір 1-{2-[(3S,4S)-4(2,2-диметилпропіонілокси)-3-метилпіперидин-1іл]-етил}-2-окса-3-азабіцикло[2.2.2]октан-3карбонової кислоти (12) трет-Бутиловий ефір (1S,4S)-1-(2гідроксиетил)-2-окса-3-азабіцикло[2.2.2]окт-5-ен-3карбонової кислоти (11) (620 мг, 2,41 ммоля) розчиняють в 24 мл пропіонітрилу та після додавання аміну 6 (480 мг, 2,41 ммоля), ціанометилтриметилфосфоніййодиду (796 мг, 6 ммолей) та діізопропілетиламіну (2 мл, 12 ммолей) суміш перемішують при 120°С впродовж 16 годин. Потім суміш випарюють при зниженому тиску. Залишок розбаСхема реакцій 4: 97389 18 вляють етилацетатом, промивають 10% розчином K2СО3 та NaCl та сушать над Na2SO4. Неочищений продукт очищують за допомогою флешхроматографії (етилацетат/гексани (9,5:0,5), силікагель). + 1 МС (ІЕР): 258 [М+Н] , H-ЯМР (CDCl3): (част./млн) 4,25 (m, 1Н), 3,86 (m, 1Н), 2,75 (m, 2Н), 2,33 (m, 2Н), 1,5-2,0 (m, 15Н), 1,42 (s, 9Н), 1,14 (s, 9Н), 0,82 (d, 3H). Стадія G: Гідрохлорид (3S,4S)-3-метил-1-[2-(2окса-3-азабіцикло[2.2.2]окт-1-іл)-етил]-піперидин-4олу (13) трет-Бутиловий ефір (1S,4S)-1-{2-[(3S,4S)-4(2,2-диметилпропіонілокси)-3-метилпіперидин-1іл]-етил}-2-окса-3-азабіцикло[2.2.2]окт-5-ен-3карбонової кислоти (12) (880 мг, 2 ммоля) розчиняють в 20 мл води та після додавання водного розчину концентрованої HCl (38%, 1,2 мл) суміш перемішують при 100°С впродовж 16 годин. Потім суміш випарюють досуха. Залишок 3 рази обробляють метанолом та випарюють при зниженому тиску. Залишок розбавляють етилацетатом, екстрагують 2М розчином K2СО3, сушать над Na2SO4 та випарюють при зниженому тиску. Продукт використовують на наступній стадії без додаткового очищення. + 1 МС (ІЕР): 255 [М+Н] , H-ЯМР (CDCl3): (част./млн) 12,18 (s, 2Н), 3,73 (s, 1Н), 3,3-3,4 (m, 2H), 3,15 (m, 2H), 2,99 (m, 2H), 2,9 (m, 1Н), 2,59 (m, 2H), 2,1 (m, 2H), 1,99 (m, 2H), 1,6-1,9 (m, 8H), 0,9 (d, 3H). Стадія Н: (3S,4S)-1-[2-(4-Аміно-1гідроксициклогексил)-етил]-3-метилпіперидин-4-ол (14) В круглодонну колбу в атмосфері аргону поміщають 10% Pd-C (240 мг) та заливають метанолом. Додають розчин (3S,4S)-3-метил-1-[2-(2-окса3-азабіцикло[2.2.2]окт-1-іл)-етил]-піперидин-4-олу (13) (584 мг, 2,3 ммоля) в 20 мл метанолу та суміш гідрують при кімнатній температурі впродовж 2 годин. Потім суміш фільтрують через целіт та випарюють при зниженому тиску. Продукт використовують на наступній стадії без додаткового очищення. + 1 МС (ІЕР): 257 [М+Н] , H-ЯМР (CDCl3): (част./млн) 4,67 (br, 1Н), 4,5 (d, 1H), 2,88 (m, 1H), 2,78 (m, 1H), 2,76 (m, 1H), 2,41 (m, 1H), 2,3 (m, 2H), 1,84 (m, 1H), 1,7 (m, 1H), 1,52 (m, 6H), 1,42 (m, 3H), 1,32 (m, 4H), 1,3 (m, 2H), 0,86 (d, 3H). Синтез структурних елементів, алкілоксиіндолів Структурні елементи, алкоксиіндоли, отримують за приведеною нижче схемою реакцій. 19 Синтез 4-циклобутилметокси-1Н-індол-2карбонової кислоти (16а): Стадія А: Етиловий ефір 4циклобутилметокси-1Н-індол-2-карбонової кислоти (15а) До розчину етилового ефіру 4-гідрокси-1Ніндол-2-карбонової кислоти (2 г, 9,75 ммоля), трифенілфосфіну (3,58 г, 13,65 ммоля) та циклобутилметанолу (1,25 мл, 12,26 ммоля) в 20 мл ТГФ повільно додають ДЕАД (2,1 мл, 13,65 ммоля) таким чином, щоб температура завжди залишалась нижче 30°С. Перемішування продовжують впродовж 2 годин та потім розчинник випарюють. Неочищений залишок очищують за допомогою хроматографії (циклогексан:EtOAc / 95:5). + 1 МС (ІЕР): 274,2 [М+Н] , Н-ЯМР (CDCl3): (част./млн) 8,83 (s, 1Н), 7,35 (s, 1H), 7,21 (t, 1H), 6,98 (d, 1H), 6,49 (d, 1H), 4,4 (q, 2H), 4,07 (d, 2H), 2,85 (m, 1H), 2,17 (m, 2H), 1,95 (m, 4H), 1,42 (t, 3H). Стадія В: 4-Циклобутилметокси-1Н-індол-2карбонова кислота (16а) Отриманий вище етиловий ефір 4циклобутилметокси-1Н-індол-2-карбонової кислоти (15а) змішують з 2М розчином KOН в EtOH (16,9 мл, 33,8 ммоля) та перемішують впродовж 24 годин. Потім розчинник випарюють та залишок піддають розподіленню між водою та ДХМ. Водний шар підкислюють за допомогою HCl та двічі екстрагують за допомогою EtOAc. Об'єднані органічні шари промивають сольовим розчином, сушать над безводним сульфатом натрію, фільтрують та випарюють та отримують білу порошкоподібну речовину. + 1 МС (ІЕР): 246,3 [М+Н] , H-ЯМР (CDCl3): (част./млн) 11,74 (br. s, 1Н), 7,14 (t, 1H), 7,03 (s, 1H), 6,99 (d, 1H), 6,51 (d, 1H), 4,05 (d, 2H), 2,8 (m, 1H), 2,11 (m, 2H), 1,93 (m, 4H). Синтез 4-(тетрагідрофуран-3-ілметокси)-1Ніндол-2-карбонової кислоти (16b): 4-(Тетрагідрофуран-3-ілметокси)-1Н-індол-2карбонову кислоту (16b) синтезують аналогічно синтезу сполуки 16а з 4-(тетрагідрофуран-3іл)метанолу та етилового ефіру 4-гідрокси-1Ніндол-2-карбонової кислоти. 97389 20 МС (ІЕР): 260,1 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,76 (br s, 1Н), 7,14 (t, 1Н), 7,03 (m, 2H), 6,52 (d, 1Н), 4,05 (m, 2H), 3,83 (m, 2H), 3,69 (m, 1H), 3,6 (m, 1H), 2,74 (m, 1H), 2,05 (m, 1H), 1,73 (m, 1H). Синтез 4-(фуран-2-ілметокси)-1Н-індол-2карбонової кислоти (16с): + 1 4-(Фуран-3-ілметокси)-1Н-індол-2-карбонову кислоту (16с) синтезують аналогічно синтезу сполуки 16а з фуран-3-ілметанолу та етилового ефіру 4-гідрокси-1Н-індол-2-карбонової кислоти. + 1 МС (ІЕР): 258,0 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 12,79 (br s, 1Н), 11,71 (s, 1H), 7,81 (s, 1H), 7,67 (s, 1H), 7,13 (m, 1H), 7,01 (m, 2H), 6,62 (m, 2H), 5,07 (s, 2H). Синтез 4-(2-хлортіазол-4-ілметокси)-1Н-індол2-карбонової кислоти (16d): 4-(2-Хлортіазол-4-ілметокси)-1Н-індол-2карбонову кислоту (16d) синтезують аналогічно синтезу сполуки 16а з 4-(2-хлортіазол-4іл)метанолу та етилового ефіру 4-гідрокси-1Hіндол-2-карбонової кислоти. + 1 МС (ІЕР): 309, 311 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 12,9 (s, 1Н), 11,8 (s, 1Н), 7,85 (s, 1Н), 7,15 (dd, 1H), 7,1 (m, 1H), 7,05 (d, 2H), 6,67 (d, 1H), 5,25 (s, 2H). Синтез 4-(6-метоксипіридин-3-ілметокси)-1Ніндол-2-карбонової кислоти (16е): 4-(6-Метоксипіридин-3-ілметокси)-1Н-індол-2карбонову кислоту (16е) синтезують аналогічно синтезу сполуки 16а з 4-(6-метоксипіридин-3 21 іл)метанолу та етилового ефіру 4-гідрокси-1Hіндол-2-карбонової кислоти. 1 H-ЯМР (ДМСО-d6): (част./млн) 11,78 (s, 1Н), 8,32 (s, 1H), 7,85 (d, 1H), 7,15 (t, 1H), 7,02 (m, 2H), 6,86 (d, 1H), 6,66 (d, 1H), 5,17 (s, 2H), 3,86 (s, 3H). Синтез 4-(4-оксо-4,5,6,7тетрагідробензофуран-3-ілметокси)-1Н-індол-2карбонової кислоти (16f): 4-(4-Оксо-4,5,6,7-тетрагідробензофуран-3ілметокси)-1H-індол-2-карбонову кислоту (16f) синтезують аналогічно синтезу сполуки 16а з 4-оксо4,5,6,7-тетрагідробензофуран-3-ілметанолу та етилового ефіру 4-гідрокси-1H-індол-2-карбонової кислоти. + 1 MC (IEP): 326 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 11,78 (br s, 1Н), 7,88 (s, 1H), 7,16 (t, 1Н), 7,11 (s, 1Н), 7,03 (d, 1Н), 6,59 (d, 1Н), 5,21 (s, 2Н), 3,3-3,9 (v br s, 1Н), 2,91 (t, 2H), 2,45 (t, 2H), 2,11 (m, 2H). Стадія А: 6,6-Диметил-4-оксо-4,5,6,7тетрагідробензофуран-3-карбонова кислота (17) 5,5-Диметил-1,3-циклогександіон розчиняють в 15 мл метанолу та охолоджують до 0°С. По краплям додають розчин KOН (2 г, 35,7 ммоля) в 15 мл метанолу. По краплям додають розчин етилового ефіру 3-бром-2-оксопропіонової кислоти (4,7 мл, 37,5 ммоля) в 15 мл метанолу. Суміші дають нагрітися до кімнатної температури та перемішують впродовж 16 годин. Потім додають 15 мл 45% водного розчину гідроксиду натрію. Ще через 4 години при кімнатній температурі додають 25 мл концентрованої HCl. Метанол повільно випарюють при зниженому тиску, при цьому продукт осаджується у вигляді світлих кристалів. Продукт відфільтровують та промивають водою. + 1 MC (ΙΕΡ): 209,0 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 12,96 (br s, 1Н), 8,38 (s, 1H), 2,86 (s, 2H), 2,49 (s, 2H), 1,07 (s, 6H). Стадія В: 6,6-Диметил-4-оксо-4,5,6,7тетрагідробензофуран-3-ілметанол (18) 6,6-Диметил-4-оксо-4,5,6,7тетрагідробензофуран-3-карбонову кислоту (17) (1 97389 22 Синтез 4-(6,6-диметил-4-оксо-4,5,6,7тетрагідробензофуран-3-ілметокси)-1Н-індол-2карбонової кислоти (16g): 4-(6,6-Диметил-4-оксо-4,5,6,7тетрагідробензофуран-3-ілметокси)-1Н-індол-2карбонову кислоту (16g) синтезують аналогічно синтезу сполуки 16а з 4-(6,6-диметил-4-оксо4,5,6,7-тетрагідробензофуран-3-іл)метанолу 19 (опис синтезу див. нижче) та етилового ефіру 4гідрокси-1Н-індол-2-карбонової кислоти. + 1 МС (ІЕР): 353 [М] , H-ЯМР (ДМСО-d6): (част./млн) 12,8 (br s, 1Н), 11,7 (s, 1H), 7,86 (s, 1H), 7,15 (dd, 1H), 7,08 (s, 1H), 7,02 (d, 1H), 6,57 (d, 1H), 5,2 (s, 2H), 2,8 (s, 2H), 2,36 (s, 2H), 1,06 (s, 6H). Синтез 4-(6,6-диметил-4-оксо-4,5,6,7тетрагідробензофуран-3-ілметанолу (19): г, 4,8 ммоля) розчиняють в 80 мл дихлорметану та після додавання 187 мкл ДМФА (2,4 ммоля) суміш охолоджують до 10-15°С. По краплям додають оксалілхлорид (619 мкл, 7,2 ммоля) та суміш перемішують при кімнатній температурі впродовж 30 хвил. Суміш випарюють при зниженому тиску, розчиняють в ТГФ та охолоджують до -55°С. Шприцом додають розчин NaBH4 (1,3 г, 34,1 ммоля) в 10 мл ДМФА. Білу суспензію перемішують при -55°С впродовж ще 1,5 години. При цій температурі додають 4 мл оцтової кислоти та суміш виливають в 150 мл 5% водного розчину NаНСО3. Суміш розбавляють етилацетатом та промивають сольовим розчином. Неочищений продукт очищують за допомогою флеш-хроматографії (етилацетат/гексани (4:6), силікагель). + 1 МС (ІЕР): 195,0 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 7,47 (s, 1H), 4,95 (t, 1H), 4,5 (d, 2Н), 2,76 (s, 2H), 2,32 (s, 2H), 1,06 (s, 6H). Синтез 4-(6,6-диметил-4-оксо-4,5,6,7тетрагідробензофуран-3-ілметокси)-1Н-індол-2карбонової кислоти (16h): 23 4-(6,6-Диметил-4-оксо-4,5,6,7тетрагідробензофуран-3-ілметокси)-1Н-індол-2карбонову кислоту (16h) синтезують аналогічно синтезу сполуки 16а з (R)-1-(2,3дигідробензофуран-3-іл)-метанолу та етилового ефіру 4-гідрокси-1Н-індол-2-карбонової кислоти. 1 МС (ІЕР): 307,9 [М-Н], Н-ЯМР (ДМСО-d6): (част./млн) 7,44 (d, 1H), 7,15 (m, 2H), 7,04 (m, 2Н), 6,87 (t, 1H), 6,82 (d, 1H), 6,57 (d, 1Н), 4,75 (t, 1Н), 4,48 (dd, 1H), 4,3 (dd, 1H), 4,21 (dd, 1Н), 4,02 (m, 1Н). Синтез 4-(6,6-диметил-4-оксо-4,5,6,7тетрагідробензофуран-3-ілметокси)-1Н-індол-2карбонової кислоти (16і): Стадія А: (R,S)-2-(2-Йод-5метоксифеноксиметил)-оксиран (19) 2-Йод-5-метоксифенол (2 г, 8 ммолей) розчиняють в 15 мл ДМФА, додають карбонат цезію (3,9 г, 12 ммолей) та 2-хлорметилоксиран (0,94 мл, 12 ммолей) та суміш перемішують впродовж 60 годин. Потім реакційну суміш обробляють за допомогою 10 мл 2 н. розчину NaOH та екстрагують діетиловим ефіром. Ефірний шар промивають 1 н. розчином NaOH, водою та сольовим розчином, сушать над сульфатом натрію та випарюють. Неочищене масло використовують на наступній стадії без додаткового очищення. + 1 МС (ІЕР): 306,8 [М+Н] , H-ЯМР (CDCl3): (част./млн) 7,56 (d, 1Н), 6,4 (d, 1H), 6,28 (dd, 1H), 4,2 (dd, 1H), 3,97 (dd, 1H), 3,72 (s, 3H), 3,33 (m, 1H), 2,85 (m, 2H). Стадія В: (R)-1-(2,3-Дигідробензофуран-3-іл)метанол (20) Отриманий вище неочищений оксиран 19 (2,4 г, 7,84 ммоля) розчиняють в 50 мл ТГФ та охолоджують до -78°С в бані з твердим діоксидом вуглецю. При цій температурі по краплям додають нBuLi (1,6М в гексані, 4,9 мл, 7,84 ммоля). Потім суміш перемішують впродовж 1 години та їй дають нагрітися до 0°С. Після ретельного гідролізу та екстракції за допомогою EtOAc неочищену речовину очищують за допомогою флеш-хроматографії (етилацетат/гексани (від 5:95 до 25:75), силікагель). 97389 24 4-(6,6-Диметил-4-оксо-4,5,6,7тетрагідробензофуран-3-ілметокси)-1Н-індол-2карбонову кислоту (16і) синтезують аналогічно синтезу сполуки 16а з (R,S)-(6-метокси-2,3дигідробензофуран-3-іл)-метанолу 20 (опис синтезу див. нижче) та етилового ефіру 4-гідрокси-1Hіндол-2-карбонової кислоти. + 1 МС (ІЕР): 339,9 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,8 (br s, 1Н), 7,3 (d, 1H), 7,14 (t, 1Н), 7,05 (m, 2Н), 6,55 (d, 1Н), 6,45 (m, 2Н), 4,75 (t, 1Н), 4,5 (dd, 1Н), 4,25 (m, 1Н), 4,15 (m, 1Н), 3,93 (m, 1Н), 3,7 (s, 3H). Синтез (R,S)-(6-метокси-2,3дигідробензофуран-3-іл)-метанолу (23): МС (ІЕР): 180,9 [М+Н] , H-ЯМР (CDCl3): (част./млн) 7,1 (d, 1Н), 6,46 (d, 1Н), 6,42 (s, 1H), 4,67 (dd, 1H), 4,52 (dd, 1H), 3,79 (s, 3H), 3,6 (m, 1H), 1,65 (br s, 1H). Синтез 4-[2-(2-метоксифеніл)-етокси]-1Ніндол-2-карбонової кислоти (16j): + 1 4-[2-(2-Метоксифеніл)-етокси]-1Н-індол-2карбонову кислоту (16j) синтезують аналогічно синтезу сполуки 16а з 2-(2-метоксифеніл)-етанолу та етилового ефіру 4-гідрокси-1H-індол-2карбонової кислоти. + 1 МС (ІЕР): 312 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 10,75 (br, 1H), 7,28 (dd, 1H), 7,20 (ddd, 1Н), 6,97 (d, 1Н), 6,83-6,92 (m, 3H), 6,47 (s, 1Н), 6,38 (dd, 1Н), 4,17 (t, 2Н), 3,81 (s, 3H), 3,07 (t, 2H). Синтез 4-[2-(3-метоксифеніл)-етокси]-1Ніндол-2-карбонової кислоти (16k): 25 4-[2-(3-Метоксифеніл)-етокси]-1Н-індол-2карбонову кислоту (16k) синтезують аналогічно синтезу сполуки 16а з 2-(3-метоксифеніл)-етанолу та етилового ефіру 4-гідрокси-1H-індол-2карбонової кислоти. + 1 МС (ІЕР): 312 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 12,8 (br, 1Н), 11,69 (s, 1H), 7,22 (dd, 1Н), 7,11 (dd, 1Н), 6,91-6,99 (m, 2Н), 6,79 (m, 1Н), 6,50 (d, 1Н), 4,27 (t, 2Н), 3,74 (s, 3H), 3,06 (t, 2H). Синтез 4-[2-(4-метоксифеніл)-етокси]-1Ніндол-2-карбонової кислоти (16l): 4-[2-(4-Метоксифеніл)-етокси]-1Н-індол-2карбонову кислоту (16l) синтезують аналогічно синтезу сполуки 16а з 2-(4-метоксифеніл)-етанолу та етилового ефіру 4-гідрокси-1H-індол-2карбонової кислоти. + 1 МС (ІЕР): 312 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 12,85 (br, 1H), 11,69 (s, 1H), 7,28 (d, 2Н), 7,1 (dd, 1Н), 6,96-6,95 (m, 2Н), 6,87 (d, 2Н), 6,50 (d, 1Н), 4,23 (t, 2Н), 3,72 (s, 3H), 3,04 (t, 2H). Синтез 4-[2-(2-метоксипіридин-3-іл)-етокси]1Н-індол-2-карбонової кислоти (16m): 4-[2-(2-Метоксипіридин-3-іл)-етокси]-1H-індол2-карбонову кислоту (16m) синтезують аналогічно синтезу сполуки 16а з 4-[2-(2-метоксипіридин-3-іл)етанолу та етилового ефіру 4-гідрокси-1H-індол-2карбонової кислоти. + 1 МС (ІЕР): 313,2 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,74 (s, 1Н), 8,06 (d, 1H), 7,71 (d, 1H), 7,13 (t, 1H), 6,97 (m, 2H), 6,55 (d, 1H), 4,26 (t, 2H), 3,9 (s, 3H), 3,07 (t, 2H). Синтез 4-[2-(6-метоксипіридин-3-іл)-етокси]1Н-індол-2-карбонової кислоти (16n): 97389 26 4-[2-(6-Метоксипіридин-3-іл)-етокси]-1H-індол2-карбонову кислоту (16n) синтезують аналогічно синтезу сполуки 16а з 4-[2-(6-метоксипіридин-3-іл)етанолу та етилового ефіру 4-гідрокси-1H-індол-2карбонової кислоти. + MC (IEP): 313,0 [M+H] . Синтез 4-[2-(6-метоксибензофуран-3-іл)етокси]-1Н-індол-2-карбонової кислоти (16ο): 4-[2-(6-Метоксибензофуран-3-іл)-етокси]-1Ніндол-2-карбонову кислоту (16о) синтезують аналогічно синтезу сполуки 16а з 4-[2-(6метоксибензофуран-3-іл)-етанолу 21 (опис синтезу див. нижче) та етилового ефіру 4-гідрокси-1Ніндол-2-карбонової кислоти. 1 H-ЯМР (ДМСО-d6): (част./млн) 11,7 (s, 1Н), 7,82 (s, 1H), 7,65 (d, 1Н), 7,17 (d, 1H), 7,12 (t, 1Н), 7,0 (m, 2Н), 6,89 (dd, 1Н), 6,55 (dd, 1Н), 4,34 (m, 2Н), 3,8 (s, 3H), 3,16 (m, 2Н). Синтез 4-[2-(6-метоксибензофуран-3-іл)етанолу (21): Розчин (6-метоксибензофуран-3-іл)-оцтової кислоти (10,16 г, 49,3 ммоля) в 500 мл ТГФ охолоджують в бані з льодом. До цього розчину додають АГЛ (1M в ТГФ, 49,3 мл, 49,3 ммоля) та перемішування продовжують впродовж 1 години. Потім реакційну суміш в охолоджену льодом 1 н. HCl та 3 рази екстрагують за допомогою EtOAc. Об'єднані органічні шари сушать та випарюють. 1 Н-ЯМР (CDCl3): (част./млн) 7,43 (s, 1Н), 7,42 (d, 1H), 7,01 (d, 1H), 6,88 (dd, 1H), 3,91 (t, 2H), 3,85 (s, 3H), 2,91 (t, 2H), 1,6 (v br s, 1H). Синтез структурних елементів, бензофуранів Структурний елемент, бензофуран 26, отримують за приведеною нижче схемою реакцій. 27 97389 28 Схема реакцій 5: Синтез етилового ефіру 6гідроксибензофуран-3-карбонової кислоти (26): Стадія А: Етиловий ефір (3-метоксифенокси)оцтової кислоти (22) 3-Метоксифенол (43,4 мл, 400 ммолей) розчиняють в ацетоні (800 мл) та після додавання етилового ефіру хлороцтової кислоти (42,6 мл, 400 ммолей) та K2СО3 (111 г, 800 ммолей) суміш кип'ятять зі зворотним холодильником впродовж 22 годин. Після охолодження до 0°С суміш фільтрують та фільтрат випарюють при зниженому тиску. Залишок розбавляють етилацетатом, охолоджують до 0°С та промивають водним розчином NaOH. Органічний шар сушать над сульфатом натрію та випарюють при зниженому тиску. + 1 МС (ІЕР): 211,54 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 7,20 (dd, 1H), 6,56 (dd, 1Н),6,50 (m, 2Н), 4,77 (s, 2Н), 4,19 (q, 2Н), 3,75 (s, 3H), 1,23 (t, 3H). Стадія В: Діетиловий ефір 2-(3метоксифенокси)-3-оксобурштинової кислоти (23) Етоксид натрію (32,5 г, 454 ммоля) заливають за допомогою 1 л сухого діетилового ефіру. Впродовж 20 хвилин по краплям додають діетиловий ефір щавлевої кислоти (55,2 мл, 416 ммолей). Після перемішування при кімнатній температурі впродовж 30 хвилин суміш кип'ятять зі зворотним холодильником. Впродовж 30 хвилин по краплям додають розчин етилового ефіру (3метоксифенокси)-оцтової кислоти (22) (79,5 г, 378 ммолей) в 80 мл сухого діетилового ефіру та суміш кип'ятять зі зворотним холодильником впродовж 1 години. Після охолодження до кімнатної температури реакційну суміш виливають в суміш 2М HCl (400 мл)/лід (400 г) та екстрагують діетиловим ефіром. Органічні шари сушать над сульфатом натрію, фільтрують та випарюють. + 1 МС (ІЕР): 310 [М] , H-ЯМР (ДМСО-d6): (част./млн) 7,15-7,2 (m, 1Н), 6,5-6,6 (m, 1Н), 6,4-6,5 (m, 1Н), 4,25 (m, 4Н), 4,0-4,2 (m, 3H), 3,71 (s, 3H), 1,05-1,3 (m, 6Н). Стадія С: Діетиловий ефір 6метоксибензофуран-2,3-дикарбонової кислоти (24) Діетиловий ефір 2-(3-метоксифенокси)-3оксобурштинової кислоти (23) (60 г, 193,4 ммоля) розчиняють в 32 мл охолодженої (-15°С) концентрованої сірчаної кислоти та перемішують впродовж 3 годин, при цьому реакційна суміш повільно нагрівається до кімнатної температури. Потім су міш виливають в 1 кг льоду та екстрагують діетиловим ефіром. Органічні шари промивають сольовим розчином, сушать над сульфатом натрію, фільтрують та випарюють. Неочищений продукт очищують за допомогою флеш-хроматографії (силікагель, етилацетат/гексани 1:9). + 1 МС (ІЕР): 293,67 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 7,7 (d, 1Н), 7,39 (d, 1H), 7,06 (dd, 1H), 4,38 (q, 2H), 4,36 (q, 2H), 3,64 (s, 3H), 1,34 (t, 3H), 1,32 (t, 3H). Стадія D: Етиловий ефір 6метоксибензофуран-3-карбонової кислоти (25) Діетиловий ефір 6-метоксибензофуран-2,3дикарбонової кислоти (24) (27 г, 92 ммоля) розчиняють в 200 мл ДМСО та суміш нагрівають до 170°С. Потім додають хлорид натрію (10,7 г, 184 ммоля) та воду (3,3 мл) та суміш перемішують при 160°С (температура реакційної суміші) впродовж 2 годин. Потім суміші дають охолодитися та її випарюють у високому вакуумі. Залишок розчиняють в етилацетаті, промивають водою та сольовим розчином та сушать над сульфатом натрію. Випарювання забезпечує одержання коричневої твердої речовини, яку потім очищують за допомогою флеш-хроматографії (силікагель, етилацетат/гексани 3:7). + 1 МС (ІЕР): 221 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 8,6 (s, 1Н), 7,79 (d, 1H), 7,3 (d, 1Н), 7,01 (dd, 1Н), 4,32 (q, 2Н), 3,81 (s, 3H), 1,34 (t, 3H). Стадія Е: Етиловий ефір 6гідроксибензофуран-3-карбонової кислоти (26) Етиловий ефір 6-метоксибензофуран-3карбонової кислоти (25) (9,3 г, 42 ммоля) розчиняють в 80 мл дихлорметану та охолоджують до 0°С. Додають 1M розчин ВВг3 в дихлорметані (84,5 мл, 84,5 ммоля) та суміш перемішують при КТ впродовж 2 годин. Суміш виливають в охолоджену льодом воду та нейтралізують гідрокарбонатом натрію. Органічний шар сушать над сульфатом натрію, фільтрують та випарюють при зниженому тиску. 1 МС (ІЕР): 205 [М-Н], H-ЯМР (ДМСО-d6): (част./млн) 9,74 (br, 1H), 8,50 (s, 1H), 7,69 (d, 1Н), 6,98 (d, 1H), 6,86 (dd, 1H), 4,31 (q, 2H), 1,32 (t, 3H). Синтез структурних елементів, бензофуранілметоксиіндолів Структурні елементи, алкоксиіндоли, отримують за приведеною нижче схемою реакцій. 29 97389 30 Схема реакцій 6: Синтез 4-(6-етоксибензофуран-3-ілметокси)1Н-індол-2-карбонової кислоти (30а) (методика А): Стадія А: Етиловий ефір 6-етоксибензофуран3-карбонової кислоти (27а) Етиловий ефір 6-гідроксибензофуран-3карбонової кислоти (26) (8 г, 39 ммолей) розчиняють в 80 мл ДМФА та після додавання брометану (5,8 мл, 78 ммолей) та Cs2CO3 (15,2 г, 46,6 ммоля) суміш перемішують при 100°С впродовж 2 годин. Після випарювання суміші у високому вакуумі залишок розчиняють в етилацетаті, промивають водою та сольовим розчином, сушать над сульфатом натрію та випарюють при зниженому тиску. Жовту тверду речовину використовують на наступній стадії без додаткового очищення. + 1 МС (ІЕР): 235 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 8,58 (s, 1Н), 7,77 (d, 1H), 7,27 (s, 1H), 6,99 (d, 1H), 4,31 (q, 2H), 4,07 (q, 2H), 1,35 (t, 3H), 1,33 (t, 3H). Стадія В: (6-Етоксибензофуран-3-іл)-метанол (28а) 1M розчин LiAlH4 в ТГФ (47,6 мл, 47,6 ммоля) розбавляють за допомогою 200 мл ТГФ та охолоджують до 0°С. Етиловий ефір 6етоксибензофуран-3-карбонової кислоти (27а) (5,6 г, 23,8 ммоля) розчиняють в 100 мл ТГФ та впродовж 30 хвилин по краплям додають до суміші. Після завершення додавання суміш перемішують при 0°С впродовж 2 годин. Потім реакційну суміш охолоджують до -15°С та дуже повільно додають 10 мл 1M розчину NaOH. Потім суміш фільтрують через целіт, промивають за допомогою ТГФ та випарюють при зниженому тиску. MC (ΙΕΡ): 193 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 7,7 (s, 1Н), 7,5 (d, 1H), 7,12 (d, 1H), 7,85 (dd, 1H), 5,1 (br s, 1H), 4,58 (s, 2H), 4,05 (q, 2H), 1,35 (t, 3H). Стадія С: 1-трет-Бутиловий ефір 2-етиловий ефір 4-(6-етоксибензофуран-3-ілметокси)-індол1,2-дикарбонової кислоти (29а) 1-трет-Бутиловий ефір, 2-етиловий ефір 4гідроксиіндол-1,2-дикарбонової кислоти (2) (5,2 г, 17,2 ммоля), (6-етоксибензофуран-3-іл)-метанол (28а) (3,3 г, 17,2 ммоля) та трифенілфосфін (5,4 г, 20,6 ммоля) розчиняють в 30 мл ТГФ та охолоджують до 0°С. Потім по краплям додають 40% розчин етилазодикарбоксилату в ТГФ (9 мл, 20,6 ммоля). Після завершення додавання суміш перемішують при КТ впродовж 16 годин (за проходженням реакції слідкують за допомогою ТШХ). Потім суміш випарюють при зниженому тиску. Залишок розбавляють етилацетатом, промивають насиченими розчинами NаНСО3 та NaCl та сушать над Na2SO4. Неочищений продукт очищують за допомогою флеш-хроматографії (етилацетат/гексани (1:9), силікагель). + 1 МС (ІЕР): 480 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 8,04 (s, 1Н), 7,55 (d, 1Н), 7,52 (d, 1Н), 7,39 (dd, 1H), 7,17 (s, 1H), 7,17 (s, 1H), 7,03 (d, 1H), 6,88 (d, 1Н), 5,38 (s, 2Н), 4,28 (q, 2Н), 4,0-4,1 (m, 2Н), 1,55 (s, 9H), 1,34 (t, 3H), 1,29 (t, 3H). Стадія D: 4-(6-Етоксибензофуран-3ілметокси)-1Н-індол-2-карбонова кислота (30а) 1-трет-Бутиловий ефір, 2-етиловий ефір 4-(6етоксибензофуран-3-ілметокси)-індол-1,2дикарбонової кислоти (29а) (7,5 г, 15,6 ммоля) розчиняють в 150 мл суміші 1:1:1 ТГФ, етанолу та води, та після додавання гранул KOН (4,4 г, 78,2 ммоля) суміш перемішують при 85°С впродовж 2 годин (за проходженням реакції слідкують за допомогою ТШХ). Потім органічний розчинник видаляють при зниженому тиску. Залишок охолоджують до 0°С та обробляють за допомогою 2М HCl. Неочищений продукт відфільтровують та сушать у + 1 31 високому вакуумі. Неочищений продукт перекристалізовують з етилацетату. + 1 МС (ІЕР): 352 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 12,81 (br s, 1Н), 11,72 (s, 1Н), 8,01 (s, 1Н), 7,56 (d, 1Н), 7,17 (s, 1Н), 7,14 (dd, 1Н), 7,02 (m, 2H), 6,89 (d, 1H), 6,71 (d, 1H), 5,33 (s, 2H), 4,05 (q, 2H), 1,34 (t, 3H). Синтез 4-(6-циклопропілметоксибензофуран3-ілметокси)-1Н-індол-2-карбонової кислоти (30b) (методика А): 4-(6-Циклопропілметоксибензофуран-3ілметокси)-1H-індол-2-карбонову кислоту (30b) синтезують аналогічно синтезу сполуки 30а з етилового ефіру 6-гідроксибензофуран-3-карбонової кислоти (26) та бромметилциклопропану. 1 МС (ІЕР): 376 [М-Н], H-ЯМР (ДМСО-d6): (част./млн) 12,82 (br s, 1H), 11,72 (s, 1H), 8,01 (s, 1Н), 7,57 (d, 1Н), 7,16 (d, 1Н), 7,14 (d, 1Н), 7,02 (m, 2H), 6,91 (dd, 1H), 6,71 (d, 1H), 5,34 (s, 2H), 3,85 (d, 2H), 1,24 (m, 1H), 0,58 (m, 2H), 0,34 (m, 2H). Синтез 4-[6-(2-етоксиетокси)-бензофуран-3ілметокси]-1Н-індол-2-карбонової кислоти (30с) (методика А): 4-[6-(2-Етоксиетокси)-бензофуран-3ілметокси]-1H-індол-2-карбонову кислоту (30с) синтезують аналогічно синтезу сполуки 30а з етилового ефіру 6-гідроксибензофуран-3-карбонової кислоти (26) та 2-брометилетилового ефіру. 1 МС (ІЕР): 394 [М-Н], H-ЯМР (ДМСО-d6): (част./млн) 12,82 (br s, 1Н), 11,73 (s, 1H), 8,03 (s, 1H), 7,57 (d, 1H), 7,21 (d, 1Н), 7,15 (dd, 1Н), 7,02 (s, 1H), 7,01 (d, 1H), 6,92 (dd, 1H), 6,72 (d, 1H), 5,35 (s, 2H), 4,12 (dd, 2H), 3,71 (dd, 2H), 3,50 (q, 2H), 1,13 (t, 3H). Синтез 4-[6-(2-метокси-1-метилетокси)бензофуран-3-ілметокси]-1Н-індол-2-карбонової кислоти (30d) (методика В): 97389 32 Стадія А: Етиловий ефір 6-(2-метокси-1метилетокси)-бензофуран-3-карбонової кислоти (27d) Етиловий ефір 6-гідроксибензофуран-3карбонової кислоти (26) (0,5 г, 2,4 ммоля) розчиняють в 24 мл сухого ТГФ та після додавання 1метокси-2-пропанолу (262 мг, 2,9 ммоля) та трифенілфосфіну (763 мг, 2,9 ммоля) суміш охолоджують до 0°С. Потім по краплям додають 40% розчин етилазодикарбоксилату в толуолі (1,3 мл, 2,9 ммоля) та реакційну суміш перемішують впродовж 16 годин при кімнатній температурі. Потім суміш випарюють при зниженому тиску та неочищений продукт очищують за допомогою флешхроматографії (силікагель, етилацетат/гексани 1:9) та отримують безбарвне масло. + 1 МС (ІЕР): 279 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 8,58 (s, 1H), 7,77 (d, 1H), 7,33 (d, 1Н), 6,99 (dd, 1Н), 4,67 (m, 1H), 4,31 (q, 2H), 3,48 (m, 2H), 3,28 (d, 3H), 1,33 (t, 3H), 1,23 (d, 3H). Стадії від В до D проводять за методикою синтезу сполуки 30а. 4-[6-(2-Метокси-1-метилетокси)-бензофуран-3ілметокси]-1H-індол-2-карбонова кислота (30d) + МС (ІЕР): 396,64 [М+Н] . Синтез 4-[6-(2-ізопропоксиетокси)бензофуран-3-ілметокси]-1Н-індол-2-карбонової кислоти (30е) (методика В): 4-[6-(2-Ізопропоксиетокси)-бензофуран-3ілметокси]-1H-індол-2-карбонову кислоту (30е) синтезують аналогічно синтезу сполуки 30d з етилового ефіру 6-гідроксибензофуран-3-карбонової кислоти (26) та 2-ізопропоксиетанолу. 1 МС (ІЕР): 408 [М-Н], H-ЯМР (ДМСО-d6): (част./млн) 12,8 (br s, 1H), 11,73 (s, 1H), 8,03 (s, 1Н), 7,56 (d, 1Н), 7,21 (s, 1Н), 7,15 (dd, 1Н), 7,03 (s, 1H), 7,0 (m, 1H), 6,93 (dd, 1H), 6,73 (d, 1H), 5,35 (s, 2H), 4,1 (t, 2H), 3,7 (t, 2H), 3,63 (m, 1H), 1,11 (s, 6H). Синтез 4-[6-(3-метоксипропокси)-бензофуран3-ілметокси]-1Н-індол-2-карбонової кислоти (30f) (методика В): 4-[6-(3-Метоксипропокси)-бензофуран-3ілметокси]-1H-індол-2-карбонову кислоту (30f) синтезують аналогічно синтезу сполуки 30d з етило 33 вого ефіру 6-гідроксибензофуран-3-карбонової кислоти (26) та 3-метокси-1-пропанолу. Синтез 4-[6-(3-етоксипропокси)-бензофуран-3ілметокси]-1Н-індол-2-карбонової кислоти (30g) (методика В): 4-[6-(3-Етоксипропокси)-бензофуран-3ілметокси]-1H-індол-2-карбонову кислоту (30g) синтезують аналогічно синтезу сполуки 30d з етилового ефіру 6-гідроксибензофуран-3-карбонової кислоти (26) та 3-етокси-1-пропанолу. Синтез 4-{6-[(S)-(тетрагідрофуран-3-іл)окси]бензофуран-3-ілметокси}-1Н-індол-2-карбонової кислоти (30h) (методика В): 4-{6-[(S)-(Тетрагідрофуран-3-іл)окси]бензофуран-3-ілметокси}-1Н-індол-2-карбонову кислоту (30h) синтезують аналогічно синтезу сполуки 30d з етилового ефіру 6-гідроксибензофуран3-карбонової кислоти (26) та (S)-(-)-3-гідрокситетрагідрофурану. - 1 МС (ІЕР): 392 [М-Н] , H-ЯМР (ДМСО-d6): (част./млн) 12,79 (br s, 1Н), 11,72 (s, 1H), 8,03 (s, 1H), 7,58 (d, 1H), 7,19 (d, 1Н), 7,14 (dd, 1H), 7,01 (s, 1Н), 7,0 (m, 1H), 6,89 (dd, 1H), 6,71 (d, 1H), 5,34 (s, 2H), 5,07 (m, 1H), 3,7-3,95 (m, 4H), 2,22 (m, 1H), 1,99 (m, 1H). Синтез індол-2-карбоксамідів Індол-2-карбоксаміди звичайно отримують шляхом реакції сполучення, що каталізують за допомогою TBTU, відповідно заміщених індол-2карбонових кислот з відповідними амінами в присутності основи Хюніга (схема реакцій 7). 97389 34 Схема реакцій 7: Ілюстративні приклади приведені нижче. Приклад 1 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4циклобутилметокси-1Н-індол-2-карбонової кислоти Розчин 4-циклобутилметокси-1Н-індол-2карбонової кислоти (16а) (140 мг, 0,383 ммоля), (3S,4S)-1-[2-(4-аміно-1-гідроксициклогексил)-етил]3-метил-піперидин-4-олу (14) (103 мг, 0,421 ммоля) та ДІЕА (0,263 мл, 1,532 ммоля) в 5 мл ДМФА обробляють твердим TBTU (139 мг, 0,421 ммоля). Суміш перемішують при КТ впродовж 2 годин та випарюють. Неочищений залишок розчиняють в EtOAc та екстрагують 1M розчином HCl. Водний шар відділяють, значення його рН доводять до 14 та 3 рази екстрагують за допомогою ДХМ. Органічні шари сушать над сульфатом натрію та випарюють. Потім неочищений продукт очищують за допомогою хроматографії на силікагелі з використанням суміші метанолу та ДХМ (насичений амонієм) від 1:99 до 5:95. Одержання гідрохлоридів можна здійснити шляхом обробки розчину вільної основи в ДХМ або ацетоні при 0°С 2М розчином HCl в метанолі. + 1 МС (ІЕР): 484 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,46 (s, 1Н), 8,26 (d, 1H), 7,25 (s, 1H), 7,04 (t, 1H), 6,98 (d, 1H), 6,48 (d, 1H), 4,89 (br s, 1H), 4,56 (d, 1H), 4,04 (d, 2H), 3,73 (m, 1Н), 2,71-2,97 (m, 4H), 2,42 (m, 2H), 2,12 (m, 2H), 1,82-2,02 (m, 5H), 1,44-1,81 (m, 10H), 1,2-1,43 (m, 4H), 0,87 (d, 3H). Приклад 2 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4(тетрагідрофуран-3-ілметокси)-1H-індол-2карбонової кислоти 35 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(тетрагідрофуран-3ілметокси)-1H-індол-2-карбонової кислоти 16b та аміну 14. + 1 МС (ІЕР): 500 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 11,42 (s, 1Н), 8,21 (d, 1Н), 7,22 (s, 1Н), 7,02 (t, 1H), 6,97 (d, 1H), 6,47 (d, 1H), 4,82 (s, 1Н), 4,51 (d, 1H), 3,93-4,08 (m, 2H), 3,57-3,88 (m, 5Н), 2,64-2,96 (m, 4Н), 2,4 (m, 2Н), 2,05 (m, 1Н), 1,87 (m, 1Н), 1,67-1,8 (m, 4Н), 1,45-1,66 (m, 7Н), 1,24-1,42 (m, 4Н), 0,87 (d, 3H). Приклад 3 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4(фуран-3-ілметокси)-1Н-індол-2-карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(фуран-3-ілметокси)-1Hіндол-2-карбонової кислоти 16с та аміну 14. + 1 МС (ІЕР): 496 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 11,42 (s, 1Н), 8,15 (d, 1Н), 7,81 (s, 1H), 7,67 (s, 1H), 7,25 (s, 1H), 7,04 (t, 1H), 6,98 (d, 1H), 6,61 (s, 1H), 6,58 (d, 1H), 5,02 (s, 2H), 4,8 (s, 1H), 4,51 (d, 1H), 3,71 (m, 1H), 2,72-2,94 (m, 3H), 2,4 (m, 2H), 1,86 (m, 1H), 1,44-1,8 (m, 10H), 1,22-1,43 (m, 4H), 0,87 (d, 3H). Приклад 4 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(2хлортіазол-4-ілметокси)-1H-індол-2-карбонової кислоти 97389 36 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(2-хлортіазол-4-ілметокси)1Н-індол-2-карбонової кислоти 16d та аміну 14. + 1 МС (ІЕР): 547 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 11,5 (s, 1H), 9,45 (br, 1H), 8,20 (d, 1Н), 7,8 (s, 1H), 7,28 (s, 1H), 7,05 (dd, 1H), 7,03 (dd, 1H), 6,63 (d, 1H), 5,2 (s, 1Н), 5,05 (br, 1Н), 4,37 (br, 1Н), 3,75 (m, 1Н), 2,72-3,5 (m, 3H), 2,62 (m, 2Н), 1,95 (m, 1Н), 1,55-1,8 (m, 10Н), 1,3-1,45 (m, 4Н), 0,95 (d, 3H). Приклад 5 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4(6-метоксипіридин-3-ілметокси)-1H-індол-2карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(6-метоксипіридин-3ілметокси)-1Н-індол-2-карбонової кислоти 16е та аміну 14. + 1 МС (ІЕР): 537 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,44 (s, 1Н), 8,32 (d, 1H), 8,16 (d, 1Н), 7,85 (dd, 1Н), 7,26 (d, 1Н), 7,07 (t, 1Н), 7,0 (d, 1Н), 6,87 (d, 1Н), 6,62 (d, 1Н), 5,13 (s, 2Н), 4,81 (s, 1Н), 4,52 (d, 1Н), 3,87 (s, 3H), 3,71 (m, 1Н), 2,75-2,94 (m, 3H), 2,41 (m, 2Н), 1,87 (m, 1Н), 1,47-1,79 (m, 10Н), 1,24-1,42 (m, 4Н), 0,88 (d, 3H). Приклад 6 {4-Гідрокси-4[2-((3 S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(4оксо-4,5,6,7-тетрагідробензофуран-3-ілметокси)1Н-індол-2-карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(4-оксо-4,5,6,7тетрагідробензофуран-3-ілметокси)-1Н-індол-2карбонової кислоти 16f та аміну 14. + 1 МС (ІЕР): 564 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,43 (s, 1Н), 8,14 (d, 1Н), 7,79 (s, 1Н), 7,26 (s, 1Н), 7,06 (t, 1Н), 7,0 (d, 1Н), 6,56 (d, 1Н), 5,18 (s, 2Н), 4,82 (s, 1Н), 4,52 (d, 1Н), 3,71 (m, 1Н), 2,92 (m, 2Н), 2,73-2,88 (m, 3H), 2,35-2,48 (m, 4Н), 37 97389 38 2,12 (m, 2Н), 1,88 (m, 1Н), 1,45-1,78 (m, 10Н), 1,211,43 (m, 4Н), 0,88 (d, 3H). Приклад 7 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4(6,6-диметил-4-оксо-4,5,6,7-тетрагідробензофуран3-ілметокси)-1Н-індол-2-карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(6,6-диметил-4-оксо4,5,6,7-тетрагідробензофуран-3-ілметокси)-1Ніндол-2-карбонової кислоти 16g та аміну 14. + 1 МС (ІЕР): 592 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,46 (s, 1Н), 9,9 (br s, 1H), 8,17 (d, 1Н), 7,79 (s, 1Н), 7,23 (s, 1Н), 7,03 (dd, 1Н), 7,0 (dd, 1Н), 6,56 (d, 1Н), 5,2 (br, 1Н), 5,18 (s, 2Н), 4,37 (br, 1Н), 3,74 (m, 1Н), 3,3-3,5 (m, 4H), 3,0-3,2 (m, 3H), 2,82 (s, 2H), 2,36 (s, 2H), 1,9 (m, 2Н), 1,5-1,85 (m, 8Н), 1,25-1,4 (m, 2Н), 1,08 (s, 6H), 0,92 (d, 3H). Приклад 8 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4[(S)-1-(2,3-дигідробензофуран-3-іл)метокси]-1Ніндол-2-карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[(S)-1-(2,3дигідробензофуран-3-іл)метокси]-1Н-індол-2карбонової кислоти 16h та аміну 14. + 1 МС (ІЕР): 548 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,46 (s, 1H), 8,25 (d, 1Н), 7,45 (d, 1Н), 7,27 (s, 1Н), 7,15 (t, 1H), 6,99-7,06 (m, 2H), 6,87 (t, 1H), 6,81 (d, 1H), 6,52 (d, 1H), 4,85 (br s, 1Н), 4,73 (t, 1Н), 4,53 (d, 1Н), 4,48 (dd, 1Н), 4,31 (m, 1Н), 4,28 (m, 1Н), 4,02 (m, 1Н), 3,74 (m, 1Н), 2,77-2,95 (m, 3H), 2,42 (m, 2Н), 1,89 (m, 1Н), 1,47-1,81 (m, 10Н), 1,27-1,42 (m, 4Н), 0,88 (d, 3H). Приклад 9 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4((R,S)-6-метокси-2,3-дигідробензофуран-3ілметокси)-1H-індол-2-карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-((R,S)-6-метокси-2,3дигідробензофуран-3-ілметокси)-1Н-індол-2карбонової кислоти 16і та аміну 14. + 1 МС (ІЕР): 578 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,46 (s, 1Н), 8,25 (d, 1H), 7,32 (d, 1H), 7,27 (s, 1H), 6,99-7,06 (m, 2H), 6,52 (d, 1H), 6,43 (m, 2H), 4,85 (br s, 1H), 4,74 (t, 1H), 4,54 (br s, 1H), 4,49 (dd, 1H), 4,24 (m, 1H), 4,14 (m, 1H), 3,93 (m, 1H), 3,76 (m, 1H), 3,71 (s, 3H), 2,76-2,98 (m, 3H), 2,44 (m, 2H), 1,9 (m, 1H), 1,46-1,83 (m, 10H), 1,26-1,45 (m, 4H), 0,89 (d, 3H). Приклад 10 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4(4-метоксибензофуран-3-ілметокси)-1H-індол-2карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(4-метоксибензофуран-3ілметокси)-1H-індол-2-карбонової кислоти (синтез описаний у WO2005077932A2, сполука 122) та аміну 14. + 1 МС (ІЕР): 576 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,43 (s, 1Н), 8,11 (d, 1Н), 8,01 (s, 1Н), 7,27 (m, 2H), 7,2 (d, 1H), 7,08 (t, 1H), 7,01 (d, 1Н), 6,81 (d, 1H), 6,65 (d, 1H), 5,34 (s, 2H), 4,81 (m, 1Н), 4,52 (d, 1Н), 3,8 (s, 3H), 3,7 (m, 1Н), 2,73-2,95 (m, 3H), 2,4 (m, 2Н), 1,87 (m, 1Н), 1,46-1,78 (m, 10Н), 1,22-1,42 (m, 4Н), 0,87 (d, 3H). Приклад 11 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4(4,6-дифторбензофуран-3-ілметокси)-1H-індол-2карбонової кислоти 39 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(4,6-дифторбензофуран-3ілметокси)-1H-індол-2-карбонової кислоти (синтез описаний у WO2005077932A2, сполука 115) та аміну 14. + 1 МС (ІЕР): 582 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,45 (s, 1H), 8,26 (s, 1H), 8,14 (d, 1Н), 7,54 (dd, 1Н), 7,22 (m, 2Н), 7,08 (t, 1Н), 7,02 (d, 1Н), 6,68 (d, 1Н), 5,3 (s, 2Н), 4,8 (m, 1Н), 4,51 (d, 1Н), 3,7 (m, 1Н), 2,72-2,95 (m, 3H), 2,4 (m, 2Н), 1,87 (m, 1Н), 1,45-1,79 (m, 10Н), 1,22-1,43 (m, 4Н), 0,87 (d, 3H). Приклад 12 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4(5-хлорбензофуран-3-ілметокси)-1Н-індол-2карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(5-хлорбензофуран-3ілметокси)-1Н-індол-2-карбонової кислоти (синтез описаний у WO2005077932A2, сполука 113) та аміну 14. + 1 МС (ІЕР): 581 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,49 (s, 1Н), 8,27 (s, 1H), 8,16 (d, 1Н), 7,81 (d, 1Н), 7,69 (d, 1Н), 7,41 (d, 1H), 7,39 (s, 1Н), 7,26 (s, 1H), 7,11 (t, 1H), 7,05 (d, 1Н), 6,72 (d, 1Н), 5,37 (s, 2Н), 4,53 (d, 1Н), 3,72 (m, 1Н), 2,91 (m, 1Н), 2,82 (m, 2Н), 2,42 (m, 2Н), 1,89 (m, 1Н), 1,46-1,8 (m, 10Н), 1,23-1,43 (m, 4Н), 0,88 (d, 3H). Приклад 13 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4(6-метоксибензофуран-3-ілметокси)-1H-індол-2карбонової кислоти 97389 40 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(6-метоксибензофуран-3ілметокси)-1Н-індол-2-карбонової кислоти (синтез описаний у WO2005077932A2, сполука 120) та аміну 14. + 1 МС (ІЕР): 576 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,44 (s, 1Н), 8,14 (d, 1Н), 8,03 (s, 1Н), 7,57 (d, 1Н), 7,22 (m, 2Н), 7,08 (t, 1Н), 7,01 (d, 1Н), 6,93 (dd, 1Н), 6,69 (d, 1Н), 5,31 (s, 2Н), 4,8 (br s, 1Н), 4,51 (d, 1Н), 3,81 (s, 3H), 3,7 (m, 1Н), 2,73-2,96 (m, 3H), 2,4 (m, 2Н), 1,86 (m, 1Н), 1,45-1,79 (m, 10Н), 1,24-1,42 (m, 4Н), 0,87 (d, 3H). Приклад 14 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4(6-етоксибензофуран-3-ілметокси)-1Н-індол-2карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(6-етоксибензофуран-3ілметокси)-1Н-індол-2-карбонової кислоти 30а та аміну 14. + 1 МС (ІЕР): 590 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,45 (s, 1H), 9,3 (br, 1H), 8,15 (d, 1Н), 8,03 (s, 1Н), 7,55 (d, 1Н), 7,23 (s, 1Н), 7,19 (s, 1Н), 7,08 (dd, 1Н), 7,02 (d, 1Н), 6,92 (m, 1Н), 6,7 (d, 1Н), 5,3 (s, 2Н), 4,06 (q, 2Н), 3,7-3,9 (m, 3H), 3,0-3,25 (m, 3H), 2,94 (m, 2Н), 2,61 (m, 2Н), 1,5-1,8 (m, 12Н), 1,35 (t, 3H), 0,94 (d, 3H). Приклад 15 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-(6циклопропілметоксибензофуран-3-ілметокси)-1Hіндол-2-карбонової кислоти 41 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(6циклопропілметоксибензофуран-3-ілметокси)-1Hіндол-2-карбонової кислоти 30b та аміну 14. + 1 МС (ІЕР): 616 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 11,45 (s, 1H), 9,7 (br, 1Н), 8,17 (d, 1Н), 8,02 (s, 1H), 7,55 (d, 1H), 7,22 (d, 1H), 7,18 (d, 1H), 7,08 (dd, 1H), 7,0 (d, 1H), 6,9 (dd, 1Н), 6,68 (d, 1H), 5,7 (s, 2H), 5,0 (br, 1H), 4,38 (br, 1H), 3,85 (d, 2H), 3,65-3,9 (m, 2H), 2,5-3,5 (m, 6Н), 1,3-2,0 (m, 13Н), 0,92 (d, 3H), 0,55-0,6 (m, 2Н), 0,3-0,38 (m, 2Н). Приклад 16 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(2-етоксиетокси)-бензофуран-3-ілметокси]-1Ніндол-2-карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[6-(2-етоксиетокси)бензофуран-3-ілметокси]-1Н-індол-2-карбонової кислоти 30с та аміну 14. + 1 МС (ІЕР): 634 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,44 (s, 1H), 9,7 (br, 1H), 8,15 (d, 1Н), 8,02 (s, 1H), 7,56 (d, 1Н), 7,22 (d, 1H), 7,2 (m, 1H), 7,08 (dd, 1Н), 7,0 (d, 1H), 6,92 (dd, 1Н), 6,68 (d, 1Н), 5,3 (s, 2Н), 5,0 (br, 1Н), 4,38 (br, 1Н), 4,13 (t, 2Н), 3,7 (t, 2Н), 3,68-3,75 (m, 1Н), 3,5 (q, 2Н), 2,7-2,9 (m, 3H), 2,39 (m, 2Н), 1,2-2,0 (m, 14Н), 1,13 (t, 3H), 0,9 (d, 3H). Приклад 17 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6((RS)-2-метокси-1-метилетокси)-бензофуран-3ілметокси]-1Н-індол-2-карбонової кислоти 97389 42 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[6-((RS)-2-метокси-1метилетокси)-бензофуран-3-ілметокси]-1Н-індол2-карбонової кислоти 30d та аміну 14. + 1 МС (ІЕР): 634,4 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 11,45 (s, 1H), 9,53 (br, 1H), 8,15 (d, 1H), 8,03 (s, 1Н), 7,55 (d, 1H), 7,22 (m, 1H), 7,21 (m, 1H), 7,08 (dd, 1Н), 7,0 (d, 1Н), 6,9 (dd, 1Н), 6,68 (d, 1Н), 5,3 (s, 2Н), 5,1 (br, 1Н), 4,65 (m, 1Н), 4,4 (br, 1Н), 4,08 (m, 1Н), 3,7 (m, 2Н), 3,65-3,9 (m, 1Н), 3,42-3,55 (m, 2H), 3,25-3,35 (m, 5H), 3,18 (m, 2H), 1,2-2,0 (m, 12H), 1,23 (d, 3H), 0,9 (d, 3H). Приклад 18 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(2-ізопропоксиетокси)-бензофуран-3-ілметокси]1Н-індол-2-карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[6-(2-ізопропоксиетокси)бензофуран-3-ілметокси]-1Н-індол-2-карбонової кислоти 30е та аміну 14. + 1 МС (ІЕР): 648,4 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,46 (s, 1H), 9,9 (br, 1H), 8,15 (d, 1H), 8,02 (s, 1H), 7,55 (d, 1H), 7,22 (s, 1H), 7,22 (s, 1H), 7,07 (dd, 1H), 7,01 (d, 1H), 6,92 (dd, 1Н), 6,69 (d, 1Н), 5,3 (s, 2Н), 5,02 (br d, 1Н), 4,35 (s, 1Н), 4,1 (t, 2H), 3,7 (m, 3H), 3,62 (m, 1H), 3,3-3,45 (m, 2H), 3,15 (m, 1H), 3,05 (m, 2H), 2,9 (m, 1H), 2,58 (m, 1H), 1,25-2,0 (m, 12H), 1,11 (d, 6H), 0,92 (d, 3H). Приклад 19 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(3-метоксипропокси)-бензофуран-3-ілметокси]-1Ніндол-2-карбонової кислоти 43 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[6-(3-метоксипропокси)бензофуран-3-ілметокси]-1Н-індол-2-карбонової кислоти 30f та аміну 14. + 1 MC (ΙΕΡ): 634 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,46 (s, 1H), 9,92 (br, 1H), 8,15 (d, 1H), 8,02 (s, 1H), 7,55 (d, 1H), 7,22 (s, 1H), 7,19 (s, 1H), 7,05 (dd, 1H), 7,01 (d, 1H), 6,91 (d, 1H), 6,68 (d, 1H), 5,3 (s, 2H), 4,2 (br, 2H), 4,05 (t, 2H), 3,72 (m, 1H), 3,47 (t, 2H), 3,3-3,45 (m, 2H), 3,24 (s, 3H), 3,15 (m, 2H), 3,06 (m, 2H), 2,9 (m, 1H), 2,6 (m, 1H), 1,25-2,0 (m, 13H), 0,92 (d, 3H). Приклад 20 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[6(3-етоксипропокси)-бензофуран-3-ілметокси]-1Ніндол-2-карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[6-(3-етоксипропокси)бензофуран-3-ілметокси]-1Н-індол-2-карбонової кислоти 30g та аміну 14. + 1 МС (ІЕР): 648,5 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 11,47 (s, 1H), 10,1 (br, 1H), 8,15 (d, 1H), 8,02 (s, 1H), 7,55 (d, 1H), 7,22 (s, 1H), 7,19 (s, 1H), 7,07 (dd, 1H), 7,01 (d, 1H), 6,91 (d, 1Н), 6,68 (d, 1H), 5,29 (s, 2H), 5,0-5,5 (br, 2H), 4,06 (t, 2H), 3,72 (m, 1H), 3,51 (t, 2H), 3,35-3,45 (m, 3H), 3,31 (m, 1Н), 3,15 (m, 1Н), 3,06 (m, 2Н), 2,91 (m, 1Н), 2,57 (m, 1Н), 1,25-2,0 (m, 14Н), 1,10 (t, 3H), 0,92 (d, 3H). Приклад 21 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-{6[(S)-(тетрагідрофуран-3-іл)окси]-бензофуран-3ілметокси}-1Н-індол-2-карбонової кислоти 97389 44 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-{6-[(S)-(тетрагідрофуран-3іл)окси]-бензофуран-3-ілметокси}-1Н-індол-2карбонової кислоти 30h та аміну 14. + 1 МС (ІЕР): 632 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,45 (s, 1H), 9,8 (br, 1H), 8,15 (d, 1Н), 8,02 (s, 1Н), 7,55 (d, 1H), 7,22 (s, 1Н), 7,19 (s, 1H), 7,07 (dd, 1H), 7,01 (d, 1Н), 6,90 (d, 1Н), 6,69 (d, 1H), 5,29 (s, 2H), 5,07 (m, 1H), 5,0 (br, 1H), 4,4 (br, 1H), 3,6-3,95 (m, 5H), 2,6-2,9 (m, 3H), 2,38 (t, 2Н), 2,22 (m, 2Н), 1,2-2,0 (m, 14Н), 0,86 (d, 3H). Приклад 22 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4(6-фторбензофуран-3-ілметокси)-1H-індол-2карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(6-фторбензофуран-3ілметокси)-1Н-індол-2-карбонової кислоти (синтез описаний у WO2005077932A2, сполука 106) та аміну 14. + 1 МС (ІЕР): 564 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 11,44 (s, 1H), 8,19 (s, 1H), 8,13 (d, 1Н), 7,72 (dd, 1Н), 7,58 (dd, 1H), 7,23 (s, 1H), 7,19 (m, 1H), 7,08 (t, 1H), 7,01 (d, 1H), 6,7 (d, 1Н), 5,35 (s, 2Н), 4,79 (br s, 1Н), 4,51 (d, 1Н), 3,7 (m, 1H), 2,732,95 (m, 3H), 2,4 (m, 2H), 1,87 (m, 1H), 1,45-1,79 (m, 10H), 1,2-1,44 (m, 4H), 0,88 (d, 3H). Приклад 23 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4(7-метоксибензофуран-3-ілметокси)-1H-індол-2карбонової кислоти 45 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-(7-метоксибензофуран-3ілметокси)-1H-індол-2-карбонової кислоти (синтез описаний у WO2005077932A2, сполука 119) та аміну 14. + 1 МС (ІЕР): 576 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,46 (s, 1Н), 8,16 (d, 1Н), 8,13 (s, 1Н), 7,27 (m, 1Н), 7,17-7,25 (m, 2Н), 7,05-7,1 (m, 1Н), 7,02 (m, 1Н), 6,97 (m, 1Н), 6,71 (m, 1Н), 5,33 (s, 2Н), 4,99 (br, 1Н), 4,3 (br, 1Н), 3,94 (s, 3H), 3,71 (m, 1Н), 2,8-3,4 (m, 7Н), 1,91 (m, 2Н), 1,5-1,8 (m, 7Н), 1,34 (m, 4Н), 0,92 (d, 3H). Приклад 24 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(2-метоксифеніл)-етокси]-1H-індол-2-карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[2-(2-метоксифеніл)етокси]-1H-індол-2-карбонової кислоти 16j та аміну 14. + 1 МС (ІЕР): 550 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,44 (s, 1Н), 8,22 (d, 1H), 7,79 (d, 0,5H), 7,54 (d, 0,5H), 7,2-7,32 (m, 4H), 6,96-7,05 (m, 3H), 6,9 (t, 1H), 6,5 (d, 1H), 4,73 (br s, 1H), 4,23 (t, 2H), 3,82 (s, 3H), 3,73 (m, 1H), 3,1 (t, 2H), 2,93-3,06 (br m, 3H), 2,6-2,75 (br m, 2H), 1,41-1,87 (m, 11H), 1,141,4 (m, 3H), 0,91 (d, 3H). Приклад 25 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(3-метоксифеніл)-етокси]-1Н-індол-2-карбонової кислоти 97389 46 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[2-(3-метоксифеніл)етокси]-1Н-індол-2-карбонової кислоти 16k та аміну 14. + 1 МС (ІЕР): 550 [М+Н] , Н-ЯМР (ДМСО-d6): (част./млн) 11,41 (s, 1Н), 8,2 (d, 1Н), 7,24 (s, 1Н), 7,22 (t, 1Н), 6,93-7,05 (m, 4Н), 6,79 (m, 1Н), 6,49 (d, 1Н), 4,83 (br s, 1Н), 4,52 (d, 1Н), 4,29 (t, 2Н), 3,74 (s, 3H, та m, що перекривається, 1Н), 3,09 (t, 2H), 2,75-2,96 (m, 3H), 2,42 (t, 2Н), 1,88 (m, 1Н), 1,471,81 (m, 10Н), 1,21-1,45 (m, 4Н), 0,88 (d, 3H). Приклад 26 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(4-метоксифеніл)-етокси]-1Н-індол-2-карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[2-(4-метоксифеніл)етокси]-1Н-індол-2-карбонової кислоти 161 та аміну 14. + 1 МС (ІЕР): 550 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,42 (s, 1Н), 8,21 (d, 1Н), 7,28 (d, 2H), 7,24 (s, 1H), 7,02 (t, 1H), 6,97 (d, 1H), 6,87 (d, 2H), 6,48 (d, 1H), 4,84 (br s, 1H), 4,52 (d, 1H), 4,23 (t, 2H), 3,72 (s, 3H, та m, що перекривається, 1H), 3,05 (t, 2H), 2,76-2,96 (m, 3H), 2,42 (t, 2H), 1,89 (m, 1H), 1,47-1,82 (m, 10H), 1,25-1,45 (m, 4H), 0,88 (d, 3H). Приклад 27 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4[2-(2-метоксипіридин-3-іл)-етокси]-1Н-індол-2карбонової кислоти 47 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[2-(2-метоксипіридин-3-іл)етокси]-1Н-індол-2-карбонової кислоти 16m та аміну 14. + 1 МС (ІЕР): 551 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,42 (s, 1H), 8,18 (d, 1H), 8,05 (m, 1Н), 7,68 (m, 1Н), 7,21 (s, 1Н), 7,03 (t, 1Н), 6,94-6,98 (m, 2Н), 6,51 (d, 1Н), 4,84 (br s, 1Н), 4,53 (d, 1H), 4,28 (t, 2H), 3,9 (s, 3H), 3,72 (m, 1Н), 3,08 (t, 2H), 2,75-2,95 (m, 3H), 2,42 (t, 2Н), 1,88 (m, 1Н), 1,45-1,81 (m, 10Н), 1,25-1,44 (m, 4Н), 0,88 (d, 3H). Приклад 28 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-цикло-гексил}-амід 4[2-(6-метоксипіридин-3-іл)-етокси]-1Н-індол-2карбонової кислоти Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[2-(6-метоксипіридин-3-іл)етокси]-1Н-індол-2-карбонової кислоти 16n та аміну 14. + 1 МС (ІЕР): 551 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,43 (s, 1Н), 8,21 (d, 1Н), 8,15 (d, 1Н), 7,73 (dd, 1H), 7,23 (s, 1H), 7,02 (t, 1H), 6,97 (d, 1H), 6,77 (d, 1H), 6,48 (d, 1H), 4,84 (br s, 1H), 4,53 (d, 1H), 4,25 (t, 2H), 3,82 (s, 3H), 3,73 (m, 1H), 3,06 (t, 2H), 2,77-2,94 (m, 3H), 2,42 (t, 2H), 1,88 (m, 1H), 1,46-1,81 (m, 10H), 1,24-1,43 (m, 4H), 0,88 (d, 3H). Приклад 29 {4-Гідрокси-4-[2-((3S,4S)-4-гідрокси-3метилпіперидин-1-іл)-етил]-циклогексил}-амід 4-[2(6-метоксибензофуран-3-іл)-етокси]-1Н-індол-2карбонової кислоти 97389 48 Цю сполуку синтезують аналогічно синтезу сполуки прикладу 1 з 4-[2-(6-метоксибензофуран3-іл)-етокси]-1Н-індол-2-карбонової кислоти 16о та аміну 14. + 1 МС (ІЕР): 590 [М+Н] , H-ЯМР (ДМСО-d6): (част./млн) 11,42 (s, 1Н), 8,19 (d, 1Н), 7,76 (s, 1Н), 7,61 (d, 1H), 7,25 (s, 1H), 7,14 (d, 1H), 7,02 (t, 1H), 6,97 (d, 1H), 6,87 (dd, 1H), 6,5 (d, 1Н), 4,82 (br s, 1H), 4,52 (d, 1H), 4,34 (t, 2H), 3,78 (s, 3H), 3,71 (m, 1H), 3,15 (t, 2H), 2,74-2,93 (m, 3H), 2,41 (t, 2Н), 1,87 (m, 1Н), 1,46-1,8 (m, 10Н), 1,25-1,42 (m, 4Н), 0,87 (d, 3H). Сполуки формули І у вільній формі або у формі фармацевтично прийнятної солі мають цінні фармакологічні характеристики, наприклад, як антагоністи CCR2 та CCR5, про що свідчать результати досліджень in vitro, описаних нижче. а) Дослідження зв'язування CCR2 з мембраною Методологію ПСА (проксимальносцинтиляційний аналіз) використовують, щоб показати, що досліджувані сполуки попереджають зв'язування МСР-1 з клітинними мембранами, що експресують рецептор CCR2. Трансфіковані клітини CHO-dukX, що стабільно експресують ген hCCR2b, вирощують в середовищі МПС альфа (мінімальне підтримуюче середовище) до злиття, що становить від 70 до 80%. Після видалення середовища додають 30 мл охолодженого льодом фізіологічного буферного розчину, що містить 1 мМ ЕДТК (етилендіамінтетраоцтова кислота), та клітини вилучають з планшету скребком. Суспензію клітин центрифугують при 800 g впродовж 10 хвил. при 4°С та таблетку клітин повторно суспендують в буфері. Лізис клітин проводять за допомогою приладу Polytron PTI300D при 28000 оборотів/хвилину 2 рази по 30 сек. на льоду. Мембрани збирають за допомогою центрифугування при 42000 g впродовж 20 хвилин при 4°С та повторно піддають лізису (Polytron, 28000 оборотів/хвилину, 230 с на льоду). Після центрифугування при 42000 g впродовж 20 хвил. при 4°C мембрани повторно суспендують у буфері при концентрації білку, що дорівнює 2 мг/мл, та зберігають при 80°C. Готують 10 мМ вихідні розчини досліджуваних сполук в 100% ДМСО. Досліджувані сполуки додатково розводять у буфері та отримують чотириразово розведені розчини для досліджень, які -10 -5 використовують у діапазоні 10 -10 М. Дослідження за допомогою ПСА проводять при кінцевому об'ємі, що дорівнює 200 мкл/лунку, в 96лункових планшетах. Компоненти додають у лунки в наступному порядку: 50 мкл Буфер (+/- досліджувана сполука) 50 мкл Гранули ПАК (поліакрилат натрію) з аглютиніном зародків пшениці (1,25 мг/лунка) у буфері 50 мкл Суспензія мембран CCR2B, розведена буфером до 0,04 мг/мл (2 мкг/лунку), альтернативно - 50000 клітин/лунку 125 50 мкл [ І] МСР-1 у буфері (кінцева концентрація 60 пМ, 2,5 мкКі/планшет) Після додавання всіх компонентів планшет герметизують та інкубують впродовж 90 хвил. при 49 кімнатній температурі при постійному струшуванні. Після інкубації планшет центрифугують при 1000 оборотів/хвил. у центрифузі Sorvall RC3B впродовж 4 хвил. при кімнатній температурі та проводять підрахунок впродовж 3 хвил./лунку на приладі ТОР COUNT (Packard). Скореговані на гасіння кількості імпульсів використовують для дослідження зв'язування радіоліганду. Сполуки формули І мають значення ІС50, рівні від 0,002 до 10 мкМ: Аналогічним чином проведені дослідження зв'язування з рецепторами CCR2 щурів, мишей та макак-резусів. Внаслідок специфічності антагоністів CCR2 для різних видів сполуки формули І мають значення ІС50, рівні від 0,015 до 10 мкМ для CCR2 мишей та від 0,020 до 10 мкМ для CCR2 щурів. b) Функціональне дослідження CCR2 - хемотаксис Мікро-крізьклітинне дослідження хемотаксису з використанням моноцитів периферичної крові людини використовують для дослідження антагоністів CCR2. Мононуклеари периферичної крові людини (МНПК) виділяють із лейкоцитарної плівки донорної крові за допомогою центрифугування в градієнті щільності Ficoll-Paque. МНПК, зібрані на границі розділу, промивають та до використання заморожують при -80°. Дослідження хемотаксису проводять в 96-лункових планшетах MultiScreenMIC з полікарбонатними фільтрами, що мають пори розміром 5 мкм. Суспензії клітин та МСР-1 (1 нМ) готують у середовищі RPMI1640 із глютамаксом з додаванням 1% замінних амінокислот, пірувату натрію, суміші пеніцилін/стрептоміцин, 50 мкМ бета-меркаптоетанолу та 1% альбуміну людини. Заморожені МНПК відтають, промивають та 6 повторно суспендують при 210 /мл. Для оцінки інгібуючого впливу сполук на опосередковуваний за допомогою CCR2 хемотаксис, клітини, МСР-1 та сполуки готовлять у вигляді розведених вдвічі концентрованих розчинів, перемішують та поміщають у фільтрувальний планшет та прийомний планшет. Важливо відзначити, що сполуки попередньо розводять у ДМСО при 2000-разовому молярному надлишку, таким чином, що кінцева концентрація ДМСО при дослідженні хемотаксису дорівнює 0,05% (показано, що ця концентрація ДМСО не впливає на хемотаксис). Для створення однорідної концентрації сполуки додають у верхнє відділення (клітини), а також у нижнє відділення (хемокін). Після міграції впродовж 3 годин при 37°С в інкубаторі фільтруючий планшет обережно знімають із прийомного планшету та відкидають. Клітинну прийомному планшеті, що мігрували, повторно суспендують та переносять у круглодонний 96-лунковий планшет, центрифугують та повторно суспендують в 100 ЗФР (забуферений фосфатом фізіологічний розчин), що містить 2% ФТС та 0,1% NaN3. Вихідні клітини (100 мкл) обробляють аналогічним чином. Для оцінки специфічної міграції додають фіксовану кількість гранул (10000) в 20 мкл буферу та суспензію аналізують за допомогою проточної цитометрії з використанням приладу FACScalibur, забезпеченого автоматичним пробовідбірником AutoSampler MAS-1, та програмного 97389 50 забезпечення CellQuest з використанням заданих настроювань для МНПК та гранул. Моноцити ідентифікують за даними про розсіювання вперед (FSC) та бічне розсіювання (SSC). Хемотаксис характеризують у відсотках від кількості вихідних моноцитів по наступній формулі: ((моноцити, %/гранули,%)/(вихідні моноцити, %/вихідні гранули, %))*100. с) Функціональне дослідження CCR5 - хемотаксис Мікро-крізьклітинне дослідження хемотаксису з використанням мишачих В-клітин-попередників L1.2, трансфікованих за допомогою CCR5 людини, використовують для дослідження антагоністів CCR5. Клітини вирощують у середовищі RPMI1640 із глютамаксом з додаванням 1% замінних амінокислот, пірувату натрію, суміші пеніцилін/стрептоміцин, 50 мкМ бета-меркаптоетанолу (що далі в даному винаході називають повним середовищем RPMI) та 10% інактивованих нагріванням ФТС. Клітини звичайно зберігають у куль6 турі при щільності, рівній менше 1,510 клітин/мл. За день до проведення експерименту клітини роз6 водять до щільності, рівної 0,210 клітин/мл. Дослідження хемотаксису проводять в 96-лункових планшетах MultiScreen-MIC з полікарбонатними фільтрами, що мають пори розміром 5 мкм. Суспензії клітин та МІР-1 розводять у повному середовищі RPMI, що містить 1% альбуміну людини. 6 100 мкл 210 клітин/мл додають у лунки фільтрувального планшету та потім фільтрувальний планшет обережно поміщають на прийомний планшет, що містить 150 мкл середовища, що є контролем, або певного розведення МІР-1. Для оцінки інгібуючого впливу сполук на опосередковуваний за допомогою CCR5 хемотаксис, клітини, МІР-1 та сполуки готують у вигляді розведених вдвічі концентрованих розчинів, перемішують та поміщають у фільтрувальний планшет та прийомний планшет. Важливо відзначити, що сполуки попередньо розводять у ДМСО при 2000-разовому молярному надлишку, таким чином, що кінцева концентрація ДМСО при дослідженні хемотаксису дорівнює 0,05% (показано, що ця концентрація ДМСО не впливає на хемотаксис). Для створення однорідної концентрації сполуки додають у верхнє відділення (клітини), а також у нижнє відділення (МІР-1). Після міграції впродовж 4 годин при 37°С в інкубаторі фільтруючий планшет обережно знімають із прийомного планшету та відкидають. Клітини у прийомному планшеті, що мігрували, повторно суспендують та переносять у кругло донний 96-лунковий планшет, центрифугують та повторно суспендують в 100 ЗФР, що містить 2% ФТС та 0,1% NaN3. Вихідні клітини (100 мкл) обробляють аналогічним чином. Для оцінки специфічної міграції додають фіксовану кількість гранул (10000) в 20 мкл буферу FACS та суспензію аналізують за допомогою проточної цитометрії з використанням приладу FACScalibur, забезпеченого автоматичним пробовідбірником AutoSampler MAS-1, та програмного забезпечення CellQuest з використанням заданих настроювань для клітин 300-19 та гранул. Хемотаксис характеризують у відсотках від кількості вихідних клітин за наступ 51 97389 ною формулою: ((клітини, %/%/гранули,%)/(вихідні клітини, %/вихідні гранули, %))*100. d) Дослідження зв'язування CCR5 з мембранами CCR5 людини використовують для одержання стабільних трансфектантів у клітинах СНО K1. Мембрани, приготовлені із цих трансфектантів CCR5, застосовують для дослідження зв'язування радіолігандів з використанням 125-І-МІР-1 як ліганду та досліджують інгібуючу активність сполук 52 формули І. Дані приводять у вигляді значень ІС50, тобто концентрації сполуки, необхідної для забезпечення 50% інгібування зв'язування [І-125]МІР-1. За даними цього дослідження сполуки формули І мають значення ІС50, рівні від 0,004 до 10 мкМ. За даними цих досліджень сполуки формули І мають значення ІС50, рівні від 0,0002 до 10 мкМ. Конкретні дані наведені в прикладених таблицях: Приклад 1 6 7 8 10 11 12 13 15 CCR2 ІС50 [нМ] 12,0 24,3 13,8 10,8 1,5 2,3 0,2 2,7 0,4 Приклад 16 17 18 19 20 21 22 23 CCR2 ІС50 [нМ] 0,8 0,8 0,2 0,7 0,9 1,6 7,4 12,5 Приклад 1 3 6 7 8 10 12 CCR5 ІС50 [нМ] 13,2 13,8 27,0 11,9 58,5 10,6 0,5 Приклад 15 13 16 18 20 21 23 CCR5 ІС50 [нМ] 4,8 5,8 2,9 3,3 3,2 9,0 12,1 Засоби, запропоновані в даному винаході, є ефективними як подвійні антагоністи CCR-2 та CCR-5. Тому засоби, запропоновані в даному винаході, застосовні для профілактики та лікування опосередковуваних за допомогою CCR-2 та CCR-5 захворювань або патологічних станів. CCR-2 та CCR-5 відіграють важливу роль у переносі лейкоцитів, зокрема, у міграції моноцитів до ділянок запалення та тому засоби, запропоновані в даному винаході, можна застосовувати для пригнічення міграції моноцитів, наприклад, для лікування запальних патологічних станів, алергій та алергійних патологічних станів, аутоімунних захворювань, хронічного болю, відторгнення трансплантатів, ракових захворювань, які включають інфільтрацію лейкоцитів, стенозу або рестенозу, атеросклерозу, ревматоїдного артриту, остеоартриту та хронічного болю. Захворювання або патологічні стани, які можна лікувати засобами, запропонованими в даному винаході, включають: запальні або алергійні патологічні стани, включаючи респіраторні алергійні захворювання, такі як астма, алергійний риніт, ХОЗЛ (хронічне обструктивне захворювання легенів), алергійні захворювання легенів, гіперчутливий пневмоніт, інтерстиціальний легеневий процес (ІЛП), (наприклад, ідіопатичний фіброз легенів або ІЛП, пов'язане з аутоімунними захворюваннями, такі як RA, SLE тощо); хронічне обструктивне захворювання легенів, анафілаксія або реакції гіперчутливості, лікарські алергії (наприклад, на пеніциліни або цефалоспорини), та алергійні реакції на укус кома хи; запальні захворювання кишечнику, такі як хвороба Крона та виразковий коліт; спондилоартропатії, склеродермія; псоріаз та запальні дерматози, такі як дерматит, екзема, атопічний дерматит, алергійний контактний дерматит, уртикарія; васкуліт; аутоімунні захворювання, зокрема, аутоімунні захворювання з етіологією, що включає запальний компонент, такі як артрит (наприклад, ревматоїдний артрит, хронічний прогресуючий артрит, псоріатичний артрит та деформуючий артрит) та ревматичні захворювання, що включають запальні патологічні стани, та захворювання, що включають втрату кісткової маси, запальний біль, гіперчутливість (включаючи і гіперчутливість дихальних шляхів, і шкірну гіперчутливість) та алергії. Конкретні аутоімунні захворювання, при яких можна застосовувати антитіла, запропоновані в даному винаході, включають аутоімунні гематологічні порушення (включаючи наприклад, гемолітичну анемію, апластичну анемію, справжню еритроцитарну анемію та ідіопатичну тромбоцитопенію), системний червоний вовчак, поліхондрит, склеродермію, грануломатоз Вегенера, дерматоміозит, хронічний активний гепатит, міастенію gravis, псоріаз, синдром Стівенса - Джонсона, ідіопатичний спру, аутоімунне запальне захворювання кишечнику (включаючи наприклад, виразковий коліт, хворобу Крона та синдром подразненої товстої кишки), аутоімунний тиреоідит, хворобу Бехчета, ендокринну офтальмопатію, хворобу Грейвса, саркоідоз, розсіяний склероз, первинний біліарний цироз, юнацький діабет (цукровий діабет типу І), 53 увеїт (передній та задній), сухий кератокон'юнктивіт та весняний кератокон'юнктивіт, інтерстиціальний фіброз легенів та гломерулонефрит (з нефротичним синдромом та без нього, наприклад, включаючи ідіопатичний нефротичний синдром або нефропатію з мінімальними змінами); відторгнення трансплантату (наприклад, при трансплантації серця, легенів, комбінованої серцялегенів, печінки, нирок, підшлункової залози, шкіри та роговиці), включаючи відторгнення алотрансплантату або відторгнення ксенотрансплантату або реакцію "трансплантат проти хазяїна", та атеросклероз, пов'язаний із трансплантацією органу; рак з інфільтрацією лейкоцитів у шкіру або органи; рак молочної залози; стеноз або рестеноз судинної системи, зокрема, артерій, наприклад, коронарної артерії, включаючи стеноз або рестеноз, викликаний операцією на судинах, а також неоінтимальна гіперплазія; інсульт; та інші захворювання або патологічні стани, що включають запальні реакції, включаючи реперфузійне ураження, злоякісні захворювання крові, обумовлену цитокінами токсичність (наприклад, септичний шок або ендотоксичний шок), поліміозит, дерматоміозит, та гранулематозні захворювання, включаючи саркоідоз; інфекційні захворювання, включаючи ВІЛ (вірус імунодефіциту людини) та СНІД (синдром набутого імундефіциту). Термін "лікування" при використанні в даному винаході слід розуміти, як такий, що включає терапевтичний та профілактичний режими лікування, наприклад, у зв'язку з лікуванням неоплазії лікування для попередження прояву неоплазії, що виявляють клінічно або доклінічно, або попередження утворення злоякісних клітин, або зупинку або обіг прогресування передракових клітин у ракові, а також попередження або пригнічення росту або метастазування новоутворень. У цьому контексті даний винахід переважно відноситься до застосування сполук, запропонованих у даному винаході, для пригнічення або попередження розвинення раку шкіри, наприклад, сквамозної або базально-клітинної карциноми після впливу ультрафіолетового випромінювання, наприклад, обумовленого тривалим впливом сонячного світла. Засоби, запропоновані в даному винаході, є особливо підходящими для лікування захворювань кісток та розладів метаболізму хрящів, включаючи остеоартрит, остеопороз та інші запальні ураження шкіри ревматичного або подагричного походження, наприклад, ревматоїдний артрит та втрату кісткової маси, включаючи вікову втрату кісткової маси, та, особливо, захворювання періодонту. Засоби, запропоновані в даному винаході, також можна застосовувати в офтальмології, включаючи лікування очних хвороб, зокрема, запальних очних розладів, очного болю, включаючи біль, пов'язаний з операціями очей, такими як фоторефракційна кератоектомія та видалення катаракти, алергійними захворюваннями ока, фотофобією різної етіології, підвищеним внутрішньоочним тиском (при глаукомі) шляхом пригнічення утворення 97389 54 білку, індукуючого глюкокортикоїдну відповідь трабекулярної системи (TIGR), та сухого кератиту. Зрозуміло, при зазначених вище показаннях підходяща доза буде мінятися, наприклад, залежно від конкретного засобу, що використовується, запропонованого в даному винаході, суб'єкта, що піддається лікуванню, шляху введення та природи та важкості патологічного стану, що піддається лікуванню. Однак зазначають, що при використанні для профілактики задовільні результати звичайно забезпечуються при дозах, що становлять від приблизно 0,05 до приблизно 10 мг/(кг маси тіла), частіше - від приблизно 0,1 до приблизно 5 мг/(кг маси тіла). Частота введення при профілактиці звичайно знаходиться в діапазоні від приблизно одного разу в тиждень до приблизно одного разу в 3 місяці, частіше - у діапазоні від приблизно одного разу на 2 тижні до приблизно одного разу на 10 тижнів, наприклад, один раз на 4 або 8 тижнів. Засіб, запропонований у даному винаході, звичайно вводять парентерально, внутрішньовенно, наприклад, у вену, що знаходиться спереду від ліктьового суглоба, або іншу периферичну вену, внутрішньошньом'язово або підшкірно. Наприклад, профілактичне лікування звичайно включає введення засобу, запропонованого в даному винаході, від одного разу на місяць до одного разу в 2-3 місяці або рідше. Засоби, запропоновані в даному винаході, можна вводити в комбінації з іншим активним засобом. Підходящі активні засоби включають антиметаболіти (наприклад, метотрексат), засоби проти фактору некрозу пухлини (наприклад, ремікаде (інфліксимаб), енбрел (етанерцепт), гуміра (адалумімаб)), засоби проти IL-1 (наприклад, пралнакасан, ACZ885), нуклеозидні та ненуклеозидні інгібітори зворотної транскриптази, інгібітори ВІЛ протеази, інгібітори злиття та інші антиретровірусні засоби. Активний засіб або засоби можна вводити одночасно, окремо або послідовно із засобом, запропонованим у даному винаході. Фармацевтичні композиції, запропоновані в даному винаході, можна готувати звичайним чином. Композицію, запропоновану в даному винаході, переважно готують у ліофілізованій формі. Для негайного введення її розчиняють у підходящому водному носії, наприклад, стерильній воді для ін'єкцій або в стерильному забуференому фізіологічному розчині. Якщо вважають бажаним готування більшого об'єму розчину для введення шляхом вливання, а не болюсної ін'єкції, тоді у фізіологічний розчин під час готування переважно додавати сироватковий альбумін людини або власну гепаринізовану кров пацієнта. Наявність надлишку такого фізіологічно інертного білку запобігає втраті антитіл внаслідок адсорбції на стінках контейнера та трубок, що використовуються з розчином для вливання. Якщо використовується альбумін, тоді підходяща концентрація становить від 0,5 до 4,5 мас. % у перерахуванні на масу фізіологічного розчину. Засоби, запропоновані в даному винаході, можна вводити будь-яким звичайним шляхом, наприклад, перорально, наприклад, у вигляді розчинів для пиття, таблеток або капсул, або парентераль 55 97389 но, наприклад, у вигляді розчинів або суспензій для ін'єкцій. Звичайно для системного введення кращі пероральні дозовані форми, хоча при деяких показаннях засоби, запропоновані в даному винаході, також можна вводити місцево або дермально, наприклад, у вигляді шкірного крему або гелю або аналогічних препаратів або, для введення в очі, у вигляді очного крему, гелю або крапель; або можна вводити шляхом інгаляції, наприклад, для лікування астми. Разові дозовані форми, що підходять для перорального введення містять у разовій дозованій формі, наприклад, від 25 до 250 мг засобу, запропонованого в даному винаході. Засоби, запропоновані в даному винаході, звичайно мають сприятливі фармакокінетичні характеристики, тобто такі як відносно швидке виведення. Швидке виведення звичайно вказує на поліпшену переносимість та звичайно зв'язується з меншою кількістю побічних ефектів. Його можна оцінити шляхом визначення, наприклад, залежності зайнятості рецептору CCR2 від часу. Дослідження зайнятості рецептору можна проводити в 96-лункових планшетах. 45 мкл свіжовідібраних проб крові інкубують з 5 мкл розчину МСР1 (декількох концентрацій для побудови залежності для зв'язування). Концентрація зазначеного розчину МСР-1 становить від 0,01 до 100 нм та готують розведення в RPMI1640 із глютамаксом з додаванням 1% замінних амінокислот, пірувату натрію, суміші пеніцилін/стрептоміцин, 50 мкл бета-меркаптоетанолу та 1% альбуміну людини. Приклад № WO05/077932 (приклад 42) WO05/077932 (приклад 86) WO05/077932 (приклад 98) Даний винахід (приклад 15) Даний винахід (приклад 16) Даний винахід (приклад 18) Комп’ютерна верстка О. Гапоненко Доза (мг/кг) 10 10 10 10 10 10 56 Зазначену інкубацію проводять впродовж 30 хвилин при 37°С та потім зупиняють шляхом додавання 180 мкл літичного розчину BD FACS з наступним центрифугуванням. Зазначене додавання літичного розчину та центрифугування повторюють ще раз та потім клітини, що залишилися, промивають холодним буфером FACS (ФБС (фетальна бичача сироватка), що містить 2% ФТС (фетальна теляча сироватка) та 0,1% NaN3). Потім клітини забарвлюють антитілами для дослідження за допомогою FACS. Потім клітини тричі забарвлюють за допомогою FITC-кон'югованого анти-CD14, РЕкон'югованого анти-HLA-DR та АРС-кон'югованого анти-ССR2. Антитіла розводять у буфері FACS, додають 3 мг/мл IgG людини та забарвлення проводять всього в 25 мкл впродовж 30 хвил. на льоді. Забарвлені клітини двічі промивають холодним буфером FACS та потім аналізують за допомогою проточної цитометрії з використанням приладу FACScalibur та програмного забезпечення CellQuest. Визначають експрессування CCR2 на CD-14- та HLA-DR-позитивних моноцитах та результати представляють у вигляді середньої інтенсивності флуоресценції (СІФ). Відносне експресування CCR2 виражають у відсотках від забарвлення контролю. Для сполук, запропонованих у даному винаході, наведені дані свідчать про значне зменшення блокування рецепторів через 24 години у порівнянні зі сполуками наявного рівня техніки. Блокування рецептору через 2 год., % 100 93,2 92,5 103,2 78,1 88,2 Підписне Блокування рецептору через 24 год., % 97,2 92,9 88,3 42,6 21,6 43,5 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAryl carboxylic acid cyclohexyl amide derivatives
Автори англійськоюHersperger, Rene, Janser, Philipp, Miltz, Wolfgang
Назва патенту російськоюПроизводные циклогексиламида арилкарбоновой кислоты
Автори російськоюХерспергер Рене, Янсер Филиипп, Мильтц Вольфганг
МПК / Мітки
МПК: A61P 29/00, A61K 31/435, C07D 401/12, A61P 31/18, C07D 405/14, C07D 417/14, C07D 401/14
Мітки: арилкарбонової, циклогексиламіду, кислоти, похідні
Код посилання
<a href="https://ua.patents.su/28-97389-pokhidni-ciklogeksilamidu-arilkarbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Похідні циклогексиламіду арилкарбонової кислоти</a>