Протипаразитарні агенти
Номер патенту: 97388
Опубліковано: 10.02.2012
Автори: Комлей Стюарт Ніколас, Хоусон Уільям, Лоре Крістелль, Хеннам Джоанн Клер, Сабніс Йогеш Аніл
Формула / Реферат
1. Сполука формули
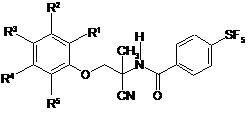 (I)
(I)
або її таутомер або пролікарська форма, або фармацевтично прийнятна сіль вказаної сполуки, таутомеру або пролікарської форми, де:
R1, R2, R3, R4 та R5 кожен незалежно вибрані з Н, гало, CN, СF3 та CONH2.
2. Сполука за п. 1, де R1, R2, R3, R4 та R5 кожен незалежно вибирають з Н, F, Сl, Вr, CN та CF3.
3. Сполука за пп. 1 або 2, де щонайменше один R1, R2, R3, R4 та R5 означає CN та щонайменше два з R1, R2, R3, R4 та R5 означають Н.
4. Сполука за будь-яким з попередніх пунктів, де R1 та R4 означають Н, один з R2 та R3 означає Н та інший означає CN, та R5 вибирають з F, Сl, Вr та СF3.
5. Сполука за будь-яким з попередніх пунктів, де R3 означає CN, та R5 означає СF3.
6. Сполука за будь-яким з попередніх пунктів, вибрана з:
N-{1-ціано-2-[5-ціано-2-(трифторметил)фенокси]-1-метилетил}-4-пентафтортіобензаміду,
N-{(1R)-1-ціано-2-[5-ціано-2-(трифторметил)фенокси]-1-метилетил}-4-пентафтортіобензаміду,
N-{(1S)-1-ціано-2-[5-ціано-2-(трифторметил)фенокси]-1-метилетил}-4-пентафтортіобензаміду,
N-[2-(2-хлор-5-ціанофенокси)-1-ціано-1-метилетил]-4-пентафтортіобензаміду,
N-[2-(2-хлор-5-ціанофенокси)-(1R)-1-ціано-1-метилетил]-4-пентафтортіобензаміду,
N-[2-(2-хлор-5-ціанофенокси)-(1S)-1-ціано-1-метилетил]-4-пентафтортіобензаміду,
N-{1-ціано-2-[4-ціано-2-(трифторметил)фенокси]-1-метилетил}-4-пентафтортіобензаміду,
N-{(1R)1-ціано-2-[4-ціано-2-(трифторметил)фенокси]-1-метилетил}-4-пентафтортіобензаміду,
N-{(1S)1-ціано-2-[4-ціано-2-(трифторметил)фенокси]-1-метилетил}-4-пентафтортіобензаміду,
N-{2-[2-хлор-5-ціано-3-(трифторметил)фенокси]-1-ціано-1-метилетил}-4-пентафтортіобензаміду,
N-{2-[2-хлор-5-ціано-3-(трифторметил)фенокси]-(1R)-1-ціано-1-метилетил}-4-пентафтортіобензаміду,
N-{2-[2-хлор-5-ціано-3-(трифторметил)фенокси]-(1S)-1-ціано-1-метилетил}-4-пентафтортіобензаміду,
N-[2-(2-хлор-4,5-диціанофенокси)-1-ціано-1-метилетил]-4-пентафтортіобензаміду,
N-[2-(2-хлор-4,5-диціанофенокси)-(1R)-1-ціано-1-метилетил]-4-пентафтортіобензаміду,
N-[2-(2-хлор-4,5-диціанофенокси)-(1S)-1-ціано-1-метилетил]-4-пентафтортіобензаміду,
N-(1-ціано-2-[4-ціано-2-(трифторметил)фенокси]-1-метилетил}-4-пентафтортіобензаміду,
N-{(1R)-1-ціано-2-[4-ціано-2-(трифторметил)фенокси]-1-метилетил}-4-пентафтортіобензаміду та
N-{(1S)-1-ціано-2-[4-ціано-2-(трифторметил)фенокси]-1-метилетил}-4-пентафтортіобензаміду,
або її фармацевтично прийнятна сіль.
7. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-6 або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій.
8. Фармацевтична композиція за п. 7, яка додатково містить другий терапевтичний агент.
9. Фармацевтична композиція за п. 8, де другий терапевтичний агент вибирають з наступних: івермектин, авермектин, абамектин, емамектин, епріномектин, дорамектин, селамектин, моксидектин, немадектин, мілбеміцин оксим, альбендазол, камбендазол, фенбендазол, флубендазол, мебендазол, оксфендазол, оксибендазол, парбендазол, тетрамізол, левамізол, пірантел памоат, оксантел, морантел, клозантел, триклабендазол, клорсулон, рафоксанід, ніклозамід, празиквантел, епсипрантел, 2-дезоксопарагерквамід, фіпроніл, пірипрол, пірафлупрол, люфенурон, спіромезифен, тебуфенозид, спіносад, спінеторам, імідаклоприд, динотефуран, метафлумізон, флубендіамід, хлорантраніліпрол, індоксакарб, піридаліл, піримідифен та пірифлуквіназон.
10. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-6 для застосування як лікарського засобу.
11. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-6 для виготовлення лікарського засобу для подолання інвазії паразитами тварини-хазяїна.
12. Застосування за п. 11, де твариною-хазяїном не є людина.
13. Застосування за пп. 11 або 12, де паразитом є нематода.
14. Застосування фармацевтичної композиції за будь-яким з пп. 7-9 для виготовлення лікарського засобу для подолання інвазії паразитами тварини-хазяїна.
15. Застосування за п. 14, де твариною-хазяїном не є людина.
16. Застосування за пп. 14 або 15, де паразитом є нематода.
17. Спосіб подолання інвазії паразитами тварини-хазяїна, в якому тварині-хазяїну вводять ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-6.
18. Спосіб за п. 17, де твариною-хазяїном не є людина.
19.Спосіб за пп. 17 або 18, де паразитом є нематода.
20. Спосіб подолання інвазії паразитами тварини-хазяїна, в якому тварині-хазяїну вводять ефективну кількість фармацевтичної композиції за будь-яким з пп. 7-9.
21. Спосіб за п. 20, де твариною-хазяїном не є людина.
22. Спосіб за пп. 20 або 21, де паразитом є нематода.
Текст
1. Сполука формули R2 C2 2 (19) 1 3 97388 4 8. Фармацевтична композиція за п. 7, яка додатково містить другий терапевтичний агент. 9. Фармацевтична композиція за п. 8, де другий терапевтичний агент вибирають з наступних: івермектин, авермектин, абамектин, емамектин, епріномектин, дорамектин, селамектин, моксидектин, немадектин, мілбеміцин оксим, альбендазол, камбендазол, фенбендазол, флубендазол, мебендазол, оксфендазол, оксибендазол, парбендазол, тетрамізол, левамізол, пірантел памоат, оксантел, морантел, клозантел, триклабендазол, клорсулон, рафоксанід, ніклозамід, празиквантел, епсипрантел, 2-дезоксопарагерквамід, фіпроніл, пірипрол, пірафлупрол, люфенурон, спіромезифен, тебуфенозид, спіносад, спінеторам, імідаклоприд, динотефуран, метафлумізон, флубендіамід, хлорантраніліпрол, індоксакарб, піридаліл, піримідифен та пірифлуквіназон. 10. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-6 для застосування як лікарського засобу. 11. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-6 для виготовлення лікарського засобу для подолання інвазії паразитами тварини-хазяїна. 12. Застосування за п. 11, де твариною-хазяїном не є людина. 13. Застосування за пп. 11 або 12, де паразитом є нематода. 14. Застосування фармацевтичної композиції за будь-яким з пп. 7-9 для виготовлення лікарського засобу для подолання інвазії паразитами тваринихазяїна. 15. Застосування за п. 14, де твариною-хазяїном не є людина. 16. Застосування за пп. 14 або 15, де паразитом є нематода. 17. Спосіб подолання інвазії паразитами тваринихазяїна, в якому тварині-хазяїну вводять ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-6. 18. Спосіб за п. 17, де твариною-хазяїном не є людина. 19.Спосіб за пп. 17 або 18, де паразитом є нематода. 20. Спосіб подолання інвазії паразитами тваринихазяїна, в якому тварині-хазяїну вводять ефективну кількість фармацевтичної композиції за будьяким з пп. 7-9. 21. Спосіб за п. 20, де твариною-хазяїном не є людина. 22. Спосіб за пп. 20 або 21, де паразитом є нематода. Даний винахід стосується похідних пентафтортіобензамідоацетонітрилу. Винахід також стосується фармацевтичних композицій, які містять такі сполуки, та їх застосування для лікування паразитарних інфекцій. Існує потреба у нових агентах для боротьби з інвазією паразитів, які становлять загрозу здоров'ю людини та тварин. Зокрема, нові агенти потрібні для боротьби з інвазією ендопаразитів домашніх тварин, внаслідок значної розповсюджуваності паразитів, та зокрема нематод, які є нечутливими до впливу багатьох агентів, які застосовують на даний час з цією метою. Європейська заявка на патент ЕР-0953565-А2 (Nihon Nohyaku Co. Ltd.) описує клас похідних амідоацетонітрилу та містить данні щодо того, що ці сполуки мають інсектицидні властивості. Міжнародна заявка на патент WO-2002/060257-A1 (Novartis AG) заявляє, що той самий клас є активним проти ендопаразитів, таких як гельмінти. Відповідний клас та підклас описані у WO-2002/049641-A2 (Novartis), WO-2002/050052-А1 (Syngenta), WO2005/044784-A1 (Novartis), WO-2005/121075-A1 (Novartis) та WO-2006/043654 (Nihon). Механізм дії цих агентів ще повністю не визначили. У галузі є потреба у додаткових сполуках як альтернативних або покращених терапевтичних агентах. Бажані сполуки повинні бути сильнодіючими паразитицидними засобами, водночас вони повинні бути нетоксичними або в не значній мірі токсичними для тварини-хазяїна, та повинні існувати у стабільній фізичній формі, бути негігроскопічними та легко утворювати суміш. Вони повинні мати високу біодоступність, бути метаболічно стабільними та мати придатні фармакокінетичні властивості. При застосуванні для домашніх тварин сполуки повинні виводитись таким чином, щоб мінімізувати ризик для харчового ланцюгу. У першому аспекті, даний винахід стосується сполуки формули: або її таутомеру або пролікарської форми, фармацевтично прийнятної солі вказаної сполуки, таутомеру або пролікарської форми, де: 1 2 3 4 5 R , R , R , R та R кожен незалежно вибирають з Н, гало, CN, CF3 та CONH2. У іншому аспекті, даний винахід стосується сполуки формули (І) або її таутомеру або пролікарської форми, фармацевтично прийнятної солі вказаної сполуки, таутомеру або пролікарської форми для застосування як лікарського засобу. У іншому аспекті, даний винахід стосується застосування сполуки формули (І) або її таутомеру або пролікарської форми, фармацевтично прийнятної солі вказаної сполуки, таутомеру або пролікарської форми для виготовлення лікарського засобу для подолання інвазії паразитами тваринихазяїна. 5 Уіншому аспекті, даний винахід стосується способу подолання інвазії паразитами тваринихазяїна, який включає лікування тварини-хазяїна ефективною кількістю сполуки формули (І) або її таутомеру або пролікарської форми, або фармацевтично прийнятної солі вказаної сполуки, таутомеру або пролікарської форми. У іншому аспекті, даний винахід стосується фармацевтичної композиції, яка містить сполуку формули (І) або її таутомер або пролікарської форми, або фармацевтично прийнятну сіль вказаної сполуки, таутомер або пролікарської форми, та фармацевтично прийнятний носій. Для даного документу наводяться наступні пояснення: "Гало" включає фтор, хлор, бром або йод. Термін "фармацевтично прийнятний" як вказано у описі, наприклад, при посиланні на солі та сольвати, включає поняття «ветеринарно прийнятний» та «сільськогосподарсько прийнятний». Сполуки формули (І) містять асиметричний атом вуглецю (×іральний центр), позначений як 1*у структурній формулі нижче. Відповідно, сполуки формули (І) існують як оптичні ізомери. Даний винахід включає індивідуальні енантіомери сполук формули (І) та їх суміші, включаючи рацемати. Певні сполуки формули (І) можуть існувати як геометричні ізомери. Даний винахід включає як такі сполуки у цис- (Z-) або транс- (Е-) конфігурації, так і суміші цих геометричних ізомерів. Певні сполуки формули (І) можуть існувати у більш ніж одній таутомерій формі. Даний винахід включає всі такі таутомери та їх суміші. Даний винахід включає всі фармацевтично прийнятні мічені ізотопами сполуки формули (І), де один або кілька атомів замінені на атомами, які мають таке ж атомне число, проте у яких атомна маса або масове число відрізняються від атомної маси або масового числа переважно наявного у природі. Приклади ізотопів, придатних для включення у 2 сполуки винаходу, включають водень, такий як Н 3 11 13 14 та Н, вуглець, такий як С, С та С, хлор, такий 36 18 123 125 як СІ, фтор, такий як F, йод, такий як І та І, 13 15 15 17 азот, такий як N та N, кисень, такий як О, О 18 35 та О та сірку, таку як S. Певні сполуки формули (І), мічені ізотопами, наприклад, мічені радіоактивним ізотопом, використовують у дослідженнях розподілення ліків та/або субстрату у тканинах. Радіоактивні ізотопи тритій, 3 14 тобто, Н, та вуглець-14, тобто С, є особливо придатними для цієї мети, завдяки легкості їх включення та наявності засобів для їх виявлення. Заміщення більш важкими ізотопами, такими 2 як дейтерій, тобто Н, приводить до певних терапевтичних переваг, які виникають завдяки більшій метаболічній стабільності, наприклад, збільшеного 97388 6 періоду напівжиття in vivo або зменшеній дозі, та тому є бажаним при певних обставинах. Заміщення позитроно-активними ізотопами, 11 18 15 13 такими як С, F, O та N, здійснюють при позитрон-емісійній томографії (ПЕТ) для дослідження ступеню насиченості рецептора субстратом. Сполуки формули (І), мічені ізотопами, загалом одержують за технологіями відомими фахівцям, або за способами аналогічними тим, що описані у супровідних Прикладах та Приготуваннях, з використанням відповідного міченого ізотопом реагенту замість попередньо використаного неміченого реагенту. Певні сполуки формули (І), які містять основну функціональну групу, здатні утворювати кислотноаддитивні солі. Певні сполуки формули (І), які містять кислотну функціональну групу, здатні утворювати аддитивні солі з придатними основами. Такі солі входять у рамки даного винаходу з умовою, що вони є прийнятними для ветеринарного або фармацевтичного застосування. Придатні кислотно-аддитивні солі отримують з кислот, які утворюють не токсичні солі. Приклади включають солі наступних сполук: ацетат, адіпат, аспартат, бензоат, безилат, бікарбонат/карбонат, бісульфат/сульфат, борат, камсилат, цитрат, цикламат, едізилат, езілат, формат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гібензат, гідрохлорид/хлорид, гідробромід/бромід, гідройодид/йодид, ізетіонат, лактат, малат, малеат, малонат, мезілат, метилсульфат, нафтілат, 2напсилат, нікотинат, нітрат, оротат, оксалат, пальмітат, памоат, фосфат/гідрофосфат/дигідрофосфат, піроглутамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат та ксинафоат. Придатні основні солі одержують з основ, які утворюють нетоксичні солі. Приклади включають солі алюмінію, аргініну, бензатину, кальцію, хлору, діетиламіну, діоламіну, гліцину, лізину, магнію, меглуміну, оламіну, калію, натрію, трометаміну та цинку. Гемісолі кислот та основ також отримують, наприклад, з гемісульфат та гемі кальцієві солі. Опис придатних солей, дивитись у Handbook ofPharmaceutical Salts: Properties, Selection, and Use by Stahl and Wermuth (Wiley-VCH, 2002). Фармацевтично прийнятні солі сполук формули (І) отримують за одним з трьох способів: (і) шляхом взаємодії сполуки формули (І) з бажаною кислотою або основою; (іі) шляхом видалення кислотної- або основної-лабільної захисної групи з придатного попередника, наприклад, лактона або лактама, використовуючи бажану кислоту або основу; або (ііі) шляхом перетворення однієї солі сполуки формули (І) на іншу шляхом взаємодії з відповідною кислотою або основою або за допомогою використання придатної іонообмінної колонки. Всі три реакції зазвичай здійснюють у розчині. Отриману сіль осаджують та збирають шляхом фільтрування або отримують шляхом випаровування розчинника. Сполуки формули (І) та їх солі можуть існувати у сукупності твердих станів, в діапазоні від повніс 7 тю аморфного до повністю кристалічного. Термін 'аморфний' стосується стану, коли у матеріалу відсутній дальній порядок на молекулярному рівні, та в залежності від температури може проявляти властивості твердого матеріалу або рідини. Зазвичай такі матеріали не дають характерної дифракційної рентгенограми, та коли проявляють властивості твердої речовини, більш формально описуються як рідина. Під час нагрівання властивості твердої речовини змінюються на властивості рідини, що характеризується зміною стану, зазвичай другий порядок (перехід до склоподібного стану). Термін «кристалічний» стосується твердої фази, в якій матеріал має регулярну внутрішню структуру на молекулярному рівні та має характерну дифракційну рентгенограму з визначеними піками. Такі матеріали при достатньому нагріванні проявляють властивості рідини, проте перехід з твердої на рідку характеризується зміною фази, зазвичай перший порядок («точка плавлення»). Сполуки формули (І) та їх солі також існують у формі сольватів та не сольватів. Термін «сольват» застосовують у даному документі для опису молекулярного комплексу, який містить сполуку даного винаходу та один або кілька фармацевтично прийнятних молекул розчинника, наприклад, етанолу. Термін «гідрат» застосовують, коли вказаним розчинником є вода. Сучасною придатною класифікацією органічних гідратів є така система, яка визначає ізольований сайт, канал або метал-іон координаційні гідрати - дивитись Polymorphism in Pharmaceutical Solids by K. R. Morris (Ed. H. G. Brittain, Marcel Dekker, 1995). Ізольовані сайти гідратів це такі сайти, де молекули води є ізольованими від безпосереднього контакту один з одним шляхом вбудовування органічних молекул. В канальних гідратах молекули води знаходяться у решітчастих каналах, де вони знаходяться поряд з іншими молекулами води. У метал-іон координованих гідратах молекули води є приєднаними до іону металу. Коли розчинник та вода є тісно пов'язаними, то комплекс буде мати стійку стехіометрію незалежну від вологості. Коли, однак, розчинник та вода є слабко пов'язаними, як у канальних сольватах та гігроскопічних сполуках, вміст вода/розчинник буде залежати від вологості та умов висушування. У таких випадках нормальним є нестехіометричність. Фармацевтично прийнятні сольвати згідно з винаходом включають такі, де розчинник для кристалізації може бути ізотопно заміщеним, наприклад, D2O, d6-ацетон, d6-DMSO. Винахід також стосується мультикомпонентних комплексів (які відрізняються від солей та сольватів), де лікарська речовина та щонайменше один компонент є наявними у стехіометричній або нестехіометричній кількостях. Комплекси такого типу включають клатрати (комплекси-включення лікарська речовина-хазяїн) та спів-кристали. Останні зазвичай визначають як кристалічні комплекси нейтральних молекулярних компонентів, які зв'язані нековалентними зв'язками, проте також можуть бути комплексом нейтральної молекули з сіллю. Спів-кристали можна одержати кристаліза 97388 8 цією з розплаву, перекристалізацією з розчинників або шляхом фізичного подрібнення компонентів разом - дивитись Chem Commun, V7, 1889-1896, by О. Almarsson and Μ. J. Zaworotko (2004). Загальний опис мультикомпонентних комплексів наведено у J Pharm Sci, 64 (8), 1269-1288, by Haleblian (August 1975). Сполуки формули (І) та їх солі також можуть існувати у мезоморфному стані (мезофаза або рідкий кристал) у придатних умовах. Мезоморфний стан є проміжним між справжнім кристалічним та справжнім рідким станом (або розплав або розчин). Мезоморфізм, який виникає як результат зміни температури називається «термотропним», та при додаванні другого компонента, такого як вода або інший розчинник, називається «ліотропним». Сполуки, що здатні утворювати ліотропні мезофази описані як «амфіфільні» та складаються + з молекул, які містять іонну (таку як -COO Na , - + + СОO K або -SO3 Na ) або неіонну (таку як + NN (CH3)3) полярну головну групу. Більш детально описано у Crystals and the Polarizing Microscope by th N. H. Hartshorne and A. Stuart, 4 Edition (Edward Arnold, 1970). У подальшому усі посилання на сполуки формули (І) включають посилання на їх солі, сольвати, мультикомпонентні комплекси та рідкі кристали, та на сольвати, мультикомпонентні комплекси та рідкі кристали їх солей. У бажаному варіанті здійснення сполуки фор1 2 3 4 5 мули (І) R , R , R , R та R кожен незалежно вибирають з Н, F, СІ, Br, CN та CF3. Більш бажано, 1 2 3 4 5 щонайменше один з R , R , R , R та R означає 1 2 3 4 5 CN, та щонайменше два з R , R , R , R та R 1 4 означають Н. Більш бажано R та R означають Н, 2 3 один з R та R означає Η та інший означає CN, та 5 R вибирають з F, СІ, Вr та CF3. У іншому бажаному варіанті здійснення сполу1 4 5 ки формули (І) R , R та R кожен незалежно виби2 3 рають з Н, гало та CF3, та один з R та R означає CN та інший вибирають з Η та CN. У іншому бажаному варіанті здійснення сполу1 4 5 ки формули (І), R та R кожен означає Н, та R вибирають з СІ, Вr та CF3. У іншому бажаному варіанті здійснення сполу1 2 3 4 5 ки формули (І), R , R , R , R та R кожен незалежно вибирають з Н, CN та CF3. У іншому бажаному варіанті здійснення сполу1 2 4 ки формули (І), R , R та R кожен означає Н. У іншому бажаному варіанті здійснення сполу3 ки формули (І), R означає CN. У іншому бажаному варіанті здійснення сполу5 ки формули (І), R означає CF3. Особливо бажані сполуки формули (І) включають: N-{1-ціано-2-[5-ціано-2(трифторметил)фенокси]-1-метилетил}-4пентафтортіобензамід, N-{(1R)-1-ціано-2-[5-ціано-2(трифторметил)фенокси]-1-метилетил}-4пентафтортіобензамід, N-{(1S)-1-ціано-2-[5-ціано-2(трифторметил)фенокси]-1-метилетил}-4пентафтортіобензамід, 9 N-[2-(2-хлор-5-ціанофенокси)-1-ціано-1метилетил]-4-пентафтортіобензамід, N-[2-(2-хлор-5-ціанофенокси)-(1R)-1-ціано-1метилетил]-4-пентафтортіобензамід, N-[2-(2-хлор-5-ціанофенокси)-(1S)-1-ціано-1метилетил]-4-пентафтортіобензамід, N-{1-ціано-2-[4-ціано-2(трифторметил)фенокси]-1-метилетил}-4пентафтортіобензамід, N-{(1R)-1-ціано-2-[4-ціано-2(трифторметил)фенокси]-1-метилетил}-4пентафтортіобензамід, N-{(1S)-1-ціано-2-[4-ціано-2(трифторметил)фенокси]-1-метилетил}-4пентафтортіо-бєнзамід, N-{2-[2-хлор-5-ціано-3(трифторметил)фенокси]-1-ціано-1-метилетил}-4пентафтортіобензамід, N-{2-[2-хлор-5-ціано-3(трифторметил)фенокси]-(1R)-1-ціано-1метилетил}-4-пентафтортіобензамід, N-{2-[2-хлор-5-ціано-3(трифторметил)фенокси]-(1S)-1-ціано-1метилетил}-4-пентафтортіобензамід, N-[2-(2-хлор-4,5-сІіціанофенокси)-1-ціано-1метилетил]-4-пентафтортіобензамід, N-[2-(2-хлор-4,5-сІіціанофенокси)-(1R)-1-ціано1-метилетил]-4-пентафтортіобензамід, N-[2-(2-хлор-4,5-сііціанофенокси)-(1S)-1-ціано1-метилетил]-4-пентафтортіобензамід, N-(1-ціано-2-[4-ціано-2(трифторметил)фенокси]-1-метилетил}-4пентафтортіобензамід, N-{(1R)-1-ціано-2-[4-ціано-2(трифторметил)фенокси]-1-метилетил}-4пентафтортіобeнзамід, і N-{(1S)-1-ціано-2-[4-ціано-2(трифторметил)фенокси]-1-метилетил}-4пентафтортіобензамід, та їх фармацевтично прийнятні солі. У іншому бажаному варіанті сполукою формули (І) є: N-{(1S)-1-ціано-2-[4-ціано-2(трифторметил)фенокси]-1-метилетил}-4пентафтортіобензамід та його фармацевтично прийнятні солі. У іншому аспекті, даний винахід стосується способів приготування сполуки формули (І), або її фармацевтично, ветеринарно або сільськогосподарсько прийнятної солі, або фармацевтично або ветеринарно прийнятного сольвату (включаючи гідрат) любого походження, як показано нижче. Для фахівців буде очевидно, що чутлива функціональна група може потребувати захисту та зняття захисту протягом синтезу сполуки винаходу. Цього досягають звичайними способами, наприклад, описаними у "Protective Groups in Organic Synthesis" by TW Greene and PGM Wuts, John Wiley & Sons Inc (1999), та посилання у даному документі. Наступні способи ілюструють загальні етапи синтезу, які можна адоптувати з метою отримання сполук винаходу. 1 2 3 4 5 Коли одна або кілька з R , R , R , R та R містять реактивні функціональні групи, тоді додатко 97388 10 вий захист забезпечують згідно з стандартними способами протягом синтезу сполук формули (І). У нижчеописаних процесах для всіх синтетичних попередників, використаних у синтезі сполук фор1 2 3 4 5 1 2 мули (І), визначення R , R , R , R та R де R , R , 3 4 5 R , R та R є такими як визначено для формули (І), необов'язково містять придатні захисні варіан1 2 3 4 5 ти Р , Р , Р , Р та Р . Такі придатні захисні групи для цих функцій описані у посиланнях, перелічених у даному документі, та застосування таких груп у разі потреби входить у рамки способу, описаного у даному винаході, для одержання сполук формули (І) та їх попередників. При застосуванні придатних захисних груп, потім їх потрібно видаляти отримуючи сполуку формули (І). Зняття захисту здійснюють згідно з стандартними способами, включаючи ті, що описані у посиланнях, перелічених у даному документі. 1 Синтез сполук формули (І) 1.1 Утворення амідного зв'язку 1 2 3 4 5 Сполуки формули (І) де R , R , R , R та R , є такими як визначено для формули (І), можна синтезувати шляхом поєднання амінонітрилів форму1 2 3 4 5 ли (II), де R , R , R , R та R є такими як визначено для формули (І), з кислотою формули (III), або придатно активованими кислотними похідними, такими як ацил галіди, естери або ангідриди. Фахівці у галузі розуміють, що багато стандартних умов реакції можна використовувати для утворення амідного зв'язку, деякі з них описані у "Amide bond formation and peptide coupling" C.A.G.N.Montalbetti and V.Falque, Tetrahedron, 2005, 61, 10827-10852. 11 Наприклад, амінонітрили формули (II) можуть реагувати з кислотним хлоридом формули (IV) у біполярному апротонному розчиннику, такому як тетрагідрофуран, у присутності основи, такої як діізопропілетиламін, при пониженій температурі, зазвичай 0°С, протягом 2 - 24 годин. Альтернативно, кислота формули (III) може реагувати з амінонітрилами формули (II), у полярному розчиннику, такому як Ν,Ν-диметилформамід у присутності О(етоксикарбоніл)ціанометиленаміно)-N,N,N',N'тетраметилуронію тетрафторборату, та у присутності основи, такої як діізопропілетиламін, при пониженій температурі, зазвичай 0°С протягом 2 - 24 годин, у інертній атмосфері. 1.2 Нуклеофільне заміщення арильних галидів 1 2 3 4 5 Сполуки формули (І), де R , R , R , R та R є такими, як визначено для формули (І), також синтезують шляхом взаємодії спирту формули (V) з 1 2 3 арильними галідами формули (VI), де R , R , R , 4 5 R тa R є такими, як визначено для формули (І) та Hal = фтор або хлор, бажано фтор. 97388 12 Наприклад, трет-бутоксид калію додають при пониженій температурі, зазвичай 0°С до розчину сполуки формули (V) та сполук формули (VI) у біполярному апротонному розчиннику, такому як тетрагідрофуран, після чого реакцію здійснюють при кімнатній температурі протягом довгого часу, зазвичай 16-24 годин, необов'язково в атмосфері азоту. Альтернативно, трет-бутоксид калію додають при кімнатній температурі до розчину сполук формули (V) та сполук формули (VI) у біполярному апротонному розчиннику, такому як тетрагідрофуран, після чого реакцію здійснюють у температурному діапазоні від 55°С до 75°С, зазвичай 65°С протягом довгого часу, зазвичай 16-24 години, необов'язково в атмосфері азоту. Інші основи, такі як гідрид натрію застосовують у придатних розчинниках, зазвичай N,N-диметилформаміді, необов'язково у інертній атмосфері. Альтернативно, трет-бутоксид калію у тетрагідрофурані додають до розчину сполуки формули (V) та сполук формули (VI) у диметилсульфоксиді, після чого реакцію здійснюють при кімнатній температурі протягом довгого часу, зазвичай 16-24 годин, необов'язково в атмосфері азоту. При застосуванні арильних фторидів формули (VI), де Hal = фтор, для взаємодії потрібен безводний диметилсульфоксид. Індивідуальні енантіомери спирту формули (V) отримують з рацемату за допомогою хіральної HPLC за стандартних хроматографічних умов. Наприклад, використовуючи суміші метанол/етанол/гексан як елюанти на колонці 500 мм × 50 мм ID Chiralcel AD-H 5 MKM з швидкістю потоку 50 мл/хв. Ці енантіомери формули (V) також застосовують у реакції нуклеофільного заміщення для отримання індивідуальних енантіомерів сполуки формули (І). Для цієї реакції, при використанні сполук фор1 мули (VI), де Hal = фтор та один або кілька з R , 2 3 4 5 R , R , R або R також означає фтор, кожен атом фтору може бути заміщеним для отримання сумішей регіоізомерів. 1.3 Синтез амінонітрилів формули (II) 13 97388 1 2 3 4 5 Сполуки формули (II), де R , R , R , R та R є такими як визначено для формули (І), синтезують як показано на Схемі А. Захист гідроксиацетону формули (VII) здійснюють як захист етиленового кеталю формули (IX) шляхом взаємодії з 1,2біс(триметилсилілокси)етаном, сполукою формули (VIII), та триметилсиліл трифторметансульфонатом у безводному біполярному апротонному розчиннику, такому як тетрагідрофуран, при кімнатній температурі протягом 10 - 30 годин, зазвичай 18 1 2 3 4 5 годин. Сполуки формули (X), де R , R , R , R та R є такими як визначено для формули (І), синтезують шляхом взаємодії етиленового кеталю формули (IX) з ариловими фторидами формули (VI). Наприклад, трет-бутоксид калію додають при пониженій температурі, зазвичай 0°С, до розчину сполук формули (IX) та сполук формули (VI) у біполярному апротонному розчиннику, такому як тетрагідрофуран, після чого реакцію здійснюють при кімнатній температурі протягом довгого часу, зазвичай 16 - 24 годин, необов'язково в атмосфері азоту. Зняття захисту з кеталів формули (X) здійснюють для отримання феноксикетонів формули (XI), шляхом кип'ятіння із зворотнім холодильником у ацетоні у присутності кислотного каталізатору, такого як 2М хлорводнева кислота, протягом часу в діапазоні 15-30 годин, зазвичай 20 годин. Амінонітрили формули (II) одержують з кетонів формули (XI) використовуючи описані у літературі умови синтезу Стренера. Наприклад, кетони формули (XI) взаємодіють з хлоридом амонію у метанольному амонію при кімнатній температурі протягом 15 - 45 хв., після чого додають ціанід натрію та продовжують реакцію при кімнатній температурі протягом 15 - 70 годин. 1 2 3 4 Амінонітрили формули (II), де R , R , R , R та 5 R є такими як визначено для формули (І), мають єдиний стереоцентр альфа відносно нітрилу, що 1 2 3 4 забезпечує відсутність стереоцентру R , R , R , R 14 5 та R . Такі сполуки отримують стереохімічно чистими використовуючи різноманітні способи асиметричного синтезу Стренера, описані у літературі. Деякі з таких способів описані у Org.Letters, 2000, 2, 6, 867-870; Tetrahedron - Asymmetry 2001, 12, 1147-1150; J.Amer. Chem. Soc. 2003, 125, 56345635; J.Amer. Chem. Soc, 1998, 120, 5315-5316; Tetrahedron Leters, 1996, 37, 33, 5839-5840; та Org. Letters, 2004, 5, 26, 5027-5029. 1.4 Хлорид кислоти формули (IV) 4-Пентафтортіобензоїлхлорид одержують згідно з Схемою В. 1-йодо-4-(пентафтортіо)бензол, сполука формули (XIII), одержують шляхом взаємодії діазонової солі, утвореної реагуванням 4(пентафтортіо)аніліну з нітритом натрію у водній хлорводневій кислоті, з йодидом калію. Діазанова сіль бажано утворюється при t 0°С; наступне йодування здійснюють при кімнатній температурі протягом 18-60 годин. Алкен формули (XIV) одержують шляхом взаємодії йодної сполуки формули (XIII) з трибутил(виніл)оловом використовуючи каталізатор тетракіс(трифенілфосфін)паладій(0) у полярному розчиннику, такий як Ν,Νдиметилформамід при 100°С, в атмосфері азоту, протягом 1 - 5 годин, зазвичай 1,5 годин. Кислоту формули (XV) одержують шляхом окислення алкену формули (XIV) використовуючи, наприклад, періодат натрію у суміші розчинників ацетоніт 15 97388 16 рил/тетрахлорид вуглецю/вода у присутності каталізатора гідрохлориду рутенію (III), у інертній атмосфері, при кімнатній температурі протягом 1 20 годин. Кислотний хлорид формули (IV) одержують з кислоти формули (XV) використовуючи добре відомі фахівцям у галузі способи, описані у літературі. Зазвичай нагрівання з надлишком тіоніл хлориду при 65°С протягом 2 - 4 годин. Кислоту формули (XV) одержують безпосередньо з сполуки формули (XIII) шляхом взаємодії діоксиду вуглецю з органометалевими сполуками, одержаними з сполуки (XIII); наприклад використовуючи ізопропілмагнійхлорид у безводному протонному розчиннику, такому як тетрагідрофуран. Сполуки формули (XV) та (IV) також одержують у промисловому обсязі. 1.5 Синтез амідного спирту формули (V) Амідний спирт формули (V) одержують як показано на Схемі С. Амінонітрил формули (XVI) одержують з гідроксилацетону формули (VII), використовуючи стандартні умови синтезу Стренера, описані у літературі. Наприклад, гідроксиацетон взаємодіє із хлоридом амонію у метанольному амонії при кімнатній температурі протягом 15 - 45 хвилин, після чого додають ціанід натрію та продовжують реакцію при кімнатній температурі протягом 15 - 25 годин. Амід формули (V) одержують шляхом взаємодії хлоридів кислоти формули (IV) з амінонітрилом формули (XVI). Наприклад, амінонітрил формули (XVI) взаємодіє з хлоридами кислоти формули (IV) у біполярному апротонному розчиннику, такому як тетрагідрофуран, у присутності основи, такої як діізопропілетиламін, при пониженій температурі, зазвичай 0°С протягом 2 - 24 годин. 1.6 Арильні галіди формули (VI) Більшість арильних галідів формули (VI) є наявними на ринку або їх можна отримати за стан дартними способами, описаними у літературі, які є добре відомими фахівцям у галузі. Наступні приклади ілюструють деякі успішні синтетичні перетворення, проте не представляють весь їх перелік. 4-ціано-2-фторбензамід одержують шляхом амонолізу 4-ціано-2-фторбензойної кислоти, використовуючи водний гідроксид амонію (35%) у придатному розчиннику, такому як ацетонітрил, у присутності 1,1'-дикарбонілдіімідазолу. 2Фтортерефталонітрил одержують з 4-ціано-2фторбензаміду шляхом взаємодії з хлоридом паладію (II) у придатному розчиннику, такому як ацетонітрил, в діапазоні температур від 30° - 60°С, зазвичай 50°С, протягом 15 - 30 годин, зазвичай 24 годин. 4-Фторізофталонітрили одержують з 2фтор-5-формілбензонітрилу шляхом взаємодії з гідроксиламін-О-сульфоновою кислотою у водному розчині при 50°С протягом декількох годин, зазвичай 5 годин. На Схемі Д показано Приготування 4-хлор-3фтор-5-(трифторметил)бензонітрилу, сполуки (XX). Сполуку (XVIII) одержують шляхом бромування 2-аміно-3-фторбензотрифториду, використовуючи N-бромсукцинімід у придатному розчиннику, такому як ацетонітрил, у присутності хлориду заліза (III). Нітрил (XIX) одержують з сполуки (XVIII) шляхом взаємодії з ціанідом натрію у при датному розчиннику, такому як 1-метил-2піролідинон, у присутності броміду нікелю (II), шляхом нагрівання у мікрохвильовій пічці (звичайна модель СЕМ 300W) при 160°С протягом декількох годин, зазвичай 6 годин. Сполуку (XIX) перетворюють на сполуку (XX) за стандартних умов Зандмейєра, використовуючи трет-бутиловий нітрил та хлорид міді (І). 17 97388 Метил 5-ціано-2-фторбензоат одержують з 3бром-4-фторбензонітрилу шляхом нагрівання у метанолі при 60°С, у атмосфері монооксиду вуглецю у присутності основи, такої як триетиламін, та придатного каталізатора, зазвичай [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладій (II). 2 Внутрішні перетворення функціональних груп 1 2 3 4 5 Замісники R , R , R , R та R , які є такими як визначено для сполук формули (І), у сполуках формули (І) або сполуках формули (V), можуть бути перетворені, коли хімічно можливо, у інші замісни1 2 3 4 5 ки, де R , R , R , R та R є такими як визначено для сполук формули (І). 1 2 3 4 Сполуки формули (І), де один з R , R , R , R 5 та R = -C(O)NH2, одержують з відповідних сполук 1 2 3 4 5 формули (XXI), де один з R , R , R , R та R = С(О)ОН, використовуючи стандартні способи, описані у літературі. Для фахівців у галузі зрозуміло, що для утворення аміду застосовують багато стандартних умов реагування, описаних у літературі, деякі з них описані у "Amide bond formation and peptide coupling" C.A.G.N.Montalbetti and V.Falque, Tetrahedron, 2005, 61, 10827-10852. 1 2 3 Кислоти формули (XXI), де один з R , R , R , 4 5 1 2 3 4 5 R , R = С(О)ОН та інші з R , R , R , R та R є такими, як визначено для сполук формули (І), одержують з відповідних алкілових естерів шляхом взаємодії з моногідратом гідроксиду літію у тетрагідрофуран : вода (1:1) при кімнатній температурі протягом ночі. Кислоти перетворюють на метилові естери шляхом взаємодії з діазометаном або (триметилсиліл)діазо метаном. 1 Алкілові естери формули (XXI), де один з R , 2 3 4 5 R , R , R та R = -С(О)О-алкіл одержують з відповідних сполук брому шляхом карбонілування з використанням каталізатора Pd використовуючи монооксид вуглецю у присутності спиртів у розчиннику, такому як N,N-диметилформамід. Ці естери можна безпосередньо перетворити на аміди використовуючи відомі фахівцям у галузі способи, описані у літературі. Ці сполуки брому також беруть участь у різних реакціях конденсації органометалевих сполук. Для цих реакцій інші чутливі функціональні групи у будь-якому місці молекули можуть потребувати відповідного захисту. Наприклад, літіювання шляхом застосування бутиллітію у апротонних розчинниках, таких як тетрагідрофуран, у інертній атмосфері, дає проміжні сполуки ариллітію, які можуть взаємодіяти з естерами хлорформату з метою отримання сполук формули (І) або сполук 1 2 3 4 5 формули (V), де один з R , R , R , R та R = СООМе. Також фахівці у галузі вважають за краще, коли у певних процесах порядок стадій синтезу від 18 різняється та залежить між іншим від факторів, таких як природа інших функціональних груп наявних у певному субстраті, наявність ключових проміжних сполук, та адаптованої стратегії захисних груп (якщо такі мають місце). Очевидно такі фактори також будуть впливати на вибір реагенту для застосування у вказаних стадіях синтезу. Фахівці у галузі вважають за краще, коли сполуки винаходу можна отримати за іншими способами, ніж ті, що описані у даному документі, шляхом адаптування способів описаних у даному документі та/або способів відомих у галузі, наприклад, рівня техніки описаного у даному документі, або використовуючи стандартні посібники, такі як "Comprehensive Organic Transformations - A Guide to Functional Group Transformations", RC Larock, Wiley-VCH (1999 або пізніші видання). Зрозуміло, що способи синтетичного перетворення, описані у даному документі, є тільки зразковими, та їх можна здійснювати у різних послідовностях, з метою ефективного отримання бажаних сполук. Досвідчений хімік віддасть перевагу найбільш ефективній послідовності реакцій синтезу сполуки мішені. Сполуки формули (І) мають антипаразитарну активність та таким чином є придатними для застосування для боротьби з інвазією паразитів у тварини-хазяїна. Паразитом може бути ендопаразит, такий як гельмінт, або ектопаразит, такий як членистоногі. Приклади гельмінтів включають паразитів типу плоскі черви (таких як цестоди та трематоди; наприклад, види Fasciola; Fascioloides; Paramphistomum; Dicrocoelium; Eurytrema; Ophisthorchis; Fasciolopsis; Echinostoma; Paragonimus) та типу нематоди (таких як війчасті, кишкові та тканинні нематоди; наприклад, види Haemonchus; Ostertagia; Cooperia; Oesphagastomum; Nematodirus; Dictyocaulus; Trichuris; Toxocara; Toxascaris; Trichinella; Dirofilaria; Ancyclostoma; Necator, Strongyloides; Capillaria; Ascaris; Enterobius та Trichostrongylus). Приклади артропод включають акаріни, включаючи кліщів (наприклад, види Ixodes, види Boophilus, Boophilus microplus, види Amblyomma, Hyalomma, Rhipicephalus, наприклад, види Rhipicephalus appendiculatus, Haemaphysalis, Dermacentor, Ornithodorus (наприклад, Omithodorus moubata)), кліщів (наприклад, види Damalinia, Dermanyssus gallinae, види Sarcoptes, наприклад, Sarcoptes scabiei, види Psoroptes, види Chorioptes, види Demodex, види Eutrombicula); отряд двукрилі (наприклад, види Aedes, Anopheles, Muscidae, наприклад, Stomoxys calcitrans та Haematobia irritans, види Hypoderma, Gastrophilus, Simulium); отряд напівжорсткокрилі (клопи) (наприклад, вид Triatoma); отряд пухоїдові (наприклад, види Damalinia, Linognathus); отряд блохи (наприклад, вид Ctenocephalides); отряд таргани (наприклад, види Periplaneta, Blatella) та отряд перетинчастокрилі (наприклад, Monomorium pharaonis). Сполуки формули (І) є особливо придатними для боротьби з інвазією гельмінтами. Твариною-хазяїном може бути ссавець або не ссавець, такий як птах або риба. Коли твариною 19 хазяїном є ссавець, то це може бути людина або не людина. Нелюдські ссавці включають домашню худобу та домашніх тварин, такі як велика рогата худоба, вівці, козли, коні, свині, собаки та коти. Сполуки формули (І) вводять будь-яким придатним шляхом. Приклади придатних шляхів введення включають оральне, місцеве та парентеральне введення. Вибір шляху залежить від виду тварини-хазяїна та природи інвазійного паразита. Наприклад, у випадку людини або домашніх тварин бажаними є оральне введення або для боротьби з ендопаразитами, у той час як для багатьох видів домашньої худоби, такої як стадо великої рогатої худоби бажаним є місцеве введення. Сполуки формули (І) можна вводити як окремо, так і у композиції, придатної для певної мети. Зазвичай, їх вводять як композиції у комбінації з одним або кількома фармацевтично прийнятними наповнювачами. Термін "наповнювач" застосовують у даному документі для описання будь-якого інгредієнту відмінного від активних сполук. Вибір наповнювача буде в значній мірі залежати від таких факторів як певний спосіб введення, вплив наповнювача на розчинність та стабільність, та природи лікарської форми. Сполуки формули (І) вводять як кристалічні або аморфні сполуки, наприклад, дисперсії висушені розпиленням або як виготовлені шляхом екструзії з розплаву або нано-помолом. їх отримують, наприклад, як тверді шарики, порошки або плівки (наприклад, швидкого розчинення або мікроадгезивні плівки) за способами, такими як осадження, кристалізація, заморожування висушування або сушка розпиленням, або сушка випарюванням. Мікрохвилі або радіочастоти використовують для цієї мети. Способи, за якими вводять сполуки формули (І), включають оральне ведення капсул, пілюль, пластинок, порошків, таблеток, жувальних гум, мульти- та наночастинок, гелів, плівок, спреїв або рідких композицій. Рідкі форми включають суспензії, розчини, сиропи, кисіль та еліксири. Такі композиції застосовують як наповнювачі м'яких або твердих капсул та зазвичай включають носій, наприклад, воду, етанол, поліетиленгліколь, пропіленгліколь, метилцелюлозу або придатну олію, та один або кілька емульгаторів та/або суспендувальних агентів. Рідкі композиції також одержують шляхом відновлення твердої речовини, наприклад, з саше. Оральні таблетки зазвичай одержують шляхом розчинення або суспендування активного інгредієнту у придатному середовищі. Таким чином композиції, придатні для орального введення, одержують шляхом змішування активного інгредієнта з придатним тонко диспергованим розчинником та/або дизінтегрувальним агентом та/або звязуючою речовиною, та/або лубрикантом тощо. Інші придатні інгредієнти включають антиоксиданти, барвники, агенти, що додають смак, консерванти та агенти, що маскують смак. Для оральних лікарських форм, в залежності від дози, кількість лікарських речовини становить від 1 ваг.% до 80 ваг.% від лікарської форми, більш зазвичай від 5 ваг.% до 60 ваг.% від лікарської форми. Приклади придатних дизінтегрантів 97388 20 для застосування у даному документі включають натрію крохмаль глюколат, натрію карбоксиметил целюлозу, кальцію карбоксиметил целюлозу, натрію кроскармелозу, кросповідон, полівінілпіролідон, метилцелюлозу, гідроксипропілцелюлозу заміщена нижчим алкілом, крохмаль, попередньо желатинізований крохмаль та альгінат натрію. Загалом, дизінтегрант буде містити від 1 ваг.% до 25 ваг.%, бадано від 5 ваг.% до 20 ваг.% від лікарської форми. Зв'язуючі речовини застосовують для надання когезивних властивостей таблетці. Приклади придатних зв'язуючих речовин включають мікрокристалічну целюлозу, желатин, сахари, поліетиленгліколь, природні та синтетичні смоли, полівінілпіролідон, попередньо же латинізований крохмаль, гідроксипропілцелюлоза та гідроксипропілметилцелюлоза. Приклади розчинників включають лактозу (моногідрат, висушений в спреї моногідрат, безводну тощо), маніт, ксиліт, декстрозу, цукрозу, сорбіт, мікрокристалічну целюлозу, крохмаль та двоосновний дигідратфосфат кальцію. Оральні композиції також необов'язково можуть включати поверхнево-активні інгредієнти, такі як лаурилсульфат натрію та полісорбат 80, та гліданти, такі як діоксид кремнію та тальк. При наявності, поверхнево-активні інгредієнти можуть складати від 0,2 ваг.% до 5 ваг.% від таблетки, та гліданти можуть складати від 0,2 ваг.% до 1 ваг.% таблетки. Лубріканти включають стеарат магнію, стеарат кальцію, стеарат цинку, натрію стеарин фумарат, та суміші стеарату магнію з лаурилсульфатом натрію. Лубриканти зазвичай складають від 0,25 ваг.% до 10 ваг.%, бажано від 0,5 ваг.% до 3 ваг.% від таблетки. Зразкові таблетки містять до приблизно 80% лікарської речовини, від приблизно 10 ваг.% до приблизно 90 ваг.% зв'язувальної речовини, від приблизно 0 ваг.% до приблизно 85 ваг.% розчинника, від приблизно 2 ваг.% до приблизно 10 ваг.% дизінтегранту, та від приблизно 0,25 ваг.% до приблизно 10 ваг.% лубриканту. Композиції таблеток описані у "Pharmaceutical Dosage Forms: Tablets, Vol. 1", by H. Lieberman and L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-Х). Сполуки формули (І) вводять місцево на шкіру, дермально або трансдермально. Сполуки також вводять крізь слизову оболонку. Зазвичай композиції для цієї мети включають рідину для оббризкування, рідину для мокання, рідину для обливання, спрей, мус, шампунь, порошкові композиції, гелі, гідрогелі, лосьйони, розчини, креми, мазі, пилові порошки, пов'язки, піни, плівки, пластирі, капсули, імплантанти, губки, волокна, бинти та мікроемульсії. Також застосовують ліпосоми. Звичайні основи включають спирт, воду, мінеральну олію, рідкий вазелін, медицинський вазелін, гліцерин, поліетиленгілколь та пропіленгліколь. Покращувачі проникнення є також включеними - дивитись, наприклад, J Pharm Sci, 88 (10), 955-958 by Finnin and Morgan (October 1999). Pour-on or spoton formulations одержують шляхом розчинення активного інгредієнту у придатній рідкій основі, 21 такій як бутил диголь, рідкий парафін або нелеткі естери, необов'язково з додаванням леткого компоненту, такого як пропан-2-ол. Альтернативно, рідину для поливання, рідину для розбризкування або спреї одержують шляхом інкапсулювання, для того, щоб залишити залишок активного інгредієнту на поверхні тварини. Композиції для введення готують у формі стерильного розчину, який може містити інші сполуки, наприклад, солі або глюкозу для того, щоб зробити розчин ізотонічним з кров'ю. Прийнятні рідкі носії включають овочеву олію, таку як олія кунжуту, гліцеріди, такі як тріацетин, естери, такі як бензил бензоат, ізопропіл міристат та жирнокислотні похідні пропіленгліколю, також як і органічні розчинники, такі як піролідин-2-он та гліцерин формаль. Композиції отримують шляхом розведення або суспендування активного інгредієнту у рідкому носії, таким чином, що кінцева композиція буде містити від 0,01 до 10 ваг.% активного компонента. Ці композиції можуть бути такими, що самоконсервуються, самосетрилізуються, або можуть бути нестерильними, до яких необов'язково додають консерванти. Відповідним чином сполуки формули (І) вводять парентерально, або шляхом введення безпосередньо у кров'яне русло, м'язи або у внутрішній орган. Придатні шляхи парентерального введення включають внутрішньовенний, внутрішньоартеріальний, внутрішньочеревний, інтратекальний, внутрішньошлуночковий, внутрішньоуретральний, внутрішньогрудинний, внутрішньочерепний, внутрішньом'язовий та підшкірний. Придатні прилади для парентерального введення включають голкові інжектори (включаючи мікроголкові), безголкові інжектори та вливання. Парентеральні композиції зазвичай є водними розчинами, які можуть містити наповнювачі, такі як солі, вуглеводні та буферні агенти (бажано значення рН від 3 до 9), проте, для деяких випадків їх більш придатно формулюють як стерильний безводний розчин або як порошкова висушена форма для застосування з придатним засобом, таким як стерильна апірогенна вода. Приготування парентеральних композицій в стерильних умовах, наприклад, шляхом ліофілізації, швидко здійснюють за допомогою стандартних фармацевтичних технологій, добре відомих фахівцям. Розчинність сполук формули (І), які застосовували у приготуванні парентеральних розчинів, можна збільшити шляхом застосування відповідних технологій, таких як введення агентів, які покращують розчинність. Такі композиції одержують звичайним шляхом у відповідності до стандартної медицинської або ветеринарної практики. Ці композиції дуже змінюються стосовно ваги активної сполуки, яку вони містять, в залежності від виду тварини-хазяїна, що обробляють, жорсткості та виду інфекції та маси тіла хазяїна. Для парентерального, місцевого та орального введення, звичайними діапазонами доз є 0,01 -100 мг/кг маси тіла тварини. Бажано діапазон становить від 0,1 до 10 мг/кг маси тіла. Композиції можуть вивільнятись миттєво або бути утворені таким чином, щоб мати контрольо 97388 22 ваний або модифікований профіль вивільнення. Композиції модифікованого вивільнення включають такі композиції, які мають уповільнене-, безперевне-, імпульсне-, направлене- або програмоване вивільнення. Придатні композиції модифікованого вивільнення для цілей винаходу описані у патенті США № 6,106,864. Деталі інших придатних технологій вивільнення, таких як високоенергійне диспергування та осмотичні та покриті частинки можна знайти у Verma et al, Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Застосування жувальної гумки для забезпечення контрольованого вивільнення описано у міжнародній публікації WO 00/35298. Альтернативно, сполуки винаходу можуть бути сформульовані як тверді, напівтверді або тіксотропна рідина для введення як імплантоване депо, яке забезпечує модифіковане вивільнення активної сполуки. Приклади таких композицій включають стенти, які містять лікарський засіб, та PGLA-мікросфери. Як альтернатива сполуки формули (І) можна вводити не людині разом із кормом, та для цієї мети готують концентровану харчову добавку або домішок, для змішування з нормальної їжею для тварин. Сполуки формули (І) переважно застосовують у комбінації з одним або кількома терапевтичними агентами, які включають, проте не обмежуються наступними протипаразитарними агентами. Приклади антипаразитарних агентів, які застосовують у комбінації із сполуками формули (І) включають протигельмінтні агенти, агенти проти фасціольозу та ектопаразитициди. У одному варіанті здійснення винаходу, сполуки формули (І) застосовують у комбінації з другим протигельмінтним агентом. Така комбінація може зменшувати вірогідність розвитку протидії. Придатні протигельмінтні агенти включають: • макроциклічні лактони (такий як івермектин, авермектин, абамектин, емамектин, епріномектин, дорамектин, селамектин, моксідектин, немадектин, мілбіміцин та похідні мелбіміцину, такі як ті, що описані у ЕР-357460, ЕР-444964 та ЕР-594291, та напівсинтетичні та біосинтетичні похідні авермектину/мідбіміцину, такі як ті, що описані у US5015630, WO-9415944 та WO-9522552); • бензимідазоли (такі як ілбендазол, камбендазол, фенбендазол, флубендазол, мебендаззол, оксфендазол, оксибендазол та парбендазол); • імідазотіазоли та тетрагідропіримідини (такі як тетрамізол, левамізол, пірантел памоат, оксантел або морантел); • похідні та аналоги класу парагерквамід/макрофортин протигельмінтних агентів, зокрема 2-дезоксопарагерквамід; • нітросканат; • протипаразитарні оксазоліни (такі як ті, що описані у US-5478855, US-4639771 та DE19520936); • похідні та аналоги головного класу діоксоморфолінових протипаразитарних агентів описаних у міжнародній публікації WO-9615121; та • циклічні депсіпептиди (такі як ті, що описані у WO-9611945, WO-9319053, WO-9325543, ЕР 23 626375, ЕР-382173, WO-9419334, ЕР-382173 та ЕР-503538, та особливо емодепсид). У бажаному варіанті здійснення, сполуки формули (І) застосовують у комбінації із протигельмінтним агентом представленим макроциклічним лактоном, вибраним з івермектину, авермектину, абамектину, емамектину, епріномектину, дорамектину, селамектину, моксидектину, немадектину та мілбеміцин оксиму. У іншому бажаному варіанті здійснення, сполуки формули (І) застосовують у комбінації з бензимідазольнимми протигельмінтними агентами, вибраними з альбендазолу, камбендазолу, фенбендазолу, флубендазолу, мебендазолу, оксфендазолу, оксібендазолу та парбендазолу. У іншому бажаному варіанті здійснення, сполуки формули (І) застосовують у комбінації з протигельмінтними агентами, вибраними з тетрамізолу, левамізолу, пірантелпамоату, оксантелу та морантелу. У іншому бажаному варіанті здійснення, сполуки формули (І) застосовують у комбінації з похідними та аналогами сполук класу парагерквамід/маркфортин протигельмінтних агентів, зокрема 2-дезоксопарагерквамідом. У іншому варіанті здійснення, сполуки формули (І) застосовують у комбінації з флукіцидом, наприклад фасциоліцидом. Придатні агенти включаютьклозантел, тріклабендазол, клорсулон, рафоксанід, ніклозамід, празіквантел та епсіпрантел. У іншому варіанті здійснення винаходу, сполуки формули (І) застосовують у комбінації з ектопаразитицидом. Придатні агенти включають: • арил піразоли (такі як фіпроніл, пірипрол, пірафлупрол тощо); • піретроїди; • органофосфати; • регулятори росту комах (такі як луфенурон тощо); • спірокетоенольні інсектициди (такі як спіромезифен тощо); • агоністи екдізону (такі як тебуфенозид тощо); • спінозини (такі як спінозад, спінеторам тощо, особливо спінеторам); • неонікотіноїди (такі як імідаклоприд, дінотефуран тощо) та • інші інсектициди (такі як метафлумізон, флубендіамід, хлорантраніліпрол, інлоксакарб, піридаліл, піримідифен та пірифлуквіназон, особливо метафлумізон, індоксакарб та флубендіамід). У іншому бажаному варіанті здійснення, сполуки формули (І) застосовують у комбінації з екстопаразитицидним агентом, вибраним з фіпронілу, пірипролу, пірафлупролу, луфенурону, спіромезіфену, тебуфенозиду, спінозаду, спінетораму, імідаклоприду, дінотефурану, метафлумізону, флубендіаміду, хлорантраніліпролу, індоксакарбу, піридалілу, піримидифену та пірифлуквіназону. При використанні сполуки формули (І) для боротьби з інвазією паразитами домашніх тварин, їх можна застосовувати у комбінації з будь-якими агентами відомими у галузі як корисні у харчових добавках для таких домашніх тварин, та які описані у таких посібниках як "2006 Feed Additive 97388 24 Companion" та "Handbook of Feed Additives 2006". Придатні агенти включають: • поліетер іонофори (такі як лазалодин, монензин, саліноміцин, наразин та лаідломіцин); • антибіотики (такі як тетрацикліни, бацитрацин, тілозин, тіамулін, лінкоміцин, віргініаміцин, хінолінові антибактеріальні препарати та карбадокс); • стероїдні похідні (такі як меленгестерол ацетат); • агенти для запобігання та лікування підгострого ацидозу рубца (такі як бікарбонат натрію, акарбоз та інші інгібітори амілази та глюкозидази); • покращують якість туші/анаболічні агенти (такі як бета адренергічні ліганди, включаючи рактопамін, сальбутамол та альметерол); та • інші добавки (такі як ферменти, мінерали та вітаміни). Два компоненти можна вводити одночасно, послідовно або окремо. При послідовному або окремому введенні двох компонентів, їх обидва можна вводити однаковим або різними шляхами. Як вказано у даному документі одночасне введення означає введення обох компонентів тварині-хазяїну за одну дію, що потребує щоб обидва компоненти були включеними у єдину лікарську форму та єдиний розчин для обливання. Послідовне введення означає введення кожного компонента окремою дією, проте обидві дії є пов'язаними. Наприклад, введення таблетки, яка містить один компонент та другої таблетки, яка містить другий компонент, розглядають як послідовне введення, навіть, коли дві таблетки вводять тварині-хазяїну одночасно. Окреме введення стосується введення кожного компонента незалежно від іншого. Одночасне введення є бажаним. Обидва компоненти можуть бути наявними у наборі. Такий набір включає дві або більше фармацевтичні композиції, щонайменше одна з яких містить сполуку формули (І), та одна містить додатковий протипаразитарний агент, та засіб для окремого збереження вказаних композицій, такий як контейнер, поділена пляшка або поділений плівчастий пакет. Прикладом такого набору є відоме блістерне упакування, яке використовують для упакування таблеток, капсул тощо. Набір є особливо придатним для введення різних лікарських форм, наприклад, оральної та парентеральної, для введення окремих композицій у різних інтервалах дозувань, або для титрування однієї окремої композиції проти іншої. Для відповідності набір зазвичай містить напрямки для введення, та може бути оснащеним так званим доповнення до пам'яті. Приклади Наступні Приклади ілюструють Приготування сполук формули (І). У наступних експериментальних деталях спектральні дані ядерно магнитного резонансу (ЯМР) отримували використовуючи спектрометри Varian Inova 300, Varian Inova 400, Varian Mercury 400, Varian Unityplus 400, Bruker AC 300MHz, Bruker AM 250MHz або Varian T60 MHz, отримані хімічні зсуви є послідовними до запропонованих структур. Хімі 25 чні зсуви ЯМР виражені у м.ч. у бік слабого поля від тетраметилсилану. У наступних Прикладах, де у Прикладі вказано про суміш стереоізомерів, то наведені ЯМР інтеграли стосуються відносного співвідношення інтегралів для вказаного хімічного зсуву. Мас спектральні дані отримували на спектрометрі Finnigan ThermoQuest Aqa, Waters micromass ZQ або Hewlett Packard GCMS System Model 5971. Розраховані та виявлені іони у дужках стосуються ізотопної композиції найменшої маси. HPLC означає високоефективну рідинну хроматографію. Кімнатна температура означає 20 - 25°С. Коли у Прикладах вказано суміш регіоізомерів, біологічні дані стосуються суміші сполук з приведеним співвідношенням. Коли не вказано джерело простого попередника, то ці сполуки отримують з комерційних джерел або згідно з способами, описаними у літературі. Надалі наведено перелік комерційних постачальників для таких сполук: Sigma-Aldrich, Ρ О Box 14508, St. Louis, MO, 63178, USA Fluorochem Ltd., Wesley Street, Old Glossop, Derbyshire, SK13 7RY, UK Alfa Aesar, 26 Parkridge Road, Ward Hill, MA, 01835, USA Apollo Scientific Ltd., Whitefield Rd., Bredbury, Stockport, Cheshire, SK6 2QR, UK Fluka Chemie GmbH, Industriestrasse 25, P.O. Box 260, CH-9471 Buchs, Switzerland ChemPurGmbH, Rueppurrer Str. 92, Karlsruhe, D-76137, Germany Біологічні дослідження Дослідження Haemonchus contortus L3 (HcL3) застосовують для вимірювання біологічної активності заявлених сполук. Дослідження потребує in vitro тестування проти Н. contortus яке здійснюють згідно з наступною основною процедурою. Личинки HcL3 збирали з інфікованих овець та після очищення, зберігали у воді при 12°С не більше одного місяця. Життєздатні інфіковані личинки попередньо захищали використовуючи 10% гіпохлорит у збалансованому розчині Glucose Tyrodes, який містить антибіотики, та ресуспедували у основному середовищі (20 г/л бактотриптон, 5 г/л екстракт дріжджів, 57 г/л глюкоза, 0,8 г/л гідроортофосфат калію, 0,8 г/л дигідрофосфат калію та 2 мкМ Hepes з антибіотиками). Суспензію черв'яків 95 мкл додавали до кожної лунки 96лункового планшету. Тестові сполуки розводили у диметилсульфоксиді для отримання готового розчину 20 мг/мл. Готову концентрацію розводили 1:10 у основному середовищі для отримання 2,0 мг/мл (10% DMSO). 5 мкл готового розчину сполуки додавали до суспензії черв'яків для отримання кінцевої концентрації 100 мкг/мл. Планшети накривали підтиском чутливою плівкою та інкубували при 37°С. Спостереження здійснювали на 2 г, 24 г, 48 г, 72 г та 4 день після обробки, використовуючи інверсний мікроскоп. Активність записували якщо значна кількість черв'яків була мертвою або пошкодженою впливом сполуки, у порівнянні з контролем, який містить 1% DMSO. Сполуки тестували при 100 мкг/мл, де відповіді релевантно!" дози (100, 30, 10, 97388 26 3, 1, 0,3, 0,1 мкг/мл) проводили у подвійних експериментах для п=2. Дані записували як мінімальну ефективну дозу. Приклад 1 N-{1-Ціано-2-[5-ціано-2(трифторметил)фенікси]-1-метилетил}-4(пентафтортіо)бензамід Приклад 1а (Рацемат) До розчину сполуки Приготування 1 (2,2 г, 8,2 ммоль) та N,N-діізопропілетиламіну (1,7 мл, 9,9 ммоль) у тетрагідрофурані (10 мл), при 0°С, додавали сполуку Приготування 2 (2,7 г, 8,2 ммоль) у тетрагідрофурані (10 мл). Реакційну суміш нагрівали до кімнатної температури протягом 2 годин, перед тим як додавати воду (10 мл). До суміші додавали етилацетат (25 мл) та відділяли два шари. Органічну фазу промивали водним розчином карбонату калію (10%, 20 мл), насиченим водним розчином хлориду амонію (20 мл) та сольовим розчином, висушували (MgSO4) та концентрували in vacuo. Залишок розтирали у порошок третбутилметиловим етером, та отриманий осад збирали шляхом фільтрування та висушували in vacuo отримуючи сполуку Прикладу 1а (2,0 г). + Експериментальне МН 500,0; очікуване 500,1 1 Н-ЯМР (CDCI3): 1.99 - 2,01 (3Н), 4,45 - 4,48 (1Н), 4,70 - 4,74 (1Н), 6,47 - 6,50 (1Н), 7,28 - 7,30 (1Н), 7,42 - 7,45 (1Н), 7,71 - 7,75 (1Н), 7,84 - 7,88 (4Н) in vitro Η.с. (L3) MED = 3 мкг/мл Альтернативний синтез До розчину сполуки Приготування 1 (228 мг, 0,8 ммоль) та Приготування 3 (210 мг, 0,8 ммоль) у N,N-диметилформаміді (5 мл), при 0°С, додавали О-((етоксикарбоніл)ціанометиленаміно)-N,N,N',N'тетраметилуренію тетрафторборат (TOTU, 278 мг, 0,8 ммоль). Реакційну колбу очищали азотом, перед додавання краплями N,N-діізопропілетиламіну (0,3 мл, 1,7 ммоль), реакційну суміш нагрівали до кімнатної температури та струшували протягом 18 годин. Суміш виливали у воду (50 мл) та екстрагували етилацетатом (40 мл). Комбіновані екстракти послідовно промивали водою (20 мл), насиченим водним розчином гідрокарбонату натрію (20 мл), водою (20 мл), водним розчином лимонної кислоти (5%, 20 мл) та сольовим розчином (20 мл). Розчин висушували (MgSO4) та концентрували in vacuo отримуючи сполуку Прикладу 1а (395 мг). + Експериментальне (М-Н ) 498,1; очікуване 498,1 Приклад 1b (енантіомер, що виходить першим) та Приклад 1с (енантіомер, що виходить другим) Сполуку Прикладу 1а (240 мг, 0,5 ммоль) розчиняли у етанолі (8 мл) та розділяли енантіомери за допомогою автоматизованої рідинної хроматографії (Gilson system, 250 × 20 мм ID Chiralcel AD-H, 5 мкм колонка, 12 мл/хв), використовуючи метанол : етанол : гексан [10:10:80] як рухому фазу. Відповідні фракції комбінували та концентрували 27 для отримання двох енантіомерно чистих продуктів, сполуки Прикладу 1b та сполуки Прикладу 1с. Приклад 1b: Час утримання = 14,50 хв (250 × 4,6 мм Chiralcel AD-H, 5 мкм колонка, метанол : етанол : гексан [10:10:80], 1 мл/хв.) + Експериментальне МН 500,1; очікуване 500,1 1 Н-ЯМР (CDCI3): 2,00 - 2,02 (3Н), 4,41 - 4,44 (1Н), 4,70 - 4,73 (1Η), 6,42 - 6,45 (1Η), 7,27 - 7,28 (1Η), 7,40 - 7,42 (1Η), 7,72 - 7,74 (1Η), 7,81 - 7,84 (4Η) in vitro Η.с. (L3) MED =1 мкг/мл Приклад 1с: Час утримання = 19,51 хв. (250 × 4,6 мм Chiralcel AD-H, 5 мкм колонка, метанол : етанол : гексан [10:10:80], 1 мл/хв.) + Експериментальне МН 500,1; очікуване 500,1 1 Н-ЯМР (CDCI3): 1,99 - 2,01 (3Н), 4,42 - 4,45 (1Η), 4,70 - 4,73 (1Η), 6,41 - 6,44 (1Η), 7,25 - 7,26 (1Η), 7,40 - 7,42 (1Η), 7,72 - 7,74 (1Η), 7,81 - 7,84 (4Η) in vitro Η.с. (L3) MED > 30 мкг/мл Приклад 1с - абсолютна стереохімія, як визначено за допомогою рентгенографічного аналізу монокристалу. Приклад 2 N-[2-(2-Хлор-5-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід До суміші сполуки Приготування 9 (150 мг, 0,5 ммоль) та 4-хлор-3-фторбензонітрилу (71 мг, 0,5 ммоль), в атмосфері азоту, додавали тетрагідрофуран (2 мл). Суміш охолоджували до 0°С, перед тим, як краплями додавати трет-бутоксид калію (1М у тетрагідрофурані, 0,8 мл, 0,8 ммоль). Реакційну суміш нагрівали до кімнатної температури та струшували протягом 19 годин. Суміш розводили етилацетатом та промивали насиченим водним розчином хлориду амонію (×2), водою та сольовим розчином, висушували (MgSO4) та концентрували in vacuo. Залишок розчиняли у ацетонітрилі (2 мл) та очищали автоматичною рідинною хроматографією (Gilson system, 150 мм × 50 мм LUNA C18(2) 10 мкм колонка, 120 мл/хв.), використовуючи градієнт ацетонітрил : вода [60:40 (протягом 15 хв.) до 98:2 (протягом 3 хв.) до 60:40 (протягом 1 хв.)]. Відповідні фракції концентрували in vacuo одержуючи сполуку вказану у заголовку (72 мг) як рацемічної суміші. + Експериментальне МН 466,0; очікуване 466,0 1 Н-ЯМР (d6-Ацетон): 2,00 - 2,03 (3Н), 4,65 4,69 (1Н), 4,78 - 4,82 (1Н), 7,40 - 7,43 (1Н), 7,63 7,67 (2Н), 8,00 - 8,03 (2Н), 8,10 - 8,14 (2Н), 8,56 8,60 (1Н) in vitro Η.с. (L3) MED = 1 мкг/мл 97388 28 Приклад 3 N-{1-Ціано-2-[4-ціано-2(трифторметил)фенокси]-1-метилетил}-4(пентафтортіо)бензамід Приклад 3а (Рацемат) До суміші сполуки Приготування 9 (150 мг, 0,5 ммоль) та 4-фтор-3-(трифторметил)бензонітрил (86 мг, 0,5 ммоль), в атмосфері азоту, додавали тетрагідрофуран (2 мл). Суміш охолоджували до 0°С, перед тим, як краплями додавати третбутоксид кальцію (1М у тетрагідрофурані, 0,8 мл, 0,8 ммоль). Реакційну суміш нагрівали до кімнатної температури та струшували протягом 19 годин. Суміш розводили етилацетатом та промивали насиченим водним розчином хлориду амонію (×2), водою та сольовим розчином, висушували (MgSO4) та концентрували in vacuo. Залишок розчиняли у метанолі (2 мл) та очищали автоматичною рідинною хроматографією (Gilson system, 150 мм × 50 мм LUNA C18(2) 10 мкм колонка, 120 мл/хв.) використовуючи градієнт ацетонітрил : вода [55:45 (протягом 15 хв.) до 98:2 (протягом 3 хв.) до 55:45 (протягом 1 хв.)]. Відповідні фракції концентрували in vacuo отримуючи сполуку Прикладу 3а (73 мг) як рацемічної суміші. + Експериментальне МН 499,9; очікуване 500,1 1 Н-ЯМР (d6-ацетон): 1,98 - 2,00 (3Н), 4,78 - 4,80 (1Н), 4,84 - 4,86 (1Н), 7,58 - 7,60 (1Н), 8,00 - 8,03 (2Н), 8,08 - 8,12 (4Н) in vitro Η.с. (L3) MED = 1 мкг/мл Приклад 3b (Єдиний енантіомер) До розчину сполуки Приготування 20 (2,5 г, 7,6 ммоль) та 4-фтор-3-(трифторметил)-бензонітрилу (2,2 г, 11,4 ммоль) у тетрагідрофурані (25 мл), при -10°С, додавали краплями трет-бутоксиді калію (1М у тетрагідрофурані, 15,1 мл, 15,1 ммоль). Реакційну суміш струшували при -10°С протягом 2 годин та після цього гасили шляхом додавання насиченого водного розчину хлориду амонію (80 мл). Суміш екстрагували етилацетатом (2 × 40 мл) та комбіновані екстракти промивали водою (50 мл) та сольовим розчином (40 мл), висушували (MgSO4) та концентрували in vacuo. Залишок очищали за допомогою автоматичної флешхроматографії (Biotage™, 65i кварцовий картридж) з градієнтом елюювання етилацетат : циклогексан [0:100 до 50:50]. Відповідні фракції комбінували та концентрували, та до залишку додавали етилацетат (50 мл). Розчин промивали водою (40 мл), висушували (MgSO4) та концентрували in vacuo. Залишок розчиняли та концентрували in vacuo отримуючи сполуку Прикладу ЗЬ (1,6 г) як єдиного енантіомеру. + Експериментальне МН 499,9; очікуване 500,1 1 Н-ЯМР (CDCI3): 1,98 - 2,00 (3Н), 4,46-4,48 (1Н), 4,79-4,81 (1Н), 7,12-7,14 (1Н), 7,81 -7,86 (5Н), 7,89-7,90 (1Н) in vitro Η.с. (L3) MED = 1 мкг/мл Приклад 3с (Єдиний енантіомер) 29 До розчину сполуки Приготування 21 (2,5 г, 7,6 ммоль) та 4-фтор-3-(трифторметил)-бензонітрилу (2,2 г, 11,4 ммоль) у тетрагідрофурані (25 мл), при -10°С, додавали краплями трет-бутоксид калію (1М у тетрагідрофурані, 15,1 мл, 15,1 ммоль). Реакційну суміш струшували при -10°С протягом 2 годин та після цього зупиняли шляхом додавання насиченого водного розчину хлориду амонію (80 мл). Суміш екстрагували етилацетатом (2 × 40 мл) та комбіновані екстракти промивали водою (50 мл) та сольовим розчином (40 мл), висушували (MgSO4) та концентрували in vacuo. Залишок очищали за допомогою автоматичної флешхроматографії (Biotage™, 65M кварцовий картридж) з градієнтом елюювання етилацетат : циклогексан [0:100 до 50:50]. Відповідні фракції комбінували та концентрували одержуючи сполуку вказану у заголовку (3,1 г) як єдиного енантіомера. + Експериментальне МН 499,9; очікуване 500,1 1 Н-ЯМР (CDCI3): 1,98-2,00 (3Н), 4,48-4,50 (1Η), 4,79-4,81 (1Н), 7,13 - 7,15 (1Н), 7,82 - 7,87 (5Н), 7,88 - 7,90 (1Н) in vitro Η.с. (L3) MED > 30 мкг/мл Приклад 4 N-{1-Ціано-2-[4-ціано-2-фтор-6(трифторметил)фенокси]-1-метилетил}-4(пентафтортіо)бензамід 97388 30 До розчину сполуки Приготування 9 (500 мг, 1,5 ммоль) та 3,4-дифтор-5(трифторметил)бензонітрилу (376 мг, 1,8 ммоль) у тетрагідрофурані (10 мл), при 0°С, додавали краплями трет-бутоксид калію (1М у тетрагідрофурані, 1,8 мл, 1,8 ммоль). Реакційну суміш нагрівали до кімнатної температури та струшували протягом 18 годин в атмосфері азоту. Суміш розводили етилацетатом (50 мл) та промивали насиченим водним розчином хлориду амонію (20 мл), водою (20 мл) та сольовим розчином (20 мл), висушували (MgSO4) та концентрували in vacuo. Залишок розчиняли у ацетонітрилі (2 мл) та очищали за допомогою автоматизованої препаративної рідинної флеш-хроматографії (Gilson system, 150 мм × 50 мм LUNA C18(2) 10 мкм колонка, 120 мл/хв.) використовуючи градієнт ацетонітрил : вода [60:40 (протягом 13 хв.) до 98:2 (протягом З хв.) до 60:40 (протягом 1 хв.)]. Відповідні фракції комбінували та концентрували одержуючи сполуку вказану у заголовку (123 мг) як рацемічної суміші. + Експериментальне МН 517,9; очікуване 518,1 1 Н-ЯМР (d6-ацетон): 1,99 - 2,01 (3Н), 4,90 - 4,92 (1Н), 5,01 - 5,03 (1Н), 7,99 - 8,03 (3Н), 8,09-8,12 (3Н) in vitro Η.с. (L3) MED = 3 мкг/мл Таким же чином одержували: 31 Приклад 5 N-[2-(2-Хлор-4-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 2,00 - 2,06 (3Н), 4,72 4,76 (1Н), 4,80 - 4,84 (1Н), 7,40 - 7,42 (1Н), 7.78 7,80 (1Н), 7,87 - 7,89 (1Н), 8,00 - 8,05 (2Н), 8,08 8,12 (2Н), 8,56 - 8,59 (1Н) Приклад 6 N-[2-(3-Хлор-4-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,97 - 1,99 (3Н), 4,60 4,63 (1Н), 4,76 - 4,79 (1Н), 7,20 - 7,22 (1Н), 7,38 7,39 (1Н), 7,80 - 7,82 (1Н), 8,00 - 8,03 (2Н), 8,08 8,11 (2Н) Приклад 7 N-{1-Ціано-2-[3-ціано-5(трифторметил)фенокси]-1-метилетил}-4(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,99 - 2,01 (3Н), 4,65 4,68 (1Н), 4,80 - 4,83 (1Н), 7,75 - 7,77 (1Н), 7,79 7,82 (2Н), 7,99 - 8,02 (2Н), 8,10 - 8,13 (2Н) Приклад 8 N-[1-Ціано-2-(2-ціано-4,6-дифторфенокси)-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 2,01 - 2,04 (3Н), 4,82 4,84 (2Н), 7,47 - 7,50 (1Н), 7,57 - 7,60 (1Н), 7,99 8,03 (2Н), 8,09 - 8,12 (2Н) Приклад 9 N-[1-Ціано-2-(3,5-диціанофенокси)-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,98 - 2,00 (3Н), 4,63-4,65 (1Н), 4,78-4,81 (1Н), 7,82 - 7,84 (2Н), 7,89 - 7,90 (1Н), 8,00 - 8,03 (2Н), 8,09 - 8,12 (2Н) Приклад 10 N-{2-[4-Бром-2-(трифторметил)фенокси]-1ціано-1-метилетил}-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,98-2,01 (3Н), 4,61 -4,63 (1Н), 4,74 - 4,77 (1Н), 7,35 - 7,38 (1Н), 7,78 - 7,82 (2Н), 8,00 - 8,03 (2Н), 8,06 - 8,09 (2Н) 97388 32 Приклад 11 N-[2-(2-Бром-4-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,95 - 1,98 (3Н), 4,57 - 4,60 (1Н), 4,65 - 4,68 (1Н), 7,21 - 7,23 (1Н), 7,70 - 7,72 (1Н), 7,94 - 8,01 (5Н) Приклад 12 N-[1-Ціано-2-(2,4-дихлорфенокси)-1метилетил]-4-(пентафтортіо)бензамід До розчину сполуки Приготування 9 (120 мг, 0,4 ммоль) у диметилсульфоксиді (0,8 мл) додавали 2,4-дихлор-1-фторбензол (90 мг, 0,5 ммоль), після чого додавали трет-бутоксид калію (1М у тетрагідрофурані, 0,5 мл, 0,5 ммоль). Після цього реакційну суміш струшували при кімнатній температурі протягом 18 годин. Реакційну суміш очищали за допомогою автоматизованої препаративної рідинної флешхроматографії (Gilson system, 150 мм × 22,4 мм Gemini C18(2)) 5 мкм колонка, 20 мл/хв.) використовуючи градієнт ацетонітрил : вода [50:50 (протягом 2 хв.) до 98:2 (протягом 13 хв.) до 50:50 (протягом 2 хв.)]. Відповідні фракції комбінували та концентрували in vacuo одержуючи сполуку вказану у заголовку (55 мг). + Експериментальне МН 474,9; очікуване 475,0 1 Н-ЯМР (d6-Ацетон): 2,00 - 2,02 (3Н), 4,59 4,61 (1Н), 4,68 - 4,70 (1Н), 7,20 - 7,22 (1Н), 7,34 7,36 (1Н), 8,00 - 8,02 (2Н), 8,09 - 8,11 (2Н) in vitro H.c. (L3) MED = 3 Таким же чином одержували: 33 97388 34 35 97388 36 37 *Суміші регіостереоізомерів отримували з цих вихідних матеріалів Приклад 13 Приклад 13а N-[2-(2-Хлор-4-фторфенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід та Приклад 13b N-[2-(3-Хлор-4-фторфенокси)1-ціано-1-метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,97 - 2,01 (3Н), 4,58 4,61 (1Н), 4,62 - 4,65 (1Н), 7,09 - 7,12 (1Н), 7,22 7,28 (2Н), 7,99 - 8,02 (2Н), 8,07 - 8,10 (2Н) (для головного компонента) 3:1 суміш регіоізомерів Приклад 14 N-[2-(3-Хлор-5-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,99 - 2,02 (3Н), 4,58 4,61 (1Н), 4,69 - 4,72 (1Н), 7,43 - 7,47 (3Н), 7,99 8,02 (2Н), 8,08 - 8,11 (2Н) Приклад 15 N-[2-(4-Хлорфенокси)-1-ціано-1-метилетил]-4(пентафтортіо)бензамід 97388 38 1 Н-ЯМР (d6-Ацетон): 1,97 - 1,99 (3Н), 4,42 4,44 (1Н), 4,59 - 4,61 (1Н), 7,02 - 7,05 (2Н), 7,30 7,33 (2Н), 7,99 - 8,01 (2Н), 8,09 - 8,11 (2Н) Приклад 16 N-[2-(5-Бром-2-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,90 - 1,93 (3Н), 4,61 - 4,63 (2Н), 7,30 - 7,33 (1Н), 7,50 - 7,59 (2Н), 7,95 - 7,98 (2Н), 7,98 - 8,01 (2Н) Приклад 17 N-[2-(4-Хлор-2-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 2,00 - 2,02 (3Н), 4,76 4,79 (2Н), 7,38 - 7,41 (1Н), 7,67 - 7,70 (1Н), 7,74 7,77 (1Н), 7,99 - 8,02 (2Н), 8,09 - 8,11 (2Н) Приклад 18 N-[1-Ціано-2-(2-ціано-3-фторфенокси)-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,50 - 1,51 та 1,79 - 1,80 (3Н), 4,79 - 4,80 (2Н), 7,00 - 7,03 (1Н), 7,19 - 7,21 (1Н), 7,70 - 7,76 (1Н), 8,00 - 8,04 (2Н), 8,08 - 8,10 (1Н), 8,17 - 8,19 (1Н) 39 Приклад 19 N-[1-Ціано-2-(2-ціанофенокси)-1-метилетил]-4(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 2,00 - 2,02 (3Н), 4,76 4,78 (2Н), 7,15-7,17 (1Н), 7,36 - 7,38 (1Н), 7,63 7,66 (2Н), 7,99 - 8,01 (2Н), 8,10-8,12 (2Н) Приклад 20 N-[1-Ціано-2-(4-йодофенокси)-1-метилетил]-4(пентафтортіо)бензамід 1 Н-ЯМР (CDCI3): 1,98 - 2,00 (3Н), 4,26 - 4,28 (1Н), 4,40 - 4,42 (1Н), 6,71 - 6,73 (2Н), 7,59 -7,61 (2Н), 7,81-7,83 (4Н) Приклад 21 N-{1-Ціано-1-метил-2-[2(трифторметил)фенокси]етил}-4(пентафтортіо)бензамід 1 Н-ЯМР (CDCI3): 1,98 - 2,00 (3Н), 4,30 - 4,32 (1Н), 4,63 - 4,65 (1Н), 7,00 - 7,02 (1Н), 7,11 - 7,13 (1Н), 7,55 - 7,58 (1Н), 7,60 - 7,62 (1Н), 7,81 - 7,83 (4Н) Приклад 22 N-[1-Ціано-2-(4-ціанофенокси)-1-метилетил]-4(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,97 - 2,00 (3Н), 4,56 4,60 (1Н), 4,68 - 4,72 (1Н), 7,20 - 7,24 (2Н), 7,75 7,79 (2Н), 8,00 - 8,04 (2Н), 8,07 - 8,11 (2Н) Приклад 23 N-[2-(3-Хлор-5-фторфенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,97 - 1,99 (3Н), 4,50 4,52 (1Н), 4,62 - 4,64 (1Н), 6,82 - 6,85 (2Н), 6,98 6,99 (1Н), 8,00 - 8,02 (2Н), 8,08 - 8,10 (2Н) Приклад 24 N-[2-(5-Хлор-2-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,45 - 1,49 (3Н), 4,79-4,82 (2Н), 7,20 - 7,23 (1Н), 7,45 - 7,47 (1Н), 7,70 - 7,73 (1Н), 8,00 - 8,03 (2Н), 8,10-8,13 (2Н) Приклад 25 N-[2-(2-Хлорфенокси)-1-ціано-1-метилетил]-4(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 2,00 - 2,02 (3Н), 4,59 4,61 (1Н), 4,63 - 4,65 (1Н), 7,00 - 7,02 (1Н), 7,20 7,22 (1Н), 7,30 - 7,32 (1Н), 7,41 - 7,43 (1Н), 8,00 8,02 (2Н), 8,10 - 8,13 (2Н) Приклад 26 N-[2-(3-Хлор-2-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 2,00 - 2,02 (3Н), 4,79 4,82 (2Н), 7,24 - 7,29 (2Н), 7,65 - 7,68 (1Н), 8,00 8,03 (2Н), 8,08 - 8,10 (2Н) Приклад 27 Приклад 27а N-[1-Ціано-2-(2-ціано-4-фторфенокси)-1метилетил]-4-(пентафтортіо)бензамід та Приклад 27b N-[1-Ціано-2-(3-ціано-4-фторфенокси)-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 2,00 - 2,02 (3Н), 4,70 4,74 (2Н), 7,39 - 7,42 (1Н), 7,49 - 7,55 (1Н), 7,577,60 (1Н), 7,99-8,03 (2Н), 8,10-8,14 (2Н) (для головного компонента) 4:1 суміш регіоізомерів Приклад 28 N-[2-(4-Хлор-2-фторфенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 97388 40 1 Н-ЯМР (d6-Ацетон): 1,97-1,99 (3Н), 4,60-4,62 (1Н), 4,69-4,71 (1Н), 7,01 -7,03 (1Н), 7,19 - 7,22 (1Н), 7,35 - 7,37 (1Н), 7,99 - 8,01 (2Н), 8,08 - 8,11 (2Н) Приклад 29 Приклад 29а N-[1-Ціано-2-(4-ціано-2-фторфенокси)-1метилетил]-4-(пентафтортіо)бензамід та Приклад 29b N-[1-Ціано-2-(5-ціано-2-фторфенокси)-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CDCI3): 2,00 - 2,03 (3Н), 4,45 - 4,48 (1Н), 4,51 - 4,53 (1Н), 7,07 -7,11(1 Н), 7,39 - 7,45 (2Н), 7,80 - 7,84 (2Н), 8,02 - 8,06 (2Н) 1:1 суміш регіоізомерів Приклад 30 N-{1-Ціано-2-[2-фтор-4(трифторметил)фенокси]-1-метилетил)-4(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,99 - 2,02 (3Н), 4,70 4,73 (1Н), 4,77 - 4,80 (1Н), 7,45 - 7,49 (1Н), 7,52 7,57 (2Н), 7,99 - 8,03 (2Н), 8,03 - 8,06 (2Н) Приклад 31 N-[2-(3-Хлорфенокси)-1-ціано-1-метилетил]-4(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 1,96 - 1,99 (3Н), 4,45 4,48 (1Н), 4,60 - 4,63 (1Н), 7,00 - 7,03 (2Н), 7,09 7,11(1 Н), 7,30 - 7,33 (1Н), 8,00 - 8,03 (2Н), 8,05 8,08 (2Н) Приклад 32 N-[2-(2-Бром-5-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,96 - 2,00 (3Н), 4,54 - 4,57 (1Н), 4,60 - 4,63 (1Н), 7,25 - 7,28 (1Н), 7,44 - 7,46 (1Н), 7,77 - 7,80 (1Н), 7,95 - 8,05 (4Н) Приклад 33 Приклад 33а N-[2-(2-Бром-4-фторфенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід та Приклад 33b N-[2-(3-Бром-4-фторфенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,96 - 1,98 (3Н), 4,46 - 4,48 (1Н), 4,53 - 4,55 (1Н), 7,09 - 7,13 (2Н), 7,38 - 7,40 (1Н), 7,92 - 8,00 (4Н) (для головного компонента) 3:1 суміш регіоізомерів Приклад 34 N-[2-(4-Бром-2-фторфенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,90 - 1,92 (3Н), 4,50 - 4,52 (1Н), 4,52 - 4,54 (1Н), 7,07 - 7,10 (1Н), 7,11 - 7,13 (1Н), 7,36 - 7,38 (1Н), 7,95 - 7,98 (4Н) Приклад 35 N-[2-(3-Бром-5-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,95 - 1,97 (3Н), 4,40 - 4,42 (1Н), 4,58 - 4,60 (1Н), 7,40 - 7,41 (1Н), 7,56 - 7,58 (2Н), 7,95 - 8,00 (4Н) Приклад 36 N-{1-Ціано-2-[3-ціано-2(трифторметил)фенокси]-1-метилетил}-4(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,90 - 1,95 (3Н), 4,57 - 4,61 (1Н), 4,67 - 4,71 (1Н), 7,55 - 7,58 (1Н), 7,58 - 7,61 (1Н), 7,72 - 7,76 (1Н), 7,92 - 8,00 (4Н) 41 Приклад 37 N-[2-(2-Бром-3-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 2,01 - 2,03 (3Н), 4,73 4,75 (1Н), 4,77 - 4,79 (1Н), 7,45 - 7,47 (1Н), 7,53 7,60 (2Н), 8,00 - 8,02 (2Н), 8,09 - 8,11 (2Н) Приклад 38 N-[1-Ціано-2-(2,5-дихлорфенокси)-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,96 - 1,97 (3Н), 4,50 - 4,52 (1Н), 4,57 - 4,59 (1Н), 6,99 - 7,01 (1Н), 7,19 - 7,20 (1Н), 7,37 - 7,39 (1Н), 7,92 - 8,00 (4Н) Приклад 39 N-[2-(2-Хлор-3-фторфенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,95 - 1,99 (3Н), 4,50 - 4,54 (1Н), 4,59 - 4,63 (1Н), 6,85 - 6,89 (1Н), 6,95 - 6,98 (1Н), 7,22 - 7,27 (1Н), 7,92 - 8,00 (4Н) Приклад 40 N-[2-(3-Бром-2-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (d6-Ацетон): 2,00 - 2,02 (3Н), 4,78 4,80 (2Н), 7,38 - 7,41 (1Н), 7,41 - 7,43 (1Н), 7,60 7,63 (1Н), 8,00 - 8,02 (2Н), 8,10-8,12 (2Н) Приклад 41 N-[2-(4-Бром-2-ціанофенокси)-1-ціано-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,96 - 1,98 (3Н), 4,61 - 4,63 (2Н), 7,20 - 7,22 (1Н), 7,75 - 7,78 (1Н), 7,81 - 7,82 (1Н), 7,90 - 7,93 (2Н), 7,98 - 8,00 (2Н) Приклад 42 N-[1-Ціано-2-(2,3-діхлорфенокси)-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,96 -1,99 (3Н), 4,50 - 4,53 (1Н), 4,56 - 4,59 (1Н), 7,08 - 7,10 (1Н), 7,15 - 7,17 (1Н), 7,20 - 7,23 (1Н), 7,90 - 8,00 (4Н) Приклад 43 4-(2-Ціано-2-{[4-(пентафтортіо)бензоїл]аміно} пропокси)-3-(трифторметил)бензамід До розчину сполуки Приготування 9 (200 мг, 0,6 ммоль) у безводному диметилсульфоксиді (3 мл) краплями додавали трет-бутоксид калію (1М у тетрагідрофурані, 1,2 мл, 1,2 ммоль). Після струшування протягом 15 хв., додавали 4-фтор-3(трифторметил)бензамід (251 мг, 1,2 ммоль) та реакційну суміш струшували при кімнатній температурі протягом 4 годин. Додатково додавали трет-бутоксид калію (1М у тетрагідрофурані, 1,2 мл, 1,2 ммоль) та реакційну суміш струшували протягом ще 18 годин. Реакцію зупиняли шляхом додавання водного розчину хлориду амонію та екстрагували етилацетатом. Комбіновані екстракти промивали водою та сольовим розчином, вису 97388 42 шували (MgSO4) та концентрували in vacuo. Залишок очищали за допомогою автоматизованої флеш-хроматографії (Biotage™, 25+S кварцовий картридж) з градієнтом елюювання етилацетат : циклогексан [12:88 до 100:0]. Відповідні фракції комбінували та концентрували одержуючи сполуку вказану у заголовку (290 мг) як рацемічної суміші. + Експериментальне МН 518,0; очікуване 518,1 1 Н-ЯМР (CD3OD): 1,95 - 1,98 (3Н), 4,59 - 4,62 (1Н), 4,69 - 4,72 (1Н), 7,30 - 7,32 (1Н), 7,92-8,00 (4Н), 8,10 -8,12 (1Н), 8,12 -8,13 (1Н) in vitro H.c. (L3) MED = 1 Приклад 44 N-{2-[2-Хлор-5-ціано-3(трифторметил)фенокси]-1-ціано-1-метилетил}-4(пентафтортіо)бензамід До розчину сполуки Приготування 9 (110 мг, 0,3 ммоль) та сполуки Приготування 14 (112 мг, 0,5 ммоль) в безводному диметилсульфоксиді (4 мл) краплями додавали трет-бутоксид калію (1М у тетрагідрофурані, 0,7 мл, 0,7 ммоль). Реакційну суміш струшували при кімнатній температурі протягом 3 годин, та після цього реакцію зупиняли шляхом додавання насиченого водного розчину хлориду амонію (15 мл). Суміш екстрагували етилацетатом (2×5 мл), та комбіновані екстракти промивали водою (5 мл) та сольовим розчином (5 мл), висушували (MgSO4) та концентрували in vacuo. Залишок розчиняли у ацетонітрил : вода (9:1, 2 мл) та очищали за допомогою автоматизованої препаративної рідинної хроматографії (Gilson system, 250 мм × 50 мм LUNA C18(2) 10 MKM колонка, 120 мл/хв.), використовуючи градієнт ацетонітрил : вода [65:35 (протягом 12 хв.) до 95:5 (протягом 3 хв.) до 65:35 (протягом 1 хв.)]. Відповідні фракції комбінували та концентрували одержуючи сполуку вказану у заголовку (28 мг) як рацемічної суміші. + Експериментальне (М-Н ) 532,0; очікуване 532,0 1 Н-ЯМР (CD3OD): 1,96 - 1,98 (3Н), 4,60 - 4,62 (1Н), 4,72 - 4,74 (1Н), 7,80 - 7,81 (1Н), 7,87 - 7,88 (1Н), 7,92 - 8,00 (4Н) in vitro H.c. (L3)MED = 10 Таким же чином приготували наступні: 43 Приклад 45 4-Ціано-2-(2-ціано-2-{[4-(пентафтортіо)бензоїл] аміно}пропокси)бензамід 1 Н-ЯМР (d6-Ацетон): 1,99 - 2,01 (3Н), 4,78 4,81 (2Н), 7,54 - 7,55 (1Н), 7,69 - 7,70 (1Н), 7,98 8,01 (3Н), 8,12 - 8,14 (2Н) Приклад 46 N-[1-Ціано-2-(2,5-диціанофенокси)-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,96 - 1,98 (3Н), 4,65 - 4,67 (1Н), 4,70 - 4,72 (1Н), 7,48 - 7,50 (1Н), 7,69 - 7,70 (1Н), 7,82 - 7,84 (1Н), 7,95 - 7,97 (2Н), 8,00 - 8,02 (2Н) Приклад 47 N-[1-Ціано-2-(2,4-диціанофенокси)-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CDCI3): 1,60-1,61 (3Н), 4,50-4,52 (1Η), 4,86-4,88 (1Η), 7,15 - 7,17 (1Н), 7,82 -7,91 (6Н) Приклад 48 N-[1-Ціано-2-(3-ціано-5-фторфенокси)-1метилетил]-4-(пентафтортіо)бензамід 1 Н-ЯМР (CDCI3): 1,97 - 1,99 (3Н), 4,40 - 4,42 (1Н), 4,44 - 4,46 (1Н), 6,92 - 6,94 (1Н), 7,00 7,02(2Н), 7,92 - 7,94 (4Н) Приклад 49 3-Хлор-4-(2-ціано-2-{[4-(пентафтортіо)бензоїл] аміно}пропокси)бензамід 97388 44 1 Н-ЯМР (CDCI3): 2,00 - 2,02 (3Н), 4,39 - 4,41 (1Н), 4,62 - 4,64 (1Н), 7,00 - 7,02 (1Н), 7,66 - 7,68 (1Н), 7,83-7,88 (5Н) Приклад 50 N-[1-Ціано-2-(3-ціанофенокси)-1-метилетил]-4(пентафтортіо)бензамід До розчину сполуки Приготування 9 (200 мг, 0,6 ммоль) у N,N-диметилформаміді (2 мл) додавали гідрат натрію (60% у олії, 32 мг, 1,3 ммоль) та суміш струшували протягом 15 хв. До суміші додавали 3-фторбензонітрил (81 мг, 0,7 ммоль) у N,Nдиметилформаміді (1 мл) та реакційну суміш струшували при кімнатній температурі протягом 24 годин. Додавали додатковий гідрат натрію (60% у олії, 64 мг, 2,7 ммоль) та струшували протягом 4 наступних днів. Суміш гасили шляхом додавання води та екстрагували етилацетатом. Комбіновані екстракти промивали водою та сольовим розчином, висушували (MgSO4) та концентрували in vacuo. Залишок розчиняли у диметилсульфоксиді (2,8 мл) та очищали за допомогою автоматизованої препаративної рідинної хроматографії (Gilson 45 97388 46 system, 150 мм × 50 мм LUNA C18(2) 10 MKM колонка, 120 мл/хв.) використовуючи градієнт ацетонітрил : вода [55:45 (протягом 15 хв.) до 98:2 (протягом 3 хв.) до 55:45 (протягом 1 хв.)]. Відповідні фракції комбінували та концентрували одержуючи сполуку вказану у заголовку (46 мг) як рацемічної суміші. + Експериментальне МН 431.9; очікуване 432.1 1 Н-ЯМР (d6-Ацетон): 1,98 - 2,00 (3Н), 4,56-4,58 (1Н), 4,67-4,69 (1Н), 7,39 - 7,41 (2Н), 7,43 - 7,44 (1Н), 7,54 - 7,56 (1Н), 8,00 - 8,02 (2Н), 8,09 - 8,11 (2Н) in vitro H.c. (L3) MED = 3 Одержували подібним чином: Приклад 51 N-[1-Ціано-2-(4-ціано-2,6-дифторфенокси)-1метилетил]-4-(пентафтортіо)бензамід1 Н-ЯМР (d6-Ацетон): 1,98 - 2,00 (3Н), 4,81 4,83 (1Н), 4,85 - 4,87 (1Н), 7,61 - 7,63 (2Н), 8,00 8,03 (2Н), 8,06 - 8,09 (2Н) Приклад 52 N-{2-[З-Хлор-2-(трифторметил)фенокси]-1ціано-1-метилетил}-4-(пентафтортіо)бензамід 1 Н-ЯМР (CD3OD): 1,90 - 1,92 (3Н), 4,50 - 4,52 (1Н), 4,61 - 4,63 (1Н), 7,18 - 7,20 (2Н), 7,49 - 7,52 1Н), 7,95 - 8,00 (4Н) Приклад 53 3-Ціано-5-(2-ціано-2-{[4(пентафтортіо)бензоїл]аміно)пропокси)бензамід автоматизованої препаративної рідинної хроматографії (Gilson system, 150 мм × 30 мм LUNA C18(2) 10 мкм колонка, 40 мл/хв.), використовуючи градієнт ацетонітрил : вода [45:55 (протягом 14 хв.) до 98:2 (протягом 3 хв.) до 45:55 (протягом 1 хв.)]. Відповідні фракції комбінували та концентрували одержуючи сполуку вказану у заголовку (71 мг) як рацемічної суміші. + Експериментальне (М-Н ) 473,0; очікуване 473,1 1 Н-ЯМР (CD3OD): 1,89 - 1,93 (3Н), 4,45 - 4,48 (1Н), 4,60 - 4,63 (1Н), 7,56 - 7,58 (1Н), 7,79 - 7,84 (2Н), 7,90 - 8,00 (4Н) in vitro H.c. (L3) MED = 30 Приготування Наступні приготування показують синтез певних проміжних продуктів попередніх Прикладів. Приготування 1 3-(2-Аміно-2-ціанопропокси)-4-(трифторметил) бензонітрил Суміші сполуки Приготування 6 (3,5 г, 14,4 ммоль), хлориду амонію (1,2 г, 22,3 ммоль) та аміаку (7N у метанолі, 41,1 мл, 288,0 ммоль) струшували при кімнатній температурі протягом 20 хв., перед тим, як додавати ціанід натрію (921 мг, 18,4 ммоль). Реакційну суміш струшували при кімнатній температурі протягом 65 годин та після цього гасили шляхом додавання водного розчину гідроксиду натрію (2М, 100 мл). Суміш екстрагували толуолом (3 × 75 мл) та комбіновані екстракти промивали сольовим розчином (100 мл), висушували (MgSO4) та концентрували in vacuo. До залишку додавали дихлорметан (380 мл) та іонообмінну смолу Amberlyst® 15 (виготовлено згідно з J. Org. Chem., 1998, 63, 3471). Розчин обережно струшували протягом 17 годин та смолу видаляли та промивали циклогексаном, після чого тетрагідрофураном та метанолом. До смоли додавали амоній (2М у метанолі, 380 мл) та розчин струшували протягом 1 години. До розчину додавали тет До розчину сполуки Приготування 17 (194 мг, 0,4 ммоль) у ацетонітрилі (4 мл) додавали 1,1'карбонілдіімідазол (99 мг, 0,6 ммоль) та реакційну суміш струшували при кімнатній температурі в атмосфері азоту протягом 1,5 годин. Додавали додатковий 1,1'-карбонілдіімідазол (99 мг, 0,6 ммоль) та реакційну суміш струшували протягом ще 1 години. До суміші додавали водний розчин гідроксиду амонію (35%, 5 мл) та реакційну суміш струшували протягом 1 години. Суміш гасили водою та розводили етилацетатом. Два шари розділяли та водну фазу екстрагували етилацетатом. Комбіновані органічні шари промивали водою та сольовим розчином, висушували (MgSO4) та концентрували in vacuo. Залишок розчиняли у метанолі (1,5 мл), який містить кілька крапель диметилсульфоксиду, та очищали за допомогою 47 рагідрофуран (380 мл) та видаляли смолу. Після цього розчин концентрували in vacuo одержуючи сполуку вказану у заголовку (3,2 г). 1 Н-ЯМР (CDCI3): 1,61 - 1,62 (3Н), 3,97-4,00 (1Н), 4,18 - 4,20 (1Н), 7,20 - 7,22 (1Н), 7,40 - 7,42 (1Н), 7,73-7,75 (1Н) Приготування 2 4-(Пентафтортіо)бензоїлхлорид Розчин сполуки Приготування 3 (8,5 г, 34,3 ммоль) у тіоніл хлориді (50 мл) нагрівали при 65°С протягом 4 годин. Суміш концентрували in vacuo та розтирали в порошок з толуолом одержуючи сполуку вказану у заголовку (7,6 г). 1 Н-ЯМР (CDCI3): 7,95 - 8,00 (2Н), 8,21 - 8,26 (2Н) Приготування 3 4-(пентафтортіо)бензойна кислота Суміш сполуки Приготування 4 (8,0 г, 34,8 ммоль) та натрію періодату (30,5 г, 142,0 ммоль) у ацетонітрилі (60 мл), тетрахлорид вуглецю (60 мл) та води (60 мл) дегазували та обробляли гідрохлоридом рутенію (III) (157 мг, 0,7 ммоль). Реакційну суміш струшували при кімнатній температурі протягом 1 години та після цього розділяли між діетиловим етером та водою. Два шари відділяли, та органічну фазу промивали водним розчином гідроксиду натрію (1N). Значення рН водної фази доводили до рН 1 шляхом додавання хлорводневої кислоти та після цього екстрагували діетиловим етером. Комбіновані екстракти промивали сольовим розчином, висушували (MgSO4) та концентрували in vacuo одержуючи сполуку вказану у заголовку (2,8 г). + Експериментальне (М-Н ) 247,1; очікуване 247,0 Приготування 4 1-(Пентафтортіо)-4-винілбензол Суміш сполуки Приготування 5 (16,6 г, 50,4 ммоль), трибутилу(вініл)олова (22,1 мл, 24,0 г, 75,6 ммоль) та тетракіс(трифенілфосфін)паладію(0) (2,1 г, 1,8 ммоль) у Ν,Ν-диметилформаміді (170 мл) очищали азотом та нагрівали при 100°С протягом 1,5 годин. Суміш розділяли між діетиловим етером та водою та відділяли органічну фазу, промивали водним розчином фториду калію (2 × 50 мл) та сольовим розчином, висушували (MgSO4) та концентрували in vacuo. Залишок очищали за допомогою колонкової хроматографії (кварц, 800 г), елюювали пентаном. Надалі залишок очищали шляхом дистилювання одержуючи сполуку вказану у заголовку (18,0 г). 1 Н-ЯМР (CDCI3): 5,39 - 5,43 (1Η), 5,80 - 5,84 (1Н), 6,65 - 6,70 (1Η), 7,41 - 7,44 (2Н), 7,68 - 7,72 (2Н) Приготування 5 1-йодо-4-(пентафтортіо)бензол До розчину 4-(пентафтортіо)аніліну (15,0 г, 68,4 ммоль) та льоду (40,0 г) у хлорводневій кислоті (12М, 30 мл) додавали розчин нітриту натрію (5,0 г, 72,5 ммоль) у воді (120 мл) при 0°С. Після струшування протягом 2 хв. суміш додавали до йодиду калію (13,0 г, 78,3 ммоль) у воді (120 мл), та упевнювались, що температура не піднялась вище 10°С. Реакційну суміш струшували при 0°С протягом 10 хв. та після цього при кімнатній тем 97388 48 пературі протягом 60 годин. Суміш екстрагували діетиловим етером (2 × 100 мл) та комбіновані екстракти промивали сольовим розчином, висушували (MgSO4) та концентрували in vacuo. Залишок очищали колон очною хроматографією (кремнезем, 300 г), елюювали діетиловий етер : циклогексан [1:10]. Відповідні фракції комбінували та концентрували одержуючи сполуку вказану у заголовку (16,6 г). 1 Н-ЯМР (CDCI3): 7,90 - 7,95 (2Н), 8,20 - 8,25 (2Н) Приготування 6 3-(2-Оксопропокси)-4-(трифторметил)бензонітрил Розчин сполуки Приготування 7 (7,0 г, 24,5 ммоль) у ацетоні (122 мл) та хлор водневій кислоті (2М, 61,1 мл) нагрівали із зворотнім холодильником протягом 19 годин. Після охолодження до кімнатної температури суміш концентрували in vacuo та до залишку додавали етилацетат (150 мл). Розчин промивали насиченим водним розчином карбонатом натрію та водою, висушували (MgSO4) та концентрували in vacuo. Залишок перекристалізували з циклогексану : трет-бутиловий етер [95:5] одержуючи сполуку вказану у заголовку (3,5 г). 1 Н-ЯМР (CDCI3): 2,37 - 2,39 (3Н), 4,60 - 4,62 (2Н), 7,07 - 7,09 (1Н), 7,39 - 7,41 (1Н), 7,75 7,78(1Н) Приготування 7 3-[(2-метил-1,3-діоксолан-2-іл)метокси]-4(трифторметил)бензонітрил До суміші 3-фтор-4(трифторметил)бензонітрилу (12,1 г, 63,9 ммоль) та сполуки Приготування 8 (21,0 г, 160,0 ммоль) у тетрагідрофурані (345 мл), при 0°С та в атмосфері азоту, краплями додавали трет-бутоксид калію (1М у тетрагідрофурані, 70,3 мл, 70,3 ммоль). Реакційну суміш струшували при 0°С протягом 1 години та після цього нагрівали до кімнатної температури. До суміші додавали етилацетат (200 мл) та насичений водний розчин хлориду амонію (250 мл) та розділяли два шари. Органічну фазу промивали насиченим водним розчином хлориду амонію, водою та сольовим розчином, висушували (MgSO4) та концентрували in vacuo. До залишку додавали циклогексан (100 мл) та суміш залишали постояти протягом 1 години. Твердий залишок збирали фільтруванням та висушували одержуючи сполуку вказану у заголовку (16,3 г). 1 Н-ЯМР (CDCI3): 1,45 - 1,47 (3Н), 4,00 - 4,06 (6Н), 7,20 - 7,21 (1Н), 7,32 - 7,34 (1Н), 7,63 - 7,65 (1H) Приготування 8 (2-метил-1,3-діоксолан-2-іл)метанол До розчину 1,2-біс(триметилсилілокси)етану (41,2 г, 200,0 ммоль) та 1-гідроксиацетону (15,2 мл, 200,0 ммоль) у безводному тетрагідрофурані (35 мл) краплями додавали триметилсиліл трифторметансульфонат (2,0 мл, 11,1 ммоль). Реакційну суміш струшували при кімнатній температурі протягом 18 годин, перед додаванням піридину (32,3 мл). Суміш вливали у водний розчин гідрокарбонату натрію (100 мл) та екстрагували етилацетатом (3 × 150 мл). Комбіновані екстракти промивали сольовим розчином, висушували (MgSO4) та 49 концентрували in vacuo. Залишок азеотропували толуолом (× 2) одержуючи сполуку вказану у заголовку (16,6 г). 1 Н-ЯМР (CDCI3): 1,35 - 1,37 (3Н), 3,51 - 3,53 (2Н), 3,98 - 4,00 (4Н) Приготування 9 N-(1-Ціано-2-гідрокси-1-метилетил)-4(пентафтортіо)бензамід До розчину сполуки Приготування 10 (563 мг, 5,6 ммоль) та N,N-діізопропілетиламіну (1,1 мл, 6,4 ммоль) у тетрагідрофурані (9 мл), при -10°С, краплями додавали сполуку Приготування 2 (1,5 г, 5,6 ммоль) у тетрагідрофурані (10 мл). Після струшування протягом 1 години, реакційну суміш концентрували in vacuo та до залишку додавали етилацетат (200 мл). Цей розчин промивали хлорводневою кислотою (0,1М, 80 мл), насиченим водним розчином гідрокарбонату натрію (100 мл) та сольовим розчином (50 мл), висушували (MgSO4) та концентрували in vacuo одержуючи сполуку вказану у заголовку (1,6 г). + Експериментальне (М-Н ) 329,1; очікуване 329,0 Приготування 10 2-аміно-3-гідрокси-2-метилпропаннітрил Суміш ціаніду натрію (13,0 г, 259,0 ммоль), хлориду амонію (16,8 г, 314,0 ммоль) та аміаку (7М у метанолі, 579 мл, 4,1 моль) струшували при кімнатній температурі протягом 10 хв. перед додаванням 1-гідроксиацетону (14 мл, 202,0 ммоль). Реакційну суміш струшували при кімнатній температурі, в атмосфері азоту, протягом 23 годин та після цього концентрували in vacuo. До залишку додавали етилацетат (200 мл) та суміш профільтровували. Фільтрат концентрували in vacuo та до залишку додавали дихлорметан. Розчин охолоджували до -20°С та залишали постояти протягом 60 годин. Отриманий осад збирали шляхом фільтрування, промивали охолодженим дихлорметаном та висушували in vacuo одержуючи сполуку вказа1 ну у заголовку (8,3 г). Н-ЯМР (CD3OD): 1,40 - 1,43 (3Н), 3,45 - 3,55 (2Н) Приготування 11 4-Ціано-2-фторбензамід До розчину 4-ціано-2-фторбензойної кислоти (500 мг, 3,0 ммоль) у ацетонітрилі (20 мл) додавали 1,1'-карбонілдіімідазол (736 мг, 4,5 ммоль). Суміш струшували при кімнатній температурі протягом 45 хв, перед додаванням водного розчину гідроксиду амонію (35%, 10 мл). Реакційну суміш струшували протягом 45 хв. та додавали льодяну воду (15 мл). Залишок збирали шляхом фільтрування та висушували у вакуумній пічці при 60°С протягом 18 годин одержуючи сполуку вказану у заголовку (292 мг). 1 Н-ЯМР (d6-Ацетон): 7,70 - 7,78 (2Н), 7,98 8,02 (1Н) Приготування 12 2-Фтортерефталонітрил До розчину сполуки Приготування 11 (138 мг, 0,8 ммоль) у ацетонітрилі (6 мл) та води (2 мл) додавали хлорид паладію (II) (15 мг), та реакційну суміш нагрівали при 50°С протягом 24 годин. Суміш концентрували in vacuo та залишок екстрагували етилацетатом (2 × 10 мл). Комбіновані екст 97388 50 ракти висушували (MgSO4) та концентрували in vacuo одержуючи сполуку вказану у заголовку (113 мг). 1 Н-ЯМР (CD3OD): 7,80 - 7,84 (2Н), 7,84 - 7,87 (1Н) Приготування 13 4-фторізофталонітрил До розчину 2-фтор-5-формілбензонітрилу (5,1 г, 33,9 ммоль) у воді (75 мл) додавали гідроксиламін-О-сульфонову кислоту (4,6 г, 40,7 ммоль) та реакційну суміш нагрівали при 50°С протягом 5 годин. Суміш фільтрували та твердий матеріал промивали водою та висушували in vacuo протягом 18 годин одержуючи сполуку вказану у заголовку (4,3 г). 1 Н-ЯМР (CDCI3): 7,38-7,41 (1Н), 7,91 - 7,94 (1Н), 7,94 - 7,97 (1Н) Приготування 14 4-Хлор-3-фтор-5-(трифторметил)бензонітрил Суміш сполуки Приготування 15 (200 мг, 1,0 ммоль), трет-бутил нітриту (0,2 мл, 1,5 ммоль) та хлориду міді (II) (209 мг, 1,2 ммоль) у ацетонітрилі (10 мл) нагрівали при 70°С протягом 2 годин. Суміш охолоджували та додавали до хлорводневої кислоти (20%, 10 мл), перед додаваннями води (10 мл). Суміш екстрагували дихлорметаном (2×10 мл) та комбіновані органічні фази висушували (MgSO4) та концентрували in vacuo одержуючи сполуку вказану у заголовку (180 мг). 1 Н-ЯМР (CDCI3): 7,63 - 7,67 (1Η), 7,80 - 7,82 (1Н) Приготування 15 4-Аміно-3-фтор-5-(трифторметил)бензонітрил Суміш сполуки Приготування 16 (1,1 г, 4,3 ммоль), ціаніду натрію (418 мг, 8,5 ммоль) та броміду нікелю (II) (932 мг, 4,3 ммоль) у 1-метил-2піролідиноні (12 мл) нагрівали при 160°С у мікрохвильовій пічці (СЕМ 300W) протягом 6 годин. До суміші додавали воду (60 мл) та дихлорметан (50 мл) та розчин фільтрували крізь Arbocel®, промивали дихлорметаном (50 мл). Два шари розділяли та органічну фазу висушували (MgSO4) та концентрували in vacuo. Залишок комбінували з іншими неочищеними партіями (загальна кількість приблизно 4 г) та очищали автоматизованою флешхроматографіею (Biotage™ 60si cartridge) з градієнтом елюювання, етилацетат : циклогексан [0:1 до 2:3]. Відповідні фракції комбінували та концентрували одержуючи сполуку вказану у заголовку (1,7 г). 1 Н-ЯМР (CDCI3): 4,75 - 4,90 (2Н), 7,39 - 7,43 (1Н), 7,56 - 7,58 (1Н) Приготування 16 4-Бром-2-фтор-6-(трифторметил)анілін До розчину 2-аміно-3-фторбензотрифториду (0,7 мл, 5,6 ммоль) у ацетонітрилі (2 мл) додавали N-бромсукцинімід (994 мг, 5,6 ммоль), після чого додавали хлорид заліза (III) (90,1 мг, 0,6 ммоль). Реакційну суміш струшували при кімнатній температурі протягом 90 хв., перед додаванням води (20 мл). Суміш екстрагували трет-бутилметиловим етером (2×15 мл) та комбіновані екстракти промивали сольовим розчином (20 мл), висушували (MgSO4) та концентрували in vacuo одержуючи 51 сполуку вказану у заголовку (1,4 г), яку безпосередньо використовували. Приготування 17 3-Ціано-5-(2-ціано-2-{[4(пентафтортіо)бензоїл]аміно}пропокси)бензойна кислота До розчину сполуки Приготування 18 (257 мг, 0,5 ммоль) у тетрагідрофурані та воді (1:1, 6 мл) додавали моногідрат гідроксиду літію (44 мг, 1,0 ммоль) та реакційну суміш струшували при кімнатній температурі протягом 2 годин. Значення рН суміші встановлювали на рівні рН 4 шляхом додавання хлорводневої кислоти (2М) та екстрагували етилацетатом. Комбіновані органічні фази промивали сольовим розчином, висушували (MgSO4) та концентрували in vacuo одержуючи сполуку вказану у заголовку (202 мг). + Експериментальне МН 475,8; очікуване 476,1 Приготування 18 Метил-3-ціано-5-(2-ціано-2-{[4(пентафтортіо)бензоїл]аміно)пропокси)бензоат До розчину сполуки Приготування 9 (200 мг, 0,6 ммоль) у безводному Ν,Ν-диметилформаміді (3 мл), при 0°С та в атмосфері азоту, додавали гідрид натрію (60% у олії, 48 мг, 1,2 ммоль). Після струшування протягом 15 хв., додавали розчин сполуки Приготування 19 (217 мг, 1,2 ммоль) у безводному N,N-диметилформаміді (1 мл), та реакційну суміш струшували при кімнатній температурі протягом 2,5 годин. Суміш гасили шляхом додавання води (10 мл) та додаткової води (10 мл) та етилацетату (20 мл). Два шари розділяли та водну фазу екстрагували етилацетатом (2 × 20 мл). Комбіновані екстракти промивали водою та сольовим розчином, висушували (MgSO4) та концентрували in vacuo. Залишок розчиняли у дихлорметані та очищали автоматизованою флеш-хроматографією (Biotage™ 25+M cartridge) з градієнтом елюювання, етилацетат : циклогексан [6:94 до 50:50]. Відповідні фракції комбінували та концентрували одержуючи сполуку вказану у заголовку (61 мг). 1 Н-ЯМР (CD3OD): 1,96 - 1,98 (3Н), 3,92 - 3,94 (3Н), 4,50 - 4,52 (1Н), 4,61 - 4,63 (1Н), 7,63 - 7,64 (1Н), 7,89 - 7,90 (1Н), 7,94 - 7,97 (3Н), 7,97 - 8,00 (2Н) Комп’ютерна верстка Т. Чепелева 97388 52 Приготування 19 Метил 3-ціано-5-фторбензоат До розчину 3-ціано-5-фторбензойної кислоти (1,0 г, 6,1 ммоль) у дихлорметані (5 мл) та метанолі (0,5 мл), при 0°С, краплями додавали (триметилсиліл)діазометан (2М у гексані, 3,6 мл, 7,3 ммоль). Реакційну суміш струшували при кімнатній температурі, в атмосфері азоту, протягом 18 годин, та після цього концентрували in vacuo одержуючи сполуку вказану у заголовку (1,1 г). 1 Н-ЯМР (CDCI3): 3,98 - 4,00 (3Н), 7,56 - 7,58 (1Н), 7,97 - 7,99 (1Н), 8,15 - 8,17 (1Н) Приготування 20 N-(1-Ціано-2-гідрокси-1-метилетил)-4(пентафтортіо)бензамід (енантіомер, що елююється першим) Сполуку Приготування 9 (12,1 г, 36,8 ммоль) розчиняли у етанолі (4,5 мл) у партіях по 605 мг та енантіомери розділяли за допомогою автоматизованої препаративної рідинної хроматографії (Gilson system, 500 × 50 мм ID Chiralcel AD-H, 5 мкм колонка, 50 мл/хв.) використовуючи метанол : етанол : гексан [10:10:80] як рухому фазу. Фракції, які містили енантіомер, що елююється першим, комбінували та концентрували одержуючи сполуку вказану у заголовку (5,9 г). Час утримання = 7,55 хв. 250 × 4,6 мм Chiralpak AD-H, 5 мкм колонка, метанол : етанол : гексан [10:10:80], 1мл/хв. + Експериментальне МН 331,0; очікуване 331,1 Приготування 21 N-(1-Ціано-2-гідрокси-1-метилетил)-4(пентафтортіо)бензамід (енантіомер, що елююється другим) Сполуку Приготування 9 (12,1 г, 36,8 ммоль) розчиняли у етанолі (4,5 мл) у партіях по 605 мг та енантіомери відділяли за допомогою автоматизованої препаративної рідинної хроматографії (Gilson system, 500 × 50 мм ID Chiralcel AD-H, 5 мкм колонка, 50 мл/хв.) використовуючи метанол : етанол : гексан [10:10:80] як рухому фазу. Фракції, які містили енантіомер, що елююється другим, комбінували та концентрували одержуючи сполуку вказану у заголовку (5,7 г). Час утримання = 10,40 хв. 250 × 4,6 мм Chiralpak AD-H, 5 мкм колонка, метанол : етанол : гексан [10:10:80], 1 мл/хв. + Експериментальне МН 331,0; очікуване 331,1. Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAntiparasitic agents
Автори англійськоюComlay, Stuart, Nicholas, Hannam, Joanne, Clare, Howson, William, Lauret, Christelle, Sabnis, Yogesh, Anil
Назва патенту російськоюПротивопаразитарные агенты
Автори російськоюКомлей Стюарт Николас, Хеннам Джоанн Клер, Хоусон Уильям, Лоре Кристелль, Сабнис Йогеш Анил
МПК / Мітки
МПК: C07C 381/00, A01N 41/12
Мітки: протипаразитарні, агенти
Код посилання
<a href="https://ua.patents.su/26-97388-protiparazitarni-agenti.html" target="_blank" rel="follow" title="База патентів України">Протипаразитарні агенти</a>
Попередній патент: Інтегральний дозиметр для отримання доз в змішаних гамма-, нейтронних полях
Наступний патент: Похідні циклогексиламіду арилкарбонової кислоти
Випадковий патент: Освітлювач лазера з твердого тіла












