Оральна лікарська форма 4-аміно-2-(2,6-діоксопіперидин-3-іл)ізоіндолін-1,3-діону (варіанти)
Формула / Реферат
1. Оральна лікарська форма в формі капсули, що містить: 1) помалідомід у кількості від 0,1 до 3 мас. % від загальної маси композиції; 2) зв'язуюче або наповнювач у кількості від 90 до 99 мас. % від загальної маси композиції, де зв'язуюче або наповнювач являє собою крохмаль, маніт або їх суміші.
2. Лікарська форма за п. 1, у якій помалідомід присутній у кількості від 0,5 до 2 мас. % від загальної маси композиції.
3. Лікарська форма за п. 1, у якій зв'язуюче або наповнювач присутні у кількості від 95 до 99 мас. % від загальної маси композиції.
4. Лікарська форма за п. 1, у якій зв'язуюче або наповнювач являє собою суміш крохмалю і маніту.
5. Лікарська форма за п. 4, у якій крохмаль являє собою попередньо желатинований крохмаль.
6. Лікарська форма за п. 4, у якій маніт являє собою висушений розпилюванням маніт.
7. Лікарська форма за п. 1, що додатково включає мастильну речовину в кількості від 0,01 до 1,0 мас. % від загальної маси композиції.
8. Лікарська форма за п. 7, де мастильна речовина міститься в кількості від 0,1 до 0,5 мас. % від загальної маси композиції.
9. Лікарська форма за п. 7 або 8, в якій мастильна речовина являє собою стеарилфумарат натрію.
10. Оральна лікарська форма, що має масу 62,5 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват у кількості, яка забезпечує ефективність 0,5 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 35 мг; 3) стеарилфумарат натрію в кількості 0,16 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 62,5 мг.
11. Лікарська форма за п. 10, призначена для введення в капсулі розміру № 4 або більш великій капсулі.
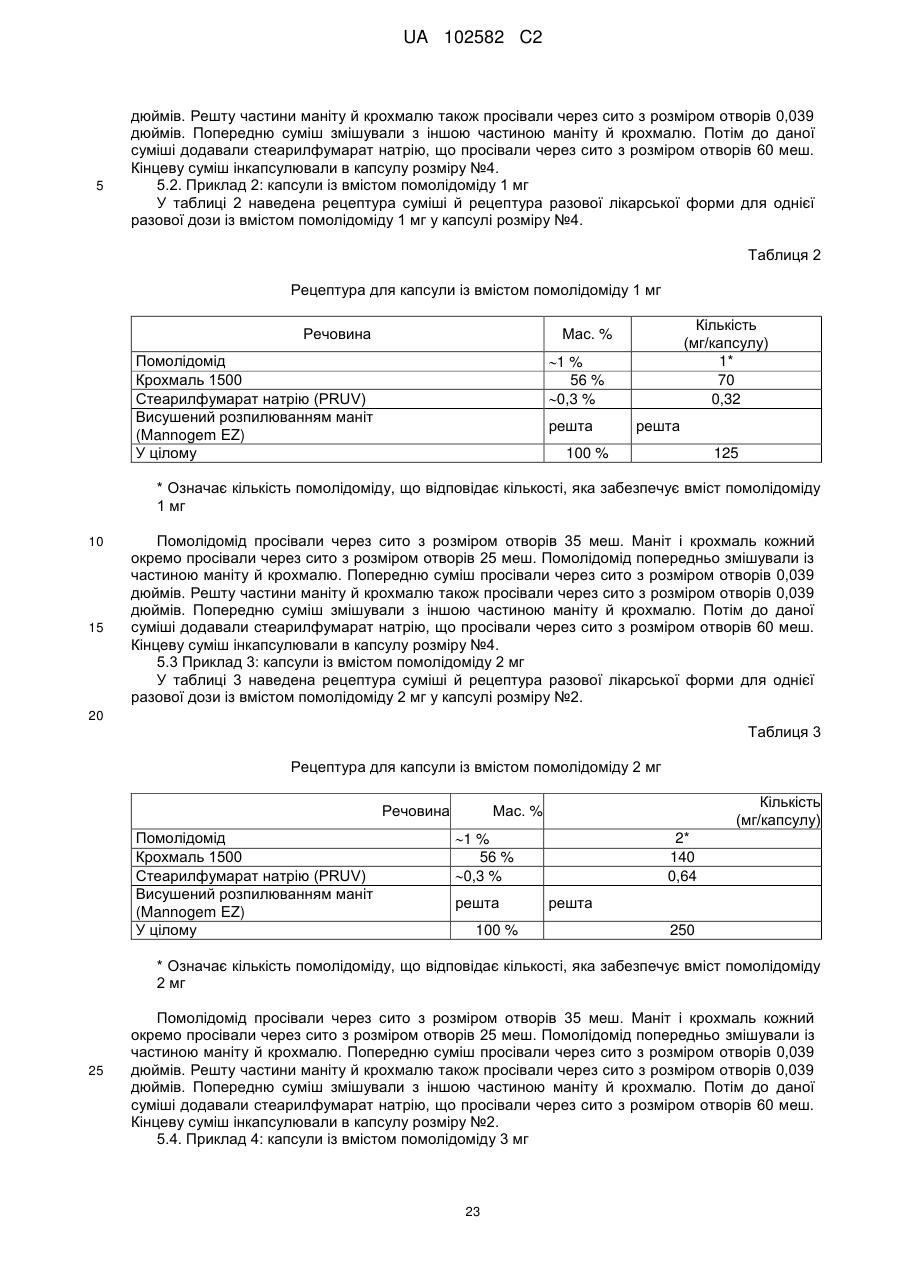
12. Оральна лікарська форма, що має масу 125 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват в кількості, що забезпечує ефективність 1,0 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 70 мг; 3) стеарилфумарат натрію в кількості 0,32 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 125 мг.
13. Лікарська форма за п. 12, призначена для введення в капсулі розміру № 4 або більш великій капсулі.
14. Оральна лікарська форма, що має масу 250 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват в кількості, що забезпечує ефективність 2,0 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 140 мг; 3) стеарилфумарат натрію в кількості 0,64 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 250 мг.
15. Лікарська форма за п. 14, призначена для введення в капсулі розміру № 2 або більш великій капсулі.
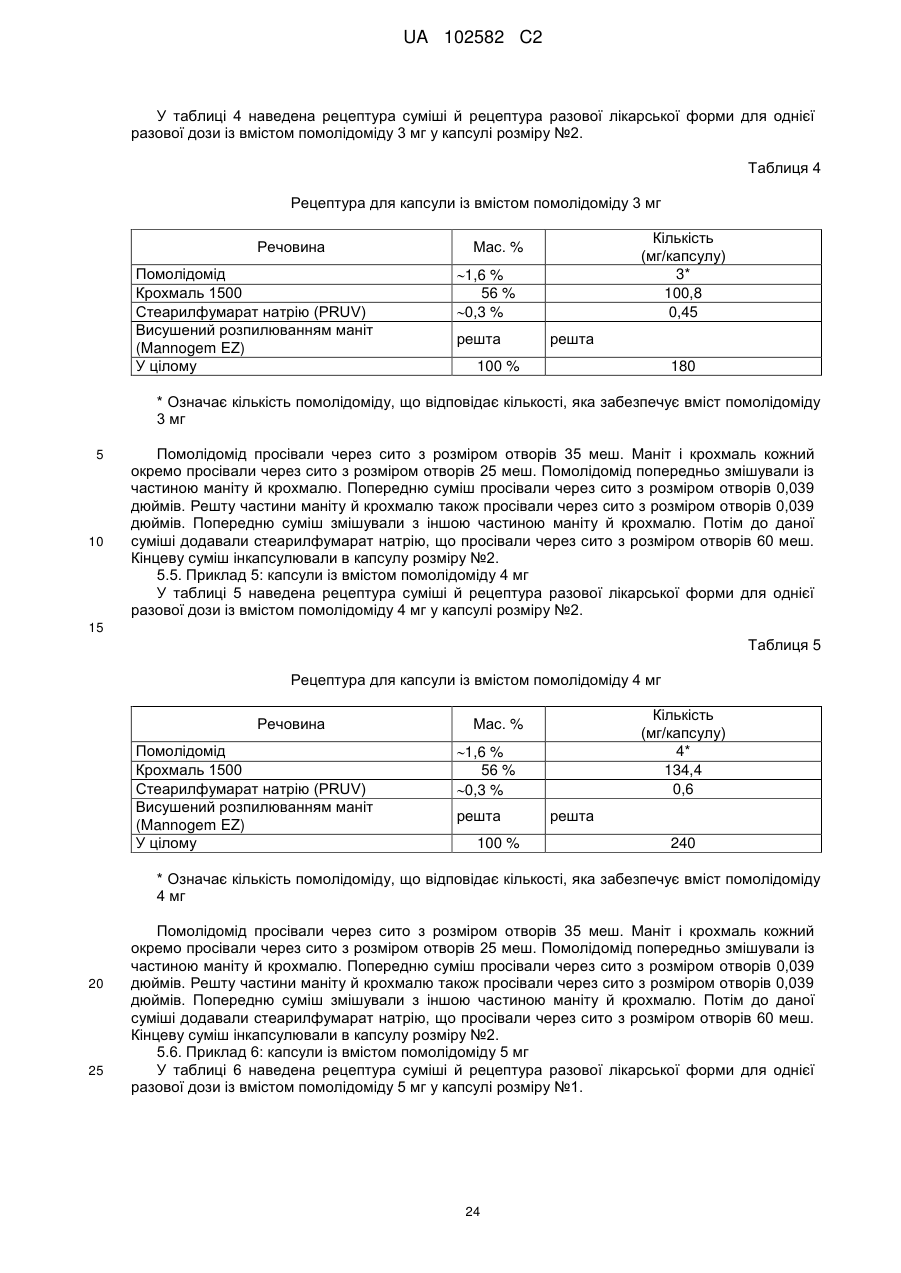
16. Оральна лікарська форма, що має масу 180 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват в кількості, що забезпечує ефективність 3,0 мг помалідоміду; і 2) попередньо желатинованийкрохмаль у кількості 100,8 мг; 3) стеарилфумарат натрію в кількості 0,45 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 180 мг.
17. Лікарська форма за п. 16, призначена для введення в капсулі розміру № 2 або більш великій капсулі.
18. Оральна лікарська форма, що має масу 240 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват в кількості, що забезпечує ефективність 4,0 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 134,4 мг; 3) стеарилфумарат натрію в кількості 0,6 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 240 мг.
19. Лікарська форма за п. 18, призначена для введення в капсулі розміру № 2 або більш великій капсулі.
20. Оральна лікарська форма, що має масу 300 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват в кількості, що забезпечує ефективність 5,0 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 168 мг; 3) стеарилфумарат натрію в кількості 0,75 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 300 мг.
21. Лікарська форма за п. 20, призначена для введення в капсулі розміру № 1 або більш великій капсулі.
22. Спосіб лікування, попередження або менеджменту раку, болю, дегенерації жовтої плями, захворювання шкіри, захворювання легенів, захворювання, викликаного впливом азбесту, паразитарного захворювання, імунодефіцитного розладу, розладу ЦНС, ушкодження ЦНС, атеросклерозу, розладу сну, гемоглобінопатії, анемії, запального захворювання, аутоімунного захворювання, вірусного захворювання, спадкового захворювання, алергійного захворювання, бактеріального захворювання, неоваскуляризації ока, хороїдальної неоваскуляризації, неоваскуляризації сітківки або рубеозу, що включає введення пацієнту оральної лікарської форми за будь-яким з пп. 1-21.
Текст
Реферат: Винахід стосується оральних лікарських форм, що містять помалідомід як активну речовину. UA 102582 C2 (12) UA 102582 C2 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 1. Галузь техніки, до якої належить винахід Розкриваються композиції й лікарські форми помолідоміду, тобто 4-аміно-2-(2,6діоксопіперидин-3-іл)ізоіндолін-1,3-діону або СС-4047. Також розкриваються способи застосування композицій і лікарських форм. 2. Попередній рівень техніки Фармацевтичні субстанції для лікарських препаратів звичайно вводять у вигляді компонента композиції в комбінації з однією або більше іншими речовинами, що виконуть різні й спеціалізовані функції. Лікарські форми різних типів можна приготувати при вибірковому використанні фармацевтичних наповнювачів. Фармацевтичні наповнювачі мають різні функції й вносять свій внесок у фармацевтичні композиції багатьма різними шляхами, наприклад, приводячи до солюбілізації, розведення, загущення, стабілізації, консервації, фарбування, додавання смаку й запаху й т. д. Властивості, які звичайно беруть до уваги при формуляції активної речовини, включають біодоступність, простоту виробництва, простоту введення й стабільність лікарської форми. З урахуванням різних властивостей активної речовини, що підлягає формуляції, як правило, для лікарських форм вибирають фармацевтичні наповнювачі, які унікальним чином підганяються до активної речовини для досягнення поліпшених фізичних і фармацевтичних властивостей. Помолідомід, також відомий як СС-4047, у хімічному відношенні являє собою 4-аміно-2-(2,6діоксопіперидин-3-іл)ізоіндолін-1,3-діон. Помолідомід є імуномодулятором, який інгібує, наприклад, продукцію моноцитами TNFα, IL-1β, IL-12, IL-6, MIP-1, MCP-1, GM-CSF, G-CSF і COX-2, індуковану LPS. Також відомо, що сполука костимулює активацію Т-клітин. Помолідомід і спосіб синтезу сполуки описані, наприклад, у патенті США №5635517, що у повному об'ємі включений у даний документ для відома. Через різноманіття фармакологічних властивостей помолідомід є придатним для лікування, профілактики і/або контролю різних захворювань або розладів. Таким чином, існує потреба в лікарських формах помолідоміду, які мають переважні фізичні й фармацевтичні властивості. 3. Суть винаходу Розкриваються фармацевтичні лікарські форми помолідоміду або його фармацевтично прийнятного стереоізомера, проліків, солі, сольвату, гідрату або клатрату. Також розкриваються способи лікування, контролювання або попередження захворювань або станів, таких як, не обмежуючись цим, рак, біль, макулярна дегенерація, шкірне захворювання, захворювання легенів, захворювання, викликане впливом азбесту, паразитарне захворювання, імунодефіцит, розлад ЦНС, ушкодження ЦНС, атеросклероз, розлад сну, гемоглобінопатія, анемія, аутоімунне захворювання, вірусне захворювання, спадкоємне захворювання, алергійне захворювання, бактеріальне захворювання, неоваскуляризація ока, хороїдальна неоваскуляризація, неоваскуляризація сітківки й рубеоз, з використанням помолідоміду або його фармацевтично прийнятного стереоізомера, проліків, солі, сольвату, гідрату або клатрату, у лікарських формах, описаних у даному документі. 3.1. Визначення У тому розумінні, у якому в даному документі використовується, і якщо не зазначено інакше, термін композиція, що "по суті не містить" сполуки, означає, що композиція містить менше ніж приблизно 20 мас. %, більш переважно менше ніж приблизно 10 мас. %, ще більш переважно менше ніж приблизно 5 мас. % і найбільше переважно менше ніж приблизно 3 мас. % сполуки. У тому розумінні, у якому в даному документі використовується, і якщо не зазначено інакше, термін "стереоізомерно чиста", він означає композицію, яка містить один стереоізомер сполуки й по суті не містить інших стереоізомерів сполуки. Наприклад, стереоізомерно чиста композиція сполуки, що містить один хіральний центр, по суті не буде містити протилежний енантіомер сполуки. Стереоізомерно чиста композиція сполуки, що містить два хіральних центри, по суті не буде містити інші діастереоізомери сполуки. Типово стереізомерно чиста сполука містить більше ніж при 80 мас. % одного стереоізомера сполуки й менше ніж приблизно 20 мас. % інших стереоізомерів сполуки, більш переважно більше ніж приблизно 90 мас. % одного стереоізомера сполуки й менше ніж приблизно 10 мас. % інших стереоізомерів сполуки, ще більш переважно більше ніж приблизно 95 мас. % одного стереоізомера сполуки й менше ніж приблизно 5 мас. % інших стереоізомерів сполуки, і найбільше переважно більше ніж приблизно 97 мас. % одного стереоізомера сполуки й менше ніж приблизно 3 мас. % інших стереоізомерів сполуки. У тому розумінні, у якому в даному документі використовується, і якщо не зазначено інакше, термін "енантіомерно чиста", він означає стереоізомерно чисту композицію сполуки, що містить один хіральний центр. 1 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 У тому розумінні, у якому в даному документі використовується, і якщо не зазначено інакше, термін "фармацевтично прийнятна сіль(і)», він включає, не обмежуючись цим, солі кислих і основних груп талідоміду. Основні групи здатні до утворення широкого ряду солей з різними неорганічними й органічними кислотами. Кислоти, які можна використовувати для одержання фармацевтично прийнятних адитивних солей кислоти таких основних сполук, представляють кислоти, що утворюють нетоксичні адитивні солі кислоти, тобто солі, що містять фармакологічно прийнятні аніони. Прийнятні органічні кислоти включають, не обмежуючись цим, малеїнову, фумарову, бензойну, аскорбінову, бурштинову, оцтову, мурашину, щавлеву, пропіонову, винну, саліцилову, лимонну, глюконову, молочну, мигдальну, цинамову, олеїнову, дубильну, аспарагінову, стеаринову, пальмітинову, гліколеву, глутамінову, глюконову, глюкуронову, цукрову, ізонікотинову, метансульфонову, етансульфонову, п-толуолсульфонову, бензолсульфонову або памоєву (тобто 1,1’-метилен-біс-(2-гідрокси-3-нафтоат) кислоти. Прийнятні неорганічні кислоти включають, не обмежуючись цим, хлористоводневу, бромистоводневу, йодистоводневу, сірчані, фосфорну або азотну кислоти. Сполуки, які містять аміногрупу, здатні до утворення фармацевтично прийнятних солей з різними амінокислотами, на додаток до кислот, вказаних вище. Хімічні групи, які є кислими по своїй природі, здатні до утворення основних солей з різними фармакологічно прийнятними катіонами. Прикладами таких солей є солі лужних металів або лужноземельних металів, і, зокрема, кальцію, магнію, натрію, літію, цинку, калію або заліза. У тому розумінні, у якому в даному документі використовується, і якщо не зазначено інакше, термін "сольват", він означає сполуку, описану в даному документі, або її сіль, що додатково містить стехіометричну або нестехіометричну кількість розчинника, зв'язаного нековалентними міжмолекулярними зв'язками. У тому випадку, коли розчинником є вода, то сольват представляє гідрат. У тому розумінні, у якому в даному документі використовується, і якщо не зазначено інакше, термін "проліки", він означає похідну сполуки, що може піддаватися гідролізу, окиснюванню або взаємодіяти іншим способом у біологічних умовах (in vitro або in vivo) з утворенням вихідної сполуки. Приклади проліків включають, не обмежуючись цим, похідні талідоміду, що містять біогідролізовані групи, такі як біогідролізовані аміди, біогідролізовані складні ефіри, біогідролізовані карбамати, біогідролізовані карбонати, біогідролізовані уреїди і біогідролізовані фосфати. Інші приклади проліків включають похідні талідоміду, що містять групи -NO, -NO2, -ONO або -ONO2. У тому розумінні, у якому в даному документі використовуються, і якщо не зазначено інакше, терміни "біогідролізований карбамат", "біогідролізований карбонат", "біогідролізований уреїд" і "біогідролізований фосфат", вони означають відповідно карбамат, карбонат, уреїд або фосфат сполуки, які: 1) не чинять негативного впливу на біологічну активність сполуки, але можуть надавати сполуці поліпшених властивостей в умовах in vivo, такі як поглинання, тривалість дії або початок дії або 2) є біологічно неактивними, але перетворюються в умовах in vivo у біологічно активну сполуку. Приклади "біогідролізованих карбаматів" включають, не обмежуючись цим, нижчі алкіламіни, заміщені етилендіаміни, амінокислоти, гідроксіалкіламіни, гетероциклічні або гетероароматичні аміни й поліефіраміни. У тому розумінні, у якому в даному документі використовується, і якщо не зазначено інакше, термін "біогідролізований складний ефір", він означає складний ефір сполуки, що: 1) не чинить негативного впливу на біологічну активність сполуки, але може надавати сполуці поліпшені властивості в умовах in vivo, такі як поглинання, тривалість дії або початок дії або 2) є біологічно неактивною, але перетворюється в умовах in vivo у біологічно активну сполуку. Приклади "біогідролізованих складних ефірів" включають, не обмежуючись цим, нижчі алкілові складні ефіри, алкоксіацилоксіефіри, алкілациламіноалкілові складні ефіри й складні холінові ефіри. У тому розумінні, у якому в даному документі використовується, і якщо не зазначено інакше, термін "біогідролізований амід", він означає амід сполуки, що: 1) не чинить негативного впливу на біологічну активність сполуки, але може надавати сполуці поліпшені властивості в умовах in vivo, такі як поглинання, тривалість дії або початок дії або 2) є біологічно неактивною, але перетворюється в умовах in vivo у біологічно активну сполуку. Приклади "біогідролізованих амідів" включають, не обмежуючись цим, нижчі алкіламіди, аміди α-амінокислот, алкоксіациламіди й алкіламіноалкілкарбоніламіди. У тому розумінні, у якому в даному документі використовуються, і якщо не зазначено інакше, терміни "лікувати", "процес лікування" і "лікування", вони припускають дію, що має місце, коли пацієнт страждає на певне захворювання або розлад, що приводить до зниження тяжкості захворювання або розладу, або придушує або сповільнює прогресування захворювання або розладу. 2 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 У тому розумінні, у якому в даному документі використовуються, і якщо не зазначено інакше, терміни "профілактувати", "процес профілактики" і "профілактика", вони належать до попередження початку, рецидиву або прогресування захворювання або розладу, або одного або більше його симптомів. Терміни "профілактувати", "процес профілактики" і "профілактика" передбачають дію, що має місце, перш ніж пацієнт починає страждати на конкретне захворювання або розлад, що приведе до придушення або зниження тяжкості захворювання або розладу. У тому розумінні, у якому в даному документі використовуються, і якщо не зазначено інакше, терміни "контролювати", "процес контролю" і "контроль", вони включають попередження рецидиву певного захворювання або розладу в пацієнта, що вже страждає на захворювання або розлад, і/або подовження періоду часу, протягом якого пацієнт, що страждає на захворювання або розлад, залишається в стані ремісії. Термін включає модуляцію порога, прогресування і/або тривалості протікання захворювання або розладу, або зміну характеру реакцій, якими пацієнт відповідає на причину захворювання або розладу. У тому розумінні, у якому в даному документі використовується, і якщо не зазначено інакше, термін "приблизно", коли він використовується стосовно доз, кількостей або масових відсотків інгредієнтів у композиції або лікарській формі, він означає дозу, кількість або масовий відсоток, відомі фахівцям у даній галузі, для забезпечення фармакологічного ефекту, еквівалентного отриманому від конкретної дози, кількості або масового відсотка. Зокрема, термін "приблизно" передбачає дозу, кількість або масовий відсоток у межах 30 %, 25 %, 20 %, 15 %, 10 % або 5 % від конкретної дози, кількості або масового відсотка. У тому розумінні, у якому в даному документі використовується, і якщо не зазначено інакше, термін "стабільна стосовно композиції або лікарської форми, він означає, що активний інгредієнт у композиції або лікарській формі залишається в солюбілізованому стані протягом певного періоду часу й суттєво не деградує або агрегує, або стає модифікованим іншим способом (наприклад, по даних ВЕРХ). У деяких варіантах здійснення приблизно 70 % або вище, приблизно 80 % або вище, або приблизно 90 % або вище сполуки залишається солюбілізованим після певного періоду часу. 4. Докладний опис винаходу Розкриваються фармацевтичні лікарські форми помолідоміду або його фармацевтично прийнятного стереоізомера, проліків, солі, сольвату, гідрату або клатрату. У деяких варіантах здійснення лікарські форми підходять для перорального введення пацієнту. В інших варіантах здійснення лікарські форми, розкриті в даному документі, проявляють поліпшені фізичні і/або фармакологічні властивості. Такі властивості включають, не обмежуючись цим, простоту аналізу, однорідність складу, сипкість для виробництва, розчинення й біодоступність, і стабільність. У деяких варіантах здійснення лікарські форми, розкриті в даному документі, мають період напіврозпаду, що становить щонайменше приблизно 12 місяців щонайменше приблизно 24 місяця або щонайменше приблизно 36 місяців при зберіганні без охолодження. Також розкриваються набори, що містять фармацевтичні композиції й лікарські форми, описані в даному документі. Також розкриваються способи лікування, контролю і/або профілактики захворювання або стану, які включають введення пацієнту, який потребує цього, фармацевтичної композиції або лікарської форми, описаної в даному документі. 4.1. Композиції й лікарські форми В одному варіанті здійснення в даному документі розкривається окрема разова лікарська форма, що підходить для перорального введення людині, яка містить кількість активного інгредієнта, що дорівнює або вища ніж приблизно 1; 5; 10; 15; 20; 25; 30; 50; 75; 100; 150 або 200 мг; і фармацевтично прийнятний наповнювач; у якій активний інгредієнт представляє помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат. У деяких варіантах здійснення кількість активного інгредієнта знаходиться в межах приблизно від 0,1 до приблизно 100 мг, приблизно від 0,5 до приблизно 50 мг, приблизно від 0,5 до приблизно 25 мг, приблизно від 1 до приблизно 10 мг, приблизно від 0,5 до приблизно 5 мг або приблизно від 1 до приблизно 5 мг. В одному варіанті здійснення кількість активного інгредієнта становить приблизно 0,5 мг. У ще одному варіанті здійснення кількість активного інгредієнта становить приблизно 1 мг. У ще одному варіанті здійснення кількість активного інгредієнта становить приблизно 2 мг. У ще одному варіанті здійснення кількість активного інгредієнта становить приблизно 5 мг. Фармацевтичні композиції й препаративні форми, описані в даному документі, можуть знаходитися у вигляді окремих лікарських форм, таких як капсули (наприклад, гель-капсули), таблетки у вигляді капсул, таблетки, пастилки, смоктальні таблетки, дисперсії й супозиторії, де кожна форма містить попередньо визначену кількість активного інгредієнта у вигляді порошку 3 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 або гранул, розчину або суспензії у водній або неводній рідині, емульсії масло-у-воді або емульсії вода-у-маслі. За рахунок простоти введення таблетки, таблетки у вигляді капсул і капсули є переважними разовими лікарськими формами. Як правило, таблетки, таблетки у вигляді капсул і капсули містять приблизно від 50 мг до приблизно 500 мг фармацевтичної композиції (тобто активного інгредієнта й наповнювача(ів)). Капсули можуть бути будь-якого розміру. Приклади стандартних розмірів включають №000, №00, №0, №1, №2, №3, №4 і №5. Дивися, наприклад, Remington's Pharmaceutical Sciences, th page 1658-1659 (Alfonso Gennaro ed., Mack Publishing Company, Easton Pennsylvania, 18 ed., 1990), це джерело включене в даний документ для відома. У деяких варіантах здійснення капсули, розкриті в даному документі, мають розмір №1 або більше, №2 або більше, або №4 або більше. Також у даному документі розкриваються безводні фармацевтичні композиції й лікарські форми, що містять активний інгредієнт, оскільки вода може сприяти деградації деяких сполук. Наприклад, додавання води (наприклад, 5 %) широко застосовується у фармації як спосіб моделювання періоду напіврозпаду, тобто тривалого періоду зберігання, для визначення таких характеристик, як період напіврозпаду або стабільність композицій із плином часу. Дивися, наприклад, Jens T. Cartensen, Drug Stability: Principles&Practice, 2d Ed., Marcel Dekker, NY, NY, 1995, pp. 379-380. Фактично вода й нагрівання прискорюють розкладання. Таким чином, вплив води на композицію може мати дуже велике значення, оскільки волога і/або вологість є звичайними факторами під час виробництва, поводження, упакування, зберігання, транспортування й застосування композицій. Безводні фармацевтичні композиції необхідно готувати й зберігати таким чином, щоб зберігався їхній безводний стан. Отже, у деяких варіантах здійснення безводні композиції упаковують із використанням матеріалів, про які відомо, що вони попереджають вплив води, так, що їх можна включити в прийнятні формульовані набори. Приклади прийнятних упаковок включають, не обмежуючись цим, герметично закриту фольгу, пластик або тому подібне, контейнери для разових лікарських форм, блістерні упаковки й стріп-упаковки. В цьому відношенні також у даному документі розкривається спосіб одержання твердої фармацевтичної композиції, що містить активний інгредієнт за допомогою змішування активного інгредієнта й наповнювача в безводних умовах і/або умовах з низьким вмістом вологи/вологості, у якій інгредієнти по суті не містять води. Спосіб може додатково включати упаковування безводної або негігроскопічної твердої композиції в умовах з низькою вологістю. При використанні таких умов ризик контактування з водою знижується, і розкладання активного інгредієнта можна попередити й суттєво знизити. Також у даному документі розкриваються фармацевтичні композиції й лікарські форми, що не містять лактозу. Композиції й лікарські форми, що містять активний інгредієнт, який представляє первинний або вторинний амін, переважно не містять лактозу. У тому розумінні, у якому в даному документі використовується термін "які не містять лактозу", він означає, що кількість присутньої лактози, якщо вона взагалі знаходиться в композиції, є недостатньою для суттєвого збільшення швидкості розкладання активного інгредієнта, що являє собою первинний або вторинний амін. Композиції, які не містять лактозу, розкриті в даному документі, можуть містити наповнювачі, добре відомі в даній галузі й перераховані у Фармакопеї США (USP (XXI)/NF (XVI)), це джерело включене в даний документ для відома. В одному варіанті здійснення помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат становить приблизно від 0,1 до приблизно 10 мас. % до загальної маси композиції. У ще одному варіанті здійснення помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат становить приблизно від 0,1 до приблизно 5 мас. % до загальної маси композиції. У ще одному варіанті здійснення помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат становить приблизно від 0,1 до приблизно 3 мас. % до загальної маси композиції. У ще одному варіанті здійснення помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат становить приблизно від 0,5 до приблизно 3 мас. % до загальної маси композиції. У ще одному варіанті здійснення помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат становить приблизно від 0,5 до приблизно 2 мас. % до загальної маси композиції. У ще одному варіанті здійснення помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат становить приблизно 1 мас. % до загальної маси композиції. У ще одному варіанті здійснення помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат становить приблизно 0,8 мас. % до загальної маси композиції. У ще одному варіанті здійснення 4 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат становить приблизно 2 мас. % до загальної маси композиції. У ще одному варіанті здійснення помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат становить приблизно 1,7 мас. % до загальної маси композиції. В одному варіанті здійснення активний інгредієнт і носій, розріджувач, зв'язувальна речовина або заповнювач змішуються безпосередньо, як описано в даному документі. У ще одному варіанті здійснення носій, розріджувач, зв'язувальна речовина або заповнювач включають маніт і/або крохмаль. У ще одному варіанті здійснення маніт представляє висушений розпилюванням маніт. У ще одному варіанті здійснення крохмаль представляє попередньо желатинований крохмаль. В одному варіанті здійснення носій, розріджувач, зв'язувальна речовина або заповнювач становлять приблизно від 70 до приблизно 99 мас. % до загальної маси композиції. У ще одному варіанті здійснення носій, розріджувач, зв'язувальна речовина або заповнювач становлять приблизно від 80 до приблизно 99 мас. % до загальної маси композиції. У ще одному варіанті здійснення носій, розріджувач, зв'язувальна речовина або заповнювач становлять приблизно від 85 до приблизно 99 мас. % до загальної маси композиції. У ще одному варіанті здійснення носій, розріджувач, зв'язувальна речовина або заповнювач становлять приблизно від 90 до приблизно 99 мас. % до загальної маси композиції. У ще одному варіанті здійснення носій, розріджувач, зв'язувальна речовина або заповнювач становлять приблизно від 95 до приблизно 99 мас. % до загальної маси композиції. У ще одному варіанті здійснення носій, розріджувач, зв'язувальна речовина або заповнювач становлять приблизно 98 мас. % до загальної маси композиції. У ще одному варіанті здійснення носій, розріджувач, зв'язувальна речовина або заповнювач становлять приблизно 99 мас. % до загальної маси композиції. В одному варіанті здійснення лікарські форми, описані в даному документі, містять одночасно маніт і крохмаль. В одному варіанті здійснення маніт і крохмаль становлять приблизно від 70 до приблизно 99 мас. % до загальної маси композиції. У ще одному варіанті здійснення маніт і крохмаль становлять приблизно від 80 до приблизно 99 мас. % до загальної маси композиції. У ще одному варіанті здійснення маніт і крохмаль становлять приблизно від 85 до приблизно 99 мас. % до загальної маси композиції. У ще одному варіанті здійснення маніт і крохмаль становлять приблизно від 90 до приблизно 99 мас. % до загальної маси композиції. У ще одному варіанті здійснення маніт і крохмаль становлять приблизно від 95до приблизно 99 мас. % до загальної маси композиції. У ще одному варіанті здійснення маніт і крохмаль становлять приблизно 98 мас. % до загальної маси композиції. У ще одному варіанті здійснення маніт і крохмаль становлять приблизно 99 мас. % до загальної маси композиції. В одному варіанті здійснення співвідношення маніт:крохмаль у лікарській формі знаходиться в межах приблизно від 1:1 до приблизно 1:1,5. В одному варіанті здійснення співвідношення маніт:крохмаль у лікарській формі становить приблизно 1:1,3. У ще одному варіанті здійснення лікарська форма містить мастильну речовину. В одному варіанті здійснення лікарська форма містить приблизно 0,2; 0,3; 0,5; 0,6 або 0,8 мг мастильної речовини. У ще одному варіанті здійснення лікарська форма містить приблизно 0,16; 0,32; 0,64 або 0,75 мг мастильної речовини. У ще одному варіанті здійснення мастильна речовина представляє стеарилфумарат натрію (PRUV). В одному варіанті здійснення мастильна речовина наприклад, PRUV, становить приблизно від 0,01 до приблизно 5 мас. % до загальної маси композиції. У ще одному варіанті здійснення мастильна речовина наприклад, PRUV, становить приблизно від 0,01 до приблизно 1 мас. % до загальної маси композиції. У ще одному варіанті здійснення мастильна речовина наприклад, PRUV, становить приблизно від 0,1 до приблизно 1 мас. % до загальної маси композиції. У ще одному варіанті здійснення мастильна речовина наприклад, PRUV, становить приблизно від 0,1 до приблизно 0,5 мас. % до загальної маси композиції. У ще одному варіанті здійснення мастильна речовина наприклад, PRUV, становить приблизно від 0,2 до приблизно 0,3 мас. % до загальної маси композиції. У ще одному варіанті здійснення мастильна речовина наприклад, PRUV, становить приблизно 0,25 мас. % до загальної маси композиції. З врахуванням того, що звичайно помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат одержують із чистотою нижчою 100 %, то в деяких варіантах здійснення композиції й лікарські форми, описані в даному документі, можна визначити як композиції, препаративні форми або лікарські форми, що містять помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, у кількості, що забезпечує вміст певної кількості 100 % чистого помолідоміду. 5 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 Наприклад, в одному варіанті здійснення розкривається окрема разова лікарська форма, що містить відповідно: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 0,5; 1; 2; 3; 4 або 5 мг і 2) приблизно 60; 120; 250; 180; 240 і 300 мг носія, розріджувача, зв'язувальної речовини або заповнювача. В одному варіанті здійснення кількість носія, розріджувача, зв'язувальної речовини або заповнювача становить відповідно 62; 124; 248; 177; 236 або 295 мг. В одному варіанті здійснення розкривається лікарська форма, що містить відповідно: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 0,5 мг і 2) фармацевтично прийнятний наповнювач. В одному варіанті здійснення загальна маса лікарської форми становить приблизно 62,5 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №4 або більшій капсулі. В одному варіанті здійснення наповнювач включає носій, розріджувач, зв'язувальну речовину й заповнювач. В одному варіанті здійснення наповнювачі включають носій, розріджувач, зв'язувальну речовину або заповнювач, і мастильну речовину. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 62,5 мг, носій, розріджувач, зв'язувальна речовина або заповнювач включають маніт і/або крохмаль. В одному варіанті здійснення наповнювач включає одночасно маніт і крохмаль. В одному варіанті здійснення, коли в лікарській формі присутні одночасно маніт і крохмаль, то лікарська форма містить приблизно 35 мг крохмалю, і інша маса заповнена крохмалем. В одному варіанті здійснення маніт представляє висушений розпилюванням маніт. У ще одному варіанті здійснення крохмаль представляє попередньо желатинований крохмаль. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 62,5 мг і де є присутньою мастильна речовина, то мастильна речовина представляє стеарилфумарат натрію. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,2 мг. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,16 мг. В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 0,5 мг; 2) приблизно 35 мг попередньо желатинованого крохмалю; 3) приблизно 0,16 мг стеарилфумарату натрію й 4) висушений розпилюванням маніт у кількості, що доводить загальну масу лікарської форми до 62,5 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №4 або більшій капсулі. В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 1 мг і 2) фармацевтично прийнятний наповнювач. В одному варіанті здійснення загальна маса лікарської форми становить приблизно 125 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №4 або більшій капсулі. В одному варіанті здійснення наповнювач включає носій, розріджувач, зв'язувальну речовину й заповнювач. В одному варіанті здійснення наповнювачі включають носій, розріджувач, зв'язувальну речовину або заповнювач, і мастильну речовину. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 125 мг, носій, розріджувач, зв'язувальна речовина або заповнювач включають маніт і/або крохмаль. В одному варіанті здійснення наповнювач включає одночасно маніт і крохмаль. В одному варіанті здійснення, коли в лікарській формі присутні одночасно маніт і крохмаль, то лікарська форма містить приблизно 70 мг крохмалю, і інша маса заповнена крохмалем. В одному варіанті здійснення маніт представляє висушений розпилюванням маніт. У ще одному варіанті здійснення крохмаль представляє попередньо желатинований крохмаль. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 125 мг і де є присутньою мастильна речовина, то мастильна речовина представляє стеарилфумарат натрію. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,3 мг. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,32 мг. В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 1 мг; 2) приблизно 70 мг попередньо желатинованого крохмалю; 3) приблизно 0,32 мг стеарилфумарату натрію й 4) 6 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 висушений розпилюванням маніт у кількості, що доводить загальну масу лікарської форми до 125 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №4 або більшій капсулі. В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 2 мг і 2) фармацевтично прийнятний наповнювач. В одному варіанті здійснення загальна маса лікарської форми становить приблизно 250 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №2 або більшій капсулі. В одному варіанті здійснення наповнювач включає носій, розріджувач, зв'язувальну речовину й заповнювач. В одному варіанті здійснення наповнювачі включають носій, розріджувач, зв'язувальну речовину або заповнювач, і мастильну речовину. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 250 мг, носій, розріджувач, зв'язувальна речовина або заповнювач включають маніт і/або крохмаль. В одному варіанті здійснення наповнювач включає одночасно маніт і крохмаль. В одному варіанті здійснення, коли в лікарській формі присутні одночасно маніт і крохмаль, то лікарська форма містить приблизно 140 мг крохмалю, і інша маса заповнена крохмалем. В одному варіанті здійснення маніт представляє висушений розпилюванням маніт. У ще одному варіанті здійснення крохмаль представляє попередньо желатинований крохмаль. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 250 мг і де присутня мастильна речовина, то мастильна речовина представляє стеарилфумарат натрію. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,6 мг. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,64 мг. В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 2 мг; 2) приблизно 140 мг попередньо желатинованого крохмалю; 3) приблизно 0,64 мг стеарилфумарату натрію й 4) висушений розпилюванням маніт у кількості, що доводить загальну масу лікарської форми до 250 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №2 або більшій капсулі. В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 3 мг і 2) фармацевтично прийнятний наповнювач. В одному варіанті здійснення загальна маса лікарської форми становить приблизно 180 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №2 або більшій капсулі. В одному варіанті здійснення наповнювач включає носій, розріджувач, зв'язувальну речовину й заповнювач. В одному варіанті здійснення наповнювачі включають носій, розріджувач, зв'язувальну речовину або заповнювач, і мастильну речовину. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 180 мг, носій, розріджувач, зв'язувальна речовина або заповнювач включають маніт і/або крохмаль. В одному варіанті здійснення наповнювач включає одночасно маніт і крохмаль. В одному варіанті здійснення, коли в лікарській формі присутні одночасно маніт і крохмаль, то лікарська форма містить приблизно 100 мг крохмалю, і інша маса заповнена крохмалем. В одному варіанті здійснення маніт представляє висушений розпилюванням маніт. У ще одному варіанті здійснення крохмаль представляє попередньо желатинований крохмаль. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 180 мг і де присутня мастильна речовина, то мастильна речовина представляє стеарилфумарат натрію. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,5 мг. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,45 мг. В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 3 мг; 2) приблизно 100,8 мг попередньо желатинованого крохмалю; 3) приблизно 0,45 мг стеарилфумарату натрію й 4) висушений розпилюванням маніт у кількості, що доводить загальну масу лікарської форми до 180 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №2 або більшій капсулі. 7 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 4 мг і 2) фармацевтично прийнятний наповнювач. В одному варіанті здійснення загальна маса лікарської форми становить приблизно 240 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №2 або більшій капсулі. В одному варіанті здійснення наповнювач включає носій, розріджувач, зв'язувальну речовину й заповнювач. В одному варіанті здійснення наповнювачі включають носій, розріджувач, зв'язувальну речовину або заповнювач, і мастильну речовину. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 240 мг, носій, розріджувач, зв'язувальна речовина або заповнювач включають маніт і/або крохмаль. В одному варіанті здійснення наповнювач включає одночасно маніт і крохмаль. В одному варіанті здійснення, коли в лікарській формі присутні одночасно маніт і крохмаль, то лікарська форма містить приблизно 135 мг крохмалю, і інша маса заповнена крохмалем. В одному варіанті здійснення маніт представляє висушений розпилюванням маніт. У ще одному варіанті здійснення крохмаль представляє попередньо желатинований крохмаль. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 240 мг і де присутня мастильна речовина, то мастильна речовина представляє стеарилфумарат натрію. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,6 мг. В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 4 мг; 2) приблизно 134,4 мг попередньо желатинованого крохмалю; 3) приблизно 0,6 мг стеарилфумарату натрію й 4) висушений розпилюванням маніт у кількості, що доводить загальну масу лікарської форми до 240 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №2 або більшій капсулі. В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 5 мг і 2) фармацевтично прийнятний наповнювач. В одному варіанті здійснення загальна маса лікарської форми становить приблизно 300 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №1 або більшій капсулі. В одному варіанті здійснення наповнювач включає носій, розріджувач, зв'язувальну речовину й заповнювач. В одному варіанті здійснення наповнювачі включають носій, розріджувач, зв'язувальну речовину або заповнювач, і мастильну речовину. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 300 мг, носій, розріджувач, зв'язувальна речовина або заповнювач включають маніт і/або крохмаль. В одному варіанті здійснення наповнювач включає одночасно маніт і крохмаль. В одному варіанті здійснення, коли в лікарській формі присутні одночасно маніт і крохмаль, то лікарська форма містить приблизно 168 мг крохмалю, і інша маса заповнена крохмалем. В одному варіанті здійснення маніт представляє висушений розпилюванням маніт. У ще одному варіанті здійснення крохмаль представляє попередньо желатинований крохмаль. В одному варіанті здійснення, де загальна маса лікарської форми становить приблизно 300 мг і де присутня мастильна речовина, то мастильна речовина представляє стеарилфумарат натрію. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,8 мг. В одному варіанті здійснення стеарилфумарат натрію знаходиться в кількості приблизно 0,75 мг. В одному варіанті здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 5 мг; 2) приблизно 168 мг попередньо желатинованого крохмалю; 3) приблизно 0,75 мг стеарилфумарату натрію й 4) висушений розпилюванням маніт у кількості, що доводить загальну масу лікарської форми до 300 мг. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №1 або більшій капсулі. У ще одному варіанті здійснення розкривається лікарська форма, що містить помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 0,5 мг, що є стабільною протягом щонайменше приблизно 12, приблизно 24 або приблизно 36 місяців при зберіганні без охолодження. У деяких варіантах здійснення лікарська форма містить маніт і/або 8 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 крохмаль. В одному варіанті здійснення, коли в лікарській формі присутні одночасно маніт і крохмаль, то крохмаль знаходиться в кількості приблизно 35 мг, і маніт знаходиться в кількості, що доводить загальну масу лікарської форми до 62,5 мг. У деяких варіантах здійснення лікарська форма додатково містить стеарилфумарат натрію в кількості приблизно 0,2 мг або приблизно 0,16 мг. У деяких варіантах здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 0,5 мг; 2) приблизно 35 мг попередньо желатинованого крохмалю; 3) приблизно 0,16 мг стеарилфумарату натрію й 4) висушений розпилюванням маніт у кількості, що доводить загальну масу лікарської форми до 62,5 мг; де лікарська форма є стабільною протягом щонайменше приблизно 12, приблизно 24 або приблизно 36 місяців при зберіганні без охолодження. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №4 або більшій капсулі. У ще одному варіанті здійснення розкривається лікарська форма, що містить помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 1 мг, що є стабільною протягом щонайменше приблизно 12, приблизно 24 або приблизно 36 місяців при зберіганні без охолодження. У деяких варіантах здійснення лікарська форма містить маніт і/або крохмаль. В одному варіанті здійснення, коли в лікарській формі присутні одночасно маніт і крохмаль, то крохмаль знаходиться в кількості приблизно 70 мг, і маніт знаходиться в кількості, що доводить загальну масу лікарської форми до 125 мг. У деяких варіантах здійснення лікарська форма додатково містить стеарилфумарат натрію в кількості приблизно 0,3 мг або приблизно 0,32 мг. У деяких варіантах здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 1 мг; 2) приблизно 70 мг попередньо желатинованого крохмалю; 3) приблизно 0,32 мг стеарилфумарату натрію й 4) висушений розпилюванням маніт у кількості, що доводить загальну масу лікарської форми до 125 мг; де лікарська форма є стабільною протягом щонайменше приблизно 12, приблизно 24 або приблизно 36 місяців при зберіганні без охолодження. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №4 або більшій капсулі. У ще одному варіанті здійснення розкривається лікарська форма, що містить помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 2 мг, що є стабільною протягом щонайменше приблизно 12, приблизно 24 або приблизно 36 місяців при зберіганні без охолодження. У деяких варіантах здійснення лікарська форма містить маніт і/або крохмаль. В одному варіанті здійснення, коли в лікарській формі присутні одночасно маніт і крохмаль, то крохмаль знаходиться в кількості приблизно 140 мг, і маніт знаходиться в кількості, що доводить загальну масу лікарської форми до 250 мг. У деяких варіантах здійснення лікарська форма додатково містить стеарилфумарат натрію в кількості приблизно 0,6 мг або приблизно 0,64 мг. У деяких варіантах здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 2 мг; 2) приблизно 140 мг попередньо желатинованого крохмалю; 3) приблизно 0,64 мг стеарилфумарату натрію й 4) висушений розпилюванням маніт у кількості, що доводить загальну масу лікарської форми до 250 мг; де лікарська форма є стабільною протягом щонайменше приблизно 12, приблизно 24 або приблизно 36 місяців при зберіганні без охолодження. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №2 або більшій капсулі. У ще одному варіанті здійснення розкривається лікарська форма, що містить помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 5 мг, що є стабільною протягом щонайменше приблизно 12, приблизно 24 або приблизно 36 місяців при зберіганні без охолодження. У деяких варіантах здійснення лікарська форма містить маніт і/або крохмаль. В одному варіанті здійснення, коли в лікарській формі присутні одночасно маніт і крохмаль, то крохмаль знаходиться в кількості приблизно 168 мг, і маніт знаходиться в кількості, що доводить загальну масу лікарської форми до 300 мг. У деяких варіантах здійснення лікарська форма додатково містить стеарилфумарат натрію в кількості приблизно 0,8 мг або приблизно 0,75 мг. У деяких варіантах здійснення розкривається лікарська форма, що містить: 1) помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат, що знаходиться в кількості, яка забезпечує вміст помолідоміду приблизно 5 мг; 2) приблизно 168 мг попередньо желатинованого крохмалю; 3) приблизно 0,75 мг стеарилфумарату натрію й 4) висушений розпилюванням маніт у кількості, що доводить загальну масу лікарської форми до 9 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 300 мг; де лікарська форма є стабільною протягом щонайменше приблизно 12, приблизно 24або приблизно 36 місяців при зберіганні без охолодження. В одному варіанті здійснення лікарська форма підходить для введення в капсулі розміру №1 або більшій капсулі. 4.1.1. Другі активні засоби У деяких варіантах здійснення розкриваються композиції й лікарські форми помолідоміду або його фармацевтично прийнятного стереоізомера, проліків, солі, сольвату, гідрату або клатрату, які можуть додатково містити один або більше вторинних активних інгредієнтів. Деякі комбінації можуть функціонувати синергічно при лікуванні конкретних типів захворювань і розладів, і станів і симптомів, асоційованих з такими захворюваннями або розладами. Помолідомід або його фармацевтично прийнятний стереоізомер, проліки, сіль, сольват, гідрат або клатрат також можуть послабляти побічні ефекти, асоційовані з деякими другими активними засобами й навпаки. Конкретні другі активні сполуки, які можуть входити в композиції й лікарські форми, розкриті в даному документі, відрізняються залежно від конкретного показання, що піддається лікуванню, профілактиці або контролю. Наприклад, для лікування, профілактики й контролю злоякісного захворювання другі активні інгредієнти включають, не обмежуючись цим, семаксаніб; циклоспорин; етанерцепт; доксициклін; бортезоміб; ацивіцин; акларубіцин; акодазолу гідрохлорид; акронін; адозелезин; алдеслейкін; алтретамін; амбоміцин; аментантрону ацетат; амсакрин; анастрозол; антраміцин; аспарагіназу; асперлін; азацитидин; азетепу; азотоміцин; батимастат; бензодопу; бікалутамід; бізантрену гідрохлорид; біснафиду димезилат; бізелесин; блеоміцину сульфат; брехінар натрію; бропіримін; бусульфан; кактиноміцин; калустерон; карацемід; карбетимер; карбоплатин; кармустин; карубіцину гідрохлорид; карзелезин; цедефингол; целекоксиб; хлорамбуцил; циролеміцин; цисплатин; кладрибін; кристанолу мезилат; циклофосфамід; цитарабін; дакарбазин; дактиноміцин; даунорубіцину гідрохлорид; децитабін; дексормаплатин; дезагуанін; дезагуаніну мезилат; діазиквон; доцетаксел; доксорубіцин; доксорубіцину гідрохлорид; дролоксифен; дролоксифену цитрат; дромосталону пропіонат; дуазоміцин; едатрексат; ефлорнітину гідрохлорид; елсамітруцин; енлоплатин; енпромат; епіпропідин; епірубіцину гідрохлорид; ербузолон; езорубіцину гідрохлорид; естрамустин; естрамустин фосфат натрію; етанідазол; етопозид; етопозиду фосфат; етоприн; фадрозолу гідрохлорид; фазарабін; фенритинід; флоксорудин; флударабіну фосфат; фторурацил; фторцитабін; фосквідон; фостриецин натрію; гемцитабін; гемцитабіну гідрохлорид; гідроксисечовину; ідарубіцину гідрохлорид; іфосфамід; ілмофозин; іпроплатин; іринотекан; іринотекану гідрохлорид; ланреотиду ацетат; летрозол; лейпроліду ацетат; ліарозолу гідрохлорид; лометрексол натрію; ломустин; лозоксантрону гідрохлорид; мазопрокол; майтанзин; мехлоретаміну гідрохлорид; мегестролу ацетат; меленгестролу ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрію; метоприн; метуредепу; мітиндомін; мітокарцин; мітокромін; мітогилін; мітомалцин; мітоміцин; мітоспер; мітотан; мітоксантрону гідрохлорид; мікофенолову кислоту; нокодазол; ногаламіцин; ормаплатин; оксисуран; паклітаксел; пегаспаргазу; пеліоміцин; пентамустин; пепломіцину сульфат; перфосфамід; піпоброман; піпосульфан; піпоксантрон; піроксантрону гідрохлорид; плікаміцин; пломестан; порфімер натрію; порфіроміцин; преднімустин; прокарбазину гідрохлорид; пуроміцин; пуроміцину гідрохлорид; піразофурин; рибоприн; сафінгол; сафінголу гідрохлорид; семустин; симтразен; спарфозат натрію; спарсоміцин; спірогерманію гідрохлорид; спіромустин; спіроплатин; стрептонігрин; стрептозоцин; сулофенур; талісоміцин; текогалан натрію; таксотере; тегафур; телоксантрону гідрохлорид; темопорфін; теніпозид; тероксирон; тестолактон; тіаміприн; тіогуанін; тіотепу; тіазофурин; тірапазамін; тореміфену цитрат; трестолону ацетат; трицирибіну фосфат; триметрексат; триметрексату глюкуронат; трипторелін; тубулозолу гідрохлорид; урациловий іприт; уредепу; вапреотид; вертепорфін; вінбластину сульфат; вінкристину сульфат; віндезин; вінепідину сульфат; вінгліцинату сульфат; вінлейрозину сульфат; вінорелбіну тартрат; вінрозидину сульфат; вінзолідину сульфат; ворозол; зеніплатин; зиностатин і зорубіцину гідрохлорид. Інші другі засоби включають, не обмежуючись цим, 20-епі-1,25-дигідровітамін D3; 5етинілурацил; абіратерон; акларубіцин; ацилфулвен; адеципенол; адозелезин; алдеслейкін; антагоністи ALL-TK; алтретамін; амбамустин; амідокс; аміфостин; амінолевулінову кислоту; амрубіцин; амсакрин; анагрелід; анастрозол; андрографолід; інгібітори ангіогенезу; антагоніст D; антагоніст G; антарелікс; антидорсалуючий морфогенетичний протеїн-1; антиандроген при карциномі передміхурової залози; антиестроген; антинеопластон; антисмислові олігонуклеотиди; афідиколіну гліцинат; модулятори гена апоптозу; регулятори апоптозу; апуринову кислоту; ара-CDP-DL-PTBA; деаміназу аргініну; асулакрин; атаместан; атримустин; 10 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 аксинастин 1; аксинастин 2; аксинастин 3; азасетрон; азатоксин; азатирозин; похідні бакатину III; баланол; батимастат; антагоністи BCR/ABL; бензохлорини; бензоїлстауроспорин; похідні беталактаму; бета-алетин; бетакламіцин В; бетулінову кислоту; інгібітор bFGF; бікалутамід; бізантрен; бісаридинілспермін; біснафид; бістратен А; бізелезин; брефлат; бропіримін; будотитан; бутіоніну сульфоксимін; кальципотриол; калфостин С; похідні камптотецину; капецитабін; карбоксамід-аміно-триазол; карбоксиамідотриазол; CaRest M3; CARN 700; інгібітор, отриманий із хрящової тканини; карзелезин; інгібітори казеїнкінази (ICOS); кастаноспермін; цекропін В; сетрорелікс; хлорини; хлорхіноксаліну сульфонамід; цикапрост; ципорфірин; кладрибін; аналоги кломіфену; клотримазол; колісміцин А; колісміцин В; комбретастатин А4; аналог комбретастину; конагенін; крамбесцидин 816; криснатол; криптофіцин 8; похідні криптофіцину А; курацин А; циклопентантрахінони; циклоплатам; ципеміцин; цитарабіну окфосфат; цитолітичний фактор; цитостатин; дакліксимаб; децитабін; дегідродидемнін В; деслорелін; дексаметазон; дексифосфамід; декстразоксан; дексверапаміл; діазиквон; дидемнін В; дидокс; діетилнорспермін; дигідро-5-азацитидин; 9-дигідротаксол; діоксаміцин; дифенілспіромустин; доцетаксел; докозанол; доласетрон; доксифлуридин; доксорубіцин; дролоксифен; дронабінол; дуокарміцин SA; ебселен; екомустин; еделфозин; едреколомаб; ефлорнітин; елемен; емітефур; епірубіцин; епристерид; аналог естрамустину; агоністи естрогенів; антагоністи естрогенів; етанідазол; етопозиду фосфат; ексеместан; фадрозол; фазарабін; фенретинід; філграстим; фінастерид; флавопіридол; флезеластин; флуастерон; флударабін; фтордауноруніцину гідрохлорид; форфенімекс; форместан; фостриецин; фотемустин; гадоліній тексафірин; нітрат галію; галоцитабін; ганірелікс; інгібітори гелатинази; гемцитабін; інгібітори глутатіону; гепсульфам; герегулін; гексаметиленбісацетамід; гіперицин; ібандронову кислоту; ідарубіцин; ідоксифен; ідрамантон; ілмофозин; іломастат; іматиніб (Gleevec); іміхімод; пептиди-імуностимулятори; інгібітор рецептора інсуліноподібного фактора росту-1; агоністи інтерферону; інтерферони; інтерлейкіни; іобенгуан; йододоксорубіцин; 4-іпомеанол; іроплакт; ірсогладин; ізобенгазол; ізогомогалікондрин В; ітасетрон; джасплакінолід; кагалалід F; ламеларин-N триацетат; ланреотид; лейнаміцин; ленограстим; лентинану сульфат; лептолстатин; летрозол; інгібуючий лейкоз фактор; лейкоцитарний альфа-інтерферон; лейпролід+естроген+прогестерон; лейпрорелін; левамізол; ліарозол; лінійний аналог поліаміну; ліпофільний дисахаридний пептид; ліпофільні похідні платини; лісоклінамід 7; лобаплатин; ломбрицин; лометрексол; лонідамін; лозоксантрон; локсорибін; луртотекан; лутетію тексафірин; лізофілін; літичні пептиди; майтанзин; маностатин А; маримастат; мазопрозол; маспін; інгібітори матрилізину; інгібітори матричної металопротеїнази; меногарил; мербарон; метерелін; метіоніназу; метоклопрамід; інгібітор MIF; міфепристон; мілтефозин; міримостим; мітогуазон; метолактол; аналоги мітоміцину; мітонафід; мітотоксин фактор росту-сапорин фібробластів; мітоксантрон; мофаротен; молграмостин; ербитукс; людський хоріонічний гонадотропін; монофосфорилліпід А + клітинна стінка міобактерій sk; мопідамол; протипухлинний препарат на основі іприту; мікапероксид В; екстракт клітинної стінки мікобактерій; міріапорон; N-ацетилдиналін; N-заміщені бензаміди; нафарелін; нагрестрип; налоксон+пентазоцин; напавін; нафтерпин; нартограстим; недаплатин; неморубіцин; неридронову кислоту; нілутамід; нізаміцин; модулятори оксиду азоту; нітроксидний антиоксидант; нітруліин; облімерсен (Genasense ); О-6-бензилгуанін; октреотид; окиценон; олігонуклеотиди; онапристон; ондансетрон; орацин; індуктор цитокінів для перорального введення; ормаплатин; озатерон; оксиплатин; оксауноміцин; паклітаксел; аналоги паклітакселу; похідні паклітакселу; палауамін; пальмітоїлризоксин; памідронову кислоту; панакситриол; паноміфен; парабактин; пазелліптин; пегаспаргазу; пелдезин; пентосан полісульфат натрію; пентостатин; пентрозол; перфлуброн; перфосфамід; периловий спирт; феназиноміцин; фенілацетат; інгібітори фосфатази; піцибаніл; пілокарпіну гідрохлорид; пірарубіцин; піритрексим; плацетин А; плацетин В; інгібітор активатора плазміногену; платиновий комплекс; похідні платини; комплекс платина-триамін; порфімер натрію; порфіроміцин; преднізон; пропіл-біс-акридон; простагландин J2; інгібітори протеасоми; імуномодулятор на основі протеїну А; інгібітор протеїнкінази С; інгібітори протеїнкінази С; мікроалгал; інгібітори протеїн-тирозин-фосфатази; інгібітори фосфорилази пуринових нуклеозидів; пурпурини; піразолоакридин; кон'югат піридоксилованого гемоглобіну поліоксіетилену; антагоністи raf; ралтитрексед; рамосетрон; інгібітори фарнезилпротеїнтрансферази ras; інгібітори ras; інгібітор ras-GAP; ретеллиптин деметилований; реній Re 186 етидронат; ризоксин; рибозими; ретинамід RII; рогітукин; ромуртид; рохінімекс; рубігінон В1; рубоксил; сафінгол; саїнтопін; SarCNU; саркофітол А; сарграмостим; міметики Sdi 1; семустин; похідний сенесенса інгібітор 1, смислові олігонуклеотиди; інгібітори сигнальної трансдукції; сизофіран; собузоксан; борокаптат натрію; фенілацетат натрію; солверол; соматомедин 11 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язувальний білок; сонермин; спарфозиву кислоту; спікаміцин D; спіромустин; спленопентин; спонгістатин 1; скваламін; стипіамід; інгібітори стромелізину; сульфінозин; суперактивний антагоніст вазоактивного кишкового пептиду; сурадисту; сурамін; сваїнсонин; талімустин; тамоксифену метіодид; тауромустин; тазаротен; текогалан натрію; тегафур; телурапірилій; інгібітори теломерази; темопорфін; теніпозид; тетрахлордекаоксид; тетразомін талібластин; тіокоралін; тромбопоетин; міметик тромбопоетину; тималфазин; агоніст рецептора тимопоетину; тимотринан; тиреоїдний стимулюючий гормон; етилолово етіопурпурин; тирапазамін; титаноцену біхлорид; топсентин; тореміфен; інгібітори трансляції; третиноїн; триацетилуридин; трицирибін; триметрексат; трипторелин; тропизетрон; туростерид; інгібітори тирозинкінази; тирфостини; інгібітори UBC; убінімекс; інгібуючий фактор росту сечостатевого синуса; антагоністи рецептора урокінази; вапреотид; варіолін В; веларезол; верамін; вердини; вертепорфін; вінорелбін; вінксалтин; вітаксин; ворозол; занотерон; зеніплатин; зиласкорб і зиностатин стималамер. Ще одні другі активні засоби включають, не обмежуючись цим, 2-метоксіестрадіол; теломестатин; індуктори апоптозу клітин множинної мієломи (такі як, наприклад, TRAIL); статини; семаксаніб; циклоспорин; етанерцепт; доксициклін; бортезоміб; облімерсен (Genasense); ремікаде; доцетаксел; целекоксиб; мелфалан; дексаметазон (Decadron ); стероїди; гемцитабін; цисплатин; темозоломід; етопозид; циклофосфамід; темодар; карбоплатин; прокарбазин; гліадел; тамоксифен; топотекан; метотрексат; Arisa; таксол; таксотере; фторурацил; лейковорин; іринотекан; кселоду; CPT-11; інтерферон-альфа; пегильований інтерферон-альфа (наприклад, PEG INTRON-A); капецитабін; цисплатин; тіотепу; флударабін; карбоплатин; ліпосомальний даунорубіцин; цитарабін; доцетаксол; паклітаксел; вінбластин; IL-2; GM-CSF; дакарбазин; вінорелбін; золедронову кислоту; пальмітронат; біаксин; бусульфан; преднізон; біфосфонат; триоксид миш'яку; вінкристин; доксорубіцин (Doxil ); паклітаксел, ганцикловір; адріаміцин; естрамустин натрію фосфат (Emcyt ); суліндак і етопозид. У ще одному варіанті здійснення приклади конкретних других засобів для показань, призначених для лікування, профілактики й контролю, можна знайти в наступних джерелах, які всі в повному об'ємі включені в даний документ для відома: у патентах США №№ 6281230 і 5635517; у публікаціях патентів США №№ 2004/0220144, 2004/0190609, 2004/0087546, 2005/0203142, 2004/0091455, 2005/0100529, 2005/0214328, 2005/0239842, 2006/0154880, 2006/0122228 і 2005/0143344; і в попередній заявці на патент США №60/631870. Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю болю, включають, не обмежуючись цим, звичайні лікарські препарати для лікування або профілактики болю, такі як антидепресанти; протисудомні засоби; гіпотензивні препарати; анксіолітики; блокатори кальцієвих каналів; м'язові релаксанти; ненаркотичні анальгетики; опіоїдні анальгетики; протизапальні препарати; інгібітори COX-2; імуномодулятори; агоністи або антагоністи альфа-адренергічних рецепторів; імуносупресори; кортикостероїди; терапію гіпербаричним киснем; кетамін; інші анестетики; антагоністи NMDA і інші лікарські препарати, наведені, наприклад, в Physician's Desk Reference, 2003. Конкретні приклади включають, не обмежуючись цим, ацетилсаліцилову кислоту (Aspirin ); целекоксиб (Celebrex); Enbrel; кетамін; габапентин (Neurontin); фенітоїн (Dilantin); карбамазепин (Tegretol); окскарбазепин (Trileptal); вальпроєву кислоту (Depakene ); морфіну сульфат; гідроморфон; преднізон; гризеофульвін; пентоній; алендронат; дифенгідрамід; гуанетидин; кеторолак (Acular ); тирокальцитонін; диметилсульфоксид (ДМСО); клонідин (Catapress ); бретилій; кетансерин; резерпін; дроперидол; атропін; фентоламін; бупівакаїн; лідокаїн; ацетамінофен; нортриптилін (Pamelor); амітриптилін (Elavil); іміпрамін (Tofranil); доксепін (Sinequan); клопіпрамін (Anafranil); флуоксетин (Prozac); сертралін (Zoloft); напроксен; нефазодон (Serzone); венлафаксин (Effexor); тразодон (Desyrel); бупропіон (Wellbutrin); мексилетин; ніфедипін; пропранолол; трамадол; ламотригін; віокс; зиконотид; кетамін; декстрометорфан; бензодіазепіни; баклофен; тизанідин і феноксибензамін. Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю макулярної дегенерації й пов'язаних синдромів, включають, не обмежуючись цим, стероїд; світловий сенсибілізатор; інтегрин; антиоксидант; інтерферон; похідну ксантину; гормон росту; нейротрофічний фактор; регулятор неоваскуляризації; анти-VEGF-антитіло; простагландин; антибіотик; фітоестроген; протизапальний препарат або препарат, інгібуючий ангіогенез, або їхню комбінацію. Конкретні приклади включають, не обмежуючись цим, вертепорфін; пурлітин; ангіостатичний стероїд; rhuFab; інтерферон-2α; пентоксифілін; етиопурпурин олова; мотексафин; люцентис; лутетій; 9-фтор-11,21-дигідрокси-16,17-1метилетилідинбіс(окси)прегна-1,4-дієен-3,20-діон; латанопрост (дивися патент США №6225348); тетрациклін і його похідні; рифаміцин і його похідні; макроліди, метронідазол 12 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 (патенти США №№ 6218369 і 6015803); геністеїн; геністин; 6'-О-Mal геністин; 6'-О-Ac геністин; даїдзин; 6'-О-Mal даїдзин; 6'-О-Ac даїдзин; гліцитеїн; гліцитин; 6'-О-Mal гліцитин; біоханін А; формононетин (патент США №6001368); триамцинолону ацетомід; дексаметазон (патент США №5770589); талідомід; глутатіон (патент США №5632984); основний фактор росту фібробластів (bFGF); трансформуючий фактор росту b (TGF-b); нейротрофічний фактор мозку (BDNF); активатор плазміногену фактор типу 2 (PAI-2); EYE101 (Eyetech Pharmaceuticals); LY333531 (Eli Lilly); міравант і імплант RETISERT (Bausch&Lomb). Всі джерела, цитовані в даному документі, у повному об'ємі включені для відома. Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю хвороб шкіри, включають, не обмежуючись цим, кератолітики; ретиноїди; αоксикислоти; антибіотики; колаген; ботуліністичні токсини; інтерферон; стероїди й імуномодулятори. Конкретні приклади включають, не обмежуючись цим, 5-фторурацил; мазопросол; трихлороцтову кислоту; саліцилову кислоту; молочну кислоту; лактат амонію; сечовину; третиноїн; ізотретиноїн; антибіотики; колаген; ботуліністичні токсини; інтерферон; кортикостероїди; трансретиноєву кислоту й колагени, такі як плацентарний колаген людини; плацентарний колаген тварин; дерматоген; алодерм; фасція; циметру; аутологен; зидерм; зипласт; резопласт і ізолаген. Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю легеневої гіпертензії й пов'язаних порушень, включають, не обмежуючись цим, антикоагулянти; діуретики; серцеві глікозиди; блокатори кальцієвих каналів; вазодилататори; аналоги простацикліну; антагоністи ендотеліну; інгібітори фосфодіестерази (наприклад, інгібітори PDE V); інгібітори ендопептидази; препарати, що знижують вміст ліпідів; інгібітори тромбоксану й інші лікарські препарати, про які відомо, що вони знижують легеневий артеріальний тиск. Конкретні приклади включають, не обмежуючись цим, варфарин (Coumadin); діуретик; серцевий глікозид; дигоксин-кисень; дилтіазем; ніфедипін; вазодилататор, такий як простациклін (наприклад, простагландин I2 (PGI1)); епопростенол (EPO, Floran); трептостиніл (Remodulin); оксид азоту (NO); бозентан (Tracleer ); амлодипін; епопростенол (Floran); трепростиніл (Remodulin); простациклін; тадалафил (Cialis ); симвастатин (Zocor); омапатрилат (Vanlev); ірбесартан (Avapro); правастатин (Pravachol); дигоксин; L-аргінін; ілопрост; бетапрост і силденафіл (Viagra ). Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю захворювань, викликаних впливом азбесту, включають, не обмежуючись цим, антрациклін; платину; алкілуючий агент; облімерсен (Genasense); цисплатину; циклофосфамід; темодар; карбоплатин; прокарбазин; гліадел; тамоксифен; топотекан; метотрексат; таксотере; іринотекан; капецитабін; циспплатин; тіотепу; флударабін; карбоплатин; ліпосомальний даунорубіцин; цитарабін; доцетаксел; паклітаксел; вінбластин; IL-2; GM-CSF; дакарбазин; вінорелбін; золедронову кислоту; пальмітонат; біаксин; бусульфан; преднізон; бісфосфонат; триоксид миш'яку; вінкристин; доксорубіцин (Doxil); паклітаксел; ганцикловір; адріаміцин; блеоміцин; гуалуронідазу; мітоцин С; мепакрин; тіотепу; тетрациклін і гемцитабін. Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю паразитарних захворювань, включають, не обмежуючись цим, хлорхін; хінін; хінідин; піриметамін; сульфадіазин; доксициклін; кліндаміцин; мефлохін; галофантрин; примахін; гідроксихлорхін; прогуаніл; атоквон; азитроміцин; сурамін; пентамідин; меларсопрол; ніфуртимокс; амфотерецин В; похідні п'ятивалентної сурми (наприклад, стибоглюкоранту натрію); інтерферон-гама; інтраконазол; комбінацію недіючі промастиготи й BCG, лейковорин; кортикостероїди; сульфонамід; спіраміцин; IgG (серологія); триметоприм і сульфаметоксазол. Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю імунодефіцитів, включають, не обмежуючись цим, антибіотики (у терапевтичних або профілактичних цілях), такі як, не обмежуючись цим, ампіцилін, тетрациклін, пеніцилін, цефалоспорини, стрептоміцин, канаміцин і еритроміцин; противірусні препарати, такі як, не обмежуючись цим, амантадин, римантадин, ацикловір і рибавірин; імуноглобулін; плазму; імуностимулятори, такі як левамізол і ізопринозин; біологічні препарати, такі як, не обмежуючись цим, гаммаглобулін, фактор перенесення, інтерлейкіни й інтерферони; гормони, такі як, не обмежуючись цим, гормон тимусу; і інші імунологічні препарати, такі як, не обмежуючись цим, стимулятори В-клітин (наприклад, BAFF/BlyS); цитокіни (наприклад, IL-2, IL-4 і IL-5); фактори росту (наприклад, TGF-α); антитіла (наприклад, анти-CD 40-антитіла й IgM); олігонуклеотиди, що містять неметиловані CpG мотиви, і вакцини (наприклад, вірусні вакцини й вакцини на основі пухлинних пептидів). Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю розладів ЦНС, включають, не обмежуючись цим, опіоїди; агоніст або антагоніст 13 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 допаміну, такий як, не обмежуючись цим, леводопа, L-DOPA, кокаїн, α-метилтирозин, резерпін, тетрабеназин, бензотропін, паргілін, фенодолпама мезилат, каберголін, праміпексола дигідрохлорид, ропінорол, амантадину гідрохлорид, селегиліну гідрохлорид, карбідопа, перголіду мезилат, синемет CR і симметрел; інгібітор MAO, такий як, не обмежуючись цим, іпроніазид, клоргілін, фенелзин і ізокарбоксазид; інгібітор COMT, такий як, не обмежуючись цим, толкапон і ентакапон; інгібітор холінестерази, такий як, не обмежуючись цим, фізостигміну саліклат, фізостигміну сульфат, фізостигміну бромід, меостигміну бромід, неостигміну метилсульфат, амбеноніму хлорид, едрофоній хлорид, такрин, палідоксину хлорид, обідоксиму хлорид, тримедоксиму бромід, діацетилмоноксим, ендрофоній, піридостигмін і демекарій; протизапальний препарат, такий як, не обмежуючись цим, напроксен натрію, диклофенак натрію, диклофенак калію, целекоксиб, суліндак, оксапрозин, дифлунізал, етодолак, мелоксикам, ібупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномід, сульфасалазин, солі золота, імунноглобулін Rho-D, мікофенілат мофетил, циклоспорин, азатіоприн, такролімус, базиліксимаб, даклізумаб, саліцилову кислоту, ацетилсаліцилову кислоту, метилсаліцилат, дифлунісал, салсалат, олсалазин, сульфасалазин, ацетамінофен, індометацин, суліндак, мефенамову кислоту, меклофенамат натрію, толметин, кеторолак, диклофенак, флурбінпрофен, оксапрозин, піроксикам, мелоксикам, ампіроксикам, дроксикам, півоксикам, теноксикам, фенілбутазон, оксифенбутазон, антипірин, амінопірин, апазон, зилейтон, ауротіоглюкозу, тіомалат золота й натрію, ауранофін, метотрексат, колхіцин, алопуринол, пробенецид, сульфінпіразон і бензбромарон або бетаметазон, і інші глюкокортикоїди; і протиблювотні препарати, такі як, не обмежуючись цим, метоклопромід, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамід, ондансетрон, гранісетрон, гідроксизин, ацетиллейцин моноетаноламін, алізаприд, азасетрон, бензхінамід, бієтанаутин, бромоприд, буклізин, клебоприд, циклізин, дименгідринат, дифенідол, доласетрон, меклізин, металлатал, метопімазин, набілон, оксипендил, піпамазин, скополамін, сульпірид, тетрагідрканабінол, тіетилперазин, тіопроперазин, тропісетрон і їхні комбінації. Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю ушкоджень ЦНС і пов'язаних синдромів, включають, не обмежуючись цим, імуномодулятори; імуносупресори; гіпотензивні препарати; протисудомні препарати; фібринолітичні засоби; антитромбоцитарні засоби; антипсихотики; антидепресанти; бензодіазепіни; буспірон; амантадин і інші відомі й традиційні препарати, які застосовують у пацієнтів із травмою/ушкодженням ЦНС і близькими синдромами. Конкретні приклади включають, не обмежуючись цим, стероїди (наприклад, глюкокортикоїди, такі як, не обмежуючись цим, метилпреднізолон, дексаметазон і бетаметазон); протизапальний препарат, включаючи, не обмежуючись цим, напроксен натрію, напроксен натрію, диклофенак натрію, диклофенак калію, целекоксиб, суліндак, оксапрозин, дифлунізал, етодолак, мелоксикам, ібупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномід, сульфасалазин, солі золота, імуноглобулін Rho-D, мікофенілат мофетил, циклоспорин, азатіоприн, такролімус, базиліксимаб, даклізумаб, саліцилову кислоту, ацетилсаліцилову кислоту, метилсаліцилат, дифлунізал, салсалат, олсалазин, сульфасалазин, ацетамінофен, індометацин, суліндак, мефенамову кислоту, меклофенамат натрію, толметин, кеторолак, диклофенак, флурбінпрофен, оксапрозин, піроксикам, мелоксикам, ампіроксикам, дроксикам, півоксикам, теноксикам, фенілбутазон, оксифенбутазон, антипірин, амінопірин, апазон, зилейтон, ауротіоглюкозу, тіомалат золота і натрію, ауранофін, метотрексат, колхіцин, алопуринол, пробенецид, сульфінпіразон і бензбромарон або бетаметазон; аналог cAMP, включаючи, не обмежуючись цим, db-cAMP; засіб, що включає метилфенідат, що містить l-треометилфенідат, d-треометилфенідат, dl-треометилфенідат, l-еритрометилфенідат, d-еритрометилфенідат, dlеритрометилфенідат і їхні комбінації; і діуретик, такий як, не обмежуючись цим, маніт, фуросемід, гліцерин і сечовину. Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю порушень сну й пов'язаних синдромів, включають, не обмежуючись цим, трициклічний антидепресант; вибірковий інгібітор захоплення серотоніну; антиепілептичний препарат (габапентин, прегабалін, карбамазепин, окскарбазепин, левітирацетам, топірамат); антиаритмічний засіб; блокатор натрієвих каналів; селективний інгібітор медіаторів запалення; опіоїдний засіб; другий імуномодулятор; комбінований препарат і інші відомі й традиційні препарати, які застосовують для лікування сну. Конкретні приклади включають, не обмежуючись цим, нейронтин; оксиконтин; морфін; топірамат; амітриптилін; нортриптилін; карбамазепин; леводопу; L-DOPA; кокаїн; α-метилтирозин; резерпін; тетрабензаїн; бензотропін; паргілін; фенодолпама мезилат; каберголін; праміпексолу дигідрохлорид; ропінорол; амантадину гідрохлорид; селегиліну гідрохлорид; карбідопу; перголіду мезилат; синемет CR; 14 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 симметрел; іпроніазид; клоргілін; фенелзин і ізокарбоксазид; толкапон; ентакапон; фізостигміну саліклат; фізостигміну сульфат; фізостигміну бромід; меостигміну бромід; неостигміну метилсаліцилат; амбеноніну хлорид; едрофоній хлорид; такрин; палідоксину хлорид; обідоксиму хлорид; тримедоксиму бромід; діацетилмоноксим; ендрофоній; піридостигмін і демекарій; напроксен натрію; диклофенак натрію; диклофенак калію; целекоксиб; суліндак; оксапрозин; дифлунізал; етодолак; мелоксикам; ібупрофен; кетопрофен; набуметон; рефекоксиб; метотрексат; лефлуномід; сульфасалазин; солі золота; імунноглобулін Rho-D; микофенілат мофетил; циклоспорин; азатіоприн; такролімус; базиліксимаб; даклізумаб; саліцилову кислоту; ацетилсаліцилову кислоту; метилсаліцилат; дифлунісал; салсалат; олсалазин; сульфасалазин; ацетамінофен; індометацин; суліндак; мефенамову кислоту; меклофенамат натрію; толметин; кеторолак; диклофенак; флурбінпрофен; оксапрозин; піроксикам; мелоксикам; ампіроксикам; дроксикам; півоксикам; теноксикам; фенілбутазон; оксифенбутазон; антипірин; амінопирин; апазон; зилейтон; ауротиоглюкозу; тіомалат золота натрію; ауранофін; метотрексат; колхіцин; алопуринол; пробенецид; сульфінпіразон і бензбромарон або бетаметазон і інші глюкокортикоїди; метоклопромід; домперидон; прохлорперазин; прометазин; хлорпромазин; триметобензамід; ондансетрон; гранісетрон; гідроксизин; ацетиллейцин моноетаноламін; алізаприд; азасетрон; бензхінамід; бієтанаутин; бромоприд; буклізин; клебоприд; циклізин; дименгідринат; дифенідол; доласетрон; меклізин; металлатал; метопімазин; набілон; оксипендил; піпамазин; скополамін; сульпірид; тетрагідроканабінол; тіетилперазин; тіопроперазин; тропісетрон і їхні комбінації. Приклади других активних засобів, які можна використовувати для лікування, профілактики й контролю гемоглобінопатії й пов'язаних порушень, включають, не обмежуючись цим, інтерлейкіни, такі як IL-2 (включаючи рекомбінантний IL-II ("rIL2") і канарипокс IL-2), IL-10, IL-12 і IL-18; інтерферони, такі як інтерферон альфа-2а, інтерферон альфа-2b, інтерферон альфа-n1, інтерферон альфа-n3, інтерферон бета-Iа й інтерферон гама-Ib; і G-CSF; гідроксисечовину; TM TM бутирати або похідні бутиратів; оксид азоту; гідроксисечовину; HEMOXIN (NIPRISAN ; дивися патент США №5800819); антагоністи каналів Gardos, такі як клотримазол або похідні триарилметану; дефероксамін; протеїн С; і переливання крові або кровозамінники, такі як TM TM Hemospan або Hemospan PS (Sangart). 4.2. Спосіб одержання лікарських форм Лікарські форми, розкриті в даному документі, можна приготувати будь-якими способами, звичайно застосовуваними у фармацевтиці, але всі способи включають стадію об'єднання активного інгредієнта з наповнювачем, що включає один або більше необхідних інгредієнтів. У загальному композиції готують змішанням до однорідної маси (наприклад, прямим змішуванням) активного інгредієнта з рідкими наповнювачами або дрібно подрібненими твердими наповнювачами, або обома разом, і потім, при необхідності, додаванням продукту бажаної форми (наприклад, пресуванням, таким як вальцьове пресування). Якщо бажано, то таблетки можна покрити оболонками з використанням стандартних способів, у яких застосовуються водні або неводні рідини. Лікарську форму, розкриту в даному документі, можна приготувати пресуванням або формуванням, необов'язково з одним або більше допоміжними інгредієнтами. Пресовані таблетки можна одержати з використанням прийнятного апарата пресуванням активного інгредієнта в сипкій формі, такій як порошок або гранули, необов'язково в суміші з наповнювачем, зазначеним вище, і/або поверхнево-активною або диспергуючою речовиною. Формовані таблетки можна приготувати формуванням суміші порошкоподібної сполуки, змоченої інертним рідким розріджувачем, на прийнятному апараті. Інкапсулювання лікарських форм, описаних у даному документі, можна провести з використанням капсул з метилцелюлози, альгінату натрію або желатину. У деяких варіантах здійснення активні інгредієнти й наповнювачі піддають прямому змішуванню й наповнюють сумішшю, наприклад, капсули, або безпосередньо пресують її в таблетки. У деяких випадках прямо змішана лікарська форма може бути більш переважною в порівнянні із пресованою (наприклад, отриманою з використанням вальцьового пресування), оскільки пряме змішування може знизити або навіть повністю усунути негативні для здоров'я ефекти, причиною яких можуть бути аерозольні частинки інгредієнтів, що утворюються у виробництві з використанням пресування. У деяких випадках композиції, отримані прямим змішуванням, можуть мати переваги, оскільки для них необхідна тільки одна стадія змішування активного інгредієнта й наповнювачів перед формуляцією у кінцеву лікарську форму, наприклад, таблетку або капсулу. Це може знизити до мінімуму утворення аерозольних частинок або пилу, у той час як для вальцьового пресування характерне утворення пилу. У процесі вальцьового пресування пресований 15 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 матеріал часто подрібнюють до більш дрібних частинок для наступної обробки. При подрібнюванні можуть утворитися більші кількості аерозольних частинок, оскільки метою даної стадії виробництва є зменшення розміру частинок. Потім подрібнений матеріал змішують із іншими інгредієнтами перед готуванням кінцевої лікарської форми. Для деяких активних інгредієнтів, зокрема, сполук з низькою розчинністю, розмір частинок активного інгредієнта зменшують до розміру частинок дрібного порошку з метою підвищення швидкості солюбілізації активного інгредієнта. Підвищення швидкості солюбілізації часто є необхідним для ефективного усмоктування активного інгредієнта в шлунково-кишковому тракті. Однак для того, щоб дрібні порошки можна було піддати прямому змішуванню й завантажити в капсули, переважно наповнювачі повинні додати деякі характеристики, які роблять інгредієнти прийнятними для прямого змішування. Приклади таких характеристик включають, не обмежуючись цим, прийнятну сипкість. Отже, в одному варіанті здійснення розкривається застосування й композиції, що містять наповнювачі, які можуть забезпечити характеристики, що роблять отриману суміш прийнятною для прямого змішування, наприклад, гарну сипкість. 4.2.1. Скринінг Спосіб одержання фармацевтичних композицій за винаходом переважно включає скринінг активного інгредієнта й наповнювача(ів). В одному варіанті здійснення активний інгредієнт просівають через сито з отворами розміром приблизно від 200 до 750 мкм. У ще одному варіанті здійснення активний інгредієнт просівають через сито з отворами розміром приблизно від 200 до 400 мкм. У ще одному варіанті здійснення активний інгредієнт просівають через сито з отворами розміром приблизно від 300 до 400 мкм. Залежно від використовуваного наповнювача(ів) отвору сита можуть відрізнятися. Наприклад, розпушувачі й зв'язувальні речовини просівають через отвори розміром приблизно від 430 до 750 мкм, приблизно від 600 до 720 мкм або приблизно 710 мкм. Як правило, мастильні речовини просівають через більш дрібні отвори, наприклад, розміром приблизно від 150 до 250 мкм. В одному варіанті здійснення мастильну речовину, просівають через сито з отворами розміром приблизно 210 мкм. 4.2.2. Попереднє змішування Після просівання інгредієнтів наповнювач і активний інгредієнт змішують у змішувачі з дифузійним механізмом. В одному варіанті здійснення час змішування знаходиться в межах приблизно від 1 хв до приблизно 50 хв, приблизно від 5 хв до приблизно 45 хв, приблизно від 10 хв до приблизно 40 хв або приблизно від 10 хв до приблизно 25 хв. У ще одному варіанті здійснення час змішування становить приблизно 15 хв. У тому випадку, коли використовують більше ніж один наповнювач, то наповнювачі можна змішати в барабанному змішувачі протягом приблизно від 1 хв. до приблизно 20 хв. або приблизно від 5 хв. до приблизно 10 хв. перед змішуванням з активним інгредієнтом. 4.2.3. Вальцьове пресування В одному варіанті здійснення попередню суміш можна необов'язково пропустити через вальцьовий прес із молотковим млином, приєднаним до розвантажувального механізму преса. 4.2.4. Кінцева суміш У тому випадку, коли використовують мастильну речовину, наприклад, стеарилфумарат натрію, то мастильну речовину змішують із попередньою сумішшю наприкінці способу з одержанням кінцевої композиції. Дане додаткове змішування проводять протягом приблизно від 1 хв. до приблизно 10 хв. або приблизно від 3 хв. до приблизно 5 хв. 4.2.5. Інкапсулювання Потім суміш, призначену для формуляції, інкапсулюють в оболонку капсул бажаного розміру з використанням, наприклад, апарата для заповнення капсул або роторного преса для виготовлення таблеток. 4.3. Набори Також забезпечуються фармацевтичні упаковки або набори, що містять фармацевтичні композиції або лікарські форми, розкриті в даному документі. Приклад набору містить повідомлення у формі, запропонованій урядовою організацією, що регулює виробництво, застосування або продаж фармацевтичних або біологічних продуктів, де в даному повідомленні приводиться дозвіл організації на виробництво, застосування або продаж для лікування людей. 4.4. Способи лікування, профілактики й контролю Розкриваються способи лікування, профілактики і/або контролю деяких захворювань або порушень із використанням препаративних форм, композицій і/або лікарських форм, розкритих у даному документі. Приклади захворювань і порушень включають, не обмежуючись цим, рак, розлади, асоційовані з ангіогенезом, біль, включаючи, не обмежуючись цим, комплексний регіонарний больовий синдром ("CRPS"), макулярну дегенерацію ("MD") і пов'язані синдроми, захворювання 16 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 шкіри, захворювання, викликані впливом азбесту, паразитарні захворювання, імунодефіцити, розлади ЦНС, ушкодження ЦНС, атеросклероз і пов'язані порушення, розлад сну й пов'язані порушення, гемоглобінопатію й пов'язані порушення (наприклад, анемію), пов'язані з TNFα порушення, і інші різні захворювання й розлади. Приклади злоякісних захворювань і передзлоякісних станів включають, не обмежуючись цим, описані в патентах США №№ 6281230 і 5635517, Muller et al.; у різних публікаціях патентів США, Zeldis, включаючи публікації 2004/0220144А1, опубліковану 4 листопада 2004 (Treatment of Myelodysplastic Syndrome); 2004/0029832А1, опубліковану 12 лютого 2004 (Treatment of Various Types of Cancer); і 2004/0087546, опубліковану 6 травня 2004 (Treatment of Myeloproliferative Diseases). Приклади також включають захворювання, описані в міжнародній заявці WO 2004/103274, опублікованої 2 грудня 2004. Всі ці джерела в повному об'ємі включені в даний документ для відома. Деякі приклади злоякісного захворювання включають, не обмежуючись цим, рак шкіри, такий як меланома; лімфатичного вузла; молочної залози; шийки матки; органів шлунковокишкового тракту; легенів; яєчників; передміхурової залози; ободової кишки; прямої кишки; ротової порожнини; мозку; голови й шиї; горла; яєчка; нирок; підшлункової залози; кісток; селезінки; печінки; сечового міхура; гортані; носових шляхів; і пов'язані зі СНІДом злоякісні захворювання. Сполуки також є придатними для лікування злоякісних захворювань крові й кісткового мозку, таких як множинна мієлома й гострий і хронічний лейкози, наприклад, лімфобластний, мієлогенний, лімфоцитарний і мієлоцитарний лейкози. Сполуки, розкриті в даному документі, можна використовувати для лікування, профілактики або контролю первинних або метастатичних пухлин. Інші злоякісні захворювання включають, не обмежуючись цим, злоякісне захворювання на пізніх стадіях; амілоїдоз; нейробластому; менінгіому; гемангіоперицитому; множинні метастази в мозок; мультиформну гліобластому; гліобластому; гліому стовбура мозку; злоякісну пухлину мозку з несприятливим прогнозом; злоякісну гліому; рецидивуючу злоякісну гліому; анапластичну астроцитому; анапластичну олігодендрогліому; нейроендокринну пухлину; колоректальний рак з поширеністю C&D по Dukes; неоперабельну колоректальну карциному; метастатичну гепатоцелюлярну карциному; саркому Капоші; гострий мієлобластний лейкоз; хронічний лімфоцитарний лейкоз (CLL); лімфому Ходжкіна; неходжкінську лімфому; шкірну Тклітинну лімфому; шкірну В-клітинну лімфому; дифузійну В-клітинну крупноклітинну лімфому; фолікулярну лімфому низького ступеня злоякісності; метастатичну меланому (локалізовану меланому, включаючи, не обмежуючись цим, окулярну меланому); злоякісну мезотеліому; злоякісну мезотеліому із плевральною ефузією; перитонеальну карциному; папілярну серозну карциному; гінекологічну саркому; саркому м'яких тканин; склеродерму; шкірний васкуліт; гістиоцитоз із клітин Лангерганса; лейоміосаркому; прогресуючу осифікуючу фібродисплазію; нечутливу до гормонів злоякісну пухлину передміхурової залози; операбельну саркому м'яких тканин з високим ризиком; неоперабельну гепатоцелюлярну карциному; макроглобулінемію Вальденстрома; в'ялу мієлому; в'ялотекучу мієлому; рак фаллопієвих труб; андрогеннезалежний рак передміхурової залози; андрогензалежний неметастатичний рак передміхурової залози на IV стадії; гормоннезалежний рак передміхурової залози; нечутливий до хіміотерапії рак передміхурової залози; папілярну карциному щитовидної залози; фолікулярну карциному щитовидної залози; медулярну карциному щитовидної залози й лейоміому. У конкретному варіанті здійснення злоякісна пухлина є метастатичною. У ще одному варіанті здійснення злоякісна пухлина є стійкою або резистентною до хіміотерапії або променевої терапії. В одному варіанті здійснення захворювання або порушення являють собою різні форми лейкозів, такі як хронічний лімфоцитарний лейкоз; хронічний мієлоцитарний лейкоз; гострий лімфобластний лейкоз; гострий мієлогенний лейкоз і гострий мієлобластний лейкоз, включаючи, не обмежуючись цим, лейкози, які є рецидивуючими, рефратерними або резистентними, які розкриті в публікації патенту США №2006/0030594, опублікованій 9 лютого 2006 року, що включена в даний документ для відома. Термін "лейкоз" стосується злоякісних новоутворень кровотворних тканин. Лейкози включають, не обмежуючись цим, хронічний лімфоцитарний лейкоз; хронічний мієлоцитарний лейкоз; гострий лімфобластний лейкоз; гострий мієлогенний лейкоз і гострий мієлобластний лейкоз. Лейкоз може бути рецидивуючим, рефратерним або резистентним до звичайної хіміотерапії. Термін "рецидивуючий" стосується випадків, коли пацієнти, у яких мала місце ремісія лейкозу після терапії, відбувається рецидив росту лейкозних клітин у кістковому мозку й зниження кількості нормальних клітин у крові. Термін "рефрактерний або резистентний" 17 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 стосується випадків, коли в пацієнтів навіть після інтенсивної терапії зберігаються залишкові лейкозні клітки в кістковому мозку. У ще одному варіанті здійснення захворювання або порушення являють собою різні типи лімфом, включаючи неходжкінську лімфому (NHL). Термін "лімфома" стосується гетерогенної групи новоутворень, що походять з ретикулоендотеліальної і лімфатичної систем. "NHL" стосується злоякісної моноклональної проліферації лімфоїдних клітин в імунній системі, включаючи лімфатичні вузли, кістковий мозок, селезінку, печінку й шлунково-кишковий тракт. Приклади NHL включають, не обмежуючись цим, лімфому із клітин мантійної зони (MCL), лімфоцитарнулімфому із проміжним ступенем диференціювання, проміжну лімфоцитарну лімфому (ILL), дифузійну слабкодиференційовану лімфоцитарну лімфому (PDL), центроцитарну лімфому; дифузійну дрібноклітинну лімфому із розщепленими ядрами (DSCCL); фолікулярну лімфому, і будь-який тип лімфом із клітин мантійної зони, які можна виявити під мікроскопом (нодулярну, дифузійну, баластну й лімфому із клітин мантійної зони). Приклади захворювань і порушень, асоційованих з або що характеризуються, небажаним ангіогенезом, включають, не обмежуючись цим, запальні захворювання; аутоімунні захворювання; вірусні захворювання; спадкоємні захворювання; алергенні захворювання; бактеріальні захворювання; неовакуляризацію око; хороїдальну неоваскуляризацію; неоваскуляризацію сітківки й рубеоз (неоваскуляризація кута передньої камери ока). Конкретні приклади захворювань і порушень, асоційованих з або які характеризуються небажаним ангіогенезом, включають, не обмежуючись цим, артрит; ендометріоз; хворобу Крона; серцеву недостатність; серцеву недостатність на пізніх стадіях захворювання; порушення функції нирок; ендотоксемію; токсичний шок; остеоартрит; ретровірусну інфекцію; виснаження; менінгіт; викликаний діоксидом кремнію фіброз; викликаний азбестом фіброз; ветеринарне захворювання; гіперкальцемію в результаті раку; інсульт; циркуляторний шок; періодонтит; гінгівіт; макроцитарну анемію; рефрактерну анемію й 5 q-делеційний синдром. Приклади болю включають, не обмежуючись цим, описані в публікації патенту США №2005/0203142, опублікованій 15 вересня 2005 року, що включена в даний документ для відома. Конкретні приклади болю включають, не обмежуючись цим, ноцицептивний біль; нейропатичний біль; змішаний біль із ноцицептивного і нейропатичного болю; вісцеральний біль; мігрень; головний біль і післяопераційний біль. Приклади ноцицептивного болю включають, не обмежуючись цим, біль, пов'язаний з хімічним або термічним опіком; порізами на шкірі; остеоартритом; ревматоїдним артритом; тендонітом, і міофасціальний біль. Приклади нейропатичного болю включають, не обмежуючись цим, CRPS типу I; CRPS типу II; рефлекторну симпатичну дистрофію (RSD); рефлекторну нейроваскулярну дистрофію; рефлекторну дистрофію; симпатичний біль, що зберігається; каузалгію; атрофію кісток Судека; алгонейродистрофію; синдром плече-рука; посттравматичну дистрофію; невралгію трійчастого нерва; постгерпетичну невралгію; біль, пов'язаний з раком; фантомний біль у кінцівках; фіброміалгію; синдром хронічної утоми; біль при травмі спинного мозку; центральний постінсультний біль; радикулопатію; дрифтер нейропатію; постінсульний біль; нейропатію при сифілісі й інші хворобливі нейропатичні стани, такі як викликані лікарськими препаратами, такими як вінкристин і велкаде. У тому розумінні, у якому в даному документі, використовуються терміни "комплексний регіонарний больовий синдром", "CRPS" і "CRPS і пов'язані синдроми", вони означають хронічний больовий синдром, що характеризується одним або більше з наступних: болем, спонтанним або індукованим, включаючи алодинію (больова реакція на стимул, що звичайно не є болісною) і гіпералгезію (сильна реакція на стимул, що звичайно є тільки слабкоболісною); біль, який є диспропорційним на подію, що його викликала (наприклад, сильний біль протягом багатьох років після розтягання гомілковостопного суглоба); регіональний біль, що не обмежується по ходу одного периферичного нерва й автономну дисрегуляцію (наприклад, набряк, зміна кровотоку й гіпергідроз), асоційований із трофічними змінами шкіри (аномалії росту волосся й нігтів і шкірні виразки). Приклади MD і пов'язаних синдромів включають, не обмежуючись цим, описані в публікації патенту США №2004/0091455, опублікованій 13 травня 2004 року, що включена в даний документ для відома. Конкретні приклади включають, не обмежуючись цим, атрофічну (суху) MD; ексудативну (вологу) MD; вікову макулопатію (ARM); хороїдальну неоваскуляризацію (CNVM); відшарування пігментного епітелію сітківки (PED) і атрофію пігментного епітелію сітківки (RPE). Приклади шкірних захворювань включають, не обмежуючись цим, описані в публікації патенту США №2005/0214328А1, опублікованій 29 вересня 2005 року, що включена в даний 18 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 документ для відома. Конкретні приклади включають, не обмежуючись цим, кератози й пов'язані симптоми; захворювання шкіри й порушення, що характеризуються підвищеним ростом епідермісу; вугри й зморшки. У тому розумінні, у якому в даному документі, використовується термін "кератоз", він стосується будь-якої ділянки ураження в епідермісі, що характеризується обмеженим підвищеним ростом рогового шару, включаючи, не обмежуючись цим, актинічний кератоз; себорейний кератоз; кератоакантому; фолікулярний кератоз (хвороба Дар'є); інвертований фолікулярний кератоз; долонно-підошовну кератодерму (PPK, кератоз долонь і стоп); кератоз повік і штукатурний кератоз. Термін "актинічний кератоз" також стосується старечого кератозу; сенільного кератозу; старечих бородавок; старечих плоских бородавок; сонячного кератозу; кератодерми або кератоми. Термін "себорейний кератоз" також стосується себорейних бородавок; старечих бородавок або базальноклітинної папіломи. Для кератозу характерні наступні симптоми: грубий зовнішній вигляд, лускаті, еритематозні папули, бляшки, спікули або вузлики на відкритих поверхнях (наприклад, обличчі, руках, вухах, шиї, ногах і грудях), розростання кератину, що належить до рогових кератом, гіперкератоз, телеангієктазія, еластоз, пігментовані висипання, акантоз, паракератоз, дискератози, папіломатоз, гіперпігментація базальних клітин епідермісу, клітинна атипія, мітотичні фігури, аномальна клітинна адгезія, щільні запальні інфільтрати й невеликий відсоток плоскоклітиних карцином. Приклади хвороб шкіри або порушень, що характеризуються підвищеним ростом епідермісу, включають, не обмежуючись цим, будь-які стани, захворювання або порушення, що характеризуються розростанням епідермісу, включаючи, не обмежуючись цим, інфекції, викликані вірусом папіломи; арсенікальні кератози; симптом Лесера-Трелата; бородавчасту дискератому (WD); пучкоподібне волосся (TS); варіабельну еритрокератодермію (EKV); іхтіоз плода (іхтіоз Арлекіна); уроджену вузлуватість пальців; шкірну меланоакантому; порокератоз; псоріаз; плоскоклітинну карциному; зливний і ретикулярний папіломатоз (CRP); м'які бородавки; рогову кератому; хворобу Коудена (синдром множинної гамартоми); папульозний дерматоз негрів (DPN); епідермальний невус (ENS); іхтіоз вульгарний; молюск контагіозний; вузлувате пруриго й чорний акантоз (AN). Приклади захворювань легенів включають, не обмежуючись цим, описані в публікації патенту США №2005/0239842А1, опублікованій 27 жовтня 2005 року, яка включена в даний документ для відома. Конкретні приклади включають, не обмежуючись цим, легеневу гіпертензію й пов'язані порушення. Приклади легеневої гіпертензії й пов'язаних порушень включають, не обмежуючись цим, первинну легеневу гіпертензію (PPH); вторинну легеневу гіпертензію (SPH); сімейну форму РРН; спорадичну РРН; прекапілярну легеневу гіпертензію; артеріальну гіпертензію (РАН); легеневу артеріальну гіпертензію; ідіоматичну артеріальну гіпертензію; тромботичну легеневу артеріопатію (ТРА); плексогенну легеневу артеріопатію; легеневу гіпертензію функціонального класу I-IV і легеневу гіпертензію, асоційовану, зв'язану або вторинну дисфункції лівого шлуночка; хворобу мітрального клапана; констриктивний перикардит; стеноз аорти; кардіоміопатію; медіастинальний фіброз; аномальний легеневовенозний дренаж; венооклюзивне захворювання легенів; колагенове судинне захворювання; застійну хворобу серця; ВІЛ-інфекцію; вплив лікарських препаратів і токсинів, таких як фенфлураміни; застійну хворобу серця; легенево-венозну гіпертензію; хронічне обструктивне захворювання легенів; інтерстиціальне захворювання легенів; розлад сну, пов'язаний з порушенням дихання; альвеолярну гіповентиляцію; тривалий вплив високогірних умов; захворювання легенів у немовлят; альвеолярно-капілярну дисплазію; хворобу серповидних еритроцитів; інші порушення коагуляції; хронічну тромбоемболію; сполучнотканинне захворювання; вовчак, включаючи системний й шкірний вовчак; шистосомоз; саркоїдоз або легеневий капілярний гемангіоматоз. Приклади захворювань, викликаних впливом азбесту, включають, не обмежуючись цим, описані в публікації патенту США №2005/0100529, опублікованій 12 травня 2005 року, яка включена в даний документ для відома. Конкретні приклади включають, не обмежуючись цим, мезотеліому; азбестоз; злоякісну плевральну ефузію; доброякісну плевральну ефузію; плевральні бляшки; плевральне ущільнення; дифузійне плевральне ущільнення; округлий ателектаз; фіброзні маси й рак легенів. Приклади паразитарних захворювань включають, не обмежуючись цим, описані в публікації патенту США №2006/0154880, опублікованій 13 липня 2006 року, яка включена в даний документ для відома. Паразитарні захворювання включають захворювання й порушення, викликані внутрішньоклітинними паразитами людини, такими як, не обмежуючись цим, P. falcifarium, P. ovale, P. vivax, P. malariae, L. donovari, L. infantum, L. aethiopica, L. major, L. tropica, L. mexicana, L. braziliensis, T. gondii, B. microti, B. divergens, B. coli, C. parvum, C. cayetanensis, E. 19 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 histolytica, I. belli, S. mansonii, S. haematobium, Trypanosoma ssp., Toxoplasma ssp. і O. volvulus. Також включаються інші захворювання й порушення, викликані внутрішньоклітинними паразитами тварин, такі як, не обмежуючись цим, Babesia bovis, Babesia canis, Babesia gibsoni, Besnoitia darlingi, Cytauxzoon felis, Eimeria ssp., Hammondia ssp. і Theileria ssp. Конкретні приклади включають, не обмежуючись цим, малярію; бабезіоз; трипаносомоз; лейшманіоз; токсоплазмоз; менінгоенцефаліт; кератит; амебіаз; гіардіаз; криптоспоридіоз; ізоспороз; циклоспороз; мікроспороз; аскаридоз; трихоцефалез; анкілостомоз; стронгільоз; токсокароз; трихінельоз; лімфатичний філяріоз; онхоцеркоз; філяріоз; шистосомоз і дерматит, викликаний шистосомами, що паразитують у тварин. Приклади імунодефіцитів включають, не обмежуючись цим, описані в заявці на патент США №11/289723, поданій 30 листопада 2005 року. Конкретні приклади включають, не обмежуючись цим, недостатність аденозиндеамінази; дефіцит антитіл з нормальним або підвищеним рівнем Ig; атаксію-тенлангієктазію; непідтверджений лімфоцитарний синдром; загальна варіабельну імунодефіцит; Ig-недостатність із гіпер-IgM; делеції важкого ланцюга Ig; недостатність IgA; імунодефіцит з тимомою; ретикулярний дисгенез; синдром Незелофа; селективну недостатність субкласу IgG; тимчасову гіпогаммаглобулінемію немовляти; синдром Віскотта-Алдріха; Хзчеплену агаммаглобулінемію; Х-зчеплений тяжкий комбінований імунодефіцит. Приклади розладів ЦНС включають, не обмежуючись цим, описані в публікації патенту США №2005/0143344, опублікованій 30 червня 2005 року. Конкретні приклади включають, не обмежуючись цим, аміотрофічний бічний склероз; хворобу Альцгеймера; хворобу Паркінсона; хворобу Гантінгтона; розсіяний склероз, інші нейроімунологічні розлади, такі як синдром Туретта; делерій; або незначні порушення у свідомості, які мають місце протягом короткого періоду часу, і амнезію, або незначні порушення пам'яті, що мають місце при відсутності інших порушень центральної нервової системи. Приклади ушкодження ЦНС і пов'язаних синдромів включають, не обмежуючись цим, описані в публікації патенту США №2006/0122228, опублікованій 8 червня 2006 року, що включена в даний документ для відома. Конкретні приклади включають, не обмежуючись цим, ушкодження/порушення ЦНС і пов'язані синдроми; включаючи, не обмежуючись цим, первинне ушкодження головного мозку; вторинне ушкодження головного мозку; травматичне ушкодження головного мозку; фокальне ушкодження головного мозку; дифузійне аксональне ушкодження; травму голови; струс; синдром після струсу; церебральну контузію й травматичну рану; субдуральну гематому; епідермальну гематому; посттравматичну епілепсію; повний SCI; неповний SCI; гострий SCI; підгострий SCI; хронічний SCI; синдром центральної частини спинного мозку; синдром Брауна-Секварда; синдром передньої частини спинного мозку; синдром епіконуса; синдром "кінського хвоста"; нейрогенний шок; спінальний шок; змінена свідомість; головний біль; нудоту; блювання; втрату пам'яті; запаморочення; диплопію; розпливчастий зір; емоційну лабільність; порушення сну; дратівливість; нездатність концентруватися; нервозність; поведінкові порушення; когнітивний дефіцит і судоми. Інші захворювання або порушення включають, не обмежуючись цим, вірусні, спадкоємні, алергійні й аутоімунні захворювання. Конкретні приклади включають, не обмежуючись цим, ВІЛінфекцію; гепатит; респіраторний дистрес-синдром у дорослих; резорбцію кісток; хронічні захворювання легенів; дерматит; кістозний фіброз; септичний шок; ендотоксичний шок; гемодинамічний шок; септичний синдром; постишемічне реперфузійне ушкодження; менінгіт; псоріаз; фіброз; кахексію; синдром трансплантат проти хазяїна; відторгнення трансплантата; аутоімунне захворювання; ревматоїдний спондиліт; хворобу Крона; виразковий коліт; запальне захворювання кишечника; розсіяний склероз; системний червоний вовчак; ENL при проказі; наслідки опромінення; рак; астму або ушкодження альвеол при гіпероксії. Приклади атеросклерозу й зв'язаних синдромів включають, не обмежуючись цим, описані в публікації патенту США №2002/0054899, опублікованій 9 травня 2002 року. Конкретні приклади включають, не обмежуючись цим, всі форми станів, що включають атеросклероз, у тому числі рестеноз після втручання на судинах, такого як ангіопластика; стентування; атеректомія й трансплантація. У даному документі передбачаються всі види втручань на судинах, які мають місце при захворюваннях серцево-судинної системи й нирок, такі як, не обмежуючись цим, ангіопластику ниркових судин, перкутане коронарне втручання (PCI); перкутанну транслумінальну коронарну ангіопластику (PTCA); перкутанну транслумінальну ангіопластику сонної артерії (PTA); анастомоз коронарної артерії; ангіопластику з імплантацією стенту; периферичне перкутанне транслумінальне втручання на клубовій, стегновій або підколінній артеріях, і хірургічне втручання з використанням імпрегнованих штучних трансплантатів. У наступній таблиці приводиться перелік основних системних артерій, для яких може знадобитися лікування, які всі передбачаються в даному документі: 20 UA 102582 C2 Артерія пахвова плечова плечоголівна черевна загальна сонна загальна клубова коронарна глибока стегнова пальцева тильна артерія стопи зовнішня сонна зовнішня клубова стегнова шлункова печіночна нижня брижова внутрішня сонна внутрішня клубова ліва шлункова середня сакральна яєчникова долонна дуга малогомілкова підколінна великогомілкова легенева радіальна ниркова селезінкова підключична верхня брижова тестикулярна ліктьова 5 10 15 20 Ділянки тіла, які вона постачає кров'ю плече й пахвова западина верхня частина руки голова, шия й рука розділяється на ліву шлункову, селезінкову й печіночну артерії шия розділяється на зовнішню й внутрішню клубові артерії серце стегно пальці ступні шия й зовнішні ділянки голови стегнова артерія стегно шлунок печінка, жовчний міхур, підшлункова залоза й дванадцятипала кишка спадна кишка, пряма кишка й стінка таза шия й внутрішні ділянки голови пряма кишка, сечовий міхур, зовнішні статеві органи, сідниці, матка й піхва стравохід і шлунок хрестець яєчники рука ікри коліно ікри легені передпліччя нирки шлунок, підшлункова залоза й селезінка плече підшлункова залоза, тонкий кишечник, спадна і поперечна ободова кишка сім'яники лікоть Приклади порушень сну й пов'язаних синдромів включають, не обмежуючись цим, описані в публікації патенту США №2005/022229 A1, опублікованій 6 жовтня 2005 року. Конкретні приклади включають, не обмежуючись цим, хропіння під час сну; апное під час сну; безсоння; нарколепсію; синдром "неспокійних ніг"; нічний страх; ходіння під час сну; прийом їжі під час сну; і порушення сну, пов'язані із хронічними неврологічними або запальними захворюваннями. Хронічні неврологічні або запальні стани включають, не обмежуючись цим, комплексний регіонарний больовий синдром; хронічний біль у нижньому відділі спини; м'язовоскелетний біль; артрит; радикулопатію; біль при раку; фіброміалгію; синдром хронічної утоми; вісцеральний біль; біль у сечовому міхурі; хронічний панкреатит; нейропатії (дрифтери, постгерпетичні, травматичні або запальні); і нейродегенеративні захворювання, такі як хвороба Паркінсона; хвороба Альцгеймера; аміотрофічний бічний склероз; розсіяний склероз; хвороба Хантінгтона; брадикінезія; ригідність м'язів; тремор при хворобі Паркінсона; хода при хворобі Паркінсона; уповільнені рухи; депресія; порушена довгострокова пам'ять; синдром Рубінштейна-Таїбі (RTS); деменція; постуральна нестабільність; гіпокінетичні розлади; розлади, викликані синуїном; полісистемні атрофії; стріатонігриальна дегенерація; оливопонтоцеребральна атрофія; хвороба Ши-Драгера; хвороба моторних нейронів з ознаками паркінсонізму; деменція з тельцями Леві; Тау-патологія; прогресуючий над'ядерний параліч; кортикобазальна дегенерація; фронтотемпоральна деменція; амілоїдні хвороби; помірний когнітивний розлад; хвороба Альцгеймера з паркінсонізмом; хвороба Вільсона; хвороба Галлервордена-Спатца; хвороба Хедіака-Гагаши; спіноцеребральна атаксія SCA-3; Х-зчеплена дистонія; паркінсонізм; пріонова 21 UA 102582 C2 5 10 15 20 25 30 35 40 хвороба; гіперкінетичні розлади; хорея; балізм; дистонічні судоми; аміотрофічний бічний склероз (ALS); травма ЦНС і міоклонічні судоми. Приклади гемоглобінопатії й пов'язаних синдромів включають, не обмежуючись цим, описані в публікації патенту США №2005/0143420А1, опублікованій 30 червня 2005 року, яка включена в даний документ для відома. Конкретні приклади включають, не обмежуючись цим, гемоглобінопатію; серповидноклітинну анемію й будь-які інші розлади, пов'язані з диференціюванням CD34+ клітин. Приклади розладів, пов'язаних з TNFα, включають, не обмежуючись цим, описані в міжнародних заявках WO 98/03502 і WO 98/54170, які обидві включені в даний документ для відома. Конкретні приклади включають, не обмежуючись цим, ендотоксемію або токсичний шок; кахексію; респіраторний дистрес-синдром у дорослих; резорбцію кісток, таку як артрит; гіперкальцемію; реакцію трансплантат проти хазяїна; церебральну малярію; запалення; ріст пухлини; хронічні запальні захворювання легенів; реперфузійне ушкодження; інфаркт міокарда; інсульт; циркуляторний шок; ревматоїдний артрит; хворобу Крона; ВІЛ-інфекцію й СНІД; інші порушення, такі як ревматоїдний артрит; ревматоїдний спондиліт; остеоартрит; псоріатичний артрит і інші форми артриту; септичний шок; сепсис; ендотоксичний шок; синдром трансплантат проти хазяїна; виснаження; хвороба Крона; виразковий коліт; розсіяний склероз; системний червоний вовчак; ENL при проказіі; ВІЛ; СНІД і опортуністичні інфекції при СНІДі; такі порушення, як шок; сепсис; ендотоксичний шок; гемодинамічний шок і септичний синдром; постішемічне реперфузійне ушкодження; малярію; мікобактеріальну інфекцію; менінгіт; псоріаз; застійну серцеву недостатність; фіброз легенів; кахесію; відторгнення трансплантата; онкогенне або злоякісне захворювання; астму; аутоімунне захворювання; наслідки опромінення й ушкодження альвеол у результаті гіпероксії; вірусні інфекції, наприклад, викликані герпес вірусами; вірусний кон'юнктивіт або атопічний дерматит. В інших варіантах здійснення також розкривається застосування препаративних форм, композицій і лікарських форм, описаних у даному документі, у різних імунологічних застосуваннях, зокрема, як ад'юванти для вакцин, наприклад, ад'юванти для протипухлинних вакцин, розкритих у публікації №2007/0048327, опублікованій 1 березня 2007 року, що у повному об'ємі включена в даний документ для відома. Дані варіанти здійснення також стосуються застосувань композицій, препаративних форм або лікарських форм, розкритих у даному документі, у комбінації з вакцинами для лікування або профілактики раку або інфекційних захворювань, і іншим різним застосуванням, таким як зниження або десенсибілізація алергійних реакцій. 5. Приклади Варіанти здійснення, розкриті в даному документі, можна зрозуміти повніше при звертанні до наступних прикладів. Дані приклади призначені для ілюстрації фармацевтичних композицій і лікарських форм, описаних у даному документі, і жодним чином для обмеження. 5.1. Приклад 1: капсули з вмістом помолідоміду 0,5 мг У таблиці 1 наведена рецептура суміші й рецептура разової лікарської форми для однієї разової дози із вмістом помолідоміду 0,5 мг у капсулі розміру №4. Таблиця 1 Рецептура для капсули із вмістом помолідоміду 0,5 мг Речовина Кількість (мг/капсулу) 0,5* 35 0,16 Мас. % 1 % 56 % 0,3 % Помолідомід Крохмаль 1500 Стеарилфумарат натрію (PRUV) Висушений розпилюванням маніт (Mannogem EZ) У цілому решта 100 % решта 62,5 * Означає кількість помолідоміду, що відповідає кількості, яка забезпечує вміст помолідоміду 0,5 мг 45 Помолідомід просівали через сито з розміром отворів 35 меш. Маніт і крохмаль кожний окремо просівали через сито з розміром отворів 25 меш. Помолідомід попередньо змішували із частиною маніту й крохмалю. Попередню суміш просівали через сито з розміром отворів 0,039 22 UA 102582 C2 5 дюймів. Решту частини маніту й крохмалю також просівали через сито з розміром отворів 0,039 дюймів. Попередню суміш змішували з іншою частиною маніту й крохмалю. Потім до даної суміші додавали стеарилфумарат натрію, що просівали через сито з розміром отворів 60 меш. Кінцеву суміш інкапсулювали в капсулу розміру №4. 5.2. Приклад 2: капсули із вмістом помолідоміду 1 мг У таблиці 2 наведена рецептура суміші й рецептура разової лікарської форми для однієї разової дози із вмістом помолідоміду 1 мг у капсулі розміру №4. Таблиця 2 Рецептура для капсули із вмістом помолідоміду 1 мг Речовина Кількість (мг/капсулу) 1* 70 0,32 Мас. % 1 % 56 % 0,3 % Помолідомід Крохмаль 1500 Стеарилфумарат натрію (PRUV) Висушений розпилюванням маніт (Mannogem EZ) У цілому решта решта 100 % 125 * Означає кількість помолідоміду, що відповідає кількості, яка забезпечує вміст помолідоміду 1 мг 10 15 Помолідомід просівали через сито з розміром отворів 35 меш. Маніт і крохмаль кожний окремо просівали через сито з розміром отворів 25 меш. Помолідомід попередньо змішували із частиною маніту й крохмалю. Попередню суміш просівали через сито з розміром отворів 0,039 дюймів. Решту частини маніту й крохмалю також просівали через сито з розміром отворів 0,039 дюймів. Попередню суміш змішували з іншою частиною маніту й крохмалю. Потім до даної суміші додавали стеарилфумарат натрію, що просівали через сито з розміром отворів 60 меш. Кінцеву суміш інкапсулювали в капсулу розміру №4. 5.3 Приклад 3: капсули із вмістом помолідоміду 2 мг У таблиці 3 наведена рецептура суміші й рецептура разової лікарської форми для однієї разової дози із вмістом помолідоміду 2 мг у капсулі розміру №2. 20 Таблиця 3 Рецептура для капсули із вмістом помолідоміду 2 мг Речовина Помолідомід Крохмаль 1500 Стеарилфумарат натрію (PRUV) Висушений розпилюванням маніт (Mannogem EZ) У цілому Кількість (мг/капсулу) Мас. % 1 % 56 % 0,3 % решта 100 % 2* 140 0,64 решта 250 * Означає кількість помолідоміду, що відповідає кількості, яка забезпечує вміст помолідоміду 2 мг 25 Помолідомід просівали через сито з розміром отворів 35 меш. Маніт і крохмаль кожний окремо просівали через сито з розміром отворів 25 меш. Помолідомід попередньо змішували із частиною маніту й крохмалю. Попередню суміш просівали через сито з розміром отворів 0,039 дюймів. Решту частини маніту й крохмалю також просівали через сито з розміром отворів 0,039 дюймів. Попередню суміш змішували з іншою частиною маніту й крохмалю. Потім до даної суміші додавали стеарилфумарат натрію, що просівали через сито з розміром отворів 60 меш. Кінцеву суміш інкапсулювали в капсулу розміру №2. 5.4. Приклад 4: капсули із вмістом помолідоміду 3 мг 23 UA 102582 C2 У таблиці 4 наведена рецептура суміші й рецептура разової лікарської форми для однієї разової дози із вмістом помолідоміду 3 мг у капсулі розміру №2. Таблиця 4 Рецептура для капсули із вмістом помолідоміду 3 мг Речовина Помолідомід Крохмаль 1500 Стеарилфумарат натрію (PRUV) Висушений розпилюванням маніт (Mannogem EZ) У цілому Кількість (мг/капсулу) 3* 100,8 0,45 Мас. % 1,6 % 56 % 0,3 % решта решта 100 % 180 * Означає кількість помолідоміду, що відповідає кількості, яка забезпечує вміст помолідоміду 3 мг 5 10 Помолідомід просівали через сито з розміром отворів 35 меш. Маніт і крохмаль кожний окремо просівали через сито з розміром отворів 25 меш. Помолідомід попередньо змішували із частиною маніту й крохмалю. Попередню суміш просівали через сито з розміром отворів 0,039 дюймів. Решту частини маніту й крохмалю також просівали через сито з розміром отворів 0,039 дюймів. Попередню суміш змішували з іншою частиною маніту й крохмалю. Потім до даної суміші додавали стеарилфумарат натрію, що просівали через сито з розміром отворів 60 меш. Кінцеву суміш інкапсулювали в капсулу розміру №2. 5.5. Приклад 5: капсули із вмістом помолідоміду 4 мг У таблиці 5 наведена рецептура суміші й рецептура разової лікарської форми для однієї разової дози із вмістом помолідоміду 4 мг у капсулі розміру №2. 15 Таблиця 5 Рецептура для капсули із вмістом помолідоміду 4 мг Речовина Помолідомід Крохмаль 1500 Стеарилфумарат натрію (PRUV) Висушений розпилюванням маніт (Mannogem EZ) У цілому Кількість (мг/капсулу) 4* 134,4 0,6 Мас. % 1,6 % 56 % 0,3 % решта 100 % решта 240 * Означає кількість помолідоміду, що відповідає кількості, яка забезпечує вміст помолідоміду 4 мг 20 25 Помолідомід просівали через сито з розміром отворів 35 меш. Маніт і крохмаль кожний окремо просівали через сито з розміром отворів 25 меш. Помолідомід попередньо змішували із частиною маніту й крохмалю. Попередню суміш просівали через сито з розміром отворів 0,039 дюймів. Решту частини маніту й крохмалю також просівали через сито з розміром отворів 0,039 дюймів. Попередню суміш змішували з іншою частиною маніту й крохмалю. Потім до даної суміші додавали стеарилфумарат натрію, що просівали через сито з розміром отворів 60 меш. Кінцеву суміш інкапсулювали в капсулу розміру №2. 5.6. Приклад 6: капсули із вмістом помолідоміду 5 мг У таблиці 6 наведена рецептура суміші й рецептура разової лікарської форми для однієї разової дози із вмістом помолідоміду 5 мг у капсулі розміру №1. 24 UA 102582 C2 Таблиця 6 Рецептура для капсули із вмістом помолідоміду 5 мг Речовина Кількість (мг/капсулу) 5* 168 0,75 Мас. % 2 % 56 % 0,3 % Помолідомід Крохмаль 1500 Стеарилфумарат натрію (PRUV) Висушений розпилюванням маніт (Mannogem EZ) У цілому решта 100 % решта 300 * Означає кількість помолідоміду, що відповідає кількості, яка забезпечує вміст помолідоміду 5 мг 5 10 Помолідомід просівали через сито з розміром отворів 35 меш. Маніт і крохмаль кожний окремо просівали через сито з розміром отворів 25 меш. Помолідомід попередньо змішували із частиною маніту й крохмалю. Попередню суміш просівали через сито з розміром отворів 0,039 дюймів. Решту частини маніту й крохмалю також просівали через сито з розміром отворів 0,039 дюймів. Попередню суміш змішували з іншою частиною маніту й крохмалю. Потім до даної суміші додавали стеарилфумарат натрію, що просівали через сито з розміром отворів 60 меш. Кінцеву суміш інкапсулювали в капсулу розміру №1. 5.7. Приклад 7: стабільність композиції Стабільність в умовах прискореного старіння оцінювали при 40º/75 % відносній вологості, і визначали вміст домішок протягом 0; 1; 3 і 6 місяців. Також оцінювали стабільність в умовах тривалого зберігання при 25º/60 % протягом 0-24 місяців. Для визначення вмісту домішок використовували градієнтну ВЕРХ у наступних умовах: 15 Колонка: Температура: Рухома фаза: Профіль градієнта: Швидкість потоку: Об'єм інжектування: Детектування: Час аналізу: 20 Zorbax SB-CN, 150 мм × 4,6 мм внутрішній діаметр, розмір частинок 5 мкм кімнатна А: 10/90 метанол/0,1 % трифтороцтова кислота Час (хв) %А %В 0 90 10 5 90 10 50 20 80 51 90 10 60 90 10 1,0 мл/хв 25 мкл УФ, 240 нм 60 хв Результати дослідів свідчать про те, що вміст домішок у композиції, розкритої в даному документі, залишалося на рівні нижче чутливості методу протягом усього періоду випробувань. Функціональні характеристики лікарської форми також зберігалися протягом усього періоду випробувань. Результати свідчать, що композиції, описані в даному документі, мають адекватну стабільність для клінічних і інших застосувань. Фахівцям у даній галузі, мабуть, зрозуміло, що незважаючи на те, що в даному документі описані деякі конкретні варіанти здійснення, можливо, зробити різні зміни й модифікації. Такі модифікації також входять в об'єм прикладеної формули винаходу. 25 ФОРМУЛА ВИНАХОДУ 30 1. Оральна лікарська форма в формі капсули, що містить: 1) помалідомід у кількості від 0,1 до 3 мас. % від загальної маси композиції; 2) зв'язуюче або наповнювач у кількості від 90 до 99 мас. % від загальної маси композиції, де зв'язуюче або наповнювач являє собою крохмаль, маніт або їх суміші. 25 UA 102582 C2 5 10 15 20 25 30 35 40 45 50 55 60 2. Лікарська форма за п. 1, у якій помалідомід присутній у кількості від 0,5 до 2 мас. % від загальної маси композиції. 3. Лікарська форма за п. 1, у якій зв'язуюче або наповнювач присутні у кількості від 95 до 99 мас. % від загальної маси композиції. 4. Лікарська форма за п. 1, у якій зв'язуюче або наповнювач являє собою суміш крохмалю і маніту. 5. Лікарська форма за п. 4, у якій крохмаль являє собою попередньо желатинований крохмаль. 6. Лікарська форма за п. 4, у якій маніт являє собою висушений розпилюванням маніт. 7. Лікарська форма за п. 1, що додатково включає мастильну речовину в кількості від 0,01 до 1,0 мас. % від загальної маси композиції. 8. Лікарська форма за п. 7, де мастильна речовина міститься в кількості від 0,1 до 0,5 мас. % від загальної маси композиції. 9. Лікарська форма за п. 7 або 8, в якій мастильна речовина являє собою стеарилфумарат натрію. 10. Оральна лікарська форма, що має масу 62,5 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват у кількості, яка забезпечує ефективність 0,5 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 35 мг; 3) стеарилфумарат натрію в кількості 0,16 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 62,5 мг. 11. Лікарська форма за п. 10, призначена для введення в капсулі розміру № 4 або більш великій капсулі. 12. Оральна лікарська форма, що має масу 125 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват в кількості, що забезпечує ефективність 1,0 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 70 мг; 3) стеарилфумарат натрію в кількості 0,32 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 125 мг. 13. Лікарська форма за п. 12, призначена для введення в капсулі розміру № 4 або більш великій капсулі. 14. Оральна лікарська форма, що має масу 250 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват в кількості, що забезпечує ефективність 2,0 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 140 мг; 3) стеарилфумарат натрію в кількості 0,64 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 250 мг. 15. Лікарська форма за п. 14, призначена для введення в капсулі розміру № 2 або більш великій капсулі. 16. Оральна лікарська форма, що має масу 180 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват в кількості, що забезпечує ефективність 3,0 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 100,8 мг; 3) стеарилфумарат натрію в кількості 0,45 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 180 мг. 17. Лікарська форма за п. 16, призначена для введення в капсулі розміру № 2 або більш великій капсулі. 18. Оральна лікарська форма, що має масу 240 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват в кількості, що забезпечує ефективність 4,0 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 134,4 мг; 3) стеарилфумарат натрію в кількості 0,6 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 240 мг. 19. Лікарська форма за п. 18, призначена для введення в капсулі розміру № 2 або більш великій капсулі. 20. Оральна лікарська форма, що має масу 300 мг і містить: 1) помалідомід або його фармацевтично прийнятну сіль або сольват в кількості, що забезпечує ефективність 5,0 мг помалідоміду; і 2) попередньо желатинований крохмаль у кількості 168 мг; 3) стеарилфумарат натрію в кількості 0,75 мг; і 4) висушений розпиленням маніт знаходиться в кількості, яка доводить загальну масу композиції до 300 мг. 21. Лікарська форма за п. 20, призначена для введення в капсулі розміру № 1 або більш великій капсулі. 22. Спосіб лікування, попередження або менеджменту раку, болю, дегенерації жовтої плями, захворювання шкіри, захворювання легенів, захворювання, викликаного впливом азбесту, паразитарного захворювання, імунодефіцитного розладу, розладу ЦНС, ушкодження ЦНС, атеросклерозу, розладу сну, гемоглобінопатії, анемії, запального захворювання, аутоімунного 26 UA 102582 C2 захворювання, вірусного захворювання, спадкового захворювання, алергійного захворювання, бактеріального захворювання, неоваскуляризації ока, хороїдальної неоваскуляризації, неоваскуляризації сітківки або рубеозу, що включає введення пацієнту оральної лікарської форми за будь-яким з пп. 1-21. 5 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 27
ДивитисяДодаткова інформація
Назва патенту англійськоюOral dosage forms of 4-amino-2-(2,6-dioxopiperidine-3-yl)isoindoline-1,3-dione
Автори англійськоюTutino, Anthony, Kelly, Michael, T.
Назва патенту російськоюОральная лекарственная форма 4-амино-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (варианты)
Автори російськоюТатино Энтони, Келли Майкл Т.
МПК / Мітки
МПК: A61P 35/00, A61K 9/48, A61P 33/00, A61K 31/454, A61P 37/00
Мітки: 4-аміно-2-(2,6-діоксопіперидин-3-іл)ізоіндолін-1,3-діону, форма, лікарська, варіанти, оральна
Код посилання
<a href="https://ua.patents.su/29-102582-oralna-likarska-forma-4-amino-2-26-dioksopiperidin-3-ilizoindolin-13-dionu-varianti.html" target="_blank" rel="follow" title="База патентів України">Оральна лікарська форма 4-аміно-2-(2,6-діоксопіперидин-3-іл)ізоіндолін-1,3-діону (варіанти)</a>
Попередній патент: Спосіб одержання пінополіуретанів
Наступний патент: Установка для перетворення термічної енергії довкілля у корисну енергію
Випадковий патент: Двотактний симетричний підсилювач струму