Похідні піперидинопіримідину для лікування вірусних інфекцій
Номер патенту: 112668
Опубліковано: 10.10.2016
Автори: Рабуассон П'єр Жан-Марі Бернар, МакГован Девід Крейг, Даубі Хамлічі Мурад, Йонкерс Тім Хьюго Марія
Формула / Реферат
1. Сполука формули (І)
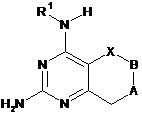 (I)
(I)
або її фармацевтично прийнятна сіль, де
А вибраний з групи, що складається з СН2 і NCOR2 в будь-якій стереохімічній конфігурації,
В вибраний з групи, що складається з СН2 і NCOR4 в будь-якій стереохімічній конфігурації,
за умови, що, якщо А являє собою NCOR2, тоді В не являє собою NCOR4,
X вибраний з СН2 в будь-якій стереохімічній конфігурації,
R1 вибраний з С4-8алкілу, необов'язково заміщеного гідроксилом,
R2 вибраний з заміщеного і незаміщеного С1-6алкілу, С3-7циклоалкілу, гетероциклу, арилу, гетероарилу, гетероарилалкілу, кожний з яких необов'язково заміщений одним або декількома замісниками, незалежно вибраними з галогену, С1-6алкілу або нітрилу,
R4 вибраний з заміщеного або незаміщеного С1-7алкілу, алкоксі(С1-4)алкілу, арилу або С3-7циклоалкілу, кожний з яких необов'язково заміщений нітрилом, і де
термін "арил" означає ароматичну кільцеву структуру, яка містить 4, 5, 6 або 7 кільцевих атомів і необов’язково містить один або два гетероатоми, що вибрані з N, O і S;
термін "гетероарил" означає арил, що містить 1 гетероатом, що вибирають з N, O і S, включаючи тіазоліл, тіадіазол, імідазоліл, ізоксазоліл, фурил, оксазоліл, піроліл, піридоніл, піридил, піридазиніл або піразиніл;
термін "гетероцикл" означає тетрагідрофуран, азетидин, морфолін, піперидин, піперазин і піролідин.
2. Сполука формули (І) за п. 1, де R1 являє собою бутил, і де А, В та X визначені в п. 1.
3. Сполука формули (І) за п. 1, де R1 являє собою С4-8алкіл, заміщений гідроксилом, і де А, В та X визначені в п. 1.
4. Сполука формули (І) за п. 3, де R1 являє собою один з наступних:
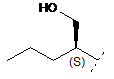 ,
,  ,
,
 ,
,  .
.
5. Сполука формули (І) за п. 1, де X являє собою CН2, і де А та В визначені в п. 1.
6. Сполука формули (І) за п. 1, де X являє собою СН2, і де А являє собою СН2, а В визначений в п. 1.
7. Сполука формули (1) за п. 1, де R2 являє собою один з наступних фрагментів, який може бути додатково заміщений С1-3алкілом і/або нітрилом:
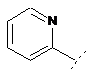 ,
, 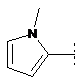 ,
, 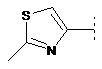 ,
, 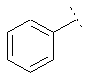 ,
, 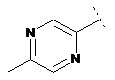 .
.
8. Фармацевтична композиція, що містить сполуку формули (І) або її фармацевтично прийнятну сіль за одним з пп. 1-7 разом з одним або декількома фармацевтично прийнятними наповнювачами, розріджувачами або носіями.
9. Фармацевтична композиція за п. 8, в якій фармацевтично прийнятні наповнювачі являють собою розріджувачі.
10. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за одним з пп. 1-7 для одержання лікарського засобу для лікування порушення, в яке залучена модуляція толл-подібних рецепторів (TLR).
11. Застосування фармацевтичної композиції за п. 8 або 9 для одержання лікарського засобу для лікування порушення, в яке залучена модуляція толл-подібних рецепторів (TLR).
12. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за одним з пп. 1-7 для одержання лікарського засобу для лікування порушення, в яке залучена модуляція TLR7 і/або TLR8.
13. Застосування фармацевтичної композиції за п. 8 або 9 для одержання лікарського засобу для лікування порушення, в яке залучена модуляція TLR7 та/або TLR8.
Текст
Реферат: Даний винахід стосується похідних піперидинопіримідину, способів їх фармацевтичних композицій і їх застосування під час лікування вірусних інфекцій. R1 H N X N H 2N N B A отримання, UA 112668 C2 (12) UA 112668 C2 UA 112668 C2 5 10 15 20 25 30 Даний винахід відноситься до похідних піперидино-піримідину, способів їх отримання, фармацевтичних композицій і їх застосування під час лікування вірусних інфекцій. Даний винахід відноситься до застосування похідних піперидино-піримідину під час лікування вірусних інфекцій, імунних або запальних порушень, до якого залучені модуляція або агонізм толл-подібних рецепторів (TLR). Толл-подібні рецептори являють собою первинні трансмембранні білки, що характеризуються позаклітинним лейцин-багатим доменом і цитоплазматичним розширенням, яке містить консервативну ділянку. Вроджена імунна система може розпізнавати патоген-асоційовані молекулярні патерни за допомогою даних TLR, експресованих на клітинній поверхні певних типів імунних клітин. Під час розпізнавання чужорідних патогенів активується утворення цитокінів та підвищення рівня регуляції костимулюючих молекул на фагоцитах. Це призводить до модуляції поведінки Т-клітин. Встановлено, що більшість видів ссавців мають від десяти до п'ятнадцяти типів толлподібних рецепторів. У загальній складності у людини і мишей виявили тринадцять TLR (під назвою TLR1-TLR13), а у інших видів ссавців виявили еквівалентні форми багатьох з них. Тим не менш, еквіваленти певних TLR, виявлених у людини, не присутні у всіх ссавців. Наприклад, ген, що кодує білок, аналогічний TLR10 у людей, присутній у мишей, але, виявляється, в певний момент у минулому був пошкоджений ретровірусом. З іншого боку, у мишей експресуються TLR 11, 12 і 13, жоден з яких не представлений у людини. У інших ссавців можуть експресуватися TLR, які не виявлені у людини. Інші види, що не є ссавцями, можуть мати TLR, відмінні від таких у ссавців, доказом цього служить TLR14, який виявлений у риби фугу. Це може ускладнити спосіб застосування експериментальних тварин в якості моделей вродженого імунітету людини. Для детального огляду толл-подібних рецепторів див. наступні журнальні статті. Hoffmann, J.A., Nature, 426, p33-38, 2003; Akira, S., Takeda, K., і Kaisho, T., Annual Rev. Immunology, 21, p335-376, 2003; Ulevitch, R. J., Nature Reviews: Immunology, 4, p512-520, 2004. Раніше були описані сполуки, які проявляють активність по відношенню до толл-подібних рецепторів, такі як похідні пурину в WO 2006/117670, похідні аденіну в WO 98/01448 і WO 99/28321 і піримідини в WO 2009/067081. Тим не менш, існує гостра потреба в нових модуляторах толл-подібних рецепторів, що мають кращу селективність, більш високу ефективність, більш високу метаболічну стабільність, а також поліпшений профіль безпеки (наприклад, знижений ризик CVS) порівняно зі сполуками з відомого рівня техніки. Згідно з даним винаходом забезпечується сполука формули (I), R1 N H 2N 35 40 45 50 55 N H X B A N (I), або її фармацевтично прийнятна сіль, таутомер(и), сольват або поліморф, де 2 3 3 3 A обраний з групи, що складається з CH2, NCOR , CHR і CR R в будь-якій стереохімічній конфігурації, 4 3 3 3 B обраний з групи, що складається з CH2, NCOR , CHR і CR R в будь-якій стереохімічній конфігурації, 2 4 за умови, що якщо A являє собою NCOR , тоді B не являє собою NCOR , і за умови, що ні A, 3 3 3 ні B не обрані з CH2, CHR або CR R , 5 X обраний з CH2 або CHR в будь-якій стереохімічній конфігурації, 1 R обраний з C1-8алкілу, необов'язково заміщеного одним або декількома з наступних: C 16алкіл, C3-7циклоалкіл, гідроксил, гідроксіалкіл, аміно, нітрил, алкоксі, алкокси(C 1-4)алкіл, карбонова кислота, ефір карбонової кислоти, карбамат або сульфон, 2 R обраний з заміщеного і незаміщеного C1-6алкілу, C3-7циклоалкілу, гетероциклу, арилу, гетероарилу, гетероарилалкілу, кожен з яких необов'язково заміщений одним або декількома замісниками, незалежно обраними з галогену, гідроксилу, аміно, C 1-6алкілу, ди-(C1-6)алкіламіно, C1-6алкіламіно, C1-6алкілу, C1-6алкоксі, C3-6циклоалкілу, карбонової кислоти, ефіру карбонової кислоти, аміду карбонової кислоти, гетероциклу, арилу, алкенілу, алкінілу, арилалкілу, гетероарилу, гетероарилалкілу або нітрилу, 3 R обраний з водню, заміщеного і незаміщеного C1-6алкілу, алкоксі, алкокси-(C1-4)алкілу, C37циклоалкілу, C4-7гетероциклу, ароматичного радикалу, біциклічного гетероциклу, арилалкілу, гетероарилу, гетероарилалкілу, кожний з яких необов'язково заміщений одним або декількома замісниками, незалежно обраними з галогену, гідроксилу, аміно, C 1-6алкілу, ди-(C1-6)алкіламіно, 1 UA 112668 C2 5 10 15 C1-6алкіламіно, C1-6алкілу, C1-6алкоксі, C3-6циклоалкілу, карбонової кислоти, ефіру карбонової кислоти, аміду карбонової кислоти, гетероциклу, арилу, алкенілу, алкінілу, арилалкілу, гетероарилу, гетероарилалкілу або нітрилу, 4 R обраний з заміщеного або незаміщеного C1-7алкілу, алкоксі, алкокси-(C1-4)алкілу, арилу або C3-7циклоалкілу, кожний з яких необов'язково заміщений гетероциклом, нітрилом, гетероарилалкілом або гетероарилом, і де 5 R обраний з ароматичного радикалу, біциклічного гетероциклу, арилу, гетероарилу, кожний з яких необов'язково заміщений одним або декількома замісниками, незалежно обраними з галогену, гідроксилу, аміно, C1-6алкілу, ди-(C1-6)алкіламіно, C1-6алкіламіно, C1-6алкілу, C1-6алкоксі, C3-6циклоалкілу, карбонової кислоти, ефіру карбонової кислоти, аміду карбонової кислоти, гетероциклу, арилу, алкенілу, алкінілу, арилалкілу, гетероарилу, гетероарилалкілу або нітрилу. У першому варіанті здійснення даний винахід забезпечує сполуки формули (I), де R1 являє собою бутил і де А, В та Х визначені вище. У наступному варіанті здійснення даний винахід відноситься до сполук формули (I), де R1 являє собою C4-8алкіл, заміщений гідроксилом, і де А, В та Х визначені вище. 1 Інший варіант здійснення відноситься до сполук формули (I), де R , будучи C4-8алкілом, заміщеним гідроксилом, являє собою один з наступних: 20 25 Крім того, даний винахід також забезпечує сполуки формули (I), де X являє собою CH 2 і де А і В визначені вище. В іншому варіанті здійснення даний винахід забезпечує сполуки формули (I), де X являє собою CH2 і де А являє собою CH2, а В визначений вище. 2 Крім того, даний винахід відноситься до сполук формули (I), де R являє собою один з наступних прикладів, який може бути додатково заміщений C 1-3алкілом, гідроксилом, алкоксі, нітрилом, гетероциклом, ефіром карбонової кислоти або амідом карбонової кислоти: N N N S N . Переважні сполуки являють собою сполуки під номерами 3 і 1 з наступними хімічними структурами, відповідно: N 30 NH N H 2N NH N N O O N N N і H 2N N . Інші переважні сполуки згідно з даним винаходом являють собою сполуки з наступними хімічними структурами: HN HO O N N HN N S N (S) NH N O N N H 2N N N O N S , H2N N та . Сполуки формули (I) і їх фармацевтично прийнятна сіль, таутомер(и), сольват або поліморф володіють активністю як фармацевтичні препарати, зокрема, як модулятори активності толлH 2N 35 (S) (S) OH OH N 2 UA 112668 C2 5 10 15 20 25 30 35 40 45 50 55 60 подібних рецепторів (особливо TLR7 та/або TLR8). У додатковому аспекті даний винахід забезпечує фармацевтичну композицію, що містить сполуку формули (I) або її фармацевтично прийнятну сіль, сольват або поліморф разом з одним або декількома фармацевтично прийнятними наповнювачами, розріджувачами або носіями. Крім того, сполука формули (I) або її фармацевтично прийнятна сіль, сольват або поліморф згідно з даним винаходом, або фармацевтична композиція, що містить зазначену сполуку формули (I) або її фармацевтично прийнятну сіль, сольват або поліморф, можуть застосовуватися у якості лікарського препарату. Іншим аспектом даного винаходу є те, що сполука формули (I) або її фармацевтично прийнятна сіль, сольват або поліморф, або зазначена фармацевтична композиція, що містить зазначену сполуку формули (I) або її фармацевтично прийнятну сіль, сольват або поліморф, можуть відповідно застосовуватися для лікування порушення, до якого залучена модуляція TLR7 та/або TLR8. Термін "алкіл" відноситься до насиченого аліфатичного вуглеводню з нерозгалуженим ланцюгом або розгалуженим ланцюгом, який містить певну кількість атомів вуглецю. Термін "галоген" відноситься до фтору, хлору, брому або йоду. Термін "алкеніл" відноситься до алкілу, визначеному вище, що складається з щонайменше двох атомів вуглецю і щонайменше одного вуглець-вуглецевого подвійного зв'язка. Термін "алкініл" відноситься до алкілу, визначеному вище, що складається щонайменше з двох атомів вуглецю і щонайменше з одного вуглець-вуглецевого потрійного зв'язку. Термін "циклоалкіл" відноситься до карбоциклічного кільця, що містить певну кількість атомів вуглецю. Термін "гетероарил" означає ароматичну кільцеву структуру, визначену щодо терміна "арил", і яка містить щонайменше 1 гетероатом, обраний з N, O та S, зокрема, з N і О. Термін "арил" означає ароматичну кільцеву структуру, що необов'язково містить один або два гетероатоми, обрані з N, O та S, зокрема, з N і О. Зазначена ароматична кільцева структура може містити 4, 5, 6 або 7 кільцевих атомів. Зокрема, зазначена ароматична кільцева структура може містити 5 або 6 кільцевих атомів. Термін "біциклічний гетероцикл" означає ароматичну кільцеву структуру, визначену для терміна "арил", що включає два конденсованих ароматичних кільця. Кожне кільце необов'язково включає гетероатоми, обрані з N, O і S, зокрема, з N і O. Термін "арилалкіл" означає ароматичну кільцеву структуру, визначену щодо терміна "арил", необов'язково заміщену алкільною групою. Термін "гетероарилалкіл" передбачає ароматичну кільцеву структуру, визначену для терміна "гетероарил", необов'язково заміщену алкільною групою. Термін "алкоксі" відноситься до алкільної групи (ланцюги вуглецю і водню), окремо пов'язаної з киснем, як наприклад, метоксигрупа або етоксигрупа. Гетероцикл відноситься до молекул, які насичені або частково насичені і включають етилоксид, тетрагідрофуран, діоксан або інші циклічні ефіри. Гетероцикли, що містять азот, включають, наприклад, азетидин, морфолін, піперидин, піперазин, піролідин і т.п. Інші гетероцикли включають, наприклад, тіоморфолін, діоксолініл і циклічні сульфони. Гетероарильні групи являють собою гетероциклічні групи, які за своєю природою є ароматичними. Вони є моноциклічними, біциклічними або поліциклічними і містять один або декілька гетероатомів, обраних з N, O або S. Гетероарильні групи можуть являти собою, наприклад, імідазоліл, ізоксазоліл, фурил, оксазоліл, піроліл, піридоніл, піридил, піридазиніл або піразиніл. Фармацевтично прийнятні солі сполук формули (I) включають їх кислотно-адитивні та основні солі. Придатні кислотно-адитивні солі утворюються від кислот, які утворюють нетоксичні солі. Придатні основні солі утворюються від основ, які утворюють нетоксичні солі. Сполуки за даним винаходом також можуть існувати в несольватованій і сольватованій формах. Термін "сольват" застосовується в даному документі для опису молекулярного комплексу, що включає сполуку за даним винаходом і одну або декілька молекул фармацевтично прийнятного розчинника, наприклад, етанолу. Термін "поліморф" відноситься до здатності сполуки за даним винаходом існувати у більш, ніж одній формі або кристалічній структурі. Сполуки за даним винаходом можуть вводитися у вигляді кристалічних або аморфних продуктів. Вони можуть бути отримані, наприклад, у вигляді твердих пробок, порошків або плівок за допомогою способів, таких як осадження, кристалізація, ліофільне сушіння, розпилювальне сушіння або сушіння випарюванням. Вони можуть вводитися окремо або в 3 UA 112668 C2 5 10 15 20 25 30 35 40 45 50 55 60 комбінації з одною або декількома іншими сполуками за даним винаходом або в комбінації з одним або декількома іншими лікарськими засобами. В основному, вони будуть вводитися у вигляді складу в поєднанні з одним або декількома фармацевтично прийнятними наповнювачами. Термін "наповнювач" застосовується в даному документі для опису будь-якого інгредієнта, відмінного від сполуки(сполук) за даним винаходом. Вибір наповнювача в більшій мірі залежить від факторів, таких як конкретний спосіб введення, вплив наповнювача на розчинність і стабільність, і природа лікарської форми. Сполуки за даним винаходом або будь-яка їх підгрупа можуть бути складені в різноманітні фармацевтичні форми для цілей введення. В якості придатних композицій можуть бути згадані всі композиції, що зазвичай використовуються для системного введення лікарських засобів. Для отримання фармацевтичних композицій за даним винаходом ефективна кількість конкретної сполуки, необов'язково в формі солі приєднання, в якості активного інгредієнта об'єднується в однорідну суміш з фармацевтично прийнятним носієм, при цьому носій може приймати широку різноманітність форм в залежності від форми препарату, необхідного для введення. Дані фармацевтичні композиції доцільно знаходяться в одиничній лікарській формі, придатній, наприклад, для перорального, ректального або черезшкірного введення. Наприклад, під час отримання композицій в пероральній лікарській формі може використовуватися будь-яке з загальноприйнятих фармацевтичних середовищ, таке як, наприклад, вода, гліколі, масла, спирти і т.п. у випадку пероральних рідких препаратів, таких як суспензії, сиропи, еліксири, емульсії та розчини; або твердих носіїв, таких як крохмалі, цукри, каолін, розріджувачі, змащувальні засоби, зв'язувальні засоби, засоби для покращення розпаду таблеток і т.п. у випадку порошків, пілюль, капсул і таблеток. Завдяки своїй простоті введення таблетки і капсули являють собою найбільш переважні пероральні форми одиниці дозування, у випадку яких очевидно використовуються тверді фармацевтичні носії. Також включені препарати твердої форми, які незадовго до застосування можуть бути перетворені в рідкі форми. В композиціях, придатних для черезшкірного введення, носій необов'язково включає засіб, що сприяє проникненню та/або придатний змочувальний засіб, необов'язково в комбінації з придатними добавками будь-якої природи в мінімальних пропорціях, при цьому добавки не спричиняють значного шкідливого впливу на шкіру. Зазначені добавки можуть полегшувати введення в шкіру та/або можуть бути корисними для отримання необхідних композицій. Дані композиції можуть вводитися по-різному, наприклад, за допомогою трансдермального пластиру, точково, у вигляді мазі. Сполуки за даним винаходом також можуть вводитися шляхом інгаляції або інсуфляції за допомогою способів і складів, що використовуються в даному рівні техніки для введення таким шляхом. Таким чином, в основному сполуки за даним винаходом можуть вводитися в легені в формі розчину, суспензії або сухого порошку. Особливо переважно складання вищезазначених фармацевтичних композицій в одиничній лікарській формі для простоти введення і рівномірності дозування. Одинична лікарська форма, що застосовується в даному документі, відноситься до фізично окремих одиниць, придатних в якості одиничних доз, при цьому кожна одиниця містить попередньо задану кількість активного інгредієнта, розраховану для отримання бажаного терапевтичного ефекту, в поєднанні з необхідним фармацевтичним носієм. Прикладами таких одиничних лікарських форм є таблетки (включаючи таблетки, що діляться, або таблетки, покриті оболонкою), капсули, пілюлі, пакети для порошкоподібного продукту, пластинки, супозиторії, ін'єкційні розчини або суспензії і т.п., і їх окрема кратна кількість. Фахівці в галузі лікування інфекційних захворювань зможуть визначити ефективну кількість, виходячи з результатів тестів, представлених далі в даному документі. В основному передбачається, що ефективна добова кількість буде складати від 0,01 мг/кг до 50 мг/кг ваги тіла, більш переважно від 0,1 мг/кг до 10 мг/кг ваги тіла. Може бути введення необхідної дози у вигляді двох, трьох, чотирьох або більше частин дози при придатних інтервалах протягом дня. Зазначені частини дози можуть складатися у вигляді одиничних лікарських форм, наприклад, що містять від 1 до 1000 мг, і, зокрема, від 5 до 200 мг активного інгредієнта на одиницю лікарської форми. Точне дозування і частота введення залежить від конкретної застосовуваної сполуки формули (I), конкретного стану, який лікується, тяжкості стану, який лікується, віку, ваги і загального фізичного стану конкретного пацієнта, а також іншої лікарської терапії, яку може проходити людина, що є добре відомим фахівцям в даній галузі техніки. Більш того, очевидно, що ефективна кількість може бути знижена або збільшена в залежності від реакції людини, яка проходить лікування та/або в залежності від оцінки лікаря, який приписує сполуки за даним винаходом. Таким чином, вищезгадані діапазони ефективної кількості є тільки рекомендаціями і не призначені обмежувати в тій або іншій мірі обсяг або застосування даного винаходу. 4 UA 112668 C2 Загальні способи синтезу 5 10 15 20 4 Сполуки формули (I), де B являє собою NCOR , отримували за схемою 1. При отриманні III виявили, що карбонат гуанідину можна використовувати з основою або без основи (наприклад, етоксид натрію) в спиртовому розчиннику, такому як етанол. Хлорування гідроксипіримідинового кільця для отримання хлорпіриміду IV можна здійснювати за допомогою хлорувального засобу, такого як POCl3, або в якості розчинника разом з іншими розчинниками (наприклад, дихлорметаном), або в комбінації з основою, наприклад, N, N-диметиланіліном. Витиснення хлору з отриманням проміжної сполуки V можна здійснювати при високій температурі в полярному розчиннику (наприклад, аценітрилі або DMF) з надлишком аміну (NH 21 R ) з основою або без основи (наприклад, DIPEA). Boc-захист V для отримання проміжної сполуки VI можна виконати з використанням каталізатора N, N-диметиламінопіридину (DMAP) в неполярному розчиннику, такому як дихлорметан або THF. Видалення N-бензил (Bn) групи можна здійснювати шляхом каталітичної гідрогенізації. Утворення амідних продуктів формули I можна досягти шляхом приведення в реакцію VII або з хлорангідридом в комбінації з надлишком основи (наприклад, триетиламіну); або з карбоновою кислотою в комбінації із зв'язувальним засобом (наприклад, HBTU) і основою (наприклад, триетиламіном). Приклади Отримання сполук формули I 5 UA 112668 C2 5 10 Суспензію A (19,5 г, 68,7 ммоля) і карбонату гуанідину (19,5 г, 41,23 ммоля) в етанолі (170 мл) нагрівали протягом 16 годин при 120ºC. Розчинник видаляли при зниженому тиску, відновлювали в ацетонітрилі, де неочищений продукт осаджували і відділяли за допомогою фільтрації. Тверду речовину використовували на наступному етапі без додаткового очищення. 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 2,35-2,46 (m, 2H), 2,57-2,65 (m, 2H), 3,04 (s, 2H), 3,60 (s, 2H), 6,28 (br. s., 2H), 7,27 (dt, J=8,7, 4,5 Гц, 1H), 7,31-7,36 (m, 4H), 10,74 (br. s., 1H) + МС маса/заряд: 257 [M+H ] Отримання C NH2 N NH2 N N OH N N Cl POCl3 N 100ºC B 15 20 C Розчин B (8,2 г, 32 ммоля) в фосфорилоксихлориді (POCl3) (90 мл) нагрівали протягом 16 годин при 100ºC. Після охолодження видаляли розчинник при зниженому тиску і розчиняли залишок в етилацетаті (150 мл), а потім промивали насиченим водним NaHCO 3 (3 × 100 мл). Органічні шари об'єднували, висушували над сульфатом магнію, тверді речовини видаляли шляхом фільтрації, і розчинники фільтрату видаляли при зниженому тиску. Тверду речовину використовували на наступному етапі без додаткового очищення. + МС маса/заряд: 275 [M+H ] Отримання D 6 UA 112668 C2 5 10 Розчин C (2,78 г, 10,12 ммоля) в діоксані (25 мл) та н-бутиламіні (1,5 мл, 15,2 ммоля) нагрівали протягом 16 годин при 120ºC. Після охолодження до кімнатної температури розчинник видаляли при зниженому тиску, і неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням дихлорметану-5 % метанолу в градієнті дихлорметану. 1 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,90-1,01 (m, 3H), 1,28-1,46 (m, 2H), 1,49-1,64 (m, 2H), 2,70-2,81 (m, 4H), 3,21 (s, 2H), 3,44 (td, J=7,1, 5,7 Гц, 2H), 3,74 (s, 2H), 4,47 (br. s., 1H), 5,215,46 (m, 2H), 7,30-7,40 (m, 5H) + МС маса/заряд: 312 [M+H ] Отримання E NH2 N NBoc2 N N N N H N N Boc Boc2O DMAP/THF N D 15 20 E Розчин D (3 г, 9,63 ммоля), ди-трет-бутилдикарбонату (12,6 г, 57,8 ммоля) і 4-N, Nдиметиламінопіридину (0,118 г, 0,1 ммоля) в THF (60 мл) нагрівали до 80ºC протягом 4 годин. Реакційну суміш охолоджували до кімнатної температури і розчинник видаляли при зниженому тиску. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням градієнту гептану-етилацетату. + МС маса/заряд: 612 [M+H ] Отримання F NBoc2 NBoc2 N N N N Boc N Boc N N N H H2, Pd/C F E 25 30 До розчину E (0,711 г, 1,16 ммоля) етанолу (6 мл) додавали 0,2 вага/вага еквівалента Pd/C (10 %, вологий) (71 мг). Флакон запаювали; повітря видаляли за допомогою вакууму. Флакон оснащали балоном, наповненим газоподібним воднем. Суміш перемішували при кімнатній температурі протягом 16 годин. Суміш фільтрували через ущільнений целіт, а розчинник фільтрату видаляли при зниженому тиску. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням дихлорметану-5 % метанолу в градієнті дихлорметану. 1 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,90 (t, J=7,4 Гц, 3H), 1,19-1,36 (m, 2H), 1,41-1,50 (m, 27H), 1,51-1,58 (m, 2H), 1,64 (s, 2H), 2,91-3,02 (m, 2H), 3,26 (t, J=6,1 Гц, 2H), 3,71-3,82 (m, 2H), 3,86 (s, 1H) 7 UA 112668 C2 + МС маса/заряд: 523 [M+H ] Отримання сполуки 1 1. Et3N/DMAP CH2Cl2 NBoc2 N NH2 O Cl N N N N H N Boc N 2. HCl N H O F 1 5 10 15 20 До суміші F (100 мг, 0,191 ммоля), DMAP (2 мг, 0,019 ммоля) і Et3N (0,081 мл, 0,576 ммоля) в дихлорметані (2 мл) додавали циклобутанкарбонілхлорид (25 мг, 0,21 ммоля) при 0ºC. Cуміші дозволяли досягнути кімнатної температури, і її перемішували протягом 16 годин. Додавали HCl (1 н, 1 мл) і перемішували реакційну суміш протягом додаткових 30 хвилин, а потім додавали NaHCO3 (нас. вод., 10 мл). Суміш екстрагували етилацетатом (3 × 10 мл), і об'єднані органічні шари висушували над MgSO4, тверді речовини видаляли шляхом фільтрації, і розчинники фільтрату видаляли при зниженому тиску. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням градієнту гептану-етилацетату. Кращі фракції зводили воєдино, а розчинники видаляли при зниженому тиску з отриманням сполуки 1. + МС маса/заряд: 304 [M+H ] Приклади 2 Сполуки формули (I), де A являє собою NCOR , отримували за схемою 3. Суспензію G (0,5 г, 1,76 ммоля) і карбонату гуанідину (190 мг, 1,06 ммоля) в етанолі (5 мл) 8 UA 112668 C2 нагрівали зі зворотним холодильником протягом 16 годин. Розчинник видаляли при зниженому тиску, неочищений продукт осаджували в ацетонітрилі і відділяли за допомогою фільтрації. Тверду речовину використовували на наступному етапі без додаткового очищення. + МС маса/заряд: 257 [M+H ] 5 10 Розчин H (6 г, 23,4 ммоля) в фосфорилоксихлориді (POCl3) (65 мл) нагрівали протягом 3 годин при 100ºC. Після охолодження розчинник видаляли при зниженому тиску, а залишок розчиняли в етилацетаті (150 мл), промивали насиченим, водним NaHCO 3 (3 × 100 мл). Органічні шари об'єднували, висушували над сульфатом магнію, тверді речовини видаляли за допомогою фільтрації, і розчинники фільтрату видаляли при зниженому тиску. Неочищену тверду речовину очищали за допомогою колонкової хроматографії на силікагелі з використанням градієнту дихлорметану-5 % метанолу. + МС маса/заряд: 275 [M+H ] 15 20 25 Розчин I (2,78 г, 10,12 ммоля) в DMA (25 мл) і н-бутиламіну (1,5 мл, 15,2 ммоля) нагрівали протягом 16 годин при 120ºC. Після охолодження до кімнатної температури розчинник видаляли при зниженому тиску, і неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням дихлорметану-3 % метанолу в градієнті дихлорметану. 1 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,76-0,87 (m, 3H), 1,16-1,35 (m, 2H), 1,38-1,71 (m, 2H), 2,00 (quin, J=6,9 Гц, 2H), 2,64 (td, J=7,4, 2,4 Гц, 2H), 3,46 (dd, J=11,4, 2,6 Гц, 1H), 3,52 (dd, J=5,1, 2,2 Гц, 1H), 3,72 (s, 2H), 3,84 (td, J=6,3, 1,8 Гц, 1H), 4,06 (d, J=2,7 Гц, 1H), 4,48 (br. s., 2H), 4,89 (d, J=8,7 Гц, 1H), 6,72-6,80 (m, 2H), 7,02 (d, J=8,7 Гц, 2H), 7,25 (s, 1H) + МС маса/заряд: 312 [M+H ] Отримання K Розчин J (3 г, 9,63 ммоля), ди-трет-бутилдикарбонату (12,6 г, 57,8 ммоля) і 4-N, Nдиметиламінопіридину (0,118 г, 0,1 ммоля) в THF (50 мл) нагрівали до 80ºC протягом 4 годин. 9 UA 112668 C2 5 Реакційну суміш охолоджували до кімнатної температури і розчинник видаляли при зниженому тиску. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням градієнту гептану-етилацетату. + МС маса/заряд: 612 [M+H ] Отримання L NBoc2 NBoc 2 N N N N Boc N H 2, Pd/C HN N N Boc L K 10 До розчину К (0,711 г, 1,16 ммоля) етанолу (6 мл) додавали 0,2 вага/вага еквівалента Pd/C (10 %, вологий) (0,071 г) і перемішували в атмосфері водню (балон) протягом 16 годин. Суміш фільтрували через ущільнений целіт, а розчинник фільтрату видаляли при зниженому тиску. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням градієнту гептану-етилацетату. + МС маса/заряд: 523 [M+H ] 15 20 До розчину L (100 мг, 0,191 ммоля) додавали Et3N (58 мг, 0,58 ммоля), бензоїлхлорид (30 мг, 0,211 ммоля) в дихлорметані (3 мл) і DMAP (2 мг, 0,019 ммоля), а потім перемішували при кімнатній температурі протягом 16 годин. До нього додавали NaHCO3 (нас., вод. 10 мл) і суміш екстрагували етилацетатом (3 × 10 мл). Органічні шари об'єднували, висушували над MgSO 4, тверді речовини видаляли шляхом фільтрації, та розчинники фільтрату видаляли при зниженому тиску. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням дихлорметану-5 % метанолу в градієнті дихлорметану. З очищеного, boc-захищеного продукту знімали захист шляхом додавання HCl в ізопропанолі. 25 10 UA 112668 C2 5 До розчину L (90 мг, 0,173 ммоля) в DMF (3 мл) додавали DIPEA (33 мг, 0,26 ммоля), HBTU (72 мг, 0,19 ммоля) і 1-метил-2-піролкарбонову кислоту (23 мг, 0,18 ммоля), а потім перемішували при кімнатній температурі протягом 16 годин. До нього додавали NaHCO3 (нас., вод. 10 мл) і суміш екстрагували етилацетатом (3 × 10 мл). Органічні шари об'єднували, висушували (MgSO4), тверді речовини видаляли шляхом фільтрації, і розчинники фільтрату видаляли при зниженому тиску. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням дихлорметану-3 % метанолу в градієнті дихлорметану. З очищеного, boc-захищеного продукту знімали захист шляхом додавання HCl в ізопропанолі. 10 15 20 До перемішуваного розчину L (110 мг, 0,2 ммоля) в дихлорметані (2 мл) додавали триетиламін (60 мг, 0,6 ммоля), DMAP (6 мг, 0,05 ммоля) і циклопропанкарбонілхлорид (24 мг, 0,23 ммоля), і суміш перемішували при кімнатній температурі протягом 16 годин. До неї додавали NaHCO3 (нас., вод. 50 мл) і суміш екстрагували етилацетатом (3 × 10 мл). Органічні шари об'єднували, висушували (MgSO4), тверді речовини видаляли шляхом фільтрації, і розчинники фільтрату видаляли при зниженому тиску. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням градієнту гептануетилацетату. З очищеного, boc-захищеного продукту знімали захист шляхом додавання HCl в ізопропанолі. Таблиця 1. Сполуки формули (I) Продукти отримували за допомогою одного з способів, описаних вище. 2 В таблиці I A представлені сполуки, де A=NCOR , тоді як в таблиці I B представлені сполуки, 4 де B=NCOR , а таблиця I C містить обидві сполуки з позиційною ізомерією. 25 Таблиця I A # Структура Точна маса LC-MS (M+H) ЯМР 1 2 325,19 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,89 (t, J=7,3 Гц, 3H), 1,25-1,40 (m, 2H), 1,51 (quin, J=7,3 Гц, 2H), 1,59 (s, 1H), 2,34 (br. s., 2H), 3,37 (td, J=7,0, 5,7 Гц, 2H), 3,95 (br. s., 1H), 4,12-4,72 (m, 5H), 7,35 (d, J=2,7 Гц, 5H) 326 1 3 328,20 H ЯМР (300 МГц, МЕТАНОЛ-d4) δ ppm 0,86 (t, J=7,4 Гц, 3H), 1,29 (dd, J=15,1, 7,4 Гц, 2H), 1,41-1,57 (m, 2H), 2,34 (s, 2H), 3,31 (t, J=7,2 Гц, 2H), 3,63 (s, 3H), 3,85 (t, J=6,0 Гц, 2H), 4,42 (s, 3H), 4,51-4,62 (m, 2H), 6,01 (dd, J=3,8, 2,6 Гц, 1H), 6,37 (dd, J=3,8, 1,6 Гц, 1H), 6,74 (d, J=2,2 Гц, 1H) 329 11 UA 112668 C2 Таблиця I A # Структура Точна маса LC-MS (M+H) ЯМР H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,73-0,84 (m, 2H), 0,92-0,99 (m, 3H), 1,00 (br. s., 1H), 1,40 (dq, J=14,9, 7,3 Гц, 2H), 1,59 (quin, J=7,3 Гц, 2H), 1,70 (s, 3H), 1,78 (br. s., 1H), 2,25-2,48 (m, 2H), 3,36-3,51 (m, 2H), 3,88 (m, J=5,1 Гц, 2H), 4,39-4,57 (m, 2H), 4,63 (br. s., 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,92 (t, J=7,3 Гц, 3H), 1,24-1,42 (m, 2H), 1,49-1,63 (m, 2H), 2,31 (s, 2H), 3,26-3,41 (m, 2H), 3,74 (s, 2H), 4,00 (s, 2H), 4,26 (s, 2H), 5,39 (br. s., 2H), 5,93-6,10 (m, 1H), 6,85-7,01 (m, 2H), 7,27-7,40 (m, 1H) 1 4 289,19 290 9 345,16 346 1 10 343,21 H ЯМР (300 МГц, МЕТАНОЛ-d4) δ ppm 0,85 (t, J=7,3 Гц, 4H), 1,28 (d, J=7,8 Гц, 3H), 1,49 (t, J=7,3 Гц, 3H), 2,15 (s, 3H), 2,29-2,39 (m, 2H), 3,33 (t, J=7,2 Гц, 2H), 3,73 (s, 4H), 3,81-3,96 (m, 1H), 4,22-4,51 (m, 2H), 6,22 (s, 1H) 344 111 303,21 304 12 331,15 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,851,00 (m, 3H), 1,24-1,43 (m, 3H), 1,50-1,61 (m, 2H), 1,74-1,87 (m, 1H), 1,92-2,03 (m, 1H), 2,09-2,23 (m, 3H), 2,27-2,34 (m, 2H), 3,28-3,47 (m, 3H), 3,54-3,69 (m, 2H), 4,054,23 (m, 2H), 5,31-5,47 (m, 2H), 5,92-6,07 (m, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,90 (t, J=1,0 Гц, 3H), 1,21-1,38 (m, 2H), 1,45-1,58 (m, 2H), 2,33-2,43 (m, 2H), 3,23-3,32 (m, 2H), 3,75-3,89 (m, 2H), 4,31-4,46 (m, 2H), 5,67-5,83 (m, 2H), 6,31-6,47 (m, 1H), 7,087,23 (m, 1H), 7,40-7,52 (m, 1H), 7,75-7,84 (m, 1H) 332 1 13 291,21 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,84 (t, J=7,3 Гц, 3H), 0,96 (d, J=6,7 Гц, 6H), 1,26 (d, J=7,4 Гц, 2H), 1,46 (t, J=7,2 Гц, 2H), 2,25 (br. s., 2H), 2,75-2,89 (m, 1H), 3,26 (d, J=6,6 Гц, 2H), 3,62 (t, J=5,8 Гц, 2H), 4,15 (s, 2H), 5,29 (br. s., 2H), 5,82-6,04 (m, 1H) 292 1 14 332,14 H ЯМР (300 МГц, МЕТАНОЛ-d4) δ ppm 0,86 (t, J=7,3 Гц, 3H), 1,28 (m, J=7,8 Гц, 2H), 1,50 (s, 2H), 2,31-2,49 (m, 2H), 3,29-3,40 (m, 2H), 3,91 (t, J=5,8 Гц, 2H), 4,39-4,63 (m, 2H), 8,05 (d, J=1,9 Гц, 1H), 8,97 (d, J=2,1 Гц, 1H), здатні до обміну протони не показані. 333 1 15 347,15 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,92 (t, J=7,3 Гц, 3H), 1,35 (d, J=7,3 Гц, 2H), 1,55 (s, 2H), 2,36 (s, 2H), 3,34 (d, J=6,5 Гц, 2H), 3,86 (s, 2H), 4,42 (s, 2H), 5,36 (s, 2H), 5,90-6,06 (m, 1H), 6,82 (br. s., 2H), 6,97 (s, 1H) 348 12 UA 112668 C2 Таблиця I A # Структура Точна маса LC-MS (M+H) ЯМР 1 16 293,19 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,84 (t, J=1,0 Гц, 3H), 1,16-1,20 (m, 1H), 1,22-1,34 (m, 2H), 1,39-1,55 (m, 2H), 2,18-2,33 (m, 2H), 3,24 (s, 4H), 3,52-3,65 (m, 2H), 4,04 (s, 2H), 4,12 (s, 2H), 5,20-5,39 (m, 2H), 5,856,01 (m, 1H) 294 1 17 263,17 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,97 (t, J=7,3 Гц, 3H), 1,36-1,47 (m, 2H), 1,52-1,61 (m, 2H), 2,12-2,20 (m, 3H), 2,262,42 (m, 2H), 3,35-3,52 (m, 2H), 3,70 (t, J=5,8 Гц, 1H), 3,86 (t, J=5,9 Гц, 1H), 4,31 (s, 2H), 4,40-4,50 (m, 1H), 4,65 (br. s., 2H) 264 1 18 329,20 330 19 326,19 327 20 365,11 366 21 331,15 332 22 327,18 328 23 288,17 H ЯМР (300 МГц, МЕТАНОЛ-d4) δ ppm 0,86 (t, J=7,4 Гц, 3H), 1,28 (m, J=15,2, 7,4 Гц, 2H), 1,51 (m, J=7,2, 7,2 Гц, 2H), 2,322,51 (m, 2H), 3,38 (t, J=7,2 Гц, 2H), 3,73 (s, 3H), 3,91 (d, J=5,4 Гц, 2H), 4,40-4,54 (m, 1H), 4,67 (br. s., 1H), 6,96 (s, 1H), 7,14 (s, 1H), здатні до обміну протони не показані. 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,92 (t, J=7,3 Гц, 3H), 1,30-1,43 (m, 2H), 1,55 (m, J=7,1, 7,1 Гц, 2H), 2,40 (t, J=5,5 Гц, 2H), 3,35 (m, J=6,5 Гц, 2H), 3,51-3,98 (m, 2H), 4,23-4,45 (m, 2H), 5,40 (br. s., 2H), 5,94-6,14 (m, 1H), 7,42-7,52 (m, 1H), 7,60 (d, J=7,8 Гц, 1H), 7,83-8,00 (m, 1H), 8,61 (d, J=4,7 Гц, 1H) 1 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,97 (t, J=7,3 Гц, 3H), 1,40 (dq, J=14,9, 7,3 Гц, 2H), 1,51-1,67 (m, 2H), 2,44 (t, J=5,8 Гц, 2H), 3,45 (td, J=7,1, 5,6 Гц, 2H), 3,79-4,11 (m, 2H), 4,34-4,55 (m, 3H), 4,66 (br. s., 2H), 6,92 (d, J=5,2 Гц, 1H), 7,38 (d, J=5,2 Гц, 1H) 1 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,96 (t, J=7,3 Гц, 3H), 1,34-1,48 (m, 2H), 1,51-1,66 (m, 2H), 1,98 (br. s., 2H), 2,41 (t, J=5,7 Гц, 2H), 3,36-3,51 (m, 2H), 3,76-4,11 (m, 2H), 4,49 (br. s., 2H), 4,66 (br. s., 1H), 7,23 (dd, J=4,9, 1,1 Гц, 1H), 7,34 (dd, J=4,9, 3,0 Гц, 1H), 7,58 (dd, J=2,9, 1,2 Гц, 1H) 1 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,96 (t, J=7,3 Гц, 3H), 1,40 (dq, J=15,0, 7,3 Гц, 2H), 1,52-1,67 (m, 2H), 1,88 (br. s., 2H), 2,49 (q, J=6,0 Гц, 2H), 3,35-3,51 (m, 2H), 4,07 (t, J=5,9 Гц, 1H), 4,51-4,69 (m, 3H), 4,77 (br. s., 1H), 8,57 (m, J=2,2, 1,4 Гц, 1H), 8,628,70 (m, 1H), 8,96-9,05 (m, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,89 (t, J=7,3 Гц, 3H), 1,30 (dq, J=14,9, 7,3 Гц, 2H), 1,50 (quin, J=7,3 Гц, 2H), 2,26 (t, J=5,6 Гц, 1H), 2,36 (t, J=5,6 Гц, 1H), 3,24-3,33 (m, 2H), 3,57 (t, J=5,8 Гц, 1H), 3,67 (t, J=5,7 Гц, 1H), 4,11 (s, 1H), 4,13 (s, 2H), 4,19 (s, 1H), 5,76 (d, J=7,3 Гц, 2H), 6,40 (t, J=5,4 Гц, 1H) 289 13 UA 112668 C2 Таблиця I A # Структура Точна маса LC-MS (M+H) ЯМР H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,96 (t, J=7,3 Гц, 3H), 1,40 (dq, J=15,0, 7,2 Гц, 2H), 1,59 (quin, J=7,3 Гц, 2H), 1,85 (br. s., 2H), 2,34 (t, J=5,9 Гц, 1H), 2,41 (t, J=5,8 Гц, 1H), 3,20-3,37 (m, 2H), 3,45 (td, J=7,0, 5,7 Гц, 2H), 3,73 (t, J=5,8 Гц, 1H), 3,91 (t, J=5,9 Гц, 1H), 4,31 (s, 1H), 4,58-4,81 (m, 2H) 1 24 331,16 332 Таблица I B # Структура Точна маса LC-MS (M+H) ЯМР 1 1 303,21 304 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,94 (t, J=1,0 Гц, 3H), 1,29-1,43 (m, 2H), 1,51-1,64 (m, 2H), 1,73-1,84 (m, 1H), 1,90-2,02 (m, 1H), 2,082,29 (m, 4H), 2,39-2,47 (m, 1H), 3,19-3,25 (m, 1H), 3,29-3,48 (m, 3H), 3,52-3,63 (m, 2H), 4,054,27 (m, 2H), 5,33-5,49 (m, 2H), 6,03-6,23 (m, 1H) 1 5 263,17 264 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,900,98 (m, 3H), 1,39 (dq, J=14,9, 7,3 Гц, 2H), 1,501,65 (m, 2H), 2,19 (s, 3H), 2,69 (t, J=5,8 Гц, 2H), 3,43 (td, J=7,1, 5,6 Гц, 2H), 3,68 (t, J=5,9 Гц, 2H), 4,29 (s, 2H), 4,46-4,57 (m, 1H), 4,67-4,85 (m, 2H) 1 6 345,16 346 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,90 (m, J=6,6 Гц, 3H), 1,18-1,37 (m, 2H), 1,44-1,59 (m, 2 H), 2,32-2,40 (m, 2H), 3,21-3,29 (m, 2H), 3,613,76 (m, 2H), 4,03 (s, 2H), 4,16-4,34 (m, 2H), 5,61-5,78 (m, 2H), 6,24-6,45 (m, 1H), 6,85-7,03 (m, 2H), 7,30-7,46 (m, 1H) 1 7 291,21 292 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,75 (t, J=7,4 Гц, 3H), 0,87 (d, J=6,7 Гц, 6H), 1,19 (s, 2H), 1,38 (s, 2H), 2,24-2,30 (m, 2H), 2,74-2,77 (m, 1H), 3,18 (d, J=6,6 Гц, 2H), 3,50 (s, 2H), 4,06 (s, 2H), 5,18 (br. s., 2H), 5,86-6,02 (m, 1H) 1 8 277,19 278 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,96 (td, J=7,3, 3,6 Гц, 3H), 1,07 (t, J=7,4 Гц, 3H), 1,37 (s, 2H), 1,56 (br. s., 2H), 2,45 (dd, J=7,4, 3,0 Гц, 3H), 2,50-2,54 (m, 1H), 3,29-3,34 (m, 2H), 3,68 (d, J=8,0 Гц, 2H), 4,23 (d, J=7,6 Гц, 2H), 4,31-4,31 (m, 0H), 5,80 (d, J=8,2 Гц, 2H), 6,34-6,57 (m, 1H) 14 UA 112668 C2 Таблиця I C Структура # То чна маса LC -MS (M+H) ЯМР 1 32 0,2 32 1 2 5 29 2,2 29 3 2 6 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,68-1,01 (m, 7H), 1,32 (dq, J=14,9, 7,3 Гц, 2H), 1,43-1,62 (m, 6H), 1,76 (dd, J=12,5, 6,3 Гц, 1H), 2,26 (td, J=14,2, 6,1 Гц, 2H), 3,36 (q, J=6,6 Гц, 2H), 3,42 (s, 1H), 3,49 (d, J=5,2 Гц, 1H), 3,66 (br. s., 1H), 3,71-3,95 (m, 1H), 4,17-4,30 (m, 1H), 4,32-4,46 (m, 1H), 4,53 (br. s., 2H) 1 H ЯМР (300 МГц, ХЛОРОФОРМ-d) δ ppm 0,89 (t, J=7,3 Гц, 3H), 1,08-1,25 (m, 3H), 1,32 (dq, J=14,9, 7,3 Гц, 2H), 1,44-1,65 (m, 6H), 2,24 (t, J=5,6 Гц, 1H), 3,31-3,40 (m, 2H), 3,42 (s, 1H), 3,71-3,91 (m, 2H), 4,25 (d, J=8,2 Гц, 1H), 4,31-4,46 (m, 1H), 4,53 (br. s., 2H) 1 33 3,1 33 4 2 7 32 2 6,2 32 7 8 33 3,2 33 4 2 9 27 3 7,2 27 8 0 3 1 33 3,2 33 4 15 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,90 (t, J=7,3 Гц, 3H), 1,31 (dq, J=14,9, 7,3 Гц, 2H), 1,51 (quin, J=7,3 Гц, 2H), 2,42 (t, J=5,2 Гц, 2H), 3,18-3,28 (m, 2H), 3,75 (t, J=5,4 Гц, 1H), 3,96 (t, J=5,4 Гц, 1H), 4,29-4,60 (m, 2H), 5,656,00 (m, 2H), 6,33-6,66 (m, 1H), 9,529,70 (m, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,93 (t, J=7,3 Гц, 3H), 1,20-1,43 (m, 5H), 1,48-1,62 (m, 2H), 2,38 (br. s., 2H), 3,35 (q, J=6,5 Гц, 1H), 3,51-3,80 (m, 1H), 4,24 (br. s., 1H), 5,40 (br. s., 2H), 6,04 (br. s., 1H), 7,39 (d, J=5,8 Гц, 2H), 8,69 (d, J=5,8 Гц, 2H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,92 (t, J=7,3 Гц, 3H), 1,19-1,44 (m, 3H), 1,47-1,77 (m, 6H), 2,33 (t, J=5,8 Гц, 2H), 2,94 (t, J=4,3 Гц, 2H), 3,283,38 (m, 2H), 3,44 (td, J=11,4, 2,4 Гц, 2H), 3,72 (t, J=5,9 Гц, 2H), 3,80-3,93 (m, 2H), 5,38 (br. s., 2H), 6,00 (br. s., 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,90 (t, J=7,3 Гц, 3H), 1,00 (q, J=7,7 Гц, 3H), 1,19-1,38 (m, 2H), 1,50 (quin, J=7,3 Гц, 2H), 2,23 (t, J=5,5 Гц, 1H), 2,27-2,45 (m, 3H), 3,27 (br. s., 2H), 3,56-3,73 (m, 2H), 4,18 (s, 2H), 5,71 (br. s., 2H), 6,16-6,42 (m, 1H) дані недоступні UA 112668 C2 Таблиця I C Структура # То чна маса LC -MS (M+H) ЯМР 1 28 3 8,2 3 1,1 28 9 2 33 33 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,93 (t, J=7,3 Гц, 3H), 1,20-1,43 (m, 4H), 1,56 (quin, J=7,3 Гц, 2H), 3,36 (q, J=6,2 Гц, 2H), 3,63 (br. s., 2H), 4,00 (s, 2H), 4,21 (br. s., 2H), 5,44 (br. s., 2H), 6,16 (br. s., 1H) дані недоступні 2 3 1 33 3 0,2 33 1 4 31 3 6,2 31 7 5 31 3 6,2 31 7 6 37 6,2 37 7 3 7 33 3 0,2 33 1 8 16 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,83-0,98 (m, 3H), 1,22-1,43 (m, 2H), 1,48-1,65 (m, 2H), 2,48 (s, 3H), 3,023,07 (m, 2H), 3,25-3,55 (m, 2H), 3,643,96 (m, 2H), 4,39 (br. s., 2H), 5,42 (br. s., 2H), 5,91-6,34 (m, 1H), 6,36-6,49 (m, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,93 (s, 3H), 1,25-1,46 (m, 2H), 1,491,64 (m, 2H), 2,53-2,61 (m, 2H), 3,283,44 (m, 2H), 3,86-4,03 (m, 2H), 4,304,51 (m, 2H), 5,27-5,52 (m, 2H), 6,026,25 (m, 1H), 8,39-8,44 (m, 1H), 8,468,50 (m, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,94 (t, J=7,4 Гц, 3H), 1,37 (d, J=7,6 Гц, 2H), 1,57 (s, 2H), 2,43 (s, 2H), 3,37 (d, J=6,6 Гц, 2H), 3,98 (br. s., 2H), 4,52 (br. s., 2H), 5,42 (br. s., 2H), 5,97-6,14 (m, 1H), 8,44 (s, 1H), 8,50 (s, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,82 (d, J=7,4 Гц, 3H), 1,11-1,31 (m, 2H), 1,34-1,55 (m, 2H), 2,07-2,17 (m, 1H), 3,16-3,21 (m, 2H), 3,69-3,78 (m, 1H), 3,87-4,01 (m, 1H), 4,47 (s, 2H), 5,43-5,58 (m, 1H), 5,69-5,80 (m, 2H), 6,11-6,26 (m, 1H), 7,54-7,69 (m, 1H), 7,71-7,91 (m, 1H), 7,72-7,82 (m, 1H), 7,84-7,91 (m, 1H), 7,97-8,06 (m, 1H), 8,37-8,53 (m, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,92 (t, J=7,3 Гц, 3H), 1,24-1,43 (m, 2H), 1,55 (t, J=7,3 Гц, 2H), 2,40 (t, J=5,8 Гц, 2H), 2,48 (s, 3H), 3,35 (d, J=6,6 Гц, 2H), 3,84 (br. s., 2H), 4,38 (s, 2H), 5,42 (br. s., 2H), 5,95-6,19 (m, 1H), 6,42 (s, 1H) UA 112668 C2 Таблиця I C Структура # То чна маса LC -MS (M+H) ЯМР 1 36 3 9,2 37 0 9 37 6,2 37 7 4 0 35 9,2 36 0 4 1 39 0,2 39 1 4 2 37 3,2 37 4 4 3 40 4,2 40 5 4 4 17 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,75-0,96 (m, 3H), 1,14-1,39 (m, 3H), 1,43-1,79 (m, 5H), 3,38-3,51 (m, 2H), 3,55-3,73 (m, 2H), 3,99-4,16 (m, 1H), 4,21-4,39 (m, 3H), 5,32-5,49 (m, 2H), 5,68-5,83 (m, 1H), 7,27-7,59 (m, 5H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,91 (t, J=7,3 Гц, 3H), 1,23-1,42 (m, 2H), 1,54 (d, J=6,7 Гц, 2H), 1,66-1,76 (m, 2H), 2,57 (t, J=5,8 Гц, 2H), 3,49 (br. s., 2H), 3,86 (d, J=5,9 Гц, 1H), 4,044,19 (m, 1H), 4,22-4,37 (m, 1H), 4,44 (s, 2H), 5,43 (br. s., 2H), 5,70 (s, 1H), 5,755,91 (m, 1H), 8,13 (d, J=1,9 Гц, 1H), 9,15 (d, J=1,8 Гц, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,92 (t, J=7,3 Гц, 3H), 1,17-1,41 (m, 2H), 1,57 (dt, J=14,2, 7,0 Гц, 2H), 1,661,82 (m, 2H), 2,60 (t, J=5,8 Гц, 2H), 3,24 (br. s., 1H), 3,51 (br. s., 2H), 3,89 (t, J=5,9 Гц, 2H), 4,13 (br. s., 1H), 4,43 (s, 2H), 5,43 (s, 2H), 5,84 (d, J=8,4 Гц, 1H), 6,64 (dd, J=3,2, 1,5 Гц, 1H), 7,04 (d, J=3,4 Гц, 1H), 7,71-7,91 (m, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,89 (t, J=7,3 Гц, 3H), 1,12 (t, J=7,0 Гц, 1H), 1,24-1,40 (m, 2H), 1,44-1,61 (m, 2H), 1,62-1,78 (m, 2H), 2,54-2,58 (m, 2H), 2,71 (s, 3H), 3,36-3,53 (m, 2H), 3,85 (q, J=6,7 Гц, 1H), 4,11 (br. s., 1H), 4,20-4,35 (m, 1H), 4,44 (s, 2H), 5,40 (br. s., 2H), 5,78 (d, J=6,7 Гц, 1H), 7,87 (s, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,85 (t, J=6,5 Гц, 3H), 1,25 (d, J=4,1 Гц, 4H), 1,43-1,77 (m, 4H), 2,57 (br. s., 2H), 3,40 (q, J=6,2 Гц, 2H), 3,74-3,98 (m, 2H), 4,15-4,30 (m, 1H), 4,32-4,49 (m, 3H), 5,80 (br. s, 2H), 6,17 (br. s., 1H), 6,66 (dd, J=3,4, 1,8 Гц, 1H), 7,08 (d, J=3,3 Гц, 1H), 7,86 (d, J=1,0 Гц, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,88 (t, J=6,2 Гц, 3H), 1,31 (br. s., 4H), 1,46-1,62 (m, 2H), 1,69 (dt, J=13,2, 6,6 Гц, 2H), 2,53-2,59 (m, 2H), 2,71 (s, 3H), 3,48 (br. s., 2H), 3,85 (dq, J=13,1, 6,8 Гц, 2H), 4,11 (br. s., 1H), 4,19-4,34 (m, 1H), 4,44 (s, 2H), 5,41 (br. s., 2H), 5,79 (d, J=6,7 Гц, 1H), 7,87 (s, 1H) UA 112668 C2 Таблиця I C Структура # То чна маса LC -MS (M+H) ЯМР 1 38 9,2 39 0 4 5 39 0,2 39 1 4 6 37 5,2 37 6 4 7 38 4 3,2 38 4 8 37 2,2 37 3 4 9 38 6,2 38 7 5 0 18 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,87 (t, J=6,4 Гц, 3H), 1,29 (d, J=3,3 Гц, 4H), 1,45-1,60 (m, 2H), 1,63-1,79 (m, 2H), 2,58 (t, J=5,8 Гц, 2H), 3,47 (d, J=4,8 Гц, 2H), 3,84 (q, J=6,6 Гц, 2H), 4,11 (br. s., 1H), 4,19-4,34 (m, 1H), 4,42 (s, 2H), 5,41 (s, 2H), 5,81 (d, J=8,4 Гц, 1H), 7,14 (t, J=4,3 Гц, 1H), 7,48 (d, J=3,6 Гц, 1H), 7,72 (d, J=4,9 Гц, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,80 (t, J=6,8 Гц, 3H), 1,11-1,30 (m, 3H), 1,48 (br. s., 2H), 1,56-1,69 (m, 2H), 2,48 (t, J=6,0 Гц, 2H), 3,13 (d, J=5,1 Гц, 1H), 3,39 (d, J=5,1 Гц, 2H), 3,76 (d, J=6,3 Гц, 2H), 3,93-4,06 (m, 1H), 4,094,24 (m, 1H), 4,34 (s, 2H), 5,32 (br. s., 2H), 5,64-5,80 (m, 1H), 8,03 (d, J=2,1 Гц, 1H), 9,05 (d, J=1,9 Гц, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,76-0,99 (m, 3H), 1,16-1,23 (m, 1H), 1,27-1,39 (m, 2H), 1,44-1,61 (m, 2H), 1,65-1,81 (m, 2H), 2,55-2,62 (m, 2H), 3,18-3,28 (m, 2H), 3,41-3,53 (m, 1H), 3,79-3,92 (m, 2H), 4,40-4,47 (m, 2H), 5,34-5,50 (m, 2H), 5,81-5,89 (m, 1H), 7,10-7,25 (m, 1H), 7,41-7,54 (m, 1H), 7,68-7,79 (m, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,87 (t, J=6,7 Гц, 3H), 1,29 (br. s., 4H), 1,54 (br. s., 2H), 1,67 (s, 2H), 2,53 (br. s., 2H), 3,46 (br. s., 2H), 3,53-3,77 (m, 2H), 4,00-4,14 (m, 1H), 4,20-4,28 (m, 1H), 4,32 (s, 2H), 5,40 (br. s., 2H), 5,675,86 (m, 1H), 7,27-7,53 (m, 5H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,70-0,83 (m, 3H), 1,09-1,29 (m, 3H), 1,32-1,71 (m, 4H), 2,26-2,37 (m, 2H), 3,32-3,40 (m, 2H), 3,56-3,64 (m, 3H), 3,71-3,82 (m, 2H), 4,10-4,22 (m, 1H), 4,26-4,32 (m, 2H), 4,33-4,45 (m, 1H), 5,61-5,74 (m, 1H), 5,84-5,94 (m, 1H), 5,96-6,04 (m, 1H), 6,27-6,36 (m, 1H), 6,81-6,88 (m, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,77-0,92 (m, 3H), 1,13-1,36 (m, 4H), 1,39-1,74 (m, 4H), 2,32-2,43 (m, 2H), 3,38-3,47 (m, 2H), 3,63-3,71 (m, 3H), 3,77-3,90 (m, 2H), 4,17-4,26 (m, 1H), 4,32-4,38 (m, 2H), 4,39-4,45 (m, 1H), 5,65-5,76 (m, 2H), 5,91-6,01 (m, 1H), 6,02-6,10 (m, 1H), 6,34-6,43 (m, 1H), 6,89-6,95 (m, 1H) UA 112668 C2 Таблиця I C Структура # То чна маса LC -MS (M+H) ЯМР 1 38 6,2 38 7 5 1 37 0,2 37 1 5 2 5 10 15 20 25 30 35 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,68 (t, J=6,5 Гц, 3H), 1,10 (d, J=3,3 Гц, 4H), 1,27-1,40 (m, 2H), 1,49 (dt, J=13,2, 6,6 Гц, 2), 2,33-2,39 (m, 2H), 3,28 (t, J=6,2 Гц, 2H), 3,50 (s, 3H), 3,54-3,73 (m, 2H), 3,84-3,97 (m, 1H), 4,07 (d, J=7,6 Гц, 1H), 4,18 (s, 2H), 5,28 (br. s., 2 H), 5,66 (d, J=8,4 Гц, 1 H), 5,81-5,91 (m, 1H), 6,17 (dd, J=3,7, 1,5 Гц, 1H), 6,67 (d, J=1,6 Гц, 1H) 1 H ЯМР (300 МГц, DMSO-d6) δ ppm 0,80-1,01 (m, 3H), 1,16-1,39 (m, 3H), 1,44-1,78 (m, 3H), 2,26-2,46 (m, 2H), 3,43-3,56 (m, 2H), 3,86-3,98 (m, 1H), 4,06-4,13 (m, 1H), 4,22-4,34 (m, 1H), 4,38-4,49 (m, 2H), 5,64-5,73 (m, 1H), 5,80-5,89 (m, 2H), 5,93-6,15 (m, 1H), 7,40-7,58 (m, 2H), 8,69-8,81 (m, 2H) Аналітичні методи Всі сполуки досліджували за допомогою LC-MS. Застосовували наступні методи LC-MS: Всі аналізи проводили із застосуванням квадрупольного LC/MSD серій Agilent 1100, з'єднаного з системою для рідинної хроматографії (LC) серій Agilent 1100, що складається з насоса для двокомпонентних сумішей з дегазатором, автоматичного пробовідбирача, термостатованої колонки, детектора на діодній матриці. Мас-спектрометр (MS) застосовували з джерелом іонізації електростатичним розпиленням при атмосферному тиску (API-ES). Напругу на капілярі установлювали на 3000 В, напругу фрагментора до 70 В і температуру квадруполя підтримували при 100 °C. Значення потоку і температури сушильного газу складали 12,0 л/хв. і 350 °C, відповідно. Азот застосовували в якості газу-розпилювача при тиску 35 фунтів/кв. дюйм зб. Збір даних проводили за допомогою програмного забезпечення Agilent Chemstation. Аналізи здійснювали на колонці YMC pack ODS-AQ C18 (50 мм x 4,6 мм; розмір частинок 3 мкм) при 35 °C зі швидкістю потоку 2,6 мл/хв. Градієнтне елюювання проводили від 95 % (вода + 0,1 % мурашина кислота)/5 % ацетонітрил до 5 % (вода + 0,1 % мурашина кислота)/95 % ацетонітрил за 4,80 хвилини, кінцеву композицію рухливої фази утримували додатково протягом 1,00 хв. Стандартний об'єм проби, що вводиться, складав 2 мкл. Діапазони вимірювань установлювали на 190-400 нм для UV-PDA-детектора і 100-1400 маса/заряд для MS-детектора. ЯМР-аналіз виконували із застосуванням спектрометра BRUKER Avance III з магнітом 300МГц Ultrashield. Опис аналізів біологічної активності Оцінка активності TLR7 і TLR8 Здатність сполук активувати TLR7 та/або TLR8 людини оцінювали в аналізі репортерного гена з використанням клітин HEK293, тимчасово трансфікованих вектором експресії TLR7 або TLR8 і репортерним конструктом NFB-люцифераза. В одному прикладі при експресованому конструкті TLR експресується відповідна послідовність дикого типу або мутантна послідовність, яка містить делецію в другому багатому лейцином повторі TLR. Як зазначалося раніше, такі мутантні білки TLR більше схильні до активації агоністом (документ США 7498409). Стисло, клітини HEK293 вирощували в культуральному середовищі (DMEM, збагачене 10 % FCS і 2 мМ глутаміну). Для трансфекції клітин в 10 см чашках клітини відшаровували трипсином-EDTA, трансфікували сумішшю CMV-TLR7 або плазміди TLR8 (750 нг), плазміди NFκB-люциферази (375 нг) і трансфекційного реагенту і інкубували 24 години при 37 °C в зволоженій атмосфері 5 % CO2. Далі трансфіковані клітини відшаровували трипсином-EDTA, 5 промивали в PBS і ресуспендували в середовищі до щільності 1,67 × 10 клітин/мл. Тридцять мікролітрів клітин потім розподіляли в кожну лунку в 384-лункових планшетах, де вже містилося 10 мкл сполуки в 4 % DMSO. Після 6 годин інкубації при 37 °C, 5 % CO2 визначали 19 UA 112668 C2 5 10 15 люциферазну активність шляхом додавання 15 мкл субстрату Steady Lite Plus (Perkin Elmer) в кожну лунку і зчитували показання, отримані на пристрої для зчитування мікропланшетів ViewLux ultraHTS (Perkin Elmer). Криві залежності доза-ефект були створені виходячи з вимірювань, виконаних в чотирьох повторах. Для кожної сполуки визначали значення найнижчих ефективних концентрацій (LEC), визначених як концентрація, яка викликає ефект, який щонайменше в два рази вище припустимого відхилення аналізу. Токсичність сполуки визначали в паралелях з використанням однакових серій розведення сполуки - 30 мкл на лунку з клітинами, трансфікованими тільки конструктом CMV-TLR7 (1,67 × 5 10 клітин/мл), в 384-лункових планшетах. Життєздатність клітин вимірювали після 6 годин інкубування при 37 °C, 5 % CO2 шляхом додавання 15 мкл ATP lite (Perkin Elmer) на лунку і зчитування показань пристроєм для зчитування мікропланшетів ViewLux ultraHTS (Perkin Elmer). Дані зазначали як CC50. Біологічна активність сполук формули (I). Всі сполуки показали CC50 >24 мкM у TOX-аналізі НЕК293, описаному вище. Таблиця 2. Біологічна активність сполук формули (I) 2 В таблиці II A представлені сполуки, де A=NCOR , тоді як в таблиці II B представлені 4 сполуки, де B=NCOR , а таблиця II C містить обидві сполуки з позиційною ізомерією. 20 UA 112668 C2 21 UA 112668 C2 22 UA 112668 C2 Таблиця II B TLR7 людини (LEC, мкM) TLR8 людини (LEC, мкM) 1 0,83 0,32 5 4,90 0,50 # Структура 23 UA 112668 C2 Таблиця II B TLR7 людини (LEC, мкM) TLR8 людини (LEC, мкM) 6 3,45 0,88 7 8,13 1,62 8 2,34 0,40 Структура # Таблиця II C TLR7 людини (LEC, мкM) TLR8 людини (LEC, мкM) PBMC-IFNa (LEC, мкM) 20,0 1,8 1,1 16,8 2,1 0,6 >25 1,9 1,2 8,6 2,2 1,9 >25 7,5 8,7 5,0 0,5 0,5 7,7 0,6 1,3 7,1 0,6 0,9 0,3 0,2 0,2 0,8 0,4 0,2 0,7 0,2 0,2 4,7 0,9 0,6 7,2 # 1,7 1,8 5,2 0,8 0,6 25 26 27 28 29 30 31 32 33 34 35 36 37 38 24 UA 112668 C2 Таблиця II C TLR7 людини (LEC, мкM) TLR8 людини (LEC, мкM) PBMC-IFNa (LEC, мкM) 2,5 4,2 0,5 2,2 4,5 0,2 0,4 0,4 0,1 2,2 2,1 0,2 0,1 0,7 0,04 1,0 6,6 0,2 0,2 1,7 0,2 0,6 3,5 0,2 0,2 1,1 0,2 1,2 3,9 0,3 2,7 4,0 0,3 1,7 3,9 0,3 0,5 0,4 0,1 12,1 # 15 NA 39 40 41 42 43 44 45 46 47 48 49 50 51 52 ФОРМУЛА ВИНАХОДУ 1. Сполука формули (І) 5 R 1 N X N H2N 10 15 20 H N B A (I) або її фармацевтично прийнятна сіль, де 2 А вибраний з групи, що складається з СН2 і NCOR в будь-якій стереохімічній конфігурації, 4 В вибраний з групи, що складається з СН2 і NCOR в будь-якій стереохімічній конфігурації, 2 4 за умови, що, якщо А являє собою NCOR , тоді В не являє собою NCOR , X вибраний з СН2 в будь-якій стереохімічній конфігурації, 1 R вибраний з С4-8алкілу, необов'язково заміщеного гідроксилом, 2 R вибраний з заміщеного і незаміщеного С 1-6алкілу, С3-7циклоалкілу, гетероциклу, арилу, гетероарилу, гетероарилалкілу, кожний з яких необов'язково заміщений одним або декількома замісниками, незалежно вибраними з галогену, С1-6алкілу або нітрилу, 4 R вибраний з заміщеного або незаміщеного С1-7алкілу, алкоксі(С1-4)алкілу, арилу або С3-7циклоалкілу, кожний з яких необов'язково заміщений нітрилом, і де 25 UA 112668 C2 5 10 термін "арил" означає ароматичну кільцеву структуру, яка містить 4, 5, 6 або 7 кільцевих атомів і необов’язково містить один або два гетероатоми, що вибрані з N, O і S; термін "гетероарил" означає арил, що містить 1 гетероатом, що вибирають з N, O і S, включаючи тіазоліл, тіадіазол, імідазоліл, ізоксазоліл, фурил, оксазоліл, піроліл, піридоніл, піридил, піридазиніл або піразиніл; термін "гетероцикл" означає тетрагідрофуран, азетидин, морфолін, піперидин, піперазин і піролідин. 1 2. Сполука формули (І) за п. 1, де R являє собою бутил, і де А, В та X визначені в п. 1. 1 3. Сполука формули (І) за п. 1, де R являє собою С4-8алкіл, заміщений гідроксилом, і де А, В та X визначені в п. 1. 1 4. Сполука формули (І) за п. 3, де R являє собою один з наступних: OH HO (S) (S) , , OH HO (S) (S) , . 15 20 5. Сполука формули (І) за п. 1, де X являє собою CН2, і де А та В визначені в п. 1. 6. Сполука формули (І) за п. 1, де X являє собою СН2, і де А являє собою СН2, а В визначений в п. 1. 2 7. Сполука формули (1) за п. 1, де R являє собою один з наступних фрагментів, який може бути додатково заміщений С1-3алкілом і/або нітрилом: N S N N N N , 25 30 35 , , , . 8. Фармацевтична композиція, що містить сполуку формули (І) або її фармацевтично прийнятну сіль за одним з пп. 1-7 разом з одним або декількома фармацевтично прийнятними наповнювачами, розріджувачами або носіями. 9. Фармацевтична композиція за п. 8, в якій фармацевтично прийнятні наповнювачі являють собою розріджувачі. 10. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за одним з пп. 1-7 для одержання лікарського засобу для лікування порушення, в яке залучена модуляція толл-подібних рецепторів (TLR). 11. Застосування фармацевтичної композиції за п. 8 або 9 для одержання лікарського засобу для лікування порушення, в яке залучена модуляція толл-подібних рецепторів (TLR). 12. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за одним з пп. 1-7 для одержання лікарського засобу для лікування порушення, в яке залучена модуляція TLR7 і/або TLR8. 13. Застосування фармацевтичної композиції за п. 8 або 9 для одержання лікарського засобу для лікування порушення, в яке залучена модуляція TLR7 та/або TLR8. 40 26 UA 112668 C2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 27
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperidino-pyrimidine derivatives for the treatment of viral infections
Автори англійськоюMc Gowan, David Craig, Raboisson, Pierre Jean-Marie Bernard, Jonckers, Tim Hugo Maria, Daoubi Khamlichi, Mourad
Автори російськоюМакГован Дэвид Крэйг, Рабуассон Пьер Жан-Мари Бернар, Йонкерс Тим Хьюго Мария, Дауби Хамличи Мурад
МПК / Мітки
МПК: A61K 31/519, C07D 471/04
Мітки: інфекцій, вірусних, похідні, лікування, піперидинопіримідину
Код посилання
<a href="https://ua.patents.su/29-112668-pokhidni-piperidinopirimidinu-dlya-likuvannya-virusnikh-infekcijj.html" target="_blank" rel="follow" title="База патентів України">Похідні піперидинопіримідину для лікування вірусних інфекцій</a>
Попередній патент: Комбінація антагоніста crth2 і інгібітору протонного насоса для лікування еозинофільного езофагіту
Наступний патент: Олійна дисперсія, що має самостійну консервуючу дію
Випадковий патент: Спосіб пролонгованої санації порожнини ехінококових кіст печінки після інтраабдомінальної пункції та дренування












