Фармацевтична композиція бендамустину, призначена для ліофілізації
Формула / Реферат
1. Спосіб виробництва ліофілізованого препарату бендамустину, який відрізняється тим, що регулюють концентрацію продуктів розкладання бендамустину в кінцевому продукті так, що при вивільненні концентрація продуктів розкладання бендамустину складає менше 4,0 % (процент площі піка бендамустину) і концентрація НР1 складає менше 0,5 % (процент площі піка бендамустину).
2. Спосіб виробництва ліофілізованого препарату бендамустину, який відрізняється тим, що регулюють концентрацію продуктів розкладання бендамустину в кінцевому продукті так, що концентрація НР1 при вивільненні складає менше 0,9 % (процент площі піка бендамустину) і концентрація продуктів розкладання бендамустину складає менше 7,0 % під час закінчення терміну зберігання продукту, де вказаний продукт зберігають при 5 °С.
3. Спосіб виробництва ліофілізованого препарату бендамустину за п. 2, який включає регулювання концентрації продуктів розкладання бендамустину в кінцевому продукті так, що концентрація НР1 при вивільненні складає менше 0,5 % (процент площі піка бендамустину) і концентрація продуктів розкладання бендамустину складає менше 7,0 % під час закінчення терміну зберігання продукту, де вказаний продукт зберігають при 5 °С.
4. Преліофілізаційний розчин або дисперсія бендамустину, що містить один або декілька органічних розчинників, де вказаний розчин або дисперсія містить щонайменше один органічний розчинник в стабілізуючій концентрації, який знижує рівень розкладання бендамустину так, що кількість НР1, який утворюється під час ліофілізації протягом від приблизно 0 до 24 годин, не перевищує 0,9 % (процент площі піка бендамустину).
5. Преліофілізаційний розчин або дисперсія бендамустину за п. 4, що містить один або декілька органічних розчинників, де вказаний розчин або дисперсія включає щонайменше один органічний розчинник в стабілізуючій концентрації, який знижує рівень розкладання бендамустину так, що кількість НР1, який утворюється під час ліофілізації протягом від приблизно 0 до 24 годин, не перевищує 0,5 % (процент площі піка бендамустину).
6. Ліофілізований порошок, одержаний з преліофілізаційного розчину або дисперсії за п. 4.
7. Спосіб одержання ліофілізованого препарату бендамустину, який включає:
a) розчинення бендамустину в розчині зі стабілізуючою концентрацією спирту, що містить від приблизно 5 % до приблизно 100 % (об'ємн.) спирту, для одержання преліофілізаційного розчину; і
b) ліофілізацію преліофілізаційного розчину;
де вказаний ліофілізований препарат бендамустину містить не більше ніж приблизно 0,9% (процент площі піка бендамустину) НР1, представленого формулою (II)
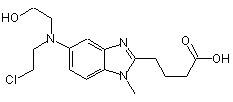 ,
,
Формула (II)
де вказана кількість НР1 являє собою кількість НР1, яка є при вивільненні.
8. Спосіб одержання ліофілізованого препарату бендамустину за п. 7, який включає:
a) розчинення бендамустину в розчині зі стабілізуючою концентрацією спирту, що містить від приблизно 5 % до приблизно 100 % (об'ємн.) спирту, для одержання преліофілізаційного розчину; і
b) ліофілізацію преліофілізаційного розчину;
де вказаний ліофілізований препарат бендамустину містить не більше ніж приблизно 0,5 % (процент площі піка бендамустину) НР1, представленого формулою (II), де вказана кількість НР1 являє собою кількість НР1, який є при вивільненні.
9. Спосіб за п. 7, де концентрація спирту складає від приблизно 5 % до приблизно 99,9 %.
10. Спосіб за п. 7, де вказаний спирт вибраний з одного або декількох спиртів з числа метанолу, етанолу, пропанолу, ізопропанолу, бутанолу і трет-бутанолу.
11. Спосіб за п. 10, де вказаний спирт є трет-бутанолом.
12. Спосіб за п. 11, де вказаний трет-бутанол присутній в концентрації приблизно від 20 % до 30 %.
13. Спосіб за п. 11, де вказаний трет-бутанол присутній в концентрації приблизно 30 %.
14. Спосіб за п. 7, в якому перед ліофілізацією додають наповнювач.
15. Спосіб за п. 14, в якому наповнювач являє собою маніт.
16. Спосіб за п. 7, де концентрація бендамустину складає приблизно від 2 до 50 мг/мл.
17. Спосіб за п. 7, де стадія b) включає:
і) заморожування преліофілізаційного розчину до температури нижче приблизно -40 °С для утворення замороженого розчину;
іі) витримування замороженого розчину при температурі нижче -40 °С протягом щонайменше 2 годин;
ііі) підвищення температури замороженого розчину до температури первинного висушування приблизно від -40 °С до -10 °С для утворення висушеного розчину;
iv) витримування протягом приблизно від 10 до 70 годин;
v) підвищення температури висушеного розчину до температури вторинного висушування приблизно від 25 °С до 40 °С; і
vi) витримування від приблизно 5 до приблизно 40 годин для одержання ліофілізованого препарату бендамустину.
18. Спосіб за п. 17, де вказаний спирт являє собою трет-бутанол.
19. Спосіб за п. 18, де вказаний трет-бутанол присутній в концентрації приблизно від 20 % до 30 %.
20. Спосіб за п. 19, де вказаний трет-бутанол присутній в концентрації приблизно 30 %.
21. Спосіб за п. 7, в якому стадія b) включає:
і) заморожування преліофілізаційного розчину до приблизно -50 °С для утворення замороженого розчину;
іі) витримування замороженого розчину при приблизно -50 °С протягом щонайменше від 2 годин до приблизно 4 годин;
ііі) підвищення температури до температури первинного висушування від приблизно -20 °С до приблизно -12 °С для одержання висушеного розчину;
iv) витримування при температурі первинного висушування протягом від приблизно 10 до приблизно 48 годин;
v) підвищення температури висушеного розчину до температури вторинного висушування від приблизно 25 °С до приблизно 40 °С; і
vi) витримування при температурі вторинного висушування протягом щонайменше від 5 годин до приблизно 20 годин.
22. Спосіб за п. 21, де вказаний спирт являє собою трет-бутанол.
23. Спосіб за п. 22, де вказаний трет-бутанол присутній в концентрації приблизно від 20 % до 30 %.
24. Спосіб за п. 23, де вказаний трет-бутанол присутній в концентрації приблизно 30 %.
25. Спосіб за п. 7, де стадія b) включає:
і) початок стадії при температурі полиці приблизно 5 °С для завантаження;
іі) заморожування до приблизно -50 °С протягом приблизно 8 годин;
ііі) витримування при -50 °С протягом приблизно 4 годин;
iv) підвищення температури до приблизно -20 °С протягом приблизно 3 годин;
v) витримування при температурі приблизно -20 °С протягом 6 годин; підвищення температури до приблизно -15 °С протягом приблизно 1 години;
vi) витримування при -15 °С протягом приблизно 20 годин;
vii) підвищення температури до приблизно -15 °С протягом приблизно 1 години;
viii) витримування при приблизно -15 °С протягом приблизно 20 годин;
іх) підвищення температури до приблизно -12 °С протягом приблизно 0,5 години;
х) витримування при приблизно -12 °С протягом приблизно 15,5 годин;
хі) підвищення температури до приблизно 25-40 °С або більш високої протягом приблизно 15 годин;
хіі) витримування при температурі приблизно 25-40 °С протягом приблизно 10 годин;
хііі) підвищення до температури приблизно 40 °С протягом приблизно 1 години; і
xiv) витримування при температурі приблизно 40 °С протягом приблизно 5 годин; вивантаження продукту при приблизно 5 °С і тиску приблизно 13,5 футів/кв. дюйм в фармацевтично прийнятний контейнер, який герметично запечатують; де тиск під час первинного висушування становить приблизно 150 мкм рт.ст. і 50 мкм рт.ст. під час вторинного висушування.
26. Спосіб за п. 25, де стадія (хі) являє собою підвищення температури до приблизно 30-35 °С протягом приблизно 15 годин.
27. Ліофілізований порошок, одержаний згідно з способом за п. 25 або 26.
28. Склад для ліофілізації, який включає бендамустин в концентрації приблизно 15 мг/мл, маніт в концентрації приблизно 25,5 мг/мл, трет-бутиловий спирт в концентрації приблизно 30 % (об'ємн.) і воду.
29. Преліофілізована фармацевтична композиція бендамустину, яка містить приблизно 15 мг/мл гідрохлориду бендамустину, приблизно 25,5 мг/мл маніту, приблизно 30 % (об'ємн.) трет-бутилового спирту, а також воду.
30. Спосіб за п. 10, де вказаний спирт є етанолом.
31. Спосіб за п. 30, де вказаний етанол присутній у концентрації приблизно від 20 % до 30 %.
32. Спосіб за п. 30, де вказаний етанол присутній у концентрації приблизно 30 %.
33. Спосіб за п. 17, де вказаний спирт є етанолом.
34. Спосіб за п. 33, де вказаний етанол присутній у концентрації приблизно від 20 % до 30 %.
35. Спосіб за п. 34, де вказаний етанол присутній у концентрації приблизно 30 %.
36. Спосіб за п. 21, де вказаний спирт є етанолом.
37. Спосіб за п. 36, де вказаний етанол присутній у концентрації приблизно від 20 % до 30 %.
38. Спосіб за п. 37, де вказаний етанол присутній у концентрації приблизно 30 %.
39. Склад для ліофілізації, що включає бендамустин у концентрації приблизно 15 мг/мл, маніт у концентрації приблизно 25,5 мг/мл, етанол у концентрації приблизно 30 % (об'ємн.) і воду.
40. Ліофілізований препарат бендамустину, одержаний способом за будь-яким з пп. 7, 8, 9, 10, 11, 12, 13,14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 30, 31, 32, 33, 34, 35, 36, 37 і 38.
41. Ліофілізований препарат, одержаний зі складу за п. 28 або п. 39.
Текст
1. Спосіб виробництва ліофілізованого препарату бендамустину, який відрізняється тим, що регулюють концентрацію продуктів розкладання бендамустину в кінцевому продукті так, що при вивільненні концентрація продуктів розкладання бендамустину складає менше 4,0 % (процент площі піка бендамустину) і концентрація НР1 складає менше 0,5 % (процент площі піка бендамустину). 2. Спосіб виробництва ліофілізованого препарату бендамустину, який відрізняється тим, що регулюють концентрацію продуктів розкладання бендамустину в кінцевому продукті так, що концентрація НР1 при вивільненні складає менше 0,9 % 2 (19) 1 3 94036 HO N N O OH Cl N , Формула (II) де вказана кількість НР1 являє собою кількість НР1, яка є при вивільненні. 8. Спосіб одержання ліофілізованого препарату бендамустину за п. 7, який включає: a) розчинення бендамустину в розчині зі стабілізуючою концентрацією спирту, що містить від приблизно 5 % до приблизно 100 % (об'ємн.) спирту, для одержання преліофілізаційного розчину; і b) ліофілізацію преліофілізаційного розчину; де вказаний ліофілізований препарат бендамустину містить не більше ніж приблизно 0,5 % (процент площі піка бендамустину) НР1, представленого формулою (II), де вказана кількість НР1 являє собою кількість НР1, який є при вивільненні. 9. Спосіб за п. 7, де концентрація спирту складає від приблизно 5 % до приблизно 99,9 %. 10. Спосіб за п. 7, де вказаний спирт вибраний з одного або декількох спиртів з числа метанолу, етанолу, пропанолу, ізопропанолу, бутанолу і трет-бутанолу. 11. Спосіб за п. 10, де вказаний спирт є третбутанолом. 12. Спосіб за п. 11, де вказаний трет-бутанол присутній в концентрації приблизно від 20 % до 30 %. 13. Спосіб за п. 11, де вказаний трет-бутанол присутній в концентрації приблизно 30 %. 14. Спосіб за п. 7, в якому перед ліофілізацією додають наповнювач. 15. Спосіб за п. 14, в якому наповнювач являє собою маніт. 16. Спосіб за п. 7, де концентрація бендамустину складає приблизно від 2 до 50 мг/мл. 17. Спосіб за п. 7, де стадія b) включає: і) заморожування преліофілізаційного розчину до температури нижче приблизно -40 °С для утворення замороженого розчину; іі) витримування замороженого розчину при температурі нижче -40 °С протягом щонайменше 2 годин; ііі) підвищення температури замороженого розчину до температури первинного висушування приблизно від -40 °С до -10 °С для утворення висушеного розчину; iv) витримування протягом приблизно від 10 до 70 годин; v) підвищення температури висушеного розчину до температури вторинного висушування приблизно від 25 °С до 40 °С; і vi) витримування від приблизно 5 до приблизно 40 годин для одержання ліофілізованого препарату бендамустину. 18. Спосіб за п. 17, де вказаний спирт являє собою трет-бутанол. 19. Спосіб за п. 18, де вказаний трет-бутанол присутній в концентрації приблизно від 20 % до 30 %. 20. Спосіб за п. 19, де вказаний трет-бутанол присутній в концентрації приблизно 30 %. 4 21. Спосіб за п. 7, в якому стадія b) включає: і) заморожування преліофілізаційного розчину до приблизно -50 °С для утворення замороженого розчину; іі) витримування замороженого розчину при приблизно -50 °С протягом щонайменше від 2 годин до приблизно 4 годин; ііі) підвищення температури до температури первинного висушування від приблизно -20 °С до приблизно -12 °С для одержання висушеного розчину; iv) витримування при температурі первинного висушування протягом від приблизно 10 до приблизно 48 годин; v) підвищення температури висушеного розчину до температури вторинного висушування від приблизно 25 °С до приблизно 40 °С; і vi) витримування при температурі вторинного висушування протягом щонайменше від 5 годин до приблизно 20 годин. 22. Спосіб за п. 21, де вказаний спирт являє собою трет-бутанол. 23. Спосіб за п. 22, де вказаний трет-бутанол присутній в концентрації приблизно від 20 % до 30 %. 24. Спосіб за п. 23, де вказаний трет-бутанол присутній в концентрації приблизно 30 %. 25. Спосіб за п. 7, де стадія b) включає: і) початок стадії при температурі полиці приблизно 5 °С для завантаження; іі) заморожування до приблизно -50 °С протягом приблизно 8 годин; ііі) витримування при -50 °С протягом приблизно 4 годин; iv) підвищення температури до приблизно -20 °С протягом приблизно 3 годин; v) витримування при температурі приблизно -20 °С протягом 6 годин; підвищення температури до приблизно -15 °С протягом приблизно 1 години; vi) витримування при -15 °С протягом приблизно 20 годин; vii) підвищення температури до приблизно -15 °С протягом приблизно 1 години; viii) витримування при приблизно -15 °С протягом приблизно 20 годин; іх) підвищення температури до приблизно -12 °С протягом приблизно 0,5 години; х) витримування при приблизно -12 °С протягом приблизно 15,5 годин; хі) підвищення температури до приблизно 25-40 °С або більш високої протягом приблизно 15 годин; хіі) витримування при температурі приблизно 2540 °С протягом приблизно 10 годин; хііі) підвищення до температури приблизно 40 °С протягом приблизно 1 години; і xiv) витримування при температурі приблизно 40°С протягом приблизно 5 годин; вивантаження продукту при приблизно 5 °С і тиску приблизно 13,5 футів/кв. дюйм в фармацевтично прийнятний контейнер, який герметично запечатують; де тиск під час первинного висушування становить приблизно 150 мкм рт.ст. і 50 мкм рт.ст. під час вторинного висушування. 26. Спосіб за п. 25, де стадія (хі) являє собою підвищення температури до приблизно 30-35 °С протягом приблизно 15 годин. 5 94036 6 27. Ліофілізований порошок, одержаний згідно з способом за п. 25 або 26. 28. Склад для ліофілізації, який включає бендамустин в концентрації приблизно 15 мг/мл, маніт в концентрації приблизно 25,5 мг/мл, третбутиловий спирт в концентрації приблизно 30 % (об'ємн.) і воду. 29. Преліофілізована фармацевтична композиція бендамустину, яка містить приблизно 15 мг/мл гідрохлориду бендамустину, приблизно 25,5 мг/мл маніту, приблизно 30 % (об'ємн.) трет-бутилового спирту, а також воду. 30. Спосіб за п. 10, де вказаний спирт є етанолом. 31. Спосіб за п. 30, де вказаний етанол присутній у концентрації приблизно від 20 % до 30 %. 32. Спосіб за п. 30, де вказаний етанол присутній у концентрації приблизно 30 %. 33. Спосіб за п. 17, де вказаний спирт є етанолом. 34. Спосіб за п. 33, де вказаний етанол присутній у концентрації приблизно від 20 % до 30 %. 35. Спосіб за п. 34, де вказаний етанол присутній у концентрації приблизно 30 %. 36. Спосіб за п. 21, де вказаний спирт є етанолом. 37. Спосіб за п. 36, де вказаний етанол присутній у концентрації приблизно від 20 % до 30 %. 38. Спосіб за п. 37, де вказаний етанол присутній у концентрації приблизно 30 %. 39. Склад для ліофілізації, що включає бендамустин у концентрації приблизно 15 мг/мл, маніт у концентрації приблизно 25,5 мг/мл, етанол у концентрації приблизно 30 % (об'ємн.) і воду. 40. Ліофілізований препарат бендамустину, одержаний способом за будь-яким з пп. 7, 8, 9, 10, 11, 12, 13,14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 30, 31, 32, 33, 34, 35, 36, 37 і 38. 41. Ліофілізований препарат, одержаний зі складу за п. 28 або п. 39. Галузь техніки, до якої належить винахід Даний винахід належить до галузі фармацевтичних композицій для лікування різних хворобливих станів, особливо неопластичних захворювань і автоімунних захворювань. Зокрема, винахід належить до фармацевтичних складів, які включають аналоги азотистого іприту, в т. ч. такий аналог азотистого іприту, як бендамустин, наприклад, гідрохлорид бендамустину. Рівень техніки Даний винахід претендує на перевагу і пріоритет заявки на патент США № 60/644354, поданої 14 січня 2005 р. і озаглавленої «Фармацевтичні композиції бендамустину», яка включена в дану заявку за допомогою посилання у всій її повноті, включаючи ілюстративний матеріал і формулу винаходу. Представлений нижче опис включає інформацію, яка може бути корисною для розуміння даного винаходу. Це не є визнанням того, що будь-яка така інформація являє собою відомий рівень техніки або належить до винаходу, що описується в даній заявці, або що будь-яка спеціально або неявно згадувана публікація являє собою відомий рівень техніки. Завдяки високій реакційній здатності азотистого іприту у водному розчині створення фармацевтичних засобів на їх основі ускладнене, і часто вони постачаються для введення в ліофілізованій формі, яка вимагає відновлення перед введенням, як правило, шляхом розчинення у воді, кваліфікованим персоналом клініки. Попадаючи у водний розчин, азотистий іприт піддається розпаду за рахунок гідролізу, внаслідок чого відновлений продукт повинен бути введений пацієнту в максимально короткий термін після відновлення. Бендамустин, тобто 4-{5-[біс(2хлоретил)аміно]-1-метил-2бензімідазоліл}масляна кислота, є нетиповою структурою з бензімідазольним циклом, що включає активний фрагмент азотистого іприту (дивіться формулу І, яка відображає гідрохлорид бендамустину) . Бендамустин був уперше синтезований в 1963 році в Німецькій Демократичній Республіці (НДР) і постачався з цієї країни з 1971 по 1992 під назвою Cytostasan. Після цього часу він поступав на ринок Німеччини під торговим найменуванням Ribomustin. Він широко застосовувався в Німеччині для лікування хронічної лімфоцитарної лейкемії, хвороби Ходжкіна, неходжкінської лімфоми, множинної мієломи і раку грудей. Через розкладання у водних розчинах (що характерно і для іншого азотистого іприту) бендамустин постачається у вигляді ліофілізованого продукту. Застосовуваний на цей час ліофілізований склад бендамустину (Ribomustin) містить гідрохлорид бендамустину і маніт в стерильній ліофілізованій формі і має вигляд білого порошку, призначеного для внутрішньовенного застосування після відновлення. Кінцевий ліофілізат нестабільний при дії світла. Тому продукт зберігають в скляних бутлях коричневого або янтарного кольору. Ліофілізований склад бендамустину, що є на цей час, містить продукти розкладання, які можуть з'являтися під час виробництва лікарської речовини і/або під час процесу ліофілізації при одержанні готового лікарського складу. У цей час лікарською формою бендамустину є ліофілізований порошок для ін'єкції, який містить 100 мг лікарської речовини на 50-мл флакон або 25 мг лікарської речовини на 20-мл флакон. Флакони відкривають і відновлюють препарат в мо 7 мент часу, максимально близький до часу введення пацієнту. Продукт відновлюють додаванням 40 мл (для 100 мг різновиду) або 10 мл (для 25 мг різновиду) стерильної води для ін'єкцій. Після цього відновлений продукт розбавляють 500 мл q.s. 0,9% розчину хлориду натрію для ін'єкцій. Препарат вводять шляхом внутрішньовенної інфузії протягом 30-60 хвилин. Після відновлення шляхом додавання 40 мл стерильної води для ін'єкцій, розчин бендамустину стабільний протягом 7 годин у випадку зберігання при кімнатній температурі, або протягом 6 днів, у випадку зберігання при 2-8°С. Суміш, одержану після розбавлення 500 мл хлориду натрію, потрібно ввести пацієнту протягом 7 годин після відновлення флакона з ліофілізованим препаратом (в припущенні, що суміш зберігалася при кімнатній температурі). Відновлення доступного на цей час ліофілізованого порошку бендамустину є складним процесом. Повідомлення з клінік вказують на те, що відновлення може потребувати щонайменше 15 хвилин, причому необхідний час може досягати тридцяти хвилин. Окрім того, що процес відновлення продукту обтяжливий і віднімає багато часу у працівників охорони здоров'я, тривалий вплив води на бендамустин в ході відновлення збільшує можливість втрати ефективності і утворення домішок через гідроліз продукту під дією води. Таким чином, є потреба в ліофілізованих складах бендамустину, які легше відновлюються і які мають кращі властивості з точки зору наявності забруднень, ніж доступні на цей час ліофільні склади (ліофілізовані порошки) бендамустину. У німецькому (НДР) патенті № 34727 розкритий спосіб одержання -[5-біс-(хлоретил)амінобензимідазоліл-2]алканкарбонових кислот, заміщених в положенні 1. У німецькому (НДР) патенті № 80967 розкритий придатний для ін'єкції препарат гідрохлориду -[1-метил-5-біс-(-хлоретил)амінобензимідазоліл2]масляної кислоти. У німецькому (НДР) патенті № 159877 розкритий спосіб одержання 4-[1-метил-5-біс(2хлоретил)амінобензимідазоліл-2]масляної кислоти. У німецькому (НДР) патенті № 159289 розкритий придатний для ін'єкцій розчин бендамустину. Стаття про продукт на основі бендамустину під назвою Ribomustin (оновлене 1/2002) за адресою http://wmv.ribosepharm.de/pdf/ribomustin bendamustin/productmonograph.pdf містить інформацію про Ribomustin, включаючи опис продукту. Ni і співавтори повідомляють, що нітрозосечовина SarCNU була більш стабільна в чистому трет-бутанолі, ніж в чистій оцтовій кислоті, диме 94036 8 тилсульфоксиді, метиловому спирті, воді або сумішах ТВА/вода (Ni et al. (2001) Intl. J. Pharmaceutics 226:39-46). У техніці відомі ліофілізовані циклофосфаміди, дивіться, наприклад, патенти США №№ 5418233; 5413995; 5268368; 5227374; 5130305; 4659699; 4537883 і 5 066 647. Ліофілізовані іфосфаміди азотистого іприту розкриті в міжнародній публікації WO 2003/066027; патентах США №№ 6613927; 5750131; 5972912; 5227373 і 5204335. Teagarden і співавтори розкривають ліофілізовані склади простагландину Ε-1, одержані розчиненням PGE-1 в розчині лактози і трет-бутилового спирту (патент США № 5770230). Суть винаходу Метою даного винаходу є одержання стабільних фармацевтичних композицій азотистого іприту, зокрема ліофілізованого бендамустину, і їх застосування в лікуванні різних хворобливих станів, особливо неопластичних захворювань і автоімунних захворювань. Одним з варіантів здійснення даного винаходу є фармацевтична композиція бендамустину, яка містить не більше ніж приблизно 0,5-0,9% (процент площі піка бендамустину на хроматограмі ВЕРХ) сполуки НР1, представленої формулою (II): , під час вивільнення або де кількість НР1 являє собою кількість НР1, яка є в нульовий момент часу після відновлення ліофілізованої фармацевтичної композиції бендамустину, описаної в даній заявці. У переважному варіанті здійснення винахід належить до фармацевтичної композиції бендамустину, яка містить не більше ніж приблизно 0,5% (процент площі піка бендамустину) НР1, переважно не більше ніж приблизно 0,45%, більш переважно не більше ніж приблизно 0,40%, більш переважно не більше ніж приблизно 0,35%, ще більш переважно не більше ніж 0,30%. Інший варіант здійснення даного винаходу являє собою ліофілізований препарат бендамустину, який містить не більше ніж приблизно 0,1-0,3% димеру бендамустину, представленого формулою (III), під час вивільнення або в нульовий момент часу після відновлення. 9 94036 10 . Ще один варіант здійснення даного винаходу являє собою ліофілізований препарат бендамустину, який містить не більше ніж 0,5%, переважно від 0,15% до 0,5%, етилового ефіру бендамустину, представленого формулою (IV), під час вивільнення або в нульовий момент часу після відновлення . Ще один варіант здійснення винаходу являє собою ліофілізований препарат бендамустину, в якому концентрація етилового ефіру бендамустину (формула IV) не більше ніж на 0,2%, переважно на 0,1%, перевищує концентрацію етилового ефіру бендамустину, виявлену в лікарській речовині, використаній для одержання ліофілізованого препарату. У іншому варіанті здійснення даний винахід належить до ліофілізованого препарату бендамустину, який містить не більше ніж приблизно 0,50,9% (процент площі піка бендамустину) НР1 під час вивільнення лікарського продукту. Переважним варіантом здійснення є ліофілізований препарат бендамустину, який містить не більше ніж приблизно 0,50% (процент площі піка бендамустину) НР1, переважно не більше ніж приблизно 0,45%, більш переважно не більше ніж приблизно 0,40%, більш переважно не більше ніж приблизно 0,35%, ще більш переважно не більше ніж 0,30%. Одним з аспектів даного винаходу є ліофілізований препарат бендамустину, який містить не більше ніж приблизно 0,5-0,9%, переважно 0,5% (процент площі піка бендамустину), НР1 під час вивільнення лікарського продукту, якщо ліофілізований препарат упакований у флакон або інший фармацевтично прийнятний контейнер. У ще одному аспекті даного винаходу ліофілізовані препарати бендамустину є стабільними відносно кількості НР1 протягом щонайменше 6 місяців, переважно 12 місяців, переважно 24 місяців до приблизно 36 місяців або більше, при зберіганні при температурі приблизно від 2 до 30°С. Переважними температурами для зберігання є близько 5°С і температура, яка приблизно дорівнює кімнатній. Іншим варіантом здійснення даного винаходу є дозована лікарська форма, яка включає фармацевтичну композицію бендамустину, яка містить не більше ніж приблизно 0,5-0,9% НР1, переважно не більше ніж приблизно 0,50%, переважно не більше ніж приблизно 0,45%, більш переважно не більше ніж приблизно 0,40%, більш переважно не більше ніж приблизно 0,35%, ще більш переважно не більше ніж 0,30%, де НР1 являє собою кількість НР1, яка є під час вивільнення або в нульовий момент часу після відновлення ліофілізованого препарату бендамустину за даним винаходом. У переважних аспектах даного винаходу дозована форма може включати від приблизно 5 до приблизно 500 мг бендамустину, від приблизно 10 до приблизно 300 мг бендамустину, приблизно 25 мг бендамустину, приблизно 100 мг бендамустину і приблизно 200 мг бендамустину. Ще один варіант здійснення даного винаходу являє собою дозовану лікарську форму, яка включає ліофілізований препарат бендамустину, який містить не більше ніж приблизно 0,5-0,9%, переважно 0,5%, НР1. Переважні дозовані форми можуть містити від приблизно 5 до приблизно 500 мг бендамустину, від приблизно 10 до приблизно 300 мг бендамустину, приблизно 25 мг бендамустину. приблизно 100 мг бендамустину і приблизно 200 мг бендамустину. У ще одному варіанті здійснення винахід належить до фармацевтичної композиції бендамустину, що включає бендамустин, яка містить не більше ніж приблизно від 0,5% до 0,9% (процент площі піка бендамустину), переважно не більше ніж приблизно 0,50%, переважно не більше ніж приблизно 0,45%, більш переважно не більше ніж приблизно 0,40%, більш переважно не більше ніж приблизно 0,35%, ще більш переважно не більше ніж 0,30%, а також слідові кількості одного або декількох органічних розчинників, де вказана кількість НР1 являє собою кількість НР1, присутню під час вивільнення або в нульовий момент часу після відновлення ліофілізованої фармацевтичної композиції бендамустину, розкритої в даному винаході. У інших аспектах даного винаходу органічний розчинник вибраний з одного або декількох розчинників з числа трет-бутанолу, н-пропанолу, нбутанолу, ізогіропанолу, етанолу, метанолу, ацетону, етилацетату, диметилкарбонату, ацетонітрилу, дихлорметану, метилетилкетону, метилізобутилкетону, 1-пентанолу, метилацетату, чотирихлористого вуглецю, диметилсульфоксиду, гексафторацетону, хлорбутанолу, диметилсульфону, оцтової кислоти і циклогексану. Переважні органічні розчинники включають один або декілька розчинників з числа етанолу, метанолу, пропано 11 лу, бутанолу, ізопропанолу і трет-бутанолу. Більш переважним органічним розчинником є третбутанол, відомий також як ТВА, т-бутанол, третбутиловий спирт або третинний бутиловий спирт. Даний винахід включає спосіб одержання схвалення продуктів бендамустину державними органами, причому дане удосконалення включає встановлення технічних умов на вивільнення продуктів розпаду бендамустину на рівні менше приблизно 4,0%, переважно приблизно від 2% до 4% (процент площі піка бендамустину), або, іншими словами, спосіб одержання фармацевтичних композицій, описаних в даній заявці. Одним з аспектів даного винаходу є спосіб одержання схвалення продуктів бендамустину контролюючими агентствами, який включає встановлення технічних умов на вивільнення НР1, що не перевищує 1,5% (процент площі піка бендамустину). Продукт бендамустину за даною заявкою містить не більше ніж приблизно 0,5% (процент площі піка бендамустину) НР1 під час вивільнення. Іншим варіантом здійснення є спосіб одержання схвалення державними органами продукту бендамустину, причому дане удосконалення включає встановлення технічних умов на термін зберігання, згідно з якими вміст продуктів розпаду бендамустину складає менше ніж приблизно 7,0%, переважно від приблизно 5,0% до 7,0% (процент площі піка бендамустину), якщо продукт зберігають при температурі від приблизно 2°С до приблизно 30°С. Переважними температурами зберігання є приблизно 5°С і температура, яка приблизно дорівнює кімнатній. Продукт бендамустину за даною заявкою містить не більше ніж приблизно 0,5% (процент площі піка бендамустину) НР1 під час вивільнення. Іншим варіантом здійснення даного винаходу є спосіб виробництва люфілїзованого препарату бендамустину, який включає регулювання концентрації продуктів розпаду бендамустину в кінцевому продукті, так що концентрація продуктів розпаду бендамустину складає менше ніж приблизно 4,0%, переважно не більше ніж приблизно від 2% до 4% (процент площі піка бендамустину), при вивільненні, або, іншими словами, одержання фармацевтичних композицій, описаних в даній заявці. Продукт бендамустину за даним винаходом містить не більше ніж приблизно 0,5-0,9%, переважно приблизно 0,5% (процент площі піка бендамустину), НР1 при вивільненні. У даному винаході розкритий спосіб одержання ліофілізованого препарату бендамустину, який включає регулювання концентрації продуктів розпаду бендамустину в кінцевому продукті, так, щоб при вивільненні концентрація НР1 була менше 0,9%, переважно 0,5% (процент площі піка бендамустину), і, в момент закінчення терміну зберігання продукту, концентрація продуктів розпаду бендамустину була менше приблизно 7,0%, переважно не більше приблизно 5-7%; при умові зберігання вказаного продукту при температурі від приблизно 2°С до приблизно 30°С. Інший варіант здійснення даного винаходу являє собою преліофілізаційний розчин або дисперсію бендамустину, що включає один або декілька 94036 12 органічних розчинників, причому згадані розчин або дисперсія включають щонайменше один органічний розчинник в стабілізуючій концентрації, який знижує рівень розпаду бендамустину, так що кількість НР1, який утворився під час ліофілізації, за час від приблизно 0 до 24 годин, не перевищує приблизно 0,5-0,9% (процент площі піка бендамустину), переважно 0,50%, переважно 0,45%, більш переважно 0,40%, більш переважно 0,35%, ще більш переважно 0,30%. Одним з аспектів цього варіанта здійснення є ліофілізований порошок, одержаний з вказаного преліофілізаційного розчину або дисперсії. Ще одним варіантом здійснення даного винаходу є преліофілізаційний розчин або дисперсія бендамустину, що включає один або декілька органічних розчинників, причому згадані розчин або дисперсія включають щонайменше один органічний розчинник в стабілізуючій концентрації, яка знижує рівень розкладання бендамустину, так що кількість етилового ефіру бендамустину, що утворюється під час ліофілізації протягом приблизно 024 годин, не перевищує приблизно 0,5% (процент площі піка бендамустину). Одним з аспектів цього варіанта здійснення є ліофілізований порошок, одержаний з вказаного преліофілізаційного розчину або дисперсії. Ще одним варіантом здійснення даного винаходу є преліофілізаційний розчин або дисперсія бендамустину, що включає один або декілька органічних розчинників, причому згадані розчин або дисперсія включають щонайменше один органічний розчинник в стабілізуючій концентрації, яка знижує рівень розпаду бендамустину, так що кількість етилового ефіру бендамустину (відображеного формулою (IV)), що утворюється під час ліофілізації протягом 0-24 годин, не більше ніж на 0,2%, переважно на 0,1%, перевищує концентрацію етилового ефіру бендамустину, виявленого в лікарській речовині, що застосовується для одержання преліофілізаційного розчину. Переважним органічним розчинником є трет-бутанол. Крім того, в даному винаході розкриті способи одержання ліофілізованого препарату бендамустину, які включають розчинення бендамустину в спиртовмісному розчиннику, що має стабілізуючу концентрацію спирту від приблизно 5% до приблизно 100% (об'єм/об'єм) для утворення преліофілізаційного розчину; і ліофілізацію преліофілізаційного розчину; де ліофілізований препарат бендамустину, одержаний такими способами, містить не більше ніж приблизно 0,5-0,9%, переважно 0,5% (процент площі піка бендамустину), НР1, відображеного формулою (II), де кількість НР1 являє собою кількість НР1, яка є при вивільненні або в нульовий момент часу після відновлення ліофілізованої фармацевтичної композиції бендамустину. Інші концентрації спирту включають від приблизно 5% до приблизно 99,9%, від приблизно 5% до приблизно 70%, від приблизно 5% до приблизно 60%, від приблизно 5% до приблизно 50%, від приблизно 5% до приблизно 40%, від приблизно 20% до приблизно 35%. Переважною концентрацією спирту є концентрація від приблизно 20% до приблизно 30%. Переважні спирти включають 13 один або декілька спиртів з числа метанолу, етанолу, пропанолу, ізопропанолу, бутанолу і третбутанолу. Більш переважним спиртом є третбутанол. Переважна концентрація трет-бутанолу складає від приблизно 20% до приблизно 30%, переважно близько 30%. Одним з аспектів цього варіанта здійснення є додавання наповнювача до ліофілізації. Переважним наповнювачем є маніт. Переважні преліофілізаційні концентрації бендамустину складають від приблизно 2 мг/мл до приблизно 50 мг/мл. У переважному способі одержання ліофілізованого препарату бендамустину ліофілізація преліофілізаційного розчину включає і) заморожування преліофілізаційного розчину до температури нижче приблизно -40°С, переважно -50°С, для утворення замороженого розчину; іі) витримування замороженого розчину при температурі нижче 40°С, переважно -50°С, протягом щонайменше 2 годин; ііі) підвищення температури замороженого розчину до температури первинного висушування від приблизно -40°С до приблизно -10°С для утворення висушеного розчину; iv) витримування протягом приблизно 10-70 годин; ν) підвищення температури висушеного розчину до другої температури висушування від приблизно 25°С до приблизно 40°С; і vi) витримування від приблизно 5 до приблизно 40 годин для утворення ліофілізованого препарату бендамустину У більш переважному способі ліофілізація преліофілізаційного розчину включає і) заморожування преліофілізаційного розчину до температури приблизно -50°С для утворення замороженого розчину; іі) витримування замороженого розчину при температурі приблизно -50°С протягом від мінімум 2 годин до приблизно 4 годин; ііі) підвищення температури замороженого розчину до первинної температури висушування від приблизно -20°С до приблизно -12°С для утворення висушеного розчину; iv) витримування при температурі первинного висушування протягом приблизно 10-48 годин; ν) підвищення температури висушеного розчину до другої температури висушування від приблизно 25°С до приблизно 40°С; і vi) витримування при температурі вторинного висушування від мінімум 5 годин до приблизно 20 годин. Переважним спиртом є трет-бутанол. Переважна концентрація третбутанолу складає від приблизно 20% до приблизно 30%, переважно приблизно 30%. Одним з аспектів цього варіанта здійснення є додавання наповнювача перед ліофілізацією. Переважним наповнювачем є маніт. Переважні преліофілізаційні концентрації бендамустину складають від приблизно 2 мг/мл до приблизно 50 мг/мл. Іншим варіантом здійснення даного винаходу є ліофілізований порошок або препарат, одержаний за допомогою розкритих в даній заявці способів одержання ліофілізованих препаратів бендамустину. Крім того, даний винахід включає склади бендамустину для ліофілізації, які містять наповнювач і органічного розчинник в стабілізуючій концентрації. Переважний склад включає бендамустин в концентрації приблизно 15 мг/мл, маніт в концентрації приблизно 25,5 мг/мл, трет-бутиловий спирт 94036 14 в концентрації приблизно 30% (об’ємн.), а також воду. У цей варіант здійснення винаходу включені ліофілізовані препарати, одержані з таких складів бендамустину. У даний винахід входять способи лікування медичних станів у пацієнта, які включають введення терапевтично ефективної кількості фармацевтичної композиції за даним винаходом, якщо стан може бути поліпшений при лікуванні вказаною фармацевтичною композицією. Деякі стани, що піддаються лікуванню композиціями за даним винаходом, включають хронічну лімфоцитарну лейкемію (CLL), хворобу Ходжкіна, неходжкінську лімфому (NHL), множинну мієлому (ММ), рак грудей, дрібноклітинний рак легень, гіперпроліферативні розлади і автоімунні захворювання. Переважні стани включають NHL, CLL, рак грудей і MM. Переважні автоімунні захворювання включають ревматоїдний артрит, множинний склероз або вовчак. У об'єм даного винаходу входить застосування фармацевтичних композицій або фармацевтичних препаратів за даним винаходом з метою виробництва лікарського засобу для лікування у пацієнта медичних станів, визначених в даній заявці, причому це застосування включає введення терапевтично ефективної кількості фармацевтичної композиції за даним винаходом, якщо стан може бути поліпшено лікуванням за допомогою вказаної фармацевтичної композиції. Крім того, в даний винахід включені способи лікування, в яких фармацевтичні композиції за даним винаходом застосовують в поєднанні з одним або декількома антинеопластичними засобами, причому антинеопластичний засіб вводять до, одночасно або після введення фармацевтичної композиції за даним винаходом. Переважними антинеопластичними засобами є антитіла, специфічні для CD20. Іншим варіантом здійснення даного винаходу є ліофілізаційний цикл для одержання ліофілізованих препаратів бендамустину за даним винаходом. Переважний ліофілізаційний цикл включає а) заморожування до температури приблизно -50°С приблизно за 8 годин; b) витримування при -50°С протягом приблизно 4 годин; с) підвищення температури до -25°С протягом приблизно 3 годин; d) витримування при -10°С протягом 30 годин; e) підвищення температури до значення від приблизно 25°С до приблизно 40°C або вище протягом приблизно 3 годин; f) витримування при температурі від приблизно 25°С до приблизно 40°С протягом приблизно 25 годин; g) поступове зниження температури до приблизно 20°С протягом 1 години; h) вивантаження одержаного препарату при температурі приблизно 20°С і тиску 13,5 фунтів/кв.дюйм в фармацевтично прийнятний герметично закритий контейнер, де тиск під час первинного висушування становить приблизно 150 мкм рт.ст. і 50 мкм рт.ст. під час вторинного висушування. Один з аспектів цього циклу включає стадію (е), на якій температуру плавно підіймають до приблизно 3035°С протягом 3 годин і потім плавно підіймають до 40°С протягом 5 годин. Іншим аспектом цього варіанта здійснення є ліофілізований порошок, 15 одержаний внаслідок здійснення такого ліофілізаційного циклу. Більш переважний ліофілізаційний цикл включає і) початок циклу при температурі полиці ліофілізатора приблизно 5°С для завантаження вихідного розчину; іі) заморожування до приблизно -50°С протягом приблизно 8 годин; ііі) витримування при -50°С протягом приблизно 4 годин; iv) підвищення температури до приблизно 20°С протягом приблизно 3 годин; ν) витримування при приблизно -20°С протягом 6 годин; підйом температури до приблизно -15°С протягом приблизно 1 години; vi) витримування при -15°С протягом приблизно 20 годин; vii) підйом температури до приблизно -15°С протягом приблизно 1 години; viii) витримування при температурі приблизно 15°С протягом приблизно 20 годин; іх) підвищення температури до приблизно -12°С протягом приблизно 0,5 години; х) витримування при температурі приблизно -12°С протягом приблизно 15,5 годин; хі) підвищення температури до значення від приблизно 25°С до приблизно 40°С або вище протягом приблизно 15 годин; хіі) витримування при температурі від приблизно 25°С до приблизно 40°С протягом приблизно 10 годин; хііі) підвищення температури до приблизно 40°С протягом приблизно 1 години; і xiv) витримування при температурі приблизно 40°С протягом приблизно 5 годин; вивантаження при приблизно 5°С і тиску приблизно 13,5 футів/кв.дюйм в фармацевтично прийнятний герметично закритий контейнер; де тиск під час первинного висушування становить приблизно 150 мкм рт.ст. і 50 мкм рт.ст. під час вторинного висушування. У переважному варіанті здійснення на стадії (хі) температуру підіймають до приблизно 30-35°С протягом приблизно 15 годин. Крім того, даний винахід охоплює фармацевтичну дозовану форму бендамустину, яка містить не більше ніж приблизно 0,5-0,9%, переважно 0,5%, НР1 (процент площі піка бендамустину), де вказана дозована форма включає флакон або інший фармацевтично прийнятний контейнер, причому вказана кількість НР1 являє собою кількість НР1, яка є перед відновленням або в нульовий момент часу після відновлення вказаної дозованої форми. Переважні концентрації бендамустину включають концентрації в діапазоні від приблизно 10 до приблизно 500 мг/контейнер, приблизно 100мг/контейнер, від приблизно 5 мг до приблизно 2 г/контейнер і приблизно 170 мг/контейнер. У об'єм даного винаходу також входять преліофілізовані фармацевтичні композиції бендамустину. Переважна преліофілізована композиція включає гідрохлорид бендамустину в кількості приблизно 15 мг/мл, маніт в кількості приблизно 25,5 мг/мл, трет-бутиловий спирт в кількості приблизно 30% (об’ємн.) і воду. Перераховані вище, а також інші варіанти здійснення винаходу описані далі по тексту даної заявки або очевидні рядовим фахівцям в даній галузі техніки на основі викладеного нижче розкриття винаходу. Короткий опис ілюстративного матеріалу На Фіг. 1 показана розчинність бендамустину при різних температурах для двох різних розчинів бендамустину в трет-бутанолі. 94036 16 На Фіг. 2 показані результати дослідження, чистоти препаратів за допомогою ВЕРХ-аналізу, після витримування бендамустину в різних спиртах протягом 24 годин при 5°С. Результати представлені в процентах площі піка бендамустину. На Фіг. 3 показане утворення НР1 (формула II) протягом 24 годин в різних сумішах розчинників спирт/вода при 5°С. На Фіг. 4 показане утворення димеру (формула III) протягом 24 годин в різних сумішах розчинників спирт/вода при 5°С. На Фіг. 5 показаний ліофілізаційний цикл для бендамустину із застосуванням суміші розчинників ТВА/вода. На Фіг. 6 показана хроматограма Ribomustin,a при застосуванні способу №1 ВЕРХ. Докладний опис винаходу У даному описі терміни «створювати склад», «включати в склад» належать до одержання лікарського препарату, наприклад, бендамустину, в формі, відповідній для введення пацієнту з числа ссавців, переважно людині. Таким чином, термін «створення складу» може включати додавання фармацевтично прийнятних наповнювачів, розріджувачів або носіїв. У даному описі термін «ліофілізований порошок» або «ліофілізований препарат» належать до будь-якої твердої речовини, одержаної ліофілізацією, тобто висушуванням замороженого водного розчину. Водний розчин може містити неводний розчинник, тобто являти собою розчин, що складається з водного і одного або декількох неводних розчинників (розчинника). Переважно ліофілізований препарат є таким препаратом, в якому тверду речовину одержують висушуванням замороженого розчину, що складається з водного і одного або декількох неводних розчинників, більш переважно неводний розчинник являє собою спирт. Під «стабільною фармацевтичною композицією» мається на увазі будь-яка фармацевтична композиція, яка має достатню стабільність, щоб знайти застосування як фармацевтичний продукт. Переважно, стабільна фармацевтична композиція має достатню стабільність, щоб була можливість зберігати її при стандартній температурі, переважно в межах від -20°С до 40°С, більш переважно від приблизно 2°С до приблизно 30°С, протягом прийнятного періоду часу, наприклад, термін зберігання продукту не перевищує одного місяця, але. як правило, шість місяців або більше, більш переважно один рік або більше, ще більш переважно двадцять чотири місяці або більше і ще більш переважно тридцять шість місяців або більше. Термін зберігання або термін закінчення придатності може являти собою таку кількість часу, за який діючий інгредієнт розкладається до чистоти менше 90%. Для цілей даного винаходу термін «стабільна фармацевтична композиція» належить до фармацевтичної композиції з конкретними діапазонами вмісту домішок, вказаними в даному описі. Переважно, стабільною фармацевтичною композицією є така композиція, в якій є мінімальне розкладання діючого інгредієнта, наприклад, в ній зберігається щонайменше приблизно 85% діючої речовини, що не розпалася, переважно щонайменше приблизно 17 90% і більш переважно щонайменше приблизно 95%, після зберігання при 2-30°С протягом 2-3річного періоду часу. Під «стабільним ліофілізованим препаратом» мається на увазі будь-який ліофілізований препарат, який має достатню стабільність, щоб мати застосовність як фармацевтичного продукту, тобто який має такі ж характеристики, які наведені в даному описі для стабільної фармацевтичної композиції. Термін «який розпався» або «який розклався» має на увазі, що хімічна структура діючої речовини зазнала змін. Термін «терапевтично ефективна кількість» в даному описі належить до такої кількості сполуки, що вводиться, яка повинна до деякої міри полегшити один або декілька симптомів розладу, що піддається лікуванню. Застосовно до лікування новоутворень, терапевтично ефективна кількість належить до кількості, яка має такі ефекти як (1) зменшення розмірів пухлини, (2) пригнічення (тобто сповільнення до деякої міри, переважно припинення) утворення метастазів пухлини, (3) пригнічення до деякої міри (тобто сповільнення до деякої міри, переважно припинення) росту пухлини і/або (4) полегшення до деякої міри (або, переважно, усунення) одного або декількох симптомів, пов'язаних з раком. Термін «терапевтично ефективна кількість» може також належати до запобігання виникненню захворювання у тварини, яка може бути схильна до цього захворювання, але захворювання поки не виникло або не виявляються його симптоми (профілактичний вплив). Крім того, терапевтично ефективною кількістю може бути така кількість, яка збільшує очікувану тривалість життя пацієнта, ураженого розладом в останній стадії. Типові терапевтично ефективні дози бендамустину для лікування неходжкінської лімфоми можуть бути приблизно 60-120 мг/м2 у вигляді однократної дози протягом двох днів підряд. Цей цикл можна повторювати кожні три-чотири тижні. При лікуванні хронічної лімфоцитарної лейкемії (CLL) можна вводити бендамустин в кількості приблизно 80100мг/м в дні 1 і 2. Цей цикл можна повторювати приблизно через 4 тижні. Для лікування хвороби Ходжкіна (стадії II-IV) бендамустин можна вводити в «режимі DBVBe» з даунорубіцином 25 мг/м2 в дні 1 і 15, вінкристином 1,4 мг/м2 в дні 1 і 15 і бендамустин в кількості 50 мг/м2 в дні 1-5, з повторенням циклу приблизно кожні 4 тижні. У випадку раку грудей бендамустин (120 мг/м2) в дні 1 і 8 можна вводити в комбінації з метотрексатом 40 мг/м2 в дні 1 і 8 і 5-фторурацилом 600 мг/м2 в дні 1 і 8 з повторенням циклу приблизно кожні 4 тижні. Як другий рівень терапії раку грудей бендамустин можна вводити в кількості приблизно 100-150 мг/м в дні 1 і 2 з повторенням циклу приблизно кожні 4 тижні. У даному описі термін «неопластичний» належить до новоутворень, які є результатом аномального росту, причому такий ріст виникає через проліферації клітини і не схильний до звичайних обмежень росту. Термін «антинеопластичний засіб» в даному описі означає будь-яку сполуку, композицію, добавку або суміш, які інгібують, зни 94036 18 щують, сповільнюють або обертають неопластичний фенотип клітин. У даному описі термін «гіперпроліферація» означає надмірне розмноження клітин у відповідь на окремі фактори росту. «Гіперпроліферативними розладами» є захворювання, при яких має місце надмірне розмноження клітин у відповідь на окремі фактори росту. Приклади таких «гіперпроліферативних розладів» включають діабетичну ретинопатію, псоріаз, ендометріоз, рак, плямисті дегенеративні розлади і доброякісні розлади росту, такі як збільшення простати. У даному описі термін «флакон» належить до будь-якого контейнера, що має стінку, як тверду, так і гнучку. Термін «регулювання» в даному описі означає постановку процесу під контроль на місці для полегшення досягнення результатів, заради яких здійснюють регулювання. Наприклад, в цьому випадку «регулювання» може означати дослідження зразків з кожної партії або декількох партій регулярно або випадково; встановлення концентрації продуктів розкладання як технічної умови на їх виділення; вибір умов проведення процесу, наприклад, застосування спиртів і/або інших органічних розчинників в преліофілізаційному розчині або дисперсії так, щоб гарантувати, що концентрація продуктів розкладання діючого інгредієнта не є неприйнятно високою; і т. д. Контроль за продуктами розкладання шляхом встановлення технічної умови на кількість продуктів розкладання, що виділяються, може застосовуватися для полегшення схвалення фармацевтичного продукту контролюючим агентством, як, наприклад, Управлінням по контролю за продуктами харчування і лікарськими засобами США і аналогічними агентствами в інших країнах або регіонах («контролюючими агентствами»). Термін «фармацевтично прийнятний» в даному описі означає, що предмет, який є фармацевтично прийнятним, наприклад, компоненти фармацевтичних композицій, включаючи контейнери, не викликають неприйнятної втрати фармакологічної активності або неприйнятних шкідливих побічних ефектів. Приклади фармацевтично прийнятних компонентів наведені в фармакопеї США (USP), національному фармакологічному довіднику (NF), схваленому рішенням фармакопейного з'їзду США в Rockville, Md. в 1990, а також довіднику з інертних інгредієнтів 1990, 1996, виданому Управлінням по контролю за продуктами харчування і лікарськими засобами США (обидва довідники включені в дану заявку за допомогою посилання, включаючи весь ілюстративний матеріал). Також можуть використовуватися інші класифікації якості розчинів або компонентів, які відповідають необхідним нормам і/або технічним умовам, які не входять в USP/NF. Термін «фармацевтична композиція» в даному описі буде означати композицію, яка виготовлена в таких умовах, що вона придатна для введення людям, наприклад, в умовах GMP, і містить фармацевтично прийнятні наповнювачі, наприклад, не обмежуючись перерахованими, стабілізатори, засоби для надання об'єму, буфери, носії, розріджу 19 вачі, основи, засоби для збільшення розчинності і зв'язуючі засоби. У даному описі фармацевтичні композиції включають, не обмежуючись перерахованим, преліофілізаційні розчини або дисперсії, а також рідкі форми після відновлення ліофілізованих препаратів, готові для ін'єкції або інфузії. Термін «дозована лікарська форма» в даному описі означає розкриту в описі фармацевтичну композицію, що знаходиться в контейнері в такій кількості, яка придатна для відновлення і введення однієї або декількох доз. як правило, приблизно 12, 1-3, 1-4, 1-5, 1-6, 1-10 або приблизно 1-20 доз. У даному описі термін «дозована лікарська форма» переважно означає розкриту в описі ліофілізовану фармацевтичну композицію в контейнері і в кількості, придатній для відновлення і введення однієї або декількох доз, як правило, приблизно 1-2, 1-3, 1-4, 1-5, 1-6, 1-10 або приблизно 1-20 доз. Фармацевтична лікарська форма може включати флакон або шприц, або інший придатний фармацевтично прийнятний контейнер. Дозована лікарська форма, придатна для застосування у вигляді ін'єкції або інфузії, може включати стерильні водні розчини або дисперсії, або стерильні порошки, що містять діючий інгредієнт, які пристосовані для приготування безпосередньо перед введенням, або стерильні розчини або дисперсії, придатні для ін'єкції або інфузії. У всіх випадках, кінцева лікарська форма повинна бути стерильною, текучою і стабільною в умовах виробництва і зберігання. Рідкий носій або основа може являти собою розчинник або рідке дисперсійне середовище, включаючи, наприклад, воду, етанол, поліоли, такі як гліцерин, пропіленгліколь або рідкі поліетиленгліколі і т. п., рослинні олії, нетоксичні складні ефіри гліцерину і їх придатні суміші. Попередження росту мікроорганізмів може бути здійснене за допомогою різних антибактеріальних і протигрибкових засобів, наприклад, парабенів, хлорбутанолу, фенолу, сорбінової кислоти, тимеросалу і т. п. У даному описі термін «наповнювач» означає речовини, що застосовуються для включення діючих фармацевтичних інгредієнтів (АРІ) в фармацевтичні склади; в переважному варіанті здійснення наповнювач не знижує або не заважає вияву первинної терапевтичної дії АРІ. Переважно наповнювач є терапевтично інертним. Термін «наповнювач» охоплює носії, розріджувачі, основи, засоби для підвищення розчинності, стабілізатори, засоби для збільшення об'єму і зв'язуючі речовини. Наповнювачами також можуть бути такі речовини, які попадають в фармацевтичний склад, як непрямий або ненавмисний результат процесу виробництва. Переважно, наповнювачі затверджені або розглядаються як безпечні для введення людині або тваринам, тобто є речовинами GRAS (що звичайно розглядаються як безпечні). Список речовин GRAS наведений Управлінням по контролю за продуктами харчування і лікарськими засобами США в зводі федеральних нормативних актів (CFR) в 21 CFR §182 і 21 CFR §184, які включені в дану заявку за допомогою посилання. Переважні наповнювачі включають, не обмежуючись вказаними, гексити, в т. ч. маніт і т. п. 94036 20 У даному описі терміни «стабілізуюча концентрація органічного розчинника» або «стабілізуюча концентрація спирту» означають кількість органічного розчинника або спирту, яка зменшує рівень розкладання бендамустину, для досягнення вказаного в технічній умові рівня продуктів розкладання в кінцевому лікарському продукті. Наприклад, що стосується продукту розкладання НР1. стабілізуюча концентрація органічного розчинника являє собою таку кількість останнього, яка приводить до концентрації НР1 (в процентах від площі піка бендамустину), меншої ніж 0,5%, переважно меншої ніж 0,45%, переважно меншої ніж 0,40%, більш переважно меншої ніж 0,35%, більш переважно меншої ніж 0,30% і ще більш переважно меншої 0,25%. Що стосується сумарної або загальної концентрації продуктів розкладання в кінцевому лікарському продукті, стабілізуюча концентрація органічного розчинника є такою кількістю останнього, яка приводить до загальної концентрації продуктів розкладання (під час вивільнення лікарського продукту), меншої ніж приблизно 7% (в процентах площі піка бендамустину), переважно меншої ніж приблизно 6%, більш переважно меншої ніж приблизно 5% і ще більш переважно меншої ніж приблизно 4,0%. Під терміном «в процентах площі піка бендамустину» мається на увазі кількість конкретного продукту розкладання, наприклад НР1, по відношенню до кількості бендамустину, визначеної, наприклад, ВЕРХ. Термін «органічний розчинник» має на увазі органічну речовину, звичайно рідину, здатну розчиняти інші речовини. Термін «слідові кількості органічного розчинника» в даному описі означає кількість розчинника, яка менше або дорівнює рівню, рекомендованому для фармацевтичних продуктів, наприклад, рекомендованому вказівками ІСН (Міжнародними конференціями по гармонізації, Impurities Guidelines for Residual Solvents. Q3C. Federal Register. 1997; 62(247): 67377). Нижньою межею є найменша кількість, яка може бути виявлена. Термін «вивільнення» або «при вивільненні» означає лікарський продукт, який задовольняє технічним умовам по виділенню і може застосовуватися для наміченої фармацевтичної мети. А. Загальні зауваження У даному винаході розроблені стабільні, фармацевтично прийнятні композиції, одержані з бендамустину. Зокрема, винахід належить до складів для ліофілізації гідрохлориду бендамустину. Ліофілізований порошок, одержаний з таких складів, відновлюється легше, ніж доступний на цей час ліофілізований порошок бендамустину. Крім того, ліофілізовані продукти за даним винаходом мають кращій профіль забруднень в порівнянні з Ribomustin,ом відносно певних домішок, зокрема НР1, димеру бендамустину і етилового ефіру бендамустину, перед відновленням, при зберіганні продукту ліофілізації або після відновлення і змішування. Далі, в даному винаході розроблені склади бендамустину, застосовні для лікування неопластичних захворювань. Склади, описані в даній заявці, можуть вводитися самі по собі або в комбінації 21 з щонайменше одним додатковим антинеопластичним засобом і/або радіаційною терапією. Одним з аспектів даного винаходу є умови і засоби для поліпшення стабільності бендамустину до процесу ліофілізації і під час нього, при зберіганні або при відновленні. Антинеопластичні засоби, які можуть застосовуватися в поєднанні зі складами за даним винаходом, включають засоби, наведені в Merck Index 11, рр.. 16-17, Merck & Co., Inc. (1989) і The Chemotherapy Source Book (1997). Обидві книги широко визнані і легко доступні фахівцеві в даній галузі техніки. Існує велика кількість антинеопластичних засобів, доступних на комерційній основі, що проходять клінічну оцінку і доклінічну розробку, які могли б бути вибрані для лікування новоутворень шляхом комбінованої лікарської хіміотерапії. Такі антинеопластичні засоби належать до декількох основних категорій, а саме, можна виділити засоби класу антибіотиків, лікарські препарати, ковалентно зв'язуючі ДНК, антиметаболіти, гормональні засоби, включаючи глюкокортикоїди, такі як преднізон і дексаметазон, імунологічні засоби, засоби класу інтерферону, диференціювальні засоби, такі як ретиноїди, проапоптичні засоби, а також категорію засобів зі змішаним характером дії, в яку входять такі сполуки, як малі антисмислові РНК і т. п. Альтернативно можуть застосовуватися інші неопластичні засоби, такі як інгібітори матриксних металопротеаз (ММР), імітатори SOD або інгібітори альфау бета3. Одне з сімейств антинеопластичних засобів, які можуть застосовуватися в комбінації із сполуками за даним винаходом, складається з антинеопластичних засобів класу антиметаболітів. Придатні антиметаболіти для лікування новоутворень можуть бути вибрані з групи, яка складається з аланозину, AG2037 (Pfizer), 5-ри-фібриногену, акантифолієвої кислоти, амінотіадіазолу, бреквінару натрію, кармофуру, Ciba-Geigy CGP-30694, циклопентилу цитозину, цитарабіну фосфату стеарату, кон'югатів цитарабіну, Lilly DATHF, Merrel Dow DDFC, дезагуаніну, дідеоксицитидину, дідеоксигуанозину, дідоксу, Yoshitomi DMDC, доксифлуридину, Wellcome EHNA, Merck & Ca. EΧ-015, фазарабіну, флоксуридину, флударабіну фосфату, 5фторурацилу, N-(2'-фуранідил)-5-фторурацилу, Daiichi Seiyaku FO-152, ізопропілпіролізину, Lilly LY-188011, Lilly LY-264618, метобензаприму, метотрексату, Wellcome MZPES, норспермідину, NCI NSC-127716, NCI NSC-264880, NCI NSC-39661, NCI NSC-612567, Warner-Lambert PALA, пентостатину, піритрексиму, плікаміцину, Asahi Chemical PL-AC, Takeda TAC-788, тіогуаніну, тіазофурину, Erbamont TIF, триметрексату, інгібіторів тирозинкінази, інгібіторів тирозинпротешкінази, Tahio UFT і уріцитину. Друге сімейство антинеопластичних засобів, які можуть застосовуватися в комбінації із сполуками за даним винаходом, складається з засобів, ковалентно зв'язуючих ДНК. Придатні антинеопластичні засоби з групи алкілуючих засобів можуть бути вибрані з групи, яка складається з Shionogi 254-S, аналогів альдо-фосфаміду, алтретаміну, 94036 22 анаксирону, Boehringer Mannheim BBR-2207, бестрабуцилу, будотитану, Wakunaga CA-102, карбоплатину, кармустину, Chinoin-139, Chinoin-153, хлорамбуцилу, цисплатину, циклофосфаміду, American Cyanamid CL-286558, Sanofi CY-233, циплатату, Degussa D-19-384, Sumimoto DACHP(Myr)2, дифенілспіромустину, диплатинового цитостатику, похідних дистаміцину Erba, Chugai DWA-2114R, ITI E09, елмустану, Erbamont FCE24517, естрамустину фосфату натрію, фотемустину, Unimed G-6-M, Chinoin GYKI-17230, гепсульфаму, іфосфаміду, іпроплатину, ломустину, мафосфаміду, мелфалану, мітолактолу, Nippon Kayaku NK-121, NCI NSC-264395, NCI NSC-342215, оксаліплатину, Upjohn PCNU, преднімустину, Proter PTT-119, ранімустину, семустину, SmithKline SK&F-101772, Yakult Honsha SN-22, спіромустину, Tanabe Seiyaku TA-077, тауромустину, темозоломіду, тероксирону, тетраплатину і тримеламолу. Інше сімейство антинеопластичних засобів, які можуть застосовуватися в комбінації із сполуками, розкритими в даній заявці, складається з антинеопластичних засобів класу антибіотиків. Придатні антинеопластичні засоби класу антибіотиків можуть бути вибрані з групи, яка складається з Taiho 4181-А, акларубіцину, актиноміцину D, актинопланону, аланозину, Erbamont ADR-456, похідних аероплісиніну, Ajinomoto AN-201-II, Ajinomoto AN-3, Nippon Soda анісоміцинів. антрацикліну, азиноміцину-А, бісукаберину. Bristol-Myers BL-6859, Bristol-Myers BMY-25067, Bristol-Myers BMY-25551, Bristol-Myers BMY-26605, Bristor-Myers BMY-27557, Bristol-Myers BMY-28438, блеоміцину сульфату, бріостатину-1, Tahio З-1027, каліхеміцину, хромохіміцину, дактиноміцину, даунорубіцину, Kyowa Hakko DC-102, Kyowa Hakko DC-79, Kyowa Hakko DC-88A, Kyowa Hakko DC89-A1, Kyowa Hakko DC92-B, дитрисарубіцину В, Shionogi DOB-41, доксорубіцину, доксорубіцинфібриногену, елсаміцинуА, епірубіцину, ербстатину, езорубіцину, еспераміцину-А1, еспераміцину-A1b, Erbamont FCE-21954, Fujisawa FK-973, фострієцину, Fujisawa FR-900482, глідобактину, грегатину-А, грінкаміцину, гербіміцину, ідарубіцину, ілудинсу, казусаміцину, кесаріродинсу, Kyowa Hakko KM-5539, Kirin Brewery KRN8602, Kyowa Hakko KT-5432, Kyowa Hakko KT5594, Kyowa Hakko KT-6149, American Cyanamid LL-D49194, Meiji Seika ME 2303, меногарилу, мітоміцину, мітоксантрону, SmithKline M-TAG, неоенактину, Nippon Kayaku NK-313, Nippon Kayaku NKT01, SRI International NSC-357704, оксалізину, оксауноміцину, пепломіцину, пілатину, пірарубіцину, поротраміцину, піриндаміцину A, Tobishi RA-I, рапаміцину, різоксину, родорубіцину, сибаноміцину, свенміцину (siwenmycin), Sumitomo SM-5887, Snow Brand SN-706, Snow Brand SN-07, сорангіцину-А, спарсоміцину, SS Pharmaceutical SS-21020, SS Pharmaceutical SS-7313B, SS Pharmaceutical SS9816B, стефіміцину В, Tahio 4181-2, талісоміцину, Takeda TAN-868A, терпентецину, тразину, трикрозарину A, Upjohn U-73975, Kyowa Hakko UCN10028A, Fujisawa WF-3405, Yoshitomi Y-25024 і зорубіцину. Четверте сімейство антинеопластичних засобів, які можуть застосовуватися в комбінації із 23 сполуками за даним винаходом, включає сімейство різноманітних антинеопластичних засобів, вибраних з групи, яка складається з альфа-каротину, альфа-дифторметиларгініну, ацитретину, триоксиду миш'яку, Avastin (бевацизумабу), Biotec AD-5, Kyorin AHC-52, алстоніну, амонафіду, амфетинілу, амсакрину, ангіостату, анкіноміцину, антинеопластону А10, антинеопластону А2, антинеопластону A3, антинеопластону А5, антинеопластону AS2-1, Henkel APD, афідиколіну глінинату, аспарагінази, аваролу, бакхарину (baccharin), батрацикліну, бенфлурону, бензотрипту, Ipsen-Beaufour BIM-23015, бісантрену, Bristol-Myers BMY-40481, Vestar boron10, бромфосфаміду, Wellcome BW-502, Wellcome BW-773, карацеміду, карметізолу гідрохлориду, Ajinomoto CDAF, хлорсульфахіноксалону, Chemes CHX-2053, Chemex CHX-100, Warner-Lambert CI921, Warner-LamBert Cl-937, Warner-Lambert СІ941, Warner-Lambert CI-958, кланфенуру. клавіриденону, ICN сполуки 1259, ICN сполуки 4711, контракану, Yakult Honsha CPT-11, криснатолу, курадерму, цитохалазину В, цитарабіну, цитокітину, Merz D-609, DABIS малеату, дакарбазину, дателіптинію, дидемніну-В, ефіру дигематопорфірину, дигідроленперону, диналіну, дистаміцину, Toyo Pharmar DM-341, Toyo Pharmar DM-75, Daiichi Seiyaku DN-9693, еліпрабіну, еліптинію ацетату, epothionesTsumura ЕРМТС, ербітуксу, ерготаміну, урлотнібу, етопозиду, етретинату, фенретиніду, Fujisawa FR-57704, нітрату галію, генквадафніну, Gleevec (іматнібу), Chugai GLA-43, Glaxo GR63178, гефітинібу, грифолану NMF-5N, гексадецилфосфохоліну, Green Cross HO-221, гомогарингтоніну, гідроксисечовини, BTG ICRF-187, інданоцину, ілмофосину, ізоглутаміну, ізотретиноїну, Otsuka JI-36, Ramot K-477, Otsuak K-76COONa, Kureha Chemical K-AM, МЕСТ Corp KI-8110, American Cyanamid L-623, лейкорегуліну, лонідаміну, Lundbeck LU-23-112, Lilly LY-186641, NCI (US) MAP, марицину, мефлохіну, Merrel Dow MDL27048, Medco MEDR-340, мербарону, похідних мероціаніну, метиланілінакридину, Molecular Genetics MGI-136, мінактивіну, мітонафіду, мітохідону, мопідамолу, мотретиніду, Zenyaku Kogyo MST-16, N-ретиноїл)амінокислот, Nisshin Flour Milling N-021, N-ацилованих дегідроаланінів, нафазатрому, Taishio NCU-190, похідних нокодазолу, нормосангу, NCI NSC-145813, NCI NSC-361456, NCI NSC-604782, NCI NSC-95580, октреотиду, Ono ONO-112, охізаноцину, Akzo Org-10172, паклітакселу, панкратистатину, пазеліптину, WarnerLambert PD-111707, Warner-Lambert PD-115934, Warner-Lambert PD-131141, Pierre Fabre PE-1001, ICRT пептиду D, піроксантрону, полігематопорфірину, поліпреєвої кислоти, ефамолу порфірину, пробіману, прокарбазину, проглуміду, Invitron протеази нексину І, Tobishi RA-700, разоксану, Sapporo Breweries RBS, рестриктину-Р, ретеліптину, ретиноєвої кислоти. Rhone-Poulenc RP-49532. 94036 24 Rhone-Poulenc RP-56976, Rituxan (і інші анти CD20 антитіла, наприклад, Bexxar, Zevalin), SmithKline SK&F-104864, статинів (Lipitor і т. д.), Sumitomo SM-108, Kuraray SMANCS, SeaPharm SP-10094, спатолу, похідних спіроциклопропану, спірогерманію, унімеду, SS Pharmaceutical SS-554, стриполдинону, стиполдинону, Suntory SUN 0237, Suntory SUN 2071. супероксиду дисмутази, талідоміду, аналогів талідоміду, Toyama T-506, Toyama T-680, таксолу, Teijin TEI-0303, теніпозиду, талібластину, Eastman Kodak TJB-29, токотриєнолу, топостину, Teijin TT-82, Kyowa Hakko UCN-01, Kyowa Hakko UCN-1028, ukrain, Eastman Kodak USB-006, вінбластину сульфату, вінкристину, віндезину, вінестраміду, вінорелбіну, вінтриптолу, вінзолідину, вітанолідів і Yamanouchi YM-534, Zometa. Прикладами протипроменевих засобів, які можуть застосовуватися в комбінованої хіміотерапії за даним винаходом, є AD-5, adchnon (аденохром моногуанілгідразон метансульфонат), аналоги аміфостину, детокс, димесна, 1-102, MM-159, Nациловані дегідроаланіни, TGF-Genentech, типротимод, аміфостин, WR-151327, FUT-187, трансдермальний кетопрофен, набуметон, супероксид дисмутази (Chiron і Enzon). Способи одержання вказаних вище антинеопластичних засобів можуть бути знайдені в літературі. Наприклад, способи одержання доксорубіцину описані в патентах США №№ 3590028 і 4012448. Способи одержання інгібіторів матриксних металопротеаз описані в ЕР 780386. Способи одержання інгібіторів альфаv бета3 описані в WO 97/08174. Переважні антинеопластичні засоби включають, не обмежуючись цим, один або декілька засобів з числа даунорубіцину, блеоміцину, вінкристину, доксорубіцину, дакарбазину, преднізолону, мітоксантрону, преднізону, метотрексату, 5фторурацилу, дексаметазону, талідоміду, похідних талідоміду, 2МЕ2, неовастату, R 115777, триоксиду миш'яку, бортезомібу, тамоксифену, G3139 (антисмислового) і SU5416, мітоміцину, анти-СD20 антитіл, таких як Rituxan і R-етодолак. Переважні режими прийому лікарських засобів, в рамках яких можуть застосовуватися склади за даним винаходом в поєднанні з іншими компонентами або як заміна одного або декілька компонентів, включають, не обмежуючись цим, ABVD (доксорубіцин, блеоміцин, вінкристин, дикарбазин), DBV (даунорубіцин, блеоміцин, вінкристин), CVPP (циклофосфамід, вінбластин, прокарбазин, преднізолон), COP (циклофосфамід, вінкристин, преднізолон), CHOP (циклофосфамід, доксорубіцин, вінкристин і преднізон) і CMF (циклофосфамід, метотрексат, 5-фторурацил). Додаткові режими наведені нижче в таблиці А. 25 94036 26 Таблиця А Терапевтичні режими при лікуванні раку Скорочення AC CFM (CF, FNC) CMF NFL подальший Dox-CMF VATH EMA-86 Застосовувані лікарські засоби Доксорубіцин і циклофосфамід Циклофосфамід, фторурацил, мітаксантрон Циклофосфамід, метотрексат, фторурацил Мітоксантрон, фторурацил, лейковорин Доксорубіцин Вінбластин, доксорубіцин, тіотепа, флуоксиместерон Етопозид, мітоксантрон, цитарабін Цитарабін з даунорубіцином або ідаробіцином або мітоксантроном Цитарабін з даунорубіцином або мітоксантро5+2 ном HiDAC Цитарабін Доксорубіцин, блеоміцин, вінбластин, дакарбаABVD зин Хлорамбуцил, вінбластин, прокарбазин, предніChlVPP зон EVA Етопозид, вінбластин. доксорубіцин Меклоретамін, вінкристин, прокарбазин, предніMOPP зон Меклоретамін, вінкристин, прокарбазин, предніMOPP/ABV гібридний зон, доксорубіцин, блеоміцин, вінбластин Меклоретамін, доксорубіцин, вінбластин, блеоMOPP/ABVD міцин, етопозид, преднізон Циклофосфамід, мітоксантрон, вінкристин, преCNOP днізон Циклофосфамід, вінкристин, метотрексат, лейCOMLA коворин, цитарабін DHAP Дексаметазон, цисплатин, цитарабін Етопозид, метилпреднізолон, цисплатин, цитаESHAP рабін Метотрексат, лейковорин, доксорубіцин, циклоMACOP-B фосфамід, вінкристин, преднізон, блеоміцин, септра, кетоконазол Метотрексат, лейковорин, блеоміцин, доксоруm-BACOD біцин, циклофосфамід, вінкристин, дексаметазон MINE-ESHAP Месна, іфосфамід, мітоксантрон, етопозид NOVP Мітоксантрон, вінбластин, преднізон, вінкристин Преднізон, доксорубіцин, циклофосфамід, етоProMACE/cytaBOM позид, цитарабін, блеоміцин, вінкристин, метотрексат, лейковорин, септра Вінкристин, кармустин, циклофосфамід, мелфаM2 лан, преднізон МР Мелфалан, преднізон VAD Вінкристин, доксорубіцин, дексаметазон Вінкристин, кармустин, мелфалан, циклофосVBMCP фамід, преднізон 7+3 Як зазначалося в даному описі, ліофілізований склад бендамустину вдається одержати після видалення органічного розчинника і води. Найбільш типовим прикладом розчинника, що застосовується для одержання таких складів, є трет-бутанол (ТВА). Можуть застосовуватися інші органічні розчинники, в т, ч. етанол, н-пропанол, н-бутанол. Захворювання Рак грудей Рак грудей Рак грудей Рак грудей Рак грудей Рак грудей AML (Гостра мієлогенна лейкемія) (початкова стадія) AML (початкова стадія) AML (початкова стадія) AML (після ремісії) Хвороба Ходжкіна Хвороба Ходжкіна Хвороба Ходжкіна Хвороба Ходжкіна Хвороба Ходжкіна Хвороба Ходжкіна Неходжкінська лімфома Неходжкінська лімфома Неходжкінська лімфома Неходжкінська лімфома Неходжкінська лімфома Неходжкінська лімфома Неходжкінська лімфома Неходжкінська лімфома Неходжкінська лімфома Множинна мієлома Множинна мієлома Множинна мієлома Множинна мієлома ізопропанол, етилацетат, диметилкарбонат, ацетонітрил, дихлорметан, метилетилкетон, метилізобутилкетон, ацетон, 1-пентанол, метилацетат, метанол, чотирихлористий вуглець, диметилсульфоксид, гексафторацетон, хлорбутанол, диметилсульфон, оцтова кислота, циклогексан. Вказані розчинники можуть застосовуватися індивідуально 27 або в комбінації. Придатні для застосування розчинники повинні утворювати стабільні розчини з бендамустином і не повинні помітним чином руйнувати або дезактивувати АРІ. Розчинність бендамустину у вибраному розчиннику повинна бути досить високою для утворення комерційно придатних концентрацій лікарської речовини в розчиннику. Крім того, повинна бути можливість легко видаляти розчинник з водної дисперсії або розчину лікарської речовини, наприклад при ліофілізації або вакуумному сушінні. Переважно, застосовують розчин, що має концентрацію бендамустину приблизно 2-80 мг/мл. переважно приблизно 5-40мг/мл, більш переважно 5-20 мг/мл і ще більш переважно від 12 до 17 мг/мл. Фармацевтично прийнятний наповнювач для ліофілізації може бути розчинений у водній фазі. Приклади наповнювачів, застосовних для цілей даного винаходу, включають, не обмежуючись перерахованими, фосфат натрію або калію, лимонну кислоту, винну кислоту, желатин, гліцин, а також вуглеводи, такі як лактоза, сахароза, мальтоза, гліцерин, декстроза, декстран, трегалоза і гідроксіетилкрохмаль. Переважним наповнювачем є маніт. Інші наповнювачі, які можна застосувати при бажанні, включають такі антиоксиданти, як, не обмежуючись перерахованим, аскорбінова кислота, ацетилцистеїн, цистеїн, гідросульфіт натрію, бутилгідроксіанізол, бутилгідрокситолуол або альфа-токоферолацетат, або хелатоутворювальні реагенти. Типовий склад і ліофілізаційний цикл, що застосовуються за даним винаходом, наведені нижче. Ліофілізацію можна проводити із застосуванням стандартного обладнання, що використовується для ліофілізації або вакуумного сушіння. Цикл може змінюватися в залежності від обладнання і пристроїв, що застосовується для заповнення/завершення процесу. Відповідно до типового варіанта здійснення даного винаходу, по-перше, готують водний преліофілізаційний розчин або дисперсію в фармацевтично прийнятній судині для складання сумішей. Цей розчин піддають асептичному фільтруванню в стерильну місткість, розливають у флакони відповідного розміру, нещільно закривають і вміщують в ліофілізатор. Застосовуючи описані в даній заявці методики ліофілізації, розчин ліофілізують, доти, поки не буде досягнутий вміст вологи в діапазоні від приблизно 0,1 до приблизно 8,0 процентів. Одержаний в результаті ліофілізації порошок, будучи ліофілізованим порошком, стабільний від приблизно шести місяців до більше ніж приблизно 2 років, переважно більше приблизно 3 років, при температурі від приблизно 5°С до приблизно 25°С і може бути легко відновлений при додаванні стерильної води для ін'єкцій або іншого придатного носія, з утворенням рідких складів бендамустину, придатних для внутрішнього введення, наприклад, парентеральною ін'єкцією. Для внутрішньовенного введення відновлений рідкий склад, тобто фармацевтична композиція, переважно є розчином. Преліофілізаційний розчин або дисперсію звичайно, по-перше, готують в фармацевтично прийнятній місткості шляхом: 1) додавання до води 94036 28 (приблизно 65% від загального об'єму) наповнювача, такого як маніт (від приблизно 0 до приблизно 50 мг/мл), при перемішуванні при кімнатній температурі, 2) додавання до водного розчину органічного розчинника (0,5-99,9% об’ємн.), такого як ТВА, при перемішуванні і температурі приблизно 20-35°С, 3) додавання гідрохлориду бендамустину до бажаної концентрації при перемішуванні, 4) додавання води до досягнення кінцевого об'єму; і 5) охолоджування розчину до температури приблизно 1-30°С, переважно приблизно 5°С. Хоч вказані стадії наведені в певній послідовності, передбачається, що фахівець в даній галузі техніки може при необхідності міняти порядок проведення стадій і кількості інгредієнтів. Крім того, склад може бути приготований при використанні кількісних співвідношень речовин на масовій основі. Преліофілізаційний розчин або дисперсію можна стерилізувати перед ліофілізацією, причому стерилізацію, як правило, проводять шляхом асептичного фільтрування, наприклад через фільтр 0,22 мікрона або менше. Можна застосувати декілька стерилізаційних фільтрів. Можна добитися стерилізації розчину або дисперсії іншими способами, відомими в техніці, наприклад, опроміненням. У цьому випадку після стерилізації розчин або дисперсія готові для ліофілізації. Як правило, фільтрований розчин збирають в стерильну приймальну посудину і потім переносять в будь-який придатний контейнер або контейнери, в яких склад може бути ефективно ліофілізований. Звичайно склад ефективно і раціонально ліофілізовувати в контейнерах, в яких продукт повинен поступати на ринок, як, наприклад, не обмежуючись вказаним, у флаконах, описаних в даній заявці і відомих в техніці. Типовий спосіб, що застосовується для ліофілізації преліофілізаційного розчину або дисперсії, викладений нижче. Однак, фахівець в даній галузі техніки зрозумів би, що можуть бути здійснені модифікації описаного способу в залежності від таких речей, як, не обмежуючись перерахованим, преліофілізаційний розчин або дисперсія і ліофілізаційне обладнання. Спочатку продукт вміщують в ліофілізаційну камеру в певному діапазоні температур і потім піддають дії температури, значно меншої температури замерзання продукту, як правило, на декілька годин. Переважно, температура буде складати близько -40°С або нижче, і час - щонайменше 2 години. Після закінчення замерзання, камеру і конденсатор вакуумують за допомогою вакуумних насосів, причому поверхню конденсатора заздалегідь охолоджують циркулюючим холодоагентом. Переважно, конденсатор повинен бути охолоджений до температури нижче температури замерзання розчину, переважно до приблизно -40°С, більш переважно до приблизну -50°C або нижче, ще більш переважно до приблизно -60°С або нижче. Крім того, вакуумування камери потрібно продовжувати до досягнення тиску від приблизно 10мкм рт.ст до приблизно 600 мкм рт.ст., переважно від приблизно 50 до приблизно 150 мкм рт.ст. 29 Потім композицію, яка містить продукт, нагрівають у вакуумі в камері і конденсаторі. Цю операцію звичайно проводять нагріванням полиць в ліофілізаторі, на яких продукт залишається протягом всього процесу ліофілізації при тиску в діапазоні від приблизно 10 до приблизно 600 мкм рт.ст. Процес підвищення температури краще усього проводити дуже поступово, протягом декількох годин. Наприклад, температура продукту повинна бути спочатку підвищена від приблизно -30°С до приблизно -10°С і підтримуватися протягом приблизно 10-70 годин. Крім того, температура продукту може бути підвищена від температури замерзання до приблизно 25-40°С за період 30-192 години. Для запобігання викиду продукту ліофілізації з флаконів, повне видалення органічного розчинника і води повинно бути здійснене під час фази первинного висушування. Повнота висушування може бути підтверджена стабілізацією вакууму, температури конденсатора і температур полиць для продукту. Після первинного висушування температуру продукту потрібно підвищити до приблизно 25-40°С і підтримувати її протягом приблизно 5-40 годин. Коли цикл висушування завершений, тиск в камері може бути повільно піднятий до атмосферного (або трохи меншого) за допомогою стерильного сухого газоподібного азоту (або еквівалентного газу). Якщо композиція, що містить продукт, була ліофілізована в таких контейнерах, як флакони, останні можна закрити, видалити і щільно запечатати. Декілька типових зразків можна відібрати з метою виконання різних фізичних, хімічних і мікробіологічних тестів для аналізу якості продукту. Ліофілізований склад бендамустину, як правило, поступає в продаж у вигляді дозованої лікарської форми. Дозована лікарська форма за даним винаходом, хоч, в основному, ця форма є флаконом, може являти собою будь-який придатний контейнер, як, наприклад, ампули, шприци, флакони з вуглекислотою, в яких можливе підтримання стерильного середовища. Такі контейнери можуть бути скляними або пластмасовими, при умові, що матеріал не взаємодіє зі складом, який містить бендамустин. Закупорювальним засобом, як правило, є пробка, найбільш типово стерильна гумова пробка, переважно пробка з бромбутилкаучуку, який забезпечує герметичне ущільнення. Після ліофілізації, ліофілізованим порошком бендамустину можуть бути заповнені контейнери, як, наприклад, флакони або, з іншого боку, в такі флакони може бути вміщений преліофілізаційний розчин, який ліофілізують в цих флаконах, внаслі 94036 30 док чого безпосередньо одержують флакони, що містять ліофілізований склад бендамустину. Такі флакони після заповнення або ліофілізації в них розчину щільно закривають пробками, одержуючи запечатану, стерильну дозовану лікарську форму. Як правило, флакон повинен містити ліофілізований порошок, що включає приблизно 10-500 мг/флакон, переважно приблизно 100 мг/флакон, бендамустину і приблизно 5 мг-2 г/флакон, переважно приблизно 170 мг/флакон, маніту. Ліофілізовані склади за даним винаходом можуть бути відновлені водою, переважно стерильною водою для ін'єкцій або іншими стерильними рідинами, такими як додаткові розчинники, з метою одержання придатного розчину бендамустину для введення шляхом парентеральної ін'єкції після подальшого розбавлення в контейнері придатною внутрішньовенною сумішшю, наприклад, нормальним сольовим розчином. В. Розчинність Розчинність гідрохлориду бендамустину (бендамустину) в чистій воді, а також у воді з різними кількостями спиртів, що звичайно застосовуються при ліофілізації, наприклад, метанолу, етанолу, пропанолу, ізопропанолу, бутанолу і третбутилового спирту (ТВА), визначали візуально. Кількість бендамустину, необхідна для одержання концентрації 15 мг/мл, змішану з манітом в кількості 25,5 мг/мл. змішували з 10 мл спиртового розчину, що досліджується, при кімнатній температурі (дивіться таблицю 1). Потім зразки охолоджували до 5°С і оглядали через 0, 3, 6 і 24 години для виявлення утворення частинок і/або осаду. Результати, наведеш в таблиці 1, показують, що розчинність бендамустину залежить від температури і кількості спирту у водних розчинах. Для досліджених спиртів розчинність бендамустину збільшувалася із зростанням концентрації спирту. Утворення осаду також залежало від температури і часу. З будь-яким спиртом бендамустин не осаджувався негайно, але кристалізувався після зберігання при 5°С. Спирти розрізнювалися за своїм впливом на розчинність. Не бажаючи обмежуватися якою-небудь конкретною теорією, спирти з молекулами меншого розміру, такі як метанол і етанол, мають менший вплив на розчинність в порівнянні зі спиртами, які мають молекули більшого розміру (трет-бутанол і н-бутанол). Однак важливу роль грає також форма молекули спирту. Наприклад, було знайдено, що н-пропанол перевершує ізопропанол з точки зору запобігання утворенню осаду в даній системі. Двома спиртами з найбільшим впливом на розчинність були нпропанол і трет-бутанол. 31 94036 32 Таблиця 1 Розчинність бендамустину протягом 24 годин в різних спиртах при зберіганні при 5°С 0 годин Метанол (об’ємн. %) 0% (чиста вода) 5% 10% 20% 30% Етанол (об’ємн. %) 1,9% 5% 10% 20% 30% н-пропанол (об’ємн. %) 5% 10% 20% 30% ізопропанол (об’ємн. %) 5% 10% 20% 30% н-бутанол (об’ємн. %) 5% 10% 20% 30% трет-бутанол (об’ємн. %) 5% 10% 20% 30% 3 години 6 годин 24 години CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS осад осад CCS CCS CCS осад осад осад осад CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS осад осад CCS CCS CCS осад осад осад CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS осад CCS CCS CCS CCS CCS CCS CCS осад CCS CCS CCS осад CCS CCS CCS осад CCS CCS CCS CCS CCS 2 шари 2 шари CCS CCS 2 шари 2 шари CCS CCS 2 шари 2 шари CCS CCS 2 шари 2 шари CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS CCS осад осад CCS CCS CCS означає прозорий безбарвний розчин Результати експериментів по кількісному визначенню розчинності бендамустину при різних температурах для трьох різних розчинів наведені на Фіг. 1 і в таблиці 2. Використана в експерименті кількість ТВА, а саме 20 об’ємн. % і 30 об’ємн. %, була вибрана на основі досліджень стабільності (результати описані нижче). Для обох досліджених розчинів розчинність бендамустину лінійно знижувалася із зміною температури від 25°С до 0°С. Цей експеримент підтвердив дані, показані в таблиці 1, і підкресливвідмінність в розчинності бендамустину для 20% і 30% розчинів ТВА. Таблиця 2 Розчинність бендамустину в ТВА -8°С 20% (об’ємн.) ТВА 25,5 мг/мл маніту вода q.s. до бажаного об'єму 30% (об’ємн.) ТВА 25,5 мг/мл маніту вода q.s. до бажаного об'єму 0°С 5°С 25°С 14 мг/мл 11 мг/мл 17 мг/мл 47 мг/мл 20 мг/мл 18 мг/мл 27 мг/мл 65 мг/мл q.s. достатня кількість С. Стабільність Через нестабільність водних розчинів, яка викликається гідролізом під дією води, бендамустин потребує ліофілізації, щоб зробити продукт придатним для фармацевтичного застосування. Однак, під час виробництва ліофілізованого лікарського 33 94036 продукту, перед ліофілізацією звичайно потрібно одержувати водні розчини для заповнення контейнерів. Таким чином, застосування водних розчинів під час одержання композицій і наповнення у випадку бендамустину і іншого азотистого іприту може приводити до розкладання лікарської сполуки. Внаслідок цього, проводили оцінку впливу різних спиртів на розкладання бендамустину, щоб визначити, чи можуть бути виявлені склади, які дали б можливість збільшити час від заповнення до кінця процесу ліофілізації, даючи порошки ліофілізатів, які могли б відновлюватися швидше, ніж існуючий на цей час склад Ribomustin, і/або забезпечувати одержання препаратів бендамустину з кращим профілем забруднень відносно певних домішок, наприклад, НР1 і димеру ВМ1 в порівнянні з Ribomustin. Переважно, ліофілізований препарат за даним винаходом стабільний з точки зору кількості НР1, тобто кількість НР1 помітно не зростає (не пере 34 вищує технічних умов на зберігання) протягом 6 місяців, більш переважно 12 місяців і ще більш переважно більше 24 місяців, наприклад 36 місяців, у випадку зберігання при температурі від приблизно 2°С до приблизно 30°С, переважно 5°С. У таблиці 3 показані результати, що належать до стабільності бендамустину у воді без додавання спирту протягом 24 годин при 5°С. Бендамустин швидко розкладається в чистій воді і в основному утворює продукт гідролізу, тобто НР1 (моногідроксибендамустин). Таблиця 3 Стабільність бендамустину у воді 0% спирту, тобто чиста вода Час витримування 0 годин 3 години 6 годин 24 години Чистота (% площі піка) 99,11 98,83 98,44 95,67 Іншим основним продуктом розкладання, що спостерігався під час цього дослідження, а також НР1 (%) 0,60 0,86 1,22 3,81 Димер (%) 0,11 0,13 0,17 0,29 інших досліджень довготривалої стабільності, був Димер бендамустину. Іншими продуктами розпаду, що містилися в ліофілізованому продукті Ribomustin, є етиловий ефір бендамустину (ВМ1ЕЕ) (формула (IV)) і BM1DCE (формула (V)). ВМ1ЕЕ утворюється при реакції бендамустину з етиловим спиртом. На Фіг. 2 підсумовані результати дослідження чистоти ВЕРХ-аналізом після витримування бендамустину в різних спиртах протягом 24 годин при 5°С. Результати представлені у вигляді процентів площі того або іншого піка від загальної площі всіх піків. Числові значення, відображені на Фіг. 2, наведені в таблицях 3-9. Найбшьш висока чистота спостерігалася в розчинах, що містять більш високі концентрації спиртів, незалежно від природи спирту. Серед досліджених спиртів, найменше 35 94036 розкладання бендамустину спостерігалося в розчині, що містить приблизно 30% (об’ємн.) ТВА. Серед приблизно 10% і приблизно 20% спиртових розчинів, найкращі результати в запобіганні розпаду бендамустину показав н-бутанол. При 20% і 30% (об’ємн.) змішування н-бутанолу з водою приводило до утворення двофазної системи через нерозчинність н-бутанолу у воді при цих концентраціях. На Фіг. 3 і 4 показана визначена способом ВЕРХ (як описано в даній заявці) кількість бенда 36 мустину, що розклався, виміряна по утворенню НР1 і димеру. Утворення НР1 і дим еру зростає із зменшенням концентрації спирту, незалежно від конкретного спирту. Це збільшення кількості домішок відбувається з очікуваною залежністю від часу (дивіться таблиці 3-9). Трет-бутанол і н-бутанол перевершували інші спирти з точки зору запобігання руйнуванню продукту. Як видно з таблиці 10, маніт не здійснював впливу на стабілізацію бендамустину трет-бутанолом. Таблиця 4 Результати ВЕРХ, що належать до стабільності бендамустину в розчинах етилового спирту різної концентрації протягом 24 годин. НР1 і димер були домішками, кількість яких збільшувалася на цій стадії. Об'ємний процент спирту 1,9% етанол 5% етанол 10% етанол 20% етанол 30% етанол Час витримування 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години Чистота (% площі) 99,11 98,83 98,60 96,16 99,31 99,10 98,87 96,89 99,44 99,28 99,10 98,03 99,54 99,45 99,36 98,61 99,62 99,56 99,52 99,21 НР1 (%) 0,64 0,90 1,12 3,41 0,44 0,64 0,86 2,68 0,33 0,48 0,65 1,57 0,22 0,30 0,39 0,96 0,15 0,21 0,24 0,45 Димер (%) 0,12 0,14 0,15 0,27 0,12 0,13 0,14 0,25 0,11 0,12 0,12 0,18 0,10 0,11 0,11 0,15 0,10 0,11 0,12 0,12 Таблиця 5 Результати ВЕРХ, що належать до стабільності бендамустину в розчинах трет-бутанолу різної концентрації протягом 24 годин. НР1 і димер були домішками, кількість яких збільшувалася на цій стадії. Концентрація спирту (об’ємн.) 5% трет-бутанол 10% трет-бутанол 20% трет-бутанол 30% трет-бутанол Час витримування Чистота (% площі) НР1 (%) Димер (%) 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 99,34 99,10 98,85 97,58 99,46 99,26 99,05 98,04 99,59 99,48 99,35 98,35 99,63 99,60 99,58 99,42 0,41 0,64 0,88 2,09 0,30 0,48 0,69 1,64 0,17 0,29 0,40 1,27 0,13 0,16 0,18 0,34 0,12 0,14 0,13 0,20 0,11 0,12 0,13 0,19 0,11 0,11 0,12 0,20 0,10 0,10 0,11 0,12 37 94036 38 Таблиця 6 Результати ВЕРХ, що належать до стабільності бендамустину в розчинах н-пропілового спирту різної концентрації протягом 24 годин. НР1 і димер були домішками, кількість яких збільшувалася на цій стадії. Концентрація спирту (об’ємн.) 5% н-пропанол 10% н-пропанол 20% н-пропанол 30% н-пропанол Час витримування 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години Чистота (% площі) 99,25 99,00 98,72 97,24 99,34 99,17 98,92 97,67 99,45 99,42 99,29 98,60 99,53 99,51 99,44 99,27 НР1 (%) 0,43 0,66 0,94 2,33 0,33 0,48 0,70 1,83 0,33 0,26 0,39 0,97 0,15 0,15 0,20 0,36 Димер (%) 0,13 0,15 0,16 0,26 0,15 0,14 0,16 0,28 0,13 0,13 0,14 0,24 0,13 0,15 0,11 0,17 Таблиця 7 Результати ВЕРХ, що належать до стабільності бендамустину в розчинах ізопропілового спирту різної концентрації протягом 24 годин. НР1 і димер були домішками, кількість яких збільшувалася на цій стадії. Концентрація спирту (об’ємн.) 5% ізопропанол 10% ізопропанол 20% ізопропанол 30% ізопропанол Час витримування 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години Чистота (% площі) 99,21 98,65 38,56 96,14 99,32 99,11 98,85 97,68 99,49 99,39 99,22 98,61 99,56 99,47 99,40 99,15 НР1 (%) 0,48 0,72 1,02 3,35 0,37 0,55 0,75 1,92 0,21 0,31 0,42 1,04 0,15 0,20 0,24 0,52 Димер (%) 0,13 0,14 0,14 0,26 0,12 0,14 0,16 0,21 0,11 0,12 0,13 0,17 0,10 0,12 0,11 0,14 Таблиця 8 Результати ВЕРХ, що належать до стабільності бендамустину в розчинах метилового спирту різної концентрації протягом 24 годин. НР1 і дим ер були домішками, кількість яких збільшувалася на цій стадії. Концентрація спирту (об’ємн.) 5% метанол 10% метанол Час витримування 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години Чистота (% площі) 99,35 98,97 98,66 96,65 99,42 99,01 98,86 97,65 НР1 (%) 0,40 0,70 0,95 2,83 0,34 0,59 0,80 1,85 Димер (%) 0,12 0,14 0,14 0,23 0,11 0,12 0,12 0,18 39 94036 40 Продовження таблиці 8 20% метанол 30% метанол 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 99,56 99,31 98,99 98,31 99,59 99,43 99,25 98,65 0,22 0,38 0,50 1,15 0,18 0,27 0,34 0,76 0,11 0,11 0,12 0,16 0,10 0,11 0,11 0,13 Таблиця 9 Результати ВЕРХ, що належать до стабільності бендамустину в розчинах н-бутилового спирту різної концентрації протягом 24 годин. НР1 і димер були домішками, кількість яких збільшувалася на цій стадії. Концентрація спирту (об’ємн.) 5% бутанол 10% бутанол 20% бутанол 30% бутанол Час витримування 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години 0 годин 3 години 6 годин 24 години а - Обидва розчини включали 2 рідких шари/фази в посудині. Перед приготуванням зразка розчини енергійно перемішували Чистота (% площі) 99,25 98,94 98,76 97,46 99,44 99,18 99,03 98,13 99,54 99,45 99,30 98,81 99,55 99,40 99,40 99,00 НР1 (%) 0,49 0,73 0,91 2,20 0,30 0,49 0,64 1,55 0,23 0,31 0,40 0,91 0,24 0,29 0,37 0,74 Димер (%) 0,13 0,14 0,14 0,21 0,11 0,12 0,12 0,17 0,10 0,11 0,11 0,14 0,10 0,10 0,11 0,12 Результати, наведені в таблицях 1-9, показують, що стабільність гідрохлориду бендамустину у відношенні утворення НР1 і димеру поліпшується із збільшенням концентрації спирту. Таблиця 10 Результати ВЕРХ, що належать до стабільності бендамустину в ТВА в присутності і за відсутності маніту протягом 24 годин Зразок ТВА 20% (об’ємн.) з манітом 0 годин 24 години при 5°С ТВА 20% (об’ємн.) без маніту 0 годин 24 години при 5°С Чистота (% площі) НР1 (%) 99,59 99,35 0,17 1,27 100,0 98,80 0,00 1,21 Примітка: Зразки, що не містили маніту, аналізували ВЕРХ, використовуючи спосіб на нормальній фазі, тоді як зразки, що містили маніт, аналізували із застосуванням способу ВЕРХ на оберненій фазі. Незначна відмінність в результатах між двома цими способами могла спостерігатися і в інших проаналізованих зразках. D. Розробка циклу ліофілізації Готували різні преліофілізаційні склади з різними концентраціями бендамустину, маніту і спиртів у воді. Змінювали і оптимізували хід циклу на кожній стадії, в т. ч. для заморожування (швидке або повільне), первинного висушування (міняли як температуру, так і тиск) і вторинного висушування, як описано в даній заявці. На основі всієї інформації про розчинність, стабільність і легкість ліофілізації, детально описану вище, в число переважних складів входять наступні: 41 94036 42 вода q.s. до Інгредієнти бендамустин маніт спирт вода q.s. до Концентрація приблизно 2-40 мг/мл приблизно 0-50 мг/мл приблизно 0,5%-40% (об’ємн.) бажаного об'єму де спирт вибраний з метанолу, н-пропанолу або ізопропанолу Інгредієнти бендамустин маніт спирт вода q.s. до Концентрація приблизно 5-20 мг/мл 10-30 мг/мл 1-20% (об’ємн.) бажаного об'єму де спирт вибраний з метанолу, н-пропанолу або ізопропанолу Інгредієнти бендамустин маніт спирт вода q.s. до Концентрація приблизно 5-20 мг/мл 10-30 мг/мл 5-40% (об’ємн.) бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 12-17 мг/мл дрохлорид маніт приблизно 20-30 мг/мл спирт приблизно 5-15% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 15 мг/мл дрохлорид маніт приблизно 25,5 мг/мл спирт приблизно 10% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 2-40 мг/мл дрохлорид маніт приблизно 0-50 мг/мл бутанол приблизно 0,5-20% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 5-20 мг/мл дрохлорид маніт приблизно 10-30 мг/мл бутанол приблизно 1-10% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 12-17 мг/мл дрохлорид маніт приблизно 20-30 мг/мл бутанол приблизно 1-10% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 15 мг/мл дрохлорид маніт приблизно 25,5 мг/мл бутанол приблизно 10% (об’ємн.) бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 2-50 мг/мл дрохлорид маніт приблизно 0-50 мг/мл трет-бутанол приблизно 0,5-100% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 2-50 мг/мл дрохлорид маніт приблизно 0-50 мг/мл трет-бутанол приблизно 0,5-99,9% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 2-50 мг/мл дрохлорид маніт приблизно 0-50 мг/мл трет-бутанол приблизно 0,5-99% (оо'ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 2-50 мг/мл дрохлорид маніт приблизно 0-50 мг/мл трет-бутанол приблизно 90-99% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 5-20 мг/мл дрохлорид маніт приблизно 10-30 мг/мл трет-бутанол приблизно 5-80% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 12-17 мг/мл дрохлорид маніт приблизно 20-30 мг/мл трет-бутанол приблизно 10-50% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 12,5-15 мг/мл дрохлорид маніт приблизно 0-30 мг/мл етанол приблизно 20-30% (об’ємн.) вода q.s. до бажаного об'єму Інгредієнти Концентрація бендамустину гіприблизно 15 мг/мл дрохлорид маніт приблизно 25,5 мг/мл трет-бутанол приблизно 30% (об’ємн.) вода q.s. до бажаного об'єму Приклади Наступні приклади наведені для ілюстрації деяких аспектів даного винаходу і з метою сприяння фахівцям в даній галузі техніки при практичному застосуванні винаходу. Ці приклади ніяким чином не треба розглядати, як обмеження об'єму даного винаходу. 43 94036 Матеріали: Гідрохлорид бендамустину (Degussa, партії №№ 0206005 і 0206007) маніт, NF або еквівалентний (Mallinckrodt) дегідратований етиловий спирт (200 градус міцності) USP або еквівалентний (Spectrum) трет-бутиловий спирт, ACS (EM Science) метанол (Spectrum і EMD) пропанол (Spectrum) ізопропанол (Spectrum) бутанол (Spectrum) вода, категорії для ВЕРХ або еквівалентна (EMD) ацетонітрил, категорії для ВЕРХ або еквівалентний (EMD) трифтороцтова кислота, J.T.Baker Методика 1 Рухома фаза А: рухома фаза В: УФ: швидкість потоку: температура колонки: колонка: температура зразка: об'єм уприскування: концентрація зразка: градієнт: час проведення хроматографування: час після хроматографування: Методика 2 Рухома фаза А: рухома фаза В: УФ: швидкість потоку: колонка: температура колонки: температура зразка: об'єм уприскування: концентрація зразка: градієнт: час проведення хроматографування: час після хроматографування: Методика 3 Фаза А: Фаза В: УФ: швидкість потоку: колонка: температура колонки: температура зразка: об'єм уприскування: час проведення дослідження: 44 метанол, категорії для ВЕРХ або еквівалентний (EM Science, кат. № МХ0488Р-1) трифтороцтова кислота, категорії для ВЕРХ або еквівалентна (JT Baker, кат. № JT9470-01) Обладнання: ВЕРХ система з фотодіодним матричним детектором Waters 2695 Alliance ВЕРХ система з подвійним детектором довжини хвилі Waters 2795 Alliance аналітична вага (Mettler AG285, ID #1028) і (Mettler XS205) VirTis ліофілізатор Advantage Agilent Zorbax SB-C18 5 мкм 80Å 4,6x250 мм колонка, кат. № 880975-902 Приклад 1: Методики ВЕРХ 0,1% ТФО; Н2О 0,1% ТФО; 50% ацетонітрил:50% H2О 230 нм 1,0 мл/хв. 30°С Zorbax SB-C18 5 мкм 80Å 4,6x250 мм 5°С 10 мкл 0,25 мг/мл в МеОН 20% В протягом 1 хв. 20-90% В протягом 23 хв. 90% В протягом 6 хв. повернення до 20% В протягом 1 хв. витримування при 20% В протягом 4 хв. 30 хв. 5 хв. 0,1% ТФО; Н2О:ацетонітрил (9:1) 0,1% ТФО; Н2О:ацетонітрил (5:5) 230 нм 1,0 мл/хв. Zorbax SB-C18 5 мкм 80Å 4,6x250 мм 30°С 5°С 10 мкл 0,25 мг/мл в МеОН 0% В протягом 3 хв. 0-50% В протягом 13 хв. 50-70% В протягом 17 хв. 70-90% В протягом 2 хв. 90% В протягом 5 хв. повернення до 0% В протягом 1 хв. витримування при 0% В протягом 4 хв. 40 хв. 5 хв. вода категорії для ВЕРХ з 0,1% ТФО (об’ємн.) ацетонітрил категорії для ВЕРХ/вода (1:1 об’ємн.) з 0,1% ТФО (об’ємн.) 254 нм 1,0 мл/хв. Zorbax SB-C18 5 мкм 80Å 4,6x250 мм 30°С 5°С 5 мкл 30 хв. 45 94036 час після дослідження: розріджувач: градієнт: 9 хв. метанол Час (хв.) 0,0 7,0 11,0 15,0 30,0 31,0 % Фази А 82 60 60 20 20 82 Спосіб приготування зразків: розчиняли лікарський продукт в 200 мл МеОН. Впливали ульМетодика 4 Фаза А: Фаза В: УФ: швидкість потоку: колонка: температура колонки: температура зразка: об'єм уприскування: час проведення дослідження: час після дослідження: розріджувач: градієнт: Час (хв.) 0,0 5 13 16 25 31 % Фази А 93 93 73 73 10 10 % Фази В 18 40 40 80 80 18 тразвуком протягом 6 хвилин. Розчин можна вводити безпосередньо в ВЕРХ (прибл. 0,5 мг/мл). вода категорії для ВЕРХ з 0,1% ТФО (об’ємн.) ацетонітрил категорії для ВЕРХ з 0,1% ТФО (об’ємн.) 254 нм 1,0 мл/хв. Zorbax Bonus RP-C14 5мкм 4,6x150 мм 30°С 5°С 2 мкл 31 хв. 5 хв. NMP/0,1% ТФО у воді (50:50 об’ємн.) % Фази В 7 7 27 27 90 90 Приготування зразка для методики 4: розчиняли лікарський продукт у відомій кількості розріджувача для досягнення концентрації 4,2 мг/мл для уприскування безпосередньо в ВЕРХ. Може виявитися необхідним здійснити друге розбавлення (для лікарської форми 100 мг/флакон) для одержання концентрації зразка 4,2 мг/мл. Результати Часи утримування для деяких домішок бендамустину при застосуванні описаної вище методики 1 показані в таблиці 11. ВЕРХ-хроматограма Ribomustin, одержана із застосуванням вказаної тут методики, наведена на Фіг. 6. Таблиця 11 Час утримування для бендамустину і деяких домішок при використанні ВЕРХ за методикою 1 Найменування сполуки НР1 бендамустин 46 Час утримування (хв.) 14,110 22,182 ВМ1 димер ВМ1ЕЕ 24,824 26,968 Хоч при проведенні ВЕРХ за методикою 1 можна виявити домішки, виявлені в бендамустині, дана методика не здатна відділити потенційну домішку, що утворюється під час аналізу, а саме метиловий складний ефір бендамустину (ВМ1МЕ). Різниця часів утримування ВМ1МЕ і димеру ВМ1 становила лише 0,3 хвилини. Для розрізнення сигналу димеру ВМ1 була розроблена інша методика ВЕРХ (№ 2). Методика ВЕРХ № 2 здатна розділити всі домішки, але вимагає більш тривалого часу, рівного 45 хвилинам (таблиця 12). Таблиця 12 Час утримування для бендамустину і деяких домішок при використанні ВЕРХ за методикою 2 Найменування сполуки НР1 ВМ1 ВМ1МЕ ВМ1 димер ВМ1ЕЕ Час утримування (хв.) 15,694 25,420 31,065 32,467 36,038 Профіль забруднення в різних партіях Ribomustin'y, встановлений за методикою З ВЕРХ, показаний в таблиці 13. 47 94036 48 Таблиця 13 Профіль забруднення Ribomustin'y, встановлений за, методикою 3 ВЕРХ партія 03H08 03Н07 02K27 03С08 Бендамустин (HCl) 98,14 97,67 96,93 97,61 % площі піків НР1 ВМ1EЕ 1,07 0,21 1,5 0,2 0,93 0,29 1,24 0,19 Приклад 2: Розчинність Розчинність гідрохлориду бендамустину (бендамустин) у воді (чистій) і у воді з добавками різних кількостей метанолу, етанолу, пропанолу, ізопропанолу, бутанолу і трет-бутилового спирту (ТВА) визначали візуально. Готували розчини бендамустину в кількості 15 мг/мл і маніту в кількості 25,5 мг/мл в 10 мл вказаних спиртових розчинів (таблиця 1) при кімнатній температурі. Потім зразки охолоджували до 5°С і оглядали через 0, 3, 6 і 24 години з метою виявлення частинок і/або осадів. Результати, підсумовані в таблиці 1, показують, що розчинність бендамустину знаходиться в залежності від температури і кількості спиртів у водних розчинах. Для всіх спиртів розчинність бендамустину збільшувалася із зростанням концентрації спирту. Утворення осадів також залежало від температури і часу. Крім того, визначали розчинність бендамустину в 20% (об’ємн.) розчині ТВА у воді, що містив маніт в концентрації 25,5 мг/мл, і в 30% (об’ємн.) розчині ТВА у воді, що містив маніт в концентрації 25,5 мг/мл (Фіг. 1). Бендамустин додавали до 4 мл кожного розчину при перемішуванні, доти, поки він не припиняв розчинятися. Насичені розчини залишали перемішуватися протягом 1 години при -8°С, 0°С, 5°С або 25°С. Зразки центрифугували і знову витримували при тій же температурі протягом мінімум 30 хвилин. Зразок, який випробовували при температурі -8°С, вміщували в льодяну баню, що містить хлорид натрію, який знижував температуру льодяної бані, і вимірювали температуру при витяганні зразка для проведення аналізуй кожного зразка відбирали аліквоту і готували зразок для аналізу ВЕРХ. Результати описаних експериментів показані на Фіг. 1 і в таблиці 2. Використані в експериментах (Фіг. 1) концентрації розчинів ТВА, тобто 20% (об’ємн.) і 30% (об’ємн.), були засновані на дослідженнях стабільності розчинів бендамустину, описаних в даній заявці. Як показано на Фіг. 1, розчинність бендамустину лінійно зменшується з температурою (від 25°С до 0°С). Розчинність бендамустину демонструє температурну залежність, як при розчиненні в чистій воді, так і у воді зі спиртом. Концентрація розчину ТВА, рівна 20% (об’ємн.), ймовірно, може бути нижньою границею, необхідною для ефективного і стійкого фармацевтичного виробництва з точки зору стабільності і розчинності бендамустину. Розчин із вмістом бендамустину 15 мг/мл близький до межі насичення 17,2 мг/мл бендамустину ВМ1 димер 0,34 0,33 1,18 0,46 BM1DCE 0,03 0,04 0,08 0,02 при 5°С, але перевищує цю межу при 0°С. Концентрація 30% (об’ємн.) ТВА є рекомендованою концентрацією ТВА для кінцевого складу, і при цій концентрації розчинність бендамустину із запасом укладається в межі розчинності, незалежно від температури. Приклад 3: Стабільність A. Стабільність у воді При кімнатній температурі готували розчини бендамустину (15 мг/мл) і маніту (25,5 мг/мл) у воді і негайно вміщували їх в льодяну баню (для швидкого зниження температури до приблизно 5°С на 10 хвилин і потім тримали охолодженими при 5°С. Зразки кожного складу аналізували ВЕРХ, застосовуючи описані в даній заявці методики, через 0, 3, 6 і 24 години зберігання при 5°С. B. Стабільність в спиртах При кімнатній температурі готували розчини, що містять 15 мг/мл бендамустину, 25,5 мг/мл маніту і 1,9%, 5%, 10%, 20% або 30% (об’ємн.) етилового спирту у воді або 5%, 10%, 20% або 30% (об’ємн.) ТВА, метанолу, пропанолу, ізопропанолу або бутанолу у воді, вміщували їх в льодяну баню на 10 хвилин і потім тримали охолодженими при 5°С. Зразки кожного складу аналізували ВЕРХ, застосовуючи описані в даній заявці методики, через 0, 3, 6 і 24 години зберігання при 5°С. С. Результати дослідження стабільності У таблиці 3 показані результати досліджень стабільності бендамустину у воді без добавок спиртів протягом 24 годин при 5°С. Бендамустин швидко розкладається у воді, але його стабільність збільшується із зростанням концентрації спирту (Фіг. 2, 3 і 4). Хоч спирти часто застосовуються при ліофілізації для сприяння розв'язанню проблеми розчинності, вплив спиртів на стабільність бендамустину є винятковим, несподіваним і корисним при виробництві препаратів бендамустину з меншою кількістю домішок, оскільки при збереженні стабільності бендамустину може застосовуватися водний розчин. Було знайдено, що ТВА є кращим стабілізатором серед шести досліджених спиртів (Фіг. 2, 3 і 4). Всі спирти при концентрації 30% (об’ємн.) зменшували утворення таких домішок, як НР1 і димер, протягом 24 годин при 5°С. Що стосується ТВА, вміст НР1 досягає лише 0,4% у випадку зберігання при 5°С протягом терміну до 24 годин. Більш низькі концентрації спирту можуть не бути ефективними при вмісті бендамустину 15 мг/мл і зберіганні при 5°С через осадження бендамустину і утворення забруднюючих речовин. Приклад 4: Оптимізація складу 49 Після того, як були визначені розчинність і стабільність бендамустину, проводили оптимізацію складу для ліофілізації. Оскільки концентрація бендамустину була вище в насиченому розчині в суміші 30% TBA/вода в порівнянні з іншими спиртовими розчинами, очікувалося, що об'єм флакона, необхідного для розчинення 100 мг бендамустину, буде меншим, ніж для існуючого на цей час препарату Ribomustin. Хоч насичений розчин бендамустину при 0°С містить 18 мг/мл, для складу була вибрана концентрація 15 мг/мл, для компенсації незначних відмінностей розчинності АРІ через відмінності в об'ємній чистоті АРІ внаслідок відмінності між партіями. При концентрації бендамустину 15 мг/мл потрібно 6,67 мл для одержання насиченого розчину 100 мг гідрохлориду бендамустину на флакон. Співвідношення площі поверхні (сублімації) до об'єму є вирішальним для одержання ліофілізованого продукту з хорошим зовнішнім виглядом, який швидко висушується в замороженому стані. Як правило, ліофілізовані продукти займають від 30 до 50% об'єму флакона. 5,67 мл розчину займають 30% об'єму 20 мл флакона, причому співвідношення площі поверхні до об'єму становить 0,796см2/мл. Маніт був вибраний як наповнювач, щоб склад залишався схожим на Ribomustin. Були проведені дослідження для оцінки впливу маніту на розчинність бендамустину і зовнішній вигляд продукту. Маніт зменшував розчинність бендамустину (при 15 мг/мл) у водних розчинах, як етанолу, так і TBA. Наприклад, розчини, що містили 5% і 10% етанолу і TBA, без маніту не виділяли осаду протягом 24 годин. Однак для зразків з манітом (таблиця 1) утворення осаду спостерігалося протягом 24 годин. Осад не випадав з водного розчину, що містив 30% (об’ємн.) TBA, 15 мг/мл бендамустину і 25,5 мг/мл маніту. Для того щоб зберегти коржик ліофілізованого продукту хорошої форми, стійкої до дроблення при обробці, було потрібно мінімум 134 мг маніту на флакон, причому відмінності по цьому параметрі не спостерігалися до вмісту маніту 200 мг/флакон. Всі досліджені спирти збільшували стабільність і розчинність бендамустину. Однак, була необхідна значна мольна частка спирту для впливу на стабільність заповнюючого розчину і легкість виробництва препарату. У випадку спиртів з молекулами матого розміру виявлявся небажаний ефект пониження температури замерзання об'єму розчину, що вимагало тривалих циклів ліофілізації при більш низьких температурах. Більш високі концентрації метанолу і етанолу приводили до утворення коржиків ліофілізатів непривабливого вигляду, які було важко відновлювати. Готували і піддавали ліофілізації водні розчини, що містять 10% етанолу, 20% етанолу, 10% ізопропанолу, 20% ізопропанолу або 30% ТВА, а також бендамустин (15 мг/мл) і маніт (25,5 мг/мл). Посудини з ліофілізатами, одержаними з розчинів 10% етанолу, 20% етанолу, 10% ізопропанолу, 20% ізопропанолу, містили або зруйнований коржик, або залишок у вигляді плівки. Єдиною розчинювальною системою, що забезпечила прийнятний коржик 94036 50 ліофілізату, був 30% ТВА. Крім того, відновлення ліофілізатів, одержаних з розчинів 10% етанолу, 20% етанолу, 10% ізопропанолу, 20% ізопропанолу, було утруднене, і продукт не розчинявся повністю за час >45 хвилин. Можливість використання флакона меншого розміру стримується концентрацією або розчинністю бендамустину у водному/органічному розчині. При більш низьких концентраціях етанолу, метанолу, ізопропанолу і н-пропанолу, які приводять до одержання коржика ліофілізату прийнятного зовнішнього вигляду, потрібні більш розбавлені розчини бендамустину через обмежену розчинність. Для збереження існуючої дозованої форми бендамустину із вмістом 100 мг на флакон, був би потрібен флакон, що перевищує по об'єму 50 мл. Крім того, дослідження стабільності, описані в даній заявці, показали, що при більш низьких концентраціях спирту хімічна стабільність була недостатньою для забезпечення прийнятного часу заповнення. Одним з факторів, що впливають на легкість відновлення, є пористість продукту ліофілізації. В основному тверді речовини, осаджені в аморфному стані, з незначною площею поверхні розчиняються дуже складно. Велика частина ліофілізатів, що містять маніт, повинна відновлюватися протягом 3-5 хвилин, якщо під час ліофілізації не утворюється осад, що часто викликається випаровуванням рідини (повторне плавлення). На основі досвіду роботи авторів з декількома системами розчинників для ліофілізації і небажання обмежуватися якою-небудь конкретною теорією, проблеми, пов'язані з відновленням Ribomustin, можуть бути пов'язані з осадженням, викликаним повторним плавленням під час ліофілізації. Більшість органічних розчинників не сприяють ефективній ліофілізації і спричиняють повторне плавлення через низькі температури плавлення. ТВА (третбутиловий спирт) має високу температуру плавлення і тиск парів, порівнянний з тиском парів води. ТВА видаляється за рахунок сублімації, а не випаровування, приблизно з тією ж швидкістю, що і вода. Продукти ліофілізації, одержані із застосуванням 30% (об’ємн.) розчину ТВА за даним винаходом, відновлюються протягом 3-10 хвилин, в порівнянні з комерційно доступним Ribomustin'ом, відновлення якого може займати 30-45 хвилин. Виходячи з розчинності, стабільності, легкості відновлення і виробничих факторів, переважним є наступний преліофілізаційний склад за даним винаходом: гідрохлорид бендамустину приблизно 15мг/мл, маніт приблизно 25,5 мг/мл, третбутиловий спирт приблизно 30% (об’ємн.) і доведення до потрібного об'єму із застосуванням води для ін'єкцій. Потім при 5°С 6,67 мл цього складу заливають в 20-мл флакон зі стінками янтарного кольору, частково закривають пробкою з бромбутилкаучуку і завантажують в заздалегідь охолоджений ліофілізатор. Приклад 5: Оцінка забруднення Основні домішки, що з'являються під час виробництва, змішування, заповнення і процедури ліофілізації Ribomustin, згідно з даними ВЕРХаналізу (Фіг. 6), являють собою продукт гідролізу 51 НР1, димер бендамустину і етиловий ефір бендамустину, тобто ВМ1ЕЕ. ВМ1ЕЕ може утворюватися під час виробництва самої лікарської речовини, наприклад, при перекристалізації і/або очищенні. Відомо, що ВМ1ЕЕ являє собою більш потужний цитотоксичний засіб в порівнянні з бендамустином. Проводилися експерименти для визначення того, чи веде застосування 30% водного розчину TBA для заповнення флаконів до утворення третбутилового ефіру бендамустину. Експерименти проводили з використанням умов традиційної реакції етерифікації Фішера, необхідної для утворення т-бутилового ефіру бендамустину. Бендамустин нагрівали в ТВА при 60°С з HCl протягом 20 годин. У цих умовах взаємодії не спостерігалося. Цей результат показав, що утворення трет-бутилового ефіру бендамустину в процесі заповнення/остаточної ліофілізації було б дуже утруднене. До цього часу в дослідженнях стабільності не спостерігалося нових домішок в лікарському продукті, одержаному з ТВА. Для сприяння дослідженню лікарського продукту були розроблені шляхи синтезу, в яких використовуються більш реакційноздатні джерела третбутильного фрагмента. Була зроблена ще одна спроба одержання трет-бутилового ефіру шляхом одержання ацилхлориду бендамустину. Суспензію бендамустину в метиленхлориді обробляли оксалілхлоридом і N,N-диметилформамідом. Після утворення ацилхлориду розчинник видаляли. Залишок додавали до суміші хлористого метилену, трет-бутанолу, триетиламіну і 4диметиламінопіридину і перемішували суміш при кімнатній температурі протягом ночі. Після додавання всіх розчинників і очищення була одержана невідома сполука. При дослідженні РХ-МС молекулярна маса не відповідала молекулярній масі трет-бутилового ефіру бендамустину, і в спектрі ПМР не був виявлений пік трет-бутилу. Отже, дана спроба одержання трет-бутилового ефіру бендамустину також зазнала невдачі. Таким чином, застосування ТВА як додаткового розчинника дало додаткову вигоду, яка полягала тому, що спирт не утворював складний ефір. Приклад 6: Розробка ліофілізаційного циклу. Для оцінки найбільш критичних стадій ліофїлізаціі і досягнення найбільш ефективного циклу висушування проводили велику кількість ліофілізаційних циклів. Здійснювали експерименти для оцінки впливу на кінцевий продукт швидкості заморожування, температури первинного висушування, часу і тиску. A. Швидкість заморожування За відомостями літературних джерел, ТВА приймає різні кристалічні форми в залежності від швидкості заморожування. У деяких розчинах ТВА, чим повільніше продукт замерзає, тим швидше він висушується. Більш великі кристали, що форму 94036 52 ються під час повільного заморожування, утворюють пори більшого розміру, які роблять можливою більш ефективну сублімацію. Однак, під час досліджень складів бендамустину було виявлено, що швидкість заморожування не є критичним параметром обробки при оцінці часу заморожування 2 і 8 годин. B. Первинне і вторинне висушування Під час перших спроб здійснити ліофілізацію 30% розчинів ТВА, коржик ліофілізованого продукту руйнувався, і порошок викидало з посудини. Мабуть, ці коржики містили аморфні частинки в ліофілізаті, що вказувало на повторне плавлення. Це явище відтворювалося і мало місце, коли продукт досягав температури приблизно -10°С (посилання на Фіг. 5) незалежно від швидкості підвищення температури. Досліджували декілька змінних параметрів процесу для визначення причини проблеми з викидом порошку і виявлення відповідного розчину. Підвищували тиск від 50 мкм рт.ст. до 150 мкм рт.ст. під час первинного висушування, але викид порошку як і раніше спостерігався, хоч і в меншій мірі. Потім цей експеримент повторили, з тією різницею, що швидкість заморожування збільшили з 8 до 2 годин. Ця зміна не здійснила впливу. Потім перейшли до дослідження тривалості первинного висушування. Наприклад, досліджували наступний дуже повільний цикл висушування; заморожування від +25°С до -50°С протягом 8 годин; витримування при -50°С протягом 5 годин, нагрівання від -50°С до -25°С і висушування протягом 7 годин; витримування при -25°С протягом 12 годин, нагрівання від -25°С до -15°С і висушування протягом 2 годин і витримування при -15°С протягом 12 годин, нагрівання від -15°С до 40°С протягом шести годин і витримування при 40°С протягом 12 годин при підтриманні тиску в камері під час висушування 150 мкм рт.ст Викид порошку (Фіг. 5) не спостерігався. Цей цикл приводив до коржика ліофілізату хорошої форми без дроблення, який легко відновлювався. Не бажаючи обмежуватися конкретною теорією, проблеми з викидом порошку і складності з відновленням могли бути результатом дуже швидкого висушування порошку, що приводило до сильного потоку парів з коржика, а також повторного плавлення. При використанні менш агресивного циклу висушування відтворювано формувався естетичний, стабільний і легко відновлюваний коржик. Таким чином, видалення всієї незв'язаної води і трет-бутилового спирту перед вторинним висушуванням може запобігти повторному плавленню, а також викиду порошку. Далі ліофілізаційний цикл оптимізували в цих м'яких умовах (Фіг. 5). Було відсутнім негайне утворення продуктів розкладання внаслідок висушування при 40°С протягом часу до 20 годин. 53 Приклад 7: Ліофілізаційний цикл Стадія Опис 1 витримування 2 зміна температури 3 витримування 4 зміна температури 5 витримування 6 зміна температури 7 витримування 8 зміна температури 9 витримування 10 зміна температури 11 витримування 12 зміна температури витримування Усього 94036 Час (години) 0,25 8 4 3 6 1 20 0,5 15,5 15 10 1 5 89,25 Всі сполуки і способи, розкриті в даній заявці і включені в формулу винаходу, можуть бути одержані і реалізовані без проведення надмірного об'єму експериментів в світлі наведеного опису винаходу. Хоч композиції і способи за даним винаходом були описані на основі переважних варіантів здійснення, фахівцеві в даній галузі техніки повинно бути ясно, що в композиції, способи, в їх окремі стадії, а також в послідовності стадій описаних в даній заявці способів можуть бути внесені зміни без відхилення від суті і об'єму винаходу. Більш конкретно, повинно бути ясно, що деякі розчинники, які як хімічно, так і фізіологічно родинні розчинникам, розкритим в даній заявці, можуть застосовуватися замість вказаних в заявці розчинників, причому можуть бути досягнуті такі ж або подібні результати. Вважається, що всі ці аналогічні заміни і модифікації, очевидні фахівцеві в даній галузі техніки, відповідають суті і об'єму даного винаходу, які визначені прикладеною формулою винаходу. Всі патенти, заявки на патенти і публікації, згадані в даному описі, є показниками рівня рядового фахівця в тій галузі техніки, до якої належить винахід. Всі патенти, заявки на патенти і публікації включені в дану заявку за допомогою посилання в тій же мірі, як якби відносно кожної індивідуальної 54 Температура (°С) 5°С -50°С -50°С -20°С -20°С -15°С -15°С -12°С -12°С 35°С 35°С 40°С 40°С Тиск (мкм рт.ст.) 150 150 150 150 150 150 50 50 50 50 публікації було конкретно і окремо указано, що вона включена за допомогою посилання. Ілюстративно описаний в даній заявці винахід придатний для застосування на практиці за відсутності будь-якого елемента (елементів), які конкретно не розкриті в заявці. Так, наприклад, в кожному випадку будь-який з термінів «який включає», «який в основному складається з» і «який складається з» може бути замінений будь-яким з двох інших термінів. Терміни і вирази, які використані в заявці, використані як терміни опису, а не обмеження, причому не мається на увазі, що застосування таких термінів і виразів приводить до виключення яких-небудь еквівалентів показаних і описаних відмітних особливостей винаходу або їх частин, але признається, що в об'ємі прикладеної формули винаходу можливі різні модифікації. Таким чином, потрібно розуміти, що, хоч даний винахід був конкретно розкрито шляхом викладення переважних варіантів здійснення і додаткових особливостей, модифікації і зміна розкритих в заявці ідей можуть бути реконструйовані фахівцем в даній галузі техніки, і вважається, що всі такі модифікації і зміни знаходяться в об'ємі даного винаходу і визначені прикладеною формулою винаходу. 55 94036 56 57 Комп’ютерна верстка О. Гапоненко 94036 Підписне 58 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBendamustine pharmaceutical compositions for lyophilisation
Автори англійськоюBrittain Jason Edward, Franklin Joe Craig
Назва патенту російськоюФармацевтическая композиция бендамустина, предназначенная для лиофилизации
Автори російськоюБриттайн Джейсон Эдвард, Франклин Джо Крейг
МПК / Мітки
МПК: A61P 35/00, A61K 9/19, A61K 31/4184, A61P 35/02
Мітки: ліофілізації, фармацевтична, композиція, призначена, бендамустину
Код посилання
<a href="https://ua.patents.su/29-94036-farmacevtichna-kompoziciya-bendamustinu-priznachena-dlya-liofilizaci.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція бендамустину, призначена для ліофілізації</a>
Попередній патент: Новий вірус рослин, позначений як томато торрадо вірус
Наступний патент: Спосіб пакування свіжого м’яса, упаковка для свіжого м’яса, яку можна одержати за його допомогою, та здвоєна покривальна плівка
Випадковий патент: Вітрогенератор з дифузором спеціального призначення












