Рідкий препарат, що містить похідне камптотецину, та фармацевтична композиція, яку можна одержати шляхом ліофілізації цього препарату
Формула / Реферат
1. Рідкий препарат, який відрізняється тим, що містить похідне камптотецину, одержане шляхом зв'язування сполуки формули (І)
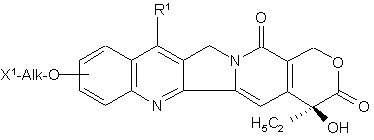 ,(І)
,(І)
в якій R1 являє собою заміщену або незаміщену нижчу алкільну групу, X1 означає групу формули -NHR2 (R2 означає атом водню або нижчу алкільну групу) або гідроксигрупу, Alk являє собою алкіленову групу з нерозгалуженим або розгалуженим ланцюжком, при необхідності перерваним атомом кисню,
і полісахариду, який має карбоксильні групи, через амінокислоту або пептид, або його фармацевтично прийнятну сіль, який доводять до значення pH 5-8.
2. Рідкий препарат за п. 1, який відрізняється тим, що він містить одну або декілька сполук, вибраних з групи, яка складається з лимонної кислоти, цитрату лужного металу, оцтової кислоти, ацетату лужного металу і дигідрофосфату лужного металу як буфера.
3. Рідкий препарат за п. 2, який відрізняється тим, що в ньому іонна сила буферного розчину дорівнює 0,2 або становить менше ніж 0,2.
4. Рідкий препарат за будь-яким з пп. 1-3, який відрізняється тим, що в ньому значення pH регулюють від 5 до 7,5.
5. Рідкий препарат за будь-яким з пп. 1-3, який відрізняється тим, що в ньому значення pH регулюють від 5 до 7.
6. Рідкий препарат за будь-яким з пп. 1-3, який відрізняється тим, що в ньому значення pH регулюють від 5 до 6.
7. Рідкий препарат за п. 1, який відрізняється тим, що в ньому вміст похідного камптотецину або його фармацевтично прийнятної солі становить від 1% до 20%.
8. Рідкий препарат за п. 1, який відрізняється тим, що він додатково містить один або кілька компонентів, вибраних із стабілізатора і наповнювача.
9. Рідкий препарат за п. 1, який відрізняється тим, що він додатково містить один або кілька стабілізаторів, вибраних з карбонату лужного металу і гідрокарбонату лужного металу, і один або кілька наповнювачів, вибраних з лактози, сахарози, маніту, декстрану, мальтози і трегалози.
10. Рідкий препарат за п. 1, який відрізняється тим, що він додатково містить одну або кілька солей, вибраних з хлориду лужного металу, хлориду лужноземельного металу і сульфату лужного металу.
11. Рідкий препарат за п. 1, який відрізняється тим, що в ньому R1 являє собою незаміщену С1-С6-алкільну групу, X1 являє собою аміногрупу і група Alk означає С1-С6-алкіленову групу з прямим ланцюжком, яка не переривається атомом кисню, полісахарид являє собою карбоксиметилований декстран або пулулан, і пептид являє собою пептид, що складається з 2-5 амінокислот.
12. Рідкий препарат за п. 11, який відрізняється тим, що в ньому R1 являє собою етильну групу, група формули X1-Alk-O- означає 3-амінопропілоксигрупу, і сполука камптотецину формули (І) зв'язана за положенням 10 ядра камптотецину, полісахарид являє собою декстран, до якого введено карбоксильну групу, і пептид являє собою гліцил-гліцил-L- або D-фенілаланіл-гліцин, гліцил-гліцин, гліцил-гліцил-гліцин, гліцил-гліцил-гліцил-гліцин, гліцил-гліцил-гліцил-гліцил-гліцин, L- або D-фенілаланіл-гліцин та L- або D-лейцил-гліцин.
13. Рідкий препарат за п. 12, який відрізняється тим, що в ньому пептид являє собою гліцил-гліцил-гліцин.
14. Ліофілізована композиція лікарського препарату, яка відрізняється тим, що вона одержана шляхом ліофілізації рідкого препарата за будь-яким з пп. 1-13.
15. Рідка композиція для ін'єкції, яка відрізняється тим, що композицію за п. 14 розчиняють у водному середовищі.
16. Рідкий препарат, який відрізняється тим, що містить похідне камптотецину, одержане шляхом зв'язування сполуки формули (Іа):
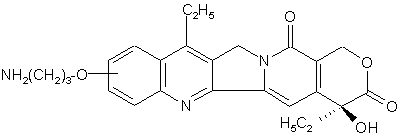 (Іа)
(Іа)
і декстрану, який має карбоксильні групи, через гліцил-гліцил-гліцин, або його фармацевтично прийнятну сіль, де рідкий препарат доведено буфером до значення pH від 5 до 8.
17. Рідкий препарат за п. 16, який відрізняється тим, що в ньому буфер являє собою одну або більше сполук, вибраних з лимонної кислоти, цитрату лужного металу, оцтової кислоти, ацетату лужного металу і дигідрофосфату лужного металу.
18. Рідкий препарат за п. 17, який відрізняється тим, що в ньому буфер являє собою лимонну кислоту і дигідрофосфат натрію.
19. Рідкий препарат за п. 18, який відрізняється тим, що він додатково містить хлорид натрію.
Текст
1. Рідкий препарат, який відрізняється тим, що містить похідне камптотецину, одержане шляхом зв'язування сполуки формули (І) C2 2 (19) 1 3 77295 4 13. Рідкий препарат за п.12, який відрізняється і декстрану, який має карбоксильні групи, через тим, що в ньому пептид являє собою гліцилгліцил-гліцил-гліцин, або його фармацевтично гліцил-гліцин. прийнятну сіль, де рідкий препарат доведено бу14. Ліофілізована композиція лікарського препарафером до значення pH від 5 до 8. ту, яка відрізняється тим, що вона одержана 17. Рідкий препарат за п.16, який відрізняється шляхом ліофілізації рідкого препарата за будьтим, що в ньому буфер являє собою одну або біяким з пп.1-13. льше сполук, вибраних з лимонної кислоти, цитра15. Рідка композиція для ін'єкції, яка відрізняєтьту лужного металу, оцтової кислоти, ацетату лужся тим, що композицію за п.14 розчиняють у водного металу і дигідрофосфату лужного металу. 18. Рідкий препарат за п.17, який відрізняється ному середовищі. 16. Рідкий препарат, який відрізняється тим, що тим, що в ньому буфер являє собою лимонну кисмістить похідне камптотецину, одержане шляхом лоту і дигідрофосфат натрію. 19. Рідкий препарат за п.18, який відрізняється зв'язування сполуки формули (Іа): C2H5 тим, що він додатково містить хлорид натрію. O N NH2(CH2)3-O O N H5 C2 (Іа) O OH , Даний винахід стосується рідкого препарату, що містить похідне камптотецину або його фармацевтично прийнятну сіль, який володіє високою протипухлинною активністю, фармацевтичної композиції, яку одержують шляхом ліофілізаціі препарату, та способу одержання зазначеної фармацевтичної композиції. Більш конкретно, даний винахід стосується рідкого препарату для ін'єкцій, що містить похідне камптотецину, який одержують шляхом зв'язування сполуки формули (І) (I) , де R1 являє собою заміщену або незаміщену нижчу алкільну групу, X1 означає групу формули NHR2 (R2 означає атом водню або нижчу алкільну групу) або гідрокси-групу та Alk являє собою алкіленову групу з нерозгалуженим або розгалуженим ланцюжком, при необхідності перерваним атомом кисню, і полісахариду, який має карбоксильні групи, через амінокислоту або пептид, або його фармацевтично прийнятну сіль, який доводять до значення рН 5-8, або фармацевтичної композиції, одержаної шляхом ліофілізаціі вказаного рідкого препарату, або способу одержання композиції. Похідні камптотецину за даним винаходом та їх фармацевтично прийнятні солі являють собою лікарський препарат, який володіє високою протипухлинною активністю у відношенні різних пухлин, особливу терапевтичну активність вони демонструють по відношенню до солідних пухлин, таких як рак легенів, рак матки, рак яєчників, рак молочної залози або рак шлунково-кишкової системи (рак товстої кишки, рак шлунку та ін.)· Відомо, що вказані сполуки можуть бути введені парентерально (наприклад, внутрішньосудинна ін'єкція), як правило, у вигляді рідкого препарату (наприклад, розчин, суспензія, емульсія та ін.) [див. документи JP-10-72467A, ЕР-0757049А]. Вказане вище похідне камптотецину має структуру, в якій сполука камптотецину (активна речовина) формули (І) зв'язана з полісахаридом (карбоксиметильований декстран або пулулан) за допомогою спейсера (амінокислоти або пептиду). Зазначені похідні камптотецину при одержанні рецептури рідкого препарату часто піддаються гідролізу в місці приєднання спейсеру або полісахаридного фрагменту в процесі приготування або зберігання. Гідроліз полісахаридного фрагменту призводить до зменшення середньої молекулярної маси вказаних похідних камптотецину та до збільшення дисперсії молекулярно-масового розподілу, причому ці зміни молекулярної маси здатні негативно вплинути на фармакокінетичні властивості зазначеного лікарського препарату. Крім того, гідроліз спейсера може призвести до вивільнення значної кількості активної речовини (сполука камптотецину формули (І) під час його приготування, що є небажаним з точки зору терапевтичних ефектів або побічної дії. У зв'язку з цим бажаним було б розробити рідкий препарат з високою стабільністю лікарського препарату в процесі його приготування та зберігання. Автори даного винаходу провели інтенсивні дослідження для вирішення зазначеної проблеми та виявили, що рідкий препарат з високою стабільністю може бути одержаний шляхом регулювання рН рідкого препарату, що містить похідне камптотецину згідно винаходу, в інтервалі між 5 і 8 в процесі його одержання, іздійснили цей винахід. Таким чином, даний винахід забезпечує рідкий препарат для ін'єкцій, який містить похідне камптотецину, в якому сполука камптотецина зазначеної вище формули (І) зв'язана з полісахаридом, який має карбоксильну групу, через амінокислоту або пептид, або його фармацевтично прийнятну сіль, в якому значення рН доводиться до 5-8. Крім того, автори даного винаходу встановили, що фармацевтична композиція, одержана шляхом 5 77295 6 ліофілізації рідкого препарату, зазначеного вище, ті, в яких R1 означає етильну групу, група формули також володіє високою лікарською стабільністю в Х1-Аlк-О- означає 3-амінопропілоксигрупу, і сполупроцесі приготування та зберігання. Відповідно, ка камптотецину (І), зв'язана за положенням 10 даний винахід також забезпечує таку фармацевядра камптотецину, і декстран, до якого введена тичну композицію. карбоксильна група, зв'язуються через пептид, В даному винаході може бути використане обраний з групи, яка складається з: гліцил-гліцилбудь-яке з похідних камптотецину, розкритих в L- або D-фенілаланіл-гліцину, гліцил-гліцину, глі[документі JP-10-72467A], тобто похідне камптотецил-гліцил-гліцину, гліцил-гліцил-гліцил-гліцину, цину, в якому сполука камптотецину зазначеної гліцил-гліцил-гліцил-гліцил-гліцину, L- або Dвище формули (І) зв'язана з полісахаридом, який фенілаланіл-гліцину та L- або D-лейцил-гліцину. має карбоксильну групу, через амінокислоту або Серед цих пептидів гліцил-гліцил-гліцин є особлипептид. Конкретні приклади похідних камптотецину во переважним. включають ті, в яких група X1 сполуки формули (І) і Як ілюстрація фармацевтично прийнятних сокарбоксильна група амінокислоти або пептиду лей похідних камптотецину передбачені солі луж(наприклад, пептиду, що складається з 2-5 аміноних металів, такі як сіль натрію або сіль калію, солі кислот) зв'язуються з утворенням кислотнолужноземельних металів, такі як сіль кальцію, або амідного зв'язку або складноефірного зв'язку, а солі амінокислоти, такі як сіль аргініну або лізину. аміногрупа вказаної амінокислоти або пептиду та Рідкий препарат за даним винаходом одержучастина або всі карбоксильні групи полісахариду, ють, наприклад, наступним чином: 1) вказане витакого як карбоксиметильований декстран або ще похідне камптотецину або його фармацевтично пулулан, зв'язуються з утворенням зв'язку (зв'язприйнятну сіль і, у випадку необхідності, інші комків) кислота-амід. поненти (наприклад, допоміжні засоби для фарБільш конкретно, похідні камптотецину вклюмацевтичних препаратів, такі як буфери, стабілічають ті похідні, в яких частина або всі карбоксизуючі агенти) розчиняють у рідкому середовищі, льні групи полісахариду зв'язані з N-кінцевою амітакому як вода для ін'єкцій та ін.; 2) розчин довоногрупою вказаної амінокислоти або пептиду з дять до значення рН 5-8, переважно 5-7,5, більш утворенням кислотно-амідного зв'язку, і С-кінцева переважно 5-7, особливо переважно 6-7 за допокарбоксильна група вказаної амінокислоти або могою придатного буфера (наприклад, лимонної пептиду зв'язуються з групою X1 сполуки (І) з утвокислоти, соляної кислоти, гідроксиду натрію та ін.) ренням кислотно-амідного зв'язку або складноефіі потім 3) після розведення водою для ін'єкцій з рного зв'язку. метою одержання бажаної концентрації лікарськоЗамісники в сполуці загальної формули (І) го препарату розчин фільтрують через мембран2 включають наступні групи. Коли X являє собою ний фільтр тощо для того, щоб видалити нерозгрупу -NHR2, нижча алкільна група R2 включає С1чинні матеріали (пірогени та ін.) і потім розчином С4-алкільну групу, а замісник Ε нижчій алкільній заповнюють скляну судину, яка піддається гермегрупі R1 включає гідроксильну групу, яка при необтизації, з наступною стерилізацією, для того, щоб хідності захищена, меркаптанову групу та аміногодержати рідкий препарат. рупу (наприклад, при необхідності захищену алкіКількість похідного камптотецину або його фальною групою або ацильною групою). Група Alk рмацевтично прийнятної солі не обмежується, але включає С1-С6-алкіленову групу з прямим або розскладає від 1% до 20% (мас./об.), переважно від галуженим ланцюжком, при необхідності перерва1% (мас./об.) до 10% (мас./об.). ним атомом кисню. Буфер, який використовується для рідкого Полісахариди, які відносяться до даного винапрепарату за даним винаходом, обирають з групи, ходу, включають полісахариди, в молекулі яких яка складається з лимонної кислоти, цитрату лужпочатково присутня карбоксильна група (наприного металу (наприклад, натрієвої солі лимонної клад, гіалуронова кислота, пектин та ін.), та полікислоти та ін.), оцтової кислоти, ацетату лужного сахариди (наприклад, карбоксиметильований пуметалу (наприклад, ацетатунатрію та ін.) та дигідлулан, карбоксиметильований декстран та ін.), які рофосфату лужного металу (дигідрофосфату наодержують шляхом введення карбоксильної групи трію та ін.). Ці сполуки доцільним чином сполучадо полісахариду, в молекулі якого карбоксильна ються з метою використання в ролі буферу. група початково була відсутня (наприклад, декПереважним сполученням для буферу є сполустран, пулулан та ін.). Серед полісахаридів карбочення лимонної кислоти і цитрату натрію, сполуксиметильований декстран (наприклад, зі ступечення лимонної кислоти і дигідрофосфату натрію, нем карбоксиметилювання більше, ніж 0,3, і сполучення оцтової кислоти і ацетату натрію, пеменше, ніж 0,8) є особливо переважним. Його сереважно сполучення лимонної кислоти і цитрату редня молекулярна маса переважно становить натрію. Іонна сила буферного розчину, який вико20000-400000, особливо переважно 50000-150000. ристовується для рідкого препарату за даним виПереважними похідними камптотецину є ті, в находом, може бути відрегульована, наприклад, яких R1 являє собою С1-С6-алкільну групу, X1 явна рівні 0,01-0,6, переважно 0,01-0,3, особливо ляє собою аміногрупу і група Alk означає С1-Сбпереважно 0,05-0,2. алкіленову групу з прямим ланцюжком, який не До рідкого препарату за даним винаходом та переривається атомом кисню, полісахарид є карйого ліофілізованої композиції можуть бути додані боксиметильованим декстраном або пулуланом, і традиційні компоненти, які використовуються для пептид являє собою пептид, що складається з 2-5 ін'єкцій, а також вказані вище компоненти. Ці комамінокислот. поненти являють собою наповнювачі (лактоза, Більш переважними похідними камптотецину є сахароза, маніт, декстран, мальтоза, трегалоза та 7 77295 8 ін.), солюбілізуючі агенти (складний ефір жирної бливо препарату, який містить маніт, декстран кислоти і поліоксиетиленсорбітану, такий як політа/або карбонат натрію та ін., захист від руйнувансорбат 80 та ін., поліоксиетиленовану та гідрогеніня судини забезпечується попереднім додаванням зовану рицинову олію, таку як НСО-60 та ін., просщонайменше однієї солі, обраної з групи, яка тий поліоксиетиленалкіловий ефір, такий як складається з хлоридів лужних металів (хлориду поліоксиетилен-лауриловий ефір, сорбітановий літію, хлориду натрію, хлориду калію та ін.), хлоскладний ефір жирної кислоти, такий як Span 80 та ридів лужноземельних металів (хлориду магнію, ін.), стабілізатор (карбонат лужного металу, такий хлориду кальцію та ін.) та сульфатів лужних метаяк карбонат натрію, гідрокарбонат лужного металу, лів (сульфату літію, сульфату натрію, сульфату такий як гідрокарбонат натрію та ін.), антиоксиданкалію та ін.) до вказаного рідкого препарату. В ти (гідрохлорид цистеїну, токоферол, аскорбінова цьому випадку переважними солями є хлорид накислота), агенти для підтримання тонічності (глітрію, сульфат натрію та ін. Переважна кількість церин, глюкоза та ін.) і консерванти (тимерозал, вказаної солі становить 0,01-10%, більш переважетанол, пропіленгліколь, бензиловий спирт, алкіно 0,1-5% від ваги лікарського препарату. ловий ефір п-гідроксибензойної кислоти, такий як Рідкий препарат та фармацевтична композибутиловий ефір п-гідроксибензойної кислоти та ція, яку одержують шляхом ліофілізації цього рідін.). кого препарату, переважно зберігаються в запаяКількість наповнювача складає, наприклад, 10ній судині, захищеній від дії світла. 100% від похідного каптотецину формули (І) або Рідкий препарат за даним винаходом, пригойого фармацевтично прийнятної солі. Кількість тований як вказано вище, володіє чудовими влассолюбілізуючого агента становить, наприклад, 0,1тивостями у відношенні стабільності лікарського 10% від похідного камптотецину формули (І) або препарату (похідне камптотецину) в процесі пригойого фармацевтично прийнятної солі. Кількість тування або зберігання. Тому рідкий препарат мостабілізатору становить, наприклад, 0,1-10% від же бути безпосередньо введений пацієнту. Дозупохідного камптотецину формули (І) або його фавання рідкого препарату варіює в залежності від рмацевтично прийнятної солі. Кількість антиоксивіку, ваги тіла та умов, але звичайно становить данту становить, наприклад, 0,1-10% від похідного 0,02-50мг/кг, особливо 0,1-10мг/кг, в розрахунку на камптотецину формули (І) або його фармацевтичсполуку камптотецину формули (І) (у випадку, коли но прийнятної солі. Кількість агенту для підтриXі являє собою групу -NHR2, то його гідрохлорид). мання тонічності становить, наприклад, 0,01-1% Крім того, фармацевтична композиція, одервід похідного камптотецину формули (І) або його жана шляхом ліофілізації рідкого препарату за фармацевтично прийнятної солі. Кількість консерданим винаходом, володіє чудовими властивостяванту становить, наприклад, 0,001-0,2% від похідми у відношенні стабільності лікарського препараного камптотецину формули (І) або його фармацету в процесі приготування або зберігання, і тому втично прийнятної солі. вона застосовується в ін'єкції, яка готується при Рідкий препарат, одержаний як описано вище, необхідності. заливають до жорсткої судини, такої як стерильна Даний винахід додатково пояснюється з детаампула, пляшечка, шприц тощо, і піддають ліофільним розгляданням у прикладах, але винахід не лізації традиційним способом, для того щоб одерповинен бути обмежений цими прикладами. жати фармацевтичну композицію за даним винаПриклад 1. Приготування рідкого препарату. ходом. У відповідності до складу інгредієнтів, наведеЛіофілізовану фармацевтичну композицію за ного нижче в Таблиці 1, готують водний розчин даним винаходом готують наступним чином. лікарського препарату і фільтрують крізь мемКількість рідкого препарату, яким заповнюють бранний фільтр (тип GS, діаметр пор 0,22мкм, судину, становить, наприклад, 5-50% (об./об.) від виробництво фірми Millipore Ltd.). Фільтрат (1мл) об'єму судини, особливо переважно 10-25% заливають у скляні ампули об'ємом 3мл. Кожну (об./об.). ампулу стерилізують паром при 100°С протягом Зовнішню температуру при ліофілізації пере15хв, з одержанням рідкого препарату. важно підтримують від -50 до 60°С, особливо пеЛікарський препарат: похідне камптотецину, реважно від -50 до 40°С, і застосовуваний тиск для описане в прикладі 84 документа JP-10-72467A, де сублімації розчинника переважно становить від воно представлене наступною формулою: 0,01 до 0,2мм рт.ст., більш переважно від 0,01 до 0,1мм рт.ст. Переважно швидкість ліофілізації регулюється таким чином, щоб об'єм розчинника (в розрахунку на розчин) сублімувався зі швидкістю від 10мкл до 100мкл на 1см2 площини поверхні, з якої сублімується розчинник, на протязі 1 години, особливо від 30 до 60мкл, при дотриманні інгредів якій CM-Dextran означає "карбоксиметильоєнтів рідини, яку піддають ліофілізації, температуваний декстран". ри ліофілізації, тиску сублімації розчинника та ін. У випадку ліофілізації рідкого препарату, осо 9 77295 10 Таблиця 1 0,110 0,118 Рідкий препарат за даним винаходом 1 2 3 4 0,4 0,147 0,180 0,213 0,245 0,093 0,071 0,047 0,023 q. s. * q·s. q. s. 0,771 q. s. 100мл 4,0 q·s. 0,771 q·s. 100мл Порівняльний приклад Лікарський препарат (г) Дигідрофосфат натрію (г) Лимонна кислота Водний 0,4Μ розчин дигідрофосфату натрію Водний 0,2Μ розчин лимонної кислоти Хлорид натрію (г) Вода для ін'єкцій ВСЬОГО: Значення рН 5,0 6,0 7,0 8,0 *) Скільки потрібно. Стабільність рідких препаратів. Одержаний вище препарат зберігають за визначених умов зберігання (при температурі 60°С протягом 20 діб, 50°С протягом 30 діб або 40°С протягом 120 діб), і визначають стабільність лікарського препарату (середня молекулярна маса і розподіл молекулярної маси, і кількість вільного активного камптоте розподіл середньої молекулярн ої маси цину) . Результати наведені нижче, в Таблиці 2. Середню молекулярну масу лікарського препарату розраховують з використанням методу GPS багатокутового лазерного розсіювання (метод MALLS), а розподіл середньої молекулярної маси розраховують за наступною формулою: середньовагова молекулярн а маса MW середньочисленна молекулярн а маса MN Таблиця 2 Значення рН Рідкий препарат 1 за даним винаходом Рідкий препарат 2 за даним винаходом Рідкий препарат 3 за даним винаходом Рідкий препарат 4 за даним винаходом Порівняльний приклад 5,0 6,0 7,0 8,0 4,0 Умови зберігання Вихідний 60°С протягом 20 діб Вихідний 60°С протягом 20 діб Вихідний 60°С протягом 20 діб Вихідний 60°С протягом 20 діб Вихідний 60°С протягом 20 діб Середня молекулярна маса 138 900 125 800 129 100 131 200 131 400 131 400 130 900 127 000 129 800 110 100 Розподіл середньої молекулярної маси 1,195 1,183 1,169 1,177 1,191 1, 186 1,202 1,195 1,200 1,720 Таблиця 3 Рідкий препарат 1 за даним винаходом Рідкий препарат 2 за даним винаходом Рідкий препарат 3 за даним винаходом Рідкий препарат 4 за даним винаходом Порівняльний приклад Значення рН 5,0 6,0 7,0 8,0 4,0 Кількість вільної активної сполуки камптотецину*, % вихідна 60°С, 20 діб 50°С, 30 діб 40°С, 120 діб 3,08 13,15 9,17 10,60 1,67 8,12 5,83 5,53 1,48 14,53 6, 60 6,52 1,93 17,32 8,31 7,95 13,81 23,73 24,84 27,33 *) Сполука активного камптотецину означає сполуку наступної формули, і її вміст аналізують кількісно в наступних умовах (ті ж самі і для решти прикладів). Кількісний аналіз. Розчин зразка розбавляють 0,2Μ розчином буферу мурашина кислота - форміат амонію в 200 разів, і потім змішують розбавлений розчин (0,4мл) з розчином внутрішнього стандарту (0,1мл), і суміш фільтрують крізь мембранний фільтр (діаметр пор 0,45мкм), щоб одержати досліджуваний зразок для кількісного аналі зу. Кількісний аналіз зразка проводять за методом високоефективної рідинної хроматографії (ВЕРХ) за наступних умов. Кількість (%) вільного активного камптотецину в кожному зразку розраховують як % від кількості вільної активної сполуки камптотецину, яка утворюється при додаванні 10-разової кількості б Η 11 77295 12 соляної кислоти до розчину зразка, який зберігавняльного прикладу, і тому визнано, що попереють в холодильнику, і далі при нагріванні при темджається збільшення дисперсії розподілу середпературі 100°С протягом 4год. Умови ВЕРХ. ньої молекулярної маси. Це показує, що в рідкому Колонка: Inertsil ODS (виробництва фірми GL препараті за даним винаходом може бути попереScience Inc.). джено розкладання лікарського препарату (а саме, Рухома фаза: 35мМ розчин буферу - мураширозщеплення ланцюжка в молекулі декстрану), і на кислота - форміат амонію (рН 3)/ацетонітрил крім того, може бути попереджене небажане утво(80/20) (потік - 1,0мл/хв). рення вільної активної сполуки камптотецину внаТемпература колонки: 40°С. слідок розкладання спейсерної ділянки. Детектування: флуоресцентний фотометр Приклад 2. Приготування ліофілізованих ком(Ех=360, Em=420нм). позицій. Активна сполука камптотецину: Використовуючи той самий лікарський препарат, що і в прикладі 1, і на основі рецептури, описаної в Таблиці 4, готують кожний із зазначених водних розчинів лікарського препарату і фільтрують його крізь мембранний фільтр (тип GS, діаметр пор 0,22мкм виробництва фірми Millipore Ltd.). Фільтрат (1мл) заливають у безбарвні ампули об'ємом 13мл, які запаюють. Кожну ампулу піддають ліофілізації (попередньо заморожують при в якій Ra являє собою атом водню, групу Gly-, температурі -50°С протягом 3год і проводять перGly- Gly- або Gly- Gly- Gly-. винну дегідратацію при 20°С протягом 30год та З наведених вище результатів випливає, що в вторинну дегідратацію при 60°С протягом 6год), рідких препаратах за даним винаходом (рН 5-8) для того, щоб одержати композицію ліофілізованосередня молекулярна маса лікарського препарату го лікарського препарату. знижується менше, ніж у рідкому препараті з поріТаблиця 4 Порівняльний приклад А В Лікарський препарат (г) Дигідрофосфат натрію (г) Лимонна кислота 0,4Μ розчин дигідрофосфату натрію Водний 0,2Μ розчин лимонної кислоти Вода для ін'єкцій ВСЬОГО: Значення рН 0,0059 0,153 0,110 0,118 q. s. * q. s. q. s. 100мл 3,0 4,0 Композиція за винаходом даним 1 2 3 4 5,0 0,147 0,180 0,213 0,245 0,093 0,071 0,047 0,023 q. s. q·s. q·s. 100мл 5,0 6,0 7,0 8,0 *) Скільки потрібно. Стабільність ліофілізованих композицій. Одержаний вище препарат зберігають при температурі 60°С протягом 20 діб, і визначають стабільність композицій лікарського препарату (зміна кольору, наявність або відсутність нерозчинних матеріалів після відновлення, розподіл молекулярної маси лікарського препарату і кількість вільної активної сполуки). Результати наведені в наступних Таблицях 5-1, 5-2 і 5-3. Таблиця 5-1 Наявність (чи відсутність) нерозчинних матеріалів Порівняльний приклад Композиція за даним винаходом А В 1 2 3 4 Немає (блідий жовЗміна кольору Немає (жовтий) Немає (блідий жовто-зелений) то-зелений) Наявний нерозчин- Трохи нерозчинноСтан після відновлення Нерозчинний матеріал відсутній ний матеріал го матеріалу Значення рН після відновлення 3,0 4,1 5,1 6,1 7,1 8,1 13 77295 14 Таблиця 5-2 Зміна середньої молекулярної маси і розподілу молекулярної, маси лікарського препарату Значення рН Композиція 1 за даним винаходом Композиція 2 за даним винаходом Композиція 3 за даним винаходом Композиція 4 за даним винаходом Порівняльний приклад А Порівняльний приклад В 5,0 6,0 7,0 8,0 3,0 4,0 Умови зберігання Вихідний 60°С протягом 20 діб Вихідний 60°С протягом 20 діб Вихідний 60°С протягом 20 діб Вихідний 60°С протягом 20 діб Вихідний 60°С протягом 20 діб Вихідний 60°С протягом 20 діб Середня молекулярна маса 135 400 128 700 132 800 128 500 130 600 128 300 129 800 131 100 132 900 150 300 135 100 138 100 Розподіл середньої молекулярної маси 1,144 1,145 1,145 1,140 1,143 1,147 1,144 1,128 1,120 1,280 1,134 1,209 Таблиця 5-3 Кількість вільної активної сполуки Значення рН Композиція 1 за даним винаходом Композиція 2 за даним винаходом Композиція 3 за даним винаходом Композиція 4 за даним винаходом Порівняльний приклад А Порівняльний приклад В 5,0 6,0 7,0 8,0 3,0 4,0 Приклад 3. Одержання ліофілізованих композицій. Той же самий лікарський препарат (10г), що і в прикладі 1, моногідрат лимонної кислоти (0,42г) та хлорид натрію (500мг) розчиняють у воді для ін'єкцій (100мл) і розчин доводять до рН 5,0 1М розчином гідроксиду натрію, і далі доводять загальний об'єм до 200мл додаванням води для ін'єкцій. Розчин фільтрують крізь мембранний фільтр (тип GS, діаметр пор 0,22мкм, виробництво фірми Millipore Ltd.), і фільтрат (2мл) заливають в безбарвні скляні ампули об'ємом 3мл. Вміст кожної ампули піддають ліофілізації звичайним способом, для того, Кількість вільної активної сполуки камптотецину, %(Умови зберігання: 60°С, 20 діб)
ДивитисяДодаткова інформація
Назва патенту англійськоюLiquid preparation comprising camptothecin derivative and pharmaceutical composition produced by freeze-drying
Назва патенту російськоюЖидкий препарат, содержащий производное камптотецина, и фармацевтическая композиция, которую можно получить путем лиофилизации препарата
МПК / Мітки
МПК: A61K 47/48, C07D 491/147
Мітки: можна, містить, фармацевтична, композиція, цього, одержати, ліофілізації, рідкий, шляхом, яку, похідне, камптотецину, препарату, препарат
Код посилання
<a href="https://ua.patents.su/8-77295-ridkijj-preparat-shho-mistit-pokhidne-kamptotecinu-ta-farmacevtichna-kompoziciya-yaku-mozhna-oderzhati-shlyakhom-liofilizaci-cogo-preparatu.html" target="_blank" rel="follow" title="База патентів України">Рідкий препарат, що містить похідне камптотецину, та фармацевтична композиція, яку можна одержати шляхом ліофілізації цього препарату</a>
Попередній патент: Пристрій для контейнерного сушіння сипких матеріалів
Наступний патент: Фосфатні проліки фтороксіндолів
Випадковий патент: Спосіб виготовлення булату заданого гатунку












