Спосіб одержання вітамін е-зв’язуючих білків з печінки щурів
Номер патенту: 14645
Опубліковано: 20.01.1997
Автори: Бойко Лариса Михайлівна, Донченко Георгій Вікторович, Постоєнко Володимир Олексійович, Паливода Ольга Михайлівна
Формула / Реферат
Способ получения витамин Е-связывающих белков из печени крыс, включающий гомогенизацию ее в буферном растворе, отделение твердой фазы от жидкой и выделение целевого продукта из жидкой фазы, отличающийся тем, что выделение целевого продукта осуществляют хроматографпей при использовании в качестве аффинного сорбента 2,2,5,7,8-пентаметил-4-карбокси-6-оксихроман-1,6-диамииогексанссфарозы 4В или 2,2,5,7,8-пентаметил-4-аминометил-6-оксихроманглицилглицинсефарозы 4В, причем сорбцию и промывку проводят 0,04-0,08 М трис-НСl буфером рН 7,4-8,0, содержащим 0,25 М сахарозы, а элюцию белка осуществляют тем же буфером, содержащим 0,4-0,8 М NaCl.
Текст
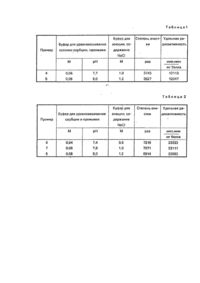
Изобретение относится к области препаративной биохимии, а именно к способам выделения витамин Е-связывающих белков. Известны способы получения витамин Е-связывающих белков методом аффинной хроматографии (авт. св. СССР № t398357, С 07 D 311 /72,1986; авт. св. СССР № 1405278, С 07 D 311/72, 1986). За прототип нами принят способ получения витамин Е-связывающих белков, описанный в G. LCatignanl "Hepatic a-Tocopherol-Blndlng Protein". Methods of Enzymology, 1980, v. 67, part F., p. 117-122. По этому способу печень животных (крыс, цыплят и др.) гомогенизируют в 10 мМ трис-HCl буфере при рН 7,5 и содержании сахарозы 0,2 М, двойным центрифугированием сначала при 10000 gut 4°C в течение 15 мин, затем при 105000 g и 14°C в течение 1 ч получают цитозоль печени. Аликвоту ци-тозоля печени инкубируют с оЧ2(5-метил-3Н) токоферолом (100 нм) в течение 4 ч при 26°С в присутствии 400-кратного избытка немеченого a-токоферола и без него, после чего центрифугированием в 10 мМ трис-НСІ буфере при рН 7,5 и содержании сахарозы 520% показывают наличие специфического связывания a-токоферола белком. Недостатком прототипа является то, что проводится лишь грубая очистка белков. Задачей изобретения является создание способа получения витамин Е-связывающих белков, позволяющего путем использования в качестве аффинного сорбеита 2. 2. 5, 7, 8-пентаметил-4карбокси-6-оксихроман-1,6-диаминогексансефарозы 4В или 2,2, 5, 7, 8-пентаметил-4аминометил-6-оксихроманглицилглицинсефарозы 4В, проведения сорбции и промывки трис-НСІ буфером, содержащим сахарозу и осуществления элюции белка тем же буфером, содержащим NaCI, обеспечить повышение качества очистки белков. Для этого в способе получения витамин Е-связывающих белков из печени крыс, включающем гомогенизацию ее в буферном растворе, отделение твердой фазы от жидкой и выделение целевого продукта из жидкой фазы, выделение последнего осуществляется хроматографией при использовании в качестве аффинного сорбента 2, 2, 5, 7, 8-пентаметил-4-карбокси-6-оксихроман1,6-диаминогексаносефаро-зы 4В или 2, 2, 5, 7, 8-пентаметил-4-амино-метил-6оксихроманглицилглицинсефаро-зы 4В, причем сорбцию и промывку проводят 0,04-0,08 М трисНСl буфером рН 7,4-8,0, содержащим 0,25 М сахарозы, а элюцию белка осуществляют тем же буфером, содержащим 0,4-0,8 М NaCI. Новым является проведение аффинной хроматографии на специально синтезированном для выделения кислых и щелочных витамин Е-связывающих белков сорбенте и выполнение условий и режимов сорбции, промывки и элюции. Предложенный способ обеспечивает качественно более высокий уровень очистки указанных белков из печени крыс. Пример 1.1. Получение 2, 5, 7, 8-тетраметил-2-(2-метил-3-карбоксипентан)-6-оксихроман- 1,6диаминогексансефарозы 4В (аффинный сорбент 1) состоит из трех стадий. 1. В трехгорлый реактор емкостью 500 мл под слой бензола вносят 25 мг триметилгидрохинона, 3 мл эфирата трехфтористого бора и нагревают до кипения в токе инертного газа. В кипящую смесь в течение 1,5 ч при перемешивании по каплям прибавляют 27 мл терпенсида С10. Постоянную температуру поддерживают 5 часов, затем охлаждают до комнатной температуры, отмывают водой, 10% раствором ПаНСО3, водой. Бензол отгоняют под вакуумом, остаток растворяют а гексане, промывают 80% этанолом. Гексан отгоняют под вакуумом. Продукт реакции перегоняют под высоким вакуумом и хроматографируют на колонке с SL 100 (160 Lachema, Chamapoe (ЧССР), элюция гексаном и эфиром в соотношении 95:5). Получают 22 г вязкой жидкости светло-желтого цвета - 2, 5, 7, 8 - тетраметил-2-(2-метилпен-тен-2)- и 6оксихроман (№ 1). R f 0,56 (Sleufol UV-254, гексан: эфир - 70:30. ИК-спектр (см.-1): 1088 (пирановый цикл), 3528 (-ОН-группа). Найдено, %: С-79,10; Н-9,80. Вычислено С-78,95; Н-9,90. 2. В круглодонную колбу на 100 мл, снабженную механической мешалкой, вносят 0,025 моль (7,3 г) вещества № 1, растворенного в небольшом объеме эфира, 0,05 моль (2,3 г) муравьиной кислоты и 0,2 моль (19,6 г) серной кислоты. Перемешивают на ледяной бане в течение 2 ч. Продукт реакции экстрагируют эфиром, промывают водой до нейтральной реакции, эфир упаривают на роторном испарителе. Выход вещества № 2 2, 5, 7, 8-тетраметил-2-(2-метил-3карбокси-пентан)-6-оксихроман по карбоксильной группе, определенный титрованием, составляет 40%. 3. К бромцианоактивированной сефарозе 4В через 1,6-диаминогексан (спейсер) присоединяют вещество № 2 (лиганд). Подсушенную сефарозу со спейсером суспендируют в спиртовом растворе лиганда (4,5 г лиганда в 20 мл спирта на 10 г сефарозы). К полученной суспензии по каплям добавляют 10 мл спиртового раствора (200 мг) дициклогексилкарбоксидиимида. Смесь перемешивают 16 ч при 4°С. Прибавляют избыток уксусной кислоты для блокирования несвязавшихся реакционных групп спейсера, перемешивают 2 ч при 4°С. После этого последовательно промывают сефарозу спиртом, смесью спирт и вода (1:1), 0,1 М НСІ.0,1 М NaНСО3, водой. Получают аффинный сорбент I. Пример 2. Получение 2, 5, 7, 8-тетра-метил-2-(2-метил-3-аминометилпентан)-6оксихроманглицинсефарозы 4В (сорбент П). 1. Сначала получают вещество № 1, как описано в примере 1, стадия 1. 2. Вещество 2, 5 , 7, 8-метраметил-2(2-метил-3-аминопентан)-6-оксихромам (вещество № 3) получают путем йодирования (4), цианирования (5), восстановления нитрилов к- аминам литий алюминийгидридом в присутствии хлорида алюминия (6). Выход вещества № 3 по аминогруппе составляет 33%. 3. К бромцианоактивированной сефаро-зе 4В через глицилглициновый спейсер присоединяют вещество № 3 (лиганд). Непрореагировавшие активные группы на сефарозе инактивируют избытком этаноламина. Пример 3. Получение витамин Е-связывающих белков на аффинном сорбенте 1. Печень крыс гомогенизируют в 0,04 М трис-НСІ буфере рН 7,4 0 с 0,25 М са харозой (50%-ный гомогенат). Гомогенат центрифугир уют при 10000° 15 мин, а затем при 105000 ° 60 мин. Липидную пленку удаляют фильтрованием, а полученный цитозоль, содержащий 1000 мг белка, пропускают через колонку (размером 1,1x10 см) с аффинным сорбентом 1, который предварительно уравновешивают буфером 0,04 М трис-HCI рН 7.4, со скоростью 10 мл/см 2 'ч. Балластные белки удаляют тем же буфером, Сорбированный белок элюируютступенчатым градиентом на указанном буфере: 0,5 М ПаСІ, 0,8 М NаСІ, 30% этиленгликолем с 0,5 М NaCI, 50% этанолом. Получают четыре белковые фракции, при этом только вторая фракция обладает токоферолсвязывающей активностью. Выделяют 0,253 мг целевого белка (степень очистки по сравнению с цитозолем увеличивается в 3958 раз), удельная радиоактивность 12500 имп мин /мг белка. Примеры 4и5 осуществляют согласно схеме, описанной в примере 3, на аффинном сорбенте 1. Изменение условий и режимов получения белка, а также результаты очистки показаны в табл. 1. Примеры 6-8. Получение витамин Е-связывающих белков на аффинном сорбенте II. Схема способа получения соответствует примеру 3. Выделяют три фракции, токоферолсвязывающую активность проявляет вторая. Получают 0,139 мг белка. Изменение режимов и условий, а также результаты очистки представлены в табл. 2. Полученные результаты по выделению белка подтверждают преимущество разработанного способа на основе аффинных сорбентов I, II при соблюдении указанных усло вий сорбции, промывки и элюции в сравнении со способом-прототипом: степень очистки возрастает в 4-7 тыс. раз.
ДивитисяДодаткова інформація
Автори англійськоюDonchenko Heorhii Viktorovych, Postoenko Volodymyr Oleksiovych, Palivoda Olha Mykhailivna, Boiko Larysa Mykhailivna
Автори російськоюДонченко Георгий Викторович, Постоенко Владимир Алексеевич, Паливода Ольга Михайловна, Бойко Лариса Михайловна
МПК / Мітки
МПК: C07D 311/72, C12P 13/00
Мітки: одержання, е-зв'язуючих, вітамін, печінки, спосіб, білків, щурів
Код посилання
<a href="https://ua.patents.su/3-14645-sposib-oderzhannya-vitamin-e-zvyazuyuchikh-bilkiv-z-pechinki-shhuriv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання вітамін е-зв’язуючих білків з печінки щурів</a>
Попередній патент: Пристрій для наповнення форм пластично-в’язким продуктом
Наступний патент: Спосіб визначення серцевої недостатності
Випадковий патент: Пристрій для тракції хребта та суглобів