Спосіб одержання 5-ароїл-3,6-діарилдигідропіримідин-2,4-(1н,3н)-діонів
Номер патенту: 33738
Опубліковано: 10.07.2008
Автори: Кушнір Олег Васильович, Сукач Володимир Андрійович, Вовк Михайло Володимирович
Формула / Реферат
Спосіб одержання 5-ароїл-3,6-діарилдигідропіримідин-2,4-(1Н,3Н)-діонів загальної формули:
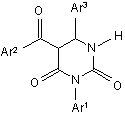 ,
,
де Аr1 = Ph, 4-С1С6Н4, 4-PhOC6H5, 3,4-Me2C6H4;
Аr2 = 4-С1С6H4, 4-ВrС6Н4, 4-МеС6Н4;
Аr3 = 2-FC6H4, 3-BrC6H4, 4-NO2C6H4, 3,4-С12С6Н3,
який відрізняється тим, що N-арил-S-метилароїлкетенацеталі піддають взаємодії з 1-хлоробензилізоціанатами при кімнатній температурі в органічному розчиннику в присутності води з наступним виділенням цільових продуктів звичайними методами.
Текст
Корисна модель відноситься до органічної хімії, а саме до способу отримання нових похідних гетероциклічної системи дигідропіримідин-2,4(1Н,3Н)-діону загальної формули: Ar3 O H N Ar 2 N O O Ar1 де Аr1 = Ph, 4-СlС6Н4, 4-PhOC6H5, 3,4-Me2C6H4; Аr2 = 4-СlС6H4, 4-ВrС6Н4, 4-МеС6Н4; Аr3 = 2-FC6H4, 3-BrC6H4, 4-NO2C6H4, 3,4-Сl2С6Н3 Сполуки цього типу можуть знайти застосування як біологічно активні речовини, а також як вихідні для нових агрохімічних та фармацевтичних препаратів. Названі сполуки, їх властивості і застосування в науковій літературі та патентних виданнях не описані. Найближчим структурним аналогом сполук, які заявляються, є 3,6-дизаміщені дигідропіримідин-2,4-діони R3 R2 H N N O O R1 де R1, R3 = Alk, Ar; R2 - H, Alk Показано, що серед похідних названої гетероциклічної системи є сполуки з високою гербіцидною активністю [1, 2], протипухлинною та протимікробною дією [3], а також антагоністи серотонінових рецепторів [4]. Для синтезу 3,6-диарилдигідропіримідин-2,4-діонів, як правило, використовують внутрішньомолекулярну конденсацію важкодоступних 3-арил-3-(N’-арилуреїдо)пропіонових кислот [3,5-7], яка дуже чутлива до природи ароматичних замісників і часто приводить до цільових продуктів з низькими виходами. 3-Арил-5-етил-6-гідрокси-6пропілдигідропіримідин-2,4-діони [2] отримують при рециклізації відповідних важкодоступних оксазиндіонів з великим надлишком аміаку, а 5.6-диметил-3-[3-(4-фенілпіперазин-1-1-іл)пропіл]дигідропіримідин-2,4-діон [4] багатостадійними перетвореннями з використанням відносно дорогих 1-феніл-4-(3-амінопропілпіперазину) та метилового естеру 3-ізоціанато-3,3-диметилпропанової кислоти. Описані методи мають ряд суттєвих синтетичних обмежень і не дають можливості вводити в положення 5 дигідропіримідинового циклу бензольні групи, що може значно розширити спектр корисних властивостей цільових сполук. Задачею корисної моделі є спосіб отримання нових 5-ароїлпохідних дигідро-піримідин-2,4(1Н,3Н)-діону загальної формули: O Ar3 N Ar2 O N H O Ar1 де Аr1 = Ph, 4-СlС6Н4, 4-PhOC6H5, 3,4-Ме2С6Н4; Аr2 - 4-СlС6Н4, 4-ВrС6Н4, 4-МеС6Н4; Аr3 - 2-FC6H4, 3-BrC6H4, 4-NO2C6H4, 3,4-Сl2С6Н3 Спосіб отримання сполук, які заявляються, полягає в тому, що S-метил-N-арилароїлкетенацеталі піддають взаємодії з 1-хлоробензилізоціанатами при кімнатній температурі в органічному розчиннику в присутності двох еквівалентів води. Цільові продукти виділяють з реакційної суміші стандартними методами. Виходи становлять 45-70%. O O SMe Ar 2 NHAr1 Ar3 N + Cl C O H2O -HCl, -MeSH Ar3 N Ar2 O N Ar1 H O де Аr1 = Ph, 4-СlС6Н4, 4-PhOC6H5, 3,4-Me2C6H4; Аr2 = 4-СlС6Н4, 4-ВrС6Н4, 4-МеС6H4; Аr3 = 2-FC6H4, 3-BrC6H4, 4-NO2C6H4, 3,4-Сl2С6Н3 Запропонований підхід відкриває шлях до сполук, які можуть знайти практичне застосування як фармацевтичні препарати, а також, завдяки наявності в структурі піримідину схильних до модифікації екзоциклічного ароїльного та ендоциклічних карбамоїльного і уреїдного фрагментів, як вихідні речовини в синтезі раніше невідомих типів сполук. Отриманий результат практично неможливо було передбачити, оскільки, виходячи з високоелектрофільного характеру 1-хлороалкіл-ізоціанатів[8,9], варто було очікувати, що в присутності в реакційній суміші води вони будуть досить легко гідролізуватись і тим самим виводитись із сфери реакції. При відсутності в реакційній суміші води продуктами взаємодії є 5-ароїл-6-метилтіо-3,4-дигідропіримідин-2-(1Н)-они формули: O Ar3 N Ar2 MeS N Ar1 H O де Аr1 = Ph, 4-СlС6Н4, 3,4-Ме2С6Н3; Аr2 =4-СlС6Н4, 4-ВrС6Н4, 4-МеС6Н4; Аr3 = 2-FC6H4, 3-BrC6H4, 4-NO2C6H4 які не перетворюються в цільові 5-ароїлпіримідин-2,4(1Н,3Н)-діони при довготривалому (8-10год) нагріванні з водою розчині етанолу або діоксану навіть в присутності каталітичних кількостей кислоти або лугу. Реальний перебіг процесу циклоконденсації, очевидно, характеризується швидким утворенням на першій стадії продукту С-алкілування 1-хлоробензилізоціанатом S,N-кетенацеталю, MeS-група якого при дії води в присутності НСl, який виділяється при алкілуванні, легко гідролізується до відповідного a-гідроксиіміну, на атом азоту якого направлена атака ізоціанатної групи, що приводить до формування піримідонового циклу. Індивідуальність та склад всіх отриманих 5-ароїл-3,6-діарилдигідро-піримідин-2,4(1Н,3Н)-діонів доведені результатами хроматомас-спектрометрії і елементного аналізу, а будова - ІЧ, ЯМР 1Н та 13С спектрами. Корисна модель ілюструється загальним методом отримання 5-ароїл-3,6-діарил-дигідропіримідин-2,4(1Н,3Н)діонів і фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання 5-ароїл-3,6-діарилдигідропіримідин-2,4(1Н,3Н)-діонів До розчину 2.8ммоль S-метил-N-арилароїлкетенацеталю в 20мл сухого толуолу або метиленхлориду додавали 0,1мл води, а потім 2,8ммоль 1-хлоробензилізоціанату і залишали при кімнатній температурі на 24год. До реакційної суміші додавали 20мл гексану, утворений твердий продукт відфільтровували, сушили і кристалізували з етанолу. Приклад 1. 6-(4-Нітрофенил)-5-(4-хлорбензоїл)-3-фенілдигидропіримідин-2,4(1Н,3Н)-діон. Вихід 61%, топл. 243-245°С. ІЧ спектр, см-1: 3280 (NH), 1725 (С=О), 1670 (С=О). Спектр ЯМР 1Н, d, м.ч.: 5.30д (1Н, Н6, J 7.3Гц), 5.58д (1Н, Н5, J 7.3Гц), 7.18-7.38м (5Н аром.), 7.56д (2Н аром.), 7.81д (2Н аром), 8.03д (2Н аром.), 8.29д (2Н аром.), 8.68с (1Н, NH). Спектр ЯМР 13С, d, м.д.: 51.92 (С6), 54.97 (С5), 123.83, 127.98, 128.67, 128.69, 128.98, 129.03, 130.74, 134.33, 135.37, 139.20, 145.87, 147.38 (САr), 152.40 (С2), 164.37 (С4), 191.45 (Аr2С=О ). Знайдено, %: С 61.63; Н 3.72; N 9.26.; [М-1] 448.0. С23Н16СlN3О5. Вирахувано, %: С 61.41; Н 3.59; N 9.34; М 449.8. Приклад 2. 6-(3-Бромфеніл)-5-(4-хлорбензоїл)-3-(4-хлорфеніл)дигідропіримідин-2,4(1Н,3Н)-діон. Вихід 47%, т.топл. 218219°С. ІЧ спектр, см-1: 3275 (NH), 1720 (С=О), 1665 (С=О). Спектр ЯМР 1Н, d, м.ч.: 5.15д (1Н, Н6, J 7.2Гц), 5.54д (1Н, Н5, J 7.2ц), 7.17-7.56м (9Н аром.), 7.69с (1Н аром.), 8.00д (2Н аром), 8.61с (1Н, NH). Спектр ЯМР 13С, d, м.ч.: 51.88 (С6), 54.85 (С5), 123.77, 127.64, 128.60, 130.83, 131.58, 132.58, 132.21, 134.32, 136.05, 137.10, 137.51, 139.18, 142.15, 145.65 (СAr), 151.91 (С2), 166.65 (С4), 192.22 (Аr2С=О ). Знайдено, %: С 53.05; Н 3.05; N 5.28, М 518.6. С23Н15ВrСl2N2О3. Вирахувано, %: С 53.31; Н 2.92; N 5.41, М 518.2. Приклад 3. 6-(4-Нітрофеніл)-5-(4-хлорбензоїл)-3-(4-хлорфеніл)дигідро-піримідин-2,4(1Н,3Н)-діон. Вихід 70%, т.топл. 255257°С. ІЧ спектр, см-1: 3275 (NH), 1720 (С=О), 1665 (С-О). Спектр ЯМР 1Н, d, м.ч.: 5.32д (1Н, Н6, J 7.2Гц), 5.61д (1Н, Н5, J 7.2Гц), 7.24д (2Наром.), 7.45д (2Наром.), 7.56д (2Наром.), 7.76д (2Наром.), 8.01д (2Наром.), 8.22д (2Наром.), 8.73с (1Н, NH). Спектр ЯМР 13С, d, м.ч.: 51.93 (С6), 54.86 (С5), 121.43, 123.82, 128.72, 129.01, 130.69, 130.87, 132.62, 134.24, 134.35, 139.22, 145.68, 147.39 (САr), 152.18 (С2), 166.72 (С4), 193.36 (Аr2С=О). Знайдено, %: С 56.79; Н 3.15; N 8.85; М+ 484.4 С23Н15Сl2N3О5. Вирахувано, %: С 57.04; Н 3.12; N 8.68; М 484.3. Приклад 4. 6-(4-Нітрофеніл)-5-(4-хлорбензоїл)-3-(4-феноксифеніл)дигідро-піримідин-2,4(1H,3Н)-діон. Вихід 45%, т.пл. 228-230°С. ІЧ спектр, см-1: 3270 (NH), 1735 (С=О ), 1680 (С=О ). Спектр ЯМР 1Н, d, м.ч.: 5.31д (1Н, Н6, J 6.9Гц), 5.57д (1Н, Н5, J 6.9Гц), 7.01-7.15м (7Н аром.), 7.38д (2Н аром.), 7.54д (2Н аром.), 7.79д (2Н аром.), 8.04д (2Н аром), 8.23д (2Н аром.), 8.66с (1Н, NH). Спектр ЯМР 13С, d, м.ч.: 51.96 (С6), 54.97 (С5), 119.10, 123.83, 123.89, 128.72, 129.03, 130.12, 130.23, 130.58, 130.72, 131.48, 132.88, 134.01, 134.37, 139.20, 145.84, 147.39 (САr), 152.46 (С2), 166.85 (С4), 193.46 (Аr2С=O). Знайдено, %: С 64.01; Н 3.59; N 7.90; [М-1]+ 540.0. С29Н20СlN3О6. Вирахувано, %: С 64.27; Н 3.72; N 7.75; М 541.9. Приклад 5. 5-(4-Бромбензоїл)-6-(3-бромфеніл)-3-фенілдигідропіримідин-2,4(1Н,3Н)-діон. Вихід 55%, т.топл. 287-289°С. ІЧ спектр, см-1: 3250 (NH), 1720 (С=О), 1660 (С=О). Спектр ЯМР 1Н, d, м.ч.: 5.13д (1H, Н6, J 6.9Гц), 5.53д (1H, Н5, J 6.9Гц), 7.12д (2Н аром.), 7.23-7.68м (9Н аром.), 7.92д (2Н аром.), 8.57с (1Н, NH). Спектр ЯМР 13С, d, м.ч.: 51.92 (С6), 55.00 (С5), 121.83, 126.24, 127.94, 128.42, 128.68, 128.91, 130.04, 130.71, 130.84, 131.22, 131.98, 134.75, 135.42, 141.05 (САr.), 152.38 (С2), 166.99 (С4), 193.92 (Аr2С=O). Знайдено, %: С 52.56; Н 2.87; N 5.39; М 528.0. C23H16Br2N2O3. Вирахувано, %: С 52.30; Н 3.05; N 5.30; М 528.2. Приклад 6. 5-(4-Бромбензоїл)-6-(4-нітрофеніл)-3-фенілдигідропіримідин-2,4(1H,3Н)-діон. Вихід 64%, т.топл. 268-270°С. ІЧ спектр, см-1: 3250 (NH), 1725 (С=О), 1680 (С=О). Спектр ЯМР 1Н, d, м.ч.: 5.31д (1H, Н6, J 7.1Гц), 5.56д (1Н, Н5, J 7.1Гц), 7.18д (2Н аром.), 7.39м (3Н аром.), 7.68д (2Н аром.), 7.81д (2Н аром.), 7.97д (2Н аром.), 8.25д (2Н аром.), 8.68с (1Н, NH). Спектр ЯМР 13С, d, м.ч.: 51.87 (С6), 54.98 (С5), 123.78, 127.93, 128.43, 128.61, 128.73, 128.92, 130.73, 131.94, 134.60, 135.33, 145.84, 147.37 (САr), 152.34 (С2), 166.61 (С4), 193.64 (Аr2С =О) . Знайдено, %: С 56.11; Н 3.17; N 8.36. [М-1]+ 493.7. C23H16BrN3O5. Вирахувано, %: С 55.89; Н 3.26; N 8.50; 494.3. Приклад 7. 5-(4-Бромбензоїл)-6-(3,4-дихлорфеніл)-3-фенілдигидропіримідин-2,4(1H,3Н)-діон. Вихід 62%, т.топл. 231233°С. ІЧ спектр, см-1: 3250 (NH), 1720 (С=О), 1660 (С=О). Спектр ЯМР 1Н, d, м.ч.: 5.16д (1H, Н6, J 7.6Гц), 5.56д (1Н, Н5 , J 7.6Гц), 7.12д (2Наром.), 7.39-7.72д (8Наром.), 7.95д (2Наром.), 8.52с (1H, NH). Спектр ЯМР 13С, d, м.ч.: 51.43 (С6), 54.75 (С5), 126.54, 128.10, 128.91, 129.72, 130.14, 131.10, 131.55, 134.76, 135.35, 137.19, 137.57, 139.41, 142.63, 143.21 (СAr), 152.28 (С2), 166.85 (С4), 193.76 (Аr2С=О). Знайдено, %: С 53.42; Н 3.08; N 5.17; [М-1]+ 517.3. С23Н15ВrСl2N2О3. Вирахувано, %: С 53.31; Н 2.92; N 5.41; М 518.2. Приклад 8. 3-(3,4-Диметилфеніл)-5-(4-метилбензоїл)-6-(2-фторфеніл)дигідро-піримідин-2,4(1Н,3Н)-діон. Вихід 51%, т.топл. 215-217°С. ІЧ спектр, см-1: 3245 (NH), 1720 (С=О), 1675 (С=О). Спектр ЯМР 1Н, d, м.ч.: 2.26с (6Н, 2 СН3), 2.41с (3Н, СН3), 5.23 уш.с (2Н, Н6+Н5), 6.90-7.51м (9Н аром.), 7.95д (2Н аром.), 8.41с (1H, NH). Спектр ЯМР 13С, d, м.д.: 46.85 (С6), 54.11 (С5), 124.92, 125.41, 125.51, 126.06, 128.01, 128.81, 129.45, 129.54, 129.59, 130.37, 130.45, 130.48, 132.82, 133.10, 135.99, 136.51, 144.81 (САr), 152.72 (С2), 167.05 (С4), 194.12 (Аr2C=O). Знайдено, %: С 71.83; Н 5.28; N 6.32; М+ 430.7. C26H23FN2O3. Вирахувано, %: С 72.54; Н 5.39; N 6.51 М 430.5. Загальний спосіб одержання 5-ароїл-1,4-діарил-6-метилтіо-3,4-дигідропіримідин-2(1H)-онів До розчину 2.8ммоль S-метил-N-арилароїлкетенацеталю в 20мл сухого толуолу додавали 2.8ммоль 1хлоробензилізоціанату і залишали при кімнатній температурі на 24год. До реакційної суміші додавали 20мл гексану, утворений твердий продукт відфільтровували, сушили і кристалізували з етанолу. Приклад 1. 6-Метилтіо-4-(4-нітрофеніл)-5-(4-хлорбензоїл)-1-феніл-3,4-дигідропіримідин-2(1Н)-он. Вихід 63%, т.топл. 211213°С. ІЧ спектр, см-1: 3220 (NH), 1690 (C=О), 1640 (С=О). Спектр ЯМР 1Н, d, м.ч.: 1.78с (3Н, CH3S), 5.30д (1Н, Н4, J 3,9Гц), 7.28-7.49м (6Н аром.), 7.67-7.84м (5Н аром.), 8.27д (2Н аром.), 8.53д (1Н, NH, J 3,9Гц). Спектр ЯМР 13С, d, м.ч.: 17.63 (CH3S), 51.87 (С4), 118.22 (С5), 123.77, 127.59, 128.05, 128.92, 129.78, 130.46, 134.38, 135.33, 137.17, 139.13, 143.14, 149.55 (CAr), 152.11 (С6), 152.34 (С2), 192.32 (Аг2С = Знайдено, %: S; N. С24Н18СlN3О4S. О) Вирахувано, %: S 6.68; N 8.76, M 479.9. Приклад 2. 4-(3-Бромфеніл)-6-метилтіо-5-(4-хлорбензоїл)-1-(4-хлорфеніл)-3,4-дигідропіримідин-2(1H)-он. Вихід 59%, т.топл. 177-179°С. ІЧ спектр, см-1: 3215 (NH), 1700 (С=О), 1655 (С=О). Спектр ЯМР 1Н, d, м.ч.: 1.72с (3Н, СН3), %: 5.16д (1Н, Н4, J 3.6Гц), 7.24-7.83м (10Наром.), 8.03д (2Наром.), 8.46д (1Н, NH, J 3.6Гц). Спектр ЯМР 13С, d, м.ч.: 17.54 (CH3S), 54.18 (С4), 119.51 (С5), 121.18, 121.78, 125.26, 128.12, 128.65, 130.89, 131.51, 132.13, 136.15, 137.05, 137.57, 141.00, 144.66 (CAr), 152.08 (С6), 192.29 (Ar2C=O). Знайдено, %: N 5.26; S 6.03; M+ 548.8. С24H17ВrСl2N2O2S. Вирахувано, %: N 5.11;S5.85; M 548.3. Приклад 3. 5-(4-Бромбензоїл)-6-метилтіо-4-(4-нітрофеніл)-1-феніл-3,4-дигідропіримідин-2(1Н)-он. Вихід 63%, т.топл. 194-196°С. ІЧ спектр, см-1: 3225 (NH), 1705 (С=О), 1650 (C=О). Спектр ЯМР 1Н, d, м.д.:1.69с (3Н, CH3S), 5.28д (1Н, Н4, J 3.9Гц), 7.24-7.89м (11Н аром.), 8.40д (2Н аром.), 8.59д (1Н, NH, J 3.9Гц). Спектр ЯМР 13С, d, м.ч.: 17.64 (CH3S), 54.08 (С4), 118.18 (С5), 123.85, 126.45, 127.58, 128.04, 128.59, 129.76, 130.56, 131.51, 137.17, 137.66, 143.25, 146.94 (СAr), 149.54 (С6), 152.10 (С2=О ), 192.50 (Аr2СО). Знайдено, %: N 8.17; S 5.87; [М+1]+ 525.2. C24H18BrN3O4S. Вирахувано, %: N 8.01; S 6.11;М 524.4. Приклад 4. 1-(3,4-Диметилфеніл)-6-метилтіо-5-(4-метилбензоїл)-4-(2-фтор-феніл)-3,4-дигідропіримідин-2(1H)-он. Вихід 48%, т.топл. 195-197°С. ІЧ спектр, см-1: 3230 (NH), 1700 (С=О ), 1640 (С=О ). Спектр ЯМР 1Н, d, м.ч.: 1.73с (3Н, CH3S), 5.38д (1Н, Н4, J 3.3Гц), 7.03-7.34м (9Н аром.), 7.60д (2Н аром.), 8.03д (1Н, NH, J 3.3Гц). Спектр ЯМР 13С, d, м.ч.: 17.91 (CH3S), 18.91. 19.27, 21.06 (3 СН3), 50.69 (С4), 119.52 (С5), 124.81, 127.11, 128.10, 128.60, 128.81, 128.97, 129.15, 129.92, 129.97, 130.68, 135.14, 135.19, 135.54, 135.85, 137.56, 143.38 (СAr), 152.37 (С6), 160.36 (С2), 192.56 (Аr2С=О). Знайдено, %: N 6.11; S 7.09; [М+1]+ 461.2. C27H25FN2O2S. Вирахувано, %: N 6.08; S 6.96; М 460.6. Література: 1. Pat. Belg. 625,897. 10 June 1963. Uracils and hydrouracils/ Loux H.M., Luckenbaugh R.W., Soboczenski E.J. Chem. Abstr. – 1964. - Vol.60. - 14519c. 2. Pat. Ger. 2,132,763. 18 January 1973. Herbicidal 6-hydroxydihydrouracils/ Jarger G., Wenzellurger J., Schmidt R.R. Chem. Abstr. - 1973. - Vol.78. - 97692. 3. Soliman R., Habib N.S., Ismail K., Moustafa A., Sarg M.T., Fanaki N.H. Synthesis of novel pyrimidine-2,4-diones and 2-thioxo-pyrimidine-4-ones as potential anticancer and antimicrobial agents. 4. Pat. Ger. Hexahydropyrimidines. 21 December 1978. Weber R.O., Anagrostopulos H., Gebet U. (Hoechst A.-G). Chem Abstr. - 1979. - Vol.90. – 186989r. 5. Родионов B.M., Вязлова С.А. Синтез b-арил-b-ураминопропионовых кислот и их фенильных и нафтильных производных// Журн. общ. химии. - 1933. - Т.3. - С.628-631. 6. Jonson Т.В., Livak J.E. Researches on Pyrimidines. CXLIX. The Synthesis of Aryl Substituted Dihydrouracils and their Conversion to Uracil Derivatives// J. Amer. Chem. Soc. - 1936. - Vol.58. - P.299-303. 7. Родионов В.М., Куртев Б.И. b-(b-Нафтил)-b-аминопропионовая кислота и ее пиримидиновые производные// Изв. АН СССР. Сер. хим. - 1952. - №2. - С.268-273. 8. Gorbatenko V.I., Samarai L.I. Synthesi and Reactions of a-Haloalkyl Isocyanates// Synthesis. - 1980. - N2. - P.85110. 9. Sukach V.A., Bol’but A.V., Sinitsa A.D., Vovk M.V. A Convenient Synthesis of N-1-Substituted 3,4Dihydropyrimidin-2(1H)-ones by Cyclocondensation of a-Chlorobenzyl Isocyanates with Ethy1 N-alky1(ary1)-baminocrotonates// Synlett. - 2006. - N3. - P.375-378.
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 5-aroyl-3,6-diaryldihydropyrimidine-2,4-(1h,3h)-diones
Автори англійськоюVovk Mykhailo Volodymyrovych, Sukach Volodymyr Andriiovych, Kushnir Oleh Vasylovych
Назва патенту російськоюСпособ получения 5-ароил-3,6- диарилдигидропиримидин-2,4-(1н,3н)-дионов
Автори російськоюВовк Михаил Владимирович, Сукач Владимир Андреевич, Кушнир Олег Васильевич
МПК / Мітки
МПК: C07D 239/00
Мітки: 5-ароїл-3,6-діарилдигідропіримідин-2,4-(1н,3н)-діонів, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/3-33738-sposib-oderzhannya-5-arol-36-diarildigidropirimidin-24-1n3n-dioniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-ароїл-3,6-діарилдигідропіримідин-2,4-(1н,3н)-діонів</a>
Попередній патент: Пропульсивна установка з груповим приводом та одноступеневою передачею потужності на гвинти, що перекривають один одного
Наступний патент: Спосіб формування груп ризику з розвитку імунної недостатності серед дітей, народжених від опромінених батьків
Випадковий патент: Спосіб утилізації шуму







