Спосіб одержання 1-заміщених 2,4-дихлоро-1н-імідазол-5-карбальдегідів
Номер патенту: 51273
Опубліковано: 12.07.2010
Автори: Чорноус Віталій Олександрович, Грозав Аліна Миколаївна, Вовк Михайло Володимирович
Формула / Реферат
Спосіб одержання 1-заміщених 2,4-дихлоро-1Н-імідазол-5-карбальдегідів
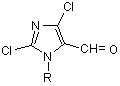 ,
,
де R=Me, Ph, 4-СlС6Н4, 4-FC6H4, 2-MeC6H4, 4-MeC6H4, 4-MeOC6H4, який відрізняється тим, що 1-заміщені імідазолідин-2,4-діони піддають взаємодії з сумішшю диметилформаміду та хлороксиду фосфору у мольному співвідношенні 1:2:5 при 90 °С з наступним виділенням цільових продуктів звичайними методами.
Текст
Спосіб одержання 1-заміщених 2,4-дихлоро1Н-імідазол-5-карбальдегідів 2 3 51273 суванням спеціального обладнання - колонок «Isolute HM-N», що в значній мірі обмежує технологічний масштаб процесу. Задачею винаходу є спосіб отримання нових 2,4-дихлоро-5-форміл-похідних 1H-імідазолу загальної формули: Cl де R=Me, Ph, 4-СlС6Н4, 4-FC6H4, 2-МеС6Н4, 4МеС6Н4, 4-МеОС6H4 Спосіб одержання сполук, які заявляються, полягає в тому, що препаративно доступні [4-6] 1алкіл(арил)імідазолідин-2,4-діони (гідантоїни) піддають взаємодії з сумішшю диметилформаміду та хлороксиду фосфору у мольному співвідношенні 1:2:5 при 90°С. Цільові продукти відділяють стандартними методами за допомогою операцій фільтрування, екстракції та кристалізації. Виходи сягають 47-52%. N Cl CH O N 4 R O H N O N R Cl H N POCl3/ДМФА O Cl N POCl3 N R де R=Me, Ph, 4-СlС6Н4, 4-FC6H4, 2-МеС6Н4, 4МеС6Н4, 4-МеОС6Н4 Отриманий результат є новим та оригінальним, оскільки як в науковій, так і патентній літературі відсутні дані, які б стосувались синтезу 1заміщених 2,4-дихлоро-1H-імідазол-5карбальдегідів при реакції 1-заміщених гідантоїнів з системою хлороксид фосфорудиметилформамід. Окрім цього, він є непередбачуваним, оскільки з врахуванням раніше опублікованих [7] результатів взаємодії 3арилімідазолідин-2,4-діонів з реагентом Вільсмейєра-Хаака можна було очікувати що реакція зупиниться на стадії 3-заміщених 5-хлоро-2-оксо2,3-дигідро-1H-імідазол-4-карбальдегідів. Насправді ж, на відміну від 3-арилімідазолідин-2,4-діонів у випадку ізомерних до них 1-алкіл(арил)імідазолідин-2,4-діонів проміжні 5-хлоро-2-оксо2,3-дигідро-1H-імідазол-4-карбальдегіди при дії надлишку хлороксиду фосфору перетворюються у цільові 2,4-дихлоро-1H-імідазол-5-карбальдегіди. Запропонований підхід, завдяки наявності в структурі синтезованих імідазолів трьох високоелектрофільних центрів - атомів хлору в положеннях 2, 4 та альдегідної групи в положенні 5 - відкриває ефективний шлях до сполук, які можуть бути використані як вихідні для отримання нових агрохімічних та фармацевтичних препаратів. При цьому на особливу увагу заслуговує альдегідна група, яка дозволяє здійснювати модифікацію положення 5 циклу низкою функціональних ациклічних та гетероциклічних фрагментів, що практично неможливо зробити послуговуючись методом хлорування відповідних 5-функціонально заміщених імідазолів. Будова та склад отриманих 1-заміщених 2,4дихлоро-1H-імідазол-5-карбальдегідів доведені даними елементного аналізу та результатами вимірів ІЧ-спектрів, ЯМР 1Н, 13С спектрів та хроматомас-спектрів. Вихід ілюструється загальним способом одержання 1-заміщених 2,4-дихлоро-1H-імідазол-5 CH O Cl N CH O R карбальдегідів та фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання 1-заміщених 2,4дихлоро-1H-імідазол-5-карбальдегідів. До суспензії 0.03моль імідазолін-2,4-діону в 4.38г (0.06моль) диметилформаміду при перемішуванні і охолодженні до 0-5°С додавали 23г (0.15моль) хлороксиду фосфору. Отриману суміш нагрівали на водяній бані при 90°С впродовж 8год. Надлишок хлор оксиду фосфору видаляли в вавкуумі, до залишку додавали 50мл води і нейтралізували кристалічним бікарбонатом натрію до рН 8.0. Утворений осад відфільтровували, фільтрат екстрагували етилацетатом (3 20мл), екстракт випарювали, залишок об'єднували з осадом. Отриманий продукт розчиняли в суміші гексанетилацетат, 1:1, фільтрували через оксид алюмінію, фільтрат випарювали, залишок кристалізували із 60%-ного водного етанолу. Приклад 1 1-Метил-2,4-дихлоро-1H-імідазол-5-карбальдегід. Вихід 49%, т.топл. 52-54°С. ІЧ спектр, см-1: 1685 (С=О). Спектр ЯМР 1Н, , м.ч.: 3.86 с (3Н, СН3), 9.69 с (1Н, СН=О). Спектр ЯМР 13С, , м.ч.: 33.49 (СН3), 126.41 (С5), 134.61 (С2), 141.11 (С4), 177.39 (СН=О). Знайдено, %: С 33.31; Н 2.30; N 15.51. [М+1]+ 180. C5H4Cl2N2O. Вирахувано, %: С 33.55; Н 2.25; N 15.65. М 179.0. 1-Феніл-2,4-дихлоро-1H-імідазол-5карбальдегід Вихід 52%, т.топл. 110-112°С. ІЧ спектр, см-1: 1680 (С=О). Спектр ЯМР 1Н, , м.ч.: 7.48-7.67м (5H, Наром.), 9.54 с (1Н, СН=О). Спектр ЯМР 13С, , м.ч.: 127.19, 129.59, 130.36, 133.93 (САr), 127.56 (С5), 138.58 (С2), 140.65 (С4), 176.07 (СН=О). Знайдено, %: С 49.60; Н 2.55; N 11.78. [M+1]+ 242. C10H6Cl2N2O. Вирахувано, %: С 49.82; Н 2.51; N 11.62. М 241.0. 1-(4-Хлорофеніл)-2,4-дихлоро-1H-імідазол-5карбальдегід. 5 51273 Вихід 51%, т.топл. 135-137°С. ІЧ спектр, см-1: 1685 (С=О). Спектр ЯМР 1Н, , м.ч.: 7.53-7.63 м (4Н, Наром.), 9.58 с (1Н, СН=О). Спектр ЯМР 13С, , м.ч.: 127.45 (С5), 128.49, 129.87, 132.41, 136.58 2 4 (СAr), 138.79 (С ), 141.28 (С ), 175.99 (СН=О). Знайдено, %: С 43.27; Н 1.72; N 10.25. [M+1]+ 276. C10H5Cl3N2O. Вирахувано, %: С 43.59; Н 1.83; N 10.14. М 275.5. 1-(4-Фторофеніл)-2,4-дихлоро-1H-імідазол-5карбальдегід. Вихід 49%, т.топл. 123-125°С. ІЧ спектр, см-1: 1680 (С=О). Спектр ЯМР 1Н, , м.ч.: 7.38-7.58 м (4Н, Наром.), 9.57 с (1Н, СН=О). Спектр ЯМР 13С, , м.ч.: 116.73д (J2С-F 22.6 Гц), 127.54, 129.12, 163.31д (J1C-F 251.5 Гц) (САr), 129.92 (С5), 138.93 (С2), 141.12 (С4), 176.03 (СН=О). Знайдено, %: С 46.50; Н 1.87; N 10.64. [М+1]+ 260. C10H5Cl2FN2O. Вирахувано, %: С 46.36; Н 1.95; N 10.81. М 259.0. 1-(2-Метилфеніл)-2,4-дихлоро-1H-імідазол-5карбальдегід. Вихід 50%, т.топл. 85-88°С. ІЧ спектр, см-1: 1685 (С=О). Спектр ЯМР 1Н, , м.ч.: 2.03 с (3Н, СН3), 7.36-7.52 м (4Н, Наром.), 9.56 с (1Н, СН=О). Спектр ЯМР 13С, , м.ч.: 17.24 (СН3), 127.25, 127.39, 130.67, 131.31, 133.41, 135.47 (СAr), 127.45 (С5), 138.61 (С2), 140.59 (С4), 176.07 (СН=О). Знайдено, %: С 51.70; Н 3.24; N 10.81. [М+1]+ 256. C11H8Cl2N2O. Вирахувано, %: С 51.79; Н 3.16; N 10.98. М 255.1. 1-(4-Метилфеніл)-2,4-дихлоро-1H-імідазол-5карбальдегід. Вихід 48%, т.топл. 99-100°С. ІЧ спектр, см-1: 1685 (С=О). Спектр ЯМР 1Н, , м.ч.: 2.45 с (3Н, СН3), 7.34-7.39 м (4Н, Наром.), 9.52 с (1Н, СН=О). Спектр ЯМР 13С, , м.ч.: 21.37 (СН3), 126.87, 130.22, 131.31, 140.68 (САr), 127.57 (С5), 138.67(С2), 140.55 (С4), 176.16 (СН=О). Знайдено, %: С 51.72; Н 3.10; N 10.89. [M+1]+ 256. C11H8Cl2N2O. Вирахувано, %: С 51.79; Н 3.16; N 10.98. М 255.1. 1-(4-Метоксифеніл)-2,4-дихлоро-1H-імідазол5-карбальдегід. Вихід 51%, т.пл. 64-66°С. ІЧ спектр, см-1: 1685 (С=О). Спектр ЯМР 1Н, , м.ч.: 3.87 с (3Н, СН3О), Комп’ютерна верстка М. Ломалова 6 7.08-7.41 м (4Н, Наром.), 9.52 с (1Н, СН=О). Спектр ЯМР 13С, , м.ч.: 55.61 (СН3О), 114.74, 126.39, 128.32, 160.79 (САr), 127.66 (С5), 138.94 (С2), 140.53 (С4), 176.23 (СН=О). Знайдено, %: С + 48.96; Н 2.91; N 10.19. [М+1] 272. C11H8Cl2N2O2. Вирахувано, %: С 48.73; Н 2.97; N 10.33. М 271.1. Література: 1. Pat. WO 2009/053102А1. 30 April 2009. Dumeunier R., Lambert С, Trah S., Wenborn S. Novel imidazole derivatives / Syngenta Tarticipations AG. 2. Pat. WO 2009/127615A1. 22 October 2009. Dumeunier R., Lambert C, Trah S., Novel imidazole derivatives having microbiological activity / Syngenta Tarticipations AG. 3. Almansa G., Alfon J., de Arriba A.F., Cavalcanti F.L., Escamilla I., Gomes L.A., Miralles A., Soliva R., Bartroli J., Carceller E., Merlos M., GarciaRafanell J. Synthesis and Structure-Activity Relationship of a New Series of COX-2 Inhibitors: 1,5Diarylimidazoles // J, Med. Chem. 2003. - Vol.46, №16. - P. 3463-3475. 4. Albuquerque J.F.C., Rolea Filho J.A., Brandao S.S.T., Lima M.C.A., Ximenes E.A., Galdino S.L., Pitta I.R., Chantegrel J., Perrisin M., Luu-Duc C. Synthesis and antimicrobal activity of substituted imidazolidinediones and thiaoxoimidazolidinones // Farmaco. - 1999. - Vol.54, N 12. - P. 77-82. 5. Кочканян В.О., Исраелян Ю.А., Заритовский А.И. Новый метод синтеза азолидонов // Химия гетероцикл. соед. - 1978. - №1. - С. 87-89. 6. Beckurts Н., Frerich G., Beckurts H. Beitrage zur Kenntnis der Ureide und der acidylierten Carbaminsaureester. Ueber die Einwirkund von aromatishen Aminen auf Chloroacetyluretane und Chloracetylharnstoffe // Archiv Pharm. - 1899. Vol.237, N5. - P. 331-346. 7. Баранов С.И., Кочканян P.O., Заритовский А.И., Белова Г.И., Раднова С.С. Синтез хлоральдегидов гетероциклического ряда / Хим. гетероцикл. соед. 1975. - №1. - С. 85. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 1-substituted 2,4-chloro-1h-imidazole-5-carbaldehydes
Автори англійськоюVovk Mykhailo Volodymyrovych, Chornous Vitalii Oleksandrovych, Hrozav Alina Mykolaivna
Назва патенту російськоюСпособ получения 1-замещенных 2,4-дихлор-1н-имидазол-5-карбальдегидов
Автори російськоюВовк Михаил Владимирович, Черноус Виталий Александрович, Грозав Алина Николаевна
МПК / Мітки
МПК: C07D 233/54
Мітки: 2,4-дихлоро-1н-імідазол-5-карбальдегідів, 1-заміщених, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/3-51273-sposib-oderzhannya-1-zamishhenikh-24-dikhloro-1n-imidazol-5-karbaldegidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 1-заміщених 2,4-дихлоро-1н-імідазол-5-карбальдегідів</a>
Попередній патент: Спосіб електрокардіографічної діагностики дрібних тварин
Наступний патент: Спосіб підвищення виходу наупліїв з цист артемії
Випадковий патент: Електроскальпель







