Спосіб одержання 2-заміщених 8,9-циклоалкілтієно[3,2-е][1,2,4]триазоло[1,5-с]піримідин-5-(6н)-онів
Формула / Реферат
Спосіб одержання 2-заміщених 8,9-циклоалкілтієно[3,2-е][1,2,4]триазоло[1,5-с]піримідин-5-(6Н)-онів загальної формули :
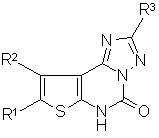 ,
,
де R1R2=(СН2)4, СН2СН(СН3)(СН2)2, (СН2)5,
R3=Ph, 4-FC6H4, 4-СlС6Н4, 4-BrC6H4, 4-NO2C6H4, CH2O-(3-FC6H4),
2-фурил, 3-піридил,
який відрізняється тим, що 2-аміно-3-ціано-4,5-циклоалкілтіофени вводять в реакцію з фенілхлороформіатом при нагріванні в органічному розчиннику при 138-144 °С, а отримані 3-ціано-(4,5-циклоалкілтієн-2-іл)фенілкарбамати піддають взаємодії з гідразидами карбонових кислот при нагріванні в тому ж органічному розчиннику при тій самій температурі з наступним виділенням цільових продуктів звичайними методами.
Текст
Спосіб одержання 2-заміщених 8,9циклоалкілтієно[3,2-е][1,2,4]триазоло[1,5с]піримідин-5-(6Н)-онів загальної формули : R3 N R2 S N H де R1R2=(СН2)4, СН2СН(СН3)(СН2)2, (СН2)5, R3=Ph, 4-FC6H4, 4-СlС6Н4, 4-BrC6H4, 4-NO2C6H4, CH2O-(3FC6H4), 2-фурил, 3-піридил, який відрізняється тим, що 2-аміно-3-ціано-4,5циклоалкілтіофени вводять в реакцію з фенілхлороформіатом при нагріванні в органічному розчиннику при 138-144°С, а отримані 3-ціано-(4,5циклоалкілтієн-2-іл)фенілкарбамати піддають взаємодії з гідразидами карбонових кислот при нагріванні в тому ж органічному розчиннику при тій самій температурі з наступним виділенням цільових продуктів звичайними методами. N O , N R1 N S N H R3 N N O де R1R2=(СН2)4, СН2СН(СН3)(СН2)2, (СН2)5; R3=Ph, 4-FC6H4, 4-СlС6Н4, 4-BrC6H4, 4-NO2C6H4, CH2O(3-FC6H4), 2-фурил, 3-піридил. Сполуки такого типу можуть знайти застосування як біологічно активні речовини, а також як R2 R1 N S N N (19) R2 (11) R3 попередники для отримання нових лікарських засобів. Названі сполуки, їх властивості і застосування в науковій літературі та патентних виданнях не описані. Найближчими структурними аналогами сполук, які заявляються, є 2,4,8,9-заміщені тієно[3,2е][1,2,4]-триазоло[1,5-с]піримідини UA Корисна модель відноситься до органічної хімії, а саме до способу отримання нових похідних конденсованої гетероциклічної системи тієно[3,2е][1,2,4]-триазоло[1,5-с]піримідину загальної формули: 40458 (13) U R1 N 2 R4 де R1R2=(СН2)3, CH2N(CH3)(CH2)2, CH2N(CH2Ph)(CH2)2, CH2CH2(1,2-C6H4); R3=H, Me; R4=H, Me, CH2Cl. Похідні наведеної конденсованої гетероциклічної системи є сполуками з широким спектром біологічної дії. Серед них виявлені речовини з ви 3 40458 соким бактерицидним ефектом [1], противірусною та протипухлинною [2], а також протизапальною активністю [3]. В науковій літературі описано два синтетичних підходи до їх отримання. Перший з них [1-5] базується на використанні відповідних 2аміно-3-ціанотіофенів і включає первинну модифікацію аміногрупи до аміноестерної групи, наступний гідразиноліз з утворенням 3-аміно-4-іміно-3,4дигідротієно[2,3-d]піримідинів та подальше формування тризольного циклу під дією ортоетилформіату або ортоетилацетату. Другий метод [6, 7] передбачає анелювання піримідинового циклу до важкодоступних 2-аміно-3-(1,2,4-триазол-3іл)тіофенів під дією високотоксичного сірковуглецю або хлорангідриду монохлороцтової кислоти. Істотним недоліком обох методів є обмежене введення замісників в положення 2 конденсованої трициклічної системи, що суттєво знижує її придатність для отримання малих хімічних бібліотек для раціонального скринінгу потенційних лікарських препаратів. Окрім цього, описані методи придатні тільки для отримання конденсованих сполук з ароматичним піримідиновим циклом. Задачею корисної моделі є спосіб отримання нових 2-заміщених похідних 8,9-тієно[3,2-е][1,2,4]триазоло[1,5-с]піримідину загальної формули: R2 CN PhOC(O)Cl R1 S NH 2 4 R3 N R2 R1 N S N N R4 де R1R2=(СН2)4, СН2СН(СН3)(СН2)2, (СН2)5 R3=Ph, 4-FC6H4, 4-СlС6Н4, 4-BrC6H4, 4-NO2C6H4, CH2O(3-FC6H4), 2-фурил, 3-піридил. Спосіб одержання сполук, які заявляються, полягає в тому, що 2-аміно-3-ціано-4,5циклоалкілтіофени вводять в реакцію з комерційно доступним фенілхлороформіатом при нагріванні в органічному розчиннику (орто-, мета- або параксилол) при 138-144°С, а отримані 3-ціано-(4,5циклоалкілтієн-2-іл)фенілкарбамати піддають взаємодії з гідразидами карбонових кислот при нагріванні в тому ж органічному розчиннику при аналогічній температурі. Цільові продукти виділяють з реакційної суміші стандартними методами. Виходи становлять 78-94%. R2 CN O R1 S - PhOH N H O Ph R3C(O)NHNH2 R3 NH N R2 R1 N S N H R2 N O -H2O де R1R2=(СН2)4, СН2СН(СН3)(СН2)2, (СН2)5; R3=Ph, 4-FC6H4, 4-СlС6Н4, 4-BrC6H4, 4-NO2C6H4, CH2O(3-FC6H4), 2-фурил, 3-піридил. Запропонований двостадійний варіант синтезу відкриває шлях до сполук, які можуть знайти практичне застосування як базові об'єкти при отриманні фармацевтичних препаратів. Такий висновок ґрунтується як на можливості введення в цільові структури різноманітних фармакофорних замісників R3, так і легкості перетворення NHC(O)N фрагмента в N=CCl-N фрагмент, що створює сприятливі передумови для функціоналізації положення 5 нуклео-фільними групами. Для прикладу зазначимо, що спрямоване введення в саме це положення структурно близького 9-хлоро-2-(2фураніл)[1,2,4]-триазоло-[1,5-с]хіналізинового циклу аміногрупи лежить в основі ефективного синтезу нового антагоніста аденозину CGS 15943 [8], який приблизно в 500 раз активніший за теофілін. R1 S O N N H O N H R3 Опрацьований метод синтезу, в основі якого лежить постадійне формування піримідинового і 1,2,4-триазольного циклу, вигідно відрізняється від зреалізованого в літературі [9] на прикладі важкодоступного 2-ціанофенілізоціанату. Оскільки його аналоги - 3-ціано(тієн-2-іл)ізоціанати - до цих пір ще не описані, запропонована нами методологія передбачає первинне перетворення 3ціаноамінотіофенів під дією фенілхлороформіату в 3-ціано(тієн-2-іл)фенілкарбамати, які при підвищеній температурі схильні до взаємодії з гідразидами карбонових кислот. Подальший перебіг хімічного перетворення важко було заздалегідь передбачити, оскільки не виключалось утворення 3-х типів продуктів: лінійної структури внаслідок заміщення феноксильної групи на гідразидну; піримідинового циклу за рахунок взаємодії b-NH-гідразидної групи з CN-групою; піримідо[1,2,4]триазольного циклу за рахунок конденсації гідразидної СО-групи з ендоциклічною NH-групою піримідинового циклу. Дета 5 льне дослідження реакції методами IЧ, ЯМР 1Н спектроскопії та хроматомас-спектрометрії дозволяє стверджувати, що вона протікає як домінопроцес через всі вищерозглянуті стадії. При цьому найлегше здійснюється заміщення феноксильної групи на гідразидну, свідченням чого є наявність в реакційній суміші після 2год. нагрівання при 138144°С суміші продуктів тієно[2,3-d]піримідинової та тієно[3,2-е][1,2,4]-триазоло[1,5-с]піримідинової структури в приблизно однаковому співвідношенні. Наступне 2год. нагрівання приводить до утворення з високими виходами виключно цільових похідних тієно[3,2-е][1,2,4]-триазоло[1,5-с]піримідину. Індивідуальність та склад синтезованих проміжних та цільових продуктів доведені результатами хроматомас-спектрометрії, а будова -IЧ та ЯМР 1Н спектрами. Корисна модель ілюструється загальним способом отримання 3-ціано-(4,5циклоалкілтієн-2-іл)фенілкарбаматів та 2заміщених 8,9-циклоалкілтієно[3,2-е][1,2,4]триазоло[1,5-с]піримідин-5-(6Н)-онів і фізикохімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання 3-ціано-(4,5циклоалкілтієн-2-іл)фенілкарбаматів До суспензії 0,04 моль 2-аміно-3-ціано-4,5циклоалкілтіофену в 50мл орто-, мета- або параксилолу додавали 7г (0,045 моль) фенілхлороформіату і нагрівали при кип'ятінні в реакторі, обладнаному системою для поглинання хлороводню, впродовж 2год. Реакційну суміш охолоджували, утворений осад відфільтровували, промивали діетиловим етером (2´15мл) і висушували. Приклад 1. 3-ціано(4,5,6,7-тетрагідро-1-бензотієн-2іл)фенілкарбамат. Вихід 86%, т. топл. 185-186°С. ІЧ спектр, см-1: 1745 (С=О), 2230 (СºN), 3250 (N-H). Спектр ЯМР 1 Н, d, м.ч.: 1,76м (4Н, 2СН2), 2,512,59м (4Н, СН2), 7,24-7,47м (5Наром.), 11,76с. (1Н, NH). Знайдено, %: С 64,70; Н 4,59; N 9,60. C16H14N2O2S. Вирахувано, %: С 64,41; Н 4,25; N 9,39. Приклад 2. 3-ціано-6-метил(4,5,6,7-тетрагідро-1-бензотієн2-іл)фенілкарбамат. Вихід 89%, т. топл. 175-177°С. ІЧ спектр, см-1: 1750 (С=О), 2230 (СºN), 3260 (N-H). Спектр ЯМР 1Н, d, м.ч.: 1,05 д (3Н, СН3), 1,14 гепт (1Н, СН), 1,86-2,72м (6Н, СН2), 7,21-7,45м (5Наром.), 11,70с. (1Н, NH). Знайдено, %: С 65,60; Н 5,29; N 9,00. C17H16N2O2S. Вирахувано, %: С 65,36; Н 5,16; N 8,97 Приклад 3. 3-ціано-6-метил(5,6,7,8-тетрагідро-4Нциклопента[b]тієн-2-іл)феніл-карбамат. Вихід 89%, т. топл. 157-158°С. ІЧ спектр, см-1: 1740 (С=О ), 2225 (СºN), 3250 (N-H). Спектр ЯМР 1Н, d, м.ч.: 1,63-1,85м (6Н, СН2), 2,62-2,68м (4Н, СН2), 7,217,42м (5Наром.), 11,56с. (1Н, NH). Знайдено, %: С 65,18; Н 5,09; N 9,12. C17H16N2O2S. Вирахувано, %: С 65,36; Н 5,16; N 8,97 Загальний спосіб одержання 8,9циклоалкілтієно[3,2-е][1,2,4]-триазоло-[1,5с]піримідин-5-(6Н)-онів Суспензію 0,02моль 3-ціано-(4,5циклоалкілтієн-2-іл)феніл-карбамату та 0,02моль 40458 6 гідразиду карбонової кислоти в 20мл орто-, метаабо пара-ксилолу нагрівали при кип'ятінні впродовж 4год. Реакційну суміш охолоджували, осад відфільтровували, додавали до нього 15мл етанолу, нагрівали до кипіння, охолоджували, відфільтровували і висушували. Приклад 4. 2-(4-хлорофеніл)-8,9,10,11тетрагідро[1]бензотієно[3,2-е][1,2,4]триазоло[1,5с]піримідин-5(6Н)-он. Вихід 85%, т. топл. >300°С. ІЧ спектр, см-1: 1705 (С=О ), 3200 (N-H). Спектр ЯМР 1Н, d, м.ч.: 1,85с. (4Н, СН2), 2,68с. (2Н, СН2), 2.92с. (2Н, СН2), 7,49 д (2Наром), 8,13 д (2Наром), 12,83 ш.с (1Н, NH). Знайдено, %: С 57,56; Н 3,79; N 15,55. М+ 357,0 C17H13ClN4OS. Вирахувано, %: С 57,22; Н 3,67; N 15,70.М 356,84. Приклад 5. 2-(фурил-2)-8,9,10,11тетрагідро[1]бензотієно[3,2-е][1,2,4]триазоло[1,5с]піримідин-5(6Н)-он. Вихід 78%, т. топл. >300°С. ІЧ спектр, см-1: 1705 (С=О ), 3220 (N-H). Спектр ЯМР 1Н, d, м.ч.: 1,84с. (4Н, СН2), 2,68с. (2Н, СН2), 2,92м (2Н, СН2), 6,64с. (1Нфурил), 7,11с. (1Нфурил), 7,83 (1Нфурил), 12,91 ш.с (1Н, NH). Знайдено, %: С 57,83; Н 3,99; N 17,75. М+ 313,2 C15H12N4O2S. Вирахувано, %: С 57,68; Н 3,89; N 17,94. М 312,35. Приклад 6. 2-(3-фторофеноксиметил)-9-метил-8,9,10,11тетрагідро[1]-бензотієно[3,2-е][1,2,4]триазоло[1,5с]піримідин-5(6Н)-он. Вихід 81%, т. топл. 220222°С. ІЧ спектр, см-1: 1710 (С=О ), 3200 (N-H). Спектр ЯМР 1Н, d, м.ч.: 1,10 д (3Н, СН3), 1,45 гепт (1Н, СН), 1,93-3,01м (6Н, СН2), 6,95-7,32м (4Наром.), 12,75 ш.с (1Н, NH). Знайдено, %: С 59,04; Н 4,59; N 14,35. М+ 385,0. C19H17FN4O2S. Вирахувано, %: С 59,36; Н 4,46; N 14,57. М 384,44. Приклад 7. 2-(3-піридил)-9-метил-8,9,10,11тетрагідро[1]бензотієно[3,2-е][1,2,4]-триазоло[1,5с]піримідин-5(6Н)-он. Вихід 90%, т. топл. >300°С. ІЧ спектр, см-1: 1705 (С=О ), 3230 (N-H). Спектр ЯМР 1Н, d, м.ч.: 1,10 д (3Н, СН3), 1,46 гепт (1Н, СН), 1,95-3,16м (6Н, СН2), 7,49т (1Нпіридил), 7,94т (1Нпіридил), 8,22 д (1Нпіридил), 8,73 (1Нпіридил), 12,96 ш.с (1Н, NH). Знайдено, %: С 60,28; Н 4,59; N 20,53. М+ 338,2. C17H15N5OS. Вирахувано, %: С 60,52; Н 4,48; N 20,76. М 337,41. Приклад 8. 2-феніл-9-метил-8,9,10,11тетрагідро[1]бензотієно[3,2-е][1,2,4]-триазоло[1,5с]піримідин-5(6Н)-он. Вихід 91%, т. топл. >300°С. ІЧ спектр, см-1: 1705 (С=О ), 3210 (N-H). Спектр ЯМР 1Н, d, м.ч.: 1,08 д (3Н, СН3), 1,46 гепт (1Н, СН), 1,92-3,14м (6Н, СН2), 7,48-7,51м (3Наром), 8,17-8,21м (2Наром), 12,90 ш.с (1Н, NH). Знайдено, %: С 64,08; Н 4,69; N 16,89. М+ 336,1. C18H16N4OS. Вирахувано, %: С 64,27; Н 4,79; N 16,65. М 336,42. Приклад 9. 2-(4-нітрофеніл)-9-метил-8,9,10,11тетрагідро[1]бензотієно[3,2-е][1,2,4]-триазоло[1,5с]піримідин-5(6Н)-он. Вихід 94%, т. топл. >300°С. ІЧ спектр, см-1: 1715 (С=О ), 3240 (N-H). Спектр ЯМР 1Н, d, м.ч.: 1,12 д (3Н, СН3), 1,50 гепт (1Н, 7 40458 СН), 1,99-3,19м (6Н, СН2), 8,33 д (2Наром), 8,41 д (2Наром), 12,90 ш.с (1Н, NH). Знайдено, %: С 56,93; Н 3,79; N 18,59. М+ 382,5. С18H15N5O3S. Вирахувано, %: С 56;68; Н 3,96; N 18,36. М 381,42. Приклад 10. 2-(4-бромофеніл)-6,8,9,10,11-гексагідро-5Нциклопента[4,5]тієно[3,2-е][1,2.4]-триазоло[1,5с]піримідин-5(6Н)-он. Вихід 87%, т. топл. °С. ІЧ спектр, см-1: 1710 (C=O), 3205 (N-H). Спектр ЯМР 1 Н, d, м.ч.: 1,72м (2Н, СН2), 1,92м (2Н, СН2), 2,80м (2Н, СН2), 3,05м (2Н, СН2), 3,34м (2Н, СН2) 7,68 д (2Наром), 8,11 д (2Наром), 12,82 ш.с (1Н, NH). Знайдено, %: С 51,97; Н 4,99; N 13,69. М+ 418,0. С18Н17BrN4OS. Вирахувано, %: С 51,81; Н 4,11; N 13,43. М 417,33. Приклад 11. 2-(4-фторофеніл)-6,8,9,10,11-гексагідро-5Нциклопента[4,5]тієно[3,2-е][1,2.4]-триазоло[1,5с]піримідин-5(6Н)-он. Вихід 79%, т. топл. °С. ІЧ спектр, см-1: 1710 (С =О), 3205 (N-H). Спектр ЯМР 1 Н, d, м.ч.: 1,70м (4Н, СН2), 1,91м (2Н, СН2), 2,80м (2Н, СН2), 3,34м (2Н, СН2), 7,29т (2Наром), 8,24м (2Наром), 12,83 ш.с (1Н, NH). Знайдено, %: С 60,39; Н 4,65; N 15,69. М+ 357,1. C18H17FN4OS. Вирахувано, %: С 60,66; Н 4,81; N 15,72 М 356,42. Джерела інформації: 1. Hozien Z. A., Abdel-Wahb A.A., Hassan K.M., Atta F.M., Ahmed S.A. Synthesis and some biologically active agents derived from thieno[2,3d]pyrimidine derivatives //Pharmazie. -1997. -Vol.52, №10. -P.753-758. 2. El-Sherbeny M.A., Youssef K.M., Al-Shafein F.S., Al-Obaid A.M. Novel Pyridothienopyrimidine and Pyridothienothiazine Derivatives as Potent Antiviral and Antitumor Agents //Med. Chem. Res. -2000 Vol.10, №2. -P.122-136. Комп’ютерна верстка Л.Литвиненко 8 3. Rashad A.E., Heikal O.A., El-Nezhawy A.O.H., Abdel-Megeid F.M.E. Synthesis and Izomerization of Thienotriazolopyrimidine and Thienotetrazolopyrimidine Derivatives with Potential Antiinflammatory Activity //Heteroatom Chem. -2005. Vol.16, №3. -P.226-234. 4. Shishoo C.J., Devani M.B., Ullas G.V., Ananthan S., Bradti V.S. Studies in the Synthesis and Interconversion of Isomeric Triazolothienopyridines //J. Heterocycl. Chem. -1981. -Vol.18, №1. -P.43-46. 5. Sauter F., Stanetty D.C. Synthese newer Derivate des 2-Amino-4,5,6,7-tetrahydrobenzo[b]thiophen-3-carbonitrils: basishe Substitutionsproducte und Auellirte Thieno-[1,2,4]-triazolopyrimidine //Monatsh. Chem. -1975. -Bd.106, №5. S.1111-1116. 6. Shishoo C.J., Devani M.B., Ullas G.V., Ananthan S., Bhadti V.S. Studies in the Synthesis and Interconversion of Isomeric Triazolothienopyridines. Patr. ІІІ. Cyclization Reactions of 2-Amino-3(1H-1,2,4triazol-3-yl)thiophenes //J. Heterocycl. Chem. -1987. Vol.24, N4. -P.1125-1131. 7. Shishoo C.J., Devani M.B., Ullas G.V., Ananthan S., Bhadti V.S. Synthesis of 5H-Triazolo[1,5-d]and 5H-Tetrazolo[1,5-d]thieno[3,2-f]-1,4-diazepin6(7H)-ones //J. Heterocycl. Chem. -1988. -Vol.25, №2. -P.615-622. 8. Gelotte K.O., Mason D.N., Mecker H., Shien W.-C, Starkey C.M. An Efficient Synthesis of Novel Triazoloquinazoline Adenosine Antagonist, CGS 15943 //J. Heterocycl. Chem. -1990. -Vol.27, №5. P.1549-1552. 9. Pfeiffer W.-D., Hetzheim A., Pazdera P., Bodtke A., Mucke J. Synthesis and Reactivity of 1,2,4Triazolo[1,5-c]quinazolines //J. Heterocycl. Chem. 1999. -Vol.36, №5. -P.1327-1336. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 2-substituted 8,9-cycloalkylthieno[3,2-e][1,2,4]triazolo[1,5-c]pyrimidin-5-(6h)-ones
Автори англійськоюVovk Mykhailo Volodymyrovych
Назва патенту російськоюСпособ получения 2-замещенных 8,9-циклоалкилтиено[3,2-е][1,2,4]триазоло[1,5-с]пиримидин-5-(6н)-онов
Автори російськоюВовк Михаил Владимирович
МПК / Мітки
МПК: C07D 495/00
Мітки: 8,9-циклоалкілтієно[3,2-е][1,2,4]триазоло[1,5-с]піримідин-5-(6н)-онів, спосіб, 2-заміщених, одержання
Код посилання
<a href="https://ua.patents.su/4-40458-sposib-oderzhannya-2-zamishhenikh-89-cikloalkiltiehno32-e124triazolo15-spirimidin-5-6n-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 2-заміщених 8,9-циклоалкілтієно[3,2-е][1,2,4]триазоло[1,5-с]піримідин-5-(6н)-онів</a>
Попередній патент: Спосіб зменшення часу отримання інформації від датчиків параметричного типу
Наступний патент: Спосіб селезнева збереження тверезості
Випадковий патент: Підлога транспортного засобу








