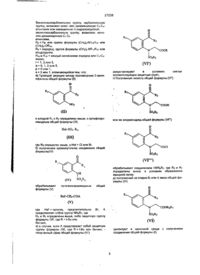
Нові проміжні продукти для одержання n,n’-місткових бісіндолілмалеімідів, спосіб отримання цих проміжних продуктів та фармацевтична композиція на їх основі
Номер патенту: 56145
Опубліковано: 15.05.2003
Автори: Фоул Маргарет Мері, Уіннероскі Леонард Ларрі, мол., Крамріх Крістін Енн
Формула / Реферат
1. Сполука формули
,
де R1 - Вr, І або O-тозил.
2. Сполука за п. 1 формули
3. Сполука за п. 1 або п. 2, де R1 - Вr або І.
4. Фармацевтична лікарська форма, до складу якої входить сполука за будь-яким з пп. 1-3 та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів.
5. Спосіб одержання амінозаміщеного N,N'-місточкового бісіндолілмалеіміду формули
,
де: R2 - -N(СF3)СН3), -NH(CF3) або -NR3R4, де R3 та R4, незалежно, - водень, С1-С4 алкіл, феніл, бензил або поєднуються з азотом, з яким вони зв'язані, з утворенням насиченого або ненасиченого 5- або 6-членного кільця, в якому піддають взаємодії сполуку за будь-яким з пп. 1-3 з аміном у інертному полярному розчиннику.
6. Спосіб за п. 5, де сполукою є
та R1 - Вr або I.
7. Спосіб за п. 6, де аміном є HN(CH3)2 або Н2N(СН3).
8. Спосіб одержання N,N'-місточкового бісіндолілмалеіміду формули (V)
(V),
в якому піддають взаємодії сполуку формули
,
де R1 - Вr або І, з HN(CH3)2 у інертному полярному розчиннику.
9. Спосіб одержання сполуки за будь-яким з пп. 1-3, який включає перетворення сполуки формули
на сполуку за будь-яким з пп. 1-3.
10. Спосіб за п. 9, який здійснюють у присутності РХ3, (феніл)3РХ2 або (фенокси)3РХ2, де Х - бром або йод.
11. Спосіб за п. 10, який здійснюють у присутності (фенокси)3РВr2.
12. Спосіб одержання сполуки формули (V)
(V),
який включає:
а) взаємодію сполуки формули (ІIIа)
(IIIa)
з РХ3, (феніл)3РХ3 або (фенокси)3РХ2, де Х - бром або йод, до утворення сполуки формули (ІІа)
(ІІа),
де R1 - Вr або І; та
b) взаємодію сполуки формули (ІІа) з НN(СН3)2 у інертному полярному розчиннику.
13. Спосіб за п. 12, де R1 - Вr.
14. Спосіб за п. 13, який додатково включає взаємодію сполуки формули (V) з СН3SО3Н.
15. N,N'-місточковий бісіндолілмалеімід, який одержано за способом за будь-яким з пп. 5-8 або 12-14.
16. Сполука формули
,
де R1 - Вr, І або O-тозил, яку одержано за способом за будь-яким з пп. 9-11.
Текст
1 Сполука формули де R 2 --N(CF 3 )CH 3 ), -NH(CF 3 ) a6o-NR 3 R 4 , fleR3Ta R4, незалежно, - водень, С1-С4 алкіл, феніл, бензил або поєднуються з азотом, з яким вони зв'язані, з утворенням насиченого або ненасиченого 5або 6-членного кільця, в якому піддають взаємодії сполуку за будь-яким з пп 1 - 3 з аміном у інертному полярному розчиннику 6 Спосіб за п 5, де сполукою є О Ю де Ri - Br, І або О-тозил 2 Сполука за п 1 формули CW-^-^sO та Ri - Br або І 7 Спосіб за п 6, де аміном є HN(CH 3 )2 або H 2 N(CH 3 ) 8 Спосіб одержання N,N'-MicTO4KOBoro бісіндолілмалеіміду формули (V) ОЯгО 3 Сполука за п 1 або п 2, де Ri - Br або І 4 Фармацевтична лікарська форма, до складу якої входить сполука за будь-яким з пп 1 - 3 та один або більше фармацевтично прийнятних носив, розріджувачів або наповнювачів 5 Спосіб одержання амінозаміщеного N,N'місточкового бісіндолілмалеіміду формули в якому піддають взаємодії сполуку формули (О ю 56145 де Ri - Вг або І, з НІЧ(СНз)2 у інертному полярному розчиннику 9 Спосіб одержання сполуки за будь-яким з пп 13, який включає перетворення сполуки формули на сполуку за будь-яким з пп 1 - З 10 Спосіб за п 9, який здійснюють у присутності РХз, (феніл)зРХ2 або (фенокси)зРХ2, де X - бром або йод 11 Спосіб за п 10, який здійснюють у присутності (фенокси)зРВг2 12 Спосіб одержання сполуки формули (V) з РХз, (феніл)зРХз або (фенокси)зРХ2, де X - бром або йод, до утворення сполуки формули (Па) де Ri - Вг або І, та Ь) взаємодію сполуки формули (На) з НІЧ(СНз)2 У інертному полярному розчиннику 13 Спосіб за п 12, де Ri- Br 14 Спосіб за п 13, який додатково включає взаємодію сполуки формули (V) з CH3SO3H 15 І\І,І\Г-місточковий бісіндолілмалеімід, який одержано за способом за будь-яким з пп 5 - 8 або 12-14 16 Сполука формули (V), який включає а) взаємодію сполуки формули (ІІІа) де Ri - Вг, І або О-тозил, яку одержано за способом за будь-яким з пп 9 -11 Убіквітарна природа ізоферментів РКС та їх важлива роль у фізіологи є стимулом до продукування високовибіркових інгібіторів РКС(протешкшази С) Приймаючи до уваги свідчення, які демонструють зв'язок певних ізоферментів з хворобливими станами, можна зробити цілком обгрунтований висновок про те, що шпбіторні сполуки, селективні по відношенню до одного або двох ізоферментів РКС, порівняльно до інших ізоферментів РКС та інших протешкіназ, є чудовими терапевтичними агентами Такі сполуки демонструють підвищену ефективність та знижену токсичність внаслідок їх специфічності Клас N,N'-MICTO4KOBHX бісіндолілмалеімідів, вибіркових щодо ізоферментів РКС, було розкрито у Європейському патенті №0657458(Heath (Хіт) та ІНШІ), опублікованому 14 червня 1995 року До переважної сполуки у цьому М,М'-містечковому ряді належить сполука формули де R - аміно, алкіламшо або діалкіламшо Хіт та ІНШІ навели, як приклад, цілий ряд цих амінозаміщених N,N' - містечкових бісіндолілмалеімідів, які одержують наступним чином Анапо -S2H O OC 3 56145 та заявляється у цьому описі, наступні терміни та скорочення визначаються таким чином Термін "С1-С4 алкіл" означає циклоалкільну групу з прямим або розгалуженим ланцюгом, який включає від одного до чотирьох атомів вуглецю, наприклад, метил, етил, n-пропіл, ізопропіл, циклопропіл, п-бутил, ізобутил, вторбутил, t-бутил та Ha жаль, було встановлено, що О-мезилатна функціональна група, яку використовують для одержання амінозаміщених І\І,І\Г-містечкових бісіндолілмалеімідів, є токсичною і небажаною домішкою при одержанні амінозаміщених N,N'містечкових бісіндолілмалеімідів Для забезпечення видалення О-мезилатного проміжного продукта з кінцевого продукту необхідно застосувати дорогі способи очищення Цей винахід надає ключовий проміжний продукт при синтезуванні амінозаміщених N,N'містечкових бісіндолілмалеімідів Цей новий проміжний продукт легко перетворюється на амінозаміщені N,N'-MICTO4KOBI бісіндолілмалеіміди ІНШІ Термін "арил" означає заміщений або незаміщений бензил, феніл або нафтил Термін "амін", який використовують у цьому описі, означає -N(CF3)CH3), -NH(CF3) або -NR3R4, де R3Ta R4, незалежно, водень, С1-С4 алкіл, феніл, бензил або поєднуються з азотом, з яким вони зв'язані, з утворенням насиченого або ненасиченого 5 або 6-членного кільця Як згадувалось перед тим, цей винахід надає сполуку формули II без проходження через етап О-мезилатного проміжного продукту Проміжний продукт, крім того, значно більш реактивний Цей проміжний продукт, у переважному варіанті, використовують для одержання амінозаміщених N,N'-MICTO4KOBHX бісіндолілмалеі МІДІВ при нижчих температурах та за коротший час реагування, наслідком чого є підвищений вихід з меншою КІЛЬКІСТЮ побічних продуктів Таким чином, цей проміжний продукт є придатним для одержання N,N'-MICTO4KOBHX бісіндолілмалеімідів з високим виходом та без небажаних токсичних домішок На додаток до цього, згадані сполуки є придатними, як ізоферментвибіркові інгібітори РКС Як такі, сполуки є придатними для лікування станів, пов'язаних з цукровим діабетом та його ускладненнями, ішемії, запалень, розладів центральної нервової системи, серцево-судинних хвороб, дерматологічних захворювань та раку Цей винахід надає сполуку формули II де Ri-Br, І або О-тозил Визначається, що можуть існувати різні стереоізомерні форми сполук формули II Переважними сполуками цього винаходу є сполуки формул Пата lib Ella! де Ri - Вг, І або О-тозил Цей винахід додатково надає фармацевтичну лікарську форму, до складу якої входить сполука формули II та один або більше фармацевтично прийнятних носив, розріджувачів або наповнювачів Додатковим аспектом цього винаходу є спосіб використання сполуки формули II для одержання амінозаміщених г\І,г\Г-містечкових бісіндолілмалеіМІДІВ формули І, який включає реагування сполуки формули II з аміном у інертному полярному розчиннику Для цілей цього винаходу, який розкривається (ІїЬ). Однак, рацемати та окремі енантюмери та їх суміші утворюють частину цього винаходу Сполуки за цим винаходом найлегше одержують зі сполуки формули 56145 8 заміщені N,N'-MICTO4KOBI бісіндолілмалеіміди м у л и IV т а к и м ч и н о м фор (ні) Цей пдроксизаміщений І\І,І\Г-місточковий бісіндолілмалеімід, сполука III, одержують за допомогою способів, які було описано у Європейському патенті №0657458(Хіт та ІНШІ), опублікованому 14 червня 1995р , який включено сюди як посилання Згадані сполуки одержують таким чином (НІ) (II) Ri - відповідає визначенню, наведеному перед тим Переважно, Ri-Br або І, найбільш переважно, Ri-Br Згадані тозилатні(р-толуолсульфоніл) сполуки одержують шляхом реагування спирту з ртолуолсульфоновим ангідридом у присутності основи, наприклад, піридину у THF, ефірі, метиленхлориді або іншому інертному органічному розчиннику Реакцію, звичайно, здійснюють у атмосфері азоту при температурі реакційної суміші від кімнатної до температури перегонки Згадані галогеніди одержують шляхом реагування спирту з джерелом брому або йоду Джерелом брому або йоду може бути ряд реактивів, відомих у цій галузі техніки, до яких належить НІ, HBr, LiBr, СаВгг, РВгз> RsPB^, N-бромсукцинімід, СВг4, аліл-Вг, бензил-Br, SOBr2, де Rs - феніл, фенілокси, алкіл або арил Фахівцю у цій галузі техніки зрозуміло, що до реакційної суміші можна додавати різні активуючі агенти, наприклад, 1,1'карбонілдммідазол Перетворення гідрокси (III) на галогенід (II) може здійснюватись за способами, відомими у цій галузі техніки і розкритими у роботі Річарда К J~lapoKa(Richard C Larock), A Guide To Functional Group Preparations, VCH Publishers, crop 356 - 63(1989), яку включено до цього опису посиланням До переважних умов належить бром або йод у присутності галогеніду фосфору, наприклад РХз, (феніл)зРХ2 або (фенокси)зРХ2, де X бром або йод Реакцію, звичайно, здійснюють у THF, ацетонітрилі, метиленхлориді або інших інертних розчинниках, відомих у цій галузі техніки Придатним також є DMF або ІНШІ розчинники, внаслідок утворення реактивів вілсмеєрівського типу, які було описано у Барленга Дж (Barluenga J), Synthesis, crop 426(1985) та Ходосі Г (Hodosi G) Carbohydrate Research 230 327-42(1992) Сполуки формули II перетворюють на аміно (іі) де Ri-Br, І або О-тозил, R2 - -N(CF3)CH3), або -NR3R4, де R3 та R4, незалежно, водень, С1-С4 алкіл, феніл, бензил або поєднуються з азотом, з яким вони зв'язані, з утворенням насиченого або ненасиченого 5 або 6-членного кільця У переважному варіанті, R2-N(CH3) Спосіб використання сполуки II для одержання сполуки IV включає реагування сполуки II з аміном наступних формул HN(CF3)CH3), HNH(CF3) або HNR3R4, де R3 та R4, незалежно, водень, С1-С4 алкіл, феніл, бензил або поєднуються з азотом, з яким вони зв'язані, з утворенням насиченого або ненасиченого 5 або 6-членного кільця, у інертному полярному апротонному розчиннику Реакцію, у переважному варіанті, здійснюють у розчині DMF, THF води або диметилацетаміду при температурі реакційної суміші, яка коливається від 0°С до температури перегонки Реакція, як правило, завершується впродовж 1 - 20 годин Реакцію, у переважному варіанті, здійснюють при температурі від кімнатної до 50°С Сполука IV може відокремлюватись з реакційної суміші за допомогою стандартних способів, однак, у переважному варіанті, вона кристалізується безпосередньо з реакційної суміші Вкрай несподівано, наслідком використання заявленого проміжного продукту для одержання амінозаміщеного ІЧІМ'-бісіндолілмалеіміду є підвищений вихід і запобігання включенню токсичних домішок Заявлений проміжний продукт є набагато активнішим, ніж відомий мезилатний проміжний продукт Хімічна активність різних відщеплюваних груп відносно НІ\І(СНз)2 представлена у Таблиці 1 Відносна хімічна активність, прогнозована у цій галузі, описана у роботі Кері(Сагеу) та CaHfl6epra(Sundberg), Частина А, 3 видання, сторінка 291(1990) Таблиця 1 Швидкість реакції з І\ІН(СНз); Група р-толуолсульфонат MsO СІ І Вг Кгеї (швидкість реакції відщеплюваної групи з HN(CH3)2) 22x10' 55x10' 98хЮ4 20x10 ' 22x10' 56145 10 тільки з метою додаткового ілюстрування цього винаходу Обсяг цього винаходу не розглядається, як такий, що обмежується наступними прикладами У наступних прикладах та препаратах точка плавлення, спектри ядерного магнітного резонансу, мас-спектри, рідинна хроматографія високого тиску на силікагелі, N.N-диметилформамід, тетрапдрофуран та етилацетат скорочуються таким чином М Pt, NMR, MS, HPLC, DMF, THFTa EtOAc, ВІДПОВІДНО Терміни "NMR" та "MS" вказують нате, що спектр відповідає необхідній структурі Препарат 1 3-(2-[(метилсульфоніл)окси]етокси]-4(трифенілметокси)-і-бутанолметансульфонат Тритилхлорид(175,2г, 0,616моль) розчиняли у 500мл СН2СІ2 у атмосфері N2 Додавали триетиламш(71,9г, ЮОмл, 0,710моль), потім R,Sгліцидний спирт(50,0г, 0,648моль), і реакційну суміш нагрівали у колбі зі зворотним холодильником при температурі 42°С впродовж 4 годин Реакційну суміш охолоджували до кімнатної температури і Як згадувалось перед тим, було встановлено, ДВІЧІ екстрагували 250мл водного насиченого розщо О-мезилатна функціональна група, яку викоричину хлориду амонію та 250мл розсолу Водні шастовують для одержання амінозаміщених N,N'ри піддавали зворотному екстрагуванню 10Омл місточкових бісіндолілмалеімідів, є токсичною і СН2СІ2, органічний шар сушил^МдЭСч) та випанебажаною домішкою при одержанні амінозаміщерювали in vacuo до одержання тритилгліцидного них N,N'-MICTO4KOBHX бісіндолілмалеімідів Для спирту у вигляді масла, яке перекристалізовували забезпечення видалення 0-мезилатного проміжноз етанолу до одержання 104,4г(54%) тритилгліциго продукту з кінцевого продукту необхідно застодного спирту у вигляді твердої речовини сувати дорогі способи очищення Таким чином, додатковою перевагою даних проміжних продуктів 1 М THF розчину ВІНІЛмагнійброміду(50мл, та способу одержання амінозаміщених N,N'50ммоль, 2,0екв) охолоджували до -20°С у атмомісточкових бісіндолілмалеімідів з використанням сфері N2 і додавали каталітичну КІЛЬКІСТЬ йодиду заявлених проміжних продуктів є виключення важМІДІ(0,24Г, 1,26ммоль, 0,05екв) Одержану суміш ких етапів очищення для видалення токсичних перемішували при -20°С впродовж 5 хвилин, після домішок чого впродовж 15 хвилин при -20°С прикраплювали розчин тритилгліцидного спирту(7,91г, Переважними сполуками, які одержують з ви25,0ммоль) у 40мл сухого THF Реакційну суміш користанням заявлених проміжних продуктів, є перемішували впродовж 3 годин при -20°С, після такі (3)-13-[(диметиламшо)метил]-10,11,14,15чого витримували до нагрівання до кімнатної темтетрапдро-4,9 16,21-диметено-1Н,13Нператури і перемішували впродовж 15 хвилин дибензо[Е,К]піроло[3,4Реакцію припиняли охолодженням реакційної суН][1,4,13]оксадіазациклогексадецин-1,3(2Н)-дюн, міші до -30°С і повільно додавали 125мл водного зокрема, мезилатна сіль, (S)-13насиченого розчину хлориду амонію Одержану [(монометиламіно)метил]-10,11,14,15-тетрапдросуміш екстрагували 200мл етилацетату Після цьо4,9 16,21-диметено-1Н,13Нго органічний шар екстрагували водним розчином дибензо[Е,К]піроло[3,40,93г(2,50ммоль, 0,1 екв) дипдрату динатрієвої Н][1,4,13]оксадіазациклогексадецин-1,3(2Н)-дюн, солі етилендіамштетраоцтової кислоти(ЕОТА) у (3)-13-[(піролідино)метил]-10,11,14,15-тетрапдро125мл деюнізованої води для видалення будь4,9 16,21-диметено-1Н,13Няких металів Водні шари піддавали зворотному дибензо[Е,К]піроло[3,4екстрагуванню 50мл етилацетату, змішані органічН][1,4,13]оксадіазациклогексадецин-1,3(2Н)-дюн ні шари промивали 100мл розсолу, сушимонопдрохлорид, та (3)-13-[бензиламшометил]nn(MgSO4) випарювали in vacuo до одержання 10,11,14,15-тетрапдро-4,9 16,21 -диметено-1 Н.13Нмасла, яке фільтрували через дюксид кремдибензо[Е,К]піроло[3,4-Н][ нію(76г) з застосуванням 1,2л (3/1) гекса1,4,13]оксадіазациклогексадецин-1,3(2Н)-дюн нів/етилацетату Фільтрат випарювали in vacuo до Переважні монозаміщені аміни формули IV одержання 9,07г 1-0-(трифенілметил)-2можна одержувати безпосередньо зі згаданих пдроксипентанолу у формі масла світло-жовтого сполук Безпосереднє одержання цих сполук з кольору(100%) мезилатним проміжним продуктом з високим виходом є неможливим 60% суспензію гідриду натрію у мінеральному Сполуки формули IV одержують у вигляді вімаслі(6,13г, 0,153моль, 1,5екв) суспендували у льної основиі, у переважному варіанті, перетво175мл сухого THF, який додавали при кімнатній рюють на фармацевтично прийнятну сіль за допотемпературі Утворену суміш перемішували при могою способів, відомих у цій галузі техніки До кімнатній температурі впродовж 1,5 години, після переважних солей належать хлористоводнева та чого за допомогою шприца додавали мезилатна 17,7мл(0,204ммоль, 2,0екв) свіжодистильованого алілброміду Реакційну суміш нагрівали до 45°С Наступні приклади та препарати наведено Дані у Таблиці 1 демонструють, що тозил, бром та йод є, несподівано, ХІМІЧНО активними особливо бром та йод, хімічна активність яких у 8 36 разів перевищує хімічну активність відомого мезилатного проміжного продукта Така підвищена хімічна активність відносно MsO також спостерігалась з H2NCH3, Н2Г\І(бензил) Наслідком підвищення хімічної активності є знижена температура реакції, яка завершується впродовж короткого періоду часу Наслідком використання заявленого проміжного продукта є також зменшення КІЛЬКОСТІ ДОМІШОК у продукті У разі використання відомого Омезильного проміжного продукту, наслідком реакції для одержання амінозаміщеного N,N'бісіндолілмалеіміду є рівень домішок від 15 до 30% внаслідок побічних продуктів, утворених під час реакції на малеімід-карбонільній групі У разі використання заявленого проміжного продукту, рівень домішок складає менш, ніж 5%, що є суттєвим поліпшенням 12 11 56145 впродовж 1 години Розвиток реакції контролюварозчин нагрівали у колбі зі зворотним холодильнили за допомогою TLC або HPLC Реакційну суміш ком при температурі 42°С впродовж 3 - 4 годин охолоджували до 0°С і для гасіння надлишкової Реакційну суміш охолоджували до кімнатної темоснови повільно додавали 400мл водного насичеператури і додавали Зл розсолу Органічний шар ного розчину хлориду амонію Утворену суміш екссушили(600г Na2SO4) і випарювали in vacuo до трагували 800мл етилацетату і органічний шар одержання цільової сполуки у вигляді масла, яке промивали 500мл води Водні шари піддавали перекристалізовували з етанолу до одержання зворотному екстрагуванню ЮОмл етилацетату, 2354г(70%) цільової сполуки у вигляді твердої резмішані органічні шари промивали 200мл розсолу, човини сушили(МдЗО4) і випарювали in vacuo до одерПрепарат З жання 41,5г(>100%) 1,1',1"-[[[2-(2-пропенілокси)-4(3)-3-[2-[(метилсульфоніл)окси]етокси]-4пентеніл]окси]метилідин]трис[бензолу] у вигляді (трифенілметокси)-і-бутанолметансульфонат масла жовтого кольору 1 М THF розчину ВІНІЛмагнійброміду(5,76л, 5,76моль, 1,96екв) охолоджували до -20°С у ат1,1',1"-[[[2-(2-пропенілокси)-4мосфері N2 і додавали каталітичну КІЛЬКІСТЬ йодипентеніл]окси]метилідин]трис[бензол](39,3г, ду МІДІ(28,2Г, 0,148ммоль, 0,05екв) Одержану су0,102моль) розчиняли у розчині 390мл безводного міш перемішували при -20°С впродовж 5 хвилин, метилового спирту та 60мл СН2СІ2 і охолоджували після чого впродовж 1,5 годин при -20°С прикрапдо -40° - -50°С з одночасним барботуванням N2 лювали розчин (З)-тритилгліцидного спирчерез в'язкий реакційний розчин Озон барботувату(929,0г, 2,94моль) у 3,2л сухого THF Реакційну ли через реакційну суміш при температурі від суміш перемішували впродовж 1 години при -20°С 50°С до -40°С впродовж 80 хвилин, доки колір реРеакцію припиняли охолодженням реакційної суакційної суміші не став блідо-голубим Одержану міші до -30°С і повільно додавали 5л насиченого реакційну суміш витримували до нагрівання до 0°С розчину хлориду амонію Після цього органічний у атмосфері N2, після чого для зупинки реакції пошар ДВІЧІ екстрагували 1л 10%(маса/об'єм) розчивільно додавали розчин боропдриду нану дипдрату динатрієвої солі етилендіамінтетраотрію(23,15г, 0,612моль, бекв) у 85мл етаноцтової кислоти EDTA для видалення будь-яких лу/85мл води з одночасним підтримуванням металів Органічний шар промивали 2л розсолу, температури реакційної суміші нижче 10°С Реаксушили(МдЗО4) і випарювали in vacuo до одерційну суміш перемішували на льодяній бані впрожання 1061г(96%) (3)-1-0-трифенілметил-4довж ЗО хвилин, після чого витримували до нагріпдроксипентанолу у вигляді масла вання до кімнатної температури і перемішували впродовж ночі Температура після нагрівання під60% суспензію гідриду натрію у мінеральному вищувалась до 31 °С Реакційну суміш розводили маслі(268,9г, 6,72моль, 1,5екв) суспендували у 400мл водного насиченого розчину хлориду амо2,8л сухого THF у атмосфері N2, і при кімнатній нію і екстрагували 800мл етилацетату Органічний температурі додавали розчин (S)-1-0шар промивали 400мл води і водні шари піддаватрифенілметил-4-пдроксипентанолу (1543г, ли зворотному екстрагуванню 150мл етилацетату 4,48моль) у 5,6л сухого THF Одержану суміш пеЗмішаний органічний шар промивали 200мл розремішували при кімнатній температурі впродовж солу, сушили(МдЗО4) і випарювали in vacuo до 1,5 годин, потім, впродовж 20 хвилин, додавали одержання каламутного масла Це масло перекри770мл(8,89моль, 2,0екв) свіжодистильованого сталізовували з (2/1) гексанів/етилацетату трьома алілброміду Реакційну суміш нагрівали до 45°С заходами до одержання 28,9г 3-(2-пдроксиетокси)впродовж 1 - 2 годин Реакційну суміш охолоджу4-(трифенілметокси)- 1-бутанолу(72%) вали до 15 - 20°С і для гасіння надлишкової основи повільно додавали 2л водного насиченого роз3-(2-пдроксиетокси)-4-(трифенілметокси)-1чину хлориду амонію Утворену суміш розводили бутанол(14,0г, 35,7ммоль) розчиняли у 140мл 1л етилацетату та 1л води і виділяли органічний СН2СІ2, охолоджували до 0°С у атмосфері N2 і шар Водний шар піддавали зворотному екстрагудодавали триетиламш(10,8г, 14,9мл, 0,107моль, ванню 500мл етилацетату і змішані органічні шари З.Оекв) Після ЦЬОГО при
ДивитисяДодаткова інформація
Назва патенту англійськоюNew intermediate products to prepare n.n'-bridged bisindolylmaleimides, a process for preparing these intermediate products and a pharmaceutical composition based thereon
Автори англійськоюWinneroski Leonard Larry, Junior
Назва патенту російськоюНовые промежуточные продукты для получения n,n'-мосточковых бисиндолилмалеимидов, способ получения этих промежуточных продуктов и фармацевтическая композиция на их основе
Автори російськоюУиннероски Леонард Ларри, мл.
МПК / Мітки
МПК: A61P 3/10, C07D 498/22, A61P 9/10, A61P 25/28, A61P 9/00, A61K 31/00, A61P 25/00, A61P 29/00, A61K 31/40, A61K 31/407, A61P 3/00, A61P 17/00, A61P 35/00
Мітки: спосіб, бісіндолілмалеімідів, основі, проміжні, отримання, композиція, нові, продукти, продуктів, цих, n,n'-місткових, фармацевтична, одержання, проміжних
Код посилання
<a href="https://ua.patents.su/11-56145-novi-promizhni-produkti-dlya-oderzhannya-nn-mistkovikh-bisindolilmaleimidiv-sposib-otrimannya-cikh-promizhnikh-produktiv-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Нові проміжні продукти для одержання n,n’-місткових бісіндолілмалеімідів, спосіб отримання цих проміжних продуктів та фармацевтична композиція на їх основі</a>