Стабілізатор протеолітичних ферментів тваринного походження
Формула / Реферат
Застосування двочетвертинних амонійових сполук як стабілізатора протеолітичних ферментів тваринного походження.
Текст
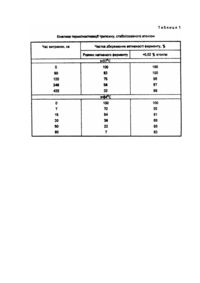
Винахід стосується ензимології і медицини і може бути використаний для підвищення стабільності ферментів в розчині, наприклад під час теплової стерилізації, зберігання та застосування ферментвмісних лікарських композицій. Сьогочасне з метою стабілізації ферментів використовують різні методи фізичної та хімічної іммобілізації, для чого запропоновано багато матриць-носіїв природного і синтетичного походження. Одним з відомих способів стабілізації е внесення у ферментний розчин речовин, які утворюють з молекулами ензиму специфічні комплекси з підвищеною стабільністю. Як приклад такої стабілізації можна навести додавання до ферментного розчину різних органічних сполук (гліцерин, етиленгліколь, сахароза, диметилсульфоксид та ін.) [1]. Перевагою такого методу стабілізації являється простота виконання. В основу винаходу покладено завдання здобути стабільний ферментний препарат, для чого уперше запропоновано додавати до розчину ферменту двочетвертинну амонійову сполуку, наприклад етоній або декаметоксин, які утворюють із ферментом комплекс, стійкий щодо дії інактивуючих чинників. Вказані речовини широко застосовують в медицині як антимікробні препарати з метою лікування запальних захворювань [2]. Спосіб застосування двочетвертинної амонійової сполуки з метою стабілізації ферменту міститься у тому, що до 0,01 - 0,1% водного розчину трипсину або хімотрипсину додають етоній або декаметоксин у кількості 0,01 - 0,05%. взаємодія даних речовин з ферментом відбувається при кімнатній температурі практично миттєво. 1. Опис процедури здобуття стабільного ферменту 5мг трипсину розчинюють в 50мл дистильованої води, після чого додають 10мг етонію і перемішують, доки не утвориться прозорий розчин. 2. Кінетика термоінактивації стабілізованого ферменту Розчин стабілізованого ферменту витримують при 37°C протягом 8год. Через 1; 1; 4 і 6год з розчину відбирають проби по 0,2мл, які використовують для визначення протеолітичної активності згідно з методикою [3]. Для цього до відібраної проби додають 5мл 1мМ розчину D-Lбензоіларгінін-п-нітроаніліну (Кооператив "Біотехнолог", м.Київ) у 0,05М трис-буфері (pH = 8,2), який містить 0,02М хлориду кальцію. Суміш витримують 15хв при 37°C, після чого ферментативну реакцію зупиняють внесенням соєвого інгібітора трипсину ("Reanal"). Кількість п-нітроаніліну, який утворився при каталітичному розкладі субстрату, визначають шляхом вимірювання оптичної густини розчину при 400нм. Калібрувальну криву готують за допомогою стандартних розчинів пнітроаніліну (0,2 - 1,0мг/100мл). Одночасно вивчають кінетику термоінактивації нативного трипсину (без стабілізатора). Аналогічно вивчають кінетику термоінактивації трипсину при 84°C. Розчин ферменту при цій температурі витримують 7; 15; 30; 50 та 90хв. Результати кінетичних досліджень, які наведені у табл.1, свідчать про значну термостабілізацію трипсину у присутності 0,02% етонію. Зокрема при "фізіологічній" температурі 37°C активність стабілізованого трипсину протягом всього часу стеження майже не змінюється. 3. Стійкість стабілізованого ферменту щодо дії 6М розчину сечовини Денатуруючу дію на стабілізований трипсин концентрованого розчину сечовини вивчали за допомогою трьох проб, склад яких наведено у табл.2. Активність ферменту визначали за вищезгаданою методикою. Як видно з таблиці, додання етонію значною мірою зберігає фермент від інактивації сечовиною. 4. Вибір оптимальної концентрації двочетвертинної амонійової сполуки під час виконання процедури стабілізації ферменту З цією метою вивчали залежність ефекту стабілізації ферменту від концентрації стабілізатора. Ряд проб 0,01% розчину трипсину з різним вмістом етонію (0,01 - 0,30%%) витримували при 84°C протягом 1год, після чого визначали залишкову активність ферменту за допомогою вищезгаданого методу. Аналогічні випробовування проводили з розчином, який містить 0,05% трипсину. Результати вимірювань наведено у табл.3. Як видно, оптимальна концентрація етонію, яка сприяє максимальній стабілізації ферменту, складає близько 0,01 - 0,05%% і не залежить від концентрації ферменту. Усі виявлені закономірності зберігаються, якщо замість етонію буде використана інша двочетвертинна амонійова сполука - декаметоксин. Ефект стабілізації розповсюджується на хімотрипсин та інші протеолітичні ферменти тваринного походження.
ДивитисяДодаткова інформація
Назва патенту англійськоюThe stabilizer of proteolytic enzymes of animal origin
Автори англійськоюHeraschenko Ihor Ivanovych
Назва патенту російськоюСтабилизатор протеолитических ферментов животного происхождения
Автори російськоюГеращенко Игорь Иванович
МПК / Мітки
МПК: C12N 9/96
Мітки: стабілізатор, тваринного, ферментів, протеолітичних, походження
Код посилання
<a href="https://ua.patents.su/3-9674-stabilizator-proteolitichnikh-fermentiv-tvarinnogo-pokhodzhennya.html" target="_blank" rel="follow" title="База патентів України">Стабілізатор протеолітичних ферментів тваринного походження</a>
Попередній патент: Респіратор
Випадковий патент: Спосіб одержання полімерних гідрогелей