Спосіб виготовлення добавки для ферментативного розкладання мікотоксинів, добавка та її застосування
Номер патенту: 103335
Опубліковано: 10.10.2013
Автори: Молль Вульф-Дітер, Хартінгер Доріс, Грісслер Карін, Біндер Єва-Марія, Шатцмайр Герд
Формула / Реферат
1. Спосіб виготовлення добавки для ферментативного розкладання фумонізинів у рослинній сировині, який відрізняється тим, що забезпечують принаймні одну нуклеїново-кислотну послідовність генів, що відповідає послідовностям SEQ ID NOs:8, 18 і 24, експресують принаймні одну послідовність нуклеїнових кислот у прокаріотичних або еукаріотичних клітинах і використовують принаймні один приготований таким чином фермент, що відповідає послідовностям SEQ ID NOs:9, 19 і 25 разом з кофактором.
2. Спосіб за п. 1, який відрізняється тим, що розкладають фумонізини у киснево-незалежному середовищі.
3. Спосіб за п. 1 або 2, який відрізняється тим, що перед застосуванням ферментів у вихідному рослинному матеріалі модифікують шаблон методами молекулярної генетики, мутагенезом або молекулярною еволюцією.
4. Спосіб за пп. 1, 2, або 3, який відрізняється тим, що ізолюють ферменти.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що інкапсулюють ферменти в захисне покриття.
6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що вибирають ферменти з-поміж карбоксилестерази SEQ ID NO:9 та/або амінотрансферази SEQ ID NO:19 .
7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що застосовують фермент, який містить принаймні 90 % послідовності, ідентичної до принаймні одного з ферментів за SEQ ID NOs:9, 19 або 25.
8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що при використанні принаймні однієї амінотрансферази SEQ ID NO:19 або SEQ ID NO:25 використовують кетон, зокрема, α-кетокислоту як кофактор.
9. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що при використанні карбоксилестерази SEQ ID NO:9 додатково використовують принаймні один адсорбент, вибраний, зокрема, з-поміж глинястих мінералів.
10. Спосіб за будь-яким з пп. 1-9, який відрізняється тим, що використовують добавку у вихідному рослинному матеріалі, який буде ферментований, або у рослинній масі для виготовлення біоетанолу.
11. Добавка для ферментативного розкладання фумонізинів у рослинній сировині або у сумішах, які містять рослинну сировину, яка відрізняється тим, що містить принаймні один фермент з послідовностями SEQ ID NOs:9, 19 і 25, а також додатково принаймні один кофактор для принаймні одного або кількох використовуваних ферментів та інертний носій.
12. Добавка за п. 11, яка відрізняється тим, що використовувані ферменти модифіковані методами молекулярної генетики, мутагенезом або молекулярною еволюцією.
13. Добавка за п. 11 або 12, яка відрізняється тим, що використовуваний фермент, який містить принаймні 90 % послідовності, ідентичної до принаймні одного з ферментів за SEQ ID NOs:9, 19 або 25.
14. Добавка за пп. 11, 12 або 13, яка відрізняється тим, що ферменти, модифіковані ферменти та/або принаймні на 90 % ідентичні ферменти використовуються укритими захисним покриттям.
15. Добавка за будь-яким з пп. 11-14, яка відрізняється тим, що містить карбоксилестеразу SEQ ID NO:9, принаймні одну амінотрансферазу SEQ ID NO:19 або SEQ ID NO:25, α-кетокислоту як кофактор та інертний носій.
16. Добавка за будь-яким з пп. 11-15, яка відрізняється тим, що містить карбоксилестеразу SEQ ID NO:9, принаймні один адсорбент, зокрема, принаймні один глинястий мінерал, а також, необов’язково, інертний носій.
17. Добавка за будь-яким з пп. 11-16, яка відрізняється тим, що добавка використовується у киснево-незалежному середовищі при виготовленні біоетанолу разом з рослинними масами або вихідному рослинному матеріалі.
18. Застосування генів, представлених у послідовностях, для експресії у прокаріотичних або еукаріотичних клітинах послідовностей генів за SEQ ID NOs:8, 18 та 24, а також кофакторів, для виготовлення добавки для розкладання фумонізинів у рослинній сировині.
19. Застосування за п. 18, яке відрізняється тим, що використовують кофактор, вибраний з групи, що включає карбоксилестеразу SEQ ID NO:9, амінотрансферазу SEQ ID NO:19 або SEQ ID NO:25, або α-кетокислоти і інертний носій.
20. Застосування за п. 18, яке відрізняється тим, що використовують карбоксилестеразу, принаймні один адсорбент, зокрема глинястий мінерал, а також, необов′язково, інертний носій.
21. Застосування за будь-яким з пп. 18, 19 або 20 для безкисневої обробки вихідного рослинного матеріалу або рослинної маси у виробництві біоетанолу.
22. Застосування повністю рекомбінантних організмів для експресії послідовностей генів за SEQ ID NOs:8, 18 та 24, а також кофакторів для виготовлення добавки для розкладання фумонізинів у рослинній сировині.
23. Застосування за п. 22, яке відрізняється тим, що використовують кофактор, вибраний з групи, що включає карбоксилестеразу SEQ ID NO:9, амінотрансферазу SEQ ID NO:19 або SEQ ID NO:25, або α-кетокислоти і інертний носій.
24. Застосування за п. 22, яке відрізняється тим, що використовують карбоксилестеразу, принаймні один адсорбент, зокрема глинястий мінерал, а також, необов′язково, інертний носій.
25. Застосування за будь-яким з пп. 22, 23 або 24 для безкисневої обробки вихідного рослинного матеріалу або рослинної маси у виробництві біоетанолу.
Текст
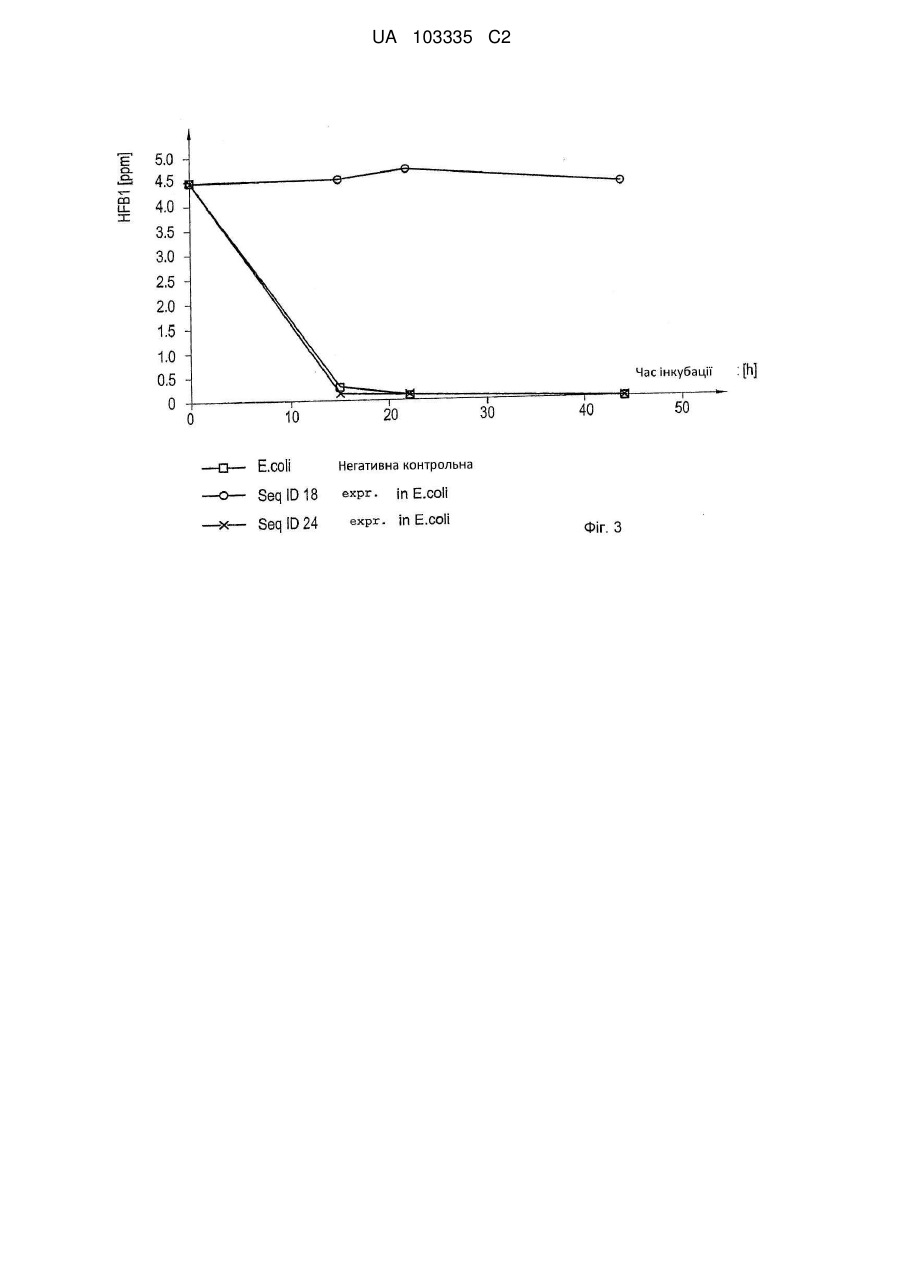
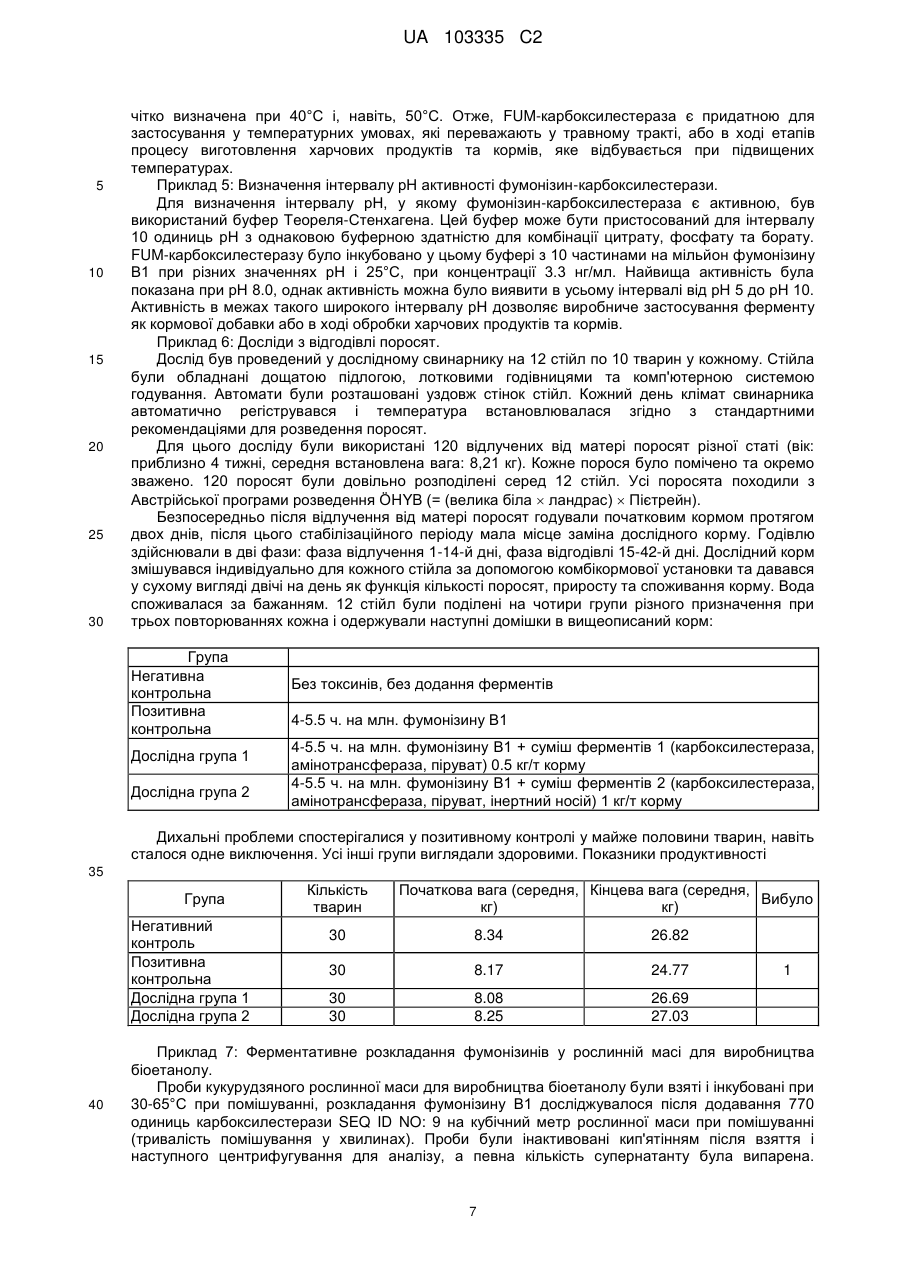
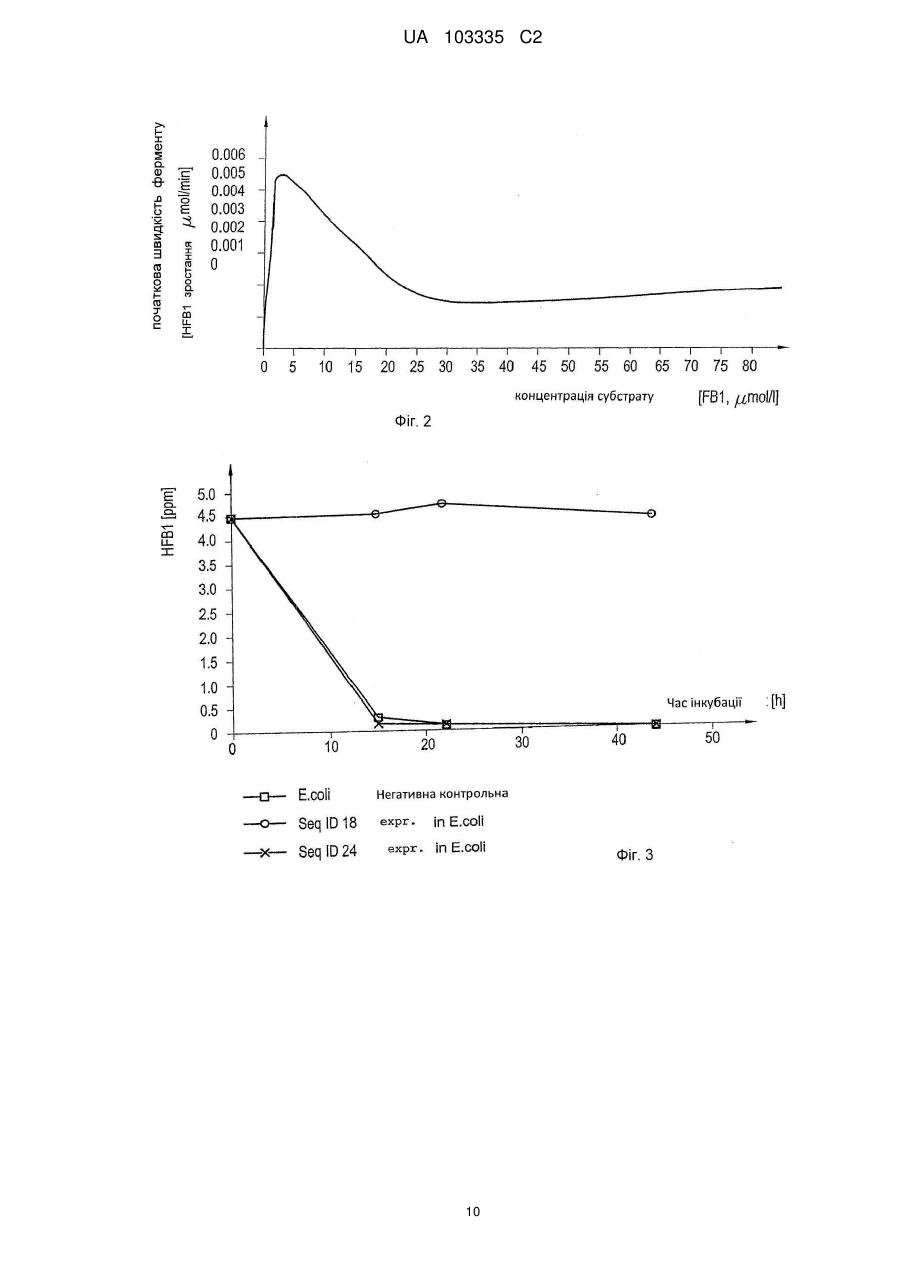
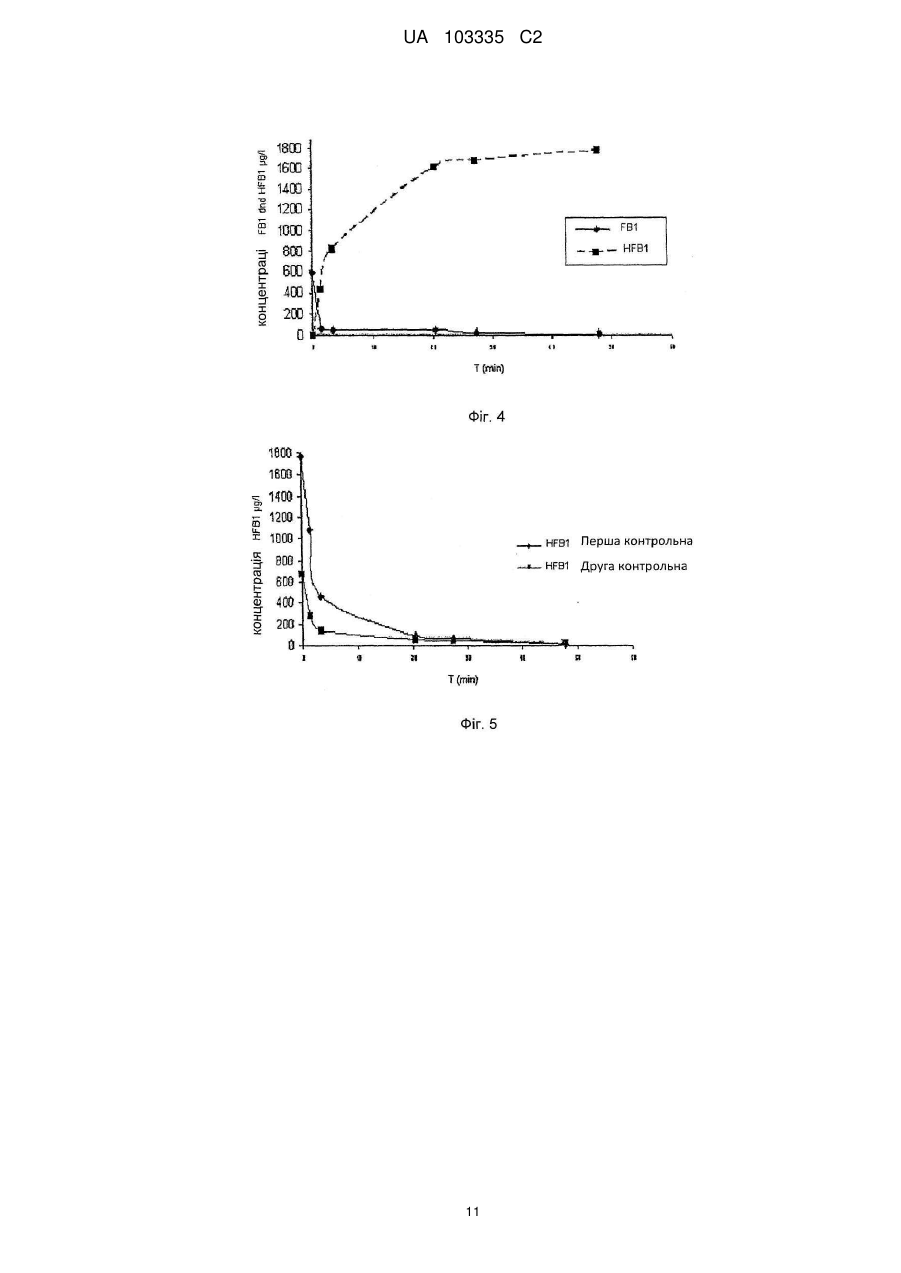
Реферат: Винахід належить до способу виготовлення добавки для ферментативного розкладання фумонізинів у рослинній сировині. Згідно з винаходом забезпечують принаймні одну нуклеїново-кислотну послідовність генів, що відповідає послідовностям SEQ ID NOs:8, 18 та 24, принаймні одну послідовність нуклеїнових кислот експресують у прокаріотичних або еукаріотичних клітинах і використовують принаймні один приготований таким чином фермент, що відповідає послідовностям SEQ ID NOs:9, 19 та 25 разом з кофактором для розкладання фумонізинів у рослинній сировині. UA 103335 C2 (12) UA 103335 C2 UA 103335 C2 5 10 15 20 25 30 35 40 45 50 55 60 Представлений винахід стосується способу виготовлення добавки для ферментативного розкладання фумонізинів, добавки для ферментативного розкладання фумонізинів у рослинній сировині та сумішах, що містять рослинну сировину, а також використання генів. Мікотоксини дуже часто зустрічаються у сільськогосподарських продуктах рослинництва і, в залежності від виду мікотоксинів, заподіюють серйозну економічну шкоду, в особливості, харчовим продуктам, виготовленим з сільськогосподарських продуктів, і навіть тваринам та людям, які споживають такі харчові продукти, причому вказана шкода є дуже різноманітною. Вже розроблені численні заходи, спрямовані на детоксифікацію або розкладання, або знешкодження таких мікотоксинів, з метою завадити будь-якій шкоді, спричиненої мікотоксинами в галузях харчування тварин та людей, розведення тварин, обробці харчових продуктів та кормів, тощо. Відомі мікотоксини включають велику кількість структурно пов'язаних між собою мікотоксинів, як, наприклад, фумонізини, серед яких фумонізин Віє таким токсином групи, який зустрічається найчастіше. Втім, також відомі численні похідні та пов'язані молекули, які також чинять отруйну дію на людей та тварин. Так, відомо, що фумонізини, взаємодіючи з ферментом церамідсинтазою, порушують метаболізм сфінголіпідів. Сфінголіпіди є не лише компонентами мембран клітин, але також відіграють важливу роль, як сигнальні та месенджерні молекули, у багатьох елементарних клітинних процесах, таких як зростання, міграція та зв'язування клітин, у запалювальних процесах і внутрішньоклітинних транспортних процесах. Належно до такого порушення метаболізму сфінголіпідів, фумонізини відповідальні за створюваний токсичний вплив на різновиди тварин, а також на людей. Таким чином, можна продемонструвати, що фумонізини чинять канцерогенну дію на гризунів; і, судячи з епідеміологічних даних, вони пов'язані з раком шлунку та дефектами нервової трубки у людей. Вони відповідальні за типовий токсикоз, спричинений набряком легенів, у різних тварин, таких як, наприклад, свині. У цьому контексті фумонізини становлять практично повсюдне джерело забруднення різних зернових, зокрема, кукурудзи, а також горіхів та овочів, і вказаною значною негативною дією на здоров'я людей та тварин нехтувати неприпустимо. Бактеріальна деградація фумонізинів вже описане у ЕР-А 1 860 954, згідно з яким для детоксикації фумонізинів та їх похідних використовують мікроорганізми, вводячи у корма детоксифікуючі бактерії або дріжджі, обрані серед точно визначених штамів, знешкоджуючих фумонізини. Також вже описані катаболічні метаболічні шляхи біологічного розкладання фумонізинів і відповідні гени та ферменти що відповідальні за них. Так, наприклад, ЕР 0 988 383 описує композиції та способи розкладання фумонізинів, в яких використовувані ферменти, що розкладають фумонізини, виробляються насамперед у трансгенних рослинах, в яких детоксифікація фумонізинів здійснюється з використанням аміноксидази, яка для своєї ферментативної активності потребує молекулярного кисню. Більш того, WO 2004/085624 описує трансамінази, дезамінази та аміномутази, а також композиції та способи ферментативної детоксифікації, зокрема, амінованих токсинів, наприклад, фумонізинів. У цьому контексті для детоксикації використовують поліпептиди, які мають дезаміназну активність. З WO 00/04158 відоме використання амінооксидаз, детоксифікуючих фумонізини, у виготовленні харчових продуктів та кормів і при обробці рослинної сировини. Однак відомі на цей час способи спільним мають те, що при детоксифікації мікотоксинів для описаних катаболічних метаболічних шляхів вони потребують молекулярний кисень, тоді як амінооксидази, які зокрема тут потрібні, не можуть працювати в безкисневих умовах. Використання таких генів та ферментів для детоксифікації кормів, наприклад, у травному тракті тварин, не є можливим через те, що відомі гени та ферменти не виявляють жодної активності у по суті безкисневому середовищі травного тракту тварин. Метою винаходу є створення способу виготовлення добавки для ферментативного розкладання мікотоксинів, яка б забезпечувала безпечне та надійне розкладання токсичношкідливих речовин або детоксифікацію фумонізинів. Для рішення цих задач спосіб згідно з винаходом здійснюють таким чином: використовують принаймні одну нуклеїново-кислотну послідовність генів, що відповідає послідовностям SEQ ID NOs: 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 та 24, експресують у прокаріотних або еукаріотних клітинах принаймні одну послідовність нуклеїнової кислоти і використовують у рослинній сировині принаймні один приготовлений таким чином фермент, що відповідає послідовностям SEQ ID NOs: З, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23 та 25, за бажанням разом з кофактором. Завдяки вживанню принаймні однієї нуклеїново-кислотної послідовності генів, що відповідає послідовностям SEQ ID NOs: 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 та 24, є можливим клонування 1 UA 103335 C2 5 10 15 20 25 30 35 40 45 50 55 60 та експресія специфічних генів, які відповідають за розкладання фумонізинів або мікотоксинів, така експресія проводиться, наприклад, в Е. соlі та Pichia pastoris, з використанням стандартних прийомів, якими досягається експресія ферментів, відповідно до послідовностей SEQ ID NOs: 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23 та 25, причому принаймні один фермент за бажанням може застосовуватися в оброблюваній сировині разом з кофактором. Добавка, виготовлена згідно з таким способом, з одного боку, дозволяє повністю та надійно розкладати, наприклад, мікотоксини безпосередньо у сировині з тим, що специфічні ферменти, виготовлені таким способом, каталізують розкладання фумонізинів та проміжних продуктів на шляху розкладання, а, з іншого боку, дозволяє розкладати мікотоксини, наприклад, безпосередньо при виробництві біоетанолу в рослинній масі для виготовлення спирту або розкладати і знешкоджувати мікотоксини навіть безпосередньо у ході виготовлення кормів. В цьому контексті рослинна сировина включає зернові або круп'яні продукти, трави, фрукти або овочі, і проміжні продукти, які містять ці речовини, для виготовлення харчів або кормів, таких як, наприклад, силос, фруктовий затір абощо. В цьому контексті добавками є, зокрема, кормові добавки, харчові добавки, а також добавки для виробництва біоетанолу. Додатково такий спосіб дає можливість підтримувати метаболізм сфінголіпідів, що порушується взаємодією фумонізинів з ферментом керамідсинтазою з одночасним біологічним розкладанням фумонізинів на нетоксичні речовини. Нарешті, технологічне детоксифікуюче застосування може бути досягнуто оскільки цей спосіб також придатний для застосування в великомасштабному виробництві, як уможливлюючий безпечне й надійне виготовлення продуктів, які не містять мікотоксинів. Послідовності нуклеїнових кислот, використовуваних у способі згідно з винаходом, і каталітично-активні в без кисневих умовах ферменти, експресовані в прокаріотичних та еукаріотичних клітинах вказаними послідовностями нуклеїнових кислот, представлені як окрема частина опису. Згідно з кращим варіантом здійснення, спосіб згідно з винаходом здійснюють так, що фумонізини розкладають киснево-незалежним або анаеробним чином. Завдяки розкладанню фумонізинів у безкисневому середовищі є можливим подальший розвиток способу згідно з винаходом, так, що нуклеїново-кислотні послідовності генів або ферментів нададуть змогу здійснювати реакції розкладання безпечно і надійно без використання молекулярного кисню, щоб зробити виготовлену таким чином добавку можливою для використання в кисневонезалежному або анаеробному середовищі, де мікотоксини можуть бути розкладені, таких як, наприклад, в кормах для людей і тварин, у виготовленні біоетанолу, але також для виготовлення генетично-модифікованих сільськогосподарських культур. Згідно з подальшим варіантом здійснення, спосіб згідно з винаходом здійснюють так, що перед використанням ферментів у вихідному рослинному матеріалі шаблон модифікують методами молекулярної генетики, мутагенезу або молекулярної еволюції. Завдяки здійсненню способу таким чином, що ферменти перед їх застосуванням у вихідному рослинному матеріалі модифікують методами молекулярної генетики, мутагенезом або молекулярною еволюцією, є можливим виготовлення ферментів у більш стабільній формі, пристосованій до подальшого застосування, щоб навіть більше поліпшити або вдосконалити киснево-незалежне розкладання фумонізинів. Згідно з кращим подальшим варіантом здійснення винаходу, спосіб проводять так, що ферменти ізолюють. Завдяки такому здійсненню способу фумонізини, зокрема, будуть повністю розкладені у безкисневому середовищі. Згідно з іншим кращим варіантом здійснення винаходу, спосіб проводять так, що ферменти інкапсулюють в захисне покриття. Завдяки інкапсуляції ферментів в захисне покриття є можливим транспортування ферментів до місця призначення їх використання, наприклад, зокрема, до травного тракту, не зазнавши змін і, зокрема, розкладення чи пошкоджень, так, що ферменти не почнуть діяти до розчинення захисного покриття, наприклад, у шлунковокишковому тракті людей або тварин, уможливлюючи таким чином більш селективне, швидке та повне розкладання мікотоксинів у безкисневому середовищі шлунково-кишкового тракту, водночас запобігаючи фумонізинам чинити їх отруйні дії на живі істоти, які отримали їх разом з харчовими продуктами. Згідно з кращим подальшим варіантом здійснення, спосіб згідно з винаходом проводять так, що ферменти обирають з-поміж пермеази SEQ ID NO: 3, карбоксилестерази SEQ ID NO: 9, трикарбалілат-дегідрогенази SEQ ID NO: 11, цитрат-утилізуючого протеїну, SEQ ID NO: 13, алкогольдегідрогенази SEQ ID NO: 17, амінотрансферази SEQ ID NO: 19 та/або ацетолактатсинтази SEQ ID NO: 23. Завдяки такому проведенню процесу можна повністю й без 2 UA 103335 C2 5 10 15 20 труднощів розкладати фумонізини в безкисневому середовищі. У цьому випадку транскрипція відкритих рамок зчитування у генних кластерах FUM, ізольованих від генного кластера послідовності нуклеїнової кислоти SEQ ID NO: 1, яка одержана з прокаріотичного штаму з інвентарним № DSM 16254, регулюється двостороннім промотором, розташованим між FumA та FumI, як видно нижче з табл.1. Кластери кодують білки, що беруть участь у регулюванні експресії генів, наприклад, FumB та FumC, у відборі субстрату та його транспортуванні, наприклад, FumA, FumJ, FumG, та у катаболізмі субстрату, наприклад, FumD, FumE, FumF, FumH, FumI, FumK. Із цих послідовностей нуклеїнових кислот, які кодують спеціальні гени та ферменти, згідно з подальшим варіантом здійснення способу за винаходом, обирають ті гени, які відповідають за катаболізм субстрату, дозволяючи таким чином відповідно сформованим ферментам повністю катаболізувати субстрат, тобто фумонізини. У цьому випадку відкриті рамки зчитування, обрані, наприклад, з генного кластера послідовності нуклеїнових кислот SEQ ID NO: 1, експресовані в прокаріотичних або еукаріотичних клітинах. Транскрипція відкритих рамок зчитування, що містяться у генному кластері послідовності SEQ ID NO: 1, у штамі бактерій з інвентарним № DSM 16254, відбувається під контролем двостороннього промотора, який знаходиться між FumA та FumI, як видно з фіг. 1. Гени кодують білки, які беруть участь у регулюванні генної експресії, наприклад, FumB та FumC, у розпізнаванні субстрату та його транспортуванні, наприклад, FumA, FumJ, FumG, та у катаболізмі субстрату, наприклад, FumD, FumE, FumF, FumH, FumI і FumK. Нижче у таблиці 1 перелічені позначення генів кластера, що катаболізують фумонізини, причому О означає орієнтацію (f - передня, г - зворотна). Таблиця 1 Ген fumA fumB fumC fumD fumE fumF fumG fumH fuml fumJ fumK 25 30 35 40 45 № послід. O 2 f 4 f 6 f 8 f 10 f 12 f 14 f 16 f 18 r 20 r 22 r Початок 5214 6418 7232 8294 9876 11494 12541 13957 5063 3513 551 Кінець 6395 7068 8176 9916 11378 12537 13836 15027 3795 679 ? Довжина 1182 651 945 1623 1503 1044 1296 1071 1269 2835 ? Позначення пермеаза регулятор транскрипції типу tetR регулятор транскрипції типу lysR карбоксилестераза трикарбалілат- дегідрогеназа цитрат-утилізуючий протеїн Б протонний симпорт трикарбалілату алкоголь-дегідрогеназа амінотрансфераза TonВ-залежний рецептор ацетолактатсинтаза (частково) Завдяки кращому здійсненню способу згідно з винаходом так, що використовують фермент, який містить принаймні 90% послідовності, ідентичної до принаймні одного з ферментів, маючих SEQ ID NOs: 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23 або 25, досягається більш повне розкладання фумонізинів, де не тільки фумонізини, але також зв'язані або структурно подібні мікотоксини, одночасно будуть повністю детоксифіковані, особливо в анаеробному або безкисневому середовищі, наприклад, AAL-токсин. Завдяки кращому проведенню способу таким чином, що, коли використовують амінотрансферазу SEQ ID NO: 19, -кетокислота використовується в якості кофактору, є можливою, зокрема з розкладанням аміногрупи фумонізина та одночасним використанням кетокислоти, такої як, наприклад, піровиноградна кислота, для заміни аміногрупи на кетогрупу в молекулах фумонізина з формуванням аланіну, як побічного продукту реакції, який повністю нешкодливий, забезпечуючи таким чином повне розкладання фумонізинів на нешкідливі речовини. Згідно з подальшим кращим здійсненням, спосіб згідно з винаходом може також бути проведений таким чином, що при використанні карбоксилестерази SEQ ID NO: 9 додатково використовують принаймні один адсорбент, обраний, в особливості, з глинястих матеріалів. Завдяки додатковому використанню принаймні одного адсорбенту, обраного, в особливості, з глинястих матеріалів, при використанні карбоксилестерази SEQ ID NO: 9, є можливим повне знешкодження фумонізинів навіть без додавання інших додаткових ферментів, відщеплюючи два бічних ланцюга трикарбалілової кислоти за допомогою карбоксилестерази від молекули фумонізину на першому етапі і формуючи те, що називається гідролізований фумонізин. Гідролізований фумонізин, який є загалом ланцюговоподібною молекулою, пізніше може бути 3 UA 103335 C2 5 10 15 20 25 30 35 40 45 50 55 60 адсорбований, наприклад, на глинясті матеріали, так що фумонізини можуть бути повністю знешкодженими навіть в одноетапному процесі ферментативного розкладання. Згідно з подальшим кращим здійсненням, спосіб згідно з винаходом проводиться так, що виготовлена таким чином добавка використовується в початковому рослинному матеріалі для ферментизації або в рослинній масі для виготовлення біоетанолу. Завдяки використанню добавки, виготовленої таким способом згідно з винаходом, в початковому рослинному матеріалі для ферментизації або в рослинній масі для виготовлення біоетанолу, є можливим вивільнення додаткових продуктів виробництва етанолу, а саме мезги, тобто висушених зернових залишків та нерозчинених компонентів, або висушеної барди (висушені продукти дистиляції з розчинними - DDGS) від фумонізинів або мікотоксинів, зокрема, в безкисневому середовищі. Подальшим об'єктом винаходу є добавка для ферментативного розкладання фумонізинів, завдяки якій можливе надійне і безпечне розкладання або детоксифікація таких мікотоксинів в безкисневому середовищі. Для вирішення цих задач добавка цього типу відрізняється тим, що містить принаймні один фермент з послідовностей SEQ ID NOs: 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23 та 25, а також, необов'язково, додатково принаймні один кофермент для принаймні одного або кількох з використовуваних ферментів, і інертний носій. Така добавка, яка містить принаймні один фермент або повний рекомбінантний організм для експресії вказаного ферменту, а також, необов'язково, додатково принаймні один кофермент для принаймні одного або кількох з використовуваних ферментів, і інертний носій, відрізняється вибірковим розкладанням і, відтак, детоксифікуванням фумонізинів. Використання добавки згідно з винаходом, яка по суті складається з ізольованих ферментів, а також, необов'язково, їхніх коферментів і носіїв, дає перевагу в тому, що шаблон утримує їхні каталітичні активності в середовищі та за умов, в яких, наприклад, цілі мікроорганізми не можуть або можуть частково бути активними, водночас дозволяючи значне підвищення специфічної активності та каталізацію певних реакцій з уникненням небажаних бічних реакцій. До того ж, проблеми, спричинені, згідно з відомим рівнем техніки, сільськогосподарським рослинним продуктам через використання здатних до відтворювання бактерій, будуть безпечно уникатися, і добавки, що містять тільки ізольовані ферменти, будуть забезпечувати покращену придатність до вибіркової і регульованої активації, тобто, наприклад, у певному місці травного тракту, а також уникнення небажаного підвищеного споживання субстрату. В порядку подальшого покращення цієї специфіки добавку, згідно з винаходом, розвивають з метою так, що використовують ферменти, модифіковані молекулярно-генетичними методами, мутагенезом або молекулярною еволюцією. Згідно з подальшим кращим здійсненням, добавка розроблена так, що використовуваний фермент, який містить принаймні 90% послідовності, ідентичної з ферментом, маючим SEQ ID NOs: 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23 або 25. При використанні ферменту, що містить принаймні 90% послідовності, ідентичної до ферменту, маючого SEQ ID NOs: 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23 або 25, є можливим безпечне і надійне розкладання в безкисневому середовищі багатьох мікотоксинів, крім фумонізинів, що мають бути розкладеними, уможливлюючи таким чином розширену детоксифікацію фумонізинів присутніх, наприклад, в продуктах з рослинної сировини. Завдяки розробці добавки таким чином, що ферменти, модифіковані ферменти та/або принаймні на 90% ідентичні ферменти використовуються захищеними захисним покриттям, як у відповідності з кращим додатковим здійсненням винаходу, буде забезпечено те, що ферменти, принаймні на 90% ідентичні ферменти або модифіковані ферменти будуть захищені проти будьякої передчасної втрати активності, щоб безпечно і надійно розвивати свою діяльність у визначеному місці, наприклад, в шлунково-кишковому тракті. Завдяки кращому подальшому вдосконаленню добавки таким чином, що ферменти вибираються з карбоксилестерази SEQ ID NO: 9, трикарбалілат-дегідрогенази SEQ ID NO: 11, цитрат-утилізуючого протеїну, SEQ ID NO: 13, алкогольдегідрогенази SEQ ID NO: 17, амінотрансферази SEQ ID NO: 19 та/або SEQ ID NO: 25, та/або ацетолактатсинтази SEQ ID NO: 23, ферменти, кваліфіковані для катаболізму субстрату, будуть застосовані загалом так, щоб забезпечити, на додаток до зменшеної кількості застосовуваних ферментів, те, що підчас використання вказаних ферментів не трапиться небажаної бічної реакції. Згідно з кращим подальшим вдосконаленням винаходу, добавка розроблена такою, що містить карбоксилестеразу SEQ ID NO: 9, амінотрансферазу SEQ ID NO: 19 або SEQ ID NO: 25, -кетокислоту, як кофактор, та інертний носій. Завдяки вмісту в добавці карбоксилестерази, амінотрансферази, -кетокислоти, як кофактора, та інертного носія, є можливим, зокрема, початкове гідролізування фумонізинів, що містяться в їжі, відщеплюванням залишків 4 UA 103335 C2 5 10 15 20 25 30 35 40 45 50 55 трикарбалілової кислоти від фумонізинів, використовуючи карбоксилестеразу, і наступне додаткове вступання в реакцію отриманого таким чином гідролізованого фумонізину під дією амінотрансферази і -кетокислоти, як кофермента, в даному випадку краще піровиноградної кислоти, замінюючи аміногрупу молекули гідролізованого фумонізину на кетогрупу, щоб сформувати 2-кетогідролізований фумонізин, який повністю нешкідливий, наприклад, для ссавців, і може бути виведений без змін, і аланін, як бічний продукт, який також не завдає або не має жодних негативних ефектів, наприклад, на організми. Згідно з кращим подальшим вдосконаленням винаходу добавка додатково розроблена такою, що містить карбоксилестеразу SEQ ID NO: 9, принаймні один адсорбент, такий як глинястий мінерал, а також, необов'язково, інертний носій. При використанні тільки карбоксилестерази SEQ ID NO: 9 та принаймні одного адсорбенту детоксифікація фумонізинів може також проводитися таким чином, що відщеплюються тільки залишки трикарбалілатової кислоти і таким чином сформований гідролізований фумонізин адсорбується на вказаний адсорбент. Завдяки відщеплюванню залишків трикарбалілатової кислоти за допомогою карбоксилестерази утворюється загалом довго-ланцюгова молекула, яка може бути легко і надійно адсорбована, щоб забезпечити повну детоксифікацію просто вибірковим використанням ферменту, зокрема, безкисневим розкладанням фумонізину і наступною адсорбцією. З причини того, що, як у відповідності з подальшим вдосконаленням винаходу, добавка використовується в киснево-незалежному середовищі при виробництві біоетанолу, зокрема, разом з рослинними масами або початковим рослинним матеріалом, через обирання добавки такою, що ферменти, які містяться в ній, є повністю отриманими з бактерій, що каталізують катаболізм фумонізину високо специфічним шляхом розкладання, є можливим використання точно такої добавки з високою специфічністю, активністю і ефективністю, щоб забезпечити добавку можливістю бути також використаною технологічно в безкисневому середовищі. Нарешті, цей винахід стосується використання як представлених у послідовностях генів або повністю рекомбінантних організмів для експресії послідовностей генів з №№ 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22 та 24, так і, за бажанням, кофакторів, для виготовлення добавки для розкладання фумонізинів при обробці або використанні рослинної сировини. Одержана таким чином добавка дозволяє проводити повне та надійне розкладання фумонізинів, зокрема, у безкисневому середовищі. В кращому способі кофактор вибраний з групи, що включає карбоксилестеразу SEQ ID NO: 9, амінотрансферазу SEQ ID NO: 19 або SEQ ID NO: 25, або -кетокислоту, і інертний носій, використовувані згідно з винаходом, використання яких дозволяє надійне і повне розкладання на безпечні компоненти усіх фумонізинів в, наприклад, матеріалах рослинної сировини або вихідних матеріалах. Подальше краще використання відрізняється тим, що використовують карбоксилестеразу, принаймні один адсорбент, в особливості, глинястий мінерал, а також, необов'язково, інертний носій. При використанні карбоксилестерази та принаймні одного адсорбенту є можливим надійно і повністю детоксифікувати фумонізини, використовуючи один фермент, та залишки трикарбалілатової кислоти відщеплені від фумонізину під дією або за допомогою вказаного ферменту, і сформований таким чином гідролізований фумонізин з довгим ланцюгом згодом адсорбується на адсорбент, щоб зробити токсин нешкідливим в безпечний і надійний спосіб. Згідно з кращим використанням добавка, згідно з винаходом, використовується для кисневонезалежної або анаеробної обробки початкового рослинного матеріалу або рослинної маси у виробництві біоетанолу. В цьому випадку є можливим безпечно і надійно зробити мікотоксини, що містяться в початковому рослинному матеріалі або сировині, безпечними впродовж виробництва біоетанолу в безкисневому середовищі, щоб дозволити наступне використання залишку виробництва етанолу, а саме, мезги або сушеної барди, пізніше безпосередньо або після сушіння і гранулювання без подальшої обробки, і, зокрема, детоксифікації, як кормів, що вільні від фумонізинів. Далі, винахід роз'яснюється більш детально на прикладах здійснення та фігурах, де: Фіг. 1 зображує генний кластер, що катаболізує фумонізини; Фіг. 2 ілюструє криву Міхаеліса-Ментен для карбоксилестерази фумонізину FumD; Фіг. 3 показує криву розкладання гідролізованого фумонізину В1; Фіг. 4 ілюструє конвертування фумонізину FB1 в гідролізований фумонізин HFB1 після додавання карбоксилестерази SEQ ID NO: 9; і Фіг. 5 ілюструє розкладання гідролізованого фумонізину HFB1 доданням амінотрансферази SEQ ID NO: 19. 5 UA 103335 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 1 зображує генний кластер, що катаболізує фумонізини, як часткову послідовність 15420 пар основ мікробного штаму, який має інвентарний № DSM 16254. У fum-генному кластері прокаріотичного штаму DSM 16254 транскрипція відкритої рамки зчитування регулюється двостороннім промотором, який знаходиться між fumA та fuml. Кластер кодує білки, що беруть участь у регулюванні експресії генів, наприклад, FumB та FumC, у розпізнаванні субстрату та його транспортуванні, наприклад, FumA, FumJ, FumG, та у катаболізмі субстрату, наприклад, FumD, FumE, FumF, FumH, Fuml та FumK. Приклади. Приклад 1: Кінетика ферменту фумонізин карбоксилестерази Ген fumD (послідовність SEQ ID NO: 8), який кодує фумонізин карбоксилестеразу, був клонований та експресований у Pichia pastoris, використовуючи стандартні процедури. Hisмічений фермент був відновлений та очищений з супернатанту культури за допомогою афінної хроматографії. Була визначена концентрація ферменту та ферментно-кінетичні параметри з сімома різними концентраціями субстрату від 50 мкг до 25 мг FB1 на літр та концентрацією ферменту 0.33 нг/мл. Реакції були забуферені 20 мМ Tris-Cl (pH 8.0) з 0.1 мг/мл альбуміну бичачої сироватки і інкубовані при 30°С. Проби були взяті після 0, 30, 60, 120 та 240 хвилин інкубації і проаналізовані HPLC-MS/MS. Була обчислена кількість фумонізину В1 (FB1) та гідролізованого фумонізину В1, грунтуючись на калібрування з очищеними еталонними 13 речовинами та повністю С-міченим внутрішнім стандартом FB1. Фіг. 2 ілюструє криву Міхаеліса-Ментен для гідролізу фумонізину В1 (FB1) фумонізинкарбоксилестеразою FumD, яка була визначена при концентрації ферменту 0.33 нг/мл у буфері Tris-Cl (pH 8.0), з початковими швидкостями ферменту нанесеними на графік напроти концентрацій субстрату. Крива Міхаеліса-Ментен показує спадання при високих концентраціях субстрату, оскільки швидкість ферменту була розрахована на підставі продукту, тобто утворення гідролізованого FB1. Оскілки гідролізований FB1 утворюється з FB1 в двоетапній реакції через частково гідролізований FB1 з тільки одним бічним ланцюгом трикарбалілатової кислоти, який залишився, і бічним ланцюгом, який був відщеплений, утворення кінцевого продукту було затримано при високих концентраціях субстрату. Стала Міхаеліса-Ментен КМ була розрахована як 0.90 мкмол/л, що є еквівалентом 650 часток на мільярд, а швидкість конвертації була 900 на секунду. З фіг. 2 витікає, що фумонізини можуть бути швидко й повністю гідролізовані з карбоксилестеразою у відповідних інтервалах концентрацій. Приклад 2: Каталітична активність HFB1 (гідролізований фумонізин В1) амінотрансферази Послідовності SEQ ID NOs: 18 та 24 були одержані клонуванням, використовуючи стандартні процедури, та експресовані в Е. coli під контролем промотора - бактеріофага Т7. Бактеріальні клітини були зібрані, знов ресуспендовані у буфері 50 мМ фосфату натрію та лізовані під дією ультразвуку. Був доданий гідролізований фумонізин і проби були інкубовані при 25°С. Проби були відібрані через інтервали часу й проаналізовані HPLC-MS/MS. Жодного зниження концентрації гідролізованого FB1 не спостерігалося. Коли кофактор, такий як, наприклад, -кетокислота, така як піровиноградна кислота або оксалацетат, був доданий в реакцію, можна було спостерігати повне розкладання гідролізованого фумонізину до 2-кетоHFB1, як показано на фіг. 3. Ця речовина абсолютно нешкідлива для ссавців. Приклад 3: Активність ферментів у кишковому середовищі Для дослідження ферментативної активності FUM-карбоксилестерази в травному тракті були використані кишки свіжо забитих свиней, транспортовані до лабораторії без доступу кисню та досліджені на анаеробній стерильній установці. Шматки приблизно 10 см завдовжки були відміряні і відрізані від дванадцятипалої кишки та порожньої кишки. Фумонізин В1, розбавлений до кінцевої концентрації близько 10 частин на мільйон у концентрованому водному розчині, був введений через голки та змішаний з вмістом кишок. Після цього 5 мкг фумонізинкарбоксилестерази у водному розчині або такий самий об'єм води в негативних контролях відповідно був введений і змішаний. Відрізки кишок були інкубовані при 39°С. Проби були відібрані за допомогою голок і проаналізовані HPLC-MS/MS (високоефективною рідинною хроматографією та мас-спектрометрією). Було показано, що під час взяття першої проби через дві години фумонізин В1 вже був повністю гідролізований у дванадцятипалій кишці та у порожній кишці. Приклад 4: Визначення температурного інтервалу активності фумонізин-карбоксилестерази. Для визначення інтервалу температур, у якому фумонізин-карбоксилестераза є активною, 1.6 нг/мл FUM-карбоксилестерази у буфері 20 мМ Tris-Cl, pH 7.0, були інкубовані з 0.1 мг/мл BSA та 10 частинами на мільйон фумонізину В1 при різних температурах. Було показано, що температурний оптимум для цього ферменту був при 30°С. Ферментативна активність була 6 UA 103335 C2 5 10 15 20 25 30 чітко визначена при 40°С і, навіть, 50°С. Отже, FUM-карбоксилестераза є придатною для застосування у температурних умовах, які переважають у травному тракті, або в ході етапів процесу виготовлення харчових продуктів та кормів, яке відбувається при підвищених температурах. Приклад 5: Визначення інтервалу рН активності фумонізин-карбоксилестерази. Для визначення інтервалу рН, у якому фумонізин-карбоксилестераза є активною, був використаний буфер Теореля-Стенхагена. Цей буфер може бути пристосований для інтервалу 10 одиниць рН з однаковою буферною здатністю для комбінації цитрату, фосфату та борату. FUM-карбоксилестеразу було інкубовано у цьому буфері з 10 частинами на мільйон фумонізину В1 при різних значеннях рН і 25°С, при концентрації 3.3 нг/мл. Найвища активність була показана при рН 8.0, однак активність можна було виявити в усьому інтервалі від рН 5 до рН 10. Активність в межах такого широкого інтервалу рН дозволяє виробниче застосування ферменту як кормової добавки або в ході обробки харчових продуктів та кормів. Приклад 6: Досліди з відгодівлі поросят. Дослід був проведений у дослідному свинарнику на 12 стійл по 10 тварин у кожному. Стійла були обладнані дощатою підлогою, лотковими годівницями та комп'ютерною системою годування. Автомати були розташовані уздовж стінок стійл. Кожний день клімат свинарника автоматично регіструвався і температура встановлювалася згідно з стандартними рекомендаціями для розведення поросят. Для цього досліду були використані 120 відлучених від матері поросят різної статі (вік: приблизно 4 тижні, середня встановлена вага: 8,21 кг). Кожне порося було помічено та окремо зважено. 120 поросят були довільно розподілені серед 12 стійл. Усі поросята походили з Австрійської програми розведення ÖHYB (= (велика біла ландрас) Пієтрейн). Безпосередньо після відлучення від матері поросят годували початковим кормом протягом двох днів, після цього стабілізаційного періоду мала місце заміна дослідного корму. Годівлю здійснювали в дві фази: фаза відлучення 1-14-й дні, фаза відгодівлі 15-42-й дні. Дослідний корм змішувався індивідуально для кожного стійла за допомогою комбікормової установки та давався у сухому вигляді двічі на день як функція кількості поросят, приросту та споживання корму. Вода споживалася за бажанням. 12 стійл були поділені на чотири групи різного призначення при трьох повторюваннях кожна і одержували наступні домішки в вищеописаний корм: Група Негативна контрольна Позитивна контрольна Дослідна група 1 Дослідна група 2 Без токсинів, без додання ферментів 4-5.5 ч. на млн. фумонізину В1 4-5.5 ч. на млн. фумонізину В1 + суміш ферментів 1 (карбоксилестераза, амінотрансфераза, піруват) 0.5 кг/т корму 4-5.5 ч. на млн. фумонізину В1 + суміш ферментів 2 (карбоксилестераза, амінотрансфераза, піруват, інертний носій) 1 кг/т корму Дихальні проблеми спостерігалися у позитивному контролі у майже половини тварин, навіть сталося одне виключення. Усі інші групи виглядали здоровими. Показники продуктивності 35 Група Негативний контроль Позитивна контрольна Дослідна група 1 Дослідна група 2 40 Кількість тварин Початкова вага (середня, Кінцева вага (середня, Вибуло кг) кг) 30 8.34 26.82 30 8.17 24.77 30 30 8.08 8.25 26.69 27.03 1 Приклад 7: Ферментативне розкладання фумонізинів у рослинній масі для виробництва біоетанолу. Проби кукурудзяного рослинної маси для виробництва біоетанолу були взяті і інкубовані при 30-65°С при помішуванні, розкладання фумонізину В1 досліджувалося після додавання 770 одиниць карбоксилестерази SEQ ID NO: 9 на кубічний метр рослинної маси при помішуванні (тривалість помішування у хвилинах). Проби були інактивовані кип'ятінням після взяття і наступного центрифугування для аналізу, а певна кількість супернатанту була випарена. 7 UA 103335 C2 13 5 10 15 20 Залишок вміщували в 200 мкл пробного буферу, що містив С -мічений внутрішній стандарт фумонізину, струшували впродовж 1,5 хв., центрифугували, і тоді піддавали LC-MS-аналізу. Результатом цього є те, що, як зображено на фіг. 4, фумонізин FB1 повністю конвертується в гідролізований фумонізин HFB1. Після додавання амінотрансферази SEQ ID NO: 19 гідролізований фумонізин HFB1 повністю розкладається до нешкідливих компонентів, як зображено на фіг. 5. Приклад 8: Розкладання фумонізинів та їх похідних у кукурудзяній каші для перепічок та каші для пластівців Активність ферментів, що розкладають фумонізин, була вивчена на зразках кукурудзяної каші (кукурудзяної крупи) для виготовлення кукурудзяних перепічок і кукурудзяних пластівців. Контаміновану фумонізином кукурудзу (приблизно 1 частина на мільйон) перемалювали на кукурудзяну муку, змішували з водою та кип'ятили. Для виготовлення перепічок в охолоджену до приблизно 50-60°С кукурудзяну кашу додавали суміш протеїназ у лужному розчині. Після 30180 хвилин, коли рН опускалося нижче 9, краще нижче 8, була додана суміш карбоксилестерази 3 та амінотрансферази (500-1000 од./м кожної) і інкубована ще 30-60 хвилин. Щодо виготовлення кукурудзяних пластівців, кукурудзяну кашу з кукурудзяного борошна та ячмінного солоду кип'ятили в сосуді високого тиску приблизно годину; після охолодження нижче 60°С (краще 50°С) була додана суміш ферментів, що містила карбоксилестеразу та амінотрансферазу (5003 1000 од./м кожної), і інкубована ще 30-60 хвилин. З цієї суміші були відібрані проби та проаналізовані на залишки FB1 та HFB1, як у прикладі 7. Рівні HFB1 були менше 80 часток на мільярд в усіх пробах, HFB1, утворений з FB1, явно продовжував реагувати й далі. Виміряні значення FB1 наведені у таблиці нижче. Таблиця Ферментативне розкладання FB1 та HFB1 у кукурудзяній каші; вміст фумонізину у частках на мільярд (мкг/кг) Час обробки сумішшю ферментів (хв.) 0 10 30 Каша для перепічок (40°С, 500 одиниць) 852 116 32 Каша для перепічок (50°С, 1000 одиниць) 866 134 71 Каша для пластівців (35°С, 500 одиниць) 912 51 17 Каша для пластівців (40°С, 1000 одиниць) 1053 97 37 25 ФОРМУЛА ВИНАХОДУ 30 35 40 45 1. Спосіб виготовлення добавки для ферментативного розкладання фумонізинів у рослинній сировині, який відрізняється тим, що забезпечують принаймні одну нуклеїновокислотну послідовність генів, що відповідає послідовностям SEQ ID NOs:8, 18 і 24, експресують принаймні одну послідовність нуклеїнових кислот у прокаріотичних або еукаріотичних клітинах і використовують принаймні один приготований таким чином фермент, що відповідає послідовностям SEQ ID NOs:9, 19 і 25 разом з кофактором. 2. Спосіб за п. 1, який відрізняється тим, що розкладають фумонізини у кисневонезалежному середовищі. 3. Спосіб за п. 1 або 2, який відрізняється тим, що перед застосуванням ферментів у вихідному рослинному матеріалі модифікують шаблон методами молекулярної генетики, мутагенезом або молекулярною еволюцією. 4. Спосіб за пп. 1, 2, або 3, який відрізняється тим, що ізолюють ферменти. 5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що інкапсулюють ферменти в захисне покриття. 6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що вибирають ферменти зпоміж карбоксилестерази SEQ ID NO:9 та/або амінотрансферази SEQ ID NO:19. 7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що застосовують фермент, який містить принаймні 90 % послідовності, ідентичної до принаймні одного з ферментів за SEQ ID NOs:9, 19 або 25. 8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що при використанні принаймні однієї амінотрансферази SEQ ID NO:19 або SEQ ID NO:25 використовують кетон, зокрема, αкетокислоту як кофактор. 8 UA 103335 C2 5 10 15 20 25 30 35 40 45 9. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що при використанні карбоксилестерази SEQ ID NO:9 додатково використовують принаймні один адсорбент, вибраний, зокрема, з-поміж глинястих мінералів. 10. Спосіб за будь-яким з пп. 1-9, який відрізняється тим, що використовують добавку у вихідному рослинному матеріалі, який буде ферментований, або у рослинній масі для виготовлення біоетанолу. 11. Добавка для ферментативного розкладання фумонізинів у рослинній сировині або у сумішах, які містять рослинну сировину, яка відрізняється тим, що містить принаймні один фермент з послідовностями SEQ ID NOs:9, 19 і 25, а також додатково принаймні один кофактор для принаймні одного або кількох використовуваних ферментів та інертний носій. 12. Добавка за п. 11, яка відрізняється тим, що використовувані ферменти модифіковані методами молекулярної генетики, мутагенезом або молекулярною еволюцією. 13. Добавка за п. 11 або 12, яка відрізняється тим, що використовуваний фермент, який містить принаймні 90 % послідовності, ідентичної до принаймні одного з ферментів за SEQ ID NOs:9, 19 або 25. 14. Добавка за пп. 11, 12 або 13, яка відрізняється тим, що ферменти, модифіковані ферменти та/або принаймні на 90 % ідентичні ферменти використовуються укритими захисним покриттям. 15. Добавка за будь-яким з пп. 11-14, яка відрізняється тим, що містить карбоксилестеразу SEQ ID NO:9, принаймні одну амінотрансферазу SEQ ID NO:19 або SEQ ID NO:25, α-кетокислоту як кофактор та інертний носій. 16. Добавка за будь-яким з пп. 11-15, яка відрізняється тим, що містить карбоксилестеразу SEQ ID NO:9, принаймні один адсорбент, зокрема, принаймні один глинястий мінерал, а також, необов’язково, інертний носій. 17. Добавка за будь-яким з пп. 11-16, яка відрізняється тим, що добавка використовується у киснево-незалежному середовищі при виготовленні біоетанолу разом з рослинними масами або вихідному рослинному матеріалі. 18. Застосування генів, представлених у послідовностях, для експресії у прокаріотичних або еукаріотичних клітинах послідовностей генів за SEQ ID NOs:8, 18 та 24, а також кофакторів, для виготовлення добавки для розкладання фумонізинів у рослинній сировині. 19. Застосування за п. 18, яке відрізняється тим, що використовують кофактор, вибраний з групи, що включає карбоксилестеразу SEQ ID NO:9, амінотрансферазу SEQ ID NO:19 або SEQ ID NO:25, або α-кетокислоти і інертний носій. 20. Застосування за п. 18, яке відрізняється тим, що використовують карбоксилестеразу, принаймні один адсорбент, зокрема глинястий мінерал, а також, необов′язково, інертний носій. 21. Застосування за будь-яким з пп. 18, 19 або 20 для безкисневої обробки вихідного рослинного матеріалу або рослинної маси у виробництві біоетанолу. 22. Застосування повністю рекомбінантних організмів для експресії послідовностей генів за SEQ ID NOs:8, 18 та 24, а також кофакторів для виготовлення добавки для розкладання фумонізинів у рослинній сировині. 23. Застосування за п. 22, яке відрізняється тим, що використовують кофактор, вибраний з групи, що включає карбоксилестеразу SEQ ID NO:9, амінотрансферазу SEQ ID NO:19 або SEQ ID NO:25, або α-кетокислоти і інертний носій. 24. Застосування за п. 22, яке відрізняється тим, що використовують карбоксилестеразу, принаймні один адсорбент, зокрема глинястий мінерал, а також, необов′язково, інертний носій. 25. Застосування за будь-яким з пп. 22, 23 або 24 для безкисневої обробки вихідного рослинного матеріалу або рослинної маси у виробництві біоетанолу. 9 UA 103335 C2 10 UA 103335 C2 11 UA 103335 C2 12 UA 103335 C2 13 UA 103335 C2 14 UA 103335 C2 15 UA 103335 C2 16 UA 103335 C2 17 UA 103335 C2 18 UA 103335 C2 19 UA 103335 C2 20 UA 103335 C2 21 UA 103335 C2 22 UA 103335 C2 23 UA 103335 C2 24 UA 103335 C2 25 UA 103335 C2 26 UA 103335 C2 27 UA 103335 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the production of an additive for the enzymatic decomposition of mycotoxins, additive, and use thereof
Автори англійськоюMoll, Wulf-Dieter, Hartinger, Doris, Griessler, Karin, Binder, Eva, Maria, Schatzmayr, Gerd
Автори російськоюШатцмайр Герд
МПК / Мітки
МПК: C12N 15/52, A23K 1/165, C12N 9/10, C12N 9/18, C12P 7/06
Мітки: ферментативного, добавки, виготовлення, добавка, застосування, розкладання, спосіб, мікотоксинів
Код посилання
<a href="https://ua.patents.su/30-103335-sposib-vigotovlennya-dobavki-dlya-fermentativnogo-rozkladannya-mikotoksiniv-dobavka-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Спосіб виготовлення добавки для ферментативного розкладання мікотоксинів, добавка та її застосування</a>
Попередній патент: Блок для рафінування і модифікування чавуну та сталі
Випадковий патент: Пристрій для складання і зварювання труб