Похідні 1-бензил-3-гідроксиметиліндазолу та їх застосування у лікуванні хвороб, основаних на експресії mcp-1, cx3cr1 та р40
Номер патенту: 103605
Опубліковано: 11.11.2013
Автори: Фурлотті Гвідо, Мангано Джорджина, Гугліелмотті Анджело, Каццолла Нікола, Гарофало Барбара
Формула / Реферат
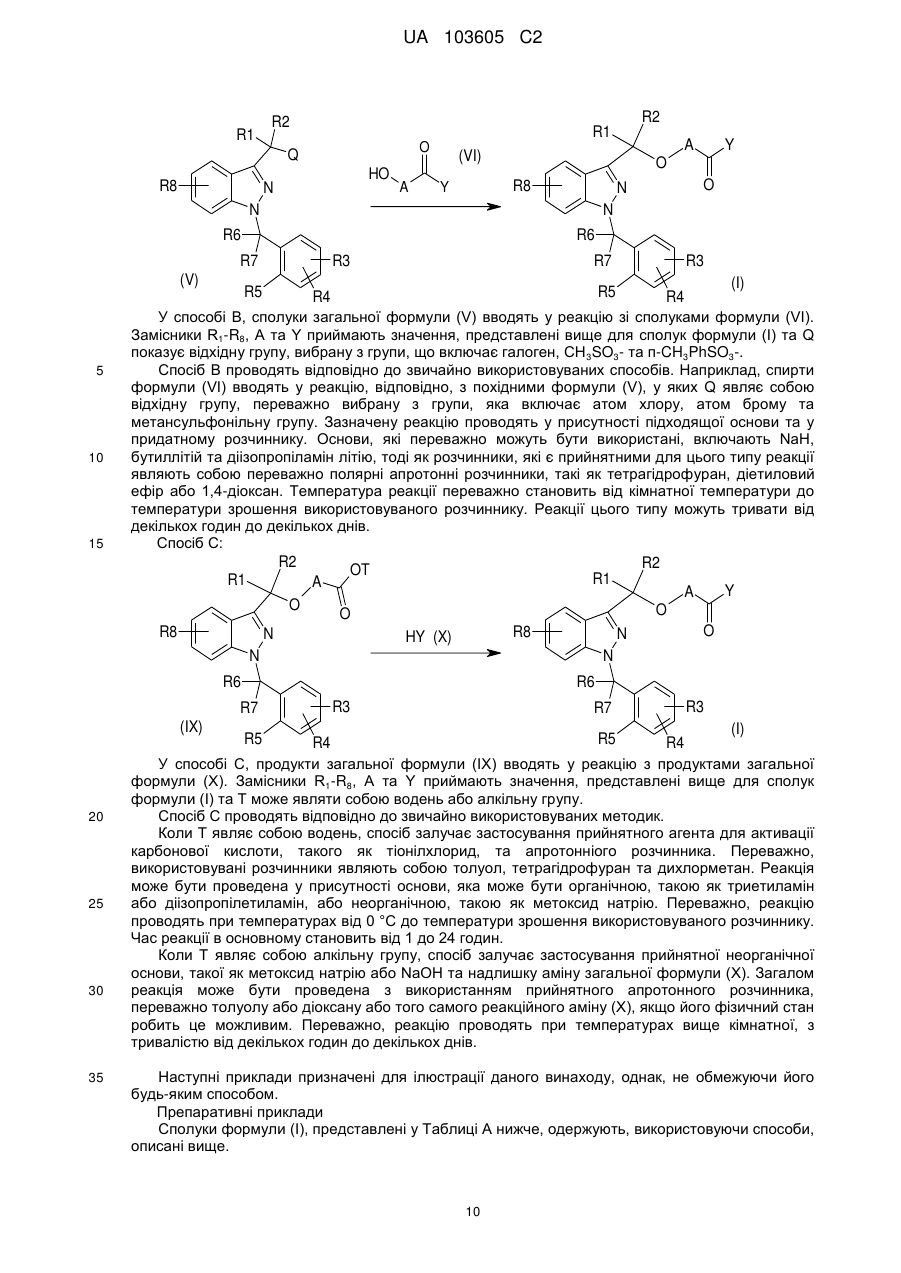
1. Сполука формули (I)
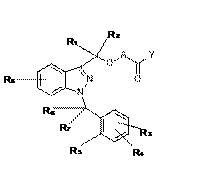 , (I)
, (I)
у якій:
A може являти собою -X1- або -X1-OC(R9)(R10)-, де
X1 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що мають від 1 до 3 атомів вуглецю, та
R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю,
Y може являти собою N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2-CO-X3, де
R11 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або R11 разом з R12 утворює 5-6-членний гетероцикл,
R12 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, арильну групу, що має 6 атомів вуглецю, 6-членну гетероарильну групу, що містить принаймні один N-атом, або R12 разом з R11, утворює 5-6-членний гетероцикл,
R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю,
R14 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, COR’, COOR’, CON(R’)(R”), де R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю,
X2 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, яка необов’язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають 1 атом вуглецю,
X3 може являти собою OH, NH2,
R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має 1 атом вуглецю,
R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”), -N(R’)COR”, -CN, -CONR’R”, -SO2NR’R” та трифторметил; причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю,
R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”) та трифторметил, або R5, разом з одним з R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R’ та R” представлені атомом водню,
R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю.
2. Сполука за п. 1, де X1 являє собою алкільну групу, що має від 1 до 3 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 3 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що мають 1 або 2 атоми вуглецю.
3. Сполука за п. 1, де X1 вибраний з групи, що включає групу CH2, групу CH2CH2 або групу C(CH3)2, та R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, являють собою атом водню або CH3-групу.
4. Сполука за п. 1, де залишок A вибраний з групи, що включає групу CH2, групу CH2CH2, групу C(CH3)2, групу CH2CH2OCH2, групу CH2CH2OC(CH3)2 та групу CH2CH2CH2OC(CH3)2.
5. Сполука за п. 1, де R12 являє собою атом водню, алкільну групу, що має 1 атом вуглецю, 6-членну гетероарильну групу, що містить принаймні один N-атом, або R12 разом з R11 утворюють 5- або 6- членний гетероцикл.
6. Сполука за п. 1, де R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, або алкоксигрупою, що має 1 або 2 атоми вуглецю.
7. Сполука за п. 1, де R14 являє собою атом водню, алкільну групу, що має від 1 до 3 атомів вуглецю, COR’, COOR’, CON(R’)(R”), де R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю.
8. Сполука за п. 1, де X2 являє собою алкільну групу, що має від 1 до 3 атомів вуглецю, яка необов’язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають 1 атом вуглецю.
9. Сполука за п. 1, де R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, вибрані з групи, що включає атом водню, алкільну групу, що має від 1 до 3 атомів вуглецю, алкоксигрупу, що має 1 або 2 атоми вуглецю, атом Br, Cl або F, OH-групу, трифторметильну групу або групу N(R’)(R”) або -N(R’)COR”, -CN, -CONR’R”, -SO2NR’R”, причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 3 атомів вуглецю.
10. Сполука за п. 1, де R5 вибраний з групи, що включає атом водню, алкільну групу, що має від 1 до 3 атомів вуглецю, алкоксигрупу, що має 1 або 2 атоми вуглецю, атом галогену, OH-групу, або R5, разом з одним з R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю.
11. Фармацевтична композиція, що містить сполуку формули (I) за будь-яким з попередніх пунктів або її стереоізомер або енантіомер, або її фармацевтично прийнятну сіль, складний ефір або проліки та щонайменше один фармацевтично прийнятний носій.
12. Фармацевтична композиція за п. 11, яка відрізняється тим, що фармацевтично прийнятна сіль являє собою сіль приєднання з фізіологічно прийнятними органічними або неорганічними кислотами або основами.
13. Фармацевтична композиція за п. 12, яка відрізняється тим, що фізіологічно прийнятні кислоти вибрані з групи, що включає соляну кислоту, бромистоводневу кислоту, сірчану кислоту, фосфорну кислоту, азотну кислоту, оцтову кислоту, аскорбінову кислоту, бензойну кислоту, лимонну кислоту, фумарову кислоту, молочну кислоту, малеїнову кислоту, метансульфонову кислоту, щавлеву кислоту, пара-толуолсульфонову кислоту, бензолсульфонову кислоту, бурштинову кислоту, дубильну кислоту та винну кислоту.
14. Фармацевтична композиція за п. 12, яка відрізняється тим, що фізіологічно прийнятні основи вибрані з групи, що включає гідроксид амонію, гідроксид кальцію, карбонат магнію, гідрокарбонат натрію, гідрокарбонат калію, аргінін, бетаїн, кофеїн, холін, N,N-дибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2-диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, N-етилпіперидин, N-метилглюкамін, глюкамін, глюкозамін, гістидин, N-(2-гідроксіетил)піперидин, N-(2-гідроксіетил)піролідин, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, теобромін, триетиламін, триметиламін, трипропіламін та трометамін.
15. Фармацевтична композиція за п. 11, яка відрізняється тим, що фармацевтично прийнятний складний ефір утворений з фізіологічно прийнятними органічними кислотами або спиртами.
16. Фармацевтична композиція за будь-яким з пунктів 11-15, яка відрізняється тим, що містить стереоізомер або енантіомер сполуки формули (I) або його фармацевтично прийнятну сіль, складний ефір або проліки або їх суміш.
17. Фармацевтична композиція за будь-яким з пунктів 11-16, яка відрізняється тим, що фармацевтично прийнятний носій вибраний з групи, що включає гліданти, зв’язуючі речовини, дезінтегранти, наповнювачі, розріджувачі, ароматизатори, барвники, флюїдизатори, лубриканти, консерванти, гігроскопічні речовини, абсорбенти та підсолоджувачі.
18. Застосування сполуки формули (I)
 , (I)
, (I)
у якій:
A може являти собою -X1- або -X1-OC(R9)(R10)-, де
X1 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що мають від 1 до 3 атомів вуглецю, та
R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю,
Y може являти собою N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2-CO-X3, де
R11 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або R11 разом з R12 утворює 5-6-членний гетероцикл,
R12 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, арильну групу, що має 6 атомів вуглецю, 6-членну гетероарильну групу, що містить принаймні один N-атом, або R12 разом з R11, утворює 5- або 6-членний гетероцикл,
R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю,
R14 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, COR’, COOR’, CON(R’)(R”), де R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю,
X2 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, яка необов’язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають 1 атом вуглецю,
X3 може являти собою OH, NH2,
R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню або алкільну групу, що має 1 атом вуглецю,
R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”), -N(R’)COR”, -CN, -CONR’R”, -SO2NR’R” та трифторметил; причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю,
R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”) та трифторметил, або R5, разом з одним з R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R’ та R” представлені атомом водню,
R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю,
для одержання фармацевтичної композиції для лікування хвороб, основаних на експресії MCP-1, CX3CR1 та p40.
19. Застосування за п. 18, де зазначена хвороба, основана на експресії MCP-1 та CX3CR1, вибрана з групи, що включає такі як: хвороби суглобів, хвороби нирок, серцево-судинні хвороби, метаболічний синдром, ожиріння, діабет, резистентність до інсуліну та рак.
20. Застосування за п. 19, де зазначена хвороба, основана на експресії MCP-1, вибрана з групи, що включає такі як: ревматоїдний артрит, артрит, викликаний вірусними інфекціями, псоріатичний артрит, артроз, вовчаковий нефрит, діабетична нефропатія, гломерулонефрит, полікістозна хвороба нирок, інтерстиціальна легенева хвороба, фіброз, розсіяний склероз, хвороба Альцгеймера, пов’язана з ВІЛ деменція, атопічний дерматит, псоріаз, васкуліт, рестеноз, атеросклероз, інфаркт міокарда, стенокардія, гострі коронарні хвороби, аденоми, карциноми та метастази, метаболічні хвороби та ускладнення після хірургічних втручань.
21. Застосування за п. 19, де зазначена хвороба, основана на експресії CX3CR1, вибрана з групи, що включає такі як: ревматоїдний артрит, вовчаковий нефрит, діабетична нефропатія, хвороба Крона, виразковий коліт, коронарні хвороби серця, рестеноз, атеросклероз, інфаркт міокарда, стенокардія та ускладнення після хірургічних втручань.
22. Застосування за п. 18, де зазначена хвороба, основана на експресії p40, вибрана з групи, що включає аутоімунні хвороби, хронічні дегенеративні запальні хвороби та рак.
23. Застосування за п. 22, де зазначена хвороба, основана на експресії p40, вибрана з групи, що включає ревматоїдний артрит, псоріаз, гломерулонефрит, червоний вовчак, діабет, хворобу Крона та пухлини.
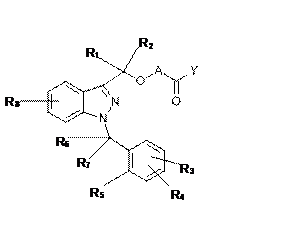
24. Спосіб лікування або профілактики хвороб, основаних на експресії MCP-1, CX3CR1 та p40, у якому пацієнту, що цього потребує, вводять ефективну кількість сполуки формули (I):
 , (I)
, (I)
у якій:
A може являти собою -X1- або -X1-OC(R9)(R10)-, де
X1 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що мають від 1 до 3 атомів вуглецю, та
R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю,
Y може являти собою N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2-CO-X3, де
R11 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або R11 разом з R12 утворює 5- або 6-членний гетероцикл,
R12 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, арильну групу, що містить 6 атомів вуглецю, 6-членну гетероарильну групу, що містить принаймні один N-атом, або R12 разом з R11, утворює 5- або 6-членний гетероцикл,
R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю,
R14 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, COR’, COOR’, CON(R’)(R”), де R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю,
X2 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, яка необов’язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають 1 атом вуглецю,
X3 може являти собою OH, NH2,
R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має 1 атом вуглецю,
R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”), -N(R’)COR”, -CN, -CONR’R”, -SO2NR’R” та трифторметил; причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю,
R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”) та трифторметил, або R5, разом з одним з R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R’ та R” представлені атомом водню, та
R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю.
Текст
Реферат: Даний винахід стосується нових похідних 1-бензил-3-гідроксиметиліндазолу відповідно до формули (І) R1 R2 R8 R6 R7 R5 R3 R4 (I) UA 103605 C2 (12) UA 103605 C2 та фармацевтичної композиції, що містить їх разом з фармацевтично прийнятним носієм. Крім того, даний винахід стосується застосування похідних 1-бензил-3-гідроксиметиліндазолу для одержання фармацевтичної композиції, яка є активною у лікуванні хвороб, основаних на експресії МСР-1, CX3CR1 та р40, та їх застосування у способі лікування або профілактики хвороб, основаних на експресії МСР-1, CX3CR1 та р40. UA 103605 C2 5 10 ГАЛУЗЬ ВИНАХОДУ Даний винахід відноситься до похідних 1-бензил-3-гідроксиметиліндазолу, до фармацевтичної композиції, що містить їх, та до їх застосування у лікуванні хвороб, основаних на експресії MCP-1, CX3CR1 та p40. Зокрема, даний винахід відноситься до нових похідних 1-бензил-3-гідроксиметиліндазолу відповідно до формули (I), представленої нижче, та до фармацевтичної композиції, що містить їх разом з фармацевтично прийнятним носієм. Крім того, даний винахід відноситься до застосування похідних 1-бензил-3-гідроксиметиліндазолу для одержання фармацевтичної композиції, яка є активною у лікуванні хвороб, основаних на експресії MCP-1, CX3CR1 та p40, та до їх застосування у способі лікування або профілактики хвороб, основаних на експресії MCP-1, CX3CR1 та p40. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ 15 20 25 30 35 40 45 50 55 60 Як відомо, MCP-1 (Моноцитарний Хемотаксичний Білок-1) являє собою білок, що належить до підсімейства хемокінів. MCP-1 має сильну хемотаксичну дію на моноцити та робить всій вплив також на T лімфоцити, мастоцити та базофіли (Rollins B.J., Chemokines, Blood 1997; 90: 909-928; M. Baggiolini, Chemokines and leukocyte traffic, Nature 1998; 392: 565-568). Інші хемокіни, що належать до підсімейства, являють собою, наприклад, MCP-2 (Моноцитарний Хемотаксичний Білок-2), MCP-3, MCP-4, MIP-1 та MIP-1, RANTES. підсімейство відрізняється від підсімейства тим, що у структурі перші два цистеїни є суміжними для підсімейства, в той час як для підсімейства вони є розділеними проміжною амінокислотою. MCP-1 виробляється різними типами клітин (лейкоцити, тромбоцити, фібробласти, ендотеліальні клітини та клітини гладких м'язів). Серед всіх відомих хемокінів, MCP-1 показує найвищу специфічність до моноцитів та макрофагів, для яких він визначає не тільки хемотаксичний фактор, але також активаційний стимул, таким чином, індукуючи процеси вироблення численних запальних факторів (суперпероксиди, арахідонова кислота та похідні, цитокіни/хемокіни) та посилюючи фагоцитарну активність. Секреція хемокінів загалом, та MCP-1 зокрема, як правило, викликається різними прозапальними факторами, наприклад, такими як інтерлейкін-1 (IL-1), інтерлейкін-2 (IL-2), TNF (Фактор некрозу пухлини ), інтерферон- та бактеріальний ліпополісахарид (LPS). Запобігання появі запальної відповіді шляхом блокування системи хемокін/хемокіновий рецептор представляє одну з головних цілей фармакологічного втручання (Gerard C. and Rollins B.J., Chemokines and disease. Nature Immunol. 2001; 2:108-115). Існує багато доказів того, що MCP-1 грає ключову роль в запальних процесах та показаний як нова та підтверджена ціль у різних патологіях. Доведення значного фізіопатологічного внеску MCP-1 отримане у випадку пацієнтів з запальними хворобами суглобів та нирок (ревматоїдний артрит, вовчаковий нефрит, діабетична нефропатія та відторгнення після трансплантації). Однак, нещодавно, MCP-1 був показаний серед факторів, залучених у запальні патології ЦНС (розсіяний склероз, хвороба Альцгеймера, пов'язана з ВІЛ деменція) та інші патології та стани, з та без очевидного запального компоненту, включаючи атопічний дерматит, коліт, інтерстиціальні легеневі патології, рестеноз, атеросклероз, ускладнення після хірургічного втручання (наприклад, такого як пластична операція на судинах, артеректомія, трансплантація, заміна органу та/або тканини, протезування), рак (аденоми, карциноми та метастази) та навіть метаболічні хвороби, такі як резистентність до інсуліну та ожиріння. Крім того, незважаючи на той факт, що хемокінова система залучена у контролювання та подолання вірусних інфекцій, нещодавні дослідження показали, що відповідь певних хемокінів, та зокрема MCP-1, може грати шкідливу роль у випадку взаємодій між хазяїном та патогенним мікроорганізмом. Зокрема, MCP-1 був показаний серед хемокінів, які роблять свій внесок у ураження органу та тканини в патологіях, що опосередковуються альфа вірусами, які характеризується інфільтрацією моноциту/макрофагу у суглобах та м'язах (Mahalingam S. et al. Chemokines and viruses: friend or foes? Trends in Microbiology 2003; 11: 383-391; Rulli N. et al. Ross River Virus: molecular and cellular aspects of disease pathogenesis. 2005; 107: 329-342). Моноцити є головними попередниками макрофагів та дендритних клітин, та грають критичну роль як медіатори запальних процесів. CX3CR1, з його лігандом CX3CL1 (fractalkine), являє собою ключовий фактор у регулюванні міграції та адгезивності моноцитів. CX3CR1 експресується у моноцитах, в той час як CX3CL1 являє собою трансмембранний хемокін у 1 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 ендотеліальних клітинах. Генетичні дослідження на людських та тваринних моделях показали важливу роль у фізіопатології запальних хвороб CX3CR1 та CX3CL1. Фактично існує багато доказів ключового внеску CX3CR1 та його ліганду у патогенез та прогресування запальних хвороб суглобів, нирок, шлунково-кишкового тракту та судин (наприклад, ревматоїдний артрит, вовчаковий нефрит, діабетична нефропатія, хвороба Крона, виразковий коліт, рестеноз та атеросклероз). Експресія CX3CR1 надрегулюється у T клітинах, що, як вважають, накопичуються у синовіальній оболонці пацієнтів, що страждають на ревматоїдний артрит. Крім того, експресія CX3CL1 надрегулюється у ендотеліальних клітинах та фібробластах, присутніх у синовіальній оболонці цих пацієнтів. Отже, CX3CR1/CX3CL1 система грає важливу роль у контролюванні типу клітини та способу інфільтрації синовіальної оболонки та робить свій внесок у патогенез ревматоїдного артриту (Nanki T. et al., "Migration of CX3CR1-positive T cells producing type 1 cytokines and cytotoxic molecules into the synovium of patients with rheumatoid arthritis", Arthritis & Rheumatism (2002), vol. 46, No. 11, pp. 2878-2883). У пацієнтів, що страждають від ураження нирок, більшість запальних лейкоцитів, які інфільтрують нирки, експресують CX3CR1, та зокрема він експресується на двох з основних типів клітин, залучених у найбільш розповсюджені запальні патології нирок та у відторгнення трансплантату нирки, T клітинах та моноцитах (Segerer S. et al., Expression of the fractalkine receptor (CX3CR1) in human kidney diseases, Kidney International (2002) 62, pp. 488-495). Також передбачається, що CX3CR1/CX3CL1 система приймає участь у запальних хворобах кишок (IBD). У випадку пацієнтів, що страждають від IBD (наприклад, хвороба Крона, виразковий коліт), фактично, було показане значне збільшення у виробленні CX3CL1 капілярною системою кишечнику та значне збільшення у CX3CR1-позитивних клітинах, як у кровоносному рівні, так і у слизовій оболонці (Sans M. et al., "Enhanced recruitment of CX3CR1+T cells by mucosal endothelial cell-derived fractalkine in inflammatory bowel diseases", Gastroenterology 2007, vol. 132, No. 1, pp. 139-153). Навіть більш цікавою є демонстрація ключової ролі, які грає система CX3CR1/CX3CL1 в ураженні судин та зокрема за патологічних умов, наприклад, таких як атеросклероз та рестеноз. Показано, що CX3CR1 є критичним фактором у процесі інфільтрації та накопичення моноцитів у стінці судини, та CX3CR1 поліморфізм у людини пов'язаний із зниженим рівнем розповсюдженості атеросклерозу, коронарних хвороб серця та рестенозу (Liu P. et al., "Crosstalk among Smad, MAPK and integrin signalling pathways enhances adventitial fibroblast functions activated by transforming growth factor-1 and inhibited by Gax" Arterioscler. Thromb. Vasc. Biol. 2008; McDermott D.H. et al., "Chemokine receptor mutant CX3CR1-M280 has impaired adhesive function and correlates with protection from cardiovascular diseases in humans", J. Clin. Invest. 2003; Niessner A. et al., Thrombosis and Haemostasis 2005). IL-12 та IL-23 є членами невеликого сімейства прозапальних гетеродимерних цитокінів. Обидва цитокіни поділяють загальну субодиницю, p40, яка є ковалентно прикріпленою або до p35 субодиниці для одержання зрілої форми IL-12, або до p19 субодиниці для одержання зрілої форми IL-23. Рецептор для IL-12 складається з субодиниць IL-12R1 та IL-12R2, в той час як рецептор для IL-23 складається з субодиниць IL-12R1 та IL-23R. IL-12 та IL-23, головним чином, експресуються активованими дендритними клітинами та фагоцитами. Рецептори для двох цитокінів експресуються на T та NK клітинах, та NK T клітинах, але низькі рівні комплексів рецептору для IL-23 також присутні у моноцитах, макрофагах та дендритних клітинах. Незважаючи на ці подібності, існує багато доказів того, що IL-12 та IL-23 контролюють різні імунологічні ланцюги. Фактично, в той час як IL-12 контролює розвиток Th1 клітин, які здатні виробляти гама-інтерферон (IFN-), та збільшує цитотоксичну, протимікробну та протипухлинну + відповідь, IL-23 регулює ланцюг, який веде до створення CD4 клітин, які здатні виробляти IL-17. Індукування IL-23-залежних процесів веде до мобілізації різних типів запальних клітин, наприклад TH-17, та, як було показано, є критичним для патогенезу численних запальних патологій, що опосередковуються імунологічними відповідями. Типові приклади патологій, пов'язаних з експресією p40, включають хронічні запальні хвороби суглобного апарату (наприклад, ревматоїдний артрит), дерматологічного апарату (наприклад, псоріаз) та шлунково-кишкового апарату (наприклад, хвороба Крона). Однак, IL-23 також грає роль у промотуванні появи та росту пухлини. В дійсності, IL-23 регулює цілий ряд ланцюгів у мікрооточенні пухлини, стимулюванні ангіогенезу та виробленні медіаторів запалення. Псоріаз є хронічною запальною хворобою шкіри, на яку хворіє 3 % всього населення світу (Koo J. Dermatol. Clin. 1996; 14:485-96; Schon M.P. et al., N. Engl. J. Med. 2005; 352: 1899-912). 2 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 Аберантна імунна відповідь типу-1 корелюється з патогенезом псоріазу, та цитокіни, які викликають цю відповідь, такі як IL-12 та IL-23, можуть являти собою підходящі терапевтичні об'єкти. Експресія IL-12 та IL-23, які поділяють субодиницю p40, є значно збільшеною у псоріатичних бляшках, та доклінічні дослідження показали роль цих цитокінів у патогенезі псоріазу. Нещодавно, лікування анти- IL-12 та IL-23 моноклональними антитілами пацієнтів, що страждають на псоріаз, довело ефективність у покращенні ознак прогресування та серйозності хвороби та додатково збільшило роль IL-12 та IL-23 у фізіопатології псоріазу. Хвороба Крона являє собою хронічну запальну патологію травного апарату та може впливати на будь-яку його область – від рота до ануса. Як правило, вона уражує кінцевий тракт підвздошної кишки та певні області товстої кишки. Часто вона пов'язана з системними автоімунними розладами, такими як виразки у роті та ревматоїдний артрит. Від хвороби Крона страждає 500 000 людей у Європі та 600 000 людей у Сполучених Штатах. Хвороба Крона являє собою патологію, пов'язану з Th1 клітина-опосередкованою надмірною активністю цитокінів. IL-12 являє собою ключовий цитокін у ініціації запальної відповіді, опосередкованої Th1 клітинами. Хвороба Крона характеризується збільшеним виробленням IL-12 клітинами, що надають антиген у тканині кишечнику, та гама-інтерферону (IFN-) та TNF лімфоцитами та макрофагами кишечнику. Ці цитокіни викликають та підтримують запальний процес та потовщення стінки кишечнику, які є характерними ознаками патології. Доклінічні та клінічні дослідження показали, що інгібування IL-12 є ефективним у контролюванні запальної відповіді у моделях запалення кишечнику та/або у пацієнтів, що страждають від хвороби Крона. Взаємозв'язок між раком та запаленням наразі є встановленим фактом. Багато форм пухлин виникають у місцях запалення, та медіатори запалення часто виробляються у пухлинах. IL-23 визначений, як цитокін, пов'язаний з раком, та, зокрема, експресія IL-23 є значно вищою у зразках карцином людини у порівнянні з нормальними прилеглими тканинами. Крім того, відсутність значної експресії IL-23 у нормальних прилеглих тканинах говорить про надрегулювання IL-23 у пухлинах, збільшуючи його роль у генезисі пухлини. Європейський патент EP-B-0 382 276 описує декілька 1-бензил-3-гідроксиметил-індазольних похідних, що мають аналгетичну активність. У свою чергу, Європейський патент EP-B-0 510 748 описує, з іншого боку, застосування цих похідних для одержання фармацевтичної композиції, яка є активною у лікуванні автоімунних хвороб. Нарешті, Європейський патент EP-B-1 005 332 описує застосування цих похідних для одержання фармацевтичної композиції, яка є активною у лікуванні хвороб, що виникають від вироблення MCP-1. Вважають, що 2-метил-2-{[1(фенілметил)-1H-індазол-3-іл]метокси}-пропанова кислота здатна інгібувати, дозо-залежним способом, вироблення MCP-1 та TNF-, що індукуються in vitro у моноцитах з LPS та Candida albicans, в той час як та сама сполука не показала жодного ефекту у виробленні цитокінів IL-1 та IL-6, та хемокінів IL-8, MIP-1, та RANTES (Sironi M. et al., "A small synthetic molecule capable of preferentially inhibiting the production of the CC chemokine monocyte chemotactic protein-1", European Cytokine Network. Vol. 10, No. 3, 437-41, September 1999). Європейська патентна заявка EP-A-1 185 528 відноситься до триазинових похідних для інгібування вироблення IL-12. Європейські патентні заявки EP-A-1 188 438 та EP-A-1 199 074 відносяться до застосування інгібіторів ферменту PDE4, наприклад, Роліпрам (Rolipram), Аріфло (Ariflo) та діазепін-індольні похідні, у лікуванні та профілактиці хвороб, пов'язаних з надмірним виробленням IL-12. Європейська патентна заявка EP-A-1 369 119 відноситься до застосування гіалуронану з молекулярною масою від 600000 до 3000000 дальтонів для контролювання та інгібування експресії IL-12. Європейська патентна заявка EP-A-1 458 687 відноситься до застосування піримідинових похідних для лікування хвороб, пов'язаних з надвиробленням IL-12. Європейська патентна заявка EP-A-1 819 341 відноситься до застосування азотних гетероциклічних сполук, наприклад, піридинових, піримідинових та триазинових похідних, для інгібування вироблення IL-12 (або його цитокінів, таких як IL-23 та IL27, які стимулюють вироблення IL-12). Європейська патентна заявка EP-A-1 827 447 відноситься до застосування піримідинових похідних для лікування хвороб, пов'язаних з надвиробленням IL-12, IL-23 та IL-27. Європейські патентні заявки EP-A-1 869 055, EP-A-1 869 056 та EP-A-1 675 862 описують 1,3-тіазоло-4,5-піримідинові похідні, які здатні діяти як антагоністи CX3CR1 рецептору. Незважаючи на активність, винайдену до сих пір, все ще відчувається необхідність у нових фармацевтичних композиціях та сполуках, які є ефективними у лікуванні хвороб, основаних на експресії MCP-1, CX3CR1 та p40. Неочікувано, Заявник винайшов нові 1-бензил-3-гідроксиметиліндазольні похідні з фармакологічною активністю. 3 UA 103605 C2 5 10 Неочікувано, Заявник визначив, що нові 1-бензил-3-гідроксиметиліндазольні похідні відповідно до формули (I) даного винаходу здатні зменшувати вироблення хемокіну MCP-1. Ще більш неочікувано, Заявник визначив, що нові 1-бензил-3-гідроксиметиліндазольні похідні відповідно до формули (I) даного винаходу здатні зменшувати експресію хемокіну MCP1. Навіть ще більш неочікувано, Заявник визначив, що нові 1-бензил-3гідроксиметиліндазольні похідні відповідно до формули (I) даного винаходу здатні зменшувати експресію субодиниці p40, залученої у вироблення цитокінів IL-12 та IL-23, та експресію рецептору CX3CR1. Таким чином, у першому аспекті, даний винахід включає сполуку формули (I) R2 R1 Y A O R8 O N N R6 R3 R7 R5 15 20 25 30 35 40 45 R4 (I) у якій: A може являти собою -X1- або -X1-OC(R9)(R10)-, у якій X1 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, що необов'язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкокси груп, що мають від 1 до 3 атомів вуглецю, та R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкокси групу, що має від 1 до 3 атомів вуглецю, Y може являти собою N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2-CO-X3, де R11 може являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, або R 11 разом з R12 утворює 4- - 7-членний гетероцикл, R12 може являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, арильну групу, гетероарильну групу, алкіларильну групу, алкілгетероарильну групу, COR", COOR", CON(R")(R"), де R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, або R12 разом з R11, утворює 4- - 7-членний гетероцикл, R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю або алкокси групу, що має від 1 до 3 атомів вуглецю, R14 може являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, арильну групу, гетероарильну групу, алкіларильну групу, алкілгетероарильну групу, COR", COOR", CON(R")(R"), де R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, X2 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, яка необов'язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 5 атомів вуглецю або однієї або більшої кількості алкокси груп, що мають від 1 до 3 атомів вуглецю, X3 може являти собою OH, NH2, NHOH або NHNH2, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкокси групу, що має від 1 до 3 атомів вуглецю, R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R")(R"), -N(R")COR", -CN, -CONR'R", -SO2NR'R", SO2R", нітрогрупу та трифторметил; причому R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, 4 UA 103605 C2 5 10 15 20 R5 може являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R")(R"), -N(R")COR", нітрогрупу та трифторметил, або R5 разом з одним з R6 та R7 утворює кільце, що має 5 або 6 атомів вуглецю; причому R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю. У другому аспекті, даний винахід відноситься до фармацевтичної композиції, що містить нові похідні 1-бензил-3-гідроксиметиліндазолу відповідно до формули (I) або їх фармацевтично прийнятну сіль разом з щонайменше одним фармацевтично прийнятним носієм. Надрегулювання та/або підвищення експресії описаних вище MCP-1, CX3CR1, та p40, відповідно останнє приводить до IL-12 та/або IL-23 експресії/вироблення, що приводить до розвинення патології та/або хвороби, яку часто називають у даній галузі техніки терміном "надекспресія". Для цілі даного винаходу, термін експресія, як передбачається, включає надекспресію, як відомо у даній галузі техніки. Неочікувано, Заявник виявив, що нові 1-бензил-3-гідроксиметиліндазольні похідні можуть бути використані для одержання фармацевтичної композиції, яка є активною у випадку хвороб, основаних на експресії хемокіну MCP-1, субодиниці p40, та відповідно цитокінів IL-12 та IL-23, та рецептору CX3CR1. Таким чином, у додатковому аспекті, даний винахід відноситься до застосування сполуки формули (I) R2 R1 Y A O R8 O N N R6 R3 R7 R5 25 30 35 40 45 R4 (I) у якій: A може являти собою -X1- або -X1-OC(R9)(R10)-, у якій X1 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, яка необов'язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 5 атомів вуглецю або однієї або більшої кількості алкокси груп, що мають від 1 до 3 атомів вуглецю, та R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкокси групу, що має від 1 до 3 атомів вуглецю, Y може являти собою N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2-CO-X3, де R11 може являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, або R 11 разом з R12 утворює 4- - 7-членний гетероцикл, R12 може являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, арильну групу, гетероарильну групу, алкіларильну групу, алкілгетероарильну групу, COR", COOR", CON(R")(R"), де R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, або R12 разом з R11, утворює 4- - 7-членний гетероцикл, R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю або алкокси групу, що має від 1 до 3 атомів вуглецю, R14 може являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, арильну групу, гетероарильну групу, алкіларильну групу, алкілгетероарильну групу, COR", COOR", CON(R")(R"), де R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, X2 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, яка необов'язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 5 атомів 5 UA 103605 C2 5 10 15 20 25 вуглецю або однієї або більшої кількості алкокси груп, що мають від 1 до 3 атомів вуглецю, X3 може являти собою OH, NH2, NHOH або NHNH2, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкокси групу, що має від 1 до 3 атомів вуглецю, R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R")(R"), -N(R")COR", -CN, -CONR'R", -SO2NR'R", SO2R", нітрогрупу та трифторметил; причому R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R5 може являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R")(R"), -N(R")COR", нітрогрупу та трифторметил, або R5 разом з одним з R6 та R7 утворює кільце, що має 5 або 6 атомів вуглецю; причому R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, та R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю, для одержання фармацевтичної композиції для лікування хвороб, основаних на експресії MCP-1, CX3CR1 та p40. Крім того, у додатковому аспекті, даний винахід відноситься до способу лікування або профілактики хвороб, основаних на експресії MCP-1, CX3CR1 та p40, що характеризується введенням пацієнту, який цього потребує, ефективної кількості сполуки формули (I), як описано вище. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ 30 35 40 45 50 55 60 Переважно, у формулі (I) описаній вище, залишок A представлений групою X 1 або X1OC(R9)(R10), де X1 являє собою алкільну групу, що має від 1 до 3 атомів вуглецю, необов'язково заміщену за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 3 атомів вуглецю, або однієї або більшої кількості алкокси груп, що мають 1 або 2 атомів вуглецю, та R 9 та R10, які можуть бути однаковими або відрізнятися один від іншого, являють собою водень, алкільну групу, що має від 1 до 3 атомів вуглецю, або алкокси групу, що має 1 або 2 атоми вуглецю. Більш переважно, залишок A представлений групою X 1 або X1-OC(R9)(R10), де X1 являє собою групу CH2, групу CH2CH2 або групу C(CH3)2, та R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, являють собою водень або CH3 групу. Здебільшого залишок A вибирають з групи, що включає групу CH 2, групу CH2CH2, групу C(CH3)2, групу CH2CH2OCH2, групу CH2CH2 °C(CH3)2 та групу CH2CH2CH2 °C(CH3)2. Переважно, у формулі (I) описаній вище, залишок Y представлений групою N(R 11)(R12), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15) або N(R13)-X2-CO-X3. Більш переважно, у формулі (I) описаній вище, залишок Y представлений групою N(R11)(R12), N(R13)N(R14)(R15) або N(R13)-X2-N(R14)(R15). Здебільшого, R11 представлений атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, алкокси групою, що має 1 або 2 атоми вуглецю, або R 11 разом з R12 утворюють 5- або 6-членний гетероцикл. Більш переважно, R11 представлений атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, або R11 разом з R12 утворюють 5- або 6-членний гетероцикл. Здебільшого, R12 представлений атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, алкокси групою, що має 1 або 2 атоми вуглецю, гетероарильною групою, алкіларильною групою, алкілгетероарильною групою, CON(R")(R"), де R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені воднем та алкільною групою, що має від 1 до 3 атомів вуглецю, або R12 разом з R11 утворюють 5- або 6- членний гетероцикл. Більш переважно, R12 представлений атомом водню, алкільною групою, що має 1 або 2 атоми вуглецю, алкокси групою, що має 1 або 2 атоми вуглецю, гетероарильною групою, CON(R")(R"), де R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені воднем та алкільною групою, що має від 1 до 3 атомів вуглецю, або R 12 разом з R11 утворює 5- або 6- членний гетероцикл. Переважно, R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, 6 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 представлені атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю або алкокси групою, що має 1 або 2 атоми вуглецю. Більш переважно, R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню, алкільною групою, що має 1 або 2 атоми вуглецю, або алкокси групою, що має 1 або 2 атоми вуглецю. Переважно, R14 представлений атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, арильною групою, гетероарильною групою, алкіларильною групою, алкілгетероарильною групою, COR", COOR", CON(R")(R"), де R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені воднем та алкільною групою, що має від 1 до 3 атомів вуглецю. Більш переважно, R14 представлений атомом водню, алкільною групою, що має 1 або 2 атоми вуглецю, арильною групою або CON(R")(R"), де R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені воднем та алкільною групою, що має від 1 до 3 атомів вуглецю. Здебільшого, X2 представлений алкільною групою, що має від 1 до 3 атомів вуглецю, яка необов'язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 3 атомів вуглецю або однієї або більшої кількості алкокси груп, що мають 1 або 2 атоми вуглецю. Здебільшого, X3 представлений групами OH, NH2, NHOH або NHNH2. Переважно, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, або алкокси групою, що має 1 або 2 атоми вуглецю. Переважно, R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, алкокси групою, що має 1 або 2 атоми вуглецю, атомом Br, Cl або F, OH групою, нітро групою, трифторметильною групою або групою N(R")(R") або N(R")COR"; -CN, -CONR'R", -SO2NR'R", SO2R", причому R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомомводню та алкільною групою, що має від 1 до 3 атомів вуглецю. Здебільшого, R5 представлений атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, алкокси групою, що має 1 або 2 атоми вуглецю, атомом галогену, OH групою, або R 5, разом з одним з R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю. Переважно, R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, або разом утворюють групу C=O, або один з R 6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю. У випадку певних замісників, сполука формули (I) відповідно до даного винаходу може мати асиметричний атом вуглецю та тому може бути у формі стереоізомерів та енантіомерів. В залежності від природи замісників, сполука формули (I) може утворювати солі приєднання з фізіологічно прийнятними органічними або неорганічними кислотами або основами. Типові приклади підходящих фізіологічно прийнятних неорганічних кислот включають соляну кислоту, бромистоводневу кислоту, сірчану кислоту, фосфорну кислоту та азотну кислоту. Типові приклади підходящих фізіологічно прийнятних органічних кислот включають оцтову кислоту, аскорбінову кислоту, бензойну кислоту, лимонну кислоту, фумарову кислоту, молочну кислоту, малеїнову кислоту, метансульфонову кислоту, щавлеву кислоту, паратолуолсульфонову кислоту, бензолсульфонову кислоту, бурштинову кислоту, дубильну кислоту та винну кислоту. Типові приклади підходящих фізіологічно прийнятних неорганічних основ включають гідроксиди, карбонати та гідрокарбонати амонію, кальцію, магнію, натрію та калію, наприклад, гідроксид амонію, гідроксид кальцію, карбонат магнію, гідрокарбонат натрію та гідрокарбонат калію. Типові приклади підходящих фізіологічно прийнятних органічних основ включають: аргінін, бетаїн, кофеїн, холін, N, N-дибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, N-етилпіперидин, Nметилглюкамін, глюкамін, глюкозамін, гістидин, N-(2-гідроксиетил)піперидин, N-(2гідроксиетил)піролідин, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, теобромін, триетиламін, триметиламін, трипропіламін та трометамін. В залежності від природи замісників, сполука формули (I) може утворювати складні ефіри з фізіологічно прийнятними органічними кислотами або основами. Сполуки даного винаходу також включають проліки, стереоізомери, енантіомери та 7 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично прийнятні солі або складні ефіри сполук, представлених формулою (I), описаною у пунктах Формули винаходу. Проліки сполуки формули (I) являють собою речовину по суті у неактивній формі, яка, при введенні живій істоті, метаболізується у сполуку формули (I). Терміни "фармацевтично прийнятний" та "фізіологічно прийнятний", як передбачають, позначають, без будь-якого певного обмеження, будь-який матеріал, прийнятний для одержання фармацевтичної композиції для введення живій істоті. Сполуки відповідно до формули (I) даного винаходу можуть бути використані для одержання фармацевтичної композиції, яка є активною у лікуванні хвороб (або патологій), основаних на експресії хемокіну MCP-1, цитокіну p40, субодиниці p40 (залученої у вироблення цитокінів IL-12 та IL-23) та рецептору CX3CR1. Переважно, патології, пов'язані з експресією MCP-1 та CX3CR1, являють собою хвороби суглобів, хвороби нирок, серцево-судинні хвороби, метаболічний синдром, ожиріння, діабет, резистентність до інсуліну та рак. Зокрема, патології, пов'язані з експресією MCP-1, являють собою такі як: ревматоїдний артрит, артрит, викликаний вірусними інфекціями, псоріатичний артрит, артроз, вовчаковий нефрит, діабетична нефропатія, гломерулонефрит, полікистозна хвороба нирок, інтерстиціальна легенева хвороба, фіброз, розсіяний склероз, хвороба Альцгеймера, пов'язана з ВІЛ деменція, атопічний дерматит, псоріаз, васкуліт, рестеноз, атеросклероз, інфаркт міокарда, стенокардія, гострі коронарні хвороби, аденоми, карциноми та метастази, метаболічні хвороби та ускладнення після хірургічних втручань, таких як, наприклад, пластична операція на судинах, артеректомія, процедури поновлення кровообігу, трансплантації, заміни органів, заміни тканин та протезування. Зокрема, патології, пов'язані з експресією CX3CR1, являють собою такі як: ревматоїдний артрит, вовчаковий нефрит, діабетична нефропатія, хвороба Крона, виразковий коліт, коронарні хвороби серця, рестеноз, атеросклероз, інфаркт міокарда, стенокардія, та ускладнення після хірургічних втручань, таких як, наприклад, пластична операція на судинах, артеректомія та процедури поновлення кровообігу. Переважно, патології, пов'язані з експресією p40, та патології, пов'язані з експресією IL-12 та IL-23, являють собою такі як: аутоімунні хвороби, такі як хронічні дегенеративні запальні хвороби та рак. Зокрема, патології, пов'язані з експресією p40, являють собою такі як: ревматоїдний артрит, псоріаз, гломерулонефрит, діабет, червоний вовчак, діабет, хвороба Крона, та пухлини, такі як, наприклад, карциноми товстої кишки, карциноми молочної залози, карциноми легені та карциноми передміхурової залози, та шкіри та неоплазії ЦНС. Переважно, фармацевтичні композиції даного винаходу одержують у прийнятних дозованих формах, що включають ефективну дозу щонайменше однієї сполуки формули (I), або її фармацевтично прийнятної солі, складного ефіру або проліків, та щонайменше один фармацевтично прийнятний носій. Приклади фармацевтично прийнятних носіїв, відомих з попереднього рівня техніки, включають, наприклад, гліданти, зв'язуючі речовини, дезінтегранти, наповнювачі, розріджувачі, ароматизатори, барвники, флюідизатори, любриканти, консерванти, гігроскопічні речовини, абсорбенти та підсолоджувачі. Приклади придатних фармацевтично прийнятних наповнювачів включають цукри, такі як лактоза, глюкоза або сахароза, крохмалі, такі як кукурудзяний крохмаль та картопляний крохмаль, целюлозу та її похідні, наприклад, карбоксиметилцелюлоза натрію, етилцелюлоза та ацетат целюлози, трагакантова камедь, солод, желатин, тальк, масло какао, воски, масла, такі як арахісове масло, бавовняне масло, соняшникове масло, кунжутне масло, оливкове масло, кукурудзяне масло та соєве масло, гліколі, такі як пропіленгліколь, поліоли, такі як гліцерин, сорбіт, маніт та поліетиленгліколь, складні ефіри, такі як етилолеат та етиллаурат, агар-агар та подібні. Приклади прийнятних дозованих форм включають таблетки, капсули, покриті таблетки, гранули, розчини та сиропи для перорального введення; лікарські пластирі, розчини, пасти, креми та мазі для трансдермального введення; супозиторії для ректального введення та стерильні розчини для ін'єкційного або аерозольного введення. Інші прийнятні дозовані форми включають форми уповільненого вивільнення та форми на основі ліпосом, або для перорального або ін'єкційного шляху. Дозовані форми також можуть містити інші звичайно використовувані інгредієнти, такі як: консерванти, стабілізатори, поверхнево-активні речовини, буфери, регулятори осмотичного тиску, емульгатори, підсолоджувачі, барвники, ароматизатори та подібні. 8 UA 103605 C2 5 10 15 20 25 30 Коли необхідно для певних видів терапії, фармацевтична композиція даного винаходу може містити інші фармакологічно активні інгредієнти, одночасне введення яких є корисним. Кількість сполуки формули (I) або її фармацевтично прийнятної солі, складного ефіру або проліків у фармацевтичній композиції даного винаходу може змінюватися у широкому інтервалі як функція відомих факторів, наприклад, таких як тип патології, яку необхідно лікувати, серйозність хвороби, маса тіла пацієнта, дозована форма, вибраний шлях введення, кількість введень на день та ефективність вибраної сполуки формули (I). Однак, оптимальна кількість може бути визначена просто та у плановому порядку спеціалістом, кваліфікованим у даній галуі техніки. Як правило, кількість сполуки формули (I) або її фармацевтично прийнятної солі, складного ефіру або проліків у фармацевтичній композиції даного винаходу буде такою, що забезпечує рівень введення від 0,001 до 100 мг/кг/день. Переважно, рівень введення становить від 0,05 до 50 мг/кг/день та навіть більш переважно від 0,1 до 10 мг/кг/день. Дозовані форми фармацевтичної композиції даного винаходу можуть бути одержані відповідно до технологій, які добре відомі хімікам - фармацевтам, включаючи змішування, гранулювання, пресування, розчинення, стерилізацію та подібні. Активність сполук даного винаходу на MCP-1 та CX3CR1 показана in vitro у моноцитах людини за допомогою технологій аналізу генної експресії з РЧ-ПЛР (RT-PCR) "у реальному часі" та шляхом аналізу білкового вироблення за допомогою імуноферментного тесту. Як відомо спеціалістам у даній галузі техніки, описані вище експериментальні моделі вважаються корисними для перевірки активності сполук відносно експресії та вироблення MCP-1 та експресії CX3CR1. Отже, описані вище моделі можуть вважатися прогнозуючими активність у людини для лікування патологій, що характеризуються експресією та виробленням MCP-1, експресією CX3CR1 та запальними станами з присутністю інфільтратів, у яких багато моноцитів та макрофагів. Активність сполук даного винаходу на p40 показана in vitro у моноцитах людини за допомогою технологій аналізу генної експресії з РЧ-ПЛР (RT-PCR) "у реальному часі". Як відомо спеціалістам у даній галузі техніки, описані вище експериментальні моделі вважаються корисними для перевірки активності сполук відносно експресії p40 та можуть вважатися прогнозуючими активність у людини для лікування патологій, що характеризуються експресією p40. Одержання сполук загальної формули (I) може бути проведене відповідно до однієї з наступних процедур. Спосіб A: R1 R2 R2 R1 O OH R8 Q N A O R8 Y N R6 R6 R3 R7 35 40 45 O N N (III) Y A (IV) R5 R3 R7 R5 R4 R4 (I) У способі A, сполуки загальної формули (III) вводять у реакцію зі сполуками формули (IV). Замісники R1-R8, A та Y приймають значення, представлені вище для сполук формули (I) та Q показує відхідну групу, вибрану з групи, що включає галоген, CH3SO3- та п-CH3PhSO3-. Спосіб A проводять відповідно до звичайно використовуваних способів. Наприклад, спирти формули (III) вводять у реакцію, відповідно, з похідними формули (IV), у яких Q являє собою відхідну групу, вибрану з групи, яка включає атом хлору, атом брому та метансульфонільну групу. Зазначену реакцію проводять у присутності підходящої основи та у придатному розчиннику. Основи, які переважно можуть бути використані, включають NaH, бутиллітій та діізопропіламін літію, тоді як розчинники, які є прийнятними для цього типу реакції являють собою переважно полярні апротонні розчинники, такі як тетрагідрофуран, діетиловий ефір або 1,4-діоксан. Температура реакції переважно становить від кімнатної температури до температури зрошення використовуваного розчинника. Реакції цього типу можуть тривати від декількох годин до декількох днів. Спосіб B: 9 UA 103605 C2 R1 R2 R2 R1 O Q R8 HO N A O R8 Y N R6 R6 R3 R7 5 10 15 R5 R5 A O R8 R2 OT R1 O N R8 HY (X) R6 R3 R7 35 O N N R6 (IX) Y A O N 30 (I) R4 У способі B, сполуки загальної формули (V) вводять у реакцію зі сполуками формули (VI). Замісники R1-R8, A та Y приймають значення, представлені вище для сполук формули (I) та Q показує відхідну групу, вибрану з групи, що включає галоген, CH 3SO3- та п-CH3PhSO3-. Спосіб B проводять відповідно до звичайно використовуваних способів. Наприклад, спирти формули (VI) вводять у реакцію, відповідно, з похідними формули (V), у яких Q являє собою відхідну групу, переважно вибрану з групи, яка включає атом хлору, атом брому та метансульфонільну групу. Зазначену реакцію проводять у присутності підходящої основи та у придатному розчиннику. Основи, які переважно можуть бути використані, включають NaH, бутиллітій та діізопропіламін літію, тоді як розчинники, які є прийнятними для цього типу реакції являють собою переважно полярні апротонні розчинники, такі як тетрагідрофуран, діетиловий ефір або 1,4-діоксан. Температура реакції переважно становить від кімнатної температури до температури зрошення використовуваного розчиннику. Реакції цього типу можуть тривати від декількох годин до декількох днів. Спосіб C: R2 25 R3 R7 R4 R1 20 O N N (V) Y A (VI) R5 R3 R7 R5 R4 R4 (I) У способі C, продукти загальної формули (IX) вводять у реакцію з продуктами загальної формули (X). Замісники R1-R8, A та Y приймають значення, представлені вище для сполук формули (I) та T може являти собою водень або алкільну групу. Спосіб C проводять відповідно до звичайно використовуваних методик. Коли T являє собою водень, спосіб залучає застосування прийнятного агента для активації карбонової кислоти, такого як тіонілхлорид, та апротонніого розчинника. Переважно, використовувані розчинники являють собою толуол, тетрагідрофуран та дихлорметан. Реакція може бути проведена у присутності основи, яка може бути органічною, такою як триетиламін або діізопропілетиламін, або неорганічною, такою як метоксид натрію. Переважно, реакцію проводять при температурах від 0 °C до температури зрошення використовуваного розчиннику. Час реакції в основному становить від 1 до 24 годин. Коли T являє собою алкільну групу, спосіб залучає застосування прийнятної неорганічної основи, такої як метоксид натрію або NaOH та надлишку аміну загальної формули (X). Загалом реакція може бути проведена з використанням прийнятного апротонного розчинника, переважно толуолу або діоксану або того самого реакційного аміну (X), якщо його фізичний стан робить це можливим. Переважно, реакцію проводять при температурах вище кімнатної, з тривалістю від декількох годин до декількох днів. Наступні приклади призначені для ілюстрації даного винаходу, однак, не обмежуючи його будь-яким способом. Препаративні приклади Сполуки формули (I), представлені у Таблиці A нижче, одержують, використовуючи способи, описані вище. 10 UA 103605 C2 ТАБЛИЦЯ A № 9 10 11 12 13 14 A C(CH3)2 “ “ “ “ “ 15 “ 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 5 10 15 20 25 “ „ “ “ “ “ “ “ “ “ CH2 “ C(CH3)2CH2 °C(CH3)2 C(CH3)2CH2OCH2 “ “ CH2CH2 °C(CH3)2 CH2CH2CH2 °C(CH3)2 CH2CH2CH2OCH2 “ CH2CH2OCH2 “ “ Групи R 1 2 3 H H H “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ 5 H “ “ “ “ “ 6 H “ “ “ “ “ 7 H “ “ “ “ “ H “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ NH2 NHOH NHNH2 NHNHCONH2 NH(CH2)2N(CH3)2 NH-(2-піридин) NH-[1-(4-CH3)піперазин] NHCH2COOH NH-NH-Ph N-морфолін NH2 “ “ NHOH “ “ “ “ NH2 “ “ NHOH “ “ “ “ NH2 “ NHOH NHNH2 H “ “ “ “ “ “ Y “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ п-Cl п-Cl H п-OCH3 H “ п-OCH3 H “ “ “ п-OCH3 H “ “ “ “ “ “ “ “ “ “ “ м-Cl H “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ CO (CH2)3 H H “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ 4 H “ “ “ “ “ “ “ “ “ “ “ “ “ 8 5-OCH3 H “ 5-CN 5-CN H H “ 5-CONH2 H “ “ “ “ “ “ “ “ “ “ Деталі одержання більшості сполук Таблиці A представлені у цьому описі нижче. Решту сполук одержують за відповідними способами, використовуючи придатні вихідні продукти та реагенти. Одержання сполуки 9 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанамід 9a) метил 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропаноат Суспензію 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанової кислоти (20 г; 0,062 моль) [отриманої як описано у патентній заявці EP 382 276] в метанолі (300 мл) обробляють при 0 °C газоподібним HCl впродовж 4 годин. Потім суміш виливають у воду (500 мл) і продукт екстрагують діетиловим ефіром (3×250 мл). Об'єднані органічні фази промивають за допомогою 5 % розчину бікарбонату натрію (2×100 мл) та потім водою (50 мл). Розчинник випарюють при зниженому тиску та сирий залишок очищують кристалізацією з гексану. Отримують 18,5 г метил 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропаноату. Температура плавлення = 66°-67 °C 1 H-ЯМР (CDCl3, ppm): 1,56 (s, 6 H), 3,77 (s, 3 H), 4,87 (s, 2 H), 5,54 (s, 2 H), 7,0-7,4 (m, 8 H), 8,03 (d, J=7,61 Гц, 1 H). 9b) 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанамід Розчин метил 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанової кислоти (15 г; 0,044 моль) в метанолі (250 мл) переміщуваний при кімнатній температурі був оброблений газоподібним NH3 впродовж 48 годин. Після цього розчинник упарюють при зниженому тиску та сирий залишок очищують кристалізацією з етилацетату. Отримують 7,3 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанаміду. 11 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 Температура плавлення = 111°-112 °C 1 H-ЯМР (CDCl3, ppm): 1,58 (s, 6 H), 4,88 (s, 2 H), 5,57 (s, 2 H), 5,64 (bs, 1 H), 6,94 (bs, 1 H), 7,08-7,43 (m, 8 H), 7,77 (d, J=8,04 Гц, 1 H). Одержання сполуки 10 2-[(1-бензил-1H-індазол-3-іл)метокси]-N-гідрокси-2-метилпропанамід 10a) метил 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропаноат Суспензію 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанової кислоти (20 г; 0,062 моль) в метанолі (300 мл) обробляють при 0 °C газоподібним HCl впродовж 4 годин. Потім суміш виливають у воду (500 мл) і продукт екстрагують діетиловим ефіром (3×250 мл). Об'єднані органічні фази промивають за допомогою 5 % розчину бікарбонату натрію (2×100 мл) та потім водою (50 мл). Розчинник випарюють при зниженому тиску та сирий залишок очищують кристалізацією з гексану. Таким чином отримують 18,5 г метил 2-[(1-бензил-1H-індазол-3-іл)метокси]-2метилпропанової кислоти. Температура плавлення = 66°-67 °C 1 H-ЯМР (CDCl3, ppm): 1,56 (s, 6 H), 3,77 (s, 3 H), 4,87 (s, 2 H), 5,54 (s, 2 H), 7,0-7,4 (m, 8 H), 8,03 (d, J=7,61 Гц, 1 H). 10b) 2-[(1-бензил-1H-індазол-3-іл)метокси]-N-гідрокси-2-метилпропанамід Розчин KOH (9,7 g, 0,173 моль) в метанолі (25 мл) додають при кімнатній температурі до розчину гідроксиламіну гідрохлориду (8,0 г, 0,115 моль) в метанолі (45 мл). Отриману суміш перемішують при 0 °C впродовж 30 хвилин і фільтрують, а розчин додають до розчину метил 2[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанової кислоти (19 г, 0,057 моль) в метанолі (30 мл) та CHCl3 (15 мл). Суміш перемішують при кімнатній температурі впродовж 72 годин. Реакцію зупиняють шляхом упарювання розчинника при зниженому тиску та промивають залишок, перенесений в воді (100 мл) діетиловим ефіром (3×50 мл). Водну фазу підкислюють за допомогою 2N HCl і продукт екстрагують діетиловим ефіром (3×100 мл). ПІсля цього органічну фазу концентрують при зниженому тиску та отриманий сирий залишок очищують подвійною кристалізацією з суміші 1/1 гексан/етилацетат. Отримують 6 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-N-гідрокси-2-метилпропанаміду. Температура плавлення = 115°-116 °C 1 H-ЯМР (CDCl3, ppm): 1,58 (s, 6 H), 4,87 (s, 2 H), 5,57 (s, 2 H), 7,12-7,41 (m, 8 H), 8,10 (bs, 1 H), 7,72 (d, J=8,09 Гц, 1 H), 10,05 (bs, 1 H). Одержання сполуки 11 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанoгідразид До розчину 1M гідразингідрату(100 мл, 0,100 моль) перемішуваного при 80 °C додають порціями метил 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропаноат (20 г, 0,060 моль). Після закінчення додавання, суміш перемішують упродовж 30 хвилин при тій самій температурі та потім нагрівають при 120 °C впродовж 2 годин. Реакцію зупиняють шляхом розведення суміші водою (600 мл) та екстрагують продукт діетиловим ефіром (4×200 мл). Після цього, об'єднані органічні фази екстрагують за допомогою 2N HCl (4×200 мл). Тоді кислотну фазу доводять до основного pH за допомогою 10N NaOH та знову екстрагують діетиловим ефіром (4×200 мл). Об'єднані органічні фази концентрують при зниженому тиску та сирий залишок очищують кристалізацією з суміші 1/1 гексан/етилацетат. 16 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанoгідразид отримують. температура плавлення = 92°-93 °C 1 H-ЯМР (ДМСО-d6, ppm): 1,41 (s, 6 H), 4,30 (s, 2 H), 4,73 (s, 2 H), 5,62 (s, 2 H), 7,15 (ddd, J=8,00; 6,98; 0,80 Гц, 1 H), 7,20-7,34 (m, 5 H), 7,38 (ddd, J=8,37; 6,98; 1,17 Гц, 1 H), 7,66 (d, J=8,48 Гц, 1 H), 7,90 (dt, J=8,11; 0,91 Гц, 1 H), 8,84 (s, 1 H). Одержання сполуки 12 2-{2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанoїл}гідразинкарбоксамід До розчину 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанoгідразиду (7,0 г, 0,021 моль) у воді (100 мл) та 3N HCl (15 мл), який перемішують при кімнатній температурі, повільно додають розчин KOCN (1,8 г, 0,022 моль) у воді (30 мл). Суміш перемішують при тій самій температурі впродовж 30 хвилин, а потім реакцію зупиняють шляхом фільтрування, таким чином одержуючи тверду речовину. Виділену тверду речовину кристалізують з 95° етанолу. Отримують 6,0 г 2-{2-[(1-бензил-1H-індазол-3-іл)метокси]-2метилпропанoїл}гідразинкарбоксаміду. Температура плавлення = 174°-175 °C 1 H-ЯМР (ДМСО-d6, ppm): 1,43 (s, 6 H), 4,80 (s, 2 H), 5,62 (s, 2 H), 5,90 (s, 2 H), 7,14 (t, J=7,45 Гц, 1 H), 7,20-7,43 (m, 6 H), 7,66 (d, J=8,48 Гц, 1 H), 7,77 (s, 1 H), 7,96 (d, J=8,04 Гц, 1 H), 12 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 9,37 (s, 1 H). Одержання сполуки 13 2-[(1-бензил-1H-індазол-3-іл)метокси]-N-[2-(диметиламіно)етил]-2-метилпропанамід гідрохлорид До розчину 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанової кислоти, отриманої, як описано у EP 382 276 (19,5 г, 0,060 моль), у толуолі (150 мл), який перемішують при кімнатній температурі, додають триетиламін (8,4 мл, 0,060 моль). Потім суміш охолоджують до 0 °C та додають розчин етилхлорформіату (7,0 мл, 0,073 моль) у толуолі (30 мл). Після закінчення додавання, суміш перемішують при тій самій температурі впродовж 30 хвилин, а потім додають N, N-диметилетан-1,2-діамін (7,0 мл, 0,064 моль) розчинений у толуолі (30 мл). Після закінчення додавання, суміш перемішують при кімнатній температурі впродовж 24 годин. Потім суміш розбавляють діетиловим ефіром (500 мл) та екстрагують 1N HCl (4×150 мл). Комбіновані кислотні водні фази промивають діетиловим ефіром (3×50 мл), а потім доводять до основного pH за допомогою 10N NaOH та знову екстрагують діетиловим ефіром (4×150 мл). Після цього органічну фазу промивають водою (2×50 мл) та насиченим розчином NaCl (2×50 мл). Потім розчин висушують безводним Na2SO4 та після цього розчинник упарюють при зниженому тиску. Одержаний залишок розчиняють в етилацетаті (150 мл) та обробляють при кімнатній температурі за допомогою розчину HCl в етанолі (приблизно 5N). Утворену таким чином тверду речовину відфільтровують та очищують кристалізацією з суміші 9/1 етилацетат/етанол. Отримують 12,1 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-N-[2-(диметиламіно)етил]-2метилпропанаміду гідрохлориду. Температура плавлення = 136°-137 °C 1 H-ЯМР (CDCl3, ppm): 1,54 (s, 6 H), 2,75 (d, J=4,76 Гц, 6 H), 3,01-3,13 (m, 2 H), 3,69 (q, J=6,46 Гц, 2 H), 4,87 (s, 2 H), 5,61 (s, 2 H), 7,13-7,41 (m, 8 H), 7,69 (t, J=5,85 Гц, 1 H), 7,80 (d, J=8,05 Гц, 1 H), 12,68 (bs, 1 H). Одержання сполуки 14 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метил-N-пірид-2-илпропанамід 8 г (0,024 моль) 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанової кислоти обробляють при кімнатній температурі за допомогою 30 % метоксиду натрію (4,33 мл, 0,024 моль) впродовж 5 хвилин. Після цього розчинник упарюють при зниженому тиску та одержаний залишок суспендують у толуолі (160 мл), з послідуючим додаванням, при кімнатній температурі, 2-амінопіридину (6,8 г, 0,072 моль). До цієї суміші, яку перемішують при кімнатній температурі, повільно додають розчин тіонілхлориду (2,1 мл, 0,029 моль) у толуолі (40 мл). Після закінчення додавання, суміш перемішують упродовж 24 годин. Одержаний розчин фільтрують та розчинник випарюють при зниженому тиску. Отриманий сирий залишок очищують кристалізацією з ізопропанолу. 3 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метил-N-пірид-2-илпропанамід отримують. Температура плавлення = 121°-122 °C 1 H-ЯМР (CDCl3, ppm): 1,65 (s, 6 H), 4,97 (s, 2 H), 5,60 (s, 2 H), 6,98-7,04 (m, 1 H), 7,15 (ddd, J=8,04; 5,77; 2,12 Гц, 1 H), 7,20-7,37 (m, 7 H), 7,64-7,73 (m, 1 H), 7,84 (d, J=8,18 Гц, 1 H), 8,22-8,27 (m, 2 H), 9,32 (bs, 1 H). Одержання сполуки 15 1-бензил-3-{[1,1-диметил-2-(4-метилпіперазин-1-іл)-2-оксоетокси]метил}-1H-індазол 50 мл 1-метилпіперазину (0,452 моль) обробляють при кімнатній температурі за допомогою метанольного розчину30 % метоксиду натрію (9 мл, 0,045 моль) в метанолі (5 мл). До розчину, який перемішують при кімнатній температурі, додають метил 2-[(1-бензил-1H-індазол-3іл)метокси]-2-метилпропанову кислоту (15 г, 0,045 моль). Суміш перемішують при зрошенні впродовж 18 годин. Реакцію зупиняють шляхом виливання суміші у воду (500 мл) та екстрагують продукт діетиловим ефіром (3×150 мл). Об'єднані органічні фази екстрагують 3N HCl (3×100 мл). Тоді кислотну фазу доводять до основного pH за допомогою 10N NaOH та екстрагують діетиловим ефіром (3×150 мл). Об'єднані органічні фази концентрують при зниженому тиску. Одержаний залишок очищують кристалізацією з суміші 1/3 гексан/етилацетат. Таким чином отримують 6 г 1-бензил-3-{[1,1-диметил-2-(4-метилпіперазин-1-іл)-2оксоетокси]метил}-1H-індазолу. Температура плавлення = 97°-98 °C 1 H-ЯМР (CDCl3, ppm): 1,60 (s, 6 H), 2,21 (s, 3 H), 2,24-2,47 (m, 4 H), 3,47-4,16 (m, 4 H), 4,82 (s, 2 H), 5,56 (s, 2 H), 7,09-7,38 (m, 8 H), 7,76 (d, J=8,18 Гц, 1 H). Одержання сполуки 26 N-{2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанoїл}гліцин 4,17 г гліцин-етилового естеру (0,040 моль) обробляють при кімнатній температурі розчином 13 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 30 % метоксиду натрію в метанолі (0,46 мл), а після цього розчинник упарюють при зниженому тиску. Одержаний залишок додають до розчину 2-[(1-бензил-1H-індазол-3-іл)метокси]-2метилпропанової кислоти (10 г, 0,04 моль) в дихлорметані (ДХМ) (100 мл) при перемішуванні за кімнатної температури. Потім суміш охолоджують до 0 °C, та додають до неї розчин N, N’дициклогексилкарбодііміду (6,73 г, 0,033 моль) в ДХМ (25 мл). Суміш перемішують при кімнатній температурі впродовж 24 годин. Реакцію зупиняють відфільтровуванням утвореної, таким чином, твердої речовини та упарюванням розчинника при зниженому тиску. Сирий залишок очищають шляхом флеш хроматографії на силікагелі, використовуючи як елюент суміш 1/1 гексан/етилацетат. Отриманий продукт суспендують у воді (100 мл) та додають до нього NaOH (1,28 г, 0,032 моль). Суміш перемішують при 50 °C впродовж 16 годин, а потім охолоджують та підкислюють концентрованою HCl. Отриману, таким чином, тверду речовину очищують кристалізацією з етанолу. Отримують 5,2 г N-{2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанoїл}гліцину. Температура плавлення = 157°-158 °C 1 H-ЯМР (CDCl3, ppm): 1,55 (s, 6 H), 3,95 (d, J=5,74 Гц, 2 H), 4,89 (s, 2 H), 5,52 (s, 2 H), 7,07,4 (m, 8 H), 7,6 (bt, 1 H), 7,77 (d, J=7,82 Гц, 1 H), 10,38 (bs, 1 H). Одержання сполуки 27 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метил-N’-фенілпропанoгідразид 24 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанової кислоти (0,074 моль) обробляють при кімнатній температурі розчином 30 % метоксиду натрію в метанолі (13 мл, 0,074 моль) упродовж 10 хвилин. Після цього розчинник упарюють при зниженому тиску і залишок суспендують у толуолі (240 мл), та додають до нього фенілгідразин (29,1 мл, 0,296 моль). До цієї суміші, яку продовжують перемішувати при тій самій температурі, повільно додають розчин тіонілхлориду (6,3 мл, 0,088 моль) у толуолі (50 мл). Після закінчення додавання, суміш перемішують упродовж 24 годин. Сформовану тверду речовину фільтрують та розчинник випарюють при зниженому тиску. Сирий залишок промивають за допомогою гексану (3×100 мл) та суміші 10/1 гексан/етилацетат (30 мл). Отриманий сирий залишок очищують шляхом послідовних кристалізацій з ізопропанолу. Отримують 11 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метил-N’-фенілпропанoгідразиду. Температура плавлення = 124°-125 °C 1 H-ЯМР (CDCl3, ppm): 1,61 (s, 2 H), 4,94 (s, 2 H), 5,53 (s, 2 H), 6,10 (bd, J=4,70 Гц, 1 H), 6,77,0 (m, 3 H), 7,1-7,4 (m, 13 H), 7,78 (dt, J1, J2=7,78; 1,19 Гц, 1 H), 8,99 (bd, J=4,70 Гц, 1 H). Одержання сполуки 28 1-бензил-3-[(1,1-диметил-2-морфолін-4-іл-2-оксоетокси)метил]-1H-індазол 72 г (0,222 моль) 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропанової кислоти обробляють при кімнатній температурі за допомогою метанольного розчину30 % метоксиду натрію (39 мл; 0,222 моль) впродовж 10 хвилин. Після цього розчинник упарюють при зниженому тиску та одержаний залишок суспендують у безводному толуолі (750 мл). До цієї суспензії, яку перемішують при кімнатній температурі, додають морфолін (77,6 мл; 0,888 моль) з наступним повільним додаванням розчину тіонілхлориду (19,3 мл; 0,266 моль) у толуолі (150 мл). Суміш перемішують впродовж 24 годин, а потім реакцію зупиняють відфільтровуванням утвореної, таким чином, твердої речовини. Розчин концентрують при зниженому тиску та отриманий сирий залишок очищують кристалізацією з ізопропанолу. Таким чином отримують 14 г 1-бензил-3-[(1,1-диметил-2-морфолін-4-іл-2-оксоетокси)метил]1H-індазолу. Температура плавлення = 135°-137 °C 1 H-ЯМР (ДМСО-d6, ppm): 1,47 (s, 6 H), 3,1-4,0 (2bs, 8 H), 4,73 (s, 2 H), 5,83 (s, 2 H), 7,0-7,9 (m, 9 H). Одержання сполуки 29 2-[(1-бензил-5-метокси-1H-індазол-3-іл)метокси]-2-метилпропанамід 29a) бензил 1-бензил-5-метокси-1H-індазол-3-карбоксилат Суспензію 5-метокси-1H-індазол-3-карбонової кислоти (21,5 г; 0,11 моль) та 60 % NaH (10,5 г; 0,44 моль) в N, N-диметилформаміді (ДМФА) (200 мл) перемішують при 70 °C впродовж 1 години. Потім до цієї суспензії повільно додають бензилхлорид (32,9 г; 0,26 моль), суміш перемішують при 70 °C впродовж 4 годин. Реакцію зупиняють шляхом охолодження суміші до кімнатної температури та виливання суміші у воду з льодом. Продукт екстрагують етилацетатом (3×250 мл). Об'єднані органічні фази концентрують при зниженому тиску. Отриманий таким чином сирий залишок очищують шляхом послідовних кристалізацій з 95° етанолу, що приводить 14 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 до одержання 18 г бензил 1-бензил-5-метокси-1H-індазол-3-карбоксилату з температурою плавлення 107-109 °C. 1 H-ЯМР (CDCl3, ppm): 3,78 (s, 3 H), 5,51 (s, 2 H), 6,9-7,6 (m, 13 H). 29b) (1-бензил-5-метокси-1H-індазол-3-іл)метанол До розчину бензил 1-бензил-5-метокси-1H-індазол-3-карбоксилату (17,7 г; 0,05 моль), діетилового ефіру (100 мл) та тетрагідрофурану (ТГФ) (170 мл), який перемішують при кімнатній температурі, повільно додають LiAlH4 (3,8 г; 0,1 моль). Після закінчення додавання, цю суспензію перемішують при зрошенні впродовж 24 годин. Реакцію зупиняють руйнуванням надлишку LiAlH4 за домопогою додавання води (40 мл) та 5N NaOH (10 мл). Органічну фазу відділяють та розчинник випарюють при зниженому тиску. Отриманий сирий залишок очищують кристалізацією з 95° етанолу, що приводить до одержання 14 г (1-бензил-5-метокси-1H-індазол3-іл)метанолу з температурою плавлення 97-98 °C. 1 H-ЯМР (CDCl3, ppm): 3,3 (bs, 1 H), 3,80 (s, 3 H), 4,92 (s, 2 H), 5,47 (s, 2 H), 6,9-7,5 (m, 8 H). 29c) 1-бензил-3-(хлорметил)-5-метокси-1H-індазол До розчину (1-бензил-5-метокси-1H-індазол-3-іл)метанолу (18 г; 0,07 моль) у хлороформі (200 мл), який перемішують при кімнатній температурі, повільно додають тіонілхлорид (15,8 г; 0,13 моль). Після закінчення додавання, розчин нагрівають при зрошенні впродовж 24 годин. Потім реакцію зупиняють шляхом охолодження суміші до кімнатної температури та випарювання розчинника при зниженому тиску. Залишок декілька разів переносять у толуолі та концентрують при зниженому тиску. Отриманий сирий залишок очищують кристалізацією з гексану, що приводить до одержання 9,5 г 1-бензил-3-(хлорметил)-5метокси-1H-індазол з температурою плавлення 78-80 °C. 1 H-ЯМР (CDCl3, ppm): 3,85 (s, 3 H), 4,97 (s, 2 H), 5,51 (s, 2 H), 6,9-7,4 (m, 8 H). 29d) 2-[(1-бензил-5-метокси-1H-індазол-3-іл)метокси]-2-метилпропанова кислота До розчину, що містить 1-бензил-3-(хлорметил)-5-метокси-1H-індазол (2,95 г; 0,01 моль) та етил 3-гідрокси-3-метилбутаноат (1,98 г; 0,015 моль) в ДМФА (30 мл), який перемішують при кімнатній температурі, повільно додають 60 % NaH (0,36 г; 0,015 моль). Потім суміш нагрівають при 40 °C впродовж 24 годин. Реакцію зупиняють шляхом охолодження цієї суспензії до кімнатної температури та додавання води (200 мл). Розчинник випарюють при зниженому тиску, а залишок обробляють при зрошенні за допомогою NaOH (0,84 г; 0,021 моль) у воді (6 мл) та 95° етанолу (6 мл) впродовж 6 годин. Потім суміш охолоджують до кімнатної температури та розбавляють водою (50 мл). Лужну фазу промивають діетиловим ефіром (2×20 мл), а потім підкислюють концентрованою HCl та екстрагують діетиловим ефіром (3×30 мл). Об'єднані органічні фази концентрують при зниженому тиску й отриманий сирий залишок очищують кристалізацією з суміші 10/1 гексан/етилацетат, що приводить до одержання 0,8 г 2[(1-бензил-5-метокси-1H-індазол-3-іл)метокси]-2-метилпропанової кислоти з температурою плавлення 128-130 °C. 1 H-ЯМР (ДМСО-d6, ppm): 1,44 (s, 6 H), 3,77 (s, 3 H), 4,69 (s, 2 H), 5,55 (s, 2 H), 7,02 (dd, J=9,15; 2,38 Гц, 1 H), 7,17-7,33 (m, 5 H), 7,41 (d, J=2,38 Гц, 1 H), 7,55 (d, J=9,15 Гц, 1 H), 12,79 (s, 1 H). 29e) 2-[(1-бензил-5-метокси-1H-індазол-3-іл)метокси]-2-метилпропанамід Цей продукт отримують, застосовуючи процедуру, описану для одержання сполуки 9, використовуючи 2-[(1-бензил-5-метокси-1H-індазол-3-іл)метокси]-2-метилпропанову кислоту, як вихідний реагент. Одержання сполуки 30 2-{[1-(4-хлорбензил)-1H-індазол-3-іл]метокси}-2-метилпропанамід 30a) [1-(4-хлорбензил)-1H-індазол-3-іл]метанол До суспензії 60 % NaH (2,7 г; 0,07 моль) у толуолі (200 мл) додають 1-бензил-3гідроксиметиліндазол (10 г; 0,07 моль). Суміш доводять до температури кипіння та залишають перемішуватися при зрошенні впродовж 1 години. Потім додають 4-хлорбензилхлорид (14,4 г; 0,09 моль). Після цього, суміш перемішують при зрошенні впродовж 4 годин. Реакцію зупиняють шляхом охолодження суміші до кімнатної температури та додавання води (50 мл). Органічну фазу відділяють та промивають, відповідно, за допомогою 2N HCl (50 мл) та води (5×50 мл). Розчинник випарюють при зниженому тиску. Отриманий таким чином сирий залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи як елюент суміш 3/1 гексан/етилацетат. Отриманий продукт кристалізують з суміші 5/1 гексан/етилацетат, що приводить до одержання 4,4 г [1-(4-хлорбензил)-1H-індазол-3-іл]метанолу. Температура плавлення = 102°-104 °C 1 H-ЯМР (CDCl3, ppm): 3,5 (bs, 1 H), 5,01 (s, 2 H), 5,37 (s, 2 H), 6,8-7,5 (m, 7 H), 7,81 (d, J=7,82 Гц, 1 H). 15 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 30b) 2-{[1-(4-хлорбензил)-1H-індазол-3-іл]метокси}-2-метилпропанова кислота До суспензії NaOH (15,6 г; 0,39 моль) у ацетоні (50 мл) додають [1-(4-хлорбензил)-1Hіндазол-3-іл]метанол (9,1 г; 0,03 моль). До цієї суміші повільно додають розчин хлороформу (7,2 мл; 0,09 моль) та ацетон (7,2 мл; 0,1 моль). Додавання викликає зрошення суміші розчинників. Після закінчення додавання, суміш нагрівають при зрошенні впродовж 1 години. Реакцію зупиняють шляхом охолодження суміші до кімнатної температури та випарювання розчинника при зниженому тиску. Отриманий сирий залишок переносять у толуолі (100 мл) та воді (50 мл). Водну фазу відділяють від органічної фази, а потім промивають за допомогою толуолу (2×50 мл). Об'єднані органічні фази екстрагують водою (3×50 мл). Об'єднані водні фази промивають за допомогою гексану (2×30 мл), а потім підкислюють за допомогою 2N HCl та перемішують при кімнатній температурі. Отриману таким чином тверду речовину відфільтровують та кристалізують спочатку з суміші 5/1 вода/оцтова кислота, а потім з толуолу, що приводить до одержання 4,0 г 2-{[1-(4-хлорбензил)-1H-індазол-3-іл]метокси}-2-метилпропанової кислоти. Температура плавлення = 186°-188 °C. 1 H-ЯМР (CDCl3, ppm): 1,61 (s, 6 H), 4,91 (s, 2 H), 5,54 (s, 2 H), 7,0-7,5 (m, 7 H), 8,07 (s, 1 H), 10,3 (bs, 1 H). 30c) 2-{[1-(4-хлорбензил)-1H-індазол-3-іл]метокси}-2-метилпропанамід Цей продукт отримують, застосовуючи процедуру, описану для одержання сполуки 9, використовуючи 2-{[1-(4-хлорбензил)-1H-індазол-3-іл]метокси}-2-метилпропанову кислоту, як вихідний реагент. Одержання сполуки 31 2-{[1-(3,4-дихлорбензил)-1H-індазол-3-іл]метокси}-2-метилпропанамід 31a) [1-(3,4-дихлорбензил)-1H-індазол-3-іл]метанол Цей продукт отримують за допомогою способу, описаного у Прикладі 30a), використовуючи 3,4-хлорбензилхлорид як реагент. Отриманий продукт очищують кристалізацією з суміші 1/1 гексан/етилацетат. Температура плавлення = 118°-120 °C 1 H-ЯМР (CDCl3, ppm): 3,1-3,3 (m, 1 H), 4,9-5,2 (m, 2 H), 5,38 (s, 2 H), 6,89 (dd, J1, J2=8,27; 2,05 Гц, 1 H), 7,1-7,5 (m, 5 H), 7,82 (dt, J1, J2=8,01; 0,93, 1 H). 31b) 2-{[1-(3,4-дихлорбензил)-1H-індазол-3-іл]метокси}-2-метилпропанова кислота Цей продукт отримують за допомогою способу, описаного у Прикладі 30b), використовуючи [1-(3,4-дихлорбензил)-1H-індазол-3-іл]метанол як вихідний реагент. Отриманий продукт очищують кристалізацією з толуолу. Температура плавлення = 174°-176 °C 1 H-ЯМР (ДМСО-d6, ppm): 1,44 (s, 6 H), 4,76 (s, 2 H), 5,64 (s, 2 H), 7,12-7,22 (m, 2 H), 7,41 (t, J=7,68 Гц, 1 H), 7,54 (d, J=2,01 Гц, 1 H), 7,58 (d, J=8,42 Гц, 1 H), 7,72 (d, J=8,42 Гц, 1 H), 7,95 (d, J=8,05 Гц, 1 H), 12,81 (bs, 1 H). 31c) 2-{[1-(3,4-дихлорбензил)-1H-індазол-3-іл]метокси}-2-метилпропанамід Цей продукт отримують, застосовуючи процедуру, описану для одержання сполуки 9, використовуючи 2-{[1-(3,4-дихлорбензил)-1H-індазол-3-іл]метокси}-2-метилпропанову кислоту, як вихідний реагент. Одержання сполуки 34 2-[(1-бензоїл-1H-індазол-3-іл)метокси]-N-гідрокси-2-метилпропанамід 34a) (1-тритиліндазол-3-іл)метанол До розчину, що містить ізобутил 1H-індазол-3-карбоксилат (280 г; 1,28 моль) у хлороформі (2 л), який перемішують при кімнатній температурі додають триетиламін (300 мл; 2,16 моль) та трифенілхлорметан (400 г; 1,4 моль). Розчин перемішують при кімнатній температурі впродовж 4 днів, а потім додають воду (500 мл). Органічну фазу відділяють та концентрують при зниженому тиску. Отриманий сирий залишок використовують без додаткового очищення у наступній стадії. До розчину сирого ізобутил 1-тритиліндазол-3-карбоксилату (180 г; 0,39 моль) в ТГФ (1 л), який перемішують при кімнатній температурі, повільно додають суспензію LiAlH4 (18 г; 0,48 моль) в ТГФ (100 мл). Після закінчення додавання, суміш перемішують при кімнатній температурі впродовж 30 хвилин, а потім реакцію зупиняють шляхом охолодження суміші до 0 °C та послідовного додавання води (40 мл), 2N NaOH (40 мл) та води (60 мл). Утворену таким чином тверду речовину відфільтровують та розчин концентрують при зниженому тиску. Отриманий сирий залишок очищують кристалізацією з суміші 1/1 гексан/етилацетат. Отримують 120 г (1-тритиліндазол-3-іл)метанолу. Температура плавлення = 192°-193 °C 1 H-ЯМР (CDCl3; ppm): 2,51 (t, J=6,98 Гц, 1 H), 4,90 (d, J=6,98 Гц, 2 H), 6,2-6,5 (m, 1 H), 6,9 16 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 7,4 (m, 17 H), 7,6-7,8 (m, 1 H). 34b) 2-(1-тритиліндазол-3-ілметокси)-2-метилпропанова кислота До суспензії (1-тритиліндазол-3-іл)метанолу (78 г; 0,20 моль), ацетону (260 мл) та води (0,5 мл), яку перемішують при кімнатній температурі, додають NaOH (76 г; 1,9 моль) і, повільно, суміш 1/1 хлороформ/ацетон (100 мл). Реакція є екзотермічною і швидкість додавання регулюють таким чином, щоб температура реакції була наближеною до температури кипіння. Через 30 хвилин після закінчення додавання, реакцію зупиняють шляхом охолодження суміші до кімнатної температури та випарювання розчинника при зниженому тиску. Залишок переносять у воду (500 мл) та промивають діетиловим ефіром (3×100 мл). Потім водну фазу підкислюють концентрованою HCl і продукт екстрагують толуолом (3×250 мл). Об'єднані органічні фази концентрують при зниженому тиску та отриманий сирий залишок очищують кристалізацією з суміші 3/7 гексан/етилацетат, що приводить до одержання 22 г 2-(1тритиліндазол-3-ілметокси)-2-метилпропанової кислоти. Температура плавлення = 179°-180 °C. 1 H-ЯМР (CDCl3, ppm): 1,53 (s, 6 H), 4,88 (s, 2 H), 6,3-6,5 (m, 1 H), 6,9-7,5 (m, 17 H), 7,8-8,0 (m, 1 H), 9,3 (bs, 1 H). 34c) 2-(1H-індазол-3-ілметокси)-2-метилпропанова кислота До розчину 2-(1-тритиліндазол-3-ілметокси)-2-метилпропанової кислоти (83 г; 0,174 моль) в дихлорметані (ДХМ) (900 мл), який перемішують при кімнатній температурі, додають паратолуолсульфонову кислоту (ПТСК) (50 г; 0,29 моль). Суміш перемішують впродовж 30 хвилин при кімнатній температурі, а потім виливають у 5N NaOH (400 мл). Органічну фазу відділяють та промивають водою (300 мл). Об'єднані водні фази підкислюють концентрованою HCl та потім екстрагують етилацетатом (5×300 мл). Об'єднані органічні фази випарюють при зниженому тиску і отриманий сирий залишок очищують кристалізацією з суміші 1/1 гексан/етилацетат. Отримують 42 г 2-(1H-індазол-3-ілметокси)-2-метилпропанової кислоти. Температура плавлення = 135°-137 °C. 1 H-ЯМР (ДМСО-d6, ppm): 1,46 (s, 6 H), 4,77 (s, 2 H), 7,0-7,6 (m, 3 H), 7,94 (d, J=7,88 Гц, 1 H). 34d) 2-[(1-бензоїл-1H-індазол-3-іл)метокси]-2-метилпропанова кислота До розчину 2-(1H-індазол-3-ілметокси)-2-метилпропанової кислоти (6 г; 0,026 моль) у ацетоні (50 мл), який перемішують при кімнатній температурі, додають K 2CO3 (6,8 г; 0,049 моль), а потім, повільно, розчин бензоїлхлориду (5 мл; 0,043 моль) у ацетоні (30 мл). Суміш перемішують при кімнатній температурі впродовж 24 годин, а потім виливають у воду (1 л). Після цього розчин доводять до основного pH за допомогою 5N NaOH та промивають діетиловим ефіром (3×150 мл). Потім лужну фазу підкислюють концентрованою HCl та екстрагують діетиловим ефіром (3×300 мл). Об'єднані органічні фази концентрують при зниженому тиску і отриманий сирий залишок очищують кристалізацією з суміші 1/1 гексан/етилацетат. Отримують 2 г 2-[(1-бензоїл-1H-індазол-3-іл)метокси]-2-метилпропанової кислоти. Температура плавлення = 132°-135 °C. 1 H-ЯМР (CDCl3, ppm): 1,61 (s, 6 H), 4,93 (s, 2 H), 7,41 (t, J=7,60 Гц, 1 H), 7,46-7,66 (m, 4 H), 8,02-8,09 (m, 3 H), 8. 68 (bs, 1 H), 8,53 (d, J=8,42 Гц, 1 H). 34e) 2-[(1-бензоїл-1H-індазол-3-іл)метокси]-N-гідрокси-2-метилпропанамід Цей продукт отримують, застосовуючи процедуру, описану для одержання сполуки 10, використовуючи 2-[(1-бензоїл-1H-індазол-3-іл)метокси]-2-метилпропанову кислоту, як вихідний реагент. Таким чином, отримують 0,34 г 2-[(1-бензоїл-1H-індазол-3-іл)метокси]-N-гідрокси-2метилпропанамід. Одержання сполуки 35 2-{[1-(1,2,3,4-тетрагідронафт-1-ил)-1H-індазол-3-іл]метокси}-N-гідрокси-2-метилпропанамід 35a) 2-метил-2-{[1-(1,2,3,4-тетрагідронафт-1-ил)-1H-індазол-3-іл]метокси}-пропанова кислота До розчину 2-метил-2-[(1H-індазол-3-іл)метокси]пропанової кислоти (26 г; 0,093 моль) в ДМФА (200 мл) додають 60 % NaH (10 г; 0,25 моль) і суміш перемішують впродовж 10 хвилин при 60 °C. Потім додають до цієї суміші 1-хлор-1,2,3,4-тетрагідронафталін (0,217 моль) і всю суміш перемішують при 60 °C впродовж 18 годин. Реакцію зупиняють шляхом виливання суміші у воду (1 л), що супроводжують підкислюванням за допомогою 5 N HCl, та екстрагують продукт діетиловим ефіром (3×250 мл). Одержаний залишок розчиняють в 95° етанолі (100 мл) і обробляють при зрошенні 1N NaOH (200 мл) впродовж 2 годин. Потім розчин охолоджують до кімнатної температури та промивають діетиловим ефіром (3×200 мл). Після цього лужну фазу підкислюють концентрованою HCl та екстрагують етилацетатом (3×300 мл). Об'єднані органічні 17 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 фази концентрують при зниженому тиску, і отриманий сирий залишок очищують кристалізацією з етилацетату. 31 г 2-метил-2-{[1-(1,2,3,4-тетрагідронафт-1-ил)-1H-індазол-3-іл]метокси}-пропанова кислота таким чином отримують. Температура плавлення = 132°-134 °C 1 H-ЯМР (CDCl3, ppm): 1,60 (d, J=2,15 Гц, 6 H), 1,84-2,02 (m, 1 H), 2,03-2,18 (m, 1 H), 2,232,46 (m, 2 H), 2,90 (dt, J=16,50; 4,85 Гц, 1 H), 2,98-3,12 (m, 1 H), 4,95 (s, 2 H), 5,92 (dd, J=8,83; 6,52 Гц, 1 H), 6,71 (d, J=7,76 Гц, 1 H), 6,93-7,05 (m, 2 H), 7,08-7,32 (m, 4 H), 7,85 (d, J=8,09 Гц, 1 H). 35b) 2-{[1-(1,2,3,4-тетрагідронафт-1-ил)-1H-індазол-3-іл]метокси}-N-гідрокси-2метилпропанамід. Продукт одержують застосовуючи аналогічну процедуру, описаній для одержання сполуки 10, використовуючи 2-метил-2-{[1-(1,2,3,4-тетрагідронафт-1-ил)-1H-індазол-3-іл]метокси}пропанову кислоту, як вихідний матеріал. Одержання сполуки 36 {[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-N-гідроксиацетамід 36a) [1-(4-метоксибензил)-1H-індазол-3-іл]метанол До суспензії 60 % NaH (2,7 г; 0,07 моль) у толуолі (200 мл) додають 1-бензил-3гідроксиметиліндазол (10 г; 0,07 моль). Суміш доводять до температури кипіння та залишають перемішуватися при зрошенні впродовж 1 години. Потім додають 4-метоксибензилхлорид (14 г; 0,09 моль). Після цього суміш перемішують при зрошенні впродовж 4 годин. Реакцію зупиняють шляхом охолодження суміші до кімнатної температури та додавання води (50 мл). Органічну фазу відділяють та промивають, відповідно, за допомогою 2N HCl (50 мл) та води (5×50 мл). Розчинник випарюють при зниженому тиску. Отриманий, таким чином, сирий залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи як елюент суміш 3/2 гексан/етилацетат. Отриманий продукт кристалізують з суміші 5/1 гексан/етилацетат, що приводить до одержання 5,1 г [1-(4-метоксибензил)-1H-індазол-3-іл]метанолу з температурою плавлення 95-97 °C. 1 H-ЯМР (CDCl3, ppm): 3,43 (t, J=6,9 Гц, 1 H), 3,67 (s, 3 H), 4,98 (d, J=6,9 Гц, 2 H), 5,36 (s, 2 H), 6,5-6,8 (m, 2 H), 6,9-7,4 (m, 7 H), 7,80 (d, J=7,86 Гц, 1 H). 36b) {[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}оцтова кислота Суспензію, що містить [1-(4-метоксибензил)-1H-індазол-3-іл]метанол (6 г; 0,022 моль), бромоцтову кислоту (4 г; 0,03 моль) та 50 % NaH (3 г; 0,066 моль) в ТГФ (170 мл) перемішують при зрошенні впродовж 72 годин. Потім реакцію зупиняють розведенням суспензією води та льоду (300 мл) та промивають водну фазу діетиловим ефіром (3×150 мл). Водну фазу підкислюють концентрованою HCl. Утворену таким чином тверду речовину відфільтровують та очищують кристалізацією з ізопропанолу. Таким чином отримують 4,5 г {[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}оцтової кислоти. 36c) {[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-N-гідроксиацетамід Продукт одержують відповідно до способу, описаного для одержання сполуки 10, використовуючи {[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}оцтову кислоту, як вихідний матеріал. Одержання сполуки 39 {2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропокси}ацетамід 39a) 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропан-1-ол До суспензії LiAlH4 (4,48 г; 0,118 моль) в діетиловому ефірі (100 мл), яку перемішують при кімнатній температурі, повільно додають розчин метил 2-[(1-бензил-1H-індазол-3іл)метокси]-2-метилпропаноату, одержаного відповідно до способу, описаного в EP 0 382 276, (20 г; 0,06 моль) в діетиловому ефірі (200 мл) та ТГФ (50 мл). Після закінчення додавання, суміш перемішують при кімнатній температурі впродовж 30 хвилин та реакцію закінчують шляхом додавання 10 N NaOH (20 мл) та води (40 мл). Розчинник випарюють при зниженому тиску, а маслянистий залишок очищають перегонкою при 0,01 ммHg та 190 °C. Таким чином одержану тверду речовину кристалізують з ізопропанолу. Отримують 11 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропан-1-олу. Температура плавлення = 52°-53 °C 1 H-ЯМР (CDCl3, ppm): 1,34 (s, 6 H), 2,50 (bs, 1 H), 3,51 (s, 2 H), 4,87 (s, 2 H), 5,55 (s, 2 H), 7,14 (ddd, J=8,04; 6,21; 1,68 Гц, 1 H), 7,17-7,38 (m, 7 H), 7,78 (dt, J=8,08; 1,00 Гц, 1 H). 39b) {2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропокси}оцтова кислота До розчину 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропан-1-олу (11,0 г, 0,04 моль) у 18 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 сухому тетрагідрофурані (ТГФ) (100 мл), який перемішують при кімнатній температурі, додають 60 % гідриду натрію (1,6 г, 0,04 моль). Суміш нагрівають при температурі кипіння впродовж 2 годин, а потім охолоджують до кімнатної температури, і до нього повільно додають розчин етилбромацетату (7,4 г, 0,044 моль) в ТГФ (7 мл). Після закінчення додавання, суміш нагрівають при зрошенні впродовж додаткових 2 годин. Реакцію зупиняють охолодженням до кімнатної температури та випарювання розчинника при зниженому тиску. Залишок переносять в 2N NaOH (100 мл), і продукт екстрагують діетиловим ефіром (3×150 мл). Об'єднані органічні фази концентрують при зниженому тиску. Сирий залишок переносять в розчин NaOH (1,9 г, 0,045 моль) в суміші 1/1 вода/етанол (160 мл). Після цього суміш перемішують при зрошенні впродовж 2 годин. Реакцію зупиняють шляхом упарювання розчинника при зниженому тиску, та залишок переносять у воду (100 мл) та промивають діетиловим ефіром (3×50 мл). Після цього лужну фазу підкислюють концентрованою HCl та сформовану тверду речовину відфільтровують. Продукт очищують подвійною кристалізацією з суміші 1/2 гексан/етилацетат. Таким чином отримують 4,6 г {2-[(1-бензил-1H-індазол-3-іл)метокси]-2метилпропокси}оцтової кислоти. 39c) {2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропокси}ацетамід Цей продукт отримують, застосовуючи процедуру, описану для одержання сполуки 9, використовуючи {2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропокси}оцтову кислоту, як вихідний реагент. Одержання сполуки 40 {2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропокси}-N-гідрокси-ацетамід Цей продукт отримують, застосовуючи процедуру, описану для одержання сполуки 10, використовуючи {2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропокси}оцтову кислоту, як вихідний реагент. Одержання сполуки 41 (2-{[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-2-метилпропокси)-N-гідрокси-ацетамід 41a) [1-(4-метоксибензил)-1H-індазол-3-іл]метанол До суспензії 60 % NaH (2,7 г; 0,07 моль) у толуолі (200 мл) додають 1-бензил-3гідроксиметиліндазол (10 г; 0,07 моль). Суміш доводять до температури кипіння та залишають перемішуватися при зрошенні впродовж 1 години. Потім додають 4-метоксибензилхлорид (14 г; 0,09 моль). Після цього, суміш перемішують при зрошенні впродовж 4 годин. Реакцію зупиняють шляхом охолодження суміші до кімнатної температури та додавання води (50 мл). Органічну фазу відділяють та промивають, відповідно, за допомогою 2N HCl (50 мл) та води (5×50 мл). Розчинник випарюють при зниженому тиску. Отриманий, таким чином, сирий залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи як елюент суміш 3/2 гексан/етилацетат. Отриманий продукт кристалізують з суміші 5/1 гексан/етилацетат, що приводить до одержання 5,1 г [1-(4-метоксибензил)-1H-індазол-3-іл]метанолу з температурою плавлення 95-97 °C. 1 H-ЯМР (CDCl3, ppm): 3,43 (t, J=6,9 Гц, 1 H), 3,67 (s, 3 H), 4,98 (d, J=6,9 Гц, 2 H), 5,36 (s, 2 H), 6,5-6,8 (m, 2 H), 6,9-7,4 (m, 7 H), 7,80 (d, J=7,86 Гц, 1 H). 41b) 2-{[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-2-метилпропанова кислота До суспензії NaOH (15,6 г; 0,39 моль) у ацетоні (50 мл) додають [1-(4-метоксибензил)-1Hіндазол-3-іл]метанол (8,7 г; 0,03 моль). До цієї суміші повільно додають розчин хлороформу (7,2 мл; 0,09 моль) та ацетону (7,2 мл; 0,1 моль). Додавання викликає зрошення суміші розчинників. Після закінчення додавання, суміш нагрівають при зрошенні впродовж 1 години. Реакцію зупиняють шляхом охолодження суміші до кімнатної температури та випарювання розчинника при зниженому тиску. Отриманий сирий залишок переносять у толуол (100 мл) та воду (50 мл). Водну фазу відділяють від органічної фази та промивають толуолом (2×50 мл). Об'єднані органічні фази екстрагують водою (3×50 мл). Об'єднані водні фази промивають за допомогою гексану (2×30 мл), а потім підкислюють за допомогою 2N HCl та перемішують при кімнатній температурі. Отриману, таким чином, тверду речовину відфільтровують та кристалізують спочатку з суміші 5/1 вода/оцтова кислота, а потім з толуолу, що приводить до одержання 4,8 г 2-{[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-2-метилпропанової кислоти з температурою плавлення 169-171 °C. 1 H-ЯМР (ДМСО-d6, ppm): 1,44 (s, 6 H), 3,69 (s, 3 H), 4,74 (s, 2 H), 5,52 (s, 2 H), 6,82-6,90 (m, 2 H), 7,13 (t, J=7,50 Гц, 1 H), 7,18-7,26 (m, 2 H), 7,36 (t, J=7,23 Гц, 1 H), 7,66 (d, J=8,42 Гц, 1 H), 7,92 (dd, J=8,14; 1,01 Гц, 1 H), 12,76 (s, 1 H). 41c) 2-{[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-2-метилпропан-1-ол Продукт одержують відповідно до способу, описаного для одержання сполуки 39a, 19 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовуючи 2-{[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-2-метилпропанову кислоту, як вихідний матеріал. 41d) (2-{[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-2-метилпропокси)оцтова кислота Продукт одержують відповідно до способу, описаного для одержання сполуки 39b, використовуючи 2-{[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-2-метилпропан-1-ол, як вихідний матеріал. 41e) (2-{[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-2-метилпропокси)-N-гідроксиацетамід Продукт одержують відповідно до способу, описаного для одержання сполуки 10, використовуючи (2-{[1-(4-метоксибензил)-1H-індазол-3-іл]метокси}-2-метилпропокси)оцтову кислоту, як вихідний матеріал. Одержання сполуки 42 2-{2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}-N-гідрокси-2-метилпропанамід 42a) 2-[(1-бензил-1H-індазол-3-іл)метокси]етанол До розчину NaOH (2,8 г; 0,07 моль) в етиленгліколі (150 мл), який перемішують при кімнатній температурі, додають 1-бензил-3-хлорметиліндазол, отриманий як описано у EP 0 382 276 (17,6 г; 0,07 моль). Цей розчин нагрівають при 130 °C впродовж 4 годин, а потім охолоджують до кімнатної температури та розчинник випарюють при зниженому тиску. Залишок переносять у воду (100 мл) і продукт екстрагують етилацетатом (3×100 мл). Об'єднані органічні фази концентрують при зниженому тиску та отриманий сирий залишок очищують кристалізацією з приблизно суміші 1/1 гексан/етилацетат. Таким чином отримують 13,8 г 2-[(1-бензил-1H-індазол-3-іл)метокси]етанолу. Температура плавлення = 67°-69 °C 1 H-ЯМР (CDCl3, ppm): 2,15 (bs, 1 H), 3,61-3,82 (m, 4 H), 4,97 (s, 2 H), 5,57 (s, 2 H), 7,11-7,38 (m, 8 H), 7,81 (dt, J=8,15; 0,97 Гц, 1 H). 42b) 2-{2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}-2-метилпропанова кислота До суміші 2-[(1-бензил-1H-індазол-3-іл)метокси]етанолу (35 г, 0,124 моль) та NaOH (63 г, 1,57 моль) у ацетоні (180 мл) та води (1 мл), яку перемішують при кімнатній температурі, повільно додають суміш 1/1 хлороформ/ацетон (80 мл). Під час додавання, температура зростає до точки зрошення. Після закінчення додавання, розчинник випарюють при зниженому тиску та залишок переносять у воду (100 мл) та промивають діетиловим ефіром (3×50 мл). Водну фазу підкислюють льодяною оцтовою кислотою, а потім екстрагують діетиловим ефіром (3×150 мл). Об'єднані органічні фази концентрують при зниженому тиску. Отриманий сирий залишок очищують кристалізацією з суміші 1/1 гексан/етилацетат. Отримують 12,4 г 2-{2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}-2-метилпропанової кислоти. Температура плавлення = 94°-95 °C 1 H-ЯМР (CDCl3, ppm): 1,43 (s, 6 H), 3,56-3,63 (m, 2 H), 3,65-3,71 (m, 2 H), 5,03 (s, 2 H), 5,58 (s, 2 H), 7,13-7,39 (m, 8 H), 7,83 (dt, J=8,05; 0,82 Гц, 1 H), 9,60 (bs, 1 H). 42c) 2-{2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}-N-гідрокси-2-метилпропанамід Продукт одержують відповідно до способу, описаного для одержання сполуки 34e), використовуючи 2-{2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}-2-метилпропанову кислоту, як вихідний матеріал. Одержання сполуки 43 2-{3-[(1-бензил-1H-індазол-3-іл)метокси]пропокси}-N-гідрокси-2-метилпропанамід 43a) 3-[(1-бензил-1H-індазол-3-іл)метокси]пропан-1-ол До розчину NaOH (2,8 г; 0,07 моль) в 1,3-пропандіолі (150 мл), який перемішують при кімнатній температурі, додають 1-бензил-3-хлорметиліндазол, отриманий як описано у EP 0 382 276 (17,6 г; 0,07 моль). Цей розчин нагрівають при 130 °C впродовж 4 годин, а потім охолоджують до кімнатної температури, та розчинник випарюють при зниженому тиску. Залишок переносять у воду (100 мл) і продукт екстрагують етилацетатом (3×100 мл). Об'єднані органічні фази концентрують при зниженому тиску та отриманий сирий залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи, як елюент приблизно 1/1 суміш гексан/етилацетат. Таким чином отримують 10,5 г 3-[(1-бензил-1H-індазол-3-іл)метокси]пропан-1-олу. 1 H-ЯМР (CDCl3, ppm): 1,85 (q, J=5,83 Гц, 2 H), 2,75 (bs, 1 H), 3,71 (t, J=7,74 Гц, 4 H), 4,91 (s, 2 H), 5,55 (s, 2 H), 7,0-7,4 (m, 8 H), 7,80 (d, J=7,77 Гц, 1 H). 43b) 2-{3-[(1-бензил-1H-індазол-3-іл)метокси]пропокси}-2-метил-пропанова кислота Цей продукт отримують за допомогою способу, описаного у Прикладі 42b), використовуючи, як вихідний матеріал 3-[(1-бензил-1H-індазол-3-іл)метокси]пропан-1-ол. Продукт очищують 20 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 подвійною кристалізацією з суміші 7/3 гексан/етилацетат. Температура плавлення = 57°-59 °C 1 H-ЯМР (ДМСО-d6, ppm): 1,25 (s, 6 H), 1,72 (quint., J=6,40 Гц, 2 H), 3,37 (t, J=6,40 Гц, 2 H), 3,53 (t, J=6,40 Гц, 2 H), 4,77 (s, 2 H), 5,62 (s, 2 H), 7,14 (ddd, J=8,00; 7,00; 0,73 Гц, 1 H), 7,19-7,33 (m, 5 H), 7,38 (ddd, J=8,37; 7,00; 0,91 Гц, 1 H), 7,66 (d, J=8,42 Гц, 1 H), 7,79 (dt, J=8,05; 0,91 Гц, 1 H), 12,46 (s, 1 H). 43c) 2-{3-[(1-бензил-1H-індазол-3-іл)метокси]пропокси}-N-гідрокси-2-метилпропанамід Продукт одержують відповідно до способу, описаного для одержання сполуки 10, використовуючи 2-{3-[(1-бензил-1H-індазол-3-іл)метокси]пропокси}-2-метилпропанову кислоту, як вихідний матеріал. Одержання сполуки 46 {2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}ацетамід 46a) 2-[(1-бензил-1H-індазол-3-іл)метокси]етанол До розчину NaOH (2,8 г; 0,07 моль) в етиленгліколі (150 мл) перемішують при кімнатній температурі додають 1-бензил-3-хлорметиліндазол, отриманий як описано у EP 0 382 276 (17,6 г; 0,07 моль). Цей розчин нагрівають при 130 °C впродовж 4 годин, а потім охолоджують до кімнатної температури та розчинник випарюють при зниженому тиску. Залишок переносять у воду (100 мл) і продукт екстрагують етилацетатом (3×100 мл). Об'єднані органічні фази концентрують при зниженому тиску та отриманий сирий залишок очищують кристалізацією з приблизно 1/1 гексан/етилацетат суміш. 13,8 г 2-[(1-бензил-1H-індазол-3-іл)метокси]етанол таким чином отримують. Температура плавлення = 67°-69 °C 1 H-ЯМР (CDCl3, ppm): 2,15 (bs, 1 H), 3,61-3,82 (m, 4 H), 4,97 (s, 2 H), 5,57 (s, 2 H), 7,11-7,38 (m, 8 H), 7,81 (dt, J=8,15; 0,97 Гц, 1 H). 46b) {2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}оцтову кислоту До розчину 2-[(1-бензил-1H-індазол-3-іл)метокси]етанолу (11,28 г, 0,04 моль) у сухому тетрагідрофурані (ТГФ) (100 мл), який перемішують при кімнатній температурі, додають 60 % гідриду натрію (1,6 г, 0,04 моль). Суміш нагрівають при температурі кипіння впродовж 2 годин, а потім охолоджують до кімнатної температури, та повільно додають до неї розчин етилбромацетату (7,4 г, 0,044 моль) в ТГФ (7 мл). Після закінчення додавання, суміш нагрівають при зрошенні впродовж додаткових 2 годин. Реакцію зупиняють охолодженням до кімнатної температури та випарювання розчинника при зниженому тиску. Залишок переносять в 2N NaOH (100 мл) і продукт екстрагують діетиловим ефіром (3×150 мл). Об'єднані органічні фази концентрують при зниженому тиску. Сирий залишок переносять в розчин NaOH (1,9 г, 0,045 моль) у суміші 1/1 вода/етанол (160 мл). Після цього суміш перемішують при зрошенні впродовж 2 годин. Реакцію зупиняють шляхом упарювання розчинника при зниженому тиску, та залишок переносять у воду (100 мл) та промивають діетиловим ефіром (3×50 мл). Після цього лужну фазу підкислюють концентрованою HCl та сформовану тверду речовину відфільтровують. Продукт очищують подвійною кристалізацією з суміші 1/3 гексан/етилацетат. Отримують 5,8 г {2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}оцтової кислоти. Температура плавлення = 101°-103 °C 1 H-ЯМР (CDCl3, ppm): 3,66-3,79 (m, 4H), 4,13 (s, 2 H), 5,01 (s, 2 H), 5,58 (s, 2 H), 7,66 (bs, 1 H), 7,14-7,40 (m, 8 H), 7,84 (dt, J=8,11; 0,99 Гц, 1 H). 46c) {2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}ацетамід Продукт одержують відповідно до способу, описаного для одержання сполуки 9, використовуючи {2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}оцтову кислоту, як вихідний матеріал. Одержання сполуки 47 {2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}-N-гідрокси-ацетамід Продукт одержують відповідно до способу, описаного для одержання сполуки 10 використовуючи {2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}оцтову кислоту, як вихідний матеріал. Одержання сполуки 48 {2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}-ацетогідразид Суспензію {2-[(1-бензил-1H-індазол-3-іл)метокси]етокси}оцтової кислоти (19 г; 0,06 моль) в метанолі (300 мл) обробляють при 0 °C газоподібним HCl впродовж 4 годин. Потім суміш виливають у воду (500 мл) і продукт екстрагують діетиловим ефіром (3×250 мл). Об'єднані органічні фази промивають за допомогою 5 % розчину бікарбонату натрію (2×100 мл), а потім водою (50 мл). Розчинник випарюють при зниженому тиску та сирий залишок очищують 21 UA 103605 C2 5 10 15 20 25 30 35 кристалізацією з гексану. Таким чином, отримують 16 г метил 2-[(1-бензоїл-1H-індазол-3іл)метокси]-ацетату. До розчину 1M гідразингідрату (100 мл, 0,100 моль), який перемішують при 80 °C порціями додають метил 2-[(1-бензил-1H-індазол-3-іл)метокси]-ацетат (19 г, 0,06 моль). Після закінчення додавання, суміш перемішують впродовж 30 хвилин при тій самій температурі, а потім нагрівають при 120 °C впродовж 2 годин. Реакцію зупиняють шляхом розведення суміші водою (600 мл) та екстрагують продукт діетиловим ефіром (4×200 мл). Після цього, об'єднані органічні фази екстрагують за допомогою 2N HCl (4×200 мл). Тоді кислотну фазу доводять до основного pH за допомогою 10N NaOH та знову екстрагують діетиловим ефіром (4×200 мл). Об'єднані органічні фази концентрують при зниженому тиску та сирий залишок очищують кристалізацією з суміші 1/1 гексан/етилацетат. Таким чином, отримують 15 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-ацетогідразид. Приклад 1 Аналіз генної експресії MCP-1 у моноцитарній лінії людини Оцінюють здатність сполук інгібувати експресію MCP-1 стимульованими ліпополісахаридами (LPS) MonoMac6 клітинами. Клітини поміщають у 96-лункові планшети при концентрації 50000 клітин/лунку. Сполуки досліджують при максимальній розчинній концентрації, представленій у Таблиці 1 (у інтервалі 30-300 мкM) та інкубують впродовж 1 години. Потім клітини стимулюють за допомогою LPS (100 нг/мл) впродовж 4 годин. Всю РНК екстрагують з клітинної таблетки, використовуючи мінінабір RNeasy (Qiagen), обернено зчитують генетичний код за допомогою набору TaqMan Reverse transcription reagents synthesis (Applied Biosystems) та отримані кДНК використовують для ПЦР реакції у реальному часі. Ампліфікацію отримують у 96-лункових планшетах, використовуючи ABI Prism 7000 систему визначення послідовності (Applied Biosystems), застосовуючи наступний температурний профіль: 50 °C впродовж 2 хвилин, 95 °C впродовж 10 хвилин та 45 циклів при 95 °C впродовж 15 секунд та 60 °C впродовж 1 хвилини. Для ампліфікації використовують набір праймерів та зонд, специфічний для MCP-1 людини (Applied Biosystems, RefSeq NM_002982.3). Набір праймерів та зонд для -актину використовують у окремих лунках як внутрішній контроль зразків для цілей нормалізації. Коли реакція відбулася, дані флуоресценції аналізують, використовуючи програмне забезпечення ABI Prism 7000 SDS, шляхом розрахунку граничного циклу (Ct) для кожного зразку та далі проводячи відносне кількісне визначення за допомогою ΔΔCt способу. Отримані результати, виражені як відсоток інгібування, представлені у Таблиці 1 нижче. ТАБЛИЦЯ 1 № 9 10 11 12 13 14 15 40 45 50 % інгібування 99 61 68 20 72 49 40 [мкM] 300 150 150 300 75 30 75 Як видно з результатів, отриманих та представлених у Таблиці 1, сполуки здатні значно інгібувати LPS-викликану експресію MCP-1 у моноцитарній лінії людини, та показують зменшення у рівнях специфічних мРНК від 20 % до 99 %. Приклад 2 Вимірювання вироблення MCP-1 у моноцитарній лінії людини Оцінюють здатність сполук інгібувати експресію MCP-1 стимульованими ліпополісахаридами (LPS) MonoMac6 клітинами. Клітини поміщають у 96-лункові планшети при концентрації 50000 клітин/лунку. Сполуки досліджують при максимальній розчинній концентрації, представленій у Таблиці 2 (у інтервалі 30-300 мкM) та інкубують впродовж 1 години. Потім клітини стимулюють за допомогою LPS (100 нг/мл) впродовж 20 годин. Кількість виробленого MCP-1 вимірюють у надосадових рідинах, прийнятно розведених буфером, за допомогою імуноферментного способу (ELISA), використовуючи комерційний набір (ELISA MCP-1/JE, R&D Systems). Отримані результати, виражені як відсоток інгібування, представлені у Таблиці 2 нижче. 22 UA 103605 C2 ТАБЛИЦЯ 2 № 9 10 11 12 13 14 15 27 5 10 15 20 25 % інгібування 98 91 79 48 74 70 59 82 [мкM] 300 150 150 300 75 30 75 30 Як показано у результатах, отриманих та представлених у Таблиці 2, сполуки здатні значно інгібувати LPS-викликану експресію MCP-1 у моноцитарній лінії людини, та показують зменшення у рівнях виробленого білку від 48 % до 98 %. Приклад 3 Аналіз генної експресії CX3CR1 у моноцитарній лінії людини Оцінюють здатність сполук інгібувати експресію CX3CR1 стимульованими ліпополісахаридами (LPS) MonoMac6 клітинами. Клітини поміщають у 96-лункові планшети при концентрації 50000 клітин/лунку. Сполуки досліджують при максимальній розчинній концентрації, представленій у Таблиці 3 (у інтервалі 30-300 мкM) та інкубують впродовж 1 години. Потім клітини стимулюють за допомогою LPS (100 нг/мл) впродовж 20 годин. Всю РНК екстрагують з клітинної таблетки, використовуючи мінінабір RNeasy (Qiagen), обернено зчитують генетичний код за допомогою набору TaqMan Reverse transcription reagents synthesis (Applied Biosystems) та отримані кДНК використовують для ПЦР реакції у реальному часі. Ампліфікацію отримують у 96-лункових планшетах, використовуючи ABI Prism 7000 систему визначення послідовності (Applied Biosystems), застосовуючи наступний температурний профіль: 50 °C впродовж 2 хвилин, 95 °C впродовж 10 хвилин та 45 циклів при 95 °C впродовж 15 секунд та 60 °C впродовж 1 хвилини. Для ампліфікації використовують набір праймерів та зонд, специфічний для CX3CR1 людини (Applied Biosystems, RefSeq NM_001337.3). Набір праймерів та зонд для -актину використовують у окремих лунках як внутрішній контроль зразків для цілей нормалізації. Коли реакція відбулася, дані флуоресценції аналізують, використовуючи програмне забезпечення ABI Prism 7000 SDS, шляхом розрахунку граничного циклу (Ct) для кожного зразка та далі проводячи відносне кількісне визначення за допомогою ΔΔCt способу. Отримані результати, виражені як відсоток інгібування, показані у Таблиці 3 нижче. ТАБЛИЦЯ 3 30 № 9 10 11 12 13 14 15 % інгібування 99 95 90 83 100 44 89 [мкM] 300 150 150 300 75 30 75 Як показано у результатах, отриманих та представлених у Таблиці 3, сполуки здатні значно інгібувати LPS-викликану експресію CX3CR1 у моноцитарній лінії людини, та показують зменшення у рівнях специфічної мРНК від 44 % до 100 %. 35 40 Приклад 4 Аналіз генної експресії p40 у моноцитарній лінії людини Оцінюють здатність сполук інгібувати експресію p40 стимульованими ліпополісахаридами (LPS) MonoMac6 клітинами. Клітини поміщають у 96-лункові планшети при концентрації 50000 клітин/лунку. Сполуки досліджують при максимальній розчинній концентрації, представленій у Таблиці 4 (у інтервалі 30-300 мкM) та інкубують впродовж 1 години. Потім клітини стимулюють за допомогою LPS (100 нг/мл) впродовж 4 годин. Всю РНК екстрагують з клітинної таблетки, використовуючи мінінабір RNeasy (Qiagen), 23 UA 103605 C2 5 10 обернено зчитують генетичний код за допомогою набору TaqMan Reverse transcription reagents synthesis (Applied Biosystems) та отримані кДНК використовують для ПЦР реакції у реальному часі. Ампліфікацію отримують у 96-лункових планшетах, використовуючи ABI Prism 7000 систему визначення послідовності (Applied Biosystems), застосовуючи наступний температурний профіль: 50 °C впродовж 2 хвилин, 95 °C впродовж 10 хвилин та 45 циклів при 95 °C впродовж 15 секунд та 60 °C впродовж 1 хвилини. Для ампліфікації використовують набір праймерів та зонд, специфічний для p40 людини (Applied Biosystems, RefSeq NM_002187.2). Набір праймерів та зонд для -актину використовують у окремих лунках як внутрішній контроль зразків для цілей нормалізації. Коли реакція відбулася, дані флуоресценції аналізують, використовуючи програмне забезпечення ABI Prism 7000 SDS, шляхом розрахунку граничного циклу (Ct) для кожного зразку та далі проводячи відносне кількісне визначення за допомогою ΔΔCt способу. Отримані результати, виражені як відсоток інгібування, представлені у Таблиці 4 нижче. ТАБЛИЦЯ 4 № 9 10 11 13 14 15 % інгібування 96 54 44 59 27 33 [мкM] 300 150 150 75 30 75 15 Як показано у результатах, отриманих та представлених у Таблиці 4, сполуки здатні значно інгібувати LPS-викликану експресію p40 у моноцитарній лінії людини, та показують зменшення у рівнях специфічної мРНК від 33 % до 96 %. ФОРМУЛА ВИНАХОДУ 20 1. Сполука формули (I) R1 R2 R8 R6 R7 R5 25 30 35 40 R3 R4 , (I) у якій: A може являти собою -X1- або -X1-OC(R9)(R10)-, де X1 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що мають від 1 до 3 атомів вуглецю, та R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю, Y може являти собою N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2CO-X3, де R11 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або R 11, разом з R12, утворює 5-6-членний гетероцикл, R12 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, арильну групу, що має 6 атомів вуглецю, 6-членну гетероарильну групу, що містить принаймні один N-атом, або R12, разом з R11, утворює 5-6-членний гетероцикл, R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю, R14 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, COR', 24 UA 103605 C2 5 10 15 20 25 30 35 40 45 50 55 60 COOR', CON(R')(R''), де R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю, X2 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, яка необов’язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають 1 атом вуглецю, X3 може являти собою OH, NH2, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має 1 атом вуглецю, R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R''), -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'' та трифторметил; причому R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю, R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R'') та трифторметил, або R5, разом з одним з R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R' та R'' представлені атомом водню, R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю. 2. Сполука за п. 1, де X1 являє собою алкільну групу, що має від 1 до 3 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 3 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що мають 1 або 2 атоми вуглецю. 3. Сполука за п. 1, де X 1 вибраний з групи, що включає групу CH2, групу CH2CH2 або групу C(CH3)2, та R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, являють собою атом водню або CH3-групу. 4. Сполука за п. 1, де залишок A вибраний з групи, що включає групу CH2, групу CH2CH2, групу C(CH3)2, групу CH2CH2OCH2, групу CH2CH2OC(CH3)2 та групу CH2CH2CH2OC(CH3)2. 5. Сполука за п. 1, де R12 являє собою атом водню, алкільну групу, що має 1 атом вуглецю, 6членну гетероарильну групу, що містить принаймні один N-атом, або R12 разом з R11 утворюють 5- або 6-членний гетероцикл. 6. Сполука за п. 1, де R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, або алкоксигрупою, що має 1 або 2 атоми вуглецю. 7. Сполука за п. 1, де R14 являє собою атом водню, алкільну групу, що має від 1 до 3 атомів вуглецю, COR', COOR', CON(R')(R''), де R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю. 8. Сполука за п. 1, де X2 являє собою алкільну групу, що має від 1 до 3 атомів вуглецю, яка необов’язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають 1 атом вуглецю. 9. Сполука за п. 1, де R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, вибрані з групи, що включає атом водню, алкільну групу, що має від 1 до 3 атомів вуглецю, алкоксигрупу, що має 1 або 2 атоми вуглецю, атом Br, Cl або F, OH-групу, трифторметильну групу або групу N(R’)(R”) або -N(R’)COR”, -CN, -CONR’R”, -SO2NR’R”, причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 3 атомів вуглецю. 10. Сполука за п. 1, де R5 вибраний з групи, що включає атом водню, алкільну групу, що має від 1 до 3 атомів вуглецю, алкоксигрупу, що має 1 або 2 атоми вуглецю, атом галогену, OH-групу, або R5, разом з одним з R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю. 11. Фармацевтична композиція, що містить сполуку формули (I) за будь-яким з попередніх пунктів або її стереоізомер або енантіомер, або її фармацевтично прийнятну сіль, складний ефір або проліки та щонайменше один фармацевтично прийнятний носій. 12. Фармацевтична композиція за п. 11, яка відрізняється тим, що фармацевтично прийнятна сіль являє собою сіль приєднання з фізіологічно прийнятними органічними або неорганічними кислотами або основами. 13. Фармацевтична композиція за п. 12, яка відрізняється тим, що фізіологічно прийнятні кислоти вибрані з групи, що включає соляну кислоту, бромистоводневу кислоту, сірчану кислоту, фосфорну кислоту, азотну кислоту, оцтову кислоту, аскорбінову кислоту, бензойну кислоту, лимонну кислоту, фумарову кислоту, молочну кислоту, малеїнову кислоту, метансульфонову кислоту, щавлеву кислоту, пара-толуолсульфонову кислоту, 25 UA 103605 C2 5 10 15 бензолсульфонову кислоту, бурштинову кислоту, дубильну кислоту та винну кислоту. 14. Фармацевтична композиція за п. 12, яка відрізняється тим, що фізіологічно прийнятні основи вибрані з групи, що включає гідроксид амонію, гідроксид кальцію, карбонат магнію, гідрокарбонат натрію, гідрокарбонат калію, аргінін, бетаїн, кофеїн, холін, N,Nдибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2-диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, N-етилпіперидин, N-метилглюкамін, глюкамін, глюкозамін, гістидин, N-(2-гідроксіетил)піперидин, N-(2-гідроксіетил)піролідин, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, теобромін, триетиламін, триметиламін, трипропіламін та трометамін. 15. Фармацевтична композиція за п. 11, яка відрізняється тим, що фармацевтично прийнятний складний ефір утворений з фізіологічно прийнятними органічними кислотами або спиртами. 16. Фармацевтична композиція за будь-яким з пунктів 11-15, яка відрізняється тим, що містить стереоізомер або енантіомер сполуки формули (I) або його фармацевтично прийнятну сіль, складний ефір або проліки або їх суміш. 17. Фармацевтична композиція за будь-яким з пунктів 11-16, яка відрізняється тим, що фармацевтично прийнятний носій вибраний з групи, що включає гліданти, зв’язуючі речовини, дезінтегранти, наповнювачі, розріджувачі, ароматизатори, барвники, флюїдизатори, лубриканти, консерванти, гігроскопічні речовини, абсорбенти та підсолоджувачі. 18. Застосування сполуки формули (I) R1 R2 R8 R6 R7 R5 20 25 30 35 40 45 R3 R4 , (I) у якій: A може являти собою -X1- або -X1-OC(R9)(R10)-, де X1 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що мають від 1 до 3 атомів вуглецю, та R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю, Y може являти собою N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2CO-X3, де R11 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або R 11 разом з R12 утворюють 5-6-членний гетероцикл, R12 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, арильну групу, що має 6 атомів вуглецю, 6-членну гетероарильну групу, що містить принаймні один N-атом, або R12 разом з R11 утворюють 5- або 6-членний гетероцикл, R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю, R14 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, COR', COOR', CON(R')(R''), де R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю, X2 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, яка необов'язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають 1 атом вуглецю, X3 може являти собою OH, NH2, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню або алкільну групу, що має 1 атом вуглецю, 26 UA 103605 C2 5 10 15 20 25 30 35 R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R''), -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'' та трифторметил; причому R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю, R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R'') та трифторметил, або R5, разом з одним з R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R' та R'' представлені атомом водню, R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю, для одержання фармацевтичної композиції для лікування хвороб, основаних на експресії MCP1, CX3CR1 та p40. 19. Застосування за п. 18, де зазначена хвороба, основана на експресії MCP-1 та CX3CR1, вибрана з групи, що включає такі як: хвороби суглобів, хвороби нирок, серцево-судинні хвороби, метаболічний синдром, ожиріння, діабет, резистентність до інсуліну та рак. 20. Застосування за п. 19, де зазначена хвороба, основана на експресії MCP-1, вибрана з групи, що включає такі як: ревматоїдний артрит, артрит, викликаний вірусними інфекціями, псоріатичний артрит, артроз, вовчаковий нефрит, діабетична нефропатія, гломерулонефрит, полікістозна хвороба нирок, інтерстиціальна легенева хвороба, фіброз, розсіяний склероз, хвороба Альцгеймера, пов’язана з ВІЛ деменція, атопічний дерматит, псоріаз, васкуліт, рестеноз, атеросклероз, інфаркт міокарда, стенокардія, гострі коронарні хвороби, аденоми, карциноми та метастази, метаболічні хвороби та ускладнення після хірургічних втручань. 21. Застосування за п. 19, де зазначена хвороба, основана на експресії CX3CR1, вибрана з групи, що включає такі як: ревматоїдний артрит, вовчаковий нефрит, діабетична нефропатія, хвороба Крона, виразковий коліт, коронарні хвороби серця, рестеноз, атеросклероз, інфаркт міокарда, стенокардія та ускладнення після хірургічних втручань. 22. Застосування за п. 18, де зазначена хвороба, основана на експресії p40, вибрана з групи, що включає аутоімунні хвороби, хронічні дегенеративні запальні хвороби та рак. 23. Застосування за п. 22, де зазначена хвороба, основана на експресії p40, вибрана з групи, що включає ревматоїдний артрит, псоріаз, гломерулонефрит, червоний вовчак, діабет, хворобу Крона та пухлини. 24. Спосіб лікування або профілактики хвороб, основаних на експресії MCP-1, CX3CR1 та p40, у якому пацієнту, що цього потребує, вводять ефективну кількість сполуки формули (I): R1 R2 R8 R6 R7 R5 40 45 R3 R4 , (I) у якій: A може являти собою -X1- або -X1-OC(R9)(R10)-, де X1 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що мають від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що мають від 1 до 3 атомів вуглецю, та R9 та R10, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю, Y може являти собою N(R11)(R12), N(R13)O(R14), N(R13)N(R14)(R15), N(R13)-X2-N(R14)(R15), N(R13)-X2CO-X3, де R11 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або R11 разом з R12 27 UA 103605 C2 5 10 15 20 25 утворюють 5- або 6-членний гетероцикл, R12 може являти собою атом водню, алкільну групу, що має 1 атом вуглецю, арильну групу, що містить 6 атомів вуглецю, 6-членну гетероарильну групу, що містить принаймні один N-атом, або R12 разом з R11 утворюють 5- або 6-членний гетероцикл, R13 та R15, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або алкоксигрупу, що має від 1 до 3 атомів вуглецю, R14 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, COR', COOR', CON(R')(R''), де R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю, X2 може являти собою алкільну групу, що має від 1 до 5 атомів вуглецю, яка необов’язково заміщена за допомогою однієї або більшої кількості алкільних груп, що мають 1 атом вуглецю, X3 може являти собою OH, NH2, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має 1 атом вуглецю, R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R''), -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'' та трифторметил; причому R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню або алкільною групою, що має 1 атом вуглецю, R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R'') та трифторметил, або R5, разом з одним з R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R' та R'' представлені атомом водню, та R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має 1 атом вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійською1-benzyl-3-hydroxymethylindazole derivatives and use thereof in the treatment of diseases based on the expression of mcp-1, cx3cr1 and p40
Автори англійськоюGuglielmotti, Angelo, Furlotti, Guido, Mangano, Giorgina, Cazzolla, Nicola, Garofalo, Barbara
Автори російськоюГуглиелмотти Анджело, Гуглиэлмотти Анджело, Фурлотти Гвидо, Мангано Джорджина, Каццолла Никола
МПК / Мітки
МПК: A61P 25/00, A61P 13/00, A61P 29/00, A61K 31/415, C07D 231/56
Мітки: основаних, застосування, експресії, хвороб, mcp-1, cx3cr1, 1-бензил-3-гідроксиметиліндазолу, лікуванні, похідні
Код посилання
<a href="https://ua.patents.su/30-103605-pokhidni-1-benzil-3-gidroksimetilindazolu-ta-kh-zastosuvannya-u-likuvanni-khvorob-osnovanikh-na-ekspresi-mcp-1-cx3cr1-ta-r40.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-бензил-3-гідроксиметиліндазолу та їх застосування у лікуванні хвороб, основаних на експресії mcp-1, cx3cr1 та р40</a>
Попередній патент: Пестицидні склади для обробки насіння і способи застосування
Наступний патент: Спосіб роботи енерготехнологічного котла, енерготехнологічний котел та система керування його роботою
Випадковий патент: Спосіб визначення ведення пологів при клінічно вузькому тазі