Лікарські вуглеводи для лікування респіраторних розладів
Номер патенту: 110325
Опубліковано: 25.12.2015
Автори: Ву Вен-Янг, Джонс Пол Артур, Дженкінс Пітер Джеймс, Джін Бетті, Сіх Іе Лінг
Формула / Реферат
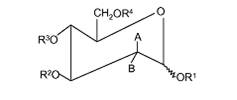
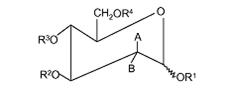
1. Спосіб відновлення активної клітинної проліферації ушкодженої респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції, де спосіб включає стадію введення суб'єкту після вірусної або бактеріальної респіраторної інфекції ефективної кількості принаймні однієї фармацевтично прийнятої сполуки, де принаймні одну фармацевтично прийнятну сполуку вибирають із групи, що містить сполуки Формули (1) і сполуки Формули (2), де сполука Формули (1) має формулу:
 , (Формула 1)
, (Формула 1)
в якій
R1, R2, R3 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR5R6R7 і CO-естери;
R5, R6, R7 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH3CH2(OCH2CH2)mCH3 (m=1-200);
R4 є таким же самим або відмінним від R1, R2, R3 і вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR5R6R7, CO-естери і
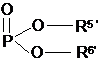 ;
;
R5", R6" є однаковими або різними і кожний незалежно вибраний із групи, що складається з H або фармацевтично прийнятної неорганічної або органічної солі і фармацевтично прийнятного естеру;
один з A і B є H, за умови, що:
коли B є H, то A вибраний із групи, що складається з наступного: NHCOCH3, NH2, ОН, NH2·HX, або
коли A є H, B вибраний із групи, що складається з наступного: NHCOCH3, NH2 і NH2·HX, де HX представляє фармацевтично прийнятну неорганічну або органічну кислоту;
і
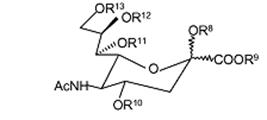
де сполука Формули (2) має формулу
 , (Формула 2)
, (Формула 2)
де
R8 вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCH2Ph, СО-естер і COCR14R15R16; де R14, R15, R16 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200); цитидин, монофосфат цитидину, дифосфат цитидину, трифосфат цитидину, аденозин, монофосфат аденозину, дифосфат аденозину і трифосфат аденозину;
R9 вибраний із групи, що складається з H, CH3, фармацевтично прийнятної неорганічної або органічної солі або фармацевтично прийнятного естеру; CH2CR17R18R19 де R17, R18, R19 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), C6H5 і CH2Ph;
R10, R11, R12 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR20R21R22, де R20, R21, R22 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH2CH2(OCH2CH2)mCH3 (m=1-200);
R13 є таким же самим або відмінним від R10, R11, R12 і вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR20R21R22, де R20, R21, R22 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200) і
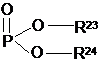 ;
;
R23, R24 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), CH2Ph або естер і CH2CR25R26R27 або фармацевтично прийнятна неорганічна або органічна сіль, і R25, R26, R27 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20) і C6H5, CH2Ph.
2. Спосіб за пунктом 1, де принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступного: N-ацетилманозаміну, N-ацетилглюкозаміну, N-ацетилнейрамінової кислоти, ЦМФ-сіалової кислоти, їх фармацевтично прийнятних похідних та їх комбінацій.
3. Спосіб лікування респіраторного розладу у суб'єкта після вірусної або бактеріальної респіраторної інфекції, де спосіб включає стадію введення суб'єкту після вірусної або бактеріальної респіраторної інфекції ефективної кількості принаймні однієї фармацевтично прийнятної сполуки, де принаймні одну фармацевтично прийнятну сполуку вибирають із групи, що містить сполуки Формули (1) і сполуки Формули (2), де сполука Формули (1) має формулу:
 , (Формула 1)
, (Формула 1)
в якій
R1, R2, R3 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR5R6R7 і CO-естери;
R5, R6, R7 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH3CH2(OCH2CH2)mCH3 (m=1-200);
R4 є таким же самим або відмінним від R1, R2, R3 і вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR5R6R7, CO-естери і
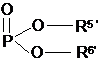 ;
;
R5", R6" є однаковими або різними і кожний незалежно вибраний із групи, що складається з H, або фармацевтично прийнятної неорганічної або органічної солі і фармацевтично прийнятного естеру,
один з A і B є H, за умови, що:
коли B є H, то A вибраний із групи, що складається з наступного: NHCOCH3, NH2, ОН, NH2·HX, або
коли A є H, B вибраний із групи, що складається з наступного: NHCOCH3, NH2 і NH2·HX, де HX представляє фармацевтично прийнятну неорганічну або органічну кислоту;
і
де сполука Формули (2) має формулу
 , (Формула 2)
, (Формула 2)
де
R8 вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCH2Ph, СО-естер і COCR14R15R16; де R14, R15, R16 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200); цитидин, монофосфат цитидину, дифосфат цитидину, трифосфат цитидину, аденозин, монофосфат аденозину, дифосфат аденозину і трифосфат аденозину;
R9 вибраний із групи, що складається з H, CH3, фармацевтично прийнятної неорганічної або органічної солі або фармацевтично прийнятного естеру; CH2CR17R18R19 де R17, R18, R19 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), C6H5 і CH2Ph;
R10, R11, R12 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR20R21R22, де R20, R21, R22 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH2CH2(OCH2CH2)mCH3 (m=1-200);
R13 є таким же самим або відмінним від R10, R11, R12 і вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR20R21R22, де R20, R21, R22 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200) і
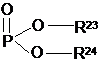 ;
;
R23, R24 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), CH2Ph або естер і CH2CR25R26R27 або фармацевтично прийнятна неорганічна або органічна сіль, і R25, R26, R27 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20) і C6H5, CH2Ph;
де респіраторний розлад вибраний із групи, що складається з наступного: кашель, гострий/хронічний бронхіт, хронічне обструктивне легеневе захворювання (ХОЛЗ), муковісцидоз і інші респіраторні запальні розлади.
4. Спосіб за пунктом 3, де принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступного: N-ацетилманозаміну, N-ацетилглюкозаміну, N-ацетилнейрамінової кислоти, ЦМФ-сіалової кислоти, їх фармацевтично прийнятних похідних і їх комбінацій.
5. Композиція для відновлення активної клітинної проліферації ушкодженої респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції, де згадана композиція містить ефективну кількість принаймні однієї фармацевтично прийнятної сполуки для введення суб'єкту після вірусної або бактеріальної респіраторної інфекції для відновлення активної клітинної проліферації, де принаймні одну фармацевтично прийнятну сполуку вибирають із групи, що містить сполуки Формули (1) і сполуки Формули (2), де сполука Формули (1) має формулу:
 , (Формула 1)
, (Формула 1)
в якій
R1, R2, R3 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR5R6R7 і CO-естери;
R5, R6, R7 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH3CH2(OCH2CH2)mCH3 (m=1-200);
R4 є таким же самим або відмінним від R1, R2, R3 і вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR5R6R7, CO-естери і
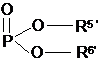 ;
;
R5", R6" є однаковими або різними і кожний незалежно вибраний із групи, що складається з H або фармацевтично прийнятної неорганічної або органічної солі і фармацевтично прийнятного естеру;
один з A і B є H, за умови, що:
коли B є H, то A вибраний із групи, що складається з наступного: NHCOCH3, NH2, ОН, NH2·HX, або
коли A є H, B вибраний із групи, що складається з наступного: NHCOCH3, NH2 і NH2·HX, де HX представляє фармацевтично прийнятну неорганічну або органічну кислоту;
і
де сполука Формули (2) має формулу
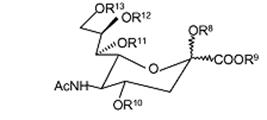 , (Формула 2)
, (Формула 2)
де
R8 вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCH2Ph, СО-естер і COCR14R15R16; де R14, R15, R16 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200); цитидин, монофосфат цитидину, дифосфат цитидину, трифосфат цитидину, аденозин, монофосфат аденозину, дифосфат аденозину і трифосфат аденозину;
R9 вибраний із групи, що складається з H, CH3, фармацевтично прийнятної неорганічної або органічної солі або фармацевтично прийнятного естеру; CH2CR17R18R19 де R17, R18, R19 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), C6H5 і CH2Ph;
R10, R11, R12 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR20R21R22, де R20, R21, R22 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH2CH2(OCH2CH2)mCH3 (m=1-200);
R13 є таким же самим або відмінним від R10, R11, R12 і вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR20R21R22, де R20, R21, R22 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200) і
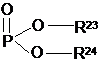 ;
;
R23, R24 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), CH2Ph або естер і CH2CR25R26R27 або фармацевтично прийнятна неорганічна або органічна сіль, і R25, R26, R27 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20) і C6H5, CH2Ph.
6. Композиція за пунктом 5, де принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступного: N-ацетилманозаміну, N-ацетилглюкозаміну, N-ацетилнейрамінової кислоти, ЦМФ-сіалової кислоти, їх фармацевтично прийнятних похідних і їх комбінацій.
7. Фармацевтична композиція для лікування респіраторного розладу, викликаного ушкодженням респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції, де композиція містить ефективну кількість принаймні однієї фармацевтично прийнятної сполуки для введення суб'єкту після вірусної або бактеріальної респіраторної інфекції для відновлення активності клітинної проліферації, вибраної із групи, що містить сполуки Формули (1) і сполуки Формули (2), де сполука Формули (1) має формулу:
 , (Формула 1)
, (Формула 1)
в якій
R1, R2, R3 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR5R6R7 і CO-естери;
R5, R6, R7 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH3CH2(OCH2CH2)mCH3 (m=1-200);
R4 є таким же самим або відмінним від R1, R2, R3 і вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR5R6R7, CO-естери і
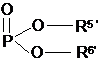 ;
;
R5", R6" є однаковими або різними і кожний незалежно вибраний із групи, що складається з H або фармацевтично прийнятної неорганічної або органічної солі і фармацевтично прийнятного естеру;
один з A і B є H, за умови, що:
коли B є H, то A вибраний із групи, що складається з наступного: NHCOCH3, NH2, ОН, NH2·HX, або
коли A є H, B вибраний із групи, що складається з наступного: NHCOCH3, NH2 і NH2·HX, де HX представляє фармацевтично прийнятну неорганічну або органічну кислоту;
і
де сполука Формули (2) має формулу
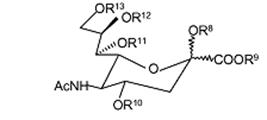 , (Формула 2)
, (Формула 2)
де
R8 вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCH2Ph, СО-естер і COCR14R15R16; де R14, R15, R16 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200); цитидин, монофосфат цитидину, дифосфат цитидину, трифосфат цитидину, аденозин, монофосфат аденозину, дифосфат аденозину і трифосфат аденозину;
R9 вибраний із групи, що складається з H, CH3, фармацевтично прийнятної неорганічної або органічної солі або фармацевтично прийнятного естеру; CH2CR17R18R19 де R17, R18, R19 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), C6H5 і CH2Ph;
R10, R11, R12 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR20R21R22, де R20, R21, R22 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH2CH2(OCH2CH2)mCH3 (m=1-200);
R13 є таким же самим або відмінним від R10, R11, R12 і вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR20R21R22, де R20, R21, R22 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200) і
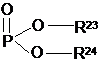 ;
;
R23, R24 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), CH2Ph або естер і CH2CR25R26R27 або фармацевтично прийнятна неорганічна або органічна сіль, і R25, R26, R27 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20) і C6H5, CH2Ph, і
де респіраторний розлад вибраний із групи, що складається з наступного: кашель, гострий/хронічний бронхіт, хронічне обструктивне легеневе захворювання (ХОЛЗ), муковісцидоз і інші респіраторні запальні розлади.
8. Фармацевтична композиція за пунктом 7, де принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступного: N-ацетилманозаміну, N-ацетилглюкозаміну, N-ацетилнейрамінової кислоти, ЦМФ-сіалової кислоти, їх фармацевтично прийнятних похідних і їх комбінацій.
9. Застосування принаймні однієї фармацевтично прийнятної сполуки для відновлення активності клітинної проліферації ушкодженої респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції, де згадану сполуку вибирають із групи, що складається із сполук Формули (1) і сполук Формули (2),
де сполука Формули (1) має формулу:
 , (Формула 1)
, (Формула 1)
в якій
R1, R2, R3 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR5R6R7 і CO-естери;
R5, R6, R7 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH3CH2(OCH2CH2)mCH3 (m=1-200);
R4 є таким же самим або відмінним від R1, R2, R3 і вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR5R6R7, CO-естери і
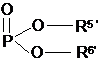 ;
;
R5", R6" є однаковими або різними і кожний незалежно вибраний із групи, що складається з H або фармацевтично прийнятної неорганічної або органічної солі і фармацевтично прийнятного естеру;
один з A і B є H, за умови, що:
коли B є H, то A вибраний із групи, що складається з наступного: NHCOCH3, NH2, ОН, NH2·HX, або
коли A є H, B вибраний із групи, що складається з наступного: NHCOCH3, NH2 і NH2·HX, де HX представляє фармацевтично прийнятну неорганічну або органічну кислоту;
і
де сполука Формули (2) має формулу
 , (Формула 2)
, (Формула 2)
де
R8 вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCH2Ph, СО-естер і COCR14R15R16; де R14, R15, R16 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200); цитидин, монофосфат цитидину, дифосфат цитидину, трифосфат цитидину, аденозин, монофосфат аденозину, дифосфат аденозину і трифосфат аденозину;
R9 вибраний із групи, що складається з H, CH3, фармацевтично прийнятної неорганічної або органічної солі або фармацевтично прийнятного естеру; CH2CR17R18R19 де R17, R18, R19 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), C6H5 і CH2Ph;
R10, R11, R12 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR20R21R22, де R20, R21, R22 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH2CH2(OCH2CH2)mCH3 (m=1-200);
R13 є таким же самим або відмінним від R10, R11, R12 і вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR20R21R22, де R20, R21, R22 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200) і
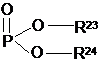 ;
;
R23, R24 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), CH2Ph або естер і CH2CR25R26R27 або фармацевтично прийнятна неорганічна або органічна сіль, і R25, R26, R27 є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20) і C6H5, CH2Ph,
у виробництві медикаменту для лікування респіраторного розладу, викликаного ушкодженням респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції для відновлення активності клітинної проліферації, де згадуваний розлад вибраний із групи, що складається з наступного: кашель, гострий/хронічний бронхіт, хронічне обструктивне легеневе захворювання (ХОЛЗ), муковісцидоз і інші респіраторні запальні розлади.
10. Застосування за пунктом 9, де принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступного: N-ацетилманозаміну, N-ацетилглюкозаміну, N-ацетилнейрамінової кислоти, ЦМФ-сіалової кислоти, їх фармацевтично прийнятних похідних і їх комбінацій.
11. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять в дозі від приблизно 0,1 мг до 500 мг/кг маси тіла на день, переважно в дозі від 0,1 мг до 50 мг/кг/день.
12. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять орально в дозі від приблизно 1 мг/кг/день до 500 мг/кг/день.
13. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять в дозі від приблизно 5 мг до 50 мг/кг, два або три рази на день протягом 5-10 днів.
14. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять за допомогою ін'єкції в інтервалі від приблизно 1 мг/кг/день до 100 мг/кг/день.
15. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять в інтервалі від приблизно 5 мг до 50 мг/кг, два або три рази на день протягом 5-20 днів.
16. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять за допомогою інгаляції в інтервалі від приблизно 0,01 мг/кг/день до 5 мг/кг/день.
17. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять в інтервалі від приблизно 0,1 до 50 мг/кг/день, один-п'ять разів на день протягом 5-10 днів.
18. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де фармацевтично прийнятну сполуку вибирають з групи, що містить:
сполуку Формули (1), в якій В є Н, А є NHCOCH3 і кожен з R1, R2, R3 і R4 є Н;
сполуку Формули (2), в якій кожен з R8, R10, R11, R12 і R13 є Н і R9 є Na;
сполуку Формули (2), в якій кожен з R8, R10, R11, R12 і R13 є Н і R9 є С2Н5;
сполуку Формули (2), в якій R8 є Н, R9 є С2Н5 і кожен з R10, R11, R12 і R13 є СН3СО;
сполуку Формули (2), в якій R8 є монофосфатом цитидину і кожен з R9, R10, R11, R12 і R13 є Н і
сполуку Формули (2), в якій кожен з R8, R10, R11 є Н і R12 та R13 разом є С(СН3)2.
Текст
Реферат: Винахід належить до способу відновлення активної клітинної проліферації ушкодженої респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції, де спосіб включає стадію введення вказаному суб'єкту введення сполук Формули (1) та/або (2) (1) і . (2) UA 110325 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ВИНАХОДУ Даний винахід стосується нового способу і групи вуглеводів Формули (1) та/або (2) і їх композицій для лікування кашлю і пов'язаних респіраторних розладів, включаючи поствірусні/бактеріальні інфекції, гострий/хронічний бронхіт, ХОЛЗ і запальні стани. ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ У людей респіраторний тракт є найбільшою поверхнею, що з'єднує організм із зовнішнім світом, необхідним для достатнього обміну повітрям; одночасно, підлягає впливу багатьох фізичних, хімічних і біологічних речовин у повітрі, що викликають розлади, включаючи астму, хронічне обструктивне легеневе захворювання, запальні стани легенів і респіраторного тракту. Крім того, деякі генетичні розлади, такі як муковісцидоз порушує сполучення респіраторного тракту із зовнішнім світом. Віруси й бактерії можуть проникати в організм й спричиняти інфекції респіраторного тракту. Кашель є одним з загальних розладів, який потрібно лікувати. Однак, у цей час доступне лікування обмежене тільки полегшенням симптомів, залишаючи організм відновлюватися самостійно та у багатьох випадках відновлення повільне. В Австралії продаж сиропу від кашлю становить більше, ніж 20 мільйонів $ на рік. Вважається, що міжнародний ринок сиропу від кашлю перевищує 1 мільярд $ на рік. Постійний кашель іноді з періодом нормального стану, що триває протягом багатьох місяців або навіть років, характерний для бронхіальної астми, латентного розладу, або поствірусній/бактеріальній інфекції, тютюнопаління, спричиняючи гіперсенситивність/гіперреактивність респіраторного тракту. Відповідно є потреба в ефективному лікуванні, яке може допомогти організму регенеруватися після впливу багатьох фізичних, хімічних, і біологічних речовин у повітрі, що можуть викликати розлади респіраторного тракту. Обговорення документів, дій, матеріалів, обладнань, статей і т.п. включені в цей опис винятково з метою забезпечення контексту для даного винаходу. Не було запропоновано або представлено, що будь-які із цих речовин були частиною попереднього рівня техніки або загальним знанням в релевантній щодо даного винаходу галузі, оскільки існували перед пріоритетною датою кожної вимоги цієї заявки. КОРОТКИЙ ОПИС ВИНАХОДУ Даний винахід забезпечує в одному аспекті спосіб сприяння відновленню сіалілглікокон'югату на поверхні ушкодженої респіраторної клітини суб'єкта, щоб лікувати респіраторний розлад у суб'єкта, спосіб, що включає стадію призначення суб'єкту принаймні однієї фармацевтично прийнятної сполуки, здатної прискорити біосинтез сіалілглікокон'югату. В одному втіленні спосіб забезпечує відновлення життєздатності клітини таким чином, що клітина перебуває в кращому для нормальної біологічної функції стані, щоб реагувати на фактори, які можуть впливати на поверхню респіраторного тракту, які призводять до респіраторних розладів, таких як кашель, поствірусні або бактеріальні інфекції, гострий/хронічний бронхіт, хронічне обструктивне легеневе захворювання (ХОЛЗ), муковісцидоз і інші респіраторні запальні розлади, але не обмежуються ними. В іншому втіленні даний винахід передбачає застосування сполуки, вибраної із групи, що складається із сполук Формули (1) і Формули (2) і їх фармацевтично прийнятних солей, і похідних, та їх комбінацій. Застосування для лікування або профілактики респіраторного розладу, як описано в цьому документі. В інших аспектах винаходу надані композиції та фармацевтичні композиції, що включають принаймні одну фармацевтично прийнятну сполуку, здатну прискорювати біосинтез сіалілглікокон'югату для застосування для лікування і профілактики респіраторних розладів. У ще одному аспекті винаходу наданий спосіб скринінгу сполук для лікування респіраторного розладу, згадуваний спосіб включає: піддавання клітини, що має пригнічені сіалілглікокон'югати на клітинній поверхні дії тестової сполуки; і визначення відновлення сіалілглікокон'югатів на клітинній поверхні після піддавання клітини дії тестової сполуки. Визначення відновлення сіалілглікокон'югатів на клітинній поверхні може бути визначене вимірюванням життєздатності клітини. У ще одному аспекті винаходу наданий спосіб лікування або профілактики респіраторного розладу у суб'єкта, спосіб, що включає стадію призначення суб'єкту принаймні однієї сполуки, ідентифікованої скринінговим способом. КОРОТКИЙ ОПИС ФІГУР Фіг. 1 демонструє шлях біосинтезу сіалілглікокон'югатів у живій клітині. 1 UA 110325 C2 5 10 15 20 25 30 35 40 45 50 ДЕТАЛІЗОВАНИЙ ОПИС ВИНАХОДУ З точки зору цитобіології та молекулярної біології, гіперчутливість/гіперреактивність ушкодженого респіраторного тракту може бути викликана його ушкодженою клітинною поверхнею, яка потім буде схильна до стимулювання подразниками. Наприклад, заявники знайшли, що клітини респіраторного тракту після вірусної або бактеріальної інфекції часто втрачали термінальні сіалові кислоти сіалілглікокон'югатів на їх поверхні. Як наслідок, життєздатність "голої" клітини була зменшена. Це потім запускає запальну реакцію, що приводить до бронхіту і кашлю. Не будучи обмеженим теорією, постулюється, що відновлення сіалових кислот на клітинній поверхні може відновити респіраторний тракт, ушкоджений інфекцією або іншими фізичними, хімічними, біологічними факторами, які в остаточному підсумку є причиною бронхіту, і зупинити кашель. Заявники тепер показали в прикладних експериментах клітинної культури, проведених на двох людських лініях клітин респіраторного тракту: Епітеліальні Клітини Малого Респіраторного Тракту (ЕКМРТ) і Нормальні Людські Бронхіальні/Трахеальні Епітеліальні Клітини (НЛБЕК). Клітини спочатку обробляли нейрамінідазами (Nas) з вірусу грипу або бактерій. Нейрамінідази (NA) відщеплюють сіалові кислоти від сіалілглікокон'югатів клітинної поверхні. Як наслідок, життєздатність "голих" клітин була зменшена. Наприклад, ЕКМРТ втратили більше, ніж 25 % життєздатності, коли були оброблені NA C. perfringens при заключній концентрації 0,01 Од/мл, або вірусом грипу NWS/G70C NA при заключній концентрації 0,17 мкг/лунку. Подібні результати були також отримані в лінії НЛБЕК клітин. Після обробки клітин NA, клітини промивали, щоб вилучити NA, потім інкубували із сполуками Формули (1) та/або (2) протягом 24 годин. В остаточному підсумку життєздатність клітин була визначена. Результати (Приклади 7-36) показали, що група вуглеводів Формули (1) та/або (2) могла допомогти відновленню життєздатності ушкоджених клітин респіраторного тракту, відновлюючи сіалілглікокон'югати на їх поверхні. Відповідно, даний винахід забезпечує в одному аспекті спосіб сприяння відновленню сіалілглікокон'югату на поверхні ушкодженої респіраторної клітини суб'єкта, щоб лікувати респіраторний розлад у суб'єкта, спосіб, що включає стадію призначення суб'єкту принаймні однієї фармацевтично прийнятної сполуки, здатної прискорити біосинтез сіалілглікокон'югату. Даний винахід забезпечує в іншому аспекті спосіб сприяння відновленню життєздатності ушкодженої респіраторної клітини суб'єкта, щоб лікувати респіраторний розлад у суб'єкта, спосіб, що включає стадію призначення суб'єкту принаймні однієї фармацевтично прийнятної сполуки, здатної прискорити біосинтез сіалілглікокон'югату. Сприяння відновленню сіалілглікокон'югату на поверхні респіраторної клітини може також вказувати на відновлення клітини до життєздатного стану або відновлення життєздатності таким чином, що клітина перебуває в кращому стані для нормальної біологічної функції, щоб реагувати на фактори, які можуть впливати на поверхню респіраторного тракту, які таким чином приводять до респіраторних розладів, таких як, кашель, поствірусні або бактеріальні інфекції, гострий/хронічний бронхіт, хронічне обструктивне легеневе захворювання (ХОЛЗ), муковісцидоз і інші респіраторні запальні розлади, але не обмежені ними. В іншому втіленні принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступних: вуглеводів, здатних до участі як проміжні ланки в біосинтезі сіалілглікокон'югату та їх прекурсорів і проліків, і їх фармацевтично прийнятних солей і похідних та їх комбінацій. Згадані вище сполуки можуть використовуватися орально, інгаляційно або ін'єкційно для лікування респіраторних розладів, вибраних із групи, що включає кашель, поствірусні або бактеріальні інфекції, гострий/хронічний бронхіт, хронічне обструктивне легеневе захворювання (ХОЛЗ), муковісцидоз і інші респіраторні запальні розлади. Всюди по опису та формулі винаходу цього опису, слово "включає" і варіації слова, такі як "включаючи", і "включають" не призначені, щоб виключити інші добавки, компоненти, системи або стадії. В іншому втіленні даний винахід передбачає застосування сполуки, вибраної із групи, що складається з: сполуки Формули (1): 2 UA 110325 C2 5 10 (Формула 1) де, коли B=H, A може бути NHCOCH3, NH2, ОН, NH2·HX або коли A=H, B може бути NHCOCH3, NH2, NH2·HX, HX може бути фармацевтично прийнятними неорганічними або органічними кислотами, такими як хлорводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, лимонна кислота і т.д.; 1 2 3 4 R , R , R , R можуть бути однаковими або відмінними. Вони можуть бути H, CH3, (CH2)nCH3 5 6 7 (n=1~20), CH2Ph, COCR R R , CO-активними естерами, таким як piva естер, інденільний естер; 5 6 7 R , R , R можуть бути однаковими або відмінними. Вони можуть бути H, CH3, (CH2)nCH3 (n=1~20), C6H5, CH2Ph, CH3CH2 (OCH2CH2)mCH3 (m=1~200); і 4 R може бути O O P 5’ 15 20 25 30 35 R5 ' O R6' ; 6’ R , R можуть бути однаковими або відмінними. Вони можуть бути H або фармацевтично прийнятною неорганічною або органічною сіллю, такою як, Na, K, Ca, Mg, Zn, NH3, 5’ 6’ триетиламінова і т.д., або R , R можуть бути фармацевтично прийнятним естером, таким як (CH2)nCH3 (n=1~20) або CH3CH2(OCH2CH2)mCH3 (m=1~200), або активним естером, таким як piva естер, інденільний естер; і сполуки Формули (2) (Формула 2), де 8 R може бути H, CH3, (CH2)nCH3 (n=1~20), CH2Ph, COCH2Ph, СО-активним естером, таким як 14 15 16 14 15 16 piva естер, інденільний естер, COCR R R ; де R , R , R можуть бути однаковими або відмінними. Вони можуть бути H, CH3, (CH2)nCH3 (n=1~20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1~200); 8 R може бути цитидином, монофосфатом цитидину, дифосфатом цитидину, трифосфатом цитидину, аденозином, монофосфатом аденозину, дифосфатом аденозину, трифосфатом аденозину; 9 R може бути H, CH3, фармацевтично прийнятною неорганічною або органічною сіллю, такою як Na, K, Ca, Mg, Zn, NH3, триетиламінова і т.д., або фармацевтично прийнятним 17 18 19 17 18 активним естером, таким як piva естер, інденільний естер і т.д., або CH 2CR R R , де R , R , 19 R можуть бути однаковими або відмінними. Вони можуть бути H, CH3, (CH2)nCH3 (n=1~20), CH2CH2(OCH2CH2)mCH3 (m=1~200), C6H5, CH2Ph; 10 11 12 13 R , R , R , R можуть бути однаковими або відмінними. Вони можуть бути H, CH3, 20 21 22 20 (CH2)nCH3 (n=1~20), CH2Ph, активним естером, таким як piva естер, або COCR R R . R , де 21 22 R , R можуть бути однаковими або відмінними. Вони можуть бути H, CH3, (CH2)nCH3 (n=1~20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1~200); 13 R може бути O O P 40 R23 O R24 3 UA 110325 C2 23 5 10 15 24 R , R можуть бути однаковими або відмінними. Вони можуть бути H, CH3, (CH2)nCH3 (n=1~20), CH2CH2(OCH2CH2)mCH3 (m=1~200), CH2Ph або активним естером, таким як piva естер, 25 26 27 інденільний естер або CH2CR R R , або фармацевтично прийнятною неорганічною або 25 26 27 органічною сіллю, такою як Na, K, Ca, Mg, Zn, NH 3, триетиламінова і т.д і R , R , R можуть бути однаковими або відмінними. Вони можуть бути H, CH3, (CH2)nCH3 (n=1~20), C6H5, CH2Ph. 1 2 3 4 В одному втіленні у Формулі (1), коли A=NHCOCH3, B=H, R , R , R , R =H, сполука є Nацетил-D-манозаміном. Вона буде згадуватися як Сполука (1) всюди у цьому описі. 8 10 11 12 13 9 В іншому втіленні у Формулі (2), коли R , R , R , R , R =H, R =Na, сполука є натрієвою сіллю N-ацетилнейрамінової кислоти (натрієва сіль сіалової кислоти). Вона буде згадуватися як Сполука (2) усюди у цьому описі. 8 9 10 11 12 13 Коли R є монофосфатом цитидину і R , R , R , R , R =H, сполука є ЦМФ-сіаловою кислотою. Сіалові кислоти як кінцеві цукри на олігосахаридних ланцюгах глікокон'югатів на клітинній поверхні є прийнятними як молекулярні детермінанти певних біологічних процесів, таких як [1] [2] [3] клітинна адгезія , утворення або маскування детермінантів розпізнавання і стабілізація [4] структури глікопротеїнів . Шлях біосинтезу сіалілглікокон'югатів у живій клітині показаний [5] нижче на Фігурі 1 . 20 25 30 Було повідомлено, що N-ацетилнейрамінова кислота, а не лактоза, дозо-залежно захищала [6] від ушкодження мукоциліарного транспорту . Крім того, попереднє лікування повторними призначеннями (інгаляції) N-ацетилнейрамінової кислоти чудово запобігало запальним змінам, [7] викликаних довготривалою експозицією SO 2 у кроликів . Було також повідомлено, що N[8] ацетил-D-манозамін при оральному введенні ссавцям швидко метаболізувався у глюкозу . Було також повідомлено про способи призначення N-ацетилманозаміну або його похідних (щоб продукувати сіалову кислоту у пацієнтів, які мають дефіцит в цукровій молекулі), щоб лікувати м'язову атрофію, включаючи спадкову міопатію з інклюзивними тільцями (HIMB) і дистальну міопатію з вакуолями в оправі (міопатія Nonaka). Певні ниркові розлади, що є результатом [8b] [8c] гіпосіалування ниркових мембран, можуть лікуватися цим способом також . Однак, жодне з цих лікувань, не відноситься до застосування цих проміжних ланок для лікування респіраторних розладів. Сполуки Формули (1) та/або (2) були протестовані на безпеку заявниками. Наприклад, Сполуки (1) і (2) використовувалися в дослідженні толерантності і субхронічної токсичності на 4 UA 110325 C2 5 10 15 20 25 30 35 40 45 50 55 60 мишах Balb-C (AEC Approval Code: BAM/ B / 2005 /16). Результати дослідження толерантності показали, що обидві сполуки в пероральній дозі 5 г/кг або 2 г/кг при інтраперитонеальній дозі були добре толерантними. У дослідженні субхронічної токсичності результати показали, що обидві сполуки при 1 г/кг/день x 30 днів перорально або 0,5 г/кг/день x 30 днів інтраперитонеально були нетоксичними. Модель кашлю у морської свинки була також встановлена заявниками. Сполуки (1) і (2) були протестовані в цій моделі. При пероральній дозі 500 мг/кг/день X 3 дні, обидві сполуки могли відновити ушкодження респіраторного тракту, викликані нейрамінідазою у морських свинок. Ці результати in vivo відповідно надані щодо даних in vitro. Таким чином, дані ефективності і безпечності досліджуваних сполук Формули (1) та/або (2) і зокрема, сполук (1), і (2) можуть бути корисними для медичного застосування. Заявниками було знайдено, що сполуки Формули (1) та/або (2) можуть прискорювати відновлення життєздатності ушкоджених клітин респіраторного тракту, відновлюючи сіалілглікокон'югати на їх поверхні. Сполуки Формули (1) та/або (2) підсилюють продукування сіалілглікокон'югатів після входження в клітини. Таким чином, один аспект цього винаходу відноситься до використання сполук Формули (1) та/або (2) і їх фармацевтично прийнятних солей і похідних, і їх комбінацій або їх сумішей як активних терапевтичних агентів для лікування кашлю, і пов'язаних респіраторних розладів, включаючи поствірусні/бактеріальні інфекції, гострий/хронічний бронхіт, хронічне обструктивне легеневе захворювання (ХОЛЗ), муковісцидоз і запальні стани. Фармацевтично прийнятні композиції сполук Формули (1) та/або (2) і їх суміші можна також утворити, комбінуючи їх з одним або більше іншими активними інгредієнтами для лікування респіраторних розладів. Наприклад, холіну теофілінат (бронходилататор), теофілін(бронходилататор), сальбутамол і тербуталіну сульфат (полегшують бронхоспазм, пов'язаний з астмою та іншими респіраторними розладами), бромгексин (відхаркувальний засіб, муколітик), кодеїн, фолкодеїн (аналгетик, засіб проти кашлю), клофеданол (засіб проти кашлю), пентоксиверин (засіб проти кашлю), диметоксанат, глауцин (засіб проти кашлю), промдат, талоксимін, ацетилпіперацетамід, евкаліптове масло, хлорид амонію, і трави, такі як fritillariae cirrhosae (трава проти кашлю). Інгібітори синтезу муцину, такі як талніфлумат, 2-аміно-фенілоцтові кислоти, або, комбінації з деякими глюкокортикоїдами, такими як флунізолід (антиастматик), або комбінації з симтоматичними фармацевтично сумісними сиропами від кашлю, або комбінації з інгібітором фосфодіестерази-4, таким як циломіласт (Ariflo) для лікування хронічного обструктивного легеневого захворювання (ХОЛЗ). Крім того, фармацевтично прийнятні композиції сполук Формули (1) та/або (2) і їх фармацевтично прийнятні солі і похідні, та їх комбінації, та їх суміші можна також утворити, комбінуючи їх з одним або більше іншими активними інгредієнтами, наприклад, противірусними засобами, такими як занамавір та/або озельтамівір (агенти проти вірусів грипу), плеконарил та/або енвіроксим (антириновірусні агенти), протимікробними агентами, такими як антибіотики, наприклад, еритроміцини, тетрацикліни, рифаміцини, пеніциліни, цефалоспорини; хінолони, фторхінолони; сульфаніламіди, і триметоприми; протигрибкові агенти, такі як амфотерицини, клотримазол, еконазол, флуконазол, флуцитозин, і т.д. Посилання на сполуки Формули (1) та/або (2) тут включають сполуки Формули (1) та/або (2) і їх фармацевтично прийнятні похідні і їх солі. В додатковому або альтернативному втіленні наданий спосіб лікування або профілактики респіраторних розладів, включаючи поствірусні/бактеріальні інфекції, гострий/хронічний бронхіт, ХОЛЗ, муковісцидоз і запальні стани у тварин, включаючи людей, що включає призначення ефективної кількості сполук Формули (1) та/або (2). Також наданий додатковий або альтернативний аспект використання сполук Формули (1) та/або (2) у виробництві ліків для лікування респіраторних розладів, включаючи поствірусні/бактеріальні інфекції, гострий/хронічний бронхіт, ХОЛЗ, муковісцидоз і запальні стани у тварин, включаючи людей. Кількість сполук Формули (1) та/або (2), необхідна для застосування у лікуванні буде варіювати залежно від шляху введення, природи розладу, який підлягає лікуванню і віку, і стану тварини (включаючи людських пацієнтів), і в остаточному підсумку буде на розсуд супроводжуючого ветеринара або лікаря. Взагалі прийнятна доза буде в діапазоні від 0,1 мг до 500 мг/кг маси тіла на добу, переважно в діапазоні від 0,1 мг до 50 мг/кг/день. Загалом, дозування для перорального введення буде від 1 мг/кг/день до 500 мг/кг/день, доза для ін'єкції буде від 1 мг/кг/день до 100 мг/кг/день. Доза для інгаляції буде від 0,01 мг/кг/день до 5 мг/кг/день. Переважно, доза складатиме від 5 мг до 50 мг/кг для перорального або ін'єкційного 5 UA 110325 C2 5 10 15 20 25 30 35 40 45 50 55 60 введення, два - три рази в день протягом 5-10 днів; доза від 0,1 до 0,5 мг/кг буде для інгаляції, один - п'ять раз у день строком на 5-10 днів. Лікування переважно розпочинають після або протягом наявності кашлю або пов'язаних розладів і продовжують, поки кашель або пов'язані розлади не припиняються. Відповідне лікування проводять 1-4 рази щодня й продовжують протягом 3-30 днів. Бажана доза може бути представлена в однократній дозі або як розділені дози, які призначають у відповідних інтервалах, наприклад як дві, три, чотири або більше субдоз на добу. Сполуки Формули (1) та/або (2) звичайно призначають у одиничній дозованій формі, наприклад, що містить 0,1-500 мг активного інгредієнта на одиничну дозовану форму. Як використовується у даному контексті, термін "одинична доза" включає не тільки індивідуально упаковані одиничні дози, такі як флакони, але також і аліквоти, розподілені у шприці та композиції для інфузії, що містяться в інфузійних контейнерах. У той же час можливо, що для використання в терапії сполуки Формули (1) та/або (2) можна призначати як неочищений хімічний продукт, але переважно представити активний інгредієнт як фармацевтичну сполуку. Винахід таким чином додатково забезпечує фармацевтичну композицію, що включає сполуки Формули (1) та/або (2) або їх фармацевтично прийнятні похідні разом з одним або більше фармацевтично прийнятними носіями і, довільно, іншими терапевтичними та/або профілактичними інгредієнтами. Носій(ї) повинен бути "прийнятним" у змісті того, щоб бути сумісним з іншими інгредієнтами композиції й нешкідливим для реціпієнта. Фармацевтичні композиції включають композиції, прийнятні для перорального, ректального, назального або парентерального (включаючи внутрішньом'язовий, внутрішньошкірний, підшкірний і внутрішньовенний) введення або у формі, прийнятній для введення у шлунковокишковий тракт, або у формі, прийнятній для введення у респіраторний тракт (включаючи носові проходи), наприклад інгаляцією або інсуфляцією або для внутрішньошкірної або підшкірної імплантації, або у формі трансдермальних пластирів. Композиції, якщо прийнятно, можуть бути представлені в дискретних дозованих одиницях і можуть бути одержані будь-яким способом, відомим у фармацевтичній галузі. Всі способи включають стадію поєднання активної сполуки з рідкими носіями або твердими носіями тонкого помелу, або обома і потім, якщо буде потреба, формують продукт у бажану композицію. Фармацевтичні композиції, прийнятні для перорального введення, можуть бути представлені як дискретні одиниці, такі як капсули, облатки або таблетки, кожна з яких містить визначену кількість активного інгредієнта; як порошок або гранули; як розчин, суспензія або як емульсія. Активний інгредієнт може також бути представлений як болюс, електуарій або паста. Таблетки й капсули для перорального введення можуть містити звичайні інертні наповнювачі, такі як зв'язувальні речовини, наповнювачі, лубриканти, дезінтегранти або змочувальні речовини. Таблетки можуть бути вкриті оболонкою способами, відомими в даній галузі. Пероральні рідкі препарати можуть бути у формі, наприклад, водних або масляних суспензій, розчинів, емульсій, сиропів або еліксирів, або можуть бути представлені як сухий продукт для змішування з водою або іншим прийнятним носієм перед застосуванням. Такі рідкі препарати можуть містити звичайні добавки, такі як суспенгатори, емульгатори, неводні носії (які можуть включати харчові масла) або консерванти. Сполуки Формули (1) та/або (2) можуть також бути утворені для парентерального введення (наприклад, ін'єкцією, наприклад, болюсною ін'єкцією або безперервною інфузією) і можуть бути представлені у одиничній дозованій формі в ампулах, попередньо наповнених шприцах, інфузії малого об'єму або в багатократнодозових контейнерах з додаванням консерванту. Композиції можуть прийняти такі форми, як суспензії, розчини або емульсії в масляних або водних носіях, і можуть містити ад'юванти, такі як суспенгатори, стабілізатори та/або диспергатори. Альтернативно, активний інгредієнт може бути в порошковій формі, одержаній асептичною ізоляцією стерильної твердої речовини або ліофілізацією з розчину для змішування з прийнятним носієм, наприклад, стерильною апірогенною водою перед застосуванням. Для ректального введення супозиторії одиничної дози, де носій є твердою речовиною, переважні. Прийнятні носії включають масло какао й інші речовини, звичайно використовувані в даній галузі, і супозиторії можна утворити, змішуючи активну сполуку з розм'якшеним або розплавленим носієм з наступним охолодженням і формуванням у формах. Для введення у респіраторний тракт (включаючи інтраназальне введення), сполуки Формули (1) та/або (2) можна призначати будь-яким способом, також як і композиції, використовувані у даній галузі для введення у респіраторний тракт. Таким чином загалом сполуки Формули (1) та/або (2) можна призначати у формі розчину або суспензії, або як сухий порошок. 6 UA 110325 C2 5 10 15 20 25 30 35 40 45 50 55 Розчини таі суспензії переважно будуть водними, наприклад, виготовлені тільки з води (наприклад, стерильна або апірогенна вода) або з води і фізіологічно прийнятного співрозчинника (наприклад, етиловий спирт, пропіленгліколь, поліетиленгліколі, такі як ПЕГ 400). Такі розчини або суспензії можуть додатково містити інші інертні наповнювачі, наприклад, консерванти (такі як хлорид бензалконію), солюбілізатори/сурфактанти, такі як полісорбати ® ® (наприклад. Твін 80, Спан 80, хлорид бензалконію), буфери, ізотонуючі агенти (наприклад хлорид натрію), підсилювачі абсорбції й підсилювачі в'язкості. Суспензії можуть додатково містити суспенгатори (наприклад, мікрокристалічна целюлоза, натрій карбоксиметилцелюлоза). Розчини або суспензії застосовуються безпосередньо до носової порожнини звичайними способами, наприклад, за допомогою крапельниці, піпетки або розпилювача. Композиції можуть бути надані в однократній дозі або багатократних дозах. В останньому випадку за бажанням наданий дозувальний засіб. У випадку крапельниці або піпетки, пацієнт може вводити відповідний, попередньо визначений об'єм розчину або суспензії. У випадку розпилювача це може бути досягнуте, наприклад, дозувальним пристроєм розпилювача. Аерозольна композиція може також використовуватися для введення у респіраторний тракт, де сполуки Формули (1) та/або (2) надані в герметичному контейнері з прийнятним пропелентом, таким як хлор-фтор-вуглець (CFC), наприклад дихлордифторметан, трихлорфторметан або дихлортетрафторетан, діоксид вуглецю або інший прийнятний газ. Аерозоль звичайно може також містити сурфактант, такий як лецитин. Дозу препарату можна контролювати дозувальним клапаном. Альтернативно, сполуки Формули (1) та/або (2) можуть бути надані у формі сухого порошку, наприклад, порошкова суміш сполуки з прийнятною порошковою основою, такою як лактоза, крохмаль, похідні крохмалю, такі як гідроксипропілметилцелюлоза і полівінілпіролідин (PVP). Зазвичай порошковий носій буде утворювати гель у носовій порожнині. Порошкова композиція може бути представлена у одиничній дозованій формі, наприклад, у капсулах або картриджах, наприклад желатинова або блістерна упаковка, з якої порошок можна вводити інгалятором. У композиціях, призначених для введення у респіраторний тракт, включаючи інтраназальні композиції, сполуки взагалі будуть мати розмір частинок, наприклад, приблизно 5 мікрон або менше. Такий розмір частинок може бути одержаний способами, відомими в даній галузі, наприклад, мікронізацією. Коли бажано можуть використовуватися композиції, пристосовані до пролонгованого вивільнення активного інгредієнта. Сполуки Формули (1) та/або (2) можуть також використовуватися в комбінації з іншими терапевтичними агентами, наприклад, протиінфекційними агентами, такими як антибіотики, противірусні засоби і агенти для лікування респіраторних розладів. Винахід таким чином забезпечує в додатковому аспекті комбінацію, що включає сполуки Формули (1) та/або (2) або їх фармацевтично прийнятні похідні разом з іншим терапевтично активним агентом. Комбінації, згадані вище, звичайно можуть бути представлені для використання у формі фармацевтичної композиції і таким чином такі композиції, що включають вище згадувану комбінацію разом з фармацевтично прийнятним носієм складають подальший аспект винаходу. Індивідуальні компоненти таких комбінацій можна призначати або послідовно, або одночасно в окремих або комбінованих фармацевтичних композиціях. Коли сполуки Формули (1) та/або (2) використовуються із другим терапевтично активним агентом, доза кожної сполуки може бути однаковою або відрізнятися від застосовуваної, коли кожна сполука використовується самостійно. Відповідні дози будуть зрозумілі фахівцям. Сполуки Формули (1) та/або (2) і їх фармацевтично прийнятні похідні можуть бути одержані будь-якими способами, відомими в галузі одержання сполук аналогічної структури. В іншому аспекті винаходу наданий спосіб скринінгу сполук для лікування респіраторного розладу, згадуваний спосіб включає: піддавання клітини, що має пригнічені сіалілглікокон'югати на клітинній поверхні дії тестової сполуки; і визначення відновлення життєздатності клітини після піддавання клітини дії тестової сполуки. Базуючись на даному винаході, інші сполуки можуть використовуватися, щоб сприяти відновленню сіалілглікокон'югатів на поверхні респіраторної клітини; або сприяти відновленню життєздатності клітини шляхом їх здатності прискорювати біосинтез сіалілглікокон'югату. Отже, відновлення клітин до кращого стану для нормальної біологічної функції, щоб реагувати на фактори, які можуть впливати на поверхню респіраторного тракту, що приводять до 7 UA 110325 C2 5 10 15 20 25 30 35 40 45 50 55 60 респіраторних розладів, може бути досягнуте, забезпечуючи відновлений на клітинній поверхні сіалілглікокон'югат. Цей спосіб включає одержання клітини, переважно респіраторної клітини, яка має пригнічені сіалілглікокон'югати на поверхні. Цю клітину називають як "гола клітина", яка вразлива для факторів, які можуть впливати на її здатність нормально функціонувати. Клітина може бути виділена, піддаючи нормальну клітину, таку як респіраторна клітина, дії нейрамінідази, щоб видалити сіалову кислоту з сіалілглікокон'югатів на клітинній поверхні. Цю клітину потім вимірюють на здатність тестової сполуки відновити сіалілглікокон'югати на її поверхні. Тестова сполука може відновити сіалілглікокон'югати, прискорюючи біосинтез сіалілглікокон'югату або іншими механізмами, які приводять до відновлення сіалілглікокон'югатів на клітинній поверхні. Здатність відновлювати сіалілглікокон'югати на поверхні клітин може бути визначена відновленням життєздатності клітини. Життєздатність клітини може бути визначена будь-яким способом, доступним фахівця. Однак, це може бути визначене здатністю клітин до клітинної проліферації. Це може бути визначено за допомогою стандартних наборів клітинної проліферації, таких як, набір ELISA клітинної проліферації, але не обежується ним, щоб виміряти BrdU, включений у новосинтезовану ДНК репродукованої клітини або за допомогою 3 [ H]-тимідин-базового дослідження клітинної проліферації. Здатність може також бути визначена, визначаючи кількість сіалілглікокон'югатів, відновлених на клітині як наслідок піддавання клітини дії тестової сполуки. Це може бути визначено способами, доступними фахівцю, але не обмежується такими як, використання антитіл до сіалілглікокон'югатів. У ще одному втіленні наданий спосіб лікування або профілактики респіраторного розладу у суб'єкта, спосіб, що включає стадію призначення суб'єкту принаймні однієї сполуки, ідентифікованої скринінговим способом. Зрештою, вищеописаний винахід схильний до варіацій, модифікацій та/або доповнень, крім певно описаних, і мається на увазі, що винахід включає всі такі варіації, модифікації та/або доповнення, які можуть бути зроблені, потрібно мати на увазі, що різні інші модифікації та/або доповнення знаходяться в межах опису, як описано вище. Наступні приклади наведені тільки в ілюстративних цілях і не повинні розглядатися як обмеження винаходу. ПРИКЛАДИ Загальні способи, використовувані в Прикладах - ЯМР реєстрували на Bruker Avance 300, версія 3,5 Xwin-ЯМР на DPX 300A. - МС реєстрували на мас-спектрометрі Waters Micromass ZMD, використовуючи ESI (іонізація електророзпиленням). Системою управляли, використовуючи Water Mass Lynx NT. - Колонкову флеш-хроматографію виконували на силікагелі 60 F245 (E. Merck). - Тонко-шарова хроматографія (TLC) була виконана на попередньо вкритих силікагелем пластинах (E. Merck). - ВЕРХ здійснювали на сепараційному модулі Waters alliance 2690, виявляючи Waters двоканальним УФ 2487 детектором, програмне забезпечення - Waters Millenium 32 - Клітинна культура й дослідження життєздатності клітини - Спосіб 1 Використовувані клітини: Епітеліальні Клітини Малого Респіраторного Тракту (ЕКМРТ) Середовище: SAGM Bullet набір (SABM + стимулятор росту) Та/або Використовувані клітини: Нормальні Людські Бронхіальні Епітеліальні Клітини (НЛБЕК) Середовище: SAGM Bullet набір(BEBM + стимулятор росту) Експериментальні деталі: 6 2 Кріоконсервовані клітини (1 × 10 клітин на мл) піддавали таненню і культивували на 175 cм чашках Петрі в повному середовищі. Середовище вилучали наступного дня й заміняли новим середовищем. Клітини культивували протягом приблизно 5-6 днів, щоб одержати 70-80 % злиття. Протягом фази росту середовище міняли через день. Після одержання прийнятного злиття, середовище вилучали. Мономолекулярний шар клітин промивали lx ФСБР. Після видалення ФСБР додавали 2 мл трипсин+ЕДТОК. Клітини обережно струшували при кімнатній температурі протягом 2 хв. Клітини збирали з lx ФСБР, центрифугували 200 г протягом 10 хв. Осад повторно суспендували до 5 × 104/мл. Клітини аліквотували в 96-лункові планшети 100 мкл/лунку (приблизно 5000 клітин/лунку). Клітини інкубували при 37 °C протягом 24 годин. Бактеріальну нейрамінідазу (від Clostridium perfringens), 10 мкл додавали у кожну лунку до кінцевої концентрації 0,01 Од/мл для ЕКМРТ і 0,008 Од/мл для НЛБЕК. Клітини потім інкубували 8 UA 110325 C2 5 10 15 20 протягом 6 год. при 37 °C. Центрифугування планшету здійснювали при 1000 об/хв протягом 10 хвилин, середовище піддавали аспірації й додавали 200 мкл свіжого середовища. Планшет центрифугували знову, середовище заміняли 100 мкл нового середовища. Сполуки для тестування склали в сумі 6x бажаної концентрації; 20 мкл сполуки додавали до кожної лунки в трьох екземплярах. Клітини потім інкубували при 37 °C протягом 24 годин. Клітини мітили протягом ночі (приблизно 16 год.) при 37 °C з 10 мкл ярлика BrdU (Набір ELISA клітинної проліферації - Roche). Мічене середовище видаляли і клітини фіксували і денатурували протягом 30 хвилин при кімнатній температурі, використовуючи фіксувальний розчин, постачений виробником. Після видалення фіксувального розчину, 100 мкл анти-BrdU-POD (при прийнятній концентрації, як запропоновано виробником) додавали до кожної лунки. Планшет інкубували при кімнатній температурі протягом 90 хв. Кон'юговане антитіло видаляли і лунки промивали три рази з 200 мкл промивного розчину (постаченого). Після видалення або промивання розчином, додавали 100 мкл розчину субстрату (постаченого); і інкубували при кімнатній температурі протягом 30 хв. Реакцію зупиняли додаванням 50 мкл 1M H2S04. Спектральну поглинальну здатність зразків визначали при 450 нм (еталонна довжина хвилі 690 нм). Епітеліальні клітини малого респіраторного тракту (ЕКМРТ), оброблені нейрамінідазою (NA) 0,01 Од/мл із Clostridium perfringens. Життєздатність клітини (середнє значення ± ССП, n=20), Контроль (нормальна клітина) 100 % 72,82 % ± 7,26 Контроль, оброблений NA Нормальні Людські Бронхіальні Епітеліальні Клітини (НЛБЕК), оброблені нейрамінідазою (NA) 0,008 Од/мл із Clostridium perfringens. 25 Життєздатність клітини (середнє значення ± ССП, n=20), Контроль (нормальна клітина) 100 % Контроль, оброблений NA 30 35 40 73,30 % ± 7,12 Дослідження життєздатності клітини звичайно давало експлуатаційне відхилення ± 10 %. Тому, результати, які показали життєздатність клітини ≥ 120 % проти контролю (оброблені нейрамінідазою), розглянуті як суттєві. Це означає, що сполуки з позитивними результатами могли відновити життєздатність клітини протягом 48 годин. Серед сполук Формули (1) та/або (2) найбільш активними сполуками з низькою цитотоксичністю були N-ацетилманозамін (Сполука 1) і N-ацетилнейрамінова кислота (Сполука 2). - Спосіб 2 Використовувані клітини: Епітеліальні Клітини Малого Респіраторного Тракту (ЕКМРТ) Середовище: набір SAGM Bullet (SABM + стимулятор росту) Та/або Використовувані клітини: Нормальні Людські Бронхіальні Епітеліальні Клітини (НЛБЕК) Середовище: набір SAGM Bullet (BEBM + стимулятор росту) Експериментальні деталі: 6 Кріоконсервовані клітини (1 × 10 клітин на 1 мл) піддавали таненню і культивували на 175 2 cм чашках Петрі в повному середовищі. Середовище видаляли наступного дня й заміняли новим середовищем. Клітини культивували протягом приблизно 5-6 днів, щоб одержати 7080 % злиття. Протягом фази росту середовище заміняли через день. 9 UA 110325 C2 5 10 15 20 25 30 35 40 45 50 55 60 Коли прийнятне злиття було одержане, середовище видаляли. Мономолекулярний шар клітин промивали 1 x ФСБР. Після видалення ФСБР додавали 2 мл трипсин+ЕДТОК. Клітини обережно струшували при кімнатній температурі протяхом 2 хв. Клітини збирали з 1 x ФСБР, центрифугували по 200 г протягом 10 хв. Осад ресуспедували до 5 × 104/мл. Клітини аліквотували в 96-лункові планшети 100 мкл/лунку (приблизно 5000 клітин/лунку). Клітини інкубували при 37 °C протягом 24 годин. Вірусну нейрамінідазу (з вірусу грипу NWS/G70C) по 10 мкл додавали у кожну лунку до заключної концентрації 0,017 мкг/мл. Клітини потім інкубували протягом 6 год. при 37 °C. Центрифугування планшету здійснювали при 1000 об/хв протягом 10 хвилин, середовище піддавали аспірації і додавали 200 мкл свіжого середовища. Планшет центрифугували знову, середовище заміняли 100 мкл нового середовища. Сполуки для тестування склали в сумі 6x бажаної концентрації; 20 мкл сполуки додавали до кожної лунки в трьох екземплярах. Клітини потім інкубували при 37 °C протягом 24 годин. Клітини мітили протягом ночі (приблизно 16 год.) при 37 °C з 10 мкл ярлика BrdU (Набір ELISA клітинної проліферації - Roche). Мічене середовище видаляли і клітини фіксували і денатурували протягом 30 хвилин при кімнатній температурі з фіксувальним розчином, постаченим виробником. Після видалення фіксувального розчину, 100 мкл анти-BrdU-POD (при прийнятній концентрації як запропоновано виробником) додавали до кожної лунки. Планшет інкубували при кімнатній температурі протягом 90 хв. Кон'юговане антитіло видаляли і лунки промивали три рази 200 мкл промивного розчину (постаченого). Після видалення промивного розчину, 100 мкл розчину субстрату (постаченого) додавали й інкубували при кімнатній температурі протягом 30 хв. Реакцію зупиняли додаванням 50 мкл 1M H2SO4. Спектральну поглинальну здатність зразків визначали при 450 нм (еталонна довжина хвилі 690 нм). Приклад 1. Одержання N-ацетил-D-манозаміну (1). 1 2 3 4 [Сполука (1), формула (1), B=H, A=NHCOCH3, R =R =R =R =H] 1г N-ацетил-D-глюкозаміну, отриманого гідролізом хітину, розчиняли в 3 мл води, потім коригували до рН>11 використовуючи 30 % розчин NaOH. Суміш відстоювали при 20 °C~40 °C протягом 48 годин. Одержаний розчин нейтралізували до рН 6,5~7,0 5N H 2SO4, потім випаровували при зниженому тиску до сухості. Тверду речовину нагрівали зі зворотним холодильником в етанолі протягом 10 хв., охолоджували до кімнатної температури і фільтрували. Фільтрат випаровували до сухості під вакуумом, щоб одержати білу тверду речовину, яка містить 85 % N-ацетил-D-манозаміну і 15 % N-ацетил-D-глюкозаміну, як 1 визначено H-ЯМР. Цю тверду речовину піддавали фракційній перекристалізації з етанол/ізопропанол/ЕА, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини(125 мг, 62,5 %, виходячи з 20 % швидкості конверсії N-ацетил-D-манозаміну). Непрореагований N-ацетил-D-глюкозамін (0,8 г) може повторно використовуватися для наступної партії реакції. 1 H-ЯМР (D2O) δ (млн.ч.) 5,15 (д, 0,7Н), 3,85~3,32 (м, 6,3Н), 1,99 (с, 3H). МС 222 (M+1) Приклад 2. Одержання натрієвої солі N-ацетил-нейрамінової кислоти (2). 8 10 11 12 13 9 [Сполука (2), Формула (2), R =R =R =R =R =H, R =Na] До розчину N-ацетилманозаміну (2,7 г, 12,2 ммоль) рН 7,0~7,5 і пірувату натрію (2,7г, 24,5ммоль) у воді (15 мл) додавали діалізний мішок (відключений MW 20000), що містить Nацетилнейрамінатліазу [EC 4,1,3,3] (25 одиниць) у реакційну суміш N-ацетилманозаміну (0,54 г) і пірувату натрію (0,54 г) у воді (3 мл) при рН 7,0-7,5. Реакційну суміш струшували при 60 об/хв при 30 °C протягом 5 днів. Ензимний мішок вилучали і повторно використовували для нової партії реакції. Реакційну суміш розбавляли з водою (15 мл), потім пропускали через колонку IRA Amberlite 400 (форма HCOO ) (150 мл). Смолу потім промивали водою (300 мл), елюювали 0,5M розчином HCOOH. Елюат збирали і випаровували під вакуумом до сухості. Залишок розчиняли у воді (2 мл), потім розбавляли із крижаною оцтовою кислотою (10 мл) при 4 °C протягом ночі, фільтрували кристали, промивали з EtOH, висушували, щоб одержати N-ацетилнейрамінову кислоту у вигляді білого кристалічного порошку (1,5г, 39,8 %). 1 H-ЯМР (D2O) δ (млн.ч.) 4,00 (м, 1H), 3,97 (м, 1H), 3,87 (д, 1H), 3,77 (дд, 1H), 3,67 (м, 1H), 3,55 (дд, 1H), 3,48 (д, 1H), 2,24 (дд, 1H, J=13,2 Гц, 5,1 Гц), 1,98 (с, 3H), 1,83 (дд, 1H, J=13,2 Гц, 11,5 Гц). МС 310 (M+1) 10 UA 110325 C2 5 10 15 20 25 30 35 40 45 50 55 60 N-ацетилнейрамінову кислоту (1г, 3,23 ммоль) розчиняли у воді (20 мл), потім перемішували з NaHCO3 (0,26г, 3,09 ммоль до рН 6~6,5), після ліофілізації одержували вказаний в заголовку продукт у вигляді білого порошку (1,05г, 98 %). Приклад 3. Одержання етил N-ацетил-нейрамінату (3). До суспензії N-ацетил-нейрамінової кислоти (1г, 3,23ммоль) у безводному етанолі (75 мл) додавали ацетилхлорид 1,5 мл. Суміш герметизували і перемішували при кімнатній температурі протягом 16 годин, щоб утворити чистий розчин. Одержаний розчин випаровували до сухості під вакуумом. Білу тверду речовину промивали з етилацетатом і висушували вакуумом, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини (1г, 91,7 %). 1 H-ЯМР (D2O) δ (м.д.) 4,27 (к, 2H), 4,04 (м, 2H), 3,91 (д, 1H), 3,78 (дд, 1H), 3,68 (дд, 1H), 3,57 (дд, 1H), 3,52 (д, 1H), 2,28 (дд, 1H), 2,01 (с, 3H), 1,88 (дд, 1H), 1,28 (т, 3H). МС 338 (M+1), 360 (M+23) Приклад 4. Одержання етил 5-ацетамід-4,7,8,9,-тетра-О-ацетил-3,5-дидеокси-β-D-гліцеро-Dгалакто-2-нонулопіранозонату (етил 5-ацетамід-4,7,8,9-тетра-О-ацетил-нейрамінат) (4). До перемішуваного розчину оцтового ангідриду (0,72г) і водної 60 % хлорної кислоти (5 мкл) при 40 °C порційно додавали більше 30 хв. етил 5-ацетамід-нейрамінат (230 мг, 0,68 ммоль). Одержану суміш перемішували при 40 °C протягом 2 годин. Потім охолоджували до кімнатної температури, розбавляли з холодною водою (10 мл), насичували сульфатом амонію, екстрагували з етилацетатом (40 мл x 3). Органічні екстракти комбінували й промивали з насиченим розчином NaHCO3 і водою послідовно. Органічний шар висушували над MgSO 4, і випаровували у вакуумі до сухості. Залишок розчиняли в етилацетаті, розведеному з гексаном, одержуючи вказану в заголовку сполуку у вигляді білого кристалу (223 мг, 65 %). 1 H-ЯМР (CDCl3) δ (млн.ч.) 5,71 (м, 1H), 5,36 (дд, 1H, J=1,5 Гц, 5,6 Гц), 5,25 (ддд, 1H, J=2,4 Гц, 7,5 Гц), 5,22 (ддд, 1H, J=11,4 Гц, 5,4 Гц, 9,5 Гц), 4,51 (дд, 1H, J=12,4 Гц), 4,47 (д, 1H, J=0,8 Гц), 4,21~4,13 (м, 4H), 4,03 (дд, 1H), 2,26 (ддд, 1H, 12,8 Гц), 2,19 (дд, 1H), 2,15, 2,11, 2,03, 2,02 і 1,91 (5с, 15H), 1,29 (т, 3H, J=7,2 Гц). МС 506 (M+1) Приклад 5. Одержання цитидин-5’-монофосфо-5-ацетамід-3,5,-дидеокси-β-D-гліцеро-Dгалакто-2-нонулопіранозонової кислоти (ЦМФ-сіалова кислота) (5). N-ацетилнейрамінову кислоту (100 мг, 0,32ммоль) і натрієву сіль цитидин-5’-трифосфату (156,3 мг, 0,32ммоль) розчиняли в 32 мл Tris-HCl буфера (100 мм, рН 8,8), що містить MgСl2 (20 мм). До цього розчину додавали ЦМФ-Neu5Ac синтетазу (5 мг, із N. meningitidis). Реакційну суміш інкубували при 37 °C протягом 2~3 годин, одночасно вимірюючи ТШХ (силікагель, EtOH:1M NH4HCO3=7:3). Реакційну суміш розбавляли з метанолом (50 мл) і фільтрували. Фільтрат випаровували під зниженим тиском до сухості. Залишок піддавали хроматографії на Bio Gel P-2 смолі (50 мл), одержуючи вказану в заголовку сполуку після висушування сублімацією у вигляді білого кристалічного порошку (147 мг, 75 %). Аналіз ВЕРХ: - Колонка C-18, - Мобільна фаза: буфер А (0,1M буфер фосфату калію, збагачений 8 мМ тетра-бутиламонію гідросульфатом, рН 5,3) і буфер B (70 % буфер А плюс 30 % метанол, рН 5,9), - Умови градієнта: 100 % буфер А протягом 2,5 хвилин, 0~40 % буфер B протягом 7,5 хвилин, 40~100 % буфер B протягом 1 хвилини, 100 % буфер B протягом 4 хвилин, 100~0 % буфер B протягом 1 хвилини, супроводжуваний фазою приведення в рівновагу 100 % буфером А протягом 4 хв. - Швидкість потоку: 1 мл/хв. - УФ виявлення при 270 нм 1 H-ЯМР (D2O) δ (млн.ч.) 7,87 (д, 1H, Гц J=7,6), 6,25 (д, 1H, Гц J=7,6), 5,91 (д, 1H, J=4,4 Гц), 4,26~4,20 (м, 2H), 4,17~4,10 (м, 3H), 4,09~3,98 (м, 2H), 3,90~3,80 (м, 3H), 3,59~3,40 (м, 2H), 2,42 (дд, 1H, J=4,8, 13,2 Гц), 1,98 (с, 3H), 1,60 (дт, 1H, J=5,6, 12,6 Гц). 2+ МС 635 (M + Na ) Приклад 6. Одержання етил 5-ацетамід-8,9-О-ізопропіліден-нейрамінату (6). До розчину етил 5-ацетамід-нейрамінату (150 мг, 0,445ммоль) у безводному ДМФ (2 мл) додавали 2,2-диметоксипропан (1 мл, 8 ммоль) і Amberlyst 15 (50 мг). Суміш перемішували при 60 °C протягом 7 годин, потім охолоджували до кімнатної температури й фільтрували. Фільтрат випаровували під зниженим тиском до сухості. ТШХ (силікагель, EA/MeOH=10:4) вказувала на завершення реакції. Залишок повторно розчиняли в EA/MeOH=10/1 (1 мл), потім піддавали 11 UA 110325 C2 5 колонковій флеш-хроматографії. Необхідні фракції комбінували й випаровували у вакуумі до сухості, одержуючи вказану в заголовку сполуку у вигляді білої речовини (135 мг, 75 %). 1 H-ЯМР (D2O) δ (млн.ч.) 4,28~4,23 (м, 2H), 4,23~4,11 (м, 2H), 4,08~3,92 (м, 2H), 3,96~3,52 (м, 3H), 2,31 (дд, 1/ 3Н), 2,23 (дд, 2/ 3Н), 1,99 (с, 3H), 1,82 (дд, 2/ 3Н), 1,70 (дд, 1/ 3Н), 1,36 (с, 3H), 1,32 (с, 3H), 1,25 (т, 3H). МС 428 (M+Na) Приклад 7: Активність сполуки (1) щодо відновлення життєздатності Епітеліальних Клітин Малого Респіраторного Тракту (ЕКМРТ) 1 2 3 4 Сполука (1) [Формула (1), B=H, A=NHCOCH3, R =R =R =R =H] 10 Життєздатність клітини (середнє значення ±ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (1) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 171 % ± 6,33 175 % ± 2,33 146 % ± 7,10 139 % ± 3,46 157 % ± 4,47 Приклад 8: Активність сполуки (1) щодо відновлення життєздатності Нормальних Людських Бронхіальних/Трахеальних Епітеліальних Клітин (НЛБЕК) Життєздатність клітини (середнє значення ±ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (1) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 125 % ± 3,20 124 % ± 2,21 120 % ± 0,79 119 % ± 2,23 116 % ± 1,42 15 Приклад 9. Активність сполуки (2) щодо відновлення життєздатності ЕКМРТ 8 10 11 12 13 9 Сполука (2) [Формула (2), R =R =R =R =R =H, R =Na] Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (2) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 0,05 мкг/мл 0,012 мкг/мл 0,003 мкг/мл 20 129 % ± 3,96 127 % ± 2,51 115 % ± 1,56 130 % ± 2,18 129 % ± 3,22 138 % ± 0,50 140 % ± 2,15 124 % ± 1,91 Приклад 10: Активність сполуки (2) щодо відновлення життєздатності НЛБЕК 12 UA 110325 C2 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (2) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 137 % ± 1,00 127 % ± 4,02 117 % ± 3,22 117 % ± 0,68 126 % ± 0,21 Приклад 11. Активність сполуки (3) щодо відновлення життєздатності ЕКМРТ 8 10 11 12 13 9 Сполука (3) [Формула (2), R =R =R =R =R =H, R =C2H5] 5 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (3) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,05 мкг/мл 104 % ± 1,66 107 % ± 0,41 109 % ± 1,41 103 % ± 3,43 104 % ± 1,46 Приклад 12: Активність сполуки (3) щодо відновлення життєздатності НЛБЕК Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (3) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 0,05 мкг/мл 0,012 мкг/мл 0,003 мкг/мл 10 106 % ±1,35 100 % ± 0,88 113 % ± 0,84 111 % ± 4,73 114 % ± 5,14 130 % ± 5,19 130 % ± 6,11 154 % ± 4,91 Приклад 13: Активність сполуки (4) щодо відновлення життєздатності ЕКМРТ 8 9 10 11 12 13 Сполука (4) [Формула (2), R =H, R =C2H5, R =R =R =R =CH3CO] Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (4) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 0,05 мкг/мл 0,012 мкг/мл 0,003 мкг/мл 99 % ± 4,00 97 % ± 3,00 100 % ± 1,80 115 % ± 4,40 121 % ± 1,80 106 % ± 6,09 116 % ± 0,10 110 % ± 1,09 Приклад 14: Активність сполуки (4) щодо відновлення життєздатності НЛБЕК 15 13 UA 110325 C2 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (4) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 0,05 мкг/мл 0,012 мкг/мл 0,003 мкг/мл 110 % ± 1,02 117 % ± 0,29 111 % ± 4,54 110 % ± 3,77 125 % ± 1,46 115 % ± 5,22 113 % ± 6,85 83 % ± 0,88 Приклад 15: Активність сполуки (5) щодо відновлення життєздатності ЕКМРТ 8 9 10 11 12 13 Сполука (5) [формула (2), R =монофосфат цитидину, R =R =R =R =R =H] 5 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (5) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 116 % ± 5,30 108 % ± 1,20 141 % ± 1,70 141 % ± 1,09 145 % ± 4,89 Приклад 16: Активність сполуки (5) щодо відновлення життєздатності НЛБЕК Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (5) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 10 116 % ± 0,93 109 % ± 3,60 112 % ± 2,59 109 % ± 1,92 89 % ± 0,79 Приклад 17: Активність сполуки (6) щодо відновлення життєздатності ЕКМРТ 8 9 10 11 12 13 Сполука (6) [формула (2), R =H, R =C2H5, R =R =H, R і R => C (CH3)2] Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (6) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 119 % ± 3,17 125 % ± 1,13 123 % ± 5,02 135 % ± 3,27 140 % ± 1,92 Приклад 18. Активність сполуки (6) щодо відновлення життєздатності НЛБЕК 15 14 UA 110325 C2 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (6) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 0,05 мкг/мл 0,012 мкг/мл 0,003 мкг/мл 90 % ± 8,36 99 % ± 3,17 121 % ± 2,10 128 % ± 3,60 133 % ± 0,88 127 % ± 1,81 122 % ± 3,33 141 % ± 4,70 Приклад 19: Активність сполуки (7) щодо відновлення життєздатності ЕКМРТ 1 2 3 4 Сполука (7) [Формула (1), B=H, A=NHCOCH3, R =R =R =R =COCH3] 5 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (7) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 0,05 мкг/мл 0,012 мкг/мл 0,003 мкг/мл 73 % ± 2,18 134 % ± 0,81 103 % ± 1,14 112 % ± 1,29 105 % ± 2,01 128 % ± 1,98 105 % ± 1,83 102 % ± 0,62 Приклад 20: Активність сполуки (7) щодо відновлення життєздатності НЛБЕК Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (7) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 0,05 мкг/мл 0,012 мкг/мл 0,003 мкг/мл 10 54 % ± 0,98 117 % ± 4,12 98 % ± 5,65 99 % ± 1,93 100 % ± 0,66 104 % ± 5,85 103 % ± 4,70 85 % ± 2,71 Приклад 21. Активність сполуки (8) щодо відновлення життєздатності ЕКМРТ 1 2 3 4 Сполука (8) [Формула (1), B=H, A=NHCOCH3, R =H, R =R =R =COCH3] 15 UA 110325 C2 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (8) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 0,05 мкг/мл 0,012 мкг/мл 0,003 мкг/мл 91 % ± 3,36 104 % ± 1,95 109 % ± 2,79 103 % ± 3,21 115 % ± 3,52 109 % ± 1,16 Не визначена 125 % ± 8,51 Приклад 22: Активність сполуки (8) щодо відновлення життєздатності НЛБЕК Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (8) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 0,05 мкг/мл 0,012 мкг/мл 0,003 мкг/мл 42 % ± 1,55 81 % ± 0,60 111 % ± 2,44 133 % ± 2,09 96 % ± 1,21 93 % ± 1,38 118 % ± 3,19 129 % ± 1,70 5 Приклад 23: Активність сполуки (9) щодо відновлення життєздатності ЕКМРТ 1 2 3 4 Сполука (9) [Формула (1), A=H, B=NHCOCH3, R =R =R =R =H] Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (9) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 10 122 % ± 3,21 119 % ± 3,04 115 % ± 3,17 120 % ± 3,14 121 % ± 2,42 Приклад 24. Активність сполуки (9) щодо відновлення життєздатності НЛБЕК Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (9) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 106 % ± 2,52 106 % ± 3,49 108 % ± 3,24 107 % ± 1,26 107 % ± 3,41 Приклад 25. Активність D-Глюкози щодо відновлення життєздатності ЕКМРТ 16 UA 110325 C2 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % 94 % ± 3,04 103 % ± 1,05 101 % ± 2,30 Контроль (оброблені нейрамінідазою) D-Глюкоза 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл Приклад 26: Активність D-Глюкози щодо відновлення життєздатності НЛБЕК Життєздатність клітини (середнє значення ± ССП, n=3) 100 % 106 % ± 2,76 104 % ± 2,13 107 % ± 3,05 99 % ± 3,15 104 % ± 2,96 Контроль (оброблені нейрамінідазою) D-Глюкоза 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 5 Приклад 27. Активність сполуки (1) у високій концентрації щодо відновлення життєздатності ЕКМРТ Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (1) 5 мг/мл 1,25 мг/мл 312,5 мкг/мл 78,1 мкг/мл 10 118 % ± 2,15 121 % ± 3,02 115 % ± 1,51 127 % ± 2,30 Приклад 28: Активність сполуки (1) у високій концентрації щодо відновлення життєздатності НЛБЕК Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (1) 5 мг/мл 1,25 мг/мл 312,5 мкг/мл 78,1 мкг/мл 15 116 % ± 2,11 125 % ± 2,02 131 % ± 3,04 128 % ± 1,85 Приклад 29: Активність сполуки (2) у високій концентрації щодо відновлення життєздатності ЕКМРТ Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (2) 5 мг/мл 1,25 мг/мл 312 мкг/мл 78,1 мкг/мл 129 % ± 1,76 115 % ± 1,38 118 % ± 1,95 135 % ± 2,06 Приклад 30: Активність сполуки (2) у високій концентрації щодо відновлення життєздатності НЛБЕК 20 17 UA 110325 C2 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (2) 5 мг/мл 1,25 мг/мл 312,5 мкг/мл 78,1 мкг/мл 122 % ± 2,05 129 % ± 3,13 118 % ± 2,17 107 % ± 1,38 Приклад 31: Активність сполуки (9) у високій концентрації щодо відновлення життєздатності ЕКМРТ 5 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (обробка з нейрамінідазою) Сполука (9) 5 мг/мл 1,25 мг/мл 312,5 мкг/мл 78,1 мкг/мл 83 % ± 2,85 96 % ± 3,16 90 % ± 3,28 100 % ± 2,92 Приклад 32: Активність сполуки (9) у високій концентрації щодо відновлення життєздатності НЛБЕК Життєздатність клітини (середнє значення ± ССП, n=3) 100 % Контроль (оброблені нейрамінідазою) Сполука (9) 5 мг/мл 1,25 мг/мл 312,5 мкг/мл 78,1 мкг/мл 76 % ± 2,71 96 % ± 2,42 95 % ± 2,85 125 % ± 3,23 10 Приклад 33: Активність суміші сполуки (1) (85 %) і сполуки (9) (15 %) у високій концентрації щодо відновлення життєздатності ЕКМРТ Життєздатність клітини (середнє значення ± ССП, n=3) 100 % 88 % ± 1,82 91 % ± 2,03 87 % ± 2,52 94 % ± 1,91 Контроль (оброблені нейрамінідазою) Суміш сполуки (1) і (9) 5 мг/мл 1,25 мг/мл 312,5 мкг/мл 78,1 мкг/мл 15 Приклад 34: Активність суміші сполуки (1) (85 %) і сполуки (9) (15 %) у високій концентрації щодо відновлення життєздатності НЛБЕК Життєздатність клітини (середнє значення ± ССП, n=3) 100 % 89 % ± 2,31 107 % ± 2,48 105 % ± 2,02 95 % ± 3,12 Контроль (оброблені нейрамінідазою) Суміш сполуки (1) і (9) 5 мг/мл 1,25 мг/мл 312,5 мкг/мл 78,1 мкг/мл 20 Приклад 35: Активність суміші сполуки (1) (85 %) і сполуки (9) (15 %) щодо відновлення життєздатності ЕКМРТ 18 UA 110325 C2 Життєздатність клітини (середнє значення ± ССП, n=3) 100 % 101 % ± 3,41 107 % ± 3,91 121 % ± 4,82 120 % ± 4,11 115 % ± 4,02 113 % ± 4,30 107 % ± 4,12 108 % ± 4,20 Контроль (оброблені нейрамінідазою) Суміш сполуки (1) і (9) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 0,77 мкг/мл 0,19 мкг/мл 0,05 мкг/мл 0,01 мкг/мл 0,003 мкг/мл Приклад 36. Активність суміші сполуки (1) (85 %) і сполуки (9) (15 %) щодо відновлення життєздатності НЛБЕК Життєздатність клітини (середнє значення ± ССП, n=3) 100 % 121 % ± 2,05 109 % ± 1,98 115 % ± 1,76 Контроль (оброблені нейрамінідазою) Суміш сполуки (1) і (9) 50 мкг/мл 12,5 мкг/мл 3,1 мкг/мл 5 10 15 [9] [10] Приклад 37. Експериментальний кашель у морських свинках Самці морських свинок поміщали у вольєр і вони мали вільний доступ до води і їжі. Це дослідження було схвалено Етичним Комітетом Інституту Тварин Bio21. Двадцять чотири самці морських свинок Hartley у стані свідомості (500~550г) були розділені на A, B, C три групи (8 тварин у кожній групі) і попередньо оброблені розчином нейрамінідази 5 Од/мл (Sigma N2133, ліофілізований порошок, Тип X, 150~400 Од/мг протеїну) у воді (група B і C) або тільки один сольовий розчин (Група A) у вигляді аерозоля протягом 5 хвилин у перший день. Потім, у перший день, другий і третій, морським свинкам орально вводили 500 мг/кг сполуки (1) (Група C) або тільки воду (Група A і B). На четвертий день усі тварини були сенсибілізовані 0,5 M розчином лимонної кислоти (експозиція розпиленням 10 хвилин). Частота кашлю, проміжок часу до 1-ого, 2-ого й третього кашлю, і проміжок часу до 1-ого свербіння носа, були потім зареєстровані протягом 15 хвилин. Результати вказали на тенденцію, що сполука (1) допомагає відновити ушкодження, викликані нейрамінідазою. 20 Частота кашлю (за 15 хвилин) Група A (Тільки сольовий розчин як контроль) Група B (обробка нейрамінідазою, як негативний контроль) Група C (перша обробка нейрамінідазою, сполукою (1) протягом 3-х днів) потім 19 13±2,5 19±2,5 16±2,2 UA 110325 C2 Час (секунди) до 1-ого кашлю 2-ого кашлю 3-ого кашлю Група A (тільки вода як контроль) Група B (оброблені нейрамінідазою як негативний контроль) Група C (перша обробка нейрамінідазою, потім обробка сполукою (1) протягом 3 днів) 87±10 157±23 200±25 70±11 109±6 150±20 85±15 137±31 220±10 Час (секунди) до 1-ого потирання носа Група A (тільки вода як контроль) Група B (оброблені нейрамінідазою як негативний контроль) Група C (перша обробка нейрамінідазою, потім обробка сполукою (1) протягом 3 днів) 5 10 15 20 25 30 35 50±4,3 27,7±3,6 49±6,5 Використовуючи сполуку (2) замість сполуки (1) відповідно до того ж самого експериментального протоколу, були отримані подібні результати. ПОСИЛАННЯ [1] Edelman, G.M. і Crossin, K.L. Молекули клітинної адгезії: Значення для молекулярної гістології. Annu. Rev. Biochem. 60, 155~190 (1991). [2] Varki A. Відмінності сіалових кислот. Glycobiology 2, 25~40 (1992). [3] Schauer, R., і інші, Біохімія й роль сіалових кислот. В:Біологія сіалових кислот. A. Rosenberg, вид. Нью-Йорк, США. стор.7~67 (1995). [4] Rens-Domiano, S. і Reisine, T. Структурний аналіз і функціональна роль карбогідратного компонента соматостатинових рецепторів. J. Biol. Chem. 266, 20094~20102 (1991). [5] Keppler, O. T., і інші, Наука 284 (5418), 1372~1376 (1999). [6] Miyata, T., і інші, Archives internationales de pharmacodynamie et de therapie, 296, 202~9 (1988). [7] Miyata, T., і інші, Archives internationales de pharmacodynamie et de therapie, 304, 277~89 (1990). [8] Amir, S.M., і інші, Природа, 211 (5052), 976~7 (1966). [8b] B. Galeano і інші, Мутація в ключовому ферменті біосинтезу сіалових кислот викликає серйозну гломерулярну протеїнурію й виліковується N-ацетилманозаміном. J. Clin. Invest. 2007 117 (6) 1585 ~1594, [8c] Тимчасова заявка на патент США № 60/932,451, подана 31 травня 2007. [9] Laude, E.A. і інші, "Порівняльне дослідження ефектів лимонної кислоти, капсаїцину і резинифератоксину на кашльовий рефлекс у морських свинок і людей". Pulmonary Pharmacology 6, 171~175 (1993). [10] Tanaka, M. і інші, "Механізми кашльового рефлексу, індукованого капсаїцином і лимонною кислотою у морської свинки". J.рНarmacol. Sci., 99, 77~82 (2005). Майбутні заявки на патенти можуть бути подані на основі або заявленого пріоритету даної заявки. Потрібно мати на увазі, що наступні вимоги надані тільки як приклад, і не призначені, щоб обмежити об'єм, що може бути заявлений в будь-якій такій майбутній заявці. Особливості можуть бути додані до або опущені з вимог пізніше, щоб додатково визначити або переглянути винахід або винаходи. Зрештою, потрібно мати на увазі, що різні інші модифікації та/або зміни можуть бути зроблені, не відступаючи від змісту даного винаходу, як наведено тут. 20 UA 110325 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 1. Спосіб відновлення активної клітинної проліферації ушкодженої респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції, де спосіб включає стадію введення суб'єкту після вірусної або бактеріальної респіраторної інфекції ефективної кількості принаймні однієї фармацевтично прийнятої сполуки, де принаймні одну фармацевтично прийнятну сполуку вибирають із групи, що містить сполуки Формули (1) і сполуки Формули (2), де сполука Формули (1) має формулу: , (Формула 1) в якій 1 2 3 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з 5 6 7 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR R R і CO-естери; 5 6 7 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH3CH2(OCH2CH2)mCH3 (m=1-200); 4 1 2 3 R є таким же самим або відмінним від R , R , R і вибраний із групи, що складається з 5 6 7 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR R R , CO-естери і O O P 5' 20 25 30 35 40 R5 ' O R6' ; 6' R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з H або фармацевтично прийнятної неорганічної або органічної солі і фармацевтично прийнятного естеру; один з A і B є H, за умови, що: коли B є H, то A вибраний із групи, що складається з наступного: NHCOCH 3, NH2, ОН, NH2∙HX, або коли A є H, B вибраний із групи, що складається з наступного: NHCOCH3, NH2 і NH2∙HX, де HX представляє фармацевтично прийнятну неорганічну або органічну кислоту; і де сполука Формули (2) має формулу , (Формула 2) де 8 R вибраний із групи, що складається з наступного: H, CH 3, (CH2)nCH3 (n=1-20), CH2Ph, 14 15 16 14 15 16 COCH2Ph, СО-естер і COCR R R ; де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH 3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200); цитидин, монофосфат цитидину, дифосфат цитидину, трифосфат цитидину, аденозин, монофосфат аденозину, дифосфат аденозину і трифосфат аденозину; 9 R вибраний із групи, що складається з H, CH 3, фармацевтично прийнятної неорганічної або 17 18 19 17 18 19 органічної солі або фармацевтично прийнятного естеру; CH2CR R R де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), C6H5 і CH2Ph; 10 11 12 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з 20 21 22 20 21 22 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR R R , де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH2CH2(OCH2CH2)mCH3 (m=1-200); 21 UA 110325 C2 13 10 11 12 R є таким же самим або відмінним від R , R , R і вибраний із групи, що складається з 20 21 22 20 21 22 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR R R , де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200) і O O P 5 10 15 23 R23 O R24 ; 24 R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), CH2Ph або естер і 25 26 27 25 26 27 CH2CR R R або фармацевтично прийнятна неорганічна або органічна сіль, і R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20) і C6H5, CH2Ph. 2. Спосіб за пунктом 1, де принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступного: N-ацетилманозаміну, N-ацетилглюкозаміну, Nацетилнейрамінової кислоти, ЦМФ-сіалової кислоти, їх фармацевтично прийнятних похідних та їх комбінацій. 3. Спосіб лікування респіраторного розладу у суб'єкта після вірусної або бактеріальної респіраторної інфекції, де спосіб включає стадію введення суб'єкту після вірусної або бактеріальної респіраторної інфекції ефективної кількості принаймні однієї фармацевтично прийнятної сполуки, де принаймні одну фармацевтично прийнятну сполуку вибирають із групи, що містить сполуки Формули (1) і сполуки Формули (2), де сполука Формули (1) має формулу: 20 25 , (Формула 1) в якій 1 2 3 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з 5 6 7 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR R R і CO-естери; 5 6 7 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH3CH2(OCH2CH2)mCH3 (m=1-200); 4 1 2 3 R є таким же самим або відмінним від R , R , R і вибраний із групи, що складається з 5 6 7 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR R R , CO-естери і O O P 30 35 5' R5 ' O R6' ; 6' R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з H, або фармацевтично прийнятної неорганічної або органічної солі і фармацевтично прийнятного естеру, один з A і B є H, за умови, що: коли B є H, то A вибраний із групи, що складається з наступного: NHCOCH3, NH2, ОН, NH2∙HX, або коли A є H, B вибраний із групи, що складається з наступного: NHCOCH 3, NH2 і NH2∙HX, де HX представляє фармацевтично прийнятну неорганічну або органічну кислоту; і де сполука Формули (2) має формулу , (Формула 2) 40 де 22 UA 110325 C2 8 5 10 15 R вибраний із групи, що складається з наступного: H, CH 3, (CH2)nCH3 (n=1-20), CH2Ph, 14 15 16 14 15 16 COCH2Ph, СО-естер і COCR R R ; де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH 3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200); цитидин, монофосфат цитидину, дифосфат цитидину, трифосфат цитидину, аденозин, монофосфат аденозину, дифосфат аденозину і трифосфат аденозину; 9 R вибраний із групи, що складається з H, CH 3, фармацевтично прийнятної неорганічної або 17 18 19 17 18 19 органічної солі або фармацевтично прийнятного естеру; CH 2CR R R де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), C6H5 і CH2Ph; 10 11 12 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з 20 21 22 20 21 22 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR R R , де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH2CH2(OCH2CH2)mCH3 (m=1-200); 13 10 11 12 R є таким же самим або відмінним від R , R , R і вибраний із групи, що складається з 20 21 22 20 21 22 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR R R , де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200) і O O P 20 25 30 35 40 45 23 R23 O R24 ; 24 R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), CH2Ph або естер і 25 26 27 25 26 27 CH2CR R R або фармацевтично прийнятна неорганічна або органічна сіль, і R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20) і C6H5, CH2Ph; де респіраторний розлад вибраний із групи, що складається з наступного: кашель, гострий/хронічний бронхіт, хронічне обструктивне легеневе захворювання (ХОЛЗ), муковісцидоз і інші респіраторні запальні розлади. 4. Спосіб за пунктом 3, де принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступного: N-ацетилманозаміну, N-ацетилглюкозаміну, Nацетилнейрамінової кислоти, ЦМФ-сіалової кислоти, їх фармацевтично прийнятних похідних і їх комбінацій. 5. Композиція для відновлення активної клітинної проліферації ушкодженої респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції,де згадана композиція містить ефективну кількість принаймні однієї фармацевтично прийнятної сполуки для введення суб'єкту після вірусної або бактеріальної респіраторної інфекції для відновлення активної клітинної проліферації, де принаймні одну фармацевтично прийнятну сполуку вибирають із групи, що містить сполуки Формули (1) і сполуки Формули (2), де сполука Формули (1) має формулу: , (Формула 1) в якій 1 2 3 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з 5 6 7 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR R R і CO-естери; 5 6 7 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH3CH2(OCH2CH2)mCH3 (m=1-200); 4 1 2 3 R є таким же самим або відмінним від R , R , R і вибраний із групи, що складається з 5 6 7 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR R R , CO-естери і O O P R5 ' O R6' ; 23 UA 110325 C2 5' 5 10 15 20 25 30 6' R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з H або фармацевтично прийнятної неорганічної або органічної солі і фармацевтично прийнятного естеру; один з A і B є H, за умови, що: коли B є H, то A вибраний із групи, що складається з наступного: NHCOCH 3, NH2, ОН, NH2∙HX, або коли A є H, B вибраний із групи, що складається з наступного: NHCOCH 3, NH2 і NH2∙HX, де HX представляє фармацевтично прийнятну неорганічну або органічну кислоту; і де сполука Формули (2) має формулу , (Формула 2) де 8 R вибраний із групи, що складається з наступного: H, CH 3, (CH2)nCH3 (n=1-20), CH2Ph, 14 15 16 14 15 16 COCH2Ph, СО-естер і COCR R R ; де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH 3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200); цитидин, монофосфат цитидину, дифосфат цитидину, трифосфат цитидину, аденозин, монофосфат аденозину, дифосфат аденозину і трифосфат аденозину; 9 R вибраний із групи, що складається з H, CH 3, фармацевтично прийнятної неорганічної або 17 18 19 17 18 19 органічної солі або фармацевтично прийнятного естеру; CH 2CR R R де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), C6H5 і CH2Ph; 10 11 12 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з 20 21 22 20 21 22 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR R R , де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH2CH2(OCH2CH2)mCH3 (m=1-200); 13 10 11 12 R є таким же самим або відмінним від R , R , R і вибраний із групи, що складається з 20 21 22 20 21 22 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR R R , де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200) і O O P 23 35 40 45 R23 O R24 ; 24 R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), CH2Ph або естер і 25 26 27 25 26 27 CH2CR R R або фармацевтично прийнятна неорганічна або органічна сіль, і R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20) і C6H5, CH2Ph. 6. Композиція за пунктом 5, де принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступного: N-ацетилманозаміну, N-ацетилглюкозаміну, Nацетилнейрамінової кислоти, ЦМФ-сіалової кислоти, їх фармацевтично прийнятних похідних і їх комбінацій. 7. Фармацевтична композиція для лікування респіраторного розладу, викликаного ушкодженням респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції, де композиція містить ефективну кількість принаймні однієї фармацевтично прийнятної сполуки для введення суб'єкту після вірусної або бактеріальної респіраторної інфекції для відновлення активності клітинної проліферації, вибраної із групи, що містить сполуки Формули (1) і сполуки Формули (2), де сполука Формули (1) має формулу: 24 UA 110325 C2 5 , (Формула 1) в якій 1 2 3 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з 5 6 7 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR R R і CO-естери; 5 6 7 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH3CH2(OCH2CH2)mCH3 (m=1-200); 4 1 2 3 R є таким же самим або відмінним від R , R , R і вибраний із групи, що складається з 5 6 7 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR R R , CO-естери і O O P 10 15 20 25 30 35 5' R5 ' O R6' ; 6' R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з H або фармацевтично прийнятної неорганічної або органічної солі і фармацевтично прийнятного естеру; один з A і B є H, за умови, що: коли B є H, то A вибраний із групи, що складається з наступного: NHCOCH3, NH2, ОН, NH2∙HX, або коли A є H, B вибраний із групи, що складається з наступного: NHCOCH 3, NH2 і NH2∙HX, де HX представляє фармацевтично прийнятну неорганічну або органічну кислоту; і де сполука Формули (2) має формулу , (Формула 2) де 8 R вибраний із групи, що складається з наступного: H, CH 3, (CH2)nCH3 (n=1-20), CH2Ph, 14 15 16 14 15 16 COCH2Ph, СО-естер і COCR R R ; де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH 3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200); цитидин, монофосфат цитидину, дифосфат цитидину, трифосфат цитидину, аденозин, монофосфат аденозину, дифосфат аденозину і трифосфат аденозину; 9 R вибраний із групи, що складається з H, CH 3, фармацевтично прийнятної неорганічної або 17 18 19 17 18 19 органічної солі або фармацевтично прийнятного естеру; CH 2CR R R де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), C6H5 і CH2Ph; 10 11 12 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з 20 21 22 20 21 22 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR R R , де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH2CH2(OCH2CH2)mCH3 (m=1-200); 13 10 11 12 R є таким же самим або відмінним від R , R , R і вибраний із групи, що складається з 20 21 22 20 21 22 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR R R , де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200) і O O P 40 R23 O R24 ; 25 UA 110325 C2 23 5 10 15 20 25 24 R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), CH2Ph або естер і 25 26 27 25 26 27 CH2CR R R або фармацевтично прийнятна неорганічна або органічна сіль, і R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20) і C6H5, CH2Ph, і де респіраторний розлад вибраний із групи, що складається з наступного: кашель, гострий/хронічний бронхіт, хронічне обструктивне легеневе захворювання (ХОЛЗ), муковісцидоз і інші респіраторні запальні розлади. 8. Фармацевтична композиція за пунктом 7, де принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступного: N-ацетилманозаміну, Nацетилглюкозаміну, N-ацетилнейрамінової кислоти, ЦМФ-сіалової кислоти, їх фармацевтично прийнятних похідних і їх комбінацій. 9. Застосування принаймні однієї фармацевтично прийнятної сполуки для відновлення активності клітинної проліферації ушкодженої респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції, де згадану сполуку вибирають із групи, що складається із сполук Формули (1) і сполук Формули (2), де сполука Формули (1) має формулу: , (Формула 1) в якій 1 2 3 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з 5 6 7 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR R R і CO-естери; 5 6 7 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH3CH2(OCH2CH2)mCH3 (m=1-200); 4 1 2 3 R є таким же самим або відмінним від R , R , R і вибраний із групи, що складається з 5 6 7 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, COCR R R , CO-естери і O O P 5' 30 35 40 R5 ' O R6' ; 6' R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з H або фармацевтично прийнятної неорганічної або органічної солі і фармацевтично прийнятного естеру; один з A і B є H, за умови, що: коли B є H, то A вибраний із групи, що складається з наступного: NHCOCH 3, NH2, ОН, NH2∙HX, або коли A є H, B вибраний із групи, що складається з наступного: NHCOCH3, NH2 і NH2∙HX, де HX представляє фармацевтично прийнятну неорганічну або органічну кислоту; і де сполука Формули (2) має формулу , (Формула 2) де 8 R вибраний із групи, що складається з наступного: H, CH 3, (CH2)nCH3 (n=1-20), CH2Ph, 14 15 16 14 15 16 COCH2Ph, СО-естер і COCR R R ; де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH 3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200); цитидин, монофосфат цитидину, дифосфат 26 UA 110325 C2 5 10 цитидину, трифосфат цитидину, аденозин, монофосфат аденозину, дифосфат аденозину і трифосфат аденозину; 9 R вибраний із групи, що складається з H, CH 3, фармацевтично прийнятної неорганічної або 17 18 19 17 18 19 органічної солі або фармацевтично прийнятного естеру; CH2CR R R де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), C6H5 і CH2Ph; 10 11 12 R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з 20 21 22 20 21 22 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR R R , де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph і CH2CH2(OCH2CH2)mCH3 (m=1-200); 13 10 11 12 R є таким же самим або відмінним від R , R , R і вибраний із групи, що складається з 20 21 22 20 21 22 наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2Ph, естер і COCR R R , де R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), C6H5, CH2Ph, CH2CH2(OCH2CH2)mCH3 (m=1-200) і O O P 15 20 25 30 35 40 45 50 55 23 R23 O R24 ; 24 R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20), CH2CH2(OCH2CH2)mCH3 (m=1-200), CH2Ph або естер і 25 26 27 25 26 27 CH2CR R R або фармацевтично прийнятна неорганічна або органічна сіль, і R , R , R є однаковими або різними і кожний незалежно вибраний із групи, що складається з наступного: H, CH3, (CH2)nCH3 (n=1-20) і C6H5, CH2Ph, у виробництві медикаменту для лікування респіраторного розладу, викликаного ушкодженням респіраторної клітини у суб'єкта після вірусної або бактеріальної респіраторної інфекції для відновлення активності клітинної проліферації, де згадуваний розлад вибраний із групи, що складається з наступного: кашель, гострий/хронічний бронхіт, хронічне обструктивне легеневе захворювання (ХОЛЗ), муковісцидоз і інші респіраторні запальні розлади. 10. Застосування за пунктом 9, де принаймні одна фармацевтично прийнятна сполука вибрана із групи, що складається з наступного: N-ацетилманозаміну, N-ацетилглюкозаміну, Nацетилнейрамінової кислоти, ЦМФ-сіалової кислоти, їх фармацевтично прийнятних похідних і їх комбінацій. 11. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять в дозі від приблизно 0,1 мг до 500 мг/кг маси тіла на день, переважно в дозі від 0,1 мг до 50 мг/кг/день. 12. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять орально в дозі від приблизно 1 мг/кг/день до 500 мг/кг/день. 13. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять в дозі від приблизно 5 мг до 50 мг/кг, два або три рази на день протягом 5-10 днів. 14. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять за допомогою ін'єкції в інтервалі від приблизно 1 мг/кг/день до 100 мг/кг/день. 15. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять в інтервалі від приблизно 5 мг до 50 мг/кг, два або три рази на день протягом 520 днів. 16. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять за допомогою інгаляції в інтервалі від приблизно 0,01 мг/кг/день до 5 мг/кг/день. 17. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де сполуку вводять в інтервалі від приблизно 0,1 до 50 мг/кг/день, один-п'ять разів на день протягом 5-10 днів. 18. Спосіб за пунктом 1 або 3, композиція за пунктом 5 або 7 і застосування за пунктом 9, де фармацевтично прийнятну сполуку вибирають з групи, що містить: 1 2 3 4 сполуку Формули (1), в якій В є Н, А є NHCOCH3 і кожен з R , R , R і R є Н; 8 10 11 12 13 9 сполуку Формули (2), в якій кожен з R , R , R , R і R є Н і R є Na; 8 10 11 12 13 9 сполуку Формули (2), в якій кожен з R , R , R , R і R є Н і R є С2Н5; 8 9 10 11 12 13 сполуку Формули (2), в якій R є Н, R є С2Н5 і кожен з R , R , R і R є СН3СО; 8 9 10 11 12 13 сполуку Формули (2), в якій R є монофосфатом цитидину і кожен з R , R , R , R і R є Н і 8 10 11 12 13 сполуку Формули (2), в якій кожен з R , R , R є Н і R та R разом є С(СН3)2. 27 UA 110325 C2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMedicinal carbohydrates for treatment of respiratory conditions
Автори англійськоюJin, Betty, Jones, Paul, Arthur, Seah, Ee, Ling, Wu, Wen, Yang, Jenkins, Peter, James
Автори російськоюДжин Бетти, Джонс Пол Артур, Сих Ие Линг, Ву Вен Янг, Дженкинс Питер Джеймс
МПК / Мітки
МПК: A61K 31/7008, A61K 31/7012, A61K 31/70, A61P 11/00
Мітки: розладів, вуглеводи, лікарські, респіраторних, лікування
Код посилання
<a href="https://ua.patents.su/30-110325-likarski-vuglevodi-dlya-likuvannya-respiratornikh-rozladiv.html" target="_blank" rel="follow" title="База патентів України">Лікарські вуглеводи для лікування респіраторних розладів</a>
Попередній патент: Інгібуючі jak сполуки на основі піразолопіримідину
Наступний патент: Спосіб синтезу івабрадину і його адитивних солей з фармацевтично прийнятною кислотою
Випадковий патент: Спосіб відновлення залізної руди












