Заміщений натрій-1н-піразол-5-олат
Номер патенту: 112422
Опубліковано: 12.09.2016
Автори: Кьоп Штефан, Мілітцер Ханс-Крістіан, Грис Йорг
Формула / Реферат
1. Натрій-1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1Н-1,2,3-триазол-1-іл)-1Н-піразол-5-олат відповідно до сполуки формули (II)
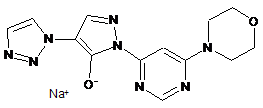 (II).
(II).
2. Кристалічна форма сполуки формули (II)
 , (II)
, (II)
яка відрізняється наступними значеннями 2-тета порошкової дифракційної рентгенограми:
сполука формули (II)
відбиття [2-тета]
5,7
23,6
11,5
25,3
13,2
26,4
13,7
26,9
15,8
27,7
16,4
27,7
18,4
29,4
18,9
29,9
19,3
30,0
21,0
30,7
22,0
31,5
23,1
31,6
3. Спосіб одержання сполуки формули (II) за пунктом 1, який відрізняється тим, що сполуку формули (І)

у розчиннику піддають взаємодії із гідроксидом натрію або водним розчином їдкого натру, або натрієвою сіллю необов'язково при додаванні основи.
4. Спосіб одержання сполуки формули (II) за пунктом 3, який відрізняється тим, що сполуку формули (І) у розчиннику піддають взаємодії із водним розчином їдкого натру необов'язково при додаванні основи.
5. Спосіб одержання сполуки формули (II) за пунктом 3, який відрізняється тим, що сполуку формули (І) у розчиннику піддають взаємодії із водним розчином їдкого натру при додаванні триетиламіну.
Текст
Реферат: Даний винахід стосується натрій-1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1Н-1,2,3-триазол-1-іл)1Н-піразол-5-олату, способу його одержання, його застосування для лікування та/або профілактики захворювань, а також його застосування для одержання лікарських засобів для лікування та/або профілактики захворювань, зокрема серцево-судинних і гематологічних захворювань, захворювань нирок, а також для сприяння загоєнню ран. O N N Na N N N N + O N ( II ) N UA 112422 C2 (12) UA 112422 C2 UA 112422 C2 5 Даний винахід стосується натрій-1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1іл)-1H-піразол-5-олату, способу його одержання, його застосування для лікування та/або профілактики захворювань, а також його застосування для одержання лікарських засобів для лікування та/або профілактики захворювань, зокрема серцево-судинних і гематологічних захворювань, захворювань нирок, а також для сприяння загоєнню ран. Сполука формули (I), 1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1-іл)-1Hпіразол-5-ол (енольна форма; формула (Ia)) або відповідно 2-[6-(морфолін-4-іл)піримідин-4-іл]4-(1H-1,2,3-триазол-1-іл)-1,2-дигідро-3H-піразол-3-он (кето-форма; формула (Ib)), відома з WO 2008/067871. 10 N HO N N N N N H N O N N 15 20 25 30 N N N N O N ( Ia ) O N N ( Ib ) (I) Сполука формули (I) діє як інгібітор HIF-проліл-4-гідроксилаз та завдяки такому специфічному механізму дії in vivo після парентерального або перорального введення викликає індукцію цільових генів HIF, таких як, наприклад, еритропоетин, і спричинені нею біологічні процеси, такі як, наприклад, еритропоез. Сполука формули (I) є гігроскопічною і у звичайних умовах навколишнього середовища (2035 °C, нормальний тиск) при відносній вологості повітря вище 20 %rF поглинає до прибл. 6 мас. % води. При вологості повітря 30 %rF вона поглинає майже 6 мас. % води. Сполука формули (І), що містить воду, при зменшенні вологості повітря до показника нижче 30 %rF виділяє частину води, яку вона містить. Таке поглинання або відповідно виділення води ускладнює роботу зі сполукою формули (I), наприклад, процедури зважування, і одержання сполуки формули (I) у незмінній, стабільній і визначеній формі для використання у лікарських засобах або відповідно одержання лікарських засобів, що містять сполуку формули (I). Особливо при цьому підвищуються технічні затрати при одержанні форм застосування, що містять сполуку формули (I), таких як, наприклад, таблетки, грануляти або розчини для пиття, оскільки для підтримання незмінної концентрації сполуки формули (I) необхідно вживати певні заходи щодо контролювання і регулювання вологості повітря. Нещодавно несподівано з'ясували, що зі сполуки формули (I) може бути одержана натрієва сіль, яка порівняно зі сполукою формули (I) має вагомі переваги. Об'єктом даного винаходу є сполука натрій-1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1H-1,2,3триазол-1-іл)-1H-піразол-5-олат відповідно до сполуки формули (II) O N N Na N N N N + O N ( II ) N . 35 40 45 Переважно в рамках даного винаходу натрій-1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1H-1,2,3триазол-1-іл)-1H-піразол-5-олат (сполука формули (II)) існує у кристалічній формі. Шляхом відповідного винаходу застосування сполуки формули (II) забезпечується значно вища стабільність по відношенню до поглинання або відповідно виділення води при несталій вологості повітря у порівнянні із відомою сполукою формули (I). Натрій-1-[6-(морфолін-4іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1-іл)-1H-піразол-5-олат (сполука формули (II)) містить менше 0,5 мас. % води, є негігроскопічною та у звичайних умовах навколишнього середовища (20-35 °C, нормальний тиск) навіть при підвищеній вологості повітря до 90 %rF змінює свій вміст води лише мінімально, тобто менше ніж на 0,5 мас. %. Сполука формули (II) технічно значно зручніша у користуванні, тобто при зважуванні та зокрема коли необхідно забезпечити незмінну 1 UA 112422 C2 5 концентрацію сполуки формули (II) у певній формі застосування, наприклад, у грануляті, розчини для пиття або таблетці. Крім того сполука формули (II) характеризується підвищеною розчинністю у воді порівняно зі сполукою формули (I). Ще одним об'єктом даного винаходу є спосіб одержання відповідної винаходу сполуки формули (II), який відрізняється тим, що сполуку формули (I) N HO N ( Ia ) 10 15 20 25 30 35 40 45 50 N N N N N H N O N O (I) N N N N N O N N ( Ib ) у розчиннику піддають взаємодії із гідроксидом натрію або водним розчином їдкого натру або натрієвою сіллю, необов'язково при додаванні основи. Перевагу надають способу одержання відповідної винаходу сполуки формули (II), який відрізняється тим, що сполуку формули (I) у розчиннику піддають взаємодії із водним розчином їдкого натру, необов'язково при додаванні основи. Особливу перевагу надають способу одержання відповідної винаходу сполуки формули (II), який відрізняється тим, що сполуку формули (I) у розчиннику піддають взаємодії із водним розчином їдкого натру, необов'язково при додаванні триетиламіну. Взаємодію з гідроксидом натрію або водним розчином їдкого натру або натрієвою сіллю здійснюють загалом у розчиннику, переважно при температурі від 20 °C до 120 °C, особливо переважно при температурі від 40 °C до 70 °C, при нормальному тиску. Сполуку формули (II) виділяють із одержаної суспензії шляхом фільтрування при температурі від -20 °C до 80 °C, переважно при температурі від 0 °C до 20 °C, при нормальному тиску, після чого сушать. Якщо взаємодія відбувається при додаванні основи, то сполуку формули (I) загалом при додаванні органічної основи спочатку розчиняють у розчиннику при температурі від 20 °C до 120 °C, переважно при температурі від 40 °C до 70 °C, при нормальному тиску, а потім сполуку формули (II) осаджують при додаванні гідроксиду натрію або водного розчину їдкого натру або натрієвої солі при температурі від 20 °C до 120 °C, переважно при температурі від 40 °C до 70 °C, при нормальному тиску. Сполуку формули (II) виділяють із одержаної суспензії шляхом фільтрування при температурі від -20 °C до 80 °C, переважно при температурі від 0 °C до 20 °C, при нормальному тиску, після чого сушать. Гідроксид натрію і водний розчин їдкого натру, а також натрієву сіль використовують у молярному співвідношенні від 0,8 до 2 молярних еквівалентів у перерахунку на сполуку формули (I). Переважно гідроксид натрію і водний розчин їдкого натру, а також натрієву сіль використовують у молярному співвідношенні від 1,0 до 1,4 молярних еквівалентів у перерахунку на сполуку формули (I). Як натрієві солі придатними є, наприклад, солі органічних кислот, такі як карбоксилати натрію, такі як, наприклад, ацетат або цитрат натрію, або солі неорганічних кислот, такі як, наприклад, карбонат, гідрокарбонат, фосфат, гідрофосфат або хлорид натрію. Як розчинники придатними є нижчі спирти, такі як, наприклад, метанол, етанол, н-пропанол, ізопропанол, н-бутанол, втор-бутанол, ізобутаном, 1-пентанол, або тетрагідрофуран, або ацетонітрил, або толуол, або 1,4-діоксан, або суміші зазначених розчинників, або суміші зазначених розчинників з водою. Переважно використовують метанол, етанол, 2-пропанол, тетрагідрофуран або суміші зазначених розчинників з водою. Особливу перевагу надають сумішам метанолу і води або етанолу і води у співвідношенні від 1: 1 до 50: 1 (об./об.), найбільшу перевагу надають сумішам метанолу і води у співвідношенні від 7: 3 до 30: 1 (об./об.). Як органічні основи придатними є третинні аміни, такі як, наприклад, триетиламін або діізопропілетиламін. Перевагу надають триетиламіну. Органічну основу використовують у співвідношенні від 0 до 4 молярних еквівалентів у перерахунку на сполуку формули (I). Переважно органічну основу використовують у співвідношенні від 0,7 до 1,5 молярних еквівалентів у перерахунку на сполуку формули (I). Одержання відповідної винаходу сполуки формули (ІІ) більш наочно можна продемонструвати на такій схемі реакції: 2 UA 112422 C2 Схема 5 10 15 20 25 30 35 40 45 Пояснення до фігур: Фігура 1: ІЧ-спектри сполуки формули (II) і сполуки формули (I) Фігура 2: Раманівські спектри сполуки формули (II) і сполуки формули (I) Фігура 3: УФ/ВИД.-спектри сполуки формули (II) і сполуки формули (I) 1 Фігура 4: H-ЯМР-спектр сполуки формули (II) 1 Фігура 5: H-ЯМР-спектр сполуки формули (I) 13 Фігура 6: C-ЯМР-спектр сполуки формули (II) 13 Фігура 7: C-ЯМР-спектр сполуки формули (I) Фігура 8: Мас-спектр сполуки формули (II) Фігура 9: Мас-спектр сполуки формули (I) Фігура 10: Рентгенівська дифрактограма сполуки формули (II) Фігура 11: Рентгенівська дифрактограма сполуки формули (I) Відповідна винаходу сполука формули (ІІ) має неочікуваний цінний фармакологічний спектр дії. Тому вона є придатною для застосування як лікарський засіб для лікування та/або профілактики захворювань людей і тварин. Відповідна винаходу сполука формули (ІІ) є специфічними інгібіторами HIF-проліл-4гідроксилаз. Відповідна винаходу сполука формули (ІІ) завдяки своїм фармакологічним властивостям може бути застосована для лікування та/або профілактики серцево-судинних захворювань, зокрема серцевої недостатності, ішемічної хвороби серця, стенокардії, інфаркту міокарду, апоплексії, артеріосклерозу, есенціальної, легеневої і злоякісної гіпертонії, а також облітерувального периферійного ендартеріїту. Відповідна винаходу сполука формули (ІІ) також придатна для лікування та/або профілактики порушень кровотворення, такихяк, наприклад, ідіопатичні анемії, ниркова анемія та анемії, які супроводжують онкологічні захворювання (зокрема анемія внаслідок хіміотерапії), інфекції (зокрема ВІЛ-інфекцію) або інші запальні захворювання, такі як, наприклад, ревматоїдний артрит. Крім того відповідна винаходу сполука формули (ІІ) придатна для підтримувального лікування анемій внаслідок втрати крові, залізодефіцитної анемії, авітамінозної анемії (наприклад, через дефіцит вітаміну B12 або фолієвої кислоти), гіпопластичної та апластичної анемії, гемолітичної анемії або для підтримувального лікування анемій внаслідок порушення переробки заліза (залізорефрактерна анемія) або анемій внаслідок інших ендокринних порушень (наприклад, гіпотиреоз). Крім того відповідна винаходу сполука формули (ІІ) є придатною для підвищення гематокриту з метою збирання власної крові перед операціями. Крім того відповідна винаходу сполука формули (ІІ) може бути застосована для лікування та/або профілактики обумовлених оперативним втручанням ішемічних станів та їх наслідків після хірургічного втручання, зокрема втручання у серце при використанні штучного серця і легенів (наприклад, шунтування, імплантація серцевих клапанів), втручання у сонну артерію, втручання у аорту та втручання при інструментальному розтинанні або проникненні у череп. Відповідна винаходу сполука формули (ІІ) є також придатною для загального лікування та/або профілактики при хірургічних втручаннях з метою прискорення загоєння ран та скорочення часу, необхідного для одужання. Крім того відповідна винаходу сполука формули (ІІ) є придатною для лікування і 3 UA 112422 C2 5 10 15 20 25 30 35 40 45 50 55 60 профілактики наслідків гострих і затяжних ішемічних станів мозку (наприклад, апоплексії, родової асфіксії). Відповідна винаходу сполука формули (ІІ) також може бути застосована для лікування та/або профілактики раку та для лікування та/або профілактики порушень стану здоров'я внаслідок лікування раку, зокрема після лікування цитостатичними засобами, антибіотиками і опроміненням. Крім того відповідна винаходу сполука формули (ІІ) є придатною для лікування та/або профілактики ревматичних захворювань та інших форм захворювань, які відносять до аутоімунних захворювань, зокрема для лікування та/або профілактики погіршення стану здоров'я, пов'язаного із медикаментозним лікуванням таких захворювань. Крім того відповідна винаходу сполука формули (ІІ) може бути використана для лікування та/або профілактики захворювань очей (наприклад, глаукоми), мозку (наприклад, хвороби Паркінсона, хвороби Альцгеймера, слабоумства, хронічних больових станів), хронічних захворювань нирок, ниркової недостатності та гострої ниркової недостатності, а також для сприяння загоєнню ран. Відповідна винаходу сполука формули (ІІ) є також придатною для лікування та/або профілактики загальної слабкості тіла, яка зокрема часто зустрічається у людей похилого віку, до кахексії. Крім того відповідна винаходу сполука формули (ІІ) є придатною для лікування та/або профілактики сексуальної дисфункції. Крім того відповідна винаходу сполука формули (ІІ) придатна для лікування та/або профілактики цукрового діабету та його наслідків, таких як, наприклад, діабетична макро- і мікроангіопатія, діабетична нефропатія і нейропатія. Відповідна винаходу сполука формули (ІІ) є також придатною для лікування та/або профілактики фібротичних захворювань, наприклад, серця, легенів і печінки. Зокрема відповідна винаходу сполука формули (ІІ) є придатною для профілактики та лікування ретинопатії недоношених дітей (Retinopathia praematurorum). Ще одним об'єктом даного винаходу є застосування відповідної винаходу сполуки формули (ІІ) для лікування та/або запобігання захворюванням, зокрема вказаним вище захворюванням. Ще одним об'єктом даного винаходу є застосування відповідної винаходу сполуки формули (ІІ) для одержання лікарського засобу для лікування та/або запобігання захворюванням, зокрема вказаним вище захворюванням. Ще одним об'єктом даного винаходу є спосіб лікування та/або запобігання захворюванням, зокрема вказаним вище захворюванням, при використанні ефективної кількості відповідної винаходу сполуки формули (ІІ). Відповідна винаходу сполука формули (ІІ) може бути застосована окремо або в разі потреби у комбінації з іншими активними речовинами. Ще одним об'єктом даного винаходу є лікарські засоби, що містять відповідну винаходу сполуку формули (ІІ) та одну або кілька інших активних речовин, зокрема для лікування та/або запобігання вказаним вище захворюванням. Придатними компонентами для комбінування є, наприклад, переважно такі: АКФ-інгібітори, антагоністи рецептора ангіотензину AII, блокатори бета-рецептора, антагоністи кальцію, інгібітори ФДЕ, антагоністи мінералокортикоїдного рецептора, діуретики, аспірин, добавки заліза, вітаміну В12 і фолієвої кислоти, статини, похідні дигоксину Digitalis, хіміотерапевтичні засоби, а також антибіотики. Згідно з переважною формою виконання винаходу відповідну винаходу сполуку формули (ІІ) вводять у комбінацію з АКФ-інгібітором, таким як, наприклад, переважно еналаприл, каптоприл, лізиноприл, раміприл, делаприл, фозиноприл, квіноприл, периндоприл або трандоприл. Згідно з переважною формою виконання винаходу відповідну винаходу сполуку формули (ІІ) вводять у комбінацію з антагоністом ангіотензину AII, таким як, наприклад, переважно лозартан, кандезартан, валзартан, тельмізартан або ембузартан. Згідно з переважною формою виконання винаходу відповідну винаходу сполуку формули (ІІ) вводять у комбінацію з блокаторами бета-рецептора, такими як, наприклад, переважно пропранолол, атенолол, тимолом, піндолол, альпренолол, окспренолол, пенбутолол, бупранолол, метипранолол, надолол, мепіндолол, каразалол, соталол, метопролол, бетаксолол, целіпролол, бісопролол, картеолол, есмолол, лабеталол, карведилол, адапролол, ландіолол, небіволол, епанолол або буциндолол. Згідно з переважною формою виконання винаходу відповідну винаходу сполуку формули (ІІ) вводять у комбінацію з антагоністом кальцію, таким як, наприклад, переважно ніфедипін, амлодипін, верапаміл або дилтіазем. Згідно з переважною формою виконання винаходу відповідну винаходу сполуку формули (ІІ) 4 UA 112422 C2 5 10 15 20 25 30 35 40 45 50 55 60 вводять у комбінацію з інгібітором фосфодіестерази (ФДЕ), таким як, наприклад, переважно мілринон, амринон, пімобендан, цилостазол, силденафіл, варденафіл або тадалафіл. Згідно з переважною формою виконання винаходу відповідну винаходу сполуку формули (ІІ) вводять у комбінацію з антагоністами мінералокортикоїдного рецептора, такими як, наприклад, переважно спіронолактон, еплеренон, канренон або канреноат калію. Згідно з переважною формою виконання винаходу відповідну винаходу сполуку формули (ІІ) вводять у комбінацію з діуретином, таким як, наприклад, переважно фуроземід, буметанід, торсемід, бендрофлуметіазид, хлортіазид, гідрохлортіазид, гідрофлуметіазид, метиклотіазил, політіазид, трихлорметіазид, хлорталідон, індапамід, метолазон, квінетазон, ацетазоламід, дихлорфенамід, метазоламід, гліцерин, ізосорбід, маніт, амілорид або триамтерен. Згідно з переважною формою виконання винаходу відповідну винаходу сполуку формули (ІІ) вводять у комбінацію з інгібітором HMG-CoA-редуктази з класу статинів, таких як, наприклад, переважно ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, розувастатин, церивастатин або пітавастатин. Згідно з переважною формою виконання винаходу відповідну винаходу сполуку формули (ІІ) вводять у комбінацію із хіміотерапевтичним засобом, наприклад, переважно з групи комплексу платини, таким як, наприклад, цисплатина та карбоплатина, алкілантів, таких як, наприклад, циклофосфамід і хлорамбуцил, антиметаболітів, таких як, наприклад, 5-фторурацил і метотрексат, інгібіторів топоізомерази, таких як, наприклад, етопосид і камптотецин, антибіотиків, таких як, наприклад, доксорубіцин і даунорубіцин, або інгібіторів кінази, таких як, наприклад, сорафеніб і сунітиніб. Згідно з переважною формою виконання винаходу відповідну винаходу сполуку формули (ІІ) вводять у комбінацію з антибіотиком, таким як, наприклад, переважно з групи пеніцилінів, цефалоспоринів або хінолінів, наприклад, ципрофлоксацин та моксифлоксацин. Ще одним об'єктом даного винаходу є лікарські засоби, що містять відповідну винаходу сполуку формули (ІІ), зазвичай разом із однією або кількома інертними нетоксичними фармацевтично прийнятними допоміжними речовинами, а також їх застосування для описаних вище цілей. Відповідна винаходу сполука формули (ІІ) може проявляти систематичну та/або локальну дію. З цією метою її вводять відповідним чином, наприклад, перорально, парентерально, легеневим способом, назально, під язик, на язик, за щоку, ректально, дермально, трансдермально, кон'юктивально, у вухо або у вигляді імплантату чи стенту. Для таких видів застосування відповідна винаходу сполука формули (ІІ) може бути використана у відповідних формах. Для перорального застосування згідно з рівнем техніки придатними є форми, здатні до швидкого та/або модифікованого вивільнення відповідної винаходу сполуки формули (ІІ), такі як, наприклад, таблетки (не покриті або покриті оболонками, наприклад, оболонками, стійкими до шлункового соку, або оболонками, які повільно розчиняються або не розчиняються взагалі, які контролюють вивільнення сполуки згідно з винаходом), таблетки або плівки/облатки, плівки/ліофілізати, капсули (наприклад, тверді або м'які желатинові капсули), які швидко розчиняються у ротовій порожнині, драже, грануляти, гранули, порошки, емульсії, суспензії, аерозолі або розчини. Парентеральне застосування може відбуватися при виключенні стадії всмоктування (наприклад, внутрішньовенно, внутрішньоартеріально, внутрішньосерцево, інтраспінально або інтралюмбально) або за умови включення стадії всмоктування (наприклад, внутрішньом'язово, підшкірно, у шкіру, перкутанно або внутрішньочеревинно). Придатними для парентерального застосування є такі форми, як ін'єкційні та інфузійні композиції у формі розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків. Для інших видів застосування придатними є, наприклад, лікарські засоби для інгаляції (а саме порошкові інгалятори, розпилювачі), краплі, розчини або спреї в ніс, таблетки під язик, на язик або за щоку, плівки/облатки або капсули, супозиторії, композиції для вух або очей, вагінальні капсули, водні суспензії (лосьйони, мікстури "бовтушки"), ліпофільні суспензії, мазі, креми, трансдермальні терапевтичні системи (наприклад, пластирі), молочко, пасти, піни, присипки, імплантати або стенти. Перевагу надають пероральному або парентеральному застосуванню, зокрема пероральному і внутрішньовенному застосуванню. Відповідна винаходу сполука формули (ІІ) може бути переведена у згадані форми застосування. Це можна здійснювати відомими способами шляхом змішування з інертними, нетоксичними фармацевтично прийнятними допоміжними речовинами. До таких допоміжних речовин належать зокрема носії (наприклад, мікрокристалічна целюлоза, лактоза, маніт), 5 UA 112422 C2 5 10 15 20 25 30 35 40 розчинники (наприклад, рідкі поліетиленгліколі), емульгатори і диспергатори або змочувальні агенти (наприклад, додецилсульфат натрію, олеат поліоксисорбіту), зв'язувальні агенти (наприклад, полівінілпіролідон), синтетичні і природні полімери (наприклад, альбумін), стабілізатори (наприклад, антиоксиданти, такі як, наприклад, аскорбінова кислота), барвники (наприклад, неорганічні пігменти, такі як оксиди заліза) та речовини, що коригують смак та/або запах. Загалом виявили, що при парентеральному застосуванні для досягнення бажаних результатів кількість активної речовини переважно становить від приблизно 0,001 до 1 мг/кг ваги тіла, переважно від приблизно 0,01 до 0,5 мг/кг ваги тіла. При пероральному застосуванні дозування становить від приблизно 0,01 до 100 мг/кг, переважно від приблизно 0,01 до 20 мг/кг та особливо переважно від 0,1 до 10 мг/кг ваги тіла. Крім того необов'язково може виникати необхідність відступати від вказаних кількостей залежно від ваги тіла, форми застосування, індивідуальної реакції на активну речовину, виду композиції та моменту або інтервалу її застосування. Так, наприклад, у деяких випадках достатнім може виявитися застосування меншої кількості, ніж вказана вище мінімальна гранична кількість, а у інших випадках необхідно перевищувати максимальну граничну кількість. У випадку застосування більших кількостей варто розподілити цю кількість на кілька окремих доз для застосування протягом дня. Наведені нижче приклади виконання пояснюють винахід, не обмежуючи обсяг його охорони. Всі показники в % у дослідженнях і прикладах, якщо не зазначено нічого іншого, відносяться до мас. %; частини відносяться до мас. частин. Співвідношення розчинників, розріджувачів і показники концентрації розчинів рідина/рідина відповідно відносяться до об'єму, якщо не зазначено нічого іншого. A. Приклади Скорочення: ACN ацетонітрил ш.с широкий синглет (у ЯМР-спектрах) д дублет (у ЯМР-спектрах) диференційна сканувальна калориметрія (Differential Scanning DSC Calorimetry) мас. % масовий процент м мультиплет (у ЯМР-спектрах) н.в. не виявлено ЯМР ядерно-магнітний резонанс (nuclear magnetic resonance) rF відносна вологість с синглет (у ЯМР-спектрах) сек. секунди т триплет (у ЯМР-спектрах) об./об. об'єм/об'єм δ деформаційні коливання ν валентні коливання Вихідні сполуки: Приклад 1A Метиловий естер 2-(1H-1,2,3-триазол-1-іл)акрилової кислоти 450 г етилового естеру 2-(1H-1,2,3-триазол-1-іл)оцтової кислоти розчиняють в 3,5 л метанолу, додають 30 г триетиламіну та протягом 16 годин перемішують при 22 °C. Потім всі розчинники відганяють у вакуумі. Одержують 410 г сполуки із заголовку у вигляді масла. Приклад 2A Метиловий естер 3-(диметиламіно)-2-(1H-1,2,3-триазол-1-іл)акрилової кислоти До 400 г метилового естеру 2-(1H-1,2,3-триазол-1-іл)акрилової кислоти додають 522 г диметилформамід-диметилацеталю та нагрівають до кипіння. Відповідні компоненти з низькою температурою кипіння відганяють. Через 4 години охолоджують до 55 °C та додають 1050 мл суміші метил-трет-бутиловий етер / 2-пропанол (3: 1 об./об.). Одержану суспензію охолоджують до 22 °C та фільтрують. Залишок на фільтрі кілька разів промивають метил-трет-бутиловим етером та сушать у вакуумі при 40 °C. Одержують 493 г сполуки із заголовку у вигляді твердої речовини. Приклад 3A 1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1-іл)-1H-піразол-5-ол (енольна форма; формула (Ia)) або відповідно 2-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1іл)-1,2-дигідро-3H-піразол-3-он (кето-форма; формула (Ib)) 6 UA 112422 C2 5 10 15 20 25 30 35 40 45 50 55 60 До 20 г 4-(6-гідразинопіримідин-4-іл)морфоліну і 24,6 г метилового естеру (2E/Z)-3(диметиламіно)-2-(1H-1,2,3-триазол-1-іл)акрилової кислоти в 210 мл етилацетату додають 5,84 г трифтороцтової кислоти та протягом 24 годин перемішують при кипінні зі зворотнім холодильником. Одержану суспензію охолоджують до 0 °C та фільтрують. Залишок на фільтрі промивають етилацетатом, швидко відсмоктують та після цього суспендують у 160 мл води. Шляхом додавання 4,5 мл оцтової кислоти у суспензії встановлюють приблизне значення pH=5, протягом наступних 15 хвилин перемішують та фільтрують. Залишок на фільтрі двічі промивають 50 мл води, а потім сушать у вакуумі при 40 °C. Вихід: 26,0 г (79,4 % від теор.) сполуки із заголовку. Одержання сполук 4-(6-гідразинопіримідин-4-іл)морфолін (приклад № 16A), етиловий естер 2-(1H-1,2,3-триазол-1-іл)оцтової кислоти (приклад № 39A) і етиловий естер 3-(диметиламіно)-2(1H-1,2,3-триазол-1-іл)акрилової кислоти (приклад № 3A) було описане у WO 2008/067871. Одержання сполуки 2-(6-морфолін-4-ілпіримідин-4-іл)-4-(1H-1,2,3-триазол-1-іл)-1,2-дигідро3H-піразол-3-он із 4-(6-гідразинопіримідин-4-іл)морфоліну і етилового естеру 3-(диметиламіно)2-(1H-1,2,3-триазол-1-іл)акрилової кислоти було також описане у WO 2008/067871 (приклад № 71). Приклади виконання: Приклад 1 Натрій-1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1-іл)-1H-піразол-5-олат (сполука формули (II)) Приклад 1.1 10 г сполуки з прикладу 3A суспендують в 50 мл суміші метанол/вода (9: 1 об./об.). До суспензії при перемішуванні додають 3,4 г 45 %-ного водного розчину їдкого натру та ще 50 мл суміші метанол/вода (9: 1 об./об.). Суспензію нагрівають до 50 °C та перемішують протягом 2 годин при 50 °C. Потім охолоджують до 0 °C, протягом 1 години перемішують при 0 °C та фільтрують. Одержаний залишок на фільтрі промивають сумішшю метанол/вода (9: 1 об./об.) та сушать. Вихід: 10,1 г сполуки формули (II); 6,8 мас. % Na Приклад 1.2 5 г сполуки з прикладу 3A суспендують в 60 мл суміші етанол/вода (1: 1 об./об.) та при 22 °C додають 1,41 г 45 %-ного розчину їдкого натру. Суспензію протягом 3 днів перемішують при 50 °C та протягом 2 годин при 20 °C. Тверду речовину відфільтровують, промивають 10 мл води та сушать. Вихід: 4 г сполуки формули (II). Приклад 1.3 30,25 г сполуки з прикладу 3A суспендують в 150 мл суміші метанол/вода (9: 1 об./об.) при 22 °C. Додають 13,3 мл триетиламіну та суміш нагрівають до 60 °C. Через 15 хвилин одержаний майже прозорий розчин фільтрують, фільтрат промивають 10 мл суміші метанол/вода (9: 1 об./об.) та до зібраного фільтрату при 60 °C повільно додають 10,3 г 45 %-ного розчину їдкого натру. До одержаної суспензії додають незначну кількість кристалів сполуки формули (II), перемішують протягом 1 години при 60 °C, потім повільно охолоджують до 0 °C і фільтрують. Залишок на фільтрі промивають 15 мл суміші метанол/вода (9: 1 об./об.) та сушать у вакуумі при 40 °C. Вихід: 25,1 г сполуки формули (II). Приклад 1.4 25 г сполуки з прикладу 3A суспендують у 150 мл суміші метанол/вода (1: 1 об./об.) та додають 11 мл триетиламіну. Одержаний розчин нагрівають до 60 °C та додають 8,5 г 45 %ного розчину їдкого натру. Одержану суспензію повільно охолоджують до 22 °C, протягом 2 годин перемішують при 22 °C, а потім протягом 1 h години при 0-5 °C. Після фільтрування залишок на фільтрі промивають 15 мл суміші метанол/вода (1: 1 об./об.) та сушать у вакуумі при 40 °C. Вихід: 26 г сполуки формули (II). Диференційна сканувальна калориметрія (DSC): Термограму одержують при використанні диференційного сканувального калориметра DSC 7 або відповідно. Pyris-1 і термогравіметричного аналізатора TGA 7 фірми Perkin-Elmer. Диференційний сканувальний калориметр DSC 7 або відповідно Pyris-1; виробник: PerkinElmer; швидкість нагрівання: 2-20 K/хв.: газ: азот; тигель: негерметичний алюмінієвий тигель;пробопідготовка: немає. Термогравіметричний аналізатор TGA 7; виробник: Perkin-Elmer; швидкість нагрівання: 10 -1 Kхв. ; газ: азот, 20-30 мл/хв.; тигель: відкритий платиновий тигель; пробопідготовка: немає. Натрій-1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1H-1,2,3-триазол-1-іл)-1H-піразол-5-олат (сполука формули (II)) розкладається при температурі вище 300 °C без кипіння. Адсорбція і десорбція водяної пари: Ізотерму сорбції вологи реєструють за допомогою аналізатора Dynamic Vapour Sorption 7 UA 112422 C2 Analyzer IGA Sorp фірми Hiden Analytical. Вимірювальна температура становить 25 °C. Ніякої пробопідготовки не здійснюють. Таблиця 1 Адсорбція і десорбція водяної пари натрій-1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1H-1,2,3триазол-1-іл)-1H-піразол-5-олату (сполука формули (II)) Сполука формули (II) Відносна вологість повітря 0 %rF 10 %rF 20 %rF 30 %rF 40 %rF 50 %rF 60 %rF 70 %rF 80 %rF 90 %rF 5 Сполука формули (I) Адсорбція Десорбція Адсорбція Десорбція 0% 0% 0,1 % 0,1 % 0,2 % 0,2 % 0,2 % 0,4 % 0,4 % 0,8 % 0% 0% 0% 0,1 % 0,2 % 0,3 % 0,3 % 0,4 % 0,5 % 0,8 % 0,1 % 0,2 % 0,3 % 4,8 % 5,1 % 5,3 % 5,4 % 5,6 % 5,7 % 5,9 % 0,1 % (5 %rF) 0,1 % 0,2 % 4,7 % 5,2 % 5,4 % 5,6 % 5,6 % 5,7 % 5,9 % Показники розчинності: Метод: насичені розчини досліджуваної сполуки одержують шляхом 16-годинного перемішування суспензії у воді при 25 °C. Потім одержані суспензії фільтрують, а вміст у фільтраті визначають за допомогою ВЕРХ. Таблиця 2 Розчинність у воді Сполука формули (II) Розчинність у воді при 25 °C [мг/100 мл] Сполука формули (I) 2800 14,3 10 ІЧ- спектроскопія і Раманівська спектроскопія: Для вимірювання ІЧ-спектрів і Раманівських спектрів сполуки формули (II) використовують спектрометр Bruker FT/IR-Spektrometer IFS 66v і Bruker FT/Raman-Spektrometer MultiRAM з такими параметрами: 15 Спектральне розділення Кількість окремих вимірювань (сканів) Область хвильового числа Пробопідготовка ІЧ -1 2 см Раман -1 2 см 32 64 -1 4000-500 см KBr таблетки -1 3500-200 см немає Таблиця 3 Положення характеристичних смуг коливальних спектрів у ІЧ-спектрах або відповідно Раманівських спектрах сполуки формули (II) Структурний елемент ν =C-H ν C-H ν C=C, ν C=N ν C-N ν C-O δ =C-H -1 ІЧ-положення смуги (см ) 3153 - 3006 2976 - 2855 1630 - 1439 1241 1112 987 8 -1 Раманівське положення смуги (см ) 3153 - 3010 2978 - 2856 1623 - 1401 1244 1118 988 UA 112422 C2 Для вимірювання ІЧ-спектрів і Раманівських спектрів сполуки формули (I) використовують спектрометр Bruker FT/IR-Spektrometer Vertex 80v і Bruker FT/Raman-Spektrometer MultiRAM з такими параметрами: ІЧ -1 2 см Спектральне розділення Кількість окремих вимірювань (сканів) Область хвильового числа Пробопідготовка Раман -1 2 см 32 64 -1 4000-500 см KBr таблетки -1 3500-100 см немає 5 Таблиця 4 Положення характеристичних смуг коливальних спектрів у ІЧ-спектрах або відповідно Раманівських спектрах сполуки формули (I) Структурний елемент -1 ІЧ-положення смуги (см ) ν O-H ν =C-H ν C-H ν C=C, ν C=N, δ C-H ν C-Oетер 10 15 3441 3135 - 3108 2965 - 2884 1636 - 1345 1257 Раманівське положення смуги -1 (см ) 3134 - 3006 2967 - 2884 1650 - 1345 1259 УФ/ВИД.-спектроскопія: УФ/ВИД.-спектри вимірюють спектрометром Perkin Elmer (Lambda 40P) при таких умовах або відповідно з такими параметрами: кювета: оптична довжина 1 см; кварц діапазон довжин хвиль: 200-800 нм щілина: 1 нм пробопідготовка: прибл. 1 мг/100 мл ацетонітрил/вода 1:1 смуги: 285; 249 нм сполуки формули (II) і 289,3; 248,2 нм сполуки формули (I) Таблиця 5 Визначення специфічної абсорбцій і коефіцієнту молярної абсорбції Сполука формули (I) (II) 20 Розчинник ацетонітрил/ вода 1:1 ацетонітрил/ вода 1:1 Довжина хвилі (нм) Специфічна абсорбція 1% A 1см (л/г * см) Коефіцієнт молярної абсорбції ε (л/моль * см) 249 1111 34928 284 501.2 16855 ЯМР-спектроскопія: Спектри ЯМР реєструють за допомогою ЯМР-спектрометру Bruker (Advance) при таких умовах або відповідно з такими параметрами: Сполука формули (II) Робоча частота Розчинник Концентрація Внутрішній стандарт Діаметр ампули Температура Технологія 1 H-ЯМР-спектр 500,13 МГц трифтороцтова кислота 6,84 мг/мл тетраметилсилан (ТМС) 5 мм 25 °C перетворення Фур'є 9 13 C-ЯМР-спектр 125,76 МГц трифтороцтова кислота 42,7 мг/мл тетраметилсилан (ТМС) 5 мм 25 °C перетворення Фур'є UA 112422 C2 1 Сполука формули (II) H-ЯМР-спектр Ширина спектру 20,65 м.ч. Цифрова роздільна здатність 0,079 Hz/Pt Тривалість імпульсу 2,83 мксек., кут збудження 30° Час реєстрації 6,399 сек. Час релаксації 0,5 сек. Кількість спадів вільної індукції 32 13 C-ЯМР-спектр 245,41 м.ч. 0,4710 Hz/Pt 9,1 мксек., кут збудження 90° 1,06 сек. 4 сек. 128 1 13 Сполука формули (I) H-ЯМР-спектр C-ЯМР-спектр Робоча частота 500,13 МГц 125,76 МГц Розчинник диметилсульфоскид-d6 (ДМСО) диметилсульфоскид-d6 (ДМСО) Концентрація 6,3 мг/мл 35,8 мг/мл Внутрішній стандарт тетраметилсилан (ТМС) тетраметилсилан (ТМС) Діаметр ампули 5 мм 5 мм Температура 25 °C 27 °C Технологія перетворення Фур'є перетворення Фур'є Ширина спектру 20,65 м.ч. 240,89 м.ч. Цифрова роздільна здатність 0,079 Hz/Pt 0,9248 Hz/Pt Тривалість імпульсу 3,1 мксек., кут збудження 30° 7,0 мксек., кут збудження 90° Час реєстрації 6,344 сек. 1,08 сек. Час релаксації 0,5 сек. 4 сек. Кількість спадів вільної індукції 32 1024 Структурні формули сполуки формули (II) і сполуки формули (I) з положенням відповідних ЯМР-сигналів 5 O 6 Na 3 2 5 5 N N1 5 3 3 N 4 N 2 OH N N 1 6 N N1 5 3 2 5 5 N 4 2 3 N 3 N 6 5 2 5 3 N O N N 4 + O 6 2 (II) N 4 N 1 2 3 2 (I) Таблиця 6 1 H-ЯМР-спектр сполуки формули (II) - хімічне зміщення, мультиплетність сигналу, відносна кількість протонів (нумерація атомів H базується на структурній формулі з положенням відповідних ЯМР-сигналів) Хім. зміщення δ (м.ч.) Мультиплетність і КССВ Кількість протонів /молекула 4,00-4,25 M 8 піримідин-4-іл]H-2 H-5 8,72 7,77 S S 1 1 4-(1H-1,2,3-триазол-1-іл)H-4 H-5 8,64 8,98 D J=1,4 Гц D J=1,4 Гц 1 1 1H-піразол-5-олат H-3 8,68 S 1 Атоми Н Натрій-1-[6-(морфолін-4-іл) H-2; H-3; H-5; H-6 10 UA 112422 C2 Таблиця 7 1 H-ЯМР-спектр сполуки формули (I) - хімічне зміщення, мультиплетність сигналу, відносна кількість протонів (нумерація атомів Н базується на структурній формулі з положенням відповідних ЯМР-сигналів) Хім. зміщення δ (м.ч.) Мультиплетність і КССВ Кількість протонів /молекула 1-[6-(морфолін-4-іл) H-2; H-3; H-5; H-6 3,71 S 8 піримідин-4-іл]H-2 H-5 8,55 7,42 S S 1 1 4-(1H-1,2,3-триазол-1-іл)H-4 H-5 7,86 8,38 D (0,6 Гц) D (0,6 Гц) 1 1 8,27 н.в (c) S н.в. 1 1 Атоми Н 1H-піразол-5-ол H-3 5-OH Таблиця 8 13 C-ЯМР-спектр сполуки формули (II) - хімічне зміщення, мультиплетність сигналу, відносна кількість C-ядер у сполуці формули (II) (нумерація атомів C базується на структурній формулі з положенням відповідних ЯМР-сигналів) Хім. зміщення δ (м.ч.) Мультиплетність і КССВ Кількість C-ядер /молекула Натрій-1-[6-(морфолін-4-іл) C-2; C-6 C-3; C-5 67,80 48,21 T T 2 2 піримідин-4-іл]C-2 C-4 C-5 C-6 151,65 152,01 91,48 159,90 D S D S 1 1 1 1 4-(1H-1,2,3-триазол-1-іл)C-4 C-5 130,93 129,57 D D 1 1 1H-піразол-5-олат C-3 C-4 C-5 138,03 106,99 157,43 Атоми C D S S 11 1 1 1 UA 112422 C2 Таблиця 9 13 C-ЯМР-спектр сполуки формули (I) - хімічне зміщення, мультиплетність сигналу, відносна кількість C-ядер у сполуці формули (I) (нумерація атомів C базується на структурній формулі з положенням відповідних ЯМР-сигналів) Хім. зміщення δ (м.ч.) Мультиплетність і КССВ Кількість C-ядер /молекула 1-[6-(морфолін-4-іл C-2; C-6 C-3, C-5 65,56 44,29 T T 2 2 піримідин-4-іл]C-2 C-4 C-5 C-6 154,08 152,43 85,62 161,99 D S D S 1 1 1 1 4-(1H-1,2,3-триазол-1-іл)C-4 C-5 132,94 123,68 D D 1 1 1H-піразол-5-ол C-3 C-4 C-5 135,84 102,82 154,70 D S S 1 1 1 Атоми C 5 Мас-спектроскопія: Мас-спектр реєструють на мас-спектрометрі Waters (ZQ) при таких умовах або відповідно з такими параметрами: Іонізаційний метод ESI (Electronic Spray Ionization - електростатичне розпилювання) Розчинник ацетонітрил/вода Таблиця 10 Інтерпретація мас-спектру сполуки формули (II) Масове число (МЧ) 315 337 Іоноутворення M+H C13H14N8O2+H Іоноутворення M+Na C13H14N8O2+Na Таблиця 11 Інтерпретація мас-спектру сполуки формули (I) Масове число (МЧ) 315 Іоноутворення M+H C13H15N8O2 Елементний аналіз: 10 Таблиця 12 Результати елементного аналізу сполуки формули (II) Елемент C H N Знайдено (%) 46,1 4,0 33,1 Розраховано (%) 46,4 3,9 33,3 12 Різниця (%) 0,3 0,1 0,2 UA 112422 C2 Таблиця 13 Результати елементного аналізу сполуки формули (I) Елемент C H N O 5 10 15 20 Знайдено (%) 49,5 4,4 35,5 12,6 Розраховано (%) 49,7 4,5 35,7 10,2 Різниця (%) 0,2 0,1 0,2 2,4 Рентгенівська дифрактометрія: Дифрактометр PANalytical X`Pert PRO з лічильником PIXcel (багатоканальним): Опромінення: міль, K alpha Первинний монохроматор: рентгенівське дзеркало зі здатністю фокусування Довжина хвилі (K1): 1,5406 Å Довжина хвилі (K2): 1,5444 Å Параметри генератора: 40 кВ, 40 мА Діапазон вимірювання: 2-38° Кімнатні умови: 25 °C, 40 - 60 %rF або відповідно STOE Pulver Diffraktions-System: Дифрактометр: трансмісійний Монохроматор: вигнутий германієвий (111) Генератор: 45 кВ, 35 мА Довжина хвилі: 1,540598 Cu Детектор: Linear PSD Режим сканування: Transmission / Moving PSD / Fixed omega Тип сканування: 2Theta:Omega Кімнатні умови: 25 °C, 40 - 60 %rF Таблиця 14 Порошкова рентгенівська дифрактометрія сполуки формули (II) Сполука формули (II) Відбиття [2 Theta] 5,7 23,6 11,5 25,3 13,2 26,4 13,7 26,9 15,8 27,7 16,4 27,7 18,4 29,4 18,9 29,9 19,3 30,0 21,0 30,7 22,0 31,5 23,1 31,6 13 UA 112422 C2 Таблиця 15 Порошкова рентгенівська дифрактометрія сполуки формули (I) Сполука формули (I) Відбиття [2 Theta] 5,6 24,6 14,4 24,8 14,9 25,1 16,3 26,3 16,5 26,8 17,6 28 17,8 28,5 18,2 29 18,5 29,9 19 32,4 19,7 32,7 21,6 33,2 22 33,8 22,4 34,7 22,9 35,7 24 36,4 24,5 36,7 5 10 15 20 25 30 B. Оцінка фармакологічної ефективності Фармакологічні властивості сполук згідно з винаходом можна продемонструвати у таких дослідженнях: Скорочення: DMEM середовище Dulbecco's Modified Eagle FCS сироватка крові теляти TMB 3,3',5,5'-тетраметилбензідин трис трис(гідроксиметил)амінометан 1. Дослідження іn vitro для визначення активності і селективності інгібіторів HIF-проліл-4гідроксилази 1.a) Інгібування активності HIF-пролілгідроксилази: Гідроксильований HIF специфічно зв'язується з протеїном Hippel-Lindau B-елонгін Cкомплекс (VBC-комплекс). Така взаємодія відбувається лише у випадку, коли HIF гідроксильований біля консервованого залишку пролілу. Це є основою для біохімічного визначення активності HIF-пролілгідроксилази. Дослідження здійснюють, як описано в літературі [Oehme F., Jonghaus W., Narouz-Ott L., Huetter J., Flamme I., Anal. Biochem. 330 (1), 74-80 (2004)]: Прозорий покритий NeutrAvidin HBC мікротитрувальний планшет, що має 96 комірок, (фірми Pierce), протягом 30 хвилин інкубують з блокатором-казеїном. Потім кожну комірку планшету тричі промивають по 200 мкл буферного розчину для промивання (50 мM Трис, pH 7,5, 100 мM NaCl, 10 % (об./об.) блокатор-казеїн, 0,05 % (об./об.) Tween 20). Додають пептид біотинDLDLEMLAPYIPMDDDFQL (фірми Eurogentec, 4102 Seraing, Belgien) у концентрації 400 нМ в 100 мкл буферного розчину для промивання. Цей пептид служить субстратом для пролілгідроксилювання та зв'язується з мікротитрувальним планшетом. Через 60 хвилин планшет тричі промивають буферним розчином для промивання, протягом 30 хвилин інкубують з 1 мM біотином в блокаторі-казеїні та знову тричі промивають буферним розчином для промивання. Для здійснення реакції пролілгідроксилази зв'язаний з планшетом пептидний субстрат протягом 1-60 хвилин інкубують у пролілгідроксилаза-вмісному клітинному лізаті. Реакція відбувається в 100 мкл реакційного буферного розчину (20 мM Трис, pH 7,5, 5 мM KCl, 1,5 мM MgCl2, 1 мкМ-1 мМ 2-оксоглутарату, 10 мкM FeSO4, 2 мM аскорбату) при кімнатній температурі. Крім того реакційна суміш містить досліджуваний інгібітор пролілгідроксилази в різних концентраціях. Досліджувану речовину переважно, однак не виключно використовують у концентрації від 1 нМ до 100 мкМ. Внаслідок триразового промивання планшета буферним 14 UA 112422 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчином для промивання реакція зупиняється. Для кількісного визначення гідроксилювання пролілу додають гібридний протеїн, що містить як тіоредоксин із E. coli, так і VBC-комплекс, в 80 мкл зв'язувального буферного розчину (50 мМ трис, pH 7,5, 120 мM NaCl). Через 15 хвилин додають 10 мкл розчину поліклонального антитіла анти-тіоредоксину кроликів у зв'язувальному буферному розчині. Через наступні 30 хвилин додають 10 мкл розчину імуноглобуліну кролика, зв'язаного з пероксидазою хріну, у зв'язувальному буферному розчині. Через 30 хвилин інкубації при кімнатній температурі тричі промивають буферним розчином для промивання з метою видалення незв'язаного VBCкомплексу та антитіл. Для визначення кількості зв'язаного VBC-комплексу протягом 15 хвилин інкубують з TMB. Реакція із забарвленням закінчується після додавання 100 мкл 1 M сірчаної кислоти. Шляхом вимірювання оптичної щільності при 450 нм визначають кількість зв'язаного VBC-комплексу. Вона пропорційна кількості гідроксильованого проліну в пептидному субстраті. Для визначення пролілгідроксилювання альтернативно можна використовувати зв'язаний з європієм (фірми Perkin Elmer) VBC-комплекс. У цьому випадку кількість зв'язаного VBCкомплексу визначається розділеною у часі флуоресценцією. Крім того можливим є 35 використання маркованого [ S]-метіоніном VBC-комплексу. При цьому радіоактивно маркований VBC-комплекс може бути одержаний in vitro-транскрипцією-трансляцією у ретикулоцитарному лізаті. Відповідна винаходу сполука формули (ІІ) інгібує активність HIF-пролілгідроксилази у цьому дослідженні при значенні IC50 0,47 мкM (середнє значення для EGLN2/PHD1) або відповідно 0,14 мкМ (середнє значення для EGLN1/PHD2). 1.b) Клітинне функціональне дослідження in vitro: Кількісне вираження ефективності сполук згідно з винаходом здійснюють за допомогою рекомбінантної лінії клітин. Використовувана клітина походить від лінії ракових клітин легенів людини (A549, ATCC: American Type Culture Collection, Manassas, VA 20108, США). Досліджувану лінію клітин стабільно трансфікують вектором, що містить репортерні гени Photinus pyralis-люциферази (що надалі називають люциферазою) під контролем штучного мінімального промотора. Мінімальний промотор складається із двох відповідальних за гіпоксію елементів вгору за течією TATA-резервуару [Oehme F., Ellinghaus P., Kolkhof P., Smith T.J., Ramakrishnan S., Hütter J., Schramm M., Flamme I., Biochem. Biophys. Res. Commun. 296 (2), 3439 (2002)]. Під впливом гіпоксії (наприклад, культивування в присутності 1 % кисню протягом 24 годин) або під впливом неселективних інгібіторів діоксигенази (наприклад, десферроксамін у концентрації 100 мкM, хлорид кобальту у концентрації 100 мкM або діетиловий естер Nоксалілгліцину у концентрації 1 мM) досліджувана лінія клітин продукує люциферазу, яка може бути виявлена та кількісно виражена за допомогою придатних біолюмінесцентних реагентів ® (наприклад, Steady-Glo Luciferase Assay System, Promega Corporation, Madison, WI 53711, США) та придатного люмометру. Хід дослідження: Клітини за день до проведення дослідження у точно виміряній кількості поміщають у культурне середовище (DMEM, 10 % FCS, 2 мM глютаміну) на мікротитрувальні планшети, що мають 384 або 1536 комірок, та тримають в інкубаторі для клітин (вологість повітря 96 %, 5 % об./об. CO2, 37ºC). У день дослідження культурне середовище замінюють досліджуваними речовинами у ступінчастій концентрації. У суміші, які використовують як негативну контрольну групу, не додають клітини досліджуваних речовин. Як позитивну контрольну групу для визначення чутливості клітин до інгібіторів додають, наприклад, десферроксамін у кінцевій концентрації 100 мкM. Через 6-24 години після перенесення досліджуваних речовин у комірки мікротитрувальних планшетів вимірюють одержаний світловий сигнал люмометром. На основі показників вимірювання встановлюють співвідношення дозування:активність, що служить основою для виявлення напівмаксимальної ефективної концентрації (яку позначають як EC 50). Значення EC50 відповідної винаходу сполуки формули (II) в описаному тут дослідженні становить 7 мкМ. 1.c) Клітинне функціональне дослідження in vitro зміни генної експресії: З метою дослідження зміни експресії специфічних іРНК у лінії клітин людини після введення досліджуваних речовин на планшетах, що мають 6 або 24 комріки, культивують такі лінії клітин: клітини гематоми людини (HUH, JCRB Cell Bank, Японія), ембріональні ниркові фібробласти людини (HEK/293, ATCC, Manassas, VA 20108, США), ракові клітини шиї людини (HeLa, ATCC, Manassas, VA 20108, США), клітини ендотелію вен пуповини людини (HUVEC, Cambrex, East Rutherford, New Jersey 07073, США). Через 24 години після додавання досліджуваних речовин клітини промивають фосфатним буферним сольовим розчином та за допомогою придатного ® методу з них одержують загальну РНК (наприклад, реагент Trizol , Invitrogen GmbH, 76131 15 UA 112422 C2 5 10 15 20 25 30 35 40 45 50 55 60 Karlsruhe, Німеччина). Для типового експерименту кожен 1 мкг одержаної таким чином загальної РНК перетруюють з ДНКазою I та при використані реакції оберненої транскриптази (ImProm-II Reverse Transcription System, Promega Corporation, Madison, WI 53711, США) переводять у комплементарну ДНК (кДНК). 2,5 % одержаної таким чином мДНК використовують відповідно для ланцюгової реакції полімерази. Рівень експресії іРНК досліджуваних генів досліджують за допомогою реакції real time quantitative polymerase chain reaction [TaqMan-PCR; Heid C.A., Stevens J., Livak K.J., Williams P.M., Genome Res. 6 (10), 986-94 (1996)] при використанні інструменту виявлення ABI Prism 7700 послідовності (фірми Applied Biosystems, Inc.). Використовувані при цьому комбінації праймер-зонд генерують за допомогою програмного забезпечення Primer Express 1.5 (фірми Applied Biosystems, Inc.). Зокрема досліджують іРНК еритропоетину, карбоангідрази IX, лактатдегідрогенази A та васкулярного фактору росту клітин ендотелію. 2. Дослідження іn vivo для виявлення дії у серцево-судинній системі 2.a) Дослідження іn vivo зміни генної експресії: Мишам або пацюкам перорально, за допомогою шлункового зонду, внутрішньочеревинно або внутрішньовенно вводять досліджувані сполуки, розчинені у придатних розчинниках. Типові дозування становлять 0,1, 0,5, 1, 5, 10, 20, 50, 100 і 300 мг речовини на кг маси тіла. Тваринам контрольної групи вводять лише розчинник. Через 4, 8 або 24 години після введення досліджуваної речовини тваринам вводять надлишкову дозу ізофлурану та шляхом подальшого перелому шийного відділу хребта тварин вмертвляють та виймають досліджувані органи. Частини органів миттєво заморожують у рідкому азоті. Із частин органів, як описано в пункті B.1.a), одержують загальну РНК та переводять її у кДНК. Рівень експресії іРНК досліджуваних генів досліджують за допомогою реакції real time quantitative polymerase chain reaction [TaqManPCR; Heid C.A., Stevens J., Livak K.J., Williams P.M., Genome Res. 6 (10), 986-94 (1996)] при використанні інструменту виявлення послідовності ABI Prism 7700 (фірми Applied Biosystems, Inc.). Речовина згідно з даним винаходом порівняно з контрольною групою плацебо після перорального або парентерального введення викликає значне залежне від дозування збільшення рівня іРНК еритропоетину у нирках. 2.b) Визначення рівня еритропоетину в сироватці: Мишам або пацюкам внутрішньочеревинно або перорально один або два рази на день вводять досліджувану сполуку у придатному розчиннику. Типові дозування становлять 0,1, 0,5, 1, 5, 10, 20, 50, 100 і 300 мг речовини на кг маси тіла. Тваринам контрольної групи вводять лише розчинник. Перед введенням та через 4 години після останнього введення речовини у тварин під наркозом короткої дії беруть кров із ретроорбітального венозного сплетіння або хвостової вени. Кров шляхом додавання літій-гепарину роблять такою, що не згортається. Центрифугуванням одержують плазму крові. У плазмі крові за допомогою еритропоетину-ELISA ® (Quantikine mouse Epo Immunoassay, R&D Systems, Inc., Minneapolis, США) відповідно до інструкції виробника визначають вміст еритропоетину. Показники перераховують згідно з контрольним вимірюванням еритропоетину мишей у пг/мл. Речовина згідно з даним винаходом порівняно з вихідними значеннями і контрольною групою плацебо після перорального і парентерального введення викликає значне залежне від дозування збільшення рівня еритропоетину в плазмі. 2.c) Визначення клітинного складу периферійної крові: Мишам або пацюкам внутрішньочеревинно або перорально один або два рази на день вводять досліджувану сполуку у придатному розчиннику. Типові дозування становлять, наприклад, 0,1, 0,5, 1, 5, 10, 20, 50, 100 і 300 мг речовини на кг маси тіла. Тваринам контрольної групи вводять лише розчинник. Наприкінці дослідження у тварин під наркозом короткої дії беруть кров із венозного сплетіння з куточка ока або хвостової вени та шляхом додавання цитрату натрію кров роблять такою, що не згортається. У придатному електронному вимірювальному пристрої у зразках крові визначають концентрацію еритроцитів, лейкоцитів і тромбоцитів. Концентрацію ретикулоцитів визначають на мазках крові, забарвлених відповідним розчином для забарвлення (фірми KABE Labortechnik, Nümbrecht), ретельно вивчаючи під мікроскопом кожні 1000 еритроцитів. Для визначення гематокриту беруть кров із ретроорбітального венозного сплетіння за допомогою гематокритних капілярів та в ручному режимі зчитують показники гематокриту після центрифугування капілярів у придатній для цього центрифузі. Речовина згідно з даним винаходом після перорального і парентерального введення викликає значне залежне від дозування збільшення рівня гематокриту, кількості еритроцитів і ретикулоцитів у порівнянні із вихідним значенням і контрольною групою плацебо. 16 UA 112422 C2 5 10 15 20 25 30 35 С. Приклади виконання для фармацевтичних композицій Відповідні винаходу сполуки можуть бути переведені у фармацевтичні композиції таким чином: Таблетка: Склад: 100 мг сполуки згідно з винаходом, 50 мг лактози (моногідрат), 50 мг кукурудзяного крохмалю (природного), 10 мг полівінілпіролідону (PVP 25) (фірми BASF, Людвігсхафен, Німеччина) та 2 мг стеарату магнію. Вага таблетки: 212 мг, діаметр: 8 мм, радіус вигину: 12 мм. Одержання: Суміш сполуки згідно з винаходом, лактози і крохмалю гранулюють в 5 %-ному розчині (м/м) ПВП у воді. Гранулят після сушки протягом 5 хвилин змішують із стеаратом магнію. Цю суміш пресують звичайним пресом для таблетування (формат таблетки див. вище). Як контрольний показник для пресування використовують зусилля пресування 15 кН. Пероральна суспензія: Склад: 1000 мг сполуки згідно з винаходом, 1000 мг етанолу (96 %), 400 мг Rhodigel® (Xanthan gum (ксантанова гума) фірми FMC, Пенсильванія, США) та 99 г води. Одна доза 100 мг сполуки згідно з винаходом відповідає 10 мл пероральної суспензії. Одержання: Родігель суспендують в етанолі, у суспензію додають сполуку згідно з винаходом. При перемішуванні здійснюють додавання води. До завершення набухання Родігелю перемішують протягом приблизно 6 годин. Пероральний розчин: Склад: 500 мг сполуки згідно з винаходом, 2,5 г полісорбату і 97 г поліетиленгліколю 400. Одна доза 100 мг сполуки згідно з винаходом відповідає 20 г перорального розчину. Одержання: Сполуку згідно з винаходом при перемішуванні суспендують у суміші поліетиленгліколю і полісорбату. Перемішування здійснюють до повного розчинення сполуки згідно з винаходом. Внутрішньовенний розчин: Сполуку згідно з винаходом у концентрації нижче показника розчинності при насиченні розчиняють у фізіологічно сумісному розчиннику (наприклад, ізотонічному розчині хлористого натрію, розчині глюкози 5 % та/або розчині PEG 400 30 %). Розчин стерильно фільтрують та розливають у резервуари для ін'єкції, що не містять піроген. ФОРМУЛА ВИНАХОДУ 40 1. Натрій-1-[6-(морфолін-4-іл)піримідин-4-іл]-4-(1Н-1,2,3-триазол-1-іл)-1Н-піразол-5-олат відповідно до сполуки формули (II) N N N O N N N Na+ O N N (II). 2. Кристалічна форма сполуки формули (II) N N N 45 O N N N Na+ O N N , (II) яка відрізняється наступними значеннями 2-тета порошкової дифракційної рентгенограми: 17 UA 112422 C2 сполука формули (II) відбиття [2-тета] 5,7 23,6 11,5 25,3 13,2 26,4 13,7 26,9 15,8 27,7 16,4 27,7 18,4 29,4 18,9 29,9 19,3 30,0 21,0 30,7 22,0 31,5 23,1 31,6 3. Спосіб одержання сполуки формули (II) за пунктом 1, який відрізняється тим, що сполуку формули (І) 5 N N N N (Ia) 15 N N N N OH 10 NH O N N (I) N N O N O N N (Ib) у розчиннику піддають взаємодії із гідроксидом натрію або водним розчином їдкого натру, або натрієвою сіллю необов'язково при додаванні основи. 4. Спосіб одержання сполуки формули (II) за пунктом 3, який відрізняється тим, що сполуку формули (І) у розчиннику піддають взаємодії із водним розчином їдкого натру необов'язково при додаванні основи. 5. Спосіб одержання сполуки формули (II) за пунктом 3, який відрізняється тим, що сполуку формули (І) у розчиннику піддають взаємодії із водним розчином їдкого натру при додаванні триетиламіну. 18 UA 112422 C2 19 UA 112422 C2 20 UA 112422 C2 21 UA 112422 C2 22 UA 112422 C2 23 UA 112422 C2 24 UA 112422 C2 25 UA 112422 C2 26 UA 112422 C2 27 UA 112422 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted sodium-1h-pyrazole-5-olate
Автори англійськоюMilitzer, Hans-Christian, Gries, Jorg, Koep, Stefan
Автори російськоюМилитцер Ханс-Кристиан, Грыс Йорг, Кёп Штефан
МПК / Мітки
МПК: A61K 31/506, C07D 403/14
Мітки: натрій-1н-піразол-5-олат, заміщений
Код посилання
<a href="https://ua.patents.su/30-112422-zamishhenijj-natrijj-1n-pirazol-5-olat.html" target="_blank" rel="follow" title="База патентів України">Заміщений натрій-1н-піразол-5-олат</a>
Попередній патент: Гелева композиція
Наступний патент: Спосіб одержання (варіанти) кристалічних форм розувастатину тба
Випадковий патент: Спосіб формування температурного режиму оболонки еластичного резервуара












