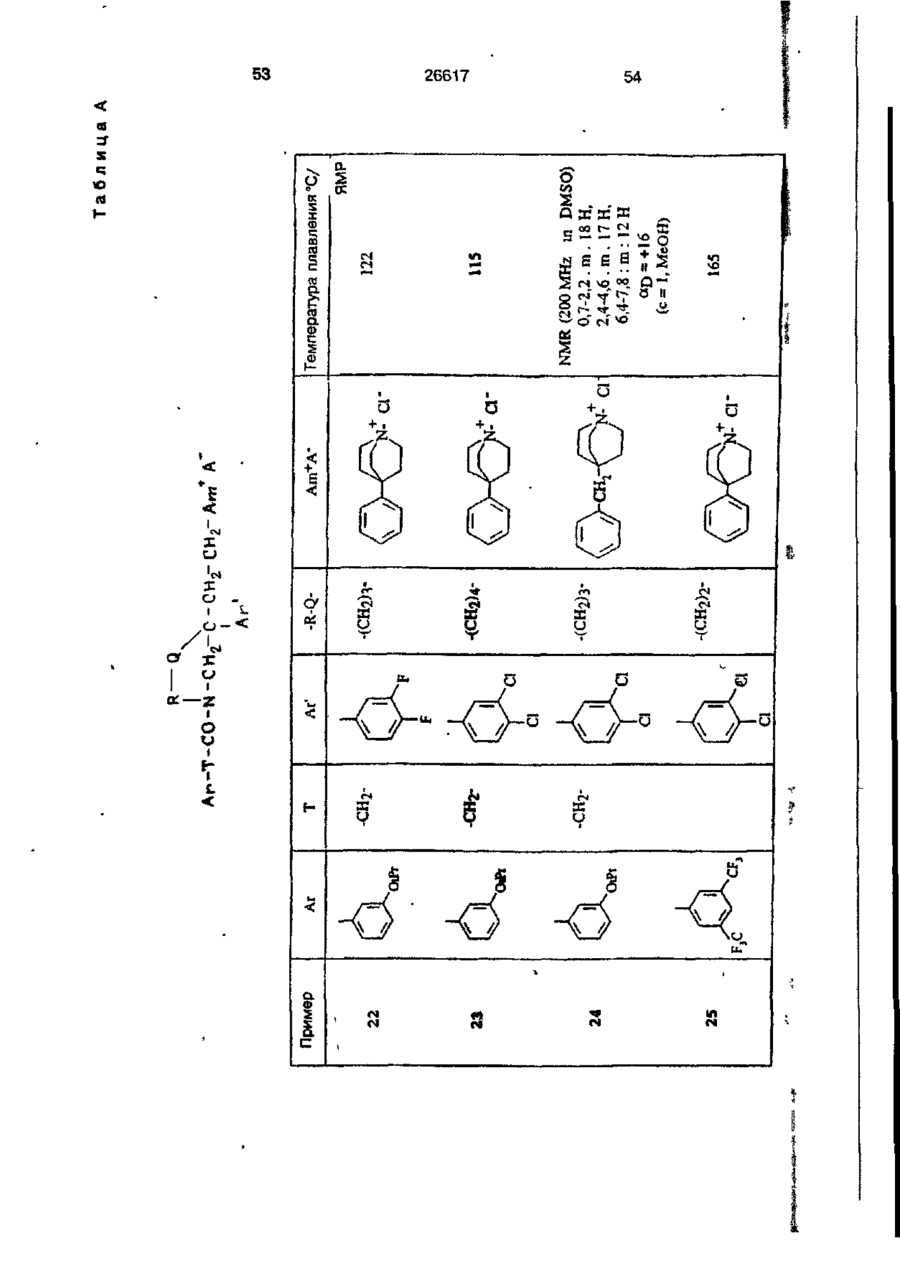
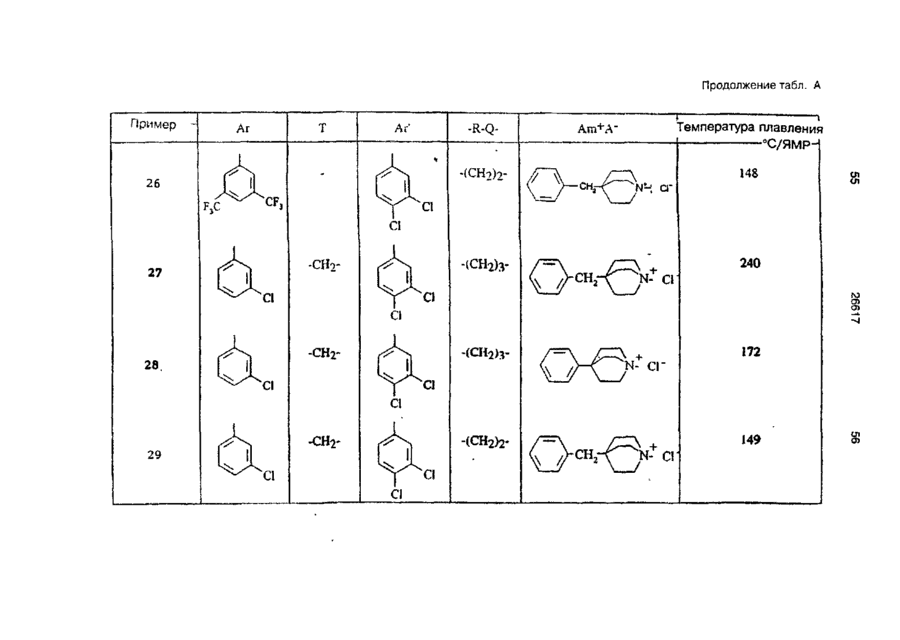
Четвертинні основні аміди, призначені для лікування патологій, що відносяться до системи тахікініну, спосіб їх одержання та фармацевтична композиція, що їх містить
Номер патенту: 26617
Опубліковано: 11.10.1999
Автори: ЕМОН-АЛЬТ Ксав'є, Гйоль Патрік, ВАН БРЕК Дідьє, Пруетто Вінченцо
Формула / Реферат
1. Четветричные основные амиды формулы l
где Ar - фенильная группа, моно- или дизамещенная одинаковыми или различными заместителями, выбранными из группы: атом галогена, гидрокси, C1-C4-алкокси, трифторметил или монозамещенная галогеном нафтильная группа;
T - простая связь или группа -CH2-;
Ar' является фенилом, дизамещенным независимо атомом галогена или нафтилом;
R представляет собой водород, C1-C4-алкил, w-C1-C4-алкокси C2-C4-алкил, w-C2-C4 алканоилокси C2-C4-алкил;
Q является водородом или Q и R вместе образуют 1,2-этиленовую, 1,3-пропиленовую или 1,4-бутиленовую группы;
Am+ является радикалом, выбранным из 1-азонийбицикло[2.2.2]окт-1-ил, 4-фенил-1-азонийбицикло[2.2.2]окт-1-ил, 4-бензил-1-азонийбицикло[2.2.2]окт-1-ил, 1-азонийбйцикло[2.2.1]гепт-1-ил, 4-фенил-1-азонийбицикло[2.2.1]гепт-1-ил, 4-бензил-1-азонийбицикло[2.2.1]гепт-1-ил;
A- - фармацевтически приемлемый анион,
предназначенные для лечения патологий, относящихся к системе тахикинина.
2. Четвертичные основные амиды формулы l по п.1, отличающиеся тем, что радикал, обозначенный как Am+, содержит от 5 до 9 атомов углерода в его азабициклической системе.
3. Четвертичные основные амиды формулы l по п.1 или 2, отличающиеся тем, что T, R, Ar' и Q - те же, что и определенные для формулы l, Am+-1-азонийбицикло[2.2.2]октан(радикал), либо 4-фенил-1-азонийбицикло[2.2.2]октан(радикал), Ar - фенил, замещенный C1-C4-алкокси, и A- - фармацевтически приемлемый анион.
4. Четвертичный основной амид по п.3, отличающийся тем, что он представлен формулой (l')
в которой R' и Q', соответственно, являются метилом и водородом, 2-ацетоксиэтилом и водородом либо R' и Q' вместе образуют группу 1,3-пропилена, R" - водород или фенильная группа и A- - фармацевтически приемлемый анион.
5. Четвертичный основной амид по п.4, отличающийся тем, что он представлен формулой (l")
в которой A- - фармацевтически приемлемый анион.
6. Четвертичные основные амиды по любому из пп.1 или 5, отличающиеся тем, что
A- - анион, выбранный из числа: хлорид, бромид, иодид, гидросульфат, метансульфонат, паратолуолсульфонат, бензенсульфонат, ацетат.
7. Четвертичные основные амиды по п.6, отличающиеся тем, что они представляют собой (+)-1-[2-[3-(3,4-дихлорфенил)-1-[(3-изопропоксифенил)ацетил]-пиперидин-3-ил]этил]-4-фенил-1-азонийбицикло[2.2.2]-октанхлорид.
8. Способ получения четвертичных основных амидов формулы (l), отличающийся тем, что производят обработку соединения формулы (ll)
где Y - любая отщепляемая группа, предпочтительно метансульфонил или бензолсульфонил, циклическим третичным амином, выбранным из 1-азонийбицикло[2.2.2]окт-1-ил, 4-фенил-1-азонийбицикло[2.2.2]окт-1-ил, 4-бензил-1-азонийбицикло[2.2.2]окт-1-ил, 1-азонийбицикло[2.2.1]гепт-1-ил, 4-фенил-1-азонийбицикло[2.2.1]гепт-1-ил, 4-бензил-1-азонийбицикло[2.21]гепт-1-ил;
в полярном апротонном растворителе при температурах от комнатной температуры до 120°C, и затем, если необходимо, меняют анион результирующей четвертичной соли на другой фармацевтически приемлемый анион.
9. Способ по п.8, отличающийсятем, что циклический третичный амин содержит от 5 до 9 атомов углерода в своей азабициклической системе.
10. Способ по п.8 или 9, отличающийся тем, что циклический третичный амин из группы:
1-азонийбицикло[2.2.2]окт-1-ил,
4-фенил-1-азонийбицикло[2.2.2]окт-1-ил,
4-бензил-1-азонийбицикло[2.2.2]окт-1-ил,
1-азонийбицикло[2.2.1]гепт-1-ил,
4-фенил-1-азонийбицкло[2.2.1]гепт-1-ил,
4-бензил-1-азонийбицикло[2.2.1]гепт-1-ил.
11. Фармацевтическая композиция, включающая активное вещество и наполнитель, отличающаяся тем, что в качестве активного вещества она содержит соединение формулы l в количестве от 0,5 до 1000мг.
12. Фармацевтическая композиция по п.11, отличающаяся тем, что она содержит активное вещество в количестве от 2,5 до 250мг.
Текст
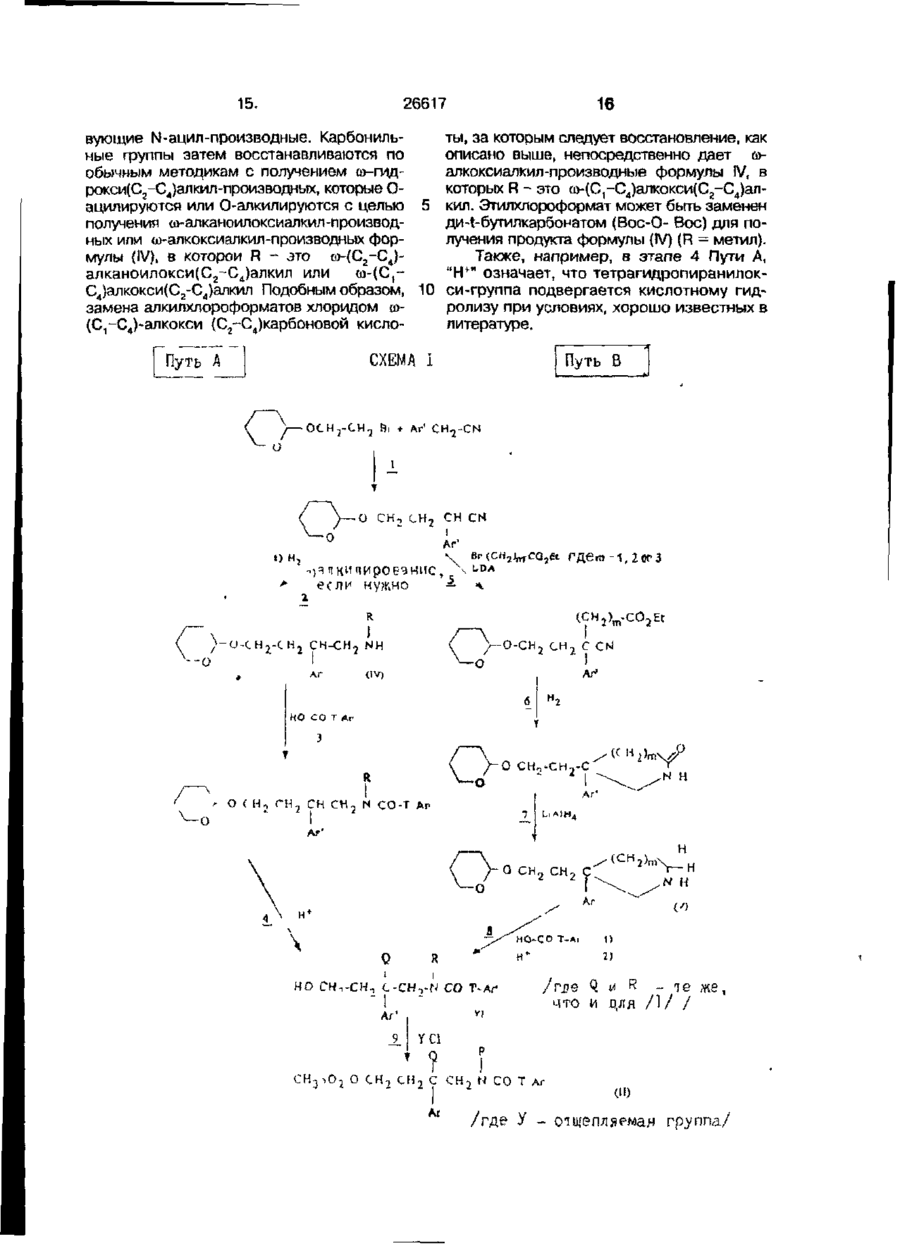
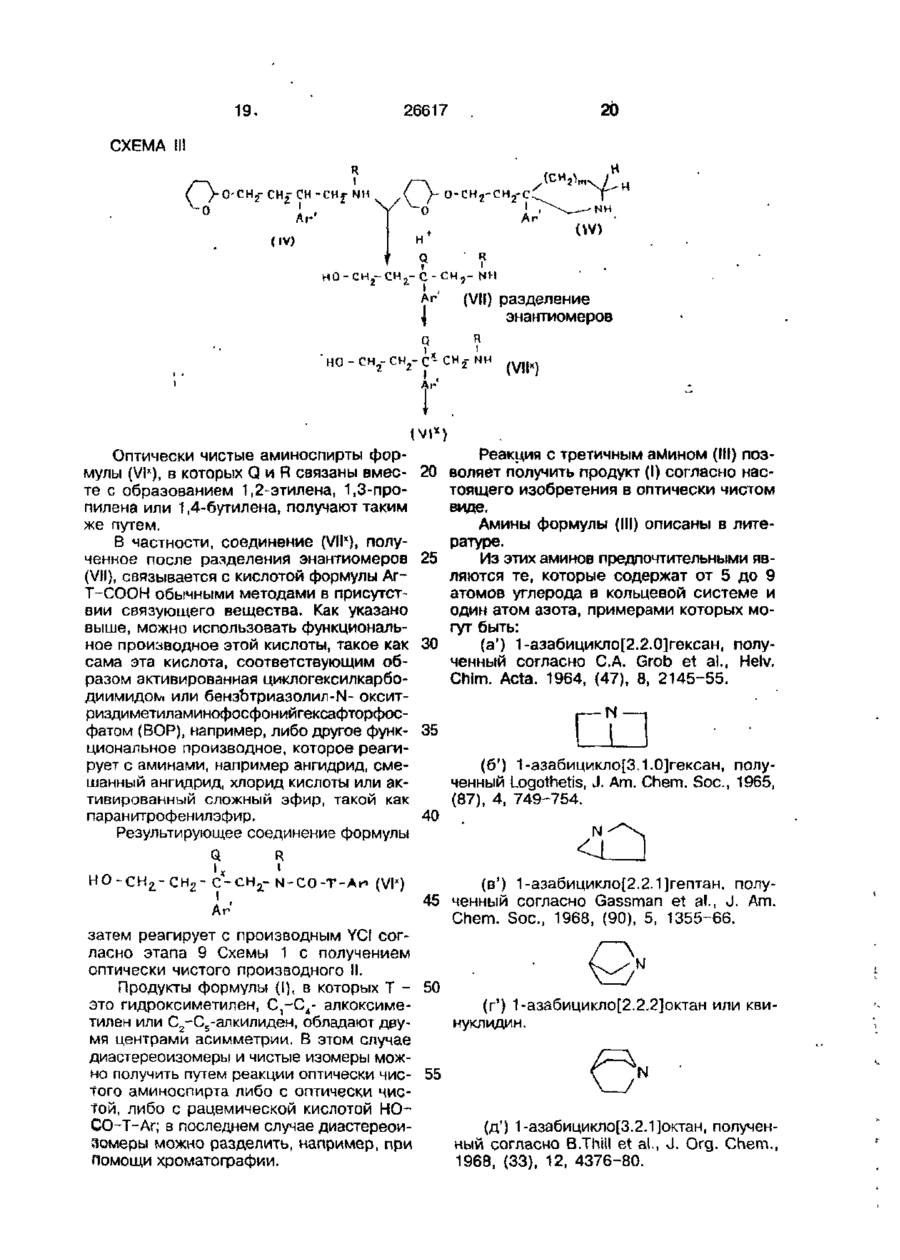
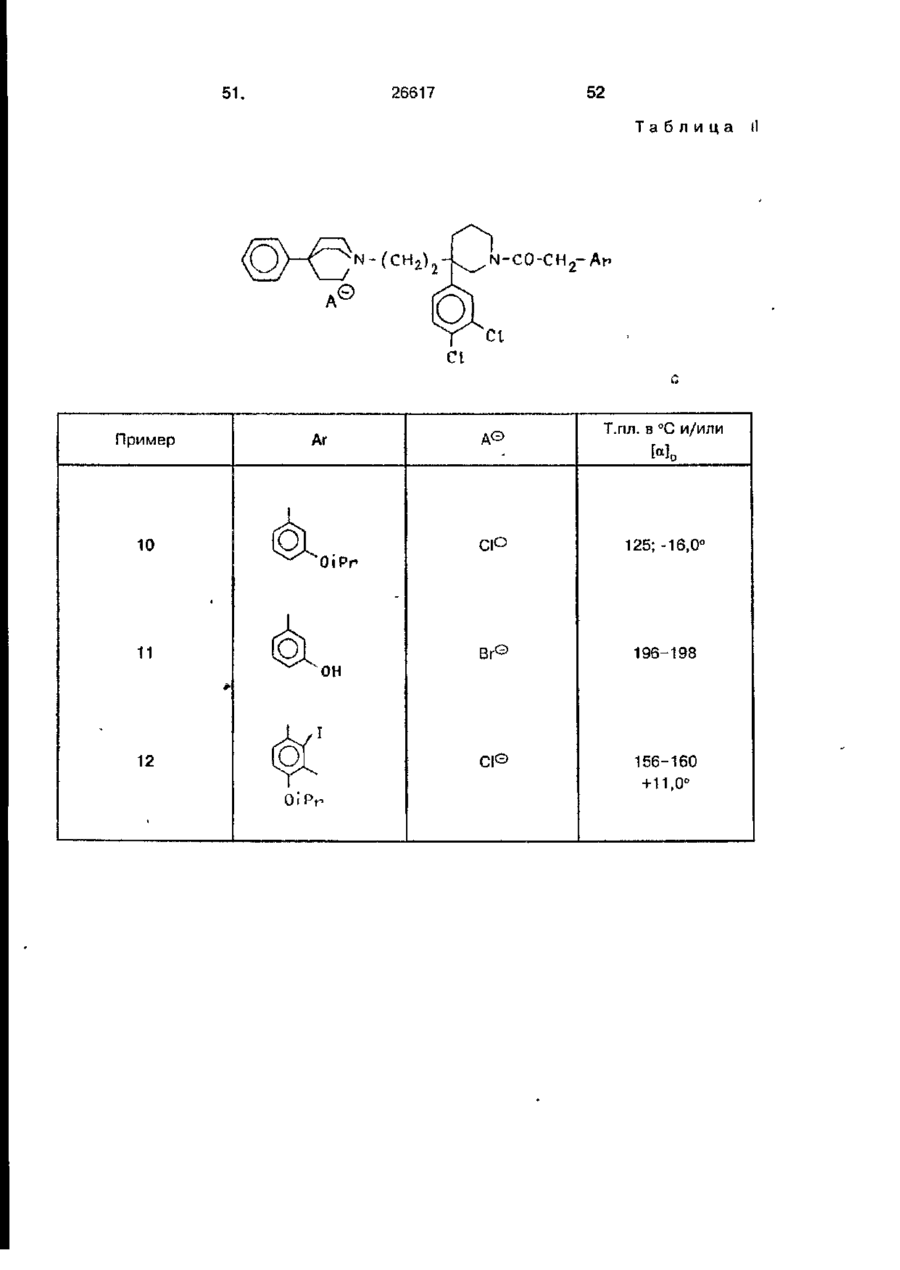
1. Четветричные основные амиды формулы І . R ї ї Q . Ar-T-C0-N-CH 2 -C-CH r CH 2 ~Am • A , Ar (I) 1 где Ar - фенильная группа,- моно- или дизамещенная одинаковыми или различными заместителями, выбранными из группы: атом галогена, гидрокси, С1-С4-алкокси, трифторметил или монозамещенная галогеном нафтильная группа; Т - простая связь или группа -ОН2-'Ь Аг' является фенилом, дизамещенным независимо атомом галогена или нафтилом; R представляет собой водород, С,-С4алкил, со-С,-С4-алкокси С2-С„- алкил, соС2-С4 алканоилокси С2-Сд-алкил; Q является водородом или Q и R вместе образуют 1,2-этил*еновую, 1,3-пропиленовую или 1,4-бутиленовую группы; А т + является радикалом, выбранным из 1-азонийбицикло[2.2.2]окт-1- ил, 4-фенил-1 -азонийбицикло[2.2.2]окт-1 -ил, 4-бензил-1- азонийбицикло[2.2.2]окт-1-ил, 1азонийбицикло[2.2.1]гепт-1-ил, 4-фенил-1азонийбицикло[2.2.1]гепт-1:ил, 4-бензил1 -азонийбицикло[2.2.1 ]гепт-1 -ил; А" - фармацевтически приемлемый анион, предназначенные для лечения патологий, относящихся к системе тахикинина. 2. Четвертичные основные амиды формулы I по п. 1, о т л и ч а ю щ и ес я тем, что радикал, обозначенный как Am', содержит от 5 до 9 атомов углерода в его азабициклической системе. 3. Четвертичные основные амиды формулы I по п.1 или 2, о т л и ч а ю щ и е с я тем, что Т, R, Аг1 и Q - те же, что и определенные для формулы І, Аггґ-1азонийбицикло[2.2.2]октан(радикал), либо 4фенил-1 - азонийбицикло[2.2.2]октан(радикал), Аг - фенил, замещенный С,-С4- алкокси, и А" - фармацевтически приемлемый анион. 4. Четвертичный основной амид по п. 3, о т л и ч а ю щ и й с я тем, что он представлен формулой (Г) R iPr-0 с > Q' сн.гсо-н-снг-с-сн2-снг-| (I') в которой R'n Q\ соответственно, являются метилом и водородом, 2-ацетоксиэтилом и водородом либо R1 и Q' вместе образуют группу 1,3-пропилена, R" - водород или фенильная группа и А" - фармацевтически приемлемый анион. 5. Четвертичный основной амид по п. 4, о т л и ч а ю щ и й с я тем, что он представлен формулой (I") ON ON 26617 гепт-1-ил, 4-фенил-1-азонийбицикло [2.2.1]гепт-1-ил, 4-бензил-1- азонийбицикло[2.2.1]гепт-1-ил; в полярном апротонном растворителе при температурах от комнатной температуры до 120°С, и затем, если необходимо, меняют анион результирующей четвертичной соли на другой фармацевтически приемлемый анион. 9. Способ по п. 8, о т л и ч а ющ и й с я тем, что циклический третичный амин содержит от 5 до 9 атомов углерода в своей азабициклической системе. 10. Способ по п. 8 или 9, о т л ич а ю щ и й с я тем, что циклический третичный амин из группы: 1 -азонийбицикло[2.2.2]окт-1 -ил, 4-фенил-1-азонийбициклоЕ2.2.2]окт-1-ил, • 4-бензил-1 -азо>^ийбицикло[2.2.2]окт-1 -ил, 1 -азонийбицикло[2.2.1 ]гепт-1 -ил, 4-фенил-1 -азонийбицикло[2.2.1 ]гегтг-1 -ил, 4-бензил-1 -азонийбицикло[2.2.1 ]гепт-1 -ил. 11. фармацевтическая композиция, включающая активное вещество и наполнитель, о т л и ч а ю щ а я с я тем, что в качестве активного вещества она содержит соединение формулы \ в количестве от 0,5 до 1000 мг. 12. Фармацевтическая композиция по п. 11, о т л и ч а ю щ а я с я тем, что она содержит активное вещество в количестве от 2,5 до 250 мг. в которой А~ - фармацевтически приемлемый анион. 6. Четвертичные основные амиды по любому из пп. 1 или 5, о т л и ч а гощ и е с я тем, что А" - анион, выбранный из числа: хлорид, бромид, иодид, гидросульфат, метансульфонат, паратолуолсульфонат, бензенсульфонат, ацетат. 7. Четвертичные основные амиды по п. 6, о т л и ч а ю щ и е с я тем, что они представляют собой (+)-1-[2-[3-{3,4дихлорфенил)-1- [(3-изопропоксифенил)ацетил]-пиперидин-3-ил]этил]-4-фенил-1 - азонийбицикло[2.2.2]-октанхлорид. 8. Способ получения четвертичных основных амидов формулы (I), о т л и ч а ю щ и й с я тем, что производят обработку соединения формулы (И) Ar-T-CO-N-CH,-C~CH?-CHj-O-Y (И) где Y - любая отщепляемая группа, предпочтительно метансульфонил или бензолсульфонил, циклическим третичным амином, выбранным из 1-азоний-бицикло [2.2.2]окт-1 -ил, 4-фенил-1 -азонийбицикло [2.2.2] окт-1-ил, 4-бензил-1-азонийбицикло [2.2.2]окт-1-ил, 1- азонийбицикло[2.2.1] Изобретение относится к новым четвертичным основным амидам, способу их получения и содержащим их фармацевтическим составам, в которых они присутствуют как активные ингредиенты. Более конкретно изобретение относится к новому классу четвертичных основных амидов для терапевтического использования при патологических явлениях, включающих тахикининовую систему, таких как боль (Regoli et ai. Life Sciences 1987, 40, 109-117), аллергия и воспаление (Morlay J.E. et at. Life Sciences, 1987, 42, 527-544), недостаточность кровообращения (Losay J. et al. 1977, Substance P, Von Euler, U.S. and Pernow ed., 287-293, Ravon Press, New York), желудочно-кишечные расстройства (Regoli D. et ai. Trends. Pharmacol. Sci., 1985, 6, 481-484) и дыхательные расстройства (Mizrahi J. et al. Pharmacology, 1982, 25, 39-50), причем эти примеры являются далеконе полными и всеохватывающими. Были описаны лиганды, эндогенные 5 по отношению к рецепторам тахикинина, такие как вещество Р/ВР/, нейрокинин А /НКу (S.J. Bailey et al., 1983, Substance P, P. Skrabanck ed., 16-17, Boole Press, Dublin) и найрокинин В /НКв/ (Watson S.P. 10 Life Sciences, 1983, 25, 797-808). Таким образом, согласно одному из признаков, настоящее изобретение относится к четвертичным основным амидам формулы 15 О) 20 Кг 6 26617 в которой Аг - это произвольно замещенная моно-, ди- или трициклическая ароматическая или гетероароматическая группа; Т - это прямая связь, группа гидроксиметилена, группа алкоксиметилена, в которой алкокси группой является С,-С4группа или группа С,~С5-алкилена; Аг' - это фенил, являющийся незамещенным либо моно- или полизамещенным заместителями из числа: атом галогена, предпочтительно хлора или фтора, трифторметил, С,-С4-алкокси или С,-С4алкил, причем упомянутые заместители являются одинаковыми или различными, тиенил, бензотиенил, нафтил или индолил, R - это водород или С,-С4-алкил, или С,-С4-со~алкокси{С2-С4)- алкил, или С 2 С4-(о-алканоилокси(С,-С4)-алкил; Q - это водород, - либо Q и R вместе образуют группу 1,2этилена, 1,3-пропилена или 1,4-бутилена; А т + - это радикал X.-KJ в котором X,, Х2 и Х3 вместе с атомом азота, с которым они связаны, образуют азабициклическую или азатри циклическую систему, произвольно замещенную фенильной группой; А° - фармацевтически приемлемый анион. Фармацевтически приемлемый анион - это те анионы, которые обычно используются для образования солей и ионами четвертичного аммония продуктов для фармацевтического использования, предпочтительно хлорид, бромид, йодид, гидросульфат, метансульфонат, паратолуолсульфонат, ацетат и бензолсульфонат. В частности в формуле (I) Аг - это моно-, ди- или три-циклическая ароматическая или гетероароматическая группа, которая может иметь один или более заместителей, и в которой атом углерода ароматического карбоцикла или ароматического гетероцикла имеет прямую связь с Т. Более конкретно, радикал Аг может быть фенильной группой, которая может быть незамещенной либо произвольно содержать один или более заместителей. Если Аг - это фенильная группа, то она может предпочтительно быть моноили дизамещенной, особенно в 2,4-положении, а также например в 2,3-, 4,5-, 3,4-, 3,5-положениях; она также может 5 10 15 20 25 30 35 40 45 50 55 быть тризамещенной, особенно в 2,4,6положении, а также например в 2,3,4-, 2,3,5-, 2,4,5- или 3,4,5-положении, тетразамещенной, например в 2,3,4,5-положении, или пентазамещенной. Заместителями в этой фенильной группе могут быть' F; CI; Br; I; CN; ОН; NH2; NH-CONK,; NO2; CONH2; CF3; С,-С10-алкил, предпочтительно С-С.-алкил, желательно метил или 1 4 этил, а также например, п-пропил, изопропил, n-бутил, изобутил, втор.-бутил, трет.бутил, пентил или n-пентил, гексил или пгексил, октил или п-октил, нонил или пнонил либо децил или п-децил; алкенил, содержащий от 2 до 10 атомов углерода, предпочтительно от 2 до 4 атомов углерода, например винил, аллил, проп-1-енил, изопропенил, бутенил или бут-1-ен-1-, -2-, -3~,или -4-ил, бут-2-ен-1-ил, бут-2-ен-2ил, пентенил, гексенил или деценил; алкинил, содержащий от 2 до 10 атомов углерода, предпочтительно 2-4 атома углерода, например этинил, проп-1-ин-і-ил, пропаргил, бутинил или бут-2-ин-1-ил, пентинил или децинил; циклоалкил, содержащий от 3 до 8 атомов углерода, предпочтительно 5 или 6 атомов углерода, желательно циклопентил или циклогексил, а также например, циклопропил, циклобутил, 1-, 2- или З'Метилциклопентил, 1-, 2-, 3- или 4-метилциклогексил, циклогептил или циклооктил; бициклоалкил, содержащий от 4 до 11 атомов углерода, предпочтительно 7 атомов углерода, предпочтительно экзо- и эндо-2-норборнил, а также например, 2-изоборнил или 5-камфил; гидроксиалкил, содержащий от 1 до 5 атомов углерода, предпочтительно 1-2 атома углерода, предпочтительно гидроксиметил и 1- или 2-гидроксиэтил, а также например, 1-гидроксипроп-1-ил, 2-гидроксипроп-1-ил, 3-гидроксипроп-1-ил( 1-гидроксипроп-2-ил, 1-гидроксибут 1-ил или 1гидроксипент-1-ил; алкокси, содержащая от 1 до 10 атомов углерода, предпочтительно 1-4 атома углерода, предпочтительно изопропокси или этокси, а также например, п-пропокси, метокси, п-бутокси, изобутокси, втор.-бутокси, трет.-бутокси, пентокси, гексилокси, гептилокси. октилокси,'нонилокси или децилокси; алкоксиалкил, содержащий от 2 до 10 атомов углерода, предпочтительно от 2 до 6 атомов углерода, например алкоксиметил или алкоксиэтил, такие как метоксиметил либо 1- или 2-метоксиэтил, 1- или 2-пбутоксизтил или 1 -или 2-п- октилоксиэтил; алкоксиалкоксиалкил, содержащий до 10 атомов углерода, предпочтительно от 4 до 7 атомов углерода, например алкоксиал 26617 коксиметил, такой как 2-метоксиэтоксиметил, 2- этоксиэтоксиметил или 2изопропоксиэтоксиметил, либо алкоксиалкоксиэтил, такой как 2-(2-этоксиэтокси)этил или 2-(2- метоксиэтокси)этил; ал- 5 коксиалкокси, содержащий от 2 до 10 атомов углерода, предпочтительно от 3 до 6 атомов углерода, например, 2метоксиэтокси, 2-этоксиэтокси или 2-пбутоксиэтокси; алкенилокси, содержащий 10 от 2 до 10 атомов углерода, предпочтительно от 2 до 4 атомов углерода, предпочтительно аллилокси, а также например, винилокси, пропенилокси, изопропенилокси, бутенилокси, такой как бут-1-ен- 15 1-, -2-, -3- или -4-илокси, бут-2-ен-1-илокси или бут-2-ен-2-илкоси, пентенилокси, гексенилокси или деценилокси; алкенилоксиалкил, имеющий до 10 атомов углерода предпочтительно 3-6 атомов углеро- 20 да, например аллилоксиметил; алкинилокси, содержащий от 2 до 10 атомов углерода, предпочтительно от 2 до 4 атомов углерода, желательно пропаргилокси, а также например этинилокси, проп-1-ин-1- 25 илокси, бутинилокси или бут-2-ин-1-илокси, пентинилокси или децинилокси; алкинилоксиалкил, содержащий от 3 до 10 атомов углерода, например этинилоксиметил, пропаргилоксиметил или 2-{бут-2- 30 ин-1-илокси); циклоалкокси, содержащий от 3 до 8 атомов углерода, предпочтительно 5 или 6 атомов углерода, желательно циклопентокси или циклогексилокси, а также например, циклопропокси, цик- 35 лобутокси, 1-, 2-, 3- или 4-метилциклогексилокси, 1-, 2- или 3-метилциклопентокси, циклогептилокси или циклооктилокси; алкилтио, содержащий от 1 до 10 атомов углерода, предпочтительно от 1 до 40 4 атомов углерода, желательно метилтио или этилтио, а также например, п-пропилтио, изопропилтио, п-бутилтио, изобутилтио, втор.-бутилтио, трет.бутилтио, пентилтио, гексилтио, октилтио, нонилтио 45 или децилтио; алкилтиоалкил, содержащий от 2 до 10 атомов углерода, предпочтительно от 2 до 6 атомов углерода, например, метилтиометил, 2-метилтиоэтил или 2-п-бутилтиоэтил; ациламино, а имен- 50 но алканоиламино, содержащий от 1 до 7 атомов углерода, предпочтительно от 1 до 4 атомов углерода, желательно формиламино и ацетиламино, а также пропиониламино, бутириламино, изобутириламино, 55 валериламино, капроиламино или гептаноиламино, либо ароиламино или бензиламино; ациламиноалкил, предпочтительно алканоиламиноалкил, содержащий от 2 до 8 атомов углерода, предпочтительно 8 от 3 до 6 атомов углерода, такой как формиламиноэтил, ацетиламиноэтил, пропиониламинометил, п- бутириламиноэтил, формиламинопропил, ацетиламинопропил, лропиониламинопропил, формиламинобутил или ацетиламинобутил, а также пропиониламинобутил или бутириламинобутил; ацилкоси, содержащий от 1 до 6 атомов углерода, предпочтительно от 2 до 4 атомов углерода, желательно ацетокси, пропионилокси или бутирилокси, а также например, формилокси, валерилокси или капроилокси; алкоксикарбонил, содержащий от 2 до 5 атомов углерода, предпочтительно 2 или 3 атома углерода, желательно метоксикарбонил и этоксикаобонил, а также например, п-пропоксикарбонил, изопропоксикарбонил, п-бутоксикарбонил, изобутоксикарбонил, втор.-бутоксикарбонил или трет.-бутоксикарбонил; циклоалкоксикарбонил, содержащий от 4 до 8 атомов углерода, предпочтительно 6 или 7 атомов, углерода, желательно циклопентоксикарбонил и циклогексилоксикарбонил, а также циклопропоксикарбонил, циклобутоксикарбонил или циклогептилоксикарбонил; алкиламинокарбониламино, содержащий от 2 до 4 атомов углерода, такой как метиламинокарбониламино, этиламинокарбониламино или пропиламинокарбониламино; диалкиламинокарбониламино, содержащий от 3 до 7 атомов углерода, предпочтительно от 3 до 5 атомов углерода, желательно диметиламинокарбониламино, а также ди-п-пропиламинокарбониламино или диизопропиламинокарбониламино; (пирролидин-1 -ил)карбониламино; циклоалкиламинокарбониламино, содержащий от 4 до 8 атомов углерода, предпочтительно 6 или 7 атомов углерода, желательно циклопентиламинокарбониламино и циклогексиламинокарбониламино, а также циклопропиламинокарбониламино, циклобутиламинокарбониламино или циклогептиламинокарбониламино; алкиламинокарбониламиноалкил, содержащий от 3 до 9 атомов углерода, предпочтительно от 4 до 7 атомов углерода, желательно метиламинокарбониламиноэтил, этиламинокарбониламиноэтил, этиламинокарбониламинопропил и этиламинокарбониламинопропил, а также например, метиламинокарбониламинометил, n-пропиламинокарбониламинобутил и пбутиламинокарбониламинобутил; диалкиламинокарбониламиноалкил, содержащий от 4 до 11 атомов углерода, например, диметиламишокарбониламинометил, диэтиламинокарбониламиноэтил, диэтиламинокарбониламинопропил и диэтилами 26617 нокарбониламинобутил; (пирролидин-1 ил)карбониламиноэтил; {пиперидин-1-ил) карбониламинозтил; циклоалкиламинокарбониламиноалкил, содержащий от 5 до 12 атомов углерода, предпочтительно от 8 до 11 атомов углерода, желательно циклопентиламинокарбониламиноэтил, циклопентиламинокарбониламинопропил, циклопентиламинокарбониламинобутил, циклогексиламинокарбониламиноэтил, циклогексиламинокарбониламинопропил и циклогексиламинокарбониламинобутил, а также например, циклопропиламинокарбониламиноэтил или циклогептиламижжарбониламиноэтил; алкоксикарбониламиноалкил, содержащий от 3 до 13 атомов углерода, предпочтительно от 4 до 9 атомов углерода, желательно метоксикарбониламиноэтил, этоксикарбониламиноэтил n-пропоксикарбониламиноэтил, изопропоксикарбониламиноэтил, п-бутоксикарбониламиноэтил, изобутоксикарбониламиноэтил, втор, -бутоксикарбониламиноэтил, трет.-бутоксикарбонил-аминоэтил, этоксикарбониламинопропил, п-бутоксикарбониламинопропил, этоксикарбониламинобутил и п-бутоксикарбониламинобутил, а также например, п-пропоксикарбониламинопропил, п- пропоксикарбониламинобутил или изопропоксикарбониламинобутил; циклоалкоксикарбониламиноалкил, содержащий от 5 до 12 атомов углерода предпочтительно от 8 до 11 атомов углерода, желательно циклопентоксикарбониламиноэтил, циклолентоксикарбониламинопропил, циклопентоксикарбониламинобутил, циклогексилоксикарбониламиноэтил, циклогексилоксикарбониламинопропил, циклогексилоксикарбониламинобутил, а также например, циклопропоксикарбониламинометил или циклогептилоксикарбониламиноэтил; карбамоилалкил, содержащий от 2 до 5 атомов углерода, предпочтительно 2 атома углерода, желаете л ьн о карбамо ил метил, а также карбамоилзтил, карбамоилпропил или карбамоилбутил; алкиламинокарбонилалкил, содержащий от 3 до 9 атомов углерода, предпочтительно от 3 до 6 атомов углерода, желательно метиламинокарбонилэтил, этиламинокарбонилметил, ппропиламинокарбонилметил, изопропиламинокарбонилметил, п- бутиламинокарбонилметил, изобутиламинокарбонилметил, втор.- бутиламинокарбонилметил, и трет,бутиламинокарбонилметил, а также например, этиламинокарбонилэтил, этиламинокарбонилпропил, зтиламинокарбонилбутил, пропиламинокарбонилбутил или п- бутил аминокарбонил бутил; диалкиламинокар 5 10 15 20 25 30 35 40 45 50 55 10 бонилалкил, содержащий от 4 до 11 атомов углерода, желательно от 4 до 8 атомов углерода, предпочтительно диметиламинокарбонилметил, диэтиламинокарбонилметил и ди-п-пропил аминокарбонил метил, а также например, диэтиламинокарбонилэтил, диэтиламинокарбонилпропил или диэтиламинокарбонилбутил; (пирролидин-1-ил)карбонилметил; (пиперидин-1ил)карбонилметил; {пиперидин-1ил)карбонилэтил; циклоалкиламинокарбонилалкил, содержащий от 5 до 12 атомов углерода, предпочтительно 7 или 8 атомов углерода, желательно циклопентиламинокарбонилметил и циклогексиламинокарбонилметил, а также например, циклопропиламинокароонилметил, циклобугиламинокарбонилметил, циклогептиламинокарбонил метил, циклогексиламинокарбонилэтил, циклогексиламинокарбонилпропил или циклогексиламинокарбонилбутил; алкиламинокарбонилалкокси, содержащий от 3 до 10 атомов углерода, предпочтительно от 3 до 5 атомов углерода, желательно метиламинокарбонилметокси, а также например, метиламинокарбонилэтокси или метиламинокарбонилпропокси; диалкиламинокарбонилалкокси, содержащий от 4 до 10 атомов углерода, предпочтительно от 4 до 7 атомов углерода, такой как диметиламинокарбонилметокси или диэтиламинокарбонилэтокси; (пиперидин-1-ил)карбонилметоки; и циклоалкиламинокарбонилалкокси, содержащий от 5 до 11 атомов углерода, предпочтительно 7 или 8 атомов углерода, такой как циклопеитиламинокарбонилметокси или циклогексиламинокарбонилметокси. Радикал Аг также может быть бициклической ароматической группой, такой как 1- или 2-нафтип или 1-, 2-, 3-, 4-, 5-, 6- или 7-инденил, в которых одна или более связей могут быть гидрированы, причем упомянутые группы могут быть незамещенными или произвольно содержать один или более заместителей, таких как: атом галогена, в частности фтора, алкильная, фенильная, циано-, гидроксиалкильная, гидрокси-, С^-С^алкокси-, оксо-, алкилкарбониламино-, алкоксикарбонильная и тиоалкильная группы, в которых алкилы - это С т -С 4 . Радикал Аг может также быть пиридилом, тиадиазолилом, индолилом, индазолилом, имидазолилом, бензимидазолилом, квинолилом, бензотриазолилом, бензофуранилом, бензотиенилом, бензотиазолилом, бензисотиазолилом, изоквинолилом, бензоксазолилом, бензоксазинилом, бензадиоксинилом, изоксазолилом, бензапи 11. 12 26617 ранилом, тиазолилом, тиенилом, фурилом, пиранилом, хроменилом, изобензофуранилом, пирролилом, пиразолилом, пиразинилом, пиримидинилом, пиридазинилом, индолизинилом, фталазинилом, квинаэо- 5 линилом, акридинилом, изотиазолилом, изохроманилом или хроманилом, в которых одна или более двойных связей могут быть гидрированными, причем для упомянутых групп возможно, чтобы они были 10 незамещенными или произвольно содержали один или более таких заместителей, как алкил-, фенил-, циано-, гидроксиалкильная, гидрокси-, алкилкарбониламино-, алкоксикарбонильная и тиоалкильная груп- 15 пы, в которых алкилы - это С,-С4. Предпочтительно, радикал Аг - это фенил, являющийся незамещенным либо моно- или полизамещенный атомом галогена, в частности хлора или фтора, триф- 20 торметилом, С,-С4-алкилом, гидрокси или С,-С4-алкокси, нафтилом, являющимся незамещенным или моно- либо полизамещенным галогеном, трифторметилом, С,С4-алкилом, гидрокси или С^С^-алкокси, 25 тиенилом, индолилом, квинолилом, бензотиенилом или имидазолилом. Особенно предпочтительными соединениями формулы (І) являются те, у которых Аг - это фенильная группа, замещен- 30 ная изопролоксигруппой, желательно в 3положении. В формуле (і) Т предпочтительно является группой метилена. Заместители R и Q являются предпоч- 35 тительно соответственно метилом *л водородом; 2-метоксиэтилом и водородом; 2ацетоксиэтилом и водородом; либо R и Q вместе образуют группу 1,3-пропилена. 1 Заместитель Аг - это предпочтитель- 40 но фенильная группа, желательно замещенная двумя атомами хлора, в частности в 3 и 4 положениях. Радикал, обозначенный в виде Am® содержит предпочтительно от 5 до 9 ато- 45 мов углерода в азабициклической или азатрициклической системе. Радикал v (г) 1-азаниабицикло[2.2.2]октан (д) 1-азониабицикло[3.2.1]октан (е) 1-азониабицикло[3.2.2]нонан (ж) 1-азониабицикло[3.3.1]нонан (з) гєксагидро-1Н-пирролизин-4 (и) октагидроиндолизин-4 (к) октагидро-2Н-квинолизин-5 (л) 1-азониатрицикло[3.3.1.137]декан (м) 4-фенил-1-азониабицикло[2.2.2]октан, причем особо предпочтительными яаляются группы (г) и (м). Особенно предпочтительными четвертичными основными амидами согласно настоящего изобретения являются те, у которых в формуле (I) одновременно: Аг - это 3-изопропоксифенильная группа; Т - это группа метилена; R и Q - это соответственно метил и водород; 2-ацетоксиэтчл и водород; либо R и Q вместе образуют группу 1,3-пропилена; г Аг' - это 3,4-дихлорфенил; А т ш ^ - это радикал (г) или (м), описанные выше; А е - это фармацевтически приемлемый анион, предпочтительно хлорид, метансульфонат и бензолсульфонат. Эти продукты формулы R' Q' .. .0 (I і ) 1 1 в которой iPr - это изопропил, R и Q это соответственно метил и водород; 2ацетоксиэтил и водород; либо R1 и Q1 вместе образуют группу 1,3-пропилена, R" - это водородная или фенильная группа и А 3 - то же, что и описано выше, особенно ион метансульфоната или хлорида, являются сильными антагонистами вещества Р. і Соединения формулы (I ), В которых Н' и Q' вместе образуют группу 1,3-пропилена, являются чрезвычайно сильными и проявляют большее сродство с рецеп50 тором нейрокинина-1, чем само вещество Р. Поэтому они являются предпочтительным элементом настоящего изобретения. Из этих соединений формулы (Г1) обозначенный в виде заместителя Am® в формуле (I) является предпочтительно ос- 55 татком азабициклической или азатрицикiPr-0 сн9-со-ы лической системы из числа: (а) 1-азониабицикло[2.2.0]гексан {б) 1-азониабицикло[3.1.0]гексан (в) 1-азониабицикло[2.2.1]гептан 13 26617 в которых А° ~ это фармацевтически приемлемый анион, особенно метансульфонат, хлорид и бензолсульфонат, являются особо ценными. Согласно другого признака, настоящее изобретение относится к способу получения соединений вышеприведенной формулы (I), который заключается в обработке производного формулы Ar-T-CO-N-CH--C-CH--CH> 0-Y 10 (II) где Y - это любая отщепляемая группа, предпочтительно метансульфонил или бензолсульфонил, циклическим третичным амином формулы 15 20 (III) в которой X,, Х2 и Хэ вместе с атомом азота, с которым они связаны, образуют азабициклическую или азатр и циклическую систему, произвольно замещенную фенильной группой, в органическом растворителе при температурах от комнатной температуры до 120°С и выделении результирующего продукта, либо по другому, в соответствующих случаях, обмена аниона метансульфоната результирующей четвертичной соли на другой фармацевтически приемлемый анион. Используемым органическим растворителем предпочтительно является полярный апротонный растворитель, например ацетонитрил, N-N- диметилформамид или N.N-димеіилфенилацетамид, однако можно также использовать простой эфир, например тетрагидрофуран, диоксан или ме.тил-1-бутилэфир, либо кетон, например метил этил кетон, причем предпочтительным является ацетонитрил. В вышеуказанном температурном интервале предпочтительными являются температуры 70-90°С Если в качестве растворителя используется ацетонитрил, то реакция желательно производится с нагреванием реакционной смеси в колбе с обратным холодильником. Продукт, полученный таким образом, выделяют в чистом виде при помощи обычных методик, затем промывают остаток водой и затем чистят при помощи обычных методик, например хроматографии или перекристаллизации. 25 30 35 40 45 50 14 Анион метансульфоната, получающийся в результате реакции между третичным амином формулы (III) и метансульфонилокси-производным формулы (К), можно обменять in situ либо после выделения соединения (І), в котором А° - это ион метансульфоната, на другой анион А°при помощи обычных методов, например при помощи обмена в растворе, таком как раствор соляной кислоты в случае если А° - это хлорид-анион, либо при помощи обмена этого аниона на другой анион путем элюирования соединения (I) на ионообменной смоле, например Amberlite IRA68® или Duolite A375 e . Производные формулы (II), используемые в качестве исходных веществ для метода согласно настоящего изобретения, можно получить по Схеме 1, приведенной ниже, где в приведенных формулах: для Пути А Q = Н; R = Н, С, с 4 алкил _ _ В R + Q = ~(СН2)П-, где _ для[Пути rv*2, 3, 4 В Схеме 1 реакции на различных этапах показаны в представительном виде, чтобы показать тип этих реакций, не приводя задействованных способов, которые являются известными. Таким образом, например, в Пути А, этап 2, и в Пути В, этап 6, "Н г " означает, что исходный нитрил подвергается восстановлению, например до каталитической гидрогенизации {никель в этаноле, в присутствии аммиака, с получением первичного амина IV). В том же этапе 2 Пути А термин "алкилирование" означает, что после восстановления этот первичный амин подвергается реакции алкилирования, которую осуществляют непосредственно при помощи алкилгалогенида или сульфата, либо непрямо при помощи ациляции и восстановления карбонильной группы. Таким образом, например, реакция первичного амина (IV) с этилхлор оформ атом и восстановление этоксикарбонильной группы дает продукт формулы (IV) R - это метил, как описано в ЕР-0428434 и ЕР-0474561. Соединение формулы (IV}, в котором R это С. -Сд-алкил получают при помощи замены этилхлороформата хлоридом (или другим функциональным производным) С 2 55 С4-апканойной кислоты при помощи восстановления карбонильной группы результирующего N-ацилированного производного. Замена этилхлороформата этилэтилоксалилом, этилгемималонатом или этилгемисукцинатом, например, дает соответст 15. 16 26617 вующие N-ацил-производные. Карбонильты, за которым следует восстановление, как ные группы затем восстанавливаются по описано выше, непосредственно дает -(С,-С4)алкокси(С2-С4)алацилируются или О-алкилируются с целью 5 кил. Этилхлороформат может быть заменен получения ш-ал каноилоксиал кил-производди-і-бутилкарбонатом (Вос-О- Вое) для поных или (о-алкоксиалкил-производных форлучения продукта формулы (IV) (R = метил). мулы (IV), в которой R - это ы-(С2-С4)Также, например, в этапе 4 Пути А, алканоилокси(С2-С4)алкил или «-(С,~ "Н + " означает, что тетрагидропиранилокСд}алкокси(С2-С4)алкил Подобным образом, 10 си-группа подвергается кислотному гидзамена алкилхлороформатов хлоридом соролизу при условиях, хорошо известных в (Сг~С4)карбоновой кислолитературе. СХЕМА 1 Путь А Путь В * Аг' CH?-CN О О СН2 СН2 СН СН Аг 1 гдет-1, 2ОРЗ он *• если нужно ^ ч •о-сн,-с н- сн-сн, NH -O-CHj С Н 2 С СМ •--о АГ -о (IV) НО СО Т Аг О Аг' О ( H j Г Н 2 СН СН 3 N СО-Т Аг Af' Аг ~y HO-CO T-AI i) /тле Q и R - те что и для / 1 / / но снл-сн2 t-CHrti со 1 " Аг 1 YC1 ? I О С Н 2 С Н 2 С С Н 2 N СО Т Аг (If) /где У - отщепляемая группа/ 26617 17 Значение заместителя Аг зависит от выбора кислоты НО-СО-Т-Аг, используемой в этапах 3 и 8 в виде одного из ее функциональных производных. Все эти кислоты хорошо известны в литературе, их можно легко получить по литературе либо они имеются в продаже. Значение заместителя Аг' зависит от выбора нитрила Ar'-CH 2 -CN T который в реакции с 2-тетрагидропиранилокси1-бромэтаном, гидрировании результирующего продукта и в соответствующих случаях N-алкилирования (этап 2), дает амин. Путь А Схемы 1, в котором R = Н, алкил и Q = Н, описан в литературе и в патентных заявках ЕР-А-0428434 и ЕР~А0474561. Путь В Схемы 1 включает ряд реакций, хорошо известных специалистам, таких как алкилирование нитрила бромированным производным в присутствии диизопропиламида лития (LDA) (этап 5), с последующим восстановлением этого нитрила в присутствии катализатора с получением соответствующего амина после восстановления промежуточного амида (этап 7), полученного во время циклизации (этап 6), например согласно А.В. Ельцову и сотр., Биол< Соедин., Акад. Наук СССР, 1965, 109-12 (СА. 1965, 63, 16299). В обоих путях Схемы 1 условия реакций определенных этапов являются теми же. Так, восстановление в этапе 2 (Путь А) и этапе 6 (Путь В) проводится при тех же условиях. Аналогично, этап 7 (Путь В) и восстановление N-ацилированного производного или этоксикарбонила в непрямой реакции алкилирования из этапа 2 (Путь В) имеют место при тех же условиях. Наконец, ацилирование из этапа 3 (Путь А) и этап 8 (Путь В), также осуществляются при одинаковых условиях. Способ получения соединений (I) согласно настоящего изобретения состоит из реакции производного (II), полученного путем реакции спирта (IV) с производным УСІ, например мезилхлоридом или бензолсульфонилхлоридом, (этап 9), с третичным амином формулы (III) в соответствии с нижеприведенной схемой II. СХЕМА II ч t R C ', Аг (I) (II) (!!!) 18 Разделяемость рацемических смесей (!) позволяет выделить энантиомеры (Iх), что также является частью настоящего изобретения. Однако предпочтительно разделять рацематы на этапе промежуточных аминоспиртов, которые могут давать соли с оптически активными кислотами. Эти аминоспирты соответствуют соединениям (IV) и (V), полученных согласно этапа 2 (Путь А) и согласно этапа 7 (Путь В) Схемы 1 после снятия защиты этих соединений путем гидролиза в кислотной среде о-сн2- сн2-сн-сн2 20 25 О (IV) (V) 30 в которых Аг' и R - те же, что и определенные для (I) и m = 1,2 или 3. Эти энантиомеры затем разделяются обычными методами, такими как кристаллизация или хиральная препа35 ративная хроматография высокого давления. Получение оптически чистых соединений иллюстрируется нижеприведенной Схемой III, где "X" означает, что атом ^ углерода, обозначенный этим символом, имеет определенную конфигурацию (+) или (-). На схеме lit последний этап, как показано, осуществляется при помощи 45 свободной кислоты, однако его можно проводить и при помощи его функционального производного, который мог бы разрушать молекулу как на гидроксиль50 ную группу, так и на аминогруппу. В этом случае, желательно снова защитить гидроксильную группу, например при помощи дигидрофурана с образованием простого тетрагидропиранилэфи55 р Получение соединений (VIх) согласно Схеме НІ, в которых R - водород или С,-С4-алкильная группа и Q - это водород, описано в ЕР-А-0428434 и ЕР-А0474561. 19. 26617 20 СХЕМА ill ,- NH (VII) разделение энантиомеров R 2 - с " CH2-NH ї (VI*) Оптически чистые аминоспирты формулы (VIх), в которых Q и R связаны вместе с образованием 1,2-этилена, 1,3-пропилена или 1,4-бутилена, получают таким же путем. В частности, соединение (VIIя}, полученное после разделения энантиомеров (VII), связывается с кислотой формулы АгТ-СООН обычными методами в присутствии связующего вещества. Как указано выше, можно использовать функциональное производное этой кислоты, такое как сама эта кислота, соответствующим образом активированная цикпогексилкарбодиимидо^ или бензЪтриазолил-N- окситризди метил аминофосфонийгексафторфосфатом (ВОР), например, либо другое функциональное производное, которое реагирует с аминами, например ангидрид, смешанный ангидрид, хлорид кислоты или активированный сложный эфир, такой как паранитрофенилэфир. Результирующее соединение формулы Реакция с третичным аМином (III) поз20 воляет получить продукт (I) согласно настоящего изобретения в оптически чистом виде. Амины формулы (III) описаны в литературе. Из этих аминов предпочтительными яв25 ляются те, которые содержат от 5 до 9 атомов углерода в кольцевой системе и один атом азота, примерами которых могут быть: 30 (а1) 1-азабицикло[2.2.0]гексан, полученный согласно С.А. Grob et al., Helv. Chim. Acta. 1964, (47), 8, 2145-55. N 35 40 (б') 1-азабицикло[3.1.0]гексан, полученный Logothetis, J. Am. Chem. Soc, 1965, (87), 4, 749-754. N Q HO-CH Z -CH 2 - C-CHjr N-C0-T-An (VIх) (в') 1-азабицикло[2.2.1]гептан, полу45 ченный согласно Gassman et al., J. Am. Chem. Soc, 1968, (90), 5, 1355-66. затем реагирует с производным YCI согласно этапа 9 Схемы 1 с получением оптически чистого производного II. Продукты формулы (І), в которых Т - 50 это гидроксиметилен, С,-С4- алкоксиме(г1) 1-азабицикло[2.2.2]октан или квитилен или С2-С5-алкилиден, обладают двунуклидин. мя центрами асимметрии. В этом случае диастереоизомеры и чистые изомеры можно получить путем реакции оптически чис- 55 того аминоспирта либо с оптически чистой, либо с рацемической кислотой НОСО-Т-Аг; в последнем случае диастереои(д1) 1-азабицикло[3.2.1]октан, получензомеры можно разделить, например, при ный согласно B.Thill et al., J. Org. Chem., Помощи хроматографии. 1968, (33), 12, 4376-80. 21 26617 K (є1) 1-азабицикло[3.2.2]нонан, полученный согласно С. Ruggles et al., J. Am. Chem. Sos., 1988, (110), 17, 5692-8. 5 10 (ж') 1-азабицикло[3.3.1]нонан, полученный согласно S. Miyano et al., J. Chem. Soc, Perkm Trans. 1, 1988, 5, 1057-63. 15 .N (з1) гексагидро-1Н-пирролизин-4, по- 20 л/ченный согласно P. Edwards et al., Tetrahedron Letters, 1984, (25), 9, 939-42. 25 (и') октагидроиндолизин-4, полученный согласно J. Chastanet et al , J. Org. Chem., 1985, (50), 16, 2910-14. 30 N (к1) октагидро-2Н-квинолизин-5, полученный согласно Р. Edwards et a!., Tetrahedron Letters, 1984, (25), 9, 939-42. 35 40 (л1) 1-аэатрицикло[3.3.1.137]декан, или . 1-азаздамантан, полученный согласно Ю. Бубнов и сотр , Ж. Органомет. Хим., 1991, 45 412 (1-2), 1-8. 50 (м')4-фенил-1-азабицикло[2.2.2]октан, или 4-фенил-квинуклидин, полученный согласно Т. Perrine, J. Org. Chem., 1957, 22, 55 1484-1489. 22 Соединение вышеприведенной формулы (I) также включают те, у которых один или более атом водорода или углерода замещены их радиоактивными изотопами, например тритием или углеродом-14. Такие меченые соединения полезны в исследованиях, работах по метаболизму или фармакокинетике, а также в биологических опытах в качестве лигандов рецепторов. С соединениями согласно настоящего изобретения были проведены биологические эксперименты. Соединения (I) проявили антагонистические свойства по отношению к связыванию вещества Р в экспериментах, проведенных на корковых мембранах крысы и на лимфобластных клетках ІМ9 согласно М A. Cascien et al , J. Biol Chem., 1983, 258, 5158-5164 и D D. Paya et al., J. Immunol., 1984, 133, 3260-3265. Из испытанных соединений, (+)-1-[2[3,4-дихлорфенил)-1 -[(3 -изопропоксифенил)ацетил]пиперидин-3-ил]этил]-4-фенил1- азокиабицикло[2.2 2]октанхлорид (соединение 4) проявило себя как сильный антагонист NKI-рецептора вещества Р: оно подавляет связывание веи\еся?° Р "о своим рецептором с константой ингибирования (Ю), равной 10-20 рМ в различных поставленных биологических экспериментах. В частности, соединения настоящего изобретения являются действующими началами фармацевтических составов, чья токсичность не является препятствием для их использования в качестве лекарств. Соединения вышеприведенной формулы (I) можно применять в ежедневных дозах от 0,01 до 100 мг на килограмм веса тела млекопитающего, подлежащего лечению, предпочтительно в ежедневных дозах от 0,1 до 50 мг/кг. У людей эта доза предпочтительно изменяется от 0,5 до 4000 мг в день, в частности от 2,5 до 1000 мг в день, в зависимости от возраста пациента или типа лечения: профилактического или целебного. При использовании в качестве лекарств соединения формулы (І) в общем случае назначаются в единицах дозы. Эти единицы дозы предпочтительно осуществляются в виде фармацевтических составов, в которых действующее начало смешивается с фармацевтическим наполнителем. Таким образом, еще по одному признаку настоящее изобретение относится к фармацевтическим составам, в которых соединение формулы (I) присутствует в качестве действующего начала. В фармацевтических составах настоящего изобретения для орального, подъя 23 26617 зычного, подкожного, внутримышечного, внутривенного, чрескожного, местного или ректального введения действующее начало может вводиться животным и людям в виде единиц введения в смеси с обычными фармацевтическими носителями. Соответствующие единицы введения включают оральные формы, такие как таблетки, желатиновые капсулы, порошки, гранулы и растворы или суспензии, принимаемые орально, подъязычные и щечные формы введения, подкожные, внутримышечные, внутривенные, внутриносовые или внутриглазные формы введения, а также ректальные формы введения. Когда готовится твердый состав в виде таблеток, то главное действующее начало смешивается с фармацевтическим наполнителем, таким как желатин, крахмал, лактоза, стеарат магния, тальк, гуммиарабик и подобные. Эти таблетки могут быть покрыты сахарозой или другим соответствующим веществом, либо могу быть изготовлены в таком виде, чтобы обеспечить продолжительное или отсроченное действие так, чтобы непрерывно выделять определенное количество действующего начала. Приготовление в виде желатиновых капсул осуществляется путем смешивания действующего начала с разбавителем и помещении полученной смеси в мягкие или твердые желатиновые капсулы. Препарат в виде'сиропа или эликсира , может содержать действующее начало вместе с подсластителем, предпочтительно некалорийным, метилпарабеном или пропилпарабеном в качестве антисептиков, вкусовым веществом и соответствующим красителем. Вододиспергируемые гранулы или порошки могут содержать действующее начало в смеси с диспергирующими или смачивающими веществами, либо с суспендирующими веществами, такими как поливинилпирролидон, а также с подсластителями или вкусовыми корректорами. Ректальное введение осуществляется через суппозитории, которые готовятся с использованием связующего, тающего при ректальной температуре, например масла какао или полиэтиленгликолей. Парентеральное, внутриносовое или внутриглазное введение осуществляется с использованием водных суспензий, изотонических соляных растворов или стерильных растворов для инъекций, содержащих фармакологически совместимые диспергирующие и/или смачивающие вещества, например пропиленгликоль или бутиленгликоль. 24 Ингаляторное введение осуществляется при помощи аэрозоля, содержащего например сор б итан три олеат или олеиновую кислоту, а также трихлорфторметан, 5 дихлорфторметан, дихлортетрафторэтан или любой другой биологически совместимый газ-носитель. Действующее начало может также быть приготовлено в виде микрокапсул с од10 ним или более носителей или добавок в соответствующих случаях. В каждой из единиц дозировки действующее начало формулы (I) содержится в количествах, соответствующих предусмот15 ренным ежедневным дозам. В общем случае каждая из единиц дозировки удобным образом выбрана по отношению к дозировке и нужному способу введения, например таблетки, желатиновые капсулы и 20 подобное, саше, ампулы, сиропы и по-добное, а также капли, так, чтобы единица дозировки содержала от 0,5 до 1000 мг действующего начала, предпочтительно от 2,5 до 250 мг, с назначением от 25 одного до четырех раз в день. Согласно другого признака, настоящее изобретение относится к использованию продуктов формулы (I) для приготовления лекарств для лечения физиоло30 гических расстройств, связанных с избытком тахикининов, особенно вещества Р и всех тахикининзависимых патологий дыхательной, желудочно-кишечной, мочевой, иммунной или сердечно-сосудистой сис35 тем, а также центральной нервной системы, боли и мигрени. Примерами, не ограничивающими настоящее изобретение, могут быть: - резкие и хронические боли, вызван40 ные, например, мигренью, болями больного раком и ангиной, хроническими воспалительными процессами, такими как остеоартрит и ревматический артрит; - воспаления, такие как при закупо45 ривающих хронических респираторных заболеваниях, астме, аллергиях, ринит, сверхчувствительность, такая как сверхчувствительность к пыльце или клещам, ревматоидных артритах, остеоартритах, 50 псориазе, язвенных колитах, болезнь Крона, воспалении кишечника (слизистый колит), простатитах, нейрогенных мочевых пузырях, циститах, уретритах, нефритах; - жалобы на иммунную систему, выз55 ванные прекращением или стимуляцией функций иммунных клеток вследствие, например, ревматоидных артритов, псориаза, болезни Крона, диабетов, волчанки; - жалобы на центральную нервную систему, такие как тревога, депрессия, 25 26617 психотические состояния, шизофрения, мания, слабоумие, эпилепсия, болезнь Паркинсона, болезнь Альцгеймера, зависимость от наркотиков, синдром Дауна, хорея Гентингтона, а также нейродегенеративные заболевания; - жалобы на желудочно-кишечную систему, такие как тошнота, слизистый колит, язвы желудка и двенадцатиперстной кишки, понос, повышенная секреция; - жалобы на сердечно-сосудистую систему, такие как сосудистые аспекты мигрени, отеки, тромбозы, ангина и спазмы сосудов. Настоящее изобретение включает метод лечения упомянутых жалоб при помощи вышеуказанных доз. Изобретение будет проиллюстрировано на следующих примерах, его не ограничивающих. Точки плавления продуктов (т.п.) измерялись на нагревательном приборе Коффлера. П О Л У Ч Е Н И Я А. АМИНОСПИРТЫ (VII) и {VII*) ПОЛУЧЕНИЕ 1: Схема 1 - Путь А (а) а-{2-тетрагидропиранилоксиэтил)3,4-дихлорбензолацетонитрил. 16,5 г 80% дисперсии гидрида натрия в масле суспендировалось в 200 мл сухого тетрагидрофурана. Раствор 100 г 3,4дихлорфенилацетонитрила в 500 мл тетрагидрофурана добавлялся по каплям при 20°С в течение 30 минут, а затем реакционная смесь перемешивалась 2 часа при комнатной температуре. Далее, смесь охлаждалась до -20°С, добавлялся раствор 118 г 1-бром-2- тетрагидропиранилокси-этана в 100 мл тетрагидрофурана, смеси позволяли нагреться до комнатной температуры, и через 2 часа, добавлялся раствор 50 г хлорида аммония в 3 литрах воды. Экстракция проводилась при помощи 1,5 литров простого эфира, затем экстракт промывался насыщенным раствором NaCI, .декантировался, высушивался над MgSO4 и концентрировался в вакууме. Остаток хроматографировался на сйликагели с использованием CH2CI2 и затем этилацетата {в объемном соотношении 95/5) в качестве элюэнта. Фракции чистого продукта концентрировались под вакуумом с получением 118 г продукта в виде масла. (б) 2-(2-тетрагидропиранилоксиэтил)3,4-дихлорбензолэтанамин. 118 г нитрила, полученного выше, растворялись в 700 мл абсолютного этанола. Добавлялось 300 мл концентрированного водного аммиака, после чего был добавлен никель Ренея (10% количества 5' 10 15 20 25 30 35 40 45 50 55 26 исходного нитрила) с продувкой азотом. Затем производилось гидрирование в атмосфере водорода при комнатной температуре и обычном давлении, За четыре часа было поглощено 16 литров. Катализатор был отфильтрован на целите, фильтрат концентрировался под вакуумом, и остаток был промыт насыщенным раствором NaCi. После экстракции при помощи простого эфира и сушки над MnS04, было получено 112 г продукта в виде масла. (в) 2-(2-гидроксиэтил)-3,4-дихлорбензолэтанамин. 81 г продукта, полученного выше в этапе (б) растворяется в 38 мл метанола 80 мл насыщенного раствора хлорида водорода в простом эфире затем добавляется, причем температура подцерживается между 20 и 25°С. Смесь перемешивается 30 мин при комнатной температуре и упаривается досуха Остаток растворяется в 250 мл воды, дважды промывается этиловым эфиром, приобретает щелочность при помощи раствора NaOH и экстрагируется при помощи СН2С12. После сушки над MnSO4 экстракт концентрируется досуха, остаток промывается 800 мл изоопропилового эфира, нерастворимый материал отфильтровывается на целите, фильтрат выпаривается в вакууме до приблизительно 300 мл и в него помещаются кристаллы-затравки аминоспирта, и эту смесь перемешивают всю ночь. Кристаллы отфильтровываются и промываются изопропиловым эфиром, а затем n-пентаном с получением 30,2 г ожидаемого продукта. Т. пл. - 90-91°С. (г) 2-{2-гидроксиэтил)-3,4-дихлорбензолэтанамин(+). Раствор 44,7 г продукта, полученного выше согласно этапа (в), в 300 мл метанола добавляется к кипящему раствору 29 г Р{-)-тартаровой кислоты в 800 мл метанола. Смеси позволяют охладиться до комнатной температуры и перемешивают 4 часа. Продукт отфильтровывается и промывается этанолом, а затем эфиром, С получением 34,1 г тартрата. Рекристаллизация из 1,75 л метанола дает 26,6 г тартрата. [a] D « - -4,2° (с = 1, в НаО). Тартрат промывался в 120 мл воды, раствор делали щелочным при помощи раствора NaOH, затем продукт дважды экстрагировался при помощи СН г СІ г , и этот экстракт высушивался над MnSO4 и упаривался досуха. Остаток помещался в 27, 26617 малое количество изопропилового эфира, добавлялся пентан, и смесь фильтровалась, в результате чего было получено 15,4 г продукта. Т. пл. = 79-80°С. [ a ] D " = +9,4° (с = 1, в СН3ОН) (д) Ы-метил-2-(2-гидроксиэтил)-3,4дихлорбензолэтанамин-(+)- гидрохлорид. (д1) Этил-М-[4-(2-гидроксиэтил)-2-(3,4дихлорбензил)бутил]карбамат. 15 г продукта, полученного согласно вышеприведенного этапа (г), растворялись в 200 мл СН2С!г Добавлялось 9,9 мл триэтиламина. Смесь охлаждали до 0°С и при этой температуре добавляли по каплям раствор 6,3 мл этилхлороформата в 30 мл СН2С(г. Через 15 минут смесь промывали водой, затем разбавленным раствором НС1 и далее насыщенным водным раствором NaHCO3. После сушки над MgSO4 ее упаривали досуха, в результате чего было получено 20 г продукта в виде масла. (д2) Восстановление этоксикарбонильной группы до метильной группы. Раствор 20 г продукта, полученного согласно вышеприведенному этапу (г), в 150 мл безводного THF добавляли к 5,1 г суспензии литииалюминиигидрида в 60 мл безводного THF. Смесь нагревалась в колбе с обратным холодильником в течение 1 часа. Ее гидролизировали при помощи 20 мл воды, неорганический материал был отфильтрован, а фильтрат был упарен досуха. Полученное масло растворяли в 100 мл ацетона. Насыщенный раствор хлорида водорода в эфире добавлялся пока рН не стало равным 1, после чего до появления помутнения добавлялся эфир. Смесь перемешивалась 1 час, и кристаллы были отфильтрованы и промыты небольшим количеством ацетона, а затем эфиром, в результате чего получено 11 г N-метил2-(2-гидроксиэтил)-3,4-дихлорбензолэтанамингидрохлорида. Т. пл. = 129°С. [a] D 2 S = +8,4° (с = 1, в СН3ОН). (е) Ы-метил-2-{2-гидроксиэтил)-3,4дихлорбензолэтанамин(-) гидрохлорид. (-)-энантиомер, получен по вышеприведенной методике с исходной !_(+)-тартаровой кислотой. Т. пл. = 129°С. [a] D 2 0 = -8,4° (с = 1, в СН3ОН). ПОЛУЧЕНИЕ II: Схема I - Путь В, m = 1 (а) 3,4-дихлор-а-{2-тетрагидропиранилоксиэтил)бензолацетонитрил. 20 г 55-60%-дисперсии гидрида натрия в масле суспендировалось в 200 мл сухого тетрагидрофурана. Раствор 85 г 3,4- дихлорфенилацетонитрила в 500 мл тетрагидрофурана добавлялся по каплям при 20°С в течение 30 минут, и затем 5 10 15 20 25 30 35 40 45 50 55 28 реакционная смесь перемешивалась 2 часа при комнатной температуре. Смесь была охлаждена до -20°С, был добавлен раствор 98 г 2- бромэтокситетрагидропирана в 100 мл тетрагидрофурана, смеси позволили нагреться самой до комнатной температуры и, через 2 часа был добавлен раствор 50 г хлорида аммония в 3 литрах воды Экстракция осуществлялась при помощи 1,5 л этилов эфира, и экстракт был промыт насыщенным раствором хлорида натрия, декантирован, высушен над MgSO4 и упарен под вакуумом. Остаток хроматографировался на силикагели, в качестве элюента исгользовался дихлорметан. Фракции чистого продукта упаривались под вакуумом, в результате чего получено 83,6 г продукта в виде масла. (б) Этил-р-тетрагидропиранилоксиэтил^~циано-р-(3,4- дихлорфенил)пропионат. 21 г нитрила, полученного согласно вышеприведенного этапа (а), растворяли в 100 мл тетрагидрофурана, затем при комнатной температуре по каплям добавлялся раствор 0,067 моль диизопропиламида лития, далее реакционная смесь при комнатной температуре перемешивалась в течение одного часа. Затем было добавлено 12 г этил б ром ацетата, и смесь нагревали при 50°С два часа. Затем смесь охладили, вылили в насыщенный раствор хлорида аммония и далее была произведена экстракция при помощи этилового эфира, экстракт был промыт водой и эфирная фаза отделена путем декантации, высушена над Na2SO4 и упарена под вакуумом. Остаток очищался при помощи хроматографии на силикагеле с использованием дихлорметана/эти л ацетата {100/1 по объему) в качестве элюента. Выпаривание чистых фракций дало в результате 13 г ожидаемого соединения. (в) 4-
ДивитисяДодаткова інформація
Автори англійськоюGillol Patrick, Pruetto Vincenzo
Автори російськоюГьель Патрик, Пруетто Винченцо
МПК / Мітки
МПК: A61K 31/4375, A61P 25/06, C07D 453/00, A61P 9/00, C07D 471/04, C07D 487/04, A61P 29/00, A61P 11/00, A61P 25/04, A61P 43/00, A61K 31/396, A61K 31/435, A61K 31/55, C07D 471/08, A61P 1/00, A61K 31/407, A61K 31/397, A61K 31/40, C07D 487/08, A61K 31/439, A61P 37/08, A61K 31/395, A61P 37/00, C07D 455/00, A61P 25/00
Мітки: аміди, основні, фармацевтична, системі, патологій, композиція, четвертинні, одержання, тахікініну, спосіб, лікування, містить, призначені, відносяться
Код посилання
<a href="https://ua.patents.su/30-26617-chetvertinni-osnovni-amidi-priznacheni-dlya-likuvannya-patologijj-shho-vidnosyatsya-do-sistemi-takhikininu-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya-shho-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Четвертинні основні аміди, призначені для лікування патологій, що відносяться до системи тахікініну, спосіб їх одержання та фармацевтична композиція, що їх містить</a>
Попередній патент: Спосіб виробництва засівних дріжджів
Наступний патент: Дозатор рідини
Випадковий патент: Спосіб контактного стикового зварювання оплавленням