Похідні ізоксазоліну як антидепресанти
Номер патенту: 77405
Опубліковано: 15.12.2006
Автори: Альказар-Вака Мануель Хесус, Стеклер Томас Хорст Вольфганг, Пастор-Фернандес Хоакін, Сід-Нанес Хосе Маріа, Ленглоіс Ксав'є Жан Мішель, Хейлен Годлів Ірма Крістін Маріа, Бейкер Маргарета Хенріка Маріа, Мегенс Антоніус Адріанус Хендрікус Петрус, Фернандес-Гедеа Франциско Хав'єр, Андрес-Жиль Хосе Ігнасіо
Формула / Реферат
1. Сполука загальної формули (І)
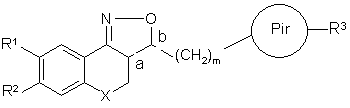 , (I)
, (I)
її фармацевтично прийнятні солі приєднання кислоти чи основи, її стереохімічно ізомерні форми та її N-оксидна форма, де:
Х означає СН2, N-R7, S чи О,
R7 вибирають з групи, що складається з гідрогену, алкілу, фенілу, фенілалкілу, алкілкарбонілу, алкілоксикарбонілу і моно- та діалкіламінокарбонілу, причому фенільна та алкільна групи є необов'язково заміщеними одним чи кількома атомами галоїду,
кожен з R1 та R2, незалежно один від одного, вибирають з групи, що складається з гідрогену, гідрокси, ціано, галоїду, OSO2H, ОSО2СН3, фенілу, фенілалкілу, алкілокси, алкілоксіалкілокси, алкілоксіалкілоксіалкілокси, тетрагідрофуранілокси, алкілкарбонілокси, алкілтіо, алкілоксіалкілкарбонілокси, піридинілкарбонілокси, алкілкарбонілоксіалкілокси, алкілоксикарбонілокси, алкенілокси, алкенілкарбонілокси і моно- та діалкіламіноалкілокси, причому алкільний та арильний радикали є необов'язково заміщеними одним чи кількома гідроксилами чи атомами галоїдів чи аміногрупами, або
R1 та R2 можуть разом утворювати бівалентний радикал -R1-R2-, який вибирають з групи, що складається з -СН2-СН2-О-, -O-CH2-CH2-, -O-CH2-O-, -CH2-O-CH2- та -O-СН2-СН2-О-,
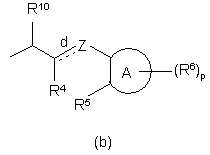
а та b є центрами асиметрії,
(СH2)m означає лінійний вуглеводневий ланцюг з m атомів карбону, де m є цілим числом в діапазоні від 1 до 4,
Ріr означає необов'язково заміщений радикал будь-якої з формул (IIа), (ІІb) чи (IIc)
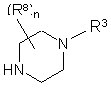 (a),
(a), 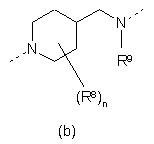 ,
, 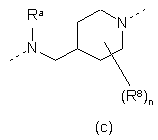 , (II)
, (II)
де:
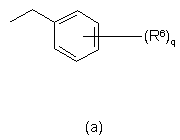
кожен з R8, незалежно один від одного, вибирають з групи, що складається з гідрогену, гідрокси, аміно, нітро, ціано, галоїду та алкілу, n означає ціле число від 1 до 5,
R9 вибирають з групи, що складається з гідрогену, алкілу та формілу, і
R3 означає радикал за будь-якою з формул (III)
 ,
,  ,
, , (ІІІ)
, (ІІІ)
де:
d означає простий зв'язок, a Z означає бівалентний радикал, вибраний з групи, що складається з -СН2-, -С(=О)-, -СН(ОН)-, -C(=N-OH)-, -СН(алкіл)-, -O-, -S-, -S(=O)-, -NH-, або d означає подвійний зв'язок, а Z означає тривалентний радикал формули =СН- чи =С(алкіл)-,
А означає 5- чи 6-членне ароматичне гомоциклічне чи гетероциклічне кільце, вибране з групи, що складається з фенілу, піранілу, піридинілу, піразинілу, піримідинілу, піридазинілу, тієнілу, ізотіазолілу, піролілу, імідазолілу, піразолілу, фуранілу, оксадіазолілу та ізоксазолілу,
р означає ціле число від 0 до 4,
q означає ціле число від 0 до 7,
R4 вибирають з групи, що складається з гідрогену, алкілу, фенілу, біфенілу, нафтилу, галоїду та ціано, причому алкільний та арильний радикали є необов'язково заміщеними одним чи кількома гідроксилами чи атомами галоїдів чи аміногрупами,
R5 дорівнює R4, або
R4 та R5 можуть разом утворювати бівалентний радикал –R-R5-, який вибирають з групи, що складається з -СН2-, -СН-, -СН2-СН2-, -СН-СН-, -O-, -NH-, -N-, -S-, -CH2N(-алкіл)-, -CH=N-, -СН2O- та -ОСН2-,
кожен з R6, незалежно один від одного, вибирають з групи, що складається з гідрогену, гідроксилу, аміно, нітро, ціано, галоїду, карбоксилу, алкілу, фенілу, алкілокси, фенілокси, алкілкарбонілокси, алкілоксикарбонілу, алкілтіо, моно- та діалкіламіно, алкілкарбоніламіно, моно- та діалкіламінокарбонілу, моно- та діалкіламінокарбонілокси, моно- та діалкіламіноалкілокси, причому алкільний та арильний радикали є необов'язково заміщеними одним чи кількома гідроксилами чи атомами галоїдів чи аміногрупами, або
два віцинальні радикали R6 можуть разом утворювати бівалентний радикал –R6-R6-, який вибирають з групи, що складається з –CH2-CH2-O-, -O-CH2-CH2-, -О-СН2-С(=O)-, -О-СН2-О-, -CH2-O-CH2, -O-CH2-CH2-O-, -СН=СН-СН=СН-, -СН=СН-CH=N-, -CH=CH-N=CH-, -CH=N-CH=CH-, -N=CH-CH=CH-, -CH2-CH2-CH2-, -CH2-CH2-C(O)- та -CH2-CH2-CH2-CH2-, і
R10 вибирають з групи, що складається з гідрогену, алкілу, фенілалкілу та фенілу.
2. Сполука за п.1, яка відрізняється тим, що Х = О чи NH, R1 та R2 обидва означають алкілокси, m = 1, Ріr означає радикал формули (ІІа), у якому R8 означає гідроген і n = 4, R3 означає радикал формули (ІІІb), у якому Z означає =CH-, d означає подвійний зв'язок, А означає фенільне кільце, R4 означає алкіл і R10 є гідрогеном.
3. Сполука за будь-яким з пп.1-2, призначена для застосування як лікарський засіб.
4. Фармацевтична композиція, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп.1-2.
5. Спосіб одержання фармацевтичної композиції за п. 4, який відрізняється тим, що змішують сполуку за будь-яким з пп.1-2 та фармацевтично прийнятний носій.
6. Застосування сполуки за будь-яким з пп.1-2 для виробництва лікарського засобу для лікування депресії, тривоги та розладів ваги тіла.
7. Фармацевтична композиція, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп.1-2 та одну чи кілька інших сполук, вибраних з групи, що складається з антидепресантів, анксіолітичних та антипсихотичних засобів.
8. Застосування фармацевтичної композиції за п.7 для виробництва лікарського засобу, призначеного для поліпшення ефективності та/або початку дії при лікуванні депресії, тривоги та розладів ваги тіла.
9. Спосіб лікування депресії, тривоги та розладів ваги тіла, при якому вводять терапевтично ефективну кількість сполуки за будь-яким з пп.1-2 та однієї чи кількох інших сполук, вибраних з групи, що складається з антидепресантів, анксіолітичних та антипсихотичних засобів разом чи послідовно та у будь-якому порядку.
10. Застосування фармацевтичної композиції за п. 7 при лікуванні депресії, тривоги та розладів ваги тіла.
11. Спосіб одержання фармацевтичної композиції за п. 7, який відрізняється тим, що змішують сполуку за будь-яким з пп.1-2 та сполуку, вибрану з групи, що складається з антидепресантів, анксіолітичних та антипсихотичних засобів, і фармацевтично прийнятний носій.
12. Спосіб одержання сполуки за будь-яким з пп.1-2, який відрізняється тим, що проводять реакцію сполуки формули (IV)
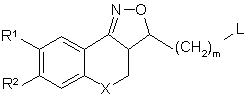 (IV)
(IV)
зі сполукою формули (V)
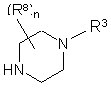 (V)
(V)
чи формули (VII)
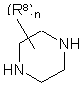 , (VII)
, (VII)
де R1, R2, R3, R8, Х, m та n мають значення, визначені у пункті 1, а L означає відхідну групу.
13. Сполука загальної формули (IV)
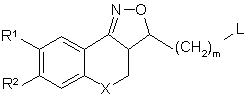 , (IV)
, (IV)
де R1, R2, X та m мають значення, вказані у пункті 1, і L вибирають з групи, що складається з OSO2С6Н4(СН3), ОSO2СН3, Сl, Вr та І,
за винятком 3,3а,4,5-тетрагідронафто[1,2-с]ізоксазол-3-оцтової кислоти.
14. Сполука загальної формули (VIII)
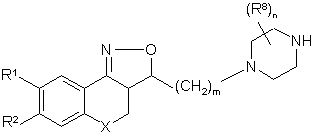 , (VIII)
, (VIII)
де R1, R2, X, m, R8 та n мають значення, вказані у пункті 1.
Текст
1. Сполука загальної формули (І) C2 2 (19) 1 3 77405 4 Ріr означає необов'язково заміщений радикал CH2-, -О-СН2-С(=O)-, -О-СН2-О-, -CH2-O-CH2, -Oбудь-якої з формул (IIа), (ІІb) чи (IIc) CH2-CH2-O-, -СН=СН-СН=СН-, -СН=СН-CH=N-, (R8)n Ra CH=CH-N=CH-, -CH=N-CH=CH-, -N=CH-CH=CH-, N 3 R N CH2-CH2-CH2-, -CH2-CH2-C(O)- та -CH2-CH2-CH2N N N R9 CH2-, і HN (II) 10 R вибирають з групи, що складається з гідрогену, (R8)n (R8)n алкілу, фенілалкілу та фенілу. (a), (c) (b) 2. Сполука за п.1, яка відрізняється тим, що Х = О де: чи NH, R1 та R2 обидва означають алкілокси, m = кожен з R8, незалежно один від одного, вибирають 1, Ріr означає радикал формули (ІІа), у якому R8 з групи, що складається з гідрогену, гідрокси, аміозначає гідроген і n = 4, R3 означає радикал форно, нітро, ціано, галоїду та алкілу, n означає ціле мули (ІІІb), у якому Z означає =CH-, d означає почисло від 1 до 5, 9 двійний зв'язок, А означає фенільне кільце, R4 R вибирають з групи, що складається з гідрогену, означає алкіл і R10 є гідрогеном. алкілу та формілу, і 3. Сполука за будь-яким з пп.1-2, призначена для R3 означає радикал за будь-якою з формул (III) застосування як лікарський засіб. R10 4. Фармацевтична композиція, що містить фармаd Z (R6)q цевтично прийнятний носій та, як активний інгреді(R6)p A єнт, терапевтично ефективну кількість сполуки за R4 R5 будь-яким з пп.1-2. 5. Спосіб одержання фармацевтичної композиції (b) (ІІІ) (a) за п. 4, який відрізняється тим, що змішують сполуку за будь-яким з пп.1-2 та фармацевтично при(R6)q йнятний носій. 6. Застосування сполуки за будь-яким з пп.1-2 для виробництва лікарського засобу для лікування (c) депресії, тривоги та розладів ваги тіла. де: 7. Фармацевтична композиція, що містить фармаd означає простий зв'язок, a Z означає бівалентцевтично прийнятний носій та, як активний інгредіний радикал, вибраний з групи, що складається з єнт, терапевтично ефективну кількість сполуки за СН2-, -С(=О)-, -СН(ОН)-, -C(=N-OH)-, -СН(алкіл)-, будь-яким з пп.1-2 та одну чи кілька інших сполук, O-, -S-, -S(=O)-, -NH-, або d означає подвійний вибраних з групи, що складається з антидепресанзв'язок, а Z означає тривалентний радикал фортів, анксіолітичних та антипсихотичних засобів. мули =СН- чи =С(алкіл)-, 8. Застосування фармацевтичної композиції за п.7 А означає 5- чи 6-членне ароматичне гомоциклічдля виробництва лікарського засобу, призначеного не чи гетероциклічне кільце, вибране з групи, що для поліпшення ефективності та/або початку дії складається з фенілу, піранілу, піридинілу, піразипри лікуванні депресії, тривоги та розладів ваги нілу, піримідинілу, піридазинілу, тієнілу, ізотіазолітіла. лу, піролілу, імідазолілу, піразолілу, фуранілу, ок9. Спосіб лікування депресії, тривоги та розладів садіазолілу та ізоксазолілу, ваги тіла, при якому вводять терапевтично ефекр означає ціле число від 0 до 4, тивну кількість сполуки за будь-яким з пп.1-2 та q означає ціле число від 0 до 7, однієї чи кількох інших сполук, вибраних з групи, R4 вибирають з групи, що складається з гідрогену, що складається з антидепресантів, анксіолітичних алкілу, фенілу, біфенілу, нафтилу, галоїду та ціата антипсихотичних засобів разом чи послідовно но, причому алкільний та арильний радикали є та у будь-якому порядку. необов'язково заміщеними одним чи кількома гід10. Застосування фармацевтичної композиції за п. роксилами чи атомами галоїдів чи аміногрупами, 7 при лікуванні депресії, тривоги та розладів ваги R5 дорівнює R4, або 4 5 тіла. R та R можуть разом утворювати бівалентний 11. Спосіб одержання фармацевтичної композиції радикал –R-R5-, який вибирають з групи, що склаза п. 7, який відрізняється тим, що змішують сподається з -СН2-, -СН-, -СН2-СН2-, -СН-СН-, -O-, луку за будь-яким з пп.1-2 та сполуку, вибрану з NH-, -N-, -S-, -CH2N(-алкіл)-, -CH=N-, -СН2O- та групи, що складається з антидепресантів, анксіоліОСН2-, 6 тичних та антипсихотичних засобів, і фармацевтикожен з R , незалежно один від одного, вибирають чно прийнятний носій. з групи, що складається з гідрогену, гідроксилу, 12. Спосіб одержання сполуки за будь-яким з пп.1аміно, нітро, ціано, галоїду, карбоксилу, алкілу, 2, який відрізняється тим, що проводять реакцію фенілу, алкілокси, фенілокси, алкілкарбонілокси, сполуки формули (IV) алкілоксикарбонілу, алкілтіо, моно- та діалкіламіN O но, алкілкарбоніламіно, моно- та діалкіламінокарL R1 (CH2)m бонілу, моно- та діалкіламінокарбонілокси, моно(IV) та діалкіламіноалкілокси, причому алкільний та R2 X арильний радикали є необов'язково заміщеними зі сполукою формули (V) одним чи кількома гідроксилами чи атомами галої(R8)n R3 дів чи аміногрупами, або N (V) два віцинальні радикали R6 можуть разом утворюHN вати бівалентний радикал –R6-R6-, який вибирають з групи, що складається з –CH2-CH2-O-, -O-CH2 5 77405 6 де R1, R2, X та m мають значення, вказані упункті (R8)n 1, і L вибирають з групи, що складається з OSO2С6Н4(СН3), ОSO2СН3, Сl, Вr та І, NH (VII) за винятком 3,3а,4,5-тетрагідронафто[1,2HN , с]ізоксазол-3-оцтової кислоти. 1 2 3 8 де R , R , R , R , Х, m та n мають значення, визна14. Сполука загальної формули (VIII) (R ) чені у пункті 1, а L означає відхідну групу. NH 13. Сполука загальної формули (IV) N O N O N R (VIII) L (CH ) R1 (CH2)m (IV) R X , R2 X 1 2 , де R , R , X, m, R8 та n мають значення, вказані у пункті 1. чи формули (VII) 8 n 1 2 m 2 Даний винахід стосується заміщених ізоксазолінових похідних, що мають антидепресивну активність та/або анксіолітичну активність та/або активність з контролю ваги тіла, способів їхнього одержання, фармацевтичних композицій, що їх містять, та їхнього використання як лікарських засобів, зокрема, для лікування депресії, тривоги, стрес-споріднених розладів, асоційованих з депресією та/або тривогою і розладів ваги тіла, включаючи нервово-психічну анорексію та булімію. Винахід також стосується нових комбінацій заміщених ізоксазолінових похідних, що мають антидепресивну активність та/або анксіолітичну активність та/або активність з контролю ваги тіла, з антидепресантами, анксіолітичними та/або антипсихотичними засобами. Тетрагідронафталінові та інданові похідні, що виявляють антидепресивну активність, відомі [з ЕР-361577 В1]. Ці сполуки є типовими блокаторами повторного поглинання моноаміну з додатковою активністю антагоністів 2-адренорецепторів і виявляють антидепресивну активність без седативного ефекту. Проблеми, асоційовані з цими сполуками у відомому рівні техніки, полягають в тому, що ці сполуки викликають значні побічні ефекти, такі як нудота, збудження, підвищена частота серцевих скорочень та зниження сексуальної функції. Крім того, потрібний тривалий час, зокрема, 3-4 тижні, до початку відповідної реакції. Метою даного винаходу є створення нових похідних сполук, що виявляють антидепресивну та/або анксіолітичну активність та/або активність з контролю ваги тіла, зокрема, сполук, які не мають вищезгаданих недоліків. Даний винахід стосується нових ізоксазолінових похідних загальної формули (І) (I) їхніх фармацевтично прийнятних солей приєднання кислоти чи основи, їхніх стереохімічно ізомерних форм та їхньої N-оксидної форми, де: 7 X позначає СН2, N-R , S чи О; 7 R вибирають з групи, що складається з гідрогену, алкілу, фенілу, фенілалкілу, алкілкарбонілу, алкілоксикарбонілу та моно- і діалкіламінокарбонілу, причому фенільні та алкільні групи є необов'язково заміщеними одним чи кількома атомами галогену; кожен з R1 та R2, незалежно один від одного, вибирають з групи, що складається з гідрогену, гідроксилу, ціано, галоїду, OSO2H, OSO2CH3, фенілу, фенілалкілу, алкілокси, алкілоксіалкілокси, алкілоксіалкілоксіалкілокси, тетрагідрофуранілокси, алкілкарбонілокси, алкілтіо, алкілоксіалкілкарбонілокси, піридинілкарбонілокси, алкілкарбонілоксіалкілокси, алкілоксикарбонілокси, алкенілокси, алкенілкарбонілокси та моно- і діалкіламіноалкілокси, причому алкільні та арильні радикали є необов'язково заміщеними одним чи кількома гідроксилами чи атомами галоїдів чи аміногрупами; або R1 та R2 можуть разом утворювати бівалентний радикал –R1-R2-, який вибирають з групи, що складається з –СН2-СН2-О-, -О-СН2-СН2-, -О-СН2О-, -СН3-О-СН2 та -О-СН2-СН2-О-; а та b є центрами асиметрії; (СН2)m позначає лінійний вуглеводневий ланцюг, що складається з m атомів карбону, де m є цілим числом від 1 до 4; Ріr позначає необов'язково заміщений радикал, що відповідає будь-якій з формул (llа), (llb) чи (llc) (II) де: кожен з R8, незалежно один від одного, вибирають з групи, що складається з гідрогену, гідроксилу, аміно, нітро, ціано, галоїду та алкілу; η позначає ціле число в інтервалі від 1 до 5; R9 вибирають з групи, що складається з гідрогену, алкілу та формілу; і R3 позначає необов'язково заміщену ароматичну гомоциклічну чи гетероциклічну кільцеву систему разом з необов'язково заміщеним та частково чи повністю гідрогенованим вуглеводневим ланцюгом довжиною від 1 до 6 атомів, за допомогою якого вказана кільцева система приєднується до радикала Ріr, причому один чи кілька з цих атомів можуть бути гетероатомами, вибраними з О, N та S. Конкретніше, винахід стосується сполук формули (І), у якій R позначає радикал, що відповідає будь-якій з формул (lllа), (lllb) та (lllс) 7 77405 (III) де: d позначає простий зв'язок, якщо Ζ позначає бівалентний радикал, вибраний з групи, що складається з -СН2-, -С(=О)-, -СН(ОН)-, -C(=N-OH)-, СН(алкіл)-, -О-, -S-, -S(=O), -NH- ; або d позначає подвійний зв'язок, якщо Ζ позначає тривалентний радикал формули =СН- чи =С(алкіл)-; А позначає 5- чи 6-членне ароматичне гомоциклічне чи гетероциклічне кільце, вибране з групи, що складається з фенілу, піранілу, піридиніл, піразинілу, піримідинілу, піридазинілу, тієнілу, ізотіазолілу, піролілу, імідазолілу, піразолілу, фуранілу, оксадіазолілу та ізоксазалілу; p позначає ціле число в інтервале від 0 до 4; q позначає ціле число від 0 до 7; R4 вибирають з групи, що складається з гідрогену, алкілу, фенілу, біфенілу, нафтилу, галоїду та ціано, причому алкільний та арильний радикали є необов'язково заміщеними одним чи кількома гідроксилами чи атомами галоїдів чи аміногрупами; R5 дорівнює R4; або R4 та R5 можуть разом утворювати бівалентний радикал -R4-R5-, вибраний з групи, що складається з -СН2-, =СН-, -СН2-СН2-, -СН=СН-, -О-, -NH-, =N-, -S-, -СН2N(алкіл)-, -CH=N-, -CH2O- та –ОСН2-; кожен з R6, незалежно один від одного, вибирають з групи, що складається з гідрогену, гідроксилу, аміно, нітро, ціано, галоїду, карбоксилу, алкілу, фенілу, алкілокси, фенілокси, алкілкарбонілокси, алкілоксикарбонілу, алкілтіо, моно- та діалкіламіно, алкілкарбоніламіно, монота діалкіламінокарбонілу, моно- та діалкіламінокарбонілокси, моно- та діалкіламіноалкілокси, причому алкільний та арильний радикали є необов'язково заміщеними одним чи кількома гідроксилами чи атомами галоїдів чи аміногрупами; або два віцинальні радикали R6 можуть разом утворювати бівалентний радикал -R6-R6-, вибраний з групи, що складається з -СН2-СН2-О-, -ОСН2-СН2, -О-СН2-С(=О)-, -О-СН2-О-, -СН2-О-СН2-, О-СН2-СН2-О-, -СН=СН-СН=СН-, -CH=CH-CH=N-, CH=CH-N=CH-, -CH=N-CH=CH-, -N=CH-CH=CH-, СН2-СН2-СН2-, -CH2-CH2-С(=О)- та –СН2-СН2-СН2СН2-; і R10 вибирають з групи, що складається з гідрогену, алкілу, фенілалкілу та фенілу. Краще, винахід стосується тих сполук, у яких X=О чи NH; R1 та R2 обидва позначають алкілокси; m=1; Ріr позначає радикал формули (llа), де R8 є гідрогеном і n=4; R3 позначає радикал формули (lllb), де Ζ позначає =СН-, d є подвійним зв'язком, А позначає фенілльне кільце, R4 позначає алкіл і R10 є гідрогеном. Ще краще, винахід стосується сполук, у яких X=О, R1 та R2 обидва позначають метокси; m=1; Ріr позначає радикал формули (llа), у якому R8 є гідрогеном і n=4; R3 позначає радикал формули (lllb), у якому Ζ позначає =СН-, d позначає подвійний зв'язок, А позначає фенільне кільце, R4 є метилом і R10 є гідрогеном. 8 В рамках даної заявки, алкіл позначає лінійні чи розгалужені насичені вуглеводневі радикали, що мають від 1 до 6 атомів карбону, наприклад, метил, етил, пропіл, бутил, 1-метилпропіл, 1,1диметилетил, пентил, гексил; або алкіл позначає циклічні насичені вуглеводневі радикали, що мають від 3 до 6 атомів карбону, наприклад, циклопропіл, метилциклопропіл, циклобутил, циклопентил та циклогексил. Галоїд (галоген) є родовою назвою флуору, хлору, брому та йоду. Алкілльні радикали, необов'язково заміщені одним чи кількома атомами галоїдів, є наприклад, полігалоїдалкільними радикали, наприклад, дифлуорметилом та трифлуорметилом. Вважається, що фармацевтично прийнятні солі включають терапевтично активні нетоксичні форми кислотно-адитивних солей, які сполуки формули (І) є здатними утворювати. Такі солі можуть бути одержані шляхом обробки основної форми сполук формули (І) відповідними кислотами, наприклад, неорганічними кислотами, наприклад, галоїдводневою кислотою, зокрема, хлористоводневою кислотою, бромистоводневою кислотою, сірчаною кислотою, азотною кислотою та фосфорною кислотою; органічними кислотами, наприклад, оцтовою кислотою, гліколевою кислотою, пропіоновою кислотою, молочною кислотою, піровиноградною кислотою, щавлевою кислотою, малоновою кислотою, бурштиновою кислотою, малеїновою кислотою, фумаровою кислотою, яблучною кислотою, винною кислотою, лимонною кислотою, метансульфоновою кислотою, етансульфоновою кислотою, бензолсульфоновою кислотою, птолуолсульфоновою кислотою, цикламовою кислотою, саліциловою кислотою, раміносаліциловою кислотою та памоєвою кислотою. Сполуки формули (І), що містять кислотні протони, також можуть бути перетворені на їхні терапевтично активні нетоксичні форми солей приєднання металів чи амінів шляхом обробки відповідними органічними та неорганічними основами. Відповідні форми солей основ включають, наприклад, солі амонію, солі лужних та лужноземельних металів, зокрема, солі літію, натрію, калію, магнію та кальцію, солі з органічними основами, наприклад, бензатином, N-метил-Оглюкаміном, солі гібраміну та солі з амінокислотами, наприклад, аргініном та лізином. Навпаки, вказані сольові форми можуть бути перетворені на вільні форми шляхом обробки відповідною основою чи кислотою. Термін "адитивна сіль" ("сіль приєднання") у тому значенні, що використовується в рамках даної заявки, включає також сольвати, які можуть утворювати сполуки формули (І), а також їхні солі. Такими сольватами є, наприклад, гідрати та алкоголяти. Вважається, що N-оксидні форми сполук формули (І) включають такі сполуки формули (І), у яких один чи кілька атомів нітрогену є окисненими до так званого N-оксиду, зокрема, такі N-оксиди, у яких N-окисненими є один чи кілька нітрогенів піперазинільного радикала. Термін "стереохімічно ізомерні форми" у тому значенні, що використовується тут, визначає усі 9 77405 10 можливі ізомерні форми, які можуть мати сполуки Stella, V.J. et al., "Prodrags", Drug Delivery Systems, формули (І). Якщо не буде вказано чи визначено 1985, pp.112-176, та Drugs, 1985, 29, pp.455-473]. інше, хімічні назви сполук позначають суміш усіх Фармакологічно активні сполуки за винаходом можливих стереохімічно ізомерних форм, причому у формі проліків загалом будуть сполуками форвказані суміші містять усі діастереомери та енантімули (І), їхніми фармацевтично прийнятними соомери основної молекулярної структури. Конкретлями приєднання кислоти чи основи, їхніми стереніше, стереогенні центри можуть мати R- чи Sохімічно ізомерними формами та їхніми Nконфігурацію; замісники на бівалентних циклічних оксидними формами, які мають етерифіковану чи (частково) насичених радикалах можуть мати цисамідовану кислотну групу. Такі етерифіковані кисабо транс-конфігурацію. Сполуки, що мають полотні групи є групами формули –COORx, де Rx двійні зв'язки, можуть мати Ε чи Z-стереохімічні позначає С1-6-алкіл, феніл, бензил чи одну з таких форми стосовно вказаного подвійного зв'язку. груп: Стереохімічно ізомерні форми сполук формули (І), безсумнівно, вважаються такими, що входять до обсягу даного винаходу. Згідно з номенклатурними правилами CAS, Амідовані групи включають групи формули якщо у молекулі присутні два стереогенні центри з CONRyRz, де Ry позначає Н, С1-6-алкіл, феніл чи відомою абсолютною конфігурацією, то дескрипбензил і Rz позначає -ОН, Н, С1-6-алкіл, феніл чи тор R чи S присвоюється (на основі правила посбензил. лідовності Кана-Інголда-Прелога (Cahn-IngoldСполуки за винаходом, що мають аміногрупу, Prelog)) хіральному центру з меншим номером можуть бути дериватизовані кетоном чи альдегіопорному центру. Конфігупація другого стереогендом, таким як формальдегід, з утворенням основи ного центра вказується за допомогою відносних Манніха. Ця основа буде гідролізуватися у воднодескрипторів [R*,R*] чи [R*,S*], де R* завжди виму розчині з кінетикою першого порядку. значається як опорний центр і [R*,R*] позначає Сполуки формули (І), одержувані способами, центри з однаковою хіральністю, a [R*,S*] познаописаними нижче, можуть бути синтезовані у фочає центри з різною хіральністю. Наприклад, якщо рмі рацемічних сумішей енантіомерів, які можуть хіральний центр з меншим номером у молекулі бути відокремлені один від одного за допомогою має S-конфігурацію, а другий центр - R, то стереовідомих фахівцям процедур розділення. Рацемічні дескриптор буде визначений як S-[R*,S*]. Якщо сполуки формули (І) можуть бути перетворені на використовуються позначки " " та "β": положення відповідні діастереомерні сольові форм шляхом старшого замісника на асиметричному атомі карпроведення реакції з придатною хіральною кислобону у кільцевій системі, який має менший номер у тою. Вказані діастереомерні сольові форми згодом кільці, завжди позначається як " "-положення серозділяють, наприклад, шляхом селективної чи редньої площини, що визначається кільцевою сисфракційної кристалізації, і енатіомери вивільняють темою. Положення старшого замісника на другому з них за допомогою лугів. Альтернативний спосіб асиметричному атомі карбону у кільцевій системі розділення енантіомерних форм сполук формули (атома гідрогену у сполуках формули(І)) стосовно (І) включає рідинну хроматографію з використанположення старшого замісника на опорному атомі ням хіральної нерухомої фази. Вказані чисті степозначається як " ", якщо він знаходиться з того ж реохімічно ізомерні форми можуть бути також боку середньої площини, визначеної кільцевою одержані з відповідних чистих стереохімічно ізосистемою, або "β", якщо він знаходиться з другого мерних форм відповідних вихідних матеріалів, за боку середньої площини, визначеної кільцевою умови, що реакція відбувається стереоспецифічсистемою. но. Якщо потрібний конкретний стереоізомер, то Сполуки формули (І) та деякі з проміжних сповказана сполука краще буде синтезована стереослук мають у своїй структурі щонайменше два степецифічними методами синтезу. У цих методах реогенні центри, які відповідно позначаються а та краще, використовуються енантіомерно чисті вихіb у формулі (І). Завдяки шляху синтезу, за яким дні матеріали. проводять синтез трициклічної системи, конфігуБуло несподівано показано, що сполуки за вирація цих двох асиметричних центрів а та b є понаходом мають активність селективного інгібітора передньо визначеною таким чином, що відносною повторного поглинання серотоніну (5-НТ) у комбіконфігурацією центра а є S*, а центра b-R*. нації з додатковою активністю антагоніста 2Винахід також включає похідні сполуки (які адренорецепторів та виявляють сильну антидепзвичайно називають "проліками") фармакологічноресивну та/або анксіолітичну активність та/або активних сполук за винаходом, які деградують in активність щодо контролю ваги тіла без седативvivo з утворенням сполук за винаходом. Проліки ного ефекту. Крім того, з урахуванням своєї активзвичайно (але не завжди) мають нижчу активність ності селективного інгібітора повторного поглищодо цільового рецептора, ніж сполуки, до яких нання серотоніну (5-НТ), а також антагоніста а2вони деградують. Проліки є особливо корисними, адренорецепторів, сполуки за винаходом є також коли бажана сполука має хімічні чи фізичні власпридатними для лікування та/або профілактики тивості, які роблять її введення складним чи неехвороб, при яких будь-яка одна з активностей чи фективним. Наприклад, бажана сполука може бути комбінація вказаних активностей можуть мати темалорозчинною, вона може погано переноситися рапевтичне застосування. Зокрема, сполуки за крізь епітелій слизової, або вона може мати небавинаходом можуть бути придатними для лікування жано короткий час напіввиведення з плазми. Дота/або профілактики таких хвороб: даткове обговорення проліків можна знайти [у - розлади центральної нервової системи, 11 77405 12 включаючи: причин, включаючи шизоафективні розлади маніа- розлади настрою, включаючи особливо векального типу, депресивного типу, змішаного типу, ликий депресивний розлад, депресію з психотичпараноїдну, несистематизовану, кататонічну, неними ознаками, кататонічними ознаками, меландиференційовану та резидуальну шизофренію, холічними ознаками, атиповими ознаками шизофренія-подібний розлад, шизоафективний післяпологових нападів чи без таких ознак і, у вирозлад, маячний розлад, короткий психотичний падку рецидивних епізодів, із сезонним характерозлад, розділений психотичний розлад, речовиром виявів чи без них, дистимічний розлад, біпона-індукований психотичний розлад та психотичлярний розлад типу І, біполярний розлад типу II, ний розлад, який не було визначено інакше, циклотимічний розлад, рецидивний короткий де- акінезію, акінетично-ригідні синдроми, дискіпресивний розлад, змішаний афективний розлад, незію та індукований лікарськими засобами паркібіполярний розлад, який не було визначено інакнсонізм, синдром Жіль де ла Туретта та його симше, розлад настрою внаслідок загального медичптоми, тремор, хорею, міоклонус, сіпання та ного стану, речовина-індукований розлад настрою, дистонію, розлад настрою, який не було визначено інакше, - розлад дефіциту уваги / гіперактивності сезонний афективний розлад та передменструа(ADHD), льні дисфорічні розлади, - хворобу Паркінсона, індукований лікарськими - тривожні розлади, включаючи напад паніки, засобами паркінсонізм, пост-енцефалітичний парагорафобію, панічний розлад без агорафобії, агокінсонізм, прогресивний надядерний параліч, мнорафобію без історії панічного розладу, специфічну жинну системну атрофію, кортикобазальну дегефобію, соціальну фобію, нав'язливонерацію, комплекс паркінсонізм-деменція компульсивний розлад, посттравматичний стресвнаслідок бічного аміотрофічного склерозу (ALS) розлад, гострий стрес-розлад, генералізований та кальцифікацію базальних ядер, тривожний розлад, тривожний розлад внаслідок - деменцію типу Альцгеймера, з раннім чи піззагального медичного стану, речовинанім початком, з депресивним настроєм, індукований тривожний розлад та тривожний роз- порушення поведінки та розлади поведінки у лад, який не було визначено інакше, осіб з деменцією та розумово відсталих, включаю- стрес-споріднені розлади, асоційовані з дечи дисфорію та ажитацію, пресією та/або тривогою, включаючи гостру стре- екстрапірамідальні розлади руху, сову реакцію, регульовані розлади (коротка де- синдром Дауна, пресивна реакція, пролонгована депресивна - акатизію, реакція, змішана тривожна та депресивна реакція, - розлади харчування, включаючи нервоворегульований розлад з переважним порушенням психічну анорексію, атипову нервово-психічну інших емоцій, регульований розлад з переважним анорексію, нейрогенну булімію, атипову нейрогенпорушенням поведінки, регульований розлад зі ну булімію, переїдання, асоційоване з іншими псизмішаним порушенням емоцій та поведінки, регухологічними порушеннями, блювоту, асоційовану з льовані розлади з іншими визначеними переважіншими психологічними порушеннями, та неспеними симптомами) та інші реакції на сильний цифічні розлади харчування, стрес, - СHIД-асоційовану деменцію, - деменцію, амнезичні розлади та розлади пі- стани хронічного болю, включаючи нейропазнавальної здатності, які не було визначено інактичний біль, запальний біль, біль при раку та пісше, особливо деменцію, спричинену дегенеративляопераційний біль після хірургії, включаючи стоними розладами, ушкодженнями, травмами, матологічну хірургію. Ці показання можуть також інфекціями, судинними розладами, токсинами, включати гострий біль, біль скелетних м'язів, біль аноксією, авітамінозом чи ендокринними розладау нижній частині спини, біль у верхніх кінцівках, ми, або амнезичні розлади, спричинені алкоголем синдроми фіброміалгії та міофасціального болю, чи іншими причинами тіамінової недостатності, орофасціальний біль, черевний біль, фантомний двостороннім ушкодженням скроневої частки внабіль; тригемінальну невралгію та атиповий біль слідок енцефаліту, спричиненого Herpes simplex, обличчя, пошкодження нервових корейців та арата інших лімбічних енцефалітів, втратою нейронів хноїдит, геріатричний біль, центральний біль та внаслідок аноксії / гіпоглікемії / тяжких конвульсій запальний біль, та хірургії, дегенеративних розладів, судинних - нейродегенеративні хвороби, включаючи розладів чи колошлуночкової патології типу III, хворобу Альцгеймера, хорею Гентингтона, хворо- розлади пізнавальної здатності внаслідок побу Крейцфельда-Якоба, хворобу Піка, розлади рушення пізнавальної здатності, спричиненого демієлінізації, такі як розсіяний склероз та бічний іншими медичними станами, розлади особистості, аміотрофічний склероз (ALS), інші невропатії та включаючи параноїдальний розлад особистості, невралгію, розсіяний склероз, бічний аміотрофічшизоїдний розлад особистості, шизотиповий розний склероз, інсульт та травму голови, лад особистості, антисоціальний розлад особисто- розлади адикції, включаючи: сті, граничний розлад особистості, гістріонний роз- залежність від речовини чи зловживання релад особистості, нарцисичний розлад особистості, човинами з фізіологічною залежністю чи без неї, уникний розлад особистості, залежний розлад особливо у тих випадках, коли речовина позначає особистості, нав'язливо-компульсивний розлад алкоголь, амфетаміни, амфетамін-подібні речовиособистості та розлад особистості, який не було ни, кофеїн, марихуану, кокаїн, галюциногени, завизначено інакше, соби для інгаляції, нікотин, опіоїди, фенциклідин, - шизоафективні розлади, що виникли з різних фенциклідин-подібні сполуки, седативно-гіпнотичні 13 77405 14 засоби, бензодіазепіни та/або інші речовини, осоанксіолітичних та антипсихотичних засобів, а табливо, придатні для лікування припинення прийкож використання такої композиції для виробництмання вказаних вище речовин та делірій внаслідок ва лікарського засобу, призначеного для поліпприпинення вживання алкоголю, шення ефективності та/або початку дії при - розлади настрою, індуковані, зокрема, алколікуванні депресії та/або тривоги. голем, афетамінами, кофеїном, марихуаною, кокаДля оцінки даних сполук за показниками in їном, галюциногенами, засобами для інгаляції, vitro антагоністичної активності щодо 2нікотином, опіоїдами, фенциклідином, седативниадренорецепторів та активності інгібування повтоми засобами, гіпнотичними засобами, анксіолітирного поглинання серотоніну (5-НТ) можуть бути ками та іншими речовинами, використані дослідження зв'язування рецепторів - тривожні розлади, індуковані, зокрема, алкота нейротрансміттерних транспортерів і трансдукголем, афетамінами, кофеїном, марихуаною, кокації сигналів. Як показники центральної пенетрації їном, галюциногенами, засобами для інгаляції, та дієвості щодо блокування 2-адренорецепторів нікотином, опіоїдами, фенциклідином, седативнита транспортерів серотоніну, відповідно, може буми засобами, гіпнотичними засобами, анксіолітити використане визначення ex vivo зайнятості 2ками та іншими речовинами і регульовані розлади адренорецепторів та транспортерів серотоніну. Як з тривогою, показник in vivo антагонізму а2-адренорецепторів - припинення куріння, може бути використане обернення втрати рефлек- контроль ваги тіла, включаючи ожиріння, су випрямлення, що спостерігається у пацюків - розлади та порушення сну, включаючи: після підшкірної ін'єкції чи орального прийому дози - дисомнії та/або парасомнії, такі як первинні сполуки перед внутрішньовенним введенням мерозлади сну, розлади сну, пов'язані з іншим розудетомідину пацюкам (медетомідиновий тест). Як мовим розладом, розлад сну внаслідок загального показник активності інгібування повторного поглимедичного стану та речовина-індукований розлад нання серотоніну (5-НТ) може бути використане сну, розлади циркадних ритмів, поліпшення якості інгібування сіпання голови та збудження у пацюків, сну, яке спостерігається після підшкірної ін'єкції чи - сексуальну дисфункцію, включаючи розлади орального прийому дози сполуки перед підшкірсексуального бажання, розлади сексуального збуним введенням п-хлорамфетаміну пацюкам (рСАдження, оргазмічні розлади, сексуальні больові тест). розлади, сексуальну дисфункцію внаслідок загаВинахід також стосується композиції, що льного медичного стану, речовина-індуковану секвключає фармацевтично прийнятний носій та, як суальну дисфункцію та сексуальну дисфункцію, активний інгредієнт, терапевтично ефективну кільяку не було визначено інакше. кість сполуки за винаходом. Сполуки за винаходом Таким чином, даний винахід також стосується чи будь-яка їхня підгрупа можуть бути включені до сполук формули (І), визначених вище, їхніх фаррецептур різних фармацевтичних форм з метою мацевтично прийнятних солей приєднання кисловведення. Як відповідні композиції, можна назвати ти чи основи, їхніх стереохімічно ізомерних форм, всі композиції, що звичайно використовуються для їхньої N-оксидної форми, а також їхніх проліків, системного введення ліків. Для виготовлення фапридатних для використання як лікарський засіб. рмацевтичних композицій за даним винаходом, Крім того, даний винахід також стосується викориефективну кількість конкретної сполуки, необов'язстання сполуки формули (І), її фармацевтично ково, у формі адитивної солі, як активний інгредіприйнятних солей приєднання кислоти чи основи, єнт, ретельно перемішують до однорідного стану з її стереохімічно ізомерних форм, її N-оксидної фофармацевтично прийнятним носієм, який може рми, а також її проліків для виробництва лікарськомати різноманітні форми, у залежності від бажаної го засобу для лікування депресії, тривоги та роздля введення форми препарату. Ці фармацевтичні ладів ваги тіла чи загалом будь-якої з названих композиції, бажано, виготовляють як дозовані лівище хвороб. карські форми, придатні, зокрема, для введення Сполуки за винаходом можуть також бути орально, ректально, підшкірно, шляхом парентепридатними для застосування як допоміжне лікуральної ін'єкції чи інгаляції. Наприклад, при виговання та/або профілактика при названих вище товленні композицій у виді дозованих форм для хворобах у комбінаціях з антидепресантами, анкорального введення, може бути використане будьсіолітичними та/або антипсихотичними засобами, яке звичайне фармацевтичне середовище, таке відомими зараз або такими, що зараз розробляяк, наприклад, вода, гліколі, масла, спирти і т.п. у ються чи з'являться у майбутньому, для поліпшенвипадку рідких препаратів для орального введення ефективності та/або початку дії. Це оцінюється ня, таких як суспензії, сиропи, еліксири, емульсії та на моделях гризунів, для яких було продемонстрозчини; або тверді носії, такі як крохмалі, цукри, ровано активність антидепресантів, анксіолітичних каолін, розріджувачі, змащувальні речовини, зв'ята/або антипсихотичних засобів. Наприклад, спозуючі речовини, розпушувальні речовини і т.п., у луки оцінюються у комбінації з антидепресантами, випадку порошків, пілюль, капсул та таблеток. Заанксіолітичними та/або антипсихотичними засобавдяки зручності введення, таблетки та капсули є ми для полегшення стану стрес-індукованої гіпернайкращими дозованими лікарськими формами термії. для орального введення, для яких, зрозуміло, виТаким чином, винахід також стосується фаркористовують тверді фармацевтичні носії. Для мацевтичної композиції, що включає сполуки за парентеральних композицій, носій буде звичайно винаходом та одну чи кілька інших сполук, вибравключати стерильну воду, принаймні здебільшого, них з групи, що складається з антидепресантів, хоч можуть бути включені інші інгредієнти, напри 15 77405 16 клад, для поліпшення розчинності. Можуть бути (IV) спочатку вводять у реакцію із заміщеним піпевиготовлені, наприклад, розчини для ін'єкцій, у разином формули (VII), після чого у молекулу ввояких носій включає сольовий розчин, розчин глюдять радикал R3. Реакційні умови є аналогічними кози чи суміш сольового та глюкозного розчинів. до описаних вище для сполуки формули (VI). Можуть бути також виготовлені суспензії для ін'єкцій, у яких можуть бути використані відповідні рідкі носії, суспендувальні агенти і т.п. Включені також препарати у виді твердих форм, які призначені для перетворення, незабаром перед використанням, У сполуці (IV), L позначає будь-яку придатну на препарати у рідкій формі. У композиціях, приреакційноздатну відхідну групу, зокрема, галоїд, датних для підшкірного введення, носій необов'язтакий як хлор, бром чи йод, або сульфонілоксигково включає агент поліпшення пенетрації та/або рупу, таку як метилсульфонілокси чи 4придатний змочувальний агент, необов'язково, у метилбензолсульфонілокси. поєднанні з невеликою кількістю придатних доміУ проміжній сполуці (VII), одна з нітрогенових шок будь-якої природи, що не виявляють суттєвого функцій може також бути захищеною, наприклад, шкідливого ефекту щодо шкіри. Вказані домішки трет-бутилоксикарбонільною групою. можуть сприяти введенню до шкіри та/або можуть бути корисними при виготовленні бажаних композицій. Ці композиції можуть бути введені різними шляхами, наприклад, як транедермальний пластир, як точковий пластир, як мазь. Особливо кращим є складання вищевказаних У сполуці (IX), L позначає будь-яку придатну фармацевтичних композицій у виді дозованих ліреакційноздатну відхідну групу, зокрема, галоїд, карських форм для зручності введення та однакотакий як хлор, бром чи йод, або сульфонілоксигвості доз. Дозовані лікрські форми у тому значенні, рупу, таку як метилсульфонілокси чи 4що використовується тут, позначають фізично метилбензолсульфонілокси. Як сполука (IX) може окремі порції, придатні для застосування як разові бути використана також R3-CHO. дози, причому кожна порція містить попередньо Сполуки формули (І) з Ріr-радикалом формули визначену кількість активного інгредієнта, розра(llа) можуть бути також одержані за 2-стадійною ховану на створення бажаного терапевтичного схемою реакції, у якій проміжну сполуку формули ефекту, у поєднанні з потрібним фармацевтичним (VIII) вводять у реакцію з кислотою формули (X), з носієм. Прикладами таких дозованих лікарських наступним відновленням карбонільної функції форм є таблетки (включаючи таблетки з надрізом проміжної сполуки (XI). Реакції стадії 1 можуть чи таблетки з покриттям), капсули, пілюлі, порошбути проведені у розчиннику, інертному щодо реаки у пакетиках, облатки, супозиторії, розчини чи кції, такому як хлороформ, дихлорметан, тетрагідсуспензії для ін'єкцій і т.п., та їхні відокремлені рофуран, диметилформамід чи їхня суміш, з викократні частки. ристанням будь-яких методів, відомих фахівцям, із Сполуки за винаходом можуть бути загалом застосуванням реагентів для проведення конденодержані за допомогою послідовності стадій, кожсації, таких як 1,1'-карбонілдіімідазол, Ν,Ν'на з яких є відомою фахівцям. дициклогексилкарбодіімід чи шляхом попередньоЗокрема, сполуки формули (І) з Ріr-радикалом го перетворення карбонової кислоти формули (X) формули (llа) можуть бути одержані шляхом прона її відповідний хлорангідрид. Реакції, зображені ведення реакції нуклеофільного заміщення проміна стадії 2, можуть бути здійснені з використанням жної сполуки формули (IV) із заміщеним піперазипридатного відновного агента, такого як гідрид ном формули (V). Ці реакції можуть бути проведені літію-алюмінію чи гідрид алюмінію, у придатному у розчиннику, інертному щодо реакції, такому як розчиннику, наприклад, тетрагідрофурані. Загадіоксан, метилізобутилкетон чи Ν,Ν'лом, ці реакції проводять в інтервалі температур диметилформамід, у присутності придатної основід -20°С до кімнатної температури. ви, такої як карбонат калію, карбонат натрію чи триетиламін, або навіть без основи, з використанням у цьому останньому випадку надлишку реагента формули (V). Зручний інтервал температур реакції складає від 100°С до 150°С. У сполуці (IV), L позначає будь-яку придатну реакційноздатну відхідну групу, зокрема, галоїд, такий як хлор, бром чи йод, або сульфонілоксигрупу, таку як метилсульфонілокси чи 4метилбензолсульфонілокси. Сполуки формули (І) з Ріr-радикалом формули (llа) можуть бути також одержані за схемою 2стадійної реакції, у якій проміжну сполуку формули У проміжних сполуках (XI) та (XII), група А позначає необов'язково заміщену ароматичну гомоциклічну чи гетероциклічну кільцеву систему, включаючи частково чи повністю гідрогенований вуглеводневий ланцюг довжиною не більше 5 атомів, з яких один чи кілька атомів карбону можуть бути заміщені одним чи кількома атомами, вибраними з групи, що складається з оксигену, 17 77405 18 нітрогену та сульфуру, за допомогою якого кільценагріванні у розчиннику, такому як киплячий під ва система приєднується до радикала Ріr, який зворотним холодильником етанол. На цій стадії було визначено вище. утворюються два стереоцентри а та b сполуки Замісники R1 та R2 можуть бути замінені чи формули (І). перетворені один на інший методами, добре відомими фахівцям, такими як деметилування, ацилювання, етерифікація, амінування та амідування. Вихідні матеріали та деякі з проміжних сполук Одержання сполуки формули (XX) може бути є сполуками, що можуть бути придбані на ринку чи здійснене з використанням відомих у техніці метоможуть бути одержані звичайними методами продів, наприклад, шляхом відновлення карбонільної ведення реакцій, загальновідомими фахівцям. сполуки формули (XIX) у присутності придатного Наприклад, проміжні сполуки формули (IV), у якій відновного агента, наприклад, натрійборгідриду, у Х=О, можуть бути одержані згідно з такою схемою придатному розчиннику, такому як вода, спирт, реакції (Схема 1): тетрагідрофуран чи їхня суміш, звичайно, при кімнатній температурі. У проміжній сполуці (XIV), L позначає будь-яку придатну реакційноздатну відхідну групу, зокрема, галоїд, такий як хлор, бром чи йод, або сульфонілоксигрупу, таку як метилсульфонілокси чи 4метилбензолсульфонілокси. Крім того, АІk у проміжній сполуці (XIV) позначає будь-яку С1-6алкільну групу, зокрема, етильну групу, a m визначений у формулі (І). Проміжні сполуки формули (IV), у яких X=NH, можуть бути також одержані у спосіб, еквівалентний стадії 1 вище, за умови, що проміжну сполуку (XIII) заміняють на її амінований аналог (XVI), краще, з аміногрупою, захищеною, наприклад, групою COCF3-. Стадія алкілування може бути проведена у розчиннику, інертному щодо реакції, наприклад, тетрагідрофурані чи диметилформаміді, у присутності сильної основи, такої як гідрид натрію чи калію, та при додаванні краун-ефіру, такого як 18-краун-6 чи 15-краун-5. Зручним є інтервал температур реакції від кімнатної температури до 60°С. Проміжні сполуки формули (XVII) перетворюють на оксими формули (XVIII) з використанням відомих у техніці методів, таких як з використанням хлориду гідроксиламонію у присутності NaHCO3 чи піридину у розчиннику, інертному щодо реакції, наприклад, етанолі. Проміжна сполука (XVIII) окиснюється до її нітрильного оксиду та зазнає in situ внутрішньомолекулярного циклоприєднання з утворенням сполуки формули (XIX). Це окиснення може бути проведене з використанням розчину гіпохлориту натрію у присутності триетиламіну у інертному розчиннику, такому як дихлорметан, при кімнатній температурі. Окиснення може бути також здійснене з використанням хлораміну Τ (натрієва сіль N-хлор-4метилбензолсульфонаміду), при перемішуванні та Проміжна сполука формули (IV) може бути одержана з проміжної сполуки формули (XX) з використанням стандартних методів. Так, реакція з метансульфонілхлоридом чи 4метилбензолсульфонілхлоридом у присутності основи, такої як триетиламін, у розчиннику, інертному щодо реакції, наприклад, дихлорметані, при температурі реакції в інтервалі від 0°С до кімнатної температури, дає відповідне сульфонілоксидне похідне проміжної сполуки (IV). Може бути також одержане відповідне галогеноване похідне, наприклад, шляхом обробки проміжної сполуки формули (XX) трифенілфосфіном в присутності тетрахлорметану у розчиннику, інертному щодо реакції, такому як тетрагідрофуран, при перемішуванні та кип'ятінні суміші зі зворотним холодильником. Зрозуміло, що у наведених вище та далі реакціях продукти реакції можуть бути ізольовані від реакційного середовища і, якщо треба, додатково очищені методами, загальновідомими у техніці, такими як екстракція, кристалізація та хроматографія. Крім того, зрозуміло, що продукти реакції, які існують у більш ніж одній енантіомерній формі, можуть бути виділені з їхньої суміші відомими методами, зокрема, препаративною хроматографією, такою як препаративна ВЕРХ. Типово, проміжні сполуки (IV) та кінцеві сполуки формули (І) можуть бути розділені на їхні енантіомерні форми. Сполуки за винаходом, у яких Х=СН2, можуть бути одержані у відповідності до наведеної далі схеми реакції (Схема 2), у якій проміжну сполуку формули (V) спочатку N-алкілують дигалоїдпохідним формули (XX) з використанням стандартних методів, у присутності основи чи без неї та у інертному щодо реакції розчиннику, такому як хлороформ, дихлорметан чи 1,2-дихлопентан, та при температурі реакції в інтервалі від кімнатної температури до 80°С, одержуючи проміжну сполуку формули (XXI). Проводять реакцію альдегіду формули (XXII) з трет-бутиламіном у апротонному розчиннику, такому як толуол, перемішуючи та 19 77405 20 нагріваючи до температури кипіння зі зворотним гезивних та антипіретичних сполук і виключена з холодильником при видаленні води за допомогою патентного захисту. стандартного пристрою, такого як пастка ДінаНаведені далі приклади ілюструють даний виСтарка, одержуючи імін формули (XXIV). Снахід, не обмежуючи його. алкілування проміжної сполуки формули (XXIV) Експериментальна частина проміжною сполукою формули (XXI) можуть бути Система нумерації вуглецевого кільця сполуки здійснене у присутності похідного алкіллітію, такоформули (І), що використовується у даній заявці, є го як н-бутиллітій, під інертною атмосферою та у такою: сухому інертному розчиннику, такому як тетрагідрофуран, при низьких температурах в інтервалі від -78°С до 0°С, з одержанням проміжної сполуки формули (XXV). Проміжна сполука формули (XXVI) може бути одержана шляхом проведення Для деяких сполук абсолютну стереохімічну реакції сполуки формули (XXV) з гідроксиламіном конфігурацію стереогенного атома (атомів) карбоу присутності основи, такої як бікарбонат натрію, у ну не було визначено експериментально. У цих розчиннику, такому як нижчий алкільний спирт, випадках стереохімічно ізомерна форма, яку була такий як етанол, звичайно, при кімнатній темперавиділено першою, позначається як "А", а друга - як турі. Зрештою, окиснення оксимного похідного "В", без додаткових посилань на справжню стереформули (XXVI) до його нітрильного оксиду та охімічну конфігурацію. Однак, вказані ізомерні фоподальше in situ циклоприєднання з утворенням рми "А" та "В" можуть бути однозначно охарактесполуки формули (XXVII), можуть бути здійснені ризовані фахівцем за допомогою відомих у техніці аналогічними стандартними методами, такими як методів, таких як, наприклад, рентгенівська дифописані вище для проміжної сполуки формули ракція. Стереогенні центри а та b у формулі (І) (XVIII), з утворенням сполук формули (XIX). мають, відповідно, номери у кільці 3а та 3. Тут та надалі, "ДМФ" позначає Ν,Νдиметилформаміі, "DIPE" позначає діізопропіловий ефір, і "ТГФ" позначає тетрагідрофуран. Одержання проміжних сполук Приклад А1. а Одержання проміжної сполуки 1 Зрозуміло, що розкриті вище стадії реакції можуть бути адаптовані до конкретних продуктів реакції. Описані стадії реакції можуть бути здійснені у будь-який спосіб, відомий фахівцям, включаючи реакції у розчині чи твердофазові реакції, при яких продукти реакції є зв'язаними з матеріалом смоли і - на останній стадії розщеплення - вивільняються з матеріалу смоли. Приклади таких варіантів втілення та удосконалень описані як Приклади далі у цій заявці. Сполука 3,3а,4,5-тетрагідронафто[1,2с]ізоксазол-3-оцтова кислота (формула (IV), у якій кожен з R1 та R2 позначає Н, m=0, Х=СН2 і L=COOH) була розкрита у Synthetic Communications, 27(16), 2733-2742 (1997) як проміжна сполука для синтезу протизапальних, анал Розчин метилового складного ефіру 4-бром-2бутенової кислоти (0,1647моль) у ДМФ (50мл) додають по краплях до суміші 2-гідрокси-4,5диметокси-бензальдегіду (0,0823моль) та K2СО3 (0,1647моль) у ДМФ (200мл). Реакційну суміш перемішують протягом 2 годин при кімнатній температурі, фільтрують і фільтрат випарюють до сухого залишку. Залишок промивають у 10% водному розчині NaOH, а потім екстрагують СН2СІ2. Відокремлений органічний шар осушають (Na2SO4), фільтрують і розчинник випарюють. Залишок промивають діетиловим ефіром, а потім висушують. Одержують: 20г проміжної сполуки 1 (87%). Приклад А1.b Одержання проміжної сполуки 2 Гідроксиламін (0,045моль) додають до розчину проміжної сполуки 1 (0,041моль) у етанолі (150мл). Додають піридин (57мл). Реакційну суміш перемішують протягом 2 годин при кімнатній температурі, а потім виливають у воду та підкислюють концентрованою НСl. Цю суміш екстрагують СН2Сl2. Відокремлений органічний шар осушають (Na2SO4), фільтрують і розчинник випарюють. Одержують: 11,7г (96%, вихід неочищеної речовини). Зразок (2г) очищають високоефективною рідинною хроматографією на силікагелі (елюент: СН2Сl2/СН3ОН 95/5). Чисті фракції збирають і роз 21 77405 22 чинник випарюють. Залишок промивають діетило(0,04368моль) додають по краплях до перемішувим ефіром, а потім висушують. Одержують: 0,9г ваного розчину проміжної сполуки 5 (одержаної проміжної сполуки 2. згідно з А1.е) (0,00873моль) у СН2Сl2 (100мл), охоПриклад А1.с лодженого до -78°С. Реакційній суміші дають наОдержання проміжної сполуки 3 грітися до -40°С і продовжують перемішування протягом 2 годин при -40°С. Потім суміш виливають у воду з льодом та екстрагують СН2Сl2. Відокремлений органічний шар осушають (MgSO4), NaOCl, 5% (130мл) додають по краплях до суфільтрують і розчинник випарюють. Залишок очиміші проміжної сполуки 2 (0,037моль) та Et3N щають флеш-хроматографією на колонці з силіка(1мл) у СН2СІ2 (220мл). Реакційну суміш перемігелем (елюент: СН2СІ2/СН3ОН 97/3), а потім ВЕРХ шують протягом 4 годин при кімнатній температу(елюент: СН2Сl2/СН3ОН 99,5/0,5 до 90/10). Збирарі, а потім промивають водою, осушають (Na2SO4), ють дві групи фракцій з продуктом та розчинник фільтрують і фільтрат випарюють. Залишок очивипарюють. Вихід: 0,750г проміжної сполуки 6 щають хроматографією на короткій відкритій коло(26%). нці із силікагелем (елюент: СН2Сl2/2-пропанон Приклад A1.g 100/0 та 95/5). Потрібні фракції збирають і розчинОдержання проміжної сполуки 7 ник випарюють. Одержують: 5,8г (54%, використовують на наступній стадії ланцюжка без додаткової очистки). Зразок (2г) перекристалізовують з ЕtOАс. Осад відокремлюють на фільтрі та висуСуміш проміжної сполуки 5 (одержаної згідно з шують. Одержують: 1,7г проміжної сполуки 3. A1.d) (0,0422моль) та піперазину (0,1267моль) у Приклад A1.d 1,4-діоксані (15мл) перемішують протягом 2 годин Одержання проміжної сполуки 4 при 100°С. Розчинник упарюють. Залишок промивають водою та екстрагують СН2Сl2. Відокремлений органічний шар осушають (Na2SO4), фільтрують і розчинник випарюють. Одержують: 13г NaBH4 (0,043моль) додають порціями до розпроміжної сполуки 7 (ЯМР: 85%). чину проміжної сполуки 3 (0,017моль) у ТГФ (50мл) Приклад A1.h та Н2О (5мл), перемішують та охолоджують на Одержання проміжної сполуки 8 льодяній бані. Одержану реакційну суміш перемішують протягом 2 годин при кімнатній температурі. Додають 2-пропанон при перемішуванні на протязі 30хв. Реакційну суміш промивають водою та Проміжну сполуку 5 (одержану згідно з А1.е) екстрагують СН2Сl2. Відокремлений органічний (200г, 0,58моль) розділяють на її енантіомери мешар промивають розсолом, осушають (Na2SO4), тодом хіральної хроматографії на колонці LC110-2 фільтрують і розчинник випарюють. Залишок очиз нерухомою фазою CHIRALPAK-AD (2000г, тиск щають хроматографією на короткій відкритій колонабивання: 45бар, діапазон детектування: 2,56, нці із силікагелем (елюент: СН2Сl2/СН3ОН 95/5) та довжина хвилі: 240нм, температура: 30°С; розчин, високоефективною рідинною хроматографією на що вводиться: 200г у 8,4л CH3CN; потім додають силікагелі (елюент: СН2Сl2/СН3ОН 98/2). Чисті 19,6л метанолу (+2% етанолу) та фільтрують; фракції збирають і розчинник випарюють. Зразок об'єм для інжектування: 700мл; елюент: (1,8г) обробляють діетиловим ефіром, а потім виCH3OH/CH3CN 70/30 )об./об.)). Збирають дві групи сушують. Одержують: 1,2г проміжної сполуки 4 фракцій продукту і розчинник випарюють. Вихід: (59%). 95г проміжної сполуки 8. Приклад А1. e Приклад А1.і Одержання проміжної сполуки 5 Одержання проміжної сполуки 9 Et3N (0,016моль) додають до розчину проміжної сполуки 4 (одержаної згідно з A3) (0,0109моль) у СН2Сl2 (60мл). Суміш охолоджують на льодяній бані. Додають метансульфонілхлорид (0,012моль) і одержану реакційну суміш перемішують протягом 30хв. Потім суміш промивають водою, осушають (Na2SO4), фільтрують і розчинник випарюють. Одержують: 3,5г проміжної сполуки 5 (82%, використовують на наступній стадії реакції без додаткової очистки). Приклад A1.f Одержання проміжної сполуки 6 Реакція під атмосферою N 2. ВВr3 Суміш проміжної сполуки 8 (одержаної згідно з A1.h) (0,0728моль) та 1-(третбутилоксикарбоніл)піперазину (0,087моль) у діоксані (500мл) перемішують та кип'ятять зі зворотним холодильником протягом 48 годин. Розчинник випарюють і додають СН2Сl2. Додають також Н2О та NaOH (50%) і суміш екстрагують СН2Сl2. Відокремлений органічний шар осушають (MgSO4) і розчинник випарюють під вакуумом. Одержують проміжну сполуку 9. Приклад А1.j Одержання проміжної сполуки 10 23 77405 24 зниженому тиску. Вихід: 2.2г проміжної сполуки 13, використовується на наступній стадії реакції без додаткової очистки. Приклад А1.n Суміш проміжної сполуки 9 (0,00318моль) та Одержання проміжної сполуки 14 2,2,2-трифлуороцтової кислоти (189мл) у СН2СІ2 (500мл) перемішують протягом 1 години при кімнатній температурі. Розчинник випарюють і залишок розчиняють у СН2Сl2. Додають NaOH (50%) і суміш екстрагують. Відокремлений органічний шар До розчину (Е)-3-йод-2-метилпропенової кисосушають (MgSO4), фільтрують і розчинник випалоти (0,009моль) у сухому СН2Сl2 (100мл) при кімрюють під вакуумом. Залишок очищають хроматонатній температурі у потоці N2 додають 1,1'графією на короткій колонці із силікагелем (елюкарбонілбіс[1Н-імідазол] (0,0099моль). Суміш пеент: CH2Cl2/(MeOH/NH3) 100/0; 95/5). Чисті фракції ремішують протягом 1 години, а потім додають збирають і розчинник випарюють. Вихід: 14,32г проміжну сполуку 7 (одержану згідно з A1.g) проміжної сполуки 10 (59%). (0,009моль). Реакційну суміш перемішують при Приклад A1.k кімнатній температурі протягом 16 годин, промиОдержання проміжної сполуки 11 вають Н2О та розсолом, осушають (Na2SO4) і розчинник випарюють при зниженому тиску. Залишок (біла піна) очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: Суміш проміжної сполуки 10 (0,00599моль), 1СН2Сl2/МеOН 99/1). Чисті фракції збирають і розхлор-2-пропанону (0,00599моль) та K2СО3 чинник випарюють. Вихід: 3,82г проміжної сполуки (0,01199моль) у ДМФ (200мл) перемішують протя14 (біла тверда речовина, 81%). гом 24 годин при кімнатній температурі. Розчинник Приклад А1.o випарюють. Залишок розчиняють у СН2Сl2. ОрганіОдержання проміжної сполуки 15 чний розчин промивають водою, осушають (MgSO4), фільтрують і розчинник випарюють під вакуумом. Вихід: (кількісний вихід) проміжної сполуки 11. Приклад А1.l Одержання проміжної сполуки 12 Реакція під атмосферою N2. Суміш 3,4дигідро-2-нафталінкарбонової кислоти (0,0043моль) та 1,1'-карбонілбіс[1H-імідазолу] (0,0047моль) у сухому СН2Сl2 перемішують протягом однієї години при кімнатній температурі. Додають розчин проміжної сполуки 7 (одержаної згідно з Al.g) (0,0043моль) у сухому СН2СІ2 і одержаний реакційний розчин перемішують протягом приблизно 24 годин при кімнатній температурі. Розчин промивають водою, а потім екстрагують СН2Сl2. Відокремлений органічний шар осушають (Na2SO4), фільтрують і розчинник випарюють. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/СН3ОН 97/3). Чисті фракції збирають і розчинник випарюють. Вихід: 0,4г проміжної сполуки 12 (22%). Приклад A1.m Одержання проміжної сполуки 13 Етенілтрифенілфосфонійбромід (0,0025моль) додають до розчину проміжної сполуки 7 (одержаної згідно з A1.g) (0,003моль) у СН2Сl2 (20мл). Реакційну суміш перемішують протягом 4 годин при кімнатній температурі. Розчинник випарюють при Розчин LiAlH4, 1,0Μ/TГΦ (0,00848моль) у ТГФ (100мл) перемішують зі зрошенням у потоці Ν2 при -20°С. Додають однією порцією АІСl3 (0,0093моль) і одержану суміш перемішують при -20°С протягом 10 хвилин. Додають по краплях розчин проміжної сполуки 14 (одержаної згідно з А1.n) (0,0077моль) у ТГФ (100мл) і одержану суміш перемішують при 20°С протягом 1 години. Додають по краплях насичений 20% розчин NH4Cl при -10°С і реакційній суміші дають нагрітися до кімнатної температури. Додають до суспензії Н2О і екстрагують СН2Сl2. Відокремлений органічний шар осушають (Na2SO4) і розчинник випарюють при зниженому тиску. Залишок обробляють Et2O та висушують. Вихід: 3,73г проміжної сполуки 15 (біла тверда речовина, 94%). Приклад А1.р Одержання проміжної сполуки 16 Суміш проміжної сполуки 7 (одержаної згідно з A1.g) (0,015моль), 1-хлор-2-пропанону (0,015моль) та K2СО3 (0,030моль) у CH3CN (60мл) перемішують протягом 24 годин при кімнатній температурі. Розчинник випарюють. Залишок розділяють між водою та СН2СІ2. Відокремлений органічний шар осушають (Na2SO4), фільтрують і розчинник випарюють. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/СН3ОН 95/5). Чисті фракції збирають і розчинник випарюють. Вихід: 4,79г проміжної сполуки 16 (82%). 25 Приклад A1.q Одержання проміжної сполуки 17 77405 26 мішують протягом 30хв. при кімнатній температурі. Додають по краплях розчин метилового складного ефіру 4-бром-3-бутенової кислоти (0,2803моль) у ДМФ (200мл). Потім додають 18-краун-6 (каталітична кількість). Одержану реакційну суміш перемішують протягом 2 годин при 60°С, а потім протяNaBH4 (0,0128моль) додають порціями до розгом ночі при кімнатній температурі. Розчинник чину проміжної сполуки 16 (одержаної згідно з випарюють. Залишок промивають у воді та екстраА1.р) (0,0051моль) та Н2О (3,2мл) у ТГФ (40,5мл) гують СН2Сl2. Відокремлений органічний шар осупри 0°С. Реакційну суміш перемішують протягом шають (Na2SO4), фільтрують і розчинник випарюночі при кімнатній температурі, а потім обробляють. Залишок очищають хроматографією на ють 10% водн. розчином NH4Cl. Цю суміш екстравідкритій колонці з силікагелем (елюент: гують СН2Сl2. Відокремлений органічний шар осуСН2Сl2/гексан 90/10, 100/0 та СН2Сl2/2-пропанон шають, фільтрують і розчинник випарюють. 96/4, 90/10 та 80/20). Чисті фракції збирають і розЗалишок очищають хроматографією на короткій чинник випарюють. Одержують: 44,37г проміжної відкритій колонці із силікагелем (елюент: сполуки 20 (75%, використовують на наступній СН2Сl2/СН3ОН 97/3). Потрібні фракції збирають і стадії реакції без додаткової очистки). розчинник випарюють. Вихід: 1,6г проміжної споПриклад А2.b луки 17 (80%). Одержання проміжної сполуки 21 Приклад А1.r Одержання проміжної сполуки 18 Проміжну сполуку 7 (одержану згідно з Al.g) (0,03моль) розчиняють у CH3CN (200мл) і додають K2СО3 (0,27мл). Додають оксиранметанол (0,27моль) і реакційну суміш перемішують протягом вихідних при 60°С. Розчинник випарюють під вакуумом. Залишок розділяють між водою та СН2Сl2. Органічний шар відокремлюють, осушають (Na2SO4), фільтрують і розчинник випарюють при зниженому тиску. Залишок очищають препаративною ВЕРХ ((1) елюент: CH2Cl2/(CH3OH/NH3) 95/5, потім (2) елюент: СН2Сl2/СН3ОН 90/10). Фракції продукту збирають і розчинник випарюють. Вихід: 7,5г (61%) чистої проміжної сполуки 18 та 3,5г суміші вихідного матеріалу/цільової сполуки 1/1. Приклад A1.s Одержання проміжної сполуки 19 Проміжну сполуку 18 (одержану згідно з А1.r) (0,0012моль) розчиняють у СН2Сl2 (20мл). Додають розчин натрієвої солі перйодної кислоти (0,0024моль) у NаНСО3/Н2О (достатня кількість (q.s.)) і одержану реакційну суміш енергійно перемішують протягом 2 годин. Суміш розділяють між водою та СН2СІ2. Відокремлений органічний шар промивають розсолом, осушають (Nа2SО4), фільтрують і розчинник випарюють під вакуумом. Вихід: 0,430г проміжної сполуки 19 (кількісний вихід; використовують на наступній стадії реакції без додаткової очистки). Приклад А2.а Одержання проміжної сполуки 20 Реакція під атмосферою N2. Розчин 2,2,2трифлуор-N-(2-формілфеніл)-ацетаміду (0,1869моль) у ДМФ (375мл) додають по краплях до NaH (0,2055моль) у ДМФ (375мл). Суміш пере Гідроксиламін (0,169моль) та піридин (0,211моль) додають до розчину проміжної сполуки 20 (одержаної згідно з А2.а) (0,1407моль) у етанолі (450мл) і одержану реакційну суміш перемішують протягом 3 годин при кімнатній температурі. Суміш промивають 10% розчином лимонної кислоти, а потім екстрагують СН2СІ2. Відокремлений органічний шар осушають (Na2SO4), фільтрують і розчинник випарюють. Одержують: 45,76г проміжної сполуки 21 (98%, використовують на наступній стадії реакції без додаткової очистки). Приклад А2.с Одержання проміжної сполуки 22 Суміш проміжної сполуки 21 (одержаної згідно з А2.b) (0,0658моль) та натрієвої солі N-хлор-4метилбензолсульфонаміду (0,0658моль) у етанолі (500мл) перемішують та кип'ятять зі зворотним холодильником протягом 2 годин. Суміш концентрують під вакуумом, фільтрують крізь дікаліт і фільтрат промивають водою та розсолом, а потім екстрагують СН2Сl2. Відокремлений органічний шар осушають (Na2SO4), фільтрують і розчинник випарюють. Залишок очищають хроматографією на відкритій колонці з силікагелем (елюент: СН2Сl2/2-пропанон 100/0, 96/4, 90/10 та 80/20). Потрібні фракції збирають і розчинник випарюють. Залишок (сироп) кристалізують з гексану, а потім промивають DIPE та висушують. Одержують: 12,32г проміжної сполуки 22 (57%). Приклад A2.d Одержання проміжної сполуки 23 27 77405 28 NaBH4 (0,0289моль) додають порціями до сушають, фільтрують і розчинник випарюють до суміші проміжної сполуки 22 (одержаної згідно з хого залишку. Залишок очищають хроматографією А2.с) (0,0116моль) у ТГФ (81мл) та Н2О (6.8мл), на короткій відкритій колонці (елюент: перемішують та охолоджують на льодяній бані. СН2Сl2/СН3ОН 99/1 та 98/2). Чисті фракції збираОдержану реакційну суміш перемішують протягом ють і розчинник випарюють. Вихід: 5,5г проміжної ночі при кімнатній температурі. Суміш обробляють сполуки 26 (23%). насиченим водним розчином NH4Cl, а потім екстПриклад A3.с рагують EtOAc. Відокремлений органічний шар Одержання проміжної сполуки 27 осушають (Na2SO4), фільтрують і розчинник випарюють. Залишок промивають СН2СІ2, а потім перекристалізовують з EtOAc. Осад відокремлюють на фільтрі та висушують. Одержують: 0,9г проміжної сполуки 23 (38%). Реакцію проводять у потоці N2. Суміш проміжПриклад А2.е ної сполуки 26 (одержаної згідно з А2.b) (0,02моль) Одержання проміжної сполуки 24 у ТГФ (80мл) та 18-краун-6 (кат.кільк.) додають порціями до суміші NaH, 60%, (0,03моль) у ТГФ (20мл). Суміш перемішують при кімнатній температурі протягом 20 хв. і додають порціями ангідрид трифлуороцтової кислоти (0,022моль). Суміш пеСуміш проміжної сполуки 23 (одержаної згідно ремішують при кімнатній температурі протягом 3 з A2.d) (0,001468моль) та трифенілфосфіну годин, обробляють розчином NH4Cl (20%), а потім (0,001909моль) у тетрахлорметані (30мл) та ТГФ екстрагують СН2СІ2 і розчинник випарюють до су(20мл) перемішують та кип'ятять зі зворотним хохого залишку. Залишок очищають хроматографією лодильником протягом 3 годин. Розчинник випана короткій відкритій колонці з силікагелем рюють до сухого залишку. Залишок очищають (СН2Сl2/СН3ОН 99/1 та 98/2). Чисті фракції збирахроматографією на короткій відкритій колонці із ють і розчинник випарюють. Вихід: 5,3г проміжної силікагелем (елюент: СН2Сl2/гексан 90/10, потім сполуки 27 (58%). 100/0). Потрібні фракції збирають і розчинник виПриклад A3.d парюють. Залишок кристалізують з метанолу. Одержання проміжної сполуки 28 Осад відокремлюють на фільтрі та висушують. Одержують: 2,6г проміжної сполуки 24 (79%). Приклад A3.а Одержання проміжної сполуки 25 1,1-Диметилетил-1-піперазинкарбоксилат (0,02моль) додають порціями до розчину 1,4дихлор-2-бутену (0,025моль) у СНСl3 (60мл). Реакційну суміш перемішують протягом 24 годин при кімнатній температурі, а потім перемішують і кип'ятять зі зворотним холодильником протягом 24 годин. Реакцію гасять насиченим водним розчином NаНСО3, осушають (Na2SO4), фільтрують і розчинник випарюють. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2СІ2/ЕtOАс). Чисті фракції збирають і розчинник випарюють. Одержують: 2,2 г проміжної сполуки 25 (40%). Приклад A3.b Одержання проміжної сполуки 26 Реакцію проводять у потоці N2. Суміш NaH, 60%, (0,0579моль) та 18-краун-6 (кат.кільк.) у ТГФ (25мл) охолоджують. Додають порціями суміш 2аміно-4,5-диметоксибензальдегіду (0,0579моль) у ТГФ (50мл). Реакцію перемішують при кімнатній температурі протягом 30хв. Додають порціями суміш проміжної сполуки 25 (одержаної згідно з А3.а) (0,0386моль) у ТГФ (50мл). Суміш перемішують при кімнатній температурі протягом 3 днів, а потім обробляють NH4Cl (10%). Суміш екстрагують СН2Сl2. Органічний шар відокремлюють, осу Суміш проміжної сполуки 27 (одержаної згідно з А3.с) (0,0115моль), гідроксиламіну (0,0126моль) та NaHCO3 (0,023моль) у абс. етанолі (60мл) перемішують при кімнатній температурі протягом 24 годин, фільтрують і розчинник випарюють до сухого залишку. Вихід: 5,8г проміжної сполуки 28 (95%). Приклад A3.e Одержання проміжної сполуки 29 1-Хлор-2,5-піролідиндіон (0,0272моль) додають порціями до розчину проміжної сполуки 28 (одержаної згідно з A3.d) (0,0109моль) у СН2Сl2 (100мл). Суміш перемішують при кімнатній температурі протягом 2 годин. Додають по краплях Et3N (0,0272моль). Суміш перемішують при кімнатній температурі протягом ночі, гасять 10% розчином K2СО3, а потім екстрагують і розчинник випарюють до сухого залишку. Вихід: проміжна сполука 29. Приклад A3.f Одержання проміжної сполуки 30 29 77405 30 Суміш проміжної сполуки 29 (одержаної згідно порціями при -10°С. Реакційну суміш перемішують з A3.e) (0,0109моль) та LiOH (0,0119моль) у Н2О протягом 24 годин при кімнатній температурі, по(17,5мл) та 1,4-діоксані (70мл) перемішують при тім гасять NH4Cl (10%) і органічний шар відокремкімнатній температурі протягом 3 годин. Суміш люють. Водний шар екстрагують СН2Сl2. Об'єднані обробляють розчином NaOH (2H), а потім екстраорганічні шари осушають (Na2SO4), фільтрують і гують СН2СІ2. Розчинник випарюють до сухого зарозчинник випарюють. Одержують: 5,6г проміжної лишку. Залишок очищають хроматографією на сполуки 34 (100%). короткій відкритій колонці (елюент: СН2Сl2/СН3OН Приклад A4.d 98/2). Чисті фракції збирають і розчинник випарюОдержання проміжної сполуки 35 ють. Вихід;: 2,07г проміжної сполуки 30 (45%). Приклад A3.g Одержання проміжної сполуки 31 NaHCO3 (0,015моль) та гідроксиламін (0,0125моль) додають до розчину проміжної сполуки 34 (одержаної згідно з А4.с) (0,0083моль) у абс. етанолі (50мл). Реакційну суміш перемішують протягом 24 годин при кімнатній температурі. Додають СН2Сl2 і тверду речовину збирають на фільТрифлуороцтову кислоту (7,9мл) додають по трі та промивають СН2Сl2. Розчинник випарюють. краплях до розчину проміжної сполуки 30 Залишок розводять СН2Сl2 і промивають 10% (0,0047моль) у СН2Сl2 (33мл). Суміш перемішують Na2CO3 та розсолом. Органічний шар відокремпри кімнатній температурі протягом 3 годин, охолюють, осушають (Na2SO4), фільтрують і розчинлоджують та підлуговують 50% розчином NaOH. ник випарюють. Залишок очищають хроматографіСуміш екстрагують і розчинник випарюють до суєю на короткій відкритій колонці із силікагелем хого залишку. Вихід: 1,6г сполуки 31 (100%). (елюент: СН2Сl2/ЕtOАс/2-пропанон). Потрібні фраПриклад А4.а кції збирають і розчинник випарюють. Одержують: Одержання проміжної сполуки 32 0,9г проміжної сполуки 35 (24%). Приклад А5.a Одержання проміжної сполуки 36 1,4-Дихлор-2-бутен (0,03моль) додають до суміші 1-(2-нафтилметил)піперазину (0,025моль) та NaHCO3 (0,025моль) у СН2Сl2 (75мл). Реакційну суміш перемішують протягом 24 годин при кімнатній температурі. Тверду речовину збирають на фільтрі, промивають додатковою кількістю СН2Сl2 і органічний розчин промивають 10% розчином Nа2СО3, осушають (Na2SO4), фільтрують і розчинник випарюють. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/ЕtOАс/2-пропанон). Чисті фракції збирають і розчинник випарюють. Вихід: 3,4г проміжної сполуки 32 (43%). Приклад А4.b Одержання проміжної сполуки 33 Розчин NS (0,0546моль) та трет-бутиламіну (0,0983моль) у толуолі (75мл) перемішують та кип'ятять зі зворотним холодильником протягом 24 годин з використанням пастки Діна-Старка. Розчинник упарюють. Залишок очищають дистиляцією (т.кип. при 0,5мм рт.ст.: 75°С). Одержують: 8,1г проміжної сполуки 33 (72%). Приклад А4.с Одержання проміжної сполуки 34 Реакція під атмосферою N2. До розчину проміжної сполуки 33 (одержаної згідно з А4.а) (0,0125моль) та 2,2,6,6-тетраметилпіперидину (0,0012моль) у сухому ТГФ (25мл) додають по краплях H-BuLi (0,014моль), перемішують при -78°С. Суміш перемішують протягом 3 годин при -10°С. Розчин проміжної сполуки 32 (одержаної згідно з А4.b) (0,0083моль) у сухому ТГФ (25мл) додають Суміш А (0,029моль) та проміжної сполуки 5 (одержаної згідно з А1.е) (0,0058моль) у 1,4діоксані (5мл) перемішують протягом 6 годин при 100°С. Розчинник випарюють. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/СН3ОН 98/2-97/3). Фракції продукту збирають і розчинник випарюють. Вихід: 3,3г проміжної сполуки 36. Приклад А5.b Одержання проміжної сполуки 37 Трифлуороцтову кислоту (11,7мл) додають по краплях до розчину проміжної сполуки 36 (одержаної згідно з A5.f) (0,0071моль) у СНСІ3 (50мл) і одержану реакційну суміш перемішують протягом 3 годин при ±10°С. Реакційну суміш охолоджують, а потім додатково підлуговують 50% NaOH. Цю суміш екстрагують і випарюють розчинник з екстракту. Вихід: 2,5г проміжної сполуки 37 (кількісний вихід; використовують на наступній стадії реакції без додаткової очистки). А. Одержання кінцевих сполук Приклад В1.а Одержання сполуки 1 Суміш проміжної сполуки 5 (одержаної згідно з А1.е) (0,0291моль) та 1-(3-феніл-2пропеніл)піперазину (0,0582моль) нагрівають протягом 2 годин при 100°С. Сирову реакційну суміш промивають водою та екстрагують СН2СІ2. Відо 31 77405 32 кремлений органічний шар осушають (Na2SO4), критій колонці (елюент: СН2Сl2/МеOН 97/3). Бажані фільтрують і розчинник випарюють. Залишок очифракції збирають і розчинник випарюють. Залишок щають хроматографією на короткій відкритій колообробляють діетиловим ефіром, а потім висушунці із силікагелем (елюент: СН2Сl2/СН3ОН 95/5) та ють. Вихід: 0,9г сполуки 4 (33%). ВЕРХ на силікагелі (елюент: СН2Сl2/СН3OН 80/20). Приклад В1.e Чисті фракції збирають і розчинник випарюють. Цю Одержання сполуки 5 фракцію розділяють на її оптичні енантіомери методом хіральної хроматографії на колонці з Chiralpak AD (елюент: C2H5OH/CH3CN 90/10). (В)Енантіомерні фракції збирають і розчинник випаСуміш проміжної сполуки 10 (одержаної згідно рюють. Залишок розчиняють у метанолі та перетворюють на сіль хлористоводневої кислоти (1:2). Осад відокремлюють на фільтрі та висушують. з А1.і) (0,0029моль), (0,0058моль), Одержують: 2,47г сполуки 1. АсОН (0,48г) та (AcO)3BHNa (0,4г) у 1,2Приклад В1.b дихлорпентані (20мл) перемішують та кип'ятять із Одержання сполуки 2 зворотним холодильником протягом ночі. Суміш обробляють Н2О та екстрагують. Розчинник відокремленого органічного шару випарюють. Залишок очищають хроматографією на короткій колонці з Суміш проміжної сполуки 5 (одержаної згідно з силікагелем (елюент: СН2Сl2/МеOН 97/3). Потрібні А1.е) (0,0044моль) та (3-феніл-2фракції збирають і розчинник випарюють. Залишок пропеніл)піперазину (0,0087моль) перемішують обробляють діетиловим ефіром, а потім висушупротягом 2 годин при 100°С. Реакційну суміш очиють. Вихід: 1,07г сполуки 5 (82%). щають хроматографією на короткій відкритій колоПриклад В1.f нці із силікагелем (елюент: СН2Сl2/СН3ОН 95/5), а Одержання сполуки 6 потім високоефективною рідинною хроматографією на силікагелі (елюент: СН2Сl2/СН3ОН 96/4). Чисті фракції збирають і розчинник випарюють. Залишок (1,4г) обробляють діетиловим ефіром, а потім висушують. Одержують: 1,2г сполуки 2 Суміш сполуки 3 (одержаної згідно з Пр.В1) (60%). (0,00020моль), ацетилхлориду (0,00024моль) та Приклад В1.с Et3N (0,00061моль) у хлороформі (10мл) переміОдержання сполуки 3 шують при кімнатній температурі протягом 2 го Суміш проміжної сполуки 6 (0,00227моль), (Е)1-(2-метил-3-феніл-2-пропеніл)піперазину (0,00273моль) та NaHCO3 (0,00455моль) у діоксані (30мл) перемішують та кип'ятять зі зворотним холодильником протягом 48 годин. Розчинник випарюють. Залишок розчиняють у СН2Сl2. Органічний розчин промивають водою, осушають (MgSO4), фільтрують і розчинник випарюють. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/(СН3OН/NH3) 99/1), а потім ВЕРХ (елюент: СН2Сl2/СН3ОН 99,5/0,5 до 98/2). Потрібні фракції збирають і розчинник випарюють. Вихід: 0,17г сполуки 3. Приклад В1.d Одержання сполуки 4 Суміш проміжної сполуки 8 (одержаної згідно з A1.h) (0,0058моль) та (0,0116моль) у діоксані (10мл) перемішують та кип'ятять із зворотним холодильником протягом 8 годин, потім перемішують протягом ночі при кімнатній температурі, а потім перемішують та кип'ятять зі зворотним холодильником протягом 18 годин. Суміш обробляють Н2О та екстрагують СН2Сl2. Розчинник відокремленого органічного шару випарюють. Залишок очищають хроматографією на короткій від дин. Додають воду і цю суміш екстрагують СН2СІ2. Відокремлений органічний шар осушають (MgSO4), фільтрують і розчинник випарюють під вакуумом. Залишок очищають хроматографією на колонці / ТШХ (CC-TLC) на Chromatotron (елюент: СН2Сl2/СН3ОН 97/3; потім 99/1). Потрібні фракції збирають і розчинник випарюють. Вихід: 0,022г сполуки 6. Приклад В1.g Одержання сполуки 7 Одержання сполуки 8 Сполуку 2 (одержану згідно з B1.b) (0,0022моль) виділяють та розділяють на її оптичні енантіомери методом хіральної хроматографії на колонці Chiralpak AD (елюент: С2Н5ОН/СН3СN 90/10). Збирають дві групи фракцій і розчинник випарюють. Одержують: ±1,5г фракції 1 (чистота LCI: >99,5%) та ±1,5г фракції 2 (чистота LCI: >99,5%). Фракцію 1 кристалізують шляхом обробки гексаном при перемішуванні протягом ночі. Осад відокремлюють на фільтрі та висушують. Одержують: 1,08г сполуки 7 (жироподібна тверда речовина). Фракцію 2 кристалізують шляхом обробки ЕtOАс при перемішуванні протягом ночі. Осад відокремлюють на фільтрі та висушують. Одержують: 0,54г 8 (жироподібна тверда речовина). 33 Приклад В2.а Одержання сполуки 9 77405 34 Одержання сполуки 13 Суміш проміжної сполуки 24 (одержаної згідно з А2.е) (0,0022моль), 1-(2нафталенілметил)піперазину, (0,0044моль) та KІ (каталітична кількість) у 1,4-діоксані (2,5мл) перемішують та кип'ятять зі зворотним холодильником протягом ночі. Реакційну суміш промивають водою і цю суміш екстрагують СН2Сl2. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/СН3ОН 98/2), а потім ВЕРХ (елюент: CH2Cl2/(CH3OH/NH3) 96/4). Чисті фракції збирають і розчинник випарюють. Залишок обробляють DIPE, збирають на фільтрі та висушують. Вихід: 0,3г сполуки 9 (30%). Приклад В2.b Одержання сполуки 10 Реакція під атмосферою N2. Розчин сполуки 9 (одержаної згідно з В2.а) (0,0012моль) у сухому ТГФ (3мл) та 18-краун-6 (каталітична кількість) повільно додають до розчину NaH, 60%, (0,0018моль) у сухому ТГФ (2мл). Реакційну суміш перемішують протягом 30хв. при кімнатній температурі, додають по краплях ацетилхлорид (0,0013моль) і реакційну суміш перемішують протягом 3 годин при кімнатній температурі. Реакційну суміш обробляють водним NH4Cl та екстрагують СН2Сl2. Відокремлений органічний шар осушають, фільтрують і розчинник випарюють. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/СН3ОН 98/2), а потім ВЕРХ (елюент: СН2Сl2/(СН3ОН/NH3) 98/2). Чисті фракції збирають і розчинник випарюють. Вихід: 0,26г сполуки 10 (52%). Приклад В3.а Одержання сполуки 11 Суміш проміжної сполуки 31 (одержаної згідно з A3.g) (0,0045моль), (Е)-(З-хлор-2-метил-1пропеніл)бензолу (0,0037моль) та K2СО3 (0,0037моль) у ДМФ (15мл) перемішують при 70°С протягом 2 годин. Суміш промивають водою, а потім екстрагують СН2СІ2. Органічний шар відокремлюють, осушають, фільтрують і розчинник випарюють. Залишок очищають хроматографією на короткій колонці з силікагелем (елюент: СН2Сl2/СН3ОН 98/2). Потрібні фракції збирають і розчинник випарюють. Залишок знов очищають методом ВЕРХ (елюент: СН2СІ2/(СН3ОН/NН3) 98/2). Чисті фракції збирають і розчинник випарюють. Залишок обробляють DIPE. Осад відокремлюють на фільтрі та висушують. Вихід: 0,34г сполуки 11 (20%). Приклад В3.b Одержання сполуки 12 Сполуку 11 (одержану згідно з В3.а) (0,00605моль) очищають високоефективною рідинною хроматографією на Chiralcel OJ (елюент: гексан/МеОН/ЕtOН 20/24/56). Потрібні фракції збирають і розчинник випарюють. Вихід: фракції А та В. Фракцію А очищають високоефективною рідинною хроматографією на RP BDS СІ8 (елюент: (0,5% NH4OAc у H2O/CH3CN (90/10))/МеОН 70/30). Чисті фракції збирають та органічний розчинник випарюють. Водний шар екстрагують СН2Сl2. Відокремлений органічний шар осушають (MgSO4), фільтрують і розчинник випарюють. Залишок перемішують у гексані та осад відокремлюють на фільтрі. Вихід: 0,69г сполуки 12. Фракцію В очищають високоефективною рідинною хроматографією на RP BDS C18 (елюент: (0,5% NH4OAc у H2O/CH3CN (90/10))/MeOH 70/30). Чисті фракції збирають та органічний розчинник випарюють. Водний шар екстрагують СН2Сl2. Відокремлений органічний шар осушають (MgSO4), фільтрують і розчинник випарюють. Залишок перемішують у гексані та осад відокремлюють на фільтрі. Вихід: 0,67г сполуки 13. Приклад 4 Одержання сполуки 14 Реакція проводиться у твердій фазі з використанням синтезатора Quest 210 (Argonaut Technologies, San Carlos, USA). Ν,ΝДіізопропілетиламін (0,0036моль) додають до суспензії (0,0006моль) у ацето нітрилі (4мл). Додають 1-(2хлорфенілметил)піперазин (0,0012моль) і одержану реакційну суміш перемішують протягом 20 годин при 80°С. Після цього кожну реакційну посудину фільтрують і фільтрат випарюють. Залишок очищають методом ВЕРХ. Чисті фракції збирають і розчинник випарюють. Вихід: 0,102г сполуки 14. Приклад В5.а Одержання сполуки 15 Суміш проміжної сполуки 7 (одержаної згідно з A1.g) (0,0036моль), 2-(бромметил)нафталіну (0,0055моль) та K2СО3 (0,0055моль) у МІК (15мл) перемішують протягом ±24 годин при 100°С. Сирову реакційну суміш промивають водою, а потім екстрагують СН2Сl2. Відокремлений органічний шар осушають (Na2SO4), фільтрують і розчинник випарюють. Залишок очищають високоефективною рідинною хроматографією на силікагелі (2х) ((І) елюент: СН2Сl2/СН3ОН 95/5; (II) елюент: CH2Cl2/(CH3OH/NH3) 98/2). Чисті фракції збирають і 35 77405 розчинник випарюють. Одержують: 0,2г сполуки 15(11%). Приклад В5.b Одержання сполуки 16 36 Суміш (0,00036моль), 2 Одержання сполуки 17 Сполуку 15 (одержану згідно з В5.а) (0,0106моль) розділяють на її енантіомери хроматографією на колонці (елюент: гексан/С2Н5ОН, градієнт від 30/70 до 0/100; колонка: CHIRALPAK AD 1000 Å 20мкм DIACEL). Збирають дві чисті фракції та випарюють з них розчинник. Залишок розчиняють у СН3ОН та перетворюють на сіль хлористоводневої кислоти (1:2). Осад відокремлюють на фільтрі та висушують. Одержують: 2,08г сполуки 16 (36%) та 2,19г сполуки 17 (38%). Приклад В6 Одержання сполуки 18 Суміш проміжної сполуки 7 (одержаної згідно з A1.g) (0,0045моль), 2-метил-3-(3-тієніл)-2пропеналю (0,00675моль), NaBH(OAc)3 (0,00675моль) та НОАс (2 краплі) у 1,2дихлоретані (30мл) перемішують протягом ночі при кімнатній температурі. Додають насичений водний розчин NH4Cl і цю суміш екстрагують СН2Сl2. Відокремлений органічний шар осушають (MgSO4), фільтрують і розчинник випарюють під вакуумом. Залишок очищають флешхроматографією на колонці з силікагелем (елюент: CH2Cl2/(CH3OH/NH3) 97/3), а потім ВЕРХ (елюент: СН2Сl2/(СН3ОН/NН3) 99/1 до 98/2). Фракції продукту збирають і розчинник випарюють. Вихід: 0,965г сполуки 18 (46%; містить також 3% ізомеру (Z)!). Приклад В7 Одержання сполуки 19 Суміш проміжної сполуки 10 (одержаної згідно з A1.j) (0,003моль), 4-хлорбензальдегіду (0,0045моль) та (AcO)3BHNa (0,0045моль) у 1,2дихлопентані (30мл) перемішують зі зрошенням протягом 2 годин при кімнатній температурі. Додають насичений водний розчин NH4Cl і суміш екстрагують СН2СІ2. Відокремлений органічний шар осушають (MgSO4), фільтрують і розчинник випарюють під вакуумом. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/(МеОН/NН3) 97/3). Потрібні фракції збирають і розчинник випарюють. Залишок осаджують з DIPE. Вихід: 1,180г сполуки 19 (57%). Приклад В8 Одержання сполуки 20 метилбензальдегіду (0,00108моль) та NaOCH3, 30% у СН3ОН, (0,00108моль) у сухому СН3ОН (8мл) перемішують протягом 16 годин при 65°С (реакція проводиться у твердій фазі з використанням синтезатора Quest 210 (Argonaut Technologies, San Carlos, USA)). Суміші фільтрують і фільтрат очищають методом ВЕРХ (елюент: СН2Сl2/(СН3OН/NН3) 98/2). Потрібні фракції збирають і розчинник випарюють. Вихід: 0,032г сполуки 20. Приклад В9 Одержання сполуки 21 Реакція під атмосферою N2. Розчин LiAlH4, 1М/ТГФ (0,8мл) перемішують при -20°С. Додають однією порцією АlСl3 (0,0009моль). Одержаний розчин перемішують протягом 10хв. при -20°С. Додають по краплях розчин проміжної сполуки 12 (одержаної згідно з А1.l) (0,0008моль) у сухому ТГФ (5мл) і одержану реакційну суміш перемішують протягом однієї години при -20°С. Потім обережно додають насичений водний розчин NH4Cl. Реакційну суміш промивають водою, а потім екстрагують СН2Сl2. Відокремлений органічний шар осушають (Na2SO4), фільтрують і розчинник випарюють. Залишок обробляють ефіром. Залишок (0,13г) очищають за допомогою CC-TLC Chromatotron (елюент: СН2Сl2/СН3OН 97/3). Чисті фракції збирають і розчинник випарюють. Вихід: 0,09г сполуки 21 (30%). Приклад В10 Одержання сполуки 22 Реакція у потоці N2. Суміш проміжної сполуки 13 (одержаної згідно з Al.m) (0,001моль) у сухому СН3ОН (20мл) перемішують при кімнатній температурі. Додають NаОСН3, 30%, у СН3ОН (0,002моль). Додають 5-інданкарбоксальдегід (0,002моль) і одержану реакційну суміш перемішують та кип'ятять зі зворотним холодильником протягом 16 годин. Реакційній суміші дають охолонути до кімнатної температури. Додають 20% NH4Cl і цю суміш екстрагують СН2Сl2. Відокремлений органічний шар промивають водою, розсолом, осушають (Na2SO4), фільтрують і розчинник випарюють при зниженому тиску. Залишок очищають хроматографією на короткій відкритій колонці та CC-TLC (елюент: СН2Сl2/СН3ОН 98/2). Фракції продукту збирають і розчинник випарюють. Вихід: 0,035г сполуки 22 (7,2%, світло-коричнева тверда речовина). Приклад В11 Одержання сполуки 23 37 77405 38 Приклад В14 Одержання сполуки 26 Суміш проміжної сполуки 15 (одержаної згідно з Аl.о) (0,00136моль), 2-(триметилстаніл)піридину (0,0027моль) та Рd(РРh3)4 (0,00013моль) у толуолі (20мл) нагрівають до 100°С. Реакційну суміш перемішують протягом 16 годин і залишають охолонути до кімнатної температури. Додають Н2О і суміш екстрагують СН2Сl2. Відокремлений органічний шар збирають, промивають Н2О та розсолом, осушають (Na2SO4) і розчинник випарюють при зниженому тиску. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/МеOН 98/2). Чисту фракцію збирають і розчинник випарюють. Одержаний залишок очищають методами CC-TLC на Chromatotron (елюент: СН2Сl2/МеOН 98/2). Збирають чисті фракції і розчинник випарюють. Вихід: 0,044г сполуки 23 (світло-коричнева тверда речовина, 7%). Приклад В12 Одержання сполуки 24 Реакція під атмосферою N 2. н-BuLi, 2,5М/гексани (0,0062моль) додають по краплях до перемішуваного розчину (пфлуорбензил)трифенілфосфонійхлориду (0,0062моль) у ТГФ (20мл). Суміш перемішують протягом 15хв. Додають по краплях розчин проміжної сполуки 11 (одержаної згідно з A1.k) (0,00514моль) у ТГФ (20мл). Реакційну суміш перемішують протягом 16 годин при 50°С. Додають воду і цю суміш екстрагують Et2O. Відокремлений органічний шар осушають (MgSO4), фільтрують і розчинник випарюють під вакуумом. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/СН3ОН 97/3), а потім ВЕРХ (елюент: СН2Сl2/(СН3ОН/NН3) 99/1) для розділення (E)/(Z) ізомерів. Збирають дві групи фракцій продуктів і випарюють з них розчинник. Вихід: 0,651г сполуки 24 (26%, (Е)). Приклад В13 Одержання сполуки 25 Смолу (0,0016моль; 1,5ммоль/г) су спендують у ТГФ. Додають 1,6М BuLi (0,0015моль) і суміш перемішують протягом 15хв. Суміш фільтрують і залишок на фільтрі (смолу) промивають безводним ТГФ (3 ). Смолу знов суспендують у ТГФ (5мл). Додають проміжну сполуку 19 (одержану згідно з A1.s) (0,0004моль) і реакційну суміш перемішують протягом ночі при 100°С. Суміш охолоджують, фільтрують і фільтрат випарюють під вакуумом. Залишок очищають препаративною ВЕРХ (елюент: CH2Cl2/(CH3OH/NH3) 97/3). Фракції продукту збирають і розчинник випарюють. Вихід: 0,168г сполуки 25. Суміш проміжної сполуки 16 (одержаної згідно з А1.р) (0,0025моль), бензоламіну (0,0028моль) та NaBH4 (0,0028моль) у НОАс (50мл) перемішують протягом 2 годин при кімнатній температурі. Додають водний розчин NH4OH. Цю суміш екстрагують СН2Сl2. Відокремлений органічний шар осушають (MgSO4), фільтрують і розчинник випарюють під вакуумом. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: CH2Cl2/(CH3OH/NH3) 99/1), а потім флеш-хроматографією на колонці з силікагелем (елюент: CH2Cl2/(CH3OH/NH3) 98/2). Фракції продукту збирають і розчинник випарюють. Вихід: 0,181г сполуки 26 (15%). Приклад В15 Одержання сполуки 27 Додають по краплях (0,0018моль) до розчину проміжної сполуки 17 (одержаної згідно з A1.q) (0,0012моль), 3флуорфенолу (0,0018моль) та PPh3, роl. (0,0024моль) у сухому ТГФ (10мл) під атмосферою N2. Реакційну суміш перемішують протягом ночі при кімнатній температурі. Суміш фільтрують, промивають СН2СІ2 та СН3ОН і розчинник випарюють. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2Сl2/ЕtOАс 2/1 та СН2Сl/СН3ОН 96/4), а потім флеш-хроматографією на колонці з силікагелем (елюент: СН2Сl2/СН3OН 97/3). Фракції продукту збирають і розчинник випарюють. Вихід: 0,29г сполуки 27 (50%). Приклад В16 Одержання сполуки 28 NaCIO (4%) (0,005моль) додають до розчину проміжної сполуки 35 (одержаної згідно з A4.d) (0,002моль) у СН2Сl2 (10мл). Реакційну суміш перемішують протягом 4 годин при кімнатній температурі. Додають Et3N (0,004моль) і реакційну суміш перемішують протягом 24 годин при кімнатній температурі. Органічний шар відокремлюють, промивають Na2SO3 (10%), осушають (Na2SO4), фільтрують і розчинник випарюють. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: ЕtOАс та СН2СІ2/СН3ОН 95/5). Потрібні фракції збирають і розчинник випарюють. Залишок розводять діетиловим ефіром, а потім фільтрують крізь дікаліт і фільтрат випарюють. Залишок розчиняють у діетиловому ефірі та перетворюють на сіль хлористоводневої кислоти (1:2). Осад відокремлюють на фільтрі, промивають 2-пропаноном та діетиловим ефіром і висушують. Вихід: 0,15г сполуки 28 (15%). 39 Приклад В17 Одержання сполуки 29 Суміш проміжної сполуки 37 (одержаної згідно з A5.g) (0,006моль) та 2-(бромметил)нафталіну (0,003моль) у діоксані (40мл) перемішують при 100°С протягом 6 годин, а потім протягом ночі при кімнатній температурі. Реакційну суміш обробляють 10% водним розчином K2СО3, а потім екстрагують СН2СІ2. Відокремлений органічний шар випарюють. Залишок очищають хроматографією на короткій відкритій колонці із силікагелем (елюент: СН2СІ2/СН3ОН 95/5 та 90/10 та СН2Сl2/(СН3ОН/NН3) 95/5). Фракції продукту збирають і розчинник випарюють. Залишок (1,49г) обробляють діетиловим ефіром, а потім висушують. Вихід: 0.8г сполуки 29 (53%). У наведених далі таблицях (Таблиці 1-5) вказано ряд сполук, які були одержані згідно з будьяким з Прикладів вище. Усі сполуки були також випробувані на фармакологічну активність. 77405 40 41 77405 42 43 77405 44 45 77405 46 47 77405 48 49 77405 50 51 77405 52 53 77405 54 С. Фармакологічні приклади Приклад СІ: Експерименти зі зв'язування 2адренергічних рецепторів та 5-НТ транспортера Загальні відомості Взаємодію сполук формули (І) з h 2рецепторами та h5-НТ-транспортерами оцінювали за допомогою in vitro експериментів зі зв'язування радіоліганду. Загалом, низьку концентрацію радіоліганду з високою спорідненістю зв'язування до певного рецептора чи транспортера інкубують зі зразком препарату тканини, збагаченого на певний рецептор чи транспортер, або з препаратом клітин, що експресують клоновані рецептори людини, 55 77405 56 у забуференому середовищі. Під час інкубування, за допомогою гомогенізатора Ultraturrax. У загальрадіоліганд зв'язується з рецептором чи транспорному об'ємі 250мкл, 50-100мкг протеїну інкубують з тером. Після досягнення рівноваги зв'язування [3Н]пароксетином (NET-869) (New England Nuclear, зв'язану рецептором радіоактивність відокремлюUSA) (кінцева концентрація 0,5нМ) з конкурентним ють від незв'язаної радіоактивності і підраховують агентом чи без нього протягом 60хв. при 25°С. рецептор- чи транспортер-зв'язану активність. Інкубування припинють швидкою фільтрацією інВзаємодію тестових сполук з рецептором оцінюкубованої суміші крізь фільтри GF/B, попередньо ють за допомогою експериментів з конкурентного змочені 0,1% поліетиленаміном, за допомогою зв'язування. Різні концентрації випробовуваної харвестера Filtermatel96 (Packard, Meriden, CT). сполуки додають до суміші для інкубації, що місФільтри промивають великою кількістю охолоджетить препарат рецептора чи транспортера та раного льодом буфера і радіоактивність на фільтрі діоліганд. Тестова сполука інгібує зв'язування рапідраховують за допомогою рідинного сцинтилядіоліганду пропорційно її спорідненості до ційного лічильника Topcount (Packard, Meriden, зв'язування та її концентрації. Як радіоліганд для CT). Дані виражають в імпульсах за хвилину (срm). Для визначення неспецифічного зв'язування викозв'язування h 2A, h 2B та h 2C-рецепторів викорисристовують іміпрамін (у кінцевій концентрації товували [3Н]-раувольсцин, а для h5-НТ1мкМ). транспортера - [3Н]-пароксетин. Аналіз даних та результати Клітинна культура та препарат мембран Дані аналізів у присутності сполуки обчислюКлітини яєчнику китайського хом'ячка (СНО), ють в процентах від загального зв'язування, вимістабільно трансфековані кДНК адренергічного 2Аряного за відсутності тестової сполуки. Криві інгі, 2B- чи 2C-рецептора людини, культивували на бування, які є графіками залежності частки середовищі Ігла, модифікованого за Дульбекко загального зв'язування від логарифмічного зна(ОМЕМ)/суміші живильних речовин Ham's F12 чення концентрації тестової сполуки, генерувалися (співвідношення 1:1) (Gibco, Gent-Belgium) з добаавтоматично, і сигмоїдальні криві інгібування апвкою 10% термоінактивованої сироватки плоду роксимують методом нелінійної регресії. Значення корови (Life Technologies, Merelbeke-Belgium) та pIC50 тестових сполук обчислюють з індивідуальантибіотиків (100МО/мл пеніциліну G, 100мкг/мл них кривих. стрептоміцинсульфату, 110мкг/мл піровиноградної Усі сполуки формули (І) спричинювали більш кислоти та 100мкг/мл L-глутаміну). За день до збиніж 50% інгібування (pIC50) принаймні сайта h 2A рання клітини індукували 5мМ бутирату натрію. (але часто також і сайтів h 2B та h 2C) і одночасно При ступені злиття 80-90%, клітини зіскрібають у сайта 5-НТ транспортера при випробуваних конфосфатно-сольовому буфері без Са2+ та Mg2+ і -6 -9 центраціях в інтервалі від 10 Μ до 10 М у концензбирають центрифугуванням при 1500xg протягом трація-залежний спосіб. Для ряду вибраних спо10 хв. Клітини гомогенізують у Трис-НСІ 50мМ за лук, що охоплює більшість різних варіантів допомогою гомогенізатора Ultraturrax та центрифуформули (І), результати досліджень in vitro навегують протягом 10хв. при 23500xg. Осад промивадені у Таблиці 6. ють один раз ресуспендуванням та регомогенізацією і кінцевий осад ресуспендують у Трис-НСІ, Таблиця 6 розділяють на аліквоти 1мл та зберігають при 70°С. Деякі результати експериментів Експерименти зі зв'язування субтипів in vitro (значення рІС50) н.в.: не визначено 2адренергічних рецепторів Сполука № ha2A ha2B ha2C 5-НТТ Мембрани відтаюють та регомогенізують у 1 8,20 8,49 8,96 8,29 буфері для інкубування (гліцилгліцин 25мМ, 3 8,63 8,59 8,73 7,79 рН8,0). У загальному об'ємі 500мкл, 2-10мкг проте8 8,34 8,14 7,92 7,75 3 9 7,99 8,33 6,97 8,80 їну інкубують з [ Н]раувольсцином (NET-722) (New 14 6,37 6,19 6,58 6,44 England Nuclear, USA) (кінцева концентрація 1нМ) 15 7,90 7,84 7,94 7,77 з конкурентним агентом чи без нього протягом 16 8,27 8,21 8,17 8,43 60хв. при 25°С з подальшою швидкою фільтрацією 21 8,79 7,73 8,98 8,92 крізь фільтр GF/B за допомогою харвестера 24 7,86 8,41 8,54 8,26 26 6,28 6,99 6,61 6,17 Filtermatel96 (Packard, Meriden, CT). Фільтри про27 8,39 8,22 8,81 7,74 мивають великою кількістю охолодженого льодом 28 8,11 7,74 7,15 8,36 буфера для промивання (Трис-НСІ, 50мМ, рН7,4). 29 6,33 6,66 6,72 8,26 Зв'язану на фільтрі радіоактивність визначають за 31 6,10 6,20 6,00 6,30 допомогою сцинтиляційного лічильника у пристрої 32 7,90 7,84 7,94 7,77 41 7,80 8,30 7,90 8,50 Topcount (Packard, Meriden, CT) і результати ви43 6,99 7,19 6,86 7,80 ражають в імпульсах за хвилину (срт). Неспецифі45 7,24 7,15 7,36 7,16 чне зв'язування визначають у присутності 1мкМ 47 6,18 6,35 6,07 7,30 оксиметазоліну для h 2A- та h 2B -рецепторів і 48 7,88 8,24 8,36 6,90 54 7,72 7,42 7,44 7,38 1мкМ спіроксатрину для h 2C -рецепторів. 65 7,88 7,74 8,29 8,29 Експерименти зі зв'язування 5-НТ транспор72 7,33 6,75 7,18 8,16 тера 76 7,14 7,05 7,60 8,80 Мембрани тромбоцитів людини (Oceanix 79 6,00 6,00 6,00 6,00 81 6,00 6,00 6,00 6,84 Biosciences Corporation, Hanover, MD, USA) відта90 6,71 6,00 7,04 6,52 юють, розводять буфером (Трис-НСІ 50мМ, 120мМ 97 6,00 6,00 6,00 6,45 NaCl і 5мМ KСl) та швидко (макс. 3с) гомогенізують 57 ПО 125 127 129 143 154 157 181 185 195 196 199 201 217 218 220 224 226 233 234 237 238 239 241 242 243 244 246 250 251 253 257 260 265 266 267 268 271 272 273 211 278 279 280 281 282 283 285 291 296 300 304 309 310 312 314 316 320 323 329 332 333 334 337 340 341 342 343 344 346 348 350 351 355 358 359 361 366 379 380 7,16 7,25 6,85 7,91 7,11 7,27 7,87 6,55 6,84 8,34 7,84 8,92 8,36 8,78 6,74 8,12 6,96 6,85 8,33 8,57 9,11 8,56 9,31 7,78 9,49 8,27 8,42 7,55 8,40 8,43 8,24 7,52 8,61 8,46 7,84 8,49 9,00 8,41 6,50 8,11 8,61 8,49 8,45 7,04 7,05 7,66 7,00 6,22 6,07 6,12 6,46 7,71 7,30 6,67 8,08 7,95 7,98 8,23 8,21 7,70 8,35 8,32 8,57 7,68 9,00 8,44 8,07 8,63 8,45 8,65 8,92 8,39 7,95 8,29 8,83 8,10 7,90 7,89 7,56 7,78 77405 6,95 6,85 6,91 8,01 7,60 7,39 7,28 6,11 7,11 8,80 8,44 9,00 8,49 8,21 6,88 7,85 7,66 7,09 8,20 8,88 8,90 8,62 8,62 8,13 9,44 7,77 8,13 7,90 8,17 8,31 7,94 8,37 8,21 7,68 7,80 7,90 8,26 7,86 7,57 7,68 8,10 8,14 8,03 6,35 7,19 7,26 7,33 6,24 6,00 6,39 6,03 7,23 н.в. н.в. н.в. 8,16 6,76 7,70 н.в. 7,56 н.в. 8,42 н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. 8,16 н.в. н.в. н.в. н.в. н.в. 7,71 8,35 7,46 7,46 7,59 8,17 7,63 7,06 7,13 6,49 7,53 8,68 8,09 8,78 8,34 7,85 5,90 7,36 7,13 6,96 7,94 8,41 8,93 8,59 9,54 8,20 8,97 8,29 8,87 7,86 8,48 8,26 7,98 8,65 8,59 7,56 7,45 8,55 8,05 7,37 6,87 7,51 7,77 8,16 8,24 6,42 7,31 7,64 7,13 6,44 6,00 6,14 6,20 7,19 7,23 7,19 8,20 8,19 6,92 8,17 8,02 7,74 9,22 8,33 8,64 7,88 8,42 8,91 9,79 8,91 8,68 8,91 8,88 8,68 8,19 8,15 8,49 8,46 8,51 8,48 7,39 7,99 7,52 7,87 7,20 8,55 7,62 7,05 7,48 7,63 7,90 8,70 8,41 7,89 8,12 7,27 6,34 7,18 7,31 8,08 7,36 7,71 7,94 8,07 7,85 7,01 7,95 6,75 6,90 7,50 7,09 6,89 6,60 7,46 7,22 7,83 8,88 8,30 8,24 8,53 8,32 7,88 6,97 6,61 7,45 8,09 7,25 8,06 8,89 6,59 6,00 6,06 6,14 7,41 6,41 6,06 7,62 8,06 6,39 7,49 7,82 7,48 7,23 7,52 7,58 7,88 7,64 8,66 7,76 7,43 8,00 8,37 7,75 7,69 8,06 7,87 7,43 7,35 8,38 7,94 7,46 7,63 58 Приклад С2: Експерименти in vivo з визначення антагонізма щодо 2-адренорецептора та інгібуючої активності повторного поглинання серотоніну (5-НТ) А. Медетомідиновий тест Початок та закінчення медетомідиніндукованої (0,10мг/кг, внутрішньовенно (i.v.)) втрати рефлексу випрямлення реєстрували для самців пацюків Wiga, які голодували протягом ночі (200-250г). Інтенсивність втрати рефлексу випрямлення оцінювали у балах: 0= нормальна поведінка, 1= легка атаксія, 2= виражена атаксія, 3= втрата рефлексу випрямлення на період 5хв. За стандартних умов, тестову сполуку чи розчинник вводили (підшкірно (s.c.) чи перорально (р.о.)) за 1год. медетомідину. Критерії індукованого лікарським засобом антагонізму: (1) антагонізм втрати рефлексу випрямлення: тривалість =0хв. (1,4% хибного позитивного контролю; n=74) (2) обернення атаксії: бальний показник
ДивитисяДодаткова інформація
Назва патенту англійськоюIsoxazolines derivatives as antidepressants
Назва патенту російськоюПроизводные изоксазолина в качестве антидепрессантов
МПК / Мітки
МПК: A61K 31/538, C07D 261/20, A61K 31/454, A61P 25/22, A61K 31/495, C07D 498/04, A61P 25/18, C07D 519/00, C07D 498/14, A61P 25/00, A61K 31/496, A61P 25/24, A61P 3/04
Мітки: антидепресанти, похідні, ізоксазоліну
Код посилання
<a href="https://ua.patents.su/30-77405-pokhidni-izoksazolinu-yak-antidepresanti.html" target="_blank" rel="follow" title="База патентів України">Похідні ізоксазоліну як антидепресанти</a>












