Конденсовані гетероцикли та їх застосування
Номер патенту: 81470
Опубліковано: 10.01.2008
Автори: Блок Майкл Говард, Ежутхачан Джайачандран, Лук Річард Вілл'ям, Чжен СяоЛань, Понц Тімоті, Теоклітоу Маріа-Елена, Філла Сандра, Аквіла Брайан, Дейвіс Одрі
Формула / Реферат
1. Сполука, яка має структурну формулу (І):
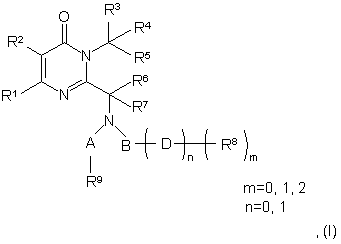
у якій
А являє собою С=О, СН2 або SO2;
В являє собою необов'язково заміщений алкіл, необов'язково заміщений алкеніл, необов'язково заміщений алкініл, необов'язково заміщений арил, необов'язково заміщений циклоалкіл або необов'язково заміщений гетероцикл;
D являє собою О або N, де О є необов'язково заміщеним одним R8, і де N є необов'язково заміщеним одним або більше R8, при цьому n дорівнює 0, a m не дорівнює 0, R8 є безпосередньо приєднаним до В;
R1 і R2 у комбінації утворюють необов'язково заміщений конденсований ізотіазол або необов'язково заміщений конденсований ізоксазол, який є необов'язково заміщеним 1 або 2 замісниками;
R3 є незалежно вибраним з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язково заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу;
R4 і R5 є незалежно вибраними з Н або необов'язково заміщеного алкілу, або R4 і R5 у комбінації утворюють 3-, 4-, 5- або 6-членне кільце, яке може бути необов'язково заміщеним;
R6 і R7 є незалежно вибраними з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язкового заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного гетероциклу, необов'язково заміщеного арилу, або R6 і R7 у комбінації утворюють 3-, 4-, 5- або 6-членне кільце, яке також може бути заміщеним;
R8 є незалежно вибраним з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язково заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу;
R9 є незалежно вибраним з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язково заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу,
або її фармацевтично прийнятна сіль.
2. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій А являє собою С=О або СН2.
3. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій А являє собою С=О.
4. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій В являє собою необов'язково заміщений алкіл або необов'язково заміщений гетероцикл.
5. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій В являє собою необов'язково заміщений С1-4алкіл.
6. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій В являє собою необов'язково заміщений С1-4алкіл, при цьому замісник є незалежно вибраним з -NH2, -ОН, -NCH3, -N(CH3)2, -N-циклопропану, -N-циклобутану, азетидину, піролідину або піперидину.
7. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій D являє собою О, необов'язково заміщений одним або більше R8.
8. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій D являє собою N, необов'язково заміщений одним або більше R8.
9. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R1 і R2 у комбінації утворюють необов'язково заміщений конденсований ізотіазол або необов'язково заміщений конденсований ізоксазол, який є необов'язково заміщеним 1 або 2 замісниками, де вказаний замісник є вибраним із С1-6алкілу або галогену.
10. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R3 являє собою необов'язково заміщений арил.
11. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R3 являє собою необов'язково заміщений С5-7арил.
12. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R3 являє собою необов'язково заміщений С5-7арил, де вказаний замісник є незалежно вибраним з С1-6алкілу, F, Сl, Вr або І.
13. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R4 і R5 являють собою Н.
14. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R6 і R7 є незалежно вибраними з Н або необов'язково заміщеного алкілу.
15. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R6 і R7 є незалежно вибраними з Н або С1-6алкілу.
16. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R8 є незалежно вибраним з Н, необов'язково заміщеного алкілу або необов'язково заміщеного гетероциклу.
17. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R9 є незалежно вибраним з необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу.
18. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R9 є незалежно вибраним з арилу або гетероциклу, кожний з яких є необов'язково заміщеним 1 або 2 замісниками, де вказаний замісник є незалежно вибраним з -С1-6алкілу, -ОС1-6алкілу, F, Сl, Вr, І.
19. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R9 являє собою С5-7арил, необов'язково заміщений 1 або 2 замісниками, де вказаний замісник є незалежно вибраним з -С1-6алкілу, -ОС1-6алкілу, F, Сl, Вr, І.
20. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій:
n дорівнює 1;
А являє собою CO або СН2;
В являє собою необов'язково заміщений С1-6алкіл;
D являє собою N або О;
R1 і R2 у комбінації утворюють конденсований ізотіазол, ізоксазол;
R3 являє собою необов'язково заміщений феніл;
R4 і R5 являють собою Н;
R6 і R7 являють собою Н або необов'язково заміщений алкіл;
R8 являє собою Н або необов'язково заміщений С1-6алкіл;
R9 являє собою необов'язково заміщений феніл.
21. Сполука або її фармацевтично прийнятна сіль формули (І) за пунктом 1, вибрана з:
N-(3-амiнопропіл)-N-{1-[5-(4-фторбензил)-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл]пропіл}-4-метилбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4-бромбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4-хлорбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-3-фтор-4-метилбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-2,3-дихлорбензаміду;
(3-амінопропіл)-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]аміду нафталін-2-карбонової кислоти;
(3-амінопропіл)-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)-пропіл]аміду бензо[b]тіофен-2-карбонової кислоти;
N-азетидин-3-ілметил-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4-метилбензаміду;
N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4-метил-N-піперидин-3-ілметилбензаміду;
N-(2-аміноетил)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4-метилбензаміду;
N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(2-диметиламіноетил)-4-метилбензаміду;
N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(3-диметиламінопропіл)-4-метилбензаміду;
N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-[3-(ізопропіламіно)пропіл]-4-метилбензаміду;
N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-[3-(циклопропіламіно)пропіл]-4-метилбензаміду;
N-(3-азетидин-1-ілпропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4-метилбензаміду;
N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4-метил-N-[3-(3-піролідин-1-іл)пропіл]бензаміду;
N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4-метил-N-[3-(метиламіно)пропіл]бензаміду;
N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(3-гідроксипропіл)-4-метилбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4-метилбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)-2-метилпропіл]-4-метилбензаміду;
N-(3-амінопропіл)-N-{1-[5-(4-фторбензил)-3-метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл]-2-метилпропіл}-4-метилбензаміду;
5-бензил-6-{1-[(3-гідроксипропіл)-(4-метилбензил)аміно]пропіл}-3-метил-5Н-ізотіазол[5,4-d]піримідин-4-ону;
N-(3-амінопропіл)-N-{1-[5-(4-фторбензил)-3-метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл]-2-метилпропіл}-4-метилбензаміду;
N-(3-амінопропіл)-3-фтор-N-{1-[5-(4-фторбензил)-3-метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл]-2-метилпропіл}-4-метилбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)-2-метилпропіл]-3-фтор-4-метилбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)-2-метилпропіл]-4-метилбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)пропіл]-4-метилбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)пропіл]-4-фторбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)пропіл]-2,3-дихлорбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)пропіл]-3-фтор-4-метилбензаміду;
N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)пропіл]-4-метоксибензаміду.
22. Сполука або її фармацевтично прийнятна сіль згідно з будь-яким з пунктів 1-21 для застосування як лікарського засобу.
23. Застосування сполуки або її фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-21, при виробництві лікарського засобу для лікування або профілактики розладів, асоційованих з раком.
24. Спосіб лікування раку, що передбачає введення хазяїнові, який має потребу в такому лікуванні, терапевтично ефективної кількості сполуки або її фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-21.
25. Спосіб профілактичного лікування різних видів раку, що передбачає введення хазяїнові, який має потребу в такому лікуванні, терапевтично ефективної кількості сполуки або її фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-21.
26. Спосіб лікування або профілактики раку, що включає введення терапевтично ефективної кількості сполуки або її фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-21.
27. Спосіб одержання інгібіторного ефекту на клітинний цикл (клітинного антипроліферативного ефекту) у теплокровної тварини, такої як людина, яка потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки або її фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-21.
28. Фармацевтична композиція, яка містить сполуку, як визначено в будь-якому з пунктів 1-21, або її фармацевтично прийнятну сіль разом з принаймні одним фармацевтично прийнятним носієм, розріджувачем або наповнювачем.
Текст
1. Сполука, яка має структурну формулу (І): 2 3 81470 необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу; R4 і R5 є незалежно вибраними з Н або необов'язково заміщеного алкілу, або R4 і R5 у комбінації утворюють 3-, 4-, 5- або 6-членне кільце, яке може бути необов'язково заміщеним; R6 і R7 є незалежно вибраними з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язкового заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного гетероциклу, необов'язково заміщеного арилу, або R6 і R7 у комбінації утворюють 3-, 4-, 5- або 6-членне кільце, яке також може бути заміщеним; R8 є незалежно вибраним з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язково заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу; R9 є незалежно вибраним з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язково заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу, або її фармацевтично прийнятна сіль. 2. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій А являє собою С =О або СН2. 3. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій А являє собою С=О. 4. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій В являє собою необов'язково заміщений алкіл або необов'язково заміщений гетероцикл. 5. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій В являє собою необов'язково заміщений С1-4алкіл. 6. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій В являє собою необов'язково заміщений С 1-4алкіл, при цьому замісник є незалежно вибраним з -NH2, -ОН, NCH3, -N(CH3)2, -N-циклопропану, -N-циклобутану, азетидину, піролідину або піперидину. 7. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій D являє собою О, необов'язково заміщений одним або більше R8. 8. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій D являє собою N, необов'язково заміщений одним або більше R8. 4 9. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R 1 і R2 у комбінації утворюють необов'язково заміщений конденсований ізотіазол або необов'язково заміщений конденсований ізоксазол, який є необов'язково заміщеним 1 або 2 замісниками, де вказаний замісник є вибраним із С1-6алкілу або галогену. 10. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R3 являє собою необов'язково заміщений арил. 11. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R3 являє собою необов'язково заміщений С5-7арил. 12. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R3 являє собою необов'язково заміщений С 5-7арил, де вказаний замісник є незалежно вибраним з С 1-6алкілу, F, Сl, Вr або І. 13. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R4 і R5 являють собою Н. 14. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R 6 і R7 є незалежно вибраними з Н або необов'язково заміщеного алкілу. 15. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R 6 і R7 є незалежно вибраними з Н або С1-6алкілу. 16. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R 8 є незалежно вибраним з Н, необов'язково заміщеного алкілу або необов'язково заміщеного гетероциклу. 17. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R 9 є незалежно вибраним з необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу. 18. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R 9 є незалежно вибраним з арилу або гетероциклу, кожний з яких є необов'язково заміщеним 1 або 2 замісниками, де вказаний замісник є незалежно вибраним з -С16алкілу, -ОС 1-6алкілу, F, Сl, Вr, І. 19. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій R9 являє собою С5-7арил, необов'язково заміщений 1 або 2 замісниками, де вказаний замісник є незалежно вибраним з -С16алкілу, -ОС 1-6алкілу, F, Сl, Вr, І. 20. Сполука або її фармацевтично прийнятна сіль згідно з пунктом 1, у якій: n дорівнює 1; А являє собою CO або СН 2; В являє собою необов'язково заміщений С1-6алкіл; D являє собою N або О; 5 R1 і R2 у комбінації утворюють конденсований ізотіазол, ізоксазол; R3 являє собою необов'язково заміщений феніл; R4 і R5 являють собою Н; R6 і R7 являють собою Н або необов'язково заміщений алкіл; R8 являє собою Н або необов'язково заміщений С1-6алкіл; R9 являє собою необов'язково заміщений феніл. 21. Сполука або її фармацевтично прийнятна сіль формули (І) за пунктом 1, вибрана з: N-(3-амiнопропіл)-N-{1-[5-(4-фторбензил)-3-метил4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл]пропіл}-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4бромбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4хлорбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-3фтор-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]2,3-дихлорбензаміду; (3-амінопропіл)-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]аміду нафталін-2-карбонової кислоти; (3-амінопропіл)-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)-пропіл]аміду бензо[b]тіофен-2-карбонової кислоти; N-азетидин-3-ілметил-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіл]-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4метил-N-піперидин-3-ілметилбензаміду; N-(2-аміноетил)-N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(2диметиламіноетил)-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(3диметиламінопропіл)-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-[3(ізопропіламіно)пропіл]-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-[3(циклопропіламіно)пропіл]-4-метилбензаміду; N-(3-азетидин-1-ілпропіл)-N-[1-(5-бензил-3-метил4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіл]-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4метил-N-[3-(3-піролідин-1-іл)пропіл]бензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4метил-N-[3-(метиламіно)пропіл]бензаміду; 81470 6 N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(3гідроксипропіл)-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)-2метилпропіл]-4-метилбензаміду; N-(3-амінопропіл)-N-{1-[5-(4-фторбензил)-3-метил4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл]-2метилпропіл}-4-метилбензаміду; 5-бензил-6-{1-[(3-гідроксипропіл)-(4метилбензил)аміно]пропіл}-3-метил-5Нізотіазол[5,4-d]піримідин-4-ону; N-(3-амінопропіл)-N-{1-[5-(4-фторбензил)-3-метил4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл]-2метилпропіл}-4-метилбензаміду; N-(3-амінопропіл)-3-фтор-N-{1-[5-(4-фторбензил)3-метил-4-оксо-4,5-дигідроізоксазол[5,4d]піримідин-6-іл]-2-метилпропіл}-4метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)-2метилпропіл]-3-фтор-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)-2метилпропіл]-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)пропіл]-4метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)пропіл]-4фторбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)пропіл]2,3-дихлорбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)пропіл]-3фтор-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)пропіл]-4метоксибензаміду. 22. Сполука або її фармацевтично прийнятна сіль згідно з будь-яким з пунктів 1-21 для застосування як лікарського засобу. 23. Застосування сполуки або її фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-21, при виробництві лікарського засобу для лікування або профілактики розладів, асоційованих з раком. 24. Спосіб лікування раку, що передбачає введення хазяїнові, який має потребу в такому лікуванні, терапевтично ефективної кількості сполуки або її фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-21. 25. Спосіб профілактичного лікування різних видів раку, що передбачає введення хазяїнові, який має потребу в такому лікуванні, терапевтично ефективної кількості сполуки або її 7 81470 фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-21. 26. Спосіб лікування або профілактики раку, що включає введення терапевтично ефективної кількості сполуки або її фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-21. 27. Спосіб одержання інгібіторного ефекту на клітинний цикл (клітинного антипроліферативного ефекту) у теплокровної тварини, такої як людина, Даний винахід стосується нових конденсованих гетероциклів, їх фармацевтичних композицій та способів їх застосування. Крім того, даний винахід стосується терапевтичних способів лікування та запобігання різних форм раку. Один з підкласів протиракових лікарських засобів, які зараз широко використовуються в клінічному лікуванні (таксани, алкалоїди барвінку), спрямований на мікротрубочки та блокує цикл клітинного поділу шля хом втручання в процес формування або розходження мітотичного веретена [дивися Chabner, В.А., R yan, D.P., PazAres, I., Garcia-Carbonero, R., та Calabresi, P. Antineoplastic agents. B: Hardman, J.G., Limbird, L.E. та Gilman, A.G., ред. Goodman and Gilman's The Pharmacological Basis of Therapeutics, 10-е вид., 2001, The MacGraw-Hill Companies, Inc.]. ТаксолÒ (паклітаксел), один з найбільш ефективних лікарських засобів у цьому класі, представляє собою стабілізатор мікротрубочок. Він впливає на процес нормального росту та скорочення мікротрубочок, блокуючи, таким чином, клітину в метафазі мітозу. Блокування мітозу часто супроводжується переходом на наступну фазу клітинного циклу при відсутності належного поділу і, в результаті, апоптозом таких ненормальних клітин [Blagosklonny, M.V. та Fojo, Т.: Molecular effects of paclitaxel: myths and reality (a critical review). Int J Cancer 1999, 83: 151-156]. Деякі побічні ефекти лікування за допомогою паклітакселу являють собою нейтропенію та периферичну нейропатію. Паклітаксел відомий як такий, що викликає неправильне упаковування мікротрубочок в інтерфазних клітинах. Крім того, деякі типи пухлин є несприйнятливими до паклітакселу, а інші п ухлини стають нечутливими під час здійснення лікування. Паклітаксел також є субстратом для нагнітання стійкості до численних лікарських засобів, Р-глікопротеїну [дивися Chabner та ін., 2001]. Таким чином, існує потреба в ефективних антимітотичних агентах, які є більш специфічними та які мають більш слабкі побічні ефекти, ніж лікарські засоби, спрямовані проти мікротрубочок, а також в агентах, які є ефективними проти пухлин, стійких до таксану. Кінезини являють собою велику родину молекулярних рухови х білків, які використовують енергію гідролізу АТФ для пересування східчастим чином уздовж мікротрубочок. Для огляду [дивися 8 яка потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки або її фармацевтично прийнятної солі, як визначено в будь-якому з пунктів 1-21. 28. Фармацевтична композиція, яка містить сполуку, як визначено в будь-якому з пунктів 1-21, або її фармацевтично прийнятну сіль разом з принаймні одним фармацевтично прийнятним носієм, розріджувачем або наповнювачем. Sablin, Ε.P.: Kinesins and microtubules: their structures and motor mechanisms. CurrOpin Cell Biol 2000, 12: 35-41 та Schief, W.R. та Howard, J.: Conformational changes during kinesin motility. Curr Opin Cell Biol 2001, 13: 19-28]. Деякі члени цієї родини транспортують молекулярний вантаж уздовж мікротрубочок до сайтів клітини, де вони потрібні. Наприклад, деякі кінезини зв'язуються з везикулами та транспортують їх на великі відстані уздовж мікротрубочок в аксонах. Деякі члени цієї родини являють собою мітотичні кінезини, оскільки вони відіграють роль у реорганізації мікротрубочок, що забезпечує утворення біполярного мітотичного веретена. Мінус кінці мікротрубочок беруть початок від центросом, або полюсів веретена, у той час, як плюс кінці зв'язуються з кінетохором у центромерній ділянці кожної хромосоми. Таким чином, мітотичне веретено розмежовує хромосоми на стадії метафази мітозу та координує їх рух порізно в індивідуальні дочірні клітини на стадії анафази та телофази (цитокінез). [Дивися Alberts, В., Bray, D., Lewis, J., Raff, M., Roberts, К., та Watson, J. D., Molecular Biology of the Cell, 3-є вид., Розділ 18, The Mechanics of Cell Division, 1994, Garland Publishing, Inc. New York.] HsEg5 (Номер доступу Х85137; [дивися Blangy, Α., Lane HA, d'Heron, P., Harper, M., Kress, M. та Nigg, E.A.: Phosphorylation by p34cdc2 regulates spindle association of human Eg5, a kinesin-related motor essential for bipolar spindle formation in vivo. Cell 1995, 83(7): 1159-1169]), або KSP, являє собою мітотичний кінезин, гомологи якого в багатьох організмах були продемонстровані як такі, що необхідні для відокремлення центросоми в профазі мітозу та для утворення біполярного мітотичного веретена. Для огляду [дивися Kashina, A.S., Rogers, G.C. та Scholey, J.M.: The bim family of kinesins: essential bipolar mitotic motors driving centrosome separation. Biochem Biophys Acta 1997, 1357: 257-271]. Eg5 утворює тетрамерний руховий механізм та, як припускають, він поперечно зв'язує мікротрубочкита бере участь в їх упаковуванні [Walczak, С. Ε., Vernos, I., Mitchison, T. J., Karsenti, E. та Heald, R.: A model for the proposed roles of different microtubule-based motor proteins in establishing spindle bipolarity. Curr Biol 1998, 8: 903-913]. Деякі повідомлення свідчать про те, що інгібування функції Еg5 приводить до блокування метафази, 9 81470 при цьому клітини демонструють монастральні веретена. Нещодавно інгібітор Еg5, названий як монастрол, був ізольований при скринінгу клітин на блокатори мітозу [Ma yer, T.U., Kapoor, Т. М., Haggarty, S.J., King, R.W., Schreiber, S.L. та Mitchison, T.J.: Small molecule inhibitor of mitotic spindle bipolarity identified in a phenotype-based screen. Science 1999, 286: 971-974]. Лікування за допомогою монастролу було продемонстроване як більш специфічне у порівнянні з лікуванням за допомогою важкого ланцюга кінезину, іншого близько спорідненого рухового механізму, що виконує різні функції [Ma yer та ін., 1999]. Монастрол блокує вивільнення АДФ із рухово го механізму Eg5 [Maliga, Z., Кароог, Т. М. та Mitchison, T.J.: Evidence that monastrol is an allosteric inhibitor of the mitotic kinesin Eg5. Chem & Biol 2002, 9: 989-996 та DeBonis, S., Simorre, J.P., Cre vel, L, Lebeau, L, Skoufias, D. Α., Blangy, Α., Ebel, C, Gans, P., Cross, R., Hackney, D. D., Wade, R. H. та Kozielski, F.: Interaction of the mitotic inhibitor monastrol with human kinesin Eg5. Biochemistry 2003, 42: 338-349], що являє собою важливий етап у каталітичному циклі рухових білків кінезину [для огляду дивися Sablin, 2000; Schief та Howard, 2001]. Лікування за допомогою монастролу було також продемонстроване як зворотне, а також як таке, що активує контрольну точку мітотичного веретена та зупиняє розвиток циклу клітинного поділу доти, поки уся ДНК не виявиться викладеною для здійснення прийнятного поділу [Кароог, Т.М., Ma yer, Т. U., Coughlin, M. L. та Mitchison, T.J.: Probing spindle assembly mechanisms with monastrol, a small molecule inhibitor of the mitotic kinesin, Eg5. J Cell Biol 2000, 150(5): 975-988]. Нещодавні повідомлення також свідчать про те, що інгібітори Eg5 приводять до апоптозу оброблених клітин та є ефективними проти деяких пухлинних клітинних ліній, а також для моделей пухлин [Ma yer та ін., 1999]. Незважаючи на те, що Eg5, як припускають, є необхідним для мітозу у всі х клітинх, одне повідомлення свідчить про те, що він понадекспресується в пухлинних клітинaх [міжнародна патентна заявка WO01/31335]. Це дає можливість припустити, що ці клітини є особливо чутливими до його інгібування. Eg5 не є присутнім у мікротрубочках в інтерфазних клітинах та націлюється на мікротрубочки шляхом фосфорилювання на ранній стадії мітозу [Blangy та ін., 1995]. [Дивися також Sawin, Κ. Ε. та Mitchison, T.J.: Mutations in the kinesin-like protein Eg5 disrupting localization to the mitotic spindle. Proc Natl Acad Sci USA 1995, 92(10): 4289-4293]. Таким чином, монастрол не спричинює обумовленого ефекту на розташування мікротрубочок в інтерфазних клітинах [Ma yer та ін., 1999]. Інше повідомлення дає можливість припустити, що Eg5 є залученим у розвиток нейронів у миші, проте він зникає з нейронів незабаром після їх народження і, таким чином, інгібування Eg5 може не викликати периферичної нейропатії, асоційованої з лікуванням за допомогою паклітакселу та інших лікарських засобів, спрямованих проти 10 мікротрубочок [Ferhat, L., Expression of the mitotic motor protein Eg5 in postmitotic neurons: implications for neuronal development. J Neurosci 1998, 18(19): 7822-7835]. У даній заявці ми описуємо ізоляцію класу специфічних та ефективних інгібіторів Eg5, які, як очікується, є корисними при лікуванні неопластичного захворювання. Згідно з даним винаходом заявники відкрили нові сполуки, які мають інгібіторну активністю стосовно клітинного циклу та відповідно до цього є корисними для антипроліферативної активності клітини (такої, як протиракова). Таким чином, вони є цінними в способах лікування захворювань, які мають клітинну проліферативну активність у людини та тварин. Крім того, даний винахід також передбачає фармацевтичні композиції, які містять нові сполуки, а також застосування таких сполук для виробництва лікарських засобів, що мають антипроліферативний клітинний ефект у людини та тварин. Винахід також відноситься до способів одержання вказаних сполук. Даний винахід включає фармацевтично прийнятні солі або пролікарські форми таких сполук. Заявниками відповідно до даного винаходу також запропоновано фармацевтичні композиції та способи для застосування таких композицій при лікуванні раку. Такі властивості, як очікується, є цінними при лікуванні хворобливих станів, асоційованих із клітинним циклом та проліферацією клітин, таких, як різні форми раку (форми солідного раку та лейкемії), фібропроліферативне захворювання та захворювання, пов'язані з диференціацією, псоріаз, ревматоїдний артрит, саркома Капоші, гемангіома, гострі та хронічні нефропатії, атерома, атеросклероз, артеріальний рестеноз, аутоімунні захворювання, гостре та хронічне запалення, захворювання кісток та очні хвороби з проліферацією судин. У першому втіленні даний винахід забезпечує нову сполуку, що має стр уктурн у формулу (І): в якій А являє собою С=О, СН2 або SO2; В являє собою необов'язково заміщений алкіл, необов'язково заміщений алкеніл, необов'язково заміщений алкініл, необов'язково заміщений арил, необов'язково заміщений циклоалкіл або необов'язково заміщений гетероцикл; D являє собою О або N, де О є необов'язково заміщеним одним R8, а N є необов'язково заміщеним одним або більше R8, при цьому n 11 81470 дорівнює 0, a m не дорівнює 0, R8 є безпосередньо приєднаним до В; R1 та R2 у комбінації утворюють конденсоване 5-членне гетероароматичне кільце, яке є необов'язково заміщеним 1 або 2 замісниками, при цьому вказане кільце містить, принаймні, один атом азоту, кисню або сірки, але не більше, ніж 2 атоми кисню або 2 атоми сірки, або 1 атом кисню та 1 атом сірки; R3 є незалежно вибраним з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язково заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу; R4 та R5 є незалежно вибраними з Η або необов'язково заміщеного алкілу, або R4 та R5 у комбінації утворюють 3-, 4-, 5- або 6-членне кільце, яке також може бути необов'язково заміщеним; R6 та R7 є незалежно вибраними з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язкового заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного гетероциклу, необов'язково заміщеного арилу, або R6 та R7 у комбінації утворюють З-, 4-, 5- або 6-членне кільце, яке також може бути заміщеним; R8 є незалежно вибраним з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язково заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу; R9 є незалежно вибраним з Н, необов'язково заміщеного алкілу, необов'язково заміщеного алкенілу, необов'язково заміщеного алкінілу, необов'язково заміщеного циклоалкілу, необов'язково заміщеного циклоалкенілу, необов'язково заміщеного циклоалкінілу, необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де А являє собою С=О або СН2. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де А являє собою С=О. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де В являє собою необов'язково заміщений алкіл або необов'язково заміщений гетероцикл. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де В являє собою необов'язково заміщений С1-4алкіл. 12 В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де В являє собою необов'язково заміщений С 1-4алкіл, в якому такий замісник є незалежно вибраним з -NH2, -ОН, NСН3, -N(CH3)2, -N-циклопропану, -N-циклобутану, азетидину, піролідину або піперидину. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де D являє собою О, необов'язково заміщений одним або більше R8. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де D являє собою N, необов'язково заміщений одним або більше R8. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R1 та R2 у комбінації утворюють конденсоване 5-членне гетероароматичне кільце, яке є необов'язково заміщеним 1 або 2 замісниками, при цьому вказане кільце має один атом азоту та один атом сірки або один атом азоту та один атом кисню. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R1 та R2 у комбінації утворюють необов'язково заміщений конденсований ізотіазол або необов'язково заміщений конденсований ізоксазол. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R1 та R2 у комбінації утворюють конденсоване 5-членне гетероароматичне кільце, яке є необов'язково заміщеним 1 або 2 замісниками, при цьому вказане кільце містить один атом азоту та один атом сірки або один атом азоту та один атом кисню, а вказаний замісник є вибраним з С 1-6алкілу або галогену. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R3 є необов'язково заміщеним арилом. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R3 є необов'язково заміщеним С5-7арилом. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R3 є необов'язково заміщеним С5-7арилом, при цьому вказаний замісник є незалежно вибраним з С1-6алкілу, F, СІ, Br або І. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R4 та R5 являють собою Н. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R6 та R7 є незалежно вибраними з Η або необов'язково заміщеного алкілу. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R6 та R7 є незалежно вибраними з Η або С1-6алкілу. 13 81470 В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R8 є незалежно вибраним з Н, необов'язково заміщеного алкілу або необов'язково заміщеного гетероциклу. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R9 є незалежно вибраним з необов'язково заміщеного арилу або необов'язково заміщеного гетероциклу. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R9 є незалежно вибраним з арилу або гетероциклу, кожний з яких є необов'язково заміщеним 1 або 2 замісниками, де вказаний замісник є незалежно вибраним з -С16алкілу , -ОС 1-6алкілу, F, СІ, Br, І. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, де R9 являє собою С5-7aрил, необов'язково заміщений 1 або 2 замісниками, де вказаний замісник є незалежно вибраним з -С16алкілу, -ОС 1-6алкілу, F, СІ, Br, І. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, в якій: n дорівнює 0 А являє собою СО або СН 2; В являє собою необов'язково заміщений С 16алкіл; R1 та R2 у комбінації утворюють конденсований 5-членний гетероарил; R3 являє собою необов'язково заміщений С 57арил. R4 та R5 являють собою Н; R6 та R7 є незалежно вибраними з Η або необов'язково заміщеного алкілу; R9 являє собою необов'язково заміщений арил або необов'язково заміщений гетероцикл. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, в якій: n дорівнює 0 А являє собою СО або СH2; В являє собою необов'язково заміщений С 16алкіл, необов'язково заміщений однієї з наступних груп: -NH2, -OH, -NCH3, -N(CH3)2, -N-циклопропан, Ν циклобутан, азетидин, піролідин або піперидин. R1 та R2 у комбінації утворюють конденсоване 5-членне гетероароматичне кільце, яке є необов'язково заміщеним 1 або 2 замісниками, при цьому вказане кільце містить один атом азоту та один атом сірки або один атом азоту та один атом кисню. R3 являє собою необов'язково заміщений феніл; R4 та R5 являють собою Н; R6 та R7 є незалежно вибраними з Η або необов'язково заміщеного С1-6алкілу; R9 являє собою необов'язково заміщений арил. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, в якій: n дорівнює 0 14 А являє собою CO; В являє собою С 1-6алкіл, необов'язково заміщений однієї з наступних гр уп: -NH2, -OH, NCH3, -N(CH3)2, -N-циклопропан, -Ν циклобутан, азетидин, піролідин або піперидин. R1 та R2 у комбінації утворюють конденсоване 5-членне гетероароматичне кільце, яке є необов'язково заміщеним 1 або 2 замісниками, при цьому вказане кільце містить один атом азоту та один атом сірки або один атом азоту та один атом кисню, та де вказаний замісник є вибраним з С 16алкілу або галогену. R3 є необов'язково заміщеним С 5-7арилом, де вказаний замісник є незалежно вибраним з С 16алкілу, F, СІ, Br або І. R4 та R5 являють собою Н; R6 та R7 є незалежно вибраними з Η або -С16алкілу; R9 являє собою С5-7арил, необов'язково заміщений 1 або 2 замісниками, де вказаний замісник є незалежно вибраним з -С1-6алкілу, -ОС16алкілу, F, СІ, Br, І. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, в якій: n дорівнює 1 А являє собою СО або СН 2; В являє собою необов'язково заміщений С 16алкіл, D являє собою N або О; R1 та R2 у комбінації утворюють конденсований 5-членний гетероарил; R3 являє собою необов'язково заміщений арил; R4 та R5 являють собою Н; R5 та R7 являють собою Η або необов'язково заміщений алкіл; R8 являють собою Η або необов'язково заміщений С1-6алкіл; R9 являє собою необов'язково заміщений арил. В окремому втіленні даний винахід забезпечує сполуку, що має структурн у формулу (І), як представлено вище, в якій: n дорівнює 1 А являє собою СО або СН 2; В являє собою необов'язково заміщений С 16алкіл, D являє собою N або О; R1 та R2 у комбінації утворюють конденсований ізотіазол, ізоксазол; R3 являє собою необов'язково заміщений феніл; R4 та R5 являють собою Н; R6 та R7 являють собою Η або необов'язково заміщений алкіл; R8 являє собою Η або необов'язково заміщений С1-6алкіл; R9 являє собою необов'язково заміщений феніл. В окремому втіленні даний винахід забезпечує сполуку, що має структурну формулу (І), вибрану з: 15 N-(3-амінопропіл)-N-{1-[5-(4-фторбензил)-3метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин6-іл]пропіл}-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіл]-4-бромбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіл]-4-хлорбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіл]-3-фтор-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіл]-2,3-дихлорбензаміду; (3-амінопропіл)-[1-(5-бензил-3-метил-4-оксо4,5-дипдроізотіазол[5,4-сі]піримідин-6іл)пропіл]амідунафталін-2-карбоновоїкислоти; (3-амінопропіл)-[1-(5-бензил-3-метил-4-оксо4,5-дигідроізотіазол[5,4-сІ]піримідин-6іл)пропіл]аміду бензо[b]тіофен-2карбоновоїкислоти; N-азетидин-3-ілметил-N-[1-(5-бензил-3-метил4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіл]-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4метил-N-піперидин-3-ілметилбензаміду; N-(2-аміноетил)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіл]-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(2диметиламіноетил)-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(3диметиламінопропіл)-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-[3(ізопропіламіно)пропіл]-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-[3(циклопропіламіно)пропіл]-4-метилбензаміду; N-(3-азетидин-1-ілпропіл)-N-[1-(5-бензил-3метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин6-іл)пропіл]-4-метилбензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4метил-N-[3-(3-піролідин-1-ілпропіл)бензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4метил-N-[3-(метиламіно)пропіл]бензаміду; N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(3гідроксипропіл)-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіл]-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)-2метилпропіл]-4-метилбензаміду; N-(3-амінопропіл)-N-{1-[5-(4-фторбензил)-3метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин6-іл]-2-метилпропіл}-4-метилбензаміду; 81470 16 5-бензил-6-{1-[(3-гідроксипропіл)-(4метилбензил)аміно]пропіл}-3-метил-5Нізотіазол[5,4-d]піримідин-4-ону; N-(3-амінопропіл)-N-{1-[5-(4-фторбензил)-3метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин6-іл]-2-метилпропіл}-4-метилбензаміду; N-(3-амінопропіл)-3-фтор-N-{1-[5-(4фторбензил)-3-метил-4-оксо-4,5дигідроізоксазол[5,4-d]піримідин-6-іл]-2метилпропіл}-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)-2метилпропіл]-3-фтор-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)-2метилпропіл]-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6іл)пропіл]-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6іл)пропіл]-4-фторбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6іл)пропіл]-2,3-дихлорбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6іл)пропіл]-3-фтор-4-метилбензаміду; N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6іл)пропіл]-4-метоксибензаміду. В окремому втіленні даний винахід забезпечує сполуку відповідно до будь-якого з пунктів 1-27 для застосування як лікарського засобу. В окремому втіленні даний винахід забезпечує застосування сполуки, як визначено у будь-якому з пунктів 1-27, при виробництві лікарського засобу для лікування або профілактики захворювань, асоційованих з раком. В окремому втіленні даний винахід забезпечує спосіб лікування раку, що включає введення хазяїну, що має потребу в такому лікуванні, терапевтично ефективної кількості сполуки, як визначено в будь-якому з пунктів 1-27. В окремому втіленні даний винахід забезпечує спосіб профілактичного лікування різних видів раку, що включає введення хазяїну, який має потребу в такому лікуванні, терапевтично ефективної кількості сполуки, як визначено в будьякому з пунктів 1-27. В окремому втіленні даний винахід забезпечує спосіб лікування або профілактики раку, що включає введення хазяїну, що має потребу в такому лікуванні, терапевтично ефективної кількості сполуки, як визначено в будь-якому з пунктів 1-27, або її фармацевтично прийнятної солі, як заявлено в будь-якому з пунктів 1-27. В окремому втіленні даний винахід забезпечує спосіб одержання інгібіторного впливу на клітинний цикл (клітинний антипроліферативний ефект) у теплокровної тварини, такої, як людина, яка має потребу в такому лікуванні, що включає введення вказаній тварині ефективної кількості сполуки, як заявлено в будь-якому з пунктів 1-27. 17 81470 В окремому втіленні даний винахід забезпечує фармацевтичну композицію, що включає сполуку, як визначено в будь-якому з пунктів 1-27, або її фармацевтично прийнятну сіль, або її складний ефір, який гідролізується в умовах in vivo, разом з, принаймні, одним фармацевтично прийнятним носієм, розріджувачем або наповнювачем. В окремому втіленні даний винахід забезпечує спосіб одержання сполуки структурної формули (І), як заявлено в пункті 1, або її фармацевтично прийнятної солі, або її складного ефіру, який гідролізується в умовах in vi vo, де вказаний спосіб включає: Визначення Визначення, представлені в даному розділі, призначені для роз'яснення термінів, які використовуються в даній заявці. Термін «у даній заявці» означає повну заявку. Якщо не вказане інше в даному описі, то номенклатура, використовувана в цьому описі, у загальному випадку відповідає правилам та прикладам, встановленим в [Nomenclature of Organic Chemistry, Розділи А, В, С, D, E, F та Н, Pergamon Press, Oxford, 1979], що введений в дану заявку як посилання для надання прикладів назв хімічних структур та правил для назви хімічних стр уктур. Термін «Cm-n» або «Cm-n група», що використовується самостійно або як префікс, відноситься до будь-якої групи, яка містить від m до n атомів вуглецю. Наприклад, С1-6 означає 1, 2, 3, 4, 5 або 6 атомів вуглецю. Термін «вуглеводень», що використовується самостійно або як суфікс або префікс, відноситься до будь-якої структури, яка містить тільки атоми вуглецю та водню, аж до 14 атомів вуглецю. Термін «вуглеводневий радикал» або «гідрокарбіл», який використовується самостійно або як суфікс або префікс, відноситься до будьякої структури, отриманої в результаті видалення одного або більше воднів з вуглеводню. Термін «алкіл», що використовується самостійно або як суфікс або префікс, відноситься до моновалентних вуглеводневих радикалів з нерозгалуженим або розгалуженим ланцюгом, що включають від 1 до приблизно 12 атомів вуглецю. Якщо не вказане 18 інше, то «алкіл» у загальному випадку включає як насичений алкіл, так і ненасичений алкіл. Термін «алкілен», що використовується самостійно або як суфікс або префікс, відноситься до дивалентних вуглеводневих радикалів з нерозгалуженим або розгалуженим ланцюгом, який включає від 1 до приблизно 12 атомів вуглецю, що служить для зв'язування двох структур разом. Термін «алкеніл», що використовується самостійно або як суфікс або префікс, відноситься до моновалентного вуглеводневого радикалу з нерозгалуженим або розгалуженим ланцюгом, який містить, принаймні, один подвійний зв'язок вуглець-вуглець та включає, принаймні, від 2 аж до приблизно 12 атомів вуглецю. Термін «алкініл», що використовується самостійно або як суфікс або префікс, відноситься до моновалентного вуглеводневого радикалу з нерозгалуженим або розгалуженим ланцюгом, який містить, принаймні, один потрійний зв'язок вуглець-вуглець та включає, принаймні, від 2 аж до приблизно 12 атомів вуглецю. Термін «циклоалкіл», що використовується самостійно або як суфікс або префікс, відноситься до моновалентного вуглеводневого радикалу, який містить кільце, яке включає від, принаймні, 3 аж до приблизно 12 атомів вуглецю. Термін «циклоалкеніл», що використовується самостійно або як суфікс або префікс, відноситься до моновалентного вуглеводневого радикалу, який містить кільце, яке включає, принаймні, один подвійний зв'язок вуглець-вуглець, та який містить, принаймні, від 3 аж до приблизно 12 атомів вуглецю. Термін «циклоалкініл», що використовується самостійно або як суфікс або префікс, відноситься до моновалентного вуглеводневого радикалу, що містить кільце, яке включає, принаймні, один потрійний зв'язок вуглець-вуглець, та який містить від приблизно 7 аж до приблизно 12 атомів вуглецю. Термін «арил», що використовується самостійно або як суфікс або префікс, відноситься до вуглеводневого радикалу, який містить одне або більше поліненасичених вуглецевих кілець, що мають ароматичний характер (наприклад, 4n+2 делокалізованих електрони), та включає від 5 аж до приблизно 14 атомів вуглецю, при цьому радикал розташований на атомі вуглецю ароматичного кільця. Термін «неароматична група» або «неароматичний», що використовується самостійно або як суфікс або префікс, відноситься до хімічної групи або радикалу, які не містять кільця, що має ароматичний характер (наприклад, 4n+2 делокалізованих електрони). Термін «арилен», що використовується самостійно або як суфікс або префікс, відноситься до дивалентного вуглеводневого радикалу, який містить одне або більше поліненасичених вуглецевих кілець, що мають ароматичний характер (наприклад, 4n+2 делокалізованих електрони), та включає від 5 аж до приблизно 14 19 81470 атомів вуглецю, що служить для зв'язування двох структур разом. Термін «гетероцикл», що використовується самостійно або як суфікс або префікс, відноситься до структури або молекули, які містять кільце, та включають один або більше мультивалентних гетероатомів, незалежно вибраних з Ν, Ο, Ρ та S, що являють собою частину кільцевої структури, при цьому він містить, принаймні, від 3 аж до приблизно 20 атомів у кільці (кільцях). Гетероцикл може бути насиченим або ненасиченим, таким, що містить один або більше подвійних зв'язків, при цьому гетероцикл може містити більше, ніж одне кільце. Коли гетероцикл містить більше, ніж одне кільце, кільця можуть бути конденсованими або неконденсованими. Термін «конденсовані кільця» у загальному випадку відноситься, принаймні, до двох кілець, які розділяють між собою два атоми. Гетероцикл може мати ароматичний характер або може не мати ароматичного характеру. Термін «гетероалкіл», що використовується самостійно або як суфікс або префікс, відноситься до радикалу, одержаному в результаті заміни одного або більше атомів вуглецю алкілу одним або більше гетероатомами, вибраними з N, О, Ρ та S. Термін «гетероароматичний», що використовується самостійно або як суфікс або префікс, відноситься до структури або молекули, які містять кільце, та включають один або більше мультивалентних гетероатомів, незалежно вибраних з Ν, Ο, Ρ та S, як частини кільцевої структури, при цьому він містить від 3 аж до приблизно 20 атомів у кільці (кільцях), де структура або молекула, що містить кільце, носить ароматичний характер (наприклад, 4n+2 делокалізованих електрони). Термін «гетероциклічна група», «гетероциклічний залишок», «гетероциклічний» або «гетероцикло», що використовується самостійно або як суфікс або префікс, відноситься до радикалу, який має походження від гетероциклу шляхом видалення з нього одного або більше воднів. Термін «гетероцикл», що використовується самостійно або як суфікс або префікс, відноситься до радикалу, який має походження від гетероциклу шляхом видалення одного водню з кільця гетероциклу. Термін «гетероциклєєн», що використовується самостійно або як суфікс або префікс, відноситься до дивалентного радикалу, що має походження від гетероциклу шляхом видалення з нього двох воднів, який служить для зв'язування двох структур разом. Термін «гетероарил», що використовується самостійно або як суфікс або префікс, відноситься до гетероциклу, який має ароматичний характер, при цьому радикал гетероциклу розташований при вуглеці ароматичного кільця гетероциклу. Термін «гетероциклоалкіл», що використовується самостійно або як суфікс або префікс, відноситься до гетероциклу, що не має ароматичного характеру. 20 Термін «гетероарилен», що використовується самостійно або як суфікс або префікс, відноситься до гетероциклілену, що має ароматичний характер. Термін «гетероциклоалкілен», що використовується самостійно або як суфікс або префікса, відноситься до гетероциклілену, що не має ароматичного характеру. Термін «шестичленний», що використовується як префікс, стосується групи, що містить кільце, яке включає шість кільцевих атомів. Термін «п'ятичленний», що використовується як префікс, відноситься до групи, що містить кільце, яке включає п'ять кільцевих атомів. Гетероарил з п'ятичленним кільцем являє собою гетероарил з кільцем, що включає п'ять кільцевих атомів, при цьому 1, 2 або 3 кільцевих атоми є незалежно вибраними з Ν, Ο та S. Приклади п'ятичленних гетероарилів являють собою тієніл, фурил, піроліл, імідазоліл, тіазоліл, оксазоліл, піразоліл, ізотіазоліл, ізоксазоліл, 1,2,3триазоліл, тетразоліл, 1,2,3-тіадіазоліл, 1,2,3оксадіазоліл, 1,2,4-триазоліл, 1,2,4-тіадіазоліл, 1,2,4-оксадіазоліл, 1,3,4-триазоліл, 1,3,4тіадіазоліл та 1,3,4-оксадіазоліл. Гетероарил із шестичленним кільцем являє собою гетероарил, що включає шість кільцевих атомів, при цьому 1, 2 або 3 кільцевих атоми є незалежно вибраними з Ν, Ο та S. Приклади шестичленних гетероарилів являють собою піридил, піразиніл, піримідиніл, триазиніл та піридазиніл. Як використовується в даній заявці, термін «необов'язково заміщений» означає, що заміщення є необов'язковим та, таким чином, для вказаного атома або молекули є можливим бути незаміщеними. У випадку, коли заміщення є бажаним, таке заміщення означає, що будь-яка кількість воднів вказаного атома може бути замінена за допомогою вибору із вказаної групи, за умови, що нормальна валентність вказаного атома не перевищується, та що заміщення приводить до одержання стабільної сполуки. Наприклад, коли замісник являє собою кето (тобто, =О), то 2 водні при атомі можуть бути замінені. Якщо вибір не забезпечується, то замісник буде вибраний з: -ОС1-6алкілу, -С1-6алкілу, F, СІ, Br, І, N, О, S, Ρ -ΝΗ2, -ОН, -NCH3, -N(CH3)2, N-циклопропану, -Ν циклобутану, азетидину, піролідину, піперидину. Приклади хімічних гр уп, що містять один або більше гетероатомів, включають гетероцикл, -ΝΟ2, -OR, -CF3, -C(=O)R, -C(=O)OH, SH, -NHR, -NR2, -SR, -SO3H, -SO2R, -S(=O)R, -CN, C(=O)OR, -C(=O)NR 2, -NRC(=O)R, оксо (=O), іміно (=NR), тіо (=S), та оксіміно (=N-OR), при цьому кожний «R» являє собою С1-12гідрокарбіл. Наприклад, заміщений феніл може відноситься до нітрофенілу, піридилфенілу, метоксифенілу, хлорфенілу, амінофенілу, і т.д., при цьому групи нітро, піридилу, метокси, хлору, та аміно можуть бути замінені будь-яким прийнятним воднем у фенільному кільці. Термін «заміщений», що використовується як суфікс першої структури, молекули або групи, що вживаються за однією або більше назвами 21 81470 хімічних груп, відноситься до другої структури, молекули або групи, яка отримана в результаті заміни одного або більше воднів першої структури, молекули або групи однієї або більше названими хімічними групами. Наприклад, «феніл, заміщений нітро» відноситься до нітрофенілу. Гетероцикл включає, наприклад, моноциклічні гетероцикли, такі, як азиридин, оксиран, тііран, азетидин, оксетан, тієтан, піролідин, піролін, імідазолідин, піразолідин, піразолін, діоксолан, сульфолан, 2,3-дигідрофуран, 2,5-дигідрофуран, тетрагідрофуран, тіофан, піперидин, 1,2,3,6тетрагідропіридин, піперазин, морфолін, тіоморфолін, піран, тіопіран, 2,3-дигідропіран, тетрагідропіран, 1,4-дигідропіридин, 1,4-діоксан, 1,3-діоксан, діоксан, гомопіперидин, 2,3,4,7тетрагідро-1H-азепін, гомопіперазин, 1,3діоксепан, 4,7-дигідро-1,3-діоксепін, та гексаметиленоксид. Крім того, гетероцикл включає ароматичні гетероцикли, наприклад, піридин, піразин, піримідин, піридазин, тіофен, фуран, фуразан, пірол, імідазол, тіазол, оксазол, піразол, ізотіазол, ізоксазол, 1,2,3-триазол, тетразол, 1,2,3-тіадіазол, 1,2,3-оксадіазол, 1,2,4-триазол, 1,2,4-тіадіазол, 1,2,4-оксадіазол, 1,3,4-триазол, 1,3,4-тіадіазол та 1,3,4-оксадіазол. Крім того, гетероцикл охоплює поліциклічні гетероцикли, наприклад, індол, індолін, ізоіндолін, хінолін, тетрагідрохінолін, ізохінолін, тетрагідроізохінолін, 1,4-бензодіоксан, кумарин, дигідрокумарин, бензофуран, 2,3дигідробензофуран, ізобензофуран, хромен, хроман, ізохроман, ксантен, феноксантіїн, тіантрен, індолізин, ізоіндол, індазол, пурин, фталазин, нафтиридин, хіноксалін, хіназолін, цинолін, птеридин, фенантридин, перимідин, фенантролін, феназин, фенотіазин, феноксазин, 1,2-бензізоксазол, бензотіофен, бензоксазол, бензтіазол, бензімідазол, бензтриазол, тіоксантин, карбазол, карболін, акридин, піролізидин та хінолізидин. У доповнення до поліциклічних гетероциклів, описаних вище, гетероцикли включають поліциклічні гетероцикли, в яких кільце конденсації між двома або більше кільцями включає більше, ніж один зв'язок, спільний з обома кільцями, та більше, ніж два атоми, спільні з обома кільцями. Приклади таких з'єднаних містком гетероциклів включають хінуклідин, діазабіцикло[2.2.1]гептан та 7-оксабіцикло[2.2.1 ]гептан. Гетероцикл включає, наприклад, моноциклічні гетероцикли, такі, як: азиридиніл, оксираніл, тіїраніл, азетидиніл, оксетаніл, тієтаніл, піролідиніл, піролініл,імідазолідиніл, піразолідиніл, піразолініл, діоксаланіл, сульфоланіл, 2,3-дигідрофураніл, 2,5дигідрофураніл, тетрагідрофураніл, тіофаніл, піперидиніл, 1,2,3,6-тетрагідропіридиніл, піперазиніл, морфолініл, тіоморфолініл, піраніл, тіопіраніл, 2,3-дигідропіраніл, тетрагідропіраніл, 1,4-дигідропіридиніл, 1,4-діоксаніл, 1,3-діоксаніл, діоксаніл, гомопіперидиніл, 2,3,4,7-тетрагідро-1Hазепініл, гомопіперазиніл, 1,3-діоксепаніл, 4,7дигідро-1,3-діоксепініл, та гексаметиленоксидил. 22 Крім того, гетероцикл включає ароматичні гетероцикли або гетероарил, наприклад, піридиніл, піразиніл, піримідиніл, піридазиніл, тієніл, фурил, фуразаніл, піроліл, імідазоліл, тіазоліл, оксазоліл, піразоліл, ізотіазоліл, ізоксазоліл, 1,2,3-триазоліл, тетразоліл, 1,2,3тіадіазоліл, 1,2,3-оксадіазоліл, 1,2,4-триазоліл, 1,2,4-тіадіазоліл, 1,2,4-оксадіазоліл, 1,3,4триазоліл, 1,3,4-тіадіазоліл та 1,3,4-оксадіазоліл. Крім того, гетероцикл охоплює поліциклічні гетероцикли (включаючи, як ароматичний, так і неароматичний), наприклад, індоліл, індолініл, ізоіндолініл, хінолініл, тетрагідрохінолініл, ізохінолініл, тетрагідроізохінолініл, 1,4бензодіоксаніл, кумариніл, дигідрокумариніл, бензофураніл, 2,3-дигідробензофураніл, ізобензофураніл, хроменіл, хроманіл, ізохроманіл, ксантеніл, феноксатіїніл, тіантреніл, індолізиніл, ізоіндоліл, індазоліл, пуриніл, фталазиніл, нафтиридиніл, хіноксалініл, хіназолініл, цинолініл, птеридиніл, фенантридиніл, перимідиніл, фенантролініл, феназиніл, фенотіазиніл, феноксазиніл, 1,2-бензізоксазоліл, бензотіофеніл, бензоксазоліл, бензтіазоліл, бензімідазоліл, бензтриазоліл, тіоксантиніл, карбазоліл, карболініл, акридиніл, піролізидиніл та хінолізидиніл. У доповнення до поліциклічних гетероциклів, описаних вище, гетероцикл включає поліциклічні гетероцикли, у яких кільце злиття між двома або більше кільцями включає більше, ніж один зв'язок, спільний з обома кільцями, та більше, ніж два атоми, спільні з обома кільцями. Приклади таких зв'язаних містком гетероциклів, включають хінуклідиніл, діазабіцикло[2.2.1]гептил; та 7оксабіцикло[2.2.1]гептил. Термін «алкокси», що використовується самостійно або як суфікс або префікс, відноситься до радикалів загальної формули -O-R, в якій -R є вибраним з вуглеводневого радикалу. Приклади алкокси включають метокси, етокси, пропокси, ізопропокси, бутокси, т-бутокси, ізобутокси, циклопропілметокси, алілокси та пропаргілокси. Термін «арилокси», що використовується самостійно або як суфікс або префікс, відноситься до радикалів загальної формули -О-Аr, в якій -Аr являє собою арил. Термін «гетероарилокси», що використовується самостійно або як суфікс або префікс, відноситься до радикалів загальної формули -О-Аr', в якій -Аr' являє собою гетероарил. Термін «амін» або «аміно», що використовується самостійно або як суфікс або префікс, відноситься до радикалів загальної формули -NRR', в якій R та R' є незалежно вибраними з водню або вуглеводневого радикалу. «Ацил», що використовується самостійно або як суфікс або префікс, означає -C(=O)-R, де -R являє собою необов'язково заміщений гідрокарбіл, водень, аміно або алкокси. Ацильні групи включають, наприклад, ацетил, пропіоніл, бензоїл, фенілацетил, карбоетокси, та диметилкарбамоїл. Галоген включає фтор, хлор, бром та йод. 23 81470 «Галогенований», що використовується як префікс групи, означає, що один або більше воднів групи замінені одним або більше галогенами. «КТ» або «кт» означає кімнатну температуру. Перша кільцева група, що є «конденсованою» із другою кільцевою групою, означає, що перше кільце та друге кільце розділяють між собою, принаймні, два атоми, що перебувають між ними. «Зв'язок», «зв'язаний» або «сполучений», якщо не вказане інше, означає ковалентне зчеплення або зв'язування. Коли перша група, структура або атом є «безпосередньо зв'язаною» із другою групою, структурою або атомом, принаймні, один атом першої групи, структури або атома утворює хімічний зв'язок з, принаймні, одним атомом другої групи, стр уктури або атома. «Насичений вуглець» означає атом вуглецю в структурі, молекулі або групі, в якому всі зв'язки, що відносяться до цього атома вуглецю, є одинарними зв'язками. Інакше кажучи, не міститься жодного подвійного або потрійного зв'язку, що відноситься до цього атома вуглецю, при цьому цей вуглецевий атом у загальному випадку набуває sp3 атомну орбітальну гібридизацію. «Ненасичений вуглець» означає атом вуглецю в структурі, молекулі або групі, у якому, принаймні, один зв'язок, що відноситься до цього вуглецевого атома, не є одинарним зв'язком. Інакше кажучи, існує, принаймні, один подвійний або потрійний зв'язок, що відноситься до цього атома вуглецю, при цьому цей вуглецевий атом у загальному випадку набуває sp або sp2 атомну орбітальну гібридизацію. Коли яка-небудь змінна (наприклад, R1, R4, Ra, e R і т.д.) зустрічається більше, ніж один раз, у будь-якій складовій частині або формулі сполуки, її визначення в кожному випадку є незалежним від її визначення в кожному іншому випадку. Таким чином, наприклад, якщо група представлена як заміщена за допомогою 0-3 R1, то вказана група може бути необов'язково заміщеною за допомогою 0, 1, 2 або 3 R1 груп, a Re у кожному випадку вибирається незалежно з визначення Re. Крім того, комбінації замісників та/або змінних є припустимими тільки, якщо такі комбінації приводять до утворення стабільних сполук. Різноманітність сполук відповідно до представленого винаходу може існувати в окремій геометричній або стереоізомерній формах. Даний винахід приймає до уваги всі такі сполуки, включаючи цис- та трансізомери, R- та Sенантіомери, діастереомери, (О)-ізомери, (L)ізомери, їх рацемічні суміші, а також інші їх суміші, при цьому всі вони охоплюються об'ємом даного винаходу. Додаткові асиметричні атоми вуглецю можуть бути присутнім у заміснику, такому, як алкільна група. Всі такі ізомери, а також їх суміші, призначені для включення в даний винахід. Описані в даній заявці сполуки можуть мати асиметричні центри. Сполуки відповідно до даного винаходу, що містять асиметрично заміщений атом, можуть бути ізольовані в оптично активній або рацемічній формах. В галузі техніки добре 24 відомо, як одержати оптично активні форми, наприклад, за допомогою розділення рацемічних форм або за допомогою синтезу з оптично активних вихідних матеріалів. Якщо це є необхідним, то розділення рацемічного матеріалу може бути досягнуте за допомогою способів, які відомі з рівня техніки. Безліч геометричних ізомерів олефінів, C=N подвійні зв'язки, тощо також можуть бути присутнім у сполуках, описаних у даній заявці, всі такі стабільні ізомери охоплюються даним винаходом. Описані також цис та транс геометричні ізомери сполук відповідно до даного винаходу, вони можуть бути ізольовані як суміші ізомерів або як розділені ізомерні форми. Всі хіральні, діастереомерні, рацемічні форми та всі геометричні ізомерні форми структури також передбачаються, якщо спеціально не вказана специфічна стереохімія або ізомерна форма. У випадку, коли зв'язок із замісником представлений як такий, що перетинає зв'язок, який з'єднує два атоми в кільці, то такий замісник може бути зв'язаний з будь-яким атомом кільця. Коли замісник наведений без вказівки атома, за допомогою якого такий замісник зв'язаний з іншою частиною сполуки даної формули, то такий замісник може бути зв'язаний через будь-який атом у такому заміснику. Комбінації замісників та/або змінних є припустимими тільки тоді, коли такі комбінації приводять до утворення стабільних сполук. Як такий, що використовується в даній заявці, термін «фармацевтично прийнятний» використовується стосовно тих сполук, матеріалів, композицій та/або дозованих форм, які перебувають у межах установлених медичних вимог, є прийнятними для застосування в контакті із тканинами людського організму та тварин без надлишкової токсичності, подразнення, алергічної реакції або інших проблем або ускладнень, при прийнятному співвідношенні переваги та ризику. Як такий, що використовується в даній заявці, термін «фармацевтично прийнятні солі» відноситься до похідних розкритих сполук, де вихідна сполука модифікована шляхом створення її солі кислоти або основи. Приклади фармацевтично прийнятних солей включають без обмеження солі мінеральних або органічних кислот основних залишків, таких, як аміни; солі лужних металів або органічних основ кислотних залишків, таких, як карбонові кислоти; тощо. Фармацевтично прийнятні солі включають традиційні нетоксичні солі або четвертинні амонійні солі вихідної сполуки, утворені, наприклад, з нетоксичних неорганічних або органічних кислот. Наприклад, такі традиційні нетоксичні солі включають ті, що мають походження від неорганічних кислот, таких, як хлористоводнева, бромистоводнева, сірчана, сульфамінова, фосфорна, азотна тощо; та солі, отримані з органічних кислот, таких, як оцтова, пропіонова, бурштинова, гліколева, стеаринова, молочна, малеїнова, винна, лимонна, аскорбінова, пальмітинова, малеїнова, гідроксималеїнова, фенілоцтова, глутамінова, бензойна, саліцилова, 25 81470 сульфанілова, 2-ацетоксибензойна, фумарова, толуолсульфонова, метансульфонова, етандисульфонова, щавлева, ізетіонова тощо. Фармацевтично прийнятні солі відповідно до даного винаходу можуть бути синтезовані з вихідної сполуки, яка містить основний або кислотний залишок, за допомогою традиційних хімічних способів. У загальному випадку такі солі можуть бути отримані шляхом реакції форм вільної кислоти або основи цих сполук зі стехіометричною кількістю прийнятної основи або кислоти у воді або в органічному розчиннику, або в суміші обох: у загальному випадку кращими є неводні середовища типу простого ефіру, етилацетату, етанолу, ізопропанолу або ацетонітрилу. Список прийнятних солей можна знайти в [Remington's Pharmaceutical Sciences, 17е вид., Mack Publishing Company, Easton, Pa., 1985, cтop.1418] розкриття якого введене в дану заявку як посилання. Термін «пролікарські форми» призначений для включення будь-яких ковалентно зв'язаних носіїв, які вивільняють активний вихідний лікарський засіб відповідно до формули (І) in vivo, коли пролікарський засіб вводиться ссавцеві. Пролікарські форми сполуки (І) одержують шляхом модифікації функціональних груп, що є присутніми у сполуці, таким чином, що модифікації розщеплюються, або за допомогою звичайних маніпуляцій, або in vivo, до ви хідної сполуки. Пролікарські форми включають сполуки формули (І), в яких гідрокси, аміно або сульфгідрильна групи зв'язані з будь-якою групою так, що, коли пролікарська форма або сполука формули (І) вводиться ссавцеві, вона розщеплюється з утворенням вільної гідроксильної групи, вільної аміногрупи або вільної сульфгідрильної групи, відповідно. Приклади пролікарських форм включають без обмеження ацетатні, форміатні та бензоатні похідні спиртових та амінних функціональних груп у сполуках формули (І), тощо. Композиції Сполуки відповідно до даного винаходу можуть вводитися перорально, парентерально, букально, вагінально, ректально, шляхом інгаляції, інсуфляції, під'язиково, внутрішньом'язово, місцево, інтраназально, інтраперитонеально, інтраторакально, внутрішньовенно, епідурально, інтратекально, інтрацеребровентрикулярно та шляхом ін'єкції в суглоби. Дозування буде залежати від способу введення, тяжкості захворювання, віку та ваги пацієнта та інших факторів, які звичайно враховуються лікарем при визначенні індивідуального режиму та рівня дозування, як це є найбільш прийнятним для даного пацієнта. Ефективна кількість сполуки відповідно до даного винаходу для застосування в терапії інфекції являє собою кількість, достатню для симптоматичного послаблення у теплокровної тварини, зокрема, людини, симптомів інфекції, для уповільнення розвитку інфекції або для зменшення у пацієнтів із симптомами інфекції ризику погіршення стану. 26 Для одержання фармацевтичних композицій зі сполук відповідно до даного винаходу інертні фармацевтично прийнятні носії можуть бути або твердими, або рідкими. Препарати твердих форм включають порошки, таблетки, гранули, які диспергуються, капсули, таблетки з оболонкою та супозиторії. Твердий носій може являти собою одну або більше речовин, які також можуть діяти як розріджувачі, смакові агенти, солюбілізатори, лубриканти, суспендувальні агенти, зв'язувльні агенти або агенти для дезінтеграції таблеток; він може також являти собою інкапсульований матеріал. У порошках носій являє собою ретельно подрібнену тверду речовину, що є сумішшю з ретельно подрібненим активним компонентом. У таблетках активний компонент змішаний з носієм, що має необхідні сполучні властивості, у прийнятних співвідношеннях та ущільнений до бажаної форми та розміру. Для одержання композицій для супозиторіїв віск із низькою точкою плавлення, такий, як суміш гліцеридів жирних кислот та масла какао, спочатку піддають розплавлюванню та диспергують у ньому активний інгредієнт шляхом, наприклад, перемішування. Розплавлену гомогенну суміш потім виливають у форми прийнятного розміру, піддають охолодженню та отвердінню. Прийнятні носії включають карбонат магнію, стеарат магнію, тальк, лактозу, цукор, пектин, декстрин, крохмаль, трагакант, метилцелюлозу, карбоксиметилцелюлозу натрію, віск із низькою точкою плавлення, масло какао тощо. Деякі сполуки відповідно до даного винаходу є здатними до утворення солей з різними неорганічними та органічними кислотами та основами, такі солі також підпадають під об'єм даного винаходу. Приклади таких солей приєднання кислоти включають ацетат, адипат, аскорбат, бензоат, бензолсульфонат, бікарбонат, бісульфат, бутират, камфорат, камфорсульфонат, холін, цитрат, циклогексилсульфамат, діетилендіамін, етансульфонат, фумарат, глутамат, гліколат, гемісульфат, 2гідроксіетилсульфонат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідроіодид, гідроксималеат, лактат, малат, малеат, метансульфонат, меглумін, 2-нафталінсульфонат, нітрат, оксалат, памоат, персульфат, фенілацетат, фосфа т, дифосфат, пікрат, півалат, пропіонат, хінат, саліцилат, стеарат, сукцинат, сульфамат, сульфанілат, сульфа т, тартрат, тозилат (птолуолсульфонат), трифторацетат та ундеканоат. Основні солі включають солі амонію, солі лужних металів, такі, як солі натрію, літію та калію, солі лужноземельних металів, такі, як солі алюмінію, кальцію та магнію, солі з органічними основами, такі, як солі дициклогексиламіну, N-метил-Dглюкаміну, та солі з амінокислотами, такими, як аргінін, лізин, орнітин тощо. Крім того, основні групи, що містять азот, можуть бути піддані кватернізації за допомогою таких агентів, як: галіди нижчих алкілів, такі, як галіди метилу, етилу, пропілу та бутилу; діалкілсульфати, типу 27 81470 диметил-, діетил-, дибутил-, діамілсульфату; галіди з довгими ланцюгами, такі, як галіди децилу, лаурилу, мірістилу та стеарилу; аралкілгаліди, подібні бензилброміду та інші. Нетоксичні фізіологічно прийнятні солі є кращими, незважаючи на те, що інші солі також є корисними, наприклад, при ізоляції та очищенні продукту. Солі можуть бути утворені при використанні традиційних способів, таких, як здійснення реакції форми вільної основи продукту з одним або більше еквівалентами прийнятної кислоти в розчиннику або середовищі, у яких сіль є нерозчинною, або в розчиннику, такому, як вода, який видаляють під вакуумом або шляхом сублімаційного висушування, або за допомогою обміну аніонів існуючої солі на інший аніон при використанні прийнятної іонообмінної смоли. Для того, щоб використати сполуку формули (І) або її фармацевтично прийнятну сіль для терапевтичного лікування ссавців (включаючи профілактичне лікування), включаючи людину, її звичайно рецептують у відповідності зі стандартною фармацевтичною практикою у вигляді фармацевтичної композиції. У доповнення до сполук відповідно до даного винаходу, фармацевтична композиція відповідно до даного винаходу може також включати або вводитися разом (одночасно або послідовно) з одним або більше фармакологічними агентами, корисними для лікування одного або більше хворобливих станів, які згадуються в даній заявці. Термін «композиція» призначений для включення сполуки активного компонента або його фармацевтично прийнятної солі з фармацевтично прийнятним носієм. Наприклад, даний винахід може бути реалізований за допомогою засобів, відомих з рівня техніки, у формі, наприклад, таблеток, капсул, водних або масляних розчинів, суспензій, емульсій, кремів, мазей, гелів, назальних аерозолів, супозиторіїв, тонко подрібнених порошків або аерозолів, або пульверизаторів для інгаляції, та для парентерального застосування (включаючи внутрішньовенне, внутрішньом'язове введення або інфузію) у вигляді стерильних водних або масляних розчинів, або суспензій, або стерильних емульсій. Рідка форма композицій включає розчини, суспензії та емульсії. Стерильна вода або водяні розчини пропіленгліколю активних сполук можуть бути згадані як приклад рідких препаратів, прийнятних для парентерального введення. Рідкі композиції можуть також бути складені у вигляді розчину у водному розчині поліетиленгліколю. Водні розчини для орального введення можуть бути отримані шляхом розчинення активного компонента у воді та шляхом додання прийнятних барвників, смакових агентів, стабілізаторів та загусників, якщо це є бажаним. Водні суспензії для орального застосування можуть бути складені шляхом диспергування тонко подрібненого активного компонента у воді разом із в'язким матеріалом, таким, як природні або синтетичні камеді, смоли, метилцелюлоза, карбоксиметилцелюлоза натрію та іншими 28 суспендувальними агентами, відомими в галузі фармацевтичних композицій. Фармацевтичні композиції можуть бути створені у формі одиничної дози. У такій формі композицію розділяють на кілька одиничних доз, що містять прийнятні кількості активного компонента. Форма одиничної дози може являти собою препарат в упаковці, при цьому упаковка містить дискретні кількості препаратів, наприклад, упаковані таблетки, капсули, порошки у флаконах або ампулах. Форма одиничної дози може також являти собою капсулу, таблетку з оболонкою або таблетку саму по собі, або може являти собою прийнятне число будь-яких упакованих форм. Комбінації Протиракове лікування, описане в даній заявці, можезастосовуватися як єдина терапія або може втягува ти в доповнення до сполуки відповідно до даного винаходу традиційну хір ургію або променеву терапію або хіміотерапію. Така хіміотерапія може включати одну або більше наступних категорій протиракових агентів: (і) антипролиіферативні/антинеопластичні лікарські засоби та їх комбінації, які використовуються в медичній онкології, такі, як алкілувальні агенти (наприклад, цис-платин, карбоплатин, циклофосфамід, гірчичний газ, мелфалан, хлорамбуцил, бусульфан та нітрозосечовини); антиметаболіти (наприклад, антифолати, такі, як фторпіримідини, подібні 5фтор урацилу та тега фуру, ралтитрексед, метотрексат, цитозин арабінозид та гідроксисечовина); протипухлинні антибіотики (наприклад, антрацикліни, подібні адріаміцину, блеоміцину, доксорубіцину, да уноміцину, епірубіцину, ідарубіцину, мітоміцину-С, дактиноміцину та мітраміцину); антимітотичні агенти (наприклад, алколоїди барвінку, подібні вінкрістіну, вінбластину, віндезину та вінорелбіну, та таксоїди, подібні таксолу та таксотере); інгібітори топоізомерази (наприклад, епіподофілотоксини, подібні етопозиду та теніпозиду, амсакрину, топотекану та камптотецину); (іі) цитостатичні агенти, такі, як антиестрогени (наприклад, тамоксифен, тореміфен, ралоксифен, дролоксифен та іодоксифен), регулятори, що виявляють знижувальну активність стосовно рецепторів естрогену (наприклад, фулвестрант), антиандрогени (наприклад, бікалутамід, флутамід, нілутамід та ципротерон ацетат), антагоністи LHRH або агоністи LHRH (наприклад, гозерелін, лейпрорелін, бузерелін), прогестогени (наприклад, мегестрол ацетат), інгібітори ароматази (наприклад, анастрозол, летрозол, воразол та ексеместан) та інгібітори 5a-редуктази, такі, як фінастерид; (ііі) агенти, які інігібують інвазію ракових клітин (наприклад, інгібітори металопротеїнази, подібні марімастату, та інгібітори функції урокіназного активатора рецептора плазміногену); (iv) інгібітори функції фактора росту, наприклад, такі інгібітори включають антитіла проти фактора росту, антитіла проти рецептора фактора росту (наприклад, анти-еrbb2 антитіло 29 81470 трастуз умаб [HerceptinÔ ] та анти-еrbb1 антитело цетуксимаб [С225]), інгібітори фарнезилтрансферази, інгібітори тирозинкінази та інгібітори серин/треонін кінази, наприклад, інгібітори родини епідермального фактора росту (наприклад, EGFR родина інгібіторів тирозинкінази, таких, як N-(3-хлор-4-фторфеніл)-7метокси-6-(3-морфолінпропокси)хіназолін-4-амін (гефітініб, AZD1839), N-(3-етинілфеніл)-6,7-біс(2метоксіетокси)хіназолін-4-амін (ерлотініб, OSI-774) та 6-акриламідо-N-(3-хлор-4-фторфеніл)-7-(3морфолінпропокси)хіназолін-4-амін (СI1033)), наприклад, інгібітори родини фактора росту тромбоцитів та, наприклад, інгібітори родини фактора росту гепатоцитів; (ν) антиангіогенні агенти, такі, як ті, що інгібують ефекти фактора росту судинного ендотелію (наприклад, антитіло проти фактора росту судинного епітелію бевациремаб [AvastinÔ ], сполуки, такі, як ті, що розкриті в [міжнародних патентних заявках WO 97/22596, WO 97/30035, WO 97/32856 та WO 98/13354]), та сполуки, які діють відповідно до інших механізмів (наприклад, ліномід, інгібітори функції інтегрину anb3 та ангіостатин); (vi) агенти, що пошкоджують судини, такі, як Комбретастатин А4, та сполуки, розкриті в [міжнародних патентних заявках WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 та WO 02/08213]; (vii) антисмислові терапевтичні засоби, наприклад, ті, що спрямовані на мішені, наведені вище, такі, як ISIS 2503, анти-ras антисмисловий; (viii) підходи на основі генної терапії, включаючи, наприклад, підходи для заміни аберантних генів, таких, як аберантний р53 або аберантний BRCA1 або BRCA2, GDEPT (генспрямована терапія на основі пролікарської форми ферменту) підходи, такі, як ті, що використовують ферменти цитозиндезаміназу, тимідинкіназу або бактеріальну нітроредуктазу, а також підходи для підвищення толерантності пацієнта до хіміотерапії або променевої терапії, такі, як генна терапія множинної резистентності до лікарських засобів; і (іх) імунотерапевтичні підходи, включаючи, наприклад, підходи ex-vi vo та іn-vi vo для підвищення імуногенності пухлинних клітин пацієнта, такі, як трансфекція за допомогою цитокінів, таких, як інтерлейкін 2, інтерлейкін 4, фактор стимуляції росту колоній гранулоцитівмакрофагів, підходи для зниження Т-клітинної алергії, підходи на основі застосування трансфікованих імунних клітин, таких, як трансфіковані цитокіном дендритні клітини, підходи при використанні пухлинних ліній клітин, трансфікованих цитокіном, та підходи на основі застосування анти-ідіотипічних антитіл. Таке поєднане лікування може бути досягнуте за допомогою одночасного, послідовного або окремого дозування індивідуальних компонентів лікування. Такі комбінаційні продукти використовують сполуки відповідно до даного винаходу в межах інтервалів дозування, описаних у даній заявці нижче, та інших фармацевтично агентів у межах схвалених інтервалів доз. 30 Синтез Сполуки відповідно до даного винаходу можуть бути отримані рядом способів, які добре відомі фахівцеві в галузі органічного синтезу. Сполуки відповідно до даного винаходу можуть бути синтезовані при використанні способів, описаних нижче, разом із синтетичними способами, відомими в галузі синтетичної органічної хімії, або за допомогою їх варіацій, що є добре зрозумілим фахівцеві в даній галузі. Такі спосіби включають без обмеження ті, що описано нижче. Всі згадування, які цитуються в даній заявці, введені у всій своїй цілісності як посилання. Нові сполуки відповідно до даного винаходу можуть бути о тримані при використанні реакцій та способів, описаних у даній заявці. Реакції здійснюють у розчинниках, прийнятних для реагентів та матеріалів, та які є прийнятними для здійснюваної трансформації. Крім того, з опису синтетичних методів, представлених нижче, зрозуміло, що всі запропоновані умови реакції, включаючи вибір розчинника, газове середовище реакції, температуру реакції, тривалість експерименту та процедури доведення, вибрані таким чином, що є умовами, стандартними для такої реакції, що легко встановлюється фахівцем у даній галузі техніки. При цьому фахівцеві в галузі органічного синтезу зрозуміло, що функціональні групи, що є присутніми у різних частинах молекули, повинні бути сумісними із запропонованими реагентами та умовами проведення реакції. Такі обмеження щодо замісників, які є сумісними з умовами реакції, будуть повністю зрозумілими фахівцеві в даній галузі, при цьому повинні використатися альтернативні способи. Вихідні матеріали для прикладів, що містяться в даній заявці, є або комерційно доступними, або легко можуть бути отримані за допомогою стандартних способів при використанні відомих матеріалів. Наприклад, наведені нижче реакції є ілюстраціями, але не обмеженнями, одержання деяких вихідних матеріалів та прикладів їх застосування. Хімічні абревіатури, використані в прикладах, визначаються в такий спосіб: «ВОС» означає Nтрет-бутоксикарбоніл, «CBZ» означає карбобензилокси; «DIEA» означає Ν,Νдіізопропілетиламін, «ДМФ» означає Ν,Νдиметилформамід; «ТГФ» означає тетрагідрофуран, «етер» означає етиловий ефір, «хв.» означає хвилини; «ч.» означає години; «КТ» або «к.т.» означає кімнатну температуру; «ВМ» означає вихідний матеріал, «МС» означає масспектрометрію, «RM» означає реакційну суміш, «ЯМР» означає ядерний магнітний резонанс, «TLC» означає тонкошарову хроматографію, «LC» означає рідинну хроматографію, «ВЕРХ» означає рідинну хроматографію високого тиску «ТФО» означає трифтороцтову кислоту, «ДМСО» означає диметилсульфоксид, «EtOAc» означає етилацетат. Якщо не вказане інше, то органічні розчини висушують над безводним сульфатом натрію. 31 Приклади нижче: таких 81470 процесів проілюстровані Спосіб 1 2-(1-етоксіетиліден)малононітрил Триетилортоацетат (97г, 0,6моля), малононітрил (33м, 0,5моля) та крижану оцтову кислоту (1,5г) поміщали в колбу на 1л з мішалкою, термометром та колонкою Vigreux (20´1 дюймів), вгорі якої поміщали дистиляційний холодильник. Реакційну суміш нагрівали та етиловий спирт починав дистилюватися тоді, коли температура реакційної суміші становила приблизно 85-90°С. Приблизно через 40хв. температура реакційної суміші досягала 140°С. Після цього реакційну суміш концентрували в роторному випарнику для видалення матеріалів з низькою точкою кипіння та залишок кристалізували з абсолютного спирту для одержання чистого продукту (62,2г, 91%) у вигляді світло-жовтої твердої речовини [точка плавлення: 91,6°С (літ. 90-92°С, MCCall. M. A. J. Org. Chem. 1962, 27, 2433-2439)]. Спосіб 2 Амід (Е)-2-ціано-3-етоксибут-2-енетіоєвої кислоти 2-(1-етоксіетиліден)малононітрил (Спосіб 1) (62г, 0,45моля) розчиняли в безводному бензолі (800мл) та додавали 1мл триетиламіну як каталізатор. Суміш перемішували та сульфід водню барботували в цей розчин протягом 40хв., при цьому утворювалася тверда речовина, що випадала в осад, її відфільтровували та висушували. Тверду речовину перекристалізовували з абсолютного спирту (100мл), фільтрували та висушували для ізоляції чистого аміду (Е)-2-ціано-3-етоксибут-2-енетіоєвої кислоти (19,3г, 25%) у вигляді світло-коричневих кристалів. Спосіб 3 Амід (Е)-3-аміно-2-ціанобут-2-енетіоєвої кислоти Амід (Е)-2-ціано-3-етоксибут-2-енетіоєвої кислоти (Спосіб 2) (19,2г, 0,136моля) розчиняли в насиченому розчині амонію в метанолі (500мл) та перемішували при к.т. протягом ночі. Реакційну суміш концентрували та залишок розчиняли в гарячій воді (600мл), а тверду речовину, що не 32 розчинилася, відфільтровували та висушували для одержання 6г вихідного тіокротонаміду. Водний розчин залишали для відстоювання протягом ночі, що забезпечувало одержання чистого аміду (Е)-3-аміно-2-ціанобут-2-енетіоєвої кислоти (6,85г, 63%) у вигляді не зовсім білих кристалів. 1Н ЯМР (300МГц, ДМСО-d6) d 2,22 (с, 3Н), 7,73 (шс, 1Н), 8,53 (шс, 1Н), 9,01 (шс, 1Н), 11,60 (шс, 1Н). Спосіб 4 5-аміно-3-метилізотіазол-4-карбонітрил До перемішаного розчину аміду (Е)-3-аміно-2ціанобут-2-енетіоєвої кислоти (Спосіб 3) (6,83г, 48,4ммоля) у метанолі (300мл) додавали по краплях 13,6мл (124ммоля) 30% пероксиду водню. Суміш перемішували при 60°С протягом 4 годин, випарювали до 60мл у роторному випарнику та охолоджували на крижаній бані. Викристалізуваний продукт відфільтровували та перекристалізовували з етилацетату з одержання чистого продукту 5-аміно-3-метилізотіазол-4карбонітрилу (5,41г, 80%) у вигляді білої кристалічної твердої речовини. 1Н ЯМР (300МГц, ДМСО-d6) d 2,24 (с, 3Н), 8,00 (шс, 2Н). Спосіб 5 N-(4-ціано-3-метилізотіазол-5-іл)бутирамід До розчину аміну (Спосіб 4) (5,31г, 38,2ммоля) в СН2СІ2 (200мл) при температурі 0°С додавали NEt3 (5г, 50ммоля), після чого по краплях додавали розчин бутирилхлориду (4,88м, 45,8ммоля) у СН 2СІ2 (50мл). Після завершення додання реакційну суміш залишали для нагрівання до к.т. та перемішували протягом ночі. Реакційну суміш промивали водою (100мл), 1N НСІ (100мл), насиченим сольовим розчином (200мл) та висушували над Na2SO4. Концентрування шару СН2СІ2 забезпечувало одержання продукту, який розтирали в порошок із СН 2СІ/гексанами (1/10) та відфільтровували для ізоляції чистого N-(4-ціано3-метилізотіазол-5-іл)бутираміду (7,57г, 95%) у вигляді оранжевої твердої речовини. Спосіб 6 Амід 5-бутириламіно-3-метилізотіазол-4карбонової кислоти До розчину N-(4-ціано-3-метилізотіазол-5іл)бутираміду (Спосіб 5) (4,18г, 20ммоля) в 30% водному розчині NH4OH (250мл) додавали по краплях 100мл пероксиду водню при к.т. Після завершення додання реакційну суміш перемішували при 60°С протягом ночі, після чого TLC показало повне зникнення ВМ. Реакційну суміш охолоджували та екстрагували за допомогою хлороформу (3´100мл). Органічний шар висушували (Na2SO4) та концентрували для одержання аміду 5-бутириламіно-3метилізотіазол-4-карбонової кислоти (2,9г, 72%) у вигляді білої твердої речовини. 1Н ЯМР (300МГц, CDCI3) d 1,03 (т, 3Н), 1,79 (м, 2Н), 2,54 (т, 3Н), 2,69 (с, 3Н), 5,97 (шс, 2Н), 11,78 (шс, 1Н). Спосіб 7 3-метил-6-пропіл-5Н-ізотіазол[5,4-d]піримідин4-он Амід 5-бутириламіно-3-метилізотіазол-4карбонової кислоти (Спосіб 6) (1,9г, 8,3ммоля) суспендували в 75мл 30% ΝΗ3 та потім нагрівали 33 81470 до 140°С протягом 4 годин у реакторі під тиском. Суміш охолоджували та нейтралізували до рН 8. Відфільтровували 3-метил-6-пропіл-5Нізотіазоло[5,4-d]піримідин-4-он, що випав в осад, промивали водою (100мл) та висушували у вакуумному термостаті при температурі 40°С протягом ночі для одержання 800мг (34%) чистого продукту. 1Н ЯМР (300МГц, CDCI3) d 1,03 (т, 3Н), 1,74 (м, 2Н), 2,67 (т, 3Н), 2,78 (с, 3Н). Спосіб 8 5-бензил-3-метил-б-пропіл-5Н-ізотіазол[5,4d]піримідин-4-он До розчину 3-метил-6-пропіл-5Н-ізотіазол[5,4d]піримідин-4-ону (Спосіб 7) (800мг, 3,8ммоля) в 20мл безводного ДМФ додавали 1,38г (10ммоля) безводної K2СО3, після чого додавали бензилбромід (655мг, 3,8ммоля) та суміш перемішували при кімнатній температурі протягом ночі. TLC реакційної суміші показало повне зникнення ВМ. Реакційну суміш виливали в охолоджену льодом воду та екстрагували за допомогою EtOAc (3´100мл). Об'єднані екстракти промивали водою (100мл), насиченим сольовим розчином (100мл), висушували (Na2SO4) та концентрували. TLC та 1Н Я МР показали присутність двох продуктів, як N-алкілованих, так і О-алкілованих продуктів, у співвідношенні 1:1. Продукти розділяли за допомогою колонкової хроматографії (силікагель, 116г) при використанні 10-20% EtOAc у гексанах. Бажаний N-алкілований продукт 5-бензил-3-метил-6-пропіл-5Нізотіазол[5,4-d]піримідин-4-он ізолювали у вигляді білої кристалічної твердої речовини (369мг, 32%). 1Н ЯМР (300МГц, CDCI3) d 0,96 (т, 3Н), 1,71-1,84 (м, 2Η), 2,73 (т, 3Н), 2,81 (с, 3Н), 5,38 (с, 2Н), 7,147,38 (м, 5Н): Наступні сполуки були синтезовані відповідно до Способу 8: 34 органічного шару забезпечувало одержання чистого 5-бензил-6-(1-бромпропіл)-3-метил-5-Hізотіазол[5,4-d|піримідин-4-ону (460мг, 100%) у вигляді білої кристалічної твердої речовини. 1Н ЯМР (300МГц, CDCI3) d 0,76 (т, 3Н), 2,1-2,47 (м, 2Η), 2,84 (с, 3Н), 4,62 (т, 1Н), 4,88 (д, 1Н), 6,20 (д, 1Н), 7,10-7,40 (м, 5Н). Наступні сполуки були синтезовані відповідно до Способу 9: Спосіб # 9а Назва сполуки 6-(1-Бромпропіл)-5-[(4-фторфеніл)метил)]-3-метилізотіа d]піримідин-4(5Н)-он Спосі10 Tрет-бутиловий ефір {3-[1-(5-бензил-3-метил4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіламіно]пропіл}карбамінової кислоти До розчину броміду (Спосіб 9) (0,46г, 1,22ммоля) у безводному етанолі (20мл), додавали трет-бутил 3-амінопропілкарбамат (0,211г, 1,22ммоля), після чого додавали безводний діізопропілетиламін (0,258г, 2ммоля) та суміш перемішували при температурі кипіння протягом 16 годин. TLC реакційної суміші показало повне зникнення вихідного броміду. Реакційну суміш виливали в охолоджену за допомогою льоду воду (200мл) та екстрагували за допомогою EtOAc (3´100мл). Органічний шар промивали водою (100мл), насиченим сольовим розчином (100мл) та висушували (Na2SO4). Концентрування органічного шару забезпечувало одержання продукту, який очищали за допомогою колонкової хроматографії (силікагель) при використанні 30-50% EtOAc у гексанах для ізоляції чистого трет-бутилового ефіру аміну {3-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-фіримідин-6іл)пропіламіно]пропіл}карбамінової кислоти (0,1г, 17%) у вигляді білої піни. 1Н ЯМР (300МГц, CDCI3) Спосіб # Назва сполуки m/z Алкілувальний агент d 0,95 (т, 3Н), 1,33 (т, 2Η), 1,42 (с, 9Н), 1,49-1,51 (м, 5-(4-Фторбензил)-3-метил-6-пропілізотіазол[5,4-d]піримідин-4- 1Н), 2,35-2,45 (м, 1Н), 2,83 (с, 2Н), 1,87-1,99 (м, (МН+) 4-фторбензилбромід 8а 318 он 3Н), 2,92-3,20 (м, 2Н), 3,64-3,70 (м, 1Н), 4,98 (д, 1Н), 5,17 (шс, 1Н), 5,85 (д, 1Н), 7,10-7,40 (м, 5Н). Спосіб 9 Наступні сполуки були синтезовані відповідно до 5-бензил-6-(1-бромпропіл)-3-метил-5-НСпособу 10: ізотіазол[5,4-d]піримідин-4-он До розчину 5-бензил-3-метил-6-пропіл-5НСпосіб # Назва сполуки ізотіазол[5,4-d]піримідин-4-ону (Спосіб 8) (369мг, Tрет-бутиловий ефір [3-({1-[5-(4-фторбензил)-3-метил1,23ммоля) та ацетату натрію (1г) в оцтовій 10а 4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6кислоті (5мл) при температурі 100°С додавали по іл]пропіл}аміно)пропіл}карбамінової кислоти краплях розчин брому (318мг, 2ммоля) в оцтовій кислоті (10мл) [Наступну краплю брому додавали Спосіб 11 тільки після того, як попередня крапля повністю Tрет-бутиловий ефір {3-[1-(5-бензил-3-метилпрореагувала, що визначали при спостереженні 4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6зникнення забарвлення] протягом періоду 20 іл)пропіламіно]пропіл}карбамінової кислоти хвилин. Реакційну суміш охолоджували після До розчину броміду (Спосіб 9) (0,1г, додання, TLC (елюент: 10% EtOAc у гексанах) та 0,26ммоля) у безводному дихлорметані (5мл) МС показали повне зникнення ВМ та наявність додавали безводний діізопропілетиламін (100мкл, тільки продукту реакції. Реакційну суміш виливали 0,52ммоля), після чого додавали трет-бутил 3в охолоджену льодом воду та екстрагували за амінопропілкарбамат (0,10г, 0,52ммоля). допомогою EtOAc (3´60мл), поєднували органічні Реакційну суміш піддавали обробці НВЧ при шари та промивали за допомогою 2%-ного температурі 120°С протягом 2 годин. LC/MC RM розчину тіосульфату натрію (60мл), води (100мл), показали повне зникнення вихідного броміду. насиченого сольового розчину (100мл) та Реакційну суміш випарювали до осушення та висушували над Na2SO4. Концентрування продукт очищали за допомогою колонкової 35 81470 хроматографії (силікагель) при використанні 4060% EtOAc у гексанах для ізоляції чистого третбутилового е фіру аміну {3-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіламіно]пропіл}карбамінової кислоти (0,085г, 64%). m/z 472 (MH+). Наступні сполуки були синтезовані відповідно до Способу 11: 36 плавлення: 127,8-129,2°С m/z 490 (МН+), 1Н ЯМР (ДМСО-d6 300МГц, 96°С) d: 7,79 (шс, 3Н), 7,376,95 (м, 9Н), 5,77 (д, 1Н), 5,50 (шс, 1Н), 4,83 (д, 1Н), 3,36 (т, 2Н), 2,72 (с, 3Н), 2,46 (т, 2Н), 2,39 (с, 3Н), 2,20-2,05 (м, 1Н), 1,96-1,75 (м, 1Н), 1,74-1,40 (м, 2Н), 0,63 (т, 3Н). Наступні сполуки були синтезовані відповідно до Способу 12: Спосіб # 12а Спосіб 12 N-(3-Амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піриіиідин-6іл)пропіл]-4-метилбензамід До розчину аміну 13 (Спосіб 10) (0,1г, 0,21ммоля) та триетиламіну (0,303г, 3ммоля) у дихлорметані (20мл) при к.т. додавали по краплях розчин п-толуолхлориду (0,1г, 0,6ммоля) у дихлорметані (10мл). Отриманий розчин перемішували при к.т. протягом 30 хвилин, після чого TLC показувало зникнення ВМ. Реакційну суміш розводили за допомогою СН 2СІ2 (60мл) та промивали за допомогою насиченого NaНСО3 (100мл), води (100мл), насиченого сольового розчину (100мл) та висушували (Na2SO4). Концентрування органічного шару забезпечувало одержання продукту, який очищали за допомогою колонкової хроматографії (силікагель) при використанні 20-30% EtOAc у гексанах як елюента. Вихід=0,117г (94%). Ацильований продукт розчиняли в 2М НСІ в етиловому ефірі та суміш перемішували при к.т. протягом 20 годин. Продукт, що випав в осад, відфільтровували, промивали за допомогою етилового ефіру та висушували у вакуумі з одержанням чистого хлориду N-(3амінопропіл)-N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-4метилбензаміду (91мг, 87%). Білий порошок, точка Назва сполуки m/z N-(3-Амінопропіл)-N-[1-(5-{4-фторбензил}-3метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин- 507 (МН 6-іл)пропіл]-4-метилбензамід Спосіб 13 N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6іл)пропіл]-4-бромбензамід До розчину трет-бутилового ефір у {3-[1-(5бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4d]піримідин-6-іл)пропіламіно]пропіл}карбамінової кислоти (Спосіб 11) (0,085г, 0,167ммоля) у дихлорметані (8мл) при к.т. додавали насичений розчин карбонату калію (8мл), після чого по краплях додавали п-бромбензоїлхлорид (0,044г, 0,2ммоля). Отриманий розчин перемішували при к.т. протягом 16 годин, після чого LC/MC показали зникнення ВМ. Реакційну суміш випарювали до осушення, ресуспендували в 3мл МеОН та очищали за допомогою ВЕРХ Гілсона при використанні 20-99% градієнту H2O/CH3CN (0,05% ТФО). Концентрування бажаних фракцій забезпечувало одержання трет-бутилового ефіру {3-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл](4бромбензоїл)аміно]пропіл}карбамінової кислоти. Продукт розчиняли в 2М НСІ в 1,4-діоксані та суміш перемішували при к.т. протягом 1 години. Реакційну суміш випарювали до осушення, промивали за допомогою етилового ефіру та висушували під вакуумом для одержання чистого гідрохлориду N-(3-амінопропіл)-N-[1-(5-бензил-3метил-4-оксо-4,5-дигідроізотІазол[5,4-d]піримідин6-іл)пропіл]-4-бромбензаміду (33мг, 34%). m/z 556 (МН+), 1Н ЯМР (ДМСО-d6 500МГц, 96°С) d: 7,80 (ш, 3Н), 7,64 (д, 2Н), 7,36-7,28 (м, 5Н), 7,13 (м, 2Н), 5,80 (д, 1Н), 5,57 (шс, 1Н), 4,95 (д, 1Н), 3,38 (т, 2Н), 2,77 (с, 3Н), 2,47 (т, 2Н), 2,17-2,13 (м, 1Н), 1,961,91 (м, 1Н),1,72-1,50 (м, 2Н), 0,68 (т, 3Н). Наступні сполуки були синтезовані відповідно до Способу 13: 37 81470 Спосіб 14 N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(3диметиламінопропіл)-4-метилбензамід До розчину 5-бензил-6-[1-(3диметиламінопропіламіно)пропіл]-3-метил-5Нізотіазол[5,4-d]піримідин-4-ону (Спосіб 11e) (0,104г, 0,26ммоля) у дихлорметані (10мл) при к.т. додавали насичений розчин карбонату калію (10мл), після чого по краплях додавали птолуолхлорид (34мкл, 0,26ммоля). Отриманий розчин перемішували при к.т. протягом 16 годин, після чого LC/MC показали зникнення ВМ. Реакційну суміш випарювали до осушення, ресуспендували в 3мл МеОН та очищали за допомогою ВЕРХ Гілсона при використанні 20-99% градієнту H2O/CH3CN (0,05% ТФО). Концентрування бажаних фракцій забезпечувало одержання N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(3диметиламінопропіл)-4-метилбензаміду (65мг, 48%). m/z 518 (МН+), 1Н ЯМР (ДМСО-d6 300МГц, 96°С) d: 7,44-7,00 (м, 9Н), 5,82 (д, 1Н), 5,51 (шс, 1Н), 4,86 (д, 1Н), 3,41 (т, 2Н), 2,75 (с, 3Н), 2,50 (с, 6Н), 2,39 (шм, 2Н), 2,12-2,05 (м, 1Н), 1,93-1,90 (м, 1Н), 1,75 (м, 1Н), 1,50 (м, 1Н), 0,66 (т, 3Н). Наступні сполуки були синтезовані відповідно до Способу 14: 38 Спосіб 15 3-[[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-(4метилбензоїл)аміно]пропіловий ефір метансульфонової кислоти До розчину N-[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-N-(3гідроксипропіл)-4-метилбензаміду (Спосіб 14b) (0,42г, 0,85ммоля) у безводному дихлорметані (57мл) додавали безводний діізопропілетиламін (295мкл, 1,70ммоля), після чого по краплях додавали метансульфонілхлорид (71мкл, 0,935ммоля). Реакційну суміш перемішували при к.т. протягом 2 годин. LC/MC RM показали повне зникнення вихідного матеріалу та повне перетворення до 3-[[1-(5-бензил-3-метил-4-оксо4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-(4метилбензоїл)аміно]пропілового ефіру метансульфонової кислоти. Реакційну суміш випарювали до осушення та використовували далі у вигляді сировинного продукту. Спосіб 16 N-(3-азетидин-1-ілпропіл)-N-[1-(5-бензил-3метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин6-іл)пропіл]-4-метилбензамід До розчину 3-[[1-(5-бензил-3-метил-4-оксо-4,5дигідроізотіазол[5,4-d]піримідин-6-іл)пропіл]-(4метилбензоїл)аміно]пропілового ефіру метансульфонової кислоти (Спосіб 15) ((як очікується, отриманого в попередній реакції) 0,080г, 0,14ммоля) у ДМФ 25мл) при к.т. додавали надлишок карбонату калію (0,097г, 0,70ммоля), після чого по краплях додавали азетидин (19мкл, 0,28ммоля). Реакційну суміш перемішували при 38°С протягом 16 годин, після чого LC/MC показали зникнення ВМ. Реакційну суміш випарювали до осушення на GeneVac HT12, ресуспендували в 3мл МеОН та очищали за допомогою ВЕРХ Гілсона при використанні 20-99% градієнту H2O/CH3CN (0,05% НСІ). Концентрування бажаних фракцій забезпечувало одержання NІ-(3-азетидин-1-ілпропіл)-N-[1-(5бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4d]піримідин-6-іл)пропіл]-4-метилбензаміду (51мг, 69%). m/z 530 (МН+), 1Н ЯМР (ДМСО-d6 400МГц, 96°С) d: 7,40-7,00 (м, 9Н), 5,85 (д, 1Н), 5,55 (шс, 1Н), 4,85 (д, 1Н), 3,40 (ш, 2Н), 2,90 (ш, 2Н), 2,78 (с, 3Н), 2,50 (ш, 2Н), 2,40 (с, 3Н), 2,35 (шм, 2Н), 2,202,00 (м, 1Н), 1,96-1,80 (м, 1Н), 1,65-1,50 (м, 1Н), 1,40-1,30 (м, 3Н), 0,65 (т, 3Н). Наступні сполуки були синтезовані відповідно до Способу 16: 39 81470 Спосіб 17 5-бензил-6-{1-[(3-гідроксипропіл)-(4метилбензил)аміно]пропіл}-3-метил-5Нізотіазол[5,4-d]піримідин-4-он До розчину 5-бензил-6-[1-(3гідроксипропіламіно)пропіл]-3-метил-5Нізотіазол[5,4-d]піримідин-4-ону (Спосіб 11f) (0,098г, 0,26ммоля) у безводному ДМФ (3мл) додавали карбонат калію (0,108г, 0,78ммоля), після чого по краплях додавали 4-метилбензилбромід (0,048г, 0,26ммоля). Отриманий розчин струшували при температурі 40°С протягом 4 годин, після чого LC/MC показали зникнення ВМ. Реакційну суміш випарювали до осушення, ресуспендували в 3мл МеОН та очищали за допомогою ВЕРХ Гілсона при використанні 20-99% градієнту H2O/CH3CN (0,05% ТФО). Концентрування бажаних фракцій забезпечувало одержання 5-бензил-6-{1-[(3гідроксипропіл)-(4-метилбензил)аміно]пропіл}-3метил-5Н-ізотіазол[5,4-d]піримідин-4-ону (48мг, 39%). m/z 477 (МН+), 1Н ЯМР (ДМСО-d6 500МГц, 96°С) d: 8,20 (с,1Н), 7,40-6,85 (м, 9Н), 5,80 (д, 1Н), 5,20 (д, 1Н), 3,80 (д, 1Н), 3,70 (м, 1Н), 3,62 (д, 1Н), 3,50-3,30 (м, 2Н), 2,90 (м, 1Н), 2,75 (с, 3Н), 2,33 (м, 2Н), 2,25 (с, 3Н), 2,20-2,16 (м, 1Н), 1,90-1,80 (м, 1Н), 1,50 (м, 2Н), 0,65 (т, 3Н). Спосіб 18 Амід 5-бутириламіно-3-метилізоксазол-4карбонової кислоти Суміш аміду 5-аміно-3-метилізоксазол-4карбонової кислоти (2г, 14,18ммоля) в 10мл бутирангідриду перемішували при 150°С протягом 0,5~1 години. Коричневий розчин розводили за допомогою гексану (100мл) та охолоджували до кімнатної температури. Тверду речовину, отриману із суміші, фільтрували та промивали за допомогою гексану та висушували під вакуумом. Вказаний у назві амід (2,6г) одержували у вигляді білої твердої речовини. Спосіб 19 3-метил-6-пропіл-5Н-ізоксазол[5,4-d]піримідин4-он Суспензію аміду 5-бутириламіно-3метилізоксазол-4-карбонової кислоти (Спосіб 18) (2,6г, розділені на 20 пробірок) в 3,5мл 2N водного розчину NaOH піддавали НВЧ опроміненню при температурі 140°С протягом 20хв. Отриманий розчин охолоджували на крижаній бані та 40 значення рН доводили до 1~3 за допомогою концентрованої НСІ. Отриману тверду речовину фільтрували, промивали за допомогою води, висушували в умовах вакууму при температурі 40°С протягом ночі. Вказаний у назві піримідинон (1,749г) одержували у вигляді білої твердої речовини. 1Н ЯМР (400МГц, ДМСО-d6): 0,91 (т, 3Н), 1,71 (м, 2Н), 2,44 (с, 3Н), 2,64 (т, 2Н), 12,78 (с, 1Н). Спосіб 20 5-бензил-3-метил-6-пропіл-5Н-ізоксазол[5,4d]піримідин-4-он Суспензію 3-метил-6-пропіл-5Н-ізоксазол[5,4d]піримідин-4-ону (Спосіб 19) (1,698г, 8,8ммоля), бензилброміду (1,5г, 8,8ммоля), карбонату калію (2,43м, 17,6ммоля) в 10мл ДМФ перемішували при кімнатній температурі протягом ночі. Суміш розводили за допомогою води, екстрагували за допомогою етилацетату (50мл´3), поєднані органічні фази висушували над безводним сульфатом натрію, концентрували, очищали за допомогою флеш колонкової хроматографії (елюювання: гексан-етилацетат=5:1). 1,69г (68%) вказаної в назві сполуки одержували у вигляді білої твердої речовини. 1Н ЯМР (400МГц, ДМСОd6): 0,80 (т, 3Н), 1,61 (м, 2Н), 2,43 (с, 3Н), 2,73 (т, 2Н), 5,35 (с, 2Н), 7,12-7,35 (м, 5Н). Спосіб 21 5-бензил-6-(1-бромпропіл)-3-метил-5Нізоксазол[5,4-d]піримідин-4-он Розчин 5-бензил-3-метил-6-пропіл-5Нізоксазол[5,4-d]піримідин-4-ону (Спосіб 20) (3,167г, 11,2ммоля) та ацетату натрію (4,59г, 56ммоля, 5екв.) у крижаній оцтовій кислоті (26мл) обробляли за допомогою попередньо приготовленого розчину брому (0,7мл брому в 10мл крижаної оцтової кислоти) (8,64мл, 22,4ммоля, 2екв.). Суміш перемішували при температурі 100°С протягом 24 годин. До суміші додавали надлишок брому (8,64мл, 22,4ммоля, 2екв.). Після цього суміш перемішували при температурі 100°С протягом наступних 24 годин. До реакційної суміші додавали воду, а після цього водний розчин карбонату калію. Суміш екстрагували за допомогою метиленхлориду (50мл´3), поєднані органічні фази промивали водою та висушували над безводним сульфатом натрію, а потім концентрували з одержанням продукту, який очищали за допомогою флеш хроматографії (елюювання: гексан-етилацетат). Одержували 2,5г продукту у вигляді білої твердої речовини. 1Н ЯМР (400МГц, ДМСО-d6): 0,79 (т, 3Н), 2,18 (м, 1Н), 2,35 (м, 1Н), 2,58 (с, 3Н), 5,12 (т, 1Н), 5,25 (д, 1Н), 5,80 (д, 1Н), 7,27-7,42 (м, 5Н). Спосіб 22 5-бензил-6-(1-бутиламінопропіл)-3-метил-5Нізоксазол[5,4-d]піримідин-4-он До суспензії 5-бензил-6-(1-бромпропіл)-3метил-5Н-ізоксазол[5,4-d]піримідин-4-ону (Спосіб 21) (2,8г, 7,73ммоля) та карбонату калію (2,67г, 19,38ммоля) в ацетонітрилі (100мл) додавали трет-бутил-N-(3-амінопропіл)карбамат (1,345г, 7,73ммоля). Суміш перемішували при температурі 100°С протягом ночі. До суміші додавали воду (30мл) та потім екстрагували за допомогою 41 81470 етилацетату (3´50мл). Поєднані органічні фази промивали при використанні насиченого сольового розчину (10мл), висушували над сульфатом натрію, концентрували з одержанням вказаного в назві аміну, який очищали при використанні флеш колонкової хроматографії (елюювання: етилацетат-гексан=1-4~1-1) з одержанням 2,6г (74%) продукту у вигляді білої твердої речовини. 1Н ЯМР (400МГц, ДМСО-d6): 0,85 (т, 3Н), 1,32 (м, 2Н), 1,41 (с, 9Н), 1,58 (м, 1Н), 1,65 (м, 1Н), 2,09 (м, 1Н), 2,40 (м, 1Н), 2,60 (с, 3Н), 2,81 (м, 2Н), 3,29 (м, 1Н), 3,75 (м, 1Н), 5,42 (д, 1Н), 5,63 (д, 1Н), 6,72 (ш, 1Н), 7,25-7,45 (м, 5Н). Спосіб 23 Трет-бутиловий ефір N-[[1-(5-бензил-3-метил4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6іл)пропіл](4метилбензоїл)аміно]пропіл)карбамінової кислоти Розчин 5-бензил-6-(1-бутиламінопропіл)-3метил-5Н-ізоксазол[5,4-d]піримідин-4-ону (Спосіб 22) (135мг, 0,297ммоля) у дихлорметані (4мл) додавали до п-толуолхлориду (46мг, 0,297ммоля), після чого додавали триетиламін (60мг, 0,594ммоля). Суміш перемішували при кімнатній температурі протягом однієї години. Потім її розводили за допомогою дихлорметану та промивали насиченим водним розчином бікарбонату натрію. Органічну фазу висушували над сульфатом натрію, фільтрували та концентрували. Сировинний продукт у вигляді масла очищали за допомогою флеш колонкової хроматографії (розчинник: етилацетат-гексан) з одержанням трет-бутилового ефіру N-[[1-(5бензил-3-метил-4-оксо-4,5-дигідроізоксазол[5,4d]піримідин-6-іл)пропіл]-(4метилбензоїл)аміно]пропіл)карбамінової кислоти (130мг) у вигляді білої твердої речовини. 1Н ЯМР (500МГц, 100°С, ДМСО-d6): 0,71 (т, 3Н), 1,12 (м, 1Н), 1,35 (с, 9Н), 1,47 (м, 1Н), 1,92 (м, 1Н), 2,14 (м, 1Н), 2,37 (с, 3Н), 2,56 (с, 3Н), 2,57 (м, 2Н), 3,29 (м, 2Н), 5,01 (д, 1Н), 5,68 (м, ш, 1Н), 5,79 (д, 1Н), 6,06 (ш, 1Н), 7,14-7,36 (м, 9Н). Спосіб 24 N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дипдроізоксазол[5,4-d]піримідин-6іл)пропіл]-4-метилбензамід Розчин трет-бутилового ефіру N-[[1-(5-бензил3-метил-4-оксо-4,5-дигідроізоксазол[5,4d]піримідин-6-іл)пропіл]-(4метилбензоїл)аміно]пропіл)карбамінової кислоти (Спосіб 23) (0,223ммоля) в 3мл 4Μ НСІ у діоксані перемішували при кімнатній температурі протягом 2 годин. Відганяли розчинник під вакуумом, а залишок висушували при 40~50°С протягом ночі під вакуумом. Одержували відповідний хлорид аміну, m/z (МН+) 1Н ЯМР (500МГц, 100°С, ДМСОd6): 0,68 (т, 3Н), 1,52 (м, 1Н), 1,72 (м, 1Н), 1,92 (м, 1Н), 2,10 (м, 1Н), 2,39 (с, 3Н), 2,51 (м, 2Н), 2,57 (с, 3Н), 3,41 (м, 2Н), 4,85 (ш, 1Н), 5,50 (ш, 1Н), 5,77 (д, 1Н), 7,07 (ш, 2Н), 7,24-7,35 (м, 7Н), 7,73 (ш, 3Н). Наступні сполуки були синтезовані відповідно до Способу 24: 42 Спосіб 25 N-(4-ціано-3-метилізотіазол-5-іл)-3метилбутирамід До розчину 5-аміно-3-метилізотіазол-4карбонітрилу (Спосіб 4) (6,38г, 45,9ммоля) у піридині (20мл) при температурі 0°С по краплях додавали ізовалерилхлорид (6,65г, 55ммоля) Після завершення додання реакційну суміш залишали для нагрівання при к.т. та перемішували протягом ночі. TLC та МС показали повне зникнення вихідного матеріалу, після цього реакційну суміш розводили за допомогою СНСІ3 (200мл), промивали водою (200мл), 2N НСІ (225мл), насиченим розчином NаНСО3 (200мл), насиченим сольовим розчином (200мл) та висушували над Nа2SО4. Концентрування шару СНСІ3 забезпечувало одержання продукту, який розтирали із сумішшю СН 2СІ2 /гексани (1/10) та відфільтровували для ізоляції N-(4-ціано-3метилізотіазол-5-іл)-3-метилбутираміду (8,1г, 79%) у вигляді не зовсім білої твердої кристалічної речовини. 1Н ЯМР (300МГц, CDCI3!3) d 1,04 (д, 6Н), 2,18-2,32 (м, 1Н), 2,46 (д, 2Н), 2,53 (с, 3Н), 9,87 (шс, 1Н). Спосіб 26 Амід 3-метил-5-(3метилбутириламіно)ізотіазол-4-карбонової кислоти До розчину N-(4-ціано-3-метилізотіазол-5-ил)3-метилбутираміду (Спосіб 25) (8г, 35,8ммоля) в 30% водному розчині ΝΗ 4ΟΗ (200мл) додавали по краплях 100мл пероксиду водню при к.т. Після завершення додання реакційну суміш перемішували при 60°С протягом ночі, після цього TLC показало повне зникнення ВМ. Реакційну суміш концентрували до 40мл та екстрагували за допомогою хлороформу (3´100мл). Органічний шар висушували (Na2SO4) з одержанням аміду 3метил-5-(3-метилбутириламіно)ізотіазол-4карбонової кислоти (6,1г, 71%) у вигляді світложовтої твердої речовини. 1Н ЯМР (300МГц, CDCI3) d 1,03 (д, 6Н), 2,24 (м, 1Н), 2,43 (д, 2Н), 2,69 (с, 3Н), 5,98 (шс, 2Н), 11,77 (шс, 1Н). Спосіб 27 6-ізобутил-3-метил-5Н-ізотіазол[5,4d]піримідин-4-он Амід 3-метил-5-(3метилбутириламіно)ізотіазол-4-карбонової кислоти 43 81470 (Спосіб 26) (6г, 25ммоля) суспендували в 150мл 30% ΝΗ3, а потім нагрівали до 140°С протягом 5 годин у реакторі під тиском. Суміш охолоджували та нейтралізували до рН 7. Реакційну суміш екстрагували за допомогою EtOAc (3 ´100мл), поєднані органічні шари промивали водою (100мл), насиченим сольовим розчином (100мл) та концентрували з одержанням продукту, який потім очищали за допомогою колонкової хроматографії при використанні 30% EtOAc у гексанах як елюента. Концентрування фракцій чистого продукту забезпечувало одержання 6-ізобутил-3метил-5Н-ізотіазол[5,4-d]піримідин-4-ону (2,2г, 38%) у вигляді не зовсім білої твердої речовини. 1 Н ЯМР (300МГц, CDCI3) d 1,05 (д, 6Н), 2,32 (м, 1Н), 2,69 (д, 2Н), 2,82 (с, 3Н). Спосіб 28 5-бензил-6-ізобутил-3-метил-5Н-ізотіазол[5,4d]піримідин-4-он До розчину 6-ізобутил-3-метил-5Нізотіазол[5,4-d]піримідин-4-ону (Спосіб 27) (1,31г, 5,8ммоля) в 20мл безводного ДМФ додавали 1,38г (10ммоля) безводної K2СО3, після чого додавали бензилбромід (1,18г, 6,9ммоля) та суміш перемішували при кімнатній температурі протягом ночі. TLC реакційної суміші показало повне зникнення ВМ. Реакційну суміш виливали в охолоджену льодом воду та екстрагували за допомогою EtOAc (3 ´100мл). Поєднані екстракти промивали водою (100мл), насиченим сольовим розчином (100мл), висушували (Na2SO4) та концентрували. TLC та 1Н Я МР показали присутність двох продуктів, як N-алкілованих, так і О-алкілованих, у співвідношенні 7:3. Продукти розділяли за допомогою колонкової хроматографії (силікагель, 116 г) при використанні 10% EtOAc у гексанах. 5-бензил-6-ізобутил-3-метил-5Нізотіазол[5,4-d]піримідин-4-он ізолювали у вигляді білої кристалічної твердої речовини (1,3г, 70%). m/z 314 (МН+), 1Н ЯМР (300МГц, CDCI3) d 0,94 (д, 6Н), 2,23-2,37 (м, 1Н), 2,64 (д, 2Н), 2,82 (с, 3Н), 5,38 (с, 2Н), 7,10-7,38 (м, 5Н). Наступні сполуки були синтезовані відповідно до Способу 28: Спосіб 29 5-бензил-6-(1-бром-2-метилпропіл)-3-метил5Н-ізотіазол[5,4-d]піримідин-4-он До розчину 5-бензил-6-ізобутил-3-метил-5Нізотіазол[5,4-d]піримідин-4-ону (Спосіб 28) (1,3г, 4,2ммоля) та ацетату натрію (2г) в оцтовій кислоті (10мл) при температурі 100°С додавали по краплях розчин брому (1,32г, 8,4ммоля) в оцтовій кислоті (10мл) протягом періоду 20 хвилин. Реакційну суміш перемішували при цій температурі протягом 30хв. та охолоджували, TLC (елюент: 10% EtOAc у гексанах) та МС показали повне зникнення ВМ та тільки наявність продукту, що утворився. Реакційну суміш виливали в охолоджену за допомогою льоду воду, 44 екстрагували за допомогою EtOAc (3´60мл), поєднували органічні шари та промивали за допомогою 2% розчину тіосульфату натрію (60мл), води (100мл), насиченого сольового розчину (100мл) та висушували над Na2SO4. Концентрування органічного шару забезпечувало одержання 5-бензил-6-(1-бром-2-метилпропіл)-3метил-5Н-ізотіазол[5,4-d]піримідин-4-ону (1,61г, 99%) у вигляді білої кристалічної твердої речовини, m/z 394 (МН+), 1Н ЯМР (300МГц, CDCI3) d 0,54 (д, 3Н), 1,11 (д, 3Н), 2,62-2,76 (м, 1Н), 2,83 (с, 3Н), 4,42 (д, 1Н), 4,80 (д, 1Н), 6,22 (д,1Н), 7,127,42 (м, 5Н). Наступні сполуки були синтезовані відповідно до Способу 29: Спосіб 30 6-(1-азидо-2-метилпропіл)-5-бензил-3-метил5Н-ізотіазол[5,4-d]піримідин-4-он До розчину 5-бензил-6-(1-бром-2метилпропіл)-3-метил-5Н-ізотіазол[5,4-d]піримідин4-ону (Спосіб 29) (0,6г, 1,52ммоля) у безводному ДМФ (20мл) додавали азид натрію (0,65г, 10ммоля) та суміш перемішували при кімнатній температурі протягом 1 години. TLC RM показало повне зникнення вихідного броміду. Реакційну суміш виливали в охолоджену за допомогою льоду воду (300мл) та екстрагували за допомогою EtOAc (3´100мл). Органічний шар промивали водою (100мл), насиченим сольовим розчином (100мл) та висушували (Na2SO4). Концентрування органічного шару забезпечувало одержання продукту, який очищали за допомогою колонкової хроматографії при використанні 30% EtOAc у гексанах як елюента для ізоляції 6-(1-азидо-2-метилпропіл)-5бензил-3-метил-5Н-ізотіазол[5,4-d]піримідин-4-ону (0,506г, 94%) у вигляді твердої речовини з низькою точкою плавлення, m/z 355 (МН+), 1Н ЯМР (300МГц, CDCI3) d 0,57 (д, 3Н), 1,07 (д, 3Н), 2,502,74 (м, 1Н), 2,98 (с, 3Н), 3,71 (д, 1Н), 5,05 (д, 1Н), 5,78 (д, 1Н), 7,12-7,40 (м, 5Н). Наступні сполуки були синтезовані відповідно до Способу 30: Спосіб 31 6-(1-аміно-2-метилпропіл)-5-бензил-3-метил5Н-ізотіазол[5,4-d]піримідин-4-он До розчину 6-(1-азидо-2-метилпропіл)-5бензил-3-метил-5Н-ізотіазол[5,4-d]піримідин-4-ону (Спосіб 30) (0,5г, 1,41ммоля) у метанолі (20мл) додавали 5% Pd/C (20ваг.%) та отриману суміш перемішували при к.т. в атмосфері Н2, за проходженням реакції спостерігали за допомогою МС. Після зникнення вихідного матеріалу реакційну суміш фільтр ували через целіт та промивали за допомогою EtOAc. Концентрування фільтрату забезпечувало одержання 6-(1-аміно-2 45 81470 метилпропіл)-5-бензил-3-метил-5Н-ізотіазол[5,4d]піримідин-4-ону у вигляді жирного масла. Продукт використовували як такий у наступній реакції без додаткового очищення, m/z 349 (МН+). Наступні сполуки були синтезовані відповідно до Способу 31: Спосіб 32 Трет-бутиловий ефір {3-[1-(5-бензил-3-метил4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)-2метилпропіламіно]пропіл}карбамінової кислоти До розчину 6-(1-аміно-2-метилпропіл)-5бензил-3-метил-5Н-ізотіазол[5,4-d]піримідин-4-ону (Спосіб 31) у дихлорметані (30мл) додавали 4A молекулярні сита (5г), після чого додавали третбутиловий е фір (3-оксопропіл)карбамінової кислоти (1,2екв.) та реакційну суміш перемішували при к.т. протягом 3 годин, при цьому за розвитком реакції спостерігали за допомогою МС. Після повного зникнення вихідного матеріалу до реакційної суміші додавали каталітичну кількість оцтової кислоти, після чого додавали триацетоксиборогідрид натрію (1,2екв.) та реакційну суміш перемішували при к.т. протягом ночі. Після завершення реакції (МС) реакційну суміш фільтрували, залишок промивали за допомогою дихлорметану, а фільтрат промивали водою (100мл), насиченим сольовим розчином (100мл) та концентрували з одержанням продукту, який використовували як такий для наступної реакції, m/z 486 (МН+). Наступні сполуки були синтезовані відповідно до Способу 32: Спосіб 33 N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізотіазол[5,4-d]піримідин-6-іл)-2метилпропіл]-4-метилбензамід До розчину трет-бутилового ефір у {3-[1-(5бензил-3-метил-4-оксо-4,5-дигідроізотіазол[5,4d]піримідин-6-іл)-2метилпропіламіно]пропіл}карбамінової кислоти (Спосіб 31) у піридині (10мл) при к.т. додавали по краплях розчин п-толуоїлхлориду (0,616г, 4ммоля) у дихлорметані (10мл) Отриманий розчин перемішували при к.т. протягом 2 днів, після чого TLC показала зникнення основної частини ВМ. Реакційну суміш розводили за допомогою СН 2СІ2 (100мл), промивали водою (2´100мл), насиченим сольовим розчином (100мл) та висушували (Na2SO4). Концентрування органічного шару забезпечувало одержання продукту, який очищали за допомогою колонкової хроматографії при використанні 20-30% ETOAC у гексанах як елюента. Вихід=0,276м аміду. Ацильований продукт розчиняли в 4М НСІ в 1,4-діоксані та 46 суміш перемішували при к.т. протягом 20хв., TLC показала повне зникнення вихідного матеріалу. Реакційну суміш концентрували в роторному випарнику та залишок розтирали з етиловим ефіром. Продукт, що випав в осад, відфільтровували, промивали за допомогою етилового ефіру та висушували в умовах вакууму для одержання N-(3-амінопропіл)-N-[1-(5-бензил-3метил-4-оксо-4,5-дигідроізотіазол[5,4-d]піримідин6-іл)-2-метилпропіл]-4-метилбензаміду у вигляді гідрохлориду (196мг, 99%). Білий порошок, точка плавлення: 139-140°С, m/z 504 (МН+), 1Н ЯМР (ДМСО-d6, 300МГц, 96°С) d: 0,45 (д, 3Н), 0,90 (д, 3Н), 1,12-1,30 (м, 1Н), 1,46-1,63 (м, 1Н), 2,25 (т, 2Н), 2,36 (с, 3Н), 2,64-2,7 (м, 1Н), 2,68 (с, 3Н), 3,34 (т, 2Н), 5,06 (д, 1Н), 5,59 (д, 1Н), 5,90 (д, 1Н), 7,207,40 (м, 9Н), 7,71 (шс, 3Н). Наступні сполуки були синтезовані відповідно до Способу 33: Спосіб 34 Амід 3-метил-5-(3-метилбутирил)ізоксазол-2карбонової кислоти Суміш аміду 5-аміно-3-метилізоксазол-4карбонової кислоти (10г, 70ммолей) в 25мл ізовалеріанового ангідриду перемішували при температурі 110-145°С протягом 1 години. Коричневий розчин розводили за допомогою гексану (500мл) та охолоджували. Смолисту речовин, що випала в осад, відокремлювали від суміші, промивали за допомогою гексану та висушували в умовах вакуум у. Амід 3-метил-5-(3метилбутирил)ізоксазол-4-карбонової кислоти одержували у вигляді жовтої смолистої речовини, яку у подальшому використовували без очищення у Способі 35. Спосіб 35 6-ізобутил-3-метил-5Н-ізоксазол[5,4d]піримідин-4-он Суспензію аміду 3-метил-5-(3метилбутирил)ізоксазол-4-карбонової кислоти (Спосіб 34) (розподілена на 40 пробірок) в 3,5мл 2N водному розчині NaOH піддавали НВЧ опроміненню при температурі 140°С протягом 20хв. Отриманий розчин охолоджували на крижаній бані та значення рН доводили до 1-3 за допомогою концентрованої НСІ. Тверду речовину відфільтровували, промивали за допомогою води, висушували в умовах вакууму при температурі 40°С протягом ночі. 6-ізобутил-3-метил-5Нізоксазол[5,4-d]піримідин-4-он (8г) одержували у вигляді білої твердої речовини. Для двох етапів вихід склав 55%. m/z: 208 (МН+), 1Н Я МР (400МГц, ДМСО-d6): 0,76 (д, 6Н), 1,95 (м, 1Н), 2,25 (с, ЗН), 2,32 (д,2Н), 12,55 (с, 1Н). Спосіб 36 5-бензил-6-ізобутил-3-метил-5Н-ізоксазол[5,4d]піримідин-4-он Суспензію 6-ізобутил-3-метил-5Нізоксазол[5,4-d]піримідин-4-ону (Спосіб 35) (5г, 47 81470 24,4ммоля), бензилброміду (4,17г, 24,4ммоля), карбонату калію (6,7г, 48,8ммоля) в 20мл ДМФ перемішували при кімнатній температурі протягом 2 днів. Суміш розводили водою, екстрагували за допомогою етилацетату (100мл´3), поєднані органічні фази висушували над безводним сульфатом натрію, концентрували, очищали за допомогою флеш колонкової хроматографії (елюювання: гексан-етилацетат=7:1). 5-Бензил-6ізобутил-3-метил-5Н-ізоксазол[5,4-d]піримідин-4-он одержували у вигляді білої твердої речовини (3г, 10,1ммоля) (41%). m/z: 298 (МН+), 1Н ЯМР (400МГц, ДМСО-d6): 0,90 (д, 6Н), 2,30 (м, 1Н), 2,55 (с, 3Н), 2,75 (д, 2Н), 5,42 (с, 2Н), 7,22-7,43 (м, 5Н). Наступні сполуки були синтезовані відповідно до Способу 36: Спосіб 37 5-бензил-б-(1-бром-2-метилпропіл)-3-метил5Н-ізоксазол[5,4-d]піримідин-4-он Розчин 5-бензил-б-ізобутил-3-метил-5Hізоксазол[5,4-d]піримідин-4-ону (Спосіб 36) (130мг, 0,44ммоля) та ацетату натрію (90мг, 1,09ммоля, 2,5екв.) у крижаній оцтовій кислоті (2мл) піддавали обробці за допомогою попередньо приготовленого розчину брому (0,7мл брому в 10мл крижаної оцтової кислоти) (1,54мл, 2ммоля). Суміш перемішували при температурі 110-120°С протягом 1 дня. Надлишок брому (1,54мл, 2ммоля) додавали до суміші кожні 4 години двічі при температурі 110-120°С. До суміші додавали воду, а після цього додавали карбонат калію та екстрагували за допомогою метиленхлориду (20мл´3), поєднані органічні фази промивали водою та висушували над безводним сульфатом натрію, а потім концентрували з одержанням продукту, який очищали за допомогою ISCO (елюювання: гексан-етилацетат). 100мг (60%) 5бензил-6-(1-бром-2-метилпропіл)-3-метил-5Нізоксазол[5,4-d]піримідин-4-ону одержували у вигляді жовтої смолистої речовини, m/z. 377 (МН+), 1 Н ЯМР (400МГц, ДМСО-d6): 0,55 (д, 3Н), 1,02 (д, 3Н), 2,48 (м, 4Н), 4,75 (д, 1Н), 5,60 (д, 1Н), 5,70 (д, 1Н), 7,16-7,30 (м, 5Н). Наступні сполуки були синтезовані відповідно до Способу 37: Спосіб 38 6-(1-Азидо-2-метилпропіл)-5-бензил-3-метил5Н-ізоксазол[5,4-d]піримідин-4-он Суспензію 5-бензил-6-(1-бром-2-метилпропіл)3-метил-5H-ізоксазол[5,4-d]піримідин-4-ону (Спосіб 37) (100мг, 0,266ммоля) та азиду натрію (34,5мг, 0,53ммоля) у ДМФ (2мл) перемішували при температурі 60°С протягом 1 години. Додавали воду (5мл) до суміші та потім екстрагували за допомогою етилацетату (3´20мл). Поєднані 48 органічні фази промивали насиченим сольовим розчином (10мл), висушували над сульфатом натрію, концентрували з одержанням 6-(1-азидо-2метилпропіл)-5-бензил-3-метил-5H-ізоксазол[5,4d]піримідин-4-ону, який очищали за допомогою ISCO (гексан-етилацетат). Одержували 50мг (56%) безбарвного масла. m/z: 339 (MH+), 1H ЯМР (400МГц, ДМСО-d6): 0,60 (д, 3Н), 0,95 (д, 3Н), 2,25 (м, 1Н), 2,45 (с, 3Н), 4,19 (д, 1Н), 5,30 (д, 1Н), 5,42 (д, 1Н), 7,12-7,30 (м, 5Н). Наступні сполуки були синтезовані відповідно до Способу 38: Спосіб 39 6-(1-аміно-2-метилпропіл)-5-бензил-3-метил5Н-ізоксазол[5,4-d]піримідин-4-он Суміш 6-(1-азидо-2-метилпропіл)-5-бензил-3метил-5H-ізоксазол[5,4-d]піримідин-4-она (Спосіб 38) (40мг, 1,118ммоля), трифенілфосфін у (62мг, 0,237ммоля) та води (4мкл) у ТГФ перемішували при температурі 60°С протягом 5 годин. До суміші додавали надлишкову кількість води (30мкл) та перемішували при 60°С протягом подальших 10 годин. Відганяли леткий розчинник, продукт очищали за допомогою ISCO (етилацетат:гексан=60%). Одержували 25мг (68%) 6-(1-аміно-2-метилпропіл)-5-бензил-3-метил-5Нізоксазол[5,4-d]піримідин-4-ону у вигляді безбарвного масла. m/z: 313 (МН+), 1Н ЯМР (400МГц, ДМСО-d6): 0,55 (д, 3Н), 0,95 (д, 3Н), 2,02 (м, 1Н), 2,15 (ш, 2Н), 2,55 (с, 3Н), 3,59 (д, 1Н), 5,38 (д, 1Н), 5,65 (д, 1Н), 7,25-7,42 (м, 5Н). Наступні сполуки були синтезовані відповідно до Способу 39: Спосіб 40 Трет-бутиловий ефір {3-[1-(5-бензил-3-метил4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)-2метилпропіламіно]пропіл}карбамінової кислоти Суміш 6-(1-аміно-2-метилпропіл)-5-бензил-3метил-5Н-ізоксазол[5,4-d]піримідин-4-ону (Спосіб 39) (20мг, 0,064ммоля) та трет-бутилового ефіру (3-оксопропіл)карбамінової кислоти (11мг, 0,064ммоля) у метиленхлориді (5мл) з висушеним 4AMS перемішували протягом 1 години при кімнатній температурі. Потім до суміші додавали триацетоксиборогідрид (2екв.) та 1 краплю оцтової кислоти. Суміш перемішували при кімнатній температурі протягом 1 дня. Суміш фільтр ували через картридж 2мкм, концентрували фільтрат, суміш очищали за допомогою ISCO (елюювання: етилацетат-гексан=30%~60%) з одержанням 18мг (60%) трет-бутилового ефіру {3-[1-(5-бензил-3метил-4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин6-іл)-2-метилпропіламіно]пропіл}карбамінової кислоти у вигляді білої твердої речовини, m/z: 470 (МН+), 1Н Я МР (400МГц, ДМСО-d6): 0,65 (д, 3Н), 49 81470 0,80 (д, 3Н), 1,10 (м, 2Н), 1,25 (с, 9Н), 1,32 (д, 1Н), 1,70-1,90 (м, 2Н), 2,18 (м, 1Н), 2,49 (с, 3Н), 2,70 (м, 2Н), 3,48 (д, 1Н), 5,15 (д, 1Н), 5,51 (д, 1Н), 6,55 (ш,1Н), 7,12-7,32 (м, 5Н). Наступні сполуки були синтезовані відповідно до Способу 40: Спосіб 41 Трет-бутиловий ефір {3-[[1-(5-бензил-3-метил4-оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)-2метилпропіл]-(4метилбензоїл)аміно]пропіл}карбамінової кислоти До розчину трет-бутилового ефір у {3-[1-(5бензил-3-метил-4-оксо-4,5-дигідроізоксазол[5,4d]піримідин-6-іл)-2метилпропіламіно]пропіл}карбамінової кислоти (Спосіб 40) (100мг, 0,213ммоля) у дихлорметані (4мл) додавали толуоїлхлорид (66мг, 0,426ммоля), після чого додавали триетиламін (65мг, 0,639ммоля). Суміш перемішували при температурі 30-40°С протягом 2 днів. Потім суміш розводили за допомогою дихлорметану, промивали насиченим водним розчином бікарбонату натрію. Органічну фазу висушували над сульфатом натрію, фільтрували та концентрували. Сировинний продукт у вигляді масла очищали за допомогою ISCO (розчинник: етилацетат-гексан) з одержанням трет-бутилового ефіру {3-[[1-(5-бензил-3-метил-4-оксо-4,5дигідроізоксазол[5,4-d]піримідин-6-іл)-2метилпропіл]-(4метилбензоїл)аміно]пропіл}карбамінової кислоти у вигляді білої твердої речовини (115мг, 0,196ммоля). m/z: 588 (МН+). Наступні сполуки були синтезовані відповідно до Способу 41: Спосіб 42 N-(3-амінопропіл)-N-[1-(5-бензил-3-метил-4оксо-4,5-дигідроізоксазол[5,4-d]піримідин-6-іл)-2метилпропіл]-4-метилбензамід 50 Розчин трет-бутилового ефіру {3-[[1-(5-бензил3-метил-4-оксо-4,5-дигідроізоксазол[5,4d]піримідин-6-іл)-2-метилпропіл]-(4метилбензоїл)аміно]пропіл}карбамінової кислоти (Спосіб 41) (0,2ммоля) в 3мл 4Μ НСІ у діоксані перемішували при кімнатній температурі протягом 2 годин. Розчинник відганяли під вакуумом, залишок висушували при температурі 40~50°С протягом ночі під вакуумом. N-(3-амінопропіл)-N[1-(5-бензил-3-метил-4-оксо-4,5дигідроізоксазол[5,4-d]піримідин-6-іл)-2метилпропіл]-4-метилбензамід одержували у вигляді солі НСІ, m/z 488 (МН+), 1Н Я МР (500МГц, 100°С, ДМСО-d6): 0,48 (д, 3Н), 0,94 (д, 3Н), 1,30 (м, 1Н), 1,60 (м, 1Н), 2,35 (м, 2Н), 2,38 (с, 3Н), 2,58 (с, 3Н), 2,70 (м, 1Н), 3,37 (м, 2Н), 5,11 (д, 1Н), 5,64 (д, 1Н), 5,90 (д, 1Н), 7,23-7,39 (м, 9Н), 7,63 (ш, 3Н). Наступні сполуки були синтезовані відповідно до Способу 42: Наступні сполуки були синтезовані відповідно до схеми синтезу А-1, представленою вище: 51 Наступні сполуки були синтезовані відповідно до схеми синтезу А-2, представленою вище: 81470 52 53 Наступні сполуки були синтезовані згідно з Прикладом В, наведеним вище: 81470 54 55 Наступні сполуки були синтезовані у відповідності зі схемою синтезу С, наведеною вище: 81470 56 Наступні сполуки були синтезовані відповідно до схеми синтезу D, наведеною вище: 57 81470 58 Наступні сполуки були синтезовані відповідно до схеми синтезу F, наведеною вище: Наступні сполуки були синтезовані відповідно до схеми синтезу Е, наведеною вище: Застосування Сполуки згідно з даним винаходом мають застосування для лікування неопластичного 59 81470 захворювання шляхом інгібування рухового білка HsEg5. Способи лікування націлені на активність Eg5, що необхідна для утворення мітотичного веретена та, таким чином, для клітинного поділу. Виходячи із цього, інгібітори Eg5 були представлені як такі, що блокують клітини в метафазі мітозу, що приводить до апоптозу клітин, які піддавалися впливу і, таким чином, він володіє антипролиферативним ефектом. Відповідно до цього інгібітори Eg5 діють як модулятори клітинного поділу та, як очікується, є активними у відношенні неопластичного захворювання, такого, як карцинома молочної залози, яєчника, легені, товстого кишечнику, передміхурової залози або інших тканин, а також відносно лейкемії та лімфоми, пухлин центральної та периферичної нервової системи та інших типів пухлин, таких, як меланома, фібросаркома та остеосаркома. Інгібітори Eg5, як передбачається, також будуть корисними для лікування інших проліферативних захворювань, включаючи без обмеження аутоімунні, запальні, неврологічні та серцевосудинні захворювання. Сполуки відповідно до даного винаходу були продемонстровані як такі, що інгібують Eg5, що було визначено за допомогою аналізу при використанні малахітового зеленого, як представлено в даній заявці. Сполуки, запропоновані в даному винаході, також будуть корисними як стандарти та реагенти при визначенні здатності потенційного фармацевтичного засобу інгібувати Eg5. Такі сполуки буду запропоновані в комерційних наборах, що включають сполуку відповідно до даного винаходу. Аналізи Аналіз при використанні малахітового зеленого Ферментативна активність Eg5 рухового механізму та ефекти інгібіторів вимірювали при використанні аналізу на основі малахітового зеленого, за допомогою якого вимірюють фосфат, що вивільнився з АТФ. Раніше цей аналіз використовували для вимірювання активності рухового механізму кінезину (Hackney та Jiang, 2001). Фермент представляв собою рекомбінантний HsEg5 руховий домен (амінокислоти 1-369-8His), його додавали при заключній концентрації 6нМ до 100мкл реакційного середовища. Буфер складався з 25мМ PIPES/KОН, рН 6,8, 2мМ МgСІ2 , 1мМ EGTA, 1мМ dtt, 0,01% Тритону Х-100 та 5мкМ паклітакселу. Реагент малахітовий зелений/молібдат амонію одержували в такий спосіб: для заключного об'єму 800мл 0,27г малахітового зеленого (J.T. Baker) розчиняли в 600мл Н2О в поліпропіленовій пляшці. 8,4г молібдату амонію (Sigma) розчиняли в 200мл 4N НСІ. Розчин перемішували протягом 20 хвилин та фільтр ували через фільтр 0,02мкм безпосередньо в поліпропіленовий контейнер. 5мкл сполуки, розведеної в 12% ДМСО, додавали до комірок планшета на 96 комірок. 80мкл ферменту, розведеного в буферному розчині, наведеному вище, додавали в кожну комірку та інкубували зі сполукою протягом 20 60 хвилин. Після цього періоду попередньої інкубації субстратний розчин, що містив 2мМ АТФ (заключна концентрація: 300мкМ) та 6,053мкМ полімеризованого тубуліну (заключна концентрація: 908нМ) в 15мкл буфера, згодом додавали до кожної комірки для початку реакції. Реакційну суміш перемішували та інкубували, зокрема, протягом 20 хвилин при кімнатній температурі. Реакції зупиняли шляхом додання 150мкл реагенту малахітового зеленого/молібдату амонію та зчитували абсорбцію при 650 нанометрах точно через 5 хвилин після зупинки реакції при використанні пристрою, що зчитує, для планшетів Spectramax Plus (Molecular Devices). Дані наносили на графік та підраховували значення ІС50 при використанні ExCel Fit (Microsoft).
ДивитисяДодаткова інформація
Назва патенту англійськоюFused heterocycles and uses thereof
Автори англійськоюAquila Brian, BLOCK MICHAEL HOWARD, Davies Audrey, Ezhuthachan Jayachandran, Filla Sandra, Luke Richard William, Pontz Timothy, Theoclitou Maria-Elena, Zheng Xiaolan, Zheng, Xiaolan
Назва патенту російськоюКонденсированные гетероциклы и их применение
Автори російськоюАквила Брайан, Блок Майкл Говард, Дейвис Одри, Эжутхачан Джайачандран, Филла Сандра, Лук Ричард Вилльям, Понц Тимоти, Теоклитоу Мариа-Елена, Чжен СяоЛань
МПК / Мітки
МПК: A61P 29/00, A61P 17/06, C07D 513/04, A61K 31/519, C07D 491/044, A61P 19/02, A61P 35/00, C07D 498/04, A61P 19/08
Мітки: гетероцикли, застосування, конденсовані
Код посилання
<a href="https://ua.patents.su/30-81470-kondensovani-geterocikli-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Конденсовані гетероцикли та їх застосування</a>
Попередній патент: Похідні 4-(2-фенілоксифеніл)піперидину або -1,2,3,6-тетрагідропіридину як інгібітори зворотного захоплення серотоніну
Наступний патент: Спосіб непрямого зрідження вугілля і пристрій для його здійснення
Випадковий патент: Привідний роликовий вузол стенда для ультразвукової дефектоскопії коліс (варіанти)












