Стабільна пероральна тверда композиція поліпептидного агоніста gc-c рецептора лінаклотиду та спосіб її одержання
Номер патенту: 104870
Опубліковано: 25.03.2014
Автори: Чжао Хун, Фретцен Ангеліка, Гроссі Альфредо, Мо Юнь, Дедія Махендра, Вітовскі Стівен
Формула / Реферат
1. Фармацевтична композиція, що містить фармацевтично прийнятний наповнювач, лінаклотид, катіон, вибраний з Mg2+, Ca2+, Zn2+, Mn2+, K+, Na+ або Аl3+, і стерично утруднений первинний амін.
2. Фармацевтична композиція за п. 1, де вказаний Mg2+, Ca2+, Zn2+, Mn2+, K+, Na+ або Аl3+ представлений як хлорид магнію, хлорид кальцію, фосфат кальцію, сульфат кальцію, ацетат цинку, хлорид марганцю, хлорид калію, хлорид натрію або хлорид алюмінію.
3. Фармацевтична композиція за п. 1 або 2, де вказаний катіон є Са2+ і представлений як хлорид кальцію.
4. Фармацевтична композиція за будь-яким з пп. 1-3, де стерично утруднений первинний амін вибраний з амінокислоти, полімерного аміну або сполуки формули:
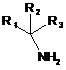 ,
,
де R1, R2 і R3 незалежно вибирають з: Н; -С(О)ОН; С1-С6-алкілу, необов'язково заміщеного
-СО2Н, -CONH2, або 5-10-членного арилу або гетероарилу; С1-С6-алкоксіалкілу; або С1-С6-тіоалкоксіалкілу, де будь-яка із вказаних вище алкільних або арильних груп може бути одноразово або багаторазово заміщена галогеном або -NH2, і за умови, що не більше ніж два з R1, R2 і R3 являють собою Н.
5. Фармацевтична композиція за п. 4, де стерично утруднений первинний амін являє собою амінокислоту, що зустрічається в природі, яка вибрана з групи, що складається з гістидину, фенілаланіну, аланіну, глютамової кислоти, аспарагінової кислоти, глютаміну, лейцину, метіоніну, аспарагіну, тирозину, треоніну, ізолейцину, триптофану або валіну.
6. Фармацевтична композиція за п. 5, де амінокислота, що зустрічається в природі, являє собою лейцин.
7. Фармацевтична композиція за будь-яким з пп. 1-6, що додатково містить фармацевтично прийнятний глідант, мастильну речовину або добавку, яка діє і як глідант, і як мастильна речовина.
8. Фармацевтична композиція за будь-яким з пп. 1-7, що додатково містить антиоксидант, фармацевтично прийнятну зв'язувальну речовину або фармацевтично прийнятний наповнювач.
9. Фармацевтична композиція за п. 8, де фармацевтично прийнятну зв'язувальну речовину вибирають з полівінілового спирту, полівінілпіролідону (повідону), крохмалю, мальтодекстрину або простого ефіру целюлози.
10. Фармацевтична композиція за п. 9, де фармацевтично прийнятна зв'язувальна речовина являє собою простий ефір целюлози, вибраний з: метилцелюлози, етилцелюлози, карбоксиметилцелюлози, гідроксіетилцелюлози, гідроксіетилметилцелюлози, гідроксипропілцелюлози і гідроксипропілметилцелюлози.
11. Фармацевтична композиція за будь-яким з пп. 8-10, де фармацевтично прийнятний наповнювач являє собою целюлозу, ізомальт, манітол або двоосновний фосфат кальцію.
12. Фармацевтична композиція за п. 11, де целюлоза вибрана з надчистої целюлози і мікрокристалічної целюлози.
13. Фармацевтична композиція за будь-яким з пп. 1-12, де стерично утруднений амін являє собою лейцин і молярне співвідношення лейцину і лінаклотиду становить як мінімум 10:1.
14. Фармацевтична композиція за будь-яким з пп. 1-13, де катіон являє собою Са2+, стерично утруднений амін являє собою лейцин і молярне співвідношення Са2+ і лейцину становить як мінімум 1:1.
15. Фармацевтична композиція за будь-яким з пп. 1-14, де молярне співвідношення катіон:стерично утруднений первинний амін:лінаклотид становить 40-100:20-50:1.
16. Фармацевтична композиція за будь-яким з пп. 1-15, де катіон являє собою Са2+, стерично утруднений амін являє собою лейцин і молярне співвідношення Са2+:лейцин:лінаклотид становить 60:30:1.
17. Фармацевтична композиція за будь-яким з пп. 1-16, що додатково включає:
і) продукт гідролізу, який має структуру
 ,
,
що становить менше 2 % по масі в порівнянні з масою лінаклотиду,
іі) формальдегід-імінний продукт, який має структуру
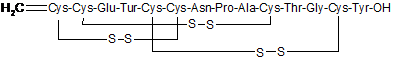 ,
,
що становить менше 2 % по масі в порівнянні з масою лінаклотиду,
ііі) продукт окиснення лінаклотиду, який має молекулярну масу 1542,8 і становить менше 2 % по масі в порівнянні з масою лінаклотиду.
18. Спосіб отримання фармацевтичної композиції, що містить лінаклотид або його сіль, де спосіб включає:
(a) виготовлення водного розчину, що містить:
(і) лінаклотид або його фармацевтично прийнятну сіль;
(іі) один або більше катіонів, вибраних з Mg2+, Ca2+, Zn2+, Mn2+, K+, Na+ або Аl3+, або стерично утруднений первинний амін; і
(ііі) за необхідності, фармацевтично прийнятну речовину; і
(b) нанесення водного розчину на фармацевтично прийнятний наповнювач з отриманням покритого лінаклотиду.
19. Спосіб за п. 18, де водний розчин наносять на наповнювач шляхом розпилення.
20. Фармацевтична композиція за будь-яким з пп. 1-17 для застосування для лікування захворювань шлунково-кишкового тракту, що вибрані з погіршеної моторики травного тракту, синдрому подразненого кишечника, констипації, болю, пов'язаного з констипацією, диспепсії, гастропарезу, хронічної кишкової псевдообструкції, хвороби Крона, виразкового коліту або запального захворювання кишечника.
21. Фармацевтична композиція за п. 20, де вказаний синдром подразненого кишечника являє собою синдром подразненого кишечника з переважанням констипації або переміжний синдром подразненого кишечника.
22. Фармацевтична композиція за п. 20, де вказаний синдром подразненого кишечника являє собою синдром подразненого кишечника з переважанням констипації.
23. Фармацевтична композиція за п. 20, де вказана констипація являє собою хронічну констипацію, ідіопатичну констипацію, постопераційну кишкову непрохідність або констипацію, що викликана вживанням опіатів.
24. Фармацевтична композиція за п. 23, де вказана констипація являє собою хронічну констипацію.
25. Фармацевтична композиція за будь-яким з пп. 20-24, де фармацевтична композиція містить від 50 мкг до 1 мг лінаклотиду.
26. Фармацевтична композиція за п. 25, де фармацевтична композиція містить 67,5 мкг, 133 мкг, 150 мкг, 266 мкг або 300 мкг лінаклотиду.
27. Фармацевтична композиція за будь-яким з пп. 20-26, де фармацевтичну композицію призначають для прийому один або два рази на день.
28. Фармацевтична композиція за будь-яким з пп. 20-27, де фармацевтичну композицію призначають для прийому один раз на день як одну або дві таблетки або капсули.
29. Фармацевтична композиція за будь-яким з пп. 20-28, де фармацевтична композиція містить 266 мкг лінаклотиду.
30. Фармацевтична композиція за будь-яким з пп. 20-28, де фармацевтична композиція містить 133 мкг лінаклотиду.
31. Фармацевтична композиція за будь-яким з пп. 20-30, де вказане лікування проводять протягом періоду, що становить як мінімум чотири тижні.
32. Фармацевтична композиція за будь-яким з пп. 20-31, де проведенням вказаного лікування покращують як мінімум один симптом, вибраний з полегшеного абдомінального болю, збільшення кількості повних самовільних випорожнень кишечника (СВВК) на тиждень, збільшення кількості самовільних випорожнень кишечника (СВВК) на тиждень, поліпшеної консистенції випорожнень, зменшення натужувань, зменшеного абдомінального дискомфорту, зменшеного метеоризму або зменшеної тяжкості симптому СРК-к.
33. Фармацевтична композиція, що містить:
лінаклотид;
Ca2+;
лейцин і
гідроксипропілметилцелюлозу,
де молярне співвідношення Са2+:лейцин:лінаклотид становить 5-100:5-50:1.
34. Фармацевтична композиція за п. 33, де Са2+ представлений як СаСl2.
35. Фармацевтична композиція за будь-яким з пп. 1-17, 33, 34, що містить покриті гранули, де гранули вкриті покривним розчином, що містить лінаклотид.
36. Фармацевтична композиція за п. 35, де покривний розчин містить:
лінаклотид;
Са2+;
лейцин і
гідроксипропілметилцелюлозу,
де молярне співвідношення Са2+:лейцин:лінаклотид становить 5-100:5-50:1.
37. Фармацевтична композиція за п. 36, де гранули містять мікрокристалічну целюлозу.
38. Стандартна лікарська форма, що містить фармацевтичну композицію за будь-яким з пп. 1-17 або 33-37.
39. Герметичний контейнер, що містить множину стандартних лікарських форм за п. 38.
Текст
Реферат У цій заявці описані тверді стабільні композиції лінаклотиду, прийнятні для перорального введення, а також способи одержання таких композицій. Композиції, які описані у цій заявці, містять поліпептид, що складається з амінокислотної послідовності Cys-Cys-Glu-Туr-Cys-CysAsn-Pro-Ala-Cys-Thr-Gly-Cys-Tyr ("лінаклотид") або її фармацевтично прийнятної солі. Композиції лінаклотиду, які описані у цій заявці, є стабільними і мають час напівжиття, достатній для виробництва, зберігання та розповсюдження лікарського засобу. UA 104870 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки Ця заявка стосується твердих композицій поліпептидного агоніста гуанілатциклазного-С рецептора, прийнятних для перорального введення та способів одержання таких композицій. заявка про пріоритет У цій заявці заявлено пріоритет патентної заявки США реєстраційний номер 61/089,422, поданої 15 серпня 2008 р., та попередньої патентної заявки США, поданої 03 серпня 2009 г під назвою "Стабільна тверда композиція поліпептидного агоністу GC-C рецептора, прийнятна для перорального введення". Весь вміст вищевказаних заявок включено до цієї заявки шляхом посилання. Рівень техніки Велика кількість терапевтично-активних поліпептидів включена до композиції у водному розчині, оскільки вони проявляють найбільшу активність у такий форма. Проте більша частина поліпептидів не є особо стабільними у водному розчині, таким чином, композиції часто мають короткий період напівжиття та потребують охолодження. Хоча водні розчини поліпептидів можуть бути висушені ліофільною сушкою, сушкою розпиленням або іншими способами, такі висушені композиції можуть бути також нестабільними та мати знижену активність порівняно із водним розчином поліпептиду. Типові механізми руйнування, яке відбувається як у водному розчині, так і у висушених композиціях, включають агломерацію та оксидативний або гідролітичний розпад. Таким чином, більша частина терапевтично-активних поліпептидів, у водному розчині або висушених, зберігають в охолоджених умовах з огляду на їх обмежену стабільність. Лінаклотид являє собою пептид, що має амінокислотну послідовність Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr, що активізує гуанілатциклазний-C (GC-C) рецептор. Лінаклотид, який може бути введений перорально, можна застосовувати для лікування шлунково-кишкових розладів та станів, включаючи синдром роздратованого кишечника (СРК) та хронічний запор (ХЗ). Композиції, що містять лінаклотид, необхідно було охолоджувати для уникнення розпаду з часом. Проте охолодження є незручним як для комерційного розповсюдження лікарського засобу, так и для зберігання пацієнтами. Таким чином, існує потреба в твердій композиції лінаклотиду, яка є стабільною при кімнатній температурі протягом щонайменше 12 місяців. Суть винаходу У цій заявці описано тверді стабільні композиції лінаклотиду, прийнятні для перорального введення та способи одержання таких композицій. Композиції, які описані у цій заявці, містять поліпептид, що складається з амінокислотної послідовності Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr ("лінаклотид") або його фармацевтично прийнятну сіль. Композиції лінаклотиду, які описані у цій заявці, є стабільними и мають час напівжиття, достатній для виробництва, зберігання и розповсюдження лікарського засобу. Наприклад, передбачається, що композиції, які описані у цій заявці, мають термін напівжиття, що становить щонайменше 12 місяців за умов зберігання при кімнатній температурі (наприклад, 25ºC/60 % відносної вологості (ОВ)). В додаткових варіантах виконання передбачається, що композиції, які описані у цій заявці, мають термін напівжиття, що становить щонайменше 18 місяців або щонайменше 24 місяців за умов зберігання при кімнатній температурі (наприклад, 25ºC/60 % ВВ). В деяких варіантах виконання, описані композиції, де ≥ 95 % вихідної кількості лінаклотиду в композиції залишається через три місяця, якщо упаковані проби зберігають в умовах прискореного розпаду (40ºC/75 % ВВ) при оцінці в аналізі на мас./мас. основі, як визначено за допомогою високоефективної рідинної хроматографії (ВЕРХ) порівняно із лінаклотидом стандартного зразка. В додаткових варіантах виконання, ≥ 90 % вихідної кількості лінаклотиду в композиції залишається через щонайменше 6 місяців, якщо упаковані проби зберігають в умовах прискореного розпаду (40ºC/75 % ВВ). В інших варіантах виконання, описані композиції, в яких хроматографічна чистота лінаклотиду, визначена як відсоток площі за допомогою ВЕРХ, залишається на рівні ≥ 95 % протягом щонайменше трьох місяців, якщо упаковані проби зберігають в умовах прискореного розпаду (40ºC/75 % ВВ). В додаткових варіантах виконання, хроматографічна чистота лінаклотиду, визначена як відсоток площі за допомогою ВЕРХ, залишається на рівні ≥ 90 % протягом щонайменше 6 місяців, якщо упаковані проби зберігають в умовах прискореного розпаду (40 ºC/75 % ВВ). Таким чином, наприклад, не більш, ніж приблизно 10 % лінаклотиду розпадається на інші продукти, такі як продукт окислення лінаклотиду, продукт гідролізу лінаклотиду або формальдегід-опосередкований імінний продукт лінаклотиду ("формальдегід-імінний продукт"). 1 UA 104870 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті виконання, даний винахід включає фармацевтичну композицію, що містить лінаклотид, де хроматографічна чистота лінаклотиду зменшується менш, ніж на 10 % через 18 місяців або 24 місяця зберігання фармацевтичної композиції в герметичному контейнері, що містить десікант, при 25 °C та при 60 % відносної вологості. В додатковому варіанті виконання, хроматографічна чистота лінаклотиду зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 % або 2 % через 18 місяців або 24 місяця зберігання фармацевтичної композиції в герметичному контейнері, що містить десікант, при 25 °C та при 60 % відносної вологості. В іншому варіанті виконання, даний винахід включає фармацевтичну композицію, що містить лінаклотид, де хроматографічна чистота лінаклотиду зменшується менш, ніж на 10 % через 3 місяця або 6 місяців зберігання фармацевтичної композиції в герметичному контейнері, що містить десікант при 40 °C та при 75 % відносної вологості. В додатковому варіанті виконання, хроматографічна чистота лінаклотиду зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 % або 2 % через 3 місяця або 6 місяців зберігання фармацевтичної композиції в герметичному контейнері, що містить десікант, при 40 °C та при 75 % відносної вологості. В одному варіанті виконання, даний винахід включає стандартну лікарську форму фармацевтичної композиції, що містить лінаклотид, де хроматографічна чистота лінаклотиду зменшується менш, ніж на 10 % через 18 місяців або 24 місяця зберігання стандартної лікарської форми в герметичному контейнері, що містить десікант, при 25 °C та при 60 % відносної вологості. В додатковому варіанті виконання, хроматографічна чистота лінаклотиду зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 % або 2 % через 18 місяців або 24 місяця зберігання стандартної лікарської форми в герметичному контейнері, що містить десікант, при 25 °C та при 60 % відносної вологості. В іншому варіанті виконання, даний винахід включає стандартну лікарську форму фармацевтичної композиції, що містить лінаклотид, де хроматографічна чистота лінаклотиду зменшується менш, ніж на 10 % через 3 місяця або 6 місяців зберігання стандартної лікарської форми в герметичному контейнері, що містить десікант, при 40 °C та при 75 % відносної вологості. В додатковому варіанті виконання, хроматографічна чистота лінаклотиду зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 % або 2 % через 3 місяця або 6 місяців зберігання стандартної лікарської форми в герметичному контейнері, що містить десікант, при 40 °C та при 75 % відносної вологості. В одному варіанті виконання, даний винахід включає герметичний контейнер, що містить множину стандартних лікарських форм фармацевтичної композиції, що містить лінаклотид, де хроматографічна чистота лінаклотиду зменшується менш, ніж на 10 % через 18 місяців або 24 місяця зберігання герметичного контейнера, що містить десікант при 25 °C та при 60 % відносної вологості. В додатковому варіанті виконання, хроматографічна чистота лінаклотиду зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, або 2 % через 18 місяців або 24 місяця зберігання герметичного контейнера, що містить десікант при 25 °C та при 60 % відносної вологості. В іншому варіанті виконання, даний винахід включає герметичний контейнер, що містить множину стандартних лікарських форм фармацевтичної композиції, що містить лінаклотид, де хроматографічна чистота лінаклотиду зменшується менш, ніж на 10 % через 3 місяця або 6 місяців зберігання герметичного контейнера, що містить десікант при 40 °C та при 75 % відносної вологості. В додатковому варіанті виконання, хроматографічна чистота лінаклотиду зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 % або 2 % через 3 місяця або 6 місяців зберігання герметичного контейнера, що містить десікант при 40 °C та при 75 % відносної вологості. В одному варіанті виконання, даний винахід включає фармацевтичну композицію, що містить лінаклотид, де оціночне значення для лінаклотиду визначене на мас./мас. основі зменшується менш, ніж на 10 % через 18 місяців або 24 місяця зберігання фармацевтичної композиції в герметичному контейнері, що містить десікант, при 25 °C та при 60 % відносної вологості. В додатковому варіанті виконання, оціночне значення для лінаклотиду визначене на мас./мас. основі зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 % або 1 % через 18 місяців або 24 місяця зберігання фармацевтичної композиції в герметичному контейнері, що містить десікант, при 25 °C та при 60 % відносної вологості. В іншому варіанті виконання, даний винахід включає фармацевтичну композицію, що містить лінаклотид, де оціночне значення для лінаклотиду визначене на мас./мас. основі зменшується менш, ніж на 10 % через 3 місяця або 6 місяців зберігання фармацевтичної композиції в герметичному контейнері, що містить десікант, при 40 °C та при 75 % відносної вологості. В додатковому варіанті виконання, хроматографічна чистота лінаклотиду зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 % або 1 % через 3 місяця або 6 місяців зберігання фармацевтичної композиції в герметичному контейнері, що містить десікант, при 40 °C та при 75 % відносної вологості. 2 UA 104870 C2 5 10 15 20 25 30 35 В одному варіанті виконання, даний винахід включає стандартну лікарську форму фармацевтичної композиції, що містить лінаклотид, де оціночне значення для лінаклотиду, визначене на мас./мас. основі, зменшується менш, ніж на 10 % через 18 місяців або 24 місяця зберігання стандартної лікарської форми в герметичному контейнері, що містить десікант, при 25 °C та при 60 % відносної вологості. В додатковому варіанті виконання, оціночне значення для лінаклотиду, визначене на мас./мас. основі, зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 % або 1 % через 18 місяців або 24 місяця зберігання стандартної лікарської форми в герметичному контейнері, що містить десікант, при 25 °C та при 60 % відносної вологості. В іншому варіанті виконання, даний винахід включає стандартну лікарську форму фармацевтичної композиції, що містить лінаклотид, де оціночне значення для лінаклотиду визначене на мас./мас. основі зменшується менш, ніж на 10 % через 3 місяця або 6 місяців зберігання стандартної лікарської форми в герметичному контейнері, що містить десікант, при 40 °C та при 75 % відносної вологості. В додатковому варіанті виконання, оціночне значення для лінаклотиду, визначене на мас./мас. основі, зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 % або 1 % через 3 місяця або 6 місяців зберігання стандартної лікарської форми в герметичному контейнері, що містить десікант при 40 °C та при 75 % відносної вологості. В одному варіанті виконання, даний винахід включає герметичний контейнер, що містить множину стандартних лікарських форм фармацевтичної композиції, що містить лінаклотид, де оціночне значення для лінаклотиду, визначене на мас./мас. основі, зменшується менш, ніж на 10 % через 18 місяців або 24 місяця зберігання герметичного контейнера при 25 °C та при 60 % відносної вологості в герметичному контейнері, що містить десікант. В додатковому варіанті виконання, оціночне значення для лінаклотиду, визначене на мас./мас. основі, зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 % або 1 % через 18 місяців або 24 місяця зберігання герметичного контейнера, що містить десікант при 25 °C та при 60 % відносної вологості. В іншому варіанті виконання, даний винахід включає герметичний контейнер, що містить множину стандартних лікарських форм фармацевтичної композиції, що містить лінаклотид, де оціночне значення для лінаклотиду, визначене на мас./мас. основі, зменшується менш, ніж на 10 % через 3 місяця або 6 місяців зберігання герметичного контейнера, що містить десікант при 40 °C та при 75 % відносної вологості. В додатковому варіанті виконання, оціночне значення для лінаклотиду, визначене на мас./мас. основі, зменшується менш, ніж на 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 % або 1 % через 3 місяця або 6 місяців зберігання герметичного контейнера, що містить десікант при 40 °C та при 75 % відносної вологості. В деяких варіантах виконання, представлена фармацевтична композиція, що містить лінаклотид и продукт гідролізу, що містить: H-Cys-Cys-Glu-Tyr-Cys-Cys-Asp-Pro-Ala-Cys-Thr-Gly-Cys-Tyr-OH S S S S S S 40 45 В деяких варіантах виконання, продукт гідролізу містить менш ніж приблизно 15 % по масі композиції, менш ніж приблизно 10 % по масі композиції, менш ніж приблизно 7 % по масі композиції або менш ніж приблизно 5 % по масі композиції. В інших варіантах виконання, продукт гідролізу містить від приблизно 0,01 % до приблизно 15 % по масі композиції, від приблизно 0,05 % до приблизно 10 % по масі композиції, від приблизно 0,05 % до приблизно 7 % по масі композиції або від приблизно 0,05 % до приблизно 5 % помасі композиції. В додаткових варіантах виконання, представлено спосіб лікування шлунково-кишкового розладу у пацієнта, що потребує такого лікування, що включає введення фармацевтичної композиції, що містить лінаклотид и продукт гідролізу. В деяких варіантах виконання, запропонована фармацевтична композиція, що містить лінаклотид и формальдегід-імінний продукт, що містить: H2C 50 Cys-Cys-Glu-Tyr-Cys-Cys-Asn-Pro-Ala-Cys-Thr-Gly-Cys-Tyr-OH S S S S S S В деяких варіантах виконання, формальдегід-імінний продукт містить менш ніж приблизно 15 % по масі композиції, менш ніж приблизно 10 % по масі композиції, менш ніж приблизно 7 % по масі композиції або менш ніж приблизно 5 % по масі композиції. В інших ілюстративних варіантах виконання, формальдегід-імінний продукт містить від приблизно 0,01 % до приблизно 3 UA 104870 C2 5 10 15 % по масі композиції, приблизно 0,05 % до приблизно 10 % по масі композиції, приблизно 0,05 % до приблизно 7 % по масі композиції або приблизно 0,05 % до приблизно 5 % по масі композиції. В додаткових варіантах виконання представлено спосіб лікування шлунковокишкового розладу у пацієнта, що потребує такого лікування, що включає введення фармацевтичної композиції, що містить лінаклотид и формальдегід-імінний продукт. В деяких варіантах виконання, представлена фармацевтична композиція, що містить лінаклотид и продукт його окислення. В одному варіанті виконання, продукт окислення лінаклотиду має молекулярну масу, що становить 1542,8, та найбільш вірогідно формується при додаванні одного атому кисню до одного з шести атомів сірки цистеїнілу в лінаклотиді. Одна з можливих структур продукту показана нижче, хоча фахівець у цій галузі визнає, що атом кисню може бути приєднаний до будь-якого з п'яти атомів сірки, що залишилися: H-Cys-Cys-Glu-Tyr-Cys-Cys-Asn-Pro-Ala-Cys-Thr-Gly-Cys-Tyr-OH S S S S S S O 15 20 25 30 35 40 45 50 55 В іншому варіанті виконання, може бути здійснено додавання більш, ніж одного атома кисню до лінаклотиду, що підвищує його молекулярну масу на 16 AО на один доданий атом кисню. В деяких варіантах виконання, продукт окислення лінаклотиду містить менш ніж приблизно 15 % по масі композиції, менш ніж приблизно 10 % по масі композиції, менш ніж приблизно 7 % по масі композиції або менш ніж приблизно 5 % по масі композиції. В інших ілюстративних варіантах виконання, продукт окислення лінаклотиду містить приблизно від 0,01 % до 15 % по масі композиції, приблизно від 0,05 % до 10 % по масі композиції, приблизно від 0,05 % до 7 % по масі композиції або приблизно від 0,05 % до 5 % по масі композиції. В додаткових варіантах виконання представлено спосіб лікування шлунково-кишкового розладу у пацієнта, що потребує такого лікування, що включає введення фармацевтичної композиції, що містить лінаклотид и продукт окислення лінаклотиду. Оціночне значення на мас./мас. основі ("мас./мас. аналіз") може бути визначено шляхом порівняння, наприклад, за допомогою ВЕРХ, кількості лінаклотиду в пробі, зі стандартним зразком лінаклотиду. Як було вжито у цій заявці, масу лінаклотиду в композиції після зберігання при кімнатній температурі або умовах прискореного розпаду в конкретний період часу (наприклад, від трьох до шести місяців зберігання в умовах прискореного розпаду [40ºC/75 % ВВ] або 12, 18 або 24 місяця зберігання в умовах кімнатної температури [25 ºC/60 % ВВ]) порівнюють з масою лінаклотиду в композиції у вихідний час (наприклад, час, коли фармацевтична композиція вивільнюється для клінічного застосування або застосування пацієнтом ("дата вивільнення")) із забезпеченням аналітичного мас./мас. значення. Наприклад, масу лінаклотиду в композиції вимірюють після зберігання протягом вказаного часу в умовах прискореного розпаду (40ºC/75 % ВВ) та порівнюють з масою лінаклотиду, який був присутній у пробі на дату вивільнення. В іншому прикладі, масу лінаклотиду в композиції вимірюють після зберігання протягом вказаного часу в умовах кімнатної температури (25ºC/60 % ВВ) та порівнюють з масою лінаклотиду, який був присутній у пробі на дату вивільнення. Таким чином, вираз “≥ 90 % вихідної кількості лінаклотиду в композиції залишається щонайменше 6 місяців, якщо упаковані проби зберігають в умовах прискореного розпаду (40ºC/75 % ВВ)”, означає, що маса лінаклотиду в композиції, виміряна в аналізі на мас./мас. основі, яку визначають за допомогою ВЕРХ, щонайменше через 6 місяців зберігання в умовах прискореного розпаду становить ≥ 90 % від кількості лінаклотиду в композиції, що був присутній у вихідний час (наприклад, дата вивільнення композиції лінаклотиду). Хроматографічна чистота лінаклотиду може бути визначена за допомогою виконання ВЕРХ в умовах, що описані у цій заявці. Площу під піком лінаклотиду вимірюють та порівнюють із загальною площею під усіма піками, за виключенням піку розчиннику та усіх піків, що не відносяться до поліпептиду (тобто, піків, пов'язаних із ексципієнтами, що можна спостерігати у плацебо). Як вживають у цій заявці, хроматографічну чистоту лінаклотиду в композиції після зберігання при кімнатній температурі або умовах прискореного розпаду в конкретний період часу (наприклад, від трьох до шести місяців зберігання в умовах прискореного розпаду [40ºC/75 % ВВ] або 12, 18 або 24 місяця зберігання в умовах кімнатної температури [25 ºC/60 % ВВ]) порівнюють із хроматографічною чистотою лінаклотиду в композиції у вихідний час (наприклад, час, коли фармацевтична композиція виділяється для клінічного застосування або застосування клієнтом ("дата вивільнення")) із забезпеченням значення хроматографічної чистоти. Наприклад, хроматографічну чистоту лінаклотиду в композиції вимірюють після зберігання протягом вказаного часу в умовах прискореного розпаду (40ºC/75 % ВВ) и 4 UA 104870 C2 5 10 15 20 25 30 35 40 45 50 55 60 порівнюють із хроматографічною чистотою лінаклотиду в композиції на дату вивільнення. В іншому прикладі, хроматографічну чистоту лінаклотиду в композиції вимірюють після зберігання протягом вказаного часу в умовах кімнатної температури (25ºC/60 % ВВ) и порівнюють із хроматографічною чистотою лінаклотиду в композиції на дату вивільнення. У цій заявці описано спосіб одержання фармацевтичної композиції, що містить лінаклотид або її фармацевтично прийнятну сіль, де спосіб включає: (a) одержання розчину, наприклад, водного розчину ("покровний розчин"), що містить: (i) лінаклотид або його фармацевтично 2+ 2+ 2+ 2+ + + 3+ прийнятну сіль; (ii) катіон, вибраний з Мg , Ca , Zn , Mn , K , Na або Al або стерично утруднений первинний амін (наприклад, лейцин) та, за необхідності, (iii) фармацевтично прийнятну звязуючу речовину; та (б) нанесення покровного розчину на фармацевтично прийнятний наповнювач з одержанням покритого поліпептидом наповнювача (наприклад, шляхом розпилювання, висушування або покриття фармацевтично прийнятного наповнювача покровним розчином). Спосіб може необов'язково включати одну або більше стадій: (i) змішування покритого поліпептидом наповнювача з фармацевтично прийнятним глідантом, фармацевтично прийнятною мастильною речовиною або фармацевтично прийнятною добавкою, яка діє і як глідант, і як мастильна речовина; (ii) змішування покритого поліпептидом наповнювача з наповнювачем, який не покритий поліпептидом, (iii) змішування покритого поліпептидом наповнювача з іншими добавками; (iii) нанесення фармацевтично прийнятної покровної добавки на наповнювач, який покритий поліпептидом. Одержана в результаті фармацевтична композиція може бути поміщена в капсули (наприклад, желатинову капсулу) або застосована для формування таблеток. 2+ 2+ 2+ 2+ + + 3+ Було відкрито, що катіон, вибраний з Мg , Ca , Zn , Mn , K , Na або Al , можна застосовувати для пригнічення утворення продукту окислення лінаклотиду під час зберігання. Також було відкрито, що стерично утруднений первинний амін, наприклад лейцин, можна застосовувати для пригнічення утворення формальдегід-імінного аддукту лінаклотиду ("формальдегід-імінного продукту") під час зберігання. Таким чином, композиція лінаклотиду, що 2+ 2+ 2+ 2+ + + 3+ містить катіон, вибраний з Мg , Ca , Zn , Mn , K , Na або Al (наприклад, двохвалентний 2+ 2+ 2+ катіон, вибраний з Zn , Мg або Ca ) або стерично утруднений первинний амін, такий, як амінокислота, має час напівжиття, достатній (відповідно до вимірювань хроматографічної чистоти або за допомогою мас./мас. аналізу) для виробництва, зберігання або розповсюдження лікарського засобу. Додатково, в той час коли присутність стерично утрудненого аміну сама по собі може підвищувати утворення продукту гідролізу лінаклотиду під час зберігання, комбінація 2+ стерично утрудненого первинного аміну та катіону, наприклад, комбінація лейцину та Ca , пригнічує утворення продукту гідролізу лінаклотиду, а також продукту окислення лінаклотиду під час зберігання, призводячи до навіть більшої загальної стабільності, відповідно до вимірів за допомогою мас./мас. аналізу або за допомогою вимірів хроматографічної чистоти. В деяких варіантах виконання, представлена фармацевтична композиція, що містить 2+ фармацевтично прийнятний носій, лінаклотид та один або більше агентів, вибраних з Мg , 2+ 2+ 2+ + + 3+ Ca , Zn , Mn , K , Na або Al и стерично утруднений первинний амін, де агент покращує щонайменше одну властивість композиції, порівняно із фармацевтичною композицією, що не 2+ 2+ містить вказаний агент. В додаткових варіантах виконання, агент являє собою Мg , Ca або 2+ 2+ Zn . В додатковому варіанті виконання, агент являє собою Ca . В деяких варіантах виконання, катіон без обмежень представлений як ацетат магнію, хлорид магнію, фосфат магнію, сульфат магнію, ацетат кальцію, хлорид кальцію, фосфат кальцію, сульфат кальцію, ацетат цинку, хлорид цинку, фосфат цинку, сульфат цинку, ацетат цинку, хлорид магнію, фосфат магнію, сульфат магнію, ацетат калію, хлорид калію, фосфат калію, сульфат калію, ацетат натрію, хлорид натрію, фосфат натрію, сульфат натрію, ацетат алюмінію, хлорид алюмінію, фосфат алюмінію або сульфат алюмінію. В додаткових варіантах виконання, катіон представлений як хлорид магнію, хлорид кальцію, фосфат кальцію, сульфат кальцію, ацетат цинку, хлорид магнію, хлорид калію, хлорид натрію або хлорид алюмінію. В інших варіантах виконання, катіон представлений як хлорид кальцію, хлорид магнію або ацетат цинку. В іншому варіанті виконання, агент являє собою стерично утруднений первинний амін. В додатковому варіанті виконання, стерично утруднений первинний амін являє собою амінокислоту. В ще одному додатковому варіанті виконання, амінокислота являє собою амінокислоту, що зустрічається у природі. В ще одному додатковому варіанті виконання, амінокислоту, що зустрічається у природі, вибирають з групи, що складається з: гістидину, фенілаланіну, аланіну, глютамової кислоти, аспарагінової кислоти, глютаміну, лейцину, метіоніну, аспарагіну, тирозину, треоніну, ізолейцину, триптофану, метіоніну та валіну; ще додатково, амінокислота, що зустрічається у природі, являє собою лейцин, ізолейцин, аланін або метіонін; в іншому варіанті виконання, амінокислота, що зустрічається у природі, являє 5 UA 104870 C2 5 10 15 20 25 30 35 40 45 50 собою лейцин або метіонін; ще додатково, амінокислота, що зустрічається у природі, являє собою лейцин. В іншому варіанті виконання, стерично утруднений первинний амін являє собою амінокислоту, що не зустрічається у природі або похідне амінокислоти (наприклад, 1аміноциклогексанкарбонову кислоту, лантонін або теанін). В додатковому варіанті виконання, стерично утруднений первинний амін являє собою циклогексиламін, 2-метилбутиламін або хітозан. В інших варіантах виконання, представлена фармацевтична композиція, що містить 2+ 2+ 2+ 2+ + + фармацевтично прийнятний носій, лінаклотид, катіон, вибраний з Мg , Ca , Zn , Mn , K , Na 3+ 2+ 2+ 2+ або Al (наприклад, дивалентний катіон, вибраний з Zn , Мg та Ca ) та стерично утруднений 2+ первинний амін. В одному варіанті виконання, катіон являє собою Ca . В іншому варіанті 2+ 2+ 2+ 2+ + + 3+ виконання, катіон являє собою суміш двох або трьох Мg , Ca , Zn , Mn , K , Na або Al 2+ 2+ 2+ (наприклад, суміш двох або трьох Zn , Мg або Ca ). В додатковому варіанті виконання, фармацевтична композиція додатково містить фармацевтично прийнятну звязуючу речовину або фармацевтично прийнятний глідант, мастильну речовину або добавку, яка діє і як глідант, і як мастильна речовина, або антиоксидант. В додатковому варіанті виконання, стерично утруднений первинний амін є амінокислотою. В ще одному додатковому варіанті виконання, амінокислота є амінокислотою, що зустрічається у природі. В ще одному додатковому варіанті виконання, амінокислоту, що зустрічається у природі, вибирають з групи, що складається з: гістидину, фенілаланіну, аланіну, глютамової кислоти, аспарагінової кислоти, глютаміну, лейцину, метіоніну, аспарагіну, тирозину, треоніну, ізолейцину, триптофану, метіоніну та валіну; ще додатково, амінокислота, що зустрічається у природі, являє собою лейцин, ізолейцин, аланін або метіонін; в іншому варіанті виконання, амінокислота, що зустрічається у природі, являє собою лейцин або метіонін; ще додатково, амінокислота, що зустрічається у природі, являє собою лейцин. В іншому варіанті виконання, стерично утруднений первинний амін може бути сумішшю більш, ніж одного стерично утрудненого первинного аміну. Наприклад, стерично утруднений первинний амін може бути сумішшю більш, ніж двох або більше стерично утруднених первинних амінів, наприклад, сумішшю двох або більше амінокислот. В деяких випадках молярне співвідношення катіон:стерично утруднений первинний 2+ амін:лінаклотид (наприклад, Ca :лейцин:лінаклотид) у водному розчині, що наносять на носій, становить 5-100:5-50:1. Може бути бажаним, щоб молярне співвідношення катіон:стерично 2+ утруднений первинний амін (наприклад, Ca :лейцин) дорівнювало або перевищувало 2:1 (наприклад, від 5:1 до 2:1). Таким чином, в деяких випадках молярне співвідношення 2+ катіон:стерично утруднений первинний амін:лінаклотид (наприклад, Ca :лейцин:лінаклотид), що наносять на носій, становить 100:50:1, 100:30:1, 80:40:1, 80:30:1, 80:20:1, 60:30:1, 60:20:1, 50:30:1, 50:20:1, 40:20:1, 20:20:1, 10:10:1, 10:5:1 або 5:10:1. Якщо зв'язувальну речовину, наприклад, метилцелюлозу, присутню в розчині лінаклотиду, наносять на носій, то вона може бути присутня у кількості 0,5 % - 2,5 % по масі (наприклад, 0,7 %-1,7 % або 0,7 % - 1 % або 1,5 % або 0,7 %). Маса лінаклотиду, яку наносять на дану масу наповнювача (наприклад, мікрокристалічну целюлозу) може варіюватися від приблизно 0,02:100 до приблизно 2,67:100. Таким чином, приблизно від 0,05 мг до 6,0 мг лінаклотиду може бути нанесено на 225 мг наповнювача. В додатковому варіанті виконання, маса лінаклотиду, яку наносять на дану масу наповнювача, становить від приблизно 0,05 мг до приблизно 2,0 мг лінаклотиду (наприклад, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7 мг пептиду на 225 мг наповнювача). В різних варіантах виконання: стерично утруднений первинний амін являє собою амінокислоту (наприклад, амінокислоту, що зустрічається у природі, або амінокислоту, що зустрічається у природі, вибрану з гістидину, фенілаланіну, аланіну, глютамової кислоти, аспарагінової кислоти, глютаміну, метіоніну, аспарагіну, тирозину, треоніну, лейцину, ізолейцину, триптофану, або валіну). В інших випадках стерично утруднений первинний амін являє собою амінокислоту, що не зустрічається у природі або похідне амінокислоти (наприклад, лантивонін, теанін або 1-аміно циклогексан). В інших випадках, стерично утруднений первинний амін являє собою аміноцукор (наприклад, хітозан або глюкозамін). В деяких випадках, стерично утруднений первинний амін має формулу: R1 R1 R2 R2 R3 R3 NH2 55 , де R1, R2 и R3 незалежно вибирають з: H; −C(O)OH; C1-C6 алкілу, необов'язково заміщеного −CO2H, −CONH2, або 5-10 членного арилу або гетероарилу; C1-C6 алкоксіалкілу; або C1-C6 тіоалкоксіалкілу, де будь-яка зі вказаних вище алкільних або арильних NH2 груп може бути однократно або багатократно заміщена галогеном або –NH2, та за умови, що не 6 UA 104870 C2 5 10 15 20 25 30 35 40 45 50 55 60 більш, ніж два з R1, R2 и R3 являють собою H. В додатковому варіанті виконання, не більш, ніж один з R1, R2 и R3 являє собою H. Термін "алкіл", як вживають у цій заявці, відноситься до насиченого лінійного або розгалуженого моновалентного вуглеводневого радикалу. Якщо не вказано інше, то алкільна група містить 1-20 атомів вуглецю (наприклад, 1-20 атомів вуглецю, 1-10 атомів вуглецю, 1-8 атомів вуглецю, 1-6 атомів вуглецю, 1-4 атомів вуглецю або 1-3 атоми вуглецю). Приклади алкільних груп включають, не обмежуючись наведеним, метил, етил, н-пропіл, ізопропіл, нбутил, ізобутил, s-бутил, т-бутил, пентил, гексил, гептил, октил та інш. Терміни Cn-m "алкоксіалкіл" та Cn-m "тіоалкоксіалкіл" означають алкіл, заміщений однією або більше алкоксі або тіоалкоксі групами, в залежності від обставин, де поєднана загальна кількість атомів вуглецю алкільної та алкоксігруп, або алкільної та тіоалкоксігруп, поєднаних, в залежності від обставин, знаходяться між значеннями n та m. Наприклад, C 4-6 алкоксіалкіл має всього 4-6 атомів вуглецю, розділених між алкільною та алкоксі частинами; наприклад вони можуть бути CH2OCH2CH2CH3, CH2CH2OCH2CH3 або CH2CH2CH2OCH3. Як вживають у цій заявці, термін "арил" (як у виразах "арильний цикл" або "арильна група"), який вживають окремо або як частину більшого фрагменту, відноситься до карбоциклічної системи, в якій щонайменше один цикл у системі є ароматичним та має одне місце приєднання до частини молекули, що залишилася. Якщо не вказано інше, то арильна група може бути моноциклічною, бициклічною або трициклічною и містити 6-18 членів циклу. Приклади арильних циклів включають, не обмежуючись наведеним, феніл, нафтил, інданіл, інденіл, тетралін, флуореніл або антраценіл. Термін "гетероарил" (або "гетероароматична" або "гетероарильна група" або "ароматичний гетероцикл"), який вживають окремо або як частину більшего фрагменту, такого, як "гетероаралкіл" або "гетероарилалкокси", відноситься до циклічної системи, в якій щонайменше один цикл в системі є ароматичним и містить один або більше гетероатомів, де кожен цикл в системі містить від 3 до 7 членів циклу и який має одне місце приєднання до частини молекули, що залишилася. Якщо не вказано інше, то гетероарильна циклічна система може бути моноциклічною, біциклічною або трициклічною та мати всього від п'яти до чотирнадцяти членів циклу. В одному варіанті виконання, все цикли в гетероарильній системі є ароматичними. Також під це визначення підпадають гетероарильні радикали, в яких гетероарильний цикл сконденсовано з одним або більше ароматичним або неароматичним карбоциклічним або гетероциклічним циклами, або їх комбінаціями, оскільки радикал або місце приєднання знаходяться в гетероарильному циклі. Біциклічна 6,5 гетероароматична система, як було вжито у цій заявці, наприклад, є шестичленним гетероароматичним циклом, сконденсованим з другим пятичленним циклом, де радикал або місце приєднання знаходяться в шестичленному циклі. Гетероарильні цикли включають, не обмежуючись наведеним, такі моноцикли: 2-фураніл, 3фураніл, N-імідозоліл, 2-імідозоліл, 4-імідозоліл, 5-імідозоліл, 3-ізоксазоліл, 4-ізоксазоліл, 5ізоксазоліл, 2-оксазоліл, 4-оксазоліл, 5-оксазоліл, N-піроліл, 2-піроліл, 3-піроліл, 2-піридил, 3піридил, 4-піридил, 2-піримідинил, 4-піримідинил, 5-піримідинил, піридазиніл (наприклад, 3піридазиніл), 2-тіазоліл, 4-тіазоліл, 5-тіазоліл, тетразоліл (наприклад, 5-тетразоліл), триазоліл (наприклад, 2-триазоліл и 5-триазоліл), 2-тієніл, 3-тієніл, пиразоліл (наприклад, 2-пиразоліл), ізотіазоліл, 1,2,3-оксадіазоліл, 1,2,5-оксадіазоліл, 1,2,4-оксадіазоліл, 1,2,3-триазоліл, 1,2,3тіадіазоліл, 1,3,4-тіадіазоліл, 1,2,5-тіадіазоліл, піразиніл, 1,3,5-тріазиніл, и такі біцикли: бензімідозоліл, бензoфурил, бензoтіофеніл, бензoпіразиніл, бензoпіраноніл, індоліл (наприклад, 2-індоліл), пуриніл, хінолініл (наприклад, 2-хінолініл, 3-хінолініл, 4-хінолініл), та ізохінолініл (наприклад, 1-ізохінолініл, 3-ізохінолініл, або 4-ізохінолініл). В різних випадках: антиоксидант вибирають з БГА (бутильованого гідроксианізолу), БГТ (бутильованого гідрокситолуолу), вітаміну E, пропілгалату, аскорбінової кислоти та її солей або естерів, токоферолів та його естерів, альфа-липоєвої кислоти, бета-каротину; фармацевтично прийнятна зв'язуючи речовина є полівініловим спиртом або полівінилпіролідоном; фармацевтично прийнятну звязуючу речовину вибирають з: крохмалю (наприклад, кукурудзяного крохмалю, попередньо желатинізованого картопляного крохмалю, рисового крохмалю, пшеничного крохмалю, та натрій крохмаль гліколяту), мальтодекстрину або ефіру целюлози (наприклад, метилцелюлози, етилцелюлози, карбоксиметилцелюлози, гідроксиетил целюлози, гідроксиетил метилцелюлози, гідроксипропілцелюлози и гідроксипропілметилцелюлози); фармацевтично прийнятний наповнювач являє собою целюлозу (наприклад, мікронізовану целюлозу або мікрокристалічну целюлозу, таку, як Celphere CP-305 або Avicel); фармацевтично прийнятний наповнювач являє собою цукор або цукровий спирт (наприклад, манітол, ізомальт, сорбітол, декстрозу, ксиліт, сукрозу та лактозу); наповнювач містить частинки, що мають середній діаметр від 50 мкм до 1000 мкм; мастильну 7 UA 104870 C2 5 10 15 20 25 30 35 40 45 50 55 60 речовину або глідант вибирають з: тальку, лейцину, стеарата магнію, стеаринової кислоти та полівінілового спирту; та мастильну речовину або глідант вибирають зі: стеарата кальцію, мінеральної олії, рослинної олії, поліетиленгліколю (ПЕГ; наприклад, ПЕГ, який є рідким або твердим при кімнатній температурі), бензоату натрію, та натрій лаурилсульфату. В деяких випадках, розчин лінаклотиду, який застосовують у способі одержання композиції, має pH нижче 7 (наприклад, pH від 1 до 3 або pH від приблизно 1,5 до приблизно 2,5). Значення pH може бути відрегульовано, наприклад, фосфорною кислотою. В деяких випадках, розчин буферують. Можуть бути застосовані різні фармацевтично прийнятні буфери (наприклад, фосфатний буфер). В деяких випадках, розчин лінаклотиду, який застосовують у способі одержання композиції містить як катіон (наприклад, CaCl2), так і стерично утруднений первинний амін (наприклад, лейцин). В деяких випадках розчин лінаклотиду містить CaCl2 та лейцин; зв'язувальною речовиною є метилцелюлоза; наповнювачем є мікрокристалічна целюлоза; глідант або мастильна речовина містить тальк або лейцин. Також представлена фармацевтична композиція, одержана будь-яким зі способів, описаних у цій заявці. В іншому аспекті, описана фармацевтична композиція, що містить фармацевтично прийнятний носій, лінаклотид та один або більше агентів, вибраних з (i) катіону, вибраного з 2+ 2+ 2+ 2+ + + 3+ Мg , Ca , Zn , Mn , K , Na або Al , або (ii) стерично утрудненого первинного аміну. В деяких варіантах виконання, фармацевтична композиція містить щонайменше один катіон и щонайменше один стерично утруднений первинний амін. Також описані способи застосування фармацевтичної композицій для лікування різних шлунково-кишкових розладів. Стислий опис фігури На Фігурі демонструється приклад аналізу лінаклотиду за допомогою ВЕРХ, де "Окислення" відноситься до продукту окислення лінаклотиду, "формальдегід-імін" відноситься до формальдегід-імінного продукту лінаклотиду, а "Гідроліз" відноситься до продукту гідролізу лінаклотиду. Ця фігура представлена для прикладу та не призначена для обмеження обсягу даного винаходу. Детальний опис винаходу Пероральні композиції, що містять лінаклотид, можуть застосовуватися для лікування різних шлунково-кишкових розладів. В різних варіантах виконання, пацієнт страждає від шлунковокишкового розладу; пацієнт страждає від розладу, вибраного з групи, що складається з: розладу моторики травного тракту, хронічної кишкової псевдо-обструкції, псевдо-обструкції товстої кишки, хвороби Хрона, дуоденогастрального рефлюксу, диспепсії, функціональної диспепсії, невиразкової диспепсії, функціонального шлунково-кишкового розладу, функціональної печії, гастроезофагеальної рефлюксної хвороби (ГЕРХ), гастропарезу, синдрому роздратованого кишечника, пост-операційної кишкової непрохідності, виразкового коліту, хронічної констипації, констипації, болю, пов'язаного із констипацією, та розладів та станів, пов'язаних із констипацією (наприклад, констипацією, пов'язаною з застосуванням опіатних болезаспокійливих засобів, післяопераційною констипацією, и констипацією, пов'язаною з нейропатичними розладами, а також інших станів та розладів, описаних у цій заявці); пацієнт страждає від розладу моторики травного тракту, хронічної кишкової псевдо-обструкції, псевдо-обструкції товстої кишки, хвороби Хрона, дуоденогастрального рефлюксу, диспепсії, функціональної диспепсії, невиразкової диспепсії, функціонального шлунково-кишкового розладу, функціональної печії, гастроезофагеальної рефлюксної хвороби (ГЕРХ), гастропарезу, запальної хвороби кишечника, синдрому роздратованого кишечника (наприклад, синдром роздратованого кишечника з перевагою діареї (д-СРК), синдром роздратованого кишечника з перевагою констипації (к-СРК) або перемежований синдром роздратованого кишечника (п-СРК)), пост-операційної кишкової непрохідності, виразкового коліту, хронічної констипації, констипації, болю, пов'язаного з констипацією, и розладів та станів, пов'язаних із констипацією, (наприклад констипацією, пов'язаною з застосуванням опіатних болезаспокійливих засобів, післяопераційної констипації, и констипації, пов'язаної з нейропатичними розладами, а також іншими станами та розладами, описаними у цій заявці); пацієнту було продіагностовано функціональний шлунково-кишечний розлад відповідно до римських критеріїв (наприклад, римських критеріїв II), пацієнту було продіагностовано синдром роздратованого кишечника (наприклад, СРК з перевагою діареї, СРК з перевагою констипації, або перемежований СРК), відповідно до римських критеріїв (наприклад, римських критеріїв II). 8 UA 104870 C2 5 10 15 20 25 30 35 40 45 50 55 60 Діапазон дозувань лінаклотиду для дорослих людей загалом становить від 25 мкг до 6 мг на день перорально. В додатковому варіанті виконання, діапазон дозувань становить от 25 мкг до 2 мг на день перорально. В деяких варіантах виконання, діапазон дозувань для дорослих людей становить от 50 мкг до 1 мг на день перорально (наприклад, 50 мкг, 67,5 мкг, 100 мкг, 133 мкг, 150 мкг, 200 мкг, 250 мкг, 266 мкг, 300 мкг, 350 мкг, 400 мкг, 450 мкг, 500 мкг, 550 мкг, 600 мкг, 650 мкг, 700 мкг, 750 мкг, 800 мкг, 850 мкг, 900 мкг, 950 мкг або 1 мг). В додаткових варіантах виконання, діапазон дозувань становить от 100 мкг до 600 мкг на день перорально. В інших варіантах виконання, доза становить 50 мкг, 67,5 мкг, 100 мкг, 133 мкг, 150 мкг, 200 мкг, 266 мкг, 300 мкг, 400 мкг, 500 мкг або 600 мкг лінаклотиду на день перорально. В одному варіанті виконання, представлена композиція лінаклотиду в дискретній одиниці, стандартній лікарській формі, (наприклад, таблетці, капсулі, саше) яка є ефективною при такому дозуванні або в такому множинному дозуванні. В певних варіантах виконання, стандартна лікарська форма та щоденні доза еквівалентні. В різних варіантах виконання, стандартну лікарську форму вводять з їжею у будь-який час дня, без їжі у будь-який час дня, з їжею після нічного голодування (наприклад із сніданком). В різних варіантах виконання, стандартну лікарську форму вводять раз на день, два раза на день або три раза на день. Стандартна лікарська форма може необов'язково містити інші добавки. В деяких варіантах виконання, одна, дві або три стандартні лікарські форми будуть містити денну пероральну дозу лінаклотиду. За точну кількість сполуки, яку вводять пацієнту, буде нести відповідальність супроводжуючий лікар. Проте, застосовна доза залежатиме від ряду факторів, включаючи вік та стать пацієнта, точний розлад, від якого лікують та його тяжкість. В одному варіанті виконання, запропонований спосіб лікування синдрому роздратованого кишечника з констипацією (СРК-к) у дорослого пацієнта, що потребує такого лікування, що включає введення пацієнтові раз на день ефективної кількості фармацевтичної композиції, що описана у цій заявці. В різних варіантах виконання, фармацевтична композиція містить 133 мкг або 266 мкг лінаклотиду на стандартну дозу на день. В інших варіантах виконання, фармацевтичну композицію вводять протягом періоду, що становить щонайменше один день, два дня, три дня, чотири дня, п'ять днів. шість днів, один тиждень, два тижня, три тижня, чотири тижня або більше. В деяких варіантах виконання, лікування композицією лінаклотиду покращує щонайменше один симптом, вибраний з полегшеного абдомінального болю, збільшення кількості повних самовільних випорожнень кишечника (СВВК) на тиждень, збільшення кількості самовільних випорожнень кишечника (СВВК) на тиждень, покращеної консистенції випорожнення, зменшених натужувань, зменшеного абдомінального дискомфорту, зменшеного метеоризму або зменшеної тяжкості симптому СРК-к. В одному варіанті виконання, запропонований спосіб лікування хронічного запору у дорослого пацієнта, що потребує такого лікування, що включає введення пацієнтові раз на день ефективної кількості фармацевтичної композиції, що описана у цій заявці. В різних варіантах виконання, фармацевтична композиція містить 133 мкг або 266 мкг лінаклотиду на стандартну дозу на день. В інших варіантах виконання, фармацевтичну композицію вводять протягом періоду, що становить щонайменше один день, два дня, три дня, чотири дня, п'ять днів. шість днів, один тиждень, два тижня, три тижня, чотири тижня або більше. В деяких варіантах виконання, лікування композицією лінаклотиду покращує щонайменше один симптом, вибраний зі збільшення кількості повних самовільних випорожнень кишечника (СВВК) на тиждень, збільшення кількості самовільних випорожнень кишечника (СВВК) на тиждень, покращеної консистенції випорожнення, зменшених натужувань, зменшеного абдомінального дискомфорту, зменшеного метеоризму або зменшеної тяжкості констипації. Консистенція випорожнення кожного ВК може бути проконтрольована за допомогою 7балльної Бристольскої шкали форм випорожнення (БШФС) (1 = тверді грудки, 2 = грудкуваті ковбаски, 3 = ковбаски з ребристою поверхнею, 4 = гладкі ковбаски, 5 = м'які грудки, 6 = кашицеподібний, 7 = водянистий). Натужування можуть бути проконтрольовані за допомогою 7балльної шкали легкості проходжень (1 = ручне вивільнення/необхідність клізми, 2 = сильні натужування, 3 = помірні натужування, 4 = незначні натужування, 5 = відсутність, 6 = невідкладні позиви, 7 = нетримання). СВВК може бути виміряний за допомогою відчуття повного випорожнення після СВК (так/ні). Абдомінальний дискомфорт, метеоризм або тяжкість констипації можуть бути виміряні за допомогою, наприклад, 5-бальної порядкової шкали (1 = відсутні, 2 = незначні, 3 = помірні, 4 = тяжкі, 5 = дуже важкі). Катіон відповідно до даного винаходу може бути представлений як фармацевтично прийнятна сіль, тобто, катіон з відповідним протиіоном. Приклади фармацевтично прийнятних солей, які можуть бути застосовані у цьому винаході, включають, без обмежень, ацетат магнію, хлорид магнію, фосфат магнію, сульфат магнію, ацетат кальцію, хлорид кальцію, фосфат 9 UA 104870 C2 5 10 15 20 25 30 35 40 45 50 55 60 кальцію, сульфат кальцію, ацетат цинку, хлорид цинку, фосфат цинку, сульфат цинку, ацетат цинку, хлорид магнію, фосфат магнію, сульфат магнію, ацетат калію, хлорид калію, фосфат калію, сульфат калію, ацетат натрію, хлорид натрію, фосфат натрію, сульфат натрію, ацетат алюмінію, хлорид алюмінію, фосфат алюмінію або сульфат алюмінію. В деяких варіантах виконання, фармацевтично прийнятні соли включають хлорид кальцію, карбонат кальцію, ацетат кальцію, хлорид магнію, ацетат магнію, ацетат цинку та хлорид цинку. В додаткових варіантах виконання, фармацевтично прийнятна сіль, що може бути застосована, являє собою хлорид кальцію, хлорид магнію та ацетат цинку. Як вживають у цій заявці, термін "зв'язуюча речовина" відноситься до будь-якої фармацевтично прийнятної звязуючої речовини, що може бути застосована при реалізації винаходу. Приклади фармацевтично прийнятних зв'язуючих речовин включають, без обмежень, крохмаль (наприклад, кукурудзяний крохмаль, картопляний крохмаль та попередньо желатинізований крохмаль (наприклад, STARCH 1500® та STARCH 1500 LM®, продає Colorcon, Ltd.) та інші крохмалі), мальтодекстрин, желатин, природні та синтетичні камеді, такі, як гуміарабік, порошкоподібний трагакант, гуарова камедь, целюлозу та її похідні (наприклад, метилцелюлозу, гідроксиетилцелюлозу, гідроксиетилметилцелюлозу, гідроксипропілцелюлозу та гідроксипропілметилцелюлозу (гіпромелозу), етилцелюлозу, ацетатцелюлозу, кальцій карбоксиметилцелюлозу, натрій карбоксиметилцелюлозу, карбоксиметилцелюлозу, мікрокристалічну целюлозу (наприклад AVICEL™, наприклад, AVICEL-PH-101™, -103™ и 105™, продає FMC Corporation, Marcus Hook, PA, USA)), полівіниловий спирт, полівінілпіролідон (наприклад, полівінилпіролідон K30), та їх суміші. Як вживають у цій заявці, термін "наповнювач" відноситься до будь-якого фармацевтично прийнятного наповнювача, який може бути застосований при реалізації винаходу. Приклади фармацевтично прийнятних наповнювачів включають, без обмежень, тальк, карбонат кальцію (наприклад, гранули або порошок), двохосновний фосфат кальцію, трьохосновний фосфат кальцію, сульфат кальцію (наприклад, гранули або порошок), мікрокристалічну целюлозу (наприклад, Avicel PH101 або Celphere CP-305), порошкоподібну целюлозу, декстрани, каолін, манітол, кремнієву кислоту, сорбітол, крохмаль (наприклад, STARCH 1500), попередньо желатиніpований крохмаль, лактозу, глюкозу, фруктозу, галактозу, трегалозу, сукрозу, мальтозу, ізомальт, рафінозу, мальтітол, мелезітозу, стахіозу, лактитол, палатиніт, ксилітол, міоінозитол, та їх суміші. Приклади фармацевтично прийнятних наповнювачів, які можуть бути особо корисними для покриття лінаклотидом включають, без обмежень, тальк, мікрокристалічну целюлозу (наприклад, Avicel PH101 або Celphere CP-305), порошкоподібну целюлозу, декстрани, каолін, манітол, кремнієву кислоту, сорбітол, крохмаль, попередньо желатинізований крохмаль, лактозу, глюкозу, фруктозу, галактозу, трегалозу, сукрозу, мальтозу, ізомальт, двохосновний фосфат кальцію, рафінозу, мальтитол, мелезітозу, стахіозу, лактітол, палатиніт, ксилітол, манітол, міоінозітол, та їх суміші. Як вживають у цій заявці, термін "добавки" відноситься до будь-якої фармацевтично прийнятної добавки. Фармацевтично прийнятні добавки включають, без обмежень, агенти розпаду, диспергуючі добавки, мастильні речовини, гліданти, антиоксиданти, покривні добавки, розжижувачі, поверхнево-активні речовини, ароматизуючі добавки, зволожувачі, добавки, що сприяють поглинанню, добавки контрольованого вивільнення, антиспікувачі, протимікробні агенти (наприклад, консерванти), пігменти, десіканти, пластифікатори та барвники. Як вживають у цій заявці, "наповнювач" являє собою будь-яку фармацевтично прийнятну добавку, наповнювач, звязуючу речовину або агент. Як вживають у цій заявці, "очищений лінаклотид ” являє собою лінаклотид або його фармацевтично прийнятну сіль, який має не менш ніж 90 відсотків чистоти або не менш ніж 95 відсотків чистоти. В деяких варіантах виконання, лінаклотид, який застосовують в способах та композиціях, описаних у цій заявці, очищують. Чистота лінаклотиду може бути виміряна, наприклад, за допомогою хроматографічної чистоти лінаклотиду з використанням противофазної ВЕРХ, як описано в Прикладі 21. Аналіз лінаклотиду [мас./мас.] може бути визначений, наприклад, шляхом використання противофазної ВЕРХ з кількісним визначенням шляхом зовнішнього калібрування за допомогою стандартного зразка, як описано в Прикладі 21. В одному аспекті, фармацевтична композиція може бути одержана шляхом розпилювання розчину, що містить лінаклотид або його фармацевтично прийнятну сіль, на фармацевтично прийнятний наповнювач з одержанням покритого лінаклотидом наповнювача. В одному варіанті виконання, спосіб включає: (a) виготовлення розчину, наприклад, водного розчину ("покровний розчин"), що містить: (i) лінаклотид або його фармацевтично прийнятну сіль; (ii) катіон, 10 UA 104870 C2 2+ 5 10 15 20 25 30 35 40 45 50 55 2+ 2+ 2+ + + 3+ вибраний з Мg , Ca , Zn , Mn , K , Na або Al або стерично утруднений первинний амін (наприклад, лейцин) та, необов'язково, (iii) фармацевтично прийнятну звязуючу речовину; та (б) нанесення покровного розчину на фармацевтично прийнятний наповнювач з одержанням покритого поліпептидом наповнювача (наприклад, шляхом розпилювання, висушування або покриття фармацевтично прийнятного наповнювача покровним розчином). Спосіб може за необхідністю включати одну або більше стадій: (i) змішування покритого поліпептидом наповнювача з фармацевтично прийнятним глідантом, фармацевтично прийнятним мастильним матеріалом або фармацевтично прийнятною добавкою, яка діє і як глідант, і як мастильна речовина; (ii) змішування покритого поліпептидом наповнювача з наповнювачем, який не покритий поліпептидом, (iii) змішування покритого поліпептидом наповнювача з іншими добавками; и (iv) нанесення фармацевтично прийнятної покровної добавки на наповнювач, який покритий поліпептидом. Одержана в результаті фармацевтична композиція може бути поміщена в капсули (наприклад, желатинову капсулу) або використана для формування таблеток. В іншому варіанті виконання, фармацевтичну композицію одержують за допомогою висушування розпиленням, що являє собою метод, який використовують для одержання мікрочастинок (наприклад, мікрокапсул або мікросфер) лікарських засобів. Висушені розпиленням пептиди загалом зберігають свою біологічну активність при розчиненні та можуть мати корисні фізичні характеристики, включаючи однаковий розмір частинок та сферичну форму. Додатково, мікрочастинки, одержані шляхом висушування розпиленням часто є вільно текучими, що сприяє проведенню процесів фармацевтичного виробництва, таких, як формування таблеток та наповнення капсул. Процеси висушування розпиленням також є корисними, оскільки вони можуть бути легко масштабовані для клінічного та комерційного виробництва. Таким чином, у цій заявці описаний спосіб одержання фармацевтичної композиції, що містить лінаклотид або його фармацевтично прийнятну сіль, де спосіб включає: (a) виготовлення розчину, наприклад, водного або органічного розчину, що містить: (i) лінаклотид 2+ 2+ 2+ 2+ + + або його фармацевтично прийнятну сіль; та (ii) катіон, вибраний з Мg , Ca , Zn , Mn , K , Na 3+ або Al або стерично утруднений первинний амін (наприклад, лейцин) и (б) висушування розпиленням розчину, що містить лінаклотид, з одержанням мікрочастинок. Розчин, що містить лінаклотид, може необов'язково містити полімер, наприклад, одну або більше зв'язуючих речовин, що описані у цій заявці, ліпід або фосфоліпід, або наповнювач, наприклад, манітол. Спосіб може необов'язково включати одну або більше додаткових стадій: (i) змішування мікрочастинок лінаклотиду з фармацевтично прийнятним глідантом, фармацевтично прийнятною мастильною речовиною або фармацевтично прийнятною добавкою, яка діє і як глідант, і як мастильна речовина; (ii) змішування мікрочастинок з наповнювачем, або (iii) змішування мікрочастинок з іншими добавками. Одержана в результаті фармацевтична композиція може бути поміщена в капсули (наприклад, желатинову капсулу) або використана для формування таблеток. В інших варіантах виконання, фармацевтичну композицію одержують за допомогою ліофільного висушування, обробки надкритичної рідини або ліофілізації розчину, наприклад, водного або органічного розчину, що містить: (i) лінаклотид або його фармацевтично прийнятну 2+ 2+ 2+ 2+ + + 3+ сіль; и (ii) катіон, вибраний з Мg , Ca , Zn , Mn , K , Na або Al або стерично утруднений первинний амін (наприклад, лейцин). В деяких варіантах виконання, представлена композиція лінаклотиду в твердій формі для перорального введення. Приклади таких форм включають, без обмежень, таблетку, саше, пілюлю, капсулу або порошок. В деяких варіантах виконання, композиції можуть бути використані для створення стандартних лікарських форм, наприклад, таблеток, капсул, саше або пілюль. Композиції для перорального введення можуть включати, наприклад, зв'язуючі речовини, мастильні речовини, інертні розжижувачі, мастильні, поверхнево-активні або диспергуючі добавки, ароматизуючі добавки, та зволожувачі. Композиції для перорального введення, такі, як таблетки, можуть необов'язково бути покриті або мати насічки та можуть бути складені в композицію таким чином, щоб забезпечити безперервне, уповільнене та контрольоване вивільнення лінаклотиду з них. Лінаклотид може бути введений разом або включений в композицію разом із іншими лікарськими засобами. В одному варіанті виконання, композиція лінаклотиду може бути введена разом із іншими лікарськими засобами, які застосовують для лікування шлунково-кишкових розладів. Композиція лінаклотиду може застосовуватися також для лікування розладів не шлунково-кишкового тракту, таких, як серцева недостатність із застійними явищами та доброякісна гіпертрофія передміхурової залози. 11 UA 104870 C2 5 10 15 20 25 30 35 40 45 50 55 60 Композиції можуть містити, наприклад, різні додаткові розчинники, диспергатори, покриття, добавки, що сприяють поглинанню добавки контрольованого вивільнення, та одну або більше інертних добавок (що включають, наприклад, крохмалі, поліоли, гранулюючі добавки, мікрокристалічну целюлозу, розжижувачі, мастильні речовини, зв'язуючі речовини, добавки для розпаду, та інш), та подібні. За бажанням, дозування таблеток описаних у цій заявці композицій можуть бути покриті за допомогою стандартних водних та неводних методів. Композиції можуть також містити, наприклад, антиспікачі, консерванти, підсолоджувачі, пігменти, ароматизатори, десіканти, пластифікатори, барвники, та інш. Прийнятні агенти розпаду включають, наприклад, агар-агар, карбонат кальцію, мікрокристалічну целюлозу, натрій кроскармелозу, кросповідон, повідон, полакрабон калий, натрій крохмаль гликолят, картопляний крохмаль або крохмаль тапіокі, інші крохмалі, попередньо желатинізований крохмаль, глини, інші альгіни, інші целюлози, камеді, та їх суміші. Прийнятні мастильні речовини включають, наприклад, стеарат кальцію, стеарат магнію, мінеральну олію, легку мінеральну олію, гліцерин, сорбітол, манітол, поліетиленгліколь, інші гліколі, стеаринову кислоту, натрій лаурилсульфат, тальк, гідрогенізовану рослинну олію (наприклад, арахісову олію, бавовняну олію, соняшникову олію, сезамову олію, оливкову олію, кукурудзяну олію та соєву олію), стеарат цинку, етил олеат, етиллаурат, агар, силоїдсабокагель (AEROSIL 200, W.R. Grace Co., Baltimore, MD USA), коагульований аерозоль синтетичного кремнезему (Evonik Degussa Co., Plano, TX USA), пірогенний диоксид кремнію (CAB-O-SIL, Cabot Co., Boston, MA USA), та їх суміші. Прийнятні гліданти включають, наприклад, лейцин, колоїдний диоксид кремнію, трисабокат магнію, порошкоподібну целюлозу, крохмаль, тальк, та трьохосновний фосфат кальцію. Прийнятні антиспікачі включають, наприклад, сабокат кальцію, сабокат магнію, диоксид кремнію, колоїдний диоксид кремнію, тальк, та їх суміші. Прийнятні протимікробні добавки, які можуть бути застосовані, наприклад, в як консервант для композицій лінаклотиду, включають, наприклад, бензалконій хлорид, бензотоній хлорид, бензойну кислоту, бензиловий спирт, бутилпарабен, цетилпіридиній хлорид, крезол, хлорбутанол, дигідрооцтову кислоту, етилпарабен, метилпарабен, фенол, фенілетиловий спирт, феноксіетанол, фенілртуть ацетат, фенілртуть нітрат, сорбат натрію, пропілпарабен, бензоат натрію, дегидроацетат натрію, пропіонат натрію, сорбінову кислоту, тімерозал, тімол, та їх суміші. Прийнятні покровні добавки включають, наприклад, натрій карбоксиметил целюлозу, ацетатфталатцелюлозу, етилцелюлозу, желатин, фармацевтичну глазур, гідроксипропіл целюлозу, гідроксипропілметилцелюлозу, гідроксипропіл метилцелюлозу, метилцелюлозу, поліетиленгліколь, полівінілацетатфталат, шелак, сукрозу, диоксид титану, карнаубський віск, мікрокристалічний віск, та їх суміші. Прийнятні захисні покриття включають Aquacoat (наприклад, водну дисперсію етилцелюлози Aquacoat, 15 % мас./мас., FMC Biopolymer, ECD-30), Eudragit (наприклад Eudragit E PO PE-EL, Roehm Pharma Polymers) та Opadry (наприклад, Opadry AMB дисперсію, 20 % мас./мас., Colorcon). В певних варіантах виконання, прийнятні добавки для композиції лінаклотиду включають одно або більше з сукрози, тальку, стеарата магнію, кросповідону або БГА.В певних варіантах виконання, термін "95 %” може бути 95,0 %, термін "90 %” може бути 90,0 %, термін "10 %” може бути 10,0 %, термін "9 %” може бути 9,0 %, термін "8 %” може бути 8,0 %, термін "7 %” може бути 7,0 %, термін "6 %” може бути 6,0 %, термін "5 %” може бути 5,0 %, термін "4 %” може бути 4,0 %, термін "3 %” може бути 3,0 %, термін "2 %” може бути 2,0 %, и термін "1 %” може бути 1.0 %. В певних варіантах виконання, представлена композиція лінаклотиду в стандартній лікарській формі. В деяких варіантах виконання, стандартна лікарська форма являє собою капсулу, таблетку, саше, пілюлю або порошок. В одному такому варіанті виконання, стандартна лікарська форма являє собою капсулу або таблетку. Такі стандартні форми дозувань можуть знаходитися в контейнері, наприклад, без обмежень, паперовому або картонному ящику, скляній або пластиковій пляшці або судині, пакеті з можливістю повторної герметизації (наприклад, для зберігання "повторного наповнення" таблеток для розміщення в інший контейнер), або блистерної упаковки з індивідуальними дозами для спресовування упаковки відповідно до графіку лікування. Вірогідно, більше одного контейнера може бути використано разом в одній упаковці для забезпечення стандартної лікарської форми. Наприклад, таблетки або капсули можуть знаходитися в пляшці, яка, в свою чергу, знаходиться в коробці. В деяких варіантах виконання, представлені стандартні форми дозувань в контейнері, що додатково містить десікант. В додатковому варіанті виконання, стандартні форми дозувань, наприклад, 12 UA 104870 C2 5 10 15 20 25 30 35 40 45 50 55 60 кількість таблеток або капсул, представлені в контейнері, наприклад, пляшці, судині або упаковці з можливістю повторної герметизації, що містить десікант. В додатковому варіанті виконання, контейнер, що містить стандартні форми дозувань упакований разом із інструкціями по введенню або дозуванням. В певних варіантах виконання, композиція лінаклотиду представлена в наборі. Композиція лінаклотиду, описана у цій заявці, та агенти комбінаційної терапії можуть бути упаковані як набір, що містить одинарні або множинні дози двох або більше агентів, кожна з яких упакована або складена в композицію індивідуально, або як одинична або множинні дози двох або більше агентів, упакованих або складених в композицію в комбінації. Таким чином, композиція лінаклотиду може бути присутня у першому контейнері, та набір може необов'язково містити один або більше агентів в другому контейнері. Контейнер або контейнери поміщають в упаковку, а упаковка може необов'язково містити інструкції по введенню або дозуванням. Приклади Такі приклади наведені тільки з метою ілюстрації даного винаходу и не мають тлумачитися як будь-яким чином обмежуючі обсяг даного винаходу, оскільки велика кількість варіацій та еквівалентів, що охоплені цим винаходом, будуть очевидними фахівцям у цій галузі після прочитання цієї заявки. Лінаклотид або його фармацевтично прийнятна сіль можуть бути одержані та очищені стандартними методами, відомими з рівня техніки, за допомогою хімічного синтезу або с наступною рекомбінантною експресією та очищуванням за допомогою стандартних методів. Схема складання в композицію A Підготовка покровного розчину: Приблизно 32 г - 42 г очищеної води змішували з соляною кислотою з одержанням розчину з pH 1,5 – 2,0. У випадку використання катіону його додавали до розчину у кількості, що забезпечує бажану концентрацію, та розчин змішували протягом достатнього часу з одержанням прозорого розчину. У випадку використання стерично утрудненого первинного аміну його додавали до розчину у кількості, що забезпечує бажану концентрацію, и розчин змішували протягом достатнього часу з одержанням прозорого розчину. Потім додавали інші добавки, наприклад, антиоксиданти, за бажанням. Значення pH розчину аналізували, та за необхідності додавали соляну кислоту з одержанням розчину, що мав значення pH від 1,5 до 2,0. Зв'язуючу речовину додавали до розчину и суміш потім перемішували протягом достатнього часу з одержанням прозорого розчину. Бажану кількість лінаклотиду додавали до розчину и перемішували протягом 30-100 хвилин із забезпеченням покровного розчину. Підготовка активних гранул: Приблизно 30-36 г гранул висушеної мікрокристалічної целюлози додавали в міні-колонку с покриттям киплячого шару. Гранули мікрокристалічної целюлози псевдозріджували та нагрівали перед пошаровим нанесенням. Потім, покровний розчин пошарово наносили на гранули. Температуру розпилювання контролювали від 24 °C до 55 °C шляхом контролювання вхідної температури, швидкості розпилювання, тиску розпилювання та об'єму повітря. Після нанесення пошарово усього покровного розчину на гранули, останні висушували. Продукт, одержаний даним способом, назвали активними гранулами. Підготовка активних гранул із захисним покриттям: Приблизно 35 г активних гранул додавали в міні-колонку с покриттям киплячого шару. Активні гранули псевдозріджували та нагрівали перед покриттям Aquacoat (наприклад водна дисперсія етилцелюлози Aquacoat, 15 % мас./мас., FMC Biopolymer, ECD-30), Eudragit (наприклад Eudragit E PO PE-EL, Roehm Pharma Polymers) або Opadry (наприклад, дисперсія Opadry AMB, 20 % мас./мас., Colorcon). Потім, покровний розчин наносили пошарово на гранули. Температуру розпилювання регулювали від 24 °C до 55 °C шляхом контролювання вхідної температури, швидкості розпилювання, тиску розпилювання та об'єму повітря. Після нанесення пошарово усього покровного розчину на гранули, останні висушували. Схема складання композиції B Одержання покровного розчину: Приблизно 8.3 кг очищеної води змішували з соляною кислотою з одержанням розчину з pH від 1,5 до 2,0. У випадку використання катіону його додавали до розчину у кількості для забезпечення бажаної концентрації, та розчин змішували протягом достатнього часу з одержанням прозорого розчину. У випадку використання стерично утрудненого первинного аміну його додавали до розчину у кількості для забезпечення бажаної концентрації, та розчин змішували протягом достатнього часу з одержанням прозорого розчину. Інші добавки, такі, як антиоксиданти, потім додавали, за необхідністю. Зв'язуючу речовину потім додавали до розчину и розчин змішували протягом достатнього часу з одержанням прозорого розчину. Значення pH розчину аналізували, та за необхідністю додавали соляну кислоту з 13 UA 104870 C2 5 10 15 20 одержанням розчину, що мав значення pH від 1,5 до 2,0. Це є розчином 1. Приблизно 8,3 кг очищеної води змішували з соляною кислотою з одержанням розчину з pH від 1,5 до 2,0. бажану кількість лінаклотиду додавали до розчину и змішували протягом від 10 до 30 хвилин. Значення pH розчину аналізували, та за необхідністю додавали соляну кислоту з одержанням розчину, що мав значення pH від 1,5 до 2,0. Це є розчином 2. Розчин 1 та розчин 2 потім змішували разом. Значення pH розчину аналізували, та за необхідністю додавали соляну кислоту з одержанням розчину, що мав значення pH від 1,5 до 2,0. Це було покровним розчином. Підготовка активних гранул: Приблизно 24,19 кг гранул мікрокристалічної целюлози додавали в колонку Wurster Column від Glatt GPCG-30 Fluid Bed. Гранули мікрокристалічної целюлози псевдозріджували та нагрівали до температури продукту, що становила 45-47 °C. Потім, покровний розчин пошарово наносили на гранули. Температуру розпилювання контролювали від 37 °C до 47 °C шляхом контролювання вхідної температури, швидкості розпилювання, тиску розпилювання та об'єму повітря. Після нанесення пошарово усього покровного розчину на гранули, гранули висушували при температурі висушування продуктів, що становила 37 °C-47 °C. Продукт, одержаний цим способом, назвали активними гранулами. Приклади 1-15: Одержання композицій лінаклотиду Композиції лінаклотиду, одержані в Прикладах 1-15, одержували, істотною мірою, як описано на Схемі одержання композицій A, де Таблиця 1 забезпечує кількості катіону, стерично утрудненого первинного аміну, звязуючої речовини, лінаклотиду и гранул, в той час як Таблиця 2 забезпечує умови, за яких проводять покриття гранул: Таблиця 1 Приклад 1 2 3 4 5 6 7 Кількість катіона []* CaCl2.2H2O 0,6740г [60] CaCl2.2H2O 0,6740г [60] CaCl2.2H2O 0,2247г [20] CaCl2.2H2O 1,123г [100] CaCl2.2H2O 0,4493г [40] МгCl2.6H2O 0,2590г [10] ZnAc.2H2O 0,2796г [10] 8 Немає даних 9 CaCl2.2H2O 0,3745г [10] 10 Немає даних 11 Немає даних Кількість аміну [] Лейцин 0,2005г [20] Лейцин 0,3007г [30] Лейцин 1,002г [100] Лейцин 0,2005г [20] Лейцин 0,4009г [40] Лейцин 0,3341г [20] Лейцин 0,3341г [20] Лейцин 0,8944г [27] Кількість звязуючої речовини Кількість ** лінаклотиду Кількість гранул Гіпромелоза 1,019г 0,1282г Celphere CP-305 33,38г Гіпромелоза 0,3063г 0,1329г Celphere CP-305 33,87г Гіпромелоза 0,0656г 0,1282г Celphere CP-305 33,86г Гіпромелоза 1,969г 0,1282г Celphere CP-305 32,36г Гіпромелоза 0,5425г 0,1282г Celphere CP-305 33,78г Гіпромелоза 0,6636г 0,2100г Celphere CP-305 33,83г Гіпромелоза 0,6636г 0,2100г Celphere CP-305 33,82г Гіпромелоза 0,6636г 0,4387г Celphere CP-305 33,40г Немає даних Гіпромелоза 0,6636г 0,4227г Celphere CP-305 33,83г Немає даних Немає даних Гіпромелоза 0,6811г Гіпромелоза 0,6636г 0,2114г Celphere CP-305 34,28г Celphere CP-305 34,13г 14 0,4227г UA 104870 C2 Таблиця 1 Приклад 12 13 14 15 5 Кількість катіона []* CuCl2.2H2O 0,4342г [10] ZnAc.2H2O 0,5590г [10] МгCl2.6H2O 0,5178г [10] Немає даних Кількість аміну [] Кількість звязуючої речовини Кількість ** лінаклотиду Кількість гранул Немає даних Гіпромелоза 0,6636г 0,4227г Celphere CP-305 33,79г Немає даних Гіпромелоза 0,6636г 0,4227г Celphere CP-305 33,68г Немає даних Гіпромелоза 0,6636г 0,4227г Celphere CP-305 33,72г Метіонін 0,0380г [1] Гіпромелоза 0,6636г 0,4387г Celphere CP-305 34,08г * "Катіон" відноситься до двохвалентного катіону, який міститься в солі, яку використовували у прикладі, "амін" відноситься до стерично утрудненого первинного аміну, значення в [] відноситься до молярного співвідношення катіону або аміну та лінаклотиду. ** Кількість лінаклотиду в цьому та наступних прикладах визначали, виходячи з вмісту пептиду та хроматографічної чистоти, як перераховано у Свідоцтві про проведення аналізу, забезпеченому для кожної виробленої партії активного фармацевтичного інгредієнта (АФІ) лінаклотиду. Таблиця 2 Приклад 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Температура розпилювання продукту (°C) 34,0 – 37,0 27,4 – 32,3 32,6 – 34,7 35,3 – 39,3 27,8 – 27,9 32,1 – 38,3 31,7 – 39,3 33,3 – 41,3 33,2 – 40,0 42,5 39,7 36,6 – 40,0 32,4 34,0 24,1 – 39,9 Вхідна температура (°C) 55,7 – 57,7 37,01 – 42,1 60,0 – 60,1 58,9 – 59,2 58,7 – 59,8 42,0 – 53,4 50,0 – 52,5 50,5 – 57,0 49,5 – 58,7 59,5 52,0 47,2 – 54,8 57,4 49,0 48,5 – 55,9 Швидкість розпилювання (мл/хв) 0,33 – 0,40 0,40 0,33 – 0,40 0,40 0,35 – 0,33 0,39 – 0,75 0,27 – 0,57 0,57 – 0,65 0,82 – 1,00 0,49 0,66 0,65 – 0,75 0,65 0,75 0,39-0,65 Тиск розпилювання (psig) 20 22 20 18 20 22 22 22 20 22 22 20-22 22 20 22-23 Повітряний потік Низький Низький Низький Низький Низький Низький Низький Низький Низький Низький Низький Низький Низький Низький Низький 10 15 Приклад 16: Одержання композиції лінаклотиду Композицію лінаклотиду, одержану в Прикладі 16, одержували, в основному, як описано на Схемі одержання композицій В, де у Таблиці 3 вказані кількості катіону, стерично утрудненого первинного аміну, звязуючої речовини, лінаклотиду та гранул, в той час як у Таблиці 4 представлені умови, за яких проводять покриття гранул: 15 UA 104870 C2 Таблиця 3 Приклад 16 Кількість катіону [] CaCl2.2H2O 385,1 г [60] Кількість аміну [] Лейцин 171,8 г [30] Кількість звязуючої речовини Кількість лінаклоти ду Кількість гранул Гіпромелоза 175,0 г 73,5 г Celphere CP-305 24,19 кг Таблиця 4 Приклад 16 5 Температура розпилювання продукту (°C) 64,9 – 65,1 Вхідна температура (°C) 80 Швидкість розпилювання (г/хв) 150 Тиск розпилювання (бар) 2,0 Об'єм технологічного повітря (куб.фт./хв.) 515-564 Температура висушування продукту(°C) 54,9 – 55,0 Приклад 17: Одержання композиції лінаклотиду Композицію лінаклотиду, одержану в Прикладі 17, одержували, в основному, як описано на Схемі одержання композицій А, за виключенням того, що композиція містила 22,96 мг бутильованого гідроксианізолу (БГА), де на Таблиці 5 вказані кількості катіону, стерично утрудненого первинного аміну, звязуючої речовини, лінаклотиду та гранул, в той час як Таблиця 6 забезпечує умови, за яких проводять покриття гранул: 10 Таблиця 5 Приклад Кількість катіону [] Кількість аміну [] Кількість звязуючої речовини Кількість лінаклотиду Кількість гранул 17 CaCl2.2H2O 0,3745 г [20] Немає даних Гіпромелоза 0,6636 г 0,2100 г Celphere CP-305 33,99 г Таблиця 6 Приклад 17 15 20 25 30 Температура розпилювання продукту (°C) 33,5 – 34,8 Вхідна температура (°C) 47,7 – 48,6 Швидкість розпилювання (мл/хв.) 0,56 – 0,74 Тиск розпилювання (psig) 26 Повітряий потік Низький Приклад 18: Одержання капсул, що містять композицію лінаклотиду Вміст лінаклотиду на активних гранулах може бути виміряний, як описано в Прикладі 21 або за допомогою інших еквівалентних способів. Для формування капсул, прийнятних для перорального введення, відповідну кількість активних гранул використовують для наповнення желатинових капсул (наприклад, желатинових капсул Розміру 2). Відповідна кількість активних гранул може містити від 50 мкг до 2 мг лінаклотиду на капсулу в діапазоні, що складає + 5 %. В деяких варіантах виконання, відповідна кількість лінаклотиду в активних гранулах може становити 50 мкг, 67,5 мкг, 100 мкг, 133 мкг, 150 мкг, 200 мкг, 266 мкг, 300 мкг, 400 мкг, 500 мкг, 600 мкг, 700 мкг, 800 мкг, 900 мкг, 1 мг, 2 мг, 4 мг або 6 мг. В конкретному варіанті виконання, відповідна кількість лінаклотиду в активних гранулах становить 67,5 мкг, 100 мкг, 133 мкг, 150 мкг, 200 мкг, 266 мкг, 300 мкг, 400 мкг, 500 мкг, 600 мкг. В більш конкретному варіанті виконання, відповідна кількість лінаклотиду в активних гранулах становить 67,5 мкг, 133 мкг, 150 мкг, 266 мкг або 300 мкг на капсулу. В іншому варіанті виконання, відповідну кількість активних гранул для наповнення бажаної кількості желатинових капсул поміщають у контейнер. Один або більше фармацевтично прийнятних наповнювачів або інших фармацевтично прийнятних добавок можуть бути додані, за бажанням, в контейнер. В деяких варіантах виконання, наповнювач або добавка являють собою тальк, лейцин, мікрокристалічну целюлозу або манітол. Вміст контейнера перемішують та суміш використовують для наповнення желатинових капсул відповідною кількістю активних 16 UA 104870 C2 5 10 15 20 25 30 35 40 45 50 55 60 гранул, що містять лінаклотид (наприклад, від 50 мкг до 2 мг лінаклотиду на капсулу в діапазоні, що становить + 5 %). В альтернативному варіанті виконання, відповідну кількість активних гранул застосовують для наповнення желатинових капсул та один або більше фармацевтично прийнятних наповнювачів або інших фармацевтично прийнятних добавок додають до желатинових капсул. Приклад 19: Одержання капсул, що містять композицію лінаклотиду Підготовка покровного розчину: Спочатку, 41,98 г очищеної води змішували з 1,13 г соляної кислоти з одержанням розчину, в якому значення pH становило від 1,5 до 2,0. Потім, 7.,49 г хлориду кальцію дигідрату та 6,68 г лейцину додавали до розчину, який потім перемішували протягом 30 хвилин з одержанням прозорого розчину. Значення pH аналізували, та додавали 1,70 г соляної кислоти для одержання розчину, в якому значення pH становило від 1,5 до 2,0. Потім, 13,27 г гіпромелози (гідроксипропіл метилцелюлози; Dow Chemical Company; Midland, MI) додавали до розчину и суміш перемішували протягом 60 хвилин з одержанням прозорого розчину. Потім, 4,39 г лінаклотиду додавали до розчину и змішували протягом 90 хвилин. Значення pH розчину становило1,73. Це був покровний розчин. Одержання активних гранул: 674,5 г гранул мікрокристалічної целюлози (Celphere CP-305; Ashai Kasei Corporation (Tokyo; Japan) додавали в колонку Wurster Column від Glatt GPCG-2 Fluid Bed. Гранули мікрокристалічної целюлози псевдозріджували и нагрівали протягом 30 хвилин при температурі продукту 60 °C. Потім, покровний розчин пошарово наносили на гранули. Температуру продукту контролювали від 45 °C до 49 °C вхідної температури, що становила 80 °C, швидкість розпилювання становила 5,0-11 г/хв., тиск розпилюваннястановив 3 2,0 бар, и об'єм повітря становив 40-50 м р. Після того, як весь покровний розчин був пошарово нанесений на гранули, гранули висушували протягом 10 хвилин при температурі продукту, що становила 46,9 °C – 50,9 °C. Продукт, одержаний таким способом, називали активними гранулами. Рідинна протифазна хроматографія лінаклотиду, екстрагованого з композиції, одержаної як описано вище, показала, що екстрагований лінаклотид та лінаклотид стандартного зразка проявляли одинакові періоди утримання, та що значна зміна чистоти в результаті процесу складання в композицію не спостерігалася. Для формування капсул, 49,50 г активних гранул додавали в порожній пакет. Потім, 0,25 г лейцину, просіяного через сита 60 меш, додавали в пакет. Пакет зав'язували та перемішували при 125 обертів для перемішування усього матеріалу. Потім, 0,25 г тальку, просіяного через сита 60 меш, додавали в пакет. Пакет зав'язували та перемішували при 125 обертів для перемішування усього матеріалу. Після перемішування усього матеріалу, суміш використовували для наповнення желатинових капсул Розміру 2 при цільовій масі 227 мг/капсул в діапазоні, що становив ± 5 %. Приклад 20: Одержання капсул, що містять композицію лінаклотиду Активні гранули одержували відповідно до Прикладом 16. Активні гранули аналізували на вміст лінаклотиду. Виходячи з результатів аналізу активних гранул, відповідну кількість активних гранул (96 мг – 123 мг) заповнювали у тверді желатинові капсули розміру 2 за допомогою пристрою виготовлення капсул MG2 Futura, з одержанням концентрації лінаклотиду, що становить 300 мкг. Активні гранули одержували відповідно до Прикладу 15. Активні гранули аналізували на вміст лінаклотиду. Виходячи з результатів аналізу активних гранул, відповідну кількість активних гранул (48 мг – 62 мг) заповнювали у тверді желатинові капсули розміру 2 за допомогою пристрою формування капсул MG2 Futura, з одержанням концентрації лінаклотиду, що становила 150 мкг. Приклад 21: Вимірювання вмісту та чистоти лінаклотиду Вміст та чистоту лінаклотиду, а також вимірювання родинних лінаклотиду речовин може бути визначено за допомогою протифазної градієнтної рідинної хроматографії за допомогою системи Agilent Series 1100 LC з програмним забезпеченням Chemstation Rev A.09.03 або TM еквівалентного. Використовували колонку YMC Pro C18 (розміри: 3,0 × 150 мм, 3,5 мкм 120 Å; Waters Corp., Milford, MA) або еквівалентну, температуру якої підтримували при 40 °C. Рухома фаза A (ПФA) складалася з води з 0,1 % трифтороцтовою кислотою, в той час, як рухома фаза B (ПФB) складалася з 95 % ацетонітрилу:5 % води з 0,1 % трифтороцтовою кислотою. Елюцію лінаклотиду та родинних лінаклотиду речовин виконували градієнті від 0 % до 47 % ПФB за 28 хвилин с наступним викидом до 100 % ПФB за 4 хвилини з 5-хвилинним утриманням при 100 % ПФВ для промивання колонки. Повторне урівноваження колонки виконували шляхом повертання - 0 % ПФВ за 1 хвилину з наступним 10-хвилинним утриманням при 100 % ПФА. Швидкість потоку становила 0,6 мл/хв., а детекцію проводили за допомогою УФ при 220 нм. 17 UA 104870 C2 5 10 15 Проби для аналізу готували шляхом додавання вмісту капсул лінаклотиду до 0,1 N HCl з одержанням цільової концентрації 20 мкг лінаклотиду /мл. 100 мкл даного розчину вприскували у колонку. Вміст лінаклотиду вимірювали шляхом визначення концентрації лінаклотиду в одержаній пробі порівняно з аналогічно підготовленим зовнішнім стандартним лінаклотидом. Приклад аналізу лінаклотиду за допомогою ВЕРХ показано на Фігурі 1, де "Окислення" відноситься до продукту окислення лінаклотиду, "Формальдегід-імін" відноситься до формальдегід-імінного продукту лінаклотиду, а "Гідроліз" відноситься до продукту гідролізу лінаклотиду. Приклад 22: Аналіз стабільності композиції лінаклотиду Для композицій, представлених у Прикладах 1-15 и 17, желатинові капсули наповнювали приблизно 225 мг активних гранул. Чотири наповнені капсули поміщали в пластикові пляшки. Пляшки містили 1 – 2 г десіканту та були індукційно герметизовані. Пляшки зберігали при 40 °C/75 % ВВ протягом шести місяців. Вміст та чистоту лінаклотиду, а також кількість родинних лінаклотиду речовин вимірювали, загалом, як описано в Прикладі 21 або за допомогою еквівалентного способу. Результати представлено в Таблиці 7. Таблиця 7 Площа % за допомогою ВЕРХ Приклад 1 98,87 95,67 103,41 99,46 98,64 92,81 93,53 77,12 85,73 Лінаклотид (% вихідного) 96,88 (99,13) 97,36 (99,42) 95,61 (97,83) 95,87 (98,68) 93,64 (95,51) 93,44 (95,36) 88,20 (94,90) 93,81 (96,55) 84,85 (87,77) 89,09 (91,63) 12 33,60 41,98 (43,15) 13 87,69 14 15 17 25 107,56 3 4 5 6 7 8 9 10 11 20 Аналіз [мас./мас.] % вихідного 86,94 87,71 98,94 Окислення Гідроліз Формальдегідімін 0,11 0,24 0,19 0,07 0,10 0,07 0,14 0,45 0,37 0,2 0,37 1,18 0,52 0,16 0,25 0,70 1,45 1,85 0,41 0,29 0,49 Немає даних 0,15 0,24 0,24 0,55 0,63 0,49 1,06 4,45 1,38 Немає даних 91,91 (94,01) 90,59 (92,70) 87,54 (93,24) 93,65 (95,16) Немає даних 1,98 0,74 0,86 0,25 0,24 ND 0,54 0,66 0,32 1,23 1,67 0,73 Для композиції, представленій в Прикладі 16, желатинові капсули наповнювали приблизно 113 мг загальної кількості гранул. 35 наповнених гранул поміщали в пластикові пляшки. Пляшки містили 2 г десіканта та були індукційно герметизовані. Пляшки зберігали при 40 °C/75 % ВВ протягом одного місяця. Вміст и чистоту лінаклотиду, а також кількість родинних лінаклотиду речовин вимірювали, в основному, як описано в Прикладі 21 або за допомогою еквівалентного способу. Результати представлено в Таблиці 8. Таблиця 8 Приклад Аналіз [мас./мас.] % вихідного 16 97,01 Площа % за допомогою ВЕРХ Лінаклотид (%вихідного) 97,12 (99,79) Окислення Гідроліз Формальдегідімін
ДивитисяДодаткова інформація
Назва патенту англійськоюStable solid formulation of a gc-c receptor agonist polypeptide suitable for oral administration
Автори російськоюFretzen, Angelika, Witowski, Steven, Grossi, Alfredo, Zhao, Hong, Dedhiya, Mahendra, Mo, Yun
МПК / Мітки
МПК: A61K 38/03, A61P 1/00
Мітки: композиція, спосіб, лінаклотиду, пероральна, рецептора, стабільна, одержання, агоніста, тверда, поліпептидного
Код посилання
<a href="https://ua.patents.su/31-104870-stabilna-peroralna-tverda-kompoziciya-polipeptidnogo-agonista-gc-c-receptora-linaklotidu-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Стабільна пероральна тверда композиція поліпептидного агоніста gc-c рецептора лінаклотиду та спосіб її одержання</a>
Попередній патент: Фармацевтичні композиції, що містять ліганди рецептора дофаміну
Наступний патент: Спільне виробництво синтез-газу та енергії
Випадковий патент: Викопуючий робочий орган коренезбиральної машини












