Похідні пурину з властивостями агоніста людського а2а рецептора, спосіб їх одержання, фармацевтична композиція та спосіб лікування
Формула / Реферат
1. Сполука формули:
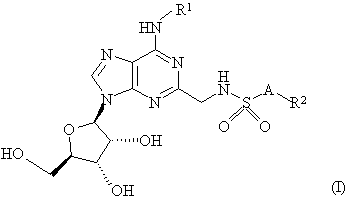
або її фармацевтично прийнятна сіль або сольват,
де R1 є воднем або C1-C6 алкілом, необов’язково, заміщеним 1 або 2 замісниками, і кожен незалежно вибирають з фенілу і нафтилу, згаданий феніл і нафтил, необов’язково, заміщений C1-C6 алкілом, C1-C6 алкокси, галогеном або ціано;
A є зв’язком або C1-C3 алкіленом;
R2 є (i) воднем, C1-C6 алкілом, C3-C7 циклоалкілом, фенілом або нафтилом, згаданий C3-C7 циклоалкіл, феніл або нафтил, необов’язково, заміщений C1-C6 алкілом, фенілом, C1-C6 алкоксі-(C1-C6)-алкілом, R3R3N-(C1-C6)-алкілом, фтор-(C1-C6)-алкілом, фтор-(C1-C6)-алкокси, C2-C5 алканоїлом, галогеном, -OR3, ціано, -COOR3, C3-C7 циклоалкілом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 або –NR3SО2R4, за умови, що R2 не є воднем, коли А є зв’язком,
або (ii) коли A є C2-C3 алкіленом, -NR3R3, -OR3, -CОOR3, -OCOR4, -SO2R4, -CN, -SO2NR3R3, -NR3COR4 або -CONR3R3,
або (ііi) C-зв’язаним, 4-11-членним моно- або біциклічним гетероциклом, що має від 1 до 4 атом(ів) азоту в кільці, або 1 або 2 атоми азоту і 1 атом кисню або 1 атом сірки, необов’язково, C-заміщений оксо, C1-C6 алкоксі-(C1-C6)-алкілом, R3R3N-(C1-C6)-алкілом, фтор-(C1-C6)-алкілом, фтор-(C1-C6)-алкокси, фтор-(C2-C5)-алканоїлом, галогеном, ціано, -OR5, R6, -COR5, -NR5R5, -COOR5, -S(O)mR6, -SO2NR5R5, -NR5SO2R6 або -NR5COR6 і, необов’язково, N-заміщеним C1-C6 алкоксі-(C1-C6)-алкілом, R3R3N-(C2-C6)-алкілом, фтор-(C1-C6)-алкілом, фтор-(C2-C5)-алканоїлом, R6, -COR5, -COOR5, -S(O)mR6, -SO2NR5R5 або -CONR5R5,
R3 є H, C1-C6 алкілом, C3-C7 циклоалкілом або фенілом;
R4 є C1-C6 алкілом, C3-C7 циклоалкілом або фенілом;
R5 є H, C1-C6 алкілом, C3-C7 циклоалкілом, фенілом, нафтилом або гет;
R6 є C1-C6 алкілом, C3-C7 циклоалкілом, фенілом, нафтилом або гет;
або R7 і R8, узяті разом з атомом азоту до якого вони приєднані, являють собою азетидиніл, піролідиніл, піперидиніл, морфолініл, піперазиніл, гомопіперидиніл, гомопіперазиніл або тетрагідроізохінолініл, кожний, необов’язково, заміщений по атому вуглецю кільця C1-C6 алкілом, C3-C8 циклоалкілом, фенілом, C1-C6 алкоксі-(С1-C6)-алкілом, R3R3N-(C1-C6)-алкілом, фтор-(C1-C6)-алкілом, -CONR3R3, -COOR3 або C2-C5 алканоїлом і, необов’язково, заміщений по атому вуглецю кільця, що не є сусіднім з атомом азоту кільця, фтор-(C1-C6)-алкокси, галогеном, OR3, ціано, -S(O)mR4, -NR3R3, -SO2NR3R3, -NR3COR4 або -NR3SO2R4, і згаданий піперазин-1-іл і гомопіперазин-1-іл, необов’язково, заміщений по атому азоту кільця, що не зв’язаний з А C1-C6 алкілом, фенілом, C1-C6 алкоксі-(C2-C6)-алкілом, R3R3N-(C2-C6)-алкілом, фтор-(C1-C6)-алкілом, C2-C5 алканоїлом, -COOR4, C3-C8 циклоалкілом, -SO2R4, -SO2NR3R3 або -CONR3R3,
або R7 є Н, C1-C6 алкілом, C3-C8 циклоалкілом, фенілом або бензилом і R8 є Н, C1-C6 алкілом, C3-C8 циклоалкілом, фенілом, бензилом, фтор-(C1-C6)-алкілом, -CONR3R3, -COOR4, C2-C5 алканоїлом або -SO2NR3R3;
m є 0, 1 або 2; і
"гет", що використовується у визначенні R5 і R6, означає C-зв’язаний піроліл, імідазоліл, тіазоліл, тієніл, фурил, тіазоліл, оксазоліл, тіадіазоліл, оксадіазоліл, піридиніл, піримідиніл, піридазиніл, піразиніл, хінолініл, ізохінолініл, бензімідазоліл, хіназолініл, фталазиніл, бензоксазоліл або хіноксалініл, кожний, необов’язково, заміщений C1-C6 алкілом, C1-C6 алкокси, ціано або галогеном.
2. Сполука згідно з пунктом 1, де
R1 є воднем або C1-C6 алкілом, необов’язково, заміщеним 1 або 2 замісниками, кожний незалежно вибирають з фенілу і нафтилу, згаданий феніл і нафтил, необов’язково, заміщений C1-C6 алкілом, C1-C6 алкокси, галогеном або ціано;
A є зв’язком або C1-C3 алкіленом;
R2 є (i) воднем, C1-C6 алкілом, C3-C7 циклоалкілом, фенілом або нафтилом, згаданий C3-C7 циклоалкіл, феніл або нафтил, необов’язково, заміщений C1-C6 алкілом, фенілом, C1-C6 алкоксі-(C1-C6)-алкілом, аміно-(C1-C6)-алкілом, фтор-(C1-C6)-алкілом, фтор-(C1-C6)-алкокси, C2-C5 алканоїлом, галогеном, -OR3, ціано, -COOR3, C3-C7 циклоалкілом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 або -NR3SО2R4, за умови, що R2 не є воднем коли, А є зв’язком,
або (ii) коли A є C2-C3 алкіленом, -NR3R3, -OR3, -CОOR3, -OCOR4, -SO2R4, -CN, -SO2NR3R3, -NR3COR4 або -CONR3R3,
або (ііi) C-зв’язаним, 4-11-членним моно- або біциклічним гетероциклом, що має від 1 до 4 атом(ів) азоту в кільці, або 1 або 2 атоми азоту і 1 атом кисню або 1 атом сірки, необов’язково, C-заміщений оксо, C1-C6 алкоксі-(C1-C6)-алкілом, аміно-(C1-C6)-алкілом, фтор-(C1-C6)-алкілом, фтор-(C1-C6)-алкокси, фтор-(C2-C5)-алканоїлом, галогеном, ціано, -OR5, R6, -COR5, -NR5R5, -COOR5, -S(O)mR6, -SO2NR5R5, -NR5SO2R6 або -NR5COR6 і, необов’язково, N-заміщеним C1-C6 алкоксі-(C1-C6)-алкілом, аміно-(C2-C6)-алкілом, фтор-(C1-C6)-алкілом, фтор-(C2-C5)-алканоїлом, R6, -COR5, -COOR5, -S(O)mR6, -SO2NR5R5 або -CONR5R5,
або (iv) коли A є C2-C3 алкіленом, N-зв’язаний азетидиніл, піролідиніл, піперидиніл або піперазиніл, кожний необов’язково С-заміщений C1-C6 алкілом, фенілом, C1-C6 алкоксі-(C1-C6)-алкілом, аміно-(C1-C6)-алкілом, фтор-(C1-C6)-алкілом, фтор-(C1-C6)-алкокси, C2-C5 алканоїлом, галогеном, -OR3, ціано, -COOR3, C3-C7 циклоалкілом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 або -NR3SО2R4 і, необов’язково, N-заміщений C1-C6 алкілом, фенілом, C1-C6 алкоксі-(C1-C6)-алкілом, аміно-(C2-C6)-алкілом, фтор-(C1-C6)-алкілом, C2-C5 алканоїлом, -COOR3, C3-C7 циклоалкілом, -S(O)mR4, -SO2NR3R3 або -CONR3R3;
R3 є H, C1-C6 алкілом або фенілом;
R4 є C1-C6 алкілом або фенілом;
R5 є H, C1-C6 алкілом, C3-C7 циклоалкілом, фенілом, нафтилом або гет;
R6 є C1-C6 алкілом, C3-C7 циклоалкілом, фенілом, нафтилом або гет;
m є 0, 1 або 2; і
"гет", що використовується у визначенні R5 і R6, означає C-зв’язаний піроліл, імідазоліл, тіазоліл, тієніл, фурил, тіазоліл, оксазоліл, тіадіазоліл, оксадіазоліл, піридиніл, піримідиніл, піридазиніл, піразиніл, хінолініл, ізохінолініл, бензімідазоліл, хіназолініл, фталазиніл, бензоксазоліл або хіноксалініл, кожний, необов’язково, заміщений C1-C6 алкілом, C1-C6 алкокси, ціано або галогеном.
3. Сполука згідно з пунктом 1 або 2, де A є зв’язком.
4. Сполука згідно з пунктом 1 або 2, де A є C1-C3 алкілeном.
5. Сполука згідно з пунктом 1, де A є C2-C3 алкіленом.
6. Сполука згідно з пунктом 5, де A є -CH2CH2-.
7. Сполука згідно з будь-яким з попередніх пунктів, де R2 є С1-C6 алкілом або фенілом.
8. Сполука згідно з пунктом 7, де R2 є 2-метилпроп-1-ілом або фенілом.
9. Сполука згідно з пунктом 5 або 6, де R2 є -NR7R8.
10. Сполука згідно з пунктом 9, де R7 є C1-C6 алкілом і R8 є C3-C8 циклоалкілом.
11. Сполука згідно з пунктом 10, де R7 є проп-2-ілом і R8 є циклопентилом.
12. Сполука згідно з будь-яким з попередніх пунктів, де R1 є С1-C6 алкілом, заміщеним 1 або 2 замісниками, де кожний незалежно вибирають з фенілу або нафтилу.
13. Сполука згідно з пунктом 12, де R1 є 2-фенілетилом, 2,2-дифенілетилом або 1-нафтилметилом.
14. Сполука згідно з пунктом 1, де -A-R2 є 2-[(2-пропіл)(циклопентил)аміно]етилом, 2-метилпроп-1-ілом або фенілом.
15. Сполука згідно з пунктом 1, яку вибирають з групи, що містить
N-({9-[(2R,3R,4S,5R)-3,4-дигідрокси-5-(гідроксиметил)тетрагідро-2-фураніл]-6-[(2,2-дифенілетил)аміно]-9H-пурин-2-іл}метил)-2-метил-1-пропансульфонамід;
N-{[9-[(2R,3R,4S,5R)-3,4-дигідрокси-5-(гідроксиметил)тетрагідро-2-фураніл]-6-(фенетиламіно)-9H-пурин-2-іл]метил}бензолсульфонамід;
N-({9-[(2R,3R,4S,5R)-3,4-дигідрокси-5-(гідроксиметил)тетрагідро-2-фураніл]-6-[(1-нафтилметил)аміно]-9H-пурин-2-іл}метил)бензолсульфонамід;
2-[циклопентил(ізопропіл)аміно]-N-({9-[(2R,3R,4S,5R)-3,4-дигідрокси-5-(гідроксиметил)тетрагідро-2-фураніл]-6-[(2,2-дифенілетил)аміно]-9H-пурин-2-іл}метил)етансульфонамід;
і її фармацевтично прийнятні солі і сольвати.
16. Фармацевтична композиція, що містить сполуку формули (I) або її фармацевтично прийнятну сіль або сольват, згідно з будь-яким з попередніх пунктів, разом з фармацевтично прийнятним наповнювачем, розріджувачем або носієм.
17. Сполука формули (I) або її фармацевтично прийнятна сіль, сольват або композиція, згідно з будь-яким з пунктів від 1-15 і 16, відповідно, для використання як медикаменту.
18. Сполука формули (I) або її фармацевтично прийнятна сіль, сольват або композиція, згідно з будь-яким з пунктів 1-15 і 16, відповідно, для виготовлення медикаменту для лікування захворювання, при якому призначають агоніст A2a рецептора.
19. Сполука формули (I) або її фармацевтично прийнятна сіль, сольват або композиція, згідно з будь-яким з пунктів 1-15 і 16, відповідно, для виготовлення антизапального агента.
20. Сполука формули (I) або її фармацевтично прийнятна сіль, сольват або композиція, згідно з будь-яким з пунктів 1-15 і 16, відповідно, для виготовлення медикаменту для лікування респіраторного захворювання.
21. Сполука згідно з пунктом 20, де захворювання вибирають з групи, що вміщує респіраторний дистрес-синдром повнолітніх (РДСП), бронхіт, хронічний бронхіт, хронічне обструктивне легеневе захворювання, цистофіброз, астму, емфізему, бронхоектазію, хронічний синусит і риніт.
22. Сполука формули (I) або її фармацевтично прийнятна сіль, сольват або композиція, згідно з будь-яким з пунктів 1-15 і 16, відповідно, для виготовлення медикаменту для лікування септичного шоку, еректильної дисфункції у чоловіків, гіпертензії, удару, епілепсії, церебральної ішемії, периферичного васкулярного захворювання, постішемічного реперфузивного ушкодження, діабету, ревматоїдного артриту, розсіяного склерозу, псоріазу, дерматиту, алергічного дерматиту, екземи, виразкового коліту, хвороби Крона, запального захворювання кісток, гастриту викликаного Heliсobacter pylori, гастриту, ушкодження кишково-шлункового тракту, викликаного нестероїдним протизапальним лікарським засобом, або психогенного захворювання, або для загоєння ран.
23. Спосіб лікування ссавця, включаючи людину, з використанням агоніста A2a рецептора, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, сольвату або композиції, згідно з будь-яким з пунктів 1-15 і 16, відповідно.
24. Спосіб лікування у ссавця запального захворювання, включаючи людину, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, сольвату або композиції, згідно з будь-яким з пунктів 1-15 і 16, відповідно.
25. Спосіб лікування у ссавця респіраторного захворювання, включаючи людину, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, сольвату або композиції, згідно з будь-яким з пунктів 1-15 і 16, відповідно.
26. Спосіб згідно з пунктом 25, де захворювання вибирають з групи, що містить респіраторний дистрес-синдром повнолітніх (РДСП), бронхіт, хронічний бронхіт, хронічне обструктивне легеневе захворювання, цистофіброз, астму, емфізему, бронхоектазію, хронічний синусит і риніт.
27. Спосіб лікування у ссавця, включаючи людину, септичного шоку, еректильної дисфункції у чоловіків, гіпертензії, удару, епілепсії, церебральної ішемії, периферичного васкулярного захворювання, постішемічного реперфузивного ушкодження, діабету, ревматоїдного артриту, розсіяного склерозу, псоріазу, дерматиту, алергічного дерматиту, екземи, виразкового коліту, хвороби Крона, запального захворювання кісток, гастриту викликаного Heliсobacter pylori, гастриту, ушкодження кишково-шлункового тракту викликаного нестероїдним протизапальним лікарським засобом, або психогенного захворювання, або для загоєння ран, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, сольвату або її композиції, згідно з будь-яким з пунктів 1-15 і 16, відповідно.
28. Спосіб одержання сполуки формули (I), як зазначено в пункті 1 або 2, або її фармацевтично прийнятної солі або сольвату, що включає зняття захисту з сполуки формули:
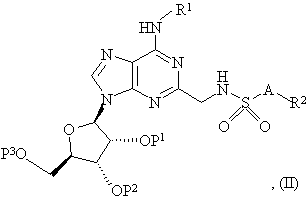
де R1, R2 і A є такими, як зазначено в пункті 1 або 2, і або Ρ1, Ρ2 і P3, коли узяті окремо, є захисними групами, або P1 і P2, коли узяті разом, є захисною групою і P3 є захисною групою, захисні групи видаляють разом або послідовно і, необов’язково, включає наступне перетворення сполуки формули (I) у її фармацевтично прийнятну сіль.
29. Спосіб одержання сполуки формули (I), як зазначено в пункті 1 або 2, або її фармацевтично прийнятної солі або сольвату, що включає зняття захисту з сполуки формули:
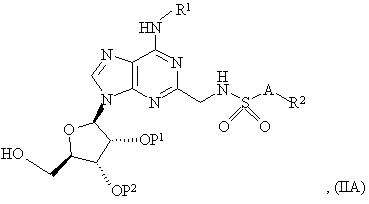
де R1, R2 і A є такими, як зазначено в пункті 1 або 2, і або Ρ1 і Ρ2, коли узяті окремо, є захисними групами, або P1 і P2, коли узяті разом, є захисною групою, захисні групи P1 і P2, коли узяті окремо, видаляють або разом або послідовно і, необов’язково, включає наступне перетворення сполуки формули (I) у її фармацевтично прийнятну сіль.
30. Спосіб одержання сполуки формули (I), як зазначено в пункті 1 або 2, або її фармацевтично прийнятної солі або сольвату, що включає зняття захисту з сполуки формули:
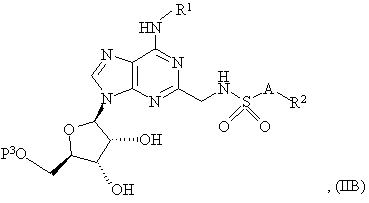
де P3 є захисною групою і R1, R2 і A є такими, як зазначено в пункті 1 або 2 і, необов’язково, включає наступне перетворення сполуки формули (I) у її фармацевтично прийнятну сіль.
31. Спосіб одержання сполуки формули (I), як зазначено в пункті 1 або 2, або її фармацевтично прийнятної солі або сольвату, що включає сульфонілювання сполуки формули:
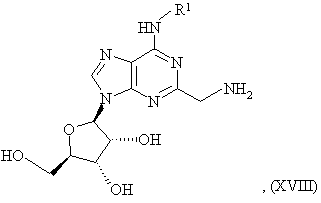
де R1 є таким, як зазначено в пункті 1 або 2, сполукою формули
R2-A-SO2X, (VII)
де X є групою, що відходить, переважно хлором, і R2 і A є такими як зазначено в пункті 1 або 2 і, необов’язково, включає наступне перетворення сполуки формули (I) у її фармацевтично прийнятну сіль.
32. Спосіб одержання сполуки формули (I), як зазначено в пункті 1 або 2, в якій A є -CH2CH2- і R2 є -NR7R8, або її фармацевтично прийнятної солі або сольвату, що включає взаємодію сполуки формули:
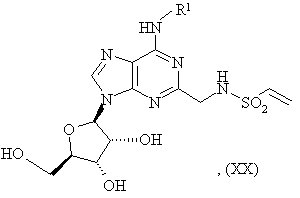
де R1 є таким як зазначено в пункті 1, з сполукою формули
R7R8NH, (XXII)
де R7 і R8 є такими як зазначено в пункті 1; і
згаданий спосіб, необов’язково, включає наступне перетворення сполуки формули (I) у її фармацевтично прийнятну сіль.
33. Сполука формули:

де або P1, P2 і P3, коли узяті окремо, є захисними групами, або P1 і P2, коли узяті разом, є захисною групою, і P3 є захисною групою, і в якій R1, R2 і А є такими, як зазначено в пункті 1 або 2.
34. Сполука формули

в якій R1 є таким, як зазначено в пункті 1 або 2.
35. Сполука формули

де група R1 є такою, як зазначено в пункті 1.
Текст
Цей винахід стосується похідних пурину. Зокрема, цей винахід стосується похідних N-[(пурин-2іл)метил]сульфонаміду і способу їх одержання, проміжних сполук, що використовуються при їх одержанні, і композиції, що містять такі похідні і їх використання. Ці похідні є селективними функціональними агоністами людського А2а рецептору аденозину і можуть використовува тись в якості антизапальних агентів при лікуванні захворювань дихальних шля хів. Аденозин є молекулою, що зустрічається у всіх тканинах і відіграє ключову роль у інтермедіарному метаболізмі у ссавців. Крім того, аденозин діючи на різні поверхневі рецептори обумовлює різні наслідки. Класифікація рецепторів аденозину виявила наявність, принаймні, чотирьох підтипів: А1, А2а, А2b і A3. Стимулювання А2 рецепторів аденозину на поверхні людських нейтрофілів приводить до ефективного інгібування ряду нейтрофільних функцій. Активовані нейтрофіли можуть пошкоджувати тканини легенів внаслідок вивільнення активного кисню, наприклад, пероксидних аніонів (О2'), і продукування гранул, наприклад, нейтрофільної еластази людини (НЕЛ), і інших медіаторів запалення. Крім того, активовані нейтрофіли призводять de novo до синтезу і вивільнення арахідонатів, таких як лейкотрієн В4 (LTB4). LTB4 є потенційним хемоатрактантом, що притягує додаткові нейтрофіли до місця запалення, що призводить до вивільнення О2' і НЕЛ, які несприятливо діють на легеневу зовнішньоклітинну матрицю. Підтип А2 рецептору, що обумовлює багато з ци х проявлень (О2' і LTB4/HEЛ вивільнення і клітинну адгезію) позначають як А2а. Відповідальність підтипу А2 (А2а або А2b) за інші проявлення ще повинна бути доведена. Селективний агоніст активності А2а рецептору, як припускають, більш терапевтично корисніший, ніж використання неселективних агоністів рецептору аденозину, оскільки він взаємодіє з іншими підтипами, що обумовлюють інші небажані проявлення в легенях моделей тварин і у дослідження людських тканин. Наприклад, у астматиків, але не будь яких інших, відбувається звуження бронхів при інгаляції аденозину. Ця відповідь, принаймні, частково обумовлена активацією А1 рецептору. Активування А1 рецепторів також промотує нейтрофільний хемотаксис і приєднання ендотеліальних клітин, таким чином викликаючи ушкодження легені. Крім того, багатьом пацієнтам з респіраторними захворюваннями призначаються р 2агонітси, і спостерігається негативна взаємодія між ізопреналіном і рецепторами аденозину у дослідженнях на тваринах, що обумовлено негативним зв'язуванням з аденилатциклазою. Дегрануляція людських тучних клітин промотується шляхом активування А2b рецепторів аденозину, таким чином селективність А2b рецептору також є корисною. Нами неочикувано було встановлено, що представлені похідні пурину інгібують нейтрофільну функцію і є селективними агоністами А2а рецептору аденозину. Вони також мають антагоністичну активність по відношенню A3 рецептору аденозину. Представлені сполуки можна використовувати для лікування будь яких захворювань для яких рекомендований агоніст A3 рецептору аденозину. Вони можуть використовуватись для лікування захворювань, при яких виникають лейкоцит (наприклад, нейтрофіл, еозинофіл, базофіл, лімфоцит, макрофаг)-індуковані ушкодження тканин. Вони корисні в якості анти-запальних агентів при лікуванні захворювань дихальних шляхі в, таких як респіраторний дистрессиндром повнолітніх (РДСП), бронхіт, хронічний бронхіт, хронічне обструктивне легеневе захворювання, цистофіброз, астма, емфізема, бронхоектаз, хронічний синусит і риніт. Представлені сполуки також можна використовувати при лікуванні септичного шоку, еректильної дисфункції у чоловіків, гіпертензії, удару, епілепсії, церебральної ішемії, периферичного васкулярного захворювання, постішемічного реперфузивного ушкодження, діабету, ревматоїдного артриту, розсіяного склерозу, псоріазу, дерматиту, алергічного дерматиту, екземи, виразкового коліту, хвороби Крона, запального захворювання кісток, гастриту викликаного Heliobacter pylori, гастриту, ушкодження кишково-шлункового тракту викликаного нестероїдним протизапальним лікарським засобом або психогенного захворювання, або для загоєння ран. Таким чином, представлений винахід стосується сполуки формули: або її фармацевтично прийнятної солі або сольвату, де R1 є воднем або С1-С6 алкілом, необов'язково, заміщеним 1 або 2 замісниками, кожний незалежно вибирають з фенілу і нафтилу, згаданий феніл і нафтил, необов'язково, заміщені С1-С6 алкілом, С1-С6 алкокси, галогеном або ціано; А є зв'язком або С 1-С3 алкіленом; R2 є (і) воднем, С1-С6 алкілом, С3-С7 циклоалкілом, фенілом або нафтилом, згаданий С3-С7 циклоалкіл, феніл або нафтил, необов'язково, заміщені С1-С6 алкілом, фенілом, С1-С6 алкокси-(С1-С6)-алкілом, R3R3N-(C1C6)-акілом, фтор-(С1-С6)-алкілом, фтор-(С1-С6)-алкокси, С2-С5 алканоїлом, галогеном, -OR 3, ціано, -COOR 3, С3С7 циклоалкілом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3 , -NR3COR4 або -NR3SO2R4, при умові, що R2 не є воднем коли, коли А є зв'язком, або (іі) коли А є С2-С3 алкіленом, -NR3R3, -OR3, -COOR 3, -OCOR 4 , -SO2R4 , -CN, -SO2NR3R3, -NR3COR4 або CONR3R3, або (ііі) С-зв'язаним, 4-11-членним моно- або біциклічним гетероциклом, що має від 1 до 4 атом(ів) азоту в кільці, або 1 або 2 азоти і 1 кисень або 1 атом сірки, необов'язково, С-заміщений оксо, С1-С6 алкокси-(С1-С6) алкілом, R3R3N-(С1-С6)-алкілом, фтор-(С1-С6)-алкілом, фтор-(С1-С6)-алкокси, фтор-(С2-С5)-алканоїлом, галогеном, ціано, -OR5, R6, -COR 5, -NR5R5, -COOR 5, -S(O) mR6, -SO2NR5R5, -NR5SO2R6 або -NR5COR6 і, необов'язково, N-заміщеним С 1-С6 алкокси-(С1-С6)-алкілом, R3R3N-(C2-C6)-алкілом, фтор-(С1-С6)-алкілом, фтор-(С2-С5)-алканоілом, R6, -COR 5, -COOR 5 , -S(O) mR6, -SO2NR5R5 або -CONR 5R5, R3 є Н, С1-С 6 алкілом, С3-С7 циклоалкілом або фенілом; R4 є С1-С6 алкілом, С3-С7 циклоалкілом або фенілом; R5 є Н, С1-С 6 алкілом, С3-С7 циклоалкілом, фенілом, нафтилом або гет; R6 є С1-С6 алкілом, С3-С7 циклоалкілом, фенілом, нафтилом або гет; або, R7 і R8, узяті разом з атомом азоту до якого вони приєднані, представляють азетидиніл, піролідиніл, піперидиніл, морфолініл, піперазиніл, гомопіперидиніл, гомопіперазиніл або тетрагідроізохінолініл, кожний, необов'язково, заміщений по атому вуглецю кільця С 1-С6 алкілом, C3-C8 циклоалкілом, фенілом, С1-С6 алкокси-(С1-С6)-алкілом, R3R3N-(С1-С6)-алкілом, фтор-(С1-С6)-алкілом, -CONR3R3, -COOR 3 або С2-С5 алканоїлом і, необов'язково, заміщений по атому вуглецю кільця, що не є сусіднім з атомом азоту кільця фтор(С1-С6)-алкокси, галогеном, OR3, ціано, -S(O)mR4, -NR3R3, -SO2NR3R3, -NR3COR4 або -NR3SO2R4, і згаданий піперазин-1-іл і гомопіперазин-1-іл, необов'язково, заміщений по атому азоту кільця, що не зв'язаний з А С 1-С6 алкілом, фенілом, С1-С6 алкокси-(С2-С6)-алкілом, R3R3N-(C2-C6)-алкілом, фтор-(С1-С6)-алкілом, С2-С5 алканоїлом, -COOR 4, С3-С8 циклоалкілом, -SO2R4, -SO 2NR3R3 або -CONR 3R3, або, R7 є Н, С1-С6 алкілом, С3-С8 циклоалкілом, фенілом або бензилом і R 8 є Н, d-С6 алкілом, С3-С8 циклоалкілом, фенілом, бензилом, фтор-(С1-С6)-алкілом, -CONR3R3, -COOR 4, C2-C5 алканоїлом або SO2NR3R3; m є 0, 1 або 2; і "гет", що використовується у визначенні R5 і R6, означає С-зв'язаний піроліл, імідазоліл, тіазоліл, тієніл, фурил, тіазоліл, оксазоліл, тіадіазоліл, оксадіазоліл, піридиніл, піримідиніл, піридазиніл, піразиніл, хінолініл, ізохінолініл, бензімідазоліл, хіназолініл, фталазиніл, бензоксазоліл або хіноксалініл, кожний, необов'язково, заміщений С1-С6 алкілом, С1-С6 алкокси, ціано або галогеном. У вище приведених визначеннях, галоген означає фтор, хлор, бром або йод і алкільна, алкіленільна, алканоїльна і алкокси групи можуть бути розгалуженими або нерозгалуженими, якщо містить потрібну кількість атомів вуглецю. Гетероцикли у визначенні R2, частина (ііі) вище, можуть бути ароматичними або повністю або частково насиченими. Вираз 'С-зв'язаний', що використовується у визначенні R2 і гет, означає, що група є зв'язаною з суміжним атомом вуглецю кільця. Прикладами алкілів є метил, етил, н-пропіл, і-пропіл, н-бутил, ібутил, втор-бутил і т-бутил. Прикладами алкокси є метокси, етокси, н-пропокси, і-пропокси, н-бутокси, ібутокси, втор-бутокси і т-бутокси. Прикладами алкіленів є метилен, 1,1-етилен, 1,2-етилен, 1,3-пропілен і 1,2пропілен. Прикладами циклоалкілів є циклопропіл, циклобутил, циклопентил, циклогексил і циклогептил. Фармацевтично прийнятними солями сполук формули (І) є кислотноадитивні і основні солі. Придатні кислотноадитивні солі одержують з кислот, які утворюють нетоксичні солі і прикладами таких солей є гідрохлоридні, гідробромідні, гідройодидні, сульфатні, бісульфатні, нітратні, фосфатні, гідрофосфа тні, ацетатні, малеатні, фумаратні, лактатні, тартратні, цитратні, глюконатні, сукцинатні, сахаратні, бензоатні, метансульфонатні, етансульфонатні, бензолсульфонатні, п-толуолсульфонатні і памоатні солі. Придатні основні солі одержують з основ, які утворюють нетоксичні солі і прикладами таких солей є натрієві, калієві, алюмінієві, кальцієві, магнієві, цинкові і діетаноламінові солі. Для ознайомлення з придатними солями дивіться Berge et al. J. Pharm. Sci., 66, 1-19,1977. Фармацевтично прийнятними сольватами сполук формули (І) є їх гідрати. Також в рамки представлених сполук формули (І) включені їх поліморфні форми. Сполуки формули (І) можуть містити один або більшу кількість асиметричних атомів вуглецю і тому існувати в двох або більшій кількості стереоізомерних форм. Представлений винахід включає індивідуальні стереоізомери сполук формули (І) разом з їх сумішами. Розділення діастереомерів можна здійснити використовуючи загальновідомі методи, наприклад, за допомогою фракційної кристалізації, хроматографії або ВЕРХ стереоізомерної суміші сполуки формули (І) або її придатної солі або похідного. Індивідуальний енантіомер сполуки формули (і) можна також одержати з відповідного оптичного чистого інтермедіату або за допомогою розділення, такого як ВЕРХ відповідного рацемату використовуючи придатні хіральні носії або за допомогою фракційної кристалізації діастереомерної солі одержаної за допомогою реакції відповідного рацемату з придатною оптично активною кислотою або основою. Переважно, R1 є С1-С6 алкілом, необов'язково, заміщеним 1 або 2 замісниками, де кожний незалежно вибирають з фенілу або нафтилу. Переважно, R1 є С 1-С6 алкілом заміщеним 1 або 2 замісниками, де кожний незалежно вибирають з фенілу або нафтилу. Переважно, R1 є С 1-С4 алкілом заміщеним 1 або 2 замісниками, де кожний незалежно вибирають з фенілу або нафтилу. Переважно, R1 є С 1-С2 алкілом заміщеним 1 або 2 замісниками, де кожний незалежно вибирають з фенілу або нафтилу. Переважно, R1 є фенілетилом, дифенілетилом або нафтилметилом. Переважно, R1 є 2-фенілетилом, 2,2-дифенілетилом або 1-нафтилметилом. Переважно, А є зв'язком. Переважно, А є С1-С3 алкіленом. Переважно, А є С2-С3 алкіленом. Переважно, А є С2 алкіленом. Переважно, А є -СН2СН2-. Переважно, R2 є С1-С6 алкілом, фенілом або NR7R8. Переважно, R2 є 2-метилпрогИ-ілом, фенілом або NR7R8. Переважно, -A-R2 є 2-метилпрогИ-ілом, фенілом або -CH2CH2NR7R8. Переважно, R7 є С1-С6 алкілом. Переважно, R7 є С1-С3 алкілом. Переважно, R7 є пропілом. Переважно, R7 є проп-2-ілом. Переважно, R8 є С3-С8 циклоалкілом. Переважно, R8 є С3-С6 циклоалкілом. Переважно, R8 є циклопентилом. Переважними гетероциклами включеними в межі визначення для R 2, частина (ііі) є піроліл, імідазоліл, тіазоліл, тієніл, фурил, тіазоліл, оксазоліл, тіадіазоліл, оксадіазоліл, піридиніл, піримідиніл, піридазиніл, піразиніл, хінолініл, ізохінолініл, бензімідазоліл, хіназолініл, фталазиніл, бензоксазоліл,* хіноксалініл, 1,2дигідроізохінолініл, 3,4-дигідроізохінолініл, 1,2,3,4-тетрагідроізохінолініл, азетидиніл, піролідиніл, піперидиніл, тетрагідропіраніл, тетрагідротіопіраніл, морфолініл і піперазиніл. Переважними прикладами сполук формули (І) є такі, що описані в розділі Приклади нижче, включаючи їх фармацевтично прийнятні солі. Сполуки формули (І) можна одержати використовуючи загальновідомі способи, такі як методики описані в розділі загальні методи представленому нижче або використовуючи специфічні методи описані в розділі Приклади, або подібні їм способи. Представлений винахід також стосується способів одержання сполук формули (І), і крім того будь яких нових проміжних сполук, які при цьому використовуються. В загальних описаних способах R1, R2 і А є такими як визначено раніше, якщо не вказано інше. Всі сполуки формули (І) можна одержати шляхом зняття захисту з сполуки формули де Р1, Ρ2 і Ρ3 представляють придатні захисні групи, які можуть бути однаковими або різними, або Р1 і Р2, необов'язково, є частиною однієї захисної групи. Приклади придатних захисних гр уп повинні бути очевидні для середнього спеціаліста [дивіться наприклад 'Protecting Groups in Organic Synthesis (Second Edition)1, Theodora W. Green and Peter G. M. Wuts, John Wiley and Sons, 1991]. Переважними індивідуальними захисними групами є силіл (заміщений трьома групами, що незалежно вибирають з арилу і алкілу), алканоїл і ароїл. Переважною захисною групою, коли Р1 і Р2 складають частину однієї захисної групи, є, коли Р1 і Р2 узяті разом, СГС6 алкіленом. Особливо переважними індивідуальними захисними групами є ацетил і бензоїл. Придатні умови для зняття захисту добре відомі в цій галузі [дивіться наприклад 'Protecting Groups in Organic Synthesis (Second Edition)', Theodora W. Green and Peter G. M. Wuts, John Wiley and Sons, 1991]. В звичайній методиці, коли Р1, Ρ2 і Ρ3 кожний є ацетилом, захисні групи можна видалити шляхом обробки розчину сполуки формули (II) в придатному розчиннику, такому як суміш води і метанолу, основою, такою як карбонат натрію, зазвичай при кімнатній температурі. Захисні групи Р1, Р 2 і Р3 можна видалити в одну стадію або послідовно, в будь якому порядку. Альтернативно, будь які дві захисні групи Р1, Р2 і Р3 можна видалити разом в одну стадію і групу, що залишилась, можна видалити на окремій стадії, в любій послідовності. Сполуки формули (II) можна одержати згідно з послідовністю приведеній на Схемах 1 і 2, в яких X є групою, що відходить, переважно хлором, і Р1, Р2 і Р3 є такими як зазначено вище. На Схемі 1, сполукиформули (II) можна одержати за допомогою реакції сполуки формули (III) з сполукою формули (IV) згідно з відомими методами. В типовій методиці, сполуку формули (III) нагрівають з N,Обіс(триметилацетамідом) в інертному розчиннику, такому як 1,1,1-трихлоретан, розчинник видаляють і розчин, що залишився, в придатному розчиннику, такому як толуол, нагрівають, переважно із зворотнім холодильником, з сполукою формули (IV) і триметилсилілтрифлатом. Сполуки формули (IV) можна одержати шляхом гідролізу сполуки формули (V). Зазвичай, сполуку формули (V) розчиняють в придатному розчиннику, такому як етанол, і обробляють кислотою, такою як хлорводнева кислота. Реакцію переважно проводять при від 0 до 100°С, більш переважно при від 20 до 50°С. Сполуки формули (V) можна одержати шляхом сульфонілювання сполуки формули (VI) сполукою формули (VII). В типовій методиці, розчин сполуки формули (VI) в придатному інертному розчиннику, такому як дихлорметан, обробляють сполукою формули (VII). Необов'язково, можна додати акцептор кислоти, такий як триетиламін. Сполуки формули (VI) можна одержати шляхом відновлення сполуки формули (VIII). Відновлення можна провести за допомогою будь якого гідридного відновлюючого агенту або шляхом гідрування. В типовій методиці, розчин сполуки формули (VIII) в придатному розчиннику, такому як етанол насичений аміаком, обробляють придатним каталізатором гідрування, таким як каталізатор Пеарлмана, і воднем, з тиском, переважно, до приблизно 414кПа (60псі). Сполуки формули (VIII) можна одержати за допомогою реакції сполуки формули (IX) з джерелом ціанід аніону, таким як ціанід калію. Реакцію зазвичай проводять в розчиннику, такому як Ν,Ν-диметилформамід при підвищеній температурі. Сполуки формули (IX) можна одержати шляхом окислення сполуки формули (X). В типовій методиці, водний розчин пероксимоносульфату калію додають до розчину сполуки формули (X) і гідрокарбонату натрію в придатному розчиннику, такому як суміш води і ацетону. Сполуки формули (X) можна одержати шляхом заміщення хлориду в сполуці формули (XI) тіометоксидом. Зазвичай, реакцію проводять в полярному розчиннику, такому як Ν,Ν-диметилформамід, при підвищених температурах і в атмосфері азоту. В якості джерела тіометоксиду використовують сіль лужного металу тіометоксиду, таку як тіометоксид натрію. Сполуки формули (XI) можна одержати за допомогою реакції сполуки формули (XII) з прийнятним первинним аміном. Зазвичай, розчин дихлорпурину (XII) в розчиннику, такому як ізопропіловий спирт, обробляють аміном і нагрівають із зворотнім холодильником. Необов'язково, можна додати додатковий акцептор кислоти, такий як дифенілетиламін. Сполуку (XII) можна одержати за допомогою реакції 2,6-дихлор-9Н-пурину (XIII) з дигідропіраном в придатному розчиннику, такому як етилацетат і в присутності кислотного каталізатору, такого як 4толуолсульфонова кислота, зазвичай при підвищеній температурі. На Схемі 2, сполуки формули (II) можна одержати шляхом сульфонілювання сполуки формули (XIV) сполукою формули (VII). В типовій методиці, розчин сполуки формули (XIV) в придатному інертному розчиннику, такому як дихлорметан, обробляють сполукою формули (VII). Необов'язково, можна додавати акцептор кислоти, такий як триетиламін. Сполуки формули (XIV) можна одержати шляхом відновлення сполуки формули (XV). Відновлення можна провести за допомогою будь якого гідридного відновлюючого агенту або шляхом гідрування. В типовій методиці, розчин сполуки формули (XV) в придатному розчиннику, такому як етанол, насичений аміаком, обробляють придатним каталізатором гідрування, таким як 5% ваг/ваг паладій на вугіллі і воднем з тиском, переважно до 1034кПа (150псі). Сполуки формули (XV) можна одержати за допомогою реакції сполуки формули (XVI) з прийнятним первинним аміном. Зазвичай, розчин сполуки (XVI) в придатному розчиннику, такому як ацетонітрил, обробляють аміном при кімнатній температурі. Необов'язково, можна додати додатковий акцептор кислоти, такий як дифенілетиламін. Сполуки формули (XVI) можна одержати шляхом заміщення йоду в сполуці формули (XVII) на ціанід. Зазвичай, розчин сполуки формули (XVII), в придатному розчиннику (наприклад, Ν,Ν-диметилформамід), обробляють ціанідом міді (II) і нагрівають, переважно при температурі вище 100°С. Сполуки формули (XVII) відомі з літератури (наприклад, дивіться J. Med. Chem., 1992, 35, 248, де Ρ1, Ρ2 і Ρ 3 кожний є ацетилом). Альтернативно, сполуки формули (І) можна одержати згідно з Схемою 3, де X є гр упою, що відходить, переважно хлором? шляхом сульфонілювання сполуки формули (XVIII) сполукою формули (VII). В типовій методиці, сполуку формули (XVIII) розчиняють в придатному розчиннику, такому як 1,4-діоксан або тетрагідрофуран (при нагріванні, якщо необхідно), і обробляють, зазвичай при кімнатній температурі, в атмосфері азоту сульфонілюючим агентом формули (VII), необов'язково, в присутності акцептору кислоти (наприклад, триетиламін). Сполуки формули (XVIII) можна одержати шляхом відновлення сполуки формули (XIX). Відновлення мо'жна провести за допомогою будь якого гідридного відновлюючого агенту або шляхом гідрування. В типовій методиці, розчин сполуки формули (XIX) в придатному розчиннику, такому як етанол насичений аміаком, обробляють придатним каталізатором гідрування, таким як 5% ваг/ваг паладій на вугіллі і воднем, з тиском, переважно, до 1034кПа (150псі). Сполуки формули (XIX) можна одержати шляхом зняття захисту з сполуки формули (XV) згідно з методами відомими в цій галузі [дивіться наприклад 'Protecting Groups in Organic Synthesis (Second Edition)1, Theodora W. Green and Peter G. M. Wuts, John Wiley and Sons, 1991]. Захисні групи можна видалити разом, окремо або в будь якій комбінації. В типовому прикладі, коли Р1, Р2 і Р3 кожний є ацетилом, розчин сполуки формули (XV) в придатному розчиннику, такому як етанол, обробляють основою, такою як аміак при кімнатній температурі. В деяких випадках, стадію зняття захисту і відновлення сполуки формули (XV) для одержання сполуки формули (XVIII) можна проводити разом в умовах відновлення. В типовому прикладі, сполуку формули (XV) розчиняють в придатному розчиннику, такому як етанол, і розчин насичують аміаком і потім обробляють прийнятним каталізатором гідрування, таким як паладій на вугіллі і тиску водню до 1034кПа (150псі). Сполуки формули (І), в якій А є -СН2СН2- і R2 є NR7R8 також можна одержати шляхом приведеним на Схемі 4. На Схемі 4, сполуки формули (І), в яких А є -СН2СН2- і R2 є -NR7R8 можна одержати за допомогою реакції сполуки формули (XX) з сполукою формули R7R8NH (XXII). В типовій методиці, сполуку формули (XX) і сполуку формули (XXII) змішують, необов'язково, в присутності придатного розчинника. Переважно, реакційну суміш нагрівають, більш переважно при температурі кипіння сполуки формули (XXII). Сполуки формули (XXII) або одержують з комерційних джерел або легко одержати використовуючи стандартні методики добре відомі для спеціаліста в цій галузі (наприклад, відновним конденсуванням аміну з кетоном або альдегідом). Сполуки формули (XX) можна одержати шляхом конденсування сполуки формули (XVIII) з 2-хлоретансульфонілхлоридом. В типовій методиці, розчин сполуки формули (XVIII) і основу, переважно третинний амін, такий як триетиламін, в придатному розчиннику, такому як дихлорметан, обробляють 2-хлоретансульфонілхлоридом. Сполуки формули (XVIII) можна одержати шляхом зняття захисту з сполуки формули (XIV), в якій захисні групи Р1, Р 2 і Р 3 є такими як зазначено вище. Захисні групи можна видалити разом, окремо або в будь якій комбінації. Придатні умови зняття захисту добре відомі в цій галузі [дивіться наприклад 'Protecting Groups in Organic Synthesis (Second Edition)', Theodora W. Green and Peter G. M. Wuts, John Wiley and Sons, 1991]. В типовій методиці, коли Ρ1, Ρ2 і Р3 кожний є ацетилом, захисні групи можна видалити шляхом обробки розчину сполуки формули (XIV) в придатному розчиннику, такому як суміш води і метанолу, основою, такою як карбонат натрію, зазвичай при кімнатній температурі. Сполуки формули (І) також можна перетворювати одна в одну використовуючи загальновідомі методики перетворення функціональних гр уп. Всі реакції і приготування нових вихідних матеріалів, що використовуються в попередніх методиках є загальноприйнятими і прийнятні реагенти і умови реакцій для їх проведення або одержання, також як і методики виділення бажаних продуктів, добре відомі спеціалістам в цій галузі з посиланням на згадані джерела інформації, Приклади і Приготування. Фармацевтично прийнятну сіль сполуки формули (І) можна легко одержати шляхом змішування розчинів сполуки формули (І) і бажаної кислоти або основи, в залежності від обставин. Сіль можна висадити з розчину і зібрати за допомогою фільтрування або можна виділити внаслідок випарювання розчинника. Антизапальні властивості сполук формули (І) визначають по їх здатності інгібувати нейтрофільну функцію, яка вимірюється виходячи з активності агоніста А2а рецептору. її оцінювали шляхом визначення профілю сполуки в дослідженні, в якому вимірюють продукування супероксиду нейтрофілами активованими fMLP. Нейтрофіли виділяли з людської периферійної крові використовуючи седиментацію декстраном з наступним центрифугуванням через розчин Фіколл-Ппакю. Всі забруднюючі еритроцити в залишку гранулоциту видаляли за допомогою лізису охолодженою дистильованою водою. Продукування супероксиду нейтрофілами індукували за допомогою fMLP в присутності ініціюючої кількості цитокалазину В. Деаміназу аденозину вводили в дослідження для видалення будь якого ендогеннопродукуємого аденозину, що може пригнічувати продукування супероксиду. Дію сполуки на fMLP-індуковану відповідь контролювали колориметрично по зменшенню вмісту цито хрому С в буфері, що досліджується. Ефективність сполук визначали виходячи з концентрації, що призводить до 50% інгібування (ІС50) порівняно з контрольною відповіддю на fMLP. Сполуки формули (І) можна призначати окремо, але зазвичай вони призначаються в суміші з придатними наповнювачами, розріджувачами або носіями, які вибирають в залежності від шляху призначення і стандартної фармацевтичної практики. Наприклад, сполуки формули (І)' можна призначати орально, букально або сублінгвально у формі таблеток, капсул, овул, еліксирів, розчинів або суспензій, які можуть містити смакові і забарвлюючі агенти, наприклад, для негайного, відстроченого довготривалого, пульсуючого або контролюємого вивільнення. Такі таблетки можуть містити наповнювачи, такі як мікрокристалічна целюлоза, лактоза, цитрат натрію, карбонат кальцію, дигідрофосфат кальцію і гліцин, дезінтегратори, такі як крохмаль (переважно кукурудзяний, картопляний або тапіоковий крохмаль), натрій гліколяткрохмаль, кроскармелоза натрію і деякі комплекси силікатів, і зв'язуючи, такі як полівінілпіролідон, гідроксипропілметилцелюлоза (ГПМЦ), гідроксипропілцелюлоза (ГПЦ), цукор, желатин і акація. Крім того, можуть бути включені замащуючі агенти, такі як стеарат магнію, стеаринова кислота, гліцирилбехенат і тальк. Тверді композиції подібного типу можуть використовува тись в якості наповнювачів желатинових капсул. Переважними наповнювачами при цьому є лактоза, крохмаль, целюлоза, молочний цукор або високомолекулярні поліетиленгліколі. Для одержання водних суспензій і/або еліксирів сполуки формули (І) можна об'єднувати з різними смаковими і підсолоджуючи агентами, барвниками, емульсифікаторами і/або суспендуючими агентами і розріджувачами, такими як вода, етанол, пропіленгліколь або гліцерин і їх комбінації. Сполуки формули (І) також можна призначати парентерально, наприклад, внутрішньовенно, внутрішньоартеріально, внутрішньобрюшинно, внутрішньотекально, внутрішньошлунково, внутрішньостемально, внутрішньочерепно, внутрішньом'язово або підшкірно, або вони можуть вводитись за допомогою інфузії. їх краще використовува ти у формі водних стерильних розчинів, як можуть містити інші речовини, наприклад, достатню кількість глюкози або солі для утворення ізотонічного з кров'ю розчину. Якщо це необхідно, водні розчини повинні бути придатно забуферені (переважно з рН від 3 до 9). Одержання придатних парентеральних рецептур в стерильних умовах здійснюють використовуючи стандартні фармацевтичні методики, що добре відомі спеціалістам в цій галузі. Для орального і парентерального призначення людям рівень добових доз сполуки формули (І) зазвичай становить від 0,01 до 100 мг/кг, переважно від 0,1 до 100мг/кг (в одиничній або розподілених дозах). Таким чином, таблетки або капсули сполуки формули (І) можуть містити від 5 до 500мг активної сполуки для призначення один раз, або двічі, або більшу кількість разів на день. Лікар в будь якому випадку визначить потрібну дозу, яка буде найбільш придатною для кожного окремого пацієнта і буде залежати від віку, ваги і відповіді пацієнта. Приведені вище дози є приблизними для середньо випадку. У будь якому випадку окремі виключення, в яких потрібні вищі або менші інтервали доз будуть мати місце і вони будуть знаходитись з межах цього винаходу. Сполуки формули (І) також можна призначати інтраназально або за допомогою інгаляції і зазвичай використовують у формі сухи х порошків для інгаляцію або аерозольних спреїв в балонах під тиском, насосів, спреїв, розпилювачів або нубелізаторів, що містять або не містять придатні пропеланти, наприклад, дихлордифторметан, трихлорфторметан, дихлортетрафторетан, гідрофторалкан, такий як 1,1,1,2тетрафторетан (HFA 134A [торгова марка]) або 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA [торгова марка]), діоксид вуглецю або інший придатний газ. У випадку аерозолів, дозована одиниця може бути визначена шляхом забезпечення клапаном, що вивільнює дозовану кількість. Балон під тиском, насос, спрей, розпилювач або нубелізатор може містити розчин або суспензію активної сполуки, наприклад, використовується суміш етанолу і пропеланту в якості розчинника, який може додатково містити лубрикант, наприклад, триолеат сорбіту. Капсули і картриджі (виготовлені, наприклад, з желатину) для використання в інгаляторі або пристрою для вдування можуть представляти собою порошкоподібну суміш, що містить сполуку формули (І) і придатний порошкоподібний носій, такий як лактоза або крохмаль. Аерозоль або рецептури сухого порошку переважно улаштовані таким чином щоб кожна відмірюєма доза або "пшик" містила від 20 до 4000мкг сполуки формули (І) для призначення пацієнту. Добова доза аерозолю становить від 20мкг до 20мг і може бути призначена один раз на день або, зазвичай, декілька разів протягом дня. Альтернативно, сполуки формули (І) можна призначати у формі супозиторіїв або песаріїв, або вони можуть використовуватись місцево у формі лосьйонів, розчинів, кремів, мазей або присипок. Сполуки формули (І) також можна призначати трансдермально, наприклад, використовуючи пластир. При місцевому використанні, сполуки формули (І) використовують у вигляді придатних мазей, що містять активну сполуку суспендовану або розчинену в, наприклад, суміші однієї або більшої кількості наступних речовин: мінеральне масло, рідкий вазелін, білий вазелін, пропіленгліколь, поліоксиетилен поліоксипропіленова сполука, емульсифікований віск і вода. Альтернативно, їх використовують у вигляді придатних лосьйонів або кремів, суспендованих або розчинених в, наприклад, суміші однієї або більшої кількості наступних речовин: мінеральне масло, моностерат сорбіту, поліетиленгліколь, рідкий парафін, полісорбат 60, цетилові естери воску, сетеариловий спирт, 2-октилдодеканол, бензиловий спирт і вода. Сполуки формули (І) також можна використовувати в комбінації з циклодекстрином. Циклодекстрини відомі як такі, що утворюють комплекси включення з молекулами лікарських засобів. Утворенням комплексів лікарський засіб-циклодекстрин можна впливати на розчинність, швидкість розчинення, біодоступність і/або стабільність молекули лікарського засобу. Комплекси лікарський засіб-циклодекстрин зазвичай корисні для більшості дозованих форм і шляхів призначення. Як альтернатива безпосередньому комплексоутворення з лікарським засобом, циклодекстрин може використовуватись в якості допоміжної речовини, наприклад, в якості носія, розріджувача або речовини, що сприяє розчиненню. Зазвичай використовують альфа-, бета- і гама-циклодекстрини і придатні приклади описані в W0-A-91/11172, WO-A-94/02518 і WO-A-98/55148. Таким чином винахід стосується: (і) сполуки формули (І), або її фармацевтично прийнятної солі, або сольвату; (іі) способу одержання сполуки формули (І), або її фармацевтично прийнятної солі, або сольвату; (ііі) фармацевтичної композиції, що містить сполуку формули (І), або її фармацевтично прийнятну сіль, або сольват, разом з фармацевтично прийнятним наповнювачем, розріджувачем або носієм; (iv) сполуки формули (І), або її фармацевтично прийнятної солі, або сольвату, або її композиції, для використання в якості медикаменту; (ν) використання сполуки формули (І), або її фармацевтично прийнятної солі, або сольвату, або її композиції, для виробництва медикаменту, що має активність агоніста А2а рецептора; (vi) використання сполуки формули (І), або її фармацевтично прийнятної солі, або сольвату, або її композиції, для виробництва антизапального агенту; (vii) використання сполуки формули (І), або її фармацевтично прийнятної солі, або сольвату, або її композиції, для виробництва медикаменту для лікування респіраторного захворювання; (viii) використання згідно з (vii), де захворювання вибирають з групи, що вміщує респіраторний дистрессиндром повнолітніх (РДСП), бронхіт, хронічний бронхіт, хронічне обструктивне легеневе захворювання, цистофіброз, астма, емфізема, бронхоектаз, хронічний синусит і риніт; (іх) використання сполуки формули (І), або її фармацевтично прийнятної солі, або сольвату, або її композиції, для виробництва медикаменту для лікування септичного шоку, еректильної дисфункції у чоловіків, гіпертензії, удару, епілепсії, церебральної ішемії, периферичного васкулярного захворювання, постішемічного реперфузивного ушкодження, діабету, ревматоїдного артриту, розсіяного склерозу, псоріазу, дерматиту, алергічного дерматиту, екземи, виразкового коліту, хвороби Крона, запального захворювання кісток, гастриту викликаного Heliobacter pylori, гастриту, ушкодження кишково-шлункового тракту викликаного нестероїдним протизапальним лікарським засобом або психогенного захворювання, або для загоєння ран; (х) способу лікування ссавця, включно з людиною, з використанням агоніста А2а рецептору, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або її композиції; (хі) способу лікування запального захворювання у ссавця, включно з людиною, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або її композиції; (хіі) способу лікування респіраторного захворювання у ссавця, включно з людиною, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або її композиції; (хііі) способу згідно з (хіі), де захворювання вибирають з групи, що вміщує респіраторний дистрессиндром повнолітніх (РДСП), бронхіт, хронічний бронхіт, хронічне обструктивне легеневе захворювання, цистофіброз, астма, емфізема, бронхоектаз, хронічний синусит і риніт; (xi v) способу лікування у ссавця, включно з людиною, септичного шоку, еректильної дисфункції у чоловіків, гіпертензії, удару, епілепсії, церебральної ішемії, периферичного васкулярного захворювання, постішемічного реперфузивного ушкодження, діабету, ревматоїдного артриту, розсіяного склерозу, псоріазу, дерматиту, алергічного дерматиту, екземи, виразкового коліту, хвороби Крона, запального захворювання кісток, гастриту викликаного Heliobacter pylori, гастриту, ушкодження кишково-шлункового тракту викликаного нестероїдним протизапальним лікарським засобом або психогенного захворювання, або для загоєння ран, що полягає у призначенні згаданому ссавцю ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, сольвату або її композиції; і (xv) деяких нових проміжних сполук описаних тут. Наступні Приклади розкривають одержання сполук формули (I):-Спектри 1Н ядерного магнітного резонансу (ЯМР) у всі х випадках відповідали запропонованим структурам. Характеристичні хімічні зсуви (δ) виражали в мільйонних частках відносно тетраметилсилану, використовуючи загальноприйняті скорочення для позначення основних піків: наприклад, с, синглет; д, дублет; т, триплет; к, квартет; м, мультиплет; ш, широкий. Масспектри (m/z) знімали в режимі термоіонізації. Використовували наступні скорочення для позначення основних розчинників: CDCI3, дейтерохлороформ; ДМСО, диметилсульфоксид. Скорочення псі означає фунт на квадратний дюйм. Коли використовується словосполучення тонкошарова хроматографія (ТШХ), він стосується ТШХ на силікагелі з використанням силікагелевих 60 платівок F254, Rf є відстанню, що пройшла сполука рухаючись з фронтом розчинника на платівці ТШХ. Скорочення Ас означає ацетил і ТБДМС означає трет-бутилдиметилсиліл. Приклад 1: N-({9-[(2R,3R,4S,5R)-3,4-Дигідрокси-5-(гідроксиметил)тетрагідро-2-фураніл]-6-[(2,2-дифенілетил)аміно]-9Нпурин-2-іл)метил)-2-метил-1-пропансульфонамід Розчин (2R,3R,4R,5R)-4-(ацетилокси)-2-[(ацетилокси)метил]-5-(6-[(2,2-дифенілетил)аміно]-2{[(ізобутилсульфоніл)аміно]метил}-9Н-пурин-9-іл)тетрагідро-3-фураніл ацетату (188 мг, 0,26 ммоль) (Приготування 9) і карбонату натрію (140мг, 1,32ммоль) в суміші вода (2мл) і метанол (10мл) перемішували при кімнатній температурі протягом 6 годин. Розчинник видаляли при пониженому тиску і залишок розділяли між етилацетатом і насиченим водним розчином хлориду натрію. Органічну фазу відокремлювали і розчинник видаляли при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту градієнт системи дихлорметан:метанол:0,88 аміак (95:5:0,5 за об'ємом) поступово змінюючи до дихлорметан:метанол:0,88 аміак (90:10:1 за об'ємом) одержуючи вказану в заголовку сполуку (77мг). MC:597(MH+);619(MNa+). 1 Н-ЯМР (CDCI3) δ : 7,60 (1Н, ш с), 7,20-7,38 (10Н, м), 6,02 (1Н, ш с), 5,91 (1Н, ш д), 5,81 (1Н, т), 5,70 (1Н, д), 4,83 (1Н, ш с), 4,50 (1Н, д), 4,07-4,40 (7Н, м), 3,90 (1Н, д), 3,75 (1Н, т), 3,32 (1Н, с), 2,95 (2Н, д), 2,26 (1Н, м), 4,06 (6Н, д). Аналіз: Знайдено С, 57,54; Н, 6,10; Ν, 13,76%; С29Н36N6 О6S•0,5Н2О потрібно С, 57,52; Н, 6,11; Ν, 13,88%. Приклад 2: N-{[9-[(2R,3R,4S,5R)-3,4-Дигідрокси-5-(гідроксиметил)тетрагідро-2-фураніл]-6-(фенетиламіно)-9Н-пурин-2іл]метил}бензолсульфонамід Розчин бензолсульфонілхлориду (0,067г, 0,38ммоль) в сухому тетрагідрофурані (2мл) додавали протягом 10 хвилин до розчину, що перемішується (2R,3R,4S,5R)-2-[2-(амінометил)-6-(фенетиламіно)-9Н-пурин-9-іл]-5(гідроксиметил)тетрагідро-3,4-фурандіолу (0,19г, 0,48ммоль) (Приготування 12) і триетиламіну (0,14г, 1,39ммоль) в сухому тетрагідрофурані (10мл) при 0°С в атмосфері азоту. С уміш перемішували при 0°С протягом 15 хвилин. Розчинник видаляли при пониженому тиску і залишок азеотропували з дихлорметаном (х3). Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту дихлорметан:метанол:0,88 аміак (92:8:0,4 за об'ємом), одержуючи продукт, який розтирали з діетиловим етером, фільтрували і сушили одержуючи вказану в заголовку сполуку у вигляді твердої речовини (200мг). МС: 540 (МН+). 1 Н-ЯМР (GDCI3) δ : 7,82 (2Н, д), 7,63 (1Н, с), 7,16-7,45 (8Н, м), 6,02-6,22 (2Н, м), 5,96 (1Н, ш с), 5,70 (1Н, д), 4,82 (1Н, м), 4,47 (1Н, д), 4,02-4,34 (4Н, м), 3,62-3,98 (4Н, м), 3,37 (1Н, с), 2,92 (2Н,т). Приклад 3: N-({9-[(2R,3R,4S,5R)-3,4-Дипдрокси-5-(пдроксиметил)тетрапдро-2-фурант]-6-[(1-нафтилметил)аміно]-9Nпурин-2-іл}метил)бензолсульфонамід Суспензію (2R,3R,4S,5R)-2-{2-(амінометил)-6-[(1-нафтилметил)аміно]-9Н-пурин-9-іл}-5(гідроксиметил)тетрагідро-3,4-фурандіолу (0,16г, 0,37ммоль) (Приготування 15) в діоксані (28мл) обережно нагрівали до утворення розчину. Розчин охолоджували до кімнатної температури і обробляли триетиламіном (0,12г, 1,19ммоль) після чого протягом 10 хвилин додавали розчин бензолсульфонілхлориду (0,060г, 0,34ммоль) в діоксані (2мл). Суміш перемішували при кімнатній температурі протягом 30 хвилин. Розчинник видаляли при пониженому тиску і залишок азеотропували з дихлорметаном. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту ди хлорметан:метанол:0,88 аміак (92:8:0,4 за об'ємом) одержуючи вказану в заголовку сполук у у вигляді білої твердої речовини (150мг). МС: 577 (МН+). 1 Н-ЯМР (ДMCO-d6) δ : 8,15-8,40 (3Н, м), 7,20-7,98 (12Н, м), 5,85 (1Н, д), 5,38 (1Н, д), 5,00-5,36 (4Н, м), 4,52 (1Н, к), 4,13 (1Н, м), 4,00 (2Н, с), 3,92 (1Н, д), 3,42-3,72 (2Н, м). Приклад 4; 2-[Циклопентил(ізопропіл)аміно]-N-({9-[(2R,3R,4S,5R)-3,4-дигідрокси-5-(гідроксиметил)тетрапдро-2фураніл]-6-[(2,2-дифенілетил)аміно]-9Н-пурин-2-іл}метил)етансульфонамід N-({9-[(2R,3R,4S,5R)-3,4-Дигідрокси-5-(гідроксиметил)тетрагідро-2-фураніл]-6-[(2,2-дифенілетил)аміно]-9Nпурин-2-іл}метил)етиленсульфонамід (60мг, 0,11ммоль) (Приготування 16) розчиняли в Nізолропілциклопентанаміні (2мл) (Приготування 17) і реакційну суміш нагрівали із зворотнім холодильником протягом двох годин. Надлишок реагенту видаляли при пониженому тиску і залишок розділяли між дихлорметаном (50мл) і водою (30мл). Органічний шар випарювали і сушили (безводний сульфат магнію) і залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту дихлорметан:метанол:аміак (92:7:1 за об'ємом) одержуючи вказану в заголовку сполуку (13мг) у вигляді масла. МС: 695 (МH+). 1 Н-ЯМР (CD3OD) δ : (1Н, с), 7,35-7,20 (10Н, м), 6,00-5,95 (1Н, м), 4,70-4,65 (1Н, м), 4,55-4,50 (1Н, м), 4,354,25 (6Н, м), 4,15 (1Н, с), 3,90-3,85 (1Н, м), 3,75-3,70 (1Н, м), 3,15-3,10 (2Н, м), 3,00-2,90 (2Н, м), 2,90-2,80 (2Н, м), 1,70-1,60 (2Н, м), 1,60-1,50 (2Н, м), 1,50-1,40 (2Н, м), 1,35-1,15 (2Н, м), 0,9-0,85 (6Н, м). Наступні Приготування описують одержання деяких проміжних сполук, що використовуються в описаних вище Прикладах. Приготування 1: 2,6-Дихлор-9-тетрагідро-2Н-піран-2-іл-9Н-пурин 2,6-Дихлор-9Н-пурин (20г, 0,11моль) і моногідрат 4-толуолсульфонової кислоти (0,2г) розчиняли в етилацетаті (300мл), суміш нагрівали до 50°С і повільно протягом 30хв. додавали розчин 2,3-дигідропірану (12,6мл, 0,14моль) в етилацетаті (50мл). Реакційну суміш о холоджували до кімнатної температури, додавали воду (100мл) і рН розчину доводили до 7 додаючи насичений водний розчин гідрокарбонату натрію. Шари розділяли і органічний шар промивали послідовно водою і насиченим водним розчином хлориду натрію, сушили над безводним сульфатом магнію, фільтрували і випарювали при пониженому тиску. Залишок азеотропували з пентаном (х2) одержуючи вказану в заголовку сполук у у вигляді білої твердої речовини з незначними домішками (30,9г). 1 Н-ЯМР (CDCI3) δ : 8,30 (1Н, с), 5,75 (1Н, дд), 4,25-4,15 (1Н, м), 3,85-3,70 (1Н, м), 2,20-1,60 (6Н,м). Приготування 2: 2-Хлор-N-(2,2-дифенілетил)-9-тетрагідро-2N-піран-2-іл-9Н-пурин-6-амін Розчин 2,6-дихлор-9-тетрагідро-2N-піран-2-іл-9Н-пурину (Приготування 1) (30,9г, 0,11моль) в ізопропіловому спирті (600мл) обробляли N-етил-N-ізопропіл-2-пропанаміном (47,5мл, 0,27моль) і 2,2дифенілетиламіном (24,8г, 0,13моль) і одержану суміш нагрівали із зворотнім холодильником протягом 3 годин. Розчинник видаляли при пониженому тиску і залишок азеотропували з етилацетатом. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту градієнт системи етилацетат:гексан (40:60 за об'ємом) поступово змінюючи до етилацетат:гексан (60:40 за об'ємом) одержуючи вказану в заголовку сполуку у вигляді піни (49,7г). 1 Н-ЯМР (CDCI3) δ : 7,95-7,75 (1Н, ш с), 7,35-7,15 (10Н, м), 5,80-5,70 (1Н, ш с), 5,65 (1Н, д), 4,35 (1Н, м), 4,30-4,18 (1Н, ш с), 4,10 (1Н, д), 3,70 (1Н, т), 2,05-1,95 (2Н, м), 1,95-1,80 (1Н,м), 1,80-1,55 (3Н, м). Приготування 3: N-(2,2-Дифенілетил)-2-(метилсульфаніл)-9-тетрагідро-2Н-піран-2-іл-9Н-пурин-6-амін Розчин 2-хлор-N-(2,2-дифенілетил)-9-тетрагідро-2Н-піран-2-іл-9Н-пурин-6-аміну (Приготування 2) (49,7г, 0,11моль) в сухому Ν,Ν-диметилформаміді (200мл) обробляли тіометоксидом натрію (10г, 0,14моль) і одержану суміш нагрівали в атмосфері азоту при 100°С протягом 90 хвилин. Суміш перемішували при кімнатній температурі протягом 72 годин і потім знову нагрівали при 100°С протягом ще 2 годин. Реакційну суміш охолоджували і розводили водою (1000мл). Одержану суспензію екстрагували діетиловим етeром (х2). Об'єднані органічні шари послідовно промивали водою і насиченим водним розчином хлориду натрію, сушили над безводним сульфатом магнію, фільтрували і випарювали при пониженому тиску. Залишок азеотропували з діетиловим етером і потім з пентаном одержуючи вказану в заголовку сполуку у вигляді піни (48,9г). 1 Н-ЯМР (CDCI3) δ : 7,80 (1Н, с), 7,20-7,10 (10Н, м), 5,70-5,55 (2Н, д), 4,40-4,20 (3Н, м), 4,20-4,05 (1Н, м), 3,80-3,65 (1Н, м), 2,60 (3Н, с), 2,15-1,90 (3Н, м), 1,90-1,60 (3Н, м). Приготування 4: N-(2,2-Дифeнiлeтил)-2-(мeтилcyльфoнiл)-9-тeтpaгiдpo-2H-пipaн-2-iл-9H-пypин-6-амін Розчин Оксону (торгова марка) (пероксимоносульфат калію) (44г, 71,7ммоль) у воді (200мл) по краплям протягом 2 годин додавали до розчину N-(2,2-дифенілетил)-2-(метилсульфаніл)-9-тетрагідро-2Н-піран-2-іл-9Нпурин-6-аміне (Приготування 3) (25г, 56,2ммоль) і гідрокарбонату натрію (20г, 238ммоль) в ацетоні (1000мл) і воді (250мл). Одержану суміш перемішували при кімнатній температурі протягом 24 годин, фільтрували і залишок промивали ацетоном. Ацетон видаляли з фільтрату при пониженому тиску і одержаний водний залишок екстрагували етилацетатом і потім дихлорметаном. Об'єднані органічні шари промивали насиченим водним розчином хлориду натрію, сушили над безводним сульфатом магнію, фільтрували і випарювали при пониженому тиску. Залишок розтирали з діетиловим етером, фільтрували, промивали діетиловим етером і пентаном і потім сушили одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини (20,32г). 1 Н-ЯМР (СОСІ3) δ : 8,00 (1Н, с), 7,35-7,15 (10Н, м), 6,05-5,95 (1Н, ш с), 5,75 (1Н, д), 4,40-4,35 (1Н, м), 4,354,20 (2Н, ш с), 4,15-4,05 (1Н, м), 3,75 (1Н, т), 3,30 (3Н, с), 2,18-2,05 (1Н, м), 2,05-1,98 (1Н, м), 1,98-1,80 (1Н, м), 1,80-1,60 (3Н, м). Приготування 5: 6-[(2,2-Дифeнiлeтил)aміно]-9-тeтpaгiдpo-2N-пipaн-2-iл-9H-пypин-2-кapбoнiтpил Розчин N-(2,2-дифенілетил)-2-(метилсульфоніл)-9-тетрагідро-2Н-піран-2-іл-9Н-пурин-6-аміну (Приготування 4) (20,1г, 42,1ммоль) в сухому Ν,Ν-диметилформаміді (100мл) обробляли ціанідом калію (5,5г, 84,6ммоль) і суміш нагрівали при 120°С протягом 24 годин в атмосфері азоту. Суміш охолоджували до кімнатної температури, виливали у воду (1000мл) і перемішували протягом наступної 1 години. Одержану тверду речовину повільно фільтрували і промивали декілька разів водою. Тверду речовину розчиняли в дихлорметані і одержаний розчин промивали водою, сушили над безводним сульфатом магнію, фільтрували і випарювали при пониженому тиску. Залишок двічі азеотропували з діетиловим етером одержуючи вказану в заголовку сполуку у вигляді масла (17г). 1 Н-ЯМР (CDCI3) 6 : 8,00 (1Н, с), 7,40-7,20 (10Н, м), 6,00-5,75 (1Н, ш с), 5,70 (1Н, д), 4,40-4,20 (3Н, м), 4,204,10 (1Н, м), 3,80-3,70 (1Н, м), 2,20-1,90 (3Н, м), 1,90-1,60 (3Н, м). Приготування 6 : N-[2-(Aмiнoмeтил)-9-тeтpaгiдpo-2H-пipaн-2-iл-9H-пypин-6-iл]-N-(2,2-дифенілетил)амін Розчин 6-[(2,2-дифенілетил)аміно]-9-тетрагідро-2Н-піран-2-іл-9Н-пурин-2-карбонітрилу (5,70г, 13,18ммоль) (Приготування 5) в етанолі (200мл) насиченому аміаком обробляли каталізатором Пеарлманна (1,00г), з тиском водню до 60псі в закритій колбі і перемішували при кімнатній температурі протягом 30 годин. Суміш фільтрували крізь шар Арбоцелю (торгова марка) і розчинник видаляли при пониженому тиску. Залишок азеотропували з дихлорметаном (х2) і потім очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту дихлорметин:метанол (95:5 за об'ємом) поступово змінюючи до дихлорметан:метанол:0,88 аміак (90:10:0,5 за об'ємом) одержуючи вказану в заголовку сполуку (4,34г). МС: 429 (МН+). 1 Н-ЯМР (CDCI3) δ : 7,84 (1Н, с), 7,14-7,36 (10Н, м), 5,70 (1Н, д), 5,50-5,70 (1Н, ш с), 4,20-4,42 (ЗН, м), 4,14 (1Н, д), 3,95 (2Н, с), 3,78 (1Н, т), 1,90-2,20 (5Н, м), 1,50-1,88 (3Н, м). Приготування 7 : N-({6-[(2,2-Дифeнiлeтил)aмiнo]-9-тeтрагiдpo-2H-пipaн-2-iл-9H-пypин-2-iл}мeтил)-2-метил-1пропансульфонамід Розчин N-[2-(амінометил)-9-тетрагідро-2Н-піран-2-іл-9Н-пурин-6-іл]-N-(2,2-дифенілетил)амiну (3,70г, 8,63ммоль) (Приготування 6) і триетиламіну (2,20г, 21,78ммоль) в сухому дихлорметані (20мл) обробляли 2метил-1-пропансульфонілхлоридом (1,48г, 9,46ммоль) і суміш перемішували при кімнатній температурі протягом 18 годин. ТШХ показала що все ще присутня деяка кількість вихідного матеріалу і тому додавали ще 2-метил-1-пропансульфонилхлорид (0,2г, 1,28ммоль) і суміш перемішували при кімнатній температурі протягом 1 години. Розчинник видаляли при пониженому тиску і залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту дихлорметан:метанол (98:2 за об'ємом) одержуючи вказану в заголовку сполуку у вигляді піни (4,4г). МС: 549 (МН+). 1 Н-ЯМР (CDCI3) δ : 7,86 (1Н, с), 7,16-7,36 (10Н, м), 5,74 (1Н, ш с), 5,64 (1Н, д), 5,57 (1Н, т), 4,18-4,46 (5Н, м), 4,14 (1Н, д), 3,77 (1Н, т), 2,92 (2Н, д), 2,28 (1Н, м) 1,92-2,10 (3Н, м), 1,58-1,88 (3Н, м), 1,03 (6Н,д). Приготування 8 : N-({6-[(2,2-Дифенілетил)аміно]-9Н-пурин-2-іл}метил)-2-метил-1-пропансульфонаміду гідрохлорид Розчин N-({6-[(2,2-дифенілетил)аміно]-9-тетрагідро-2Н-піран-2-іл-9Н-пурин-2-іл}метил)-2-метил-1пропансульфонаміду (4,30г, 7,84ммоль) (Приготування 7) в етанолі (100мл) нагрівали до 37°С і потім обробляли хлорводневою кислотою (2Ν, 15мл). Суміш залишали стояти при кімнатній температурі на 18 годин, після чого відфільтровували кристалічний залишок, його промивали етанолом (10мл) і сушили одержуючи вказану в заголовку сполуку у вигляді твердої речовини (3,0г). 1 Н-ЯМР (ДМСО-d6) δ : 8,48 (1Н, ш с), 7,75 (1Н, ш с), 7,37 (4Н, д), 7,27 (4Н, дд), 7,16 (2Н, дд), 4,56 (1Н, т), 4,20-4,40 (4Н, м), 2,95 (2Н, д), 2,10 (1Н, м), 0,95 (6Н, д). Приготування 9: (2R,3R,4R,5R)-4-(Ацетилокси)-2-[(ацетилокси)метил]-5-(6-[(2,2-дифенілетил)аміно]-2{[(ізобутилсульфоніл)аміно]метил}-9Н-пурин-9-іл)тетрагідро-3-фураніл ацетат Суспензію М-({6-[(2,2-дифенілетил)аміно]-9Н-пурин-2-іл}метил)-2-метил-1-пропансульфонамід гідрохлориду (Приготування 8) (0,21г, 0,42ммоль) в 1,1,1-трихлоретані (10мл) обробляли N,Обіс(триметилацетамідом) (0,6мл, 2,45ммоль) і суміш нагрівали із зворотнім холодильником протягом 2 годин. Розчинник видаляли при пониженому тиску і залишок азеотропували з толуолом (х2). Залишок розчиняли в толуолі (10мл) і обробляли β-D-рібофураноза-1,2,3,5-тетраацетатом (0,16г, 0,50ммоль) і триметилсилілтрифлатом (0,1мл, 0,5ммоль). Суміш потім нагрівали із зворотнім холодильником протягом 4 годин. Суміш розводили етилацетатом, промивали послідовно насиченим водним розчином гідрокарбонату натрію і насиченим водним розчином хлориду натрію і випарювали при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту градієнт системи дихлорметан:метанол (98:2 за об'ємом) поступово змінюючи до дихлорметан:метанол (95:5 за об'ємом) одержуючи вказану в заголовку сполуку у вигляді 1:3 суміші α- і β-аномерів (188мг). МС: 723 (МН+); 745 (MNa +). 1 Н-ЯМР (CDCI3) δ : 7,97 (0,25Н, ш с), 7,76 (0,75Н, ш с), 7,15-7,37 (10Н, м), 7,25 (2,25Н, м), 5,88 (1,75Н, м), 5,73 (0,75Н, м), 5,51 (0,25Н, м), 4,34-4,63 (8Н, м), 2,95 (2Н, м), 2,28 (3Н, с), 2,06-2,20 (4Н, м), 2,00 (3Н, с), 1,05 (6Н, д). Приготування 10: (2R,3R,4R,5R)-4-(Ацетилокси)-2-[(ацетилокси)метил]-5-(6-хлор-2-ціано-9Н-пурин-9-іл)тетрагідро-3-фураніл ацетат Суміш (2R,3R,4R,5R)-4-(ацетилокси)-2-[(ацетилокси)метил]-5-(6-хлор-2-йод-9Н-пурин-9-іл)тетрагідро-3фураніл ацетату (J. Med. Chem., 1992, 35, 248) (0,5г, 0,93ммоль) і ціаніду міді (II) (0,11г, 1,23ммоль) в Ν,Νдиметилформаміді нагрівали при 115°С протягом 90 хвилин. Розчинник видаляли при пониженому тиску і залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту дихлорметан:етилацетат (4:1 за об'ємом) одержуючи продукт, який потім послідовно азеотропували дихлорметаном і діетиловим етером одержуючи вказану в заголовку сполуку у вигляді твердої речовини (0,22г). МС: 438 (МН+). 1 Н-ЯМР (CDCI3) δ : 8,50 (1Н, с), 6,28 (1Н, д), 5,78 (1Н, т), 5,53 (1Н, м), 4,52 (1Н, м), 4,42 (2Н, м), 2,20 (ЗН, с), 2,17 (3Н, с), 2,10 (3Н, с). Приготування 11: (2R,3R,4R,5R)-4-(Ацетилокси)-2-[(ацетилокси)метил]-5-[2-ціано-6-(фенетиламіно)-9N-пурин-9іл]тетрагідро-3-фураніл ацетат Розчин (2R,3R,4R,5R)-4-(ацетилокси)-2-[(ацетилокси)метил]-5-(6-хлор-2-ціано-9Н-пурин-9-іл)тетрагідро-3фураніл ацетату (1,96г, 4,48ммоль) (Приготування 10) і триетиламіну (1,8г, 17,8ммоль) в ацетонітрилі (20мл) обробляли фенетиламіном (0,60г, 4,96ммоль) і суміш перемішували при кімнатній температурі в атмосфері азоту протягом 2 годин. Розчинник видаляли при пониженому тиску і залишок розділяли між дихлорметаном (75мл) і водою (20мл). Органічну фазу відокремлювали і розчинник видаляли при пониженому тиску. Піну очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту дихлорметан:етилацетат (4:1 за об'ємом) одержуючи продукт, який потім азеотропували з діетиловим етером одержуючи вказану в заголовку сполуку у вигляді піни (2,05г). МС: 523 (МН+). 1 Н-ЯМР (CDCI3) δ : 8,00 (1Н, с), 7,17-7,35 (5Н, м), 6,16 (1Н, д), 6,03 (1Н, ш с), 5,77 (1Н, м), 5,57 (1Н, м), 4,344,47 (ЗН, м), 3,80-4,00 (2Н, ш с), 2,98 (2Н, м), 2,16 (3Н, с), 2,14 (ЗН, с), 2,08 (3Н, с). Приготування 12: (2R,3R,4R,5R)-2-[2-(Амінометил)-6-(фенетиламіно)-9Н-пурин-9-іл]-5-(гідроксиметил)тетрагідро-3,4фурандіол Розчин (2R,3R,4R,5R)-4-(ацетилокси)-2-[(ацетилокси)метил]-5-[2-ціано-6-(фенетиламіно)-9Н-пурин-9іл]тетрагідро-3-фураніл ацетату (1,0г, 1,91ммоль) (Приготування 11) в етанолі (40мл) насиченому аміаком обробляли 5% ваг/ваг паладієм на вугіллі (0,50г), при тиску водню до 1034кПа (150псі) в закритій колбі і перемішували при кімнатній температурі протягом 18 годин. ТШХ аналіз показав, що все ще присутня деяка кількість вихідного матеріалу і тому додавали 5% ваг/ваг паладій на вугіллі (0,25г) і етанол (20мл) насичений аміаком і суміш знову обробляли воднем з тиском до 1034кПа (150псі) в закритій колбі і перемішували при кімнатній температурі протягом 18 годин. Суміш фільтрували крізь шар Арбоцелю (торгова марка) і фільтрат випарювали при пониженому тиску. Залишок азеотропували з дихлорметаном, потім очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту ди хлорметан:метанол:0,88 аміак (90:10:0,5 за об'ємом) одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини (340мг). МС: 401 (МН+). 1 Н-ЯМР (ДМСО-d6) δ : 8,28 (1Н, ш с), 7,91 (1Н, ш с), 7,14-7,33 (5Н, м), 5,90 (1Н, д), 5,38 ( 1Н, ш с), 5,17 (1Н, ш с), 4,61 (1Н, ш с), 4,13 (1Н, ш с), 3,95 (1Н, с), 3,73 (5Н, м), 3,66 (1Н,дд), 3,52 (1Н,дд), 2,90 (2Н,т). Приготування 13: (2R,3R,4R,5R)-4-(Ацетилокси)-2-[(ацетилокси)метил]-5-{2-ціано-6-[(1-нафтилметил)аміно]-9Н-пурин-9іл}тетрагідро-3-фураніл ацетат Розчин (2R,3R,4R,5R)-4-(ацетилокси)-2-[(ацетилокси)метил]-5-(6-хлор-2-ціано-9Н-пурин-9-іл)тетрагідро-3фураніл ацетату (3,0г, 6,86ммоль) (Приготування 10), 1-нафталенметиламін (1,2г, 7,63ммоль) і триетиламін (2,8г, 27,72ммоль) в ацетонітрилі (30мл) залишали стояти при кімнатній температурі на 2 години і в цей час повільно утворювався тонкодісперсний осад. Розчинник видаляли при пониженому тиску і залишок розділяли між дихлорметаном (150мл) і водою (50мл). Органічну фазу відокремлювали і розчинник випарювали при пониженому тиску Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту дихлорметан:етилацетат (4:1 за об'ємом) одержуючи продукт, який азеотропували з дихлорметаном одержуючи вказану в заголовку сполуку у вигляді піни (3,6г). МС: 559 (МН+). 1 Н-ЯМР (CDCI3) δ : 7,78-8,10 (4Н, м), 7,38-7,62 (4Н, м), 6,22 (1Н, ш с), 6,16 (1Н, д), 5,78 (1Н, т), 5,56 (1Н, м), 5,24 (2Н, ш с), 4,36-4,48 (3Н, м), 2,18 (3Н, с), 2,15 (ЗН, с), 2,10 (3Н, с). Приготування 14: 9-[(2R,3R,4S,5R)-3,4-Дигідрокси-5-(гідроксиметил)тетрагідро-2-фураніл]-6-((1-нафтилметил)аміно]-9Нпурин-2-карбонітрил Розчин (2R,3R,4R,5R)-4-(ацетилокси)-2-[(ацетилокси)метил]-5-{2-ціано-6-[(1-нафтилметил)аміно]-9Н пурин-9-іл}тетрагідро-3-фураніл ацетату (3,5г, 6,27ммоль) (Приготування 13) в етанолі (120мл) насиченому аміаком, перемішували при кімнатній температурі протягом 4 днів. Розчинник видаляли при пониженому тиску і залишок розтирали з водою (100мл), фільтрували і сушили одержуючи вказану в заголовку . сполуку у вигляді твердої речовини (2,4г). МС: 433 (МН+). 1 Н-ЯМР (ДМСО-d6) δ : 9,12 (1Н, ш с), 8,67 (1Н, с), 8,24 (1Н, д), 7,94 (1Н, д), 7,82 (1Н, м), 7,34-7,63 (4Н, м), 5,91 (1Н, д), 5,50 (1Н, ш с), 4,90-5,30 (4Н, м), 4,53 (1Н, м), 4,14 (1Н, ш с), 3,95 (1Н,м), 3,60 (2Н,м). Приготування 15: (2R,3R,4S,5R)-242-(Амінометил)-6-[(1-нафтилметил)аміно]-9Н-пурин-9-іл}-5-(гідроксиметил)тетрагідро-3,4фурандіол Розчин 9-[(2R,3R,4S,5R)-3,4-дигідрокси-5-(гідроксиметил)тетрагідро-2-фураніл]-6-[(1-нафтилметил)аміно]9Н-пурин-2-карбонітрилу (0,75г, 1,74ммоль) (Приготування 14) в етанолі (30мл) насиченому аміаком, обробляли 5% ваг/ваг паладієм на вугіллі (0,50г), при тиску водню до 1034кПа (150псі) щ закритій колбі і перемішували при кімнатній температурі протягом 42 годин. ТШХ аналіз показала що все ще присутня деяка кількість вихідного матеріалу і тому додавали 5% ваг/ваг паладій на вугіллі (0,50г) і етанол (10мл) насичений аміаком. Суміш повторно гідрували при тиску водню до 1034кПа (150псі) в закритій колбі і перемішували при кімнатній температурі протягом 24 годин. Суміш фільтрували крізь шар Арбоцелю (торгова марка) і фільтрат випарювали при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту градієнт системи дихлорметан:метанол:0,88 аміак (90:10:0,5 за об'ємом) поступово змінюючи до дихлорметан:метанол:0,88 аміак (85:15:0,75 за об'ємом) одержуючи вказану в заголовку сполуку (0,18г). МС: 437 (МН+). 1 Н-ЯМР (ДMCO-d 6) δ : 8,42 (1Н, ш с), 8,28 (2Н, ш с), 7,93 (1Н, д), 7,80 (1Н, д), 7,36-7,60 (4Н, м), 5,88 (1Н, д), 5,38 (1Н, ш с), 5,18 (3Н, ш с), 4,60 (1Н, ш м), 4,13 (1Н, ш с), 3,95 (1Н, м), 3,71 (2Н, с), 3,63 (1Н, дд), 3,57 (1Н, дд). Приготування 16: N-({9-[(2R,3R,4S,5R)-3,4-Дигідрокси-5-(гідроксиметил)тетрагідро-2-фураніл]-6-[(2,2-дифенілетил)аміно]-9Нпурин-2-іл}метил)етиленсульфонамід 2-Хлоретансульфонілхлорид (0,06мл, 0,58ммоль) додавали до розчину (2R,3R,4S,5R)-2-{2-(амінометил)-6[(2,2-дифенілетил)аміно]-9N-пурин-9-іл}-5-(гідроксиметил)тетрагідро-3,4-фурандіолу (250мг, 0,52ммоль) (Приготування 19) і триетиламіну (0,15мл, 1,1ммоль) в дихлорметані (5мл). Реакційну суміш перемішували протягом двох годин при кімнатній температурі і потім розводили дихлорметаном (50мл) і промивали водою (50мл). Органічний шар сушили (безводний сульфат магнію) і розчинник випарювали одержуючи залишок, що очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту метанол.дихлорметан (1:19 за об'ємом) і в подальшому підвищуючи полярність системи метанол:дихлорметан до (1:9 за об'ємом). Розчинник видаляли при пониженому тиску одержуючи вказану в заголовку сполуку (65мг) у вигляді масла. 1 Н-ЯМР (CD3OD) δ : 8,15 (1Н, с), 7,40-7,15 (10Н, м), 6,70-6,55 (1Н, м), 6,15-6,05 (1Н, м), 6,00-5,95 (1Н, м), 5,80-5,75 (1Н, м), 4,75-4,70 (1Н, м), 4,55-4,50 (1Н, м), 4,35-4,15 (6Н, м), 3,95-3,85 (1Н, м), 3,80-3,70 (1Н, м). Приготування 17: N-Ізопропілциклопентанамін Триацетоксиборгідрид натрію (33,76г, 0,16моль) додавали до розчину циклопентиламіну (15мл, 0,15моль) в ацетоні (500мл). Реакційну суміш перемішували при кімнатній температурі протягом 24г потім розчинник видаляли і реакційну суміш розділяли між етилацетатом (400мл) і 2М водним розчином гідроксиду натрію (150мл). Органічний шар відокремлювали, сушили (безводний сульфат магнію) і випарювали при пониженому тиску одержуючи вказану в заголовку сполук у (12г) у вигляді рідини. 1 Н-ЯМР (CD3OD) δ : 3,20-3,10 (1Н, м), 2,95-2,80 (1Н, м), 1,95-1,80 (2Н, м), 1,75-1,45 (4Н, м), 1,35-1,20 (2Н, м), 1,10-1,00 (6Н, м). Приготування 18: (2R,3R,4R,5R)-4-(Ацетилокси)-2-[(ацетилокси)метил]-5-{2-ціано-6-[(2,2-дифенілетил)аміно]-9Н-пурин-9іл}тетрагідро-3-фураніл ацетат Ν,Ο-Бістриметилсилілацетамід (44мл, 0,18моль) додавали до суспензії 6-[(2,2-дифенілетил)аміно]-9Нпурин-2-карбонітрилу (10,0г, 0,03моль) (дивіться WO-A-00/23457) в 1,1,1-трихлоретані (250мл). Суспензію нагрівали до температури кипіння. Після розчинення всієї суспендованої речовини реакційну суміш залишали охолоджуватись до кімнатної температури і розчинник видаляли при пониженому тиску. Залишок двічі розчиняли в толуолі (50мл) і розчинник видаляли при пониженому тиску. Залишок розчиняли в толуолі (100мл) і додавали (2R,3R,4R,5S)-4,5-біс(ацетилокси)-2-[(ацетилокси)метил]тетрагідро-3-фуранілу ацетат (10,3г, 0,032моль). Розчин перемішували при кімнатній температурі і обережно додавали триметилсилілтрифторметансульфонат (16мл, 0,088моль). Одержаний розчин нагрівали із зворотнім холодильником протягом 2 годин і потім залишали охолоджуватись до кімнатної температури. Реакційну суміш розводили додаючи етилацетат (100мл) і потім промивали насичений водний розчин гідрокарбонату натрію (десять порцій по 100мл) і насиченим водним розчином хлориду натрію (100мл). Водні екстракти об'єднували і промивали етилацетатом (три порції по 100мл). Об'єднані органічні шари сушили (безводний сульфат магнію) і розчинник видаляли при пониженому тиску одержуючи тверду речовину, що очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту дихлорметан:метанол:0,88 концентрований водний аміак (97:3:0,5 за об'ємом поступово змінюючи до 80:20:3 за об'ємом) одержуючи вказану в заголовку сполуку у вигляді піни (8,5г). 1 Н-ЯМР (CDCI3) δ : 7,95 (1Н, с), 7,35-7,20 (10Н, м), 6,15-6,10 (1Н, м), 5,95-5,90 (1Н, м), 5,80-5,75 (1Н, м), 5,60-5,55 (1Н, м), 4,45-4,35 (4Н, м), 4,35-4,25 (2Н, м), 2,15 (3Н, с), 2,10 (ЗН, с), 2,05 (3Н, с). Приготування 19: (2R,3R,4S,5R)-2-{2-(Амінометил)-6-[(2,2-дифенілетил)аміно]-9Н-пурин-9-іл}-5-(гідроксиметил)тетрагідро3,4-фурандіол 10% ваг/ваг Паладій на вугіллі (200мг) додавали до розчину (2R,3R,4R,5R)-4-(ацетилокси)-2[(ацетилокси)метил]-5-{2-ціано-6-[(2,2-дифенілетил)аміно]-9Н-пурин-9-іл}тетрагідро-3-фураніл ацетату (Приготування 18) (1,9г, 3,2ммоль) в етанолі насиченому аміаком (100мл). Реакційну суміш перемішували в атмосфері водню 414кПа (60псі) протягом 16 годин при кімнатній температурі. Тверді речовини видаляли фільтруванням крізь Арбоцель (торгова марка) і розчинник видаляли при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі використовуючи в якості елюенту дихлорметан:метанол:0,88 концентрований водний аміак (90:10:1 за об'ємом поступово змінюючи до 80:20:2 за об'ємом) одержуючи вказану в заголовку сполуку у вигляді твердої речовини (770мг). МС: 477 (МН+). 1 Н-ЯМР (CDCI3) δ : 8,10 (1 Η, с), 7,35-7,20 (8Н, м), 5,90-5,85 (1Н, м), 4,75-4,70 (1Н, м), 4,50-4,40 (1Н, м), 4,30-4,20 (2Н, м), 4,10 (1Н, м), 3,90-3,80 (2Н, м), 3,70-3,65 (1Н, м). Фармакологічна активність Визначали антизапальну активність всіх сполук Прикладів 1-4 по їх здатності інгібувати нейтрофільні функції (визначали активність агоніста А2а рецептора) за методом описаним на сторінці 20 і всі сполуки мали ІС50 менше ніж 1 мікромоль.
ДивитисяДодаткова інформація
Назва патенту англійськоюPurine derivatives with characteristics of human а2а receptor agonist, a method for the preparation thereof, pharmaceutical composition and a method for treatment
Назва патенту російськоюПроизводные пурина со свойствами агониста человеческого а2а рецептора, способ их получения, фармацевтическая композиция и способ лечения
МПК / Мітки
МПК: A61P 3/10, A61P 11/06, A61P 15/10, A61P 25/08, C07H 19/16, A61P 37/08, A61K 31/52, C07D 473/34, A61P 9/10, A61P 17/06, A61P 19/02, A61P 9/00, A61P 11/02, A61P 1/04, A61P 29/00, A61P 11/00
Мітки: композиція, а2а, властивостями, фармацевтична, похідні, одержання, людського, рецептора, пурину, агоніста, лікування, спосіб
Код посилання
<a href="https://ua.patents.su/16-66945-pokhidni-purinu-z-vlastivostyami-agonista-lyudskogo-a2a-receptora-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні пурину з властивостями агоніста людського а2а рецептора, спосіб їх одержання, фармацевтична композиція та спосіб лікування</a>
Попередній патент: Пристрій для контролю геометричних характеристик копитець та копит свійських тварин
Наступний патент: Лічильник витрати для рідких і газоподібних середовищ
Випадковий патент: Установка для лазерної обробки отворів












