Гідрохлорид 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрилу
Номер патенту: 92467
Опубліковано: 10.11.2010
Автори: Вандекрюйс Роже Петрус Гереберн, Стевенс Поль Теодоор Агнес, Пеетерс Йозеф, Копманс Алекс Герман
Формула / Реферат
1. Тверда фармацевтична композиція, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки формули (І)
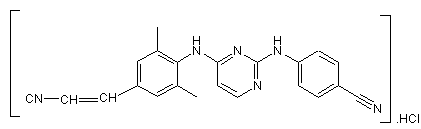 , (I)
, (I)
її N-оксиду або стереохімічно ізомерної форми.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що сполука формули (І) являє собою сполуку формули (І-а)
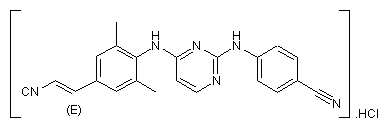 (I-a).
(I-a).
3. Фармацевтична композиція за п. 2, яка відрізняється тим, що сполука формули (І-а) являє собою поліморфну форму А, яка характеризується піками порошкової рентгенівської дифракції в положеннях два тета 9,7°±0,2°, 13,5°±0,2° і 15,0°±0,2°.
4. Фармацевтична композиція за п. 3, яка відрізняється тим, що поліморфна форма А додатково характеризується піками порошкової рентгенівської дифракції в положеннях два тета 9,1°±0,2°, 11,0°±0,2°, 14,6°±0,2°, 22,0°±0,2°, 25,0°±0,2°, 25,3°±0,2° і 26,7°±0,2°.
5. Фармацевтична композиція за п. 2, яка відрізняється тим, що сполука формули (І-а) являє собою поліморфну форму В (сухий стан), що характеризується піками порошкової рентгенівської дифракції в положеннях два тета 4,5°± 0,2°, 8,8°±0,2° і 12,5°±0,2°.
6. Фармацевтична композиція за п. 5, яка відрізняється тим, що поліморфна форма В додатково характеризується піками порошкової рентгенівської дифракції в положеннях два тета 10,3°±0,2°, 14,7°±0,2°, 20,6°±0,2°, 22,2°±0,2° і 26,1°±0,2°.
7. Фармацевтична композиція за п. 2, яка відрізняється тим, що сполука формули (І-а) являє собою поліморфну форму С, що характеризується піками порошкової рентгенівської дифракції в положеннях два тета 11,9°±0,2°, 14,3°±0,2° і 22,3°±0,2°.
8. Фармацевтична композиція за п. 7, яка відрізняється тим, що поліморфна форма С додатково характеризується піками порошкової рентгенівської дифракції в положеннях два тета 12,8°±0,2°, 18,5°±0,2°, 21,2°±0,2°, 24,3°±0,2° і 26,0°±0,2°.
9. Фармацевтична композиція за п. 2, яка відрізняється тим, що сполука формули (І-а) являє собою поліморфну форму D, що характеризується піками порошкової рентгенівської дифракції в положеннях два тета 6,6°±0,2°, 11,6°±0,2° i 17,1±0,2°.
10. Фармацевтична композиція за п. 9, яка відрізняється тим, що поліморфна форма D додатково характеризується піками порошкової рентгенівської дифракції в положеннях два тета 15,0°±0,2°, 19,2°±0,2°, 20,5°±0,2°, 21,6°±0,2° і 29,8°±0,2°.
11. Фармацевтична композиція за будь-яким з пп. 2-4, яка відрізняється тим, що сполука формули (І-а) являє собою поліморфну форму А, що характеризується ФТ ІЧ спектром зі смугами поглинання приблизно при 2217, 1652, 1497, 1435, 1338, 1199 і 550 см-1.
12. Фармацевтична композиція за п. 11, яка відрізняється тим, що поліморфна форма А додатково характеризується ФТ ІЧ спектром зі смугами поглинання при 1631, 1596, 1537, 1504, 1249, 1214, 1179, 1152 і 1070 см-1.
13. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що є придатною для перорального введення.
14. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що додатково містить зволожуючий агент.
15. Фармацевтична композиція за п. 14, яка відрізняється тим, що зволожуючий агент являє собою Tween.
16. Фармацевтична композиція за п. 14 або 15, яка відрізняється тим, що містить за масою, базуючись на загальній масі композиції:
(a) від 5 до 50 % активного інгредієнта;
(b) від 0,01 до 5 % зволожуючого агента;
(c) від 40 до 92 % розріджувача;
(d) від 0,1 до 5 % гліданту.
17. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що знаходиться у формі таблетки.
18. Фармацевтична композиція за п. 17, яка відрізняється тим, що має плівкове покриття.
19. Фармацевтична композиція за п. 17, яка відрізняється тим, що містить за масою, базуючись на загальній масі серцевини таблетки:
(a) від 5 до 50 % сполуки формули (І) або (І-а);
(b) від 0,01 до 5 % зволожуючого агента;
(c) від 40 до 92 % розріджувача;
(d) від 0 до 10 % полімеру;
(e) від 2 до 10 % розпушувача;
(f) від 0,1 до 5 % гліданту;
(g) від 0,1 до 1,5 % лубриканта.
20. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що містить таку кількість активного інгредієнта, яка є еквівалентною 25 мг відповідної вільної основи (осн. екв.).
21. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад:
сполука формули (І-а)
27,5 мг (тобто 25 мг осн. екв.)
лактози моногідрат
242,0 мг
гіпромелоза 2910 15 мПа·с
5,6 мг
полісорбат 20
1,4 мг
мікрокристалічна целюлоза
52,5 мг
натрійкроскармелоза
17,5 мг
колоїдний діоксид кремнію
1,05 мг
стеарат магнію
2,45 мг.
22. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад:
сполука формули (І-а)
27,5 мг (тобто 25 мг осн. екв.)
лактози моногідрат
55,145 мг
полівінілпіролідон
3,25 мг
полісорбат 20
0,35 мг
силіцифікована мікрокристалічна целюлоза
16,605 мг
натрійкроскармелоза
6,05 мг
стеарат магнію
1,10 мг.
23. Фармацевтична композиція за будь-яким з пп. 1-19, яка відрізняється тим, що містить таку кількість активного інгредієнта, яка є еквівалентною 50 мг відповідної вільної основи (осн. екв.).
24. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад:
сполука формули (І-а)
55 мг (тобто 50 мг осн. екв.)
лактози моногідрат
214,5 мг
гіпромелоза 2910 15 мПа·с
5,6 мг
полісорбат 20
1,4 мг
мікрокристалічна целюлоза
52,5 мг
натрійкроскармелоза
17,5 мг
колоїдний діоксид кремнію
1,05 мг
стеарат магнію
2,45 мг.
25. Фармацевтична композиція за будь-яким з пп. 1-19, яка відрізняється тим, що містить таку кількість активного інгредієнта, яка є еквівалентною 75 мг відповідної вільної основи (осн. екв.).
26. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад:
Сполука формули (І-а)
82,5 мг (тобто 75 мг осн. екв.)
лактози моногідрат
165,435 мг
полівінілпіролідон
9,75 мг
полісорбат 20
1,05 мг
силіцифікована мікрокристалічна целюлоза
49,815 мг
натрійкроскармелоза
18,15 мг
стеарат магнію
3,30 мг.
27. Фармацевтична композиція за будь-яким з пп. 1-19, яка відрізняється тим, що містить таку кількість активного інгредієнта, яка є еквівалентною 100 мг відповідної вільної основи (осн. екв.).
28. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад:
сполука формули (І-а)
110 мг (тобто 100 мг осн. екв.)
лактози моногідрат
159,5 мг
гіпромелоза 2910 15 мПа·с
5,6 мг
полісорбат 20
1,4 мг
мікрокристалічна целюлоза
52,5 мг
натрійкроскармелоза
17,5 мг
колоїдний діоксид кремнію
1,05 мг
стеарат магнію
2,45 мг.
29. Фармацевтична композиція за будь-яким з пп. 1-19, яка відрізняється тим, що містить таку кількість активного інгредієнта, яка є еквівалентною 150 мг відповідної вільної основи (осн. екв.).
30. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад:
сполука формули (І-а)
165 мг (тобто 150 мг осн. екв.)
лактози моногідрат
330,87 мг
полівінілпіролідон
19,5 мг
полісорбат 20
2,1 мг
силіцифікована мікрокристалічна целюлоза
99,63 мг
натрійкроскармелоза
36,30 мг
стеарат магнію
6,6 мг.
31. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що не містить ні емтрицитабіну, ні тенофовірдіізопроксилфумарату.
32. Фармацевтична композиція за будь-яким з пп. 1-30, яка відрізняється тим, що не містить один або декілька нуклеозидних інгібіторів зворотної транскриптази і/або один або декілька нуклеотидних інгібіторів зворотної транскриптази.
33. Застосування сполуки формули (І) за п. 1 або формули (І-а) за п. 2 для виробництва композиції за будь-яким з пп. 1-32 для лікування або профілактики ВІЛ-інфекції.
34. Спосіб одержання сполуки формули (І) за п. 1, що включає взаємодію відповідної вільної основи із соляною кислотою в присутності придатної кислоти.
35. Спосіб за п. 34, який відрізняється тим, що придатною кислотою є оцтова кислота.
36. Спосіб за п. 34 або 35, який відрізняється тим, що сполукою формули (І) є сполука формули (І-а) за будь-яким з пп. 2-4, 11 або 12.
37. Фармацевтична композиція за будь-яким з пп. 14-32, яка відрізняється тим, що сполука формули (І-а) має розмір часток менше 50 мкм.
38. Фармацевтична композиція за п. 37, яка відрізняється тим, що сполука формули (І-а) має розмір часток менше 25 мкм.
39. Частка сполуки формули (І-а) за будь-яким з пп. 2-12, яка має розмір менше 50 мкм.
40. Частка за п. 39, яка відрізняється тим, що має розмір менше 25 мкм.
41. Частка за п. 40, яка відрізняється тим, що має розмір менше 20 мкм.
42. Частка за п. 41, яка відрізняється тим, що має розмір близько 15 мкм або менше.
43. Частка за п. 42, яка відрізняється тим, що має розмір в діапазоні від близько 0,2 мкм до близько 15 мкм.
44. Частка за будь-яким з пп. 39-43, яка відрізняється тим, що сполука формули (І-а) являє собою сполуку, як визначено за будь-яким з пп. 3, 4, 11 або 12.
Текст
1. Тверда фармацевтична композиція, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки формули (І) C2 N .HCl , (I) (11) 2. Фармацевтична композиція за п. 1, яка відрізняється тим, що сполука формули (І) являє собою сполуку формули (І-а) її N-оксиду або стереохімічно ізомерної форми. H N (13) N CH CH H N N UA CN H N N N CN (E) 3. Фармацевтична композиція за п. 2, яка відрізняється тим, що сполука формули (І-а) являє собою поліморфну форму А, яка характеризується піками порошкової рентгенівської дифракції в положеннях два тета 9,7°±0,2°, 13,5°±0,2° і 15,0°±0,2°. 92467 H N N .HCl (I-a). 4. Фармацевтична композиція за п. 3, яка відрізняється тим, що поліморфна форма А додатково характеризується піками порошкової рентгенівської дифракції в положеннях два тета 9,1°±0,2°, 11,0°±0,2°, 14,6°±0,2°, 22,0°±0,2°, 25,0°±0,2°, 25,3°±0,2° і 26,7°±0,2°. (19) (21) a200701971 (22) 02.09.2005 (24) 10.11.2010 (86) PCT/EP2005/054342, 02.09.2005 (31) 05101467.8 (32) 25.02.2005 (33) EP (31) PCT/EP2004/052028 (32) 03.09.2004 (33) EP (31) PI20043578 (32) 02.09.2004 (33) MY 3 5. Фармацевтична композиція за п. 2, яка відрізняється тим, що сполука формули (І-а) являє собою поліморфну форму В (сухий стан), що характеризується піками порошкової рентгенівської дифракції в положеннях два тета 4,5°±0,2°, 8,8°±0,2° і 12,5°±0,2°. 6. Фармацевтична композиція за п. 5, яка відрізняється тим, що поліморфна форма В додатково характеризується піками порошкової рентгенівської дифракції в положеннях два тета 10,3°±0,2°, 14,7°±0,2°, 20,6°±0,2°, 22,2°±0,2° і 26,1°±0,2°. 7. Фармацевтична композиція за п. 2, яка відрізняється тим, що сполука формули (І-а) являє собою поліморфну форму С, що характеризується піками порошкової рентгенівської дифракції в положеннях два тета 11,9°±0,2°, 14,3°±0,2° і 22,3°±0,2°. 8. Фармацевтична композиція за п. 7, яка відрізняється тим, що поліморфна форма С додатково характеризується піками порошкової рентгенівської дифракції в положеннях два тета 12,8°±0,2°, 18,5°±0,2°, 21,2°±0,2°, 24,3°±0,2° і 26,0°±0,2°. 9. Фармацевтична композиція за п. 2, яка відрізняється тим, що сполука формули (І-а) являє собою поліморфну форму D, що характеризується піками порошкової рентгенівської дифракції в положеннях два тета 6,6°±0,2°, 11,6°±0,2° i 17,1±0,2°. 10. Фармацевтична композиція за п. 9, яка відрізняється тим, що поліморфна форма D додатково характеризується піками порошкової рентгенівської дифракції в положеннях два тета 15,0°±0,2°, 19,2°±0,2°, 20,5°±0,2°, 21,6°±0,2° і 29,8°±0,2°. 11. Фармацевтична композиція за будь-яким з пп. 2-4, яка відрізняється тим, що сполука формули (І-а) являє собою поліморфну форму А, що характеризується ФТ ІЧ спектром зі смугами поглинання приблизно при 2217, 1652, 1497, 1435, 1338, 1199 і 550 см-1. 12. Фармацевтична композиція за п. 11, яка відрізняється тим, що поліморфна форма А додатково характеризується ФТ ІЧ спектром зі смугами поглинання при 1631, 1596, 1537, 1504, 1249, 1214, 1179, 1152 і 1070 см-1. 13. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що є придатною для перорального введення. 14. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що додатково містить зволожуючий агент. 15. Фармацевтична композиція за п. 14, яка відрізняється тим, що зволожуючий агент являє собою Tween. 16. Фармацевтична композиція за п. 14 або 15, яка відрізняється тим, що містить за масою, базуючись на загальній масі композиції: (a) від 5 до 50 % активного інгредієнта; (b) від 0,01 до 5 % зволожуючого агента; (c) від 40 до 92 % розріджувача; (d) від 0,1 до 5 % гліданту. 17. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що знаходиться у формі таблетки. 18. Фармацевтична композиція за п. 17, яка відрізняється тим, що має плівкове покриття. 92467 4 19. Фармацевтична композиція за п. 17, яка відрізняється тим, що містить за масою, базуючись на загальній масі серцевини таблетки: (a) від 5 до 50 % сполуки формули (І) або (І-а); (b) від 0,01 до 5 % зволожуючого агента; (c) від 40 до 92 % розріджувача; (d) від 0 до 10 % полімеру; (e) від 2 до 10 % розпушувача; (f) від 0,1 до 5 % гліданту; (g) від 0,1 до 1,5 % лубриканта. 20. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що містить таку кількість активного інгредієнта, яка є еквівалентною 25 мг відповідної вільної основи (осн. екв.). 21. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад: 27,5 мг (тобто сполука формули (І-а) 25 мг осн. екв.) лактози моногідрат 242,0 мг гіпромелоза 2910 15 мПа·с 5,6 мг полісорбат 20 1,4 мг мікрокристалічна целюлоза 52,5 мг натрійкроскармелоза 17,5 мг колоїдний діоксид кремнію 1,05 мг стеарат магнію 2,45 мг. 22. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад: 27,5 мг (тобто сполука формули (І-а) 25 мг осн. екв.) лактози моногідрат 55,145 мг полівінілпіролідон 3,25 мг полісорбат 20 0,35 мг силіцифікована мікрокристалічна целюлоза 16,605 мг натрійкроскармелоза 6,05 мг стеарат магнію 1,10 мг. 23. Фармацевтична композиція за будь-яким з пп. 1-19, яка відрізняється тим, що містить таку кількість активного інгредієнта, яка є еквівалентною 50 мг відповідної вільної основи (осн. екв.). 24. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад: 55 мг (тобто сполука формули (І-а) 50 мг осн. екв.) лактози моногідрат 214,5 мг гіпромелоза 2910 15 мПа·с 5,6 мг полісорбат 20 1,4 мг мікрокристалічна целюлоза 52,5 мг натрійкроскармелоза 17,5 мг колоїдний діоксид кремнію 1,05 мг стеарат магнію 2,45 мг. 25. Фармацевтична композиція за будь-яким з пп. 1-19, яка відрізняється тим, що містить таку кількість активного інгредієнта, яка є еквівалентною 75 мг відповідної вільної основи (осн. екв.). 26. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що компо 5 92467 6 зиція є таблеткою, яка містить ядро таблетки, що має наступний склад: 82,5 мг (тобто сполука формули (І-а) 75 мг осн. екв.) лактози моногідрат 165,435 мг полівінілпіролідон 9,75 мг полісорбат 20 1,05 мг силіцифікована мікрокристалічна целюлоза 49,815 мг натрійкроскармелоза 18,15 мг стеарат магнію 3,30 мг. 27. Фармацевтична композиція за будь-яким з пп. 1-19, яка відрізняється тим, що містить таку кількість активного інгредієнта, яка є еквівалентною 100 мг відповідної вільної основи (осн. екв.). 28. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад: 110 мг (тобто сполука формули (І-а) 100 мг осн. екв.) лактози моногідрат 159,5 мг гіпромелоза 2910 15 мПа·с 5,6 мг полісорбат 20 1,4 мг мікрокристалічна целюлоза 52,5 мг натрійкроскармелоза 17,5 мг колоїдний діоксид кремнію 1,05 мг стеарат магнію 2,45 мг. 29. Фармацевтична композиція за будь-яким з пп. 1-19, яка відрізняється тим, що містить таку кількість активного інгредієнта, яка є еквівалентною 150 мг відповідної вільної основи (осн. екв.). 30. Фармацевтична композиція за будь-яким з пп. 2-4, 11 або 12, яка відрізняється тим, що композиція є таблеткою, яка містить ядро таблетки, що має наступний склад: 165 мг (тобто сполука формули (І-а) 150 мг осн. екв.) лактози моногідрат 330,87 мг полівінілпіролідон 19,5 мг полісорбат 20 2,1 мг силіцифікована мікрокристалічна целюлоза 99,63 мг натрійкроскармелоза 36,30 мг стеарат магнію 6,6 мг. 31. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що не містить ні емтрицитабіну, ні тенофовірдіізопроксилфумарату. 32. Фармацевтична композиція за будь-яким з пп. 1-30, яка відрізняється тим, що не містить один або декілька нуклеозидних інгібіторів зворотної транскриптази і/або один або декілька нуклеотидних інгібіторів зворотної транскриптази. 33. Застосування сполуки формули (І) за п. 1 або формули (І-а) за п. 2 для виробництва композиції за будь-яким з пп. 1-32 для лікування або профілактики ВІЛ-інфекції. 34. Спосіб одержання сполуки формули (І) за п. 1, що включає взаємодію відповідної вільної основи із соляною кислотою в присутності придатної кислоти. 35. Спосіб за п. 34, який відрізняється тим, що придатною кислотою є оцтова кислота. 36. Спосіб за п. 34 або 35, який відрізняється тим, що сполукою формули (І) є сполука формули (І-а) за будь-яким з пп. 2-4, 11 або 12. 37. Фармацевтична композиція за будь-яким з пп. 14-32, яка відрізняється тим, що сполука формули (І-а) має розмір часток менше 50 мкм. 38. Фармацевтична композиція за п. 37, яка відрізняється тим, що сполука формули (І-а) має розмір часток менше 25 мкм. 39. Частка сполуки формули (І-а) за будь-яким з пп. 2-12, яка має розмір менше 50 мкм. 40. Частка за п. 39, яка відрізняється тим, що має розмір менше 25 мкм. 41. Частка за п. 40, яка відрізняється тим, що має розмір менше 20 мкм. 42. Частка за п. 41, яка відрізняється тим, що має розмір близько 15 мкм або менше. 43. Частка за п. 42, яка відрізняється тим, що має розмір в діапазоні від близько 0,2 мкм до близько 15 мкм. 44. Частка за будь-яким з пп. 39-43, яка відрізняється тим, що сполука формули (І-а) являє собою сполуку, як визначено за будь-яким з пп. 3, 4, 11 або 12. Даний винахід відноситься до фармацевтичної композиції, що містить сіль гідрохлорид 4-[[4-[[4-(2ціаноетеніл)-2,6-диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрилу і до її одержання. WO 03/16306 розкриває похідні піримідину, що інгібуютьВІЛ реплікацію, серед яких 4-[[4-[[4-(2ціаноетеніл)-2,6-диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрил і його фармацевтично прийнятні солі. WO 04/0162581 розкриває способи одержання 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бентонітрилу. 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил, зокрема, Еізомер, має добру активність інгібування ВІЛ реп лікації щодо дикого типу ВІЛ, а також штамів ВІЛ з лікарською і мультилікарською стійкістю (тобто штамів, що стали стійкими щодо відомих в даній галузі ліків). Таким чином, дана сполука потенційно може бути добрим кандидатом для розробки лікарського засобу для лікування ВІЛ-інфекції. Проте висока фармакологічна активність, добрий фармакологічний профіль - це не єдиний фактор, що визначає лікарську здатність сполуки. Добрий кандидат у ліки переважно повинен бути стабільним хімічно, а також фізично; повинен мати прийнятний профіль токсичності; повинен мати прийнятну біодоступність. Біодоступність сполуки впливає на дозу сполуки, яку необхідно ввести пацієнту для досягнення 7 терапевтично ефективної концентрації сполуки. Сполуки, що мають низьку біодоступність, необхідно вводити при більш високих дозах у порівнянні зі сполуками, що мають більш високу біодоступність. Можливі наслідки необхідності більш високих доз можуть включати підвищений ризик несприятливих ефектів; збільшення розміру дозованої форми; збільшення частоти введення. Дані фактори можуть впливати на дотримання курсу антиретровірусної терапії. Суворе дотримання курсу лікування є одним з найбільш важливих факторів, що впливають на ефективність лікування ВІЛ. Збільшення частоти прийому дози і збільшення розміру таблетки може привести до зниження суворості дотримання курсу лікування і, отже, зниження ефективності терапії. Таким чином, при розробці лікарського засобу для лікування ВІЛ, це, переважно, повинна бути активна сполука з прийнятною біодоступністю. Біодоступність сполуки, призначеної для перорального прийому, залежить від розчинності сполуки у воді, а також проникності сполуки (її здатності абсорбуватися через кишкову мембрану). Науковою основою для класифікації лікарських речовин на базі їх розчинності у воді і кишковій проникності є Біофармацевтична Система Класифікації або BCS. Згідно BCS, лікарські речовини класифікують наступним чином: клас 1: висока розчинність - висока проникність; клас 2: низька розчинність - висока проникність; клас 3: висока розчинність - низька проникність; клас 4: низька розчинність - низька проникність. Сполуки з низькою розчинністю або низькою проникністю (клас 2-4) можуть мати низьку біодоступність при пероральному введенні. Вільна основа 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрил може бути класифікована як сполука BCS-класу 2 і, таким чином, мати низьку розчинність у воді. 4-[[4-[[4-(2ціаноетеніл)-2,6-диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрил демонструє низьку розчинність не тільки у воді, але також у кислому середовищі. Отже, при пероральному введенні у вигляді звичайної твердої дозованої форми можна очікувати на низьку біодоступність. Маючи справу зі сполукою BCS-класу 2, призначеною для перорального введення, фахівець в галузі фармацевтичної технології зосереджує увагу на з'ясуванні можливостей підвищення розчинності сполук, наприклад, одержуючи підходящу сіль. Даним шляхом діють у випадку 4-[[4-[[4-(2ціаноетеніл)-2,6-диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрилу. Отримані солі, очевидно, мають тільки незначно поліпшену розчинність у воді і у НСl. Отримані солі ще належать до BCS-класу 2. Таким чином, для отриманих солей також можна очікувати на низьку біодоступність. 92467 8 Зненацька, у даний час виявлено, що сіль гідрохлорид 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-гаримідиніл]аміно]бентонітрилу, зокрема, його Е-ізомер, має значно поліпшену біодоступність in vivo у порівнянні з вільною основою. Фактично дана сіль, що вводиться у вигляді твердої дозованої форми, має in vivo біодоступність, що порівняна з біодоступністю вільної основи, що вводиться перорально у вигляді PEG 400-розчину. Завдяки підвищеній біодоступності in vivo, сіль гідрохлорид можна одержати без необхідності застосування методик комплексоутворення. Виявлено також, що сіль гідрохлорид за даним винаходом є негігроскопічною і хімічно та фізично стабільною в різних умовах вологості і температури. Опис креслень На Фіг.1 представлений ІЧ спектр поліморфної форми А солі (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил.НСl. На Фіг.2 представлена картина порошкової рентгенівської дифракції поліморфної форми А солі (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил.НСl. На Фіг.3 представлений ІЧ спектр поліморфної форми В солі (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил. НСl в сухому стані. На Фіг.4 представлена картина порошкової рентгенівської дифракції поліморфної форми В солі (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил. НСl в сухому стані. На Фіг.5 представлений ІЧ спектр поліморфної форми С солі (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил. НСl. На Фіг.6 представлена картина порошкової рентгенівської дифракції поліморфної форми С солі (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил. НСl. На Фіг.7 представлений ІЧ спектр псевдополіморфної форми D солі (Е) 4-[[4-[[4-(2-ціаноетеніл)2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил. НСl. На Фіг.8 представлена картина порошкової рентгенівської дифракції псевдополіморфної форми D солі (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил. НСl. Даний винахід відноситься до солі гідрохлорид (НСl) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрилу, його N-оксиду або стереохімічно ізомерної форми. Таким чином, даний винахід відноситься, зокрема, до сполуки формули (1) 9 92467 10 , її N-оксиду або стереохімічно ізомерної форми. Передбачається, що N-оксидні форми даної сполуки формули (І) включають сполуки формули (І), в яких один або декілька третинних атомів азоту окиснені до, так названого, N-оксиду. Як використовується в даній заявці вище, вираз "стереохімічно ізомерні форми" визначає всі можливі стереоізомерні форми, що може мати сполука формули (І) і N-оксиди. Якщо не вказано або не зазначено інше, хімічна назва сполуки позначає суміш всіх можливих стереохімічно ізомерних форм, а також будь-яку з індивідуальних ізомерних форм сполуки формули (І) і її N-оксидів, яка, власне кажучи, не містить інших ізомерів. Очевидно, мається на увазі, що стереохімічно ізомерні форми сполуки формули (І) включені в межі даного винаходу. Сполука формули (І) може існувати в 2 стереохімічних конфігураціях відносно подвійного зв'язку ціаноетенільного ланцюга, а саме, Еконфігурації (Entgegen = навпроти) (Е-ізомер) і Zконфігурації (Zusammen = разом) (Z-ізомер). Позначення Е і Z добре відомі фахівцю в даній галузі. Конкретний варіант сполуки формули (І) представляє Е-ізомер, тобто сполуку формули (l-а) Інший конкретний варіант сполуки формули (І) представляє Z-ізомер, тобто сполуку формули (Ib). Коли б в даній заявці не згадувався б Еізомер, мається на увазі чистий Е-ізомер або будьяка ізомерна суміш Е- і Z-ізомерів, в якій Е-ізомер переважає, тобто ізомерна суміш, що містить більше 50% або, зокрема, більше 80% Е-ізомеру, або більш конкретно 90% Е-ізомеру. Особливий інтерес представляє Е-ізомер, який, власне кажучи, не містить Z-ізомер. Вираз «власне кажучи не містить» у даному контексті позначає E-Z-суміші без або майже без Z-ізомеру, наприклад, ізомерні суміші, що містять більше 90%, зокрема, 95% або навіть 98%, або 99% Е-ізомеру. Коли б в даній заявці не згадувався б Z-ізомер, мається на увазі чистий Z-ізомер або будь-яка ізомерна суміш Z- і Е-ізомерів, в якій Z-ізомер переважає, тобто ізомерна суміш, що містить більше 50% або, зокрема, більше 80% Z-ізомеру або, більш конкретно, більше 90% Z-ізомеру. Особливий інтерес представляє Z-ізомер, який, власне кажучи, не містить Е-ізомер. Вираз «власне кажучи не містить» у даному контексті позначає E-Zсуміші без або майже без Е-ізомеру, наприклад, ізомерні суміші, що містять більше 90%, зокрема, 95% або навіть 98% або 99% Z-ізомеру. Поліморфні форми даних солей також включені в межі даного винаходу. Поліморфні форми фармацевтичних сполук можуть становити інтерес для тих, хто займається розробкою підходящої дозованої форми, тому що якщо поліморфна форма не зберігається незмінною протягом клінічних досліджень і дослідження стабільності, то не можна зіставляти точну використану або відмірену дозу при переході від однієї серії до іншої. При одержанні фармацевтичної сполуки для застосування важливо розпізнати поліморфну форму, доставлену в кожну дозовану форму, щоб переконатися, що в процесі одержання використовується однакова форма і що в кожну 11 дозу включається однакова кількість ліків. Таким чином, треба обов'язково переконатися, що є присутньою одна поліморфна форма або деяка відома комбінація поліморфних форм. Крім того, деякі поліморфні форми можуть демонструвати підвищену термодинамічну стабільність і можуть більше, ніж інші поліморфні форми, підходити для включення у фармацевтичні препарати. Як прийнято в даній заявці, поліморфні форми сполуки за даним винаходом являють собою однакову хімічну сутність, але в різній кристалічній структурі. Форми з приєднаним розчинником (сольвати), що здатні утворювати солі за даним винаходом, також включені в межі даного винаходу. Прикладами таких форм є, наприклад, гідрати, алкоголяти і подібні. Сольвати також позначаються в даній заявці як псевдополіморфні форми. Переважною є безводна сіль. Конкретним варіантом даного винаходу є конкретна поліморфна або псевдополіморфна форма сполуки формули (l-а), тобто (Е) 4-[[4-[[4-(2ціаноетеніл)-2,6-диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрил. НСl. Перша індивідуальна поліморфна форма сполуки формули (l-а) позначена в даній заявці як форма А (див. Фіг.1 і 2). Друга індивідуальна форма сполуки формули (l-а) позначена в даній заявці як форма В. Форма В може бути присутня в двох станах, сухому стані (поліморфна форма) і в зволоженому стані (псевдополіморфна форма). Приведені тільки характеристики форми В в сухому стані (див. Фіг.3 і 4). Третя індивідуальна поліморфна форма сполуки формули (l-а) позначена в даній заявці як форма С (див. Фіг.5 і 6). Четверта індивідуальна псевдополіморфна форма сполуки формули (l-а) позначена в даній заявці як форма D (див. Фіг.7 і 8). Переважною поліморфною формою сполуки формули (l-а) є форма А. Коли б в даній заявці далі не використовувався б вираз "сполука формули (І), (l-а) або (l-b)", мається на увазі, що він також включає N-оксидні форми, стереохімічно ізомерні форми і поліморфні або псевдополіморфні форми. Особливий інтерес представляє стереохімічно чиста форма сполуки формули (І). Переважною сполукою формули (І) є сполука формули (l-а). Сполуки формули (І), (l-а) або (I-b) можна одержати за допомогою взаємодії відповідної вільної основи із соляною кислотою (НСl) у присутності підходящого розчинника, такого як, наприклад, підходяща кислота, наприклад, оцтова кислота. Сполуки формули (І), (l-а) або (I-b) мають антиретровірусну активність. Вони здатні інгібувати реплікацію ВІЛ, зокрема, ВІЛ-1. ВІЛ (вірус імунодефіциту людини) являє собою етіологічний агент синдрому придбаного імунодефіциту (СНІД) у людей. Вірус ВІЛ переважно інфікує клітини Т-4 людини і руйнує їх або змінює їх звичайну функцію, особливо координацію імунної системи. У результаті, інфікований пацієнт постійно має знижену кількість клітин Т-4, що, крім того, поводяться аномально. Отже, імунологічна захисна система не здатна боротися з інфекціями і новоутвореннями, і 92467 12 ВІЛ-інфікований суб'єкт звичайно умирає від умовно-патогенних інфекцій, таких як пневмонія, або від ракових захворювань. Інші стани, асоційовані з ВІЛ-інфекціями, включають тромбоцитопенію, саркому Капоши та інфекцію центральної нервової системи, що характеризується прогресуючою демієлінізацією, результатом якої є слабоумство і такі симптоми як прогресуюча дизартрія, атаксія і дезорієнтація. Крім того, ВІЛ-інфікування також асоціюється з периферичною невропатією, прогресуючою генералізованою лімфаденопатією (PGL) і СНІД-пов'язаним комплексом (ARC). Дані сполуки також демонструють активність проти ВІЛ-штамів з лікарською стійкістю і множинною лікарською стійкістю, зокрема, штамів ВlЛ-1 з лікарською стійкістю і множинною лікарською стійкістю, більш конкретно, дані сполуки демонструють активність проти ВІЛ-штамів, особливо ВІЛ-1 штамів, що мають придбану стійкість до одного або декількох відомих у даній галузі ненуклеозидних інгібіторів зворотної транскриптази. Відомі в даній галузі ненуклеозидні інгібітори зворотної транскриптази являють собою ненуклеозидні інгібітори зворотної транскриптази, відмінні від даних сполук і, зокрема, комерційні ненуклеозидні інгібітори зворотної транскриптази. Активність 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрилу інгібування ВІЛреплікації описана в заявці WO 03/16306, що включена в дану заявку у вигляді посилання. Завдяки своїм антиретровірусним властивостям, зокрема, своїм анти-ВІЛ властивостям, головним чином, своїй інгібуючій реплікацію ВІЛ-1 активності, дані сполуки придатні для лікування ВІЛінфікованих індивідуумів і для профілактики даних інфекцій. Взагалі, сполуки за даним винаходом можуть бути корисні при лікуванні теплокровних ссавців, інфікованих вірусами, існування яких опосередковано або залежить від ферменту зворотної транскриптази. Стани, які можна попереджати або лікувати сполуками за даним винаходом, головним чином, стани, асоційовані з ВІЛ і іншими патогенними ретровірусами, включають СНІД, СНІДпов'язаний комплекс (ARC), прогресуючу генералізовану лімфаденопатію (PGL), а також хронічні захворювання центральної нервової системи, викликані ретровірусами, такі як, наприклад, ВІЛопосередковане слабоумство і розсіяний склероз. Отже, сполуки формули (І), (l-а) або (l-b) можна застосовувати як лікарський засіб. Таким чином, сполуки за даним винаходом можна використовувати як лікарські засоби проти зазначених вище станів. Зазначене застосування як лікарського засобу або спосіб лікування включає введення ВІЛ-інфікованим суб'єктам кількості, ефективної для лікування станів, асоційованих з ВІЛ і іншими патогенними ретровірусами, головним чином, із ВІЛ-1. Зокрема, дані сполуки можна використовувати у виробництві лікарського засобу для лікування або профілактики ВІЛ-інфекцій, переважно для лікування ВІЛ-інфекцій. З урахуванням корисності даних сполук, забезпечений також спосіб лікування ссавців, включаючи людей, або спосіб профілактики теплокров 13 них ссавців, включаючи людей, що страждають від вірусних інфекцій, особливо, від ВІЛ-інфекцій. Зазначений спосіб включає введення, переважно пероральне введення, ссавцю, включаючи людей, ефективної кількості солі за даним винаходом. Завдяки більш високій біодоступності даних сполук у порівнянні з відповідною вільною основою, можна одержати терапевтично ефективні рівні в плазмі при введенні фармацевтичної композиції, що містить меншу кількість солі в порівнянні з необхідною кількістю відповідної вільної основи. Отже, можна зменшити розмір фармацевтичної композиції або знизити частоту дозування. Таким чином, даний винахід також відноситься до фармацевтичної композиції, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки формули (І), (l-а) або (I-b). Даний винахід також відноситься до фармацевтичної композиції, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки формули (І), (lа) або (I-b), за умови, що композиція не містить ні емтрицитабіну, ні тенофовірдіізопроксилфумарату. Зокрема, даний винахід також відноситься до фармацевтичної композиції, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки формули (І), (l-а) або (l-b), за умови, що композиція не містить одного або декількох нуклеозидних інгібіторів зворотної транскриптази і/або одного або декількох нуклеотидних інгібіторів зворотної транскриптази. Для цілей введення дані сполуки формули (І), (l-а) або (I-b) можна приготувати у вигляді різноманітних фармацевтичних композицій. Як підходящі композиції можна вказати всі композиції, що звичайно використовуються для системного прийому ліків. Для одержання фармацевтичних композицій за даним винаходом ефективну кількість сполуки формули (І), (l-а) або (I-b) як активний інгредієнт поєднують у гомогенну суміш з фармацевтично прийнятним носієм, причому зазначений носій може приймати різноманітні форми в залежності від форми препарату, бажаної для введення. Дані фармацевтичні композиції бажано виготовляти в стандартному дозованому вигляді, що підходить, зокрема, для перорального прийому. Наприклад, при одержанні композицій у вигляді дозованої форми для перорального прийому можна використовувати будь-яке зі звичайних фармацевтичних середовищ, наприклад, воду, гліколі, олії, спирти і подібні, у випадку рідких препаратів для перорального прийому, таких як суспензії, сиропи, еліксири, емульсії і розчини; або тверді носії, такі як крохмалі, цукри, каолін, розріджувачі, лубриканти, зв'язуючі речовини, розпушувачі і подібні у випадку порошків, пігулок, капсул і таблеток. Завдяки простоті введення таблетки і капсули являють собою найбільш переважні стандартні дозовані форми для перорального прийому, в яких, мабуть, використовують тверді фармацевтичні носії. Носій для парентеральних композицій звичайно включає стерильну воду, щонайменше, велику частину, хоча можна включати інші інгредієнти, наприклад, 92467 14 для сприяння розчинності. Наприклад, можна приготувати розчини для ін'єкцій, в яких носій включає фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину і розчину глюкози. Можна також приготувати суспензії для ін'єкцій, в яких можна використовувати підходящі рідкі носії, суспендуючі агенти і подібні. Включені також препарати у вигляді твердих форм, що призначені для перетворення в рідкі форми незадовго до використання. У композиціях, що підходять для крізьшкірного введення, носій необов'язково включає агент, що збільшує проникання, і/або підходящий зволожуючий агент, необов'язково об'єднані з підходящими добавками будь-якої природи при незначному змісті, причому зазначені добавки не здійснюють істотного шкідливого ефекту на шкіру. Зазначені добавки можуть сприяти введенню в шкіру і/або можуть бути корисні для одержання необхідних композицій. Дані композиції можна вводити різними способами, наприклад, за допомогою трансдермального пластиру, крапкового нанесення, у вигляді мазі. Солі за даним винаходом також можна вводити за допомогою інгаляції або інсуфляції, застосовуючи методи і препарати, що використовуються в даній галузі для введення даним способом. Таким чином, взагалі, солі за даним винаходом можна вводити в легені у вигляді розчину, суспензії або сухого порошку. Будь-яка система, розроблена для доставки розчинів, суспензій або сухих порошків за допомогою пероральної або носової інгаляції або інсуфляції, підходить для введення даних сполук. Сполуки за даним винаходом можна також вводити місцево у вигляді крапель, зокрема, очних крапель. Зазначені очні краплі можуть знаходитися у вигляді розчину або суспензії. Будь-яка система, розроблена для доставки розчинів або суспензій, така як очні краплі, підходить для введення даних сполук. WO 2004/069812, що включена в дану заявку у вигляді посилання, описує здатність похідних піримідину, серед яких 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил і його фармацевтично прийнятні солі, запобігати ВІЛ-інфекції при статевих зносинах або інтимному контакті між партнерами. Таким чином, даний винахід також відноситься до фармацевтичної композиції у вигляді, адаптованому для застосування в тому місці, де можуть мати місце статеві зносини або інтимний контакт, такому як геніталії, пряма кишка, рот, руки, низ живота, верх стегон, особливо, піхва і рот, що містить фармацевтично прийнятний носій і як активний інгредієнт ефективну кількість сполуки формули (І), (l-а) або (I-b). Зокрема, даний винахід також відноситься до фармацевтичної композиції у вигляді, адаптованому для застосування в місці, де можуть мати місце статеві зносини або інтимний контакт, такому як геніталії, пряма кишка, рот, руки, низ живота, верх стегон, особливо, піхва і рот, що містить фармацевтично прийнятний носій і як активний інгредієнт ефективну кількість сполуки формули (І), (l-а) або (I-b) за умови, що композиція не містить ні емтрицитабіну, ні тенофовірдіізопроксилфумарату. Більш конкретно, даний винахід також відноситься 15 до фармацевтичної композиції у вигляді, адаптованому для застосування в місці, де можуть мати місце статеві зносини або інтимний контакт, такому як геніталії, пряма кишка, рот, руки, низ живота, верх стегон, особливо, піхва і рот, що містить фармацевтично прийнятний носій і як активний інгредієнт ефективну кількість сполуки формули (І), (l-а) або (I-b) за умови, що композиція не містить один або декілька нуклеозидних інгібіторів зворотної транскриптази і/або один або декілька нуклеотидних інгібіторів зворотної транскриптази. Як підходящі спеціально адаптовані композиції можна вказати всі композиції, які звичайно використовуються в піхві, прямій кишці, у роті і на шкірі, такі як, наприклад, гелі, желе, креми, мазі, плівки, губки, піни, внутрішньопіхвові кільця, цервікальні ковпачки, супозиторії для ректального або піхвового застосування, піхвові, ректальні або букальні таблетки, полоскання для рота. Для одержання таких фармацевтичних композицій ефективну кількість активного інгредієнта поєднують у гомогенну суміш з фармацевтично прийнятним носієм, причому зазначений носій може мати різні форми в залежності від форми введення. Для збільшення часу утримання такої фармацевтичної композиції на місці застосування може бути корисно включити в композицію біоадгезійний агент, зокрема, біоадгезійний полімер. Біоадгезійний агент можна визначити як матеріал, що прилипає до живої біологічної поверхні, такої як, наприклад, слизувата мембрана або тканина шкіри. Таким чином, даний винахід також відноситься до фармацевтичної композиції, що містить фармацевтично прийнятний носій і як активний інгредієнт ефективну кількість сполуки формули (І), (l-а) або (I-b), що характеризується тим, що дана фармацевтична композиція є біоадгезійною щодо місця застосування. Переважним місцем застосування є піхва, пряма кишка, рот або шкіра, найбільш переважним є піхва. Зокрема, даний винахід також відноситься до фармацевтичної композиції, що містить фармацевтично прийнятний носій і як активний інгредієнт ефективну кількість сполуки формули (І), (l-а) або (I-b), що характеризується тим, що дана фармацевтична композиція є біоадгезійною щодо місця застосування, за умови, що композиція не містить ні емтрицитабіну, ні тенофовірдіізопроксилфумарату. Більш конкретно, даний винахід також відноситься до фармацевтичної композиції, що містить фармацевтично прийнятний носій і як активний інгредієнт ефективну кількість сполуки формули (І), (l-а) або (I-b), що характеризується тим, що дана фармацевтична композиція є біоадгезійною щодо місця застосування, за умови, що композиція не включає один або декілька нуклеозидних інгібіторів зворотної транскриптази і/або один або декілька нуклеотидних інгібіторів зворотної транс криптази. Особливо корисно виготовляти зазначені вище фармацевтичні композиції у вигляді стандартної дозованої форми для простоти введення та однорідності дозування. Як використовується в даній заявці, стандартна дозована форма представляє фізично дискретні одиниці, що підходять як разові дози, причому кожна одиниця містить 92467 16 попередньо визначену кількість активного інгредієнта, розраховану таким чином, щоб здійснювати бажаний терапевтичний ефект, в поєднанні з необхідним фармацевтичним носієм. Прикладами таких стандартних дозованих форм є таблетки (включаючи таблетки з насічкою або таблетки з оболонкою), капсули, пігулки, пакетики з порошками, пластинки, супозиторії, розчини або суспензії для ін'єкцій і подібні, і їх різновиди. Точне дозування і частота введення залежать від конкретного стану, що підлягає лікуванню, важкості стану, що підлягає лікуванню, віку, ваги, статі, ступеня захворювання і загального фізичного стану конкретного пацієнта, а також від іншого лікування, що може мати індивідуум, що добре відоме фахівцям у даній галузі. Крім того, очевидно, що зазначена ефективна щоденна кількість може бути зменшена або збільшена в залежності від реакції суб'єкта, якого лікують, і/або в залежності від оцінки лікаря, що прописує сполуки за даним винаходом. Пацієнти можуть приймати фармацевтичні композиції за даним винаходом в будь-яку годину дня незалежно від прийому їжі. Переважно приймати дані композиції на після прийому їжі. Переважний варіант даного винаходу відноситься до пероральної фармацевтичної композиції, тобто фармацевтичної композиції, що підходить для перорального введення, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки формули (І), (I-a) або (I-b). Зокрема, даний винахід відноситься до пероральної фармацевтичної композиції, тобто фармацевтичної композиції, що підходить для перорального введення, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки формули (l), (I-a) або (I-b), за умови, що композиція не містить ні емтрицитабіну, ні тенофовірдіізопроксилфумарату; більш конкретно, фармацевтичної композиції, що підходить для перорального введення, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки формули (І), (Ia) або (I-b), за умови, що композиція не включає один або декілька нуклеозидних інгібіторів зворотної транскриптази і/або один або декілька нуклеотидних інгібіторів зворотної транскриптази. Зокрема, пероральна фармацевтична композиція являє собою тверду фармацевтичну композицію для перорального прийому, більш конкретно, таблетку або капсулу, ще більш конкретно, таблетку. Згідно з даним винаходом таблетку можна приготувати у формі таблетки для прийому один раз на день. Переважно, щоб фармацевтичні композиції за даним винаходом містили такі кількості сполуки формули (І), (I-a) або (I-b), що еквівалентні приблизно 5-500мг відповідної вільної основи 4-[[4-[[4(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрилу, його Е- або Zізомеру, більш переважно приблизно 10-250мг відповідної вільної основи, ще більш переважно приблизно 20-200мг відповідної вільної основи. Переважно, щоб дані фармацевтичні композиції 17 містили такі кількості сполуки формули (І), (I-a) або (I-b), що еквівалентні 25мг, 50мг, 75мг, 100мг або 150мг відповідної вільної основи (осн. екв.). Як використовується в даній заявці вище або далі, вираз "приблизно" відносно чисельних значень х означає, наприклад, х±10%. Розмір часток сполуки формули (І), (I-a) або (Ib) переважно складає менше 50мкл, більш переважно менше 25мкм, ще більш переважно менше 20мкм. Більш переважним є розмір часток приблизно 15мкм або менше, або приблизно 12мкм або менше, або приблизно 10мкм або менше, або приблизно 5мкм або менше. Найбільш переважний розмір часток знаходиться у діапазоні від приблизно 0,2 до приблизно 15мкм або від приблизно 0,2 до приблизно 10мкм. Фармацевтичні композиції за даним винаходом переважно включають зволожуючий агент. Що стосується зволожуючого агента, у композиціях за даним винаходом можна використовувати будьякий з фізіологічно припустимих зволожуючих агентів, що підходять для використання у фармацевтичній композиції. У даній галузі добре відомо, що зволожуючий агент є амфіфільною сполукою; він містить полярні гідрофільні фрагменти, а також неполярні гідрофобні фрагменти. Терміни "гідрофільний" або "гідрофобний" є відносними. Відносну гідрофільність або гідрофобність зволожуючого агента можна виразити його значенням гідрофільно-ліпофільного балансу (значенням HLB). Зволожуючі агенти з низьким значенням HLB категоризовані як "гідрофобні" зволожуючі агенти, тоді як зволожуючі агенти з високим значенням HLB категоризовані як "гідрофільні" зволожуючі агенти. Емпіричним правилом є: зволожуючі агенти, що мають значення HLB більше приблизно 10, звичайно вважаються гідрофільними зволожуючими агентами; зволожуючі агенти, що мають значення HLB нижче приблизно 10, звичайно вважаються гідрофобними зволожуючими агентами. Дані композиції переважно містять гідрофільний зволожуючий агент. Варто брати до уваги, що значення HLB зволожуючого агента є тільки грубим показником гідрофільності/гідрофобності зволожуючого агента. Значення HLB конкретного зволожуючого агента може змінюватися в залежності від способу визначення HLB; може змінюватися в залежності від його комерційного джерела; змінюватися від партії до партії. Фахівець у даній галузі може легко ідентифікувати гідрофільні зволожуючі агенти, що підходять для використання у фармацевтичних композиціях за даним винаходом. Зволожуючий агент за даним винаходом може бути аніонним, катіонним, цвітеріонним або неіонним зволожуючим агентом, останній є переважним. Зволожуючий агент за даним винаходом також може являти собою суміш двох або більше зволожуючих агентів. Підходящі зволожуючі агенти для використання в композиціях за даним винаходом перераховані нижче. Варто підкреслити, що зазначений список зволожуючих агентів є тільки ілюстратив 92467 18 ним, характерним і невичерпним. Таким чином, винахід не обмежений зволожуючими агентами, перерахованими нижче. У даних композиціях можна також використовувати суміші зволожуючих агентів. Підходящі зволожуючі агенти, які можна використовувати в даному винаході, включають a) моноефіри поліетиленгліколю і жирних кислот, включаючи ефіри лауринової кислоти, олеїнової кислоти, стеаринової кислоти, рицинолевої кислоти і подібних з PEG 6, 7, 8, 9, 10, 12, 15, 20, 25, 30, 32, 40, 45, 50, 55, 100, 200, 300, 400, 600 і подібними, наприклад, PEG-6 лаурат або стеарат, PEG-7 олеат або лаурат, PEG-8 лаурат, або олеат, або стеарат, PEG-9 олеат або стеарат, PEG-10 лаурат, або олеат, або стеарат, PEG-12 лаурат, або олеат, або стеарат, або рицинолеат, PEG-15 стеарат або олеат, PEG-20 лаурат, або олеат, або стеарат, PEG-25 стеарат, PEG-32 лаурат, або олеат, або стеарат, PEG-30 стеарат, PEG-40 лаурат, або олеат, або стеарат, PEG-45 стеарат, PEG-50 стеарат, PEG-55 стеарат, PEG-100 олеат або стеарат, PEG-200 олеат, PEG-400 олеат, PEG600 олеат (зволожуючі агенти, що належать до даної групи, відомі, наприклад, як Cithrol, Algon, Kessco, Lauridac, Mapeg, Cremophor, Emulgante, Nikkol, Myrj, Crodet, Albunol, Lactomul); b) діефіри поліетиленгліколю і жирних кислот, що включають діефіри лауринової кислоти, стеаринової кислоти, пальмітинової кислоти, олеїнової кислоти і подібних з PEG-8, 10, 12, 20, 32, 400 і подібними, наприклад, PEG-8 дилаурат або дистеарат, PEG-10 дипальмітат, PEG-12 дилаурат, або дистеарат, або діолеат, PEG-20 дилаурат, або дистеарат, або діолеат, PEG-32 дилаурат, або дистеарат, або діолеат, PEG-400 діолеат або дистеарат (зволожуючі агенти, що належать до даної групи, відомі, наприклад, як Mapeg, Polyalso, Kessco, Cithrol); c) суміші моно- і діефірів поліетиленгліколю і жирних кислот, такі як, наприклад, PEG 4-150 моно- і дилаурат, PEG 4-150 моно- і діолеат, PEG 4150 моно- і дистеарат і подібні (зволожуючі агенти, що належать до даної групи, відомі, наприклад, як Kessco); d) поліетиленглікольгліцеринові ефіри жирних кислот, такі як, наприклад, PEG-20 гліцериллаурат, або гліцерилстеарат, або гліцерил олеат, PEG-30 гліцериллаурат або гліцерилолеат, PEG15 гліцериллаурат, PEG-40 гліцериллаурат і подібні (зволожуючі агенти, що належать до даної групи, відомі, наприклад, як Tagat, Glycerox L, Capmul); є) продукти трансетерифікації спирт-масло, що включають складні ефіри спиртів або поліспиртів, таких як гліцерин, пропіленгліколь, етиленгліколь, поліетиленгліколь, сорбіт, пентаеритрит і подібні, із природними і/або гідрогенізованими маслами або розчинними в маслах вітамінами, такими як касторова олія, гідрогенізована касторова олія, вітамін А, вітамін D, вітамін Е, вітамін K, харчова рослинна олія, наприклад, кукурудзяне олія, маслинова олія, арахісова олія, кісточкова пальмова олія, кісточкова абрикосова олія, мигдальна олія і подібні, наприклад, PEG-20 - касторова олія, 19 або гідрогенізована касторова олія, або гліцериди кукурудзяної олії, або гліцериди мигдальної олії, PEG-23 - касторова олія, PEG-25 - гідрогенізована касторова олія або триолеат, PEG-35 - касторова олія, PEG-30 - касторова олія або гідрогенізована касторова олія, PEG-38 - касторова олія, PEG-40 касторова олія, або гідрогенізована касторова олія, або кісточкова пальмова олія, PEG-45 - гідрогенізована касторова олія, PEG-50 - касторова олія або гідрогенізована касторова олія, PEG-56 касторова олія, PEG-60 - касторова олія, або гідрогенізована касторова олія, або гліцериди кукурудзяної олії, або гліцериди мигдальної олії, PEG80 - гідрогенізована касторова олія, PEG-100 - касторова олія або гідрогенізована касторова олія, PEG-200 - касторова олія, PEG-8 - каприлові/капринові гліцериди, PEG-6 каприлові/капринові гліцериди, лауроїлмакрогол-32 гліцерид, стеароїлмакроголгліцерид, токоферил PEG1000 сукцинат (TPGS) (зволожуючі агенти, що належать до даної групи, відомі, наприклад, як Emalex, Cremophor, Emulgante, Eumulgin, Nikkol, Thornley, Simulsol, Cerex, Crovol, Labrasol, Softigen, Gelucire, Вітамін Е TPGS); f) полігліцеридні похідні жирних кислот, включаючи ефіри полігліцерину і жирних кислот, такі як, наприклад, полі гліцерил-10 лаурат, або олеат, або стеарат, полігліцерил-10 моно- і діолеат, полігліцерилполірицинолеат і подібні (зволожуючі агенти, що належать до даної групи, відомі, наприклад, як Nikkol Decaglyn, Caprol або Polymuls); g) похідні стерину, що включають поліетиленглікольні похідні стерину, такі як PEG-24 холестериновий ефір, PEG- 30 холестанол, PEG-25 фітостерин, PEG-30 соєвий стерин і подібні (зволожуючі агенти, що належать до даної трупи, відомі, наприклад, як Solulan™ або Nikkol BPSH); h) ефіри поліетиленглікольсорбітану і жирних кислот, такі як, наприклад, PEG-10 сорбітанлаурат, PEG-20 сорбітанмонолаурат, або сорбітантристеарат, або сорбітанмоноолеат, або сорбітантриолеат, або сорбітанмоноізостеарат, або сорбітанмонопальміат, або сорбітанмоностеарат, PEG-4 сорбітанмонолаурат, PEG-5 сорбітанмоноолеат, PEG-6 сорбітанмоноолеат, або сорбітанмонолаурат, або сорбітанмоностеарат, PEG-8 сорбітанмоностеарат, PEG-30 сорбітантетраолеат, PEG-40 сорбітанолеат або сорбітантетраолеат, PEG-60 сорбітантетрастеарат, PEG-80 сорбітанмонолаурат, PEG сорбітгексаолеат (Atlas G-1086) і подібні (зволожуючі агенти, що належать до даної групи, відомі, наприклад, як Liposorb, Tween, Dacol MSS, Nikkol, Emalex, Atlas); і) поліетиленглікольалкілові ефіри, такі як, наприклад, PEG-10 олеїловий ефір, або цетиловий ефір, або стеариловий ефір, PEG-20 олеїловий ефір, або цетиловий ефір, або стеариловий ефір, PEG-9 лауриловий ефір, PEG-23 лауриловий ефір (laureth-23), PEG-100 стеариловий ефір і подібні (зволожуючі агенти, що належать до даної групи, відомі, наприклад, як Volpo, Brij); j) складні ефіри цукрів, такі як, наприклад, дистеарат/моностеарат сахарози, моностеарат, або монопальмітат, або монолаурат сахарози і подібні (зволожуючі агенти, що належать до даної групи, 92467 20 відомі, наприклад, як ефір Sucro, Crodesta, монолаурат сахарози); k) поліетиленглікольалкілфеноли, такі як, наприклад, PEG-10-100 нонілфенол (серії Triton X), PEG-15-100 октилфеноловий ефір (серії Triton N) і подібні; l) блоккополімери поліоксіетиленполіоксипропілен (полоксамери), такі як, наприклад, полоксамер 108, полоксамер 188, полоксамер 237, полоксамер 288 і подібні (зволожуючі агенти, що належать до даної групи, відомі, наприклад, як Synperonic РЕ, Pluronic, Emkalyx, Lutrol™, Supronic, Monolan, Pluracare, Plurodac); m) іонні зволожуючі агенти, включаючи катіонні, аніонні і цвітеріонні поверхнево-активні речовини, такі як солі жирних кислот, наприклад, олеат натрію, лаурилсульфат натрію, лаурилсаркозинат натрію, діоктилсульфосукцинат натрію, міристат натрію, пальмітат натрію, стеарат натрію, рицинолеат натрію і подібні; такі як жовчні солі, наприклад, холат натрію, таурохолат натрію, глікохолат натрію і подібні; такі як фосфоліпіди, наприклад, яєчний/соєвий лецитин, гідроксильований лецитин, лізофосфатидилхолін, фосфатидилхолін, фосфатидилетаноламін, фосфатидилгліцерин, фосфатидилсерин і подібні; такі як складні ефіри фосфорної кислоти, наприклад, фосфат діетаноламонійполіоксіетилен-10 олеїлового ефіру, продукти етерифікації жирних спиртів або етоксилатів жирних спиртів фосфорною кислотою або фосфорним ангідридом; такі як карбоксилати, наприклад, сукцинільовані моногліцериди, стеарилфумарат натрію, стеароїлпропіленгліколь гідросукцинат, моно/діацетильовані складні ефіри винної кислоти та моно- і дигліцеридів, складні ефіри лимонної кислоти та моно- і дигліцеридів, гліцериллактоефіри жирних кислот, лактильні ефіри жирних кислот, стеароїл-2-лактилат кальцію/натрію, стеароїллактилат кальцію/натрію, солі альгінати, пропіленглікольальгінат, (простий ефір) карбоксилати і подібні; такі як сульфати і сульфонати, наприклад, етоксильовані алкілсульфати, алкілбензолсульфати, альфаолефінсульфонати, ацилізетіонати, ацилтаурати, алкілгліцериловий ефір сульфонати, динатрійоктилсульфосукцинат, динатрійундециленамідо-МЕА-сульфосукцинат і подібні; такі як катіонні зволожуючі агенти, наприклад, гексадецилтриамонійбромід, децилтриметиламонійбромід, цетилтриметиламонійбромід, додециламонійхлорид, солі алкілбензилдиметиламонію, солі діізобутилфеноксіетоксидиметилбензиламонію, солі алкілпіридинію, бетаїни (лаурилбетаїн), етоксильовані аміни (поліоксиетилен-15 кокосовий амін) і подібні. Якщо в приведеному вище списку підходящих зволожуючих агентів перераховані різні можливості, наприклад, PEG-20 олеїловий ефір, або цетиловий ефір, або стеариловий ефір, це означає, що мається на увазі PEG-20 олеїловий ефір, і PEG-20 цетиловий ефір, і PEG-20 стеариловий ефір. Таким чином, наприклад, вираз «PEG-20 - касторова олія, або гідрогенізована касторова олія, або гліцериди кукурудзяної олії, або гліцериди мигдальної олії» варто тлумачити як «PEG-20 - касторова олія, і PEG-20 - гідрогенізована касторова олія, і 21 PEG-20 - гліцериди кукурудзяної олії, і PEG-20 гліцериди мигдальної олії». Переважними зволожуючими агентами в даних композиціях є лаурилсульфат натрію, діоктилсульфосукцинат натрію або таких зволожуючих агентів, що належать до групи ефірів поліетиленглікольсорбітану і жирних кислот, наприклад, зволожуючі агенти, відомі як Tween, наприклад, Tween 20, 60, 80. Найбільш переважним зволожуючим агентом є Tween 20. У композиціях за даним винаходом зволожуючий агент переважно присутній при концентрації від приблизно 0,01 до приблизно 5% мас. щодо загальної маси композиції, переважно від приблизно 0,1 до приблизно 3% мас, більш переважно від приблизно 0,1 до приблизно 1% мас. Кількість зволожуючого агента, що використовується в даних композиціях, може залежати від кількості присутньої в композиції сполуки формули (l), (I-a) або (l-b) або від розміру часток сполуки формули (l), (Ia) або (I-b). Більша кількість або менший розмір часток можуть потребувати більше зволожуючого агента. Згідно з даним винаходом, у випадку твердої фармацевтичної композиції для перорального прийому, такої як таблетка або капсула, композиція може також додатково містити органічний полімер. Органічний полімер можна використовувати у виробництві композиції як зв'язуючу речовину. Органічний полімер, що використовується в композиціях за даним винаходом, може бути будьяким з фізіологічно прийнятних водорозчинних синтетичних, напівсинтетичних або несинтетичних органічних полімерів. Таким чином, полімер може бути, наприклад, природним полімером, таким як полісахарид або поліпептид або їх похідні, або синтетичним полімером, таким як поліалкіленоксид (наприклад, PEG), поліакрилат, полівінілпіролідон і ін. Звичайно, можна також використовувати змішані полімери, наприклад, блоккополімери і глікопептиди. Зручно, якщо полімер має молекулярну масу в діапазоні від 500Да до 2МДа, і структурну в'язкість від 1 до 15000мПа.с у 2% водному розчині при 20°С. Наприклад, можна вибрати водорозчинний полімер із групи, що включає - алкілцелюлози, наприклад, метилцелюлозу, - гідроксіалкілцелюлози, наприклад, гідроксиметилцелюлозу, гідроксіетилцелюлозу, гідроксипропілцелюлозу і гідроксибутилцелюлозу, - гідроксіалкілалкілцелюлози, наприклад, гідроксіетилметилцелюлозу і гідроксипропілметилцелюлозу (наприклад, НРМС 2910 15мПа.с; НРМС 2910 5мПа.с), - карбоксіалкілцелюлози, наприклад, карбоксиметилцелюлозу, - солі лужних металів і карбоксіалкілцелюлози, наприклад, натрій-карбоксиметилцелюлозу, - карбоксіалкілалкілцелюлози, наприклад, карбоксиметилетилцелюлозу, - складні ефіри карбоксіалкілцелюлози, - крохмалі, наприклад, крохмаль 1551, пектини, наприклад, натрійкарбоксиметиламілопектин, 92467 22 - похідні хітину, наприклад, хітозан, - гепарин і гепариноїди, - полісахариди, наприклад, альгінову кислоту, її солі з лужними металами й амонієм, - карагенани, галактоманани, трагакант, агарагар, аравійську камедь, гуаровусмолу і ксантановусмолу, - поліакрилові кислоти і їх солі, - поліметакрилові кислоти і їх солі, метакрилатні кополімери, - полівініловий спирт, - полівінілпіролідон, кополімери полівінілпіролідону з вінілацетатом, - поліалкіленоксиди, наприклад, поліетиленоксид і поліпропіленоксид, і кополімери етиленоксиду і пропіленоксиду, наприклад, полоксамери і полоксаміни. Для приготування композицій за даним винаходом також підходять полімери, що не були перераховані, які є фармацевтично прийнятними і мають підходящі фізико-хімічні властивості, що визначені в даній заявці вище. Переважними органічними полімерами є крохмаль, полівінілпіролідон або прості ефіри целюлози, наприклад, PVP K29-32, PVP K90, метилцелюлоза, гідроксипропілцелюлоза, гідроксіетилметилцелюлоза або гідроксипропілметилцелюлоза(НРМС). Зазначена НРМС містить достатню кількість гідроксипропільних і метоксигруп для забезпечення розчинності у воді. НРМС, що мають ступінь метоксизаміщення від приблизно 0,8 до приблизно 2,5 і молярного гідроксипропілзаміщення від приблизно 0,05 до приблизно 3,0, звичайно є водорозчинними. Ступінь метоксизаміщення вказує середнє число метилефірних груп, що є присутніми на ангідроглюкозних ланках молекули целюлози. Молярне гідроксипропілзаміщення вказує середнє число молів пропіленоксиду, що прореагували з кожною ангідроглюкозною ланкою молекули целюлози. Переважною НРМС є гіпромелоза 2910 15мПа.с або гіпромелоза 2910 5мПа.с, особливо, гіпромелоза 2910 15мПа.с. Гідроксипропілметилцелюлоза - це прийнята в США назва для гіпромелози (див. Martindale, The Extra Pharmacopoeia, 29th edition, page 1435). У чотиризначному номері "2910" перші дві цифри представляють приблизний процентний вміст метоксигруп, а третя і четверта цифри представляють приблизний процентний вміст гідроксипропоксигруп; 15мПа.с або 5мПа.с є показниками структурної в'язкості 2% водного розчину при 20°С. У підходящих композиціях за даним винаходом органічний полімер може бути присутній у кількості приблизно до 10% мас, переважно від приблизно 0,1 до приблизно 5%, більш перевалено від приблизно 0,5 до приблизно 3% мас. (щодо загальної маси композиції). Згідно з даним винаходом, у випадку твердої фармацевтичної композиції для перорального прийому, такої як таблетка або капсула, композиція може також додатково містити розріджувач і/або глідант. Фармацевтично прийнятні розріджувачі включають карбонат кальцію, двоосновний фосфат 23 кальцію, дигідрат двоосновного фосфату кальцію, триосновний фосфат кальцію, сульфат кальцію, мікрокристалічну целюлозу, у тому числі силіцифіковану мікрокристалічну целюлозу, порошкоподібну целюлозу, декстрати, декстрин, декстрозний наповнювач, фруктозу, каолін, лактитол, безводну лактозу, моногідрат лактози, маніт, сорбіт, крохмаль, попередньо желатинізований крохмаль, хлорид натрію, сахарозу, пресований цукор, цукрову глазур, висушену розпиленням суміш моногідрату лактози і мікрокристалічної целюлози (75:25), доступну комерційно як Microcelac®, спільно оброблену висушену розпиленням суміш мікрокристалічної целюлози і колоїдного діоксиду кремнію (98:2), доступну комерційно як Prosolv®. Переважними є моногідрат лактози, мікрокристалічна целюлоза або силіцифікована мікрокристалічна целюлоза. Фармацевтично прийнятні гліданти включають тальк, колоїдний діоксид кремнію, крохмаль, стеарат магнію. Переважним є колоїдний діоксид кремнію. У випадку таблеток, композиція може також додатково містити розпушувач і лубрикант. Фармацевтично прийнятні розпушувачі включають крохмаль, іонообмінні смоли, наприклад, Amberlite, зшитий полівінілпіролідон, модифіковану целюлознусмолу, наприклад, натрійкроскармелозу (наприклад, Ac-di-Sol®), натрійкрохмальгліколат, натрій-карбоксиметилцелюлозу, додецилсульфат натрію, модифікований кукурудзяний крохмаль, мікрокристалічну целюлозу, магнійалюмінійсилікат, альгінову кислоту, альгінат, порошкоподібну целюлозу. Фармацевтично прийнятні лубриканти включають стеарат магнію, стеарат кальцію, стеаринову кислоту, тальк, поліетиленгліколь, лаурилсульфат натрію, лаурилсульфат магнію. Крім того, таблетки за даним винаходом можуть включати інші необов'язкові наповнювачі, такі як, наприклад, ароматизатори, подсолоджувачі і барвники. Тверді фармацевтичні композиції відповідно до даного винаходу можуть включати на масу, базуючись на загальній масі композиції: (a) від 5 до 50% сполуки формули (І), (I-a) або (I-b); (b) від 0,01 до 5% зволожуючого агента; (c) від 40 до 92% розріджувача: (d) від 0,1 до 5% гліданта. Таблетки відповідно до даного винаходу можуть включати на масу, базуючись на загальній масі композиції: (a) від 5 до 50% сполуки формули (І), (I-a) або (I-b); (b) від 0,01 до 5% зволожуючого агента; (c) від 40 до 92% розріджувача; (d) від 0 до 10% полімеру; (e) від 2 до 10% розпушувача; (f) від 0,1 до 5% гліданта; (g) від 0,1 до 1,5% лубриканта. На таблетки за даним винаходом необов'язково можна нанести плівкове покриття, слідуючи відомим у даній галузі методикам нанесення покриття. Таблетки з плівковим покриттям легше ков 92467 24 тати, ніж непокриті ядра таблеток, звичайно їх легше відрізнити від інших таблеток (зокрема, якщо плівкові покриття містять барвник або пігмент), вони можуть мати знижену липкість і, крім того, мати підвищену стабільність (збільшений термін зберігання), наприклад, завдяки тому, що покриття може захищати активний інгредієнт від впливу світла. Переважно, щоб плівкове покриття являло собою покриття для швидкого вивільнення. Плівкові покриття можуть включати плівкоутворюючий полімер і необов'язково пластифікатор або пігмент. Прикладом підходящого плівкоутворюючого полімеру є гідроксипропілметилцелюлоза, і прикладом підходящого пластифікатора є полі етиленгліколь, наприклад, макрогол 3000 або 6000 або триацетин. Комерційно доступні підходящі покриття для фармацевтичних таблеток добре відомі фахівцю в даній галузі. Переважно, щоб плівкове покриття було непрозорим плівковим покриттям. Прикладом підходящого покриття є Opadry®, зокрема, порошкове покриття Opadry® II White. Таблетки за даним винаходом можна одержати прямим пресуванням або вологим гранулюванням. Таким чином, даний винахід відноситься також до способу одержання таблетки, що містить сполуку формули (І), (I-a) або (I-b), що включає наступні стадії: (і) сухе перемішування активного інгредієнта, розпушувача і необов'язкового гліданта з розріджувачем; (іі) необов'язкове змішування лубриканта із сумішшю, отриманою на стадії (і); (ііі) пресування таблеток із суміші, отриманої на стадії (і) або на стадії (іі), у сухому стані; і (iv) необов'язкове нанесення плівкового покриття на таблетку, отриману на стадії (ііі). Даний винахід також відноситься до способу одержання таблетки, що містить сполуку формули (l), (I-a) або (I-b), що включає наступні стадії: (і) сухе перемішування активного інгредієнта і частини розріджувача; (іі) одержання сполучного розчину за допомогою розчинення зв'язуючого і зволожуючого агента в розчиннику для сполучного розчину; (ііі) розпилення сполучного розчину, отриманого на стадії (іі), на суміш, отриману на стадії (і); (iv) сушіння вологого порошку, отриманого на стадії (ііі), з наступним просіванням і необов'язковим перемішуванням; (v) змішування частини розріджувача, що залишилася, розпушувача і необов'язкового гліданта із сумішшю, отриманою на стадії (iv); (vi) необов'язкове додавання лубриканта до суміші, отриманої на стадії (v); (vii) пресування таблеток із суміші, отриманої на стадії (vi); (viii) необов'язкове нанесення плівкового покриття на таблетку, отриману на стадії (vii). Фахівець у даній галузі розпізнає найбільш підходяще устаткування, яке варто використовувати для описаних вище способів. Фахівець у даній галузі може модифікувати описаний вище загальний спосіб одержання таблеток за даним винаходом, 25 наприклад, додаючи деякі інгредієнти на інших стадіях, ніж вказані вище. Дану сполуку формули (l), (I-a) або (I-b) можна використовувати саму по собі або в комбінації з іншими терапевтичними агентами, такими як антивірусні агенти, антибіотики, імуномодулятори або вакцини для лікування вірусних інфекцій. Їх можна також використовувати самі по собі або в комбінації з іншими профілактичними агентами для профілактики вірусних інфекцій. Дані сполуки можна використовувати у вакцинах і способах для захисту індивідуумів від вірусних інфекцій протягом тривалого періоду часу. Сполуки можна використовувати в таких вакцинах самі по собі або разом з іншими антивірусними агентами способом, що узгоджується зі звичайним застосуванням інгібіторів зворотної транскриптази у вакцинах. Таким чином, дані сполуки можна поєднувати з фармацевтично прийнятними ад'ювантами, що звичайно використовуються у вакцинах, і вводити в профілактично ефективних кількостях для захисту індивідуумів протягом тривалого періоду часу від ВІЛінфекції. Також можна використовувати як лікарський засіб комбінацію антиретровірусної сполуки і сполуки формули (І), (I-a) або (I-b). Таким чином, даний винахід відноситься також до продукту, що містить (а) сполуку формули (І), (I-a) або (I-b) і (b) одну або декілька інших антиретровірусних сполук, як комбінований препарат для одночасного, роздільного або послідовного застосування при антиВІЛ-лікуванні. Різні ліки можна поєднувати в єдиному препараті разом з фармацевтично прийнятними носіями. Таким чином, даний винахід також відноситься до фармацевтичної композиції, що містить фармацевтично прийнятний носій, (а) терапевтично ефективну кількість сполуки формули (І), (I-a) або (I-b) і (b) один або декілька антиретровірусних агентів. Зокрема, даний винахід відноситься також до продукту, що містить (а) сполуку формули (І), (I-a) або (I-b), і (b) одну або декілька інших антиретровірусних сполук, у вигляді комбінованого препарату для одночасного, роздільного або послідовного застосування при анти-ВІЛлікуванні, за умови, що композиція не містить ні емтрицитабіну, ні тенофовірдіізопропоксилфумарату. Більш конкретно, даний винахід відноситься також до продукту, що містить (а) сполуку формули (І), (I-a) або (I-b), і (b) одну або декілька інших антиретровірусних сполук, у вигляді комбінованого препарату для одночасного, роздільного або послідовного застосування при анти-ВІЛ-лікуванні, за умови, що зазначена одна або декілька інших антиретровірусних сполук відмінні від нуклеозидних інгібіторів зворотної транскриптази і/або нуклеотидних інгібіторів зворотної транскриптази. Різні ліки можна поєднувати в єдиному препараті разом з фармацевтично прийнятними носіями. Таким чином, даний винахід також відноситься до фармацевтичної композиції, що містить фармацевтично прийнятний носій, (а) терапевтично ефективну кількість сполуки формули (І), (I-a) або (I-b) і (b) один або декілька антиретровірусних агентів. Зокрема, даний винахід відноситься до фармацевтичної композиції, що містить фармацевтично прийн 92467 26 ятний носій, (а) терапевтично ефективну кількість сполуки формули (І), (I-a) або (l-b) і (b) один або декілька антиретровірусних агентів, за умови, що композиція не містить ні емтрицитабіну, ні тенофовірдіізопропоксилфумарату. Даний винахід відноситься також до фармацевтичної композиції, що містить фармацевтично прийнятний носій, (а) терапевтично ефективну кількість сполуки формули (І), (I-a) або (I-b) і (b) один або декілька інших антиретровірусних агентів, за умови, що зазначена одна або декілька антиретровірусних сполук відмінні від нуклеозидних інгібіторів зворотної транскриптази і/або нуклеотидних інгібіторів зворотної транскриптази. Зазначені інші антиретровірусні сполуки можуть являти собою відомі антиретровірусні сполуки, такі як сурамін, пентамідин, тимопентин, кастаноспермін, декстран (декстрансульфат), фоскарнет-натрій (тринатрійфосфоноформіат); нуклеозидні інгібітори зворотної транскриптази, наприклад, зидовудин (3'-азидо-3'-деокситимідин, AZT), диданозин (2',3'-дидеоксіінозин; dd), зальцитабін (дидеоксицитидин, dd) або ламівудин (2'-3'дідеокси-3'-тіацитидин, ЗТС), ставудин (2',3'дидегідро-3'-деокситимідин, d4T), абакавір, абакавірсульфат, емтрицитабін ((-)FTC), рацемічний FTC і подібні; ненуклеозидні інгібітори зворотної транскриптази, такі як невірапін (11-циклопропіл5,11-дигідро-4-метил-6Н-дипіридо-[3,2-b:2',3'е][1,4]діазепін-6-он), ефавіренц, делавірдин, ТМС120, ТМС-125 і подібні; сполуки ТІВО (тетрагідроімідазо[4,5,1-jk][1,4]бензодіазепін-2(1Н)-он і тіон)тип, наприклад, (S)-8-хлор-4,5,6,7-тетрагідро5-метил-6-(3-метил-2-бутеніл)імідазо-[4,5,1jk][1,4]бензодіазепін-2(1Н)-тіон; сполуки типу (-АРА ((-анілінофенілацетаміду), наприклад, (-[(2нітрофеніл)аміно]-2,6-дихлорбензолацетамід і подібні; інгібітори білків, що транс-активують, такі як ТАТ-інгібітори, наприклад, RO-5-3335, або REVінгібітори і подібні; інгібітори протеази, наприклад, індинавір, ритонавір, саквінавір, лопінавір (АВТ378), нелфінавір, ампренавір, ТМС-114, BMS232632, VX-175 і подібні; інгібітори злиття, наприклад, Т-20, Т-1249 і подібні; антагоністи рецепторів CXCR4, наприклад, AMD-3100 і подібні; інгібітори вірусної інтегрази; інгібітори зворотної транскриптази нуклеотидного типу, наприклад, тенофовір, тенофовір дифосфат, тенофовір дизопроксил фумарат і подібні; інгібітори рибонуклеотидної редуктази, наприклад, гідроксикарбамід і подібні; CCR5 антагоністи, наприклад, анкривірок, аплавірок гідрохлорид, вікривірок. При введенні сполуки за даним винаходом з іншими антивірусними агентами, метою яких є різні події у вірусному життєвому циклі, можна підсилити терапевтичний ефект даних сполук. Комбінаційні терапії, що описані вище, здійснюють синергічний ефект при інгібуванні ВІЛ-реплікації, завдяки тому, що кожен компонент комбінації діє на різні сайти ВІЛ реплікації. Використовуючи такі комбінації, можна зменшити дозування прийнятого звичайного антиретровірусного агента, яке потрібно для досягнення бажаного терапевтичного або профілактичного ефекту, у порівнянні з прийомом даного агента при монотерапії. Дані комбінації 27 можуть знизити або виключити побічні ефекти звичайної антиретровірусної монотерапії, не впливаючи на антивірусну активність агентів. Дані комбінації знижують можливості резистентності до терапій із застосуванням одного агента, при цьому знижуючи до мінімуму будь-яку асоційовану токсичність. Дані комбінації можуть також збільшити ефективність звичайного агента без підвищення асоційованої токсичності. Сполуки за даним винаходом можна також приймати в комбінації з імуномодулюючими агентами, наприклад, левамізолом, бропіриміном, антитілом проти людського альфа-інтерферону, інтерферон-альфа, інтерлейкіном 2, метіонін енкефаліном, діетилдитіокарбаматом, фактором некрозу пухлини, налтрексоном і подібними; антибіотиками, наприклад, пентамідинізетіоратом і подібними; холінергічними агентами, наприклад, такрином, ривастигміном, донепезилом, галантаміном і подібними; NMDA-блокаторами каналів, наприклад, мемантином, для профілактики або боротьби з інфекціями і захворюваннями або симптомами захворювань, пов'язаними з ВІЛінфекціями, такими як СНІД і ARC, наприклад, слабоумством. Хоча даний винахід фокусується на застосуванні даних сполук з метою профілактики або лікування ВІЛ-інфекцій, дані сполуки можна також використовувати як інгібуючі агенти для інших вірусів, що залежать від тих же зворотних транскриптаз для обов'язкових подій у їх життєвому циклі. Експериментальна частина А. Синтез сполуки формули (I-a) a) 10,99кг (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрилу і 57л оцтової кислоти (2л/моль) нагрівають до 90°С у посудині для одержання продукції. Розчин фільтрують при 95°С і промивають 3л оцтової кислоти (0,21л/моль). Додають 2,973л соляної кислоти (1,1моль/моль) при 80°С. При 85°С повільно додають 60л води (2л/моль). Суміш повільно охолоджують до 25°С, промивають два рази 5,4л води і сушать при 50°С. Отриманий продукт розмелюють. Вихід: сполука формули (I-a) форма А. b) Приблизно 150мг сполуки формули (Е) 4-[[4[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрил. НСl і 500мл пропанону нагрівають у хімічній склянці до кипіння зі зворотним холодильником. Отриману фракцію залишають кристалізуватися при кімнатній температурі. Розчинник випарюють під струмом повітря до одержання сухого продукту. Вихід: сполука формули (I-a) форма В. c) 73,29кг (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрилу і 300л оцтової кислоти (2л/моль) нагрівають до 104°С у посудині для одержання продукції. Розчин фільтрують при 100°С. Додають 19,8л соляної кислоти (1,1моль/моль) при 91,4°С. При 70°С повільно додають 150л води (2л/моль). Суміш повільно охолоджують до 20°С, промивають два рази 75л води 92467 28 і сушать при 75°С. Отриманий продукт розмелюють. Вихід: сполука формули (I-a) форма С. d) 10,99кг (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрилу і 57л оцтової кислоти (2л/моль) нагрівають до 93°С у посудині для одержання продукції. Розчин фільтрують при 100°С і промивають 3л оцтової кислоти (0,21л/моль). Додають 2,973л соляної кислоти (1,1моль/моль) при 85°С. Повільно додають 60л води (2 л/моль) при температурі 85-65°С. Суміш повільно охолоджують до 19,5°С, промивають два рази 5,4л води і сушать при 50°С. Отриманий продукт розмелюють. Змішують 200мг продукту з 1мл води і суспендують протягом 1 дня при кімнатній температурі. Вихід: сполука формули (I-a) форма D. В. Ідентифікація сполуки формули (I-a) Результати ідентифікації форм А, В, С і D методами інфрачервоної спектроскопії і порошкової рентгенівської дифракції (XRPD) представлені нижче. Результати диференціальної скануючої калориметрії (ДСК) для форми А також приведені нижче. Інфрачервона спектрометрія: KBr-дисперсія Сполуку, яку необхідно проаналізувати, змішують з галогенідом лужного металу і пресують таблетку (Ph. Eur.). Прилад ФТ ІЧ спектрофотометр Nicolet Magna 560 Кількість сканувань 32 Роздільна здатність 1см-1 Діапазон довжин хвиль від 4000 до 400см-1 Коректування базової лінії так Детектор DTGS з KBr-вікнами Світодільник Ge на KBr Галогенід лужного металу KBr (бромід калію) Порошковий рентгенівський дифракційний аналіз Порошковий рентгенівський дифракційний аналіз (XRPD) проводять на дифрактометрі Philips X'PertPRO MPD PW3050/60 з генератором PW3040. Прилад оснащений рентгенівською трубкою Cu LFF PW3373/00. Сполуку, яку необхідно проаналізувати, намазують на тримач зразка з нульовим фоном. Параметри приладу Вольтаж генератора 45кВ Тік генератора 40мА Геометрія Брега-Брентано Приставка приставка для обертання Умови вимірювання Режим сканування безперервний Діапазон сканування від 3 до 50° 2 Інтервал 0,01675°/крок Час рахунку 29,845с/крок Швидкість обертання 1с Тип випромінювання Cu Довжина хвилі випромінювання 1,54056Å 29 Траєкторія падаючого променя Програмована висота щілини: 15мм Щілина Солера: 0,04рад Діаметр пучка: 15мм Щілина, що антирозсіює: 1° Шторки для обрізання променю: + Диференціальна скануюча калориметрія Приблизно 3мг сполуки, що необхідно проаналізувати, переносять у стандартну алюмінієву кювету для зразка ТА-установки. Кювети закривають підходящою кришкою і реєструють ДСК-криву на ТА-установці Q1000 MTDSC, постаченій охолоджуючим блоком RCS. Використовують наступні параметри: Початкова температура: 20°С Швидкість нагрівання: 10°С/хв Кінцева температура: 350°С Потік азоту: 50мл/хв Результати Форма А - ІЧ Форма А характеризується ФТ ІЧ спектром з типовими смугами поглинання приблизно при 2217, 1652, 1497, 1435, 1338, 1199 і 550см-1. Додаткові смуги поглинання спостерігають при 1631, 1596, 1537, 1504, 1249, 1214, 1179, 1152 і 1070см-1 (див. Фіг.1). Форма А - XRPD Форма А характеризується типовими дифракційними піками в положеннях два-тета: 9,7°±0,2°, 13,5°±0,2° і 15,0°±0,2°. Форма А додатково характеризується піками порошкової рентгенівської дифракції в положеннях два-тета 9,1°±0,2°, 11,0°±0,2°, 14,6°±0,2°, 22,0°±0,2°, 25,0°±0,2°, 25,3°±0,2° і 26,7°±0,2° (див. Фіг.2) (можуть відбуватися варіації інтенсивності внаслідок процесів, що впливають на інтенсивності, головним чином, це історія обробки зразка). Форма А - ДСК Форма А плавиться з розкладанням. Плавлення з розкладанням починається приблизно при 250°С і відбувається приблизно при 286°С. Форма В Форма В може бути представлена в двох станах: в сухому стані і в зволоженому стані. Приведені тільки характеристики форми В у сухому стані. Форма В - ІЧ Форма В характеризується спектром ФТ ІЧ з типовими смугами поглинання приблизно при 2227, 2220, 1599, 1500, 1440, 1341, 1209, 549 і 544см-1. Додаткові смуги поглинання спостерігають приблизно при 1656, 1538, 1518, 1270, 1179, 1152 і 1070см-1 (див. Фіг.3). Форма В - XRPD Форма В характеризується типовими дифракційними піками в положеннях два-тета 4,5°±0,2°, 8,8°±0,2° і 12,5°±0,2°. Форма В додатково характеризується піками рентгенівської дифракції порошку в положеннях два-тета 10,3°±0,2°, 14,7°±0,2°, 20,6°±0,2°, 22,2°±0,2° і 26,1°±0,2°. (см. Фіг.4) (можуть відбуватися варіації інтенсивності внаслідок 92467 30 Траєкторія дифракційного променя Тривалий захист від розсіювання: + щілина Солера: 0,04рад Ni-фільтр: + детектор: X'Celerator процесів, що впливають на інтенсивності, головним чином, це історія обробки зразка). Форма С - ІЧ Форма С характеризується спектром ФТ ІЧ з типовими смугами поглинання приблизно при 2221, 1654, 1502, 1239, 1193 і 546см-1. Додаткові смуги поглинання спостерігають приблизно при 1627, 1580, 1537, 1492, 1216, 1173, 1157 і 1084см-1 (див. Фіг.5). Форма С - XRPD Форма С характеризується типовими дифракційними піками в положеннях два-тета 11,9°±0,2°, 14,3°±0,2° і 22,3°±0,2°. Форма С додатково характеризується піками порошкової рентгенівської дифракції в положеннях два-тета 12,8°±0,2°, 18,5°±0,2°, 21,2°±0,2°, 24,3°±0,2° і 26,0°±0,2° (див. Фіг.6) (можуть відбуватися варіації інтенсивності внаслідок процесів, що впливають на інтенсивності, головним чином, це історія обробки зразка). Форма D - ІЧ Форма D характеризується спектром ФТ ІЧ з типовими смугами поглинання приблизно при 2218, 1657, 1506, 1448, 1357, 1220 і 547см-1. Додаткові смуги поглинання спостерігають приблизно при 1620, 1597, 1565, 1247, 1214, 1179 1152 і 1073см-1 (див. Фіг.7). Форма D - XRPD Форма D характеризується типовими дифракційними піками в положеннях два-тета 6,6°±0,2°, 11,6°±0,2° і 17,1°±0,2°. Форма D додатково характеризується піками рентгенівської дифракції порошку в положеннях два-тета 15,0°±0,2°, 19,2°±0,2°, 20,5°±0,2°, 21,6°±0,2° і 29,8°±0,2° (див. Фіг.8) (можуть відбуватися варіації інтенсивності внаслідок процесів, що впливають на інтенсивності, головним чином, це історія обробки зразка). С. Дані з розчинності У таблиці 1 представлені дані з розчинності вільної основи (Е) 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрилу і сполуки формули (I-a). Таблиця 1 Сполука Концентрація вмг/мл Вода 0,01 N НСl PEG 400 Вільна основа 0,00002 (Е-ізомер) Сполука формули 0,0012 (I-a) (форма А) 0,019 40 0,043 Вільна основа, а також сіль НСl мають слабку розчинність у воді, а також у 0,01N НСl. Вільну основу і сіль НСl можна класифікувати як сполуки 31 92467 BCS-класу 2. Розчинність вільної основи істотно підвищується в PEG 400. D. Дані зі стабільності а) Хімічна стабільність Сполуку (I-a) (форму А) зберігають у різних умовах вологості і температури. Після збереження сіль аналізують методом високоефективної рідинної хроматографії (ВЕРХ) на вміст домішок. Результати зібрані в таблиці 2 нижче. Можна зробити висновок, що дана сполука є хімічно стабільною. Таблиця 2 Умови збережен- Сума домішок, % (%, мас/мас.) ня 1 тиждень 4 тижні 8 тижнів Контроль 0,43 40°С/75% ОВ 0,42 0,44 50°С/повітря 0,41 0,41 КТ/
ДивитисяДодаткова інформація
Назва патенту англійськоюHydrochloride of 4-[[4-[[4-(2-cyanoethenyl)-2,6-dimethylphenyl]amino]-2-pyrimidinyl] amino]benzonitrile
Автори англійськоюStevens Paul Theodoor Agnes, Peeters Jozef, Vandecruys Roger Petrus Gerebe, Copmans Alex Herman
Назва патенту російськоюГидрохлорид 4-[[4-[[4-(2-цианоэтенил)-2,6-диметилфенил]амино]-2-пиримидинил]амино]бензонитрила
Автори російськоюСтевенс Поль Теодоор Агнес, Пеетерс Йозеф, Вандекрюйс Роже Петрус Гереберн, Копманс Алекс Герман
МПК / Мітки
МПК: A61P 31/18, A61K 31/505
Мітки: гідрохлорид, 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрилу
Код посилання
<a href="https://ua.patents.su/24-92467-gidrokhlorid-4-4-4-2-cianoetenil-26-dimetilfenilamino-2-pirimidinilaminobenzonitrilu.html" target="_blank" rel="follow" title="База патентів України">Гідрохлорид 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрилу</a>
Попередній патент: Спосіб виробництва концентрату квасного сусла
Наступний патент: Спосіб виробництва квасу
Випадковий патент: Спосіб нерухомого з'єднання деталей типу "вал-втулка"












