Заміщені біциклолактами
Формула / Реферат
1. Сполука формули
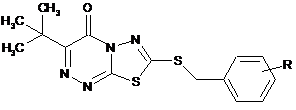 (1)
(1)
або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де:
(a) R1 є Н, -(С1-С4)алкіл, -(С1-С4)перфторалкіл, -(С1-С4)перфторалкокси або -(С1-С4)алкокси;
(b) R2 і R3, узяті окремо, є незалежно Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл;
або R2 і R3, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл;
(c) R4 є Н або -(С1-С4)алкіл;
(d) R5а, R5b, R5c і R5d є кожен незалежно Н, F, Сl, Вr, -(С1-С4)алкіл, -ОН або -O-(С1-С4)алкіл;
(e) Q є -О- або зв'язок;
(f) А є -(С3-С6)циклоалкіленова група, -(С3-С6)циклоалкеніленова група або фенілен;
(g) Z є -C(R6a)(R6b)- або зв'язок, де R6a і R6b є кожен незалежно -Н або -(С1-С4)алкіл, або R6a і R6b, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл;
(h) R7 є C(O)R8, ціано, гідроксил, -(С1-С4)алкокси, -(С1-С4)перфторалкокси або міметик карбонової кислоти;
(і) R8 є -OR9 або NHR10;
(j) R9 є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і
(k) R10 є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3.
2. Сполука за пунктом 1 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де:
(a) R1, R2, R3 і R4 є кожен незалежно Н або -СН3;
(b) R5b і R5c є кожен Н;
(c) R5d є Н, F або Сl;
(d) R5a є Н, F, Сl або метил,
(e) Z є -СН2- або зв'язок, і
(f) R7 є C(O)R8 або ціано.
3. Сполука за пунктом 2 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де:
Q є зв'язок, і
А є -(С3-С10)циклоалкіленова група або -(С3-С10)циклоалкеніленова група.
4. Сполука за пунктом 3 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де R5d є Н.
5. Сполука за пунктом 4 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де А є 1,4-циклогексилен, циклогекс-3-ен-1,4-діїл, трицикло[3.2.1.02,4]октилен-1,3-діїл або октагідропентален-1,4-діїл.
6. Сполука за пунктом 5, що має формулу
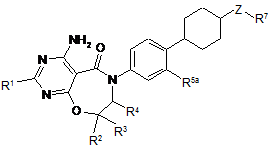 , (2)
, (2)
або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де:
R1 є Н або -СН3,
R2 є Н або -СН3,
R3 є Н або -СН3,
R4 є Н або -СН3,
R5a є Н, F, Сl або метил,
Z є -C(R6a)(R6b)- або зв'язок, де R6a і R6b є кожен незалежно -Н або -(С1-С4)алкіл, або R6a i R6b, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл;
R7 є C(O)R8, ціано, гідроксил, -(С1-С4)алкокси, -(С1-С4)перфторалкокси або міметик карбонової кислоти;
R8 є -OR9 або NHR10;
R9 є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл, і
R10 є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3.
7. Сполука за пунктом 6 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де Z є -СН2-.
8. Сполука за пунктом 7 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де R7 є -C(О)NHR10.
9. Сполука за пунктом 7 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де R7 є -CN.
10. Сполука за пунктом 9, яка є {транс-4-[4-(4-аміно-5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5Н)-іл)феніл]циклогексил}ацетонітрилом або його таутомером або фармацевтично прийнятною сіллю згаданої сполуки або таутомеру.
11. Сполука за пунктом 7 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де R7 є -С(О)ОН.
12. Сполука за пунктом 11, якою є 2-(4-(4-(4-аміно-5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5Н)-іл)-2-фторфеніл)циклогексил)оцтова кислота або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру.
13. Сполука за пунктом 11, якою є {транс-4-[4-(4-аміно-5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5Н)-іл)феніл]циклогексил}оцтова кислота або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру.
14. Сполука за пунктом 7 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де R2 є (R)-метил.
15. Сполука за пунктом 14 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де R7 є -CN.
16. Сполука за пунктом 14, якою є (транс-4-{4-[(8R)-4-аміно-8-метил-5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5Н)-іл]феніл}циклогексил)ацетонітрил або його таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру.
17. Сполука за пунктом 14 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де R7 є -С(O)ОН.
18. Сполука за пунктом 17, якою є (транс-4-{4-[(8R)-4-аміно-8-метил-5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5Н)-іл]феніл}циклогексил)оцтова кислота або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру.
19. Сполука за пунктом 17, якою є (R)-2-(4-(4-(4-аміно-8-метил-5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5Н)-іл)-2-фторфеніл)циклогексил)оцтова кислота або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру.
20. Фармацевтична композиція, що містить:
(а) сполуку формули
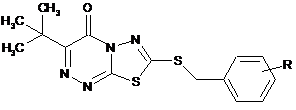 (1)
(1)
або її таутомер або фармацевтично прийнятну сіль згаданої сполуки або таутомеру, де:
R1 є Н, -(С1-С4)алкіл, -(С1-С4)перфторалкіл, -(С1-С4)перфторалкокси або -(С1-С4)алкокси;
R2 і R3, узяті окремо, є незалежно Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; або
R2 і R3, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл;
R4 є Н або -(С1-С4)алкіл;
R5a, R5b, R5c і R5d є кожен незалежно Н, F, Сl, Вr, -(С1-С4)алкіл, -ОН або -O-(С1-С4)алкіл;
Q є -О- або зв'язок;
А є -(С3-С6)циклоалкіленова група, -(С3-С6)циклоалкеніленова група або фенілен;
Z є -C(R6a)(R6b)- або зв'язок, де R6a і R6b є кожен незалежно -Н або -(С1-С4)алкіл, або R5a i R6b, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл;
R7 є C(O)R8, ціано, гідроксил, -(С1-С4)алкокси, -(С1-С4)перфторалкокси або міметик карбонової кислоти;
R8 є -OR9 або NHR10;
R9 є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і
R10 є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3; і
(б) фармацевтично прийнятний носій, розбавник, розріджувач або екципієнт.
21. Фармацевтична композиція за пунктом 20, що містить:
(а) сполуку формули
 (2)
(2)
або її таутомер або фармацевтично прийнятну сіль згаданої сполуки або таутомеру, де:
R1 є Н або -СН3;
R2 є Н або -СН3;
R3 є Н або -СН3;
R4 є Н або -СН3;
R5a є Н, F, Сl або метил;
А є 1,4-циклогексилен;
Z є -C(R6a)(R6b)- або зв'язок, де R6a і R6b є кожен незалежно -Н або -(С1-С4)алкіл, або R6a і R6b, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл;
R7 є C(O)R8, ціано, гідроксил, -(С1-С4)алкокси, -(С1-С4)перфторалкокси або міметик карбонової кислоти;
R8 є -OR9 або NHR10;
R9 є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і
R10 є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3; і
(б) фармацевтично прийнятний носій, розбавник, розріджувач або екципієнт.
22. Спосіб лікування діабету типу 2 у ссавця, який потребує такого лікування, що включає введення згаданому ссавцю терапевтично ефективної кількості сполуки формули
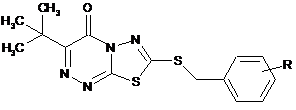 (1)
(1)
або її таутомеру або фармацевтично прийнятної солі згаданої сполуки або таутомеру, де:
R1 є Н, -(С1-С4)алкіл, -(С1-С4)перфторалкіл, -(С1-С4)перфторалкокси або -(С1-С4)алкокси;
R2 і R3, узяті окремо, є незалежно Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; або
R2 і R3, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл;
R4 є Н або -(С1-С4)алкіл;
R5a, R5b, R5c і R5d є кожен незалежно Н, F, Сl, Вr, -(С1-С4)алкіл, -ОН або -O-(С1-С4)алкіл;
Q є -О- або зв'язок;
А є -(С3-С6)циклоалкіленова група, -(С3-С6)циклоалкеніленова група або фенілен;
Z є -С(R6а)(R6b)- або зв'язок, де R6а і R6b є кожен незалежно -Н або -(С1-С4)алкіл, або R6а і R6b, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл;
R7 є C(О)R8, ціано, гідроксил, -(С1-С4)алкокси, -(С1-С4)перфторалкокси або міметик карбонової кислоти;
R8 є -OR9 або NHR10;
R9 є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і
R10 є -Н, -(С1-С4)алкіл, тетразоліл або S(О)2CF3.
23. Спосіб за пунктом 22 лікування діабету типу 2 у ссавця, який потребує такого лікування, що включає введення згаданому ссавцю терапевтично ефективної кількості сполуки формули
 (2)
(2)
або її таутомеру або фармацевтично прийнятної солі згаданої сполуки або таутомеру, де:
R1 є Н або -СН3;
R2 є Н або -СН3;
R3 є Н або -СН3;
R4 є Н або -СН3;
R5а є Н, F, Сl або метил;
А є 1,4-циклогексилен;
Z є -C(R6a)(R6b)- або зв'язок, де R6a і R6b є кожен незалежно -Н або -(С1-С4)алкіл, або R6а i R6b, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл;
R7 є C(О)R8, ціано, гідроксил, -(С1-С4)алкокси, -(С1-С4)перфторалкокси або міметик карбонової кислоти;
R8 є -OR9 або NHR10;
R9 є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і
R10 є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3.
24. Спосіб за пунктом 23, де згаданим ссавцем є людина.
25. Спосіб лікування ожиріння у ссавця, який потребує такого лікування, що включає введення згаданому ссавцю терапевтично ефективної кількості сполуки формули
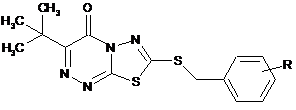 (1)
(1)
або її таутомеру або фармацевтично прийнятної солі згаданої сполуки або таутомеру, де:
R1 є Н -(С1-С4)алкіл, -(С1-С4)перфторалкіл, -(С1-С4)перфторалкокси або -(С1-С4)алкокси;
R2 і R3, узяті окремо, є незалежно Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; або
R2 і R3, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл;
R4 є Н або -(С1-С4)алкіл;
R5a, R5b, R5c i R5d є кожен незалежно Н, F, Сl, Вr, -(С1-С4)алкіл, -ОН або -O-(С1-С4)алкіл;
Q є -О- або зв'язок;
А є -(С3-С6)циклоалкіленова група, -(С3-С6)циклоалкеніленова група або фенілен;
Z є -C(R6a)(R6b)- або зв'язок, де R6a і R6b є кожен незалежно -Н або -(С1-С4)алкіл, або R6а i R6b, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл,
R7 є C(O)R8, ціано, гідроксил, -(С1-С4)алкокси, -(С1-С4)перфторалкокси або міметик карбонової кислоти;
R8 є -OR9 або NHR10;
R9 є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і
R10 є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3.
26. Спосіб за пунктом 25 лікування ожиріння у ссавця, який потребує такого лікування, що включає введення згаданому ссавцю терапевтично ефективної кількості сполуки формули
 (2)
(2)
або її таутомеру або фармацевтично прийнятної солі згаданої сполуки або таутомеру, де:
R1 є Н або -СН3;
R2 є Н або -СН3;
R3 є Н або -СН3;
R4 є Н або -СН3;
R5а є Н, F, Сl або метил;
А є 1,4-циклогексилен;
Z є -С(R6а)(R6b)- або зв'язок, де R6а і R6b є кожен незалежно -Н або -(С1-С4)алкіл, або R6а і R6b, узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл,
R7 є C(О)R8, ціано, гідроксил, -(С1-С4)алкокси, -(С1-С4)перфторалкокси або міметик карбонової кислоти;
R8 є -OR9 або NHR10;
R9 є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і
R10 є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2CF3.
27. Спосіб за пунктом 26, де згаданим ссавцем є людина.
Текст
1. Сполука формули 3 разом з вуглецем, до якого вони приєднані, є -(С3С6)циклоалкіл; 7 8 R є C(O)R , ціано, гідроксил, -(С1-С4)алкокси, -(С1С4)перфторалкокси або міметик карбонової кислоти; 8 9 10 R є -OR або NHR ; 9 R є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл, і 10 R є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3. 7. Сполука за пунктом 6 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру, де Z є -СН2-. 8. Сполука за пунктом 7 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або 7 10 таутомеру, де R є -C(О)NHR . 9. Сполука за пунктом 7 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або 7 таутомеру, де R є -CN. 10. Сполука за пунктом 9, яка є {транс-4-[4-(4аміно-5-оксо-7,8-дигідропіримідо[5,4f][1,4]оксазепін-6(5Н)іл)феніл]циклогексил}ацетонітрилом або його таутомером або фармацевтично прийнятною сіллю згаданої сполуки або таутомеру. 11. Сполука за пунктом 7 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або 7 таутомеру, де R є -С(О)ОН. 12. Сполука за пунктом 11, якою є 2-(4-(4-(4-аміно5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін6(5Н)-іл)-2-фторфеніл)циклогексил)оцтова кислота або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру. 13. Сполука за пунктом 11, якою є {транс-4-[4-(4аміно-5-оксо-7,8-дигідропіримідо[5,4f][1,4]оксазепін-6(5Н)-іл)феніл]циклогексил}оцтова кислота або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру. 14. Сполука за пунктом 7 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або 2 таутомеру, де R є (R)-метил. 15. Сполука за пунктом 14 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або 7 таутомеру, де R є -CN. 16. Сполука за пунктом 14, якою є (транс-4-{4[(8R)-4-аміно-8-метил-5-оксо-7,8дигідропіримідо[5,4-f][1,4]оксазепін-6(5Н)іл]феніл}циклогексил)ацетонітрил або його таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру. 17. Сполука за пунктом 14 або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або 7 таутомеру, де R є -С(O)ОН. 18. Сполука за пунктом 17, якою є (транс-4-{4[(8R)-4-аміно-8-метил-5-оксо-7,8дигідропіримідо[5,4-f][1,4]оксазепін-6(5Н)іл]феніл}циклогексил)оцтова кислота або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру. 19. Сполука за пунктом 17, якою є (R)-2-(4-(4-(4аміно-8-метил-5-оксо-7,8-дигідропіримідо[5,4f][1,4]оксазепін-6(5Н)-іл)-2фторфеніл)циклогексил)оцтова кислота або її таутомер або фармацевтично прийнятна сіль згаданої сполуки або таутомеру. 20. Фармацевтична композиція, що містить: (а) сполуку формули 94833 4 R5b NH2 N R1 O R5c Q N R4 R2 Z R7 R5a N O A R5d R3 (1) або її таутомер або фармацевтично прийнятну сіль згаданої сполуки або таутомеру, де: 1 R є Н, -(С1-С4)алкіл, -(С1-С4)перфторалкіл, -(С1С4)перфторалкокси або -(С1-С4)алкокси; 2 3 R і R , узяті окремо, є незалежно Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; або 2 3 R і R , узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл; 4 R є Н або -(С1-С4)алкіл; 5a 5b 5c 5d R , R , R і R є кожен незалежно Н, F, Сl, Вr, (С1-С4)алкіл, -ОН або -O-(С1-С4)алкіл; Q є -О- або зв'язок; А є -(С3-С6)циклоалкіленова група, -(С3С6)циклоалкеніленова група або фенілен; 6a 6b 6a 6b Z є -C(R )(R )- або зв'язок, де R і R є кожен 5a 6b незалежно -Н або -(С1-С4)алкіл, або R i R , узяті разом з вуглецем, до якого вони приєднані, є -(С3С6)циклоалкіл; 7 8 R є C(O)R , ціано, гідроксил, -(С1-С4)алкокси, -(С1С4)перфторалкокси або міметик карбонової кислоти; 8 9 10 R є -OR або NHR ; 9 R є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і 10 R є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3; і (б) фармацевтично прийнятний носій, розбавник, розріджувач або ексципієнт. 21. Фармацевтична композиція за пунктом 20, що містить: (а) сполуку формули Z NH2 N R1 R7 O N R5a N O R4 R2 R3 (2) або її таутомер або фармацевтично прийнятну сіль згаданої сполуки або таутомеру, де: 1 R є Н або -СН3; 2 R є Н або -СН3; 3 R є Н або -СН3; 4 R є Н або -СН3; 5a R є Н, F, Сl або метил; А є 1,4-циклогексилен; 6a 6b 6a 6b Z є -C(R )(R )- або зв'язок, де R і R є кожен 6a 6b незалежно -Н або -(С1-С4)алкіл, або R і R , узяті разом з вуглецем, до якого вони приєднані, є -(С3С6)циклоалкіл; 7 8 R є C(O)R , ціано, гідроксил, -(С1-С4)алкокси, -(С1С4)перфторалкокси або міметик карбонової кислоти; 8 9 10 R є -OR або NHR ; 9 R є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і 10 R є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3; і (б) фармацевтично прийнятний носій, розбавник, розріджувач або екципієнт. 5 94833 22. Спосіб лікування діабету типу 2 у ссавця, який потребує такого лікування, що включає введення згаданому ссавцю терапевтично ефективної кількості сполуки формули R5b R1 O R5c Q N NH2 N O A Z R7 R5b R4 NH2 R5d N R3 (1) або її таутомеру або фармацевтично прийнятної солі згаданої сполуки або таутомеру, де: 1 R є Н, -(С1-С4)алкіл, -(С1-С4)перфторалкіл, -(С1С4)перфторалкокси або -(С1-С4)алкокси; 2 3 R і R , узяті окремо, є незалежно Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; або 2 3 R і R , узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл; 4 R є Н або -(С1-С4)алкіл; 5a 5b 5c 5d R , R , R і R є кожен незалежно Н, F, Сl, Вr, (С1-С4)алкіл, -ОН або -O-(С1-С4)алкіл; Q є -О- або зв'язок; А є -(С3-С6)циклоалкіленова група, -(С3С6)циклоалкеніленова група або фенілен; 6а 6b 6а 6b Z є -С(R )(R )- або зв'язок, де R і R є кожен 6а 6b незалежно -Н або -(С1-С4)алкіл, або R і R , узяті разом з вуглецем, до якого вони приєднані, є -(С3С6)циклоалкіл; 7 8 R є C(О)R , ціано, гідроксил, -(С1-С4)алкокси, -(С1С4)перфторалкокси або міметик карбонової кислоти; 8 9 10 R є -OR або NHR ; 9 R є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і 10 R є -Н, -(С1-С4)алкіл, тетразоліл або S(О)2CF3. 23. Спосіб за пунктом 22 лікування діабету типу 2 у ссавця, який потребує такого лікування, що включає введення згаданому ссавцю терапевтично ефективної кількості сполуки формули Z NH2 N R1 10 R є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3. 24. Спосіб за пунктом 23, де згаданим ссавцем є людина. 25. Спосіб лікування ожиріння у ссавця, який потребує такого лікування, що включає введення згаданому ссавцю терапевтично ефективної кількості сполуки формули R5a N R2 6 R7 O R1 O R5c Q N R4 R2 Z R7 R5a N O A R5d R3 (1) або її таутомеру або фармацевтично прийнятної солі згаданої сполуки або таутомеру, де: 1 R є Н -(С1-С4)алкіл, -(С1-С4)перфторалкіл, -(С1С4)перфторалкокси або -(С1-С4)алкокси; 2 3 R і R , узяті окремо, є незалежно Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; або 2 3 R і R , узяті разом з вуглецем, до якого вони приєднані, є -(С3-С6)циклоалкіл; 4 R є Н або -(С1-С4)алкіл; 5a 5b 5c 5d R , R , R i R є кожен незалежно Н, F, Сl, Вr, (С1-С4)алкіл, -ОН або -O-(С1-С4)алкіл; Q є -О- або зв'язок; А є -(С3-С6)циклоалкіленова група, -(С3С6)циклоалкеніленова група або фенілен; 6a 6b 6a 6b Z є -C(R )(R )- або зв'язок, де R і R є кожен 6а 6b незалежно -Н або -(С1-С4)алкіл, або R i R , узяті разом з вуглецем, до якого вони приєднані, є -(С3С6)циклоалкіл, 7 8 R є C(O)R , ціано, гідроксил, -(С1-С4)алкокси, -(С1С4)перфторалкокси або міметик карбонової кислоти; 8 9 10 R є -OR або NHR ; 9 R є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і 10 R є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2СF3. 26. Спосіб за пунктом 25 лікування ожиріння у ссавця, який потребує такого лікування, що включає введення згаданому ссавцю терапевтично ефективної кількості сполуки формули Z N R5a N O NH2 R4 R2 R3 (2) або її таутомеру або фармацевтично прийнятної солі згаданої сполуки або таутомеру, де: 1 R є Н або -СН3; 2 R є Н або -СН3; 3 R є Н або -СН3; 4 R є Н або -СН3; 5а R є Н, F, Сl або метил; А є 1,4-циклогексилен; 6a 6b 6a 6b Z є -C(R )(R )- або зв'язок, де R і R є кожен 6а 6b незалежно -Н або -(С1-С4)алкіл, або R i R , узяті разом з вуглецем, до якого вони приєднані, є -(С3С6)циклоалкіл; 7 8 R є C(О)R , ціано, гідроксил, -(С1-С4)алкокси, -(С1С4)перфторалкокси або міметик карбонової кислоти; 8 9 10 R є -OR або NHR ; 9 R є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і N R1 R7 O N R5a N O R4 R2 R3 (2) або її таутомеру або фармацевтично прийнятної солі згаданої сполуки або таутомеру, де: 1 R є Н або -СН3; 2 R є Н або -СН3; 3 R є Н або -СН3; 4 R є Н або -СН3; 5а R є Н, F, Сl або метил; А є 1,4-циклогексилен; 6а 6b 6а 6b Z є -С(R )(R )- або зв'язок, де R і R є кожен 6а 6b незалежно -Н або -(С1-С4)алкіл, або R і R , узяті разом з вуглецем, до якого вони приєднані, є -(С3С6)циклоалкіл, 7 7 8 R є C(О)R , ціано, гідроксил, -(С1-С4)алкокси, -(С1С4)перфторалкокси або міметик карбонової кислоти; 8 9 10 R є -OR або NHR ; Галузь винаходу Винахід стосується заміщених похідних біциклолактамів, їх фармацевтичних композиції і їх застосування. Передумови створення винаходу Ожиріння, яке є надлишком жиру тіла відносно звичайної маси тіла, є хронічним захворюванням, що широко розповсюджено в сучасному суспільстві. Його пов‟язують із зменшенням тривалості життя і рядом медичних проблем, включаючи шкідливі фізіологічні проявлення, хворобу коронарної артерії, гіпертензію, інсульт, діабет типу 2, гіперліпідемію і деякі види раку. Знаковими характеристиками ожиріння є збільшення маси білої жирової тканини (БЖТ), що в значному ступені викликано акумулюванням триацилгліцирину. Це збільшення маси БЖТ є ключовим внеском в ускладнення пов‟язані з ожирінням. Діацилгліцерин O-ацилтрансфераза 1 (DGAT1) є мембранзв‟язаним ферментом, що каталізує кінцеву стадію біосинтезу триацилгліцерину. DGAT-1 експресується в кишечнику і жировій тканині. Було встановлено, що миші без DGAT-1 не страждають на ожиріння, коли знаходяться на високожирній дієті, на противагу до тварин дикого типу (Smith, et al., Nature Genetics 25:87 90, 2000). Миші без DGAT-1 проявляють зменшені рівні глюкози в плазмі після обіду і проявляють збільшення вживання енергії, але мають нормальні рівні тригліцеридів у сироватці. Фенотип мишей без DGAT-1, поряд з результатами наших досліджень зінгібіторами DGAT-1 у мишей з ожирінням викликаним дієтою (DIO), вказує, що такі миші є стійкими до ожиріння викликаного дієтою і мають підвищену чутливість до інсуліну і лептину. Ці ефекти вказують на те, що інгібування DGAT in vivo, може бути новою терапевтичною ціллю не тільки для ожиріння, але також для діабету. (Subauste A, Burant CF, Curr Drug Targets Immune Endocr Metabol Disord. 2003 Dec;3(4):263-70.) Однак, крім того, в цій галузі існує потреба, в інгібіторах DGAT-1, що є ефективними для лікування метаболічних розладів, таких як, наприклад, ожиріння, діабет типу 2 і синдрому резистентності до інсуліну. Крім того, в цій галузі існує потребa в інгібіторах DGAT-1, що мають IC50 значення менше, ніж приблизно 1000 нM і переважно нижче 100 нM. Короткий опис суті винаходу Представлений винахід стосується сполук, що мають структуру формули (1) 94833 8 9 R є -Н, -(С1-С4)алкіл або -(С1-С4)перфторалкіл; і 10 R є -Н, -(С1-С4)алкіл, тетразоліл або S(O)2CF3. 27. Спосіб за пунктом 26, де згаданим ссавцем є людина. R5b NH2 R5c Q O Z A R7 N R5a N R1 N R4 O R2 R5d R3 (1) або її таутомеру, або фармацевтично прийнятної солі згаданої сполуки або таутомеру, де: 1 R є H, -(C1-C4)алкіл, -(C1-C4)перфторалкіл, (C1-C4)перфторалкокси або -(C1-C4)алкокси; 2 3 R і R , узяті окремо, є незалежно H, -(C12 3 C4)алкіл або -(C1-C4)перфторалкіл; або R і R , узяті разом з вуглецем до якого вони приєднані, є (C3-C6)циклоалкіл; 4 R є H або -(C1-C4)алкіл; 5a 5b 5c 5d R , R , R і R є кожен незалежно H, F, Cl, Br, -(C1-C4)алкіл, -OH або -O-(C1-C4)алкіл; Q є -O- або зв‟язок; A є -(C3-C6)циклоалкіленова група, -(C3C6)циклоалкеніленова група або фенілен; 6a 6b 6a 6b Z є -C(R )(R )- або зв‟язок, де R і R є ко6a 6b жен незалежно -H або -(C1-C4)алкіл, або R і R , узяті разом з вуглецем до якого вони приєднані, є (C3-C6)циклоалкіл; 7 8 R є C(O)R , ціано, гідроксил, -(C1-C4)алкокси, (C1-C4)перфторалкокси або міметик карбонової кислоти; 8 9 10 R є -OR або NHR ; 9 R є -H, -(C1-C4)алкіл або -(C1C4)перфторалкіл; і 10 R є -H, -(C1-C4)алкіл, тетразоліл або S(O)2CF3. Представлений винахід також стосується фармацевтичної композиції, що містить сполуку представленого винаходу або фармацевтично прийнятну сіль сполуки, і фармацевтично прийнятний носій, розбавник, розріджувач або екціпієнт. Представлений винахід також стосується способу лікування діабету типу 2, синдрому резистентності до інсуліну або ожиріння, що включає введення ссавцю, що потребує такого лікування, терапевтично ефективної кількості сполуки представленого винаходу або фармацевтично прийнятної солі сполуки. Представлений винахід додатково стосується способу інгібування DGAT-1 у ссавця, що включає введення згаданому ссавцю інгібувальної кількості сполуки представленого винаходу або фармацевтично прийнятної солі згаданої сполуки. 9 Сполуки, солі і фармацевтичні композиції представленого винаходу є корисними для лікування ожиріння, діабету типу 2 і синдрому резистентності до інсуліну. Сполуки, солі і фармацевтичні композиції представленого винаходу також є корисними для лікування погіршеної толерантності до глюкози, гіперглікемії, діабетичних ускладнень, таких як цукрова катаракта, діабетична нейропатія, діабетична нефропатія, діабетична ретинопатія і діабетична кардіоміопатія, нервової анорексії, булімії, кахесії, гіперурікемії, гіперінсулінемії, гіперхолестеролемії, гіперліпідемії, дисліпідемії, змішаної дисліпідемії, гіпертригліцеридемії, неалкогольної жирової інфільтрації печенки, атеросклерозу, артеріосклерозу, гострої серцевої недостатності, застійної серцевої недостатності, захворювання коронарної артерії, кардіоміопатії, інфаркту міокарда, стенокардії, гіпертензії, гіпотензії, інсульту, ішемії, ішемічного реперфузійного ушкодження, аневризми, рестенозу, васкулярного стенозу, солідних пухлин, раку шкіри, меланоми, лімфоми, раку молочних залоз, раку легені, колоректального раку, раку шлунку, раку стравоходу, панкреатичного раку, раку простати, раку нирки, раку печінки, раку міхура, раку шийки, раку матки, раку сіменників і раку яічок. Детальний опис винаходу Терміни, що використовуються для опису представленого винаходу, мають наступні значення. Сполуки і проміжні сполуки представленого винаходу можуть бути названі згідно з системами номенклатури або IUPAC (Міжнародного союзу з чистої і прикладної хімії), або CAS (Кемікал Абстрактс Сервис). Вміст атомів вуглецю в різних вуглеводневих замісниках тут може бути вказаний як префікс що позначає мінімальну і максимальну кількість атомів вуглецю в заміснику, наприклад, префікси (CaCb)алкіл і Ca-bалкіл, означають алкільний замісник з інтервалом "a" - "b" атомів вуглецю, включно. Таким чином, наприклад, (C1-C6)алкіл і C1-6алкіл стосується алкільної групи з одним – шістьма атомами вуглецю, включно.Символ "-" представляє ковалентний зв‟язок. Термін “алкіл” означає нерозгалужений або розгалужений моновалентний радикал аліфатичного ланцюгу з атомів вуглецю. Прикладами алкільних груп є метил, етил, пропіл, ізопропіл, ізобутил і т.і.. Термін "алкокси" стосується нерозгалуженого або розгалуженого моновалентного радикалу аліфатичного ланцюгу з атомів вуглецю зв‟язаного з атомом кисню, що приєднаний до основної структури. Прикладами алкоксигруп є метокси, етокси і ізо-пропокси. Термін “міметик карбонової кислоти“ стосується міметику або біоізостеру карбонової групи, як описано в “The Practice of Medicinal Chemistry”, Wermuth C.G. Ed.; Academic Press; New York, 1996, p203. Прикладами придатних міметиків карбонових кислот є, але не обмежується ними, -SO3H, 7 7 CH2S(O)2R , -C(O)NHS(O)2R , -C(O)NHOH, 7 C(O)NHCN, -C(O)NHR , -CH(CF3)OH, -C(CF3)2OH, 94833 10 P(O)(OH)2, 1,2,5-тіадіазол-3-ол-4-іл, 1H-тетразол-5іл, 1H-1,2,4-триазол-5-іл, 1H-піразол-5-ол-3-іл, ізоксазол-5-ол-3-іл, ізоксазол-3-ол-5-іл, тіазолідин2,4-діон-5-іл, імідазолідин-2,4-діон-5-іл, 1H-пірол2,5-діон-3-іл, 1H-імідазол-2-ол-5-іл, дигідропіримідин-2,4(1H,3H)-діон-6-іл, імідазолідин-2,4-діон-1-іл, 1H-імідазол-5-ол-2-іл, 1H-піразол-3-ол-1-іл, 1Hпіразол-3-ол-4-іл, 1,3,4-тіадіазол-2-ол-5-іл, 1,3,4оксадіазол-2-ол-5-іл, 1,2,4-оксадіазол-3-ол-5-іл, 1,2,4-тіадіазол-3-ол-5-іл, оксазол-2-ол-4-іл, тіазол2-ол-4-іл, тіазол-4-ол-2-іл, 1,2,4-оксадіазол-5-ол-3іл, 1,2,4-тіадіазол-5-ол-3-іл, 1,1-ди-оксо-1,2,5тіадіазолідин-3-он-2-іл, 1,1-ди-оксо-1,2,5тіадіазолідин-3-он-5-іл, ізотіазол-3-ол-5-іл, 2H1,2,3-триазол-4-ол-2-іл, 1H-1,2,3-триазол-4-ол-1-іл, 1H-імідазол-2,4-діол-5-іл, 1-оксо-2,3-дигідро-1,2,4тіадіазол-5-ол-3-іл, тіазол-2,4-діол-5-іл, оксазол2,4-діол-5-іл, 3,4-дигідроксифуран-2(5H)-он-5-іл і 57 гідрокси-1,2,4-тіадіазол-3(2H)-он-2-іл. R , як тут використовується, є -H, -(C1-C4)алкіл або -(C3C6)циклоалкіл. Термін "циклоалкіл" означає неароматичний, моноциклічний карбоциклічний радикал. Прикладами циклоалкільних груп є циклопропіл, циклобутил, циклопентил, циклогексил. Циклоалкільні групи можуть бути необов‟язково конденсованими з ароматичними вуглеводнями, такими як бензол, утворюючи конденсовані циклоалкільні групи, такі як інданіл і т.і.. Термін "циклоалкілен" означає насичений, або частково ненасичений, моноциклічний, біциклічний або трициклічний карбоциклічний ди-валентний радикал. Прикладами циклоалкіленових груп є циклопропілен, циклобутилен, циклопентилен, циклогексилен, циклогексен-ді-іл октагідропентален-ді-іл і трициклооктилен-ді-іл. Циклоалкіленові групи можуть бути необов‟язково конденсовані з ароматичними вуглеводнями, такими як бензол, утворюючи конденсовані циклоалкіленові групи, такі як інданілен і т.і.. Термін "перфторалкіл" є визначеним тут, як моновалентний алкільний радикал, де кожен водень є заміненим фтором. Прикладами перфторалкільних груп є, але не обмежується ними, трифторметил, перфторетил, і т.і.. Термін "перфторалкокси" є визначеним тут, як алкоксигрупа, де кожен водень є заміненим фтором. Прикладами перфторалкоксигруп є, але не обмежується ними, трифторметокси, перфторетокси і т.і.. Термін "радикал" означає групу з атомів, що поводять себе як окремий реактант в хімічній реакції, наприклад, органічний радикал є групою атомів, що надають характеристичні властивості сполуці, що містить його, або який залишається незмінним під час ряду реакцій або трансформацій. Термін "заміщений" означає, що атом водню в молекулі замінений іншим атомом або молекулою. Атом або молекулу, що замінюють атом водню, позначають як "замісник". Термін “таутомер” стосується органічних сполук, що є взаємоперетворюваними в хімічній реакцій, що називається таутомеризацією. Зазвичай, реакція включає міграцію атому водню або прото 11 ну, що супроводжується зміною простого зв‟язку і суміжного подвійного зв‟язку. Терміни "лікування", як тут використовується, включає попередження (наприклад, профілактика), пом‟якшення, уповільнення розвитку і зцілення захворювання, такого як ожиріння, синдром резистентності до інсуліну, діабет типу 2 або стану залежного від захворювання, такого як діабетичне ускладнення. Фраза "терапевтично ефективна кількість" означає кількість сполуки представленого винаходу, що (i) лікує або попереджає певне захворювання, стан або розлад, (ii) пом‟якшує, покращує або зменшує один або більше симптомів певного захворювання, стану або розладу, або (iii) попереджає або затримує виникнення одного або більше симптомів певного захворювання, стану або розладу описаного тут. Фраза "фармацевтично прийнятний" вказує, що позначений носій, розріджувач, екціпієнт(и), і/або сіль загалом хімічно і/або фізично сумісною з іншими інгредієнтами, що містить рецептура, і фізіологічно сумісною з їх реципієнтом. Термін "ссавець" стосується індивідуальної тварини, що є членом таксономічного класу Ссавці. Прикладами ссавців э, але не обмежується ними, люди, собаки, коти, коні і корови. В представленому винаході, переважними ссавцями є люди, собаки і коти. Більш переважно, ссавцем є людина. Термін "залежних солей", як тут використовується, означає фармацевтично прийнятні солі сполук представленого винаходу. В представленому винаході, переважно для сполук формули (1), або для їх таутомерів, або для солей згаданих сполук або таутомерів, що (a) 1 2 3 4 R , R , R і R є кожен незалежно H або -CH3; (b) 5b 5c 5d 5a R і R є кожен H; (c) R є H, F або Cl; (d) R є H, 7 F, Cl або метил; (e) Z є -CH2- або зв‟язок, і (f) R є 8 C(O)R або ціано. Більш переважно, Q є зв‟язок; A є -(C3C10)циклоалкіленова група або -(C31 2 3 4 C10)циклоалкеніленова група. R , R , R і R є ко5b 5c 5d жен незалежно H або -CH3; R і R є кожен H; R 5a є H, F або Cl; R є H, F, Cl або метил; Z є -CH27 8 або зв‟язок, і R є C(O)R або ціано. 5d Навіть більш переважно, R є H; Q є зв‟язок; A є -(C3-C10)циклоалкіленова група або -(C31 2 3 4 C10)циклоалкеніленова група; R , R , R і R є ко5b 5c 5a жен незалежно H або -CH3; R і R є кожен H; R 7 є H, F, Cl або метил; Z є -CH2- або зв‟язок, і R є 8 C(O)R або ціано. Навіть ще більш переважно A є 1,4циклогексилен, циклогекс-3-ен-1,4-ді-іл, трицик2,4 ло[3.2.1.0 ]октилен-1,3-ді-іл або октагідропента5d 1 2 3 4 лен-1,4-ді-іл; R є H; Q є зв‟язок; R , R , R і R є 5b 5c кожен незалежно H або -CH3; R і R є кожен H; 5a 7 R є H, F, Cl або метил; Z є -CH2- або зв‟язок, і R 8 є C(O)R або ціано. Найбільш переважно, сполуками формули (1), її таутомерами і солями сполук або таутомерів, є сполуки, що мають структуру формули (2) 94833 12 Z R7 NH2 O N R5a N R1 N R4 O R2 R3 (2) або її таутомер, або фармацевтично прийнят1 на сіль згаданої сполуки або таутомеру, де: R є H 2 3 4 або -CH3; R є H або -CH3; R є H або -CH3; R є H 5a 6a 6b або -CH3; R є H, F, Cl або метил; Z є -C(R )(R )6a 6b або зв‟язок, де R і R є кожен незалежно -H або 6a 6b (C1-C4)алкіл, або R і R , узяті разом з вуглецем 7 до якого вони приєднані, є -(C3-C6)циклоалкіл; R є 8 C(O)R , ціано, гідроксил, -(C1-C4)алкокси, -(C1-C4)перфторалкокси або міметик карбонової кислоти; 8 9 10 9 R є -OR або NHR ; R є -H, -(C1-C4)алкіл або 10 (C1-C4)перфторалкіл; і R є -H, -(C1-C4)алкіл, тетразоліл або S(O)2CF3. Переважно, Z є -CH2-. В представленому винаході, переважно, для сполук формули (2), або для їх таутомерів, або для солей згаданих сполук або таутомерів, що Z є -CH2-. В першому переважному втіленні сполук формули (2), або їх таутомерів, або солей згаданих 7 10 сполук або таутомерів, Z є -CH2- і R є -C(O)NHR . В другому переважному втіленні сполук формули (2), або їх таутомерів, або солей згаданих 7 сполук або таутомерів, Z є -CH2- і R є -CN. Переважною сполукою цього втілення є {транс-4-[4-(4аміно-5-оксо-7,8-дигідропіримідо[5,4f][1,4]оксазепін-6(5H)іл)феніл]циклогексил}ацетонітрил, або його таутомер, або сіль згаданої сполуки або таутомеру. В третьому переважному втіленні сполук формули (2), або їх таутомерів, або солей згаданих 7 сполук або таутомерів, Z є -CH2- і R є -C(O)OH. Однією з переважних сполук цього втілення є 2-(4(4-(4-аміно-5-оксо-7,8-дигідропіримідо[5,4f][1,4]оксазепін-6(5H)-іл)-2фторфеніл)циклогексил)оцтова кислота, або її таутомер, або сіль згаданої сполуки або таутомеру. Іншою переважною сполукою цього втілення є {транс-4-[4-(4-аміно-5-оксо-7,8-дигідропіримідо[5,4f][1,4]-оксазепін-6(5H)-іл)феніл]циклогексил}оцтова кислота, або її таутомер, або сіль згаданої сполуки або таутомеру. В четвертому переважному втіленні сполук формули (2), або їх таутомерів, або солей згада2 них сполук або таутомерів, Z є -CH2- і R є (R)метил. Для цього втілення, більш переважно, що 7 10 R є -C(O)NHR , -CN, або -C(O)OH. Переважною сполукою цього втілення є (транс-4-{4-[(8R)-4аміно-8-метил-5-оксо-7,8-дигідропіримідо[5,4f][1,4]оксазепін-6(5H)іл]феніл}циклогексил)ацетонітрил, або його таутомер, або сіль згаданої сполуки або таутомеру. Іншою переважною сполукою цього втілення є (транс-4-{4-[(8R)-4-аміно-8-метил-5-оксо-7,8дигідропіримідо-[5,4-f][1,4]оксазепін-6(5H)іл]феніл}циклогексил)оцтова кислота, або її тауто 13 мер, або сіль згаданої сполуки або таутомеру. Ще однією іншою переважною сполукою цього втілення є (R)-2-(4-(4-(4-аміно-8-метил-5-оксо-7,8дигідро-піримідо[5,4-f][1,4]оксазепін-6(5H)-іл)-2фторфеніл)циклогексил)оцтова кислота, або її таутомер, або сіль згаданої сполуки або таутомеру. Коли сполука формули (I) містить алкенільну або алкеніленову групу, можливими є геометричні цис/транс (або Z/E) ізомери. Цис/транс ізомери можуть бути розділені звичайними способами, добре відомими фахівцям в цій галузі, наприклад, хроматографія і фракційна кристалізація. Коли сполуки представленого винаходу містять один або більше стереогенних центрів, згадані сполуки можуть бути розділені на чисті енантіомери за способами відомими фахівцям в цій галузі, наприклад, за допомогою утворення стереоізомерних солей, які можуть бути розділені, наприклад, кристалізацією; утворенням стереоізомерних похідних або комплексів, які можуть бути розділені, наприклад, кристалізацією, газорідинною або рідинною хроматографією; селективною реакцією одного енантоімера з енантіомер специфічним реагентом, наприклад, ферментною естерифікацією; або газорідинною або рідинною хроматографією в хіральному оточенні, наприклад, на хіральному носії, наприклад, силікагелі із зв‟язаним хіральним лігандом або в присутності хірального розчинника. Слід розуміти, що коли бажаний стереоізомер перетворюється на іншу хімічну речовину за допомогою однієї з методик розділення описаних вище, наступна стадія потребує вивільнення бажаної енантіомерної форми. Альтернативно, певні стереоізомери можуть бути синтезовані використовуючи оптично-активний вихідний матеріал, за допомогою асиметричного синтезу використовуючи оптично-активні реагенти, субстрати, каталізатори або розчинники, або шляхом перетворення одного стереоізомеру на інші за допомогою асиметричної трансформації. Деякі сполуки формули (1) можуть існувати в різних стабільних конформаційних формах, які можуть бути розділюваними. Обертальна асиметрія завдяки обмеженому обертанню навколо асиметричного простого зв‟язку, наприклад, внаслідок стеричного утруднення або кільцевого напруження, може дозволяти розділення різних конформерів. Сполуки представленого винаходу також включають кожен конформаційний ізомер сполук формули (1) і їх суміші. З цього витікає, що індивідуальна сполука може проявляти більше ніж один тип ізомерії. Включеними в межі рамок заявлених сполук представленого винаходу є всі стереоізомери, геометричні ізомери і таутомерні форми сполук формули (I), включаючи сполуки, що проявляють більше ніж один тип ізомерії і суміші одного або більше з них. Також включеними є кислотно-адитивні або основно-адитивні солі, де протиіон є оптично активним, наприклад, D-лактат або L-лізин, або рацемічним, наприклад, DL-тартрат або DL-аргінін. Сполуки представленого винаходу і їх солі можуть існувати в несольватованій, також як і в сольватованій формах з фармацевтично прийнят 94833 14 ними розчинниками, такими як вода, етанол, і т.і.. Термін „сольват‟ використовується тут для опису молекулярного комплексу, що містить сполуку винаходу і одну або більше фармацевтично прийнятних молекул розчинника, наприклад, етанолу. Термін „гідрат‟ використовується, коли згаданим розчинником є вода. Фармацевтично прийнятними сольватами є гідрати і інші сольвати, де кристалізаційний розчинник може бути ізотопічно заміщеним, наприклад, D2O, d6-ацетон, d6-ДМСО. Сполуки представленого винаходу можуть існувати як клатрати або інші комплекси. Деякі сполуки формули (1) і їх солі і сольвати можуть існувати в більше ніж одній кристалічній формі. Поліморфи сполук представлені формулою (1) утворюють частину цього винаходу і можуть бути одержані кристалізацією сполуки формули (1) за різних умов. Наприклад, використовуючи різні розчинники або різні суміші розчинників для перекристалізації; кристалізацію при різних температурах; різні способи охолодження, в інтервалі від дуже швидкого до дуже повільного охолодження під час кристалізації. Поліморфи також можуть бути одержані шляхом нагрівання або плавлення сполуки формули (1) з наступним поступовим або швидким охолодженням. Присутність поліморфів може бути визначена за допомогою твердотільної ЯМР спектроскопії, ІЧ спектроскопії, диференційної скануючої калориметрії, порошкової рентгенографії або інших методик. Цей винахід також включає ізотопічно-мічені сполуки, які є ідентичними згаданим сполукам описаним формулою (2), але лише з тією різницею, що один або декілька атомів замінені атомом, який має атомну масу або масовий номер, що відрізняється від атомної маси або масового номера, які зазвичай зустрічаються у природі. Прикладами ізотопів, що можуть бути включені в сполуки винаходу, є ізотопи водню, вуглецю, азоту, кисню, фо2 3 13 14 15 сфору, фтору та хлору, такі як H, Н, C, C, N, 18 17 31 32 35 18 35 O, О, P, P, S, F та Cl, відповідно. Сполуки представленого винаходу та фармацевтично прийнятні солі сполук, які містять вищезгадані ізотопи і/або інші ізотопи інших атомів, входять в межі даного винаходу. Певні мічені ізотопами сполуки даного винаходу, наприклад, сполуки, в які 3 14 включені радіоактивні ізотопи, такі як, Н та C, є корисними при дослідженні розподілення лікарського засобу і/або субстрату в тканинах. Особлива 3 перевага надається ізотопам тритію (тобто Н) та 14 вуглецю-14 (тобто C) у зв‟язку з легкістю їх одержання та визначення. Крім того, заміщення більш 2 важкими ізотопами, такими як дейтерій (тобто Н) може надавати певні терапевтичні переваги, які є наслідком більшої метаболічної стабільності, наприклад, збільшення in vivo напівжиття або зменшення необхідної дози і, таким чином, може бути переважним в деяких випадках. Мічені ізотопами сполуки формули (2) винаходу загалом можуть бути отримані з використанням методик описаних на Схемах і/або в Прикладах нижче, і шляхом заміни легко доступним міченим ізотопом реагентом не міченого ізотопом реагенту. 15 Фармацевтично прийнятними солями, як тут використовується, стосовно сполук представленого винаходу, є фармацевтично прийнятні неорганічні і органічні солі згаданих сполук. Ці солі можуть бути одержані на місці під час кінцевого виділення і очищення сполуки або за допомогою окремої реакції сполуки або її пролікарської форми з придатною органічною або неорганічною кислотою і виділення одержаної таким чином солі. Типовими солями є, але не обмежується ними, ацетат, аспартат, бензоат, безилат, бікарбонат, димезилат, дифосфат, бісульфат, бітартрат, бромід, камсилат, карбонат, хлорид, цитрат, едисилат, езилат, фумарат, глюцептат, геміфумарат, гідробромід, гідрохлорид, ізетіонат, лактат, малат, малеат, мезилат, напсилат, нітрат, оксалат, пальмітат, памоат, фосфат, сахарат, стеарат, сукцинат, сульфат, тартрат, тозилат і трифторацетат. Вони також можуть включати катіони на основі лужних і лужноземельних металів, таких як натрій, літій, калій, кальцій, магній і т.і., також як і нетоксині амонієві, четвертинні амонієві і амінокатіони включаючи, але не обмежується, амоній, тетраметиламоній, тетраетиламоній, метиламін, диметиламін, триметиламін, триетиламін, етиламін, діетиламін і т.і.. Для додаткових прикладів дивіться, наприклад, Berge, et al., J. Pharm. Sci., 66, 1-19 (1977) і “Handbook of Pharmaceutical Salts: Properties, Selection, і Use” by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Сполуки представленого винаходу можуть бути виділені і використані самі по собі або у формі їх фармацевтично прийнятних солей. У відповідності з представленим винаходом, сполуки декількома основними атомами азоту можуть утворювати солі з різною кількістю еквівалентів ("ек.") кислоти. Для фахівця зрозуміло, що всі такі солі попадають в межі рамок представленого винаходу. Представлений винахід також включає пролікарські форми сполук формули (1). Пролікарська форма сполуки формули (1) може бути сформована звичайним чином використовуючи функціональну групу сполуки, таку як аміно, гідрокси або карбоксигрупа. Термін “пролікарська форма” означає сполуку, що трансформується in vivo утворюючи сполуку формули (1) або фармацевтично прийнятну сіль сполуки. Трансформація може відбуватись за різними механізмами, таким як гідроліз в крові. Обговорення застосування пролікарських форм приведено T. Higuchi і W. Stella, “Prodrugs as Novel Delivery Systems,” Vol. 14 of the A.C.S. Symposium Series, і в Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987. Наприклад, як всі з сполук представленого винаходу включають аміногрупу, пролікарська форма може бути утворена шляхом заміни атома водню в аміногрупі групою, такою як R-карбоніл, ROкарбоніл, NRR‟-карбоніл, де R і R‟ є кожен незале 94833 16 жно (C1-C10)алкіл, (C3-C7)циклоалкіл, бензил, або R-карбоніл є природний -аміноацил або природний -аміноацил-природний -аміноацил, C(OH)C(O)OY‟, де Y‟ є H, (C1-C6)алкіл або бензил, C(OY0)Y1, де Y0 є (C1-C4) алкіл і Y1 є (C1-C6)алкіл, карбокси(C1-C6)алкіл, аміно(C1-C4)алкіл або моноN- або ди-N,N-(C1-C6)алкіламіноалкіл, -C(Y2)Y3, де Y2 є H або метил і Y3 є моно-N- або ди-N,N-(C1C6)алкіламіно, морфоліно, піперидин-1-іл або піролідин-1-іл. Аналогічно, якщо сполука представленого винаходу містить спиртову групу, пролікарська форма може бути утворена шляхом заміни атома водню спиртової групи групою, такою як (C1C6)алканоїлокси-метил, 1-((C1C6)алканоїлокси)етил, 1-метил-1-((C1C6)алканоїлокси)етил, (C1C6)алкоксикарбонілоксиметил, N-(C1C6)алкоксикарбоніламінометил, сукциноїл, (C1C6)алканоїл, -аміно(C1-C4)алканоїл, арилацил і аміноацил, або -аміноацил--аміноацил, де кожна -аміноацильна група є незалежно вибраною з L-амінокислот, що зустрічаються в природі, P(O)(OH)2, -P(O)(O)(C1-C6)алкіл)2 або глікозил (радикал одержаний внаслідок видалення гідроксильної групи з геміацетальної форми вуглеводу). Якщо сполука представленого винаходу містить карбоксильну групу, пролікарська форма може включати естер утворений заміною атома водню кислотної групи групою, такою як (C1-C8)алкіл, (C2-C12)алканоїлоксиметил, 1-(алканоїлокси)етил, що має від 4 до 9 атомів вуглецю, 1-метил-1(алканоїлокси)-етил, що має від 5 до 10 атомів вуглецю, алкоксикарбонілоксиметил, що має від 3 до 6 атомів вуглецю, 1-(алкоксикарбонілокси)етил, що має від 4 до 7 атомів вуглецю, 1метил-1-(алкоксикарбонілокси)-етил, що має від 5 до 8 атомів вуглецю, N(алкоксикарбоніл)амінометил, що має від 3 до 9 атомів вуглецю, 1-(N-(алкоксикарбоніл)аміно)етил, що має від 4 до 10 атомів вуглецю, 3-фталідил, 4кротонолактоніл, гама-бутиролактон-4-іл, ди-N,N(C1-C2)алкіламіно(C2-C3)алкіл (такий як диметиламіноетил), карбамоїл-(C1-C2)алкіл, N,Nди(C1-C2)алкілкарбамоїл-(C1-C2)алкіл і піперидинo, піролідинo- або морфоліно(C2-C3)алкіл. Синтез Загалом, сполуки формули (1) цього винаходу можна одержати за допомогою методів, що включають способи відомі в хімічній галузі, зокрема, в світлі опису приведеного тут. Деякі способи виготовлення сполук формули (1) цього винаходу показані на наступних схемах реакцій. Інші способи описуються в експериментальному розділі. Деякі вихідні сполуки для реакцій описаних на схемах і Прикладах одержують як тут показано. На Схемах 1, 3 і 4 нижче, зображені загальні способи одержання сполук формули (1). 17 94833 Схема 1 X R4 5d 18 5b NH 2 R 5c 5c R R + 5a R 1-1 A Si R5b R2 O Si R3 O R 9 COOR 5a 5d R 1-3 Cl 1 N R 5b Cl O N R5c N N Z R5a O COOR9 Cl 1-4 R4 R5d R3 Cl 2 R 1-5 Cl Q A N R Z + R 1 A R N H R3 Z R9OOC Q R 2 1-2 Q R4 O Si 1 R N R Cl R5c A Cl O HO 1-6 R3 5a R N Cl Z COOR 4 R N R R R3 O N R1 R2 2 R 1-7 Q 5b R R5c O H2N R COOR9 R5d R4 N 1 Z A R5a N N O 1A На Схемі 1, арилгалоїд/сульфонати 1-1 можуть бути одержані виходячи з комерційно доступних вихідних матеріалів і використовуючи загалmні синтетичні методики відомі фахівцю в цій галузі. Додаткова інформація для одержання проміжних сполук, таких як 1-1, де Х є галоїд або OSO2R, приведена в патенті US 7,244,727, що виданий 17 липня 2007, інформація про який включена сюди як посилання у всій своїй повноті. Сполуку 1-2 одержували за методом C. Palomo et al., Synthesis of -Lactam Scaffolds for Ditopic Peptidomimetics, Organic Letters (2007), 9(1), pages 101-104. Сполуки 1-1 і 1-2 можуть бути конденсовані використовуючи металевий каталізатор, такий як паладій або мідь з утворенням Сполуки 1-3. Більш специфічно, 1-1 і 1-2 нагрівають до температури від 80C до 130C в розчиннику, такому як толуол, з карбонатом цезію, ацетатом паладію і 2дициклогексилфосфіно-2‟,4‟,6‟триізопропілбіфенілом (X-PHOS) під азотом протягом приблизно 15-20 годин з утворенням Сполуки 1-3. Сполуку 1-3 ацилюють 1-4 використовуючи умови і реагенти відомі фахівцю в цій галузі (використовуючи м‟яку основу, таку як триетиламін або піридин) одержуючи сполуку 1-5. Сполуку 1-4 одержують за способом Tarasov, Evgeniy V.; Henckens, Anja; Ceulemans, Erik; Dehaen, Wim. A COOR9 R5d N 9 5d 4 R O Q A R5a 5c 5b N Z Q R5b R3 2 R short total synthesis of cerpegin by intramolecular hetero Diels-Alder cycloaddition reaction of an acetylene tethered pyrimidine. Synlett (2000), (5), 625-626. захисну групу (Pg) присутню в сполуці 1-5 може бути видалена фахівцем в цій галузі, використовуючи умови приведені в Greene‟s Protective th Groups in Organic Synthesis, 4 Ed., P.G.M Wuts і T. W. Greene, Wiley-Interscience, одержуючи сполуку 1-6. У випадку, коли Pg = т-бутилдиметил-силіл, зняття захисту проводять в інтервалі умов включаючи кисле середовище і фторсередовище. Переважними умовами, коли Pg є тбутилдиметилсиліл, є розведена водна хлорводнева кислота в метанолі при кімнатній температурі 2-10 годин. Циклізацію сполуки 1-6 для одержання сполуки 1-7 можна проводити використовуючи широкий інтервал основних умов, включаючи органічну (наприклад, триетиламін) і неорганічну (наприклад, карбонат калію) основи, в апротонному розчиннику при 20C - 120C з одержанням циклічного лактаму структури 1-7. Переважними умовами для цієї циклізації є триетиламін в ацетонітрилі при 40C - 120C протягом 4-16 годин. Амінування сполуки 1-7 можна проводити використовуючи аміак в апротонних або протонних розчинниках при 0C - 100C протягом 4-20 годин. 19 94833 Переважними умовами є аміак в п-діоксані при кімнатній температурі протягом 4 - 24 годин. Сполуки формули (1), які містять естер карбонової кислоти, можуть бути гідролізовані у відповідну карбонову кислоту використовуючи гідроліз каталізований основою або кислотою за умов ві 20 домих в цій галузі. Переважним способом гідролізу є обробка сполуки (1) водним гідроксидом літію в органічному розчиннику при 20C - 100C протягом 1 - 10 годин. Схема 1 (продовження) Z Q R 5c H2N 5c H2N R5d R4 N R 5d R N NH 3 4 R N 3 3 R1 R O N R R O N 1 R 2 1A CONH 2 5a R O R N A R5b 5a R O Z Q COOR9 A 5b 2 R 1B Z Q 5c 5a R O H2N N A 5b R R R5d N 4 R N 3 1 R N O 1C Сполуку 1B можна одержати за допомогою реакції пептидного конденсування між Сполукою 1A і аміаком. Сполука 1B може бути використана у формі Сполуки 1C внаслідок дегідратації аміду. Дегідратацію можна провести шляхом обробки аміду SOCl2, POCI3, PCI5, п-TosCl/піридин, Tf2O/піридин або реагентом Вільсмеєра в комбінації з органічною або неорганічною основою. Реагент Вільсмеєра може бути одержаний реакцією диметилформаміду (ДМФА) з оксалілхлоридом в ацетонітрилі, дихлорметані, хлороформі, діоксані, тетрагідрофурані (ТГФ) або діетиловому етері. R 2 R Загалом, реагент Вільсмеєра утворюється в бажаному розчиннику, наприклад, при температурі від 0°C до кімнатної. Для утворення зазвичай необхідно 5-15 хвилин. В переважному втіленні розчин аміду в бажаному розчиннику по краплям додають до реагенту Вільсмеєра при температурі від 0°C до кімнатної температури. Додавання зазвичай закінчують через 10-20 хвилин. Для утворення нітрилу, додають два еквіваленти основи. Переважно, як органічну основу, наприклад, використовують піридин або триетиламін (TEA). Також ефективною може бути неорганічна основа. Схема 2 O Br + O m(H2C) O (CH2)n O (CH2)n m(H2C) HO Br O 2-2 2-1 2-3 Br O O m (H2C) (CH2)n Br 2-5 (CH2)n m(H2C) Br 2-4 21 94833 На Схемі 2, кетони (2-5), які є еквівалентом сполуки 1-1 Схема 1, де m і n є кожен незалежно 1, 2 або 3, можуть бути одержані використовуючи методику Zang, Y.; Schuster, G., J. Org. Chem. 1994, 59, 1855-62. Монозахищені діони (2-2) мо 22 жуть бути одержані використовуючи методики Alonso, F.; et al., Tetrahedron, 1995, 51(37), 1025980, Crich, D.; Fortt, S. Tetrahedron, 1989, 45(20), 6581-98, або Lee, S.; Fuchs, P., J. Amer. Chem. Soc., 2002, 124, 13978-9. Схема 3 O O B O O O 3-1 O + O F Br F 3-3 O 3-2 O O O O F F F F 3-4 O S O HO O 3-5 F Si O O O HN 3-6 F Cl O N N N Cl O F O 1-5 O Si На Схемі 3, сполука 1-5 і її аналоги, можуть бути одержані з сполук 3-1 і 3-2, як описано в наступному Приготуванні 4 і способах відомих в цій галузі. 23 94833 Схема 3A 24 O O O O NaH ТГФ O O Pd/C, H2 EtOAc O O O O O 3A-3 3A-2 2N HCl ТГФ O O O O Tf2O, піридин ДХМ (сухий) O 3A-4 OTf 3A-5 + O O B O ДМСО O 3A-6 O B KOAc, PdCl2(dppf) B O O O 3-1 На Схемі 3A, сполука 3-1 і її аналоги, можуть бути одержані з сполуки 3A-1 і 3A-6, як описано в наступному Приготуванні 4A і способах відомих в цій галузі. Альтернативно, на Схемі 4, сполуки формули (1) також можуть бути одержані з сполуки 4-7, яку одержують за способом Схеми 3, вище, способами відомими в цій галузі. Схема 4 R5b Si O Br R5c 2 R R 3 4-1 R + 5c R I 3 Si 5b R O R Cl O R 4-3 H2N 5a R N H 2 5d I 5d N Cl 1) 1 R N Cl Et2iPrN 4-4 5a R R 4-2 2) HCl Cl R5b 5c OR N I R N 4-6 R5c N R O R N R5a 5d 3 O Cl 1 N R2 HO 5d R1 R3 2 R R Cl N 4-5 H H N R I 5b R 5c OR N R5b 5a I 1 R N N O 2 4-7 5a R R5d R H N R3 H 5c R O R5b Q N 1 N R R5a 5d R N O R2 R3 (1) A Z 7 R 25 Фармацевтична композиція представленого винаходу містить терапевтично ефективну кількість сполуки формули (1) або її фармацевтично прийнятної солі і фармацевтично прийнятний носій, розбавник, розріджувач або екціпієнт. Переважно, фармацевтична композиція представленого винаходу містить терапевтично ефективну кількість сполуки формули (2) або її фармацевтично прийнятної солі і фармацевтично прийнятної носій, розбавник, розріджувач або екціпієнт. Навіть більш переважно, фармацевтична композиція містить {транс-4-[4-(4-аміно-5-оксо-7,8дигідропіримідо[5,4-f][1,4]оксазепін-6(5H)іл)феніл]циклогексил}-ацетонітрил або його фармацевтично прийнятну сіль, 2-(4-(4-(4-аміно-5оксо-7,8-дигідропіримідо[5,4-f][1,4] оксазепін-6(5H)іл)-2-фторфеніл)-циклогексил)оцтову кислоту або її фармацевтично прийнятну сіль, {транс-4-[4-(4аміно-5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5H)-іл)феніл]-циклогексил}оцтову кислоту або її фармацевтично прийнятну сіль, (транс4-{4-[(8R)-4-аміно-8-метил-5-оксо-7,8дигідропіримідо[5,4-f][1,4]оксазепін-6(5H)іл]феніл}циклогексил)ацетонітрил або його фармацевтично прийнятну сіль, (транс-4-{4-[(8R)-4аміно-8-метил-5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5H)-іл]феніл}циклогексил)оцтову кислоту або її фармацевтично прийнятну сіль або (R)-2-(4-(4-(4-аміно-8-метил-5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5H)-іл)-2фторфеніл)-циклогексил)оцтову кислоту або її фармацевтично прийнятну сіль; і фармацевтично прийнятної носій, розбавник, розріджувач або екціпієнт. Фармацевтичні композиції сформовані комбінуванням сполук цього винаходу і фармацевтично прийнятних носіїв, розбавників або розріджувачів потім легко вводити у формі різних дозованих форм, таких як таблетки, порошки, лозенги, сиропи, розчини для ін‟єкції і т.і.. Ці фармацевтичні композиції можуть, при бажанні, містити додаткові інгредієнти, такі як ароматизатори, зв‟язувальін агенти, екціпієнти і т.і.. Таким чином, для орального введення можуть бути використані таблетки, що містять різні екціпієнт, такі як цитрат натрію, карбонат кальцію і/або фосфат кальцію, разом з різними дезінтегрантами, такими як крохмаль, алгінова кислота і/або деякі складні силікати, разом із зв‟язувальними агентами, такими як полівінілпіролідон, цукроза, желатин і/або акація. Крім того, для таблетування часто використовують змащувальні агенти, такі як стеарат магнію, лаурилсульфат натрію і тальк. Тверді композиції подібного типу також можуть використовуватись як наповнювачи м‟яких і твердих желатинових капсул. Переважними матеріалами для цього є лактоза або молочний цукор і високомолекулярні поліетиленгліколі. Коли водні суспензії або еліксири є бажаними для орального введення, активний фармацевтичний агент може поєднуватись з різними підсолоджувачами або ароматизаторами, барвниками або колорувальними агентами, якщо бажано, емульсифікаторами або суспендувальними агентами, разом з розріджува 94833 26 чами, такими як вода, етанол, пропіленгліколь, гліцерин і/або їх комбінаціями. Для парентерального введення, можуть бути використані розчини сполук або композицій цього винаходу в кунжутовому або арахісовому маслі, водному пропіленгліколі або в стерильних водних розчинах. Такі водні розчини повинні бути придатно забуферені, якщо необхідно, і рідкий розріджувач спочатку робиться ізотонічним використовуючи достатню кількість саліну або глюкози. Ці особливі водні розчини є особливо придатними для внутрішньовенного, внутрішньом‟язового, підшкірного і інтраперітонеального введення. У цьому зв‟язку, використовуване стерильне водне середовище легко одержуються використовуючи стандартні методики відомі фахівцю в цій галузі. Для інтраназального введення або введення за допомогою інгаляції, сполуки або композиції винаходу зазвичай вивільнюють у формі розчину або суспензії з контейнеру з насосом, що стискається або накачується пацієнтом або як аерозольного спрею, що вивільнюється з контейнеру під тиском або розпилювача, за допомогою придатних пропелантів, наприклад, дихлордифторметану, трихлорфторметану, дихлортетрафторетану, діоксиду вуглецю або іншого придатного газу. У випадку стиснутого аерозолю, одиниця дозування може бути визначена за допомогою клапану, що вивільнює певну кількість. Контейнер під тиском або розпилювач може містити розчин або суспензію сполуки цього винаходу. Капсули і картриджі (виготовлені, наприклад, з желатину), для використання в інгаляторі або пристрої для вдування, можуть містити порошкову суміш сполуки або сполук винаходу і придатної порошкової основи, такої як лактоза або крохмаль. Відомі способи одержання різних фармацевтичних композицій з певною кількістю активного інгредієнту або будуть зрозумілі в світлі цього опису для фахівця в цій галузі. Для ознайомлення із способами одержання фармацевтичних композицій, дивіться Remington‟s Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., 19th Edition (1995). В іншому аспекті, винахід стосується фармацевтичної композиції, яка містить терапевтично ефективну кількість першої сполуки формули (1) або фармацевтично прийнятної солі сполуки; другу сполуку, якою є протидіабетичний агент, що вибирають з інсуліну і аналогів інсуліну; інсулінотропіну; бігуанідів; α2-антагоністів і імідазолінів; глітазонів; інгібіторів альдозоредуктази; інгібіторів глікогенфосфорилази; інгібіторів сорбітдегідрогенази; інгібіторів окислення жирних кислот; інгібіторів α-глюкозидази; β-агоністів; інгібіторів фосфодіестерази; ліпідознижувальних агентів; агентів проти ожиріння; ванадату і ванадієвих комплексів і пероксиванадієвих комплексів; антагоністів аміліну; антагоністів глюкагону; стимуляторів секреції гормону росту; інгібіторів глюконеогенезу; аналогів соматостатину; антиліполітичних агентів; пролікарських форм протидіабетичних агентів або фармацевтично прийнятної солі протидіабетичних агентів і проліків. 27 В іншому аспекті, винахід стосується набору, що містить: першу дозовану форму, яка включає сполуку формули (1) або фармацевтично прийнятну сіль сполуки; і другу дозовану форму, яка включає протидіабетичний агент, що вибирають з інсуліну і аналогів інсуліну; інсулінотропіну; бігуанідів; α2-антагоністів і імідазолінів; глітазонів; інгібіторів альдозоредуктази; інгібіторів глікогенфосфорилази; інгібіторів сорбітдегідрогенази; інгібіторів окислення жирних кислот; інгібіторів αглюкозидази; β-агоністів; інгібіторів фосфодіестерази; ліпідознижувальних агентів; агентів проти ожиріння; ванадату і ванадієвих комплексів і пероксиванадієвих комплексів; антагоністів аміліну; антагоністів глюкагону; стимуляторів секреції гормону росту; інгібіторів глюконеогенезу; аналогів соматостатину; антиліполітичних агентів; пролікарських форм протидіабетичних агентів або фармацевтично прийнятної солі протидіабетичних агентів і проліків; і контейнер, що містить згадану першу дозовану форму (a) і згадану другу дозовану форму (b). В переважному втіленні набору, і перша, і друга дозовані форми незалежно містять фармацевтично прийнятної носій або розріджувач. В іншому аспекті, винахід стосується способу інгібування DGAT-1, що включає введення ссавцю інгібувальної кількості сполуки формули (1) або фармацевтично прийнятної солі сполуки або окремо, або в комбінації з протидіабетичним агентом, як описано вище. В іншому аспекті, винахід стосується способу лікування стану опосередкованого інгібування DGAT-1, що включає введення ссавцю, що потребує такого лікування, терапевтично ефективної кількості сполуки формули (1) або фармацевтично прийнятної солі сполуки або окремо, або в комбінації з протидіабетичним агентом, як описано вище. В представленому винаході, типово, станом, що лікується є діабет типу 2, синдром резистентності до інсуліну або ожиріння. Переважно, стан лікується шляхом введення сполуки формули (2) або її фармацевтично прийнятної солі. Більш переважно, стан лікується шляхом введення однієї з наступних сполук або їх фармацевтично прийнятних солей: {транс-4-[4-(4-аміно-5-оксо-7,8дигідропіримідо[5,4-f][1,4]оксазепін-6(5H)іл)феніл]циклогексил}-ацетонітрил, 2-(4-(4-(4аміно-5-оксо-7,8-дигідро-піримідо[5,4-f][1,4] оксазепін-6(5H)-іл)-2-фторфеніл)-циклогексил)оцтова кислота, {транс-4-[4-(4-аміно-5-оксо-7,8дигідропіримідо[5,4-f][1,4]-оксазепін-6(5H)іл)феніл]-циклогексил}оцтова кислота, (транс-4-{4[(8R)-4-аміно-8-метил-5-оксо-7,8дигідропіримідо[5,4-f][1,4]оксазепін-6(5H)іл]феніл}циклогексил)ацетонітрил, (транс-4-{4[(8R)-4-аміно-8-метил-5-оксо-7,8дигідропіримідо[5,4-f]-[1,4]оксазепін-6(5H)іл]феніл}циклогексил)оцтова кислота або (R)-2-(4(4-(4-аміно-8-метил-5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5H)-іл)-2фторфеніл)-циклогексил)оцтова кислота. Переважно, ссавцем, що лікується, є людина. В альтернативному втіленні, станом, що лікується, є погіршена толерантність до глюкози, гіпе 94833 28 рглікемія, діабетичні ускладнення, такі як цукрова катаракта, діабетична нейропатія, діабетична нефропатія, діабетична ретинопатія і діабетична кардіоміопатія, нервова анорексія, булімія, кахесія, гіперурікемія, гіперінсулінемія, гіперхолестеролемія, гіперліпідемія, дисліпідемія, змішана дисліпідемія, гіпертригліцеридемія, неалкогольна жирова інфільтрація печінки, атеросклероз, артеріосклероз, гостра серцева недостатність, застійна серцева недостатність, захворювання коронарної артерії, кардіоміопатія, інфаркт міокарда, стенокардія, гіпертензія, гіпотензія, інсульт, ішемія, ішемічне реперфузійне ушкодження, аневризм, рестеноз, васкулярний стеноз, солідні пухлини, рак шкіри, меланома, лімфома, рак молочної залози, рак легені, колоректальний рак, рак шлунку, рак стравоходу, панкреатичний рак, рак простати, рак нирки, рак печінки, рак міхура, рак шийки, рак матки, рак сіменників і рак яічок. Представлений винахід також стосується терапевтичних способів лікування описаних вище станів у ссавця, включаючи людину, де сполука формули (1) цього винаходу вводиться як частина прийнятного режиму дозування для одержання користі від терапії. Прийнятний режим дозування, кількість кожної введеної дози і інтервали між дозами сполуки, буде залежати від використовуваної сполуки формули (1) цього винаходу, використовуваного типу фармацевтичної композиції, характеристик суб‟єкта, що лікується, і складності стану. Загалом, ефективна доза для сполук представленого винаходу знаходиться в інтервалі 0,01 мг/кг/день - 30 мг/кг/день, переважно 0,01 мг/кг/день - 5 мг/кг/день активної сполуки в одиничній або розподіленій дозах. Однак, деякі варіації в дозуванні будуть необхідні в залежності від стану суб‟єкта, що лікується. Індивідуальність відповіді на дозу буде, в будь-якому випадку, визначатись прийнятною дозою для певного суб‟єкта. Фахівець повинен розуміють, що “кг” стосується маси пацієнта виміряної в кілограмах. Сполуки або композиції цього винаходу можуть бути введенні в одиничній (наприклад, один раз на день) або розподілених дозах або шляхом постійного вливання. Сполуки цього винаходу також можуть бути введенні окремо або в комбінації з фармацевтично прийнятними носіями, розбавниками або розріджувачами, в або одиничній, або розподіленій дозах. Придатними фармацевтичними носіями, розбавниками і розріджувачами є інертні тверді розріджувачи або наповнювачи, стерильні водні розчини і різні органічні розчинники. Сполуки або композиції представленого винаходу можуть бути введенні суб‟єктові, що потребує такого лікування за допомогою різних звичайних шляхів введення, включаючи оральний і парентеральний (наприклад, внутрішньовенний, підшкірний або внутрішьомозковий). Крім того, фармацевтичні композиції цього винаходу можуть бути введенні інтраназально, як супозиторій, або використовуючи “флеш” рецептуру, тобто, препарат розчиняється у роті без необхідності використання води. Пояснення 29 94833 Приклади приведені тут далі призначені тільки для ілюстрації. Композиції, способи і різні параметри відображені тут призначені тільки для ілюстрації різних аспектів і втілень винаходу і не призначені для обмеження рамок заявленого винаходу будь-яким чином. Скорочення використані в поясненні є визначеними далі: ДХМ є дихлорметан, ДМФА є диметилформамід, DPPF є 1,1‟-біс(дифенілфосфіно)фероцен, EDCI є 1-етил-3-(3диметиламінопропіл)карбодіімід, EtOAc є етилацетат, HCl є хлорводнева кислота, HOBt є N-гідроксибензотриазол, MТГФ є 2-Метилтетрагідрофуран, ЧУ є час утримування в хвилинах, TEA є триетиламін, TFA є трифтороцтова кислота, Tf2O є трифторметансульфоновий (трифлік) ангідрид, ТГФ є тетрагідрофуран, і X-PHOS є 2-дициклогексилфосфіно-2‟,4‟,6‟триізопропілбіфеніл. Якщо не вказано інше, всі реагенти одержували з комерційних джерел. Якщо не вказано інше, очистку проводили використовуючи картридж для очистки Biotage® SNAP FLASH (силікагель). ® Всі Combiflash очищення, обговорені тут, ® проводили використовуючи систему CombiFlash Companion (Teledyne Isco; Lincoln, Nebraska) використовуючи колонки напаковані діоксидом кремнію ® RediSep . ® Масспектр знімали на спектрометрі Waters ® (Waters Corp.; Milford, MA) Micromass Platform II. Якщо не вказано інше, масспектри знімали на спе® ® ктрометрі Waters (Milford, MA) Micromass Platform II. Хімічні зсуви протонного ЯМР приведені в м.ч. відносно тетраметилсилану і знімали на спектрометрі Varian Unity 400 МГц (мегаГерц) (Varian Inc.; Palo Alto, CA). Сполуки представленого винаходу, описані в Прикладах 1-48, одержували або потім виходили із сполуки одержаної за методикою Схеми I використовуючи сполуки Приготувань 1, 2, 3 або 4. Приготування 1 Метил {транс-4-[4-(4-хлор-5-оксо-7,8дигідропіримідо[5,4-f][1,4]оксазепін-6-(5H)іл)феніл]циклогексил}ацетат N Cl O N O N O O Метил {транс-4-[4-(4-хлор-5-оксо-7,8дигідропіримідо[5,4-f][1,4]-оксазепін-6-(5H)іл)феніл]циклогексил}ацетат одержували наступним чином. 30 Si O HN O O Стадія 1. Метил (транс-4-{4-[(2-{[третбутил(диметил)силіл]окси}етил)аміно]феніл}циклогексил)ацетат, показаний вище, одержували наступним чином. F F O O S F O O O Метил [транс-4-[4[[(трифторметил)сульфоніл]окси]феніл]циклогексил]ацетат, показаний вище, який визначений як сполука 55 в патенті US 7,244,727, що виданий 17 липня 2007, одержували згідно з методикою описаною тут. Суміш метил [транс-4-[4-[[(трифторметил)сульфоніл]окси]феніл]циклогексил]ацетату (10,1 г, 26,6 ммоль), 2-{[трет-бутил (диметил)силіл]окси}етанаміну (5,59 г, 31,9 ммоль), який може бути одержаний за різними методиками включаючи ті, що описані в Journal of the American Chemical Society, 129(37), 11408-11420; 2007, Organic Letters, 9(1), 101-104; 2007 або Bioorganic & Medicinal Chemistry, 13(11), 3821-3839; 2005, карбонат цезію (8,65 г, 26,6 ммоль), ацетат паладію (0,60 г, 2,66 ммоль) і X-PHOS (1,27 г, 2,66 ммоль) в толуолі (53 мл) під азотом нагрівали в закритій пробірці при 120°C протягом 16 годин. Реакцію охолоджували, розводили EtOAc, промивали водою (2), насиченим водним розсолом, сушили над сульфатом натрію і концентрували одержуючи темне масло. Хроматографія (330 г ® Biotage Snap Cartridge колонка з силікагелем, 015% EtOAc : гептан) давала метил (транс-4-{4-[(2{[третбутил(диметил)силіл]окси}етил)аміно]феніл}циклогек 1 сил)ацетат як світло-жовте масло, 6,70 г. H ЯМР (400 МГц, CDCl3): 7,02, (д, 2H), 6,61 (д, 2H), 3,80 (м, 2H), 3,64 (с, 3H), 3,20 (м, 2H), 2,37 (м, 1H), 2,24 (м, 2H), 1,85 (м, 5H), 1,44 (м, 2H), 1,13 (м, 2H), 0,87 (с, 9H), 0,04 (с, 6H). m/z = 406,4 (M+1). Стадія 2. Метил [транс-4-(4-{(2-{[третбутил(диметил)силіл]окси}етил)[(4,6дихлорпіримідин-5іл)карбоніл]аміно}феніл)циклогексил]ацетат, показаний нижче, одержували наступним чином. 31 94833 Cl N O N N O Cl O O Si До перемішуваного, охолодженого (0C) розчину метил (транс-4-{4-[(2-{[трет-бутил(диметил)силіл]окси}етил)аміно]феніл}циклогексил)ацет ату (9,7 г, 24,0 ммоль), з Стадії 1, і TEA (3,53 мл, 25,3 ммоль) в ТГФ (60 мл) по краплям додавали розчин 4,6-дихлорпіримідин-5-карбонілхлориду (5,31 г, 25,1 ммоль) в ТГФ (20 мл). Через 2 години, реакцію концентрували у вакуумі, розводили EtOAc, промивали водою (3), насиченим водним розсолом, сушили над сульфатом натрію і концентрували у вакуумі, одержуючи масло, яке використовували на наступній стадії без додаткового очи1 щення. H ЯМР (400 МГц, CDCl3): 8,57 (с, 1H), 7,35 (д, 2H), 7,03 (д, 2H), 4,00 (м, 2H), 3,87 (м, 2H), 3,63 (с, 3H), 2,37 (м, 1H), 2,22 (м, 2H), 1,82 (м, 5H), 1,36 (м, 2H), 1,11 (м, 2H), 0,83 (с, 9H), 0,02 (с, 6H). m/z = 580,3 (M+1). Стадія 3. Метил (транс-4-{4-[[4,6дихлорпіримідин-5-іл)карбоніл](2гідроксиетил)аміно]феніл}циклогексил)ацетат, показаний нижче, одержували наступним чином. 32 промивали водою (3), насиченим водним розсолом, сушили над сульфатом натрію і концентрували у вакуумі одержуючи жовту тверду речовину. Цей матеріал суспендували в метанолі (10 мл), фільтрували, тверді речовини промивали метанолом (2 3 мл) і сушили у вакуумі одержуючи вказану в заголовку сполуку як жовту тверду речови1 ну, 4,03 г. H ЯМР (400 МГц, CDCl3): 8,75 (с, 1H), 7,22 (с, 4H), 4,75 (м, 2H), 4,03 (м, 2H), 3,63 (с, 3H), 2,50 (м, 1H), 2,23 (м, 2H), 1,87 (м, 5H), 1,44 (м, 2H), 1,19 (м, 2H). m/z = 430,3 (M+1). Приготування 2 Метил 2-((1S,4s)-4-(4-((R)-4-хлор-8-метил-5оксо-7,8-дигідропіримідо-[5,4-f][1,4]оксазепін-6(5H)іл)феніл)циклогексил)ацетат Cl N O N N O O O Метил (транс)-4-(4-((R)4-хлор-8-метил-5-оксо7,8-дигідро-піримідо[5,4-f][1,4]оксазепін-6(5H)іл)феніл]циклогексил}ацетат одержували наступним чином. Стадія 1. Метил [транс-4-(4-{[(2R)-2-{[третбутил(диметил)силіл]окси}пропіл]аміно}феніл)циклогексил]ацетат, показаний нижче, одержували наступним чином. O O O N N Cl O HN Si Cl O O N HO Розчин метил [транс-4-(4-{(2-{[третбутил(диметил)силіл]окси}етил)[(4,6дихлорпіримідин-5іл)карбоніл]аміно}феніл)циклогексил]ацетату (14,0 г, 24,0 ммоль), з Стадії 2, в метанольному розчині HCl (3 мл концентрованого водного HCl в 97 мл метанолу) перемішували при кімнатній температурі 30 хвилин. Метанол видаляли у вакуумі, залишок розчиняли в EtOAc, промивали насиченим водним бікарбонатом натрію, насиченим водним розсолом, сушили над сульфатом натрію і концентрували у вакуумі одержуючи масло, яке використовували на наступній стадії без додаткового очи1 щення. H ЯМР (400 МГц, CDCl3): 8,59 (с, 1H), 7,32 (д, 2H), 7,04 (д, 2H), 4,08 (м, 2H), 3,92 (м, 2H), 3,63 (с, 3H), 2,38 (м, 1H), 2,23 (м, 2H), 1,82 (м, 5H), 1,39 (м, 2H), 1,11 (м, 2H). m/z = 466,2 (M+1). Стадія 4. Вказану в заголовку Приготування 1 сполуку одержували наступним чином. Суспензію метил (транс-4-{4-[[4,6дихлорпіримідин-5-іл)карбоніл](2-гідрокси-етил) аміно]феніл}циклогексил)ацетату (4,78 г, 10,2 ммоль, неочищеного матеріалу з Стадії 3) і TEA (4,15 г, 41 ммоль) в ацетонітрилі перемішували при 80C протягом 6 годин. Реакцію охолоджували, концентрували у вакуумі, розводили EtOAc, Суміш метил [транс-4-[4[[(трифторметил)сульфоніл]окси]феніл]циклогексил]ацетату (5,00 г, 13,1 ммоль), показаного нижче, O O O O S F O F F (R)-2-(трет-бутилдиметилсилілокси)пропан-1аміну (2,99 г, 15,8 ммоль), показаного нижче, Si O NH2 який можна одержати за різними методиками включаючи ті, що описані в Journal of Organic Chemistry, 72(20), 7726-7735; 2007, карбонату цезію (5,14 г, 15,8 ммоль), ацетату паладію (310 мг, 1,32 ммоль) і X-PHOS (627 мг, 1,32 ммоль) в толу 33 94833 олі (100 мл) під азотом нагрівали в закритій пробірці при 120°C протягом 16 годин. Реакцію охолоджували, розводили EtOAc (500 мл), промивали водою (2(200 мл), насиченим водним розсолом, сушили над сульфатом натрію і концентрували одержуючи темне масло. Хроматографія (120 г колонка з силікагелем, 3-15% EtOAc : гептан) давала метил [транс-4-(4-{[(2R)-2-{[третбутил(диметил)силіл)окси} пропіл]аміно}феніл)циклогексил]ацетат як світложовте масло, 4,55 г (86%). m/z= 420,1 (M+1). Стадія 2. Метил [транс-4-(4-{[(2R)-2-{[третбутил(диметил)силіл]окси}пропіл]-[(4,6дихлорпіримідин-5іл)карбоніл]аміно}феніл)циклогексил]ацетат, показаний нижче, одержували наступним чином. 34 при 80°C протягом 30 годин. До реакційної суміші додавали EtOAc (250 мл) і воду (250 мл). Органічний шар відокремлювали і сушили над MgSO4 і концентрували. Неочищений матеріал очищали за допомогою 120 г колонки з силікагелем, елюювали 30-50% EtOAc в гептані, одержуючи безбарвне масло 1,85 г (61%) як вказану в заголовку сполуку. 1 m/z=444,1(M+1). H ЯМР (400 МГц, хлороформ-d) 1,09-1,23 (м, 2 H) 1,43 (д, J=6,64 Гц, 3 H) 1,44-1,57 (м, 2 H) 1,80-1,96 (м, 5 H) 2,26 (д, J=7,05 Гц, 2 H) 2,44-2,55 (м, 1 H) 3,68 (с, 3 H) 3,80-3,95 (м, 2 H) 5,00-5,12 (м, 1 H) 7,29 (с, 4 H) 8,76 (с, 1 H). Приготування 3 Метил (транс-4-{4-[(7S)-4-хлор-7-метил-5-оксо7,8-дигідропіримідо[5,4-f][1,4]оксазепін-6(5H)іл]феніл}циклогексил)ацетат O Cl O O N O N N O N N Cl N O O Cl Si O Суміш 4,6-дихлорпіримідин-5-карбонілхлориду (2,27 г, 10,7 ммоль), метил [транс-4-(4-{[(2R)-2{[трет-бутил(диметил)силіл]окси}пропіл]аміно}феніл)циклогексил]ацетату (4,50 г, 10,7 ммоль), з Стадії 1, і TEA (2,24 мл, 16,1 ммоль) в ТГФ (150 мл) перемішували при кімнатній температурі під азотом 14 годин. Реакційну суміш концентрували до видалення ТГФ. Залишок розводили EtOAc (300 мл), промивали водою (2200 мл), сушили над MgSO4 і концентрували. Неочищений матеріал очищали на 120 г колонці з силікагелем, елюювали 3-15% EtOAc в гептані, одержуючи метил [транс-4-(4-{[(2R)-2-{[третбутил(диметил)силіл]окси}пропіл][(4,6дихлорпіримідин-5-іл)карбоніл]аміно}феніл)циклогексил]ацетат, як безбарвне масло 4,01 г 1 (63%). m/z= 594,2 (M+1). H ЯМР (400 МГц, хлороформ-d) -0,06 (с, 6 H) 0,71 (с, 9 H) 0,99 - 1,14 (м, 2 H) 1,25 - 1,30 (м, 3 H) 1,30 - 1,42 (м, 2 H) 1,78 (дд, J=28,30, 11,90 Гц, 5 H) 2,20 (д, J=7,03 Гц, 2 H) 2,28 - 2,39 (м, 1 H) 3,64 (с, 3 H) 3,83 - 3,97 (м, 2 H) 4,04 4,14 (м, 1 H) 7,00 (д, J=8,20 Гц, 2 H) 7,19 (д, J=8,59 Гц, 2 H) 8,53 (с, 1 H). Стадія 3. Вказану в заголовку Приготування 2 сполуку одержували наступним чином. 4M HCl в діоксані (25 мл) додавали до розчину метил [транс-4-(4-{[(2R)-2-{[третбутил(диметил)силіл]окси}пропіл][(4,6дихлорпіримідин-5-іл)карбоніл]аміно}феніл)циклогексил]ацетату (3,95 г, 6,72 ммоль), з Стадії 2, в метанолі (50 мл). Суміш перемішували при 23°C протягом 30 хвилин. Реакційну суміш концентрували до видалення розчинника. Залишок розчиняли в ацетонітрилі (200 мл), потім до нього додавали K2CO3 (1,86 г, 13,5 ммоль) і 5 Å молекулярні сита (1,0 г). Реакційну суміш перемішували Сполуку, метил (транс-4-{4-[(7S)-4-хлор-7метил-5-оксо-7,8-дигідропіримідо[5,4f][1,4]оксазепін-6(5H)-іл]феніл}циклогексил)ацетат, одержували наступним чином. Стадія 1. (S)-1-(Третбутилдиметилсилілокси)пропан-2-амін, показаний нижче, одержували наступним чином. NH2 Si O Трет-бутилдиметилсилілхлорид (22,1 г, 146 ммоль) додавали до перемішуваного розчину (S)2-амінопропан-1-олу (10 г, 130 ммоль) і TEA (23,9 мл, 172 ммоль) в 325 мл дихлорметану. Гетерогенну суміш перемішували при кімнатній температурі 18 годин. Реакцію розводили в EtOAc і органічний шар промивали розсолом, потім сушили над сульфатом натрію і концентрували у вакуумі виді1 ляючи 20,37 г продукту. H ЯМР (400 МГц, хлороформ-d) 0,05 (с, 6 H) 0,89 (с, 9 H) 1,01 (д, J=6,64 Гц, 3 H) 2,87 - 3,07 (м, 1 H) 3,18 - 3,35 (м, 1 H) 3,51 (дд, J=9,75, 4,35 Гц, 1 H) m/z= 190,2 (M+1). Стадія 2. 2-((1S,4r)-4-(4-((S)-1-(третбутилдиметилсилілокси)пропан-2іламіно)феніл)циклогексил)оцтову кислоту, показану нижче, одержували наступним чином Si O H N O HO Суміш метил [транс-4-(4{[(трифторметил)сульфоніл]окси}феніл)циклогексил]ацетату (1 г, 3 ммоль), (S)-1(трет-бутилдиметилсилілокси)-пропан-2-аміну (0,597 г, 3,16 ммоль), ацетату паладію (II) (0,061 г, 0,271 ммоль), X-PHOS (0,125 г, 0,263 ммоль), карбонату цезію (1,03 г, 3,16 ммоль) розводили в 26,3 мл толуолу. Суміш промивали потоком азоту про 35 94833 тягом декількох хвилин і потім щільно закривали. Реакцію потім нагрівали при 120°C при перемішуванні протягом 16 годин. Реакцію потім охолоджували і розводили EtOAc. Органічну суміш промивали водою і розсолом, сушили над MgSO4 і концентрували. Продукт переносили на колонку з силікагелем і використовували 5-20% EtOAc в гептані одержуючи 0,82 г метил транс 2S-(4-(4-(1(трет-бутилдиметилсилілокси)пропан-21 іламіно)феніл)циклогексил)ацетату. H ЯМР (400 МГц, хлороформ-d) 0,03 (д, J=4,98 Гц, 6 H) 0,89 (с, 9 H) 1,05 - 1,19 (м, 2 H) 1,18 (д, J=6,22 Гц, 3 H) 1,44 (к, J=12,44 Гц, 2 H) 1,76 - 1,93 (м, 5 H) 2,23 (д, J=7,05 Гц, 2 H) 2,34 (т, J=12,03 Гц, 1 H) 3,42 - 3,65 (м, 3 H) 3,67 (с, 3 H) 6,55 (д, J=8,29 Гц, 2 H) 6,99 (д, J=8,29 Гц, 2 H). m/z= 420,3 (M+1) Стадія 3. Метил [транс-4-(4-{[(3S)-2-{[третбутил(диметил)силіл]окси}пропіл]-[(4,6дихлорпіримідин-5іл)карбоніл]аміно}феніл)циклогексил]ацетат, показаний нижче, одержували наступним чином: O Cl O O N N N Cl O Si 4,6-Дихлорпіримідин-5-карбонілхлорид (0,454 г, 2,15 ммоль) додавали до розчину метил транс 2S-(4-(4-(1-(трет-бутилдиметилсилілокси)пропан2-іламіно)феніл)циклогексил)ацетату (0,82 г, 2,0 ммоль), з Стадії 2, і діізопропілетиламіну (0,418 мл, 2,4 ммоль) в 4,16 мл MТГФ при 0°C і перемішували холодний протягом 1,5 годин. Додавали воду і EtOAc; шари розділяли. Промивали органічний шар насиченим бікарбонатом натрію, розсолом, потім сушили і концентрували. Продукт піддавали колонковій хроматографії на силікагелі використовуючи 10-30% EtOAc в гептані одержую1 чи 0,95 г продукту. H ЯМР (400 МГц, хлороформd) 0,06 (д, J=4,98 Гц, 6 H) 0,90 (с, 9 H) 0,99 - 1,18 (м, 2 H) 1,17 (д, J=6,64 Гц, 3 H) 1,28 - 1,45 (м, 2 H) 1,73 - 1,94 (м, 5 H) 2,23 (д, J=6,64 Гц, 2 H) 2,38 (т, J=11,61 Гц, 1 H) 3,51 - 3,66 (м, 2 H) 3,67 (с, 3 H) 4,84 - 5,03 (м, 1 H) 7,03 (д, J=8,71 Гц, 2 H) 7,34 (шс, 2 H) 8,50 (с, 1 H). m/z= 597,2 (M+4) Стадія 4. Метил [транс-4-(4-{[(3S)-2{окси}пропіл][(4,6-дихлорпіримідин-5іл)карбоніл]аміно}феніл)циклогексил]ацетат, показаний нижче, одержували наступним чином. O Cl O O N N N Cl OH Метил [транс-4-(4-{[(3S)-2-{[третбутил(диметил)силіл]окси}пропіл][(4,6 36 дихлорпіримідин-5іл)карбоніл]аміно}феніл)циклогексил]ацетат (0,95 г, 1,6 ммоль), з Стадії 3, і 7,4 мл 1% HCl-метанол (3 мл 36% водного HCl і 97 мл метанолу) перемішували при кімнатній температурі і контролювали за допомогою РХ-МС. Реакційну суміш концентрували до видалення метанолу. Неочищений матеріал розчиняли в EtOAc (200 мл). EtOAc розчин промивали водним розчином NaHCO3 (2x100 мл), водою (100 мл) і розсолом (100 мл), сушили над MgSO4 і концентрували одержуючи 0,77 г продук1 ту. H ЯМР (400 МГц, хлороформ-d) 1,03 - 1,17 (м, 2 H) 1,19 (д, J=7,05 Гц, 3 H) 1,29 - 1,46 (м, 2 H) 1,69 - 1,91 (м, 5 H) 2,23 (д, J=7,05 Гц, 2 H) 2,38 (т, J=12,23 Гц, 1 H) 3,60 (дд, J=11,61, 9,12 Гц, 1 H) 3,67 (с, 3 H) 3,78 (дд, J=11,82, 4,35 Гц, 1 H) 4,85 5,04 (м, 1 H) 7,07 (д, J=8,71 Гц, 2 H) 7,33 (шс, 2 H) 8,52 (с, 1 H) m/z= 483,1 (M+4). Стадія 5. Вказану в заголовку Приготування 3 сполуку одержували наступним чином. Метил [транс-4-(4-{[(3S)-2-{окси}пропіл][(4,6дихлорпіримідин-5-іл)карбоніл]аміно}феніл)циклогексил]ацетат (0,8 г, 1,66 ммоль), карбонат калію (0,46 г, 3,33 ммоль) і 200 мг молекулярні сита змішували в 41,6 мл ацетонітрилу. Суміш додавали до закритої пробірки і нагрівали при 80°C протягом ночі. Реакційну суміш концентрували і потім розводили EtOAc і водою. Шари розділяли і промивали органічний шар розсолом, потім сушили і концентрували. Продукт хроматографували на силікагелі використовуючи 1 40% етилацетату в гептані одержуючи 0,22 г. H ЯМР (400 МГц, хлороформ-d) 1,06 (д, J=7,05 Гц, 3 H) 1,10 - 1,25 (м, 2 H) 1,42 - 1,55 (м, 2 H) 1,73 1,98 (м, 5 H) 2,26 (д, J=6,64 Гц, 2 H) 2,41 - 2,59 (м, 1 H) 3,69 (с, 3 H) 4,27 - 4,42 (м, 1 H) 4,45 - 4,70 (м, 2 H) 7,17 (д, J=8,29 Гц, 2 H) 7,30 (д, J=8,71 Гц, 2 H) 8,76 (с, 1 H) m/z= 444,0 (M+1). Приготування 4 Метил 2-(4-(4-(4-хлор-5-оксо-7,8дигідропіримідо[5,4-f][1,4] оксазепін-6(5H)-іл)-3фторфеніл)циклогексил)ацетат N Cl O N N O O F O Метил 2-(4-(4-(4-хлор-5-оксо-7,8дигідропіримідо[5,4-f][1,4]оксазепін-6(5H)-іл)-3фторфеніл)циклогексил)ацетат, показаний вище, одержували наступним чином. Стадія 1. 1-(Бромметил)бензол (4,92 г, 28,8 ммоль) і K2CO3 (3,98 г, 28,8 ммоль) додавали до розчину 4-бром-2-фторфенолу (5,0 г, 26 ммоль) в ацетоні. Реакційну суміш перемішували при кімнатній температурі 18 годин. Додавали воду (100 мл) і EtOAc (100 мл), органічний шар відокремлювали і сушили над MgSO4 і концентрували одержуючи 1(бензилокси)-4-бром-2-фторбензол, як жовту тверду речовину 7,06 г. 1 H ЯМР (400МГц, CDCl3): 7,24-7,41(м, 5H), 7,20(м, 1H), 7,16(м, 1H), 6,82(м, 1H), 5,10(м, 2H). Стадія 2. Метил 2-(4-(4-(бензилокси)-3 37 94833 фторфеніл)циклогекс-3-еніл)ацетат, нижче, одержували наступним чином. 38 показаний F O O O O O F F F Pd(PPh3)4 (16,2 мг, 0,014 ммоль) і CsCO3 (142 мг, 0,428 ммоль) додавали до розчину 1(бензилокси)-4-бром-2-фторбензолу (130 мг, 0,464 ммоль) і метил 2-(4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)циклогекс-3-еніл)ацетату (100 мг, 0,357 ммоль), показаний нижче і одержаний як описано в Приготуванні 4A, O O B O O в ТГФ (2 мл) під азотом. Реакційну суміш кип‟ятили при перемішуванні протягом 24 годин. РХ-МС показала бажаний продукт. Реакційну суміш охолоджували, розводили EtOAc (30 мл), промивали водою і розсолом, сушили над MgSO4 і концентрували. Неочищений матеріал очищали хроматографічно (12 г колонку з силікагелем елюювали 5-10% EtOAc : гептан) одержуючи метил 2-(4-(4-(бензилокси)-3фторфеніл)циклогекс-3-еніл)ацетат як білу тверду 1 речовину (110 мг). H ЯМР(400МГц, CDCl3): 7,287,42(м, 5H), 7,10(дд, 1H), 7,0(д, 1H), 6,88(т, 1H), 6,0(м, 1H), 5,1(с, 2H), 3,66(с, 3H), 2,38(м, 2H), 2,3(д, 2H), 2,2(м, 1H), 2,1(м,1H), 1,9(м,2H), 1,4(м, 1H). m/z= 355,4(M+1). Стадія 3. Метил 2-(4-(3-фтор-4гідроксифеніл)циклогексил)ацетат, показаний нижче, одержували наступним чином. O O HO F Метил 2-(4-(4-(бензилокси)-3фторфеніл)циклогекс-3-еніл)ацетат (520 мг, 1,47 ммоль) розчиняли в етанолі (15 мл) і EtOAc (15 мл). Додавали 20% Pd(OH)2/C (150 мг). Реакційну суміш збовтували при тиску водню 50 псі протягом 20 годин. Суміш фільтрували через діатомову зе® млю (Celite ) для видалення каталізатора і потім концентрували. Очищали за допомогою хроматографії (12 г RediSep® колонка з силікагелем (Teledyne ISCO, Lincoln, NE) використовуючи 510% EtOAc : гептан), одержуючи метил 2-(4-(4(бензилокси)-3-фторфеніл)циклогекс-3-еніл)ацетат 1 як безбарвне масло (320 мг). H ЯМР(400МГц,CDCl3): 6,80-7,0(м, 3H), 5,58(д, 1H), 3,63(с, 3H), 2,24-2,5(м, 1H), 2,4, 2,2(д, 2H), 1,8(м,3H), 1,6(м,4H), 1,4(м,1H), 1,12(м,1H). m/z= 265,3 (M-1). Стадія 4. Метил 2-(4-(3-фтор-4(трифторметилсульфонілокси)феніл) циклогексил)ацетат, показаний нижче, одержували наступним чином. O O S O F До перемішуваного розчину фенолу (310 мг, 1,16 ммоль) і TEA (0,24 мл, 1,75 ммоль) в CH2Cl2 (5 мл) додавали по краплям розчин трифлік ангідриду (413 мг, 1,46 ммоль). Суміш перемішували при 0°C протягом 2 годин. Реакційну суміш промивали водою (2) і розсолом (1), сушили над Na2SO4 і фільтрували. Органічний розчин концентрували і очищали хроматографічно (12 г колонку з силікагелем елюювали 3-15% EtOAc : гептан) одержуючи метил 2-(4-(3-фтор-4(трифторметилсульфонілокси)феніл)циклогексил)ацетат, як безбарвне масло (380 мг). m/z= 397,4 (M-1). Стадія 5. Метил 2-(4-(4-(2-(третбутилдиметилсилілокси)етиламіно)-3фторфеніл)циклогексил)ацетат, показаний нижче, одержували наступним чином. F NH O O O Si Суміш метил 2-(4-(3-фтор-4(трифторметилсульфонілокси)феніл)циклогексил)ацетату (190 мг, 0,477 ммоль), 2{[трет-бутил(диметил)силіл]окси}етанаміну (100 мг, 0,572 ммоль), карбонату цезію (171 мг, 0,525 ммоль), ацетату паладію (11 мг, 0,048 ммоль) і (XPHOS) (23 мг, 0,048 ммоль) в толуолі (5 мл), під азотом, нагрівали в закритій пробірці при 120°C протягом 16 годин. Реакцію охолоджували, розводили EtOAc, промивали водою (2), насиченим водним розсолом, сушили над сульфатом натрію і концентрували одержуючи темне масло. Хроматографія (12 г колонка з силікагелем, 3-15% EtOAc : гептан) давала метил 2-(4-(4-(2-(третбутилдиметилсилілокси)етиламіно)-3-фторфеніл)циклогексил)ацетат, як світло-жовте масло, 110 1 мг. H ЯМР (400 МГц, CDCl3): 7,2(м,1H), 6,95(м,1H), 6,8(м, 1H), 3,8(м, 2H), 3,64(с, 3H), 3,2(м, 2H), 2,5, 2,3(м, 1H), 2,4, 2,2(д, 2H), 1,85(м, 2H), 1,64(м, 5H), 1,4(м,1H), 1,1(м, 1H), 0,88(с, 9H), 0,06(с, 6H). m/z=424,2(M+1). Стадія 6. Метил 2-(4-(4-(N-(2-(третбутилдиметилсилілокси)етил)-4,6дихлорпіримідин-5-карбоксамідо)-3фторфеніл)циклогексил)ацетат, показаний нижче, одержували наступним чином. 39 94833 Cl N O N N O Cl F O O Si Суміш 4,6-дихлорпіримідин-5-карбонілхлориду (82,5 мг, 0,390), метил 2-(4-(4-(2-(третбутилдиметилсилілокси)етиламіно)-3фторфеніл)циклогексил)ацетату (110 мг, 0,26 ммоль) і TEA (0,054 мл, 0,39 ммоль) в ТГФ (2 мл) перемішували при кімнатній температурі під азотом 14 годин. Реакційну суміш концентрували до видалення ТГФ. Залишок розводили EtOAc, промивали водою, сушили над MgSO4 і концентрували. Неочищений матеріал очищали за допомогою 12 г колонки з силікагелем, що елюювали 3-15% EtOAc в гептані, одержуючи метил 2-(4-(4-(N-(2(трет-бутилдиметилсилілокси)етил)-4,6дихлорпіримідин-5-карбоксамідо)-3фторфеніл)циклогексил)ацетат, як безбарвне масло (60 мг). m/z= 598,2 (M+1). Стадія 7. Вказану в заголовку Приготування 4 сполуку одержували наступним чином. 4M HCl в діоксані (0,5 мл) додавали до розчину метил 2-(4-(4-(N-(2-(третбутилдиметилсилілокси)етил)-4,6дихлорпіримідин-5-карбоксамідо)-3фторфеніл)циклогексил)ацетату (30 мг, 0,05 ммоль) в метанолі (1 мл). Суміш перемішували при 23°C протягом 30 хвилин. Реакційну суміш концентрували до видалення розчинника. Залишок розчиняли в ацетонітрилі (1 мл) і додавали NEt3 (0,05 мл). Реакційну суміш перемішували при 80°C протягом 18 годин. До реакційної суміші додавали EtOAc (15 мл) і воду (15 мл). Органічний шар відокремлювали і сушили над MgSO4 і концентрували. Неочищений матеріал очищали використовуючи 4 г колонку з силікагелем, що елюювали 30-50% EtOAc в гептані, одержуючи метил 2-(4-(4-(4-хлор5-оксо-7,8-дигідропіримідо[5,4-f][1,4]оксазепін6(5H)-іл)-3-фторфеніл)циклогексил)ацетат, як безбарвне масло (20 мг). m/z=448,4(M+1). Приготування 4A Метил 2-(4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)циклогекс-3-еніл)ацетат O O B O O Метил 2-(4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)циклогекс-3-еніл)ацетат одержували наступним чином. NaH (9,2 г, 384 ммоль, 1,5 ек) суспендували в ТГФ (850 мл). Охолоджували до C і по краплям підтримуючи температуру T
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted bicyclolactams
Автори англійськоюDow, Robert, Lee, Munchhof, Michael, John
Назва патенту російськоюЗамещенные бициклолактамы
Автори російськоюДоу Роберт Ли, Мунчхоф Майкл Джон
МПК / Мітки
МПК: A61K 31/553, C07D 498/04, A61P 3/04, A61P 3/10
Мітки: заміщені, біциклолактами
Код посилання
<a href="https://ua.patents.su/31-94833-zamishheni-biciklolaktami.html" target="_blank" rel="follow" title="База патентів України">Заміщені біциклолактами</a>
Попередній патент: Спосіб отримання нанокристалічних матеріалів на основі манганітів лантану
Наступний патент: Роторно-імпульсний апарат
Випадковий патент: Пристрій управління сукупністю малопотужних вітроенергетичних установок та сонячних батарей












