Антитромбічні азациклоалкілалканоїльні пептиди і псевдопептиди
Номер патенту: 48252
Опубліковано: 15.08.2002
Автори: Гарнер Чарльз Дж., Клєйн Скотт І., МОЛІНО Брюс Ф., Чекай Марк
Формула / Реферат
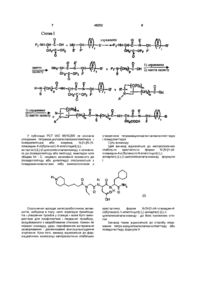
1. Сполука формули (VII)
(VII),
де
В являє собою алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, аралкіл, алкіларил або алкіларалкіл;
Е1 являє собою Н;
Е2 являє собою a-вуглецевий бічний ланцюг природної a-амінокислоти, Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, заміщений арил, аралкіл, заміщений аралкіл, гетероцикліл, заміщений гетероцикліл, гетероциклілалкіл, заміщений гетероциклілалкіл, або Е1 і Е2 разом з атомом азоту і атомом вуглецю, через які Е1 і Е2 пов'язані, утворять 4-, 5-, 6- або 7-членне азациклоалканове кільце;
G являє собою OR1 або NR1R2;
R1 і R2 незалежно один від одного являють собою Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, аралкіл, алкіларил або алкіларалкіл;
р приймає значення від 1 до 4;
Ρ1 являє собою нестійку при гідруванні захисну групу для кислоти; і
Р2' являє собою Р2 або ТФОК·Н-; і
Р2 являє собою нестійку в кислоті захисну групу для аміногрупи.
2. Сполука по п. 1, де
В являє собою алкіл;
Е1 являє собою Н;
Е2 являє собою циклоалкілалкіл;
G являє собою NR1R2;
R1 і R2 являють собою Н; і
р приймає значення 1.
3. Сполука по п. 2, де
В являє собою етил; і
Е2 являє собою циклогексилметил.
4. Сполука по п. 3, де
Р1 являє собою бензил; і
Р2' являє собою ТФУК·Н-.
5. Сполука по п. 3, де
Р1 являє собою бензил; і
Р2 являє собою трет-бутоксикарбоніл.
Текст
1 Сполука формули (VII) 8 СН и f -CH-C— G СН2СО2Р1 (VII), Де В являє собою алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, аралкіл, алкіларил або алкіларалкіл, Е1 являє собою Н, Е2 являє собою а-вуглецевий бічний ланцюг природної а-амшокислоти, Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, заміщений арил, аралкіл, заміщений аралкіл, гетероцикліл, заміщений гетероцикліл, гетероциклілалкіл, заміщений гетероциклілалкіл, Ця заявка є заявкою в часткове продовження США Серії № 08/476750, поданої 7 січня 1995 р Остання заявка є продовжуючою заявкою заявки США № 08/628648, поданої 17 жовтня 1994 р, що знаходиться на розгляді Ця заявка є заявкою в часткове продовження заявки США, що знаходиться на розгляді, № 08/138820, поданої 15 жовтня 1993 р, яка в цей час анульована Винахід відноситься до непгроскопічної стабільної кристалічної форми N-[N-[N-(4піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_) або Е1 і Е2 разом з атомом азоту і атомом вуглецю, через які Е1 і Е2 пов'язані, утворять 4-, 5-, 6- або 7членне азациклоалканове кільце, G являє собою OR1 або NR1R2, R1 і R2 незалежно один від одного являють собою Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, аралкіл, алкіларил або алкіларалкіл, р приймає значення від 1 до 4, Р1 являє собою нестійку при гідруванні захисну групу для кислоти і Р2' являє собою Р або ТФОІОН-, і Р2 являє собою нестійку в кислоті захисну групу для аміногрупи 2 Сполука по п 1, де В являє собою алкіл, Е1 являє собою Н, Е2 являє собою циклоалкілалкіл, G являє собою NR1R2, R1 і R2 являють собою Н, і р приймає значення 1 3 Сполука по п 2, де В являє собою етил, і Е2 являє собою циклогексилметил 4 Сполука по п 3, де Р1 являє собою бензил, і Р2' являє собою ТФУІОН5 Сполука по п 3, де Р1 являє собою бензил, і Р2 являє собою трет-бутоксикарбоніл О ю 00 аспартил]-(І_)-р-циклогексилаланшаміду формули 1 (0 48252 Сполука має антитромботичну активність, інгібуючи в тому числі агрегацію тромбоцитів і утворення тромбів у ссавши і може бути використане для профілактики і лікування тромбозу, асоційованого з такими хворобливими станами, як інфаркт міокарду, удар, периферичне артеріальне захворювання і дисемшоване внутрішньосудинне згортання Крім того, винахід відноситься до способу отримання кристалічної форми N-[N-[N-(4піперидин-4-іл)буганоіл)-І\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшаміду, а також до його фармацевтичної композиції і його проміжних сполук Винахід також відноситься до проміжних сполук, які можуть бути використані при отриманні тетраазациклоалкілалканоілпептидних або псевдопептидних сполук Гемостаз, тобто біохімія згортання крові, представляє собою виняткове складне явище, внаслідок якого нормальна суцільна кров і тканини тіла мимовільно зупиняють кровотечу з пошкоджених кровоносних судин Для ефективного гемостазу необхідна об'єднана активність судинних, тромбоцитарних і плазматичних чинників, а також контролюючий механізм, що попереджає надмірне згортання Дефекти, недолік або надлишок будь-кого з цих компонентів можуть привести до кровотеч або тромбозу Адгезія тромбоцитів, поширення і агрегація на позаклітинних матрицях є центральними подіями при утворенні тромбів Ці ПОДІЇ опосредуються за допомогою сімейства адгезивних гликопротешів, тобто, фібриногену, фібронектину і чинника фон Віллебранда Фібриноген являє собою кофактор агрегації тромбоцитів, тоді як фібронектин підтримує прикріплення тромбоцитів і реакції розподілу Чинник фон Віллебранда має велике значення при прикріпленні тромбоцитів до субендотелиальних матриць і їх розподілу на цих матрицях Сайти скріплення фібриногену, фібронектину і чинника фон Віллебракда розташовані на протеїновому комплексі мембрани тромбоцита, який відомий як гликопротеш ІІЬ/ІІІа Адгезивні гликопротеши типу фібриногену не зв'язуються з нормальними тромбоцитами, що знаходяться в спокої Однак коли тромбоцит активований агоністом, таким яктромбін або аденозиндифосфат, тромбоцит міняє свою форму, ймовірно роблячи сайт скріплення GPIIb/llla доступним для фібриногену Сполука цього винаходу блокує рецептор фібриногену і, таким чином, виявляє вищезазначену антитромботичну активність 2 ВІДОМІ розробки Встановлено, що для взаємодії з клітинним поверхневим рецептором у фібриногені, фібронектині і чиннику фон Віллебранда повинен бути присутнім Arq-Gly-Asp (RGD) (Ruoslahti E, Pierschbacher, Cell, 1986, 44, 517 - 18) Дві ІНШІ амінокислотні ПОСЛІДОВНОСТІ, ЯК ВИЯВЛЯЄТЬСЯ, та кож беруть участь в прикріпленні тромбоцитів під дією фібриногену, а саме ПОСЛІДОВНІСТЬ Gly-ProArg і додекапептид, ПОСЛІДОВНІСТЬ His-His-Leu-GlyGly-Ala-Lys-Gln-Ala-Gly-Asp-Val Невеликі синтетичні пептиди, що містять RGD або додекапептид, як було показано, зв'язуються з GPIIb/llla рецептором тромбоцита і конкурентно інгібують скріплення фібриногену, фібронектину і чинника фон Віллебранда, а також інгібують агрегацію активованих тромбоцитів (Flow, et al , Proc Natl Acad Sci USA 1985, 82, 8057 - 61, Ruggen, et al , Proc Natl Acad Sci USA 1986, 5709 - 12, Gmsberq, et al , J Biol Chem 1985, 260, 3931 - 36 і Gartner et al , J Biol Chem 1987, 260,11,891 -94) Індолильні сполуки, що містять гуанідіноалканоїл- і гуанідіноалкеноіл-аспартильні фрагменти, як повідомляється, є інгібіторами агрегації тромбоцитів (Tjoeng, et al , Патенти США №№ 5037808 14879313) У патенті США № 4992463 (Tjoeng, et al), виданому 12 лютого 1991 p , в загальному вигляді описано, що ряд арил- і аралкілгуанідіноалкілпептидних миметичних сполук володіє інгібуючою дією на агрегацію тромбоцитів, конкретно описаний ряд моно- і диметоксифенілпептидних миметичних сполук і біфенілалкілпептидна миметична сполука У патенті США № 4857508 (Adams et al), виданому 15 серпня 1989р, в загальному вигляді описано, що ряд похідних гуанідіноалкілпептидів, що містять кінцеві аралкільні замісники, виявляє інгібуючу агрегацію тромбоцитів активність, і конкретно описаний ряд ПРО-метилтирозин-, біфеніл-1 нафтилпохідних , що містять кінцеву амідну функціональність Haverstick D М з співавторами (Blood, 66 (4), 946 - 952, 1985) розкриває ряд синтетичних пептидів, втому числі aig-gly-asp-ser і gly-arg-gly-asp-ser, які володіють здатністю інгібувати тромбіном агрегацію тромбоцитів, що індукується Plow E F з співавторами (Proc Natl Acad Sci USA 79, 3711 - 3715, I982) показали, що тетрапептид гліцил-І_-лролил-І_-аргиніл-І_-пролш інгібує скріплення фібриногена з тромбоцитами людини У Французькій заявці № 86/17507, поданій 15 грудня 1986 р , указано, що тетра-, пента- і гексапептидні ПОХІДНІ, що містять ПОСЛІДОВНІСТЬ -arg-glyasp-, можуть бути використані як антитроботичні агенти У патенті США № 4683291 (Zimmerman et al), виданому 28 липня 1987 р , показано, що ряд пептидів, що складаються з 6 - 40 амінокислот, які містять ПОСЛІДОВНІСТЬ -arg-gly-asp-, являє собою інгібітори скріплення тромбоцитів У Європейській патентній публікації № 0319506, опублікованій 7 червня 1989 р , показано, що ряд тетра-, пета- і гексапептидних похідних, тих, що містять ПОСЛІДОВНІСТЬ -arg-gly-asp-, являє собою інгібітори агрегації тромбоцитів ЦИКЛІЧНІ пептидні аналоги, що містять фрагмент Gly-Asp, як показано в патенті США № 5023233, є антагоністами рецепторів фібриногену Пептиди і псевдопептиди, що містять аміно-, гуанідшо-, імідазалоїл- і/або амідиноалканоїл- і алкеноіл-фрагменти, є антитромботичними агентами Вони описані в заявках США №№, що знаходяться на розгляді 07/677066, 07/534385 і 07/460777, поданих 28 березня 1991 р , 7 червня 1990р і4січня1990р ВІДПОВІДНО, а також в патенті США № 4952562 і міжнародній заявці № PCT/US90/05448, поданій 25 вересня 1990р, всі права на які передані правонаступнику по цьому винаходу 48252 Пептиди і псевдопептиди, що містять аміно- і гуанідшо-алкіл-1 алкеніл-бензоїл-, фенілалканоїл-1 фенілалкеноіл-фрагменти, є антитромботичними агентами, що показано в заявці, що знаходиться на розгляді США № 07/475043, направленій на розгляд 5 лютого 1990р , і в міжнародній публікації № PCT/US91/02471, направленій на розгляд 11 квітня, 1991 р до опублікованої як Міжнародна публікація № WO 92/13117 29 жовтня 1992 р, всі права на які передані правонаступнику по цьому винаходу ПОХІДНІ алканоїл- і заміщених алканоілазациклоалкілформіласпарапнової кислоти описані як інгібітори агрегації тромбоцитів в патенті США № 5053392, поданому 1 грудня 1989р, всі права на який передані правонаступнику по цьому винаходу і що має тих же авторів, що і цей винахід ПОХІДНІ N-заміщеноі азациклоалкілкарбонілциклічної аміноациласпарапнової кислоти описані як антитромботичні агенти в патенті США № 5064814, поданому 5 квітня 1990р тими ж винахідниками і всі права на який передані правонаступнику по цьому винаходу ПОХІДНІ азациклоалкілформілгліциласпарапнової кислоти представлені як антитромботичні агенти в патенті США № 5051405, поданому 10 жовтня 1989р, і всі права на який передані правонаступнику по цьому винаходу У Європейській патентній заявці 0479481, опублікованій 8 квітня 1992р , як антагоністи рецепторів фібриногену описані азациклоалкілалканоілгліциласпартиламшокислоти У Європейській патентній заявці 0478362, опублікованій 1 квітня 1992р , як антагоністи рецепторов фібриногену описані азациклоалкілалканоілпептидил-р-аланіни У патентній публікації РСТ № WO 95/10295 розкриті азациклоалкілалканоілпептиди і псевдопептиди формули II 1 | > H В 0 і, зокрема, г\І-[г\І-[г\І-(4-пиперидин-4іл)бутаноіл)-г\І-етилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшамід, якої інгібує агрегацію тромбоцитів і утворення тромбів у ссавців і може бути використаний при профілактиці і лікуванні тромбозу Отриманий ВІДПОВІДНО ДО опису патентної публікації № WO 95/10295 N-[N-[N-(4піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшамід є аморфним, гігроскопічним і фізично нестабільним, оскільки він абсорбує вологу У патентній публікації РСТ № WO 95/10295 не описана непгроскопічна стабільна кристалічна форма N-[N-[N-(4-ninepnflHH-4іл)бутаноіл)-г\І-етилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду У патентній публікації РСТ № WO 95/10295 також показано, що азациклоалкілалканоілпептиди і псевдопептиди звичайно отримують по методиках стандартного твердофазного пептидного синтезу або пептидного синтезу в рідкій фазі з використанням початкових матеріалів і/або легко доступних ^ " Р О С—NH-CH-C-2 СКгСООН (И) проміжних сполук, що поставляються ХІМІЧНИМИ компаніями, такими як Aldnch або Sigma (H Paulsen, G Merz, V Weichart, "Solid-Phase Synthesis of O-Glycopeptide Sequences", Angew Chem Int Ed Engl 27(1988), H Mergler, R Tanner, J Gosteh, P Gregg, "Peptide Synthesis by a Combination of Solid-Phase and Solution Methods I A New Very Acid-Labile Anchor Group for the Solid-Phase Synthesis of Fully Protected Fragments" Tetrahedron Letters, 29, 4005 (1988), Mernfield R В , "Solid Phase Peptide Synthesis after 25 Years The Design and Synthesis of Antagonists of Glucagon" Makromol Chem Symp 19, 31 (1983)) Крім того, в патентній публікації заявки РСТ № WO 95/10295 указано, що аморфну і гігроскопічну форму N-[N-[N-(4піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшаміду отримують шляхом послідовного синтезу з С-кінцевої амінокислоти, як це показане на схемі І 48252 Схема I D I) я О зняття захисту A1 1) спряження 2) зняття захист} ^ У публікації РСТ WO 95/10295 не описана утворення тетраазациклоалкілалканоїл пептид їв і псевдопептидів або, зокрема, N-[N-[N-(4піперидин-4-іл)бутаноіл)-І\І-етилгліцил]-(І_)аспартил]-(і)-р-циклогексилаланшаміду з основного ди (псевдопептиду або пептиду), внаслідок чого обидва № і С- кінцевих закінчення основного ди (псевдопептиду або дипептиду) сполучаються з псевдоамшокислотами і/або амінокислотами з -NH-CH-.C—N—сН CtfeCOOH утворенням тетраазациклоалкіл-алканоїл пептид їв і псевдопептидів Суть винаходу Цей винахід відноситься до непгроскопічної стабільної кристалічної форми N-[N-[N-(4піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшаміду формули (І) Сполучення володіє антитромботичною активністю, інгібуючи в тому числі агрегацію тромбоцитів і утворення тромбів у ссавців і може бути використане для профілактики і лікування тромбозу, асоційованого з хворобливими станами, такими як інфаркт міокарду, удар, периферичне артеріальне захворювання і дисемшоване внутрішньосудинне згортання Крім того, винахід відноситься до фармацевтичної композиції непгроскопічної стабільної кристалічної форми N-[N-[N-(4-ninepHflHH-4іл)бутаноіл)-г\І-етилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду і до його проміжних сполук Винахід також відноситься до способу отримання тетра-азациклоалкілалканоїлпептиду або псевдопептиду формули II 48252 10 (П) Де А являє собою Н, В являє собою алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, аралкіл, алкіларил або алкіларалкіл CGG Z являє собою Е1 являє собою Н; Е являє собою а-вуглецевий бічний ланцюг природної (-амінокислоти, Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, заміщений арил, аралкіл, заміщений аралкіл, гетероцикліл, заміщений гетероцикліл, гетероциклілалкіл, заміщений гетероциклілалкіл, або Е1 і Е2 разом з атомом азоту і атомом вуглецю, через які Е1 і Е2 пов'язані, утворять 4-, 5-, 6- або 7членне азациклоалканове кільце, G являє собою OR1 чи NR1R2 R1 і R2 незалежно один від одного являють собою Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, аралкіл, алкіларил або алкіларалкіл, R являє собою Н, алкіл, арил або аралкіл, m приймає значення від 1 до 5, п приймає значення від 0 до 6, і р приймає значення від 1 до 4, і, зокрема, непгроскопічної стабільної форми І\І-[г\І-[г\І-(4-піперидин-4-іл)бутаноіл)-г\І-етилгліцил](І_)-аспартил]-(І_)-р-циклогексилаланшаміду Винахід також відноситься до сполуки формули II км—UHJL-* 4 ™C iC ' Q ™ ' r' *~ (VII) Де В являє собою алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, аралкіл, алкіларил або алкіларалкіл, Е1 являє собою Н, Е2 являє собою а-вуглецевий бічний ланцюг природної (-амінокислоти, Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, заміщений арил, аралкіл, заміщений аралкіл, гетероцикліл, заміщений гетероцикліл, гетероциклілалкіл, заміщений гетероциклілалкіл, або Е1 і Е2, разом з атомом азоту і атомом вуглецю, через які Е1 і Е2 пов'язані, утворять 4-, 5-, 6або 7-членне азациклоалканове кільце, G являє собою OR1 або NR1R2, R1 і R2 незалежно один від одного являють собою Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, аралкіл, алкіларил або алкіларалкіл, р приймає значення від 1 до 4, Р1 являє собою нестійку при пдрируванні кислотну захисну групу, і Р2 являє собою Р2 або ТФОК • Н-, і Р2 представляє собою кислотнонестійку амікозахисну групу Короткий опис креслень На фіг 1 представлена діаграма порошкової рентгенографії зразка непгроскопічної кристалічної форми N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nетилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду, отриманого в прикладі 13, спосіб А На фіг 2 представлена діаграма порошкової рентгенографії зразка непгроскопічної кристалічної форми N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nетилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду, отриманого в прикладі 13, спосіб В 12 11 48252 На фіг 3 представлена діаграма порошкової жності при ізотермічній мікрокалориметрії як функрентгенографії зразка непгроскопічної кристалічної ція часу для чотирьох різних ДОСЛІДІВ, ЯКІ провоформи N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nдяться ВІДПОВІДНО до опису прикладу 15 У етилгліцил]-(І_)-аспартил]-(І_)-рдослідах оцінюється термічна конверсія гігроскопіциклогексилаланшаміду, отриманого в прикладі чної кристалічної форми N-[N-[N-(4-ninepHflHH-413, спосіб В(в) іл)бутаноіл)-І\І-етилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду в його непгроскопічну На фіг 4 представлена діаграма порошкової форму при втриманні при 60°С при 65%, 75%, рентгенографії зразка гігроскопічної кристалічної 80% і 100%-вий ВВ Для фіг 8 характерне те, що форми N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nбільш висока відносна вогкість приводить до більш етилгліцил]-(І_)-аспартил]-(І_)-ршвидкої конверсії Інша характерна ознака цього циклогексилаланшаміду, отриманого в прикладі графіка полягає в тому, що конверсія в непгроско14 пічну форму сполуки має місце при 100%-вий ВВ і На фіг 5 представлена діаграма порошкової при 60°С без розрідження, яке спостерігається для рентгенографії зразка непгроскопічної кристалічної гігроскопічної форми при кімнатній температурі На форми N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nоснові цих результатів можна передбачати, що етилгліцил]-(І_)-аспартил]-(І_)-рпри 60°С швидкість конверсії в непгроскопічну фоциклогексилаланшаміду, отриманого в Прикладі рму набагато вища, ніж швидкість розрідження 14 гігроскопічної форми На фіг 6 представлений графік вихідної потужНа фіг 9 представлене порівняння графіків ності при ізотермічній мікрокалориметрії як функції збільшення ваги в залежності від ВВ (в %) для часу для трьох різних ДОСЛІДІВ, ЯКІ проведені ВІДгігроскопічної () і непгроскопічної (і) форм N-[N-[NПОВІДНО до опису Досліду 15 У дослідах оцінюєть(4-піперидин-4-іл) бутаноіл)-І\І-етилгліцил]-(І_)ся термічна конверсія різних кристалічних форм Nаспартил]-(І_)-р-циклогексилаланшаміду при 25°3, [М-[г\І-(4-піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)які отримані ВІДПОВІДНО до опису Досвіду 16 фіг 9 аспартил]-(І_)-р-циклогексилаланшаміду при експопоказує, що при збільшенні ВВ гігроскопічна форзиції нарами різних розчинників ЛІНІЯ (А) на фіг 6 ма приймає більше води, ніж непгроскопічна форпоказує, що сильний екзотермічний ефект мас ма, причому ця властивість більш яскраво вирамісце в тому випадку, коли гігроскопічний N-[N-[Nжена при ВІДНОСНІЙ вогкості понад 60% Крім того, (4-піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)фіг 9 показує, що для гігроскопічної форми сполуаспартил]-(І_)-р-циклогексилаланшамід, отриманий ки не характерна десорбція до своєї первинної ВІДПОВІДНО до методик прикладів 5 або 11, витриваги (%), тоді як непгроскопічна форма сполуки мується при 80%-вий ВВ (насичений розчин КСІ) і здатна десорбуватися до своєї первинної ваги (%) 40°С протягом ЗО годин, при такому впливі гігроскопічна форма сполуки перетворюється в непгроДокладний опис винаходу скопічну форму сполуки ЛІНІЯ (В) на фіг 6 вказує У описі цього винаходу, якщо не обумовлено на відсутність екзотермічної конверсії, коли гігроособливо, використовуються наступні терміни, скопічний N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nзначення яких розшифровується нижче етилгліцил]-(І_)-аспартил]-(І_)-рУ даному описі використовуються наступні циклогексилаланшамід, отриманий ВІДПОВІДНО ДО скорочення ВОС -трет-бутилоксикарбоніл, CBZ методики прикладів 5 або 11, зазнає впливу пар бензилоксикарбоніл, Gly - гліцин, Asp - аспарагінометанолу при 40°С (розчинник, ВІДМІННИЙ ВІД ВОДИ, ва кислота, Obzl - бензилокси, ТФОК - трив якому сполука розчинна) і, отже, на те, що метафтороцтова кислота, Спа - р -циклогексилаланін, нол не володіє рухливістю в кристалах цієї форми, ЕЮАс - етилацетат, ДМФА - диметилформамід, щоб сталася конверсія в непгроскопічну форму ДСК -дициклогексилкарбодиімід, ГОБТ - пдроксиЛІНІЯ (С) на фіг 6 показує, що екзотермічна конвебензотриазол, ТБТУ - тетрафторборат (2-ІН рсія відсутня, коли непгроскопічний N-[N-[N-(4бензотриазол-1-іл)-1,1,3,3-тетраметилурония, ДВ піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)деїзонована вода, ПНФ -п-нітрофенол, ПФФ - пенаспартил]-(І_)-р-циклогексилаланшамід, отриманий тафторфенол, ДЦМ -дициклогексид мочевина, ВІДПОВІДНО до прикладу 13, витримується при 40°С NMM-N-метилморфолш, МТБЕ трет і 80 %-вий ВВ, отже, при таких умовах непгроскобутил метиловий ефір, ВВ - відносна вогкість, ТГФ пічна форма сполуки не зазнає конверсії форм, - тетрапдрофуран, РірВи - 4-піперидинбутанова тобто, с стабільною формою кислота і PipBuen (4 На Фіг 7 представлений графік вихідної потужності при ізотермічній мікрокалориметрії як функції часу для трьох ріжих ДОСЛІДІВ, ЯКІ проведені ВІДПОВІДНО до опису Досліду 15 У цих дослідах оцінюється термічна конверсія гігроскопічної кристалічної форми непгроскопічний N-[N-[N-(4піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшаміду в його непгроскопічну форму при втриманні при 80 %-вий ВВ при 40, 50 і 60°С Графік показує, що конверсія протікає протягом приблизно 24 годин при 40°С, 6,5 годин при 50°С і протягом 3 годин при 60°С На фіг 8 представлений графік вихідної поту піперидин)бутиліденілкарбонова кислота формули Визначення "пацієнт" відноситься як до людини, так і до інших ссавців "Фармацевтичне прийнятна сіль" означає солону форму початкової сполуки формули І, яка відносно нешкідлива для пацієнта при використанні в терапевтичних дозах, так що позитивні фармацевтичні властивості початкової сполуки формули І не гіршають через побічні ефекти, що приписуються протиюну цієї сольо 14 13 48252 воі форми Фармацевтичне прийнятна сіль також нітрофеноксиацетильна, трифторацетильна, ацевключає цвиттерюн і внутрішню сіль сполуки фортоацетильна, 4-хлорбутирильна, ізобутирильна, омули І нітроцинамоільна, піколіноільна, ацилізотюціанатна, амінокапроільна, бензоільна і інш подібні гру"Алкіл" означає насичену аліфатичну вуглевопи, а також ацилокси-групи, в тому числі метоксидневу групу, яка може бути ЛІНІЙНОЮ або розгалукарбонільна, 9-флуоренилметоксикарбонільна, женою і містить приблизно від 1 до 20 атомів вуг2,2,2-трифторетоксикарбонільна, 2лецю в ланцюгу Поняття "розгалужений" означає, що нижча алкільна група, така як метил, етил і триметилсилилетоксикарбонільна, вшілоксикарбопропіл, приєднана до ЛІНІЙНОГО алкільною ланцюга нільна аллилоксикарбонільна, трет Переважними ЛІНІЙНИМИ або розгалуженими алкібутилоксикарбонільна (ВОС), 1,1льними групами є "нижчі алкільні" групи, які являдиметилпропшілоксикарбонільна, бензилоксикарють собою алкільні групи, що містять від 1 до 10 бонільна (CBZ), п-нітробензилоксикарбонільна, атомів вуглецю Найбільш переважними алкільни2,4-дихлорбензилоксикарбонільна і інш аналогічні ми групами є групи, що містять від 1 до б атомів групи вуглецю Поняття "нестійка в кислоті амінозахисна гру"Циклоалкіл" означає насичену карбоциклічну па" означає групу, що захищає аміно-групу, визнагрупу, що містить одне або декілька кілець і причену вище, яка легко видаляється при обробці близно від 3 до 10 атомів вуглецю Переважними кислотою, залишаючись відносно стабільною при циклоалкільними групами є циклопропіл, циклобудії інших реагентів Переважною рухливою в кистил, циклопентил, циклогексил, циклогептил і делоті амінозахисною групою є треткапдронафтил бутоксикарбонільна група (ВОС) Визначення "циклоалкілалкіл" відноситься до Термін "нестійка при гідруванні амінозахисна алкільної групи, заміщеної циклоалкільною групою група" означає групу, що захищає аміно-групу, Переважними циклоалкілалкільними групами є визначену вище, яка леї ко видаляється при гідруциклопентил метил, циклогексил метил, циклогекванні, залишаючись відносно стабільною під дією сил етил, декапдронафт-1-илметил і декапдроінших реагентів нафт-2-илметил Поняття "захисна кислотна група" означає гру"Алкілциклоалкіл" означає циклоалкільну групу, що легко знімається, відому в даній області як пу, заміщену алкільною групою Прикладами алкігрупа, яка захищає карбоксильну групу (-СО2Н) від лциклоалкільних груп є 1-, 2-, 3- або 4-метил- або небажаної реакції при проведенні синтетичних етилциклогексил реакцій і яка селективно знімається Використання захисних груп для карбоксильних груп добре відо"Алкілциклоалкілалкіл" означає алкільну групу, ме в даній області (див , наприклад, роботу Т Н заміщену алкілциклоалкільною групою ПрикладаGreene, P G M Wuts, Protective Groups in Organic ми алкілциклоалкільних груп є 1-, 2-, 3-або 4Synthesis, 2nd edition, John Wiley and Sons, New метил- або етилциклогексилметил або 1-, 2-, 3York (1991), приведена як довідковий матеріал) або 4-метил- або етилциклогексилетил Прикладами груп, що захищають карбоксильні "Азациклоалкан" означає насичене аліфатичгрупи, є прості ефірні групи, такі як метоксиметил, не кільце, що містить атом азоту Переважними метилтюметил, тетра-пдропіраніл, бензилоксимеазациклоалканами с піролідин і піперидин тил, заміщений і незаміщений фенацил, 2,2,2"Природна а-амшокислота" означає гліцин, трихлоретил, трет-бутил, циннаміл, заміщений і аланін, валін, лейцин, ізолейцин, серин, треонін, незаміщений бензил, триметилсиліл і ІНШІ подібні фенілаланін, тирозин, триптофан, цистеїн, метіогрупи, атакожамідні і пдразидні групи, включаючи нін, пролін, пдроксипролін, аспарагінову кислоту, N.N-диметил, 7-нітроиндолил, гідразид, Nаспарагін, глутамш, глутамшову кислоту, гистидин, фенілпдразид і інше аргінін, орнітин і лізин Поняття "нестійка при гідруванні кислотна за"а - Вуглецевий бічний ланцюг природної ахисна група" означає захисну групу для карбоксиамінокислоти" означає фрагмент, який заміняє альної групи, визначену вище, яка легко знімається вуглецевий атом природної а-амшокислоти Пришляхом гидрирования, залишаючись відносно кладами а-вуглецевих бічних ланцюгів природних стабільної до дії інших реагентів Переважною а-амшокислот є ізопропіл, метил і карбоксиметил нестійкою при гідруванні групою, що захищає карВІДПОВІДНО для валіна, аланіна і аспарагінової кисбоксильну групу, є бензильна група лоти Поняття "арил" означає фенільну або нафтиТермін "амінозахисна група" означає групу, що льну групу легко видаляється, яка, як відомо в даній області, "Заміщений арил" означає фенільну або нафзахищає аміно-групу від небажаної реакції при тильну групу, заміщену одним або декількома заздійсненні методик синтезу і селективно знімаєтьмісниками для арильною групи, які можуть бути ся Використання захисної групи для захисту аміоднаковими або різними, де "замісники для арильно-групи від небажаних реакцій при проведенні ною групи" являють собою алкіл, алкеніл, алкиніл, синтезів відоме в даній області Існує багато таких арил, аралкіл, пдрокси-групу, алкокси-, арилокси-, захисних груп (див, наприклад, Т Н Greene, аралкокси-групи, пдроксиалкіл, ацил, форміл, карPGM Wuts Protective Groups in Organic боксильну групу, алкеноїл, ароїл, галоген, нітроSynthesis, 2nd edition, John Wiley and Sons, New групу, тригалогенметильну групу, ціано-групу, алYork (1991), приведена як посилання) Переважкокси карбоніл, арилоксикарбоніл, аралкоксикарними амінозахисними групами є ацильні групи, в боніл, ациламшо-, ароіламшо-групу, карбамоільну тому числі формільна, ацетильна, хлорацетильна, групу, алкілкарбамоільну групу, диалкілкарбамоїтрихлорацетильна, о-нітрофенілацетильна, о 16 15 48252 льну групу, аридкарбамоільну, аралкілкарбамоікарбоксиметил, 2-карбоксиетил, 4-амшобутил, 3льну групу, алкілсульфонільну, алкілсульфінільну, гуанідшопропіл, циклоалкіл, циклоалкілалкіл, алкіарилсульфонільну, арилсульфінільну, аралкілсулциклоалкіл, алкілциклоалкілалкіл, арил, заміщельфонільну, аралкілсульфінільну групу або ний арил, аралкіл, заміщений аралкіл, гетероцикNRaRb, де замісники Ra і Rb незалежно один від ліл, заміщений гетероцикліл, гетероциклілалкіл 1 одного являють собою атом водню, алкіл, арил заміщений гетероциклілалкіл, або замісники Е і Е 1 2 або аралкіл разом з атомами азоту і вуглецю, через які Е і Е сполучені один з одним, утворять 4-, 5-, 6- або 7"Аралкіл" являє собою алкільну групу, заміщечленне азациклоалканове кільце, при умові, що ну арильним радикалом Переважними аралкільгетероциклілалкіл не є індол-3-ілметилом ними групами є бензил, нафт-1-ілметил, нафт-2ілметил і фенетил Більш переважна сполука, отримана ВІДПОВІД"Заміщений аралкіл" означає аралкільну групу, НО до цього винаходу, описується формулою II, де 2 заміщену по арильній групі одним або декількома замісник Е являє собою Н, алкіл, гідрокси метил, замісниками для арильною групи 1-пдроксиетил, меркаптометил, 2-метилтюетил, карбоксиметил, 2-карбоксиетил, 4-амшобутил, 3"Гетероцикліл" означає 4 - 15-членну моноцигуанідшопропіл, циклоалкіл, циклоалкілалкіл, алкіклічну або поліциклічну систему, в якій один або лциклоалкіл, алкілциклоалкілалкіл, арил, заміщедекілька атомів в КІЛЬЦІ ЯВЛЯЮТЬ собою елемент, ний арил, аралкіл, заміщений аралкіл, або замісВІДМІННИЙ від атома вуглецю, наприклад, атом азоники Е1 і Е2 разом з атомами азоту і вуглецю, ту, кисню або сірки Переважними гетероциклічничерез які Е1 і Е2 сполучені один з одним, утворять ми групами є піридил, піримідил і піролідил 4-, 5-, 6- або 7-членне азациклоалканове кільце Поняття "заміщений гетероцикліл" визначає гетероциклічну групу, заміщену одним або декільЩе більш переважна сполука цього винаходу кома замісниками для арильної групи описується формулою II, де замісник Е2 являє собою Н, алкіл, пдроксиметил, 1-пдроксиетил, мер"Гетероциклілалкіл" і "заміщений гетероциклікаптометил, 2-метилтюетил, карбоксиметил, 2лалкіл" означають алкільну групу, заміщену гетекарбоксиетил, 4-амшобутил, 3-гуанідінопропіл, роциклільною або заміщеною гетероциклільною циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алгрупою ВІДПОВІДНО кілциклоалкілалкіл, або замісники Е1 і Е2 разом з Поняття "пгроскопичність" означає сорбцию, атомами азоту і вуглецю, через які Е1 і Е2 сполучемаючи на увазі при цьому придбану або вже прині один з одним, утворять 4-, 5-, 6- або 7-членне сутню КІЛЬКІСТЬ води, якої досить для впливу на азациклоалканове кільце фізичні або ХІМІЧНІ властивості речовини (Eds J Swarbnck, J C Boylan, Encyclopedia of Також переважною є сполука, яка отримана Pharmaceutical Technology, Vol 10, p 33) ВІДПОВІДНО цього винаходу і описується формулою II, де В являє собою алкіл, циклоалкіл, циклоалкіПереважні варіанти здійснення винаходу лалкіл, алкілциклоалкіл або алкілциклоалкілалкіл Переважна сполука, отримана ВІДПОВІДНО ДО цього винаходу, представлена формулою II, де Конкретний приклад сполуки, отриманої ВІДПОзамісник Е2 являє собою Н, алкіл, гідрокси метил, ВІДНО до цього винаходу, описується формулою 1-пдроксиетил, меркаптометил, 2-метилтюетил, На о C ОИгСООН Де В являє собою алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, аралкіл, алкіларил або алкіларалкіл, J являє собою Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, заміщений арил, аралкіл або заміщений аралкіл, L являє собою OR1 або NR1R2, R1 і R2 незалежно один від одного являють собою Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл, алкілциклоалкілалкіл, арил, аралкіл, алкіларил або алкіларалкіл, m приймає значення від 1 до 5, п приймає значення від 2 до 6, і р приймає значення 1 або 2 Більш переважний варіант здійснення цього винаходу описується формулою Па, де В являє собою алкіл, циклоалкіл, циклоалкіла J (Па) лкіл, алкілциклоалкіл або алкілциклоалкілалкіл, J являє собою Н, алкіл, циклоалкіл, циклоалкілалкіл, алкілциклоалкіл або алкілциклоалкіл алкіл, m приймає значення 3, і п приймає значення 3 або 4 Інший переважний варіант здійснення цього винаходу описується формулою Па, де В являє собою алкіл, J являє собою алкіл, циклоалкіл або циклоалкілалкіл, R1 і R2 незалежно друг від друга являють собою Н, алкіл циклоалкіл, циклоалкілалкіл, алкілциклоалкіл або алкілциклоалкілалкіл, m приймає значення З, п приймає значення 3 або 4, і р приймає значення 1 Ще однією переважною сполукою, отриманим ВІДПОВІДНО до цього винаходу, є сполучека формули На, яке являє собою N-[N-[N-(4-nmepHflHH-4-in) 17 48252 бутаноіл)-І\І-етилгліцил]-(І_)-аспартил]-(І_)-рциклогексил-аланшамід Іншим варіантом здійснення цього винаходу є отримання стабільної непгроскопічної кристалічної форми N-[N-[N-(4-mnepHflHH-4-in) бутаноіл)-І\Іетилгліцил]-(І_)-аспартил]-(І_)-р-циклогексилаланшаміду ВІДПОВІДНО ДО винаходу ця форма сполуки дає можливість розробляти стабільну рецептуру названої сполуки Стабільна непгроскопічна форма N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-І\Іетилгліцил]-(І_)-аспартил]-(І_)-р-циклогексилаланшаміду також має високу температуру плавлення і не володіє здатністю абсорбувати воду Стабільна форма також володіє унікальною і несподіваною стабільністю у вологих умовах і при температурах, які значно перевищують вогкість і температуру, що звичайно зустрічаються при транспортуванні і виробництві лікарської форми або при довготривалих транспортуванні і зберіганні Ці властивості також полегшують виготовлення лікарської форми Конверсія в стабільну форму не супроводиться втратою матеріалу або його чистоти і не впливає негативного чином на його практичні властивості Переважним варіантом здійснення винаходу є сполука формули VII, де В являє собою алкіл, Е1 являє собою Н, Е2 являє собою циклоалкілалкіл, G являє собою NR1R2, і R1 і R2 являють собою Н, р приймає значення 1 Інший переважний варіант здійснення винаходу являє собою сполуку формули VII, де В являє собою етил, Е1 являє собою Н, Е2 являє собою циклогексилметил, G являє собою NR1R2, і R1 і R2 являють собою Н, і р приймає значення 1 Ще один переважний варіант здійснення цього винаходу відповідає сполуці формули VII, де В являє собою етил, Е1 являє собою Н, Е2 являє собою циклогексилметил, G являє собою NR1R2, і R1 і R2 являють собою Н, р приймає значення 1, Р1 являє собою бензил, і Р2 являє собою ТФОК • НЩе один переважний варіант здійснення цього винаходу відповідає сполуці формули VII, де В являє собою етил, Е1 являє собою Н, Е2 являє собою циклогексилметил, G являє собою NR1R2, і R1 і R2 являють собою Н, р приймає значення 1, Р1 являє собою бензил, і Р2 являє собою третбутоксикарбоніл Потрібно розуміти, що цей винахід охоплює всі комбінації переважних сполук, переважних варіантів здійснення винаходу і конкретних варіантів його здійснення, описаних тут Сполука цього винаходу використовується у вигляді вільної основи або вільної кислоти, його цвитеріонової солі або фармацевтичне прийнятної солі Всі ЦІ форми підпадають під об'єм цього винаходу Коли сполука цього винаходу заміщена основним залишком, утворюється кислотно-адитивна сіль, яка просто є більш зручною формою для застосування На практиці використання сольової форми відповідає використанню вільної основи Кислота, яка може бути використана для отримання кислотно-адитивної солі, переважно являє собою кислоту, яка при змішуванні з вільною основою дає фармацевтичне прийнятну сіль Тобто, сіль, аніон якої не токсичний для пацієнта в фар 18 мацевтичних дозах солі і позитивна інгібуюча дія на агрегацію тромбоцитів і утворення тромбів, властива ВІЛЬНІЙ ОСНОВІ, не гіршає через побічні ефекти, що приписуються аніону Хоч фармацевтичне прийнятні солі вказаних основних сполук є переважними, всі кислотно-адитивні солі можуть бути використані як джерело вільної основи, навіть якщо конкретна сіль, сама по собі, необхідна тільки як проміжна сполука Наприклад, коли сіль отримують тільки з метою очищення і ідентифікації або коли и використовують як проміжну сполуку при отриманні фармацевтичне прийнятної солі з використанням методики іонного обміну Фармацевтичне прийнятні солі цього винаходу являють собою солі, які отримані з наступних кислот мінеральні кислоти, такі як соляна, сірчана, фосфорна і сульфамінова кислоти, і органічні кислоти, такі як оцтова, лимонна, молочна, винна, малонова, метансульфонова, етанрульфонова, бензолсульфонова, п-толуолсульфонова, циклогексилсульфонова, хінна кислоти і інш До ВІДПОВІДНИХ кислотноадитивних солей відносяться наступні солі пдрогалогеніди, наприклад, пдрохлориди і пдроброміди, сульфат, фосфат, нітрат, сульфамат, ацетат, цитрат, лактат, тартрат, малонат, оксалат, саліцилат, пропюнат, сукцинат, фумарат, малеат, метилен-біс-р-пдроксинафтоати, гентизати, мезилати, ізотюнати і ди-р-толуоілтартрати, метансульфонат, етан сул ьфонат, бензолсульфонат п-толуол сул ьфонат, циклогексилсульфамат і хінат, ВІДПОВІДНО ВІДПОВІДНО ДО ще одного об'єкта цього винаходу кислотно-адитивні солі сполук, що заявляються, отримують реакцією вільної основи з ВІДПОВІДНОЮ кислотою при використанні відомих методик або при ВІДПОВІДНІЙ модифікації цих методик Наприклад, кислотно-адитивні солі сполук цього винаходу отримують при розчиненні вільної основи у воді, водно-спиртовому розчиннику або в інших ВІДПОВІДНИХ розчинниках, що містять відповідну кислоту, з подальшим виділенням солі шляхом упарювання розчинника, або при взаємодії вільної основи і кислоти в органічному розчиннику У цьому випадку сіль ВІДДІЛЯЄТЬСЯ відразу або може бути виділена після концентрування розчину Кислотно-адитивні солі сполук цього винаходу можуть бути регенеровані з солей по відомих або адаптованих методиках Наприклад, початкові сполуки винаходу можуть бути регенеровані з їх кислотно-адитивних солей шляхом обробки лугом, наприклад водним розчином бікарбонату натрію або водним розчином аміаку При заміщенні сполуки цього винаходу кислотним залишком можуть бути отримані основноадитивні солі, які просто більш зручні при застосуванні На практиці використання сольової форми відповідає використанню вільної кислоти Основи, які можуть бути використані для отримання основно-адитивної солі, переважно являє собою основу, яка при зміщенні з вільною кислотою дає фармацевтичне прийнятну сіль, тобто, сіль, катіон якої не токсичний для організму в фармацевтичних дозах солі і позитивна інгібуюча дія на агрегацію тромбоцитів і утворення тромбів, властива ВІЛЬНІЙ КИСЛОТІ, не гіршає через побічні ефекти, що приписуються катіону Фармацевтичне прийнятні солі, що 19 включають, наприклад, солі лужних і лужноземельних металів, які підпадають під об'єм винаходу, являють собою солі, отримані з наступних основ гідрид натрію, гідроксид натрію, гідроксид калію, гідроксид кальцію, гідроксид алюмінію, гідроксид ЛІТІЮ, гідроксид магнію, гідроксид цинку, аміак, етилендиамш, N-метилглюкамін, лізин, аргінін, орнітин, холин, г\І,г\Г-дибензилетилендиамін, диамін, хлорпрокаш, диетаноламш, прокат, Nбензилфенетиламш, диетиламш, піперазин, трис(пдроксиметил)-амшометан, гідроксид тетраметиламмонію і інш Солі металів сполук цього винаходу можуть бути отримані шляхом контактування гідриду, гідроксиду, карбонату або іншої реакційноздатної сполуки вибраного металу у водному або органічному розчиннику з вільною кислотною формою сполуки Водний розчинник, що використовується може являти собою воду або він може являти собою суміш води з органічним розчинником, переважно зі спиртом, таким як метанол або етанол, кетон, таким як ацетон, простим аліфатичним ефіром, таким яктетрапдрофуран, або складним ефіром, таким як етилацетат Такі реакції звичайно проводять при кімнатній температурі, однак при необхідності їх можна провести і при нагріванні АМІННІ СОЛІ сполук цього винаходу можуть бути отримані шляхом контактування аміну у водному або органічному розчиннику із сполукою у вигляді вільної кислоти Прийнятними водними розчинниками є вода або її суміші зі спиртами, такими як метанол або етанол, простим ефіром, таким як тетрапдрофуран, нітрилами, такими як ацетонітрил, або кетонами, такими як ацетон Аналогічним чином можуть бути отримані амінокислотні солі Основно-адитивні солі сполук цього винаходу можуть бути регенеровані з солей з використанням відомих або адаптованих способів Наприклад, початкові сполуки цього винаходу можна регенерувати з їх основно-адитивних солей при обробці останніх кислотою, наприклад, соляною 48252 20 кислотою Крім використання як активних сполук, солі сполук цього винаходу можуть служити для очищення сполук, наприклад, завдяки різниці розчинності солей і початкових сполук, побічних продуктів і/або початкових матеріалів У цьому випадку використовують методики, які добре ВІДОМІ кваліфікованим в даній області фахівцям Сполучення цього винаходу можуть мати асиметричні центри Такі асиметричні центри незалежно один від одного можуть мати R- або Sконфігурацію Кваліфікованому в даній області фахівцеві також очевидно, що деякі сполуки формули І можуть мати геометричну ізомерію Геометричними ізомерами є -Цис-1 Транс-форми сполук, що заявляються, що містять алкенільний залишок Цей винахід охоплює окремі геометричні ізомери і стереоізомери, а також їх суміші Такі ізомери можуть бути виділені з їх сумішей за допомогою відомих або адаптованих методик, наприклад, з допомогою хроматографії або перекристаллизацією Або вони можуть бути отримані окремо з ВІДПОВІДНИХ ізомерів їх проміжних сполук, наприклад, з використанням відомих або адаптованих способів, описаних тут У заявках США №№ 08/138820 і 08/476750, які включені в даний опис як посилання описані способи отримання аморфної сполуки формули II, і, зокрема аморфної сполуки формули І Новий спосіб отримання сполуки формули II і, зокрема кристалічної сполуки формули І, ВІДПОВІДНО до цього винаходу представлений на схемі II, де В, Е , Е2 , G, R, m, n і р приймають значення, визначені вище, а Р1 являє собою нестійку при гідруванні кисло гну захисну групу аміно таку як бензил, Р2 являє собою нестійку в кислоті групу, що захищає аміно-групу, таку як трет бутоксикарбоніл (ВОС), а Р являє собою нестійку при гідруванні групу, що захищає аміно-групу, таку як бензилоксикарбонільна група (CBZ) 48252 21 22 СХЕМА II Гідрування інаприклац. газовий at>o хімічний перенос И 8 При отриманні сполук формули II або їх проміжних сполук може бути також бажано або необхідно попередити протікання перехресної реакції між ХІМІЧНО активними замісниками, які присутні в природних амінокислотах або псевдоамшокислотах Такі замісники можуть бути захищені за допомогою стандартних захисних груп Захисні групи згодом можуть бути видалені (або залишені, якщо це необхідне) з використанням відомих способів і з отриманням необхідних продуктів або проміжних сполук (див , наприклад "Green Protective Groups in Organic Synthesis", Wiley, New York (1981) Селективна захист або селективне зняття захисту можуть бути також необхідні або бажані, щоб перетворити або видалити існуючі замісники, або щоб провести подальшу реакцію з отриманням кінцевого продукту Спосіб, представлений на Схемі II, ілюструється на прикладі отримання сполуки формули II, однак потрібно розуміти, що сполука формули І також може бути отримана при використанні ВІДПОВІДНИХ початкових матеріалів При отриманні сполуки формули І у ВІДПОВІДНОСТІ з схемою II, В являє собою етил, Е являє собою Н, F являє собою циклогексилметил, G являє собою NH2, R являє собою Н, m приймає значення 3, п приймає 23 48252 24 значення 3, р приймає значення 1, Р1 являє собою бензил, Р2 являє собою ВОС і Р3 являє собою CBZ щЛ—С-ОН 'я (IV) Альтернативний спосіб отримання сполуки формули І ВІДПОВІДНО до цього винаходу аналогічний способу, представленому на схемі II, за винятДе ком того, що використовується сполука формули R являє собою Н, m приймає значення 3, п приймає значення 3, р приймає значення 1, а Р3 визначене вище являє собою CBZ, з отриманням проміжної сполуки формули V (III) замість сполуки формули IV, о U->N-(OH2}-_1L, | ь=^ ^Л Є* О t f/ ? (V) а ДЄ 1 2 В являє собою етил, Е являє собою Н, Е являє собою циклогексилметил, G являє собою NH2, р приймає значення 1, Р1 являє собою бензил, а Р3 являє собою CBZ На схемі II представлений пятистадійний спосіб отримання сполуки цього винаходу, починаючи від формування центральної дипептидної проміжної сполуки формули VI ВІДПОВІДНО до цього винаходу fl (VI) в 9 1 В, р, Р і Р приймають значення, визначені вище У разі отримання сполуки формули І, центральна дипептидна проміжна сполука цього винаходу являє собою BOC-N(Et)-Gly-(L)Asp(OBzl)-OH Центральну дипептидну проміжна сполуку отримують без захисту вільного залишку карбонової кислоти На стадії 2 схеми II, сполука з утворенням центрального дипептиду, може бути здійснена або в дихлорметані чи в сумішах етилацетату (з або без ДМФА як сорозчинника) і органічних основ, таких як NMM Ця реакція може бути проведена при температурі від кімнатної температури і до температури 40°С Активація амінокислоти або псевдоамшокислоти наступної формули для про ведення реакції сполуки О (А) може бути здійснена з використанням активного ефіру, що не виділяється з п-нітрофенолом, пентафторфенолом і N-пдроксисукцинімідом під дією дициклогексилкарбодиіміда Час реакції сполука лежить в інтервалі приблизно від 1 до 20 годин в залежності від сполучаємих амінокислот або псевдоамшокислот, активуючого агента, розчинника і температури Центральний дипептидний продукт стадії 1 не повинен виділятися Реакційну суміш стадії 1 звичайно промивають водою або розбавленою водною кислотою (наприклад, водної НСІ) і потім використовують безпосередньо без сушки на стадії 2 В випадку, коли використовується активний ефір на основі фенолу, центральний дипептидний продукт екстрагують з реакційної суміші в лужну воду, потім реекстрагують з підкисленого водного розчину знову в органічний розчинник Отриманий розчин використовують безпосередньо на стадії 2 Дипептидну проміжну сполуку формули VI використовують для отримання трипептидної проміжної сполуки формули VII ВІДПОВІДНО до цього винаходу, 1—СН (VII) де 1 2 1 В, Е Е , G, р і Р приймають значення, визна2 чені вище, а Р являє собою Р2 або ТФОК • НКоли Р2 представляє собою ТФОК • Н-, символ "•" являє собою дисоціацію ТФОК з утворенням + + F3CCO2 і Н , де Н протонує кінцеву аміно-групу сполуки формули VII, тобто утвориться сіль ТФОК формули Vila 25 48252 I о Hhf_ rCH- L ™J У разі отримання сполуки формули І трипептидна проміжна сполука цього винаходу являє собою Р1 -N(Et)Gly-(L)-Asp(Obzl)-(L)-Cha-NH2 На стадії 2 сполука амінокислоти або псевдоамінокислоти з утворенням центрального дипептиду може бути здійснена в дихлорметані або в суміші етилацетату і ДМФА або ТГФ при кімнатній температурі або при температурі, нижче кімнатної Активація центрального дипептиду наступної формули може бути здійснена за допомогою активного ефіру, що не виділяється пентафторфенола або N-пдрокси-сукциніміда під дією дициклогексилкарбодиіміда Активація також може бути проведена з використанням ізопропілхлорформіату Час реакції може мінятися в залежності амінокислоти або псевдоамшокислоти, які повинні бути зв'язані, активуючого агенту, розчинника і температури і складає приблизно від 1 до 20 годин Коли трипептидна проміжна сполука не виділяється, реакційну суміш промивають водною органічною основою, такою як водний N-метилморфолш, і хвилею кислотою, такою як водна НСІ, і вводять в реакцію на стадії 3 після водних промивок без сушки "як воно є" На стадії 3 схеми II зняття захисної групи, такої як ВОС, з трипептидного продукту стадії 2 може бути здійснено при використанні розчину трифторуксусної кислоти в дихлорметані або при використанні суміші НВг в оцтовій кислоті і етилацетаті Реакцію можна провести приблизно при кімнатній температурі протягом приблизно 1 години (спосіб з НВг) або приблизно 2 годин (спосіб з ТФОК) Кислу сіль трипептиду відфільтровувати у вигляді кристалічного твердого продукту або безпосередньо з реакційної суміші (спосіб з НВг) або після часткового видалення розчинника шляхом відгонки і додання до отриманого залишку неполярного розчинника Ще один спосіб ВІДПОВІДНО до цього винаходу описується як об'єднаний спосіб швидкого і простого отримання ТФОК • H-N(Et)Gly-(L)-)(Asp(OBzl)-(L)-Cha-NH2 з BOC-N(Et)Gly-OH Цей спосіб являє собою реакцію, що проводиться в одній судині і що включає перші дві стадії сполуки Схеми II і обробку ТФОК ТФОК • H-N(Et)Gly-(L)-Asp-(OBzl)(L)-Cha-NH2 виділяють у вигляді кристалів безпосередньо з об'єднаного реакційного розчину Об'єднаний спосіб виключає ВІДПОВІДНІ три окремі реакції, представлені на Схемі II, і вирішує проблему створення простого, ефективною з точки зору часу і вартості синтезу, який може бути використаний в промисловості 26 CH-C-G (Vila) На схемі II представлене отримання поліпептиду в зворотному порядку, починаючи з Nзахищеної амінокислоти з подальшим доданням карбоксильного кінцевого фрагмента, на відміну від звичайного порядку, при якому поліпептид отримують шляхом послідовного амідування змінного кінця захищеної С-кінцевої амінокислоти Зворотний синтетичний спосіб ВІДПОВІДНО до цього винаходу вимагає введення захисної групи тільки в першу амінокислоту Це дає можливість з цього моменту використати подальші амінокислоти, не захищені ні по змінному, ні по кислотному кінцям (передбачувзні функцюнзльні групи бічного лзнцюгз) Зворотний синтетичний спосіб тзкож реалізовує отримання сполуки формули II, зокрема сполуки формули І, за допомогою потокової технологи виробництва, на відміну від періодичного виробництва, звичайно необхідного при проведенні синтезу пептидів в розчині Нова методика зменшує вартість виробництва, оскільки немає необхідності купувати амінокислоти, захищені по змінному кінцю При цьому не потрібно спеціального облзднзння, резгентів збо знзлітичних методик Ще один спосіб ВІДПОВІДНО до винзходу являє собою отримзння стабільного непгроскопічного кристалічного М-[М-[г\І-(4-піперидин-4-іл)бутаноіл)г\І-етилгліцил]-(І_)-зспзртил]-(І_)-рциклогексилзлзншзміду, що стійко отримується шляхом нового твердофззного перетворення гігроскопічного кристалічного N-[N-[N-(4-ninepnflHH-4іл)бутаноіл)-г\І-етилгліцил]-(І_)-зспзртил]-(І_)-рциклогексилаланшаміду, отриманого способами, що описуються схемою II і за допомогою названих альтернативних реакційних стадій Гігроскопічна кристалічна форма N-[N-[N-(4піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшаміду звичайно фізично нестабільна і при впливі певних умов (вогкість, температура) перетворюється у високостабильну, непгроскопічну кристалічну форму N-[N[М-(4-піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшаміду ВІДПОВІДНО ДО ЦЬОГО винаходу конверсія гігроскопічної кристалічної форми N-[N-[N-(4-ninepnflHH4-іл)бутаноіл)-г\І-етилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду у високостабильну непгроскопічну кристалічну форму N-[N-[N-(4піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшаміду може бути здійснена при статичних і динамічних умовах Статична методика ВІДПОВІДНО ДО ЦЬОГО винаходу описується як статична конверсія, оскільки вона включає вплив на гігроскопічну кристалічну форму N-[N-[N-(4-ninepHflHH-4-in)6yraH0in)-Nетилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду, вміщену в нерухому фо 27 48252 рму, таку як пухирець або лоток, певних умов по температурі і вогкості в регульованій кліматичній камері Таку "статичну" конверсію проводять при температурах в інтервалі приблизно від 20 до 80°С, більш переважно приблизно від 40 до 80°С, і при ВІДНОСНІЙ вогкості приблизно від 40 до 100%, переважно приблизно 65 до 80% Динамічна методика ВІДПОВІДНО ДО ЦЬОГО винаходу описується як динамічна конверсія, оскільки включає витримання гігроскопічної кристалічної форми N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nетилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду при тих же температурах і ВІДНОСНІЙ вогкості, яка використовується в статичному способі, але при перемішуванні, в тому числі при перемішуванні гігроскопічної кристалічної форми N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nетилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду в колбі роторного випарника або в циліндричній судині (в зволожуючій печі) з використанням пропеллерної мішалки Наступні приклади ілюструють винахід, але не обмежують його об'єм Якщо не обумовлено особливо, дані массспектрометрического аналізу являють собою дані масс-спектрометриї низького розрізняння при бомбардуванні швидкими атомами, отримані на приладі VG 70SE з розрахунковою величиною (М+Н)+ Спектри ядерного магнітного резонансу отримані на приладі Brucker ACF 300 в D2O Флеш хроматографію проводять на силікагелі Високоефективну рідинну хроматографію (ВЕРХ) проводять на колонках С-18 із зверненою фазою з розмірами часток в інтервалі 8 - 15мкм Якщо не обумовлено особливо, графіки порошкової рентгенографії отримані шляхом сканування порошку зразка з допомогою дифрактометра Siemens D5000 з Cu-джерелом випромінювання (1,8кВт, 45кВт і 40мА) До проведення вимірювань зразки подрібнюють, щоб виключити частки з розмірами, які впливають на інтенсивність ПІКІВ, У держатель зразка розмірами 1,5 х 1см вміщують приблизно 60мг зразка і сканують в інтервалі 3 40° 2-тета (26) при величині кроку 0,04°С і при сумарній експозиції на кожній стадії 1сек Приклад 1 Отримання BOC-N(Et)Gly-(L)-Asp(OBzl)-OH (Стадія 1 схеми II) У тригорлу круглодонну колбу об'ємом 1л завантажують 51г (0,25мопя) BOC-N(Et)Gly-OH, 35г (0,25моля) ПНФ, 400мл ЕЮАс і 100мл ДМФА Суміш перемішують до утворення розчину і охолоджують до 4 - 6°С При температурі приблизно від 5 до 8°С протягом 10 хвилин по краплях додають розчин 51,5г (0,25моля) ДЦК в 125мл ЕЮАс По закінченні додавання ДЦК видаляють охолоджуючу баню і суміш перемішують протягом 1,5 годин по мірі її нагрівання до кімнатної температури (20 22°С) Протягом цього часу утворюється твердий осадок ДСМ Закінчення утворення ефіру ПНФ визначають методом аналітичної ВЕРХ (зникнення BOC-N(Et)Gly-OH) Реакційну суміш фільтрують, ДЦМ, що залишається, промивають 2 порціями ЕЮАс по 50мл і промивні розчини додають до фільтрату ДЦМ викидають До відфільтрованого розчину при перемішу 28 ванні додають 67г (О.Змоля) H2N-(L)-Asp(OBzl)-OH, отримують суспензію в 150мл (138г, 1,36моля) NMM Суміш нагрівають до 38 - 40°С і втримують при цій температурі протягом 41 години Дані аналітичної ВЕРХ вказують на повну витрату ВОСЫ(Е1)С1у-ОПНФ Реакційну суміш охолоджують до 25°С і непрореагувавший H2N-(L)-Asp(OBzl)-OH відфільтровують Розчин охолоджують і повторно фільтрують, отримують ще 1,2г (виділене 21,7г, 11,2г являють собою додані 20% надлишки і 10,5 (0,047моля) являють собою непрореагувавший матеріал Відфільтровувати розчин екстрагують у воронці Сквібба об'ємом 2л однією порцією деюнізованоі води в 500мл, потім 2-ма порціями по 250мл Об'єднані водні розчини екстрагують 3-ма порціями по ЗООмл суміші трет -бутилметиловий ефір/ЕЮАс (1 1) для видалення ПНФ, що залишився, (дані ВЕРХ вказують на СЛІДОВІ КІЛЬКОСТІ), ПОТІМ охолоджують до 5°С і підкисляють від рН 8,9 до рН 1,79 шляхом додання по краплях 150мл концентрованої НСІ Підкислений водний розчин екстрагують 2 порціями ЕЮАс по 200мл Дані ВЕРХ показують, що в розчині не залишається бажаного продукту Екстракти ЕЮАс об'єднують , сушать над MgSC4, фільтрують і концентрують на роторному випарнику при 35°С Отримане блідооранжеве масло вакуумують при 35°С для максимального видалення розчинника, що залишився, отримують 85,68г BOC-N(Et)Gly-(L)-Asp (OBzl)-OH у вигляді масла (21,3ммоля, вихід 85,5%, без поправки на розчинник, що залишився) Спектр ЯМР 1Н (250Мгц) 5 м д 7,3 (с), 5,1 (с), 3,3 (д кв), 3,0 (д кв), 1,4 (с), 1,1 (т) Мас спектр М = 408, М + 1СПост = 409 ВЕРХ 90,79 А% (3,8 А% п-нітрофенола, без поправки на є) Елементний аналіз C20H28N2O7 H, N, Знайдено, % С 57,54, Обчислено, % С 58,81 Приклад 2 Отримання BOC-N(Et)Gly-(L)-Asp(Obzl)-(L)-Cha-NH2 (Стадія 2 схеми II) Спосіб А Ізопропілхлорформіатний спосіб У ЕЮАс (6 - 8 об'ємів, відношення вага об'єм 1 6,5) розчиняють один еквівалент BOC-N(Et)Gly(L)-Asp-(Obzl)-OH і витримують при температурі приблизно від -15 до 0°С При температурі від -15 до 0°С додають NMM (1екв) До розчину захищеного дипептиду при температурі від -15 до 0°С додають ізопропілхлорформіат (1 - 1,1екв) Реакційну суміш витримують при температурі від -15 до 0°С протягом двох-п'яти хвилин До охолодженого розчину дипептиду додають розчин H2N-(L)-ChaNH2 (1екв) в ТГФ (10 об'ємів, відношення вага об'єм 1 10), температуру підтримують в інтервалі від -15 до 0°С Заходом реакції стежать з допомогою ВЕРХ, відбираючи зразки через 15 хвилин, 1 година і 2 години, щоб визначити закінчення реакції (Реакція вважається закінченою, коли КІЛЬКІСТЬ дипептиду, що спостерігається відповідає площі менше за 10%, ВЕРХ) ВОС-трипептидний продукт випадає в осадок безпосередньо з реакційного розчину Його відфільтровують з реакційної суміші, промивають ЕЮАс (2 разу по 1 об'єму, вага об'єм) і сушать у вакуумі Звичайно вихід становить > 60%, чистота 29 48252 > 90% (по площі, ВЕРХ), вміст аспарагінової кислоти у вигляді епімірного диастереоміру менше за 1% (по площі)ПІСЛЯ повторного суспендування в ЕЮАс кінцевий вихід BOC-N(Et)Gly-(L)-Asp-(OBzl)-(L)-ChaNH2 становить приблизно 60%, міра чистоти підвищується до > 95% (по площі) при зменшенні змісту диастереоміру до менш ніж 0,5% При використанні в ізопропілхлорформіатному способі 4,55г (8,1ммоля) BOC-N(Et)Gly-(L)-Asp(OBzl)-OH і загальної методики Прикладу, отримують BOC-N(Et)Gly-(L)-Asp-(OBzl)-(L)-Cha-NH2 в КІЛЬКОСТІ 3,26г (чистота 97,9%, 0,3% диастереоміру), вихід 70% від теоретичного Спосіб Б Спосіб з використанням комплексу Пентафторфенол-ДЦК У ЕЮАс (5 об'ємів, відношення вага об'єм 1 5) при кімнатній температурі розчиняють пентафторфенол (ПФФ, 2,9екв) і ДЦК (1екв) і охолоджують до температури -15 - 0°С Один еквівалент BOC-N(Et)Gly-(L)-Asp(OBzl)-OH розчиняють в ЕЮАс (6 об'ємів, відношення вага об'єм 1 6) і змішують з одним еквівалентом bbN-fLJ-Cha-Nbb, яку заздалегідь розчиняють в ДМФА (10 об'ємів, відношення вага об'єм 1 10) Розчин дипептиду H2N-(L)-Cha-NH2 по краплях додають в розчин ПФФ і ДЦК при температурі в інтервалі -15 - 0°С Реакційну масу витримують при температурі 15 22°С протягом від п'яти до шістнадцяти годин За ходом реакції спостерігають з допомогою ВЕРХ, відбираючи контрольні зразки для ВЕРХ через 1, 2, 3, 4 і 16 годин (Реакцію вважають завершеною, коли згідно ВЕРХ КІЛЬКІСТЬ дипептиду, що спостерігається складає менше за 2% по площі) Реакційну суміш фільтрують і осадок на фільтрі (ДЦМ) промивають ЕЮАс (2 разу по 0,5 об'єми вага об'єм) Фільтрат обробляють водою (10 об'ємів, відношення вага об'єм 1 10) і водний шар видаляють Шар ЕЮАс промивають водою (1 разів 5 об'ємами, відношення вага об'єм 1 5) Шар ЕЮАс охолоджують, при цьому випадає продукт, який відфільтровують і промивають ЕЮАс (2 по 0,4 об'єми, відношення вага об'єм 1 0,4) Мольний вихід складає більше за 60%, чистота звичайно складає більше за 90% (по площі), вміст аспарагінової кислоти у вигляді епимерного диастереоміру 1 - 4% (по площі) Після повторного суспедування в ЕЮАс кінцевий вихід BOC-N(Et)Gly-(L)-Asp-(OBzl)-(L)-Cha-NH2 становить приблизно 60%, ступінь чистоти збільшується до більш ніж 99% (по площі), а зміст диастереоміру меншає до менше за 0,5% Як типовий приклад способу на основі комплексу Пентафторфенол-ДЦК з використанням загальної методики способу Би і 10г (24,5ммоля) ВОСN(Et)Gly-(L)-Asp-(OBzl)-OH отримують 3,15г ВОСN(Et)Gly-(L)-Asp-(OBzl)-(L)-Cha-NH2 (чистота 99%, 0,49% диастереоміру), вихід 59% від теоретичного Спосіб В Спосіб з використанням пдроксибензотриазолу (ГОБТ) і тетрафторборату (2-1Нбензотриазол-1-іл)-1,1,3 3-тетраметилуронію (ТБТУ) У ДМФА ( 9 - 1 0 об'ємів відношення вага об'єм 1 10) розчиняють один еквівалент ВОСN(Et)Gly-(L)-Asp-(Obzl)-OH і витримують при кімна 30 тній температурі До цього розчину додають H2N(L)-Cha-NH2 (1екв) і пдроксибензотриазола (ГОБТ, 1екв) Отриманий розчин охолоджують до температури приблизно від 0 до 10°С і додають NMM (1 1,1екв) У ДМФА (4 - 5 об'ємів, відношення вага об'єм 1 5) розчиняють зшиваючий агент ТБТУ (1 1,1екв) і додають до розчину захищеного дипептиду при температурі приблизно від 0 до 10°С Цей розчин перемішують при температурі приблизно від 10 до 25°С протягом приблизно 3 годин, доти, поки дані ВЕРХ не укажуть на закінчення реакції (менше за 2 % по площі початкової речовини) Цю реакційну суміш додають при перемішуванні до суміші 5%-вого водного розчину хлорида натрію (приблизно 4 об'єми відносно реакційної суміші) і ЕЮАс (приблизно 2 об'єми відносно реакційної суміші) Фази розділяють і водну фазу додатково екстрагують порцією ЕЮАс (приблизно 1,5 об'єму відносно реакційної суміші) Органічні фази об'єднують і промивають послідовно 0,5н водним розчином лимонної кислоти (приблизно 0,6 - 0,7 об'єму відносно органічної фази), 10% водним розчином бікарбонату натрію (дві порції, приблизно 0,6 - 0,7 об'єму відносно органічної фази кожна) і 25%-вим водним розчином хлориду натрію (приблизно 0,3 - 0,4 об'єму відносно органічної фази) Отриману органічну фазу концентрують при зниженому тиску і температурі приблизно ЗО - 50°С до приблизно 1/4 -1/2 об'єму від вихідного До отриманого теплого розчину додають такий же об'єм гептану Суміш перемішують і залишають охолоджуватися до температури приблизно від 0 до 20°С до випадання необхідного тринептиду Твердий продукт відфільтровують, промивають сумішшю ЕЮАс і гептану і сушать Звичайно вихід перевищує 60%, чистота складає більше за 95,7% (по площі), вміст аспарагінової кислоти у вигляді епимірного диастереоміру складає менше за 2% (по площі) Як типовий приклад способу на основі ГОБТ/ТБТУ при використанні загальної методики і 10г (24,5ммоля) BOC-N(Et)Gly-(L)-Asp-(Obzl)-OH отримане 9,3г BOC-N(Et)Gly-(L)-Asp-(OBzl)-(L)Cha-Nbb (чистота 96,1%, 1,77% диастереоміра Asp), вихід 67,7% від теоретичного Мас спектр Мрозр = 560, 7 М+1СПост = 561 Тпл 182,17(ДСК) Спектр ЯМР 1Н(стандарт-ТМС, DMSO-d6) 5, м д 0,89 (м, 1Н),0,94 (м, 1Н), 1,0 (дт, 2Н), 1,15 (м, 2Н), 1,06 - 1,3 (м, 4Н), 1,36 (д, 9Н), 1,4 - 1,74 (м, 6Н), 2,65 (м, 1Н), 2,85 (м, 1Н), 3,18 (м, 2Н), 3,75 (д, 2Н), 4,2 (с, 1Н), 4,66 (д, 1Н), 5,08 (с, 2Н), 7,02 (с, 1Н), 7,18 (д, 1Н), 7,36 (с, 5Н), 7,88 (дд, 1Н), 8,24 (ДД.1Н) Приклад 3 Отримання трифторацетату N(Et)Gly-(L)-Asp-(OBzl)-(L)-Cha-NH2 (Стадія 3 схеми II) У дихлорметані розчиняють BOC-N(Et)Gly-fL)Asp-(OBzl)-(L)-Cha-NH2 (приблизно 1 12 вага/вага) і до отриманого розчину при кімнатній температурі додають трифтороцтову кислоту (ТФОК) Розчин перемішують доти, поки дані ВЕРХ не укажуть на закінчення реакції (3 - 5 годин) Розчин концентрують при температурі 40 - 45°С приблизно до 1/2 об'єму До отриманого теплого роз 31 48252 чину при температурі вище за 40°С додають трет бутил метиловий ефір (при ваговому відношенні приблизно 1 10 до BOC-N(Et)Gly-(L)-Asp-(OBzl)(L)-Cha-NH2) Суміш повільно охолоджують приблизно до 5°С і перемішують протягом 1 години, щоб забезпечити повну кристалізацію Отримані тверді речовини відфільтровують і промивають охолодженим трет -бутилметиловим ефіром Тверді речовини сушать при зниженому тиску і аналізують на зміст ТФОК • N(Et)Gly-(L)-Asp-(OBzl)-(L)Cha-Nbb (ВЕРХ, вага вага) Звичайно вихід майже КІЛЬКІСНИЙ, чистота більше за 95% (по площі) Мас спектр Мрозр =460 (вільна основа), М + 32 1 Спектр ЯМР Н (стандарт-ТМС, DMSO-d 6 , 5, м д 0,9 (м, 2Н), 1,15 (т, 6Н), 1,5 (м, 1Н), 1,5 -1,8 (м, 6Н), 2,65 (дд, 1Н), 2,9 (м, ЗН), 3,7 (с, 2Н), 3,9 (м, 2Н), 4,2 (м, 1Н), 4,75 (м, 1Н), 5,1 (с, 2Н), 7,0 (с, 1Н), 7,15 (с, 1Н), 7,2 (с, 5Н), 8,13 (д, 1Н), 8,7 - 8,8 (м, ЗН) 13 Спектр ЯМР С (виразні сигнали, стандарт ТМС, DMSO-d 6 ), 5, м д 10,76, 25,49 25,68, 25,96, 31,66, 33,07 33,36,36,25, 38,59, 41,88, 47,02, 49,40, 50,47, 65,71, 127,81 - 128,34, 135,82, 165,10 163,34, 173,79 Характерні приклади зняття захисту приведені в Таблиці А 1 спост = 461 Елементний аналіз C26H37H4O7F3 Обчислено, % Н, N, F, С 54,3% Знайдено, % С 53,82 Таблиця А Лабораторний приклад КІЛЬКІСТЬ BOC-N(Et)Gly-(L)-Asp-(OBzl)-(L) Cha-Nbb в реакції Приклад 1 7,5 г (13,3 ммоля) Приклад 2 6,53 г (11, 6 ммоля) Приклад 4 Отримання CBZ-PipBu-N(Et)Gly-(L)Asp-(OBzl)-(L)-Cha-NH 2 (Стадія 4 схеми II) Готують суспензію приблизно еквімолярних кількостей ТФОК • N-(Et)Gly-(L)-Asp-(OBzl)-(L)-ChaNH 2 , CBZ-PipBu і ТБТУ в ЕЮАс, ДМФА і воді (об'ємне відношення 100 8 4, приблизно відношення загальний об'єм вага відносно ТФОК • N(Et)Gly-(L)-Asp-(OBzl)-(L)-Cha-NH 2 , 11 1) Суспензію охолоджують приблизно до 0 - 10°С і додають приблизно 3 - 4 еквіваленти NMM Суміші дають нагрітися до кімнатної температури і перемішують доти, поки дані ВЕРХ не укажуть на закінчення реакції (1 - 3 години, за цей час утвориться розчин) Додають воду (2 - 3 об'єми спочатку доданої води) і залишають для розділення фаз Водну фазу ВІДДІЛЯЮТЬ і органічну фазу промивають ще двома порціями води Об'єднані водні фракції піддають зворотній екстракції ЕЮАс і об'єднані органічні фази промивають 25%-вим водним розчином хлориду натрію Органічну фазу концентрують при зниженому тиску приблизно до 1/2 об'єму і додають трет -бутилметиловий ефір (приблизно 1/2 об'єми розчину) Цю суміш залишають кристаллізуватися (декілька годин), тверді речовини відфільтровують, промивають охолодженою сумішшю ЕЮАс і трет-бутилметилового ефіру Тверді речовини сушать при зниженому тиску 3 допомогою ВЕРХ визначають ваговий вміст CBZ-PipBuN(Et)Gly-(L)-Asp-(OBzl)-(L)-Cha-NH 2 Вихід звичайно перевищує 80%, чистота складає більше за 95% (по площі) У конкретному прикладі приведеної вище методики по загальній методиці стадії 4 і при використанні 7,25г ТФОК • N-(Et)Gly-(L)-Asp-(OBzl)-(L)Cha-NH 2 , отримують 7,9г CBZ-PipBu-N(Et)Gly-(L)Asp-(OBzl)-(L)-Cha-NH 2 (чистота більше за 99%, 0,08% диастереоміра, Asp), вихід становить 84% від теоретичного Елементний аналіз C41H57N5O8 Обчислене, Вихід І чистота ТФОК • N-(Et)Gly-(L)Asp-(OBzl)-(L)-Cha-NH 2 (по площі), % 7,4 г (12,9 ммоля), вихід 97 %, 98,8 % чистота 6,4 г (11,1 ммоля), вихід 9 6 % , 98,47 % чистота % Н, N, С 65,84% Знайдено, % 65,38 Мас спектр Мрозр = 747, М + 1СПост = 748 Т п л 101,6°С(ДСК) Спектр ЯМР 1 Н (стандарт - ТМС, DMSO-d 6 ), 5, мд 0,88 (м, 1Н), 0,98 (м, 1Н), 1,13 (2Н), 1,23 (м, 6Н), 1,4 (м, 1Н), 1,62 - 1,76 (м, 8Н), 1,86 (кв д, 1Н), 2,35 (т, 1Н), 2,74 (дд, 2Н), 3,25 (дд, 1Н), 3,47 (кв, 2Н), 3,7 (д, 1Н), 3,84 (д, 1Н), 4,15 (де, 2Н), 4,5 (д кв, 1Н), 4,68 ( д т , 1Н), 5,07 (д, 1Н), 5,14 (ушир д, 2Н), 5,16 (д, 1Н), 7 , 2 - 7 39 (м, 10Н), 7,57 (дд, 1Н) Спектр ЯМР 1 С (виразні сигнали, стандарт ТМС, CDCI 3 ), 5, м д 66,93 (обидва бензильних атоми вуглецю), 127,78 - 128,64 (обидва фенільних кільця), 155,249, 170,00 170,24, 171,69 174,27, 175,21 (всі карбонільні атоми вуглецю) Приклад 5 Отримання гігроскопічної кристалічної N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nетилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду, (Стадія 5 схеми II) Готують суміш CBZ-PipBu-N(Et)G]y-(L)-Asp(OBzl)-(L)-Cha-NH 2 , форміата амонію і 10% Pd/C в суміші спирт вода, 20 1 (відношення об'єм вага 10 1 відносно CBZ-PipBu-N(Et)Gly-(L)-Asp-(OBzl)-(L)Спа-ІЧНг) Суміш нагрівають до температури 40 50"С і перемішують доти, поки дані ВЕРХ не укажуть на закінчення реакції (1 - 2 години) Суміш охолоджують до кімнатної температури і фільтрують для видалення каталізатора Отриманий розчин нгрівають до 40 - 45°С і додають ацетон (об'єм, приблизно рівний об'єму відфільтрованого розчину), потім залишають охолоджуватися до температури 35-40Y1 До суміш) додають затравочні кристали М-[М-[г\І-(4-піперидин-4-іл)бутаноіл)г\І-етилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду При охолоджуванні до кімнатної температури (декілька годин) з суміші кристаллизуется гігроскопічна форма N-[N-[N-(4піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшаміду, Тверді 33 48252 речовини відфільтровують в атмосфері азоту, промивають ацетоном, сушать при зниженому тиску і визначають вміст гігроскопічної кристалічної форми N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nетилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду (аналіз з допомогою ВЕРХ вага/вага) Вихід становить > 85%, чистота > 95% (по площі) У конкретному прикладі описаного вище способу при використанні загальної методики стадії 5 з 5г CBZ-PipBu-N(Et)Gly-(L)-Asp(OBzl)-(L)-Cha-NH2 отримують 3,1г гігроскопічних кристалічних форми М-[І\І-[г\І-(4-піперидин-4-іл)бутаноіл)-г\І-етилгліцил](І_)-аспартил]-(І_)-р-циклогексилаланшаміду у вигляді твердого продукту (чистота 99,6%, по площі), стехіометричний вихід 89,4% Інші сполуки, отримані ВІДПОВІДНО ДО приведених вище прикладів 1 - 5 і при використанні ВІДПОВІДНИХ початкових матеріалів, являють собою N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил] валін, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]- D-валін, N-[N-[N-(3-nmepiflHH-4-in) пропаноіл)-І\Іетилгліцил] аспартил] валін, N-[N-[N-(5-ninepHflHH-4-in) пентаноіл)-І\Іетилгліцил] аспартил] валін, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартилі-Ьа-циклогексил-гліцин, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил] норлейцин, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-І_-а-(2,2-диметил) проп-3іл гліцин, г\І-[г\І-[г\І-(4-пшеридин-4-іл) бутаноіл)-г\Іетилгліцил] аспартил]-І_-р-декапдронафт-1їлаланш, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-і-а-(2-циклогексилетил) гліцин, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил] фенілаланін, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-І_-р-нафт-1-ілаланш, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-І_-р-нафт-2-ілаланш, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартилі-Ьр-циклогексилаланіна етиловий ефір, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-І_-р-цис-декапдронафт-2їлаланш, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-ааміноциклогексанкарбонова кислота, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-р-циклогексил-О-аланш, N-[N-[N-[H-(4-nmepHflHH-4-in) бутаноіл)-ІЧетилгліцил] аспартил]-р-декапдронафт-1-ілаланш, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-рциклогексилаланшетиламід, N-[N-[N-(4-ninepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-р-циклооктилаланш, N-[N-[N-(4-ninepHflHH-4-in) 6yraH0in)-N 34 етилгліцил] аспартил]-рциклогексилметилаланінамід, N-[N-[N-(4-nmepHflHH-4-in) 6yraH0in)-Nетилгліцил] аспартил]-р- адамант-1-ілаланш, N-[N-[N-[1 М-(4-піперидин-4-іл) бутаноіл)-І\Іетилгліцил] аспартил]-р-(1,2,3,4)-тетрапдронафт5-илаланін, N-[N-[N-(4-nmepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-р-(4-циклогексил) циклогексилаланш, N-[N-[N-(4-ninepHflHH-4-in) 6yraH0in)-Nетилгліцил] аспартил]-р-циклогептилаланш, N-[N-[N-(4-nmepHflHH-4-in) бутаноіл)-г\Іетилгліцил] аспартил]-р-циклооктилаланшамід, N-[N-[N-(4-nmepHflHH-4-in) 6yraH0in)-Nетилгліцил] аспартил]-а-циклогексилпропілгліцин, N-[N-[N-(1 М-(4-піперидин-4-іл) 6yraH0in)-Nетилгліцил] аспартил]-р-циклооктилметилаланш, N-[N-[N-(4-nmepHflHH-4-in) 6yraH0in)-Nетилгліцил] аспартил]-р-циклопентилаланін і N-[N-[N-(4-nmepHflHH-4-in) 6yraH0in)-Nетилгліцил] аспартил]-р-циклогексилметилаланіна етиловий ефір Приклад 6 Отримання 4-І\І-СВ2-піперидона Суміш 40кг (Nбензилоксикарбонілокси)сукциніміда і 26кг (175молей) 4-піперидон • НСІ • ЬЬО в 38,8кг води І 88кг ТГФ перемішують при температурі 15 ± 5°С до повного розчинення (приблизно 5 хвилин) При перемішуванні додають NMM (22,8кг) (екзотерма), підтримуючи температуру при 20°С або нижче Завантаження перемішують при 20 ± 5°С протягом 2,5 години (закінчення реакції визначають з допомогою ВЕРХ) Суміш розбавляють 115,2кг МТБЕ і 38,8кг води і перемішують при 20 ± 5°С протягом 5 хвилин Перемішування припиняють, шару дають розділитися, водний шар ВІДДІЛЯЮТЬ І викидають Органічний шар промивають водою (129,6кг х 2) (перемішування 5 хвилин, розділення фаз, відділення/викидання водного (нижнього) шару) Органічний шар промивають 5,2кг NaCI в 46,8кг води (перемішування 5 хвилин, розділення фаз, видалення і викидання водного (нижнього) шару) Органічний шар обробляють 11,5кг MgSO4 при перемішуванні протягом 1 години, потім суміш фільтрують Реактор промивають 8кг МТБЕ (фільтрують, об'єднують з основним фільтратом, сумарний вміст води в фільтраті 0,52%) Об'єм суміші зменшують до половини шляхом відгону при зниженому тиску при 30°С Вакуум скидають в азот, залишок охолоджують до 20°С (вміст води, в залишку - 0,43%) Залишок розбавляють 57,6кг МТБЕ, потім об'єм суміші знов зменшують наполовину шляхом відгону у вакуумі при 30°С Вакуум скидають в азот, суміш охолоджують до 20°С (вміст ВОДИ В залишку -0,25%) Цю операцію повторюють ще 5 разів Отриманий залишок розбавляють 28,8кг МТБЕ перемішують протягом 5 хвилин потім визначають зміст води і зміст 4-N-CBZпіперидона (вода - 0,05%, аналіз 4-N-CBZпіперидона вага /вага - 22,66% вага, 35 36кг, 155молей, стахюметричнии вихід 88,6%) Приклад 7 Отримання РірВи У струмі N2, і при перемішуванні отримують розчин 53,5кг З 35 36 Приклад 8 Отримання CBZ-PipBu Розчин 224кг 4-(3'-карбоксипропіл)піперидина у водному NaOH змішують з 55,3кг ТГФ і суміш при перемішуванні охолоджують до 8 ± 2°С Підтримуючи температуру < 10°С, додають NMM (20,9кг) По закінченні додавання доводять температуру до 8 ± 2°С, потім протягом 1 години при температурі 97%, 95%) Конверсію підтверджують за допомогою порошкової рентгенографи (фіг 2) Дані порошкової рентгенографії також представлені в таблиці у вигляді функції кута дифракції (26), що збільшується, ВІДПОВІДНОГО МІЖПЛОЩИННІЙ відстані кристала (d) в ангстремах ( ), імпульсам в секунду (І/сек) і ВІДНОСНІЙ інтенсивності піку (%) (Таблиця 2) Таблиця 2 N 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 26 5 186 6 371 7 570 8 232 8 817 10 428 11 377 11 600 12 667 13913 14 398 15 226 16 538 16 773 18019 18 672 18815 19 204 d 17 0268 13 8615 11 6689 10 7323 10 0206 8 4761 7 7714 7 6223 6 9828 6 3599 6 1468 5 844 5 3557 5 2814 4 9190 4 7483 4 7125 4 6178 1/сек 196 00 722 00 516 00 1094 00 257 00 365 00 129 00 11700 1805 00 551 00 178 00 2285 00 861 00 929 00 1132 00 1871 00 2052 00 2071 00 % 8 43 31 07 22 20 47 07 11 06 15 71 5 55 5 55 77 67 23 71 7 66 98 32 37 05 39 97 48 71 80 51 88 30 89 11 48252 43 44 Продовження табл 2 N 26 19 654 20 237 211 523 20 934 21 691 22 143 22 910 24 007 24 642 25 642 27 070 27 855 29 497 29 497 30 751 31 916 33 982 35 200 36 001 36 927 38 389 19 20 21 22 23 24 25 26 27 28 29 ЗО 31 32 33 34 35 36 37 38 39 d 4 5132 4 3845 4 3240 4 2400 4 0938 40112 3 8786 3 7037 3 6097 3 6097 3 2913 3 2002 3 0258 3 0013 2 9051 2 8017 2 6360 2 5475 2 4926 2 4322 2 3429 б) Конверсія форми Гігроскопічну кристалічну форму N-[N-[N-(4піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшаміду (370г) завантажують в колбу роторного випарника об'ємом 2л Колбу встановлюють на роторний випарник (Heidolph UV-2002) і опускають в заздалегідь нагріту (58°С) баню (Heidolph UV 2002) У пристрої створюють вакуум бОмБар за допомогою вакуумного насосу (Divatnon DV1), потім вакуум скидають під контролем у вологу атмосферу, створену в окремій, нагрітій, утримуючій воду колбі Прийом вологої атмосфери контролюють за допомогою пристрою, регулюючого вогкість (Vausalo Humiditique and Temperature Traumettor) так, щоб всередині пристрою отримати відносну вогкість 79% (внутрішній тиск 130 - 180мБар) Потім судину роторного випарника обертають при швидкості 145 - 160 оборотів в хвилину протягом 5 годин, підтримуючи температуру нагріваючої бані приблизно 60°С і відносну вогкість в судині при 71 - 79% Потім вакуум скидають в азот, судину і її вміст охолоджують до кімнатної температури, продукт витягують і отримують непгроскопічну кристалічну 1/сек 2226 00 1939 00 2324 00 1656 00 923 00 1411 00 994 00 964 00 991 00 991 00 1687 00 688 00 843 00 878 00 809 00 821 00 882 00 865 00 841 00 1106 00 968 00 % 95 78 83 43 100 00 71 26 39 72 60 71 42 77 41 48 42 64 42 64 72 59 29 60 36 27 37 78 34 81 35 33 37 95 37 22 36 19 47 59 41 65 форму N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nетилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду Аналогічно обробляють друге завантаження гігроскопічної кристалічної форми N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nетилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду (317г) з отриманням непгроскопічної кристалічної форми N-[N-[N-(4піперидин-4-іл)бутаноіл)-г\І-етил-гліцил]-(І_)аспартил]-(І_)-р-циклогексилаланінаміду Конверсію підтверджують за допомогою діаграми порошкової рентгенографії (фіг 3) Дві партії разом дають 667г непгроскопічних кристалічних форми N[М-[І\І-(4-піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланінаміду (97% вихід) Конверсію підтверджують за допомогою діаграми порошкової рентгенографії (фіг 3) Дані порошкової рентгенографії також представлені в таблиці у вигляді функції кута дифракції (26), що збільшується, ВІДПОВІДНОГО МІЖПЛОЩИННІЙ відстані кристала (d) в ангстремах ( ) , імпульсам в секунду (І/сек) і ВІДНОСНІЙ інтенсивність піку (%) (Таблиця 3) Таблиця З N 1 2 3 4 5 6 7 8 9 10 11 26 5 124 6 328 7 574 8 191 8 797 10 398 12 628 13 871 15218 15 723 16 538 d 17 2309 13 9565 11 6623 10 7851 10 0432 8 5004 7 0040 6 3791 5 8172 5 6317 5 3558 1/сек 180 00 408 00 305 00 556 00 166 00 244 00 1198 00 353 00 1543 00 187 00 589 00 % 1017 23 05 17 23 31 41 9 38 13 79 67 68 19 94 87 18 10 56 33 28 45 46 48252 Продовження табл З N 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 ЗО 31 32 33 34 35 36 37 38 26 16 751 18 024 18 640 18 809 19 191 19 659 20 865 20 495 20 865 21 616 22 113 22 950 24 117 24 618 25 644 26 297 27 052 27 960 29 640 30 744 33 465 33 840 35 812 36 811 37 076 38 185 39 622 d 5 2882 4 9175 4 7563 4 7141 4 6210 4 5120 4 4064 4 3299 4 2539 4 1077 4 0166 3 8719 3 6871 3 6132 3 4709 3 3862 3 2934 3 1885 30115 2 9058 2 6755 2 6467 2 5053 2 4396 2 4228 2 3549 2 2728 1/сек 621 00 869 00 1156 00 1241 00 1521 00 1413 00 1303 00 1770 00 1120 00 683 00 919 00 697 00 659 00 716 00 662 00 486 00 1270 00 518 00 705 00 695 00 697 00 764 00 736 00 858 00 919 00 870 00 882 00 Приклад 14 Діаграми порошкової рентгенографи зразка N-[N-[N-(4-nmepHflHH-4-in)6yTaH0in)-Nетилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду у вигляді його кристалічної форми і його конвертованої непгроскопічної кристалічної форми Зразок гігроскопічної кристалічної форми N-[N[г\І-(4-піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшаміду отримують ВІДПОВІДНО до методики прикладу 5 або 11 і % 35 08 49 10 65 31 70 11 85 93 79 83 73 62 100 00 63 28 38 59 51 92 39 38 37 23 40 45 37 40 27 46 71 75 29 27 39 38 39 27 39 38 43 16 41 58 48 47 51 92 49 15 49 83 перетворюють у відповідну непгроскопічну кристалічну форму по методиці прикладу 13 Діаграми порошкової рентгенографії для гігроскопічної кристалічної форми і непгроскопічної кристалічної форми також представлені в таблицях у вигляді функції кута дифракції, що збільшується (26), ВІДПОВІДНОГО МІЖПЛОЩИННІЙ відстані кристала (d) в ангстремах ( ) , імпульсам в секунду (І/сек) і ВІДНОСНІЙ інтенсивності піку (%) (Таблиці 4 і 5 ВІДПОВІДНО) Таблиця 4 N 1 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 26 2 5 073 6 451 7 837 8 491 9 699 10 488 11 570 12 530 13 576 15 327 15 790 16 179 16 770 17 085 17 750 18 151 18 504 D 3 17 4037 13 6905 11 2712 10 4049 91119 8 4278 7 6423 7 0474 6 5168 5 7763 5 6080 5 4739 5 2824 5 1856 4 9927 4 8835 4 7909 1/сек 4 1487 00 447 00 411 00 602 00 93 00 421 00 92 00 411 00 760 00 606 00 456 00 346 00 938 00 685 00 924 00 741 00 593 00 % 5 86 50 26 00 23 91 35 02 5 41 24 49 5 35 23 91 44 21 35 25 26 53 20 13 54 57 39 85 53 75 43 11 34 50 47 48252 48 Продовження табл 4 N 18 19 20 21 22 23 24 25 26 27 28 29 ЗО 31 32 33 34 35 36 37 38 39 40 41 42 43 44 26 19 323 19714 20 545 21 388 22 381 22 870 23 640 23 841 24 048 24 746 25 200 23 792 26 266 26 959 27 426 27 967 29 020 29 922 30 970 31 552 33 338 34 838 35 873 36 107 37 162 38 509 39 701 D 4 5897 4 4996 4 3194 4 1510 3 9691 3 8852 3 7604 3 7292 3 6976 3 5949 3 5311 3 4513 3 3901 3 3045 3 2494 3 1876 3 0744 2 9837 2 8851 2 8332 2 6854 2 5731 2 5012 2 4855 2 4174 2 3359 2 2684 1/сек 930 00 792 00 1719 00 897 00 373 00 258 00 563 00 680 00 623 00 338 00 366 00 590 00 731 00 555 00 769 00 528 00 771 00 491 00 384 00 510 00 627 00 520 00 653 00 639 00 683 00 775 00 784 00 % 54 10 46 07 100 00 52 18 21 70 15 01 32 75 39 56 36 24 19 66 21 29 34 32 42 52 32 29 44 74 30 72 44 85 28 56 22 34 29 67 36 47 30 25 37 99 37 17 39 73 45 08 45 61 Таблиця 5 N 1 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 2 5 152 6 386 7 580 8 225 8 801 10 408 12 660 13914 15 251 16 541 16 771 18 047 18 676 18 902 19 182 19 697 20 240 20 568 29 933 21 684 22 122 22 970 24 080 24 218 24 694 25 680 26 400 27 105 d 3 17 1371 13 8287 11 6540 10 7410 10 0390 8 4928 6 9863 6 3594 5 8047 5 3548 5 2818 49112 4 7472 4 6910 4 6231 4 5035 4 3838 4 3147 4 2403 4 0951 4 0150 3 8685 3 6927 3 6720 3 6023 3 4662 3 3732 3 2871 1/сек 4 123 00 483 00 389 00 752 00 180 00 276 00 1399 00 391 00 1675 00 608 00 652 00 775 00 1078 00 1099 00 1151 00 1164 00 1049 00 1403 00 1024 00 569 00 746 00 564 00 546 00 556 00 618 00 510 00 403 00 1093 00 % 5 7 34 28 84 23 22 44 90 10 75 16 48 83 52 23 34 100 00 36 30 38 93 46 27 64 36 65 61 68 72 69 49 62 63 83 76 61 13 33 97 44 54 33 67 33 60 33 19 36 90 30 45 24 06 65 25 48252 49 50 Продовження табл 5 N 29 ЗО 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 29 27 929 29 360 29 724 30 340 30 693 31 353 31 822 32 006 32 885 33 508 34 040 34 839 35 998 36 680 36 948 37 197 39 602 d 3 1920 3 0395 3 0031 2 9435 2 9105 2 8507 2 8098 2 7940 2 7213 2 6722 2 6316 2 5730 2 4928 2 4480 2 4309 2 4152 2 2739 Приклад 15 Ізотермічні мікрокалориметричні досліди на гігроскопічній і непгроскопічній кристалічних формах М-[г\І-[г\І-(4-піперидин-4-іл)бутаноіл)г\І-етилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду Ізотермічні мікрокалориметричні досліди на гігроскопічній і непгроскопічній кристалічних формах І\І-[г\І-[г\І-(4-піперидин-4-іл)бутаноіл)-г\І-етилгліцил](І_)-аспартил]-(І_)-р-циклогексилаланшаміду проводять на приладі Thermometrico Thermal Activity Monitor (ТАМ) Конверсію твердого стану різних кристалічних форм вивчають шляхом впливу на ці форми умов при різній вогкості або пар різних розчинників при різних температурах Для отримання умов з різною важливістю використовують насичені сольові розчини, а саме КСІ (80% ВВ), NaCI (75% ВВ) і NaBr (65% ВВ) У скляній ампулі приладу ТАМ зважують приблизно по 100 мг відповідної форми і всередину ампули вміщують мікропдростат, що містить насичені сольові розчини (з лишком твердої речовини) або органічного розчинника Ампулу герметично закривають, врівноважують при температурі досліду і встановлюють в приладі ТАМ в положення вимірювання Аналогічну систему, що містить промитий морський пісок замість сполуки в формі, що зазнає випробування, вміщують на контрольну сторону приладу Змінюють вихідну потужність як функцію часу (фіг 6 - 8) Приклад 16 Ізотерми сорбції вологи гігроскопічної і непгроскопічної кристалічних форм N-[N[г\І-(4-піперидин-4-іл)бутаноіл)-г\І-етилгліцил]-(І_)аспартил]-(І_)-р-циклогексилаланшамід Ізотерми сорбції вологи гігроскопічної і непгроскопічної кристалічних форм N-[N-[N-(4-ninepnflHH4-іл)бутаноіл)-г\І-етилгліцил]-(І_)-аспартил]-(І_)-рциклогексилаланшаміду отримують на ричажних вагах VTI MB 300G, проградуйованих в процентах вогкості Досліди проводять з використанням приблизно 15мг кристалічних форми, збільшуючи і зменшуючи ВВ При цьому вимірюють збільшення ваги (на кожній рівноважній стадії) як функцію ВВ (фіг 9) У іншому варіанті досвіду кристалічну форму витримують при ПОСТІЙНІЙ вогкості і визначають збільшення ваги як функцію часу 1/сек 450 00 555 00 595 00 429 00 552 00 476 00 531 00 545 00 485 00 547 00 606 00 580 00 596 00 629 00 727 00 703 00 697 00 % 26 87 33 13 35 52 25 61 32 96 28 42 31 70 32 54 28 96 32 66 36 18 34 63 35 58 37 55 43 40 41 97 41 61 Сполука формули II володіє корисною фармакологічною активністю і, таким чином, вводиться в фармацевтичні композиції і використовується для лікування пацієнтів, страждаючих від різних патологічних станів Цей винахід також відноситься до способу лікування пацієнтів, страждаючих від або схильних до станів, які можуть бути поліпшені або попереджені при введенні інгібіторів агрегації тромбоцитів, за рахунок шпбіторювання скріплення фібриногену і згортання крові Крім того, цей винахід відноситься до способу профілактики або лікування тромбозу, асоційованого з деякими хворобливими станами, такими як інфаркт міокарда, удар, периферичне артеріальне захворювання і дисеміноване внутрішньосудинне згортання, у людей і інших ссавців Потрібно розуміти, що під "лікуванням" в даному випадку мається на увазі профілактична терапія, а також лікування виражених станів Цей винахід також включає в свій об'єм фармацевтичні композиції, які містять фармацевтичне прийнятну КІЛЬКІСТЬ, щонайменше, однієї сполуки формули І в поєднанні з фармацевтичне прийнятним носієм або наповнювачем На практиці сполуки і лікарські композиції ВІДПОВІДНО до цього винаходу можуть бути введені будь-яким прийнятним способом, наприклад, локально, шляхом інгаляції, парентерально, ректальне або перорально, але переважним є пероральний спосіб Сполука формули II може бути представлена в лікарських формах, що забезпечують введення за допомогою найбільш переважного способу, і цей винахід також відноситься до фармацевтичних композицій, що містять, щонайменше, одну сполуку, що заявляється, які прийнятні для використання в медицині або ветеринарії Ці композиції можуть бути отримані за допомогою звичайних способів І використанням фармацевтичне прийнятних адьювантів або наповнювачів До адьювантів відносяться, крім іншого, розріджувачі, стерильне водне середовище і різні нетоксичні органічні розчинники 51 48252 Композиції можуть бути отримані в формі таблеток, пілюль, капсул, гранул, порошків, водних розчинів або суспензій, розчинів для ІН'ЄКЦІЙ, еліксирів, сиропів і ін , і можуть містити один або декілька агентів, вибраних з групи, що включає підсолоджуючі речовини, корригенти, барвники, стабілізатори і консерванти, щоб можна було приготувати фармацевтично прийнятні композиції Вибір розчинника і вміст активної речовини в розчиннику звичайно здійснюється з урахуванням розчинності і ХІМІЧНИХ властивостей продукту, конкретного способу введення умов, які необхідно дотримувати в фармацевтичній практиці Наприклад, при виготовленні таблеток можуть бути використані наповнювачі, такі як лактоза, цитрат натрію, карбонат кальцію, дикальцій фосфат, диспергуючі агенти, такі як крохмаль, альгинові кислоти і деякі комплексні силікагелі, змішані із змащуючими речовинами, такими як стеарат магнію, лаурилсульфат натрію і тальк Для отримання капсул добре використати лактозу і високомолекулярні поліетиленгликолі При отриманні водних суспензій можна додавати емульгуючі агенти або агенти, які прискорюють, утворення суспензії Можуть бути також використані розріджувачі, такі як сахароза, етанол, поліетиленгликоль, пропіленгликоль, гліцерин і хлороформ або їх суміші, а також ІНШІ матеріали Для парентерального введення можна використати емульсії, суспензії або розчини сполук цього винаходу в рослинному маслі, наприклад, в кунжутному маслі, арахісовому маслі, оливковому маслі, або у водно-органічних розчинах, таких як суміші води і пропілен гликоля, в органічному ефірі, відповідному для ІН'ЄКЦІЙ, таких як етилолеат, а також стерильні водні розчини фармацевтичне прийнятних солей продуктів ВІДПОВІДНО до цього винаходу, розчини солей продуктів цього винаходу також можуть бути використані для введення шляхом внутрішньом'язових або підшкірних ІН'ЄКЦІЙ Для внутрішньовенних ІН'ЄКЦІЙ можуть бути використані водні розчини, що містять солі в чистій дистильованій воді, при наступних умовах значення рН розчину ВІДПОВІДНИМ образом підігнане, розчини повинні містити розумний буферний агент, розчини ІЗОТОНІЧНІ завдяки введенню достатньої КІЛЬКОСТІ глюкози або хлористого натрію, розчини -стерилізовані, шляхом нагрівання, опромінення і/або мікро фильтрацм Також можна використати місцеве введення з допомогою гелю (на водній або спиртовій основі), кремів або мазей, що містять сполуку цього винаходу Сполуки, що заявляються, можуть бути введені в гелі або матричні основи для застосування у вигляді пластиру, який повинен забезпечувати введення сполуки, що контролюється через шкіряний бар'єр Тверді композиції для ректального введення включають свічки, приготовані ВІДПОВІДНО ДО ВІДОМИХ способів і що містять, щонайменше, одну сполуку формули II Процентний вміст активного інгредієнта в композиції ВІДПОВІДНО до теперішнього часу винайденому може мінятися так, щоб забезпечувати відповідне дозування ЛІКІВ Очевидно, що декілька стандартних лікарських форм може бути введено 52 приблизно в один і той же час Необхідна доза може бути визначена лікарем або кваліфікованим медичним персоналом і залежить від бажаного терапевтичного ефекту, способу ведення і тривалості лікування, а також від стану пацієнта Схема прийому лікарського засобу при здійсненні способу цього винаходу повинна бути така, щоб вона забезпечувала максимальну терапевтичну дію доти, поки спостерігається поліпшення, а з цього моменту - ефективний мінімальний рівень, який дає полегшення Звичайно пероральна доза може складати приблизно від 0,1мг/кгдо 100мг/кг, переважно від 0,1 до 20мг/кг, і найбільш переважно приблизно від 1 до 20мг/кг, а внутрішньовенна доза - приблизно від 0,1мкг/кг до 100мкг/кг, переважно від 0,1 до 50мг/кг У кожному конкретному випадку дозування ЛІКІВ визначається з урахуванням факторів, властивих даному пацієнту, таких як вік, вага, загальний стан здоров'я і ІНШІ параметри, які можуть впливати на ефективність сполуки, що заявляється Крім того, сполука формули II може вводитися так часто, як це необхідно для отримання бажаної терапевтичної дм У деяких пацієнтів може спостерігатися швидка реакція на більш високі або більш низькі дози і можуть бути достатні більш слабі підтримуючі дози Для інших пацієнтів може бути необхідно провести довготривале лікування при нормі від 1 до 4 пероральних доз в день, переважно від одного до двох доз в день, ВІДПОВІДНО до фізіологічних потреб кожного конкретного пацієнта Звичайно активний продукт може бути введений перорально 1 - 4 разу в день Звичайно, для інших пацієнтів може бути необхідно прописувати не більше за одну або двох доз в день Сполуки формули II виявляють значну фармакологічну активність при проведенні описаних в літературі ДОСЛІДІВ Результати цих ДОСЛІДІВ, ЯК вважають, відповідають фармакологічній активності для людини і інших ссавців Нижче приведені результати фармакологічних випробувань in vitro і in vivo, які характерні для сполуки формули II У приведених нижче фармакологічних випробуваннях оцінюються інгібуюча активність сполуки формули II на опосередкуєму фібриногеном агрегацію тромбоцитів, скріплення фібриногену з активованими тромбіном тромбоцитами, а також ехvivo інгібування індукованої АДФ агрегації тромбоцитів Результати цих випробувань корелюють з інгібуючими властивостями in vivo сполуки формули II Оцінка агрегації тромбоцитів заснована на описі, представленому в роботі Blood 66 (4), 946 952 (1985) Оцінка скріплення фібриногену відповідає по суті методиці, описаній Ruggen Z М , et al , Proc Natl Acad Sci, USA 83, 5708 - 5712 (1986) і Plow E F , et al , Proc Natl Acad Sci, USA 82, 8057 - 8061 (1985) Вивчення ex-vivo інгібування індукованої АДФ агрегації тромбоцитів засноване на способі Zucker, "Platelet Aggregation Measured by the Photoelectric Method", Method in Enzyrao-logy 169,117-133(1989) Оцінка агрегації тромбоцитів Приготування фіксованих активованих тромбоцитів Тромбоцити виділяють з концентратів тромбо 53 48252 цитів людини з використанням гель-фільтруючої методики, описаної Marguene G А , et al , J ВюІ Chem , 254, 5357 - 5363 (1979) і Ruggen Z М et al , Invest, 72, 1 - 12 (1983) Тромбоцити суспендують при концентрації 2 х 108кліток/мл в модифікованому не утримуючому кальцію буфері Тірода, що містить 127мМ хлористого натрію, 2мМ хлористого магнію, 0,42мМ Na2HPO4 11,9мМ МаНСОз, 2,9мМ КСІ, 5,5мМ глюкози, ЮмМ HEPES (ГЕПЕС, N-2пдроксиетилпіперазин-г\Г-2-етансульфонова кислота) при рН 7,35 і 0,35% сивороточного альбуміну людини (HSA) Ці промиті тромбоцити активують шляхом додання людського а-тромбіну при кінцевій концентрації 2од/мл з подальшим доданням шпбітора тромбіну 1-2581 при кінцевій концентрації 40мкМ До активованих тромбоцитів додають параформальдегід при кінцевій концентрації 0,50% і витримують при кімнатній температурі протягом ЗО хвилин Фіксовані активовані тромбоцити потім збирають шляхом центрифугування протягом 15 хвилин при 650 х g Пеллети тромбоцитів промивають 4 рази вказаним буфером Тірода з 0,35% HSA і знов суспендують при концентрації 2 х 108 кліток/мл в тому ж буфері Оцінка агрегації тромбоцитів Фіксовані активовані тромбоцити витримують протягом однієї хвилини з вибраною дозою сполуки, що випробовується в якості інпбітора агрегації тромбоцитів, де агрегацію ІНІЦІЮЮТЬ ШЛЯХОМ до дання фібриногену людини при кінцевій концентрації 250мкг/мл Для реєстрації агрегації тромбоцитів використовують пристрій для визначення профілю агрегації тромбоцитів Model PAP-4 Міру інгібування агрегації виражають в процентах від швидкості агрегації, що спостерігається у відсутність шпбітора Потім ДЛЯ кожної сполуки розраховують значення ІС50, тобто, КІЛЬКІСТЬ шпбітора, необхідного для зменшення швидкості агрегації на 50% (див , наприклад, Plow E F , et al Proc Natl Acad Sci, USA 82, 8057 - 8061 (1985)) Оцінка скріплення фібриногену Тромбоцити промивають від складових плазми з використанням технології градієнта ЩІЛЬНОСТІ альбуміну, описаної Walsh Р N з співавторами (Вг J Haematol 281 - 296 (1977)) і модифікованої Trapam-Lombardo V з співавторами, (J Clm Invast 76 1950 -1958 (1985)) У кожній експериментальній суміші тромбоцити в модифікованому Буфері Тірода (Ruggen Z М et al , J Clm Invest, 72, 1 - 12 (1983) стимулюють за допомогою а-тромбіну людини при 22 - 25°С протягом 10 хвилин (3,125 х 108 тромбоцитів на літр і тромбін в концентрації 0,1 одиниці Національного інституту людини (США) /мл) Потім додають гирудин в 25-кратному надлишку (одиниць/одиниць) протягом 5 хвилин перед доданням міченого ізотопом 125І фібриногену і випробуваної сполуки Після ЦЬОГО додання кінцева КІЛЬКІСТЬ тромбоцитів, в суміші становить 1 х 1011/л Після втримання протягом ще ЗО хвилин при 22 - 25°С пов'язані і ВІЛЬНІ ліганди розділяють шляхом центрифугування при 12000хд протягом 4 хвилин 50мкл суміші через ЗООмкл 20%-вий сахарози Пеллети тромбоцитів ВІДДІЛЯЮТЬ ВІД залишку суміші для визначення радіоактивності пов'язаних тромбоцитів Неспецифічне скріплення вимірюють 54 в сумішах, що містять надлишок неміченого ліганда При аналізі кривих скріплення по методу Scatchard неспецифічне скріплення отримують у вигляді підігнаного параметра з ізотерми скріплення за допомогою комп'ютерної програми (Munson Р J , Method Enzymol , 92, 542 - 576 (1983)) Для визначення концентрації кожної сполуки, необхідної для 50%-вого інгібування скріплення фібриноген з активованими тромбіном тромбоцитами (ІС50), кожну сполуку випробовують при 6 або більш концентраціях з фібриногеном, міченим 125І в концентрації 0,176мкмоля/л (60мкг/мл) ICso визначають з графіка залежності залишкового скріплення фібриногену і логарифма концентрації сполуки ex-vivo Інпбірування індукованої АДФ агрегації тромбоцитів Протокол досліду Контрольні зразки крові отримують за 5 - 10 хвилин до введення випробуваної сполуки нечистокровним собакам вагою від 10 до 20кг Сполуку вводять внутрішньошлунково через водний зонд або перорально в желатинових капсулах Зразки крові (по 5мл) відбирають через 30-ти хвилинні інтервали протягом 3 годин і через 6, 42 і 24 години після введення ЛІКІВ Кожний зразок відбирають за допомогою венепункції головної вени і збирають безпосередньо в пластиковий шприц, що містить одну частину 3,8%-вого тринатрий цитрата на дев'ять частин крові Ex-vivo агрегація тромбоцитів собак Зразки крові центрифугують при ЮООпро/мша протягом 10 хвилин з отриманням збагаченої тромбоцитами плазми (ЗТП) Після витягання ЗТП зразок центрифугують ще 10 хвилин при 2000про/міна з отриманням плазми з низьким змістом тромбоцитів (ПНТ) КІЛЬКІСТЬ тромбоцитів в ЗТП визначають за допомогою лічильника Coulter Counter (Coulter Electronics, Hialeah, FL) Якщо концентрація тромбоцитів в ЗТП складає більше ЗОООООтромбоцитів/мкл, то ЗТП розбавляють з допомогою ПНТ до змісту тромбоцитів до 300000 тромбоцитів/мкл Потім аліквоти ЗТП (250мкл) вміщують в кювети з дифузійним покриттям кремнієм (7,25 х 55мм, Bio/Data Corp , Horsham, PA) Потім ДО ЗТП додають епинефрин (кінцева концентрація 1 мкМ), плазму вигримують протягом 1 хвилини при 37°С До ЗТП додають стимулятор агрегації тромбоцитів, АДФ, при кінцевій концентрації Юмкм За агрегацією тромбоцитів спостерігають спектрофотометричне з використанням светотрансміссійного агрегометра (Bio/Date Platelet Aggregation Profiler, Mode-1 PAP-4, Bio/Date Corp , Horsham, PA) Для випробуваної сполуки ДВІЧІ записують швидкість зміни (нахил) пропущення світла і максимум світлопропускания (максимальна агрегація) Дані по агрегації тромбоцитів представляють як процент зменшення (середнє значення ± середньоквадратична помилка) нахилу або максимальної агрегації в порівнянні з даними, отриманими у випадку контрольної ЗТП, яку отримують із зразків крові, відібраних до введення випробуваної сполуки Сполуки формули II виявляють високу активність в описаних вище дослідах і розглядаються як сполуки, які можуть бути використані для лікуван 55 48252 56 рмули II за допомогою описаних вище методів представлені нижче в Таблиці 6 Також в цій Табчиці представлені результати порівняльних випробувань для 4 - 4-(піперидил) бутаноілгліциласпартилтриптофана, тобто, сполуки, описаної в європейській патентній публікації № 0479481 ня і профілактики тромбозу, асоційованого з деякими захворюваннями Антитромботична активність в дослідах за оцінкою ex-vivo агрегації тромбоцитів собаки передбачає наявність такої ж активності в організмі людини (див , наприклад, Catalfamo, J L, Dodds W Jean, "Isolation of Platelets from Laboratory Animals", Method Enzymol 169, Part A , 27, 0989)) Результати тестування сполуки фо Таблиця 6 Сполучення, N° Прикладу 15 Спол 047948) Інгібування агрегації фіксованих Доза (мг/кг) тромбоцитів (ІС,о мкМ) 0,097 ЕРА 5 0,047 ex-vivo інгібування індукованої АДФ аїрегації тромбоцитів % ex-vivo інгібування агрегації трмбоцимв Після перорального прийому 24 год 1 год Згод 6 год 12 год 50 100 100 100 98 5 53 Кваліфікований в даній області фахівець легко зрозуміє, що цей винахід добре адаптований для реалізації цілей цього винаходу і отримання названих результатів і переваг Сполуки, композиції і •165000 000 ФІГ 1 < л 20 і способи, описані тут, представлені, як переважні варіанти здійснення винаходу або для пояснення винаходу і не обмежують його об'єм 57 58 48252 3286 63 ooo 2 3 2 4 ООГ" 1 000 ФІГ 2 2 0 0 0 00 ФІГ 3 59 48252 200000 0 00 22 24 ФІГ 4 2368 81 000 167500 000 Ф1Г 5 60
ДивитисяДодаткова інформація
Назва патенту англійськоюAntithrombotic azacycloalkylalkanoyl peptides and pseudopeptides
Автори англійськоюMolino Bruce F., Czekaj Mark
Назва патенту російськоюПротивотромботические азациклоалкилалканоильные пептиды и псевдопептиды
Автори російськоюМОЛИНО Брюс Ф., Чекай Марк
МПК / Мітки
МПК: C07K 5/083, C07K 5/072, A61K 38/00, C07K 5/08, A61P 7/02, A61P 9/10
Мітки: псевдопептиди, антитромбічні, азациклоалкілалканоїльні, пептиди
Код посилання
<a href="https://ua.patents.su/32-48252-antitrombichni-azacikloalkilalkanolni-peptidi-i-psevdopeptidi.html" target="_blank" rel="follow" title="База патентів України">Антитромбічні азациклоалкілалканоїльні пептиди і псевдопептиди</a>
Попередній патент: Спосіб лікування диспепсії молодняка сільськогосподарських тварин
Наступний патент: Пристрій для контролю якості ізоляційного покриття труб
Випадковий патент: Процес введення постійного електричного струму в термоелектричне середовище