Сполуки, похідні від 5-тіоксилози, та їх терапевтичне застосування
Номер патенту: 92908
Опубліковано: 27.12.2010
Автори: Бонду Мішель, Томас Дідьє, Пейру Вінсент, Барберусс Веронік
Формула / Реферат
1. Похідна тіоксилози, вибрана з:
а) сполук формули
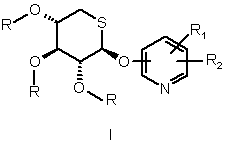 ,
,
де:
- пентапіранозильна група являє собою вільну або ацильовану 5-тio-![]() -D-ксилопіранозильну групу,
-D-ксилопіранозильну групу,
- R означає атом водню або С2-С6-ацильну групу,
- R1 являє собою С1-С4-алкілсульфонільну групу, С2-С6-ацильну групу, групу CONR'R" або групу
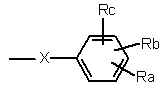 ,
,
у якій:
- X означає одинарний зв'язок, атом кисню, сульфоксильну групу, групу -CO- або групу -СНОН-,
- Ra означає атом водню, галоген, гідроксильну групу, С1-С4-алкільну групу, трифторметильну групу, трифторметоксильну групу, ціаногрупу, С1-С4-гідроксіалкільну групу, С2-С4-ацильну групу, С1-С4-алкоксильну групу або групу NR'R",
- замісники Rb і Rc незалежно один від одного являють собою атом водню, атом галогену, С1-С4-алкільну групу, ціаногрупу або С1-С4-алкоксильну групу,
- R2 означає атом водню, С1-С4-алкільну групу або атом галогену, і
- замісники R' і R" незалежно являють собою атом водню або С1-С4-алкільну групу, необов'язково заміщену ароматичним кільцем, або утворюють разом з атомом азоту, до якого вони приєднані, кільце, що містить 5 або 6 атомів вуглецю;
b) їхніх адитивних солей; і
c) їхніх активних метаболітів.
2. Сполука за п. 1, де група R1 являє собою групу формули
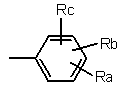 ,
,
де Ra, Rb і Rc такі, як визначені в п. 1.
3. Сполука за п. 1 або 2, де R означає атом водню.
4. Сполука за будь-яким з пп. 1-3, де R являє собою групу СОСН3.
5. Спосіб одержання сполуки, охарактеризованої в п. 1, в якому здійснюють стадії:
а) взаємодії піридинолу формули
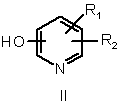 ,
,
де:
- R1 означає С1-С4-алкілсульфонільну групу, С2-С6-ацильну групу, групу CONR'R" або групу
 ,
,
у якій:
- X означає одинарний зв'язок, атом кисню, сульфоксильну групу, групу -СО- або групу -СНОН-,
- Ra означає атом водню, галоген, С1-С4-алкільну групу, трифторметильну групу, трифторметоксильну групу, ціаногрупу, С1-С4-гідроксіалкільну групу, С2-С4-ацильну групу, С1-С4-алкоксильну групу або групу NR'R",
- замісники Rb і Rc незалежно один від одного являють собою атом водню, атом галогену, С1-С4-алкільну групу, ціаногрупу або С1-С4-алкоксильну групу,
- R2 означає атом водню, С1-С4-алкільну групу або атом галогену, і
- замісники R' і R" незалежно являють собою атом водню або С1-С4-алкільну групу, необов'язково заміщену ароматичним кільцем, або утворюють разом з атомом азоту, до якого вони приєднані, кільце, що містить 5 або 6 атомів вуглецю,
з похідною 5-тіоксилопіранози формули
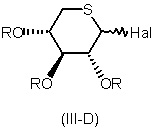 ,
,
де Hal означає галоген, переважно бром, a R являє собою С2-С6-ацильну групу,
в апротонному розчиннику за наявності солі срібла або солі цинку в безводному середовищі при температурі від 25 до 110 °С протягом від 1 до 10 годин з утворенням сполуки формули
 ,
,
де R, R1 і R2 такі, як визначені для вихідних сполук;
b) за необхідності, взаємодії сполуки формули І, отриманої вище, з розчином аміаку в метанолі з одержанням сполуки формули
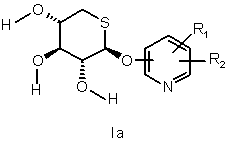 ,
,
де R1 і R2 такі, як визначені вище; і
c) за необхідності, взаємодії однієї зі сполук І або Іа, отриманих вище, з кислотою відомими способами з одержанням відповідної адитивної солі.
6. Спосіб одержання сполуки, охарактеризованої в п. 1, в якому здійснюють стадії:
а) взаємодії тетра-О-ацетил-5-тіоксилопіранози формули
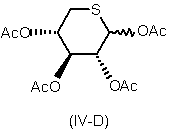 ,
,
де Ас означає ацильну групу,
зі сполукою формули
 ,
,
де:
- R1 являє собою С1-С4-алкілсульфонільну групу, С2-С6-ацильну групу, групу CONR'R" або групу
 ,
,
де:
- X означає одинарний зв'язок, атом кисню, сульфоксильну групу, групу -СО- або групу -СНОН-,
- Ra означає атом водню, галоген, С1-С4-алкільну групу, трифторметильну групу, трифторметоксильну групу, ціаногрупу, С1-С4-гідроксіалкільну групу, С2-С4-ацильну групу, С1-С4-алкоксильну групу або групу NR'R",
- замісники Rb і Rc незалежно один від одного являють собою атом водню, атом галогену, С1-С4-алкільну групу, ціаногрупу або С1-С4-алкоксильну групу,
- R2 означає атом водню, С1-С4-алкільну групу або атом галогену, і
- замісники R' і R" незалежно являють собою атом водню або С1-С4-алкільну групу, необов'язково заміщену ароматичним кільцем, або утворюють разом з атомом азоту, до якого вони приєднані, кільце, що містить 5 або 6 атомів вуглецю,
в апротонному розчиннику за наявності каталізатора типу кислоти Льюїса при температурі від 20 до 60 °С протягом від 1 до 2 годин з утворенням сполуки формули
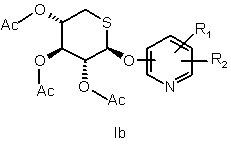 ,
,
де R1 і R2 такі, як визначені для вихідних сполук;
b) за необхідності, взаємодії сполуки формули І, отриманої вище, з метилатом натрію в метанолі з утворенням сполуки формули
 ,
,
де R1 і R2 такі, як визначені вище; і
с) за необхідності, взаємодії однієї зі сполук І або Іа, отриманих вище, з кислотою з одержанням відповідної адитивної солі.
7. Сполука за будь-яким з пп. 1-4 для застосування як фармакологічно активної речовини.
8. Застосування сполуки, охарактеризованої в будь-якому з пп. 1-4, для одержання лікарського засобу, призначеного для профілактики або лікування тромбозу, особливо венозного тромбозу.
9. Застосування сполуки, охарактеризованої в будь-якому з пп. 1-4, для одержання лікарського засобу, призначеного для профілактики або лікування серцевої недостатності.
Текст
1. Похідна тіоксилози, вибрана з: а) сполук формули O S R R1 C2 2 (13) 1 3 92908 Rc Rb X Ra , у якій: - X означає одинарний зв'язок, атом кисню, сульфоксильну групу, групу -СО- або групу -СНОН-, - Ra означає атом водню, галоген, С1-С4-алкільну групу, трифторметильну групу, трифторметоксильну групу, ціаногрупу, С1-С4-гідроксіалкільну групу, С2-С4-ацильну групу, С1-С4-алкоксильну групу або групу NR'R", - замісники Rb і Rc незалежно один від одного являють собою атом водню, атом галогену, С1-С4алкільну групу, ціаногрупу або С1-С4-алкоксильну групу, - R2 означає атом водню, С1-С4-алкільну групу або атом галогену, і - замісники R' і R" незалежно являють собою атом водню або С1-С4-алкільну групу, необов'язково заміщену ароматичним кільцем, або утворюють разом з атомом азоту, до якого вони приєднані, кільце, що містить 5 або 6 атомів вуглецю, з похідною 5-тіоксилопіранози формули S RO Hal RO (III-D) , де Hal означає галоген, переважно бром, a R являє собою С2-С6-ацильну групу, в апротонному розчиннику за наявності солі срібла або солі цинку в безводному середовищі при температурі від 25 до 110 °С протягом від 1 до 10 годин з утворенням сполуки формули O S R R1 R R2 O O N R I , де R, R1 і R2 такі, як визначені для вихідних сполук; b) за необхідності, взаємодії сполуки формули І, отриманої вище, з розчином аміаку в метанолі з одержанням сполуки формули O S H R1 O H R2 O O H Ia 6. Спосіб одержання сполуки, охарактеризованої в п. 1, в якому здійснюють стадії: а) взаємодії тетра-О-ацетил-5-тіоксилопіранози формули S OAc AcO OAc AcO (IV-D) , де Ас означає ацильну групу, зі сполукою формули R1 R2 HO N II , де: - R1 являє собою С1-С4-алкілсульфонільну групу, С2-С6-ацильну групу, групу CONR'R" або групу Rc Rb X Ra OR O 4 N , де R1 і R2 такі, як визначені вище; і c) за необхідності, взаємодії однієї зі сполук І або Іа, отриманих вище, з кислотою відомими способами з одержанням відповідної адитивної солі. , де: - X означає одинарний зв'язок, атом кисню, сульфоксильну групу, групу -СО- або групу -СНОН-, - Ra означає атом водню, галоген, С1-С4-алкільну групу, трифторметильну групу, трифторметоксильну групу, ціаногрупу, С1-С4-гідроксіалкільну групу, С2-С4-ацильну групу, С1-С4-алкоксильну групу або групу NR'R", - замісники Rb і Rc незалежно один від одного являють собою атом водню, атом галогену, С1-С4алкільну групу, ціаногрупу або С1-С4-алкоксильну групу, - R2 означає атом водню, С1-С4-алкільну групу або атом галогену, і - замісники R' і R" незалежно являють собою атом водню або С1-С4-алкільну групу, необов'язково заміщену ароматичним кільцем, або утворюють разом з атомом азоту, до якого вони приєднані, кільце, що містить 5 або 6 атомів вуглецю, в апротонному розчиннику за наявності каталізатора типу кислоти Льюїса при температурі від 20 до 60 °С протягом від 1 до 2 годин з утворенням сполуки формули O S Ac R1 O Ac R2 O O Ac N Ib , де R1 і R2 такі, як визначені для вихідних сполук; b) за необхідності, взаємодії сполуки формули І, отриманої вище, з метилатом натрію в метанолі з утворенням сполуки формули 5 O S H R1 O H 92908 R2 O O H N Ia , де R1 і R2 такі, як визначені вище; і с) за необхідності, взаємодії однієї зі сполук І або Іа, отриманих вище, з кислотою з одержанням відповідної адитивної солі. Даний винахід стосується нових похідних 5тіоксилози, переважно, похідних 5тіоксилопіранозного типу, способу їх одержання та їх застосування як активної речовини в лікарських засобах, призначених, зокрема, для лікування або профілактики тромбозу. Попередній рівень техніки Похідні D-ксилози розкриті, наприклад, у патентах ЕР 051023 В1, US 4877808, ЕР 421829 В1 або в публікації J. Med. Chem., vol. 36 no. 7, pp. 898903. Сполуки, описані в зазначених роботах, використовують для зниження ризику венозного тромбозу в людей. Механізм дії даних сполук, очевидно, полягає у впливі на глікозаміноглікани плазми (J. Biol. Chem., vol. 270, no. 6, pp. 2662-68; Thromb. Haemost., 1999, 8J., pp. 945-950). Предмет винаходу Виявлено нову групу похідних тіоксилози, які виявляють гарну антитромботичну активність і можуть бути ефективно синтезовані. Розкриття винаходу Нові сполуки відповідно до винаходу вибрані зі: а) сполук формули де: - пентапіранозильна група являє собою вільну або ацильовану 5-тіо- -D-ксилопіранозильну групу, - R означає атом водню або С2-С6-ацильну групу, - R1 являє собою С1-С4-алкілсульфонільну групу, С2-С6-ацильну групу, групу CONR'R" або групу у якій: 6 7. Сполука за будь-яким з пп. 1-4 для застосування як фармакологічно активної речовини. 8. Застосування сполуки, охарактеризованої в будь-якому з пп. 1-4, для одержання лікарського засобу, призначеного для профілактики або лікування тромбозу, особливо венозного тромбозу. 9. Застосування сполуки, охарактеризованої в будь-якому з пп. 1-4, для одержання лікарського засобу, призначеного для профілактики або лікування серцевої недостатності. - X означає одинарний зв'язок, атом кисню, сульфоксильну групу, групу -СО- або групу -СНОН-, - Ra означає атом водню, галоген, гідроксильну групу, С1-С4-алкільну групу, трифторметильну групу, трифторметоксильну групу, ціаногрупу, С1С4-гідроксіалкільну групу, С2-С4-ацильну групу, С1С4-алкоксильну групу або групу NR'R", - замісники Rb і Rc незалежно один від одного являють собою атом водню, атом галогену, С1-С4алкільну групу, ціаногрупу або С1-С4-алкоксильну групу, - R2 означає атом водню, С1-С4-алкільну групу або атом галогену, і - замісники R' і R" незалежно являють собою атом водню або С1-С4-алкільну групу, необов'язково заміщену ароматичним кільцем, або утворюють разом з атомом азоту, до якого вони приєднані, кільце, що містить 5 або 6 атомів вуглецю; b) їхніх адитивних солей; і c) їхніх активних метаболітів. Крім того, винахід стосується сполук формули І у зв'язку з їх застосуванням як фармакологічно активних речовин. Зокрема, винахід має відношення до застосування принаймні однієї речовини, вибраної зі сполук формули І і їхніх нетоксичних солей, для готування лікарського засобу, використовуваного в терапії людей або тварин і призначеного для профілактики або лікування тромбозів, особливо венозних тромбозів. Оскільки сполуки відповідно до винаходу є активними внаслідок механізму дії, що включає глікозаміноглікани, їх можна використовувати як активні речовини для лікарського засобу, призначеного для лікування або профілактики якого-небудь іншого захворювання, при якому задіяні глікозаміноглікани. Докладний опис У формулі І під С1-С4-алкільною групою мають на увазі лінійний, розгалужений або циклічний вуглеводневий ланцюг, що містить від 1 до 4 атомів вуглецю. Конкретними прикладами С1-С4алкільних груп є метил, етил, пропіл, бутил, 1метилетил, 1,1-диметилетил, 1-метилпропіл, 2метилпропіл, циклопропіл або циклопропілметил. Під алкільною групою, необов'язково заміщеною ароматичним кільцем, мають на увазі, наприклад, фенілметил (бензил) або фенілетил. 7 Під галогеном мають на увазі атом фтору, хлору, брому або йоду, переважно, атом фтору або хлору. С2-С6-ацильна група означає ацетил, пропаноїл, бутаноїл, пентаноїл або гексаноїл, або їхні гомологи, які можуть мати розгалужений ланцюг. Під С1-С4-алкоксильною групою мають на увазі лінійний, розгалужений або циклічний вуглеводневий ланцюг, що містить від 1 до 4 атомів вуглецю й приєднаний через атом кисню. Прикладами С1-С4алкоксильних груп, які можна згадати, є метокси-, етокси-, пропокси-, бутокси-, 1-метилетокси-, 1,1диметилетокси-, 1-метилпропокси-, 2- метилпропокси- або циклопропілметоксигрупи. Під адитивними солями мають на увазі адитивні солі, отримані взаємодією сполуки формули І з мінеральною або органічною кислотою. Кращими є фармацевтично прийнятні адитивні солі. Крім того, невід'ємну частину винаходу становлять гідрати або сольвати сполук формули І, або солі сполук формули І. Серед мінеральних кислот, що підходять для утворення солі з основною сполукою формули І, кращими є соляна, бромистоводнева, фосфорна й сірчана кислоти. Кращими серед органічних кислот, що підходять для утворення солі з основною сполукою формули І, є метансульфонова, бензолсульфонова, толуолсульфонова, малеїнова, фумарова, щавлева, лимонна, винна, молочна й трифтороцтова кислоти. Під активними метаболітами мають на увазі сполуки, що утворюються в біологічному середовищі зі сполук формули І і виявляють фармакологічну активність тієї самої природи, що й сполуки формули І, описані в даній заявці на патент. Наприклад, сполуки формули І, у яких R1 являє собою ацильну групу, можуть метаболізувати шляхом відновлення кетонної групи до спиртової групи (-СНОН-) з утворенням нової сполуки (метаболіту), що зберігає фармакологічну активність тієї самої природи, що й сполуки формули І. Особливо бажаними сполуками згідно з нинішнім винаходом є сполуки, в яких R1 являє собою фенільну групу, необов'язково заміщену групами Ra, Rb і Rс, такими як визначені вище. Іншими кращими сполуками згідно з нинішнім винаходом є сполуки, в яких R означає атом водню або групу -СОСН3. Сполуки формули І відповідно до винаходу можуть бути отримані за допомогою відомих методів глікозилювання, зокрема: а) за методом Гельфериха, описаним у книзі "The Carbohydrate, Chemistry and Biochemistry (Вуглеводи, хімія й біохімія)", 2nd edition, Academic Press, New York, London 1972, ν. ΙΑ, p. 292-294, конденсацією перацетильованого цукру з гідроксильованим ароматичним гетероциклом за наявності кислоти Льюїса; b) за методом Кенігса-Кнорра (там само, стор. 295-299) конденсацією галогенованої ацилози з гідроксильною групою фенольного характеру за наявності акцептора протону, такого як ціаніста ртуть, імідазолят срібла або трифторметилсульфонат срібла; 92908 8 c) за методом Шмідта конденсацією озилтрихлорацетимідату з гідроксильованим ароматичним гетероциклом за наявності кислоти Льюїса, як-от триметилсилілтрифторметансульфонат або ефірат трифтористого бору. Сполуки формули І переважно одержують способами, що є похідними з описаних вище процесів. Перший загальний спосіб включає виконання декількох стадій, що складаються із: а) взаємодії піридинолу формули де: - R1 означає С1-С4-алкілсульфонільну групу, С2-С6-ацильну групу, групу CONR'R" або групу у якій: - X означає одинарний зв'язок, атом кисню, сульфоксильну групу, групу -СО- або групу -СНОН-, - Ra означає атом водню, галоген, С1-С4алкільну групу, трифторметильну групу, трифторметоксильну групу, ціаногрупу, С1-С4гідроксіалкільну групу, С2-С4-ацильну групу, С1-С4алкоксильну групу або групу NR'R", - замісники Rb і Rc незалежно один від одного являють собою атом водню, атом галогену, С1-С4алкільну групу, ціаногрупу або С1-С4-алкоксильну групу, - R2 означає атом водню, С1-С4-алкільну групу або атом галогену, і - замісники R' і R" незалежно являють собою атом водню або С1-С4-алкільну групу, необов'язково заміщену ароматичним кільцем, або утворюють разом з атомом азоту, до якого вони приєднані, кільце, що містить 5 або 6 атомів вуглецю, з похідною 5-тіоксилопіранози формули де Hal означає галоген, переважно, бром, a R являє собою С2-С6-ацильну групу, переважно, ацетильну групу, в апротонному розчиннику, такому як ацетонітрил або толуол, за наявності солі срібла, особливо оксиду або імідазоляту срібла, або солі цинку (особливо оксиду або хлориду) у безводному середовищі при температурі від 25 до 110°С протягом від 1 до 10 годин з утворенням сполуки формули 9 де R, R1 і R2 такі, як визначені для вихідних сполук; b) за необхідністю, взаємодії сполуки формули І, отриманої вище, з розчином аміаку в метанолі для дезацилювання й, відповідно, заміщення ацильної групи атомами водню з одержанням сполуки формули у якій R1 і R2 такі, як визначені вище; і с) за необхідністю, взаємодії однієї зі сполук І або Іа, отриманих вище, з кислотою відомими способами з одержанням відповідної адитивної солі. Як варіант стадії b), описаної вище, заміщення ацильної групи атомом водню можна здійснювати взаємодією з алкоголятом металу, переважно, каталітичною кількістю метилату натрію в метанолі, при температурі від 0 до 30°С протягом від 0,5 до 2 годин з одержанням сполуки формули Іа зі сполуки формули І, у якій R являє собою С2-С6ацильну групу. Відповідно до другого способу, сполуки формули І можна одержувати взаємодією тетра-Оацетил-5-тіоксилопіранози формули де Ас означає ацетильну групу, зі сполукою формули де: - R1 означає С1-С4-алкілсульфонільну групу, С2-С6-ацильну групу, групу CONR'R" або групу де: - X означає одинарний зв'язок, атом кисню, сульфоксильну групу, групу -СО- або групу -СНОН, 92908 10 - Ra означає атом водню, галоген, С1-С4алкільну групу, трифторметильну групу, трифторметоксильну групу, ціаногрупу, С1-С4гідроксіалкільну групу, С2-С4-ацильну групу, С1-С4алкоксильну групу або групу NR'R", - замісники Rb і Rc незалежно один від одного являють собою атом водню, атом галогену, С1-С4алкільну групу, ціаногрупу або С1-С4-алкоксильну групу, - R2 означає атом водню, С1-С4-алкільну групу або атом галогену, і - замісники R' і R" незалежно являють собою атом водню або С1-С4-алкільну групу, необов'язково заміщену ароматичним кільцем, або утворюють разом з атомом азоту, до якого вони приєднані, кільце, що містить 5 або 6 атомів вуглецю, в апротонному розчиннику, такому як дихлорметан, за наявності каталізатора типу кислоти Льюїса, наприклад, тетрахлориду свинцю, при температурі від 20 до 60°С протягом від 1 до 2 годин з утворенням сполуки формули лук. де R1 і R2 такі, як визначені для вихідних спо Сполука формули Іb може потім реагувати за описаною в попередньому способі схемою синтезу з одержанням незаміщеної піранозильної сполуки й/або солі з кислотою. Відповідно до третього способу, сполуки формули І можна одержувати взаємодією похідної тіоксилози формули де Ас означає ацильну групу, зі сполукою формули де: - R1i означає С1-С4-алкілсульфонільну групу, С2-С6-ацильну групу, групу CONR'R" або групу де: - X означає одинарний зв'язок, атом кисню, сульфоксильну групу, групу -СО- або групу 11 -СНОН-, - Ra означає атом водню, галоген, С1-С4алкільну групу, трифторметильну групу, трифторметоксильну групу, ціаногрупу, С1-С4гідроксіалкільну групу, С2-С4-ацильну групу, С1-С4алкоксильну групу або групу NR'R", - замісники Rb і Rc незалежно один від одного являють собою атом водню, атом галогену, С1-С4алкільну групу, ціаногрупу С1-С4-алкоксильну групу, - R2 означає атом водню, С1-С4-алкільну групу або атом галогену, і - замісники R' і R" незалежно являють собою атом водню або С1-С4-алкільну групу, необов'язково заміщену ароматичним кільцем, або утворюють разом з атомом азоту, до якого вони приєднані, кільце, що містить 5 або 6 атомів вуглецю, в апротонному розчиннику, такому як дихлорметан, за наявності каталізатора, такого як триметилсилілтрифторметансульфонат, при температурі від 25°С до кімнатної температури протягом від 1 до 5 годин з одержанням тіоксилопіранозиду формули лук. де R1 і R2 такі, як визначені для вихідних спо Отримана в результаті сполука формули Іb може потім реагувати як зазначено вище, з утворенням незаміщених піранозильних сполук і/або кислотних солей. Сполуки формули І відповідно до винаходу, у яких R1 являє собою групу де X означає одинарний зв'язок, також можуть бути отримані з галогенованих глікозильованих продуктів за реакцією сполучення Сузукі між двома ароматичними кільцями. Один з основних способів включає проведення стадій, що полягають у: а) взаємодії сполуки формули де Hal являє собою атом галогену, переважно, брому або йоду, R2 означає атом водню, атом галогену (відмінного від брому або йоду) або С1-С4алкільну групу, a R означає атом водню або С2-С6ацильну групу, з похідною фенілборонової кислоти або алкілфенілборонатом формули 92908 12 де: - Ra означає атом водню, галоген, гідроксильну групу, С1-С4-алкільну групу, трифторметильну групу, трифторметоксильну групу, ціаногрупу, С1С4-гідроксіалкільну групу, С2-С4-ацильну групу, С1С4-алкоксильну групу або групу NR'R", - замісники Rb і Rc незалежно один від одного являють собою атом водню, атом галогену, С1-С4алкільну групу, ціаногрупу або С1-С4-алкоксильну групу, - замісники R' і R" незалежно являють собою атом водню або С1-С4-алкільну групу, необов'язково заміщену ароматичним кільцем, або утворюють разом з атомом азоту, до якого вони приєднані, кільце, що містить 5 або 6 атомів вуглецю, і - R''' означає атом водню або С1-С4-алкільну групу, за наявності паладієвого каталізатора, такого як [1,1-бісдифенілфосфінофероцен]дихлорпаладій дихлорметан, паладієвий каталізатор, іммобілізований на смолі, або каталізатор Геррманна, за наявності полярного протонного розчинника, такого як метанол, і за наявності фториду цезію або карбонату натрію або інших мінеральних основ, до яких необов'язково додають хлорид літію, при температурі від 70°С до 150°С протягом від 5 хвилин до 72 годин при нагріванні за допомогою мікрохвиль або іншими загальноприйнятими методами нагрівання з одержанням сполуки формули де: - Ra, Rb, Rc, R і R2 такі як визначені для вихідних матеріалів. Для сполук цього типу інший аналогічний спосіб полягає у взаємодії глікозильованого піридинілборонату формули з арилгалогенідом формули 13 за таких самих умов, як описані вище, з одержанням сполуки формули де: - Ra, Rb, Rc, R і R2 такі як описані для вихідних матеріалів. У загальному значенні, для одержання похідної -D-5-тіоксилопіранози краще використовувати 2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозилбромід або тетра-О-ацетил-5-тіо- D-ксилопіранозу. Реакції глікозилювання, описані вище, найчастіше приводять до суміші ізомерів - і конфігурації, і, як правило, для одержання співвідношень на користь ізомеру -конфігурації потрібно оптимізувати умови реакцій. З цієї самої причини також може виникнути необхідність проведення очищення, перекристалізацією або хроматографічно, для одержання чистого -ізомеру. Наступні приклади призначені для ілюстрації винаходу й у жодному разі не можуть обмежувати його обсяг. Точки плавлення обмірювані на стенді Кофлера або в капілярі, спектральні дані ядерного магнітного резонансу характеризуються хімічним зрушенням, розрахованим відносно ТМС (тетраметилсилану), кількістю протонів, віднесених до сигналу, і формою сигналу (с - синглет, д - дублет, т -триплет, кв - квартет, м - мультиплет). Використані робоча частота й розчинник зазначені для кожної сполуки. Використовуються наступні скорочення: мМ означає мілімоль (10-3 моль) ДМСО означає диметилсульфоксид ТГФ означає тетрагідрофуран СНСІ3 означає хлороформ ДМЕ означає диметоксіетан Синтез 1: (4-бромфеніл)(3-гідрокси-2-піридиніл)метанон 48,5 г (205,5 мМ) 1,4-дибромбензолу додають по краплях до суміші, що містить кристал йоду й 5 г (205,5 мМ) металевого магнію, покриті 150 мл ТГФ. Суміш перемішують зі зворотним холодильником при температурі кипіння розчинника протягом 2 годин, після чого охолоджують до 10°С. Потім по краплях додають 12,34 г (102,7 мМ) 2-ціано3-піридинолу. Реакційну масу нагрівають зі зворотним холодильником при температурі кипіння розчинника протягом 3 годин, потім перемішують протягом 18 годин при кімнатній температурі, після чого обробляють 300 мл 0,5 Η сірчаної кислоти. 92908 14 Розчинники відганяють при зниженому тиску, і величину рН водної фракції, що залишилася, доводять до 4 додаванням необхідної й достатньої кількості 2Н розчину гідроксиду натрію. Нейтралізовану суміш екстрагують дихлорметаном, органічну фазу сушать над сульфатом магнію. Після відгону розчинника одержують необхідний продукт у формі кристалів жовтого кольору з виходом 35%. Тпл.=94-95°С. Синтез 2: 4-[(3-гідрокси-2-піридиніл)карбоніл]бензонітрил 10 г (35,96 мМ) (4-бромфеніл)(3-гідрокси-2піридиніл)метанону змішують з 6,44г (71,92 мМ) ціаністої міді в 90 мл диметилформаміду. Суміш кип'ятять зі зворотним холодильником протягом 21 год. Готовлять розчин 19,25 г хлориду заліза в 42,5 мл води й 6,7 мл концентрованої соляної кислоти й додають до охолодженої реакційної маси, отриману суміш потім нагрівають при температурі 90°С протягом 30 хвилин. Після охолодження додають етилацетат і воду, і суміш фільтрують на целіті. Потім продукт екстрагують етилацетатом, органічну фазу промивають насиченим розчином хлориду натрію. Розчинник упарюють при зниженому тиску й одержують необхідний продукт у формі кристалів жовтого кольору з виходом 45%. Тпл.=145-146°С. Синтез 3: (5-гідрокси-2-піридиніл)[4(трифторметил)феніл]метанон Розчин 23,4 г (104 мМ) 1-бром-4трифторметилбензолу в 100 мл ТГФ по краплях додають до 2,53 г (104 мМ) металевого магнію й одного кристалу йоду, покритим 100 мл ТГФ. Суміш перемішують при температурі кипіння розчинника протягом 2 годин і потім охолоджують до 10°С. Після цього по краплях додають розчин 5 г (42 мм) 2-ціано-5-піридинолу в 80 мл ТГФ. Суміш кип'ятять зі зворотним холодильником протягом 2 годин, після чого перемішують протягом 18 годин при кімнатній температурі. Реакційну масу обробляють 120 мл 0,5 Η сірчаної кислоти, розчинники упарюють при зниженому тиску. Величину рН суміші доводять до нейтрального значення, промиваючи насиченим розчином бікарбонату натрію, екстрагують етилацетатом і екстракт сушать над сульфатом магнію. Після хроматографічного очищення на силікагелі (елюент: толуол/етилацетат 8/2, потім чистий етилацетат і, нарешті, етилацетат/водний аміак 95/5; об./об.) одержують очікуваний продукт у формі кристалів ясно-рожевого кольору з виходом 66%. Тпл.>260°С. Синтез 4: 4-(5-метокси-2-піридиніл)бензонітрил Готовлять суміш 3,1 г (13,2 мМ) 2-йод-5метоксипіридину, 2,9 г (19,8 мМ) 4ціанофенілборонової кислоти, 1,7 г (40 мМ) хлориду літію, 0,6г (0,52 мМ) тетракис(трифенілфосфін)паладію, 30 мл метанолу й 30 мл толуолу й додають 20 мл (40 мМ) 2 Μ розчину карбонату натрію. Реакційну масу нагрівають зі зворотним холодильником при температурі кипіння розчинника протягом 72 годин. Фази розділяють і водну фракцію екстрагують етилацетатом. Об'єд 15 нані органічні фракції промивають 1H розчином гідроксиду натрію, водою й насиченим розчином хлориду натрію й потім сушать над сульфатом магнію. Після відгону розчинників технічний продукт очищають хроматографічно на силікагелі, використовуючи як елюент дихлорметан, і одержують очікуваний продукт у формі кристалів ясножовтого кольору з виходом 66%. Тпл.=93-95°С. Синтез 5: 4-(5-гідрокси-2-піридиніл)бензонітрил Суміш 1,82 г (8,65 мМ) сполуки, отриманої відповідно до Синтезу 4, і 6 г (52мМ) гідрохлориду піридину нагрівають при температурі 160°С протягом 3 год. 30 хв. Потім суміш охолоджують до кімнатної температури, розбавляють 100 мл води, величину рН доводять до 7 і екстрагують етилацетатом. Органічну фракцію промивають спочатку водою, потім насиченим розчином хлориду натрію й сушать над сульфатом магнію. Після відгону розчинників продукт очищають хроматографічно на колонці з двоокисом кремнію (елюент: дихлорметан/етанол 99/1; об./об.) і одержують очікуваний продукт у формі порошку білого кольору з виходом 53%. Тпл.=210°С. Синтез 6: 4-(3-метокси-2-піридиніл)бензонітрил 4-(3-метокси-2-піридиніл)бензонітрил одержують з 2-бром-3-метоксипіридину за методикою, аналогічною Одержанню 4, у формі кристалів білого кольору з виходом 85%. 1 Н ЯМР (300 МГц; ДМСО) = 8,34 (дд, 1Н); 8,07 (д, 2Н); 7,72 (д, 2Н); 7,30 (м, 2Н); 3,90 (з, 3H). Синтез 7: 4-(3-гідрокси-2-піридиніл)бензонітрил 4-(3-гідрокси-2-піридиніл)бензонітрил одержують за методикою, аналогічною Одержанню 5, з 4(3-метокси-2-піридиніл)бензонітрилу в формі кристалів світло-бежевого кольору з виходом 65%. Тпл.=245-246°С. Синтез 8: 4-(5-метокси-3-піридиніл)бензонітрил 1,93 г (10,3 мМ) 3-бром-5-метоксипіридину й 1,85 г (12,36 мМ) 4-ціанофеніл-боронової кислоти змішують з 40 мл толуолу й 40 мл метанолу. Додають 0,6 г (0,5мМ) тетракис(трифенілфосфін)паладію й 1,3 г (30,9 мМ) хлориду літію. Потім додають 1 Μ розчин карбонату натрію. Суміш кип'ятять зі зворотним холодильником протягом 5 годин і після охолодження в реакційну масу додають воду й етилацетат. Водну фазу відокремлюють і екстрагують етилацетатом. Об'єднані органічні фракції сушать над сульфатом магнію й потім концентрують при зниженому тиску. Залишок після розпарювання очищають хроматографічно на силікагелі, використовуючи як елюент суміш дихлорметан/етилацетат (94/6; об./об.), і одержують очікуваний продукт у формі кристалів бежевого кольору з виходом 89%. 1 Н ЯМР (300 МГц; ДМСО) = 8,56 (м, 1Н); 8,36 (м, 1Н); 7,98 (м, 4Н); 7,73 (м, 1Н); 3,92 (с, 3H). Синтез 9: 4-(5-гідрокси-3-піридиніл)бензонітрил 92908 16 Суміш 1,9 г (9,02 мМ) 4-(5-метокси-3піридиніл)бензонітрилу й 6,39 г (54,2 мМ) гідрохлориду піридину нагрівають при температурі 160°С протягом 5 годин. Після охолодження й додавання води доводять величину рН до 5 за допомогою концентрованого розчину гідроксиду натрію. Суміш екстрагують етилацетатом, екстракт сушать над сульфатом магнію й концентрують при зниженому тиску. Залишок після розпарювання очищають хроматографічно на колонці з двоокисом кремнію (елюент: дихлорметан/етилацетат 92/8, об./об.; потім дихлорметан/метанол 9/1, об./об.) і одержують очікуваний продукт у формі кристалів бежевого кольору з виходом 76%. Тпл.=241-243°С. Синтез 10: 4-[(5-гідрокси-2-піридиніл)тіо]бензонітрил 0,25 г (1,31 мМ) йодиду міді (І), 7,26 г (52,5 мМ) карбонату калію й 5,8 г (26,25мМ) 6-йод-3піридинолу поміщають у трубку в атмосфері аргону. Потім додають 30 мл ізопропанолу, 5 г 1,2диметоксіетану й 3,55 г (26,25 мМ) 4меркаптобензонітрилу. Трубку герметизують і нагрівають при температурі 80°С протягом 24 годин. Після остигання суміші до кімнатної температури її розбавляють 120 мл етилацетату й фільтрують, осад на фільтрі промивають етилацетатом, і органічні фракції концентрують при зниженому тиску. Залишок після розпарювання очищають хроматографічно на колонці з двоокисом кремнію (елюент: циклогексанол/етилацетат 55/45; об./об.) і одержують очікуваний продукт у формі порошку бежевого кольору з виходом 53%. Тпл.=180-181°С. Синтез 11: 4-[(5-гідрокси-2піридиніл)сульфоніл]бензонітрил 3,15 г (13,80 мм) продукту, отриманого відповідно до Синтезу 10, розчиняють в 45 мл оцтової кислоти. Додають 7 мл перекису водню. Реакційну масу перемішують протягом 6 днів при кімнатній температурі. Утворений осад відфільтровують, промивають водою й петролейним ефіром, сушать і одержують першу порцію необхідного продукту. рН фільтрату доводять до 5 розведеним розчином гідроксиду натрію й потім екстрагують етилацетатом. Органічну фракцію сушать над сульфатом магнію й концентрують при зниженому тиску. Залишок після розпарювання очищають хроматографічно на колонці з двоокисом кремнію (елюент: толуол/етилацетат 6/4; об./об.) і одержують очікуваний продукт у формі порошку білого кольору із загальним виходом 91%. Тпл.=225-226°С. Синтез 12: 2-(метилсульфоніл)-3-піридинол Готовлять розчин 0,423 г (3 мм) 2-метилтіо-3піридинолу в 11 мл етанолу й по краплях додають розчин 1,855 г (4,8 мм) магнієвої солі монопероксифталевої кислоти в 30 мл води. Реакційну масу перемішують протягом 8 годин при кімнатній температурі й концентрують при зниженому тиску. Залишок очищають хроматографічно на силікагелі, використовуючи як елюент суміш циклогексан/ацетон (80/20; об./об.), і одержують необхідний 17 продукт у формі кристалів білого кольору з виходом 83%. Тпл.=115°С. Синтез 13: 6-(метилтіо)-3-піридинол Розчин 5,5 мл концентрованої сірчаної кислоти й 8 мл води додають до 1,9 г (13,55 мМ) 6(метилтіо)-3-піридинаміну. Реакційну масу охолоджують до температури -6°С і по краплях додають розчин 1,59 г (23,03 мМ) нітриту натрію в 3 мл води, не допускаючи підвищення температури вище 0°С. Суміш перемішують протягом 1 год. 30 хв при температурі від 0°С до -4°С, а потім кип'ятять зі зворотним холодильником протягом 1 години. Охолоджену реакційну масу виливають за наявності бікарбонату натрію, після чого суміш екстрагують етилацетатом. Органічну фракцію концентрують при зниженому тиску, потім залишок хроматографують на силікагелі (дихлорметан/етилацетат, 90/10; об./об.) і одержують очікуваний продукт у формі порошку білого кольору з виходом 60%. Тпл.=133°С. Синтез 14: 6-(метилсульфоніл)-3-піридинол 6-(Метилсульфоніл)-3-піридинол одержують з 6-(метилтіо)-3-піридинолу за методикою, аналогічною Одержанню 12, у формі порошку білого кольору з виходом 91%. Тпл.=187°С. Синтез 15: 3-метокси-5-феноксипіридин У трубці з мікрохвильовим нагріванням готовлять розчин 0,9 г (3,6 мМ) 3-бром-5феноксипіридину в 2 мл метанолу. Додають 8 мл (8 мМ) 1 Μ розчину метилату натрію в метанолі й 0,252 г (4 мМ) мідного порошку. Трубку закривають, і реакційну масу нагрівають за допомогою мікрохвиль при температурі 150°С протягом однієї години, потім фільтрують і концентрують при зниженому тиску. Концентрований залишок обробляють водою й екстрагують дихлорметаном. Органічну фазу промивають водою, сушать над сульфатом натрію й концентрують при зниженому тиску. Технічний продукт хроматографують на силікагелі, використовуючи як елюент суміш толуол/етилацетат (95/5; об./об.), і одержують очікуваний продукт у формі безбарвного масла з кількісним виходом. 1 Н ЯМР (ДМСО, 250 МГц) : 8,12 (д, 1Н); 7,92 (д, 1Н); 7,43 (м, 2Н); 7,19 (м, 1Н); 7,09 (м, 3H); 3,81 (з, 3H). Синтез 16: 5-фенокси-3-піридинол Готовлять суміш 0,6 г (3,37 мм) 3-метокси-5феноксипіридину й 1,15 г (10 мМ) гідрохлориду піридину. Суміш нагрівають під дією мікрохвиль протягом 40 хвилин при температурі 150°С і потім охолоджують, обробляють метанолом і доводять величину рН до 7 за допомогою 1H розчину гідроксиду натрію. Після концентрування при зниженому тиску утворений залишок очищають хроматографічно на силікагелі, використовуючи як елюент суміш толуол/ ізопропанол (95/5; об./об.), і одер 92908 18 жують необхідний продукт у формі кристалів брудно-білого кольору з виходом 54%. Тпл.=107°С. Синтез 17: 2-хлор-3-фтор-5-(фенілметокси)піридин Змішують 0,5 г (3,38 мм) 6-хлор-5-фтор-3піридинолу, 10 мл диметилформаміду й 0,843 г (6,08 мМ) карбонату калію. Додають 0,8 мл (6,76 мМ) бромистого бензилу, і суміш нагрівають при температурі 80°С протягом однієї години. Після гідролізу в 100 мл води суміш екстрагують етилацетатом, органічні фази промивають водою, сушать над сульфатом магнію й концентрують при зниженому тиску. Технічний продукт очищають хроматографічно на силікагелі (елюент: чистий толуол) і одержують очікуваний продукт у формі кристалів білого кольору з кількісним виходом. Тпл.=48-52°С. Синтез 18: 2-феніл-3-фтор-5-(фенілметокси)піридин Змішують 6,8 г (28,6 мМ) 2-хлор-3-фтор-5(фенілметокси)піридину, 110 мл ДМЕ й 4,18 г (34 мМ) фенілборонової кислоти. Додають 6,64 г (156 мМ) хлориду літію й 1,65 г (1,4 мМ) тетракис(трифенілфосфін)паладію. І нарешті, додають 38 мл (76 мМ) 2 Μ розчину карбонату калію, і суміш кип'ятять зі зворотним холодильником протягом 18 годин. Після гідролізу в 250 мл води суміш екстрагують етилацетатом, органічні фази промивають водою й потім сольовим розчином, сушать над сульфатом магнію, фільтрують і концентрують при зниженому тиску. Отриманий залишок очищають хроматографічно на силікагелі, використовуючи як елюент суміш циклогексан/етилацетат (95/5, потім 90/10; об./об.), і одержують необхідний продукт у формі кристалів білого кольору з виходом 84%. Тпл.=105-106°С. Синтез 19: 5-фтор-6-феніл-3-піридинол 6,55 г (29,7 мм) 2-феніл-3-фтор-5(фенілметокси)піридину додають до 160 мл метанолу, 30 мл етилацетату й 30 мл оцтової кислоти. Додають 0,33 г 10% паладію на вугіллі. Суміш перемішують в атмосфері водню протягом 3 годин. Каталізатор відфільтровують, розчинники концентрують і одержують осад білого кольору, що його обробляють 1H розчином гідроксиду натрію. Отриману водну фазу промивають дихлорметаном і потім підкисляють до рН 5 1H розчином соляної кислоти. Осад білого кольору, що випав, відфільтровують, промивають водою. Після сушіння одержують необхідний продукт у формі кристалів білого кольору з виходом 77%. Тпл.=150-151°С. Синтез 20: 5-бром-2-фтор-3-піридинол Готовлять розчин 1,36 г (6,18 мМ) 5-бром-2фтор-3-піридинборонової кислоти в суміші 9,5 мл етанолу, 2,3 мл оцтової кислоти й 1,3 мл етилацетату. До розчину додають 2,2 мл 30% перекису водню. Реакційну масу перемішують при температурі 35°С протягом 3 годин, потім охолоджують і екстрагують етиловим ефіром. Органічні фази промивають розчином залізоаміачних галунів, су 19 шать над сульфатом магнію, фільтрують і концентрують при зниженому тиску. Твердий залишок очищають хроматографічно на силікагелі, використовуючи як елюент суміш толуол/етилацетат (9/1; об./об.), і одержують необхідний продукт у формі кристалів білого кольору з виходом 62%. Тпл.=146°С. Синтез 21: 4-йод-3-піридиніл 2,3,4-три-О-ацетил-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 30, 4йод-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид одержують із 4-йод-3-піридинолу у формі кристалів білого кольору (вихід=31%). 24 D 63 (с=0,20; ДМСО). Тпл.=176°С. Синтез 22: 5-бром-2-фтор-3-піридиніл 2,3,4-три-О-ацетил5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 30, 5бром-2-фтор-3-піридиніл-2,3,4-три-О-ацетил-5-тіо-D-ксилопіранозид одержують з 5-бром-2-фтор-3піридинолу у формі кристалів білого кольору (вихід=39%). Тпл.=120-122°С. Синтез 23: 5-бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 30, 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид одержують із 5-бром-3-піридинолу у формі порошку ясно-коричневого кольору (вихід=61%). Тпл.=174°С. 20 D 20 (с=0,20; ДМСО). Синтез 24: 2-хлор-4-метил-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 30, 2хлор-4-метил-3-піридиніл-2,3,4-три-O-ацетил-5-тіо-D-ксилопіранозид одержують з 2-хлор-4-метил3-піридинолу у формі порошку білого кольору (вихід=30%). Тпл.=144°С. 30 D 45 (с=0,37; ДМСО). Синтез 25: 2-бром-4-піридиніл-2,3,4-три-О-ацетил-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 30, 2бром-4-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид одержують із 2-бром-4-піридинолу у формі кристалів білого кольору (вихід=37%). Тпл.=162°С. 29 D 11 (с=0,48; ДМСО). Синтез 26: 6-бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 30, 6бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид одержують із 6-бром-3-піридинолу у формі порошку бежевого кольору (вихід=43%). Тпл.=145°С. 92908 20 29 D 20 (с=0,52; ДМСО). Синтез 27: 4-бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 30, 4бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид одержують із 4-бром-3-піридинолу у формі порошку жовтого кольору (вихід=38%). Тпл.=153°С. 30 D 69 (с=0,31; ДМСО). Синтез 28: 2-бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 30, 2бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид одержують із 2-бром-3-піридинолу у формі порошку білого кольору (вихід=41%). Тпл.=156°С. 24 D 78 (с=0,40;СН3ОН). Синтез 29: 2-йод-6-метил-3-піридиніл-2,3,4-три-О-ацетил5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 30, 2йод-6-метил-3-піридиніл-2,3,4-три-O-ацетил-5-тіо-D-ксилопіранозид одержують із 2-йод-6-метил-3піридинолу у формі порошку білого кольору (вихід=81%). Тпл.=187°С. 30 D 88 (с=0,28;ДМСО). Синтез 30: 5-метилтіо-3-піридинол 1,284 г (8,2 мМ) 3-метокси-5-метилтіопіридину й 2,87 г (24,8 мМ) гідрохлориду піридину нагрівають при температурі 150°С протягом 2 годин у реакторі, адаптованому для мікрохвиль. До охолодженої реакційної маси додають насичений водний розчин хлориду амонію і величину рН доводять до нейтральної за допомогою 1Н розчину соляної кислоти. Утворений осад відфільтровують, фільтрат далі екстрагують ефіром, органічну фракцію сушать над сульфатом натрію й потім концентрують при зниженому тиску. Отриманий залишок очищають хроматографічно на силікагелі, використовуючи як елюент суміш дихлорметан/метанол (99/1, потім 80/20; об./об.), і одержують бажаний продукт із виходом 47%. Тпл.=179°С. Синтез 31: 5-метилсульфоніл-3-піридинол Розчин 4,018 г (10,39 мМ) магнієвої солі пероксифталевої кислоти в 120 мл води додають по краплях до розчину 0,916 г (6,49 мМ) продукту, отриманого відповідно до Синтезу 30, в 50 мл етанолу. Реакційну масу перемішують при температурі 40°С протягом 1 години й потім концентрують при зниженому тиску. Залишок обробляють у суміші дихлорметан/метанол (10/1; об./об.) і фільтрують. Фільтрат концентрують і потім очищають хроматографічно на силікагелі, використовуючи як елюент суміш толуол/ацетон (90/10; об./об.), і одержують очікуваний продукт у формі кристалів білого кольору в суміші із фталевою кислотою, продукт 21 використовують без додаткового очищення в синтезі Приклада 114. Синтез 32: 5-йод-3-піридиніл-2,3,4-три-O-ацетил-5-тіо- D-ксилопіранозид 1,34 г (3 мМ) 5-бром-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозиду, 10 мл діоксану, 0,057 г (0,3 мМ) йодиду міді (І), 0,899 г (6 мМ) йодиду натрію й 0,085 г (0,6 мМ) (1R,2R)-N,N'диметил-1,2-циклогександіаміну змішують в атмосфері аргону в реакторі, пристосованому для мікрохвиль, і суміш нагрівають протягом 3 годин 30 хвилин при температурі 130сС. До охолодженої реакційної маси додають 100 мл води й потім екстрагують етилацетатом. Органічну фазу промивають 1Н розчином тіосульфату натрію й водою, сушать над сульфатом натрію й потім концентрують при зниженому тиску. Залишок після розпарювання очищають хроматографічно на силікагелі, використовуючи як елюент суміш толуол/ацетон (1/1; об./об.), і одержують очікуваний продукт у формі кристалів білого кольору з виходом 85%. Тпл.=148-150°С. 29 D 7 (с=0,33;ДМСО). Синтез 33: 2-йод-5-триізопропілсилілоксипіридин 5 г (22,6 мм) 5-гідрокси-2-йодпіридину й 6,42 мл (30,09 мм) триізопропілсиліл-хлориду в 35 мл ацетонітрилу перемішують при кімнатній температурі протягом 10 хвилин. Після додавання 4,62 г (67,87 мм) імідазолу продовжують перемішування протягом 4 год. 20 хв. при кімнатній температурі. Відганяють ацетонітрил, і реакційну масу обробляють трьома порціями пентану по 150 мл. Об'єднані органічні фракції промивають насиченим розчином хлориду натрію, сушать над сульфатом магнію й концентрують при зниженому тиску. Залишок після розпарювання пропускають через шар двоокису кремнію, використовуючи як елюент петролейний ефір, і одержують необхідний продукт у формі масла ясно-жовтого кольору з виходом 98%. 1 Н ЯМР (250 МГц; ДМСО) = 8,04 (дд, 1Н); 7,69 (дд, 1Н); 7,08 (дд, 1Н); 1,25 (м, 3H); 1,00 (м, 18Н). Синтез 34: 5-гідрокси-N-(фенілметил)-2піридинкарбоксамід 3 г (7,95 мМ) продукту, отриманого відповідно до Синтезу 33, 3 мл (27,44 мМ) бензиламіну, 2,1 г (7,95 мМ) гексакарбонілу молібдену, 2,25 мл (14,93мМ) 1,8-діазабіцикло[5,4,0]андек-7-ену (DBU) і 0,373 г (0,4 мМ) транс-ди- -ацетатобіс[2-(ди-Отолілфосфіно)бензил]дипаладію(ІІ) (каталізатор Геррманна) змішують в атмосфері аргону в реакторі, адаптованому для мікрохвиль. Суміш нагрівають при температурі 150°С протягом 15 хвилин за допомогою мікрохвиль. Після охолодження реакційну масу фільтрують і концентрують при зниженому тиску. Залишок після розпарювання обробляють у метиленхлориді й 5 N розчині гідроксиду натрію. Об'єднані водні фракції нейтралізують при охолодженні концентрованим розчином соляної кислоти (10 N) і потім екстрагують етилацетатом. 92908 22 Органічну фазу сушать над сульфатом магнію, фільтрують і концентрують при зниженому тиску. Залишок після розпарювання очищають хроматографічно на силікагелі, використовуючи як елюент чистий дихлорметан і потім суміш дихлорметан/метанол (9/1; об./об.), і одержують очікуваний продукт у формі кристалів жовтогарячого кольору з виходом 35%. 1 Н ЯМР (250 МГц; ДМСО) (=10,3 (розширений., 1Н); 9,00 (т, 1Н); 8,14 (дд, 1Н); 7,90 (дд, 1Н); 7,25 (м, 6Н); 4,46 (д, 2Н). Синтез 35: 5-ацетил-3-піридинол Розчин 1,8 г (14,98 мМ) 5-гідрокси-3піридинкарбонітрилу в 120 мл ТГФ додають по краплях до 1,6 Μ розчину метиллітію в ефірі (18,7 мл, 29,92 мМ), охолодженому до температури 0°С. Після перемішування протягом 15 хвилин температуру реакційної маси відпускають до кімнатної й продовжують перемішування протягом 2 годин. У реакційну масу додають 50 мл 0,5 N розчину сірчаної кислоти й величину рН середовища доводять потім до 6 додаванням концентрованого розчину соляної кислоти (10 Ν). Водну фазу насичують хлоридом натрію й потім екстрагують етилацетатом. Органічну фазу сушать над сульфатом магнію, фільтрують і концентрують при зниженому тиску. Отриманий продукт потім промивають ефіром, відфільтровують і одержують необхідний продукт у формі порошку жовтого кольору з виходом 75%. Тпл.=186°С. Приклад 1: 6-ацетил-3-піридиніл-2,3,4-три-О-ацетил-5-тіо-D-ксилопіранозид 1,29 г (9,47 мМ) хлориду цинку розплавляють і залишають охолоджуватися до кімнатної температури. Додають 4 г молекулярних сит 13Х, 50 мл ацетонітрилу, 3,1 г (8,7 мМ) 2,3,4-три-О-ацетил-5тіо- -D-ксилопіранозилброміду, 1,4 г (8 мМ) імідазоляту срібла й 1 г (7,3 мМ) 6-ацетил-3піридинолу. Суміш перемішують протягом 3 годин при температурі 65°С. Після фільтрації продукт на фільтрі промивають етилацетатом і відганяють летучі розчинники при зниженому тиску. Продукт очищають хроматографічно на силікагелі, використовуючи як елюент суміш толуол/ізопропанол (98/2; об./об.). Очищений продукт кристалізують з ізопропілового спирту й одержують очікуваний продукт у формі кристалів білого кольору з виходом 15%. Тпл.=149°С. 22 D 24 (с=0,1; ДМСО). Приклад 2: 6-ацетил-3-піридиніл-5-тіо- -D-ксилопіранозид Змішують 0,1 г (0,24 мм) продукту, отриманого відповідно до Приклада 1, 5 мл метанолу й кілька крапель 8% розчину метилату натрію в метанолі. Суміш перемішують протягом 30 хвилин при кімнатній температурі. Осад, що випав, відфільтровують, сушать при зниженому тиску й одержують очікуваний продукт у формі пластівців білого кольору з виходом 48%. Тпл.=178-179°С. 23 24 D 76 (с=0,09; ДМСО). Приклад 3: 2-ацетил-3-піридиніл-2,3,4-три-О-ацетил-5-тіо-D-ксилопіранозид Суміш 2,34 г (17,5 мМ) 2-ацетил-3-піридинолу, 8,4 г (19,2 мМ) 5-тio- -Dксилопіранозилтрихлорацетимідату й 80 мл дихлорметану охолоджують до температури -20°С і додають 316 мкл (1,75мМ) триметилсилілтрифторметан-сульфонату. Суміш перемішують протягом 30 хвилин при температурі 0°С і протягом 4 годин при кімнатній температурі. Органічну фазу промивають 1Н розчином гідроксиду натрію й потім водою до нейтрального значення рН. Сушать над сульфатом магнію, розчинник видаляють при зниженому тиску. Продукт очищають хроматографічно на колонці з двоокисом кремнію, використовуючи як елюент суміш циклогексан/етилацетат (6/4; об./об.), і одержують очікуваний продукт у формі кристалів жовтого кольору з виходом 40%. Тпл.=168°С. 23 D 90 (с=0,25; СН2СІ2). Приклад 4: 2-ацетил-3-піридиніл-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 2, із продукту, отриманого в Прикладі 3, одержують 2ацетил-3-піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=82%). Тпл.=123°С. 23 D 101 (с=0,44; СН3ОН). Приклад 5: [(4-ціанобензоїл)-3-піридиніл]-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 1, з піридинолу, отриманого відповідно до Синтезу 2, одержують необхідну сполуку у формі порошку білого кольору (вихід=5%). 26 D 35,7 (с=0,11; ДМСО). Приклад 6: [2-(4-ціанобензоїл)-3-піридиніл]-5-тіо- -Dксилопіранозид 0,23 г (0,46 мМ) продукту, отриманого відповідно до Приклада 5, перемішують при кімнатній температурі протягом 2 годин 30 хвилин з 15 мл 7 Μ розчину аміаку в метанолі. Реакційну масу концентрують при зниженому тиску, і отриманий технічний продукт очищають хроматографічно на силікагелі, використовуючи як елюент суміш дихлорметан/метанол (99/1; об./об.). Отримане масло обробляють 8 мл гарячої води й потім ліофілізують, одержуючи необхідний продукт у формі порошку жовтого кольору з виходом 64%. Тпл.=112°С. 32 D 89,5 (с=0,12; ДМСО). Приклад 7: [6-[4-(трифторметил)бензоїл]-3-піридиніл]2,3,4-три-O-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 1, зі сполуки, отриманої відповідно до Синтезу 3, одержують необхідну сполуку у формі кристалів білого кольору (вихід=22%). 92908 24 26 D 10,1 (с=0,25; ДМСО). Тпл.=158-160°С. Приклад 8: [6-[4-(трифторметил)бензоїл]-3-піридиніл]-5тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 2, з продукту, отриманого в Прикладі 7, одержують необхідну сполуку у формі кристалів білого кольору (вихід=29%). Тпл.=129-132°С. 26 D 293,2 (с=0,12; ДМСО). Приклад 9: [6-(4-ціанофеніл)-3-піридиніл]-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 1, зі сполуки, отриманої відповідно до Синтезу 5, одержують очікуваний продукт у формі порошку білого кольору (вихід=26%). 23 D 26 (с=0,42; ДМСО). Тпл.=197-198°С. Приклад 10: [6-(4-ціанофеніл)-3-піридиніл]-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої відповідно до Приклада 9, одержують очікуваний продукт у формі порошку білого кольору (вихід=81%). 23 D 32 (с=0,42; ДМСО). Тпл.=213-214°С. Приклад 11: [2-(4-ціанофеніл)-3-піридиніл]-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 1, зі сполуки, отриманої відповідно до Синтезу 7, одержують очікуваний продукт у формі аморфних кристалів (вихід=10%). 26 D 912 (с=0,28; ДМСО). , Тпл.=120°С. Приклад 12: [2-(4-ціанофеніл)-3-піридиніл]-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої відповідно до Приклада 11, одержують очікуваний продукт у формі порошку білого кольору (вихід=100%). 32 D 26 (с=0,50; ДМСО). Тпл.=180°С. Приклад 13: 5-феніл-3-піридиніл-2,3,4-три-О-ацетил-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 1, з 5феніл-3-піридинолу одержують очікуваний продукт у формі кристалів білого кольору (вихід=25%). 25 D 9 (с=0,20; ДМСО). Тпл.=181°C. Приклад 14: 5-феніл-3-піридиніл-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 13, одержують очі 25 куваний продукт у формі кристалів білого кольору (вихід=54%). Тпл.=169°С. 26 D 66 (с=0,22; ДМСО). Приклад 15: [5-(4-ціанофеніл)-3-піридиніл]-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 1, з 5-(4ціанофеніл)-3-піридинолу одержують очікуваний продукт у формі порошку білого кольору (вихід=27%). 23 D 10 (с=0,39; ДМСО). Тпл.=116-117°С. Приклад 16: [2-(4-ціанофеніл)-3-піридиніл]-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої відповідно до Приклада 15, одержують очікуваний продукт у формі порошку білого кольору (вихід=72%). 23 D 40 (с=0,36; ДМСО). Тпл.=202-203°С. Приклад 17: 6-[(4-ціанофеніл)сульфоніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 1, з 6[(4-ціанофеніл)сульфоніл]-3-піридинолу одержують очікуваний продукт у формі порошку білого кольору (вихід=20%). 29 D 19,8 (с=0,24; ДМСО). Тпл.=179-180°С. Приклад 18: 6-[(4-ціанофеніл)сульфоніл]-3-піридиніл-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 17, одержують очікуваний продукт у формі пластівчастого порошку білого кольору (вихід=65%). 26 D 27 (с=0,16; ДМСО). Тпл.=179°С. Приклад 19: 2-(метилсульфоніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 1, зі сполуки, отриманої відповідно до Синтезу 12, одержують очікуваний продукт у формі порошку білого кольору (вихід=53%). Тпл.=172-173°С. Приклад 20: 2-(метилсульфоніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 19, одержують очікуваний продукт у формі пластівців білого кольору (вихід=84%). 28 D 70 (с=0,45; Н2О). Тпл. =81-105°С. Приклад 21: 6-(метилсульфоніл)-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид 92908 26 За методикою, аналогічною Прикладу 1, зі сполуки, отриманої відповідно до Синтезу 14, одержують очікуваний продукт у формі порошку білого кольору (вихід=51%). 23 D 116 (с=0,46; СНСІ3). Тпл.=178°С. Приклад 22: 6-(метилсульфоніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, з 6(метилсульфоніл)-3-піридиніл-2,3,4-три-O-ацетил5-тіо- -D-ксилопіранозиду, отриманого в Прикладі 21, одержують очікуваний продукт у формі порошку білого кольору (вихід=98%). 24 D 61 (с=0,43; ДМСО). Тпл.=95-114°С. Приклад 23: 2-феніл-3-піридиніл-2,3,4-три-О-ацетил-5-тіо-D-ксилопіранозид Змішують 0,1 г (0,24 мМ) 2-хлор-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозиду, 30 мл ДМЕ, 0,037 г (0,29 мМ) фенілборонової кислоти, 0,102 г (0,66мМ) фториду цезію й 0,021 г (0,024 мМ) [1,1'-біс(дифенілфосфіно)фероцен]дихлорпаладію(ІІ) дихлорметану. Масу нагрівають протягом 2 годин при температурі 120°С в інертній атмосфері в мікрохвильовій печі. Потім реакційну масу фільтрують на фільтрі Ватману, продукт на фільтрі промивають етилацетатом і фільтрат екстрагують. Величину рН доводять до нейтральної за допомогою розчину хлориду амонію. Органічну фазу сушать над сульфатом натрію, і продукт концентрують при зниженому тиску. Продукт очищають хроматографічно на колонці з двоокисом кремнію (елюент: дихлорметан/етилацетат 99/1; об./об.) і одержують очікуваний продукт у формі порошку білого кольору з виходом 90%. Тпл.=69-101°C. 23 D 44 (с=0,12; СНСІ3). Приклад 24: 2-феніл-3-піридиніл-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 2, з продукту, отриманого в Прикладі 23, 2-феніл-3піридиніл-5-тіо- -D-ксилопіранозид одержують у формі кристалів білого кольору (вихід=89%). Тпл.=89-108°С. 25 D 28 (с=0,2; СН3ОН). Приклад 25: 5-фенокси-3-піридиніл-2,3,4-три-О-ацетил 5тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 1, 5фенокси-3-піридиніл-2,3,4-три-O-ацетил 5-тіо- -Dксилопіранозид одержують із 5-фенокси-3піридинолу у формі кристалів білого кольору (вихід=25%). 25 D 18 (с=0,26; ДМСО). Тпл.=178°С. Приклад 26: 5-фенокси-3-піридиніл-5-тіо- -Dксилопіранозид 27 За методикою, аналогічною Прикладу 6, з продукту, отриманого в Прикладі 25, одержують 5фенокси-3-піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=78%). Тпл.=226°С. 26 D 83 (с=0,27; ДМСО). Приклад 27: 4-(4-ціанофеніл)-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид Готовлять розчин 0,55 г (1,11 мМ) 4-йод-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду в 3 мл ДМЕ й додають розчин 0,176 г (1,66 мМ) карбонату натрію в 2,5 мл води, 0,091 г (0,11 мМ) [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладію(ІІ) дихлорметану й 0,326 г (2,2 мМ) 4ціанофенілборонової кислоти. Реакційну масу нагрівають за допомогою мікрохвиль при температурі 90°С протягом 8 хвилин і охолоджують, додають воду й суміш екстрагують етилацетатом. Органічну фазу промивають 1 Μ розчином карбонату натрію й потім водою до нейтрального значення рН, сушать над сульфатом магнію й концентрують при зниженому тиску. Продукт очищають хроматографічно на колонці з двоокисом кремнію (елюент: дихлорметан/ацетон 80/20; об./об.) і одержують очікуваний продукт у формі кристалів сіруватобежевого кольору з виходом 63%. Тпл.=212°С. 21 D 113 (с=0,30; ДМСО). Приклад 28: 4-(4-ціанофеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, з продукту, отриманого в Прикладі 27, одержують 4-(4ціанофеніл)-3-піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=90%). Тпл.=238°С. 20 D 97 (с=0,20; ДМСО). Приклад 29: 5-[[(фенілметил)аміно]карбоніл]-3-піридиніл-5тіо- -D-ксилопіранозид 0,5 г (1,115 мМ) 5-бром-3-піридиніл-2,3,4-триО-ацетил-5-тіо- -D-ксилопіранозиду, 0,37 мл (3,346 мМ) бензиламіну, 0,294 г (1,115 мМ) гексакарбонілу молібдену, 0,042 г (0,056 мМ) каталізатора Геррманна й 0,5 мл (3,346 мМ) DBU (1,8діазабіцикло[5,4,0]андек-7-ену) перемішують в 3 мл ТГФ. Суміш нагрівають при температурі 150°С протягом 15 хвилин за допомогою мікрохвиль. Реакційну масу фільтрують, фільтрат обробляють в 20 мл етилацетату, органічну фазу промивають 1Н розчином гідроксиду натрію, сушать над сульфатом магнію, концентрують при зниженому тиску, і одержують очікуваний продукт у формі кристалів блідо-жовтого кольору з виходом 0,7%. 1 Н ЯМР (300 МГц; ДМСО) = 9,21 (т, 1Н); 8,71 (д, 1Н); 8,52 (д, 1Н); 7,96 (т, 1Η); 7,34 (м, 5Н); 5,57 (д, 1Н); 5,32 (д, 1Н); 5,15 (д, 1Н); 5,05 (д, 1Н); 4,50 (д, 2Н); 3,61 (м, 1Н); 3,49 (м, 1Н); 3,14 (м, 1Н); 2,64 (м, 2Н). Приклад 30: 92908 28 5-фтор-6-феніл-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид 2,76 г (19,75 мМ) хлориду цинку розплавляють і охолоджують в інертній атмосфері, після чого додають 18 мл толуолу, 18 мл ацетонітрилу, 3,16 г молекулярних сит 4 Å і 1,5 г (7,9 мМ) 5-фтор-6феніл-3-піридинолу. Цю суміш нагрівають протягом 5 хвилин при температурі 90°С і потім охолоджують до кімнатної температури. Після цього додають 2,81 мл (19,75 мМ) триетиламіну й 3,16 г (8,69мМ) 2,3,4-три-O-ацетил-5-тіо- -Dксилопіранозилброміду. Масу перемішують при температурі 90°С протягом 20 хвилин, і реакцію зупиняють охолодженням і додаванням 90 мл 0,5 Η розчину гідроксиду натрію. Реакційну масу фільтрують від мінеральних солей, які промивають етилацетатом. Об'єднані органічні фракції промивають розчином хлориду амонію до величини рН 7-8, сушать над сульфатом магнію й концентрують при зниженому тиску. Продукт кристалізують з етилового ефіру й одержують необхідний продукт у формі кристалів бежевого кольору з виходом 47%. Тпл.=160-162°С. 23 D 58 (с=0,58; СНСІ3). Приклад 31: 5-фтор-6-феніл-3-піридиніл-5-тіо- -Dксилопіранозид 1,72 г (3,71 мМ) продукту, отриманого в Прикладі 30, змішують з 35 мл метанолу. Додають 0,05 мл 7 Μ розчину метилату натрію в метанолі. Суміш перемішують протягом 30 хвилин при температурі 30°С. Реакцію зупиняють додаванням приблизно 1 г смоли IR 120. Реакційну масу фільтрують, речовину на фільтрі промивають метанолом і органічні фази концентрують. Продукт перекристалізують з етанолу й одержують необхідний продукт у формі кристалів білого кольору з виходом 61%. Тпл.=174-176°С. 23 D 53 (с=0,57; СН3ОН). Приклад 32: 5-(4-ціанофеніл)-2-фтор-3-піридиніл-2,3,4-триО-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-2-фтор-3-піридиніл-2,3,4-три-О-ацетил-5-тіо-D-ксилопіранозиду одержують 5-(4-ціанофеніл)2-фтор-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=69%). Тпл.=132-133°С. 19 D 1,3 (с=0,60;СН3ОН). Приклад 33: 5-(4-ціанофеніл)-2-фтор-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, із продукту, отриманого в Прикладі 32, одержують 5(4-ціанофеніл)-2-фтор-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів бежевого кольору (вихід=73%). Тпл.=220°С. 19 D 62 (с=0,50; СН3ОН). 29 Приклад 34: 4-[4-(трифторметил)феніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 4бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 4(трифторметил)фенілборонової кислоти одержують 4-[4-(трифторметил)феніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид у формі порошку білого кольору (вихід=31%). Тпл.=168°С. 22 D 63 (с=0,36; ДМСО). Приклад 35: 4-(4-трифторметилфеніл)-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 2, із продукту, отриманого в Прикладі 34, одержують 4(4-трифторметилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=86%). Тпл.=204°С. 22 D 70 (с=0,32; ДМСО). Приклад 36: 5-(4-трифторметоксифеніл)-3-піридиніл-5-тіо-D-ксилопіранозид 0,5 г (1,11 мМ) 5-бром-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозиду, 0,275 г (1,33 мМ) 4-(трифторметокси)фенілборонової кислоти, 0,373 г (2,45 мМ) фториду цезію й 0,24 г тетракис(трифенілфосфін)паладієвого каталізатора, прищепленого на полістирольну смолу, змішують в 3,5 мл ДМЕ й 5 мл метанолу. Реакційну масу нагрівають при температурі 110°С протягом 20 хвилин за допомогою мікрохвиль. Суміш фільтрують і потім концентрують при зниженому тиску. Технічний продукт очищають хроматографічно на колонці з двоокисом кремнію (елюент: дихлорметан/метанол 90/10; об./об.) і одержують очікуваний продукт у формі кристалів білого кольору з виходом 68%. Тпл.=199-202°С. 25 D 67,6 (с=0,10; ДМСО). Приклад 37: 5-(3-ацетилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 36, з 3ацетилфенілборонової кислоти одержують 5-(3ацетилфеніл)-3-піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=63%). Тпл.=159-163°С. 25 96,7 (с=0,12; ДМСО). [ D Приклад 38: 5-(4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 36, з 4фторфенілборонової кислоти одержують 5-(4фторфеніл)-3-піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=41%). Тпл.=208-209°С. 25 D 83,6 (с=0,13; ДМСО). Приклад 39: 92908 30 2-(1-піперидинілкарбоніл)-3-піридиніл-2,3,4три-O-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 1, з 2-(1піперидинілкарбоніл)-3-піридинолу одержують необхідну сполуку у формі кристалів білого кольору (вихід=35%). Тпл.=89-92°С. 25 D 105,6 (с=0,10; ДМСО). Приклад 40: 2-(1-піперидинілкарбоніл)-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 2, із продукту, отриманого в Прикладі 39, одержують необхідну сполуку у формі кристалів білого кольору (вихід=38%). Тпл.=81-92°С. 19 D 1016 (с=0,10; ДМСО). , Приклад 41: 2-(диметиламінокарбоніл)-3-піридиніл-2,3,4три-O-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 1, з 2(диметиламінокарбоніл)-3-піридинолу одержують необхідну сполуку у формі кристалів білого кольору (вихід=5%). Тпл.=85-89°С. 19 D 69,3 (с=0,10; ДМСО). Приклад 42: 2-(диметиламінокарбоніл)-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 2, із продукту, отриманого в Прикладі 41, одержують 2(диметиламінокарбоніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=18%). Тпл.=80-85°С. 21 D 31 (с=0,17; ДМСО). Приклад 43: 5-(4-метоксифеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид 1 г (2,23 мМ) 5-бром-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозиду, 0,4 г (2,67 мМ) 4-метоксифенілборонової кислоти, 1,6 г (4,46 мМ) карбонатної смоли й 0,02 г (0,004 мМ) [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладію(ІІ) дихлорметану змішують в 7 мл ДМЕ й 5 мл метанолу. Реакційну масу нагрівають протягом 20 хвилин при температурі 110°С за допомогою мікрохвиль. Суміш фільтрують, матеріал на фільтрі промивають метанолом, органічні фази концентрують. Продукт очищають хроматографічно на колонці з двоокисом кремнію (елюент: дихлорметан/етилацетат 98/2, потім 70/30; об./об.) і одержують очікуваний продукт у формі порошку кремового кольору з виходом 80%. Тпл.=156°С. 25 D 111 (с=0,42; ДМСО). , Приклад 44: 5-(4-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, із продукту, отриманого в Прикладі 43, одержують 5 31 (4-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі порошку сірого кольору (вихід=85%). Тпл.=216°С. 20 D 90,9 (с=0,11; ДМСО). Приклад 45: 5-(4-гідроксиметилфеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 4(гідроксиметил)фенілборонової кислоти одержують 5-(4-гідроксиметилфеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид у формі кристалів коричневого кольору (вихід=59%). Тпл.=132-133°С. 25 D 5,3 (с=0,24; ДМСО). Приклад 46: 5-(4-гідроксиметилфеніл)-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 2, із продукту, отриманого в Прикладі 45, одержують 5(4-гідроксиметилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі порошку блідо-рожевого кольору (вихід=65%). Тпл.=153°С. 25 D 67,5 (с=0,20; ДМСО). Приклад 47: 5-[4-(1-піперидиніл)феніл]-3-піридиніл-2,3,4три-O-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 4(1-піперидиніл)фенілборонової кислоти одержують необхідну сполуку у формі кристалів білого кольору (вихід=15%). Тпл.=196°С. 20 D 0 (с=0,17; ДМСО). Приклад 48: 5-[4-(1-піперидиніл)феніл]-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 47, одержують 5-[4(1-піперидиніл)феніл]-3-піридиніл-5-тіо- -Dксилопіранозид у формі порошку сіруватого кольору (вихід=74%). Тпл.=196°С. 26 D 52,5 (с=0,11; ДМСО). Приклад 49: 5-[4-(диметиламіно)феніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 4(диметиламіно)фенілборонової кислоти одержують необхідну сполуку у формі порошку бежевого кольору (вихід=25%). 22 D 16 (с=0,33; ДМСО). Тпл.=198-199°С. Приклад 50: 5-[4-(диметиламіно)феніл]-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 2, із продукту, отриманого в Прикладі 49, одержують 5[4-(диметиламіно)феніл]-3-піридиніл-5-тіо- -D 92908 32 ксилопіранозид у формі порошку білого кольору з виходом 74%. Тпл.=240°С. 23 D 40 (с=0,40; ДМСО). Приклад 51: 5-(4-метилфеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 4метилфенілборонової кислоти одержують 5-(4метилфеніл)-3-піридиніл-2,3,4-три-О-ацетил-5-тіо-D-ксилопіранозид у формі кристалів бежевого кольору (вихід=80%). Тпл.=160-162°С. 22 D 5 (с=0,44; ДМСО). Приклад 52: 5-(4-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, із продукту, отриманого в Прикладі 51, одержують 5(4-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі порошку бежевого кольору з виходом 80%. Тпл.=228°С. 22 D 73 (с=0,41; ДМСО). Приклад 53: 5-[4-(трифторметил)феніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид і 5-[4(трифторметил)феніл]-3-піридиніл-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 36, з 4(трифторметил)фенілборонової кислоти одержують 5-[4-(трифторметил)феніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид у формі порошку білого кольору (вихід=19%, Тпл.=16322 D 164°С, 14 (с=+0,44; ДМСО)), і 5-[4 (трифторметил)феніл]-3-піридиніл-5-тіо- -Dксилопіранозид одержують у формі порошку білого 22 62 кольору (вихід=17%, Тпл.=218-219°С, D (с=0,43; ДМСО)). Приклад 54: 5-(3-ціанофеніл)-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 23, і 3-ціанофенілборонової кислоти одержують 5-(3-ціанофеніл)-3-піридиніл-2,3,4-три-О-ацетил-5тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=59%). Тпл.=130-131°C. 30 D 21 (с=0,10; ДМСО). Приклад 55: 5-(3-ціанофеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 54, одержують 5-(3ціанофеніл)-3-піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=67%). Тпл.=172°С. 28 D 87 (с=0,11; ДМСО). 33 Приклад 56: 4-(4-фторфеніл)-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 4йод-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 21, і 4-фторфенілборонової кислоти одержують 4-(4-фторфеніл)-3-піридиніл-2,3,4-три-О-ацетил-5тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=47%). Тпл.=111°С. 30 D 49 (с=0,30; ДМСО). Приклад 57: 4-(4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, із продукту, отриманого в Прикладі 56, одержують 4(4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору з виходом 62%. Тпл.=219°С. 30 D 70 (с=0,32; ДМСО). Приклад 58: 5-(4-фтор-3-метилфеніл)-3-піридиніл-2,3,4-триО-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 4-фтор-3-метилфенілборонової кислоти одержують 5-(4-фтор-3-метилфеніл)-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=48%). Тпл.=161°C. 33 D 16 (с=0,27; ДМСО). Приклад 59: 5-(4-фтор-3-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 58, одержують 5-(4фтор-3-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=76%). Тпл.=197°С. 34 D 75 (с=0,20; ДМСО). Приклад 60: 5-(4-фтор-2-метилфеніл)-3-піридиніл-2,3,4-триО-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 4-фтор-2-метилфенілборонової кислоти одержують 5-(4-фтор-2-метилфеніл)-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=72%). Тпл.=120°С. 34 D 20 (с=0,25; ДМСО). Приклад 61: 5-(4-фтор-2-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 60, одержують 5-(4 92908 34 фтор-2-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=71%). Тпл.=217°С. 34 D 75 (с=0,20; ДМСО). Приклад 62: 5-(3-ціано-4-фторфеніл)-3-піридиніл-2,3,4-триО-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 3-ціано-4-фторфенілборонової кислоти одержують 5-(3-ціано-4-фторфеніл)-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид у формі порошку білого кольору (вихід=66%). Тпл.=178°С. 32 D 13 (с=0,13; ДМСО). Приклад 63: 5-(3-ціано-4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 62, одержують 5-(3ціано-4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=59%). Тпл.=197°С. 29 D 118 (с=0,11; ДМСО). Приклад 64: 5-(3-хлор-4-метоксифеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 3-хлор-4метоксифенілборонової кислоти одержують 5-(3хлор-4-метоксифеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=66%). Тпл.=155°С. 32 D 7 (с=0,30; ДМСО). Приклад 65: 5-(3-хлор-4-метоксифеніл)-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 64, одержують 5-(3хлор-4-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів сіруватобежевого кольору (вихід=60%). Тпл.=165°С. 32 D 40 (с=0,34; ДМСО). Приклад 66: 5-(3-метоксифеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 3-метоксифенілборонової кислоти одержують 5-(3-метоксифеніл)-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозид у формі порошку білого кольору (вихід=77%). Тпл.=112-115°С. 32 D 1 (с=0,12; ДМСО). 35 Приклад 67: 5-(3-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 66, одержують 5-(3метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=95%). Тпл.=200°С (перекристалізований з метанолу). 28 D 72 (с=0,32; ДМСО). Приклад 68: 5-[4-(1-метилетокси)феніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 4-метилетоксифенілборонової кислоти одержують 5-[4-(1-метилетокси)феніл]-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=55%). Тпл.=135°С. 31 D 3 (с=0,35; ДМСО). Приклад 69: 5-[4-(1-метилетокси)феніл]-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 68, одержують 5-[4(1-метилетокси)феніл]-3-піридиніл-5-тіо- -Dксилопіранозид у формі пухнатих кристалів білого кольору (вихід=20%). Тпл.=158°С. 29 D 65 (с=0,42; ДМСО). Приклад 70: 5-(3,4-диметоксифеніл)-3-піридиніл-2,3,4-триO-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-O-ацетил-5-тіо- -Dксилопіранозиду й 3,4-диметоксифенілборонової кислоти одержують 5-(3,4-диметоксифеніл)-3піридиніл-2,3,4-три-O-ацетил-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=73%). Тпл.=145°С. 32 D 8 (с=0,27; ДМСО). Приклад 71: 5-(3,4-диметоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 70, одержують 5(3,4-диметоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=76%). Тпл. =211°C. 29 D 41 (с=0,35; ДМСО). Приклад 72: 2-(4-фторфеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 2бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 4-фторфенілборонової кислоти одержують 2-(4-фторфеніл)-3-піридиніл-2,3,4-три 92908 36 O-ацетил-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=64%). Тпл.=149°С. 27 D 91 (с=0,30; ДМСО). Приклад 73: 2-(4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 72, одержують 2-(4фторфеніл)-3-піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=88%). Тпл.=110°С. 28 D 56 (с=0,14; ДМСО). Приклад 74: 2-(4-метоксифеніл)-4-метил-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 2хлор-4-метил-3-піридиніл-2,3,4-три-О-ацетил-5-тіо-D-ксилопіранозиду, отриманого відповідно до Синтезу 24, і 4-метоксифенілборонової кислоти одержують 2-(4-метоксифеніл)-4-метил-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид і відразу використовують на стадії дезацетилювання. Приклад 75: 2-(4-метоксифеніл)-4-метил-3-піридиніл-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 74, одержують 2-(4метоксифеніл)-4-метил-3-піридиніл-5-тіо- -Dксилопіранозид у формі пухнатих кристалів білого кольору (вихід=62%). Тпл.=101°C. 31 D 14 (с=0,14; ДМСО). Приклад 76: 2-(4-метоксифеніл)-4-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 2бром-4-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 25, і 4-метоксифенілборонової кислоти одержують 2-(4-метоксифеніл)-4-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид у формі кристалів бежевого кольору (вихід=53%). Тпл.=113-114°С. 27 D 9 (с=0,12; ДМСО). Приклад 77: 2-(4-метоксифеніл)-4-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 76, одержують 2-(4метоксифеніл)-4-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=33%). Тпл.=150-154°С. 27 D 44 (с=0,11; ДМСО). Приклад 78: 5-[3-фтор-4-(1-метилетокси)феніл]-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид 37 За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 3-фтор-4-(1метилетокси)фенілборонової кислоти одержують 5-[3-фтор-4-(1-метилетокси)феніл]-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=82%). Тпл.=65°С. 29 D 3 (с=0,22; ДМСО). Приклад 79: 5-[3-фтор-4-(1-метилетокси)феніл]-3піридиніл-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 78, одержують 5-[3фтор-4-(1-метилетоксифеніл)]-3-піридиніл-5-тіо- D-ксилопіранозид у формі кристалів білого кольору (вихід=67%). Тпл.=181°C. 30 D 62 (с=0,38; ДМСО). Приклад 80: 5-(2,6-дифтор-4-метоксифеніл)-3-піридиніл2,3,4-три-O-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 2,6-дифтор-4метоксифенілборонової кислоти одержують 5-(2,6дифтор-4-метоксифеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=30%). Тпл.=62°С. 30 D 4 (с=0,18; ДМСО). Приклад 81: 5-(2,6-дифтор-4-метоксифеніл)-3-піридиніл-5тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 80, одержують 5(2,6-дифтор-4-метоксифеніл)-3-піридиніл-5-тіо- D-ксилопіранозид у формі кристалів білого кольору (вихід=59%). Тпл.=200°С. 30 D 59 (с=0,36; ДМСО). Приклад 82: 5-(3,5-диметил-4-метоксифеніл)-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 3,5-диметил-4метоксифенілборонової кислоти одержують 5-(3,5диметил-4-метоксифеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=52%). Тпл.=146°С. 29 D 0 (с=0,22; ДМСО). Приклад 83: 5-(3,5-диметил-4-метоксифеніл)-3-піридиніл-5тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 82, одержують 5(3,5-диметил-4-метоксифеніл)-3-піридиніл-5-тіо- D-ксилопіранозид у формі кристалів білого кольору (вихід=72%). 92908 38 Тпл.=173°С. 26 D 63 (с=0,23; ДМСО). Приклад 84: 5-(2,4-дифторфеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 2,4-дифторфенілборонової кислоти одержують 5-(2,4-дифторфеніл)-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозид у формі піни сірувато-білого кольору (вихід=87%). Тпл.=121°C. 27 D 9 (с=0,25; ДМСО). Приклад 85: 5-(2,4-дифторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 84, одержують 5(2,4-дифторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=79%). Тпл.=221°C. 27 D 62 (с=0,66; ДМСО). Приклад 86: 5-(4-фтор-2-метоксифеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 4-фтор-2метоксифенілборонової кислоти одержують 5-(4фтор-2-метоксифеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид у формі піни сірувато-білого кольору (вихід=92%). Тпл.=121°C. 27 D 11 (с=0,23; ДМСО). Приклад 87: 5-(4-фтор-2-метоксифеніл)-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 86, одержують 5-(4фтор-2-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=71%). Тпл.=218-228°С (перекристалізований з метанолу). 27 D 64 (с=0,54; ДМСО). Приклад 88: 5-(2-хлор-4-фторфеніл)-3-піридиніл-2,3,4-триО-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 2-хлор-4-фторфенілборонової кислоти одержують 5-(2-хлор-4-фторфеніл)-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид у формі піни сірувато-білого кольору (вихід=81%). Тпл.=115°С. 27 D 11 (с=0,38; ДМСО). Приклад 89: 39 5-(2-хлор-4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 88, одержують 5-(2хлор-4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=78%). Тпл.=208-211°C. 27 D 58 (с=0,49; ДМСО). Приклад 90: 5-(4-ціано-3-фторфеніл)-3-піридиніл-2,3,4-триО-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 27, з 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 3-фтор-4-ціанофенілборонової кислоти одержують 5-(4-ціано-3-фторфеніл)-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид у формі кристалів кремового кольору (вихід=65%). Тпл.=223°С. 26 D 2 (с=0,23; ДМСО). Приклад 91: 5-(4-ціано-3-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 90, одержують 5-(4ціано-3-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=75%). Тпл.=214°С. 26 D 51 (с=0,16; ДМСО). Приклад 92: 6-(4-метоксифеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 4метоксифенілборонової кислоти й 6-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 26, одержують 6-(4-метоксифеніл)-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозид у формі світлого порошку (вихід=28%). Тпл.=208°С (кристалізували з етилацетату). 29 D 12 (с=0,25; ДМСО). Приклад 93: 6-(4-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 92, одержують 6-(4метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі порошку білого кольору (вихід=74%). Тпл.=164°С. 29 D 37 (с=0,23; ДМСО). Приклад 94: 6-[4-(гідроксиметил)феніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 4(гідроксиметил)фенілборонової кислоти й 6-бром3-піридиніл-2,3,4-три-O-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 26, одержують 6-[4-(гідроксиметил)феніл]-3 92908 40 піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид у формі порошку білого кольору (вихід=29%). Тпл.=157°С. 29 D 12 (с=0,42; ДМСО). Приклад 95: 6-[4-(гідроксиметил)феніл]-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 94, одержують 6-[4(гідроксиметил)феніл]-3-піридиніл-5-тіо- -Dксилопіранозид у формі порошку білого кольору (вихід=68%). Тпл.=215°С (кристалізували з води). 28 D 18 (с=0,17; ДМСО). Приклад 96: 6-[4-(трифторметил)феніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 4(трифторметил)фенілборонової кислоти й 6-бром3-піридиніл-2,3,4-три-O-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 26, одержують 6-[4-(трифторметил)феніл]-3піридиніл-2,3,4-три-O-ацетил-5-тіо- -Dксилопіранозид у формі порошку білого кольору (вихід=25%). Тпл.=178-180°С. 23 D 7 (с=0,34; ДМСО). Приклад 97: 6-[4-(трифторметил)феніл]-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 96, одержують 6-[4(трифторметил)феніл]-3-піридиніл-5-тіо- -Dксилопіранозид у формі порошку білого кольору (вихід=90%). Тпл.=194-195°С (кристалізували з метанолу). 28 D 41 (с=0,34; ДМСО). Приклад 98: 6-(4-метилфеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 4метилфенілборонової кислоти й 6-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 26, одержують 6-(4-метилфеніл)-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозид у формі порошку білого кольору (вихід=25%). Тпл.=150-152°С. 31 D 10 (с=0,32; ДМСО). Приклад 99: 6-(4-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 98, одержують 6-(4метилфеніл)-3-піридиніл-5-тіо- -D-ксилопіранозид у формі порошку білого кольору (вихід=84%). Тпл.=191°C. 31 D 48 (с=0,33; ДМСО). Приклад 100: 41 4-(4-метоксифеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 4метоксифенілборонової кислоти й 4-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 27, одержують 4-(4-метоксифеніл)-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=29%). Тпл.=193°С (кристалізували з 2-пропанолу). 30 D 93 (с=0,26; ДМСО). Приклад 101: 4-(4-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 100, одержують 4(4-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі порошку рожевого кольору (вихід=66%). Тпл.=228°С (кристалізували з метанолу). 32 D 80 (с=0,54; ДМСО). Приклад 102: 5-(3-фтор-4-метоксифеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 3фтор-4-метоксифенілборонової кислоти одержують 5-(3-фтор-4-метоксифеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид у формі порошку блідо-рожевого кольору (вихід=64%). Тпл.=150-152°С. 31 D 5 (с=0,16; ДМСО). Приклад 103: 5-(3-фтор-4-метоксифеніл)-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 102, одержують 5(3-фтор-4-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=80%). Тпл.=200°С (кристалізували з метанолу). 28 D 63 (с=0,48; ДМСО). Приклад 104: 5-(4-метокси-2-метилфеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 4метокси-2-метилфенілборонової кислоти одержують 5-(4-метокси-2-метилфеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид у формі порошку білого кольору (вихід=32%). Тпл.=283°С (кристалізували з 2-пропанола). 29 D 6 (с=0,35; ДМСО). Приклад 105: 5-(4-метокси-2-метилфеніл)-3-піридиніл-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 104, одержують 5(4-метокси-2-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі порошку сірого кольору (вихід=68%). Тпл.=231°C (кристалізували з води). 92908 42 29 D 57 (с=0,32; ДМСО). Приклад 106: 5-(3-фтор-4-метилфеніл)-3-піридиніл-2,3,4-триO-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 3фтор-4-метилфенілборонової кислоти одержують 5-(3-фтор-4-метилфеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид у формі порошку рожевого кольору (вихід=31%). Тпл.=159°С. 27 D 14 (с=0,19;ДМСО). Приклад 107: 5-(3-фтор-4-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 106, одержують 5(3-фтор-4-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів сірого кольору (вихід=25%). Тпл.=213°С (кристалізували з 2-пропанолу). 30 D 22 (с=0,17; ДМСО). Приклад 108: 5-(3,4-диметилфеніл)-3піридиніл-2,3,4-три-O-ацетил-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 43, з 3,4-диметилфенілборонової кислоти одержують 5(3,4-диметилфеніл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=50%). Тпл.=131°C. 27 D 5 (с=0,15; ДМСО). Приклад 109: 5-(3,4-диметилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 108, одержують 5(3,4-диметилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=31%). Тпл.=184°С. 28 D 57 (с=0,22; ДМСО). Приклад 110: 5-(2-хлор-4-метилфеніл)-3-піридиніл-2,3,4-триО-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 2хлор-4-метилфенілборонової кислоти одержують 5-(2-хлор-4-метилфеніл)-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид у формі порошку бежевого кольору (вихід=50%). Тпл.=162°С. 30 D 8 (с=0,27; ДМСО). Приклад 111: 5-(2-хлор-4-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 110, одержують 5(2-хлор-4-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі порошку білого кольору (вихід=58%). Тпл.=207°С. 43 30 D 48 (с=0,15; ДМСО). Приклад 112: 5-(2-хлор-4-метоксифеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з 2хлор-4-метоксифенілборонової кислоти одержують 5-(2-хлор-4-метоксифеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид у формі порошку білого кольору (вихід=32%). Тпл.=126°С. 30 D 11 (с=0,41; ДМСО). Приклад 113: 5-(2-хлор-4-метоксифеніл)-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 112, одержують 5(2-хлор-4-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі голок бежевого кольору (вихід=53%). Тпл.=218°С (кристалізували із суміші етанол/вода). 26 D 43 (с=0,16; ДМСО). Приклад 114: 5-метилсульфоніл-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 30, з 5метилсульфоніл-3-піридинолу, отриманого відповідно до Синтезу 31, одержують 5метилсульфоніл-3-піридиніл-2,3,4-три-O-ацетил-5тіо- -D-ксилопіранозид у формі а порошку кремового кольору (вихід=18%). Тпл.=193°С. 29 D 162 (c=0,50; CHCI3). Приклад 115: 5-метилсульфоніл-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 114, одержують 5метилсульфоніл-3-піридиніл-5-тіо- -Dксилопіранозид у формі пластівців білого кольору (вихід=90%). Тпл.=183°С. 29 D 248 (с=0,30; Н2О). Приклад 116: 6-{[(фенілметил)аміно]карбоніл}-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 30, з 2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозилброміду й 5-гідрокси-N(фенілметил)-2-піридинкарбоксаміду, отриманого відповідно до Синтезу 34, одержують 6{[(фенілметил)аміно]карбоніл}-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид у формі кристалів бежевого кольору (вихід=31%). Тпл.=177-178°С. 30 D 13 (с=0,17; ДМСО). Приклад 117: 6-{[(фенілметил)аміно]карбоніл}-3-піридиніл-5тіо- -D-ксилопіранозид 92908 44 За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 116, одержують 6{[(фенілметил)аміно]карбоніл}-3-піридиніл-5-тіо- D-ксилопіранозид у формі кристалів жовтого кольору (вихід=86%). Тпл.=89-91°C. 30 D 52 (с=0,15; ДМСО). Приклад 118: 5-ацетил-3-піридиніл-2,3,4-три-О-ацетил-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 30, з 5ацетил-3-піридинолу, отриманого відповідно до Синтезу 35, одержують 5-ацетил-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид у формі порошку ясно-жовтого кольору (вихід=20%). Тпл.=157°С. 27 D 7 (с=0,21; ДМСО). Приклад 119: 5-ацетил-3-піридиніл-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 118, одержують 5ацетил-3-піридиніл-5-тіо- -D-ксилопіранозид у формі голок рожевого кольору (вихід=50%). Тпл.=209°С. 27 D 93 (с=0,19; ДМСО). Приклад 120: 4-ацетил-3-піридиніл-2,3,4-три-O-ацетил-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 30, з 4ацетил-3-піридинолу одержують 4-ацетил-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозид і відразу використовують на стадії дезацетилювання без проміжного очищення. Приклад 121: 4-ацетил-3-піридиніл-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 120, одержують 4ацетил-3-піридиніл-5-тіо- -D-ксилопіранозид у формі порошку жовтого кольору (вихід=23%). Тпл.=163°С (кристалізували з 2-пропанолу). 29 D 83 (с=0,23; ДМСО). Приклад 122: 2-(4-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид Суміш 0,8 г (1,8 мМ) 2-бром-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозиду, отриманого відповідно до Синтезу 28, 0,325 г (2,14 мМ) 4метоксифенілборонової кислоти, 0,8 г (0,08 мМ) каталізатора Сузукі, нанесеного на смолу (Argonaut, смола PSPPh3Pd), 1,16 г (3,56 мм) карбонату цезію, 5 мл ДМЕ й 4мл метанолу поміщають у реактор, адаптований для мікрохвиль. Суміш нагрівають при температурі 120°С протягом 30 хвилин за допомогою мікрохвиль. Після фільтрації, промивання метанолом і відгону розчинників отриманий залишок відразу хроматографують на силікагелі, використовуючи як елюент спочатку чистий дихлорметан, а потім суміш дихлорметан/метанол (9/1; об./об.). Отриману піну кристалізують з ефіру й одержують очікуваний продукт у формі порошку білого кольору (вихід=65%). Тпл.=137°С. 45 33 D 79 (с=0,17; ДМСО). Приклад 123: 5-(3-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 3фторфенілборонової кислоти й 5-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду одержують 5-(3-фторфеніл)-3піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=67%). Тпл.=182-184°С. 28 D 55 (с=0,11; ДМСО). Приклад 124: 6-(3-ацетилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 3ацетилфенілборонової кислоти й 6-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 26, одержують 6-(3-ацетилфеніл)-3-піридиніл-5тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=44%). Тпл.=159-163°С (кристалізували з води). 31 D 38 (с=0,10; ДМСО). Приклад 125: 6-[4-(трифторметокси)феніл]-3-піридиніл-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 122, з 4(трифторметокси)феніл-боронової кислоти й 6бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 26, одержують 6-[4-(трифторметокси)феніл]-3піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=31%). Тпл.=184-186°С (кристалізували з води). 31 D 34 (с=0,10; ДМСО). Приклад 126: 5-(2-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 2фторфенілборонової кислоти й 5-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду одержують 5-(2-фторфеніл)-3піридиніл-5-тіо- -D-ксилопіранозид у формі порошку білого кольору (вихід=51 %). Тпл.=206-208°С. 32 D 63 (с=0,17; ДМСО). Приклад 127: 2-[4-(трифторметокси)феніл]-3-піридиніл-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 122, з 4(трифторметокси)фенілборонової кислоти й 2бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 28, одержують 2-[4-(трифторметокси)феніл]-3піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=33%). Тпл.=114-119°С (кристалізували з води). 30 D 38 (с=0,15; ДМСО). Приклад 128: 92908 46 2-(3-ацетилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 3ацетилфенілборонової кислоти й 2-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 28, одержують 2-(3-ацетилфеніл)-3-піридиніл-5тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=44%). Тпл.=128-133°С (кристалізували з води). 30 D 117 (с=0,10; ДМСО). Приклад 129: 6-(4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 4фторфенілборонової кислоти й 6-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 26, одержують 6-(4-фторфеніл)-3-піридиніл-5тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=46%). Тпл.=180-183°С. 30 D 50 (с=0,10; ДМСО). Приклад 130: 5-(2-ціанофеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 2ціанофенілборонової кислоти й 5-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду одержують 5-(2-ціанофеніл)-3піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=67%). Тпл.=177-179°С. 28 D 74 (с=0,15; ДМСО). Приклад 131: 5-(3-хлор-4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 3хлор-4-фторфенілборонової кислоти й 5-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду одержують 5-(3-хлор-4фторфеніл)-3-піридиніл-5-тіо- -D-ксилопіранозид у формі порошку білого кольору (вихід=59%). Тпл.=200-201°C. 28 D 74 (с=0,18; ДМСО). Приклад 132: 5-(3,4-дифторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 3,4-дифторфенілборонової кислоти й 5-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду одержують 5-(3,4-дифторфеніл)3-піридиніл-5-тіо- -D-ксилопіранозид у формі порошку бежевого кольору (вихід=44%). Тпл.=198-203°С. 30 D 0 (с=0,18; ДМСО). Приклад 133: 5-(2-метоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 2метоксифенілборонової кислоти й 5-бром-3 47 піридиніл-2,3,4-три-O-ацетил-5-тіо- -Dксилопіранозиду одержують 5-(2-метоксифеніл)-3піридиніл-5-тіо- -D-ксилопіранозид у формі порошку бежевого кольору (вихід=69%). Тпл.=209-211°C. 29 D 94 (с=0,14; ДМСО). Приклад 134: 2-(4-метоксифеніл)-6-метил-3-піридиніл-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 122, з 4метоксифенілборонової кислоти й 2-йод-6-метил3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, отриманого відповідно до Синтезу 29, одержують 2-(4-метоксифеніл)-6-метил-3піридиніл-5-тіо- -D-ксилопіранозид у формі порошку сірувато-бежевого кольору (вихід=70%). Тпл.=86-90°С. 28 D 25 (с=0,12; ДМСО). Приклад 135: 5-(4-хлорфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 4хлорфенілборонової кислоти й 5-бром-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозиду одержують 5-(4-хлорфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів сірувато-білого кольору (вихід=74%). Тпл.=202-203°С. 29 D 47 (с=0,48; ДМСО). Приклад 136: 5-(4-метокси-3-метилфеніл)-3-піридиніл-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 122, з4метокси-3-метилфенілборонової кислоти й 5-бром3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду одержують 5-(4-метокси-3метилфеніл)-3-піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=21%). Тпл.=181°C. 23 D 55 (с=0,13; ДМСО). Приклад 137: 5-(2,4-диметоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 2,4-диметоксифенілборонової кислоти й 5-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду одержують 5-(2,4диметоксифеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=71%). Тпл.=184°С. 29 D 66 (с=0,18; ДМСО). Приклад 138: 5-(2-фтор-5-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 122, з 2фтор-5-метилфенілборонової кислоти й 5-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду одержують 5-(2-фтор-5метилфеніл)-3-піридиніл-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=48%). 92908 48 Тпл.=198°С (кристалізували із суміші етанол/вода). 30 D 58 (с=0,18; ДМСО). Приклад 139: 5-(фенілсульфоніл)-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид 0,495 г (1 мМ) 5-йод-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозиду, 4 мл ДМСО, 0,025 г (0,05 мМ) комплексу бензол/трифторметансульфонат міді, 0,196 г (1,2 мМ) фенілсульфінату й 0,0088 г (0,1 мМ) Ν,Ν'диметилетилендіаміну змішують в атмосфері аргону в реакторі, адаптованому для мікрохвиль. Суміш нагрівають при температурі 130°С протягом 3 годин за допомогою мікрохвиль. До охолодженої реакційної маси додають воду й екстрагують етилацетатом. Органічну фазу промивають водою, сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску. Залишок після розпарювання очищають хроматографічно на силікагелі, використовуючи як елюент суміш толуол/ацетон (9/1; об./об.), і одержують очікуваний продукт у формі кристалів білого кольору з виходом 43%. Тпл.=97-99°С. 30 D 48 (с=0,17; ДМСО). Приклад 140: 5-(фенілсульфоніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 139, одержують 5(фенілсульфоніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі пухнатих кристалів білого кольору (вихід=76%). Тпл.=86°С. 29 D 75 (с=0,20; ДМСО). Приклад 141: 5-[(4-фторфеніл)сульфоніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 139, з 5йод-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й 4-фторфенілсульфінату одержують 5-[(4-фторфеніл)сульфоніл]-3-піридиніл2,3,4-три-O-ацетил-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=24%). Тпл.=128°С. 29 D 55 (с=0,26; ДМСО). Приклад 142: 5-[(4-фторфеніл)сульфоніл]-3-піридиніл-5-тіо-D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 141, одержують 5[(4-фторфеніл)сульфоніл]-3-піридиніл-5-тіо- -Dксилопіранозид у формі пухнатих кристалів білого кольору (вихід=90%). Тпл.=93-96°С. 29 D 95 (с=0,20; ДМСО). Приклад 143: 5-(2,4,6-трифторфеніл)-3-піридиніл-2,3,4-триО-ацетил-5-тіо- -D-ксилопіранозид 49 0,5 г (1,11 мМ) 5-бром-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозиду, 10 мл ДМЕ, 0,027 г (0,033 мМ) [1,1'біс(дифенілфосфіно)фероцен]-дихлорпаладію(ІІ) дихлорметану, 0,564 г (2,23 мМ) біспінаколборану й 0,379 г (3,86мм) ацетату калію змішують в атмосфері аргону в реакторі, адаптованому для мікрохвиль. Суміш нагрівають протягом 30 хвилин при температурі 110°С за допомогою мікрохвиль, охолоджують і фільтрують. До фільтрату додають 0,47 г (2,23 мМ) 2,4,6-трифтор-1-бромбензолу, 0,091 г (0,11 мМ) [1,1'-біс(дифенілфосфіно)фероцен]дихлорпаладію(ІІ) дихлорметану й розчин 0,177 г (1,67 мМ) карбонату натрію в 1 мл води. Реакційну масу нагрівають протягом 30 хвилин при температурі 130°С у мікрохвильовій печі. До охолодженої маси додають воду й екстрагують етилацетатом. Органічну фазу промивають водним розчином бікарбонату натрію й потім водою, сушать над сульфатом натрію й концентрують при зниженому тиску. Залишок після розпарювання очищають хроматографічно на силікагелі, використовуючи як елюент суміш циклогексан/етилацетат (8/2; об./об.), і одержують необхідний продукт у формі кристалів білого кольору з виходом 39%. Тпл.=143°С. 27 D 21 (с=0,20; ДМСО). Приклад 144: 5-(2,4,6-трифторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 143, одержують 5(2,4,6-трифторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=56%). Тпл.=228°С. 28 D 63 (с=0,22; ДМСО). Приклад 145: 5-(3,5-дифтор-4-метоксифеніл)-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозид 0,334 г (1,5 мМ) 4-бром-2,6-дифторанізолу, 12 мл ДМЕ, 0,569 г (2,25 мМ) биспінаколборану, 0,036 г (0,045 мМ) [1,1'-біс(дифенілфосфіно)фероцен]дихлорпаладію(ІІ) дихлорметану й 0,441 г (4,5 мм) ацетату калію змішують у реакторі, адаптованому для мікрохвиль. Реактор нагрівають при температурі 110°С протягом 30 хвилин за допомогою мікрохвиль. Після охолодження реакційну масу фільтрують, до фільтрату додають 0,672 г (1,8 мМ) 5бром-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду, 1,122 г (0,12 мМ) [1,1'біс(дифенілфосфіно)-фероцен]дихлорпаладію(ІІ) дихлорметану й розчин 0,196 г (1,8 мМ) карбонату натрію в 1,5 мл води. Суміш нагрівають при температурі 130°С протягом 30 хвилин за допомогою мікрохвиль. До охолодженої реакційної маси додають воду й екстрагують етилацетатом. Органічну фазу промивають водою, сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску. Залишок після розпарювання очищають хроматографічно на силікагелі, використовуючи як елюент суміш дихлорметан/метанол (99/1; об./об.). Отриманий продукт перекристалі 92908 50 зують з ефіру, фільтрують і одержують необхідний продукт у формі порошку білого кольору з виходом 64%. Тпл.=203°С. 29 D 18 (с=0,30; ДМСО). Приклад 146: 5-(3,5-дифтор-4-метоксифеніл)-3-піридиніл-5тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 145, одержують 5(3,5-дифтор-4-метоксифеніл)-3-піридиніл-5-тіо- D-ксилопіранозид у формі порошку білого кольору (вихід=74%). Тпл.=203°С. 29 D 64 (с=0,35; ДМСО). Приклад 147: 5-(2-ціано-4-фторфеніл)-3-піридиніл-2,3,4-триO-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 145, з 2бром-5-фторбензонітрилу, одержують 5-(2-ціано-4фторфеніл)-3-піридиніл-2,3,4-три-О-ацетил-5-тіо- D-ксилопіранозид у формі кристалів кремового кольору (вихід=29%). Тпл.=170-172°С. 23 D 23 (с=0,14; ДМСО). Приклад 148: 5-(2-ціано-4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 147, одержують 5(2-ціано-4-фторфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів бежевого кольору (вихід=70%). Тпл.=198-200°С (кристалізували з діетилового ефіру). 23 D 70 (с=0,20; ДМСО). Приклад 149: 5-(4-ціано-3-метилфеніл)-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 145, з 4бром-2-метилбензонітрилу одержують 5-(4-ціано3-метилфеніл)-3-піридиніл-2,3,4-три-О-ацетил-5тіо- -D-ксилопіранозид у формі кристалів сіруватобілого кольору (вихід=61%). Тпл.=74-80°С. 23 D 15 (с=0,16; ДМСО). Приклад 150: 5-(4-ціано-3-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 149, одержують 5(4-ціано-3-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=79%). Тпл.=198-200°С. 23 D 72 (с=0,25; ДМСО). Приклад 151: 5-(3-хлор-4-ціанофеніл)-3-піридиніл-2,3,4-триO-ацетил-5-тіо- -D-ксилопіранозид 51 За методикою, аналогічною Прикладу 145, з 4бром-2-хлорбензонітрилу одержують 5-(3-хлор-4ціанофеніл)-3-піридиніл-2,3,4-три-O-ацетил-5-тіо-D-ксилопіранозид у формі кристалів білого кольору (вихід=39%). Тпл.=148-150°С (кристалізували з етилацетату). 24 D 6 (с=0,16; ДМСО). Приклад 152: 5-(3-хлор-4-ціанофеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 151, одержують 5(3-хлор-4-ціанофеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=35%). Тпл.=202-204°С. 25 D 73 (с=0,10; ДМСО). Приклад 153: 5-(4-ціано-2-метилфеніл)-3-піридиніл-2,3,4три-O-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 145, з 4бром-3-метилбензонітрилу одержують 5-(4-ціано2-метилфеніл)-3-піридиніл-2,3,4-три-O-ацетил-5тіо- -D-ксилопіранозид у формі кристалів сіруватобілого кольору (вихід=54%). Тпл.=136-138°С (кристалізували з діетилового ефіру). 25 D 7 (с=0,18; ДМСО). Приклад 154: 5-(4-ціано-2-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 2, зі сполуки, отриманої в Прикладі 153, одержують 5(4-ціано-2-метилфеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=73%). Тпл.=202-206°С. 25 D 62 (с=0,17; ДМСО). Приклад 155: 5-(3,4-диціанофеніл)-3-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 145, з 4йод-1,2-бензолдикарбонітрилу одержують 5-(3,4диціанофеніл)-3-піридиніл-2,3,4-три-О-ацетил-5тіо- -D-ксилопіранозид у формі кристалів білого кольору (вихід=45%). Тпл.=114°С. 28 D 11 (с=0,39; ДМСО). Приклад 156: 5-(3,4-диціанофеніл)-3-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, зі сполуки, отриманої в Прикладі 155, одержують 5(3,4-диціанофеніл)-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору (вихід=19%). Тпл.=192°С (кристалізували з метанолу). 28 D 43 (с=0,20; ДМСО). Приклад 157: 92908 52 6-[4-(1-піперидиніл)феніл]-3-піридиніл-2,3,4три-О-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 43, з [4(1-піперидиніл)феніл]боронової кислоти й 6-бром3-піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду одержують необхідну сполуку у формі порошку сірого кольору (вихід=14%). Тпл.=212°С. 28 D 14 (с=0,12; ДМСО). Приклад 158: 6-[4-(1-піперидиніл)феніл]-3-піридиніл-5-тіо- D-ксилопіранозид За методикою, аналогічною Прикладу 6, із продукту, отриманого в Прикладі 157, одержують 6-[4-(1-піперидиніл)феніл]-3-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору з виходом 72%. Тпл.=221°C. 26 D 15 (с=0,13; ДМСО). Приклад 159: 5-[(N,N-діетиламіно)карбоніл]-3-піридиніл2,3,4-три-О-ацетил-5-тіо- -D-ксилопіранозид Дотримуються методики, аналогічної першої частини Приклада 143, виходячи з 5-бром-3піридиніл-2,3,4-три-О-ацетил-5-тіо- -Dксилопіранозиду й біспінаколборану. Після фільтрування й розпарювання реакційної маси залишок екстрагують етилацетатом і промивають водою. Органічну фазу сушать над сульфатом магнію й потім концентрують при зниженому тиску з одержанням масла коричневого кольору, що при розтиранні в суміші етиловий ефір/діізопропіловий ефір дає 5-(4,4,5,5-тетраметил-1,3,2диоксаборолан-2-ил)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозид. Отриманий продукт відразу використовують на наступній стадії. 1 г (2,02 мМ) 5-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)-3-піридиніл-2,3,4-три-Оацетил-5-тіо- -D-ксилопіранозиду, 0,5 мл (3,95 мМ) діетилскарбамоїлхлориду, 50 мг (0,06 мМ) [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладію(ІІ) дихлорметану й 15 мл ТГФ поміщають в атмосфері аргону в реактор, адаптований для мікрохвиль. Суміш нагрівають при температурі 110°С протягом 30 хвилин за допомогою мікрохвиль. Охолоджену реакційну масу фільтрують і потім концентрують при зниженому тиску. Залишок після розпарювання очищають хроматографічно на силікагелі, використовуючи як елюент чистий дихлорметан і потім суміш дихлорметан/метанол (9/1; об./об.). Після промивання сумішшю ефір/ізопропіловий ефір отриману кристалічну речовину коричневого кольору відразу використовують у реакції дезацетилювання, описаній у Прикладі 160. Приклад 160: 5-[(N,N-діетиламіно)карбоніл]-3-піридиніл-5тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 6, із продукту, отриманого в Прикладі 159, одержують 5-[(N,N-діетиламіно)карбоніл]-3-піридиніл-5-тіо- D-ксилопіранозид у формі кристалів бежевого кольору з виходом 59%. Тпл.=143°С (кристалізували з води). 53 25 D 53 (с=0,11; ДМСО). Приклад 161: 2-(4-фтор-2-метилфеніл)-4-піридиніл-2,3,4-триO-ацетил-5-тіо- -D-ксилопіранозид За методикою, аналогічною Прикладу 76, з 4фтор-2-метилфенілборонової кислоти одержують 2-(4-фтор-2-метилфеніл)-4-піридиніл-2,3,4-три-Oацетил-5-тіо- -D-ксилопіранозид у формі кристалів білого кольору з виходом 72%. Тпл.=137°С. 29 D 14 (с=0,28; ДМСО). Приклад 162: 92908 54 2-(4-фтор-2-метилфеніл)-4-піридиніл-5-тіо- -Dксилопіранозид За методикою, аналогічною Прикладу 6, із продукту, отриманого в Прикладі 161, одержують 2-(4-фтор-2-метилфеніл)-4-піридиніл-5-тіо- -Dксилопіранозид у формі кристалів білого кольору з виходом 70%. Тпл.=147°С (кристалізували із суміші вода/ДМСО). 32 D 52 (с=0,20; ДМСО). Структури сполук формули І, описаних вище, представлені нижче в Таблиці: 55 92908 56 57 92908 58 59 92908 60
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds derived from 5-thioxylose and therapeutic use thereof
Автори англійськоюBarberousse Veronique, Bondoux Michel, Thomas Didier, Peyrou Vincent
Назва патенту російськоюСоединения, производные от 5-тиоксилозы, и их терапевтическое применение
Автори російськоюБарберусс Вероник, Бонду Мишель, Томас Дидье, Пейру Винсент
МПК / Мітки
МПК: A61K 31/70, C07H 17/02
Мітки: похідні, терапевтичне, 5-тіоксилози, сполуки, застосування
Код посилання
<a href="https://ua.patents.su/32-92908-spoluki-pokhidni-vid-5-tioksilozi-ta-kh-terapevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Сполуки, похідні від 5-тіоксилози, та їх терапевтичне застосування</a>
Попередній патент: Похідні тетрагідроіндазолону
Наступний патент: Спосіб керування машиною для виготовлення тютюнових продуктів
Випадковий патент: Свердловинне електромагнітне ударне сейсмічне джерело












