Похідні 1-фенілсульфоніл-1,3-дигідро-2н-індол-2-ону, їх отримання та терапевтичне застосування
Номер патенту: 77181
Опубліковано: 15.11.2006
Автори: Серрадей-Лє Ґаль Клодін, Ру Рішар, Ваньйон Жан, арсія Жорж, Ді Мальта Ален, Шент'є Бруно, Тоннєрр Бернар
Формула / Реферат
1. Сполука формули:
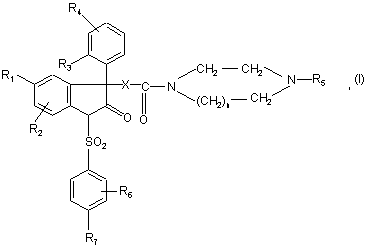
в якій:
n дорівнює 1 або 2;
Х представляє групу –СН2-; -O-; -NH-; -О-СН2-; -NH-СН2-; -NН-СН2-СН2-;
R1 представляє атом галогену; (С1-С4)алкіл; (С1-С4)алкоксил;
R2 представляє атом гідрогену; атом галогену; (С1-С4)алкіл; (С1-С4)алкоксил; трифлуорметил;
R3 представляє атом галогену; (С1-С3)алкіл; (С1-С3)алкоксил; трифлуорметил; трифлуорметоксил;
R4 представляє атом гідрогену; атом галогену; (С1-С3)алкіл; (С1-С3)алкоксил;
R5 представляє радикал, вибраний з групи:
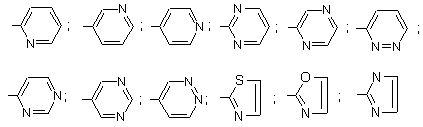 ;
;
R6 представляє (С1-С4)алкоксил;
R7 представляє ( С1-С4)алкоксил;
а також її солі з мінеральними або органічними кислотами, сольвати та/або гідрати.
2. Сполука за п. 1, в якій:
n та Х визначені для сполуки формули (І) у п. 1;
R1 представляє атом хлору або метил;
R2 представляє атом гідрогену або знаходиться у позиції 6 індол-2-ону та представляє атом хлору, метил, метоксил або трифлуорметил;
R3 представляє атом хлору, атом флуору, метоксил, етоксил, ізопропоксил, трифлуорметил або трифлуорметоксил;
R4 представляє атом гідрогену або метоксил;
R5 представляє 2-піридил, 3-піридил, 4-піридил, 2-піримідиніл, 2-піразиніл, 3-піридазиніл або 1,3-тіазол-2-іл;
R6 знаходиться у позиції 2 фенілу та представляє метоксил;
R7 представляє метоксил;
а також її солі з мінеральними або органічними кислотами, сольвати та/або гідрати.
3. Сполука, вибрана з групи:
5-хлор-3-(2-етоксифеніл)-1-[(2,4-диметоксифеніл)сульфоніл]-3-[2-оксо-2-[4-(4-піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он;
5-хлор-3-(2-ізопропоксифеніл)-1-[(2,4-диметоксифеніл)сульфоніл]-3-[2-оксо-2-[4-(4-піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл-4-(2-піридил)-1-піперазинкарбоксилат;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл-4-(4-піридил)-1-піперазинкарбоксилат;
N-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3-(2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-піридил)гомопіперазин-1-карбоксамід,
N-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3-(2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(3-піридил)піперазин-1-карбоксамід;
N-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3-(2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-піридил)піперазин-1-карбоксамід;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-метоксифеніл)-3-[[3-оксо-3-[4-(2-піридил)-1-піперазиніл]пропіл]аміно]-1,3-дигідро-2Н-індол-2-он;
5,6-дихлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3-(2-метоксифеніл)-3-[2-оксо-2-[4-(4-піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-метоксифеніл)-6-метил-3-[2-оксо-2-[4-(4-піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-метоксифеніл)-6-метил-2-оксо-2,3-дигідро-1Н-індол-3-іл-4-(4-піридил)-1-піперазинкарбоксилат;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-6-метокси-3-(2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл-4-(4-піридил)-1-піперазинкарбоксилат;
N-[5-хлор-3-(2-хлорфеніл)-1-[(2,4-диметоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(2-піридил)піперазин-1-карбоксамід;
N-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3-(2-метоксифеніл)-6-метил-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-піридил)піперазин-1-карбоксамід;
N-[6-xлop-3-(2-xлopфeнiл)-1-[(2,4-димeтoкcифeнiл)cyльфoнiл]-5-мeтил-2-oкco-2,3-дигідро-1Н-індол-3-іл]-4-(4-піридил)піперазин-1-карбоксамід;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-флуорфеніл)-3-[2-оксо-2-[4-(4-піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он;
5,6-дихлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3-(2-флуорфеніл)-3-[2-оксо-2-[4-(4-піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он;
5-хлор-3-(2,3-диметоксифеніл)-1-[(2,4-диметоксифеніл)сульфоніл]-3-[2-оксо-2-[4-(4-піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксифеніл)-3-[2-оксо-2-[4-(3-піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-ізопропоксифеніл)-3-[2-оксо-2-[4-(3-піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-ізопропоксифеніл)-3-[2-оксо-2-[4-(4-піридил)-1-гомопіперазин]етил]-1,3-дигідро-2Н-індол-2-он;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-ізопропоксифеніл)-3-[2-оксо-2-[4-(1,3-тіазол-2-іл)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл-4-(3-піридил)-1-піперазинкарбоксилат;
5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл-4-(4-піридил)-1-піперазинкарбоксилат;
у формі оптично чистих ізомерів або у формі їх суміші, а також їх солі з мінеральними або органічними кислотами, та їх сольвати та/або гідрати.
4. Спосіб отримання сполук формули (І) за п. 1, що характеризується наступним:
сполука формули:
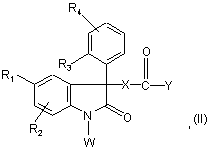
в якій R1, R2, R3, R4 та Х визначені для сполук формули (І) у п. 1, а
Y представляє гідроксил або атом хлору, коли Х представляє групу –СН2-; -OCH2-; -NH-CH2-; -NH-CH2-CH2-;
або Y представляє феноксил, коли Х представляє групу -O-; -NH-;
W представляє атом гідрогену, коли Х представляє групу –СН2-; -ОСН2-;
або W представляє групу
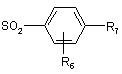 , в якій R6 та R7 визначені для сполуки формули (1) у п. 1, коли Х представляє групу -O-; -NH-; -NH-CH2-; -NН-СН2-СН2-;
, в якій R6 та R7 визначені для сполуки формули (1) у п. 1, коли Х представляє групу -O-; -NH-; -NH-CH2-; -NН-СН2-СН2-;
реагує зі сполукою формули:
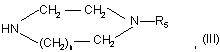
в якій n та R5 визначені для сполуки формули (І) у п. 1;
коли W представляє групу
 , отримуючи очікувану сполуку формули (I);
, отримуючи очікувану сполуку формули (I);
або, коли W представляє атом гідрогену, отримана таким чином сполука формули:
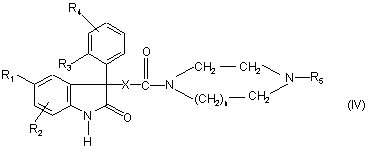
реагує у присутності основи з сульфонілгалогенідом формули:
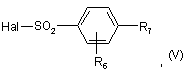
в якій R6 та R7 визначені для сполуки формули (І) у п. 1, a Hal представляє атом галогену.
5. Сполука формули:
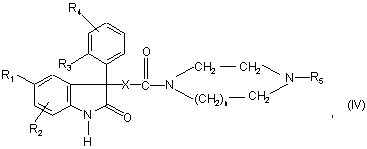
в якій:
n дорівнює 1 або 2;
Х представляє групу –СН2-; -О-СН2-;
R1 представляє атом галогену; (С1-С4)алкіл; (С1-С4)алкоксил;
R2 представляє атом гідрогену; атом галогену; (С1-С4)алкіл; (С1-С4)алкоксил; трифлуорметил;
R3 представляє атом галогену; (С1-С3)алкіл; (С1-С3)алкоксил; трифлуорметил; трифлуорметоксил;
R4 представляє атом гідрогену; атом галогену; (С1-С3)алкіл; (С1-С3)алкоксил;
R5 представляє радикал, вибраний з групи::
 ;
;
а також її солі з мінеральними або органічними кислотами, у формі оптично чистих ізомерів або у формі суміші.
6. Медикамент, який відрізняється тим, що містить сполуку за будь-яким одним з пп. 1-3, або її фармацевтично прийнятні солі з мінеральними або органічними кислотами, сольвати та/або гідрати.
7. Фармацевтична композиція, яка відрізняється тим, що містить як активний компонент сполуку за будь-яким одним з пп. 1-3, або її фармацевтично прийнятну сіль, сольват та/або гідрат, а також один або більше фармацевтично прийнятних ексципієнтів.
8. Застосування сполуки за будь-яким одним з пп. 1-3, її фармацевтично прийнятної солі з мінеральною або органічною кислотами, сольвату та/або гідрату для виробництва медикаменту, призначеного для лікування серцево-судинних захворювань, стресу, тривожності, депресії, обсесивно-компульсивного розладу, приступу паніки, захворювань ниркової системи, захворювань шлункової системи, дрібноклітинного раку легенів, ожиріння, діабету типу II, резистентності до інсуліну, гіпертригліцеридемії, атеросклерозу, синдрому Кушинга, дисменореї та при передчасних пологах.
Текст
1. Сполука формули: 2 77181 ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ 15/10 17/02 17/06 19/02 21/00 21/02 25/04 25/06 25/14 25/16 25/18 25/20 25/22 25/24 25/28 25/30 25/34 27/06 27/12 29/00 29/02 31/00 35/00 37/04 37/08 43/00 401/12 401/14 403/12 417/12 UA МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P A61P C07D C07D C07D C07D R6 R7 в якій: n дорівнює 1 або 2; Х представляє групу –СН2-; -O-; -NH-; -О-СН2-; NH-СН2-; -NН-СН2-СН2-; 3 77181 4 R1 представляє атом галогену; (С1-С4)алкіл; (С15,6-дихлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3С4)алкоксил; (2-метоксифеніл)-3-[2-оксо-2-[4-(4-піридил)-1R2 представляє атом гідрогену; атом галогену; (С1піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; С4)алкіл; (С1-С4)алкоксил; трифлуорметил; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2R3 представляє атом галогену; (С1-С3)алкіл; (С1метоксифеніл)-6-метил-3-[2-оксо-2-[4-(4-піридил)С3)алкоксил; трифлуорметил; трифлуорметоксил; 1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; R4 представляє атом гідрогену; атом галогену; (С15-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2С3)алкіл; (С1-С3)алкоксил; метоксифеніл)-6-метил-2-оксо-2,3-дигідро-1НR5 представляє радикал, вибраний з групи: індол-3-іл-4-(4-піридил)-1-піперазинкарбоксилат; N N N 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-6; ; N; ; ; ; метокси-3-(2-метоксифеніл)-2-оксо-2,3-дигідро-1НN N N N N індол-3-іл-4-(4-піридил)-1-піперазинкарбоксилат; N O S N N N-[5-хлор-3-(2-хлорфеніл)-1-[(2,4N; ; ; ; N; диметоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1НN N N N N ; індол-3-іл]-4-(2-піридил)піперазин-1-карбоксамід; R6 представляє (С1-С4)алкоксил; N-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3-(2R7 представляє ( С1-С4)алкоксил; метоксифеніл)-6-метил-2-оксо-2,3-дигідро-1На також її солі з мінеральними або органічними індол-3-іл]-4-(4-піридил)піперазин-1-карбоксамід; кислотами, сольвати та/або гідрати. N-[6-xлop-3-(2-xлopфeнiл)-1-[(2,42. Сполука за п. 1, в якій: димeтoкcифeнiл)cyльфoнiл]-5-мeтил-2-oкco-2,3n та Х визначені для сполуки формули (І) у п. 1; дигідро-1Н-індол-3-іл]-4-(4-піридил)піперазин-1R1 представляє атом хлору або метил; карбоксамід; R2 представляє атом гідрогену або знаходиться у 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2позиції 6 індол-2-ону та представляє атом хлору, флуорфеніл)-3-[2-оксо-2-[4-(4-піридил)-1метил, метоксил або трифлуорметил; піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; R3 представляє атом хлору, атом флуору, меток5,6-дихлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3сил, етоксил, ізопропоксил, трифлуорметил або (2-флуорфеніл)-3-[2-оксо-2-[4-(4-піридил)-1трифлуорметоксил; піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; R4 представляє атом гідрогену або метоксил; 5-хлор-3-(2,3-диметоксифеніл)-1-[(2,4R5 представляє 2-піридил, 3-піридил, 4-піридил, 2диметоксифеніл)сульфоніл]-3-[2-оксо-2-[4-(4піримідиніл, 2-піразиніл, 3-піридазиніл або 1,3піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індолтіазол-2-іл; 2-он; R6 знаходиться у позиції 2 фенілу та представляє 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2метоксил; етоксифеніл)-3-[2-оксо-2-[4-(3-піридил)-1R7 представляє метоксил; піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; а також її солі з мінеральними або органічними 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2кислотами, сольвати та/або гідрати. ізопропоксифеніл)-3-[2-оксо-2-[4-(3-піридил)-13. Сполука, вибрана з групи: піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; 5-хлор-3-(2-етоксифеніл)-1-[(2,45-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2диметоксифеніл)сульфоніл]-3-[2-оксо-2-[4-(4ізопропоксифеніл)-3-[2-оксо-2-[4-(4-піридил)-1піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індолгомопіперазин]етил]-1,3-дигідро-2Н-індол-2-он; 2-он; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(25-хлор-3-(2-ізопропоксифеніл)-1-[(2,4ізопропоксифеніл)-3-[2-оксо-2-[4-(1,3-тіазол-2-іл)-1диметоксифеніл)сульфоніл]-3-[2-оксо-2-[4-(4піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(22-он; етоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл-4-(35-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2піридил)-1-піперазинкарбоксилат; метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл-45-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2(2-піридил)-1-піперазинкарбоксилат; етоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл-4-(45-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2піридил)-1-піперазинкарбоксилат; ізопропоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3у формі оптично чистих ізомерів або у формі їх іл-4-(4-піридил)-1-піперазинкарбоксилат; суміші, а також їх солі з мінеральними або органічN-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3-(2ними кислотами, та їх сольвати та/або гідрати. метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-44. Спосіб отримання сполук формули (І) за п. 1, що (4-піридил)гомопіперазин-1-карбоксамід, характеризується наступним: N-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3-(2сполука формули: ізопропоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3R4 іл]-4-(3-піридил)піперазин-1-карбоксамід; N-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]-3-(2O ізопропоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3R3 R1 іл]-4-(4-піридил)піперазин-1-карбоксамід; X C Y 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2метоксифеніл)-3-[[3-оксо-3-[4-(2-піридил)-1N O , (II) R2 піперазиніл]пропіл]аміно]-1,3-дигідро-2Н-індол-2W он; в якій R1, R2, R3, R4 та Х визначені для сполук формули (І) у п. 1, а 5 77181 Y представляє гідроксил або атом хлору, коли Х представляє групу –СН2-; -OCH2-; -NH-CH2-; -NHCH2-CH2-; або Y представляє феноксил, коли Х представляє R1 групу -O-; -NH-; W представляє атом гідрогену, коли Х представR2 ляє групу –СН2-; -ОСН2-; або W представляє групу в якій: SO2 R7 R6 , в якій R6 та R7 визначені для сполуки формули (1) у п. 1, коли Х представляє групу -O-; -NH-; -NHCH2-; -NН-СН2-СН2-; реагує зі сполукою формули: CH2 CH2 HN (CH2)n N R5 , (III) CH2 6 R4 O R3 CH2 X C N (CH2)n N N R5 CH2 (IV) , O H n дорівнює 1 або 2; Х представляє групу –СН2-; -О-СН2-; R1 представляє атом галогену; (С1-С4)алкіл; (С1С4)алкоксил; R2 представляє атом гідрогену; атом галогену; (С1С4)алкіл; (С1-С4)алкоксил; трифлуорметил; R3 представляє атом галогену; (С1-С3)алкіл; (С1С3)алкоксил; трифлуорметил; трифлуорметоксил; R4 представляє атом гідрогену; атом галогену; (С1С3)алкіл; (С1-С3)алкоксил; R5 представляє радикал, вибраний з групи:: N N в якій n та R5 визначені для сполуки формули (І) у п. 1; коли W представляє групу CH2 ; ; N; N N ; N N N; N; ; ; N N N O S N ; ; N ; N SO2 R7 R6 , отримуючи очікувану сполуку формули (I); або, коли W представляє атом гідрогену, отримана таким чином сполука формули: R4 O R3 R1 CH2 X C N (CH2)n N R2 CH2 CH2 N R5 (IV) O H реагує у присутності основи з сульфонілгалогенідом формули: Hal SO2 R7 , (V) R6 в якій R6 та R7 визначені для сполуки формули (І) у п. 1, a Hal представляє атом галогену. 5. Сполука формули: Винахід стосується похідних 1,3-дигідро-2Ніндол-2-ону їх отримання та їх терапевтичного застосування. Сполуки згідно з представленим винаходом виявляють спорідненість до рецепторів арпнінвазопресину V1b (AVP) та/або до рецепторів оцитоцину (ОТ), а крім того деякі з них виявляють спорідненість до рецепторів AVP V1a. AVP є гормоном, який відомий своєю антидіуретичною дією та своєю дією на регулювання артеріального тиску. Він стимулює кілька типів N N N N ; а також її солі з мінеральними або органічними кислотами, у формі оптично чистих ізомерів або у формі суміші. 6. Медикамент, який відрізняється тим, що містить сполуку за будь-яким одним з пп. 1-3, або її фармацевтично прийнятні солі з мінеральними або органічними кислотами, сольвати та/або гідрати. 7. Фармацевтична композиція, яка відрізняється тим, що містить як активний компонент сполуку за будь-яким одним з пп. 1-3, або її фармацевтично прийнятну сіль, сольват та/або гідрат, а також один або більше фармацевтично прийнятних ексципієнтів. 8. Застосування сполуки за будь-яким одним з пп. 1 - 3, її фармацевтично прийнятної солі з мінеральною або органічною кислотами, сольвату та/або гідрату для виробництва медикаменту, призначеного для лікування серцево-судинних захворювань, стресу, тривожності, депресії, обсесивнокомпульсивного розладу, приступу паніки, захворювань ниркової системи, захворювань шлункової системи, дрібноклітинного раку легенів, ожиріння, діабету типу II, резистентності до інсуліну, гіпертригліцеридемії, атеросклерозу, синдрому Кушинга, дисменореї та при передчасних пологах. рецепторів V, (V1a, V1b), V2. Ці рецептори локалізовані зокрема у печінці, кров'яних судинах (коронарних ниркових та церебральних судинах), тромбоцитах, нирках, матці, надниркових залозах підшлунковій залозі, центральній нервовій системі та слизовій. AVP таким чином впливає на серцевосудинну систему печінку, підшлункову залозу, виявляє антидіуретичну та тромбоцит-агрегувальну дію та впливає на центральну та периферійну нервову систему та на матку. ОТ є нейроппофізарним гормоном з циклічною 7 77181 8 дев'яти-пептидною структурою, подібною до струкчерез рецептори V1b, стимуляцією секреції інсуліну тури AVP. Рецептори ОТ виявлені по суті у гладета глюкагону [В. Lee et al., Am. J. Physiol. 269 ньких м'язах матки та на мioепітеліальних клітинах (Endocnnol Metab 32): E1095-E1100, 1995] або грудних залоз. Таким чином ОТ грає важливу роль продукуванням катехоламінів у медулі надниркопри пологах, оскільки його залучено у скорочення вої залози, яка є ділянкою локального синтезу AVP м'язів матки та у лактацію. Більш того, рецептори [Е. Grazzim et al., Endocrinology, 1996, 137 (а), ОТ локалізовані також в інших периферійних тка3906-3914]. Таким чином, у медулярній тканині нинах та у центральній нервовій системі; ОТ може надниркової залози, AVP через ці рецептори можтаким чином впливати на серцево-судинну ниркона вважати, грає ключову роль у деяких типах феву, ендокринну системи або поведінку. охромоцитом надниркової залози, що секретують Локалізацію різноманітних рецепторів описано AVP, індукуючи тим безперервне продукування у [S. Jard et al., Vasopressm and oxytocin receptors катехоламінів, які є причиною станів гіпертензії, що (Рецептори вазопресину та окситоцину): огляд у є резистентними до антагоністів рецептору Progress in Endocrinology, H. Imura та К. Shizurne ангioтензину II та до інгібіторів перетворення ферed., Experta Medica, Amsterdam, 1988, 1183-1188, менту. Кора надниркової залози є також збагачена та у наступних публікаціях J. Lab. Clin. Med., 1989, рецепторами V1a, залученими у продукування глю114 (6), 617-632 та Pharmacol. Rev., 1991, 43, (1), кокортикоідів та мінералокортикоідів (альдостерон 73-108]. та кортизол). Через ці рецептори AVP (циркулююБільш особливо, рецептори AVP V1a локалізочий або синтезований локально) може індукувати вані у периферійних органах людини та у мозку. Їх продукування альдостерону з ефективністю порівклоновано зокрема у щурів та людини та вони ренювано з ефективністю ангioтензину II [G. Guillon гулюють більшість з відомих функцій AVP: агрегаet al., Endocnnology, 1995, 136 (3), 1285-1295]. Корцію тромбоцитів; скорочення матки; скорочення тизол є потужним регулятором продукування кров'яних судин; секрецію альдостерону, кортизоАСТН, гормону стресу. лу, CRF (фактор вивільнення кортикотропіну) та Нещодавні дослідження також показали, що АСТН (адренокортикотрофічний гормон); гепатичнадниркові залози здатні до вивільнення CRF ний глікогеноліз, проліферацію клітин та головну та/або АСТН безпосередньою активацією рецепцентральну дію AVP (ппотермія, пам'ять, тощо). торів V1b та/або рецепторів V1a, вироблених медуРецептори V1b спочатку ідентифіковані у аделярними клітинами [G. Mazzocchi et al., Peptides, ноппофізі різноманітних видів тварин (щури, свині, 1997, 18 (2), 191-195, Ε. Grazzini et al., J. Clin. велика рогата худоба вівці тощо), включаючи люEndocnnol. Metab., 1999, 84 (6), 2195-2203]. дину [S. Jard et al., Моl. Pharmacol., 1986, 30, 171Рецептори V1b також вважають маркерами пу177; Υ. Arsenijevic et al., J, Endocrmol., 1994, 141, хлин Пухлини, що секретують АСТН як-то деякі 383-391; J. Schwartz et al., Endocrinology, 1991, 129 пухлини слизової, деякі бронхіальні карциноми (2), 1107-1109; Υ. De Keysei et al., FEES Letters, (SCLC (рак невеликих клітин легенів)), карциноми 1994, 356, 215-220], в яких вони стимулюють вивіпідшлункової залози, надниркової залози та щитольнення аденокортикотропного гормону через AVP видної залози, індукуючи синдром Кушинга у дета роблять можливою дію CRF на вивільнення яких випадках [J. Bertherat et al., Eur. J. EndocnnoI., АСТН [G. Ε. Gillies et al., Nature, 1982, 299, 355]. У 1996, 135, 173, G. A. Wittert et aI., Lancet, 1990, гіпоталамусі рецептори V1b також індукують безпо335, 991-994, G. Dickstem et al., J. Clin. Endocnnol. середнє вивільнення CRF [Neuroendocnnology, Метаb., 1996, £31 (8), 2934-2941] надекспресують 1994, 60, 503-508] та залучені у цих різноманітних рецептори V1b. Як вважають, рецептори V1b є марвідношеннях у стресових ситуаціях. кером, більш специфічним для раку невеликих Ці рецептори V1b клоновано у щурів, людини клітин легенів (SCLC) [Р. J. Woll et al., Biochem. та мишей [Y. De Keyser, FEES Letters, 1994, 356, Biophys. Res. Commun. 1989, 164 (1), 66-73]. Таким 215-220; Τ. Sugimoto et al., J. Biol. Chem., 1994, чином, сполуки згідно з представленим винаходом 269, (43), 27088-27092; Μ. Saito et al., Biochem. є очевидним засобом діагностики та дають новий Biophys. Res. Commun., 1995, 212 (3), 751-757; S. терапевтичний підхід до проліферації та визнаJ. Lolait et al., Neurobiology, 1996, 32, 6783-6787; Μ. чення цих пухлин навіть на ранній стадії (радіо A. Ventura et al., Journal of Molecular endocnnology, мічення; СРЕТТ (комп'ютерна томографія емісією 1999, 22, 251-260] та різноманітні дослідження одиничних фотонів); PET (сканувальна томографія (гібридизація на місці PCR (полімеразна ланцюгоемісією позитронів)). ва реакція), тощо) виявили усюдисущу наявність Велика наявність попереднику рецептору V1b у цих рецепторів у різноманітних центральних ткашлунку та кишечнику свідчить про залучення AVP нинах (мозок, гіпоталамус та аденоппофіз, зокречерез цей рецептор на вивільнення шлунковома) та периферійних тканинах (нирки, підшлункова кишкових гормонів, як-то холецистокінін, гастрин залоза надниркові залози, серце, легені, кишечабо секретин [Т. Sugimoto et al., Molecular cloning ник, шлунок, печінка, брижі, сечовий міхур тимус, and functional expression of V1b receptor gene, in селезінка, матка, сітчатка, щитовидна залоза тоNeurohypophysis Recent Progress of Vasopressm що) та у деяких пухлинах (пухлини слизової, легеand Oxytocin Research (Молекулярне клонування нів, тощо), що свідчить про велику біологічну та функціональна екпресія гена рецептору V1b у та/або патологічну роль цих рецепторів та потеннейроппофізі: Сучасний прогрес стосовно досліційно включає залучення у різноманітних хвородження вазопресину та окситоцину, Τ. Saito, К. бах. Kurokawa та S. Yoshida ed., Elvesier Science, 1995, Як приклад, дослідження на щурах показали, 409-413]. що AVP регулює ендокринну підшлункову залозу Похідні 1,3-Дигідро -2Н-індол-2-ону розкриті у 9 77181 10 деяких патентних заявках як ліганди рецепторів прийнятними кислотами, але солі інших кислот, що арпніну-вазопресину та/або рецепторів оцитоцину: є корисними для очистки або виділення сполуки можна згадати патентні заявки WO 93/15051, ЕР формули (І), також утворюють частину винаходу. 636608, ЕР 636609, WO 95/18105, WO 97/15556 та Сполуки формули (І) можуть також існувати у WO 98/25901. формі гідратів або сольватів, тобто у формі асоціНові похідні 1,3-дигідро-2Н-індол-2-ону виявації або комбінації з одною або більше молекулалені зараз як такі, що виявляють спорідненість до ми води або з розчинником. Такі гідрати та сольрецепторів арпніну-вазопресину та/або рецепторів вати також утворюють частину винаходу. оцитоцину та селективність стосовно них, а крім Термін "галоген" означає хлор, бром, флуор того деякі з них виявляють спорідненість до рецеабо йод атом. пторів V1a. Ці похідні не виявляють спорідненості Термін "алкіл" означає алкіл з лінійним чи роздо рецепторів AVP V2. галуженим ланцюгом з 1-3 атомів карбону або з 1Таким чином, згідно з першим його аспектом 4 атомів карбону, як-то метил, етил, пропіл, ізоподним об'єктом представленого винаходу є сполуропіл, бутил, ізобутил, втор-бутил або трет-бутил. ки формули: Термін "алкоксил" означає алкоксил з лінійним чи розгалуженим ланцюгом з 1-3 атомів карбону або з 1-4 атомів карбону, як-то метоксил, етоксил, пропоксил, ізопропоксил, бутоксил, ізобутоксил, втор-бутоксил або трет-бутоксил. Переважно, винахід стосується сполук формули (І), в яких R представляє радикал вибраний з групи: в яких: n дорівнює 1 або2; X представляє групу -СН2-; -О-; -ΝΗ-; -О-СН2-; -NH-CH2-; -NH-CH2-CH2-; R1 представляє атом галогену (С1-С4)алкіл (С1С4)алкоксил; R2 представляє атом гідрогену атом галогену; (С1-С4)алкіл; (С1-С4)алкоксил; трифлуорметил; R3 представляє атом галогену; (С1-С3)алкіл; (С1-С3)алкоксил; трифлуорметил; трифлуорметоксил, R4 представляє атом гідрогену; атом галогену; (С1-С3)алкіл (С1-С3)алкоксил; R5 представляє радикал, вибраний з групи: R6 представляє (С1-С4)алкоксил; R7 представляє (С1-С4)алкоксил; а також їх солі з мінеральними або органічними кислотами, їх сольвати та/або гідрати. Сполуки формули (І) можуть містити один або більше асиметричних атомів карбону. Вони можуть таким чином існувати у формі енантіомерів або діастереоізомерів. Ці енантіомери та діастереоізомери, а також їх суміші, включаючи рацемічні суміші, утворюють частину винаходу. Сполуки формули (І) можуть існувати у формі основ або кислотно-адитивних солей. Так адитивні солі утворюють частину винаходу. Солі переважно отримують з фармацевтично Згідно з представленим винаходом, сполуки формули (І), що є кращими є сполуками, в яких R1 представляє атом хлору або метил. Згідно з представленим винаходом, сполуки формули (І), що є кращими є сполуками, в яких R2 представляє атом гідрогену, атом хлору, метил, метоксил або трифлуорметил. Згідно з представленим винаходом, сполуки формули (І), що є кращими, є сполуками, в яких R3 представляє атом хлору, атом флуор, метоксил, етоксил, ізопропоксил, трифлуорметоксил або трифлуорметил. Згідно з представленим винаходом, сполуки формули (І), що є кращими, є сполуками, в яких R4 представляє атом гідрогену або метоксил. Згідно з представленим винаходом, сполуки формули (І), що є кращими є сполуками, в яких R5 представляє 2-піридил, 3-піридил, 4-піридил, 2піримідиніл, 2-піразиніл, 3-піридазиніл або 1,3тіазол-2-іл. Згідно з представленим винаходом, сполуки формули (І), що є кращими є сполуками, в яких R6 знаходиться у позиції 2 фенілу та представляє метоксил. Згідно з представленим винаходом, сполуки формули (І), що є кращими, є сполуками, в яких R7 представляє меток сил. Особливо, сполуки формули (І), що є кращими, є сполуками, в яких n та X визначені для сполук формули (І); R1 представляє атом хлору або метил; R2 представляє атом гідрогену або знаходиться у позиції 4 або 6 індол-2-ону та представляє атом хлору, метил, метоксил або трифлуорметил; R3 представляє атом хлору, атом флуору, метоксил, етоксил, ізопропоксил, трифлуорметил або 11 77181 12 трифлуорметоксил; R6 знаходиться у позиції 2 фенілу та предстаR4 представляє атом гідрогену або меток сил; вляє метоксил; R5 представляє 2-піридил, 3-піридил, 4R7 представляє метоксил; піридил, 2-піримідиніл, 2-піразиніл, 3-піридазиніл а також їх солі з мінеральними або органічниабо 1,3-тіазол-2-іл; ми кислотами та їх сольвати та/або гідрати. R6 знаходиться у позиції 2 фенілу та предстаНаступні сполуки: вляє меток сил; 5-хлор-3-(2-етоксифеніл)-1-[(2,4R7 представляє метоксил; диметоксифеніл)сульфоніл]-3-[2-оксо-2-[4-(4а також їх солі з мінеральними або органічнипіридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індолми кислотами, та їх сольвати та/або гідрати. 2-он; Більш конкретно, сполуки формули (І), що є 5-хлор-3-(2-ізопропоксифеніл)-1-[(2,4кращими, є сполуками, в яких: диметоксифеніл)сульфоніл]-3-[2-оксо-2-[4-(4n дорівнює 1 або 2; піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індолX представляє групу -СН2-; -О-; -ΝΗ-; 2-он; R1 представляє атом хлору; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3R2 представляє атом гідрогену; (2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл R3 представляє метоксил, етоксил або ізопро4-(2-піридил)-1-піперазинкарбоксилат; поксил; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3R4 представляє атом гідрогену, (2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1Н-індолR5представляє радикал, вибраний з групи: 3-іл 4-(4-піридил)-1-піперазинкарбоксилат; N-[5-хлор-1-[(2,4-диметоксифент)-сульфонiл]3-(2-метоксифенiл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-(4-піридил)гомопіперазин-1-карбоксамід; N-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]3-(2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(3-піридил)піперазин-1-карбоксамід; R6 знаходиться у позиції 2 фенілу та предстаN-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]вляє метоксил; 3-(2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1НR7 представляє меток сил; індол-3-іл]-4-(4-піридил)піперазин-1-карбоксамід; а також їх солі з мінеральними або органічни5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3ми кислотами, та їх сольвати та/або гідрати. (2-метоксифеніл)-3-[[3-оксо-3-[4-(2-піридил)-1Більш конкретно, сполуки формули (І), що є піперазиніл]пропіл]аміно]-1,3-дигідро-2Н-індол-2кращими, є також сполуками в яких: он; n дорівнює 1; 5,6-дихлор-1-[(2,4-диметоксифеніл)X представляє групу -СН2; -О-; -ΝΗ-; сульфоніл]-3-(2-метоксифеніл)-3-[2-оксо-2-[4-(4R1 представляє атом хлору або метил; піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індолR2 представляє атом гідро гену або знахо2-он; диться у позиції 4 або 6 індол-2-ону та представ5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3ляє атом хлору; метил; метоксил; (2-метоксифеніл)-6-метил-3-[2-оксо-2-[4-(4R3 представляє атом хлору, атом флуору або піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індолметоксил; 2-он; R4 представляє атом гідрогену; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3R5 представляє радикал, вибраний з групи: (2-метоксифеніл)-6-метил-2-оксо-2,3-дигідро-1Ніндол-3-іл 4-(4-піридил)-1-піперазинкарбоксилат; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-6метокси-3-(2-метоксифеніл)-2-оксо-2,3-дигідро-1Ніндол-3-іл 4-(4-піридил)-1-піперазинкарбоксилат; N-[5-хлор-3-(2-хлорфеніл)-1-[(2,4R6 знаходиться у позиції 2 фенілу та предстадиметоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Нвляє меток сил; індол-3-іл]-4-(2-піридил)піперазин-1-карбоксамід; R7 представляє меток сил; N-[5-хлор-1-[(2,4-диметоксифеніл)-сульфоніл]а також їх солі з мінеральними або органічни3-(2-метоксифеніл)-6-метил-2-оксо-2,3-дигідро-1Нми кислотами, та їх сольвати та/або гідрати індол-3-іл]-4-(4-піридил )піперазин-1-карбоксамід; Кінцево, більш конкретно, сполуки формули N-[6-хлор-3-(2-хлорфенiл)-1-[(2,4 диметокси(І), що є кращими, є сполуками, в яких: феніл)сульфоніл]-5-метил-2-оксо-2,3-дигідро-1Нn дорівнює 1, індол-3-іл]-4-(4-піридил)піперазин-1-карбоксамід; X представляє групу -О-; -ΝΗ-; -NH-CH2-CH2-; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3R1 представляє атом хлору; (2-флуорфеніл)-3-[2-оксо-2-[4-(4-піридил)-1R2 представляє атом гідрогену; піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; R3 представляє атом хлору або меток сил; 5,6-дихлор-1-[(2,4-диметоксифеніл)R4 представляє атом гідрогену; сульфоніл]-3-(2-флуорфеніл)-3-[2-оксо-2-[4-(4R5 представляє піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол2-он; 5-хлор-3-(2,3-диметоксифеніл)-1-[(2,4диметоксифеніл)сульфоніл]-3-[2-оксо-2-[4-(4піридил)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол 13 77181 14 2-он; або, коли W представляє атом гідрогену, 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3отримана таким чином сполука формули: (2-етоксифеніл)-3-[2-оксо-2-[4-(3-піридил)-1піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3(2-iзопропоксифеніл)-3-[2-оксо-2-[4-(3-піридил)-1піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3(2-ізопропоксифеніл)-3-[2-оксо-2-[4-(4-піридил)-1гомопіперазин]етил]-1,3-дигідро -2Н-індол-2-он; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3(2-ізопропоксифеніл)-3-[2-оксо-2-[4-(1,3-тіазол-2іл)-1-піперазиніл]етил]-1,3-дигідро-2Н-індол-2-он; реагує, при наявності основи, з сульфонілга5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3логенідом формули: (2-етоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл 4(3-піридил)-1-піперазинкарбоксилат; 5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3(2-етоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл 4(4-піридил)-1-піперазинкарбоксилат; у формі оптично чистих ізомерів або у формі суміші, а також їх солі з мінеральними або органічв якій R6Ta R7 визначені для сполуки формули ними кислотами, та їх сольвати та/або гідрати, є (І), a Hal представляє атом галогену. найособливіше кращими. Як варіант, сполуку формули (І) перетворюють Згідно з іншим його аспектом об'єктом преду її сіль з мінеральними або органічними кислотаставленого винаходу є спосіб отримання сполуки ми. формули (І), що характеризується наступним: Коли Υ представляє гідроксил, реакцію сполусполука формули: ки формули (II) зі сполукою формули (III) проводять при наявності засобу сполучення, використовуваного у хімії пептидів, як-то бензотриазол-1ілокситрис(диметиламіно)фосфонію гексафлуорфосфат або бензотриазол-1ілокситрипіролідинофосфонію гексафлуорфосфат та при наявності основи, як-то триетиламін або Ν,Ν-діізопропілетиламін, у розчиннику, як-то дихлорметан або Ν,Ν-диметилформамід, при температурі між 0°С та кімнатною температурою. Коли Υ представляє атом хлору, реакцію сполуки (II) зі сполукою (III) проводять при відсутності в якій R1, R2, R3, R4 та X визначені для сполуки або наявності основи, як-то триетиламін або Ν,Νформули (І), а: діізопропілетиламін, у розчиннику, як-то дихлорΥ представляє гідроксил або атом хлору, коли метан або хлороформ та при температурі між X представляє групу -СН2-; -ОСН2-; -NH-CH2-; -NH60°C та кімнатною температурою. При відсутності СН2-СН2-; основи використовують надлишок сполуки (III). або Υ представляє феноксил, коли X предстаКоли Υ представляє феноксил, реакцію сполувляє групу -О-; -ΝΗ-; ки (II) зі сполукою (III) проводять у розчиннику, якW представляє атом гідро гену коли X предто дихлорметан, хлороформ або тетрагідрофуран ставляє групу -СН2-; -ОСН2-; або W представляє або суміші цих розчинників при температурі між кімнатною температурою та температурою кипіння розчиннику під зворотним холодильником. Це таким чином дає безпосередньо сполуку групу в якій формули (І) або сполуку формули (IV). Реакцію R6 та R7 визначені для сполуки формули (І), сполуки (IV) з сульфонілгалогенідом (V) проводять коли X представляє групу -О-; -NH-; -NH-CH2-; при наявності сильної основи, наприклад, гідрид NH-CH2-CH2-; металу, як-то натрій гідрид або алкоксид лужного реагує зі сполукою формули: металу як-то калій трет-бутоксид, у розчиннику, якто Ν,Ν-диметилформамід або тетрагідрофуран, при температурі між -70°С та кімнатною температурою. Реакцію переважно проводять, використовуючи сполуку формули (V), в як Hal представляє атом хлору. в як n та R5 визначені для сполуки формули Отримані таким чином сполуки формули (І) можна далі відокремлювати від реакційного середовища та очищати стандартними способами, наприклад кристалізацією або хроматографією. (І); коли W представляє групу , даюОтримані таким чином сполуки формули (І) чи очікувану сполуку формули (І); 15 77181 16 виділяють у формі вільної основи або солі стандахолодильником. ртними способами. На етапі d1, очікувану сполуку формули (II) Сполуки формули (II) отримують різними споотримують гідролізом у лужному середовищі способами. луки формули (IX), використовуючи гідроксид лужСполуки формули (II), в яких X представляє ного металу як-то натрій гідроксид, калій гідроксид групу -СН2-, Υ представляє гідроксил, a W предабо літій гідроксид у розчиннику, як-то вода, метаставляє гідроген, отримують згідно зі схемою 1 нол, етанол, тетрагідрофуран або діоксан або сунижче, в якій R1, R2, R3, R4 визначені для сполуки міші цих розчинників, при температурі між 0°С та формули (І), a Alk представляє (С1-С2)-алкіл. температурою кипіння розчиннику під зворотним холодильником. Сполуки формули (VI) відомі і їх отримують відомими способами, як-то описаними у WO 95/18105. Наприклад, сполуку формули (VI) отримують реакцією похідного 1Н-індол-2,3-дioну формули: в якій R1 та R2 визначені для сполуки формули (І), з магнійорганічним похідним формули: в якій R3 та R4 визначені для сполуки формули (І), a Hal представляє атом галогену, переважно бром або йод, у розчиннику, як-то тетрагідрофуран або діетиловий етер при температурі між 0°С та температурою кипіння розчиннику під зворотним холодильником. Сполуку формули (VI), в якій R3 визначено для сполуки формули (І), a R4, що не є гідрогеном, знаходиться у позиції 3 або 6 фенілу можна також отримати реакцією сполуки формули: На етапі а1 схеми 1, сполуку формули (VIII) отримують дегідроксилуванням відповідної сполуки формули (VI) дією триетилсилану згідно з Bioorganic та Medical Chemistry Letters, 1997, 7 (10), 1255-1260. Сполуку формули (VIII) можна також отримати реакцією циклізації (етап b1) сполуки формули (VII) у сильному кислотному середовищі, наприклад сульфатній кислоті або поліфосфатній кислоті способом, описаним у [WO 95/18105 або у J. Org. Chem., 1968, 3J3, 1640-1643]. На етапі с1, сполука формули (VIII) реагує зі сполукою формули Hal-CH2COOAIk, в як Hal представляє атом галогену, переважно бром або хлор, а АІк представляє (С1-С2)алкіл, при наявності основи, як-то карбонат лужного металу (наприклад калій карбонат) та йодид лужного металу (наприклад калій йодид) або при наявності сильної основи, як-то гідрид лужного металу (наприклад натрій гідрид), або алкоксид лужного металу (наприклад натрій етоксид), даючи сполуку формули (IX). Реакцію проводять у розчиннику, як-то ацетон або N,N-диметилформамід при температурі між 0°С та температурою кипіння розчиннику під зворотним в якій R3 визначено для сполуки формули (І), a R4 знаходиться у позиції 2 або 5 фенілу, з літієвим похідним, як-то н-бутиллітій, а отриманий таким чином літійований інтермедіат далі реагує зі сполукою формули (X). Реакцію проводять у розчиннику, як-то діетиловий етер, тетрагідрофуран, гексан або суміші цих розчинників при температурі між -70°С та кімнатною температурою. Похідні 1Н-індол-2,3-діону (X) є комерційно доступними або їх отримують способами, описаними у [Tetrahedron Letters, 1998, 39, 7679-7682; Tetrahedron Letters, 1994, 35, 7303-7306; J. Org. Chem., 1977, 42 (8), 1344-1348; J. Org. Chem., 1952, 17, 149-156; J. Am. Chem. Soc, 1946, 68, 2697-2703; Organic Syntheses, 1925, V, 71-74 та Advances у Heterocyclic Chemistry, A.R. Katritzky та A.J. Boulton, Academic Press, New York, 1975, 18, 2-58]. Магнійорганічні похідні (XI) отримують станда 17 77181 18 ртними способами, що добре відомі фахівцям. Зокрема, сполуки формули (VI), в якій R3 = (С1С2)алкоксил, a R4 = Н, або R, = R4 = (С1С2)алкоксил з R4 у позиції 3 або 6 фенілу, R2 не є атомом галогену, a R1 визначено для сполуки фоотримують згідно зі схемою 3 нижче, в якій R1, рмули (І), можна отримати способом, описаним у R2, R3, R4, R6 та R7 визначені для сполуки формусхемі 2. ли (І). (XII): R3 = (С1-С2)алкоксил, R4 = Н; R3 = R4 = (С1-С2)алкоксил з R4 у позиції 3 або 6; Υ = Η або Вr. На етапі а2 схеми 2, сполука формули (XII) спершу реагує з літієвим похідним, як-то нбутиллітій, при відсутності або наявності основи, як-то Ν,Ν,Ν',Ν'-тетраметилетилендіамін, а отриманий таким чином літійований інтермедіат далі реагує з діетилоксалатом, даючи сполуку формули (XIII). Реакцію проводять у розчиннику, як-то діетиловий етер, тетрагідрофуран, гексан або суміші цих розчинників при температурі між -70°С та кімнатною температурою. На етапі b2, сполука формули (XIV) спершу реагує з двома еквівалентами літієвого похідного, як-то трет-бутиллітій, та отриманий таким чином літійований інтермедіат далі реагує зі сполукою формули (XIII) даючи очікувану сполуку формули (VI). Реакцію проводять у розчиннику, як-то діетиловий етер, тетрагідрофуран, пентан або суміш цих розчинників та при температурі між -70°С та кімнатною температурою. Сполуки формули (XII) є комерційно доступними або їх синтезують звичайними способами. Сполуки формули (XIV) отримують реакцією відповідних похідних аніліну з ди-третбутилдикарбонатом звичайними способами. Сполуки формули (VII) відомі і їх отримують відомими способами, як-то розкритими у WO 95/18105 або у J. Org. Chem., 1968, 33, 1640-1643. Сполуки формули (II), в як X = -СН2-, Υ представляє атом хлору, a W = Н, отримують з відповідних сполук формули (II), в яких Υ = ОН, реакцією з тіонілхлоридом у розчиннику, як-то толуол, при температурі між 0°С та температурою кипіння розчиннику під зворотним холодильником. Сполуки формули (II), в яких -X- представляє О-, Υ представляє феноксил, а (II): Φ = -O-;Υ = феноксил; На етапі а3 схеми 3 гідроксил сполуки формули (VI) селективно захищають, використовуючи, 19 77181 20 наприклад, гексаметилдисилазан, способом, опиСполуки формули (II), в яких -X- представляє саним у [Sinthetic Communication, 1993, 23 (12), групу -О-СН2-, Υ представляє гідроксил, а W пред1633-1641]. ставляє гідроген, отримують згідно зі схемою 4 Отримана таким чином сполука формули (І) нижче, в якій R1, R2, R3, R4 визначені для сполуки реагує на етапі b3 з сульфонілгалогенідом формуформули (І). ли (V), при наявності сильної основи, в умовах, описаних вище. На етапі с3, зняття захисту триметилсилільною групою з отриманої таким чином сполуки формули (XVI) дає сполуку формули (XVIII). Реакцію проводять дією сильної кислоти, як-то гідрохлоридна кислота або трифлуороцтова кислота, у розчиннику, як-то дихлорметан, ацетон, тетрагідрофуран або вода, або суміш цих розчинників при температурі між кімнатною температурою та температурою кипіння розчиннику під зворотним холодильником. Сполука формули (XVIII) може також бути отримана реакцією на етапі d3 сполуки формули (X) з сульфонілгалогенідом формули (V), в умовах, описаних вище а потім реакцією отриманої таким чином сполуки формули (XVII) з магнійорганічним похідним формули (XI) в умовах, описаних раніше. На етапі f3, отримана таким чином сполука формули (XVIII) реагує з фенілхлорформіатом при наявності основи, як-то піридин, у розчиннику, якто дихлорметан, або без розчиннику, при температурі між 0°С та 100°С, даючи очікувану сполуку формули (II). Сполуку формули (VI) отримують способами, описаними раніше. Сполуку формули (VI) можна також отримати окисненням повітрям сполуки формули (VIII) при наявності основи, як-то натрій гідрид, та при наявності диметилдисульфіду. Сполуку формули (VI) можна також отримати гідролізом галогеніду формули: в якій R1, R2, R3 та R4 визначені для сполуки формули (І), a Hal представляє атом галогену, переважно бром або хлор. Реакцію проводять у розчиннику як-то тетрагідрофуран, при температурі між кімнатною температурою та температурою кипіння розчиннику під зворотним холодильником. Сполуки формули (XIX) відомі і їх отримують відомими способами, як-то описаними у WO 95/18105. Сполуки формули (II), в яких -X- представляє групу -NH-, Υ представляє феноксил, а W пред ставляє групу , отримують способами, описаними у WO 95/18105. На етапі а4 схеми 4, сполука формули (XIX) реагує з метилгліколятом при наявності сильної основи, як-то натрій гідрид, у розчиннику, як-то тетрагідрофуран або дихлорметан при температурі між 0°С та температурою кипіння розчиннику під зворотним холодильником. Отриману таким чином сполуку формули (XX) гідролізують на етапі b4 у лужному середовищі способами, описаними раніше на етапі d1 схеми 1, даючи очікувану сполуку формули (II). Сполуки формули (II), в яких X = -О-СН2-, Υ представляє атом хлору, a W = Н, отримують з відповідних сполук формули (II), в яких Υ = ОН реакцією з тіонілхлоридом описаним вище способом. Сполуки формули (II), в яких -X- представляє групу -NH-CH2-, Y представляє гідроксил, a W представляє групу отримують згідно зі схемою 5 нижче, в якій R1, R2, R3, R4, R6 та R7 визначені для сполуки формули (І). 21 На етапі а5 схеми 5, сполук формули (XIX) реагує з трет-бутиловим естером гліцину, при наявності основи, як-то триетиламін або Ν,Νдизопропілетиламін, у розчиннику, як-то дихлорметан, хлороформ або тетрагідро фуран або суміш цих розчинників та при температурі між 0°С та кімнатною температурою. Отримана таким чином сполука формули (XXI) реагує, на етапі b5, з сульфонілгалогенідом формули (V), при наявності сильної основи, в умовах, описаних раніше. На етапі с5, отримана таким чином сполука формули (XXII) гідролізують у кислому середовищі, використовуючи сильну кислоту, як-то гідрохлоридну кислоту або трифлуороцтову кислоту, у розчиннику, як-то дихлорметан, тетрагідрофуран, ацетон або вода, суміші цих розчинників або без розчиннику при температурі між 0°С та кімнатною температурою. Таким чином отримано очікувану сполуку формули (II). Сполуки формули (II), в яких X = -NH-CH2-, Y представляє атом хлору, a W представляє групу отримують з відповідних сполук формули (II), в яких Υ = ОН, способами, описаними раніше. Сполуки формули (І), в яких -X- представляє групу -NН-СН2-СН2-, Υ представляє гідроксил, a W представляє групу отримують згідно зі схемою 6 нижче, в якій R1, R2, R3, R4, R6 та R7 визначені для сполуки формули (І). 77181 22 На етапі а6 схеми 6, сполука формули (XIX) реагує з -аланіну трет-бутиловим естером при наявності основи, як-то триетиламін або Ν,Νдіізопропілетиламін, у розчиннику, як-то дихлорметан, хлороформ або тетрагідрофуран або суміш цих розчинників, при температурі між 0°С та кімнатною температурою. Отримана таким чином сполука формули (XXIII) реагує, на етапі b6, з сульфонілгалогенідом формули (V) при наявності сильної основи в умовах, описаних раніше. На етапі с6, отриману таким чином сполуку формули (XXIV) гідролізують у кислому середовищі в умовах, описаних раніше на етапі с5 схеми 5. Таким чином отримана очікувана сполука формули (II). Сполуки формули (II), в яких -X- = -NH-CH2CH2-, Y представляє атом хлору та W = отримують з відповідних сполук формули (II), в яких Υ = -ОН, способами описаними раніше Сполуки формули (III) є комерційно доступними або їх отримують відомими способами, які описані у [J. Org. Chem., 1953, 18, 1484-1488, J. Med. Chem. 1978, 21 (6), 536-542, Chem. Pharm. Bull., 1991, 3£ (9), 2288-2300, Tetrahedron Letters, 1998, 3JJ, 617-620 або у WO 97/28129]. Наприклад, сполуку формули (III) отримують реакцією сполуки формули: 23 в якій n визначено для сполуки формули (І), а Ζ представляє гідроген або Ν-захисну групу, зі сполукою формули Hal-R5 (XXVI) в якій R5 визначено для сполуки формули (І), a Hal представляє атом галогену, переважно хлор, бром або йод. Реакцію проводять при наявності або відсутності основи, в інертному розчиннику, як-то етанол, 2-пропанол, н-бутанол або ацетонітрил при температурі між 0°C та температурою кипіння розчиннику під зворотним холодильником. Коли використовують основу, її вибирають з органічних основ як-то дмзопропілетиламін або з карбонатів лужного металу, як-то натрій карбонат або калій карбонат. При відсутності основи, реакцію проводять, використовуючи надлишок сполуки формули (XXV). Реакцію можна також проводити без розчиннику, нагріванням суміші сполук (XXV) та (XXVI) до температур порядку 140°С та 180°С. Якщо прийнятно, коли Ζ представляє Nзахисну групу, її видаляють стандартними способами даючи очікувану сполуку формули (III). Сполуки формули (XXV) або формули (XXVI) відомі або їх отримують відомими способами. Сполуки формули (V) відомі або їх отримують відомими способами, як-то описаними у ЕР0469984 В та WO 95/18105. Наприклад, сполуки формули (V) можна отримати галогенуванням відповідних бензолсульфонових кислот або їх солей, наприклад їх солей натрію або калію. Реакцію проводять при наявності засобу галогенування, якто фосфор оксихлорид, тioнілхлорид, фосфор трихлорид, фосфор трибромід або фосфор пентахлорид, без розчиннику або в інертному розчиннику як-то галогенований вуглеводень або Ν,Νдиметилформамід, при температурі між -10°С та 200°С. 2,4-диметоксибензолсульфонілхлорид отримують згідно з [J. Am. Сhem. Soc. 1952, 74, 2008]. 3,4-диметоксибензолсульфонілхлорид є комерційно доступним або його отримують згідно з [J. Med. Chem., 1977, 20 (10), 1235-1239]. Для отримання сполук формули (І) у формі оптично чистих ізомерів можна використовувати стандартні способи відокремлення: наприклад фракційну перекристалізацію утвореної солі рацемічної основи з оптично активною кислотою, принципи якої добре відомі, або стандартні способи хірально-фазової хроматографії. Оптично чисті сполуки формули (І) можна також отримати з оптично чистих проміжних сполук, що є корисними для отримання сполуки формули (І). Таким чином, коли потрібно отримати оптично чисту сполуку формули (І) в якій -X- = -СН2-, оптичне розділення сполук формули (II) в яких -X- = СН2-, Υ = ОН, a W = Η проводять способом, описаним у [J. Am. Chem. Soc. 1989, 111, 7650-7651], використовуючи (R)-пантолактон як хіральний реагент або використовуючи хіральний амін, як-то (+}цинхонiн. Оптично чисті сполуки формули (І) в яких -X- = -О- можна отримати способом, описаним у схемі 7 нижче, в якій R1, R2, R3, R4, n та R5 визначені для 77181 24 сполуки формули (І), a R представляє феніл або ізобутил. На етапі а1 схеми 7, сполука формули (VI) реагує з фенілхлорформіатом при наявності основи, як-то піридин, у розчиннику, як-то дихлорметан або без розчиннику при температурі між 0°С та 100°С. Отримана таким чином сполука формули (XXVII) реагує на етапі b7, зі сполукою формули (III), у розчиннику, як-то дихлорметан, хлороформ або тетрагідрофуран, або суміш цих розчинників, при температурі між кімнатною температурою та температурою кипіння розчиннику під зворотним холодильником для отримання сполуки формули (XXVIII). Реакція сполуки (XXVIII) з L-лейцинолом (R = ізобутил) або D-лейцинолом або з (R)-(-)- фенілгліцинолом (R = феніл) або (S)-(+)-а-фенілгліцинолом дає на етапі с7 суміш діастереоізомерів сполуки формули (XXIX), що можна відокремлювати, наприклад, хроматографією або кристалізацією. Реакцією на етапі d7 одного з діастереоізомерів сполуки формули (XXIX) з сильною основою, як-то натрій метоксид, у розчиннику, як-то метанол або тетрагідрофуран або суміш цих розчинників, при температурі між 0°С та температурою кипіння розчиннику під зворотним холодильником, отримують оптично чисту сполуку формули (XXX). Реакція сполуки (XXX) з сульфонілгалогенідом формули (V) способами, описаними раніше, дає оптично чисту сполуку формули (І), в як X = -О-. Коли потрібно отримати оптично чисту сполуку формули (І) в якій -X- = -NH-, сполуку формули (II), в якій -X- = -NH-, Υ = феноксил, a W = , отримують у оптично чистій формі 25 77181 способом, описаним у схемі 8 нижче, в якій R1, R2, R3, R4, R6 та R7 визначені для сполуки формули (І), a Hal представляє атом галогену, переважно хлор або бром. 26 в якій: n дорівнює 1 або 2, X представляє групу -СН2-; -О-СН2-; R1 представляє атом галогену; (С1-С4)алкіл; (С1-С4)алкоксил; R2 представляє атом гідрогену; атом галогену; (С1-С4)алкіл; (С1-С4)алкоксил; трифлуорметил; R3 представляє атом галогену; (С1-С3)алкіл; (С1-С3)алкоксил; трифлуорметил; трифлуорметоксил; R4 представляє атом гідрогену; атом галогену; (С1-С3)алкіл; (С1-С3)алкоксил; R5 представляє радикал, вибраний з групи: На етапі а8 схеми 8, сполука формули (XIX) реагує з (S)-(+)- -фенілгліцинолом або (R)-(-)- фенілгліцинолом, даючи суміш діастереоізомерів сполуки формули (XXXI), що можна відокремлювати хроматографією або кристалізацією. На етапі b8, оптично чисту сполуку формули (XXXII) отримують окисненням плюмбум тетраацетатом та гідролізом у кислому середовищі одного з діастереоізомерів сполуки (XXXI). На етапі с8, реакція отриманої таким чином сполуки формули (XXXII) з сульфонілгалогенідом формули (V), а потім реакція отриманої таким чином сполуки формули (XXXIII) з фенілхлорформіатом (етап d8) способами, описаними у WO 95/18105, дає очікувану оптично чисту сполуку (II). Протягом будь-якого одного з етапів отримання сполук формули (І) або проміжних сполук формули (II), (III) або (IV), може бути необхідним та/або бажаним для захисту реакційних або чутливих функціональних груп, як-то амінна, гідроксильна або карбоксильна, представлена на будьякій одній з розглянутих молекул. Цей захист можна проводити, використовуючи звичайні захисні групи, як-то описані у [Protective Groups in Organic Chemistry, J. F. W. McOmie, Ed. Plenum Press, 1973, у Protective Groups in Organic Синтез, Τ. W. Greene та Ρ. G. Μ. Wutts, Ed. John Wiley та Sons, 1991 або у Protective Groups, Kocienski Ρ. J., 1994, Georg Thieme Verlag]. Видалення захисних груп можна проводити у придатному наступному етапі використовуючи способи відомі фахівцям, та які не впливають на залишки розглянутих молекул. N-захисними групами, що можна використовувати, є стандартні N-захисні групи, що добре відомі фахівцям, як-то, наприклад, третбутоксикарбоніл, флуоренілметоксикарбоніл, бензил, бензгідриліден або бензилоксикарбоніл. Сполуки формули (IV) є новими та утворюють частину винаходу. Таким чином, згідно з іншим його аспектом об'єктом винаходу є сполуки формули: а також їх солі з мінеральними або органічними кислотами, у формі оптично чистих ізомерів або у формі суміші. Сполуки вищенаведеної формули (І) також включають сполуки, в яких один або більше атомів гідрогену або атомів карбону заміщено їх радіоактивним ізотопом, наприклад тритієм або карбоном-14. Такі мічені сполуки є корисними у дослідженнях метаболізму або фармакокінетичних дослідженнях та у біохімічних тестах як ліганди рецептору. Наступні отримання та приклади ілюструють винахід без однак його обмеження: В отриманнях та у прикладах, використано такі скорочення: етер: діетиловий етер ізотер: дiiзопропіловий етер ДМФ: Ν,Ν-диметилформамід ТГФ: тетрагідрофуран ДХМ: дихлорметан EtOAc: етилацетат TMEDA: Ν,Ν,Ν',Ν'-тетраметилетилендіамін DIPEA: дпзопропілетиламін ТФОК: трифлуороцтова кислота HMDS: гексаметилдисилазан ВОР: бензотриазол-1ілокситрис(диметиламіно)фосфонію гексафлуорфосфат Рупор: бензотриазол-1iлокситрипіроллідинофосфонію гексафлуорфосфат DCC: 1,3-дициклогексилкарбоднмід HOST: 1-гідроксибензотриазолу гідрат Гідрохлоридний етер: насичений розчин гідрогенхлориду у діетиловому етері Темп. пл.: температура плавлення RT: кімнатною температурою 27 77181 28 Темп. кип.: температура кипіння D) 2-[5-Хлор-3-(2-метоксифеніл)-2-оксо-2,3ВЕРХ: високоефективна рідинна хроматоградигідро-1Н-індол-3-іл]оцтова кислота фія. Розчин 0,5г гранул NaOH у 10мл води додають Спектри протонного магнітного резонансу 1Н при кімнатній температурі до суміші 15г сполуки ЯМР) реєструють при 200МГц у d6-ДМСО, викориотриманої на попередньому етапі, у 30мл МеОН, стовуючи пік d6-ДМСО як внутрішній стандарт. та суміш перемішують протягом 20 годин при 20°С. Реакційну суміш концентрують під вакуумом Хімічні зсуви виражають частинах на мільйон залишок переносять у 20мл води, водну фазу (чнм-1) спостережені сигнали виражають таким промивають EtOAc та підкислюють до рН 1 додачином s: синглет, bs: широкий синглет, d: дублет; ванням концентрованої НСІ, та утворений осад dd: дубльований дублет; t триплет; dt: дубльовавідфільтровують відсмоктуванням. 115г очікуваноний триплет; q: квартет; up: нерозділений пік; mt: го продукту отримують, темп. пл. = 135-139°С. мультиплет. Отримання 1,2 Спектри ЯМР підтверджують структури сполук 2-[5-Хлор-3-(2-етоксифеніл)-2-оксо-2,3Отримання дигідро-1Н-індол-3-іл]оцтова кислота Отримання сполук формули (II) (II): R1 = СІ; R2 = Η; R3= ОСН2СН3; R4 = Η, Φ = Отримання 1,1 CH2-; Υ = OH; W = Η 2-[5-Хлор-3-(2-метоксифеніл)-2-оксо-2,3A) 1-Бром-2-етоксибензол дигідро-1Н-індол-3-іл]оцтова кислота Суміш 17,5г 2-бромфенолу, 66мл діетилсуль(II): R1 = СІ; R2 = Н; R3 = ОСН3; R4 = Н; X = фату та 170мл 10% розчину NaOH кип'ятять під СН2-; Υ = ОН; W = Η. зворотним холодильником протягом 2 годин. Після A) 5-Хлор-3-гідро кси-3-(2-метоксифеніл)-1,3охолодження реакційної суміші до кімнатної темдигідро -2Н-індол-2-он ператури, її екстрагують EtOAc та органічну фазу Цю сполуку отримують способом описаним у промивають 2Η розчином NaOH, сушать безводWO 95/18105. Розчин 2ним натрій сульфатом та розчинник випарюють під метоксифенілмагнійброміду отримують з 16г магвакуумом 19,6г очікуваного продукту отримують. нію у 35мл етеру та розчину 124г 1-бром-2B) 5-Хлор-3-(2-етоксифеніл)-3-гідрокси-1,3метоксибензолу у 175мл етеру. Цей розчин додадигідро-2Н-індол-2-он ють краплями в атмосфері аргону до суміші 30г 5Розчин 2-етоксифенілмагнійброміду, що отрихлор-1Н-індол-2,3-дioну у 250мл ТГФ, що охоломують з 2,2г магнію у 10мл етеру та з розчину джують перед тим у льодяній бані, та суміш далі 16,5г сполуки отриманої на попередньому етапі у залишають перемішуватися ι температурі дозво40мл етеру. Цей розчин додають краплями в атляють повернутися до кімнатної температури. Пісмосфері азоту до суміші 5г 5-хлор-1Н-індол-2,3ля перемішування протягом 1 години при кімнатній дioну у 20мл ТГФ, тримаючи температуру реакційтемпературі реакційну суміш виливають повільно у ного середовища нижче 35°С. Після перемішуваннасичений розчин NH4CI та ТГФ випарюють під ня протягом 2 годин при кімнатній температурі, вакуумом. Утворений осад відфільтровують відсреакційну суміш виливають у 200мл 2Η НСІ екстмоктуванням та промивають ізоетером. 42г очікурагують EtOAc, органічну фазу сушать безводним ваного продукту отримують та використовують без натрій сульфатом та розчинники випарюють під подальшої очистки на наступному етапі. вакуумом. Залишок переносять у гарячий ізоетер B) 5-Хлор-3-(2-метоксифеніл)-1,3-дигідро-2Нта залишають кристалізуватися. Утворений крисіндол-2-он талічний продукт відфільтровують відсмоктуванСуміш 5,8г сполуки, отриманої на попередням, промивають ізоетером та сушать 5,7г очікуньому етапі 25мл ТФОК та 10мл триетилсилану ваного продукту отримують темп. пл. = 251°С. кип'ятять під зворотним холодильником протягом C) 5-Хлор-3-(2-етоксифеніл)-1,3-дигідро-2Н24 годин. Реакційну суміш концентрують під вакуіндол-2-он умом при 100°С, залишок переносять у 30мл ізоеЦю сполуку отримують способом, описаним на теру та залишають стояти при 20°С протягом 15 етапі В отримання 1,1, починаючи з 4г сполуки, годин. Утворений осад відфільтровують відсмокотриманої на попередньому етапі, 15мл ТФОК та туванням та промивають ізоетером, а далі гепта5,6мл триетилсилану, 3,6г очікуваного продукту ном. 4,3г очікуваного продукту отримують. отримують. C) Етил 2-[5-Хлор-3-(2-метоксифеніл)-2-оксоD) Етил 2-[5-хлор-3-(2-етоксифеніл)-1-окса-2,32,3-дигідро-1Н-індол-3-іл]ацетат дигідро-1Н-індол-3-іл]ацетат Суміш 2,85г сполуки, отриманої на попередЦю сполуку отримують способом, описаним на ньому етапі, 2,05г етилбромацетату, 2,05г ΚΘ та етапі С отримання 1,1, починаючи з 3,5г сполуки, 3,1г калій карбонату у 15мл ацетону кип'ятять під отриманої на попередньому етапі, 2,2г етилброзворотним холодильником протягом 20 годин. Мімацетату, 2,1г ΚΘ та 3 5г калій карбонату у 20мл неральні солі відфільтровують та фільтрат концеацетону, 1,7г очікуваного продукту отримують піснтрують під вакуумом. Залишок екстрагують ля осадження з ізоетеру, темп. пл. = 181°С. EtOAc, органічну фазу промивають водою та суE) 2-[5-Хлор-3-(2-етоксифеніл)-2-оксо-2,3шать безводним натрій сульфатом i розчинник дигідро-1Н-індол-3-іл]оцтова кислота випарюють під вакуумом. Залишок розтирають в Суміш 1,65г сполуки, отриманої на попередізоетері та утворений осад відфільтровують відсньому етапі, та 2мл 30% розчину NaOH у 50мл моктуванням. Осад хроматографують на силікагеводи i 20мл ТГФ перемішують при кімнатній темлі, елюючи ДХМ та далі EtOAc. 1,55г очікуваного пературі протягом 24 годин. Суміш концентрують продукту отримують після перекристалізації з ізоепід вакуумом, залишок переносять у 100мл води, теру, темп. пл. = 184-187°С. 29 77181 30 водну фазу промивають EtOAc та підкислюють до Розчин 1г гранул NaOH у 10мл води додають, рН 1 додаванням концентрованої НСІ, та екстрапри 40°С, до розчину 1,6г сполуки, отриманої на гують EtOAc, органічну фазу промивають водою та попередньому етапі, у 10мл ЕtOН, та суміш пересушать безводним натрій сульфатом i розчинник мішують протягом 20 годин при 20°С. Утворену випарюють під вакуумом. 1,2г очікуваного продуксуміш концентрують під вакуумом, залишок перету отримують після кристалізації з ізотеру, темп. носять у 30мл води та гріють до 40°С, та нерозпл. = 212°С. чинний матеріал відфільтровують фільтрат підкиОтримання 1,3 слюють до рН 1 додаванням концентрованої НСІ, 2-[5-Хлор-3-(2-ізопропоксифеніл)-2-оксо-2,3та утворений осад відфільтровують відсмоктувандигідро-1Н-індол-3-іл]оцтова кислота, правооберням ι сушать 1,15г очікуваного продукту отримутовий ізомер ють, темп. пл. = 146-148°С. (II) R1 = СІ; R2 = Η; R3 = ОСН(СН3)2; F) (3R)-4,4-диметил-2-оксотетрагідро-3R4=Η; Φ=-CH2-; Υ = OH; W = Η фураніл 2-[5-хлор-3-(2-ізопропоксифеніл)-2-оксоА) 1-Бром-2-ізопропоксибензол 2,3-дигідро-1Н-індол-3-іл]ацетат, більш полярний Розчин натрій етоксиду отримують з 280мл ізомер ЕtOН та 7,3г натрію, 50г 2-бромфенолу додають та Суміш 2г сполуки, отриманої на попередньому суміш перемішують при кімнатній температурі проетапі та 10мл тioнілхлориду перемішують при 20°С тягом 30 хвилин. 43г ізопропілброміду далі додапротягом 20 годин. Суміш концентрують під вакуують та суміш кип'ятять під зворотним холодильнимом, залишок переносять у ДХМ та розчинник ком протягом 15 годин. Реакційну суміш концентрують під вакуумом при кімнатній темпеконцентрують під вакуумом, залишок переносять у ратурі даючи 2г хлорангідриду. Хлорангідрид роз1Η розчин NaOH та екстрагують етером, органічну чиняють у 20мл ДХМ, цей розчин додають до суфазу сушать безводним натрій сульфатом та розміші 0,8г of (R)-пантолактону та 1г Nчинник випарюють під вакуумом. Утворене масло метилпіролідину у 10мл ДХМ попередньо охолопереганяють під зменшеним тиском отримуючи дженої до 10°С, та утворену суміш перемішують 49,3г очікуваного продукту у формі безбарвної при кімнатній температурі протягом 2 годин. Реакрідини, темп. кип. = 113-115°С при 3366Па. ційну суміш концентрують під вакуумом, залишок B) 5-Хлор-3-гідрокси-3-(2-ізопропоксифеніл)переносять у воду та екстрагують EtOAc. Органіч1,3-дигідро-2Н-індол-2-он ну фазу промивають водою та сушать безводним Розчин 2-ізопропоксифенілмагнійброміду натрій сульфатом, а розчинник випарюють під ваотримують з 6,3г магнію у 20мл етеру та 49,3г спокуумом. Залишок хроматографують на силікагелі луки, отриманої на попередньому етапі. Цей розН, елюючи ДХМ, діастереоізомери відокремлюють чин додають протягом 3 хвилин до суміші 13,3г 5та більш полярну сполуку збирають, 0,6г очікувахлор-1Н-індол-2,3-дioну у 30мл ТГФ, а потім кип'яного продукту отримують. тять під зворотним холодильником протягом 90 G) 2-[5-Хлор-3-(2-ізопропоксифеніл)-2-оксохвилин. Після охолодження до кімнатної темпера1,3-дигідро-1Н-індол-3-іл]оцтова кислота правоотури реакційну суміш виливають у суміш бертовий ізомер лід/концентрована НСІ та екстрагують EtOAc, орРозчин 0,8г моногідрату літій гідроксиду у ганічну фазу промивають 1Η розчином NaOH та 10мл води додають до суміші 08г сполуки отримаводою, та сушать безводним натрій сульфатом, та ної на попередньому етапі у 30мл МеОН та суміш розчинник випарюють під вакуумом. Залишок пеперемішують при 20°С протягом 20 годин. Реакреносять у гарячий ізоетер та утворений осад відційну суміш концентрують під вакуумом, залишок фільтровують відсмоктуванням, після розтирання екстрагують водою та водну фазу промивають отримують 17,4г очікуваного продукту. етером, підкислюють до рН 1 додаванням конценC) 5-Хлор-3-(2-ізопропоксифеніл)-1,3-дигідротрованої НСІ та екстрагують ДХМ, органічну фазу 2Н-індол-2-он сушать безводним натрій сульфатом та розчинник Суміш 3,5г сполуки, отриманої на попередвипарюють під вакуумом, 0,5г очікуваного продукньому етапі, 15мл ТФОК та 5,5 л триетилсилану ту отримують. 20 кип'ятять під зворотним холодильником протягом D = +84° (с = 0,25, хлороформ) 8 годин. Суміш концентрують під вакуумом та заОтримання 1,4 лишок хроматографують на силікагелі, елюючи 2-[3-(2-хлорфеніл)-5-метил-2-оксо-2,3-дигідроізоетером та далі ДХМ 2,2г очікуваного продукту 1Н-індол-3-іл]оцтова кислота отримують після кристалізації з гептану темп. пл. = (II): R1 = СН3; R2 = Η; R3 = СІ; R4 = Η; Φ = -CH2-; 154°С. Υ = OH; W = Η D) Етил 2-[5-хлор-3-(2-ізопропоксифеніл)-2A) 3-(2-Хлорфеніл)-5-метил-1,3-дигідро-2Ноксо-2,3-дигідро-1Н-індол-3-іл]ацетат індол-2-он Цю сполуку отримують способом, описаним на Цю сполуку отримують способом, описаним у етапі С отримання 1,1, починаючи з 2,55г сполуки, WO 95/18105 на етапах А та В отримання 65. отриманої на попередньому етапі, 1,67г етилброB) Метил 2-[3-(2-хлорфеніл)-5-метил-2-оксомацетату, 1,66г ΚΘ та 2,52г калій карбонату у 12мл 2,3-дигідро-1Н-індол-3-іл]ацетат ацетону. Отриманий продукт хроматографують на Суміш 5г сполуки, отриманої на попередньому оксид алюмінію, елюючи ДХМ та далі з ацетон 1,6г етапі, у 10мл ДМФ охолоджують до температури очікуваного продукту отримують після кристалізанижче 10°С, 0,87г 60% натрій гідриду у маслі доції з ізоетеру, темп. пл. = 193°С. дають порціями та суміш перемішують протягом E) 2-[5-Хлор-3-(2-ізопропоксифеніл)-2-оксо-2,330 хвилин. 3,15мл метилбромацетату далі додадигідро-1Н-індол-3-іл]оцтова кислота ють суміш перемішують при кімнатній температурі 31 77181 32 протягом 4 годин, крім того 1мл метилбромацетату калій карбонату у 25мл ацетону кип'ятять під зводалі додають та суміш перемішують при кімнатній ротним холодильником протягом 16 годин. Мінетемпературі протягом 16 годин. Реакційну суміш ральні солі відфільтровують та фільтрат концентвиливають у воду та екстрагують EtOAc, органічну рують під вакуумом. Залишок хроматографують на фазу промивають водою та сушать безводним силікагелі елюючи ДХМ та далі EtOAc. 2,6г очікунатрій сульфатом, а розчинник випарюють під ваваного продукту отримують після кристалізації з куумом. Залишок хроматографують на силікагелі, ізоетеру, темп. пл. = 214-219°C. елюючи ДХМ та далі сумішшю ДХМ/EtOAc (95/5 за Ε) 2-[5,6-Дихлор-3-(2-метоксифеніл)-2-оксооб'ємом), 0,57г очікуваного продукту отримують. 2,3-дигідро-1Н-індол-3-іл]оцтова кислота С) 2-[3-(2-Хлорфеніл)-5-метил-2-оксо-2,33мл 2Η розчину NaOH додають до суміші 2,5г дигідро-1Н-індол-3-іл]оцтова кислота сполуки, отриманої на попередньому етапі, у 50мл Розчин 0,16г гранул NaOH у 40мл води додаМеОН, та суміш перемішують протягом 48 годин ють до суміші 0,57г сполуки, отриманої на поперепри 20°С. Утворену суміш концентрують під вакуудньому етапі, у 10мл діоксану, та утворену суміш мом, залишок переносять у 30мл води, нерозчинперемішують при кімнатній температурі протягом ний матеріал відфільтровують фільтрат підкислю24 годин. 50мл води додають до реакційної суміші, ють до рН 1 додаванням концентрованої НСІ та водну фазу промивають EtOAc, підкислюють до екстрагують EtOAc, органічну фазу промивають рН 1 додаванням 1Η НСІ та екстрагують EtOAc, водою та сушать безводним натрій сульфатом i органічну фазу сушать безводним натрій сульфарозчинник випарюють під вакуумом. 2г очікуваного том та розчинник випарюють під вакуумом. Залипродукту отримують після кристалізації з ізоетеру, шок хроматографують на силікагелі,елюючи сумітемп. пл. = 222-224°C. шшю ДХМ/EtOAc (95/5: за об'ємом), 0,27г Отримання 1,6 очікуваного продукту отримують. 2-[5-Хлор-3-(2-метоксифеніл)-6-метил-2-оксоОтримання 1,5 2,3-дигідро-1Н-індол-3-іл]оцтова кислота 2-[5,6-Дихлор-3-(2-метоксифеніл)-2-оксо-2,3(II): R1 = СІ; R2 = 6-СН3; R3 = ОСН3, R4 = Η; Φ = дигідро-1Н-індол-3-іл]оцтова кислота -СН2-; Υ = ОН; W = Η (II): R1 = СІ; R2= 6-СІ; R3 = ОСН3; R4 = Н; X = A) Етил 2-(2-метоксифеніл)-2-оксоацетат СН2-; Υ = ОН; W = Η Розчин 27г 1-бром-2-метокси-бензолу у 270мл A) 5,6-Дихлор-1Н-індол-2,3-дioн етеру охолоджують до -70°С в атмосфері аргону, Цю сполуку отримують способом, описаним у 90мл 1,6М розчину н-бутил-літію у пентані дода[J. Am. Chem. Soc., 1946, 68, 2697-2703 або спосоють краплями та суміш далі перемішують протябом, описаним у J. Org. Chem., 1952, 1/7, 149-156]. гом 45 хвилин. 78мл діетилоксалату додають швиB) 5,6-Дихлор-3-гідрокси-3-(2-метоксифеніл)дко та суміш перемішують, дозволяючи 1,3-дигідро-2Н-індол-2-он температурі повернутися до кімнатної. Після пе7,5г 1-бром-2-метоксибензол додають крапляремішування протягом 1 години при кімнатній темми до суспензії 1,1г магнію у 20мл етеру, що міспературі насичений розчин NH4CI додають до реатить кілька кристалів of йод, кипіння під зворотним кційної суміші, фази відокремлюють холодильником продовжують після його початку. відстоюванням, водну фазу екстрагують етером, Наприкінці додавання, суміш гріють при темперакомбіновані органічні фази промивають водою та турі кипіння під зворотним холодильником протянасиченим розчином NaCI i сушать безводним гом 2 годин. Суспензію 4,3г 5,6-дихлор-1Н-індолнатрій сульфатом та розчинники випарюють під 2,3-дioну у 20мл ТГФ далі додають та утворену вакуумом, надлишок діетилоксалату видаляють суміш кип'ятять під зворотним холодильником перегонкою під вакуумом (темп. кип. = 87°С при протягом 30 хвилин. Після охолодження до кімна2000Па). Утворений продукт хроматографують на тної температури, реакційну суміш виливають у силікагелі, елюючи сумішшю ДХМ/гексан (50/50, за суміш лід/концентрована НСІ та екстрагують об'ємом) та далі ДХМ. Отриманий продукт очищаEtOAc, органічну фазу сушать безводним натрій ють перегонкою під вакуумом 13г очікуваного просульфатом та розчинник випарюють під вакуумом. дукту отримують, темп. кип. = 110°С при 3Па. Залишок розтирають у гарячому ізоетері та утвоB) 5-Хлор-3-гідрокси-3-(2-метоксифеніл)-6рений осад відфільтровують відсмоктуванням i метил-1,3-дигідро-2Н-індол-2-он промивають етером. 5,2г очікуваного продукту a) трет-Бутил 4-хлор-3-метилфенілкарбамат отримують, темп. пл. = 245-246°С. Суміш 10г 4-хлор-3-метиланіліну та 15,26г диC) 5,6-Дихлор-3-(2-метоксифеніл)-1,3-дигідротрет-бутилдикарбонату у 50мл діоксану перемі2Н-індол-2-он шують при кімнатній температурі протягом 24 гоСуміш 5,1г сполуки, отриманої на попереддин. Реакційну суміш концентрують під вакуумом ньому етапі, 25мл ТФОК та 10мл триетилсилану та залишок хроматографують на силікагелі, елююкип'ятять під зворотним холодильником протягом чи сумішшю ДХМ/гексан градієнт від (50/50, за 15 годин. Суміш концентрують під вакуумом, заоб'ємом) до (70/30 за об'ємом). 5 6г очікуваного лишок розтирають у гептані та утворений осад продукту отримують та використовують без подавідфільтровують відсмоктуванням, 4,8г очікуванольшої очистки. го продукту отримують після кристалізації з ізоеb) розчин 5г трет-бутил 4-хлор-3теру, темп. пл. = 195-197°С. метилфенілкарбамату у 45мл етеру охолоджують D) Етил 2-[5,6-дихлор-3-(2-метоксифеніл)-2до -70°С в атмосфері аргону, 30мл 1,5М розчин оксо-2,3-дигідро-1Н-індол-3-іл]ацетат трет-бутиллітію у пентані додають краплями, суСуміш 4,8г сполуки, отриманої на попередміш перемішують протягом 1 годин, дозволяючи ньому етапі, 2,7г етилбромацетату 2,7г КІ та 4,4г температурі зрости до -10°С та перемішують про 33 77181 34 тягом 1 годин 45 хвилин при -10°С. Реакційну су1Η НСІ та сушать безводним натрій сульфатом а міш охолоджують до -70°С, розчин 5г сполуки, розчинник випарюють під вакуумом. Залишок хроотриманої на етапі у 25мл ТГФ додають краплями, матографують на силікагелі, елюючи сумішшю суміш перемішують протягом 1 години та дозвоізоетер/пентан (50/50, за об'ємом). 8г очікуваного ляють нагрітися до -30°С, та далі перемішують продукту отримують у формі масла, яке кристаліпротягом ночі, дозволяючи температурі повернузується, темп. пл. = 111°С. тися до кімнатної температури. Насичений розчин В) 5-Хлор-6-метил-1Н-індол-2,3-діон NH4CI додають до реакційної суміші, ТГФ випарюСуміш 8г сполуки, отриманої на попередньому ють, утворену водну фазу екстрагують три рази етапі та 60мл 3Η НСІ у 80мл ТГФ кип'ятять під EtOAc, органічну фазу промивають водою, насизворотним холодильником протягом 2 годин. Реаченим розчином NaCI та сушать безводним натрій кційну суміш концентрують під вакуумом, залишок сульфатом, розчинник частково випарюють та переносять у EtOH та розчинник концентрують кристалічний продукт відфільтровують відсмоктузнов під вакуумом. Залишок переносять у EtOH та ванням. 2,6г очікуваного продукту отримують, утворений осад відфільтровують відсмоктуванням темп. пл. = 254-256°С. та промивають ізоетером. 1,9г очікуваного продукC) 5-Хлор-3-(2-метоксифеніл)-6-метил-1,3ту отримують. дигідро-2Н-індол-2-он С) 5-Хлор-3-гідрокси-3-(2-ізопропоксифеніл)-6Суміш 3г сполуки, отриманої на попередньому метил-1,3-дигідро-2Н-індол-2-он етапі, 15мл ТФОК та 6мл триетилсилану кип'ятять 3,2г 1-бром-2-ізопропоксибензолу додають під зворотним холодильником протягом 15 годин. краплями до суспензії 0,36г магнію у 10мл етеру, Суміш концентрують під вакуумом та залишок розкипіння під зворотним холодильником продовжутирають у пентані, отримуючи 2,85г очікуваного ють після його початку. Наприкінці додавання супродукту, темп. пл. = 193°С. міш гріють при температурі кипіння під зворотним D) Етил 2-[5-хлор-3-(2-метоксифеніл)-6-метилхолодильником протягом 2 годин. Розчин 1,8г спо2-оксо-2,3-дигідро-1Н-індол-3-іл]ацетат луки, отриманої на попередньому етапі, у 30мл Суміш 2,8г сполуки, отриманої на попередТГФ далі додають одною порцією та суміш кип'яньому етапі, 1,7г етилбромацетату 17г КІ та 2,7г тять під зворотним холодильником протягом 30 калій карбонату у 15мл ацетону кип'ятять під звохвилин. Після охолодження до кімнатної темпераротним холодильником протягом 16 годин. Мінетури. реакційну суміш виливають у суміш ральні солі відфільтровують та фільтрат концентлід/концентрована НСІ та екстрагують EtOAc, оррують під вакуумом 2,35г очікуваного продукту ганічну фазу сушать безводним натрій сульфатом отримують після кристалізації з ізоетеру, темп. пл. та розчинник випарюють під вакуумом. Залишок = 170°С. розтирають у гарячому ізоетері та утворений осад E) 2-[5-Хлор-3-(2-метоксифеніл)-6-метил-2відфільтровують відсмоктуванням та промивають оксо-2,3-дигідро-1Н-індол-3-іл]оцтова кислота гарячим EtOAc. 1,8г очікуваного продукту отримуСуміш 2,3г сполуки, отриманої на попередють та використовують без подальшої очистки. ньому етапі, та 3,5г 12Η розчину NaOH у 100мл D) 5-Хлор-3-(2-ізопропоксифеніл)-6-метил-1,3МеОН та 5мл води перемішують при 20°С протядигідро-2Н-індол-2-он гом 20 годин. Суміш концентрують під вакуумом, Суміш 2,3г сполуки, отриманої на попередзалишок переносять у 30мл води, підкислюють до ньому етапі, 15мл ТФОК та 3,8мл триетилсилану рН 1 додаванням концентрованої НСІ та екстрагукип'ятять під зворотним холодильником протягом ють EtOAc, органічну фазу промивають водою та 10 годин. Утворену суміш концентрують під вакуусушать безводним натрій сульфатом, а розчинник мом (13Па), залишок розтирають у пентані та випарюють під вакуумом 1,3г очікуваного продукту утворений осад відфільтровують відсмоктуванням. отримують після кристалізації з ізоетеру, темп. пл. Осад хроматографують на силікагелі, елюючи = 214-216°С. ДХМ. 0,85г очікуваного продукту отримують, темп. Отримання 1,7 пл. = 145-146°С. 2-[5-Хлор-3-(2-ізопропоксифеніл)-6-метил-2E) Етил 2-[5-хлор-3-(2-ізопропоксифеніл)-6оксо-2,3-дигідро-1Н-індол-3-іл]оцтова кислота метил-2-оксо-2,3-дигідро-1Н-індол-3-іл]ацетат (II): R1 = СІ; R2 = 6-СН3; R3 = ОСН(СН3)2; R4 = Суміш 0,8г сполуки, отриманої на попередΗ; Φ = -СН2-; Υ = ОН; W = Η ньому етапі, 0,53г етилбромацетату, 0,53г ΚΘ та А) Етил 2-[2-[(трет-бутоксикарбоніл)аміно]-50,8г калій карбонату у 6мл ацетону кип'ятять під хлор-4-метилфеніл]-2-оксоацетат зворотним холодильником протягом 15 годин. МіРозчин 5,9г трет-бутил 4-хлор-3неральні солі відфільтровують, фільтрат концентметилфенілкарбамату у 60мл етеру охолоджують рують під вакуумом, залишок екстрагують ДХМ, до -50°С в атмосфері азоту, 42мл розчину треторганічну фазу промивають водою та нерозчинний бутиллiтiю у пентані додають краплями та суміш матеріал відфільтровують, фільтрат хроматограперемішують протягом 2 годин, дозволяючи темфують на силікагелі, елюючи ДХМ та далі сумішпературі зрости до -20°С. Реакційну суміш охолошю ДХМ/EtOAc (70/30; за об'ємом). 0,55г очікуваджують до -70°С, розчин 4,5г діетилоксалату у ного продукту отримують, темп. пл. = 152-154°С. 30мл ТГФ додають краплями та утворену суміш F) 2-[5-Хлор-3-(2-ізопропоксифеніл)-6-метил-2перемішують протягом 1 години, дозволяючи темоксо-2,3-дигідро-1Н-індол-3-іл]оцтова кислота пературі повернутися до 20°С. Реакційну суміш Суміш 0,53г сполуки, отриманої на попередвиливають у насичений розчин NH4CI фази відоньому етапі, та 0,25г гранул NaOH у 20мл МеОН та кремлюють відстоюванням, водну фазу екстрагу5мл води перемішують при 25°С протягом 20 гоють EtOAc комбіновані органічні фази промивають дин. Суміш концентрують під вакуумом, залишок 35 77181 36 розчиняють у 20мл води та підкислюють до рН 1 розчинник випарюють під вакуумом. Залишок хрододаванням концентрованої НСІ, та утворений матографують на силікагелі, елюючи ізоетером осад відфільтровують відсмоктуванням 0,45г очі1,05г очікуваного продукту отримують після крискуваного продукту отримують після кристалізації з талізації з ізоетеру, темп. пл. = 212-213°С. суміші ізоетер/пентан (50/50, за об'ємом), темп. пл. Отримання 1,9 = 148-150°С. 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3Отримання 1,8 (2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1H-індол5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-33-іл феніл карбонат (2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл фенілкарбонат (II): R1 = СІ; R2 = Η; R3 = ОСН3; R4 = Η, А)5-Хлор-3-(2-метоксифеніл)-3[(триметилсиліл)окси]-1,3-дигідро-2Н-індол-2-он Суміш 2,9г сполуки, отриманої на етапі А отримання 1,1 та 0,16г безводного цинк хлориду у 40мл ацетонітрилу гріють до температури кипіння під зворотним холодильником, 1,7г HMDS додають та суміш кип'ятять під зворотним холодильником протягом 1 години. Утворену суміш концентрують під вакуумом залишок екстрагують EtOAc, органічну фазу промивають водою сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом 2,4г очікуваного продукту отримують після кристалізації з ізоетеру, темп. пл. 185-187°С. B) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-метоксифеніл)-3-[(триметилсиліл)окси]-1,3дигідро-2Н-індол-2-он 0,17г 60% натрій гідриду у маслі додають до суміші 2,4г сполуки, отриманої на попередньому етапі, у 30мл ТГФ, та суміш перемішують протягом 20 хвилин при кімнатній температурі 1,7г 2,4диметокси-бензолсульфонілхлориду далі додають та суміш перемішують протягом 1 годин при кімнатній температурі. Утворену суміш концентрують під вакуумом, залишок екстрагують EtOAc, органічну фазу промивають водою та сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом 2,65г очікуваного продукту отримують після кристалізації з ізоетеру темп. пл. = 157-158°С. C) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]3-гідрокси-3-(2-метоксифеніл)-1,3-дигідро-2Ніндол-2-он Суміш 2,4г сполуки, отриманої на попередньому етапі, та 10мл ТФОК у 20мл ДХМ перемішують протягом 4 годин при 20°С. Суміш концентрують під вакуумом, залишок екстрагують EtOAc, органічну фазу промивають 10% розчином Na2CO3 та сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом 1,75г очікуваного продукту отримують після кристалізації з ізоетеру, темп. пл. = 153-160°С. D) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3іл фенілкарбонат Суміш 1,6г сполуки, отриманої на попередньому етапі та 1г фенілхлорформіату у 20 піридину перемішують протягом 3 діб при 20°С. Суміш концентрують під вакуумом, залишок екстрагують EtOAc органічну фазу промивають 10% розчином АсОН та сушать безводним натрій сульфатом, а A) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]1Н-індол-2,3-дioн (II): R1 = СІ; R2 = Η; R3 = ОСН(СН3)2; R4 = Η, 0,5г 60% натрій гідриду у маслі додають до суміші 3,6г 5-хлор-1Н-індол-2,3-дioну у 20мл ДМФ, та суміш перемішують протягом 30 хвилин при 20°С. 4,8г 2,4-диметоксибензол-сульфонілхлориду далі додають та суміш перемішують при 20°С протягом 1 години. Утворену суміш концентрують під вакуумом (1,3Па), залишок екстрагують EtOAc, органічну фазу промивають водою та сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом. Залишок розтирають в ізоетері та утворений осад відфільтровують відсмоктуванням 2,9г очікуваного продукту отримують після кристалізації з гарячого EtOAc, темп. пл.. = 194,5°С. B) 5-Хлор-1-[(2,4-диметоксифеніл )сульфоніл]3-гідрокси-3-(2-ізопропоксифеніл)-1,3-дигідро-2Ніндол-2-он Розчин 2-ізопропоксифенілмагнійброміду отримують з 0,5г магнію у 20мл ТГФ та 4г 1-бром2-ізопропоксибензолу. Цей розчин додають краплями при кімнатній температурі до суміші 4,8г сполуки, отриманої на попередньому етапі, у 50мл ТГФ, а потім кип'ятять під зворотним холодильником протягом 1 години. Після охолодження до кімнатної температури, реакційну суміш виливають у суміш лід/6Η НСІ та екстрагують EtOAc, органічну фазу промивають водою та сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом. Залишок хроматографують на силікагелі, елюючи сумішшю ДХМ/МеОН (99/1, за об'ємом). 3,8г очікуваного продукту отримують. С) 5-Хлоp-1-(2,4-диметоксифеніл)сульфоніл]3-{2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1Ηіндол-3-іл фенілкарбонат Суміш 1г сполуки, отриманої на попередньому етапі та 1,4г фенілхлорформіату у 10 піридину перемішують при кімнатній температурі протягом 48 годин. Суміш концентрують під вакуумом залишок екстрагують EtOAc, органічну фазу промивають водою, 1Η розчином НСІ, водою та сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом. 0,86г очікуваного продукту отримують після кристалізації з ізотеру, темп. пл. = 197°С. Отримання 1,10 Феніл 5-хлор-3-[(2-ізопропоксифеніл)-2-оксо-3[(феноксикарбоніл)окси]-1-індолінкарбоксилат (XXVII): R1 = СІ, R2 = Η; R3 = ОСН(СН3)2; R4 = Η Суміш 6,34г сполуки, отриманої на етапі В отримання 1,3 у 60 піридину гріють до 70°С, 7г 37 77181 38 фенілхлорформіату додають краплями та суміш [J. Org. Chem., 1968, 33, 2565-2566]. Цю сполуку далі перемішують при 70°С протягом 3 годин та можна також отримати наступним нижченаведепри кімнатній температурі протягом ночі. Реакційним способом. Суміш 17,4г 2-флуорбензальдегіду ну суміш виливають у воду та екстрагують ДХМ та 9,6г калій ціаніду у 30мл етеру охолоджують до органічну фазу промивають водою та сушать безтемператури нижче 10°С, 15мл концентрованої водним натрій сульфатом, а розчинник випарюють НСІ додають протягом 30 хвилин та утворену супід вакуумом. Залишок хроматографують на силіміш перемішують при кімнатній температурі протякагелі елюючи ДХМ. Отриманий продукт розтирагом 2 годин. Після відокремлення of фази відстоюють в ізоетері та утворений осад відфільтровують ванням, органічну фазу сушать безводним натрій відсмоктуванням. 5г очікуваного продукту отримусульфатом та розчинник випарюють під вакуумом. ють. Отриманий таким чином сирий продукт переносять Отримання 1,11 у 20мл концентрованої НСІ та кип'ятять під зворо5-Хлор-3-(2-хлорфеніл)-1-[(2,4тним холодильником протягом 5 годин. Після оходиметоксифеніл)-сульфоніл]-2-оксо-2,3-дигідролодження до кімнатної температури, реакційну 1Н-індол-3-іл феніл карбонат суміш екстрагують етером, органічну фазу проми(II): R1 = CI; R2 = H; R3 = CI; R4 = H, X = вають водою та сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом 17,5г очікуваного продукту отримують після кристалізації з ізотеру. В) N-п-Хлорфеніл-DL-2-флуорманделамід Суміш 17,5г сполуки, отриманої на попередньому етапі, та 13г п-хлораніліну у 100мл 1,2А) 5-Хлор-3-(2-хлорфеніл)-1-[(2,4дихлорбензолу кип'ятять під зворотним холодильдиметоксифеніл)сульфоніл]-3-гідрокси-1,3-дигідроником протягом 3 годин з видаленням утвореної 2Н-індол-2-он води за допомогою апарата Дина-Старка. Після Розчин 2-хлорфенілмагнійброміду отримують охолодження до кімнатної температури, суміш з 0,4г магнію, 0,01г йоду, 20мл етеру та 2,9г 1залишають кристалізуватися Утворений осад відбром-2-хлорбензолу. Суміш 2,8г сполуки, отримафільтровують відсмоктуванням та розчиняють у ної на етапі А отримання 1,9, у 30мл ТГФ додають EtOAc, органічну фазу промивають двічі 4Η розчидо цього розчину при кипінні під зворотним холоном НСІ та сушать безводним натрій сульфатом, а дильником, протягом 1 хвилини, та утворену суміш розчинник випарюють під вакуумом 16,2г очікуватримають при кипінні під зворотним холодильниного продукту отримують після кристалізації з ізоком протягом 20 хвилин. Після охолодження до теру. кімнатної температури, реакційну суміш виливаC) 5-Хлор-3-(2-флуорфеніл)-1,3-дигідро-2Нють у суміш лід/концентрована НСІ та екстрагують індол-2-он EtOAc, органічну фазу промивають водою та су16,1г сполуки, отриманої на попередньому шать безводним натрій сульфатом, а розчинник етапі, додають при кімнатній температурі до суміші випарюють під вакуумом. Залишок хроматографу64мл концентрованої (95%) H2SO4 та 16мл димляють на силікагелі, елюючи ізоетером та далі ДХМ чої сульфатної кислоти (30% олеум), та суміш далі 1,55г очікуваного продукту отримують у формі піни перемішують протягом 8 годин. Реакційну суміш яку використовують без подальшої очистки. виливають у суміш лід/вода та екстрагують EtOAc, B) 5-Хлор-3-(2-хлорфеніл)-1-[(2,4органічну фазу промивають двічі водою та сушать диметоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Нбезводним натрій сульфатом, а розчинник випаіндол-3-іл фенілкарбонат рюють під вакуумом. 12,2г очікуваного продукту Суміш 0,65г сполуки, отриманої на попередотримують після кристалізації з ізоетеру. ньому етапі, та 0,3г фенілхлорформіату у 5 піриD) 3-Бром-5-хлор-3-(2-флуорфеніл)-1,3дину перемішують при 20°С протягом 20 годин. дигідро-2Н-індол-2-он Суміш концентрують під вакуумом, залишок екстРозчин 0,78мл брому у 20мл хлороформу дорагують EtOAc, органічну фазу промивають 1Η дають, повільно при кімнатній температурі до розрозчином НСІ, 1Η розчином NaOH та водою та чину 4г сполуки, отриманої на попередньому етапі, сушать безводним натрій сульфатом, а розчинник у 100мл хлороформу. Реакційну суміш концентрувипарюють під вакуумом 0,6г очікуваного продукту ють під вакуумом, отримуючи 4г очікуваного проотримують після кристалізації з ізотеру, темп. пл. = дукту після кристалізації з ізоетеру. 222-223°С. E) 5-Хлор-3-(2-флуорфеніл)-5-гідрокси-1,3Отримання 1,12 дигідро-2Н-індол-2-он 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3Суміш 2г сполуки, отриманої на попередньому (2-флуорфеніл)-2-оксо-2,3-дигідро-1Н-iндол-3-іл етапі, у 5мл води та 20мл ТГФ кип'ятять під зворофенілкарбонат тним холодильником протягом 20 годин. Суміш (II): R1 = CI; R2 = H; R3 = F; R4 = H, концентрують під вакуумом, залишок переносять у 10% розчин натрій карбонату та утворений осад відфільтровують відсмоктуванням. 1,45г очікуваного продукту отримують після кристалізації з ізоетеру, темп. пл. = 265°С (розкл). F) 5-Хлор-3-(2-флуорфеніл)-3[(триметилсиліл)окси]-1,3-дигідро-2Н-індол-2-он А) D,L-2-Флуормигдальна кислота Суміш 1,4г сполуки, отриманої на попередЦю сполуку отримують способом, описаним у 39 77181 40 ньому етапі, та 0,12г цинк хлориду у 32мл ацетоніпротягом 30 хвилин. Після охолодження до кімнатрилу гріють до температури кипіння під звороттної температури реакційну суміш виливають у ним холодильником, додають 6мл HMDS та суміш суміш лід/концентрована НСІ та екстрагують етекип'ятять під зворотним холодильником протягом ром, органічну фазу промивають 1Η розчином 8 годин. Утворену суміш: концентрують під вакууNaOH та водою, та сушать безводним натрій сумом, залишок екстрагують EtOAc, органічну фазу льфатом, а розчинник випарюють під вакуумом промивають водою та сушать безводним натрій 5,3г очікуваного продукту отримують після кристасульфатом, а розчинник випарюють під вакуумом. лізації з гептану, темп. пл. = 205-203°С. 1,35г очікуваного продукту отримують після крисB) 5-Хлор-3-(2-трифлуорметилфеніл)-1,3талізації з гептану, темп. пл. = 125-127°С. дигідро-2Н-індол-2-он G) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]Суміш 3г сполуки, отриманої на попередньому 3-(2-флуорфеніл)-3-[(триметилсиліл)окси]-1,3етапі, та 0,1г цинк хлориду у 20мл ацетонітрилу дигідро-2Н-індол-2-он гріють до температури кипіння під зворотним хоЦю сполуку отримують способом, описаним на лодильником, 6мл HMDS додають та утворену етапі В отримання 1,8, починаючи з 1,3г сполуки, суміш кип'ятять під зворотним холодильником отриманої на попередньому етапі, 0,1г 60% натрій протягом 1 години. Суміш концентрують під вакуугідриду у маслі, 15мл ТГФ та 1г 2,4мом, залишок екстрагують етером, органічну фазу диметоксибензолсульфонілхлориду. 1,75г очікувапромивають водою та сушать безводним натрій ного продукту отримують після кристалізації з ізоесульфатом, а розчинник випарюють під вакуумом теру, темп. пл. = 184-186°С. 3,9г очікуваного продукту отримують у формі масН) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]ла, що кристалізується, темп. пл. = 175-176°С. 3-(2-флуорфеніл)-3-гідрокси-1,3-дигідро-2Н-індолC) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]2-он 3-(2-трифлуорметилфеніл)-3Суміш 1,7г сполуки, отриманої на поперед[(триметилсиліл)окси]-1,3-дигідро-2Н-індол-2-он ньому етапі, 2мл 12Н НСІ та 2мл води у 30мл ацеЦю сполуку отримують способом описаним на тону перемішують протягом 4 годин. Суміш концеетапі В отримання 1,8, починаючи з 3,8г сполуки, нтрують під вакуумом та залишок переносять у отриманої на попередньому етапі, 0,45г 60% наМеОН та знов концентрують під вакуумом. Залитрій гідриду у маслі 30мл ТГФ та 2,5г 2,4шок розтирають в ізоетері та утворений осад віддиметоксибензолсульфонілхлориду, 5г очікуванофільтровують відсмоктуванням. 1,3г очікуваного го продукту отримують після кристалізації з гептапродукту отримують, темп. пл. = 144-146°С. ну, темп. пл. = 144-145°С. І) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3D) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл](2-флуорфеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл 3-гідрокси-3-(2-трифлуорметилфеніл)-1,3-дигідрофенілкарбонат 2Н-індол-2-он 0,7г фенілхлорформіату додають при кімнатСуміш 4,9г сполуки отриманої на попередньоній температурі до суміші 1г сполуки отриманої на му етапі 3мл 12Η НСІ та 5мл води у 50мл ТГФ пепопередньому етапі, та 0,5 піридину у 20мл ДХМ ремішують при 20сС протягом 15 годин. Утворену та суміш перемішують протягом 48 годин. Реаксуміш концентрують під вакуумом при температурі ційну суміш промивають двічі водою органічну нижче 40°С залишок переносять у 30мл 10% розфазу сушать безводним натрій сульфатом, а розчин NaHCO3 та екстрагують EtOAc, екстракти сучинник випарюють під вакуумом. Залишок хромашать безводним натрій сульфатом та розчинник тографують на силікагелі, елюючи сумішшю випарюють під вакуумом 3,8г очікуваного продукту ДХМ/МеОН (99,5/0,5 за об'ємом), 0,93г очікуваного отримують після кристалізації з суміші ізоепродукту отримують. тер/гептан (80/20, за об'ємом), темп. пл. = 143°С. Отримання 1,13 E) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-33-(2-трифлуорметилфеніл)-2-оксо-2,3-дигідро-1Н(2-трифлуорметилфеніл)-2-оксо-2,3-дигідро-1Ніндол-3-іл фенілкарбонат індол-3-іл феніл карбонат 2г фенілхлорформіату додають краплями при (II): R1 = CI; R2 = H; R3 = CF3; R4 = H, 20°С до суміші 1,7г сполуки, отриманої на попередньому етапі, у 20 піридину, та суміш перемішують при 20°С протягом 7 годин. Утворену суміш концентрують під вакуумом, залишок переносять у 30мл 10% розчин АсОН та екстрагують етером, органічну фазу промивають 10% розчином NaHCO3 та водою, та сушать безводним натрій сульфатом а A) 5-Хлор-3-гідро кси-3-(2-трифлуоррозчинник випарюють під вакуумом. метилфеніл)-1,3-дигідро -2Н-індол-2-он 1,8г очікуваного продукту отримують після Суміш 2,3г магнію та 0,01г йоду у 20мл етеру кристалізації з гептану, темп. пл. = 191°С. гріють до температури кипіння під зворотним хоОтримання 1,14 лодильником, додають краплями розчин 26г 15-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3бром-2-трифлуорметилбензолу у 20мл етеру та (2-трифлуорметоксифеніл)-2-оксо-2,3-дигідро-1Нутворену суміш кип'ятять під зворотним холодильіндол-3-іл феніл карбонат ником протягом 60 хвилин. Розчин 9г 5-хлор-1Н(II): R1 = CI; R2 = H; R3 = OCF3; R4 = H, індол-2,3-дюну у 40мл ТГФ далі додають та кипіння під зворотним холодильником продовжують 41 77181 42 вають водою та сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом 1,34г очікуваного продукту отримують після кристалізації з ізоетеру, темп. пл. = 203-204°С. Отримання 1,15 A) 5-Хлор-3-гідрокси-3-(25-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3трифлуорметоксифеніл)-1,3-дигідро-2Н-індол-2-он (2-метоксифеніл)-6-метил-2-оксо-2,3-дигідро-1НРозчин 25г 1-бром-2-трифлуорметоксибензолу індол-3-іл фенілкарбонат у 130мл етеру додають краплями до суміші 2,8г (II): R1 = CI; R2 = 6-CH3; R3 = OCH3; R4 = H, магнію у 20мл етеру, кипіння під зворотним холодильником продовжують після його початку. Наприкінці додавання суміш гріють при температурі кипіння під зворотним холодильником протягом одної години. Суміш 7,5г 5-хлор-1Н-індол-2,3-дioну у 100мл ТГФ далі додають, при температурі нижче 40°С, а потім кип'ятять під зворотним холодильниА) 5-Хлор-3-(2-метоксифеніл)-6-метил-3ком протягом одної години. Після охолодження до [(триметилсиліл)окси]-1,3-дигідро-2Н-індол-1-он кімнатної температури реакційну суміш виливають Суміш 0,65г сполуки, отриманої на етапі В у суміш лід/концентрована НСІ та екстрагують отримання 1,6 та 0,05г цинкхлориду у 10мл ацетоEtOAc, органічну фазу промивають водою, 1Η рознітрилу гріють до температури кипіння під зворотчином NaOH та сушать безводним натрій сульфаним холодильником, 2,1мл HMDS додають та китом, а розчинник випарюють під вакуумом 6,5г піння під зворотним холодильником продовжують очікуваного продукту отримують після кристалізапротягом 1 години. Утворену суміш концентрують ції з суміші ДХМ/ізоетер (20/80, за об'ємом), темп. під вакуумом залишок екстрагують EtOAc, органічпл. = 214°С. ну фазу промивають водою та сушать безводним B) 5-Хлор-3-(2-трифлуорметоксифеніл)-3натрій сульфатом, а розчинник випарюють під ва[(триметилсиліл)окси]-1,3-дигідро-2Н-індол-2-он куумом 0,7г очікуваного продукту отримують після Суміш 2г сполуки отриманої на попередньому кристалізації з гептану темп. пл. = 227°С. етапі, 0,05г цинк хлориду та 1,4г HMDS у 100мл B) 5-Хлор-1-[(2,4-диметоксифеніл)сульфонілацетонітрилу кип'ятять під зворотним холодильни3-(2-метоксифеніл)-6-метил-3ком протягом 2 годин. Суміш концентрують під [(триметилсиліл)окси]-1,3-дигідро-2Н-індол-2-он вакуумом, залишок екстрагують EtOAc, органічну Цю сполуку отримують способом, описанимна фазу промивають водою та сушать безводним етапі В отримання 1, починаючи з 0,85г сполуки, натрій сульфатом, а розчинник випарюють під ваотриманої на попередньому етапі, 0,06г 60% накуумом 2,5г очікуваного продукту отримують та трійгідриду у 1,20мл ТГФ та 0,6г 2,4використовують без подальшої очистки. диметоксибензолсульфонілхлорид. 0,95г очікуваC) 5-Хлор-1-[(2,4-диметоксмфеніл)сульфоніл]ного продукту отримують після кристалізації з ізое3-(2-трифлуорметоксифеніл)-3теру, темп. пл. = 190-1?1°С. [(триметилсиліл)окси]-1,3-дигідро-2Н-індол-2-он C) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]Цю сполуку отримують способом, описаним на 3-гідрокси-3-(2-метоксифеніл)-6-метил-1,3-дигідроетапі В отримання 1,8, починаючи з 2,5г сполуки, 2Н-індол-2-он отриманої на попередньому етапі, 0,3г 60% натрій 0,5мл 12Η розчину НСІ додають до розчину гідриду у маслі 50мл ТГФ та 1,7г 2,40,85г сполуки отриманої на попередньому етапі, у диметоксибензолсульфонілхлориду 2,7г очікува20мл ацетону, та суміш перемішують при 20°С ного продукту отримують після кристалізації з ізоепротягом 4 годин. Утворену суміш концентрують теру, темп. пл. = 181°С. під вакуумом, залишок переносять у 50мл ДХМ та D) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]розчинник знов концентрують під вакуумом, 0,75г 3-гідрокси-3-(2-трифлуорметокси-феніл)-1,3очікуваного продукту отримують після кристалізадигідро-2Н-індол-2-он ції з ізоетеру, темп. пл. = 207-208°С. Суміш 2,7г сполуки, отриманої на попередD) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]ньому етапі, та 1мл концентрованої НСІ у 50мл 3-(2-метоксифеніл)-6-метил-2-оксо-2,3-дигідро-1Нацетону перемішують протягом 1 годин при теміндол-3-іл фенілкарбонат пературі нижче 40°С. Утворену суміш концентру1г фенілхлорформіату додають до розчину ють під вакуумом, залишок екстрагують EtOAc, 0,7г сполуки, отриманої на попередньому етапі, у органічну фазу промивають водою та сушать без10 піридину, та суміш перемішують при 20°С проводним натрій сульфатом, а розчинник випарюють тягом 48 годин. Утворену суміш концентрують під під вакуумом 1,66г очікуваного продукту отримувакуумом, залишок екстрагують EtOAc, органічну ють після кристалізації з ізоетеру, темп. пл. = 81°С. фазу промивають 1Η розчином НСІ, водою, 1Η E) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]розчином NaOH та водою та сушать безводним 3-(2-трифлуорметоксифеніл)-2-оксо-2,3-дигідронатрій сульфатом, а розчинник випарюють під ва1Н-індол-3-іл фенілкарбонат куумом 0,75г очікуваного продукту отримують піс1,15г фенілхлорформіату додають при кімнатля кристалізації з ізоетеру, темп. пл. = 196°С ній температурі до суміші 1,6г сполуки, отриманої (розкл.). на попередньому етапі, та 0,8 піридину у 20мл Отримання 1,16 ДХМ, та суміш перемішують при кімнатній темпе5-Хлор-3-(2-хлорфеніл)-1-[(2,4ратурі протягом 1 години. Реакційну суміш промидиметоксифеніл)сульфоніл]-6-метокси-2-оксо-2,3 43 дигідро-1Н-індол-3-іл фенілкарбонат (II): R1 = CI; R2 = 6-OCH3; R3 = CI; R4 = H, 77181 44 гріють до температури кипіння під зворотним холодильником, 3мл HMDS додають та кипіння під зворотним холодильником продовжують протягом 1 години. Утворену суміш концентрують під вакуумом, залишок екстрагують EtOAc, органічну фазу промивають водою та сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом. 1,25г очікуваного продукту отримують після крисA) 4-Хлор-3-метоксіанілін талізації з гептану, темп. пл. = 211-212°С. Суміш 36г 2-хлор-5-нпроанізолу та нікелю РеF) 5-Хлор-3-(2-хлорфеніл)-1-[(2,4нея у 150мл МеОН та 200мл ТГФ гідрують в ападиметоксифеніл)сульфоніл]-6-метокси-3раті Парра протягом 4 годин при 35°С та під тиск [(триметилсиліл)окси]-1,3-дигідро-2Н-індол-1-он 1,3бар. Каталізатор відфільтровують на Celite та Цю сполуку отримують способом, описаним на фільтрат концентрують під вакуумом, 28г очікуваетапі В отримання 1,8, починаючи з 1,2г сполуки, ного продукту отримують та використовують без отриманої на попередньому етапі, 0,08г 60% наподальшої очистки. трій гідриду у маслі, 15мл ТГФ та 0,8г 2,4B) N-(4-Хлор-3-метоксифеніл)-D,L-2диметоксибензолсульфонілхлориду. 1,6г очікувахлорманделамід ного продукту отримують після кристалізації з ізоеСуміш 28г сполуки, отриманої на попередньотеру, темп. пл. = 217-219°С. му етапі, та 33,13г D,L-2-хлормигдальної кислоти у G) 5-Хлор-3-(2-хлорфеніл)-1-[(2,4128мл 1,2-дихлорбензолу гріють при 230°С протядиметоксифеніл)сульфоніл]-3-гідрокси-6-метоксигом 4 годин з видаленням утвореної води, викори1,3-дигідро-2Н-індол-2-он стовуючи Апарат Дина-Старка. Реакційну суміш Суміш 1,55г сполуки, отриманої на попередчастково концентрують під вакуумом та залишаньому етапі та 2мл 12Н НСІ у 30мл ацетону переють кристалізуватися. Утворений кристалічний мішують при 20°С протягом 4 годин. Утворену супродукт відфільтровують відсмоктуванням та проміш концентрують під вакуумом та залишок мивають ізоетером. 40г очікуваного продукту переносять у ацетон та знов концентрують під отримують. вакуумом. Залишок переносять у ДХМ та концентС) 5-Хлор-3-(2-хлорфеніл)-6-метокси-1,3рують під вакуумом. Залишок розтирають в ізоедигідро-2Н-індол-2-он тері та утворений осад відфільтровують відсмок40г сполуки, отриманої на попередньому етапі, туванням. додають швидко до 550г полі-фосфатної кислоти 1,3г очікуваного продукту отримують, темп. пл. та суміш далі гріють при 60°С протягом 8 годин та = 233-235°С. залишають перемішуватися протягом ночі, дозвоН) 5-Хлор-3-(2-хлорфеніл)-1-[(2,4ляючи температурі повернутися до кімнатної темдиметоксифеніл)сульфоніл]-6-метокси-2-оксо-2,3ператури. Льодяну воду додають до реакційної дигідро-1Н-індол-3-іл фенілкарбонат суміші та утворений осад відфільтровують відсмоСуміш 1,3г сполуки, отриманої на попередктуванням та промивають водою. Осад переноньому етапі, у 10 піридину охолоджують до 10°С, сять у EtOAc та білий отриманий продукт після 0,8г фенілхлорформіату додають та суміш перерозтирання відфільтровують відсмоктуванням та мішують при 20°С протягом 20 хвилин. Крім того промивають ізоетером. 17,2г очікуваного продукту додають ще 0,7г фенілхлорформіату та суміш пеотримують, темп. пл. = 243-247°С. ремішують при 20°С протягом 20 годин. Утворену D) 5-Хлор-3-(2-хлорфеніл)-3-гідрокси-6суміш концентрують під вакуумом, залишок екстметокси-1,3-дигідро-2Н-індол-2-он рагують EtOAc, органічну фазу промивають 1Η 2,56г 60% натрій гідриду у маслі додають при розчином НСІ та сушать безводним натрій сулькімнатній температурі в атмосфері аргону до розфатом, а розчинник випарюють під вакуумом. Зачину 17, г сполуки, отриманої на попередньому лишок хроматографують на силікагелі, елюючи етапі, у 220мл ТГФ. Після закінчення виділення ДХМ 0,7г очікуваного продукту отримують після газу додають 6,85г диметилдисульфіду повітря кристалізації з суміші пентан/ізоетер, темп. пл. = продувають у реакційну суміш та суміш перемішу162-163°С. ють при кімнатній температурі протягом 72 годин. Отримання 1,17 Воду додають до реакційної суміші, ТГФ випарю5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3ють під вакуумом, остаточну водну фазу екстрагу(2,5-диметоксифеніл)-2-оксо-2,3-дигідро-1Н-індолють EtOAc, органічну фазу промивають водою, 3-іл фенілкарбонат насиченим розчином NaCI та сушать безводним (II): R1 = CI; R2 = H; R3 = OCH3; R4 = 5-OCH3, натрій сульфатом, а розчинник випарюють під вакуумом. Отриманий продукт розчиняють у ДХМ, розчинник частково концентрують, суміш залишають кристалізуватися та утворений кристалічний продукт відфільтровують відсмоктуванням. 6г очікуваного продукту отримують темп. пл. = 237A) 5-Хлор-3-гідрокси-3-(2,5-диметоксифеніл)240°C. 1,3-дигідро-2Н-індол-2-он E) 5-Хлор-3-(2-хлорфеніл)-6-метокси-3Розчин 2,5-диметоксифенілмагнійброміду [(триметилсиліл)окси]-1,3-дигідро-2Н-індол-2-он отримують з 2,2г магнію 18г 1-бром-2,5Суміш 1г сполуки, отриманої на попередньому диметоксибензолу та 50мл етеру. Цей розчин доетапі, та 0,07г цинк хлориду у 10мл ацетонітрилу 45 77181 46 дають краплями до суміші 5г 5-хлор-1Н-індол-2,3(II): R1 = СІ; R2 = Η; R3 = ОСН3; R4 = Η, дioну у 50мл ТГФ при температурі нижче 30°С, а А) 3-Аміно-5-хлор-3-(2-метоксифеніл)-1,3потім кип'ятять під зворотним холодильником продигідро -2Н-індол-2-он тягом 3 годин. Після охолодження до кімнатної Цю сполуку отримують способом описаним у температури, реакційну суміш виливають у 1Η WO 95/18105, в отриманні 7. розчин НСІ та екстрагують EtOAc, органічну фазу B) 3-Аміно-5-хлор-1-[(2,4промивають водою та сушать безводним натрій диметоксифеніл)сульфоніл]-3-(2-метоксифеніл)сульфатом, а розчинник випарюють під вакуумом 1,3-дигідро-1Н-індол-2-он 7,1г очікуваного продукту отримують після кристаРозчин 1,64г сполуки, отриманої на попередлізації з гарячого ізотеру. ньому етапі, у 20мл ДМФ охолоджують до 4°С, B) 5-Хлор-3-(2,5-диметоксифеніл)-30,25г 60% натрій гідриду у маслі додають та суміш [(триметилсиліл)окси]-1,3-дигідро-2Н-індол-2-он перемішують при 4°С протягом 30 хвилин. 1,34г Суміш 4г сполуки, отриманої на попередньому 2,4-диметоксибензолсульфонілхлорид далі додаетапі та 0,085г цинк хлориду у 45мл ацетонітрилу ють та суміш перемішують при кімнатній темперагріють до температури кипіння під зворотним хотурі протягом 4 годин. 50мл води додають до реалодильником, 2,8мл HMDS додають та кипіння під кційної суміші, утворену суміш екстрагують EtOAc, зворотним холодильником продовжують протягом органічну фазу промивають насиченим розчином 1 години. Утворену суміш концентрують під вакууNaCI та сушать безводним натрій сульфатом, а мом, залишок переносять у воду та екстрагують розчинник випарюють під вакуумом. Залишок хроетером органічну фазу промивають водою та суматографують на силікагелі, елюючи сумішшю шать безводним натрій сульфатом, а розчинник ДХМ/EtOAc (97/3, за об'ємом). 2г очікуваного провипарюють під вакуумом. 5г очікуваного продукту дукту отримують після кристалізації з суміші отримують після кристалізації з ізотеру. ДХМ/ізоетер. C) 5-Хлор-3-(2,5-диметоксифеніл)-1-[(2,4C) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]диметоксифеніп)сульфоніл]-3-[(триметил3-(2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3силіл)окси]-1,3-дигідро-2Н-індол-2-он іл фенілкарбамат Цю сполуку отримують способом, описаним на Розчин 2г сполуки, отриманої на попередньоетапі В отримання 1,8, починаючи з 2г сполуки му етапі, та 10 піридину у 10мл ДХМ охолоджують отриманої на попередньому етапі 0,135г 60% надо 4°С, 0,77мл фенілхлорформіату додають та трій гідриду у маслі, 40мл ТГФ та 1,3г 2,4суміш перемішують при кімнатній температурі продиметоксибензолсульфонілхлориду. 22г очікуватягом 1 години. Утворену суміш концентрують під ного продукту отримують після кристалізації з ізовакуумом, залишок екстрагують EtOAc, органічну теру. фазу промивають насиченим розчином NaCI та D) 5-Хлор-3-(2,5-диметоксифеніл)-1-[(2,4сушать безводним натрій сульфатом, а розчинник диметоксифеніл)сульфоніл]-3-гідрокси-1,3-дигідровипарюють під вакуумом Залишок хроматографу2Н-індол-2-он ють на силікагелі, елюючи сумішшю ДХМ/EtOAc Суміш 1г сполуки, отриманої на попередньому (96/4, за об'ємом). 2,6г очікуваного продукту отриетапі, та 0,5мл 12Η НСІ у 20мл ацетону перемішумують після кристалізації з суміші ДХМ/ізоетер, ють при кімнатній температурі протягом 4 годин. темп. пл. = 191°С. Суміш концентрують під вакуумом та залишок пеОтримання 1,19 реносять у ДХМ ι знов концентрують під вакуумом. 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3Залишок розтирають в ізоетері та утворений осад (2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл відфільтровують відсмоктуванням. 0,84г очікувафенілкарбамат, одиничний ізомер ного продукту отримують. (II): R1 = CI; R2 = H; R3 = OCH3; R4 = H, E) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]3-(2,5-диметоксифеніл)-2-оксо-2,3-дигідро-1Ніндол-3-іл фенілкарбонат Суміш 0,8г сполуки, отриманої на попередньому етапі, та 0,4мл фенілхлорформіату у 5 піридину перемішують при кімнатній температурі проA) 3, 5-Дихлор-3-(2-метоксифеніл)-1,3-дигідротягом ночі. Воду додають до реакційної суміші, 2Н-індол-2-он утворену суміш екстрагують ДХМ, органічну фазу Суміш 9г сполуки, отриманої на етапі А отрипромивають 2Η розчином НСІ та сушать безводмання 1,1 та 3,74 піридину у 100мл ДХМ охолоним натрій сульфатом а розчинник випарюють під джують до 0°С, розчин 3,45мл тioнілхлориду у 3мл вакуумом. 0,84г очікуваного продукту отримують ДХМ додають краплями протягом 3 хвилин, та після кристалізації з ізотеру. суміш перемішують протягом 30 хвилин. Воду доОтримання 1,18 дають до реакційної суміші та ДХМ випарюють під 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3вакуумом. Утворений осад відфільтровують відс(2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3-іл моктуванням, промивають чотири рази водою та фенілкарбамат далі холодним ізоетером та сушать. 8,8г очікуваного продукту отримують. B) 5-Хлор-3-[[(1S)-2-гідрокси-1-фенілетил]аміно]-3-(2-метоксифеніл)-1,3-дигідро-2Н-індол-2он, ізомер А та В Суміш 7г сполуки отриманої на попередньому 47 77181 48 бані, додають 1,8 піридину, а потім додають крапетапі, та 7,65г (S)-(+)- -феніл-гліцинолу у 100мл лями 0,37мл фенілхлорформіату i суміш залишахлороформу перемішують при кімнатній темперають в умовах охолодження протягом ночі. Реактурі протягом 2 годин. 2,9г DIPEA далі додають та ційну суміш розбавляють з ДХМ, органічну фазу суміш перемішують при кімнатній температурі пропромивають три рази водою сушать безводним тягом 48 годин. Утворений осад відфільтровують натрій сульфатом, а розчинник випарюють під вавідсмоктуванням та ізомер А збирають. Відфільткуумом. Залишок хроматографують на силікагелі, рований маточник промивають 5% розчином калій елюючи сумішшю ДХМ/EtOAc (98/2 за об'ємом). карбонату, органічну фазу сушать безводним на1,136г очікуваного продукту отримують. трій сульфатом та розчинник випарюють під вакуОтримання 1,20 умом. Залишок хроматографують на силікагелі, 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3елюючи сумішшю ДХМ/EtOAc (70/30; за об'ємом), (2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1Н-індолдва діастереоізомери відокремлюють: 3-іл фенілкарбамат, одиничний ізомер Менш полярний, ізомер А: 4,55г отримують (II): R1 = CI; R2 = H; R3 = OCH(CH3)2; R4 = H, (осаджують та хроматографують): 20 D = +193° (с = 0,16, хлороформ) більш полярний, ізомер В C) 3-Аміно-5-хлор-3-(2-метоксифеніл)-1,3дигідро-2Н-індол-2-он правообертовий ізомер Суміш 4,55г сполуки, отриманої на попередньому етапі (ізомер А), та 5,5г плюмбум тетраацеA) 3,5-Дихлор-3-(2-ізопропоксифеніл)-1,3тату у 75 л ДХМ та 35мл МеОН перемішують при дигідро -2Н-індол-2-он кімнатній температурі протягом 1 години 30 хвиСуміш 12г сполуки, отриманої на етапі В отрилин. Суміш концентрують під вакуумом залишок мання 1,3 та 8,35 піридину у 165мл ДХМ охолопереносять у насичений розчин NaHCO3 та екстджують до 0°С, додають краплями 7,62мл рагують EtOAc, органічну фазу промивають водою тioнілхлориду та суміш перемішують протягом 15 та насиченим розчином NaCI i сушать безводним хвилин. Утворену суміш концентрують під вакуунатрій сульфатом, а розчинник випарюють під вамом залишок екстрагують EtOAc, органічну фазу куумом. Отримане масло переносять у 100мл 3Η промивають водою та сушать безводним натрій розчину НСІ, 10мл МеОН додають та суміш пересульфатом, а розчинник випарюють під вакуумом. мішують при кімнатній температурі протягом 2 Залишок хроматографують на силікагелі, елюючи годин. Органічні розчинники концентрують під васумішшю ДХМ/EtOAc (90/10, за об'ємом). 15,22г куумом водну фазу промивають двічі етером, підочікуваного продукту отримують. лужують додаванням гранул КОН та екстрагують B) 5-Хлор-3-[[(1S)-2-гідрокси-1-фенілетил]EtOAc, органічну фазу промивають водою та нааміно]-3-(2-ізопропоксифеніл)-1,3-дигідро-2Нсиченим розчином NaCI i сушать безводним натрій індол-2-он, ізомер А та ізомер В сульфатом, а розчинник випарюють під вакуумом. Суміш 8,17г сполуки, отриманої на поперед1,178г очікуваного продукту отримують після крисньому етапі, та 3,66г (S)-(+)- -феніл-гліцинолу у талізації з суміші ДХМ/ізоетер/ТГФ, темп. пл. = 265мл хлороформу перемішують при кімнатній 202°С. температурі протягом 1 години. 4,66мл DIPEA далі 20 D = +83,3° (с = 0,16, хлороформ) додають, суміш перемішують при кімнатній темпеD) 3-Аміно-5-хлор-1-[(2,4-диметоксифеніл)ратурі протягом 3 годин та далі гріють при 50°С сульфоніл]-3-(2-метоксифеніл)-13-дигідро-2Нпротягом 18 годин. Утворену суміш концентрують індол-2-он правообертовий ізомер під вакуумом, залишок екстрагують EtOAc, органіРозчин 1, 178г сполуки, отриманої на поперечну фазу промивають 5% розчином калій карбонадньому етапі у 10мл ДМФ охолоджують до 0°С, ту та водою i сушать безводним натрій сульфатом, 0,188г 60% натрій гідриду у маслі додають в атмоа розчинник випарюють під вакуумом. Залишок сфері аргону та суміш перемішують до закінчення хроматографують на силікагелі, елюючи сумішшю виділення газу. 1,02г 2,4ДХМ/EtOAc (90/10, за об'ємом), а потім відокремдиметоксибензолсульфонілхлориду далі додають люють: та суміш перемішують при кімнатній температурі менш полярний ізомер ізомер А: 4,98г отрипротягом 3 годин. Реакційну суміш виливають у мують після кристалізації з ізоетеру. темп. пл. = 5% розчин калій карбонату та екстрагують EtOAc, 212,7°С. органічну фазу промивають водою, 5% розчином 20 D = +212,4° (с = 0,2; хлороформ) калій карбонату та насиченим розчином NaCI i Хроматографію проводять, елюючи сумішшю сушать безводним натрій сульфатом, а розчинник ДХМ/EtOAc (70/30; за об'ємом), а потім відокремвипарюють під вакуумом. Залишок хроматографулюють: ють на силікагелі, елюючи сумішшю ДХМ/EtOAc більш полярний ізомер, ізомер В: 3,49г отри(95/5 за об'ємом). 1,254г очікуваного продукту мують після кристалізації з ізоетеру, темп. пл. = отримують після кристалізації з суміші 241,3°С. ДХМ/етер/ізоетер, темп. пл. = 172-173°С. 20 20 D = -6,6° (с = 0,2; хлороформ) D = +113° (с = 0,18, хлороформ) C) 3-Аміно-5-хлор-3-(2-ізопропоксифеніл)-1,3Ε) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]дигідро-2Н-індол-2-он, правообертовий ізомер 3-(2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3Розчин 3,9г сполуки, отриманої на попереділ фенілкарбамат, одиничний ізомер ньому етапі, (ізомер А) у 75мл ДХМ та 37мл МеОН Розчин 1,1г сполуки, отриманої на попередохолоджують до 0°С, 4,35г плюмбум тетраацетату ньому етапі, у 10мл ДХМ охолоджують у льодяній 49 77181 50 додають та суміш перемішують протягом 2 годин. підлужують додаванням калій карбонату та утвоТри краплі 5% розчину NaHCO3 додають. Суміш рений осад відфільтровують відсмоктуванням 1,9г концентрують під вакуумом, залишок екстрагують очікуваного продукту отримують після кристалізаEtOAc, органічну фазу промивають водою та нації з ізоетеру, темп. пл.192°С. 20 сиченим розчином NaCI та сушать безводним наD = -42° (с = 0,2; хлороформ) трій сульфатом, а розчинник випарюють під вакуB) 3-Аміно-5-хлор-1-[(2,4-диметоксифеніл)умом. Отриманий продукт переносять у 120мл сульфоніл]-3-(2-ізопропоксифеніл)-1,3-дигідро-2Нконцентрованої НСІ, промивають етером, водну індол-2-он, лівообертовий ізомер фазу підлужують додаванням калій карбонату, Цю сполуку отримують способом, описаним на екстрагують EtOAc та залишають кристалізуватиетапі D отримання 1,19, починаючи з 1,67г сполуся. Утворені кристали відфільтровують відсмоктуки, отриманої на попередньому етапі, 0,253г 60% ванням та сушать. Відфільтрований маточник коннатрій гідриду у маслі, 20мл ДМФ та 1,249г 2,4центрують під вакуумом, залишок диметоксибензол-сульфонілхлориду. 2,453г очікухроматографують на силікагелі, елюючи сумішшю ваного продукту отримують після кристалізації з ДХМ/EtOAc (65/35, за об'ємом), та отриманий прогексану. 20 дукт кристалізують з ізоетеру. 2,03г очікуваного D = -79,8° (с = 0,2, хлороформ) продукту отримують загалом, темп. пл. = 193°С. C) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]20 3-(2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1НD = +44° (с = 0,18, хлороформ) D) 3-Аміно-5-хлор-1-[(2,4-диметоксифеніл)індол-3-іл фенілкарбамат, одиничний ізомер сульфоніл]-3-(2-ізопропоксифеніл)-1,3-дигідро-2НСуміш 2,103г сполуки, отриманої на попередіндол-2-он, правообертовий ізомер ньому етапі, та 3,5 піридину у 20мл ДХМ охолоЦю сполуку отримують способом, описаним на джують до 0°С, 0,665мл фенілхлорформіату доетапі D отримання 1,19 починаючи з 1,86г сполуки, дають та суміш залишають в умовах охолодження отриманої на попередньому етапі, 0,282г 60% напротягом 36 годин. Утворену суміш концентрують трій гідриду у маслі, 20мл ДМФ та 1,395г 2,4під вакуумом залишок переносять у 5% розчин диметоксибензол-сульфонілхлориду. калій карбонату та екстрагують EtOAc, органічну 2,68г очікуваного продукту отримують після фазу промивають водою та насиченим розчином кристалізації з гексану. NaCI i сушать безводним натрій сульфатом, а роз20 чинник випарюють під вакуумом. Залишок хромаD = +79,5° (с = 0,2; хлороформ) Ε) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]тографують на силікагелі, елюючи сумішшю 3-(2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1НДХМ/гексан (80/20; за об'ємом). 1,88г очікуваного індол-3-іл фенілкарбамат, одиничний ізомер продукту отримують та використовують без подаСуміш 2,68г сполуки, отриманої на попередльшої очистки. ньому етапі, та 4,5 піридину у 25мл ДХМ охолоОтримання 1,22 джують до 0°С, 1,06г фенілхлорформіату додають 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3протягом 30с та суміш залишають в умовах охо(2,5-диметоксифеніл)-2-оксо-2,3-дигідро-1Н-індоллодження протягом 18 годин. Реакційну суміш 3-іл фенілкарбамат хроматографують безпосередньо на силікагелі (II): R1 = CI; R2 = H; R3 = OCH3; R4 = 5-OCH3, отриманому у суміші ДХМ/гексан (80/20; за об'ємом) та елюють сумішшю ДХМ/EtOAc (95/5; за об'ємом). 2,88г очікуваного продукту отримують та використовують без подальшої очистки Отримання 1,21 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3A) 3,5-Дихлор-3-(2,5-диметоксифеніл)-1,3(2-ізопропоксифеніл)-2-оксо-2,3-дигідро-1Н-індолдигідро-2Н-індол-2-он 3-іл фенілкарбамат, одиничний ізомер Суміш 3г сполуки, отриманої на етапі А отри(II): R1 = CI; R2 = H; R3 = OCH(CH3)2; R4 = H, мання 1,17 та 1,2 піридину у 50мл ДХМ охолоджують до температури нижче 20°С, 0,8мл тюнілхлориду додають та суміш перемішують протягом 1 години. Реакційну суміш промивають водою, органічну фазу сушать безводним натрій сульфатом та розчинник випарюють під вакуумом. Залишок хроA) 3-Аміно-5-хлор-3-(2-ізопропоксифеніл)-1,3матографують на силікагелі, елюючи ДХМ. 1,9г дигідро-2Н-індол-2-он, лівообертовий ізомер очікуваного продукту отримують та використовуРозчин 3,4г сполуки, отриманої на етапі В ють без подальшої очистки отримання 1,20 (ізомер В) у 65мл ДХМ та 32,4мл B) 3-Аміно-5-хпор-3-(2,5-диметоксифеніл)-1,2МеОН охолоджують до 0°С, 3,8г плюмбум тетраадигідро-2Н-індол-2-он цетату додають та суміш перемішують протягом Суміш 1,25г сполуки, отриманої на поперед40 хвилин. Три краплі 5% розчину NaHCO3 доданьому етапі, у 7мл ТГФ охолоджують до 0°С, газують, суміш концентрують під вакуумом, залишок ватий аміак продувають через протягом 4 рази 10 екстрагують EtOAc, органічну фазу промивають хвилин протягом 6 годин та суміш перемішують водою та насиченим розчином NaCI i сушать безпри Ρ.Τ протягом 24 годин. Утворену суміш концеводним натрій сульфатом, а розчинник випарюють нтрують під вакуумом, залишок переносять у ДХМ під вакуумом. Отриманий продукт переносять у та розчинник випарюють під вакуумом. Залишок 120мл 0,5Η НСІ промивають етером, водну фазу хроматографують на силікагелі, елюючи ДХМ та 51 77181 52 далі сумішшю ДХМ/EtOAc (60/40, за об'ємом). індол-3-іл фенілкарбамат 0,808г очікуваного продукту отримують та викори(II): R1 = CI; R2 = 6-CH3; R3 = OCH3; R4 = H, стовують без подальшої очистки. C) 3-Аміно-5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2,5-диметоксифеніл)-1,3-дигідро-2Ніндол-2-он Цю сполуку отримують способом, описаним на етапі D отримання 1,19 починаючи з 0,749г сполуA) 3,5-Дихлор-3-(2-метоксифеніл)-6-метил-1,3ки, отриманої на попередньому етапі, 0,113г 60% дигідро-2Н-індол-2-он натрій гідриду у маслі, 7мл ДМФ та 0,612г 2,4Суміш 2,0г сполуки, отриманої на етапі В диметоксибензолсульфонілхлориду. 0,9г очікуваотримання 1,6, у 45мл ДХМ охолоджують до 0°С, ного продукту отримують після кристалізації з су0,77 піридину додають, потім додають 1,17г міші ДХМ/ізоетер, темп. пл. = 191°С. тioнілхлориду та суміш перемішують протягом 2 D) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]годин після повернення температури до кімнатної 3-(2,5-диметоксифеніл)-2-оксо-2,3-дигідро-1Нтемператури. Воду та ДХМ додають до реакційної індол-3-іл фенілкарбамат суміші та після відокремлення фаз відстоюванням Суміш 0,52г сполуки, отриманої на попередорганічну фазу промивають чотири рази водою i ньому етапі, та 1 піридину у 5мл ДХМ охолоджусушать безводним натрій сульфатом, а розчинник ють до 0°С, 0,16мл фенілхлорформіату додають випарюють під вакуумом. Очікуваний продукт та суміш перемішують протягом 16 годин. Воду отримують та використовують без подальшої очидодають до реакційної суміші, ДХМ випарюють під стки. вакуумом залишок екстрагують EtOAc, органічну B) 3-Аміно-5-хлор-3-(2-метоксифеніл)-6-метилфазу промивають 5% розчином калій карбонату 1,3-дигідро-2Н-індол-2-он водою та насиченим розчином NaCI i сушать безГазуватий аміак продувають протягом 30 хвиводним натрій сульфатом, а розчинник випарюють лин при кімнатній температурі у суміш 3,4г сполупід вакуумом. Залишок хроматографують на силіки, отриманої на попередньому етапі, у 25мл ДХМ, кагелі, елюючи ДХМ 0,46г очікуваного продукту та утворену суміш перемішують протягом 18 гоотримують та використовують без подальшої очидин. Суміш концентрують під вакуумом, залишок стки. екстрагують EtOAc, органічну фазу промивають Отримання 1,23 насиченим розчином NaCI i сушать безводним 5-Хлор-3-{2-хлорфеніл)-1-[(2,4натрій сульфатом, а розчинник випарюють під вадиметоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Нкуумом. Залишок хроматографують на силікагелі, індол-3-іл фенілкарбамат елюючи сумішшю ДХМ/МеОН (95/5, за об'ємом). 2г очікуваного продукту отримують. С) 3-Аміно-5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-метоксифеніл)-6-метил-1,3дигідро-2Н-індол-2-он Цю сполуку отримують способом, описаним на етапі В отримання 1,18, починаючи з 2г сполуки, A) 3-Аміно-5-хлор-3-(2-хлорфеніл)-1-[(2,4отриманої на попередньому етапі, 0,29г 60% надиметоксифеніл)сульфоніл]-1,3-дигідро-2Н-індолтрій гідриду у маслі, 15мл ДМФ та 1,54г 2,42-он диметоксибензолсульфонілхлориду. 3,2г очікува(II) R1 = СІ, R2 = Η, R3 = СІ, R4 = Η, ного продукту отримують. Цю сполуку отримують способом, описаним у D) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]WO 95/18105 у прикладі 3. 3-(2-метоксифеніл)-6-метил-2-оксо-2,3-дигідро-1НB) 5-Хлор-3-(2-хлорфеніл)-1-[(2,4індол-3-іл фенілкарбамат диметоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1НРозчин 3,2г сполуки, отриманої на попередіндол-3-іл фенілкарбамат ньому етапі, та 10 піридину у 30мл ДХМ охолоРозчин 3г сполуки, отриманої на попередньоджують до 4°С, додають краплями 1,2мл фенілхму етапі, у 25 піридину охолоджують до 0°С, долорформіату та суміш перемішують при кімнатній дають краплями розчин 1,25г фенілхлорформіату температурі протягом 2 годин. Утворену суміш у 2мл ДХМ та суміш перемішують при 0°С протяконцентрують під вакуумом залишок екстрагують гом 3 годин, а далі при кімнатній температурі проEtOAc, органічну фазу промивають 5% розчином тягом ночі. Суміш охолоджують знов до 0°С, доKHSO4, з 5% розчином натрій карбонату, водою та дають 0,96г фенілхлорформіату та суміш насиченим розчином NaCI i сушать безводним залишають в умовах охолодження протягом 18 натрій сульфатом, а розчинник випарюють під вагодин. Утворену суміш концентрують під вакуумом, куумом. 2,3г очікуваного продукту отримують після залишок переносять у 5% розчин калій карбонату кристалізації з суміші ДХМ/ізоетер. та екстрагують EtOAc, органічну фазу сушать безОтримання 1,25 водним натрій сульфатом та розчинник випарю5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3ють під вакуумом. Залишок хроматографують на (2-метоксифеніл)-6-трифлуорметил-2-оксо-2,3силікагелі, елюючи сумішшю ДХМ/EtOAc (95/5, за дигідро-1Н-індол-3-іл фенілкарбамат, одиничний об'ємом). 2,88г очікуваного продукту отримують. ізомер Отримання 1,24 (II): R1 = CI; R2 = 6-CH3; R3 = OCH3; R4 = H, 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3(2-метоксифеніл)-6-метил-2-оксо-2,3-дигідро-1Н 53 77181 54 D = +164° (с = 0,16, хлороформ). Хроматографію проводять, елюючи сумішшю ДХМ/EtOAc (70/30; за об'ємом) та відокремлюють інший діастереоізомер: більш полярний, ізомер В: 0,45г отримують, темп. пл. = 242°С. 20 D = -55° (с = 0,15 хлороформ). D) 3-Аміно-5-хлор-3-(2-метоксифеніл)-6трифлуорметил-1,3-дигідро-2Н-індол-2-он одиничний ізомер Розчин 0,7г сполуки, отриманої на попередньому етапі, (ізомер А) у 15мл ДХМ та 7мл МеОН охолоджують до 0°С, 0,907г плюмбум тетраацетату додають та суміш перемішують протягом 40 хвилин, додають кілька крапель 5% розчину NaHCO3 та суміш концентрують під вакуумом. Залишок переносять у воду та екстрагують 3 рази EtOAc, органічну фазу промивають водою та насиченим розчином NaCI i сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом. Отриманий продукт переносять у 30мл води, додають краплями 30мл 5Η розчину НСІ потім додають ТГФ до завершення розчинення, та суміш перемішують протягом 1 години. Реакційну суміш розбавляють 50мл води, водну фазу промивають 150мл етеру та підлужують до рН 12 додаванням калій карбонату, а далі концентрованого розчину NaOH, і екстрагують EtOAc, органічну фазу сушать безводним натрій сульфатом та розчинник випарюють під вакуумом. Залишок хроматографують на силікагелі, елюючи сумішшю ДХМ/МеОН (92/8; за об'ємом). 0,19г очікуваного продукту отримують. E) 3-Аміно-5-хлор-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-метоксифеніл)-6-трифлуор-метил1,3-дигідро-2Н-індол-2-он, одиничний ізомер Цю сполуку отримують способом, описаним на етапі В отримання 1,18, починаючи з 0,19г сполуки, отриманої на попередньому етапі, 0,023г 60% натрій гідриду у маслі, 2мл ДМФ та 0,138г 2,4диметоксибензолсульфонілхлориду. 0,22г очікуваного продукту отримують. F) 5-Хлор-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-метоксифеніл)-6-трифлуорметил-2-оксо-2,3дигідро-1Н-індол-3-іл фенілкарбамат, одиничний ізомер Цю сполуку отримують способом, описаним на етапі С отримання 1,18, починаючи з 0,215г сполуки, отриманої на попередньому етапі, 0,31 піридину, 5мл ДХМ та 0,079г фенілхлорформіату. 0,208г очікуваного продукту отримують. Отримання 1,26 6-Хлор-3-(2-хлорфеніл)-1-[(2,4диметоксифеніл)сульфоніл]-5-метил-2-оксо-2,3дигідро-1Н-індол-3-іл фенілкарбамат (II): R1 = CH3; R2 = 6-CI; R3 = CI; R4 = H, 20 А) 5-Хлор-3-гідрокси-3-(2-метоксифеніл)-6трифлуорметил-1,3-дигідро-2Н-індол-2-он a) трет-Бутил 4-хлор-3-трифлуорметилфенілкарбамат Цю сполуку отримують способом, описаним на етапі В а) отримання 1,6, починаючи з 4-хлор-3трифлуорметиланіліну та ди-третбутилдикарбонату у діоксані. Очікуваний продукт отримують у формі масла, що твердне, темп. пл. = 90°С. b) розчин 4г трет-бутил 4-хлор-3трифлуорметилфенілкарбамату у 30мл етеру охолоджують до -70°С в атмосфері аргону 22мл 1,5М розчин трет-бутиллітію у пентані додають краплями та суміш перемішують протягом 1 години, дозволяючи температурі зрости до -10°С, та перемішують протягом 2 годин 30 хвилин при -10°С. Реакційну суміш охолоджують до -70°С, додають краплями розчин 3,05г сполуки, отриманої на етапі А отримання 1,6 у 15мл ТГФ та суміш перемішують протягом 1 години, дозволяючи температурі зрости до -30°С, а далі протягом 16 годин, дозволяючи температурі повернутися до кімнатної температури. Насичений розчин NH4CI додають до реакційної суміші, етер та ТГФ випарюють, утворену водну фазу екстрагують EtOAc, органічну фазу промивають водою та насиченим розчином NaCI i сушать безводним натрій сульфатом, а розчинник випарюють під вакуумом. Залишок хроматографують на силікагелі, елюючи ДХМ та далі сумішшю ДХМ/EtOAc (90/10; за об'ємом). 1,48г очікуваного продукту отримують після кристалізації з суміші ізоетер/гексан темп. пл. = 230-231°С. B) 3,5-Дихлор-3-(2-метоксифеніл)-6трифлуорметил-1,3-дигідро-2Н-індол-2-он Суспензію 13г сполуки, отриманої на етапі у 8мл ДХМ охолоджують до 0°С, 0,43 піридину додають, потім додають 0,4 л тioнілхлориду та суміш перемішують протягом 15 хвилин. Реакційну суміш промивають три рази водою, органічну фазу сушать безводним натрій сульфатом та розчинник випарюють під вакуумом. 1,2г очікуваного продукту отримують та використовують без подальшої очистки. C) 5-Хлор-3-[[(1S)-2-гідрокси-1фенілетил]аміно]-3-(2-метоксифеніл)-6трифлуорметил-1,3-дигідро-2Н-індол-2-он, ізомер А та ізомер В Суміш 1,29г сполуки, отриманої на попередньому етапі, та 0,47г (S)-(+)- -феніл-гліцинолу у 35мл хлороформу перемішують при кімнатній температурі протягом 4 годиню 0,6мл DIPEA далі додають, розчинник концентрують наполовину та суміш перемішують при кімнатній температурі протягом 22 годин. Реакційну суміш концентрують під вакуумом та залишок хроматографують на силікагелі, елюючи сумішшю ДХМ/EtOAc (85/15; за об'ємом). Один діастереоізомер відокремлюють: менш полярний ізомер А: 0,712г отримують після кристалізації з суміші ДХМ/ізоетер, темп. пл. = 205°С. A) N-(3-Хлор-4-метилфеніл)-DL-2-хлорманделамід Суміш 52,72г DL-2-хлормигдальної кислоти та 40г 3-хлор-4-метиланіліну у 400мл 1,2дихлорбензолу кип'ятять під зворотним холодиль 55 77181 56 ником протягом 6 годин з видаленням утвореної отримують способом, описаним на етапі С отриводи, використовуючи Апарат Дина-Старка. Після мання 1,18, починаючи з 0,592г сполуки, отримаохолодження до кімнатної температури, суміш ної на попередньому етапі 1 піридину, 6мл ДХМ та залишають кристалізуватися та утворений осад 0,19мл фенілхлорформіату 0,690г очікуваного відфільтровують відсмоктуванням. Очікуваний продукту отримують та використовують без подапродукт отримують після перекристалізації з сумільшої очистки. ші ДХМ/ізоетер, темп. пл. = 164°С. Отримання 1,27 B) 6-Хлор-3-(2-хлорфеніл)-5-метил-1,32-[[5-Хлор-3-(2-ізопропоксифеніл)-2-оксо-2,3дигідроіндол-2-он дигідро-1Н-індол-3-іл]окси]оцтова кислота 102мл концентрованої (95%) H2SO4 охолоII: R1 = СІ R2 = Η, R3 = -ОСН(СН3)2; R4 = Η; Φ = джують до 5°С та додають краплями 23мл димляO-CH2-; Υ = OH; W = Η чої сульфатної кислоти (30% олеум). 25г сполуки, А) Метил 2-[[5-хлор-3-(2-ізопропоксифеніл)-2отриманої на попередньому етапі, далі додають оксо-2,3-дигідро-1Н-індол-3-іл]окси]ацетат порціями, при температурі нижче 5°С, та суміш 0,29г 60% натрій гідриду у маслі додають до перемішують при кімнатній температурі протягом розчину 1,05г метилгліколяту у 20мл ТГФ та суміш 48 годин. Реакційну суміш виливають у суміш перемішують при кімнатній температурі протягом лід/вода, утворений осад відфільтровують відсмо10 хвилин. Розчин 1,88г сполуки отриманої на етактуванням та промивають водою до рН 7. Осад пі А отримання 1,20 далі додають краплями та розчиняють у EtOAc, органічну фазу промивають суміш перемішують при кімнатній температурі пронасиченим розчином NaCI i сушать безводним тягом 10 хвилин. Утворену суміш концентрують під натрій сульфатом, розчинник частково випарюють вакуумом залишок екстрагують EtOAc, органічну під вакуумом та утворений осад відфільтровують фазу промивають водою та 1Η розчином НСІ i відсмоктуванням. Очікуваний продукт отримують, сушать безводним натрій сульфатом, а розчинник темп. пл. = 186°С. випарюють під вакуумом. Залишок хроматографуC) 3-Бром-6-хлор-3-(2-хлорфеніл)-5-метил-1,3ють на силікагелі, елюючи ДХМ та далі EtOAc, 0,8г дигідро-2Н-індол-2-он очікуваного продукту отримують після кристалізаРозчин 2,6мл брому у 10мл ДХМ додають поції з ізоетеру, темп. пл. = 210-213°С. вільно при кімнатній температурі до суспензії В) 2-[[5-Хлор-3-(2-ізопропоксифеніл)-2-оксо16,36г сполуки, отриманої на попередньому етапі, 2,3-дигідро-1Н-індол-3-іл]окси]оцтова кислота у 200мл ДХМ. Крім того додають ще розчин 0,26мл Розчин 0,24г гранул NaOH у 5мл води додають брому у 5мл ДХМ та реакційну суміш далі конценпри 20°С до розчину 0,8г сполуки, отриманої на трують під вакуумом. Залишок переносять двічі у попередньому етапі, у 40мл МеОН, та суміш пеДХМ та розчинник випарюють кожний раз під вакуремішують при кімнатній температурі протягом 15 умом. Залишок розчиняють у EtOAc, органічну годин. Утворену суміш концентрують під вакуумом, фазу промивають насиченим розчином NaCI i сузалишок розчиняють у 25мл води та підкислюють шать безводним магній сульфатом, а розчинник додаванням краплями 1мл 12Η НСІ i утворений випарюють під вакуумом. Очікуваний продукт осад відфільтровують відсмоктуванням. 0,8г очікуотримують. ваного продукту отримують, темп. пл. = 225-228°С. D) 3-Аміно-6-хлор-3-(2-хлорфеніл)-5-метилОтримання 1,28 1,3-дигідро -2Н-індол-2-он 2-[5-Хлор-1-[(2,4-диметоксифеніл)-сульфоніл]30мл концентрованого водного розчину аміаку 3-(2-метоксисреніл)-2-оксо-2,3-дигідро-1Н-індол-3додають до розчину 4,25г сполуки отриманої на іл]аміно]оцтова кислота попередньому етапі, у 30мл ТГФ та суміш перемі(II): R1 = CI; R2 = H; R3 = -OCH3; R4 = H, шують при кімнатній температурі протягом 24 годин. Крім того ще додають 10мл концентрованого водного розчину аміаку та суміш перемішують при кімнатній температурі протягом ночі. Утворену суміш концентрують під вакуумом, залишок екстрагують ДХМ, органічну фазу промивають водою i сушать безводним натрій сульфатом, а розчинник A) трет-Бутил 2-[[5-хлор-3-(2-метоксифеніл)-2випарюють під вакуумом 3,02г очікуваного продукоксо-2,3-дигідро-1Н-індол-3-іл]аміно]-ацетат ту отримують після кристалізації з ДХМ, темп. пл. Розчин 2,4г гідрохлориду гліцину трет= 233°С. бутилового естеру у 50мл хлороформу та 50мл E) 3-Аміно-6-хлор-3-(2-хлорфеніл)-1-[(2,4ТГФ охолоджують у льодяній бані, 2,3г триетиладиметоксифеніл)сульфоніл]-5-метил-1,3-дигідроміну додають, потім додають 35г сполуки отрима2Н-індол-2-он ної на етапі А отримання 1,19, та суміш перемішуЦю сполуку отримують способом, описаним на ють при кімнатній температурі протягом ночі. етапі В отримання 1,18 починаючи з 0,54г сполуки, Утворену суміш концентрують під вакуумом, заотриманої на попередньому етапі 0,077г 60% налишок переносять у воду та екстрагують ДХМ, трій гідриду у маслі, 5мл ДМФ та 0,435г 2,4органічну фазу сушать безводним натрій сульфадиметоксибензолсульфонілхлориду. 0,592г очікутом та розчинник випарюють під вакуумом. Заливаного продукту отримують після кристалізації з шок розтирають в ізоетері та утворений осад відсуміші ДХМ/ізотер. фільтровують відсмоктуванням. 2,2г очікуваного F) 6-Хлор-3-(2-хлорфеніл)-1-[(2,4продукту отримують. диметоксифеніл)сульфоніл]-5-метил-2-оксо-2,3B) трет-Бутил 2-[[5-хлор-1-[(2,4дигідро-1Н-індол-3-іл фенілкарбамат. Цю сполуку диметоксифеніл)сульфоніл]-3-(2-метоксифеніл)-2 57 77181 58 оксо-2,3-дигідро-1Н-індол-3-іл]аміно]ацетат 0,225г очікуваного продукту отримують, темп. пл. >250°С. 60% натрій гідриду у маслі додають до суміші 2,1г Отримання 1,30 сполуки, отриманої на попередньому етапі, у 10мл 2-[5-Хлор-3-(2-флуорфеніл)-2-оксо-2,3-дигідроДМФ та суміш перемішують при кімнатній темпе1Н-індол-3-іл]оцтова кислота, правообертовий ратурі протягом 30 хвилин 1,2г 2,4-диметоксиізомер бензолсульфонілхлорид далі додають та суміш (II) R1 = СІ; R2 = Η; R3 = -F; R4 = Η; X = -CH2-; Υ перемішують при кімнатній температурі протягом = OH; W = Η 18 годин. Реакційну суміш виливають у воду та A) Етил 2-[5-хлор-3-(2-флуорфеніл)-2-оксо-2,3екстрагують EtOAc. Органічну фазу сушать безводигідро-1Н-індол-3-іл]ацетат дним натрій сульфатом та розчинник випарюють Суміш 2,6г сполуки, отриманої на етапі С під вакуумом Залишок хроматографують на силіотримання 1,12, 1,84г етилбромацетату, 1,66г ΚΘ кагелі, елюючи DCK. 2,5г очікуваного продукту та 2г К2СО3 у 10мл ацетону кип'ятять під зворототримують після кристалізації з ізотеру. ним холодильником протягом 20 годин. Мінеральні С) 2-[[5-Хлор-1-[(2,4-диметоксифеніл)солі відфільтровують та фільтрат концентрують сульфоніл]-3-(2-метоксифеніл)-2-оксо-2,3-дигідропід вакуумом. Залишок хроматографують на силі1Н-індол-3-іл]аміно]оцтова кислота кагелі, елюючи ДХМ та далі EtOAc. 2,1г очікуваноСуміш 2,5г сполуки, отриманої на попередго продукту отримують після осадження з ізотеру. ньому етапі та 10мл ТФОК перемішують протягом B) 2-[5-Хлор-3-(2-флуорфеніл)-2-оксо-2,33 годин. Суміш концентрують під вакуумом залидигідро-1Н-індол-3-іл]оцтова кислота шок переносять у гексан та утворений осад відфіСуміш 2г сполуки отриманої на попередньому льтровують відсмоктуванням. 2г очікуваного проетапі та 2мл 30% розчину NaOH у 1мл води та дукту отримують. 50мл ЕtOН перемішують при кімнатній температурі Отримання 1,29 протягом 20 годин. Суміш концентрують під вакуу3-[[5-Хлор-1-[(2,4-диметоксифеніл)-сульфоніл]мом, залишок переносять у 40мл води та підкис3-(2-метоксифеніл)-2-оксо-2,3-дигідро-1Н-індол-3люють до рН 1 додаванням концентрованої НСІ, а іл]аміно]пропioнова кислота утворений осад відфільтровують відсмоктуванням (II): R1 = CI; R2 = H; R3 = OCH3; R4 = H, та промивають водою. 1,9г очікуваного продукту отримують. C) 2-[5-Хлор-3-(2-флуорфеніл)-2-оксо-2,3дигідро-1Н-індол-3-іл]оцтова кислота правообертовий ізомер Суміш 0,97г сполуки, отриманої на поперед20 ньому етапі та 0,89г (+)-цинхоніну ( D = +225°С; с A) трет-Бутил 3-[[5-хлор-3-(2-метоксифеніл)-2= 0,5; ЕtOН) у 31,5мл МеОН гріють до 40°С, а далі оксо-2,3-дигідро-1Н-індол-3-іл]аміно]-пропioнат кип'ятять під зворотним холодильником. Утворе2,15г триетиламіну додають до суміші 3г споний осад відфільтровують відсмоктуванням гарялуки, отриманої на етапі А отримання 1,19 та 2,1г чим, промивають гарячим МеОН та далі етером, гідрохлориду трет-бутилового естеру п-аланіну у отримуючи 0,485г солі з (+)-цинхоніном. 0,485г 50мл ДХМ та 50мл ТГФ, та суміш перемішують при отриманої таким чином солі переносять у суміш кімнатній температурі протягом 18 годин. Утворену вода/EtOAc, підкислюють до рН 0 додаванням 3Η суміш концентрують під вакуумом, залишок екстНСІ, перемішують та екстрагують EtOAc, органічну рагують EtOAc, органічну фазу промивають водою фазу промивають водою I сушать безводним наι сушать безводним натрій сульфатом, а розчинтрій сульфатом, а розчинник випарюють під вакуник випарюють під вакуумом. Залишок хроматогумом. 0,22г очікуваного продукту отримують у форафують на силікагелі, елюючи сумішшю рмі правообертового ізомеру. ДХМ/EtOAc (80/20; за об'ємом). 3,2г очікуваного 20 D = +61,3° (с = 0,15, хлороформ) продукту отримують після кристалізації з суміші Отримання 1,31 ДХМ/ізоетер, темп. пл. = 170°С. 2-[5,6-Дихлор-3-(2-флуорфеніл)-2-оксо-2,3B) трет-Бутил 3-[[5-хлор-1-[(2,4дигідро-1Н-індол-3-іл оцтова кислота диметоксифеніл)сульфоніл]-3-(2-метоксифеніл -2(II): R1 = СІ, R2 = 6-СІ; R3 = F; R4 = Η; Φ = -CH2-; оксо-2,3-дигідро-1Н-індол-3-іл]аміно]пропioнат. Цю Υ = OH; W = Η сполуку отримують способом, описаним на етапі В A) N-(3,4-дихлорфеніл)-DL-2отримання 1,28, починаючи з 2,16г сполуки, отрифлуорманделамід маної на попередньому етапі 0,225г 60% натрій Суміш 7,5г сполуки, отриманої на етапі А гідриду у маслі, 15мл ДМФ та 1,21г 2 4отримання 1,12 та 7,5г 3,4-дихлоранілін у 40мл диметоксибензолсульфонілхлориду. 2,4г очікува1,2-дихлорбензолу кип'ятять під зворотним холоного продукту отримують після кристалізації з судильником протягом 3 годин з видаленням утвоміші гептан/EtOAc, темп. пл. = 175°C. реної води за допомогою апарата Дина-Старка. C) 3-[[5-Хлор-1-[(2,4-диметоксифеніл)Суміш концентрують під вакуумом, залишок пересульфоніл]-3-(2-метоксифеніл)-2-оксо-2,3-дигідроносять в ізоетер та утворений осад відфільтрову1Н-індол-3-іл]аміно]пропioнова кислота ють відсмоктуванням. 9г очікуваного продукту Суміш 2,4г сполуки, отриманої на попередотримують. ньому етапі, та 15мл ТФОК у 5мл ДХМ перемішуB) 5,6-Дихлор-3-(2-флуорфеніл)-1,3-дигідроють протягом 18 годин. Суміш концентрують під 2Н-індол-2-он вакуумом, залишок переносять у етер та утворе8,9г сполуки, отриманої на попередньому етапі ний осад відфільтровують відсмоктуванням. 2,2г додають при кімнатній температурі до суміші 36мл 59 77181 60 концентрованої (95%) H2SO4 та 9мл димлячої сульшої очистки на наступному етапі. льфатної кислоти (30% олеум), та суміш далі пеB) 5-Хлор-3-гідрокси-3-(2,3-диметоксифеніл)ремішують протягом 8 годин. Реакційну суміш ви1,3-дигідро-2Н-індол-2-он ливають у суміш лід/вода та утворений осад a) трет-Бутил 4-хлорфенілкарбамат відфільтровують відсмоктуванням та промивають Суміш 12,7г 4-хлораніліну та 22г ди-третводою. Осад хроматографують на силікагелі, бутилдикарбонату у 60мл діоксану перемішують елюючи ДХМ та далі ізоетером, два ізомери відопри кімнатній температурі протягом 24 годин. Реакремлюють: кційну суміш концентрують під вакуумом, залишок менш полярна сполука з етапу В дає 3,7г, переносять у пентан та утворений осад відфільттемп. пл. = 204-205°С; ровують відсмоктуванням i сушать. 22,5г очікувабільш полярний 4,5-дихлор-3-(2-флуор-феніл)ного продукту отримують. 1,3-дигідро-2Н-індол-2-он дає 1,5г, темп. пл. = 244b) суміш 11,4г трет-бутил 4247°С. хлорфенілкарбамату у 100 л етеру охолоджують B) Етил 2-[5,6-дихлор-3-(2-флуорфеніл)-2до -40°С в атмосфері сухого азоту, 80мл 1,5М розоксо-2,3-дигідро-1Н-індол-3-іл]ацетат чин трет-бутиллiтiю у пентані додають краплями Суміш 3г сполуки, отриманої на попередньому та суміш перемішують при -20°С протягом 3 годин. етапі, 1,7г етилбромацетату, 1,8г ΚΘ та 1,4г калій Реакційну суміш охолоджують до -40°С, додають карбонату у 20мл ацетону кип'ятять під зворотним розчин 14г сполуки, отриманої на етапі, у 50мл холодильником протягом 10 годин. Суміш конценТГФ протягом 1 години, та суміш перемішують при трують під вакуумом, залишок переносять у воду кімнатній температурі протягом 4 діб. Реакційну та екстрагують EtOAc, органічну фазу сушать безсуміш виливають у насичений розчин NH4CI та водним натрій сульфатом та розчинник випарюутворений осад відфільтровують відсмоктуванням ють під вакуумом. Залишок хроматографують на та сушать. 10,2г очікуваного продукту отримують силікагелі елюючи ізоетером. 2,1г очікуваного прота використовують без подальшої очистки на надукту отримують після розтирання у пентані та ступному етапі. далі в ізоетері, темп. пл. = 152-158°С. C) 5-Хлор-3-(2,3-диметоксифеніл)-1,3-дигідроC) 2-[5,6-Дихлор-3-(2-флуорфеніл)-2-оксо-2,32Н-індол-2-он дигідро-1Н-індол-3-іл]оцтова кислота Суміш 8,5г сполуки, отриманої на попередСуміш 2г сполуки, отриманої на попередньому ньому етапі, 40мл ТФОК та 11,5мл триетилсилану етапі, та 3мл 30% розчину NaOH у 5мл води та кип'ятять під зворотним холодильником протягом 40мл ЕtOН перемішують при кімнатній температурі 5 годин. Суміш концентрують під вакуумом, залипротягом 20 годин. Суміш концентрують під вакуушок переносять у воду та екстрагують EtOAc, мом, залишок переносять у воду, водну фазу проутворений осад відфільтровують відсмоктуванням мивають етером, підкислюють до рН 1 додаванта промивають EtOAc та далі ізоетером, отримуюням концентрованої НСІ та екстрагують EtOAc, чи 5,1г очікуваного продукту. Відфільтрований органічну фазу сушать безводним натрій сульфаматочник відокремлюють відстоюванням, органічтом та розчинник випарюють під вакуумом. 1,5г ну фазу сушать безводним натрій сульфатом та очікуваного продукту отримують після розтирання розчинник випарюють під вакуумом. Крім того, 1,4г в ізоетері, темп. пл. = 245°С. очікуваного продукту отримують після кристалізаОтримання 1,32 ції з EtOAc, темп. пл. = 193°С. 2-[5-Хлор-3-(2,3-диметоксифеніл)-2-оксо-2,3D) Етил 2-[5-хлор-3-(2,3-диметоксифеніл)-2дигідро-1Н-індол-3-іл]оцтова кислота оксо-2,3-дигідро-1Н-індол-3-іл]ацетат (II): R1 = СІ; R2 = Η; R3 = ОСН3; R4 = 3-ОСН3; Φ Суміш 6,2г сполуки, отриманої на поперед= -СН2-; Υ = ОН; W = Η ньому етапі, 3,6г етилбромацетату, 3 5г КІ та 6,2г А) Етил 2-(2,3-Диметоксифеніл)-2-оксоацетат калій карбонату у 20мл ДМФ гріють при 60°С проСуміш 27,6г 1,2-диметоксибензолу у 160мл тягом 8 годин. Суміш концентрують під вакуумом, етеру охолоджують до -40°С, 250мл 1,6М розчинузалишок переносять у воду та екстрагують EtOAc, н-бутиллiтiю у гексані додають краплями та суміш органічну фазу промивають водою, сушать безводалі перемішують протягом 24 годин, дозволяючи дним натрій сульфатом та випарюють під вакуутемпературі повернутися до кімнатної температумом. Залишок хроматографують на силікагелі, ри. Реакційну суміш охолоджують до -20°С, додаелюючи сумішшю ДХМ/МеОН (99/1; за об'ємом). 3г ють швидко 136мл діетилоксалату та суміш переочікуваного продукту отримують, темп. пл. = мішують, дозволяючи температурі повернутися до 155°С. кімнатної температури. Після перемішування проE) 2-[5-Хлор-3-(2,3-диметоксифеніл)-2-оксотягом 30 хвилин при кімнатній температурі реак2,3-дигідро-1Н-індол-3-іл]оцтова кислота ційну суміш виливають у насичений розчин NH4CI, Суміш 3г сполуки, отриманої на попередньому фази відокремлюють відстоюванням, водну фазу етапі, та 0,5г гранул NaOH у 40мл води та 10мл екстрагують етером, комбіновані органічні фази діоксану перемішують при кімнатній температурі промивають двічі водою і сушать безводним напротягом 24 годин. 150мл води додають, водну трій сульфатом, та розчинники випарюють під вафазу промивають EtOAc та підкислюють до рН 1 куумом, надлишок діетилоксалату видаляють педодаванням концентрованої НСІ, та утворений регонкою під вакуумом (темп. кип. = 90°С при осад відфільтровують відсмоктуванням, промива2400Па). Утворений сирий продукт хроматограють водою та сушать. 2,5г очікуваного продукту фують на силікагелі, елюючи сумішшю гепотримують, темп. пл. = 235°С. тан/ізоетер (90/10; за об'ємом). 25г очікуваного Отримання 1,33 продукту отримують та використовують без пода2-[5-Хлор-3-(2-етоксифеніл)-6-метил-2-оксо
ДивитисяДодаткова інформація
Назва патенту англійською1-phenylsulfonyl-1,3-dihydro-2h-indol-2-on derivatives, their production and therapeutic use
Назва патенту російськоюПроизводные 1-фенилсульфонил-1,3-дигидро-2н-индол-2-она, их получение и терапевтическое применение
МПК / Мітки
МПК: A61P 15/10, A61P 27/06, A61P 27/12, A61K 31/496, C07D 417/12, A61P 13/08, A61P 1/16, A61P 3/10, A61P 43/00, A61P 25/14, A61P 25/18, A61P 1/08, A61P 25/24, A61P 25/16, A61P 29/00, C07D 401/14, C07D 401/12, A61P 9/10, A61P 29/02, A61P 5/24, A61P 25/04, A61P 25/06, A61P 17/06, A61K 31/55, A61P 1/14, A61P 13/00, A61K 31/506, A61P 3/04, A61P 35/00, A61P 37/04, A61P 25/20, A61P 9/12, A61P 9/04, A61P 11/00, A61P 25/30, A61P 11/06, A61P 25/34, A61P 17/02, A61P 25/28, A61P 15/00, A61P 31/00, A61P 37/08, A61P 1/12, A61P 21/00, A61P 5/38, A61P 3/12, A61P 3/06, A61P 15/04, A61K 31/497, A61P 3/08, A61P 13/12, A61P 1/04, A61P 19/02, A61P 7/04, C07D 403/12, A61P 25/22, A61P 9/00, A61P 9/08, A61P 13/02, A61P 21/02, A61K 31/501
Мітки: терапевтичне, похідні, 1-фенілсульфоніл-1,3-дигідро-2н-індол-2-ону, отримання, застосування
Код посилання
<a href="https://ua.patents.su/43-77181-pokhidni-1-fenilsulfonil-13-digidro-2n-indol-2-onu-kh-otrimannya-ta-terapevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-фенілсульфоніл-1,3-дигідро-2н-індол-2-ону, їх отримання та терапевтичне застосування</a>
Попередній патент: Спосіб визначення цитотоксичності водних розчинів за морфологічними змінами ядер і ядерець клітин тваринних тест-організмів
Наступний патент: Застосування n-ацилетаноламінів як лікарських засобів та спосіб їх використання
Випадковий патент: Верхня опора інформаційного елемента демонстраційної установки












