Спосіб одержання дикарбонових кислот за низьких рн
Формула / Реферат
1. Спосіб одержання дикарбонових кислот, який включає ферментацію дріжджів у присутності вуглеводвмісних субстратів і малих кількостей кисню при значенні рН нижче найнижчого рKа дикарбонової кислоти, в якому кисень подається при питомій швидкості споживання кисню від 8 до 0,2 ммоль/г сухої біомаси/год.
2. Спосіб за п. 1, який відрізняється тим, що дикарбоновою кислотою є фумарова кислота, малеїнова кислота або бурштинова кислота.
3. Спосіб за п. 1 або 2, який відрізняється тим, що рН лежить в межах від 1,0 до 5,5.
4. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що включає ферментацію дріжджів в обмежених по вуглецю умовах.
5. Спосіб за будь-яким з пп. 1-4 який відрізняється тим, що він відбувається у присутності додаткового донора електрона.
6. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що дріжджі належать до виду Saccharomyces cerevisiae.
7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що дріжджами є генетично модифіковані дріжджі.
8. Спосіб за п. 7, який відрізняється тим, що генетично модифіковані дріжджі містять нуклеотидну послідовність, що кодує гетерологічний фермент, вибраний з групи, що складається з фосфоенолпіруваткарбоксикінази, фумаратредуктази і фумарази.
Текст
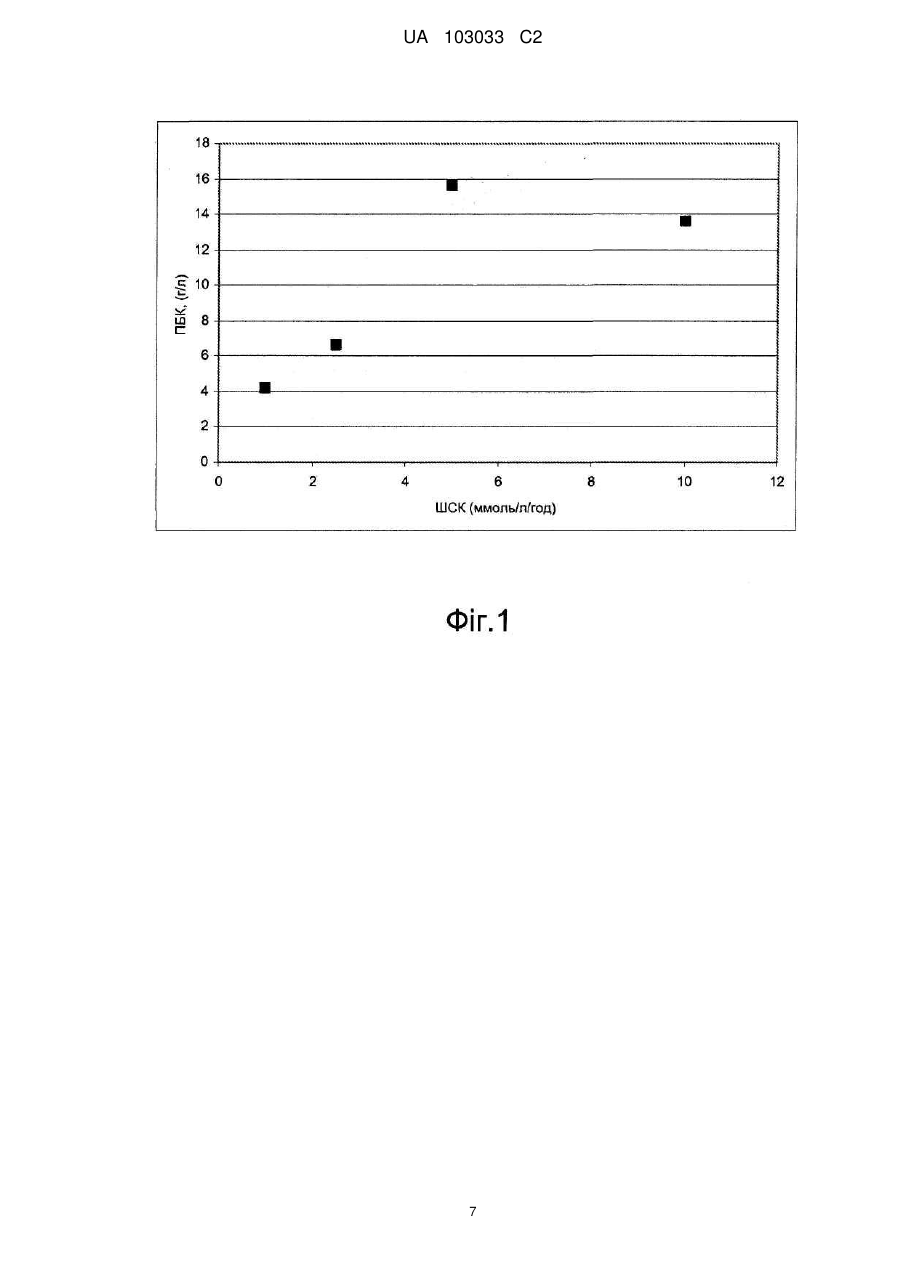
Реферат: Винахід належить до способу одержання дикарбонових кислот, який включає ферментацію дріжджів у присутності вуглеводвмісних субстратів і малих кількостей кисню при значенні рН нижче найнижчого рKа дикарбонової кислоти, при якому питома швидкість споживання кисню становить від 8 до 0,2 ммоль/г сухої біомаси/год. UA 103033 C2 (12) UA 103033 C2 UA 103033 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки, до якої належить винахід Даний винахід належить до способу отримання дикарбонових кислот. Зокрема, винахід належить до отримання дикарбонових кислот за допомогою ферментації дріжджів. Попередній рівень техніки Дикарбонові кислоти, такі як фумарова кислота і бурштинова кислота, є важливими сполуками, які використовують в харчовій промисловості для приготування і зберігання їжі, в медичній промисловості для складання лікарських препаратів та інших промислових застосувань, таких як мономери і (біо)полімери. Для задоволення потреби, що зростає, в дикарбонових кислотах, розробляються ефективніші і економічніші способи виробництва. Дикарбонові кислоти традиційно отримують ферментацією бактерій, яка може давати великі кількості дикарбонових кислот. Це описано, наприклад, в US 5573931, в якому описаний спосіб отримання бурштинової кислоти у високих концентраціях з використанням певного бактерійного штаму. Проте, одним дуже серйозним недоліком, пов'язаним з використанням бактерій для отримання дикарбонових кислот, є утворення солі дикарбонової кислоти. У разі використання бактерій рН під час ферментації слід підтримувати в межах 6-7, що вище за значення рКа всіх дикарбонових кислот. Внаслідок цього більша частина кислот утворюватиметься в їх сольовій формі, а солі необхідно перетворювати на кислоту. У процесах великомасштабного виробництва це практично невигідно і неефективно та підвищує виробничі витрати. Для отримання органічних кислот використовуються також і мікроорганізми, що не є бактеріями. У ЕР 0424384 розкривається аеробний спосіб отримання органічних кислот за допомогою гриба виду Rhizopus в середовищі, що містить карбонат кальцію. У ЕР 1183385 для отримання молочної кислоти розкриваються генетично змінені дріжджові клітини з негативним фенотипом Crabtree і що містять екзогенну молекулу нуклеїнової кислоти. Детальний опис винаходу Даний винахід належить до способу отримання дикарбонових кислот. Спосіб включає ферментацію дріжджів у присутності субстрату, що містить вуглеводи, і невеликих кількостей кисню при значенні рН нижче за рКа дикарбонової кислоти. Спосіб даного винаходу забезпечує високі виходи дикарбонової кислоти як продукту, спрощує подальшу обробку і є економічнішим, ніж існуючі способи, в яких утворюється сіль, яку потім необхідно перетворювати на кислоту. Оскільки дикарбонові кислоти мають більш за одне значення рК а, рН повинне бути нижче найнижчого рКа дикарбонової кислоти. Для більшості кислот рН повинне бути в межах від 1,0 до 5,5, переважно від 2,0 до 4,0. У одному з варіантів здійснення бурштинову кислоту отримують при значенні рН 3,0. Інша перевага полягає в тому, що завдяки низькому значенню рН знижується вірогідність забруднення. Стадії виробництва кислоти переважно передує стадія утворення біомаси, метою якої є оптимальне отримання біомаси. На стадії утворення біомаси рН лежить в межах від 2 до 7, переважно в межах від 3 до 6 і, переважніше, в межах від 4 до 5. Спосіб відповідно до даного винаходу більш економічний і може давати зниження витрат на 30%. Однією з причин цього є значне зниження витрат на тітрант. Спосіб може бути використаний для отримання будь-якої дикарбонової кислоти. Відповідні приклади включають адипінову кислоту, фумарову кислоту, ітаконову кислоту, бурштинову кислоту, малеїнову кислоту, щавлеву кислоту. Переважними дикарбоновими кислотами є бурштинова кислота, фумарова кислота і малеїнова кислота. Дріжджі, що використовуються в способі, можуть бути будь-які відповідні дріжджі. Відповідні приклади дріжджів включають Saccharomyces, Schizosaccharomyces, Kluyveromyces, Candida, Pichia і Yarrowia, такі як види Saccharomyces cerevisiae, Schizosaccharomyces pombe, Kluyvermoces lactis, Candida sonorensis, Pichia stipidis і Yarrowia lipolytica. У одному з варіантів здійснення використовуваним у способі мікроорганізмом є Saccharomyces cerevisiae мікроорганізм, що є широко вживаним і таким, що представляє промисловий інтерес мікроорганізмом. В одному з варіантів здійснення дріжджі відповідно до даного винаходу є генетично модифікованими дріжджами. Відповідно до представлення заявки, генетично модифіковані дріжджі в способі відповідно до даного винаходу визначаються як дріжджові клітини, які містять нуклеотидну послідовність або поліпептидну послідовність, яка не міститься природним чином в дріжджовій клітині, або трансформовані або генетично модифіковані цією послідовністю, або ж містять додаткову копію або копії послідовності ендогенної нуклеїнової кислоти. Дикий тип дріжджової клітини визначається в заявці як клітина-пращур для рекомбінантної клітини. Дріжджі в способі даного винаходу є переважно генетично модифікованими дріжджами, що містять нуклеотидну послідовність, що кодує гетерологічний фермент, вибраний з групи, що 1 UA 103033 C2 5 10 15 20 25 30 35 40 45 50 55 60 складається з фосфоєнолпіруват-карбоксикінази, фумарат-редуктази і фумарази. Переважні варіанти здійснення гетерологічних ферментів визначені нижче. Вираз «гомологічний», коли він використовується для зазначення спорідненості між даною (рекомбінантною) нуклеїновою кислотою або поліпептидною молекулою і даним організмомгосподарем або клітиною-господарем, слід розуміти як такий, що означає, що в природі нуклеїнова кислота або поліпептидна молекула продукуються клітиною-господарем або організмами одних і тих самих видів, переважно одного і того ж різновиду або штаму. Вираз «гетерологічний», коли він використовується відносно якої-небудь нуклеїнової кислоти (ДНК або РНК) або білка, відноситься до нуклеїнової кислоти або білка, які не зустрічаються природним чином як частина організму, клітина, геном або послідовність ДНК або РНК, в яких вони присутні, або які знаходяться в якій-небудь клітині або ділянці (ділянках) в геномі або послідовності ДНК або РНК, які відрізняються від структур, в яких вони знаходяться в природі. Гетерологічні нуклеїнові кислоти або білки не є ендогенними по відношенню до клітини, в яку їх вводять, але отримують з якої-небудь іншої клітини, отриманої синтетичним або рекомбінантним методом. Генетично модифіковані дріжджі переважно містять нуклеотидну послідовність, що кодує фосфоєнолпіруват (PEP) - карбоксикіназу. (PEP)-карбоксикіназа (ЄС 4.1.1.49) є переважно гетерологічним ферментом переважно бактерійного походження. Конкретніше, фермент, що володіє РЕР-карбоксикіназною активністю, походить з Escherichia coli, Mannheimia sp., Actinobacillus sp. або Anaerobiospirillum sp., ще конкретніше з Mannheimia succiniciproducens або Actinobacillus succinogenes. У одному з варіантів здійснення РЕР-карбоксикіназу отримують з Actinobacillus succinogenes (РСКа), де РСКа переважно заздалегідь модифікований шляхом заміни EGY в положенні 120-122 на амінокислотну послідовність DAF. Дріжджова клітина відповідно до даного винаходу переважно генетично модифікована РЕР-карбоксикіназою, послідовність якій щонайменше на 80, 85, 90, 95, 99 або на 100% ідентична амінокислотна послідовність SEQ ID NO: 6. У іншому переважному варіанті здійснення генетично модифіковані дріжджі в способі відповідно до даного винаходу містять нуклеотидну послідовність, що кодує фумарат-редуктазу. Фумарат-редуктаза є переважно гетерологічним ферментом, переважно NAD(H)-залежною фумарат-редуктазою будь-якого відповідного походження і може бути, наприклад, отримана з бактерій, грибів, найпростіших або рослин. Дріжджі в способі відповідно до даного винаходу переважно містять NAD(H)-залежну фумарат-редуктазу, переважно отриману з Trypanosoma sp., наприклад з Trypanusoma brucei. У одному з переважних варіантів здійснення нуклеотидна послідовність, кодуюча NAD(H)-залежна фумарат-редуктаза, експресується в цитозолі. У тому випадку, коли нуклеотидна послідовність, кодуюча NAD(H)-залежна фумарат-редуктаза, містить пероксисомальний або мітохондріальний націлюючий сигнал, щоб запобігти пероксисомальному або мітохондріальному націлюванню ферменту, може виявитися здатним модифікувати або видалити ряд амінокислот (і відповідних їм нуклеотидних послідовностей в кодуючій нуклеотидній послідовності). Присутність пероксисомального націлюючого сигналу може бути визначена за допомогою, наприклад, методу, розкритого Schluter et al, Nucleic acid Research 2007, 35, D815-D822. Переважно, щоб дріжджова клітина відповідно до даного винаходу була генетично модифікована NAD(H)-залежною фумарат-редуктазою, послідовність якої щонайменше на 80, 85, 90, 95, 99 або 100% ідентична амінокислотній послідовності SEQ ID NO: 7. У ще одному переважному варіанті здійснення генетично модифіковані дріжджі в способі відповідно до даного винаходу містять нуклеотидну послідовність, кодуючу фумаразу, яка може бути як гетерологічним, так і гомологічним ферментом. Нуклеотидна послідовність, що кодує гетерологічну фумаразу може бути будь-якого відповідного походження, переважно мікробного походження і переважно може бути отримана з дріжджів, зокрема з Saccharomyces cerevisiae або filamentous fungus, наприклад Rhizopus oryzae. Переважно, щоб дріжджі в способі відповідно до даного винаходу надекспресували нуклеотидну послідовність, кодуючу фумаразу, яка б на щонайменше 70, переважно на щонайменше 75, 80, 85, 90, 92, 94, 95, 96, 97, 98, або 99% або на 100% була ідентична амінокислотній послідовності SEQ ID NO: 8. У ще одному переважному варіанті здійснення генетично модифіковані дріжджі в способі відповідно до даного винаходу містять додатково нуклеотидну послідовність, кодуючу малатдегідрогеназу (MDH), яка проявляє активність в цитозолі при експресуванні нуклеотидної послідовності. У MDH переважно відсутній пероксисомальний або мітохондріальний націлюючий сигнал, щоб локалізувати фермент в цитозолі. Цитозольною MDH може бути будьяка відповідна гомологічна або гетерологічна малат-дегідрогеназа. Переважно, щоб дріжджова клітина відповідно до даного винаходу містила нуклеотидну послідовність, кодуючу малат 2 UA 103033 C2 5 10 15 20 25 30 35 40 45 50 55 60 дегідрогеназу, яка б на щонайменше 70, переважно на щонайменше 75, 80, 85, 90, 92, 94, 95, 96, 97, 98 або 99% була ідентична амінокислотній послідовності SEQ ID NO: 9. У ще одному переважному варіанті здійснення генетично модифіковані дріжджі в способі відповідно до даного винаходу містять нуклеотидну послідовність, що кодує білок-носій дикарбонової кислоти, переважно білок-носій малеїнової кислоти (МАЕ). Білок-носій дикарбонової кислоти може бути гомологічним або гетерологічним білком. Переважно білокносій дикарбонової кислоти є гетерологічним білком. Білок-носій дикарбонової кислоти може бути отриманий з будь-якого відповідного організму, переважно з Schizosaccharomyces pombe. Білком-носієм дикарбонової кислоти переважно є білок-носій малеїнової кислоти (МАЕ), послідовність якого на щонайменше 80, 85, 90, 95 або 99% або на 100% ідентична послідовності SEQ ID NO: 10. Використовуваними в способі відповідно до даного винаходу дріжджами є генетично модифіковані дріжджі, що містять гетерологічну РЕР-карбоксикіназу, гетерологічну NAD(Ρ)Ηзалежну фумарат-редуктазу, гетерологічну фумаразу, гетерологічний білок-носій малеїнової кислоти і цитозольну малат-дегідрогеназу. Переважні варіанти здійснення цих ферментів є такими, як описано вище. Ідентичність послідовності визначається в заявці як співвідношення між двома або більш амінокислотними (поліпептидними або білковими) послідовностями або двома або більш нуклеїновокислотними (полінуклєотидними) послідовностями, що визначається шляхом порівняння цих послідовностей. Зазвичай ідентичності послідовностей або подібності між послідовностями порівнюються по всій довжині порівнюваних послідовностей. У галузі, до якої належить винахід, «ідентичність» означає також, залежно від конкретного випадку, ступінь пов'язаності між амінокислотною і нуклеїновокислотною послідовностями, яка визначається відповідністю між ланцюжками цих послідовностей. Переважні методи визначення ідентичності передбачають знаходження найбільшої відповідності між випробовуваними послідовностями. Методи визначення ідентичності і подібності кодифікують в наявних у вільному доступі комп'ютерних програмах. Переважні методи визначення ідентичності і подібності між двома послідовностями, закладені в комп'ютерних програмах, включають BLASTP і BLASTN, вільний доступ до яких надають NCBI та інші джерела (BLAST Manual, Altschul, S., et al., NCBI NLM NIH Bethesda, MD 20894). Переважними параметрами для порівняння амінокислотних послідовностей з використанням BLASTP є gap open 11.0, gap extend 1, Blosum 62 matrix. Використовуваний в заявці вираз «нуклеїнова кислота» включає дезоксирибонуклеотидний або рибонуклеотидний полімер, тобто полінуклеотид, або в одно-, або в двоспіральній формі, і, якщо не обумовлені обмеження, охоплює відомі аналоги, що володіють невід'ємною властивістю природних нуклеотидів, тобто здатні гібридизуватися з односпіральними нуклеїновими кислотами аналогічним чином, як це відбувається з природними нуклеотидами (наприклад, з пептидо-нуклеїновими кислотами). Полінуклеотид може бути повнорозмірним або підпослідовністю нативного або гетерологічного структурного або регуляторного гена. Якщо не обумовлене інше, вказаний вище вираз включає як вказану послідовність, так і комплементарну їй послідовність. У одному з переважних варіантів здійснення дріжджі в способі відповідно до даного винаходу надекспресують нуклеотидні послідовності, що кодують який-небудь з названих вище ферментів. У техніці, що відноситься до винаходу, є різні засоби для надекспресії нуклеотидних послідовностей, що кодують ферменти в дріжджах в способі винаходу. Зокрема, нуклеотидна послідовність, що кодує який-небудь фермент, може бути надекспресована шляхом збільшення кількості копій гена, що кодує цей фермент в клітині, наприклад, шляхом інтеграції додаткових копій гена в геномі клітини, експресії гена з центромірного вектора, з епісомального мультікопійного вектора експресії або шляхом введення (епісомального) вектора експресії, який містить безліч копій гена. Надекспресія ферменту відповідно до винаходу переважно досягається за допомогою (сильного) конститутивного промотору. Вуглеводвмісним субстратом може бути будь-який вуглеводвмісний субстрат, включаючи мелясу, сік цукрового очерету, пентози і гексози, такі як глюкоза, фруктоза, ксилоза, арабіноза. Переважним вуглеводвмісним субстратом є субстрат, що містить глюкозу, такий як мальтоза, сахароза, глюкоза або глюкозний сироп. Вміст вуглеводу в вуглеводвмісному субстраті переважно більше 50 ваг. %, переважніше більше 55, 60, 65, 70, 75, 80 ваг. % і, найпереважніше, більше 85, 90, 95 або 99 ваг. % з розрахунку на суху вагу. Спосіб відповідно до даного винаходу переважно включає ферментацію дріжджів в обмежених по вуглецю (С) умовах. Обмежені по вуглецю умови визначаються в заявці як концентрація розчиненого вуглеводу нижча за 1 г/л, переважно нижче за 0,9 г/л або нижче за 3 UA 103033 C2 5 10 15 20 25 30 35 40 45 50 55 60 0,5 г/л розчиненого вуглеводу. Було встановлено, що ферментація дріжджів в обмежених по вуглецю умовах дає підвищений вихід бурштинової кислоти в порівнянні з необмеженими по вуглецю умовами. Необхідний для ферментації кисень може подаватися в будь-якій відповідній формі. У одному з варіантів здійснення кисень подається у вигляді повітря. Кисень слід подавати в невеликих кількостях. Це відбивається в швидкості споживання кисню (ШСК) і/або в питомій швидкості споживання кисню (qO2) дріжджами. ШСК в даному винаході нижче приблизно 8,0 ммоль кисню/л/год, переважно нижче приблизно 5,0, 4,0, 3,0 або 2,0 ммоль кисню/л/год, переважніше нижче приблизно 0,1 або 0,5 ммоль кисню/л/год і при цьому переважно більше 0,01 ммоль кисню/л/год. Питома швидкість споживання кисню (qO2) в способі винаходу лежить в межах від 8 до 0,5 ммоль кисню/г сухої біомаси/год, переважно від 5, 4, 3 або 2 до приблизно 0,4, 0,3 або 0,2 ммоль кисню/г біомаси/год. Спосіб відповідно до даного винаходу може здійснюватися в періодичному, поповнюваному періодичному або безперервному режимі. Ці режими ферментації відомі фахівцям в даній галузі. Залежно від режиму ферментації концентрація біомаси під час ферментації може більшою чи меншою мірою варіювати. При періодичному і поповнюваному періодичному режимі концентрація біомаси зазвичай підвищується. Внаслідок цього питома швидкість споживання кисню при періодичному і поповнюваному періодичному режимі зазвичай падає. Температура способу звичайно складає від 10 до 40°С, переважно від 20 до 35°С і, переважніше, від 30 до 35°С. В одному з варіантів здійснення способу відповідно до даного винаходу разом з вуглеводвмісним субстратом присутній додатковий донор електрона. Додатковим донором електрона переважно є органічний донор електрона. Відповідні приклади органічних донорів електрона включають гліцерин, форміат і поліоли такі як маніт, сорбіт і ксиліт. Короткий опис фігур Фіг.1 Вплив застосованої ШСК на продукцію бурштинової кислоти після 90 год при рН 3. Приклади Приклад 1. Отримання бурштинової кислоти за допомогою Saccharomyces cerevisiae 1.1. Конструювання дріжджового штаму 1.1.1. Конструювання експресуючих конструкцій Експресуюча конструкція pGBS414PPK-3 була створена після рестрикції вектора експресії prs414 у S. Cerevisiae (Sirkoski R.s. and Hieter Ρ, Genetics, 1989, 122(1):19-27) за допомогою BamHI/NotI і подальшого лігандування в цьому векторі фрагмента BamHI/NotI-рестрикції, який складається з синтетичної генної конструкції для фосфоєнолпіруват-карбоксикінази (походження: Actinobacillus succinogenes) (SEQ ID NO: 1). Отримана в результаті лігандування суміш була використана для трансформації клітин E.coli TOP10 (Invitrogen) з утворенням дріжджової експресуючої конструкції pGBS414PPK-1. Далі pGBK414PPK-1 була піддана рестрикції за допомогою AscI і Notl. Щоб створити pGBS414PPK-3, фрагмент AscI/NotIрестрикції, що складається з синтетичної генної конструкції (SEQ ID NO: 2) для глікосомальної фумарат-редуктази (з Т. brucei (FRDg)), був лігандований з утворенням підданого рестрикції вектора pGBS414PPK-1. Отримана в результаті лігандування суміш була використана для трансформації клітин E.coli TOP10 (Invitrogen) з утворенням дріжджової експресуючої конструкції pGBS414PPK-3. Експресуюча конструкція pGBS415FUM-3 була створена після рестрикції вектора експресії pRS415 у S. Cerevisiae (Sirkoski R.s. and Hieter Ρ, Genetics, 1989, 122(1):19-27) за допомогою BamHI/NotI і подальшого лігандування в цьому векторі фрагмента BamHI/NotI-рестрикції, що складається з синтетичної генної конструкції для фумарази (походження: Rhizopus oryzae) (SEQ ID NO: 3). Отримана в результаті лігандування суміш була використана для трансформації клітин E.coli TOP10 (Invitrogen) з утворенням дріжджової експресуючої конструкції PGBS415FUM-1. Далі pGBK415FUM-1 була піддана рестрикції за допомогою AscI і NotI. Щоб створити pGBS415FUM-3, фрагмент AsсІ/NotI-рестрикції, що складається з синтетичної генної конструкції (SEQ ID NO: 4) для пероксисомальної малат-дегідрогенази з S. cerevisiae (MDH3), був лігандований з утворенням підданого рестрикції вектора pGBS415FUM-1. Отримана в результаті лігандування суміш була використана для трансформації клітин E.coli TOP10 (Invitrogen) з утворенням дріжджової експресуючої конструкції pGBS415FUM-3. Експресуюча конструкція pGBS416MAE-1 була створена після рестрикції вектора експресії pRS416 у S. Cerevisiae (Sirkoski R.s. and Hieter P, Genetics, 1989, 122(1):19-27) за допомогою BamHI/NotI і подальшого лігандування в цьому векторі фрагмента BamHI/NotI-рестрикції, що складається з синтетичної генної конструкції (SEQ ID NO: 5) для носія малеїнової кислоти з 4 UA 103033 C2 5 10 15 Schizosaccharomyces pombe.). Отримана в результаті лігандування суміш була використана для трансформації клітин E.coli TOP10 (Invitrogen) з утворенням дріжджової експресуючої конструкції pGBS416MAE-1. 1.1.2. Конструювання штаму S. cerevisiae Плазміди pGBS414PPK-3, pGBS415FUM-3 та pGBS416MAE-1 (описані в пункті 1.1.) були трансформовані за допомогою електропорації в штамі RWB064 виду S. cerevisiae (МАТА ura352 leu2-112 trpl-289 adh1::lox adh2::lox gpdl::Kanlox) з метою створення штаму SUC-200, надекспресуючого РСКа, MDH3, FUMR, FRDg і SpMAE1. Всі гени були оптимізовані по кодонових парах для експресії S. cerevisiae згідно WO2008/000632. 1.2. S. cerevisiae, що продукує бурштинову кислоту при низькому рН і обмежених по кисню умовах Дріжджевий штам SUC-200 (МАТА ura3-52 leu2-112 trpl-289 adh1::lox adh2::lox gpdl::Kanlox, надекспресуючий РСКа, MDH3, FUMR, FRDg і SpMAE1) культивували в струшуваній колбі (2 300 мл) протягом 3 діб при 30°С і 229 об/хв. Як базове середовище була використана Verduyn (Verduyn et. al., 1992, Yeast 8, 501-517), яку модифікували джерелами вуглецю і азоту, як показано в таблиці 1. Таблиця 1 Склад середовища перед культивуванням в струшуваній колбі Сполука С6Н12О6Н2О (NH2)2CO КН2РО4 MgSO47H2O а Концентрація (г/л) 20,0 2,3 3,0 0,5 1 1 Вітамінний розчин 20 Компонент Біотин (D-) Са D(+) пантотенат Нікотинова кислота Міоінозит Тиамінхлорид-гідрохлорид Піридоксил гідрохлорид п-амінобензойна кислота b Формула C10H16N2O3S C18H32CaN2O10 C6H5NO2 С6Н12O6 C12H18Cl2N4OSxH2O C8H12ClNO3 C7H7NO2 Розчин мікроелементів Формула C10H14N2Na2O82H2O (EDTA) ZnSO47H2O MnCl22H2O CoCl26H2O CuSO45H2O Na2MoO42H2O CaCl22H2O FeSO47H2O H3BO3 KI Концентрація (г/кг) 15.00 4,50 0,84 0,30 0,30 0,40 4,50 3,00 1,00 0,10 5 Концентрація (г/кг) 0,05 1,00 1,00 25.00 1,00 1,00 0,20 UA 103033 C2 Вслід за цим вміст струшуваних колб був перенесений в 10-л ферментор (початкова вага 6 кг), в якому знаходилося наступне середовище: Таблиця 2 Вихідний матеріал Сульфат амонію Однозаміщений фосфат калію Сульфат магнію Розчин мікроелементів Вітамінний розчин 5 10 15 20 25 30 35 Формула (NH4)2SO4 КН2РО4 MgSO47H2O Концентрація (г/л) 2,5 3,0 0,5 1 1 рН контролювали на рівні 3,0 додаванням б н. КОН. Температуру контролювали на рівні 30 °С. Концентрацію глюкози обмежували (< 1 г/л) шляхом регулювання додавання сировини у ферментор. При ферментації застосовували різні швидкості споживання кисню (ШСК), що давало обмеження по кисню (Фіг.1). Застосовували загальну швидкість потоку 0,33 об/об середовища, включаючи 10% СО2, які забезпечують достатню кількість СО2 для ефективної продукції бурштинової кислоти. Результати з різними ШСК, що застосовуються при виробництві бурштинової кислоти, показані на Фіг.1. Для підтримки стійкої продукції при рН 3 був необхідний мінімальний об'єм аерації. При ШСК вище 5 ммоль/л/год продукція бурштинової кислоти була нижчою. При культивації протягом 90 год для типової концентрації біомаси мав місце приріст рівний 8 г сухої ваги на 1 л. Відповідним чином, в процесі ферментації безперервно знижувалася питома швидкість споживання кисню (qO2) . У одній з ферментацій застосовували ШСК рівну 10 ммоль/л/год, при якій qO2 падала від 10 до 1,25 ммоль/г сухої біомаси/год, і ШСК рівну 1 ммоль/л/год, при якій qO2 падала від 1 до 0,1 ммоль/г сухої біомаси/год. ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання дикарбонових кислот, який включає ферментацію дріжджів у присутності вуглеводвмісних субстратів і малих кількостей кисню при значенні рН нижче найнижчого рK а дикарбонової кислоти, в якому кисень подається при питомій швидкості споживання кисню від 8 до 0,2 ммоль/г сухої біомаси/год. 2. Спосіб за п. 1, який відрізняється тим, що дикарбоновою кислотою є фумарова кислота, малеїнова кислота або бурштинова кислота. 3. Спосіб за п. 1 або 2, який відрізняється тим, що рН лежить в межах від 1,0 до 5,5. 4. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що включає ферментацію дріжджів в обмежених по вуглецю умовах. 5. Спосіб за будь-яким з пп. 1-4 який відрізняється тим, що він відбувається у присутності додаткового донора електрона. 6. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що дріжджі належать до виду Saccharomyces cerevisiae. 7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що дріжджами є генетично модифіковані дріжджі. 8. Спосіб за п. 7, який відрізняється тим, що генетично модифіковані дріжджі містять нуклеотидну послідовність, що кодує гетерологічний фермент, вибраний з групи, що складається з фосфоенолпіруваткарбоксикінази, фумаратредуктази і фумарази. 6 UA 103033 C2 7 UA 103033 C2 8 UA 103033 C2 9 UA 103033 C2 10 UA 103033 C2 11 UA 103033 C2 12 UA 103033 C2 13 UA 103033 C2 14 UA 103033 C2 15 UA 103033 C2 16 UA 103033 C2 17 UA 103033 C2 18 UA 103033 C2 19 UA 103033 C2 20 UA 103033 C2 21 UA 103033 C2 22 UA 103033 C2 23 UA 103033 C2 24 UA 103033 C2 25 UA 103033 C2 26 UA 103033 C2 27 UA 103033 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDicarboxylic acid production by fermentation at low ph
Автори російськоюJansen, Mickel Leonardus August, Verwaal, Rene
МПК / Мітки
Мітки: низьких, кислот, дикарбонових, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/34-103033-sposib-oderzhannya-dikarbonovikh-kislot-za-nizkikh-rn.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання дикарбонових кислот за низьких рн</a>
Попередній патент: Селективні антитіла проти гепсидину-25 та їх застосування
Наступний патент: Похідні піколінаміду як інгібітори кінази
Випадковий патент: Спосіб створення розпиленого потоку рідини