Заміщені аміди, що діють на рецептор канабіноїд-1
Номер патенту: 76590
Опубліковано: 15.08.2006
Автори: Армстронг Хелен М., Джуелл Джеймс П., Ліу Пінг, Кві Хонгбо, Шах Шренік К., Хегманн Уілльям К., Ланза Томас Дж., мол., Чанг Лінда Л., Лін Лінус С., Гутхіконда Равіндра Н.
Формула / Реферат
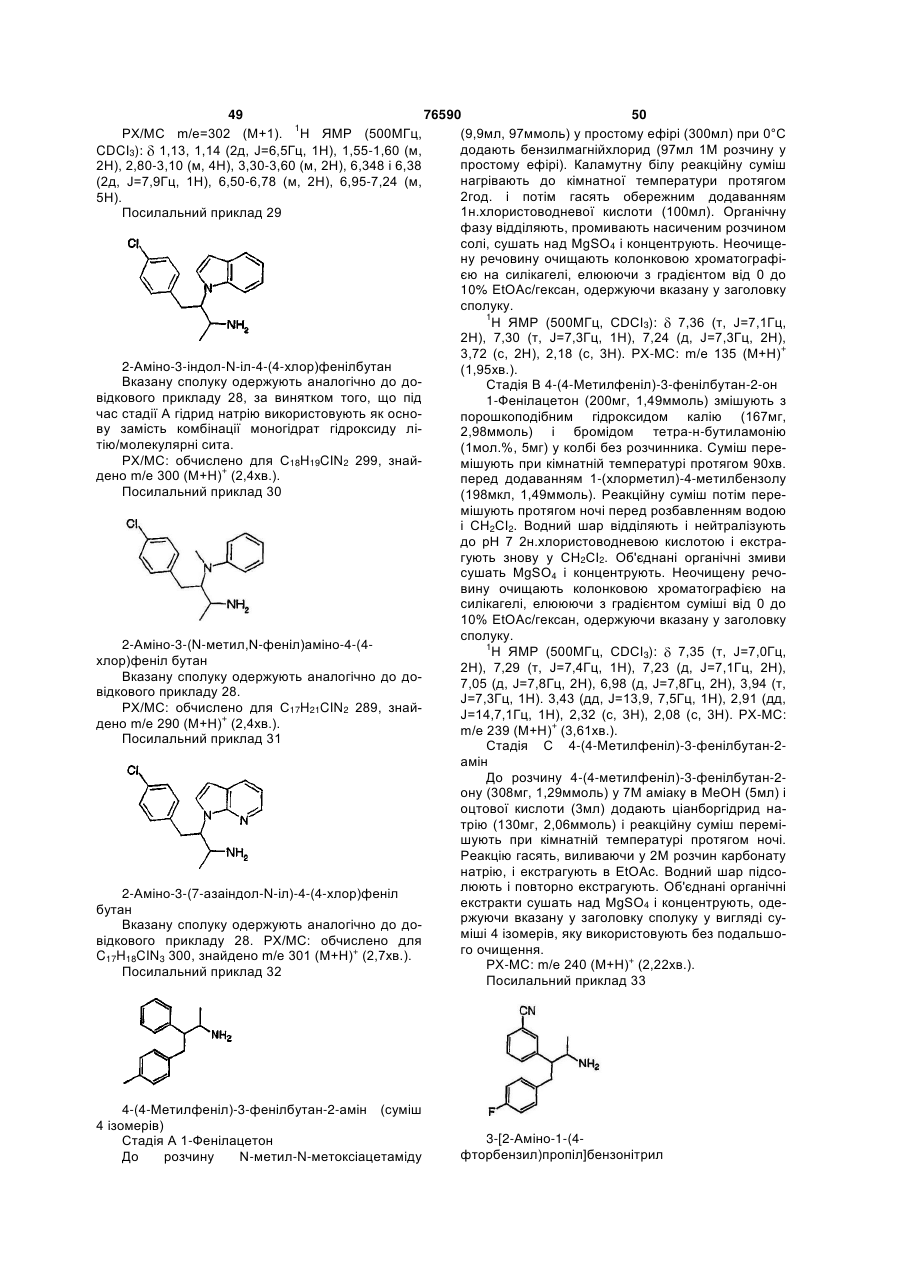
1. Сполука структурної формули І:
 , (I)
, (I)
або її фармацевтично прийнятна сіль, де:
R1 вибраний з:
(1) циклогетероалкілу,
(2) арилу,
(3) гетероарилу і
(4) –NRaRc;
де арил і гетероарил необов'язково заміщені одним-трьома замісниками, незалежно вибраними з Rb;
R2 вибраний з:
(1) С1-10 алкілу,
(2) С3-10 циклоалкіл-С1-4 алкілу,
(3) арил-С1-4 алкілу і
(4) гетероарил-С1-4 алкілу;
де кожний циклоалкіл, арил і гетероарил необов'язково заміщений одним-трьома замісниками, незалежно вибраними з Rb;
кожний Ra незалежно вибраний з:
(1) водню,
(2) метилу і
(3) –СF3;
кожний Rb незалежно вибраний з:
(1) галогену,
(2) ціано,
(3) трифторметилу,
(4) трифторметокси,
(5) С1-3 алкілокси і
(6) С1-3 алкілу;
Rc незалежно вибраний з:
(1) водню,
(2) С1-6 алкілу,
(3) арилу,
(4) гетероарилу,
(5) арилметилу і
(6) гетероарилметилу,
кожний Rc може бути незаміщений або заміщений одним-трьома замісниками, вибраними з Rh;
Rd незалежно вибраний з:
(1) циклоалкілу,
(2) арилу і
(3) гетероарилу,
кожний Rd може бути незаміщений або заміщений одним-трьома замісниками, вибраними з Rh;
кожний Rh незалежно вибраний з:
(1) галогену,
(2) С1-3 алкілу,
(3) -CN і
(4) -СF3,
де, коли піридильні групи є незаміщеними на азоті, вони можуть бути необов'язково представлені як N-оксид.
2. Сполука за п. 1, де R1 вибраний з:
(1) фенілу,
(2) піридилу,
(3) індолілу,
(4) 7-азаіндолілу,
(5) тіофенілу і
(6)  ;
;
де кожний арил і гетероарил необов'язково заміщений одним або двома замісниками, незалежно вибраними з Rb, і кожний піридил може бути необов'язково представлений як N-оксид;
та її фармацевтично прийнятні солі.
3. Сполука за п. 2, де R1 вибраний з:
(1) фенілу,
(2) 3-ціанофенілу,
(3) 3-метилфенілу,
(4) 3,5-дифторфенілу,
(5) 3-піридилу,
(6) 5-хлор-3-піридилу,
(7) 5-метил-3-піридилу,
(8) 5-ціано-3-піридилу,
(9) 1-оксидо-5-ціано-3-піридилу,
(10) 1-індолілу,
(11) 7-азаіндол-N-ілу,
(12) 2-тіофенілу і
(13)  ;
;
та її фармацевтично прийнятні солі.
4. Сполука за п. 3, де R1 означає 5-ціано-3-піридил, та її фармацевтично прийнятні солі.
5. Сполука за п. 2, де R2 вибраний з:
(1) С 1-6 алкілу,
(2) С3-6 циклоалкілметилу,
(3) фенілметилу,
(4) гетероарилметилу,
де кожний циклоалкіл, арил і гетероарил необов'язково заміщений одним-трьома замісниками, незалежно вибраними з Rb,
та її фармацевтично прийнятні солі.
6. Сполука за п. 5, де R2 вибраний з:
(1) 2-метилпропілу,
(2) н-пентилу,
(3) циклобутилметилу,
(4) циклопентилметилу,
(5) циклогексилметилу,
(6) бензилу,
(7) 4-хлорбензилу,
(8) 4-метилбензилу,
(9) 4-фторбензилу,
(10) 4-метоксибензилу і
(11) (5-хлор-2-піридил)метилу;
та ії фармацевтично прийнятні солі.
7. Сполука за п. 2, де Rd вибраний з:
(1) С4-6 циклоалкілу,
(2) арилу і
(3) гетероарилу,
де Rd може бути незаміщений або заміщений одним або двома замісниками, вибраними з Rh,
та ії фармацевтично прийнятні солі.
8. Сполука за п. 7, де Rd вибраний з:
(1) фенілу,
(2) піридилу і
(3) піримідилу,
де Rd може бути незаміщений або заміщений одним або двома замісниками, вибраними з Rh,
та її фармацевтично прийнятні солі.
9. Сполука за п. 8, де Rd вибраний з:
(1) фенілу,
(2) 4-хлорфенілу,
(3) 3-хлорфенілу,
(4) 3,5-дифторфенілу,
(5) 3,5-дихлорфенілу,
(6) 2-піридилу,
(7) 5-хлор-2-піридилу,
(8) 6-метил-2-піридилу,
(9) 5-трифторметил-2-піридилу,
(10) 4-трифторметил-2-піридилу,
(11) 4-трифторметил-2-піримідилу і
(12) 6-трифторметил-4-піримідилу, та її фармацевтично прийнятні солі.
10. Сполука за п. 1, вибрана з таких як:
(1) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2-(4-хлорфенілокси)-2-метилпропанамід;
(2) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2-(2-піридилокси)-2-метилпропанамід;
(3) N-[3-(4-хлорфеніл)-1-метил-2-(3-піридил)пропіл]-2-(4-хлорфенілокси)-2-метилпропанамід;
(4) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2-(3,5-дифторфенілокси)-2-метилпропанамід;
(5) N-[3-(4-хлорфеніл)-2-феніл-1-метилпропіл]-2-(3,5-дихлорфенілокси)-2-метилпропанамід;
(6) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2-(3-хлорфенілокси)-2-метилпропанамід;
(7) N-[3-(4-хлорфеніл)-2-(3,5-дифторфеніл)-1-метилпропіл]-2-(2-піридилокси)-2-метилпропанамід;
(8) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2-(5-хлор-2-піридилокси)-2-метилпропанамід;
(9) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2-(6-метилпіридилокси)-2-метилпропанамід;
(10) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2-(фенілокси)-2-метилпропанамід;
(11) N-[(3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2-(5-трифторметилпіридилокси)-2-метилпропанамід;
(12) N-[3-(4-хлорфеніл)-2-(3-піридил)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(13) N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(14) N-[3-(4-xлopфeнiл)-2-(5-xлop-3-пipидил)-1-мeтилпpoпiл]-2-(5-тpифтopметил-2-піридилокси)-2-метилпропанамід;
(15) N-[3-(4-хлорфеніл)-2-(5-метил-3-піридил)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(16) N-[3-(4-хлорфеніл)-2-(5-ціано-3-піридил)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(17) N-[3-(4-хлорфеніл)-2-(3-метилфеніл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(18) N-[3-(4-хлорфеніл)-2-феніл-1-метилпропіл]-2-(4-трифторметил-2-піридилокси)-2-метилпропанамід;
(19) N-[3-(4-хлорфеніл)-2-феніл-1-метилпропіл]-2-(4-трифторметил-2-піримідилокси)-2-метилпропанамід;
(20) N-[3-(4-хлорфеніл)-1-метил-2-(тіофен-3-іл)пропіл]-2-(5-хлор-2-піридилокси)-2-метилпропанамід;
(21) N-[3-(5-хлор-2-піридил)-2-феніл-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(22) N-[3-(4-метилфеніл)-1-метил-2-фенілпропіл]-2-(4-трифторметилфенілокси)-2-метилпропанамід;
(23) N-[3-(4-фторфеніл)-2-(3-ціанофеніл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(24) N-[3-(4-хлорфеніл)-2-(1-індоліл)-1-метилпропіл]-2-(5-трифторметил-2-оксипіридин-2-іл)-2-метилпропанамід;
(25) N-[3-(4-хлорфеніл)-2-(7-азаіндол-N-іл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(26) N-[3-(4-хлорфеніл)-2-(1-індолініл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(27) N-[3-(4-хлорфеніл)-2-(N-метиланіліно)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(28) N-[3-(4-метоксифеніл)-2-(3-ціанофеніл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(29) N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1-метилпропіл]-2-(6-трифторметил-4-піримідилокси)-2-метилпропанамід;
(30) N-[2-(3-ціанофеніл)-1,4-диметилпентил]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(31) N-[3-(4-хлорфеніл)-2-(1-оксидо-5-ціано-3-піридил)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(32) N-[2-(3-ціанофеніл)-3-циклобутил-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(33) N-[2-(3-ціанофеніл)-1-метилгептил]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(34) N-[2-(3-ціанофеніл)-3-циклопентил-1-метилпропіл]-2-(5 -трифторметил-2-піридилокси)-2-метилпропанамід;
(35) N-[2-(3-ціанофеніл)-3-циклогексил-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
та їх фармацевтично прийнятних солей.
11. Сполука за п. 9, де Rd означає 5-трифторметил-2-піридил,
та її фармацевтично прийнятні солі.
12. Сполука за п. 11, вибрана з таких як:
(1) N-[(3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2-(5-трифторметилпіридилокси)-2-метилпропанамід;
(2) N-[3-(4-хлорфеніл)-2-(3-піридил)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(3) N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(4) N-[3-(4-хлорфеніл)-2-(5-хлор-3-піридил)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(5) N-[3-(4-хлорфеніл)-2-(5-метил-3-піридил)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(6) N-[3-(4-хлорфеніл)-2-(5-ціано-3-піридил)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(7) N-[3-(4-хлорфеніл)-2-(3-метилфеніл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(8) N-[3-(5-хлор-2-піридил)-2-феніл-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(9) N-[3-(4-фторфеніл)-2-(3-ціанофеніл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(10) N-[3-(4-хлорфеніл)-2-(1-індоліл)-1-метилпропіл]-2-(5-трифторметил-2-оксипіридин-2-іл)-2-метилпропанамід;
(11) N-[3-(4-хлорфеніл)-2-(7-азаіндол-N-іл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(12) N-[3-(4-хлорфеніл)-2-(1-індолініл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(13) N-[3-(4-хлорфеніл)-2-(N-метиланіліно)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(14) N-[3-(4-метоксифеніл)-2-(3-ціанофеніл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(15) N-[2-(3-ціанофеніл)-1,4-диметилпентил]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(16) N-[3-(4-хлорфеніл)-2-(1-оксидо-5-ціано-3-піридил)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(17) N-[2-(3-ціанофеніл)-3-циклобутил-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(18) N-[2-(3-ціанофеніл)-1-метилгептил]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(19) N-[2-(3-ціанофеніл)-3-циклопентил-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
(20) N-[2-(3-ціанофеніл)-3-циклогексил-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід;
та їх фармацевтично прийнятних солей.
13. Сполука за п. 1, що являє собою N-[3-(4-хлорфеніл)-2(S)-феніл-1(S)-метилпропіл]-2-(4-трифторметил-2-піримідилокси)-2-метилпропанамід, і її фармацевтично прийнятні солі.
14. Сполука за п. 1, що являє собою N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід, і її фармацевтично прийнятні солі.
15. Сполука за п. 1, що являє собою N-[3-(4-хлорфеніл)-2-(5-хлор-3-піридил)-1-метилпропіл]-2-(5-трифторметил-2-піридилокси)-2-метилпропанамід, і її фармацевтично прийнятні солі.
16. Композиція, що містить сполуку за п. 1 і фармацевтично прийнятний носій.
17. Застосування сполуки за п. 1 для виготовлення лікарського засобу, корисного для лікування захворювання, що опосередковується рецептором канабіноїду-1, у людини, яка потребує такого лікування.
18. Застосування за п. 17, де захворюванням, що опосередковується рецептором канабіноїду-1, є порушення харчування, пов'язане з надмірним споживанням їжі.
19. Застосування за п. 18, де порушенням харчування, пов'язаним з надмірним споживанням їжі, є ожиріння.
20. Застосування сполуки за п. 1 для виготовлення лікарського засобу для попередження ожиріння людини, схильної до такого ризику.
Текст
1. Сполука структурної формули І: O 2 (19) 1 3 76590 4 де, коли піридильні групи є незаміщеними на азоті, та ії фармацевтично прийнятні солі. вони можуть бути необов'язково представлені як 7. Сполука за п. 2, де Rd вибраний з: N-оксид. (1) С4-6 циклоалкілу, 2. Сполука за п. 1, де R1 вибраний з: (2) арилу і (1) фенілу, (3) гетероарилу, d (2) піридилу, де R може бути незаміщений або заміщений од(3) індолілу, ним або двома замісниками, вибраними з Rh, (4) 7-азаіндолілу, та ії фармацевтично прийнятні солі. (5) тіофенілу і 8. Сполука за п. 7, де Rd вибраний з: (1) фенілу, CH3 (2) піридилу і (3) піримідилу, N де Rd може бути незаміщений або заміщений одним або двома замісниками, вибраними з Rh, та її фармацевтично прийнятні солі. (6) ; 9. Сполука за п. 8, де Rd вибраний з: (1) фенілу, де кожний арил і гетероарил необов'язково замі(2) 4-хлорфенілу, щений одним або двома замісниками, незалежно (3) 3-хлорфенілу, вибраними з Rb, і кожний піридил може бути не(4) 3,5-дифторфенілу, обов'язково представлений як N-оксид; (5) 3,5-дихлорфенілу, та її фармацевтично прийнятні солі. (6) 2-піридилу, 3. Сполука за п. 2, де R1 вибраний з: (7) 5-хлор-2-піридилу, (1) фенілу, (8) 6-метил-2-піридилу, (2) 3-ціанофенілу, (9) 5-трифторметил-2-піридилу, (3) 3-метилфенілу, (10) 4-трифторметил-2-піридилу, (4) 3,5-дифторфенілу, (11) 4-трифторметил-2-піримідилу і (5) 3-піридилу, (12) 6-трифторметил-4-піримідилу, та її фармаце(6) 5-хлор-3-піридилу, втично прийнятні солі. (7) 5-метил-3-піридилу, 10. Сполука за п. 1, вибрана з таких як: (8) 5-ціано-3-піридилу, (1) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2(9) 1-оксидо-5-ціано-3-піридилу, (4-хлорфенілокси)-2-метилпропанамід; (10) 1-індолілу, (2) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2(11) 7-азаіндол-N-ілу, (2-піридилокси)-2-метилпропанамід; (12) 2-тіофенілу і (3) N-[3-(4-хлорфеніл)-1-метил-2-(3CH3 піридил)пропіл]-2-(4-хлорфенілокси)-2метилпропанамід; N (4) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2(3,5-дифторфенілокси)-2-метилпропанамід; (5) N-[3-(4-хлорфеніл)-2-феніл-1-метилпропіл]-2(3,5-дихлорфенілокси)-2-метилпропанамід; (13) ; (6) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2та її фармацевтично прийнятні солі. (3-хлорфенілокси)-2-метилпропанамід; 4. Сполука за п. 3, де R1 означає 5-ціано-3(7) N-[3-(4-хлорфеніл)-2-(3,5-дифторфеніл)-1піридил, та її фармацевтично прийнятні солі. метилпропіл]-2-(2-піридилокси)-22 5. Сполука за п. 2, де R вибраний з: метилпропанамід; (1) С 1-6 алкілу, (8) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2(2) С3-6 циклоалкілметилу, (5-хлор-2-піридилокси)-2-метилпропанамід; (3) фенілметилу, (9) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2(4) гетероарилметилу, (6-метилпіридилокси)-2-метилпропанамід; де кожний циклоалкіл, арил і гетероарил необов'я(10) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2зково заміщений одним-трьома замісниками, не(фенілокси)-2-метилпропанамід; b залежно вибраними з R , (11) N-[(3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2та її фармацевтично прийнятні солі. (5-трифторметилпіридилокси)-2-метилпропанамід; 6. Сполука за п. 5, де R2 вибраний з: (12) N-[3-(4-хлорфеніл)-2-(3-піридил)-1(1) 2-метилпропілу, метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(2) н-пентилу, метилпропанамід; (3) циклобутилметилу, (13) N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1(4) циклопентилметилу, метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(5) циклогексилметилу, метилпропанамід; (6) бензилу, (14) N-[3-(4-xлopфeнiл)-2-(5-xлop-3-пipидил)-1(7) 4-хлорбензилу, мeтилпpoпiл]-2-(5-тpифтopметил-2-піридилокси)-2(8) 4-метилбензилу, метилпропанамід; (9) 4-фторбензилу, (15) N-[3-(4-хлорфеніл)-2-(5-метил-3-піридил)-1(10) 4-метоксибензилу і метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(11) (5-хлор-2-піридил)метилу; метилпропанамід; 5 76590 6 (16) N-[3-(4-хлорфеніл)-2-(5-ціано-3-піридил)-1(2) N-[3-(4-хлорфеніл)-2-(3-піридил)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; метилпропанамід; (17) N-[3-(4-хлорфеніл)-2-(3-метилфеніл)-1(3) N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; метилпропанамід; (18) N-[3-(4-хлорфеніл)-2-феніл-1-метилпропіл]-2(4) N-[3-(4-хлорфеніл)-2-(5-хлор-3-піридил)-1(4-трифторметил-2-піридилокси)-2метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; метилпропанамід; (19) N-[3-(4-хлорфеніл)-2-феніл-1-метилпропіл]-2(5) N-[3-(4-хлорфеніл)-2-(5-метил-3-піридил)-1(4-трифторметил-2-піримідилокси)-2метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; метилпропанамід; (20) N-[3-(4-хлорфеніл)-1-метил-2-(тіофен-3(6) N-[3-(4-хлорфеніл)-2-(5-ціано-3-піридил)-1іл)пропіл]-2-(5-хлор-2-піридилокси)-2метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; метилпропанамід; (21) N-[3-(5-хлор-2-піридил)-2-феніл-1(7) N-[3-(4-хлорфеніл)-2-(3-метилфеніл)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; метилпропанамід; (22) N-[3-(4-метилфеніл)-1-метил-2-фенілпропіл](8) N-[3-(5-хлор-2-піридил)-2-феніл-12-(4-трифторметилфенілокси)-2-метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(23) N-[3-(4-фторфеніл)-2-(3-ціанофеніл)-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(9) N-[3-(4-фторфеніл)-2-(3-ціанофеніл)-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(24) N-[3-(4-хлорфеніл)-2-(1-індоліл)-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-оксипіридин-2(10) N-[3-(4-хлорфеніл)-2-(1-індоліл)-1іл)-2-метилпропанамід; метилпропіл]-2-(5-трифторметил-2-оксипіридин-2(25) N-[3-(4-хлорфеніл)-2-(7-азаіндол-N-іл)-1іл)-2-метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(11) N-[3-(4-хлорфеніл)-2-(7-азаіндол-N-іл)-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(26) N-[3-(4-хлорфеніл)-2-(1-індолініл)-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(12) N-[3-(4-хлорфеніл)-2-(1-індолініл)-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(27) N-[3-(4-хлорфеніл)-2-(N-метиланіліно)-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(13) N-[3-(4-хлорфеніл)-2-(N-метиланіліно)-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(28) N-[3-(4-метоксифеніл)-2-(3-ціанофеніл)-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(14) N-[3-(4-метоксифеніл)-2-(3-ціанофеніл)-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(29) N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1метилпропанамід; метилпропіл]-2-(6-трифторметил-4-піримідилокси)(15) N-[2-(3-ціанофеніл)-1,4-диметилпентил]-2-(52-метилпропанамід; трифторметил-2-піридилокси)-2-метилпропанамід; (30) N-[2-(3-ціанофеніл)-1,4-диметилпентил]-2-(5(16) N-[3-(4-хлорфеніл)-2-(1-оксидо-5-ціано-3трифторметил-2-піридилокси)-2-метилпропанамід; піридил)-1-метилпропіл]-2-(5-трифторметил-2(31) N-[3-(4-хлорфеніл)-2-(1-оксидо-5-ціано-3піридилокси)-2-метилпропанамід; піридил)-1-метилпропіл]-2-(5-трифторметил-2(17) N-[2-(3-ціанофеніл)-3-циклобутил-1піридилокси)-2-метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(32) N-[2-(3-ціанофеніл)-3-циклобутил-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(18) N-[2-(3-ціанофеніл)-1-метилгептил]-2-(5метилпропанамід; трифторметил-2-піридилокси)-2-метилпропанамід; (33) N-[2-(3-ціанофеніл)-1-метилгептил]-2-(5(19) N-[2-(3-ціанофеніл)-3-циклопентил-1трифторметил-2-піридилокси)-2-метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(34) N-[2-(3-ціанофеніл)-3-циклопентил-1метилпропанамід; метилпропіл]-2-(5 -трифторметил-2-піридилокси)(20) N-[2-(3-ціанофеніл)-3-циклогексил-12-метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(35) N-[2-(3-ціанофеніл)-3-циклогексил-1метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2та їх фармацевтично прийнятних солей. метилпропанамід; 13. Сполука за п. 1, що являє собою N-[3-(4та їх фармацевтично прийнятних солей. хлорфеніл)-2(S)-феніл-1(S)-метилпропіл]-2-(411. Сполука за п. 9, де Rd означає 5трифторметил-2-піримідилокси)-2трифторметил-2-піридил, метилпропанамід, і її фармацевтично прийнятні та її фармацевтично прийнятні солі. солі. 12. Сполука за п. 11, вибрана з таких як: 14. Сполука за п. 1, що являє собою N-[3-(4(1) N-[(3-(4-хлорфеніл)-1-метил-2-фенілпропіл]-2хлорфеніл)-2-(3-ціанофеніл)-1-метилпропіл]-2-(5(5-трифторметилпіридилокси)-2-метилпропанамід; трифторметил-2-піридилокси)-2-метилпропанамід, і її фармацевтично прийнятні солі. 7 76590 8 15. Сполука за п. 1, що являє собою N-[3-(418. Застосування за п. 17, де захворюванням, що хлорфеніл)-2-(5-хлор-3-піридил)-1-метилпропіл]-2опосередковується рецептором канабіноїду-1, є (5-трифторметил-2-піридилокси)-2порушення харчування, пов'язане з надмірним метилпропанамід, і її фармацевтично прийнятні споживанням їжі. солі. 19. Застосування за п. 18, де порушенням харчу16. Композиція, що містить сполуку за п. 1 і фарвання, пов'язаним з надмірним споживанням їжі, є мацевтично прийнятний носій. ожиріння. 17. Застосування сполуки за п. 1 для виготовлення 20. Застосування сполуки за п. 1 для виготовлення лікарського засобу, корисного для лікування залікарського засобу для попередження ожиріння хворювання, що опосередковується рецептором людини, схильної до такого ризику. канабіноїду-1, у людини, яка потребує такого лікування. Марихуану (Cannabis sativa L.) та її похідні використовують протягом століть для медичних цілей і розваг. Встановлено, що основним активним 9 інгредієнтом у марихуані та гашиші є тетрагідроканабінол ( 9-ТНС). Докладне дослідження виявило, що біологічна дія 9-ТНС та інших членів сімейства канабіноїду здійснюється через два спарених рецептори G-білка, які називаються СВ1 і СВ2. Рецептор СВ1 виявлений головним чином у центральній і периферичній нервових системах та у меншій мірі у деяких периферичних органах. Рецептор СВ2 виявлений переважно у лімфоїдних тканинах і клітинах. Було ідентифіковано три ендогенних ліганди для рецептора канабіноїду, похідні арахідонової кислоти (анандамід, 2-арахідоноїлгліцерин і 2арахідонілгліцериновий простий ефір). Кожний є агоністом з активностями подібними до 9-ТНС, включаючи заспокоєння, гіпотермію, нерухомість кишечнику, антинотицепцію, аналгезію, каталепсію, протиблювотну дію і стимуляцію апетиту. Гени для відповідних рецепторів канабіноїду були зруйновані у мишей. Миші з видаленим СВ1/-рецептором виглядали нормальними і фертильними. Вони були резистентними до дії 9-ТНС і демонстрували сильне зменшення посилюючих властивостей морфіну і тяжкості абстинентного синдрому. Вони також демонстрували знижену рухову активність і гіпоальгезію. Надмірний вплив 9 -ТНС може приводити до переїдання, психозу, гіпотермії, втрати пам'яті і заспокоєння. У наш час у клінічних дослідженнях для лікування порушень харчування є, щонайменше, один модулятор СВ1, що характеризується як зворотний агоніст або антагоніст, N-(1-піперидиніл)-5-(4-хлорфеніл)-1-(2,4дихлорфеніл)-4-метилпіразол-3-карбоксамід (SR141716A). Все ще зберігається потреба у сильнодіючих низькомолекулярних модуляторах СВ1, які мали б фармакокінетичні і фармакодинамічні властивості, придатні для застосування як фармацевтичні засоби для людини. Лікування астми модуляторами рецептора СВ1 (такими як зворотні агоністи СВ1) підтверджується виявленням того, що пресинаптичні рецептори канабіноїду СВ1 опосередковують інгібування вивільнення норадреналіну (у легенях морських свинок) (Europ. J. of Pharmacology, 2001, 431 (2), 237-244). Лікування цирозу печінки модуляторами рецептора СВ1 підтверджується виявленням того, що модулятор рецептора СВ1 може змінювати низький кров'яний тиск на протилежний, що спостерігається у щурів з цирозом печінки, викликаним тетрахлоридом вуглецю, і зменшує підвищений мезентеріальний кровотік і тиск у ворітній вені (Nature Medicine, 2001, 7 (7), 827-832). Патенти США 5624941 і 6028084, заявки РСТ №№ WO98/43636 і WO98/43635 і заявка ЕРО №ЕР-658546 розкривають заміщені піразоли, що мають активність проти рецепторів канабіноїду. Заявки РСТ №№ WO98/31227 і WO98/41519 також розкривають заміщені піразоли, що мають активність проти рецепторів канабіноїду. Заявки РСТ №№ WO98/37061, WO00/10967 і WO00/10968 розкривають сульфонаміди простих діарилових ефірів, що мають активність проти рецепторів канабіноїду. Заявки РСТ №№ WO97/29079 і WO99/02499 розкривають алкоксіізоіндолони і алкоксихінолони, як такі, що мають активність проти рецепторів канабіноїду. Патент США 5532237 розкриває похідні Nбензоїліндолу, що мають активність проти рецепторів канабіноїду. Патенти США 4973587, 5013837, 5081122 і 5112820, 5292736 розкривають похідні аміноалкіліндолу, як такі, що мають активність проти рецепторів канабіноїду. Публікація РСТ WO01/58869 розкриває піразоли, піроли та імідазол як модулятори рецептора канабіноїду, корисні для лікування респіраторних і нереспіраторних пов'язаних з активацією лейкоцитів розладів. Публікації РСТ WO01/64632, 01/64633 і 01/64634, передані Aventis, відносяться до похідних азетидину як антагоністів канабіноїду. Schultz, Е.М., et al. J. Med. Chem. 1967, 10, 717 і Pines, S.H. et al. J. Med. Chem. 1967, 10, 725 розкривають малеамінові кислоти, що впливають на холестерин плазми та екскрецію пеніциліну. Сполуки даного винаходу є модуляторами рецептора канабіноїду-1 (СВ1) і корисні для лікування, попередження і придушення захворювань, що опосередковуються рецептором канабіноїду-1 (СВ1). Зокрема, сполуки даного винаходу є антагоністами або зворотними агоністами рецептора СВ1. Винахід відноситься до застосування вказа 9 76590 10 них сполук для модуляції рецептора канабіноїду-1 Винахід також відноситься до нових сполук (СВ1). Як такі, сполуки даного винаходу корисні як структурної формули І. лікарські засоби, що діють на центральну нервову Винахід також відноситься до фармацевтичсистему при лікуванні психозу, погіршення пам'яті, них композицій, що містять одну зі сполук як актипорушень пізнавальної здатності, мігрені, невровний інгредієнт. патії, нейро-запальних розладів, включаючи розсіВинахід додатково відноситься до способів яний склероз і синдром Гійєна-Баре, і запальні одержання сполук даного винаходу. ускладнення вірусного енцефаліту, церебральних Сполуки, що використовуються у способах дасудинних порушень і травми голови, неспокійних ного винаходу, представлені сполукою структурної станів, стресу, епілепсії, хвороби Паркінсона, руформули І: хових розладів і шизофренії. Сполуки також корисні для лікування зловживання речовинами, що викликають залежність, зокрема, опіатами, алкоголем, марихуаною і нікотином. Сполуки також корисні для лікування порушень харчування шляхом інгібування надмірного приймання їжі і ожиріння, що є результатом цього, і пов'язаних з ним ускладнень. Сполуки також корисні для лікування запору і хронічної кишкової псевдо-обструкції, а або її фармацевтично прийнятною сіллю, де також для лікування астми і цирозу печінки. R1 вибраний з: Даний винахід відноситься до нових заміще(1) циклогетероалкілу, них амідів загальної формули І: (2) арилу, (3) гетероарилу і (4) -NRaRc; де арил і гетероарил необов'язково заміщені одним-трьома замісниками, незалежно вибраними з Rb; R2 вибраний з: (1) С1-10 алкілу, (2) С3-10 циклоалкіл-С1-4 алкілу, та їх фармацевтично прийнятних солей, які є (3) арил-С1-4 алкілу і антагоністами і/або зворотними агоністами рецеп(4) гетероарил-С1-4 алкілу; тора канабіноїду-1 (СВ1) і корисні для лікування, де кожний циклоалкіл, арил і гетероарил непопередження та придушення захворювань, що обов'язково заміщений одним-трьома замісникаопосередковуються рецептором канабіноїду-1 ми, незалежно вибраними з Rb; (СВ1). Винахід відноситься до застосування вкакожний Ra незалежно вибраний з: заних нових сполук для селективної антагонізації (1) водню, рецептора канабіноїду-1 (СВ1). Як такі, сполуки (2) метилу і даного винаходу корисні як лікарські засоби, що (3) -CF3; діють на центральну нервову систему при лікуванкожний Rb незалежно вибраний з: ні психозу, погіршення пам'яті, порушень пізнава(1) галогену, льної здатності, мігрені, невропатії, нейро(2) ціано, запальних розладів, включаючи розсіяний склероз (3) трифторметилу, і синдром Гійєна-Баре, і запальні ускладнення ві(4) трифторметокси, русного енцефаліту, церебральних судинних по(5) С1-3 алкілокси і рушень і травми голови, неспокійних станів, стре(6) С1-3 алкілу; су, епілепсії, хвороби Паркінсона, рухових Rc незалежно вибраний з: розладів і шизофренії. Сполуки також корисні для (1) водню, лікування зловживання речовинами, що виклика(2) С1-6 алкілу, ють залежність, зокрема, опіатами, алкоголем, (3) арилу, марихуаною і нікотином, включаючи припинення (4) гетероарилу, паління. Сполуки також корисні для лікування (5) арилметилу і ожиріння або порушень харчування, пов'язаних з (6) гетероарилметилу, надмірним прийманням їжі, і пов'язаних з цим кожний Rc може бути незаміщений або заміускладнень. Сполуки також корисні для лікування щений одним-трьома замісниками, вибраними з запору і хронічної кишкової псевдо-обструкції. Rh; Сполуки також корисні для лікування цирозу печінRd незалежно вибраний з: ки. Сполуки також корисні для лікування астми. (1) циклоалкілу, Даний винахід також відноситься до лікування (2) арилу і вказаних станів і застосування сполук даного ви(3) гетероарилу, находу для виготовлення лікарського засобу, кокожний Rd може бути незаміщений або замірисного при лікуванні вказаних станів. Даний вищений одним-трьома замісниками, вибраними з нахід відноситься також до лікування вказаних Rh; станів шляхом комбінації сполук формули І та інкожний Rh незалежно вибраний з: ших доступних у наш час фармацевтичних засобів. (1) галогену, 11 76590 12 (2) С1-3 алкілу, (6) бензилу, (3) -CN і (7) 4-хлорбензилу, (4) -CF3, (8) 4-метилбензилу, де, коли піридильні групи є незаміщеними на (9) 4-фторбензилу, азоті, вони можуть бути необов'язково представ(10) 4-метоксибензилу і лені як N-оксид. (11) (5-хлор-2-піридил)метилу. В одному варіанті за даним винаходом R1 виВ одному варіанті за даним винаходом кожний браний з: Ra незалежно вибраний з: (1) фенілу, (1) водню, (2) піридилу, (2) метилу і (3) індолілу, (3) -CF3. (4) 7-азаіндолілу, В одному класі даного варіанту за даним ви(5) тіофенілу і находом, кожний Ra незалежно вибраний з: (1) водню і (2) метилу. В одному варіанті за даним винаходом кожний Rb незалежно вибраний з: (6) ; (1) галогену, де кожний арил і гетероарил необов'язково (2) ціано, заміщений одним або двома замісниками, незале(3) С1-3 алкілокси і жно вибраними з Rb, і кожний піридил необов'язко(4) С1-3 алкілу. во представлений як N-оксид. В одному класі даного варіанту за даним виВ одному класі даного варіанту за даним винаходом, кожний Rb незалежно вибраний з: находом R1 вибраний з: (1) фтору, (1) фенілу, (2) хлору, (2) 3-ціанофенілу, (3) брому, (3) 3-метилфенілу, (4) йоду, (4) 3,5-дифторфенілу, (5) ціано, (5) 3-піридилу, (6) метокси і (6) 5-хлор-3-піридилу, (7) метилу. (7) 5-метил-3-піридилу, В одному підкласі даного класу кожний Rb не(8) 5-ціано-3-піридилу, залежно вибраний з: (9) 1-оксидо-5-ціано-3-піридилу, (1) фтору, (10) 1-індолілу, (2) хлору, (11) 7-аза-індол-N-ілу, (3) ціано, (12) 2-тіофенілу і (4) метокси і (5) метилу. В одному варіанті за даним винаходом кожний Rc незалежно вибраний з: (13) ; (1) водню, У підкласіданого класу за даним винаходом (2) С1-6 алкілу, 1 R означає 5-ціано-3-піридил. (3) фенілу, 2 В іншому варіанті за даним винаходом R виб(4) піридилу, раний з: (5) бензилу і (1) С1-3 алкілу, (6) піридилметилу; (2) С3-6 циклоалкілметилу, кожний Rc може бути незаміщений або замі(3) фенілметилу, щений замісником, вибраним з Rh. (4) гетероарилметилу, В одному класі Rc означає феніл. де кожний циклоалкіл, феніл і гетероарил неВ одному варіанті за даним винаходом Rd виобов'язково заміщений одним-трьома замісникабраний з: ми, незалежно вибраними з Rb. (1) С4-6 циклоалкілу, В одному класі даного варіанту за даним ви(2) арилу і 2 находом R вибраний з: (3) гетероарилу, (1) С1-6 алкілу, де Rd може бути незаміщений або заміщений (2) С4-6 циклоалкілметилу, одним або двома замісниками, вибраними з Rh. (3) фенілметилу, В одному класі за даним винаходом Rd вибра(4) піридилу, ний з: де кожний циклоалкіл, феніл і гетероарил не(1) фенілу, обов'язково заміщений одним або двома замісни(2) піридилу і b ками, незалежно вибраними з R . (3) піримідилу, У підкласі даного класу за даним винаходом де Rd може бути незаміщений або заміщений 2 R вибраний з: одним або двома замісниками, вибраними з Rh. (1) 2-метилпропілу, В одному підкласі за даним винаходом Rd виб(2) н-пентилу, раний з: (3) циклобутилметилу, (1) фенілу, (4) циклопентилметилу, (2) 4-хлорфенілу, (5) циклогексилметилу, 13 76590 14 (3) 3-хлорфенілу, 1-метилпропіл]-2-(5-трифторметил-2-піридилокси)(4) 3,5-дифторфенілу, 2-метилпропанамід; (5) 3,5-дихлорфенілу, (17) N-[3-(4-хлорфеніл)-2-(3-метилфеніл)-1(6) 2-піридилу, метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(7) 5-хлор-2-піридилу, метилпропанамід; (8) 6-метил-2-піридилу, (18) N-[3-(4-хлорфеніл)-2-феніл-1(9) 5-трифторметил-2-піридилу, метилпропіл]-2-(4-трифторметил-2-піридилокси)-2(10) 4-трифторметил-2-піридилу, метилпропанамід; (11) 4-трифторметил-2-піримідилу і (19) N-[3-(4-хлорфеніл)-2-феніл-1(12) 6-трифторметил-4-піримідилу. метилпропіл]-2-(4-трифторметил-2-піримідилокси)В іншому підкласі за даним винаходом Rd 2-метилпропанамід; означає 5-трифторметил-2-піридил. (20) N-[3-(4-хлорфеніл)-1-метил-2-(тіофен-3В одному варіанті за даним винаходом кожний іл)пропіл]-2-(5-хлор-2-піридилокси)-2R незалежно вибраний з: метилпропанамід; (1) галогену, (21) N-[3-(5-хлор-2-піридил)-2-феніл-1(2) С1-3 алкілу, метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(3) -CN і метилпропанамід; (4) -CF3. (22) N-[3-(4-метилфеніл)-1-метил-2В одному класі за даним винаходом кожний Rh фенілпропіл]-2-(4-трифторметилфенілокси)-2незалежно вибраний з: метилпропанамід; (1) фтору, (23) N-[3-(4-фторфеніл)-2-(3-ціанофеніл)-1(2) хлору, метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(3) метилу, метилпропанамід; (4) -CN і (24) N-[3-(4-хлорфеніл)-2-(1-індоліл)-1(5) -CF3. метилпропіл]-2-(5-трифторметил-2-оксипіридин-2Конкретні нові сполуки, які можуть бути викоіл)-2-метилпропанамід; ристані у способах, застосуваннях і композиціях (25) N-[3-(4-хлорфеніл)-2-(7-азаіндол-N-іл)-1даного винаходу включають: метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(1) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]метилпропанамід; 2-(4-хлорфенілокси)-2-метилпропанамід; (26) N-[3-(4-хлорфеніл)-2-(1-індолініл)-1(2) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]метилпропіл]-2-(5-трифторметил-2-піридилокси)-22-(2-піридилокси)-2-метилпропанамід; метилпропанамід; (3) N-[3-(4-хлорфеніл)-1-метил-2-(3(27) N-[3-(4-хлорфеніл)-2-(N-метиланіліно)-1піридил)пропіл]-2-(4-хлорфенілокси)-2метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; метилпропанамід; (4) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл](28) N-[3-(4-метоксифеніл)-2-(3-ціанофеніл)-12-(3,5-дифторфенілокси)-2-метилпропанамід; метилпропіл]-2-(5-трифторметил-2-піридилокси)-2(5) N-[3-(4-хлорфеніл)-2-феніл-1-метилпропіл]метилпропанамід; 2-(3,5-дихлорфенілокси)-2-метилпропанамід; (29) N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1(6) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]метилпропіл]-2-(6-трифторметил-4-піримідилокси)2-(3-хлорфенілокси)-2-метилпропанамід; 2-метилпропанамід; (7) N-[3-(4-хлорфеніл)-2-(3,5-дифторфеніл)-1(30) N-[2-(3-ціанофеніл)-1,4-диметилпентил]-2метилпропіл]-2-(2-піридилокси)-2(5-трифторметил-2-піридилокси)-2метилпропанамід; метилпропанамід; (8) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл](31) N-[3-(4-хлорфеніл)-2-(1-оксидо-5-ціано-32-(5-хлор-2-піридилокси)-2-метилпропанамід; піридил)-1-метилпропіл]-2-(5-трифторметил-2(9) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]піридилокси)-2-метилпропанамід; 2-(6-метил-піридилокси)-2-метилпропанамід; (32) N-[2-(3-ціанофеніл)-3-циклобутил-1(10) N-[3-(4-хлорфеніл)-1-метил-2метилпропіл]-2-(5-трифторметил-2-піридилокси)-2фенілпропіл]-2-(фенілокси)-2-метил-пропанамід; метилпропанамід; (11) N-[3-(4-хлорфеніл)-1-метил-2(33) N-[2-(3-ціанофеніл)-1-метилгептил]-2-(5фенілпропіл]-2-(5-трифторметилпіридилокси)-2трифторметил-2-піридилокси)-2-метилпропанамід; метилпропанамід; (34) N-[2-(3-ціанофеніл)-3-циклопентил-1(12) N-[3-(4-хлорфеніл)-2-(3-піридил)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; метилпропанамід; (35) N-[2-(3-ціанофеніл)-3-циклогексил-1(13) N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; метилпропанамід; та їх фармацевтично прийнятні солі. (14) N-[3-(4-хлорфеніл)-2-(5-хлор-3-піридил)-1"Алкіл", а також інші групи, що мають префікс метилпропіл]-2-(5-трифторметил-2-піридилокси)-2"алк", такі як алкокси, алканоїл, означають вуглеметилпропанамід; цеві ланцюги, які можуть бути лінійними або роз(15) N-[3-(4-хлорфеніл)-2-(5-метил-3-піридил)галуженими або їх поєднанням. Приклади алкіль1-метилпропіл]-2-(5-трифторметил-2-піридилокси)них груп включають метил, етил, пропіл, ізопропіл, 2-метилпропанамід; бутил, втор- і трет-бутил, пентил, гексил, гептил, (16) N-[3-(4-хлорфеніл)-2-(5-ціано-3-піридил)октил, ноніл і тому подібне. 15 76590 16 "Циклоалкіл" означає моно- або біциклічні або ком. Коли численні групи замісників розкриті або зв'язані містком насичені карбоциклічні кільця, заявлені, заміщена сполука може бути незалежно кожне з яких має від 3 до 10 атомів вуглецю. Призаміщена однією або декількома з таких, що розкклади циклоалкілу включають циклопропіл, циклориваються, або заявлених груп замісників один бутил, циклопентил, циклогексил, циклогептил і або багато разів. Під незалежно заміщеним маєтьтому подібне. ся на увазі, що замісники (два або більше) можуть "Арил" означає моно- або біциклічні ароматичбути однаковими або різними. ні кільця, що містять тільки атоми вуглецю. ПрикСполуки формули І можуть містити один або лади арилу включають феніл, нафтил і тому подідекілька асиметричних центрів і тому можуть існубне. вати як рацемати і рацемічні суміші, окремі енанті"Гетероарил" означає моно- або біциклічне омери, діастереомерні суміші та окремі діастереоароматичне кільце, яке містить, щонайменше, мери. Мається на увазі, що даний винахід охоплює один гетероатом, вибраний з Ν, Ο і S, причому всі такі ізомерні форми сполук формули І. кожне кільце містить 5-6 атомів. Приклади гетероДеякі сполуки, що описуються у даному описі, арилу включають піроліл, ізоксазоліл, ізотіазоліл, містять олефінові подвійні зв'язки, і, якщо не вкапіразоліл, піридил, оксазоліл, оксадіазоліл, тіадіазано інакше, мається на увазі, що вони включають золіл, тіазоліл, імідазоліл, триазоліл, тетразоліл, геометричні ізомери як Е, так і Z. фураніл, триазиніл, тієніл, піримідил, піридазиніл, Таутомери характеризуються як сполуки, які піразиніл, бензоксазоліл, бензотіазоліл, бензімідасхильні до швидких зсувів протонів від одного золіл, бензофураніл, бензотіофеніл, фуро(2,3атома сполуки до іншого атома сполуки. Деякі b)піридил, хіноліл, індоліл, ізохіноліл, імідазотіазосполуки, що описуються у даному описі, можуть ліл і тому подібне. Зокрема, "гетероарил" включає існувати як таутомери з різними точками приєдпіридил, піримідил і тіофеніл. Кільце гетероарилу нання водню. Так, прикладом можуть бути кетон і може бути заміщене на одному або декількох атойого енольна форма, відомі як кето-енольні таутомах вуглецю або азоту. мери. Окремі таутомери, а також їх суміш охоплені "Циклогетероалкіл" означає моно- або біциклісполуками формули І. чні або зв'язані містком насичені кільця, які місСполуки формули І можуть бути розділені на тять, щонайменше, один гетероатом, вибраний з діастереомерні пари енантіомерів, наприклад, N, S і О, причому кожне з вказаних кілець має від 3 фракційною кристалізацією з відповідного розчиндо 10 атомів, де місцем приєднання може бути ника, наприклад, МеОН або ЕtOАс або їх суміші. вуглець або азот. Термін також охоплює моноцикОдержана таким чином пара енантіомерів може лічний гетероцикл, конденсований з групою арилу бути розділена на окремі стереоізомери звичайабо гетероарилу, де місце приєднання знаходитьними засобами, наприклад, з використанням оптися на неароматичній частині. Приклади "циклогечно активного аміну як агента, що розділяє, або тероалкілу" включають індоліл, азаіндоліл і тому колонки хіральної ВЕРХ. подібне. Кільце циклогетероалкілу може бути заАльтернативно, який-небудь енантіомер споміщене на атомах вуглецю кільця і/або на атомах луки загальної формули І може бути одержаний азоту кільця. стереоспецифічним синтезом з використанням "Галоген" включає фтор, хлор, бром і йод. оптично чистих вихідних речовин або реагентів Коли який-небудь з радикалів (наприклад, Rl, відомої конфігурації. Rd і т.д.) зустрічається більш ніж один раз в якійЯк правило, переважно вводити сполуки данонебудь складовій або у формулі І, його визначення го винаходу у вигляді енантіомерно чистих склау кожному випадку є незалежним від його визнадів. Рацемічні суміші можуть бути розділені на їх чення у кожному іншому випадку. Крім того, поєдокремі енантіомери яким-небудь з численних транання замісників і/або радикалів є допустимими диційних методів. До них відносяться хіральна тільки, якщо такі поєднання приводять до стабільхроматографія, одержання похідних з хіральною них сполук. допоміжною речовиною з подальшим розділенням За стандартною номенклатурою, що викорисхроматографією або кристалізацією, і фракційна товується у даному описі, кінцева частина вказакристалізація діастереомерних солей. ного бічного ланцюга описана спочатку з подальКрім того, деякі кристалічні форми сполук дашим зазначенням сусідньої функціональності у ного винаходу можуть існувати як поліморфи і, як напрямі до місця приєднання. Наприклад, замісник такі, включені у даний винахід. На додаток, деякі С1-5 алкілкарбоніламіно-С1-6 алкіл є еквівалентом сполуки даного винаходу можуть утворювати содля львати з водою або звичайними органічними розчинниками. Такі сольвати входять в об'єм даного винаходу. Термін "фармацевтично прийнятні солі" відноситься до солей, одержаних з фармацевтично прийнятних нетоксичних основ або кислот, вклюПри виборі сполук даного винаходу фахівець у чаючи неорганічні або органічні основи і неорганіданій галузі повинен усвідомлювати, що вибір різчні або органічні кислоти. Солі, одержані з неорга1 2 них замісників, тобто R , R і т.д., повинен провонічних основ, включають солі алюмінію, амонію, дитися відповідно до добре відомих принципів кальцію, міді, заліза (III), заліза (II), літію, магнію, зв'язування і стабільності хімічної структури. марганцю (III), марганцю (II), калію, натрію, цинку і Термін "заміщений", як мається на увазі, вклютому подібне. Особливо переважні солі амонію, чає багаторазові заміщення зазначеним замісникальцію, магнію, калію і натрію. Солі, одержані з 17 76590 18 фармацевтично прийнятних органічних нетоксичрозладів і шизофренії. Сполуки також корисні для них основ, включають солі первинних, вторинних і лікування зловживання речовинами, що викликатретинних амінів, заміщених амінів, включаючи ють залежність, зокрема, опіатами, алкоголем, природні заміщені аміни, циклічні аміни та іонообмарихуаною і нікотином. Сполуки також корисні мінні смоли основного характеру, такі як аргінін, для лікування ожиріння або порушень харчування, бетаїн, кофеїн, холін, Ν,Ν'-дибензилетилендіамін, пов'язаних з надмірним прийманням їжі, і пов'язадіетиламін, 2-діетиламіноетанол, 2них з цим ускладнень. Сполуки також корисні для диметиламіноетанол, етаноламін, етилендіамін, Nлікування запору і хронічної кишкової псевдоетилморфолін, N-етилпіперидин, глюкамін, глюкообструкції. Сполуки також корисні для лікування замін, гістидин, гідрабамін, ізопропіламін, лізин, цирозу печінки. Сполуки також корисні для лікуметилглюкамін, морфолін, піперазин, піперидин, вання астми. поліамінні смоли, прокаїн, пурини, теобромін, триТерміни "призначення" і/або "введення" сполуетиламін, триметиламін, трипропіламін, трометаки потрібно розуміти як надання сполуки даного мін і тому подібне. Термін "фармацевтично прийнвинаходу індивідууму, який потребує такого лікуятна сіль" додатково включає всі прийнятні солі, вання. такі як ацетат, лактобіонат, бензолсульфонат, лаВведення сполуки структурної формули І для урат, бензоат, малат, бікарбонат, малеат, бісультого, щоб здійснити дані способи лікування, профат, манделат, бітартрат, мезилат, борат, метилводять введенням ефективної кількості сполуки бромід, бромід, метилнітрат, едетат кальцію, структурної формули І пацієнту, який потребує метилсульфат, камсилат, мукат, карбонат, напситакого лікування або профілактики. Необхідність лат, хлорид, нітрат, клавуланат, N-метилглюкамін, профілактичного призначення відповідно до споцитрат, сіль амонію, дигідрохлорид, олеат, едетат, собів даного винаходу визначають за допомогою оксалат, едисилат, памоат (ембонат), естолат, добре відомих факторів ризику. Ефективна кільпальмітат, езилат, пантотенат, фумарат, фоскість окремої сполуки визначається у кінцевому фат/дифосфат, глюцептат, полігалактуронат, глюаналізі лікуючим лікарем, відповідальним за ситуконат, саліцилат, глутамат, стеарат, гліколіларсаацію, але в залежності від факторів, таких як конкнілат, сульфат, гексилрезорцинат, субацетат, ретне захворювання, що потребує лікування, тяжгідрабамін, сукцинат, гідробромід, танат, гідрохлокість захворювання та інші захворювання або рид, тартрат, гідроксинафтоат, теоклат, йодид, стани, від яких пацієнт страждає, вибору шляху тозилат, ізотіонат, триетіодид, лактат, паноат, вавведення інших лікарських засобів і лікувань, які лерат і тому подібне, які можуть бути використані у можуть потребуватися пацієнту одночасно, та інвигляді дозованої форми для модифікації харакших факторів за рішенням лікуючого лікаря. теристик розчинності або гідролізу, або можуть Корисність даних сполук при вказаних захвобути використані у композиціях з уповільненим рюваннях або розладах може бути продемонстровивільненням активної речовини або у пролікарсьвана на тваринних моделях захворювань, про які ких композиціях. повідомлялося у літературі. Наступними приклаПотрібно розуміти, що використовувані у дадами таких тваринних моделей захворювань є: а) ному описі посилання на сполуки формули І, ознапридушення приймання їжі і як результат втрата чають, що фармацевтично прийнятні солі також маси у щурів (Life Sciences 1998, 63, 113-117; b) включені. зменшення приймання солодкої їжі у ігрунок (мавп) Сполуки даного винаходу є модуляторами ре[Behavioural Pharm. 1998, 9, 179-181]; с) зменшенцептора СВ1. Зокрема, сполуки структурної форня приймання сахарози і етанолу у мишей мули І є антагоністами або зворотними агоністами [Psychopharm. 1997, 132, 104-106]; d) підвищена рецептора СВ1. рухова активність і відновлення адекватної пове"Агоністом" є сполука (гормон, нейротрансмідінки у щурів [Psychopharm. 1998, 135, 324-332; тер або синтетична сполука). яка зв'язується з Psychopharmacol 2000, 151:25-30]; e) спонтанна рецептором, викликаючи конформаційну зміну у локомоторна активність у мишей [J. Pharm. Exp. рецепторі, що, у свою чергу, дає реакцію у відпоTher. 1996, 277, 586-594]; f) зменшення самоввевідь, таку як протидія, релаксація, секреція, зміна дення опіату у мишей [Sci. 1999, 283, 401-404]; g) активності ферменту і т.д., подібну до тієї, яка вибронхіальна підвищена реактивність у овець і кликається фізіологічно релевантним лігандом морських свинок як моделей різних фаз астми [на(лігандами) агоніста для вказаного рецептора. приклад, див. W.M. Abraham et al., " 4-Integrins "Антагоністом" є сполука, яка ослаблює ефект mediate antigen-induced late bronchial responses агоніста. "Зворотним агоністом" є сполука, яка діє and prolonged airway hyperresponsiveness in на рецептор, але створює ефект протилежний sheep." J. Clin. Invest. 93, 776 (1993) і A.A.Y. Milne тому, який створює агоніст конкретного рецептора. and P.P. Piper, "Role of VLA-4 integrin in leucocyte Сполуки даного винаходу є модуляторами реrecruitment and bronchial hyperresponsiveness in the цептора СВ1 і, як такі, корисні як лікарські засоби, gunea-pig." Eur. J. Pharmacol., 282, 243 (1995)]; h) що діють на центральну нервову систему при лікуопосередкування стану вазодилатації при прогреванні психозу, погіршення пам'яті, порушень пізнасуючому цирозі печінки, викликаному тетрахлоривальної здатності, мігрені, невропатії, нейродом вуглецю [Nature Medicine, 2001, 7(7), 827-832]; запальних розладів, включаючи розсіяний склероз і) індукований амітриптиліном запор у мавп і синдром Гійєна-Баре, і запальні ускладнення віcynomolgus є корисним для оцінки проносних [Biol. русного енцефаліту, церебральних судинних поPharm. Bulletin (Japan), 2000, 23(5), 657-9]; j) неврушень і травми голови, неспокійних станів, стреропатологія педіатричної хронічної кишкової псевсу, епілепсії, хвороби Паркінсона, рухових до-обструкції і тваринні моделі, що відносяться до 19 76590 20 невропатології педіатричної хронічної кишкової Фармацевтичні композиції даного винаходу міпсевдо-обструкції [Journal of Pathology (England), стять як активний інгредієнт сполуку формули І 2001, 194 (3), 277-88]. або її фармацевтично прийнятну сіль і можуть таВеличина профілактичної або терапевтичної кож містити фармацевтично прийнятний носій і дози сполуки формули І буде, звичайно, змінюванеобов'язково інші терапевтичні інгредієнти. Під тися в залежності від характеру тяжкості стану, що "фармацевтично прийнятним" мається на увазі, потребує лікування, і від конкретної сполуки форщо носій, розріджувач або ексципієнт повинен бумули І і шляху її введення. Вона також буде змінюти сумісним з іншими інгредієнтами композиції і ватися відповідно до віку, маси і реакції окремого нешкідливим для його реципієнта. Зокрема, термін пацієнта. Як правило, добова доза знаходиться у "фармацевтично прийнятні солі" відноситься до межах від близько 0,001мг до близько 100мг на кг солей, одержаних з фармацевтично прийнятних маси тіла ссавця, переважно від близько 0,01мг до нетоксичних основ або кислот, включаючи неоргаблизько 50мг на кг і найбільш переважно від блинічні основи або кислоти і органічні основи або зько 0,1 до 10мг на кг, в одній або роздільних докислоти. зах. З іншого боку, у деяких випадках може бути Композиції включають композиції, придатні необхідним застосування дозувань, що виходять для перорального, ректального, місцевого, паренза вказані межі. терального (включаючи підшкірне, внутрішньом'яПри використанні композиції для внутрішньозове і внутрішньовенне), очного (офтальмічного), венного введення відповідним діапазоном дозулегеневого (інгаляція аерозолю) або назального вання є від близько 0,001мг до близько 25мг (певведення, хоча найбільш придатний шлях у кожреважно від близько 0,01мг до близько 1мг) ному конкретному випадку буде залежати від хасполуки формули І на кг маси тіла на добу і для рактеру і тяжкості станів, які піддаються лікуванню, профілактичного застосування від близько 0,1мг і характеру активного інгредієнта. Вони можуть до близько 100мг (переважно від близько 1мг до бути представлені для зручності в одиничній дозоблизько 100мг, і більш переважно від близько 1мг ваній формі і одержані яким-небудь з методів добдо близько 10мг) сполуки формули І на кг маси ре відомих у фармації. тіла на добу. Для введення інгаляцією сполуки даного винаУ випадку, коли використовують композицію ходу звичайно доставляють у вигляді струменю для перорального введення, відповідним діапазоаерозолю з упаковок, що знаходяться під тиском, ном дозування є, наприклад, від близько 0,01мг до або з розпилювачів. Сполуки можуть бути також близько 1000мг сполуки формули І на добу, передоставлені у вигляді порошків, які можуть бути важно від близько 0,1мг до близько 10мг на добу. приготовані за рецептурою, і порошкову композиДля перорального введення композиції переважно цію можна використовувати для вдихання за доявляють собою форму таблеток, що містять від помогою інгалятора для нагнітання порошку. Пе0,01 до 1000мг, переважно 0,01, 0,05, 0,1, 0,5, 1, реважні системи доставки для інгаляції - це 2,5, 5, 10, 15, 20, 25, 30, 40, 50, 100, 250, 500, 750 системи, що відміряють дозу аерозолю для інгаабо 1000 міліграмів активного інгредієнта для симляції (MDI), який може бути приготований за рецептоматичного коректування дозування для пацієнптурою у вигляді суспензії або розчину сполуки та, який потребує лікування. формули І у придатних газах-витісниках, таких як Інший аспект даного винаходу відноситься до фторвуглеці або вуглеводні, і системи для інгаляфармацевтичних композицій, які містять сполуку ції аерозолю сухого порошку (DPI), який може бути формули І і фармацевтично прийнятний носій. приготований за рецептурою у вигляді сухого поТермін "композиція", як у фармацевтичній компорошку сполуки формули І з додатковими ексципієзиції, призначений для охоплення продукту, що нтами або без них. містить активний інгредієнт(и) і інертний інгредіПридатні композиції для місцевого застосуєнт(и) (фармацевтично прийнятні ексципієнти), вання сполуки формули І включають трансдермаякий складає носій, а також який-небудь продукт, льні пристрої, аерозолі, креми, розчини, мазі, гелі, який є результатом, безпосередньо або непрямо, лосьйони, присипки і тому подібне. Фармацевтичні об'єднання, комплексоутворення або агрегації композиції для місцевого застосування, що містять яких-небудь двох або більше інгредієнтів, або дисполуки даного винаходу, звичайно містять від соціації одного або декількох інгредієнтів, або інблизько 0,005% до 5% за масою активної сполуки ших типів реакцій або взаємодій одного або декіу суміші з фармацевтично прийнятним носієм. лькох інгредієнтів. Відповідно, фармацевтичні Трансдермальні шкірні пластири, корисні для ввекомпозиції даного винаходу охоплюють будь-яку дення сполук даного винаходу, включають ті, які композицію, одержану змішуванням сполуки фордобре відомі фахівцям у даній галузі. При введенні мули І, додаткового активного інгредієнта (інгредіза допомогою системи трансдермальної доставки єнтів) і фармацевтично прийнятних ексципієнтів. дозоване введення буде, звичайно, швидше безБудь-який придатний метод введення може перервним, ніж переривчастим, протягом всьому бути використаний для забезпечення ссавця, осорежиму дозування. бливо людини, ефективною дозою сполуки даного При практичному застосуванні сполуки форвинаходу. Наприклад, можуть бути використані мули І можуть бути об'єднані як активний інгредіпероральний, ректальний, місцевий, парентеральєнт у тонку суміш з фармацевтичним носієм, відний, очний, легеневий, назальний і подібний метод повідно до звичайних методик складання введення. Дозовані форми включають таблетки, фармацевтичних сумішей. Носій може мати різнопілюлі, дисперсії, суспензії, розчини, капсули, креманітні форми в залежності від форми препарату, ми, мазі, аерозолі і тому подібне. бажаного для введення, наприклад, перорального 21 76590 22 або парентерального (включаючи внутрішньовенбує лікування. не). При одержанні композицій у формі для пероДодаткові придатні способи введення сполук рального введення може бути використане якеданого винаходу включають ін'єкцію, внутрішньонебудь звичайне фармацевтичне середовище, венний болюс або вливання інтраперитонеальне, таке як, наприклад, вода, гліколі, олії, спирти, аропідшкірне, внутрішньом'язове або місцеве з оклюматизуючі агенти, консерванти, барвники і тому зією або без. подібне, у випадку рідких пероральних препаратів, Прикладом за винаходом є фармацевтична таких як, наприклад, суспензії, еліксири і розчини; композиція, що містить яку-небудь зі сполук, опиабо у випадку твердих пероральних препаратів, саних вище, і фармацевтично прийнятний носій. таких як, наприклад, порошки, капсули і таблетки, Прикладом за винаходом служить також фармаможуть бути використані носії, такі як крохмаль, цевтична композиція, одержана об'єднанням якоїцукри, мікрокристалічна целюлоза, розріджувачі, небудь зі сполук, описаних вище, і фармацевтично гранулюючі агенти, лубриканти, зв'язуючі, дезінтеприйнятного носія. Ілюстрацією винаходу є спосіб груючі агенти і тому подібне, причому тверді пероодержання фармацевтичної композиції, що вклюральні препарати є більш переважними, ніж рідкі чає об'єднання якої-небудь зі сполук, описаних пероральні препарати. Завдяки легкості їх введенвище, і фармацевтично прийнятного носія. ня, таблетки і капсули являють собою найбільш Доза може бути введена у вигляді однієї добозручну дозовану форму для перорального введенвої дози або повне добове дозування може бути ня у тому випадку, коли явно використовують твевведене роздільними дозами два, три або чотири рді фармацевтичні носії. Якщо бажано, на таблетрази на день. Крім того, виходячи з властивостей ки можуть бути нанесені покриття з використанням окремої сполуки, вибраної для введення, доза стандартних водних або неводних методів. може вводитися менш часто, наприклад, щотижня, Фармацевтичні композиції даного винаходу, двічі на тиждень, щомісяця і т.п. Одинична доза придатні для перорального введення, можуть бути буде, звичайно, відповідно більше для менш часпредставлені як дискретні одиниці, такі як капсули того введення. (включаючи композиції з розрахованим за часом При введенні через інтраназальні шляхи, травивільненням і з тривалим вивільненням), пілюлі, нсдермальні шляхи, ректальними або вагінальниоблатки, порошки, гранули або таблетки, кожна з ми супозиторіями або з внутрішньовенним розчияких містить заздалегідь визначену кількість актином, що безперервно вводиться, дозоване вного інгредієнта; як порошок або гранули або як введення буде, звичайно, швидше безперервним, розчин або суспензія у водній рідині, неводній рініж переривчастим протягом всьому режиму дозудині, рідкій емульсії типу масло-у-воді або вода-ування. маслі, включаючи еліксири, тинктури, розчини, Наступне є прикладами типових фармацевтисуспензії, сиропи і емульсії. Такі композиції можуть чних дозованих форм для сполук формули І: бути одержані яким-небудь з методів фармації, Суспензія для ін'єкцій (І.М.) мг/мл але всі методи включають стадію об'єднання актиСполука формули І 10 вного інгредієнта з носієм, який складається з одМетилцелюлоза 5,0 ного або декількох необхідних інгредієнтів. Як праTween 80 0,5 вило, композиції одержують однорідним і Бензиловий спирт 9,0 рівномірним змішуванням активного інгредієнта з Хлорид бензалконію 1,0 рідкими носіями або тонко подрібненими твердими Вода для ін'єкцій до загального мг/таблетка носіями або і з тими, і іншими, і потім, якщо необоб'єму 1мл хідно, доданням продукту бажаної форми. НаприТаблетка клад, таблетка може бути одержана пресуванням Сполука формули І 25 або формуванням необов'язково з одним або деМікрокристалічна целюлоза 415 кількома допоміжними інгредієнтами. Пресовані Повідон 14,0 таблетки можуть бути одержані пресуванням на Пептизований крохмаль 43,5 відповідній машині активного інгредієнта у вільно Стеарат магнію 2,5 сипкій формі, такій як порошок або гранули, не500 обов'язково у суміші зі зв'язуючим, лубрикантом, Капсула мг/капсула інертним розріджувачем, поверхнево-активним Сполука формули І 25 або диспергуючим агентом. Формовані таблетки Порошок лактози 573,5 можуть бути одержані формуванням на відповідній Стеаратмагнію 1,5 машині суміші порошкоподібної сполуки, зволоже600 ної інертним рідким розріджувачем. Бажано, коли Аерозоль на контейнер кожна таблетка містить від 0,01 до 1000мг, зокреСполука формули І 24мг ма 0,01, 0,05, 0,1, 0,5, 1, 2,5, 3, 5, 6, 10, 15, 25, 50, Лецитин, NF рідк. конц. 1,2мг 75, 100, 125, 150, 175, 180, 200, 225, 500, 750 і Трихлорфторметан, NF 4,025г 1000 міліграмів активного інгредієнта для симптоДихлордифторметан, NF 12,15г матичного коректування дозування для пацієнта, Сполуки формули І можуть бути використані у який потребує лікування, і кожна облатка або капкомбінації з іншими лікарськими засобами, які висула містить від 0,01 до 1000мг, зокрема 0,01, користовуються для лікування/ попереджен0,05, 0,1, 0,5, 1,0, 2,5, 3, 5, 6, 10, 15, 25, 50, 75, 100, ня/придушення або полегшення захворювань або 125, 150, 175, 180. 200, 225, 500, 750 і 1000 мілігстанів, для яких сполуки формули І корисні. Такі рамів активного інгредієнта для симптоматичного лікарські засоби можуть бути введені таким шлякоректування дозування для пацієнта, який потрехом і у такій кількості, які звичайно використову 23 76590 24 ються для них, одночасно або послідовно зі сполуатських країнах "суб'єктом з ризиком ожиріння" є кою формули І. Коли сполуку формули І застососуб'єкт з ВМІ від більш ніж 23кг/м2 до менш ніж вують одночасно з одним або декількома іншими 25кг/м2. лікарськими засобами, переважна фармацевтична Використовуваний термін "ожиріння" означає композиція, що містить такі інші лікарські засоби охоплення всіх вказаних вище визначень ожирінна додаток до сполуки формули І. Відповідно, фаня. рмацевтичні композиції даного винаходу включаВикликане ожирінням або таке, що відноситьють і ті, які також містять один або декілька інших ся до ожиріння супутнє захворювання включає, активних інгредієнтів на додаток до сполуки форале, не обмежуючись перерахованим, діабет, інмули І. Приклади інших активних інгредієнтів, які суліннезалежний цукровий діабет типу 2, ослаблеможуть бути об'єднані зі сполукою формули І, ну толерантність до глюкози, недостатнє засвоєнвключають, але, не обмежуючись вказаним, нейня глюкози, синдром стійкості до інсуліну, ролептичні засоби, засоби, що поліпшують пізнадисліпідемію, гіпертензію, гіперурикемію, подагру, вальну здатність, засоби проти мігрені, антиастмахворобу коронарної артерії, інфаркт міокарда, стетичні засоби, протизапальні засоби, анксіолітики, нокардію, напади апное уві сні, піквікський синдзасоби проти хвороби Паркінсона, засоби проти ром, ожиріння печінки, церебральний інфаркт, цеепілепсії, анорексичні засоби та інгібітори повторребральний тромбоз, швидкоплинний ішемічний ного поглинання серотоніну й інші засоби проти напад, ортопедичні розлади, деформуючий артожиріння, які можуть бути введені окремо або у рит, люмбодинію, дисменорею та безпліддя. Зоктих же самих фармацевтичних композиціях. рема, супутні захворювання включають: гіпертенПотрібно брати до уваги, що для лікування або зію, гіперліпідемію, дисліпідемію, непереносимість попередження порушень харчування, включаючи глюкози, серцево-судинне захворювання, напади ожиріння, булімічний невроз і компульсивні поруапное уві сні, цукровий діабет та інші стани, що шення харчування, сполука даного винаходу може відносяться до ожиріння. бути використана у поєднанні з іншими анорексич"Лікування" (ожиріння і розладів, що відноними засобами. сяться до ожиріння) відноситься до введення споДаний винахід відноситься також до способу лук або композицій даного винаходу для зменлікування або попередження порушень харчуваншення або збереження маси тіла огрядного ня, що включає введення пацієнту, який потребує суб'єкта. Одним наслідком лікування може бути такого лікування, сполуки даного винаходу та анозниження маси тіла суб'єкта по відношенню до рексичного засобу у таких кількостях, щоб вони маси тіла суб'єкта безпосередньо до введення разом давали ефективне полегшення. сполук або композицій даного винаходу. Іншим "Ожиріння" - це стан, при якому є надлишок наслідком лікування може бути запобігання відножиру тіла. Практичне визначення ожиріння базувленню маси тіла, втраченої раніше внаслідок дієється на показнику маси тіла (ВМІ), який розрахоти, вправ або фармакотерапії. Іншим наслідком вують як масу тіла на ріст у квадратних метрах лікування може бути зменшення ймовірності вини(кг/м2). "Ожиріння" відноситься до стану, коли здокнення і/або тяжкості захворювань, що відносяться ровий в інших відношеннях суб'єкт має показник до ожиріння. Результатом лікування, відповідно, маси тіла (ВМІ) більше ніж або такий, що дорівнює може бути зменшення споживання суб'єктом їжі 30кг/м2, або до стану, коли суб'єкт, щонайменше, з або калорій, включаючи зменшення сумарного одним супутнім захворюванням має ВМІ більше споживання їжі або зменшення споживання конкніж або такий, що дорівнює 27кг/м2. "Огрядним ретних компонентів їжі, таких як вуглеводи або суб'єктом" є здоровий в інших відношеннях суб'єкт жири, і/або інгібування засвоєння поживних речоз показником маси тіла (ВМІ) більше ніж або тавин, і/або інгібування зниження інтенсивності обміким, що дорівнює 30кг/м2 або суб'єкт, щонайменну речовин і зменшення маси тіла пацієнтів, які ше, з одним супутнім захворюванням з ВМІ більше потребують цього. Результатом лікування може ніж або таким, що дорівнює 27кг/м2. "Суб'єктом з бути також зміна рівня обміну речовин, така як ризиком ожиріння" є здоровий в інших відношензбільшення інтенсивності обміну речовин або вірнях суб'єкт з ВМІ від 25кг/м2 до менш ніж 30кг/м2 ніше доповнення до інгібування зменшення інтенабо суб'єкт, щонайменше, з одним супутнім захвосивності обміну речовин, і/або зведення до мінірюванням з ВМІ від 25кг/м2 до менш ніж 27кг/м2. муму метаболічної стійкості, що звичайно є Підвищені ризики, пов'язані з ожирінням, трапрезультатом втрати маси. ляються при більш низькому показнику маси тіла "Попередження" (ожиріння і розладів, що від(ВМІ) у жителів Азії. В азіатських країнах, включаносяться до ожиріння) відноситься до введення ючи Японію, "ожиріння" відноситься до стану, коли сполук або композицій даного винаходу для зменсуб'єкт, щонайменше, з одним викликаним ожиріншення або підтримки маси тіла суб'єкта з ризиком ням або таким, що відноситься до ожиріння супутожиріння. Одним наслідком попередження може нім захворюванням, яке потребує зниження маси, бути зниження маси тіла суб'єкта при ризику ожимає ВМІ більше ніж або такий, що дорівнює ріння по відношенню до маси тіла цього суб'єкта 2 25кг/м . В азіатських країнах, включаючи Японію, безпосередньо до введення сполук або компози"огрядний суб'єкт" відноситься до суб'єкта, щоцій даного винаходу. Іншим наслідком поперенайменше, з одним викликаним ожирінням або дження може бути запобігання відновленню маси таким, що відноситься до ожиріння супутнім затіла, втраченої раніше внаслідок дієти, вправ або хворюванням, яке потребує зниження маси або фармакотерапії. Іншим наслідком попередження яке може бути полегшене зниженням маси, з ВМІ може бути запобігання ймовірності виникнення більше ніж або таким, що дорівнює 25кг/м2. В азіожиріння, якщо лікування призначається до почат 25 76590 26 ку ожиріння суб'єкта при ризику ожиріння. Іншим бетом типу II є також огрядними. Сполуки і компонаслідком попередження може бути зменшення зиції даного винаходу корисні для лікування діабеймовірності виникнення і/або тяжкості розладів, що ту і типу І, і типу II. Сполуки і композиції особливо відносяться до ожиріння, якщо лікування признаефективні для лікування діабету типу II. Сполуки і чається до початку ожиріння суб'єкта при ризику композиції даного винаходу корисні для лікування ожиріння. Більш того якщо починається лікування і/або попередження гестаційного цукрового діавже огрядних суб'єктів, таке лікування може запобету. бігати ймовірності виникнення, прогресуванню або Використовуваний термін "зловживання речотяжкості розладів, що відносяться до ожиріння, винами, що викликають залежність" включає затаких як, але, не обмежуючись вказаним, артеріослежність від речовини або зловживання нею без клероз, діабет типу II, полікістозна хвороба яєчнифізіологічної залежності або з набутою залежнісків, серцево-судинні захворювання, остеоартрит, тю. Речовинами, пов'язаними з такими порушендерматологічні хвороби, гіпертензія, стійкість до нями, є алкоголь, амфетаміни (або подібні до амінсуліну, гіперхолестеринемія, гіпертригліцеридефетаміну речовини), кофеїн, гашиш, кокаїн, мія і жовчнокам'яна хвороба. галюциногени, вдихувані речовини, марихуана, Розлади, що відносяться до ожиріння, пов'янікотин, опіоїди, фенциклідин (або подібні до фензані з ожирінням, викликані ним або є результатом циклідину сполуки), заспокійливі-снотворні або ожиріння. Приклади розладів, що відносяться до бензодіазепіни та інші (або невідомі) речовини і ожиріння включають переїдання і булімію, гіпертепоєднання вказаних вище. нзію, діабет, підвищені концентрації інсуліну у плаЗокрема, термін "зловживання речовинами, змі і стійкість до інсуліну, дисліпідемію, гіперліпіщо викликають залежність" включає розлади при демію, рак ендометрія, молочної залози, простати припиненні приймання лікарського засобу, такі як і товстої кишки, остеоартрит, обструктивні напади алкогольна абстиненція з перцепційними патологіапное уві сні, жовчнокам'яну хворобу, камені жовчними відхиленнями або без них, розлад свідомочного міхура, хворобу серця, аномальні ритми сесті при алкогольній абстиненції, амфетамінова рця і аритмію, інфаркт міокарда, застійну серцеву абстиненція, кокаїнова абстиненція, нікотинова недостатність, коронарну хворобу, раптову абстиненція, опіоїдна абстиненція, седативна, гіпсмерть, удар, полікістозну хворобу яєчників, кранінотична або анксіолітична абстиненція з перцепофарингіому, синдром Прадера-Віллі, синдром ційними патологічними відхиленнями або без них, Фрохліха, GH-дефіцитних суб'єктів, малий ріст при розлад свідомості при седативній, гіпнотичній або нормальній фігурі, синдром Тернера та інші патоанксіолітичній абстиненції та абстинентні симптологічні стани, що показують знижену метаболічну ми через інші речовини. Потрібно брати до уваги, активність або зниження витрат енергії у стані спощо посилання на лікування нікотинової абстиненції кою, як процентну частку загальної маси без жиру, включає лікування симптомів, пов'язаних з припинаприклад, у дітей з гострим лімфобластозним ненням паління. лейкозом. Додатковими прикладами розладів, що Інші "зловживання речовинами, що викликавідносяться до ожиріння є метаболічний синдром. ють залежність" включають викликаний речовиною відомий також як синдром X, синдром стійкості до неспокійний стан під час нападу абстиненції, виінсуліну, статева і репродуктивна дисфункція, така кликане речовиною порушення свідомості під час як безпліддя, недорозвинення статевої системи нападу абстиненції і викликане речовиною пору(гіпогонадизм) у чоловіків і надмірне оволосіння шення сну під час нападу абстиненції. (гірсутизм) у жінок, порушення шлунково-кишкової Потрібно брати до уваги, що комбінація звиперистальтики, такі як гастроезофагіальний рефчайного антипсихотичного лікарського засобу з люкс, що відноситься до ожиріння, респіраторні модулятором рецептора СВ1 може забезпечити розлади, такі як синдром гіповентиляції (піквіксьполіпшений ефект при лікуванні манії. Така комбікий синдром), серцево-судинні розлади, запаленнація, як припускається, могла б забезпечити ня, таке як системне запалення судинної сітки, швидкий початок дії для лікування маніакального артеріосклероз, гіперхолестеринемія, гіперурикеепізоду, даючи тим самим можливість призначенмія, біль у нижній частині спини, хвороба жовчного ня як "необхідної основи". Більш того така комбіміхура, подагра і рак нирок. Композиції даного винація може дозволити зменшити дозу антипсихонаходу корисні також для зниження ризику втотичного засобу, що використовується без ринних наслідків ожиріння, такого як ризик гіпертпогіршення ефективності антипсихотичного засорофії лівого шлуночка. бу, знижуючи тим самим ризик шкідливих побічних Використовуваний термін "діабет" включає як ефектів. І ще одна вигода від такої комбінації у інсулінозалежний цукровий діабет (тобто IDDM), тому, що завдяки дії модулятора рецептора СВ1, відомий також як діабет типу І, так і інсуліннезалешкідливі побічні ефекти, що викликаються антипжний цукровий діабет (тобто NIDDM), відомий тасихотичним засобом, такі як гостра дистонія, дискож як діабет типу II. Діабет типу І або інсулінозакінезія, акатезія і тремор, можуть бути зменшені лежний діабет є результатом абсолютної або відвернуті. недостатності інсуліну. гормону, який регулює заДаний винахід відноситься також до способу своєння глюкози. Діабет типу II або інсуліннезалелікування або попередження манії, що включає жний діабет (тобто інсуліннезалежний цукровий введення пацієнту, який потребує такого лікування діабет) часто трапляється у осіб з нормальними або при ризику розвитку манії, такої кількості моабо навіть підвищеними рівнями інсуліну і, ймовірдулятора рецептора СВ1 і такої кількості антипсино, є результатом нездатності тканин відповідно хотичного засобу, що вони разом будуть давати реагувати на інсулін. Більшість страждаючих діаефективне полегшення. 27 76590 28 Потрібно брати до уваги, що модулятор реценізує рецептор СВ1 переважно по відношенню до птора СВ1 і антипсихотичний засіб можуть бути інших рецепторів СВ або зв'язаних з білком G репредставлені як комбінований препарат для одноцепторів. часного, роздільного або послідовного застосуТермін "терапевтично ефективна кількість" вання при лікуванні або запобіганні манії. означає кількість сполуки структурної формули І, Потрібно брати до уваги, що при використанні яка буде викликати біологічну або лікувальну реакомбінації даного винаходу модулятор рецептора кцію у відповідь тканини, системи, тварини або СВ1 і антипсихотичний засіб можуть знаходитися в людини, якої прагне дослідник, ветеринар, лікар одному і тому ж фармацевтично прийнятному носії або інший клініцист, що включає полегшення симі, отже, можуть бути введені одночасно. Вони моптомів розладу, який лікують. Нові способи лікужуть бути у роздільних фармацевтичних носіях, вання даного винаходу призначені для розладів, таких як звичайні дозовані форми для пероральновідомих фахівцям у даній галузі. Термін "ссавець" го введення, які можуть бути введені одночасно. включає людину. Термін "комбінація" відноситься також до випадку, Абревіатури, що використовуються на наступколи сполуки надаються в окремих дозованих фоних схемах та у прикладах: вод.: водний; API-ES: рмах і вводяться послідовно. Отже, наприклад, іонізація-електроспрей при атмосферному тиску антипсихотичний засіб може бути введений у ви(термін мас-спектрометрії); (DMF): диметилфоргляді таблетки і потім, у межах раціонального пемамід; ДМСО (DMSO): диметилсульфоксид; EDC: ріоду часу, модулятор рецептора СВ1 може бути гідрохлорид 1-етил-3-(3введений або перорально, як дозована форма для диметиламінопропіл)карбодііміду; ЕРА: етиленпоперорального введення, така як таблетка, або у ліакриламід (пластик); ЕtOАс: етилацетат: год.: вигляді швидкорозчинної дозованої форми для години; Hex: гексан; HOBt: 1перорального введення. "Швидкорозчинна компогідроксибензотриазол; ВЕРХ: високоефективна зиція для перорального введення" означає форму рідинна хроматографія; ВЕРХ/МС: високоефектидля перорального введення, яка при поміщенні на вна рідинна хроматографія/мас-спектр; у вакуумі: язик пацієнта розчиняється протягом близько 10 випаровування на роторному випарнику; ІРАС: секунд. ізопропілацетат; KHMDS: гексаметилдисилазид Потрібно брати до уваги, що комбінація звикалію; РХ: рідинна хроматографія; РХ/МС, РХ-МС: чайного антипсихотичного лікарського засобу з рідинна хроматографія-мас-спектр; М: молярний; модулятором рецептора СВ1 може забезпечити Me: метил; МеОН: метанол; ммоль: мілімоль; МС: поліпшений ефект при лікуванні шизофренічних мас-спектр; н.: нормальний; NaHMDS: гексаметилрозладів. Така комбінація, як припускається, могла дисилазид натрію; ЯМР: ядерний магнітний резоб забезпечити швидкий початок дії для лікування нанс; РуВОР: гексафторфосфат (бензотриазол-1шизофренічних симптомів, даючи тим самим можілокси)трипіролідинофосфонію; Rt: час утримуванливість призначення як "необхідної основи". Більш ня; кт або КТ: кімнатна температура; TFA: трифтотого така комбінація може дозволити зменшити роцтова кислота; ТГФ (THF): тетрагідрофуран; використовувану дозу засобу ЦНС без погіршення ТШХ: тонкошарова хроматографія. ефективності антипсихотичного засобу, тим саСполуки даного винаходу можуть бути одермим, зводячи до мінімуму ризик шкідливих побічжані за методиками, що пояснюються на супровідних ефектів. Ще одна вигода від такої комбінації у них схемах та у прикладах. тому, що завдяки дії модулятора рецептора СВ1, шкідливі побічні ефекти, що викликаються антипсихотичним засобом, такі як гостра дистонія, дискінезія, акатезія і тремор, можуть бути зменшені або відвернуті. Потрібно брати до уваги, що комбінація звичайного антипсихотичного лікарського засобу з модулятором рецептора СВ1 може забезпечити На схемі 1 відповідно заміщений амін А піддаполіпшений ефект при лікуванні астми. ють взаємодії з карбоновою кислотою В у звичайТак, відповідно до додаткового аспекту даного них умовах утворення амідного зв'язку для одервинаходу, запропоноване застосування модулятожання акриламіду С. Для пояснення винаходу ра рецептора СВ1 і антиастматичного засобу для наведені наступні приклади. Дані приклади не обвиробництва лікарського засобу для лікування або межують винахід. Вони призначені тільки для підтпрофілактики астми. вердження способу здійснення винаходу на пракДаний винахід відноситься також до способу тиці. Фахівці у даній галузі можуть знайти інші лікування або попередження астми, що включає способи практичного застосування винаходу, які введення пацієнту, який потребує такого лікуваночевидні для них. Однак ці способи також розгляня, таких кількостей сполуки даного винаходу і даються як такі, що входять в об'єм даного винаантипсихотичного засобу, що вони разом будуть ходу. давати ефективне полегшення. Загальні методики. Аналізи РХ/МС проводять Спосіб лікування даного винаходу включає за допомогою мас-спектрометра MICROMASS спосіб модуляції рецептора СВ1 і лікування опосеZMD, пов'язаного з комплектом для ВЕРХ редковуваних рецептором СВ1 захворювань ввеAGILENT 1100 з колонкою YMC ODS 4,6 50мм, що денням пацієнту, який потребує такого лікування, елююють при 2,5мл/хв. з градієнтом розчинника нетоксичної терапевтично ефективної кількості від 10 до 95% В протягом 4,5хв., потім протягом сполуки даного винаходу, яка селективно антаго0,5хв. при 95% В: розчинник А=0,06% TFA у воді; 29 76590 30 розчинник В=0,05% TFA в ацетонітрилі. Спектр 1Hсилазид натрію (1М у ТГФ, 80мл, 80ммоль) (гексаЯМР одержують на спектрометрі 500МГц VARIAN метилдисилазид калію у толуолі може бути викоу CDCI3 або CD3OD. як вказано, і хімічні зсуви пористаний з подібними результатами). Реакційній суміші дають нагріватися до кімнатної температудають як , використовуючи пік розчинника як пори протягом ночі. Леткі речовини видаляють на рівняння, і константи взаємодії подають у Герцах роторному випарнику і одержану суміш розподі(Гц). ляють між насиченим хлоридом амонію (200мл) і Посилальний приклад 1 ЕtOАс (200мл). Органічний шар відділяють і водний шар екстрагують ЕtOАс (2 200мл). Об'єднані органічні екстракти сушать над безводним сульфатом натрію, фільтрують і концентрують досуха, одержуючи вказану у заголовку сполуку. 1 H ЯМР (500МГц, CD3OD): 7,36-7,10 (м, 9Н), 3,81 (дд, 1Н), 3,52 (с, 3Н), 3,36 (дд, 1Н), 3,02 (дд, 1Н). Стадія В 3-(4-Хлорфеніл)-2-фенілпропанова кислота Гідрохлорид N-[2,3-біс(4-хлорфеніл)-1До суміші метил-3-(4-хлорфеніл)-2метилпропіл]аміну фенілпропіонату (стадія А, 20г, 74ммоль) в ацетоОдержання двох діастереомерів (альфа і бенітрилі (100мл) і води (100мл) додають моногідрат та) гідрохлориду N-[2,3-бic(4-хлорфеніл)-1гідроксиду літію (8,8г, 0,21моль). Після перемішуметилпропіл]аміну було описане [Schultz, Ε.Μ, et вання при кімнатній температурі протягом 3 днів, al. J. Med Chem. 1967, 10, 717]. леткі речовини видаляють концентруванням на Діастереомер : роторному випарнику і залишок розподіляють між PX-MC: обчислено для C16H17CI2N 293, знайводою (300мл) і сумішшю гексан/простий ефір (1:1, дено m/e 294 (М+Н)+ (час утримування 2,5хв.). 200мл). Водний шар відділяють, підкислюють до Діастереомер : рН=2-3 та екстрагують ЕtOАс (2 200мл). Об'єднані РХ-МС: обчислено для C16H17CI2N 293, знайорганічні екстракти сушать над безводним сульдено m/e 294 (М+Н)+ (час утримування 2,2хв.). фатом натрію, фільтрують і концентрують досуха, Посилальний приклад 2 одержуючи вказану у заголовку сполуку. 1 H ЯМР (500МГц, CD3OD): 7,34-7,10 (м, 9Н), 3,82 (дд, 1Н), 3,36 (дд, 1Н). 2,98 (дд, 1Н). Стадія С N-Метокси-N-метил-3-(4-хлорфеніл)2-фенілпропанамід До розчину 3-(4-хлорфеніл)-2фенілпропіонової кислоти (стадія В, 14г, 55ммоль) у СН2СI2 (125мл) при 0°С додають диметилформамід (50мкл) і оксалілхлорид (14г, 0,11моль) по краплях. Реакційній суміші дають нагріватися до Гідрохлорид 2-аміно-4-(4-хлорфеніл)-3кімнатної температури протягом ночі і концентруфенілбутану ють досуха, одержуючи неочищений ацилхлорид, Вказану у заголовку сполуку одержують за меякий використовують без подальшого очищення. тодикою, описаною у довідковому прикладі 1. Так, до розчину ацилхлориду у СН2СI2 (250мл) Діастереомер : додають гідрохлорид N-метокси-N-метиламіну РХ-МС: обчислено для C16H18ClN 259, знайде(11г, 0,11моль) і триетиламін (висушений над акно m/е 260 (М+Н)+ (2,3хв.). тивованими молекулярними ситами, 30мл, Діастереомер : 0,22моль) при 0°С. Після перемішування при кімРХ-МС: обчислено для C16H18CIN 259, знайденатній температурі протягом 4год. реакційну суміш но m/е 260 (М+Н)+ (2,2хв.). розбавляють простим ефіром (500мл) і потім проПосилальний приклад 3 мивають водою, розбавленим водним гідросульфатом натрію і насиченим розчином солі, сушать над безводним MgSO4, фільтрують і концентрують досуха, одержуючи неочищений продукт, який використовують без подальшого очищення. 1 H ЯМР (500МГц, CD3OD): 7,4-7,1 (м, 9Н), 4,38 (уш., 1Н), 3,48 (с, 3Н), 3,35 (дд, 1Н), 3,10 (с, 3Н), 2,92 (дд, 1Н); PX-MS: m/e 304 (3,6хв.). Стадія D 4-(4-Хлорфеніл)-3-феніл-2-бутанон Гідрохлорид N-[3-(4-Хлорфеніл)-2-феніл-1До розчину N-метокси-N-метил-3-(4метилпропіл]аміну хлорфеніл)-2-фенілпропанаміду (стадія С, 16г, (Діастереомер ) 53ммоль, висушеного азеотропною перегонкою з Стадія А Метиловий ефір 3-(4-хлорфеніл)-2толуолом) у безводному ТГФ (200мл) при 0°С дофенілпропанової кислоти дають метилбромід магнію (3М у простому ефірі, До розчину метилфенілацетату (12г, 80ммоль) 35мл, 0,11моль). Після перемішування при 0°С і 4-хлорбензилброміду (16г, 80ммоль) у 250мл протягом 2год. реакцію гасять МеОН (5мл) і 2М безводного ТГФ при -78°С додають гексаметилдихлористоводневою кислотою (50мл). Леткі речови 31 76590 32 ни видаляють концентруванням на роторному вилонці силікагелю, елююючи гексаном, одержуючи парнику і залишок розподіляють між насиченим вказану у заголовку сполуку. хлоридом амонію (200мл) і простим ефіром Стадія Η 2-(N-трет-бутоксикарбоніл)аміно-4-(4(200мл). Органічний шар відділяють і водний шар хлорфеніл)-3-фенілбутан До розчину 2-азидо-4-(4-хлорфеніл)-3екстрагують простим ефіром (2 200мл). Об'єднані фенілбутану (стадія G, 7,0г, 24ммоль) в ЕtOАс органічні екстракти сушать над безводним MgSO4, (150мл) додають ди(трет-бутил)дикарбонат (8,0г, фільтрують і концентрують досуха, одержуючи 37моль) і діоксид платини (0,50г, 2,2ммоль). Суміш вказану у заголовку сполуку, яку використовують дегазують і наповнюють воднем з балона. Після без подальшого очищення. 1 перемішування протягом 1 дня реакційну суміш H ЯМР (500МГц, CD3OD): 7,45-7,02 (м, 9Н), фільтрують через діатомову землю CELITE і філь4,08 (дд, 1Н), 3,34 (дд, 1Н), 2,90 (дд, 1Н), 2,03 (с, трат концентрують, одержуючи неочищений про3Н). дукт, який забруднений деякою кількістю ди(третСтадія Ε 4-(4-Хлорфеніл)-3-Феніл-2-бутанол бутил)дикарбонату, що не прореагував. До розчину 4-(4-хлорфеніл)-3-феніл-21 H ЯМР (500МГц, CD3OD): 7,25-6,88 (м, 9Н), бутанону (стадія D, 13г, 50ммоль) у МеОН (100мл) 3,89 (м, 1Н), 3,20 (м, 1Н), 2,86-2,77 (м, 2Н), 1,54 (с, при 0°С додають боргідрид натрію (3,8г, 9Н), 0,92 (д, 3Н). 100ммоль). Після перемішування при 0°С протяСтадія І Гідрохлорид N-[3-(4-хлорфеніл)-2гом 30хв. реакцію гасять додаванням 2М хлорисфеніл-1-метилпропіл]аміну (Діастереомер ) товодневої кислоти (50мл). Леткі речовини видаляють концентруванням на роторному випарнику і 2-(N-трет-бутоксикарбоніл)аміно-4-(4залишок розподіляють між водою (100мл) і ЕtOАс хлорфеніл)-3-фенілбутан (стадія Н, 7,0г, 24ммоль) (200мл). Органічний шар відділяють і водний шар обробляють насиченим розчином хлористого водню в ЕtOАс (100мл) при кімнатній температурі екстрагують EtOAc (2 200мл). Об'єднані органічні протягом 30хв. (4М хлорид водню у діоксані може екстракти промивають насиченим розчином солі, бути використаний з подібними результатами). сушать над безводним сульфатом натрію, фільтСуміш концентрують досуха, одержуючи вказану у рують і концентрують досуха, одержуючи неочизаголовку сполуку. щений продукт, який очищають колонковою флеш1 хроматографією на силікагелі, елююють 10% H ЯМР (500МГц, CD3OD): 7,35-6,98 (м, 9Н), ЕtOАс у гексані, одержуючи чистий ізомер, що 3,62 (м, 1Н), 3,20 (дд, 1Н), 3,05 (м, 1Н), 2,98 (дд, швидше елююється, і суміш, що містить як ізомер, 1Н), 1,19 (д, 3Н). РХ-МС: m/е 260 (М+Н)+ (2,3хв.). що швидше елююється, так і ізомер, що повільніПосилальний приклад 4 ше елююється. Ізомер, що швидше елююється: 1 H ЯМР (500МГц, CD3OD): 7,25-7,00 (м, 9Н), 4,00 (м, 1Н), 3,15 (м, 1Н), 2,97 (м, 1Н), 2,85 (м,1Н), 1,10 (д, 3Н). Стадія F 4-(4-Хлорфеніл)-2метансульфонілокси-3-фенілбутан До розчину 4-(4-хлорфеніл)-3-феніл-2бутанолу (стадія Е, ізомер, що швидше елююєтьГідрохлорид N-[3-(4-хлорфеніл)-2(S)-фенілся, 9,0г, 34ммоль) в ЕtOАс (100мл) при 0°С дода1(S)-метилпропіл]аміну ють триетиламін (висушений над активованими Стадія А 4-(4-Хлорфеніл)-3(S)-феніл-2(R)молекулярними ситами, 5,8мл, 42ммоль) і метанбутанол сульфонілхлорид (3,0мл, 38ммоль). Після переміНаважку магнію (20г, 0,82моль) активують пешування при 0°С протягом 30хв. реакцію гасять ремішуванням в атмосфері азоту протягом 12год. і додаванням насиченого водного бікарбонату надодають безводний простий ефір (100мл), щоб трію (100мл). Після перемішування при кімнатній покрити тверду речовину. Суміш охолоджують до температурі протягом 1год. органічний шар відді0°С і додають по краплях 4-хлорбензилхлорид ляють, сушать над безводним сульфатом натрію, (40г, 0,25ммоль) у 400мл безводного простого фільтрують і концентрують досуха, одержуючи ефіру. Після перемішування при кімнатній темпевказану у заголовку сполуку, яку використовують ратурі протягом 1год. пробу вказаного розчину без додаткового очищення. 1 (32мл) додають за допомогою шприца при 0°С до H ЯМР (500МГц, CD3OD): 7,3-7,0 (м, 9Н), (1R,2R)-1-фенілпропіленоксиду (1,0г, 7,5ммоль) в 5,05 (м, 1Н), 3,2-3,0 (м, 3Н), 2,80 (с, 3Н), 1,40 (д, 100мл простого ефіру. Після перемішування при 3Н). 0°С протягом 2год. реакцію гасять додаванням Стадія G 2-Азидо-4-(4-хлорфеніл)-3насиченого водного хлориду амонію (100мл). Орфенілбутан ганічний шар відділяють і водний шар екстрагують До розчину 4-(4-хлорфеніл)-2простим ефіром (2 100мл). Об'єднані органічні метансульфонілокси-3-фенілбутану (стадія F, 12г, екстракти промивають насиченим розчином солі, 34ммоль) у ДМФА (50мл) додають азид натрію сушать над безводним MgSO4, фільтрують і кон(11г, 0,17моль). Після перемішування при 120°С центрують досуха і залишок очищають колонкопротягом 1год. реакційну суміш виливають у воду вою флеш-хроматографією на силікагелі, елююю(200мл) і продукт екстрагують простим ефіром чи градієнтом від гексану до 15% ЕtOАс у гексані, (2 100мл). Об'єднані органічні екстракти промиодержуючи вказану у заголовку сполуку. вають водою, сушать над MgSO4, фільтрують і 1 H ЯМР (500МГц, CD3OD): 7,28-7,02 (м, 9Н), концентрують досуха і залишок очищають на ко 33 76590 34 4,01 (м, 1Н), 3,14 (дд, 1Н). 2,97 (дд, 1Н), 2,85 (м, До розчину 2-фторфенолу (2,0г, 18ммоль) і 1Н), 1,12 (д, 3Н). 1,1,1-трихлор-2-метил-2-пропанолу (7,9г, Стадія В Гідрохлорид N-[3-(4-хлорфеніл)-2(S)45ммоль) в ацетоні (100мл) додають гідроксид феніл-1(S)-метилпропіл]аміну натрію (7,1г, 0,18моль) і періодично використовуПродукт стадії А (4-(4-хлорфеніл)-3(S)-фенілють водяну баню з льодом, щоб підтримувати по2(S)-бутанол (1,8г, 7,0ммоль) перетворюють у вкамірне кип'ятіння зі зворотним холодильником. Пісзану у заголовку сполуку, дотримуючись стадій, ля затихання кип'ятіння зі зворотним описаних у довідковому прикладі 3, стадії F-I, за холодильником реакційну суміш перемішують провинятком того, що хлорид водню у діоксані (4М) тягом однієї додаткової години. Леткі речовини використовують замість хлористого водню в видаляють на роторному випарнику і залишок розЕtOАс. поділяють між простим ефіром (100мл), гексаном 1 (100мл) і водою (200мл). H ЯМР (500МГц, CD3OD): 7,35-6,98 (м, 9Н), Водний шар відділяють і підкислюють концен3,62 (м, 1Н), 3,20 (дд, 1Н), 3,05 (м, 1Н), 2,98 (дд, трованою хлористоводневою кислотою (рН=2) і 1Н), 1,19 (д, 3Н). РХ-МС: m/е 260 (М+Н)+ (2,3хв.). екстрагують простим ефіром (3 100мл). Об'єднані Посилальний приклад 5 екстракти сушать над безводним MgSO4, фільтрують, концентрують досуха, одержуючи вказану у заголовку сполуку, яку використовують без подальшого очищення. 1 H ЯМР (500МГц, CD3OD): 7,15-7,05 (м, 4Н), 1,56 (с, 6Н). РХ-МС: m/е 199 (М+1)+ (2,3хв.). Кислоти довідкових прикладів 7 і 8 одержують, дотримуючись методик, описаних для довідкового прикладу 6, замінюючи 2-фторфенол відповідно Гідрохлорид N-[3-(4-хлорфеніл)-2-(3-піридил)заміщеними фенолами. 1-метилпропіл]аміну (суміш діастереомерів / Посилальний приклад 7 10:1) Стадія А 4-(4-Хлорфеніл)-3-піридил-2-бутанон До розчину гідрохлориду 3-піридилацетону [Wibaud, van der V. Reel. Trav. Chim. Pays-Bas. 1952, 71, 798] (10г, 58ммоль) і 4хлорбензилхлориду (9,1г, 58ммоль) у 100мл СН2СI2 при -78°С додають моногідрат гідроксиду 2-(3-Хлорфенілокси)-2-метилпропіонова кисцезію (39г, 0,23моль) і йодид тетрабутиламонію лота (1г). Реакційній суміші дають нагріватися до кімна1 H ЯМР (500МГц, CD3OD): 7,23 (т, 1Η), 7,00 тної температури протягом ночі і одержану суміш (дд, 1Н), 6,93 (τ, 1Η), 6,84 (дд, 1Н), 1,59 (с, 6Н). РХрозподіляють між насиченим розчином солі МС: m/е 215 (М+1)+ (2,7хв.). (100мл) і ЕtOАс (100мл). Органічний шар відділяПосилальний приклад 8 ють і водний шар екстрагують ЕtOАс (2 100мл). Об'єднані органічні екстракти сушать над безводним MgSO4, фільтрують і концентрують досуха, одержуючи вказану у заголовку сполуку. 1 H ЯМР (500МГц, CD3OD): 8,42 (д, 1Н), 8,34 (д, 1Н), 7,72 (д, 1Н), 7,40 (дд, 1Н), 7,18 (д, 2Н), 7,06 (д, 1Н), 4,23 (дд, 1Н), 3,38 (дд, 1Н), 2,95 (дд, 1Н), 2,10 (с, 3Н). РХ-МС: m/е 260 (М+Н)+ (1,9хв.). Стадія В Гідрохлорид N-[3-(4-хлорфеніл)-2-(32-(3,5-Дихлорфенілокси)-2-метилпропіонова піридил)-1-метилпропіл1аміну (суміш діастереокислота 1 мерів / 10:1) H ЯМР (500МГц, CD3OD): 7,05 (т, 1Н), 6,84 Продукт стадії А (4-(4-хлорфеніл)-3-піридил-2(д, 2H), 1,60 (с, 6Н). бутанон) (14г, 57ммоль) перетворюють у вказану у Посилальний приклад 9 заголовку сполуку, дотримуючись методики, описаної у довідковому прикладі 3, стадії Е-І. РХ-МС: m/е 261 (М+Н)+ (1,2хв.). Посилальний приклад 6 2-(2-Фторфенілокси)-2-метилпропіонова кислота Стадія А 2-(2-Фторфенілокси)-2метилпропіонова кислота 2-(2-Піридилокси)-2-метилбутанова кислота Стадія А Бензил-2-(2-піридилокси)пропіонат До суміші 2-гідроксипіридину (2,9г, 30ммоль), бензиллактату (5,0г, 21ммоль) і трифенілфосфіну (12г, 47ммоль) у 100мл СН2СI2 додають діетилазидокарбоксилат (7,8мл, 45ммоль) при 0°С. Реакційній суміші дають нагріватися до кімнатної температури протягом 4год. Одержану суміш 35 76590 36 розбавляють гексаном (100мл) і концентрують з 20г силікагелю. Продукт завантажують у колонку силікагелю, яку елююють 10% ЕtOАс у гексані, одержуючи вказану у заголовку сполуку. 1 H ЯМР (500 МГц, CD3OD): 8,00 (дд, 1Н), 7,68 (ддд, 1Н), 7,36-7,28 (м, 5Н), 6,94 (дд, 1Н), 6,84 (дд, 1Н), 5,30 (кв, 1Н), 5,18 (с, 2Н), 1,59 (д, 3Н). РХ-МС: m/е 258 (М+Н)+ (3,3хв.). Стадія В Бензил-2-(2-піридилокси)-2метилбутаноат Гідрохлорид N-[3-(4-хлорфеніл)-2-(3,5До розчину бензил-2-(2дифторфеніл)-1-метилпропіл]аміну піридилокси)пропіонату (1,6г, 6,2ммоль) і етилйо(Діастереомер ) диду (1,5мл, 25ммоль) у 10мл безводного ТГФ при Вказану у заголовку сполуку одержують, до-78°С додають гексаметилдисилазид натрію (1М у тримуючись методик, описаних для довідкового ТГФ, 9,3мл, 9,3ммоль) (гексаметилдисилазид каприкладу 3, замінюючи метил феніл ацетат метиллію у толуолі може бути використаний з подібними 3,5-дифторфенілацетатом (одержаним з 3,5результатами). Реакційній суміші дають нагріватидифторфенілоцтової кислоти і триметилсилілдіася до кімнатної температури протягом 2год. і роззометану) на стадії А і боргідрид натрію в МеОН поділяють між насиченим хлоридом амонію три(втор-бутил)боргідридом літію у ТГФ на стадії (100мл) і ЕtOАс (100мл). Органічний шар відділяЕ. РХ-МС: m/е 296 (М+Н)+ (2,39хв.). ють і водний шар екстрагують EtOAc (2 50мл). Посилальний приклад 12 Об'єднані органічні екстракти сушать над безводним сульфатом натрію, фільтрують і концентрують досуха і залишок очищають колонковою флешхроматографією на силікагелі, елююють 10% ЕtOАс у гексані, одержуючи вказану у заголовку сполуку. 1 H ЯМР (500МГц, CD3OD): 7,87 (дд, 1Н), 7,63 (ддд, 1Н), 7,27 (м, 3Н), 7,18 (м, 2Н), 6,85 (дд, 1Н), 6,74 (дд, 1Н), 5,08 (АВ кв, 2Н), 2,13 (м, 1Н), 1,94 (м, 1Н), 1,65 (с, 3Н), 0,95 (т, 3Н). РХ-МС: m/е 286 (М+Н)+ (3,8хв.). Стадія С 2-(2-Піридилокси)-2-метилбутанова Гідрохлорид N-[3-(4-хлорфеніл)-2-(3кислота ціанофеніл)-1-метилпропіл]аміну Суміш бензил-2-(2-піридилокси)-2(Діастереомер ) метилбутаноату (1,6г, 5,5ммоль) і 10% паладію на Стадія А 2-(N-трет-Бутоксикарбоніл)аміно-4-(4вуглеці (50мг) у 50мл МеОН дегазують і наповнюхлорфеніл)-3-(3-ціанофеніл)бутан ють воднем, використовуючи балон. Після переДо розчину 2-(N-трет-бутоксикарбоніл)аміно-3мішування при кімнатній температурі протягом бромфеніл-4-(4-хлор-феніл)бутану (одержаного ночі, реакційну суміш фільтрують через діатомову відповідно до методики довідкового прикладу 3, землю CELITE і промивають МеОН (20мл) і фільтстадія Н, 1,0г, 2,3ммоль) у 5мл ДМФА додають рат концентрують досуха, одержуючи вказану у ціанід цинку (0,16г, 1,4ммоль), комплекс заголовку сполуку. 1 трис(дибензиліденацетон)дипаладій-хлороформ H ЯМР (500МГц, CD3OD): 8,03 (дд, 1Н), 7,64 (3,0мг, 2,8мкмоль), 1,1'(ддд, 1Н), 6,89 (дд, 1Н), 6,76 (дд, 1Н), 2,14 (м, 1Н), біс(дифенілфосфіно)фероцен (5,0мг, 9,0мкмоль) і 1,94 (м, 1Н), 1,64 (с, 3Н), 0,99 (т, 3Н). РХ-МС: m/е воду (0,1мл). Після нагрівання при 120°С протягом 196 (М+Н)+(1,8хв.). 6год. в атмосфері азоту додають інше завантаПосилальний приклад 10 ження ціаніду цинку (0,16г, 1,4ммоль), комплексу трис(дибензиліденацетон)дипаладій-хлороформ (5,0мг, 4,8мкмоль), 1,1'біс(дифенілфосфіно)фероцену (5,0мг, 9,0мкмоль) і води (0,05мл) і нагрівання продовжують наступні 18год. Після охолоджування до кімнатної температури одержану суміш розподіляють між водою 2-(2-Піридилокси)-2-метилпропіонова кислота (50мл) і простим ефіром (50мл). Органічний шар Вказану у заголовку сполуку одержують, довідділяють і водний шар екстрагують простим ефітримуючись методик, описаних для довідкового ром (2 50мл). Об'єднані екстракти сушать над прикладу 9, замінюючи етилйодид і гексаметилдибезводним MgSO4, фільтрують і концентрують, і силазид натрію метилйодидом і гексаметилдисизалишок очищають колонковою флешлазидом калію, відповідно, на стадії В. хроматографією на силікагелі, елююють 20% 1 H ЯМР (500МГц, CD3OD): 8,04 (дд, 1Н), 7,64 ЕtOАс у гексані, одержуючи вказану у заголовку (ддд, 1Н), 6,89 (дд, 1Н), 6,76 (дд, 1Н), 1,66 (с, 6Н). сполуку. 1 РХ-МС: m/е 182 (М+Н)+ (1,5хв.). H ЯМР (400МГц, CD3OD): 7,6-7,3 (м, 4Н), Посилальний приклад 11 7,10 (д, 2Н), 6,92 (д, 2Н), 3,88 (м, 1Н), 3,20 (м, 1Н), 2,97 (м, 1Н), 1,82 (м, 1Н), 1,45 (с, 9Н), 0,94 (д, 3Н). 37 76590 38 РХ-МС: m/е 385 (М+Н)+ (3,9хв.). 5-трифторметил-2-гідроксипіридином на стадії А. 1 Стадія В Гідрохлорид N-[3-(4-хлорфеніл)-2-(3H ЯМР (500МГц, CD3OD): 8,38 (уш.с, 1Н), ціанофеніл)-1-метилпропіліаміну (Діастереомер ) 7,93 (дд, 1Н), 7,13 (д, 1Н), 1,70 (с, 6Н). РХ-МС: m/е Вказану у заголовку сполуку одержують, до250 (М+Н)+ (2,6хв.). тримуючись методики, описаної для довідкового Посилальний приклад 15 + прикладу 3, стадія І. РХ-МС: m/е 285 (М+Н) (2,2хв.). Посилальний приклад 13 2-Метил-2-(5-хлор-2-піридилокси)пропіонова кислота Стадія А Етил-2-метил-2-(5-хлор-2піридилокси)пропіонат Суміш 5-хлор-2-гідроксипіридину (5,0г, 39ммоль), етил-2-бромізобутирату (5,7мл, 39ммоль) і карбонату цезію (25г, 77ммоль) в 50мл ацетонітрилу нагрівають при 50°С протягом ночі. Леткі речовини видаляють концентруванням на роторному випарнику і залишок розподіляють між водою (100мл) і EtOAc (100мл). Органічний шар відділяють і водний шар екстрагують EtOAc (2 100мл). Об'єднані органічні екстракти сушать над безводним сульфатом натрію, фільтрують і концентрують досуха і залишок очищають колонковою флеш-хроматографією на силікагелі, елююють 5% EtOAc у гексані, одержуючи вказану у заголовку сполуку. 1 H ЯМР (500МГц, CD3OD): 7,99 (д, 1Н), 7,67 (дд, 1Н), 6,68 (д, 1Н), 4,13 (кв, 2Н), 1,64 (с, 6Н), 1,14 (т, 3Н). РХ-МС: m/е 244 (М+Н)+ (3,41хв.). Стадія В 2-Метил-2-(5-хлор-2піридилокси)пропіонова кислота Суміш етил-2-метил-2-(5-хлор-2піридилокси)пропіонату і гідроксиду натрію (0,85г, 21ммоль) в 15мл ацетонітрилу і 15мл води нагрівають при 50°С протягом ночі. Леткі речовини видаляють концентруванням на роторному випарнику і залишок розподіляють між 2М хлористоводневою кислотою (100мл) і простим ефіром (100мл). Органічний шар відділяють і промивають водою (2 50мл), сушать над безводним MgSO4, фільтрують і концентрують досуха, одержуючи вказану у заголовку сполуку. 1 H ЯМР (500МГц, CD3OD): 8,02 (д, 1Н), 7,65 (дд, 1Н), 6,77 (д, 1Н), 1,62 (с. 6Н). РХ-МС: m/е 216 (М+Н)+ (2,33хв.). Посилальний приклад 14 2-Метил-2-(5-трифторметил-2піридилокси)пропіонова кислота Вказану у заголовку сполуку одержують, дотримуючись методик, описаних для довідкового прикладу 13, замінюючи 5-хлор-2-гідроксипіридин 2-Метил-2-(6-метил-2-піридилокси)пропіонова кислота Вказану у заголовку сполуку одержують, дотримуючись методик, описаних для довідкового прикладу 13, замінюючи 5-хлор-2-гідроксипіридин 6-метил-2-гідроксипіридином на стадії А. 1 H ЯМР (500МГц, CD3OD): 7,51 (т, 1Η), 6,74 (д, 1Н), 6,53 (д, 1Н), 2,34 (с, 3Н), 1,64 (с, 6Н). РХМС: m/е 196 (М+Н)+ (1,3хв.). Посилальний приклад 16 2-Аміно-3-(1-(1,2,3-триазоліл))-4-(4хлорфеніл)бутан Стадія А Бензил-2-(1-(1,2,3-триазоліл))ацетат Суміш 1,2,3-триазолу (2,07г, 30ммоль), фенілбромацетату (6,9г, 30ммоль) і діізопропілетиламіну (5,1мл, 30ммоль) у 40мл СН2СI2 перемішують протягом ночі при кімнатній температурі. Суміш потім розбавляють простим ефіром доти, доки більше не утвориться осад. Тверду речовину фільтрують і промивають простим ефіром. Фільтрат концентрують і залишок очищають на силікагелі, використовуючи 10% гексан у СН2СI2, одержуючи ізомер вказаної у заголовку сполуки, бензил-2-(2-(1,2,3триазоліл)ацетату, у вигляді аморфної твердої речовини. Додаткове елюювання сумішшю розчинників, що містить рівні кількості простого ефіру і СН2СI2, дає вказану у заголовку сполуку у вигляді аморфної твердої речовини. 1 H ЯМР (400МГц, CDCI3): 2,251 (с, 2Н), 7,2677,390 (м, 5Н), 7,723 (с, 1Н). 7,785 (с, 1Н). Стадія В 2-(1-(1,2,3-триазоліл))оцтова кислота Гідроксид паладію (20% на вуглеці, 800мг) додають до розчину бензил-2-(1-(1,2,3триазоліл))ацетату (стадія А, 8,68г, 39,9ммоль) в 150мл МеОН і суміш гідрують протягом ночі на шейкері Пара в атмосфері водню при кімнатній температурі і при тиску 45 фунтів на кв. дюйм. Каталізатор фільтрують через шар діатомової землі CELITE і промивають МеОН. Фільтрат концентрують, одержуючи тверду речовину, яку сушать у вакуумі при 50°С протягом 36год., одержуючи вказану у заголовку сполуку. 1 H ЯМР (500МГц, CD3OD): 5,3 (с, 2Н), 7,75 (с, 1Н), 8,016 (с, 1Н). Стадія С N-Метокси-N-метил-2-(1-(1,2,3триазоліл))ацетамід 39 76590 40 Оксалілхлорид (0,95мл, 11ммоль) додають по краплях до суспензії 2-(1-(1,2,3-триазоліл))оцтової кислоти (стадія В, 1,27г, 10ммоль) у 10мл СН2СI2, що містить 0,05мл ДМФА. Спостерігається інтенсивне газовиділення. Суміш перемішують при кімнатній температурі протягом 4год. і охолоджують до -78°С. Розчин гідрохлориду Ν,Οдиметилгідроксиламіну (1,2г, 13ммоль) та діізопропілетиламіну (6,0мл, 35ммоль) у 10мл СН2СI2 додають повільно протягом 3хв. Суміші потім даГідрохлорид N-[3-(4-хлорфеніл)-2-(3ють нагрітися до кімнатної температури і переміметилфеніл)-1-метилпропіл]аміну шують протягом ночі. Реакційну суміш потім роз(Діастереомер ) бавляють простим ефіром доти, доки не буде Стадія А 2-(N-трет-Бутоксикарбоніл)аміно-4-(4з'являтися додатковий осад. Тверду речовину фіхлорфеніл)-3-(3-метил-феніл)бутан льтрують і промивають простим ефіром. Фільтрат Суміш 2-(N-трет-бутоксикарбоніл)аміно-3-(3концентрують і залишок очищають на силікагелі, бромфеніл)-4-(4-хлор-феніл)бутану (посилальний використовуючи ЕtOАс як розчинник, одержуючи приклад 3, стадія Н, 0,50г, 1,1ммоль), тетраметивказану у заголовку сполуку у вигляді аморфної лолова (0,41г, 2,3ммоль), трифенілфосфіну (0,12г, твердої речовини. 0,46ммоль), хлориду літію (0,38г, 9,1ммоль) і дих1 H ЯМР (400МГц, CDCI3): 3,252 (с, 3Н), 3,812 лорбіс(трифенілфосфін)паладію (0,12г, (с, 3Н), 5,379 (с, 2Н), 7,753 і 7,761 (всі с, 2Н). 0,17ммоль) у 20мл безводного ДМФА нагрівають Стадія D N-Метокси-N-метил-3-(4-хлорфеніл)при 100°С в атмосфері азоту протягом 18год. Реа2-(1-(1,2,3-триазоліл))пропіонамід кційну суміш охолоджують до кімнатної темпераГексаметилдисилазид літію (1-молярний у тури і розподіляють між водою (100мл) і простим ТГФ, 8,4мл, 8,4ммоль) додають по краплях до розефіром (100мл). Органічний шар відділяють і водчину N-метокси-N-метил-2-(1-(1,2,3ний шар екстрагують простим ефіром (100мл). триазоліл))ацетаміду (стадія С, 1,19г, 7ммоль) в 15 Об'єднані екстракти сушать над безводним мл ТГФ при -78°С. Після додаткових 30хв. переміMgSO4, фільтрують і концентрують досуха і залишування додають по краплях розчин 4шок очищають колонковою флеш-хроматографією хлорбензилброміду (1,65г, 8ммоль) у 5мл ТГФ. на силікагелі, елююють 10% ЕtOАс у гексані, одеСуміші дають нагрітися до кімнатної температури і ржуючи вказану у заголовку сполуку. 1 перемішують 5,5год. Суміш очищають на силікагеH ЯМР (500МГц, CD3OD): 7,2-6,8 (м, 8Н), лі, використовуючи 40% ЕtOАс у гексані, одержую3,84 (м, 1Н), 3,16 (м, 1Н), 2,80-2,68 (м, 2Н), 2,24 (с, чи вказану у заголовку сполуку. 3Н), 1,45 (с, 9Н), 0,86 (д, 3Н). РХ-МС: m/е 396 1 H ЯМР (400МГц, CDCI3): 3,186 (с, 3Н), 3,234(M+Na)+ (4,4хв.). 3,267 (м, 1Н), 3,453-3,506 (м, 1Н), 3,582 (с, 3Н), Стадія В Гідрохлорид N-[3-(4-хлорфеніл)-2-(36,145-6,188 (м, 1Н), 7,048-7,279 (м, 4Н), 7,726 (с, метил феніл)-1-метил-пропіл]аміну (Діастереомер 1Н), 7,954 (с, 1Н). ) Стадія Ε 2-Азидо-3-(1-(1,2,3-триазоліл))-4-(4Вказану у заголовку сполуку одержують, дохлорфеніл)бутан тримуючись методики, описаної для довідкового Продукт стадії D, N-метокси-N-метил-3-(4прикладу 3, стадія І. РХ-МС: m/е 274 (М+Н)+ хлорфеніл)-2-(1-(1,2,3-триазоліл)пропіон)амід, пе(2,5хв.). ретворюють у вказану у заголовку сполуку, дотриПосилальний приклад 18 муючись методик, описаних у довідковому прикладі 3, стадії D-G. 1 H ЯМР (400МГц, CDCI3): 1,219-1,246 (всі д, 3Н), 3,253-4,754 (м, 4Н), 6,866-7,299 (всі д, 4Н), 7,313, 7,618, 7,63 і 7,706 (всі с, 2Н). Стадія F 2-Аміно-3-(1-(1,2,3-триазоліл))-4-(4хлорфеніл)бутан Оксид платини (14мг) додають до розчину 2азидо-3-(1-(1,2,3-триазоліл))-4-(4хлорфеніл)бутану (стадія Е, 138мг, 0,5ммоль) в Гідрохлорид N-[3-(5-хлор-2-піридил)-2(S)4мл МеОН. Суміш гідрують в атмосфері водню, феніл-1(S)-метилпропіл]аміну використовуючи заповнений воднем балон, протя(Діастереомер ) гом 3год. при кімнатній температурі. Каталізатор Стадія А 5-Хлор-2-метилпіридин фільтрують через шар діатомової землі CELITE і Суміш 2,5-дихлорпіридину (15г, 0,10моль), тепромивають МеОН. Фільтрат концентрують, одертраметилолова (15мл, 0,11моль) і дихлоржуючи вказану у заголовку сполуку у вигляді масбіс(трифенілфосфін)паладію (2,0г, 2,8ммоль) у ла. 200мл безводного ДМФА нагрівають при 110°С в 1 H ЯМР (400МГц, CDCI3): 1,085-1,174 (всі д, атмосфері азоту протягом 72год. Реакційну суміш 3Н), 3,220-3,361 (м, 2Н), 3,517-3,563 (м, 1Н), 4,379охолоджують до кімнатної температури і вилива4,431 (м, 1Н), 6,679-7,179 (всі д, 4Н), 7,297, 7,40, ють у насичений розчин фториду калію (200мл). 7,592 і 7,607 (всі с, 2Н). Одержану суміш розподіляють між водою (500мл) і Посилальний приклад 17 простим ефіром (500мл). Органічний шар відділя 41 76590 42 ють і водний шар екстрагують простим ефіром (200мл). Об'єднані екстракти сушать над безводним MgSO4, фільтрують і концентрують досуха і залишок очищають колонковою флешхроматографією на силікагелі, елююють градієнтом від 2 до 10% простого ефіру у гексані, одержуючи вказану у заголовку сполуку. 1 H ЯМР (500МГц, CD3OD): 8,41 (д, 1Н), 7,75 (дд, 1Н), 7,30 (д, 1Н), 2,53 (с, 3Н). Стадія В 4-(5-Хлор-2-піридил)-3(S)-феніл-2(R)Гідрохлорид N-[2-(3-бромфеніл)-3-(5-хлор-2бутанол піридил)-1-метилпропіл]аміну До розчину 5-хлор-2-метилпіридину (стадія А, (Діастереомер ) 1,1г, 8,7ммоль) в 15мл безводного простого ефіру Стадія А 3-Бромфенілацетон додають феніллітій (1,8М у суміші циклогекДо розчину N-метокси-N-метилацетаміду (10г, сан/простий ефір, 7,2мл, 13ммоль) при 0°С і реак100ммоль) в 100мл безводного простого ефіру при ційну суміш перемішують при кімнатній темпера0°С додають бромід 3-бромбензилмагнію (0,25М у турі протягом 30хв. Одержану суміш охолоджують простому ефірі, 200мл, 50ммоль). Реакційній сузнову до 0°С і додають (1R,2R)-1міші дають нагріватися до кімнатної температури фенілпропіленоксид (2,3г, 17ммоль) і реакційній протягом ночі і гасять додаванням насиченого суміші дають нагріватися до кімнатної температухлориду амонію (100мл). Органічний шар відділяри протягом ночі. Реакційну суміш розподіляють ють і водний шар екстрагують гексаном (100мл). між ЕtOАс (100мл) і водою (100мл). Органічний Об'єднані екстракти сушать над безводним шар відділяють і водний шар екстрагують ЕtOАс MgSO4, фільтрують і концентрують досуха, одер(2 100мл). Об'єднані органічні екстракти сушать жуючи вказану у заголовку сполуку. над безводним MgSO4, фільтрують і концентрують 1 H ЯМР (500МГц, CD3OD): 7,45-7,40 (м, 2Н), досуха і залишок очищають колонковою флеш7,26 (т, 1Н), 7,19 (д, 1Н), 2,20 (с, 3Н). хроматографією на силікагелі, елююють з градієнСтадія В 3-(3-Бромфеніл)-4-(5-хлор-2том від 10 до 40% ЕtOАс у гексані, одержуючи вкапіридил)-2-бутанон зану у заголовку сполуку. Суспензію 5-хлор-2-метилпіридину (посилаль1 H ЯМР (500МГц, CD3OD): 8,28 (д, 1Н), 7,59 ний приклад 18, стадія А, 6,4г, 50ммоль) і N(дд, 1Н), 7,25-7,12 (м, 5Н), 7,05 (д, 1Н), 4,03 (м, бромсукциніміду (12,5г, 70ммоль) у 100мл тетрах1Н), 3,29 (дд, 1Н), 3,19 (дд, 1Н), 3,12 (м, 1Н), 1,12 лориду вуглецю нагрівають до спокійного кип'ятін(д, 3Н). ня зі зворотним холодильником (температура бані Стадія С 2(S)-Азидо-4-(5-хлор-2-піридил)-3(S)90°С) і додають декількома порціями 2,2'фенілбутан азобісізобутиронітрил (0,74г) протягом 30хв. Після До суміші 4-(5-хлор-2-піридил)-3-феніл-2перемішування при вказаній температурі протягом бутанолу (стадія В, 0,24г, 0,92ммоль), трифеніл5год. реакційну суміш концентрують. Одержану фосфіну (1,5г, 1,4ммоль) і дифенілфосфорилазиду густу суспензію розбавляють EtOAc (100мл) і про(0,30мл, 1,4ммоль) у 5мл безводного ТГФ додають мивають водою (100мл), сумішшю насиченого водіетилазидокарбоксилат (0,24мл, 1,4ммоль). Після дного бікарбонату натрію/насиченого водного тіоперемішування при кімнатній температурі протясульфату натрію і насиченим розчином солі. гом ночі одержану суміш концентрують з силікагеОрганічний розчин сушать над безводним сульфалем (10г) і залишок завантажують на колонку силітом натрію, фільтрують і концентрують досуха і кагелю. Елюювання з градієнтом від 5 до 15% залишок очищають колонковою флешЕtOАс у гексані дає вказану у заголовку сполуку. хроматографією на силікагелі, елююють градієн1 H ЯМР (500МГц, CD3OD): 8,35 (д, 1Н), 7,52 том суміші від 2 до 15% простий ефір/СН2СI2 (1:1) (дд, 1Н), 7,25-7,05 (м, 5Н), 6,95 (д, 1Н), 3,81 (м, у гексані, одержуючи 2-бромметил-5-хлорпіридин 1Н), 3,48 (м, 1Н), 3,15-3,05 (м, 2Н), 1,14 (д, 3Н). (6,0г, 60%), який відразу використовують для поСтадія D Гідрохлорид N-[3-(5-хлор-2-піридил)дальшої реакції. Так, до енергійно перемішуваного 2(S)-феніл-1(S)-метилпропіл]аміну розчину 2-бромметил-5-хлорпіридину (6,0г, Продукт стадії С (0,20г, 0,70моль) перетворю29ммоль) і 3-бромфенілацетону (стадія А, 6,0г, ють у вказану у заголовку сполуку, дотримуючись 28ммоль) та йодиду тетрабутиламонію (20мг) в методики, описаної у довідковому прикладі 3, ста30мл СН2СІ2 при -78°С додають моногідрат гідрокдії Н-І, за винятком того, що хлорид водню у діоксиду цезію (10г, 60ммоль) і реакційній суміші дасані (4М) використовують замість хлористого водють повільно нагрітися до кімнатної температури ню в EtOAc. протягом ночі. Реакційну суміш розподіляють між 1 H ЯМР (500МГц, CD3OD): 8,75 (д, 1Н), 8,19 ЕtOАс (100мл) і водою (100мл). Органічний шар (дд, 1Н), 7,55 (д, 1Н), 7,4-7,2 (м, 5Η), 3,78 (м, 1H), відділяють і водний шар екстрагують EtOAc 3,62 (дд, 1Н), 3,48 (м, 1Н), 3,43 (дд, 1Н), 1,22 (д, (2 100мл). Об'єднані органічні екстракти сушать + 3Н). РХ-МС: m/e 261 (M+H) (2,2хв.). над безводним сульфатом натрію, фільтрують і Посилальний приклад 19 концентрують досуха і залишок очищають колонковою флеш-хроматографією на силікагелі, елююють з градієнтом від 5 до 40% EtOAc у гексані, одержуючи вказану у заголовку сполуку. 1 H ЯМР (500МГц, CD3OD): 8,44 (д, 1Н), 7,66 43 76590 44 (дд, 1Н), 7,46-7,41 (м, 2Н), 7,24 (т, 1Н), 7,22 (д, 1Н), (Стадія А). 1 7,15 (д, 1Н), 4,42 (дд, 1Н), 3,54 (дд, 1Н), 3,07 (дд, H ЯМР (500МГц, CD3OD): 8,43 (д, 1Н), 8,24 + 1Н), 2,12 (с, 3Н). РХ-МС: m/е 338 (М+Н) (3,0хв). (д, 1Н), 7,98 (дд, 1Н), 7,17 (д, 2Н), 7,07 (д, 2Н), 4,04 Стадія С 3-(3-Бромфеніл)-4-(5-хлор-2(м, 1Н), 3,16 (дд, 1Н), 3,0-2,9 (м, 2Н), 1,04 (д, 3Н). піридил)-2-бутанол Стадія С Гідрохлорид N-[2-(5-бром-3-піридил)До розчину 3-(3-бромфеніл)-4-(5-хлор-23-(4-хлорфеніл)-1-метилпропіл]аміну (Діастереопіридил)-2-бутанону (стадія В, 6,7г, 20ммоль) у мер ) 50мл безводного ТГФ при -78°С додають боргідВказану у заголовку сполуку одержують, дорид три(втор-бутил)літію (1,0М у ТГФ, 30мл, тримуючись методики, описаної для довідкового 30ммоль) і реакційній суміші дають нагрітися до прикладу 4, стадія В. РХ-МС: m/е 339 (М+Н)+ кімнатної температури протягом ночі. Реакційну (2,5хв.)· суміш охолоджують до 0°С. обережно додають 2М Посилальний приклад 21 хлористоводневу кислоту (50мл) і одержану суміш розподіляють між гексаном (200мл) і водою (200мл). Водний шар відділяють і органічний шар екстрагують 2М хлористоводневою кислотою (2 100мл). Об'єднані водні екстракти нейтралізують 5н.водним гідроксидом натрію (рН>12) та екстрагують EtOAc (2 200мл). Об'єднані екстракти сушать над безводним сульфатом натрію, фільтрують і концентрують досуха, одержуючи вказану у заголовку сполуку. Стадія D Гідрохлорид N-[2-(3-бромфеніл)-3-(5хлор-2-піридил)-1-метилпропіл]аміну Гідрохлорид N-[3-(4-хлорфеніл)-2-(5-ціано-3Продукт стадії С (5,9г, 17ммоль) перетворюпіридил)-1-метилпропіл]аміну ють у вказану у заголовку сполуку, дотримуючись (Діастереомер ) методики, описаної у довідковому прикладі 18, + Стадія А 5-Ціано-3-піридилацетон стадії C-D. РХ-МС: m/е 338(М+Н) (2,3хв.). Вказану у заголовку сполуку одержують, доПосилальний приклад 20 тримуючись методики, описаної для довідкового прикладу 20, замінюючи 3,5-дибромпіридин 5бромнікотинонітрилом (5-бром-3-ціанопіридином) на стадії А. 1 H ЯМР (500МГц, CD3OD): 8,89 (д, 1Н), 8,60 (д, 1Н), 8,02 (т, 1Н), 3,98 (с, 2Н), 2,24 (с, 3Н). Стадія В Гідрохлорид N-[3-(4-хлорфетл)-2-(5ціано-2-тридил)-1-метил-пропіл]аміну (Діастереомер / 5:1) Вказану у заголовку сполуку одержують, дотримуючись методики, описаної для довідкового Гідрохлорид N-[2-(5-бром-2-піридил)-3-(4прикладу 5, замінюючи 3-піридил ацетон 5-ціано-3хлорфеніл)-1-метилпропіл]аміну піридилацетоном (стадія А). РХ-МС: m/е 286 (Діастереомер ) (М+Н)+ (1,9хв.). Стадія А 5 -Бром-3-піридилацетон Посилальний приклад 22 Суміш 3,5-дибромпіридину (50г, 0,21моль), ізопропенілацетату (26мл, 0,23ммоль), трис(дибензиліденацетон)дипаладію (1,0г, 1,1ммоль) і 2-(дифенілфосфіно)-2'-(N,Nдиметиламіно)біфенілу (1,6г, 4,2ммоль) у 400мл толуолу нагрівають при 100°С в атмосфері азоту протягом 2год. Реакційну суміш охолоджують до кімнатної температури і концентрують до близько 100мл. Одержану суміш завантажують на колонку силікагелю, яку елююють з градієнтом від 0 до 60% ЕtOАс у гексані, одержуючи вказану у заголоГідрохлорид N-[3-(4-хлорфеніл)-2-(5-хлор-3вку сполуку. 1 піридил)-1-метилпропіл]аміну H ЯМР (500МГц, CD3OD): 8,54 (уш.с, 1Н), (Діастереомер ) 8,33 (уш.с, 1Н), 7,88 (уш.с, 1Н), 3,90 (с, 2Н), 2,25 (с, Стадія А 5-Хлор-3-піридилацетон 3Н). Вказану у заголовку сполуку одержують, доСтадія В 3-(5-Бром-3-піридил)-4-(4тримуючись методики, описаної для довідкового хлорфеніл)-2-бутанол прикладу 20, замінюючи 3,5-дибромпіридин 3,5Вказану у заголовку сполуку одержують, додихлорпіридином і 2-(дифенілфосфіно)-2'-(N,Nтримуючись методики, описаної у довідковому диметиламіно)біфеніл 2-(ди-третприкладі 19, стадії В-С, замінюючи 2-бромметил-5бутилфосфіно)біфенілом на стадії А. хлорпіридин 4-хлорбензилхлоридом і 31 H ЯМР (500МГц, CD3OD): 8,42 (д, 1Н), 8,27 бромфенілацетон 5-бром-3-піридилацетоном 45 76590 (д, 1Н), 7,73 (дд, 1Н), 3,90 (с, 2Н), 2,25 (с, 3Н). Стадія В Гідрохлорид N-[3-(4-хлорфеніл)-2-(5хлор-3-піридил)-1-метил-пропіл]аміну (Діастереомер ) Вказану у заголовку сполуку одержують, дотримуючись методики, описаної для довідкового прикладу 20, стадії В-С, замінюючи 5-бром-3піридилацетон 5-хлор-3-піридилацетоном на стадії В. РХ-МС: m/е 295 (М+Н)+ (1,9хв.). Посилальний приклад 23 Гідрохлорид N-[3-(4-хлорфеніл)-2-(5-метил-3піридил)-1-метилпропіл]аміну (Діастереомер ) Вказану у заголовку сполуку одержують, дотримуючись методики, описаної для довідкового прикладу 17, замінюючи 2-(N-третбутоксикарбоніл)аміно-3-(3-бромфеніл)-4-(4хлорфеніл)бутан 2-(N-трет-бутоксикарбоніл)аміно3-(5-бром-3-піридил)-4-(4-хлорфеніл)бутаном (проміжна сполука з довідкового прикладу 20, стадія В) на стадії А. РХ-МС: m/е 275 (М+Н)+ (1,3хв.). Посилальний приклад 24 2-Метил-2-(2-піримідилокси)пропіонова кислота Вказану у заголовку сполуку одержують, дотримуючись методик, описаних для довідкового прикладу 13, замінюючи 5-хлор-2-гідроксипіридин 2-гідроксипіримідином на стадії А. 1 H ЯМР (500МГц, CD3OD): 8,53 (д, 2Н), 7,09 (т, 1Н), 1,74 (с, 6Н). Посилальний приклад 25 2-Метил-2-(4-грифгормегил-2піридилокси)пропіонова кислота Вказану у заголовку сполуку одержують, дотримуючись методик, описаних для довідкового прикладу 13, замінюючи 5-хлор-2-гідроксипіридин 4-трифторметил-2-гідроксипіридином на стадії А. 1 H ЯМР (500МГц, CD3OD): 8,30, (д, 1Н), 7,18 (д, 1Н), 7,05 (с, 1Н), 1,71 (с, 6Н). 46 Посилальний приклад 26 2-Метил-2-(6-трифторметил-4піримідилокси)пропіонова кислота Вказану у заголовку сполуку одержують, дотримуючись методик, описаних для довідкового прикладу 13, замінюючи 5-хлор-2-гідроксипіридин 6-трифторметил-4-гідроксипіримідином на стадії А. 1 H ЯМР (500МГц, CD3OD): 8,81 (с, 1Н), 7,28 (с, 1Н), 1,75 (с, 6Н). РХ-МС: m/е 251 (М+Н)+ (2,1хв.). Посилальний приклад 27 2-Метил-2-(5-трифторметил-2піридилокси)пропіонова кислота У дві продуті азотом 12-літрові 3-горлі круглодонні колби, кожна з яких обладнана термометром і дефлегматором завантажують KHMDS у ТГФ (0,91М, 3,52л у кожну, 3,205моль, 1,5екв.). Розчини охолоджують до -70°С і перемішують магнітною мішалкою. Етил-2-гідроксіізобутират (98%) (463мл, 447г, 3,38моль) додають у кожну колбу протягом 30хв., підтримуючи температуру реакції нижче 62°С. Через 10хв. 2-хлор-5-трифторметилпіридин (388г, 2,14моль) додають у кожну колбу однією порцією. Охолоджувальну баню видаляють і реакційним сумішам дають нагріватися до 20°С протягом ночі (близько 16год.). Реакції відстежують за результатами ТШХ (діоксид кремнію, 90/10 гекс/ЕtOАс) і ВЕРХ. Гідроксид натрію (1,36л, 5н.) додають у кожну реакційну колбу і реакційні суміші нагрівають при кип'ятінні зі зворотним холодильником протягом ночі (близько 22год.). Реакційні суміші концентрують разом на роторному випарнику, щоб видалити ТГФ. До концентрату додають воду (4л) і розчин екстрагують н-гептаном (2 4л). Водний шар додають протягом 10хв. до 2н. НСI (9л, 18моль) при перемішуванні. Одержану суспензію витримують протягом 30хв. (температура 30°С), потім фільтрують. Осад на фільтрі промивають водою (3 2л) і сушать на повітрі, одержуючи вологу жовтуватокоричневу тверду речовину. Речовину розчиняють у н-гептані (4л) при 65°С. Додають IPАс (1л) і DARCO KB (40г, 100меш). Суміш перемішують протягом 15хв., фільтрують через діатомову землю CELITE і осад на фільтрі промивають сумішшю 4:1 гептан/ІРАс (3 500мл). Фільтрат концентрують до приблизно 2л, одержуючи білу суспензію. Суспензію промивають гептаном (2 3л) і концентрують до приблизно 3л. Одержану білу суспензію охолоджують до 0°С і витримують 1год. Продую фільтрують і осад на фільтрі промивають холодним гептаном (1л), одержуючи вказану у заголовку сполуку у вигляді білої кристалічної речовини. Колонка ВЕРХ: YMC Combiscreen Pro C18, 50 4,6мм; рухома фаза: А 0,1% TFA в Н2О; В CH3CN. Градієнт: від 90/10 А/В 47 76590 48 до 10/90 А/В у 4хв. Витрата: 4мл/хв. Виявлення: матеріали промивають водою і потім сушать над 254нм. R, 2-хлор-5-трифторметилпіридину 2,1хв. MgSO4. Коричневе масло збирають. Неочищену Rt 2-етокси-5-трифторметилпіридину 2,9хв. Rt речовину переносять на наступну стадію. складного ефіру продукту 3,1хв. Rt цільової кислоТШХ Rf=0,12 (10:1 гексани: ЕtOАс). 1H ЯМР ти 2,05хв. (500МГц, CDCI3): 2,83 (м, 1Н). 2,97(м, 2Н), 3,13 Посилальний приклад 28 (с, 3Н), 3,34 (м, 1Н), 3,45 (с, ЗН), 3,61 (м, 2Н), 4,87 (уш., 1Н), 6,54 (д, 1Н), 6,66 (т, J=7,1Гц, 1Н), 7,07 (т, J=7,1Гц, 2Н), 7,18 (д, J=8,5Гц, 2Н), 7,24 (д, J=8,5Гц, 2Н). Стадія С 4-(4-хлорфеніл)-3-індолін-N-ілбутан2-он У висушеній у печі колбі в атмосфері азоту 2,8мл 1М розчину CH3MgBr у ТГФ додають по краплях до перемішуваного розчину N,О-диметил-3(4-хлорфеніл)-2-індолінілпропанаміду (зі стадії В, 2-Аміно-3-індолін-N-іл-4-(4-хлор)фенілбутан 965мг) у 25мл безводного ТГФ. Розчин перемішуСтадія А Етил 3-(4-хлорфеніл)-2-індолін-Nють протягом 4год., даючи нагрітися до кімнатної ілпропаноат температури. Потім додають приблизно 20мл воУ висушеній у печі колбі в атмосфері азоту ди. Суміш екстрагують три рази 50мл простого 1,1г LiOH-H2O (26,25ммоль) у ДМФА (20мл) додаефіру. Об'єднані екстракти сушать над MgSO4. ють до перемішуваної суспензії молекулярних сит Розчинники видаляють при зниженому тиску, оде4 ангстреми. Після 30 хвилин перемішування при ржуючи коричневе масло, яке переносять на накімнатній температурі додають по краплях 2,8мл ступну стадію без очищення. (25ммоль) індоліну. Через одну годину при кімнатРХ/МС m/е=301 (М+1). ТШХ Rf=0,5 (4:1 гексаній температурі додають по краплях 2,9мл ни:ЕtOАс). 1H ЯМР (500МГц. CDCI3): 2,14 (с, 3Н), (26,25ммоль) етилбромацетату. Через 1,5год. тве2,81 (дд, J=14,6, 6,6Гц, 1Н), 2,97 (τ, J=8,5Гц, 2Н), рду речовину фільтрують і залишок промивають 3,26 (м, 2Н), 3,5 (м, 1Н), 4,21 (дд, J=6,6, 6,6Гц), великою кількістю ЕtOАс. Органічну частину про6,39 (д, J=8Гц, 1Н), 6,66 (дд, J=7, 7Гц, 1Н), 7,07 (м, мивають 3 рази водою і сушать його над MgSO4. 2Н), 7,13 (д, J=8,5Гц), 7,22 (д, J=8,3Гц). Розчинники випарюють при зниженому тиску. НеСтадія D Метоксим 4-(4-хлорфеніл)-3-індоліночищену речовину потім розчиняють у 75мл безN-ілбутан-2-ону водного ТГФ, завантажують у висушену у печі круРозчин 472мг (1,573ммоль) продукту стадії С і глодонну колбу в атмосфері азоту, охолоджують 263мг (3,147ммоль) гідрохлориду метоксиламіну у до -78°С і потім обробляють 26,25мл 1М розчину безводному етанолі обробляють 255мкл NaHMDS. Розчин перемішують протягом 30 хви(3,147ммоль) піридину. Розчин перемішують пролин при -78°С і потім енолят алкілують 5,4г тягом 2год. при кімнатній температурі. Розчинник (26,25ммоль) п-хлорбензилброміду (розчин у 25мл видаляють при зниженому тиску і залишок розпобезводного ТГФ). Реакційній суміші дають нагрітиділяють між водою і простим ефіром. Воду знову ся до кімнатної температури протягом ночі. На екстрагують простим ефіром. Екстракти потім наступний день реакцію гасять водою. Водний шар об'єднують і сушать над MgSO4, фільтрують і конекстрагують 3 великими порціями ЕtOАс. Об'єднацентрують, одержуючи неочищену речовину. Обині органічні частини сушать над MgSO4. Розчиннидва ізомери Ε і Ζ переносять на наступну стадію. ки видаляють при зниженому тиску і залишок очиPX/MC m/e=330 (М+1). ТШХ Rf=0,77 і 0,65 (4:1 щають флеш-хроматографією, що дає вказану у гексани:EtOAc). 1H ЯМР (500МГц, CDCI3): 1,78 заголовку сполуку у вигляді жовтого масла. (2c, 1Η), 2,88 (дд, J=6,2, 13,8Гц, 1Н), 2,95 (м, 2H), РХ/МС m/е=331 (М+1). ТШХ Rf=0,22 (20:1 гек3,30 (м, 2Н), 3,45 (м, 1Н), 3,75 і 3,89 (2с, 3Н), 4,21 сани:ЕtOАс). 1H ЯМР (500МГц, CDCI3): 1,11 (т, (дд, J=6,9, 7,8Гц, 1Н), 6,28 і 6.47 (2д, J=8,1Гц, 1Н), J=3,55Гц, 3Н), 2,96 (м, 2Н), 3,06 (м, 1Н), 3,25 (м, 6,61 (м, 1Н), 7,02 (м, 2Н), 7,22 (м, 4Н). 1Н), 3,60 (т, 2Н), 4,07 (м, 2Н), 4,36 (т, J=3,75Гц, Стадія Е 2-Аміно-3-індолін-N-іл-4-(41Н). хлор)фенілбутан Стадія В N,О-диметил-3-(4-хлорфеніл)-2У висушеній у печі колбі, обладнаній водяним індолін-N-ілпропанамід конденсатором, в атмосфері азоту розчин 301мг У висушеній у печі колбі в атмосфері азоту (0,914ммоль) метоксиму 4-(4-хлорфеніл)-311,75мл 1М розчину (СН3)2АIСI у СН2СI2 додають індолінілбутан-2-ону (одержаного зі стадії D) у 1,5 через ділильну лійку до перемішуваної суспензії мл безводного ТГФ обробляють 3,7мл (3,7ммоль) 1,15г (11,75ммоль) гідрохлориду Ν,Ο1М ВН3-ТГФ при кімнатній температурі. Розчин диметилгідроксиламіну при 0°С. Після нагрівання потім нагрівають до 75°С протягом 2 днів. Потім до кімнатної температури розчин 970мг розчин охолоджують до 0°С і обробляють крихта(2,94ммоль) етил-3-(4-хлорфеніл)-2ми льоду до припинення виділення бульбашок. індолінілпропаноату (одержаний на стадії А) в Потім додають 500мкл 20% КОН і розчин нагріва10мл додають через ділильну лійку. Після переміють при 45°С протягом 2год. Розчин потім охолошування при кімнатній температурі протягом 5год. джують до кімнатної температури і екстрагують додають 35мл розчину фосфатного буфера з рН 8 простим ефіром 3х. Об'єднані екстракти сушать і одержану суміш енергійно перемішують протягом над MgSO4, фільтрують і концентрують, одержую30 хвилин. Фази розділяють і водний шар екстрачи неочищений амін, який використовують у нагують 2 рази хлороформом. Об'єднані органічні ступному експерименті без додаткового очищення. 49 76590 50 PX/MC m/e=302 (М+1). 1H ЯМР (500МГц, (9,9мл, 97ммоль) у простому ефірі (300мл) при 0°С додають бензилмагнійхлорид (97мл 1М розчину у CDCI3): 1,13, 1,14 (2д, J=6,5Гц, 1Н), 1,55-1,60 (м, простому ефірі). Каламутну білу реакційну суміш 2Н), 2,80-3,10 (м, 4Η), 3,30-3,60 (м, 2Н), 6,348 і 6,38 нагрівають до кімнатної температури протягом (2д, J=7,9Гц, 1Н), 6,50-6,78 (м, 2Н), 6,95-7,24 (м, 2год. і потім гасять обережним додаванням 5Н). 1н.хлористоводневої кислоти (100мл). Органічну Посилальний приклад 29 фазу відділяють, промивають насиченим розчином солі, сушать над MgSO4 і концентрують. Неочищену речовину очищають колонковою хроматографією на силікагелі, елююючи з градієнтом від 0 до 10% ЕtOАс/гексан, одержуючи вказану у заголовку сполуку. 1 H ЯМР (500МГц, CDCI3): 7,36 (т, J=7,1Гц, 2Н), 7,30 (т, J=7,3Гц, 1Н), 7,24 (д, J=7,3Гц, 2Н), 3,72 (с, 2Н), 2,18 (с, 3Н). РХ-МС: m/е 135 (М+Н)+ 2-Аміно-3-індол-N-іл-4-(4-хлор)фенілбутан (1,95хв.). Вказану сполуку одержують аналогічно до доСтадія В 4-(4-Метилфеніл)-3-фенілбутан-2-он відкового прикладу 28, за винятком того, що під 1-Фенілацетон (200мг, 1,49ммоль) змішують з час стадії А гідрид натрію використовують як оснопорошкоподібним гідроксидом калію (167мг, ву замість комбінації моногідрат гідроксиду лі2,98ммоль) і бромідом тетра-н-бутиламонію тію/молекулярні сита. (1мол.%, 5мг) у колбі без розчинника. Суміш переРХ/МС: обчислено для C18H19CIN2 299, знаймішують при кімнатній температурі протягом 90хв. дено m/е 300 (М+Н)+ (2,4хв.). перед додаванням 1-(хлорметил)-4-метилбензолу Посилальний приклад 30 (198мкл, 1,49ммоль). Реакційну суміш потім перемішують протягом ночі перед розбавленням водою і СН2СI2. Водний шар відділяють і нейтралізують до рН 7 2н.хлористоводневою кислотою і екстрагують знову у СН2СI2. Об'єднані органічні змиви сушать MgSO4 і концентрують. Неочищену речовину очищають колонковою хроматографією на силікагелі, елююючи з градієнтом суміші від 0 до 10% ЕtOАс/гексан, одержуючи вказану у заголовку сполуку. 2-Аміно-3-(N-метил,N-феніл)аміно-4-(41 H ЯМР (500МГц, CDCI3): 7,35 (т, J=7,0Гц, хлор)феніл бутан 2Н), 7,29 (т, J=7,4Гц, 1Н), 7,23 (д, J=7,1Гц, 2Н), Вказану сполуку одержують аналогічно до до7,05 (д, J=7,8Гц, 2Н), 6,98 (д, J=7,8Гц, 2Н), 3,94 (т, відкового прикладу 28. J=7,3Гц, 1Н). 3,43 (дд, J=13,9, 7,5Гц, 1Н), 2,91 (дд, РХ/МС: обчислено для C17H21CIN2 289, знайJ=14,7,1Гц, 1Н), 2,32 (с, 3Н), 2,08 (с, 3Н). РХ-МС: + дено m/е 290 (М+Н) (2,4хв.). m/е 239 (М+Н)+ (3,61хв.). Посилальний приклад 31 Стадія С 4-(4-Метилфеніл)-3-фенілбутан-2амін До розчину 4-(4-метилфеніл)-3-фенілбутан-2ону (308мг, 1,29ммоль) у 7М аміаку в МеОН (5мл) і оцтової кислоти (3мл) додають ціанборгідрид натрію (130мг, 2,06ммоль) і реакційну суміш перемішують при кімнатній температурі протягом ночі. Реакцію гасять, виливаючи у 2М розчин карбонату натрію, і екстрагують в ЕtOАс. Водний шар підсолюють і повторно екстрагують. Об'єднані органічні 2-Аміно-3-(7-азаіндол-N-іл)-4-(4-хлор)феніл екстракти сушать над MgSO4 і концентрують, одебутан ржуючи вказану у заголовку сполуку у вигляді суВказану сполуку одержують аналогічно до доміші 4 ізомерів, яку використовують без подальшовідкового прикладу 28. РХ/МС: обчислено для го очищення. C17H18CIN3 300, знайдено m/е 301 (М+Н)+ (2,7хв.). РХ-МС: m/е 240 (М+Н)+ (2,22хв.). Посилальний приклад 32 Посилальний приклад 33 4-(4-Метилфеніл)-3-фенілбутан-2-амін (суміш 4 ізомерів) Стадія А 1-Фенілацетон До розчину N-метил-N-метоксіацетаміду 3-[2-Аміно-1-(4фторбензил)пропіл]бензонітрил 51 76590 52 Одержують за методиками, описаними у приккагелі, використовуючи 40% ЕtOАс у гексані, щоб ладі 5, стадії В і С. використовуючи 3-(2одержати бажаний кетон. оксопропіл)бензонітрилу і 1-(хлорметил)-4Стадія D 2-(1Н-1,2,3-Бензотриазол-1-іл)-3-(4фторбензол як реагенти стадії В. хлорфеніл)-1-метилпропіламін РХ/МС: m/е 269 (М+Н)+ (2,87хв.). До розчину 1,18г (4моль) 2-(1Н-1,2,3Посилальний приклад 34 бензотриазол-1-іл)-3-(4-хлор-феніл)бутан-2-ону у 8,5мл (60моль) 7н.аміаку у МеОН при 0°С додають 4мл (964моль) льодяної оцтової кислоти і потім 410мг (6,5моль) ціанборгідриду натрію. Реакційній суміші дають нагрітися до кімнатної температури і перемішують протягом ночі. Реакційну суміш розподіляють між ЕtOАс і насиченим розчином NaHCO3. Органічну фазу сушать над безводним MgSO4. Розчинник видаляють у вакуумі і залишок очищають на силікагелі, використовуючи суміш 5% 2н.метанольного розчину аміаку і 95% СН2СI2, 2-(1Н-1,2,3-Бензотриазол-1-іл)-3-(4одержуючи бажаний амін у вигляді суміші діастехлорфеніл)-1-метилпропіламін реомерів. Стадія А 2-(1Н-1,2,3-Бензотриазол-1-іл)-NРХ-МС, Rt=2,0 хв., m/е=301. метокси-N-метилацетамід Посилальний приклад 35 Суміш 1,77г (10ммоль) 2-(1Н-1,2,3бензотриазол-1-іл)оцтової кислоти, 1,07г (11ммоль) гідрохлориду Ν,Οдиметилгідроксиламіну, 5,8г (11ммоль) РуВОР і 3,4мл (24,2ммоль) діізопропілетиламіну у 50мл СН2СI2 перемішують протягом ночі при КТ. Суміш розподіляють між ЕtOАс і водою. Органічний шар промивають насиченим розчином солі і сушать 3-(4-Хлорфеніл)-2-(тіофен-3-іл)-1над безводним MgSO4. Розчинник видаляють, метилпропіламін одержуючи неочищений продукт, який очищають Вказаний у заголовку амін одержують спосона силікагелі, використовуючи 60% ЕtOАс у гексані бом, описаним у довідковому прикладі 34, замінюяк розчинник, одержуючи 2,01г бажаного аміду у ючи тіофен-3-оцтовою кислотою 2-(1Н-1,2,3вигляді твердої речовини. 1 бензотриазол-1-іл)оцтову кислоту на стадії А. H ЯМР: (CDCI3): 3,26 (с, 3Н), 3,84 (с, 3Н), РХ-МС, Rt=2,19хв., m/е=266. 5,63 (с, 2Н), 7,35-8,2 (м, 4Н). Посилальний приклад 36 Стадія В 2-(1Н-1,2,3-Бензотриазол-1-іл)-3-(4хлорфеніл)-N-метокси-N-метилпропанамід. До розчину 2,0г (9ммоль) 2-(1Н-1,2,3бензотриазол-1-іл)-N-метокси-N-метилацетаміду у 15мл безводного ТГФ при -78°С додають по краплях 10мл (10ммоль) 1М біс(триметилсиліл)аміду літію. Після перемішування протягом 25хв. додають розчин 2,06г (10ммоль) 4-хлорбензилброміду у 2мл безводного ТГФ. Одержаній реакційній су2-(3-Ціанофеніл)-3-циклобутил-1міші дають нагрітися до КТ і перемішують протяметилпропіламін гом 6год. Реакцію гасять, суміш розбавляють 75мл Стадія А 1-(3-Ціанофеніл)ацетон ЕtOАс і промивають 3 рази по 10мл насиченого Вказану у заголовку сполуку одержують з 3розчину солі. Після сушіння видалення розчинника бромбензонітрилу та ізопропенілацетату за метоорганічної фази дає неочищений продукт, який дикою довідкового прикладу 20, стадія А. очищають на силікагелі, використовуючи 40% Стадія В 3-(3-Ціанофеніл)-4-циклобутилбутанЕtOАс у гексані як розчинник, одержуючи бажаний 2-он продукт у вигляді твердої речовини. 1 До розчину 1,45г (9,07ммоль) 1-(3H ЯМР: (CDCI3): 3,2 (с, 3Н), 3,34 (с, 3Н), 3,52 ціанофеніл)ацетону у 18мл ацетонітрилу додають (м, 1Н), 3,7 (м, 1Н), 6,32 (т, 1Н), 6,9-8,2 (м, 8Н). 1,1мл (9,5ммоль) циклобутилброміду і 5,91г Стадія С 2-(1Н-1,2,3-Бензотриазол-1-іл)-3-(4(18,1ммоль) карбонату цезію. Після нагрівання хлорфеніл)бутан-2-он протягом ночі розчину на бані при 60°С його охоДо розчину 1,73г (5ммоль) 2-(1Н-1,2,3лоджують і фільтрують. Фільтрат розподіляють між бензотриазол-1-іл)-3-(4-хлорфеніл)-N-метокси-Nводою і ЕtOАс і водний шар екстрагують ЕtOАс. метилпропанаміду у 10мл безводного ТГФ при 0°С Об'єднаний органічний шар промивають насичедодають 4мл (10ммоль) 2,5М броміду метилмагнію ним розчином солі, сушать і концентрують. Залиу простому ефірі. Реакційну суміш перемішують шок очищають на флеш-колонці, використовуючи протягом 4год., коли вона нагрівається до КТ. Реаградієнт 5-10% ЕtOАс/гексан, щоб виділити вказакцію гасять додаванням 10мл 1н.НСІ і одержану ну у заголовку сполуку. суміш розподіляють між ЕtOАс і водою. Органічну 1 Н ЯМР (500МГц, CDCI3): 1,5-2,2 (м, 9Н), 2,13 фазу промивають насиченим розчином солі і су(с, 3Н), 3,64 (м, 1Н), 7,4-7,7 (м, 4Н). шать над безводним MgSO4. Видалення розчинниСтадія С 2-(3-Ціанофеніл)-3-циклобутил-1ка дає неочищений кетон, який очищують на силі 53 76590 54 метилпропіламін Вказаний амін одержують, дотримуючись спо2-(3-Ціанофеніл)-3-циклогексил-1собу довідкового прикладу 3, стадії Е-І. метилпропіламін РХ-МС, Rt=2,8хв., m/е=257. РХ-МС, Rt=2,48хв., m/е=229. Приклад 1 Сполуки довідкових прикладів 37 і 38 одержуАвтоматизований синтез бібліотеки однорозють за методиками, описаними у довідковому примірних амідів Наступний синтез бібліотеки 1кладі 36. розмірних окремих чистих сполук здійснюють на Посилальний приклад 37 системі MYRIAD CORE. Всі реакційні посудини сушать у струмі азоту при 120°С протягом 12год. перед використанням. Всі розчинники сушать над ситами протягом, щонайменше, 12год. перед використанням. Відповідний вихідний розчин гідрохлориду N-[2,3-біс(4-хлорфеніл)-1метилпротл]аміну (альфа ізомер) одержують безпосередньо перед використанням у піридині з 0,05 еквівалента (по відношенню до гідрохлориду N[2,3-біс(4-хлорфеніл)-1-метилпропіл]аміну (альфа 2-(3-Ціанофеніл)-3-циклопентил-1ізомер)) доданого диметиламінопіридину; різні метилпропіламін РХ-МС, Rt=2,7хв., m/е=243. карбонові кислоти, доступні з комерційних джерел, Посилальний приклад 38 розчиняють у ДМСО безпосередньо перед використанням. Відносні кількості реагентів і зв'язуючих реагентів перераховані у таблиці 1. Таблиця 1 Кількість на реакційМол. мас ну посудину Кислота у ДМСО 1мл 0,8мл EDC: 191,71 EDC/HOBt суміш у хлороформі, що містить дейтерій HOBt: 135,13 Амін у піридині з каталітичним диме0,6мл 294,227 тиламінопіридином (~0,05екв.) Речовина Методика: У посудину, одну зі 192 сухих обпалених реакційних посудин MYRIAD ємністю 10мл, в атмосфері азоту додають відповідну субодиницю з різних кислот (1,0мл, 0,2ммоль, 0,2М у ДМСО); це повторюють для інших 191 реакцій, доки не використають різні кислоти для всіх 192 реакційних посудин. У кожну зі 192 реакційних посудин в атмосфері азоту потім додають суміш EDC/HOBt (0,8мл, 0,2ммоль, 0,25М кожний у хлороформі, що містить дейтерій). I, нарешті, у кожну Колонка: Елюент А: Елюент В: Градієнт: Витрата: Температура колонки: Кількість, що упорскується: Виявлення: Концентрація 0,2М 0,25М кожний 0,2М ммоль Екв. 0,2 1,67 0,2 1,67 кожний кожний 0,12 1,0 зі 192 реакційних посудин додають гідрохлорид N-[2,3-біс(4-хлорфеніл)-1-метилпропіл]аміну (альфа ізомер) (0,6мл, 0,12ммоль, 0,2М у піридині). Реакційні суміші потім витримують протягом 4год. при кімнатній температурі (20-25°С) і наступні 16год. при 65°С з перемішуванням упорскуванням азоту (1с імпульс азоту кожні 30 хвилин). Неочищені реакційні суміші аналізують методом 1 ВЕРХ-МС. Аналітичний метод 1 РХ: MetaChem Polaris C-18A, 30мм 4,6мм, 5,0мкм 0,1% ТРА у воді 0,1% TFA в ацетонітрилі 5% В до 95% В за 3,3 хвилини, зворотне спадання до 5% В за 0,3хв. 2,5мл/хв. 50°С 5мкл нерозбавленої неочищеної реакційної суміші УФ при 220 і 254нм МС: режим іонізації API-ES, діапазон массканування (100-700) ELSD: детектор світлорозсіювання Неочищені реакційні суміші очищають препаративною ВЕРХ, використовуючи виявлення на основі УФ (препаративний метод 2). Зібрані фракції потім аналізують на чистоту РХ-МС (аналітичний метод 3); фракції, виявлені як такі, що мають чистоту більше ніж 90%, зливають у таровані склянки ЕРА ємністю 40мл та ліофілізують. 55 76590 Препаративний метод 2 РХ: Колонка: Елюент А: Елюент В: Урівноваження перед упорскуванням: Витримування після упорскування: Градієнт: Витрата: Температура колонки: Кількість, що упорскується: Виявлення: Аналітичний метод 3 РХ: Колонка: Елюент А: Елюент В: Градієнт: Витрата: Температура колонки: Кількість, що упорскується: Виявлення: MetaChem Polaris С-18А, 100мм 21,2мм, 10мкм 0,1% TFA у воді 0,1% TFA в ацетонітрилі 1,0хв. 0,0хв. 10% В до 100% В за 6,0 хвилин, витримування при 100% протягом додаткових 2,0 хвилин, зворотне спадання від 100% В до 10% В за 1,5 хвилини 25мл/хв. оточуюча 1,5мл нерозбавленої неочищеної реакційної суміші УФ при 220 і 254нм MetaChem Polaris C-18A, 30мм 2,0мм, 3,0мкм 0,1% TFA у воді 0,1% TFA в ацетонітрилі 5% В до 95% В за 2,0 хвилини, зворотне спадання до 5% В за 0,1хв. 1,75мл/хв. 60°С 5мкл нерозбавленої фракції УФ при 220 і 254нм МС: режим іонізації API-ES, діапазон массканування (100-700) ELSD: детектор світлорозсіювання Параметри ліофілізації Контрольна точка початкового заморожування: 1год. при -70°С Контрольна точка конденсатора фази сушіння: -50°С Таблиця фази, що сохне: Температура (С) Тривалість полиці (хвилини) -60° 240 -40° 240 5° 480 20° 1000 56 Контрольна точка вакууму (мТорр) 25 25 25 25 Приклади 2 і 3 N-[2,3-біс(4-хлорфеніл)-1-метилпропіл-2-(4хлорфенілокси)-2-метилпропан-амід (діастереомери і ) До розчину 2-(4-хлорфенілокси)-2метилпропіонової кислоти (Aldrich, 0,22г, 1,0 ммоль) у СН2СI2 (2мл) при 0°С додають краплю ДМФА та оксалілхлорид (0,27мл, 3,0ммоль). Після перемішування при кімнатній температурі протягом 1год. реакційну суміш концентрують на роторному випарнику і сушать у вакуумі та одержаний неочищений ацилхлорид використовують без по дальшого очищення. Так, неочищений ацилхлорид розчиняють у 1мл СН2СI2 і додають до суспензії гідрохлоридної солі 2-аміно-3,4-біс(4хлорфеніл)бутану (порівняльний приклад 1) (діастереомер , забруднений деякою кількістю діастереомеру 0,20г, 0,60ммоль) і N-метилморфоліну (0,27мл, 2,4ммоль) у 4мл СН2СI2. Після перемішування при кімнатній температурі протягом 6год. реакційну суміш завантажують на колонку силікагелю, яку елююють 10% ЕtOАс, одержуючи чистий ізомер, що швидше елююється, (діастереомер ) та ізомер, що повільніше елююється, (діастереомер ). Діастереомер : 1 Н ЯМР (500МГц, CD3OD): 7,24 (д, 2Η), 7,20 (д, 2Н), 7,05 (д, 2Н), 7,01 (д, 2Н), 6,94 (д, 2Н), 6,76 (д, 2Н), 4,25 (м, 1Н), 3,03 (дд, 1Н), 2,88 (ддд, 1Н), 2,67 (дд, 1Н), 1,59 (с, 3Н), 1,53 (с, 3Н), 0,88 (д, 3Н). РХ-МС: m/е 490(М+Н)+ (4,7хв.). Діастереомер : 1 Н ЯМР (500МГц, CD3OD): 7,16 (д, 2Н), 7,14 (д, 2Н), 7,09 (д, 2Н), 6,99 (д, 2Н), 6,88 (д, 2Н), 6,64 (д, 2Н), 4,33 (м, 1Н), 3,12 (дд, 1Н), 3,03 (ддд, 1Н). 2.74 (дд, 1Н), 1,36 (с, 3Н), 1,30 (д, 3Н), 1,30 (с, 3Н). РХ-МС: m/е 490 (М+Н)+ (4,7хв.). Сполуки прикладів 4-7 (таблиця 2) одержують, дотримуючись методик, описаних у прикладах 2 і 3, замінюючи гідрохлорид 2-аміно-3,4-біс(4хлорфеніл)бутану відповідними амінами з довідкових прикладів і 2-(4-хлорфенілокси)-2метилпропіонову кислоту відповідними кислотами з довідкових прикладів. У деяких випадках використовують комерційні кислоти або ацилхлориди, і Nдіізопропілетиламін може бути використаний замість Ν-метилморфоліну з подібними результатами. Позначення діастереомерів ( або ) відповідають позначенням вихідних амінів. 57 76590 58 Приклади 8 і 9 N-[2,3-Біс(4-хлорфеніл)-1-метилпропіл]-2-(4хлорфенілокси)-2-метилпропанамід (діастереомер , енантіомери А і В) Препаративну ВЕРХ проводять на системі Gilson для розділення енантіомерів. Так, розчин N[2,3-біс(4-хлорфеніл)-1-метилпропіл]-2-(4-хлорфенілокси)-2-метилпропанаміду (Діастереомер ) (приклад 60, 1,0г) у суміші гексан (3мл)/етанол (7мл) завантажують на колонку Chiralpak AD (2см 25см), яку елююють 5% етанолом у гексані (витрата 9мл/хв., 500мкл на упорскування), одержуючи два чистих енантіомери. Енантіомер, що швидше елююється. (енантіомер А): аналітична ВЕРХ: час утримування=7,8хв. (колонка Chiralpak AD, витрата=0,75мл/хв., 5% етанол/гексан). РХ-МС: m/е 490 (М+Н)+ (4,7хв.). Енантіомер, що повільніше елююється, (енантіомер В): аналітична ВЕРХ: час утримування=9,6хв. (колонка Chiralpak AD, витрата=0,75мл/хв., 5% етанол/гексан). РХ-МС: m/е 490 (М+Н)+ (4,7хв.). Сполуки прикладів 10-17 (таблиця 3) виділяють як окремі енантіомери, дотримуючись методик, описаних у прикладах 8-9, з відповідної рацемічної речовини (таблиця 2) з відповідними модифікаціями (1) складу елюенту (4-15% етанол/гексан), (2) витрати (6-9мл/хв.) і (3) об'єму упорскування (200-2000мкл). Сполуку прикладу 18 (таблиця 4) одержують, дотримуючись методик, описаних у прикладах 2-3, використовуючи гідрохлорид N-[3-(4-хлорфен1л)2(S)-феніл-1(S)-метилпропіл]аміну з довідкового прикладу 4, комбінований з придатною карбоновою кислотою. Приклад 19 N-[2,3-біс(4-Хлорфеніл)-1-метилпропіл]-2-(4хлорфеніламіно)-2-метил-пропанамід 59 76590 60 До суміші гідрохлоридної солі 2-аміно-3,4тою 2-(4-хлорфенокси)-2-метилпропіонову кислоту. біс(4-хлорфеніл)бутану (діастереомер , Розділ І, посилальний приклад 1, 0,31г, 0,94ммоль) і 2-(4хлорфеніламіно)-2-метилпропіонової кислоти (0,20г, 0,94ммоль) у 5мл СН2СІ2 додають Nметилморфолін (0,41мл, 3,5моль) і гексафторфосфат трис(піролідиніл)фосфонію (0,73г, 1,4моль). Після перемішування при кімнатній температурі протягом ночі реакційну суміш завантажують на колонку силікагелю, елююють 30% ЕtOАс у гексані, одержуючи вказану у заголовку сполуку. 1 Н ЯМР (400МГц, CD3OD): 7,18 (д, 2Н), 7,04 (д, 2Н), 7,02 (д, 2Н), 6,97 (д, 2Н), 6,70 (д, 2Н), 6,56 (д, 2Н), 4,20 (м, 1Н), 3,02 (дд, 1Н), 2,78 (ддд, 1Н), Наступні сполуки у таблиці 7 виділяють відпо2,64 (дд, 1Н), 1,52 (с, 3Н), 1,45 (с, 3Н), 0,82 (д, 3Н). відно до методик розділення енантіомерів, описа+ РХ-МС: m/е 489 (М+Н) (4,3хв.). них у прикладах 8-9. Приклад 20 N-(2,3-Дифеніл-1-метилпропіл)-2-(4хлорфенокси)-2-метилпропанамід (діастереомер ) Розчин 2-(4-хлорфенокси)-2-метилпропіонової кислоти (20мг, 0,095моль) у СН2СI2 (1мл) і ДМФА (10мкл) обробляють оксалілхлоридом (11мкл). Через 30хв. реакційну суміш концентрують і залишок розчиняють у 1мл СН2СI2. Розчин додають до суміші 16мг N-(2,3-дифеніл-1-метил)пропіламіну ( ізомер) і 1мл насиченого НаНСО3. Реакційну суміш перемішують протягом ночі і органічний шар видаляють піпеткою. Очищення розчину препаративною ТШХ з елююванням сумішшю 30% ЕtOАс/гексан дає вказану у заголовку сполуку. 1 Н ЯМР (500МГц, CD3OD): 1,17 (д, 3Н), 1,36 (с, 3Н), 1,46 (с, 3Н), 2,85-3,05 (м, 3Н), 4,44 (м, 1Н), 6,37 (д, 1Н), 6,75-7,4 (м, 14Н). РХ-МС: Rt=4,4хв. m/е=422,2 (М+1). Наступні сполуки у таблиці 5 одержують, дотримуючись методик прикладу 20, замінюючи відповідним аміном N-(2,3-дифеніл-1метил)пропіламін і відповідною карбоновою кислотою 2-(4-хлорфенокси)-2-метилпропіонову кислоту. Наступні сполуки у таблиці 6 одержують, дотримуючись методик прикладів 2-3, замінюючи відповідним аміном N-(2,3-дифеніл-1метилпропіл)амін і відповідною карбоновою кисло Наступні сполуки у таблиці 8 одержують з гідрохлориду N-[3-(4-хлорфеніл)-2(S)-феніл-1(S)метилпропіл]аміну довідкового прикладу 4 і відповідної кислоти. одержуючи окремий енантіомер. Сполуки прикладів 30-33 (таблиця 9) одержують з гідрохлориду N-[3-(4-хлорфеніл)-2(S)-феніл1(S)-метилпропіл]аміну (посилальний приклад 4) або гідрохлориду N-[3-(5-хлор-2-піридил)-2(S)феніл-1(S)-метилпропіл]аміну (посилальний приклад 18) і відповідної карбонової кислоти, дотри
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted amides acting on receptor of cannabinoid-1
Назва патенту російськоюЗамещенные амиды, которые действуют на рецептор каннабиноид-1
МПК / Мітки
МПК: C07D 213/40, C07B 61/00, C07D 235/10, C07C 235/10, A61K 31/505, A61K 31/165, C07C 235/20, C07D 213/61, A61K 31/435, A61P 25/00
Мітки: рецептор, канабіноїд-1, діють, аміди, заміщені
Код посилання
<a href="https://ua.patents.su/34-76590-zamishheni-amidi-shho-diyut-na-receptor-kanabinod-1.html" target="_blank" rel="follow" title="База патентів України">Заміщені аміди, що діють на рецептор канабіноїд-1</a>
Попередній патент: Машина для вирубування заготовок із стрічки гофрованого картону і для утворення ліній згину на заготовках
Наступний патент: Пристрій для вимірювання переміщень
Випадковий патент: Заглибна гідроударна установка