Застосування пептидної сполуки тпо для лікування анемії
Номер патенту: 99254
Опубліковано: 10.08.2012
Автори: Уейс Джеффрі К., Макдональд Брайан Р., Юрков Едвард Дж.
Формула / Реферат
1. Спосіб попередження розвитку анемії після лікування, що передбачає введення суб'єкту, який потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру:
І Е G P T L R Q (2-Nal) L A A R (Sar) (SEQ ID NO:5).
2. Спосіб за п. 1, який відрізняється тим, що вказане лікування вибране з групи, що складається з лікування цитотоксичними засобами, протипухлинними засобами та радіаційним опроміненням.
3. Спосіб за п. 1, який відрізняється тим, що вказана ефективна кількість складає від приблизно 1 мкг до приблизно 300 мкг/кг ваги тіла на день.
4. Спосіб лікування анемії, що передбачає стадію введення суб’єкту, що потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру:
І Е G P T L R Q (2-Nal) L A A R (Sar) (SEQ ID NO:5).
5. Застосування ефективної кількості пептидної сполуки ТПО для одержання лікарського засобу для лікування анемії, причому вказана пептидна сполука ТПО містить наступну структуру:
І Е G P T L R Q (2-Nal) L A A R (Sar) (SEQ ID NO:5).
6. Спосіб попередження розвитку анемії після лікування, що передбачає введення суб'єкту, який потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру:
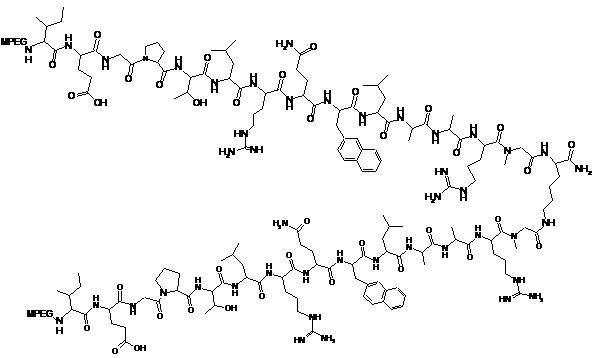 ,
,
де MPEG являє собою метоксиполіетиленгліколь, що має молекулярну вагу приблизно 20000 Дальтон.
7. Спосіб за п. 6, який відрізняється тим, що вказане лікування вибране з групи, що складається з лікування цитотоксичними засобами, протипухлинними засобами та радіаційним опроміненням.
8. Спосіб за п. 6, який відрізняється тим, що вказана ефективна кількість складає від приблизно 1 мкг до приблизно 300 мкг/кг ваги тіла на день.
9. Спосіб лікування анемії, що передбачає стадію введення суб’єкту, що потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру:
 ,
,
де MPEG являє собою метоксиполіетиленгліколь, що має молекулярну вагу приблизно 20000 Дальтон.
10. Застосування ефективної кількості пептидної сполуки ТПО для одержання лікарського засобу для лікування анемії, причому вказана пептидна сполука ТПО містить наступну структуру:
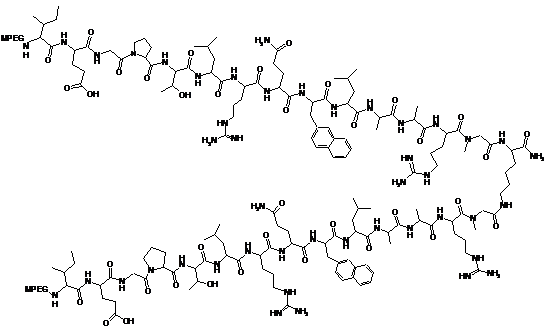 ,
,
де MPEG являє собою метоксиполіетиленгліколь, що має молекулярну вагу приблизно 20000 Дальтон.
11. Спосіб попередження розвитку анемії після лікування, що передбачає введення суб'єкту, який потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру:
І Е G Р Т L R Q (2-Nal) L A A R (Sar)
\
K(NH2)
/
І Е G Р Т L R Q (2-Nal) L A A R (Sar).
12. Спосіб за п. 11, який відрізняється тим, що вказане лікування вибране з групи, що складається з лікування цитотоксичними засобами, протипухлинними засобами та радіаційним опроміненням.
13. Спосіб за п. 11, який відрізняється тим, що вказана ефективна кількість складає від приблизно 1 мкг до приблизно 300 мкг/кг ваги тіла на день.
14. Спосіб лікування анемії, що передбачає стадію введення суб’єкту, що потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру:
І Е G Р Т L R Q (2-Nal) L A A R (Sar)
\
K(NH2)
/
І Е G Р Т L R Q (2-Nal) L A A R (Sar).
15. Застосування ефективної кількості пептидної сполуки ТПО для одержання лікарського засобу для лікування анемії, причому вказана пептидна сполука ТПО містить наступну структуру:
І Е G Р Т L R Q (2-Nal) L A A R (Sar)
\
K(NH2)
/
І Е G Р Т L R Q (2-Nal) L A A R (Sar).
Текст
Реферат: Розкрито спосіб лікування анемії. Спосіб включає введення суб'єктові пептидних сполук ТПО, зокрема сполуки формули І-Е-G-P-T-L-R-Q-(2-Nal)-L-A-A-R (Sar) (SEQ ID NO:5) UA 99254 C2 (12) UA 99254 C2 UA 99254 C2 5 10 15 20 25 30 35 40 45 50 55 60 Об'єктом цього винаходу є пептидні сполуки, які зв'язуються із рецептором тромбопоетину (c-mpl або TPO-R) й активують його або діють іншим способом як агоністи тромбопоетину ("ТПО"). Винахід застосовується у галузях біохімії та медичної хімії і, зокрема, передбачає використання агоністів ТПО у лікуватгаі хвороб людини. Пептидні сполуки, запропоновані винаходом, можуть використовуватися для лікування анемії й/або запобігання розвитку анемії й/або підтримки нормального продукування червоних клітин крові. Ген, що кодує ТПО, було клоновано та описано. Див. Kuter et al. Proc. Natl. Acad. Sci. USA 91:11104-11108 (1994); Barley et al. Cell 77:1117-1124 (1994); Kaushansky et al. Nature 369:568571 (1994); Wendling et al. Nature 369:571-574 (1994) і Sauvage et al. Nature 369:533-538 (1994). ТПО - це глікопротеїн, який має щонайменше дві форми із середніми молекулярними масами 4,2Е-20 г (25 кДа) та 5,1Е-20 г (31 кДа) зі спільною N-кінцевою послідовністю амінокислотних залишків. Див. Bartley et al. Cell 77:1117-1124 (1994). Вважається, що ТПО має дві окремі ділянки, розділені потенційним сайтом розщеплення Арг-Арг. Аміно-кінцева ділянка є висококонсервативною у людей та мишей і частково гомологічною до еритропоетину, а- та bінтерферонів. Карбокси-кінцева ділянка виявляє широку видову дивергенцію. Описано послідовності ДНК та кодовані ними послідовності пептидів ТРО-R (відомого також як c-mpl) людини. Див. Vigon et al. Proc. Natl. Acad. Sci. USA 89:5640-5644 (1992). TPO-R є членом родини гемопоетинових рецепторів факторів росту, яка характеризується спільною структурною будовою позаклітинних доменів, що включають чотири консервативні С-залишки в N-кінцевій частині та близький до трансмембранної ділянки мотив WSXWS (SEQ ID NO:1). Див. Bazan Proc. Natl. Acad. Sci. USA 87:6934-6938 (1990). Доказом того, що цей рецептор відіграє функціональну роль у гематопоезі, є спостереження, що його експресія обмежена селезінкою, кістковим мозком або печінкою ембріонів мишей (див. Souyri et al. Cell 63:1137-1147 (1990)), мегакаріоцитами, тромбоцитами і CD34+ клітинами людини (див. Methia et al. Blood 82:13951401 (1993)). Деякі дослідники припускають, що рецептор функціонує як гомодимер, подібно до рецепторів до G-CSF та еритропоетину. Доступність клонованих генів TPO-R полегшує пошук агоністів для цих важливих рецепторів. Доступність рекомбінантних рецепторних протеїнів дозволяє вивчати взаємодію рецепторліганд у низці систем випадкового та напіввипадкового генерування різноманітності пептидів. Ці системи розкриті в патентах СІЛА № 6,251,864, 6,083,913, 6,121,238, 5,932,546, 5,869,451, 6,506,362 та 6,465,430, та у Cwirla et al, Proc. Natl. Acad. Sci. USA 87:6378-6382 (1990); посилання на кожне з вищенаведених джерел наведено у цьому тексті. Клітини, що морфологічно розпізнаються, функціонально здатні і циркулюють у крові, включають еритроцити, нейтрофільні, еозинофільні, базофільні гранулоцити, В-, Т-, ні В-, ні Тлімфоцити і тромбоцити. Ці зрілі гемопоетичні клітини походять від та при потребі заміщуються на морфологічно розпізнавані клітини-попередники, що діляться і належать до відповідних клітинних ліній, такі як еритробласти для еритроцитарного ряду, мієлобласти, промієлоцити та мієлоцити для гранулоцитарного ряду, мегакаріоцити для тромбоцитів. Клітини-попередники походять з менш диференційованих клітин, які спрощено можна поділити на дві основні підгрупи: стовбурові клітини та недиференційовані клітини-попередники (для огляду див. Broxmeyer, H. Е, 1983, "Colony Assays of Hematopoietic Progenitor Cells and Correlations to Clinical Situations, " CRC Critical Review in Oncology/Hematology 1:227-257). Визначення стовбурових клітин та недиференційованих клітин-попередників є робочими і залежать швидше від функціональних, ніж від морфологічних критеріїв. Стовбурові клітини мають велику здатність до самооновлення та самопідтримання (Lajtha, Differentiation, 14:23 (1979)). Це необхідно, бо через відсутність чи виснаження цих клітин може настати повне виснаження однієї або кількох клітинних ліній, що протягом короткого часу може призвести до хвороби та смерті. Деякі стовбурові клітини диференціюються при потребі, а інші -продукують нові стовбурові клітини для підтримання пулу цих клітин. Таким чином, окрім підтримання клітин власного типу, плюрипотентні стовбурові клітини здатні до диференціації на декілька субліній недиференційованих клітин-попередників з більш обмеженою здатністю до самооновлення або без неї. Від цих недиференційованих клітин-попередників зрештою походять морфологічно розпізнавані клітини-попередники. Недиференційовані клітини-попередники здатні до проліферації та диференціації одним або кількома шляхами диференціації мієлоїдів (Lajtha, Blood Cells, 5:447 (1979)). Нестачу одного або кількох типів гемопоетичних клітин можуть спричинити різноманітні збудники інфекцій, генетичні відхилення, фактори навколишнього середовища. Крім того, хіміотерапія та променева терапія, які застосовують при лікуванні раку та певних імунологічних розладів, можуть викликати панцитопенію або поєднання анемії, нейтропенії і тромбоцитопенії. Таким чином, збільшення кількості або заміщення гемопоетичних клітин часто є вирішальним 1 UA 99254 C2 5 10 15 20 25 30 35 40 45 50 55 60 для успіху такого лікування. (Для загального обговорення гематологічних розладів та їхніх причин див. "Hematology" в Scientific American Medicine, E. Rubenstein and D. Federman, eds., Volume 2, Chapter 5, Scientific American, New York (1996)). Трансплантація кісткового мозку є загальноприйнятим методом лікування багатьох гематологічних розладів, а також усунення наслідків руйнування ендогенних гемопоетичних клітин, викликаного хіміотерапією або променевою терапією. Однак застосування пересадки кісткового мозку суттєво обмежене через те, що надзвичайно рідко можна підібрати ідеального (генетично ідентичного) донора, крім випадків, коли є однояйцевий близнюк або коли клітини кісткового мозку пацієнта під час ремісії зберігаються життєздатними у замороженому стані. За винятком таких аутологічних випадків, існує деяка неминуча генетична невідповідність, що викликає серйозні, а часом летальні ускладнення. Ці ускладнення бувають подвійні. По-перше, імунна система пацієнта зазвичай заздалегідь виведена з ладу медичними препаратами, щоб уникнути імунного відторгнення чужорідних клітин кісткового мозку (реакція "хазяїн проти трансплантата"). По-друге, коли і якщо донорські клітини кісткового мозку приживуться, вони можуть атакувати пацієнта (реакція "трансплантат проти хазяїна"), який розпізнається як чужорідний. Навіть за умови близько підібраного донора із родини, ці ускладнення через часткову невідповідність є причиною значної смертності та захворюваності, безпосередньо спричиненої трансплантацією кісткового мозку від генетично відмінної особи. В якості джерела стовбурових клітин для гемопоетичного відновлення також було досліджено периферійну кров (Nothdurtt, W., et al., 1977, Scand. J. Haematol. 19:470-481; Sarpel, S. C, et al., 1979, Exp. Hematol. 7:113-120; Ragharachar, A., et al., 1983, J. Cell. Biochem. Suppl. 7A:78; Juttner, C. A., et al., 1985, Brit. J. Haematol. 61:739-745; Abrams, R. A., et al., 1983, J. Cell. Biochem. Suppl. 7A:53; Prummer, O., et al., 1985, Exp. Hematol. 13:891-898). У деяких дослідженнях було одержано перспективні результати для хворих на різні види лейкемії (Reiffers, J., et al., 1986, Exp. Hematol. 14:312-315; Goldman, J. M., et al., 1980, Br. J. Haematol. 45:223-231; Tilly, H., et al., Jul. 19, 1986, The Lancet, c. 154-155; див. також To, L. B. and Juttner, C. A., 1987, Brit. J. Haematol. 66: 285-288 і використані у вказаних джерелах посилання) та хворих на лімфому (Korbling, M., et al., 1986, Blood 67:529-532). Однак інші дослідження із застосуванням периферійної крові не досягай ефекту відновлення (Hershko, C, et al., 1979, The Lancet 1:945-947; Ochs, H. D., et al., 1981, Pediatr. Res. 15:601). Досліджували також застосування трансплантації клітин ембріональної печінки (Cain, G. R., et al., 1986, Transplantation 41:32-25; Ochs, H. D., et al., 1981, Pediatr. Res. 15:601; Paige, C. J., et al., 1981, J. Exp. Med. 153:154-165; Touraine, J. L., 1980, Excerpta Med. 514:277; Touraine, J. L., 1983, Birth Defects 19:139; дивись також Good, R. A., et al., 1983, Cellular Immunol. 82:44-45 і використані у вказаних джерелах посилання) або клітин неонатальної селезінки (Yunis, E. J., et al., 1974, Proc. Natl. Acad. Sci. U.S.A. 72:4100) як джерел стовбурових клітин для гемопоетичного відновлення. В експериментах з імунного відновлення також трансплантували клітини неонатального тимусу (Vickery, A. C, et al., 1983, J. Parasitol. 69(3):478-485; Hirokawa, K., et al., 1982, Clin. Immunol. Immunopathol. 22:297-304). Очевидно, що існує величезна потреба у методах розмноження клітин крові in vitro або методах лікування, які збільшують продукування гемопоетичних клітин in vivo. Анемія, яка визначається як зменшення концентрації гемоглобіну у крові, зазвичай асоціюється із зменшенням загальної клітинної маси еритроцитів, що циркулюють у крові. Незалежно від причини, анемія знижує здатність крові переносити кисень та, у важких випадках, викликає клінічні симптоми та ознаки. Клінічно характерною ознакою анемії є блідість шкіри та слизових оболонок, а також прояви гіпоксії, зазвичай слабість, втома, млявість або запаморочення. Міокардіальна гіпоксія може спричинити гіпердінамічну циркуляцію із збільшенням частоти серцевих скорочень та ударного об'єму. Можуть розвинутися типові шуми викиду, а якщо анемія досить важка - серцева недостатність. Анемії загалом класифікують двома способами: або за етіологічною класифікацією (за причиною), або за морфологічною класифікацією (за змінами форми та розміру). Частіше застосовується етіологічна класифікація. Алоімунна гемолітична анемія виникає, коли антитіло однієї особи реагує з червоними клітинами крові (ЧКК) іншої особи. Алоімунна гемолітична анемія типово виникає після переливання несумісної за групою АВО крові і при резус-несумісності новонароджених. Також вона виникає після алогенної трансплантації. (Hoffbrand, A. V. in Essential Hematology, 3rd. ed., Blackwell Scientific Publications, 1993, c. 90). Прийом певних медичних препаратів може викликати короткотривалу спричинену ліками анемію. Є три механізми її виникнення: антитіло, спрямоване проти комплексу лікарська 2 UA 99254 C2 5 10 15 20 25 30 35 40 45 50 55 60 речовина-мембрана еритроцита (наприклад, пеніцилін або цефалотин); 2) осадження комплементу через комплекс лікарська речовина-протеїн (антиген)-антитіло на поверхні еритроцитів (наприклад, хінідин або хлоропропамід); або 3) аутоімунна гемолітична анемія, у виникненні якої роль лікарських речовин невідома (наприклад, метилдофа). У кожному випадку анемія зникає тільки після припинення прийому лікарської речовини (однак при прийомі метилдофа антитіла можуть залишатися протягом багатьох місяців). (Hoffbrand, A. V. in Essential Hematology, 3rd. ed., Blackwell Scientific Publications, 1993, c. 90-1). Апластична анемія визначається як панцитопенія (анемія, лейкопенія та тромбоцитопенія), яка є результатом аплазії кісткового мозку. Вона поділяється на первинні типи: вроджена форма (анемія Фанконі) і набута форма без очевидного прискорювального фактора (ідіопатична). Вторинні випадки можуть виникати з різноманітних промислових, ятрогенних та інфекційних причин. Видається, що основною причиною є значне зменшення числа гемопоетичних плюрипотентних стовбурових клітин і дефекти решти стовбурових клітин або імунні реакції на них, які роблять їх нездатними до поділу і диференціації, достатніх для заселення кісткового мозку. (Hoffbrand, A. V. in Essential Hematology, 3rd. ed., Blackwell Scientific Publications, 1993, c. 121). У деяких випадках було продемонстровано Т-клітини-супресори, а також імуноглобуліни, які інгібують еритропоетин або блокують диференціацію гемопоетичних стовбурових клітин in vitro. (Andreoli, Т. in Essentials of Medicine, W. B. Saunders, 1986, c. 349). Neelis et al., Blood, 90(1):58-63 (1997) виявили, що рекомбінантний ТПО людини стимулює відновлення клітинної лінії еритроцитів у макак-резусів, що піддавались опроміненню до 5 Гр загального опромінення тіла (рентгенівські промені при 300 кВ), з регенерацією ретикулоцитів, що починалась на 10 днів раніше, ніж у тварин, що приймали плацебо. Neelis et al. також виявили покращення показників гемоглобіну та гематокриту у порівнянні із контрольними групами. Basser et al., Blood, 89(9):3118-3128 (1997) виявили, що введення PEG-rHuMGDF та філгастриму збільшило кількість периферійних недиференційованих клітин-попередників у 2 2 пацієнтів, яким вводили карбоплатин у дозі 600 мг/м та циклофосфамід у дозі 1200 мг/м . Papayannopoulou et al., Exp. Hematol., 24(5):660-669 (1996) виявили впливи ЕПО та ТПО на диференціацію in vitro у напрямку еритропоезу і тромбопоезу. Kaushansky et al., J. Clin. Invest., 96(3):1683-1687 (1995) виявили, що ТПО діяв синергічно із Епо для збільшення кількості еритроїдних попередників. Kaushansky et al., Exp. Hematol., 24(2):265-269 (1996) виявили, що ТПО збільшував кількість клітин-попередників БУО-Е, КУО-ГМ і КУО-Мк у тварин з мієлосупресією. Анемія є серйозною проблемою, а тому необхідно якомога швидше знайти агоніст фактора росту клітин крові, який здатний запобігти розвитку анемії, лікувати її, сприяти виживанню попередників ЧКК та/або підтримувати нормальне утворення червоних клітин крові. Даний винахід пропонує такий агоніст. Даний винахід спрямований на застосування визначених низькомолекулярних пептидних сполук для лікування анемії. Визначені пептидні сполуки із низькою молекулярною масою міцно зв'язуються з TPO-R, можуть активувати TPO-R, потенційно дозволяють зменшити побічні явища у порівнянні із відомими агоністами ТПО, а також мають здатність стимулювати in vivo та in vitro утворення червоних клітин крові. Пептидні сполуки із низькою молекулярною масою можуть існувати у різноманітних формах, наприклад мономерів, димерів, олігомерів, та/або бути дериватизованими із гідрофільним полімером. Відповідно, такі пептидні сполуки є корисними для терапевтичних цілей при лікуванні та/або запобіганні анемії, а також для діагностичних цілей при вивченні анемії. Пептидні сполуки, придатні для терапевтичних та/або діагностичних цілей, мають IC50 близько 2 ммоль або нижчу, а краще – 2 нмоль або нижчу, як визначено, наприклад, аналізом зв'язування Baf/3 (обговорено далі), де нижча IC50 корелює із сильнішою спорідненістю до зв'язування з TPO-R. Для фармацевтичних цілей бажано, щоб IC50 пептидних сполук не перевищувала приблизно 100 мкмоль, а краще – приблизно 500 нмоль, ще краще - приблизно 100 пмоль, і найкраще – приблизно 5 пмоль. Пептидні сполуки, придатні для терапевтичних та/або діагностичних цілей, мають EC50 близько 2 ммоль або нижчу, а краще – 2 нмоль або нижчу, як визначено із застосуванням загальновідомих методів аналізу, наприклад аналізу зв'язування Baf/3 (обговорено далі), де нижча EC50 корелює з сильнішою спорідненістю до зв'язування з TPO-R. Для фармацевтичних цілей бажано, щоб EC50 пептидних сполук не перевищувала приблизно 100 мкмоль, а краще – приблизно 500 нмоль, ще краще – приблизно 100 пмоль, і найкраще – приблизно 5 пмоль. Молекулярна маса пептидних сполук коливається в межах від приблизно 8,3E-22 г (500 дальтон) до приблизно 1,3Е-20 г (8000 дальтон), а краще – від приблизно 1,4Е-21 г (900 3 UA 99254 C2 5 10 15 20 25 30 35 40 45 50 55 60 дальтон) до приблизно 3,3Е-21 1 (2000 дальтон). Якщо пептидні сполуки олігомеризовані, димеризовані та/або дериватизовані з гідрофільним полімером, як описано тут, молекулярна маса такого пептиду буде більшою і може коливатися у межах від приблизно 2,5Е-21 г (1500 дальтон) до приблизно 1,9Е-19 г (120000 дальтон), а краще – від приблизно 4,9Е – 21 г (3000 дальтон) до приблизно 1,3Е-19 г (80000 дальтон), а ще краще – від приблизно 4,9-20 г (30000 дальтон) до приблизно 8,3-20 г (50000 дальтон). Придатні гідрофільні полімери включають, але не обмежуються поліалкільними ефірами, прикладом яких є поліетиленгліколь та поліпропіленгліколь, полімолочна кислота, полігліколева кислота, поліоксіалкени, полівініловий спирт, полівінілпіролідон, целюлоза та похідні целюлози, декстран та похідні декстрану тощо, як описано в патентах США № 5,672,662 і 5,869,451, повний текст яких включено в цей документ шляхом посилання. У дериватизованих із гідрофільним полімером пептидних сполук зростають розчинність і період напіввиведення із кров'яного русла і приховується імуногенність. Вищезазначеного можна досягти з невеликим зниженням зв'язувальної активності пептидних сполук або й зовсім без такого зниження. Загалом, такі гідрофільні полімери мають середню молекулярну масу, яка коливається у межах від приблизно 8,3Е-22 г (5000 дальтон) до приблизно 1,7Е-19 г (100000 дальтон), а краще – від приблизно 3,3Е – 21 г (2000 дальтон) до приблизно 6,6Е-20 г (40000 дальтон), і навіть ще краще – від приблизно 8,3Е-21 г (5000 дальтон) до приблизно 3,3Е-20 г (20000 дальтон). У найбільш бажаних модифікаціях такі гідрофільні полімери мають середню молекулярну масу приблизно 8,3Е-21 г (5000 дальтон), 1,7Е-20 г (10000 дальтон) та 3,3Е – 20 г (20000 дальтон). Пептидні сполуки, запропоновані винаходом, можна дериватизувати або сполучати з такими полімерами із застосуванням будь-яких методів, викладених у Zallipsky, S., Bioconjugate Chem., 6:150-165 (1995); Monfardini, C, et al., Bioconjugate Chem., 6:62-69 (1995); патенті США № 4,640,835; патенті США № 4,496,689; патенті США № 4,301,144; патенті США № 4,670,417; патенті США № 4,791,192; патенті США № 4,179,337 або WO 95/34326, кожен з яких повністю включений у цей текст шляхом посилання. У найкращій на даний час модифікації пептидні сполуки, запропоновані даним винаходом, є дериватизованими з поліетиленгліколем (ПЕГ). ПЕГ – це лінійний водорозчинний полімер, повторюваними одиницями якого є залишки етиленоксиду з двома кінцевими гідроксильними групами. ПЕГ класифікуються за молекулярною масою, яка звичайно коливається у межах від приблизно 8,3Е-22 г (500 дальтон) до приблизно 6,6Е-20 г (40000 дальтон). У найкращій на даний час модифікації застосовують ПЕГ з молекулярними масами, які коливаються у межах від 8,3Е-21 г (5000 дальтон) до приблизно 3,3Е-20 г (20000 дальтон). ПЕГ, з'єднані із запропонованими даним винаходом пептидними сполуками, можуть бути розгалуженими або нерозгалуженими. (Див., наприклад, Monfardini, C., et al., Bioconjugate Chem., 6:62-69 (1995)). Доступні для придбання ПЕГ виробництва "Nektar Therapeutics" (Cан Карло, Каліфорнія), "Sigma Chemical Co.” та інших компаній. Такі ПЕГ включають, але не обмежуються монометоксиполіетиленгліколем (MePEG-OH), монометоксиполіетиленглікольсукцинатом (MePEG-S), монометоксиполіетиленглікольсукцинімідилсукцинатом (MePEG-S-NHS), монометоксиполіетиленглікольаміном (MePEG-NH2), монометоксиполіетиленглікольтрезилатом (MePEG-TRES) та монометоксиполіетиленглікольімідазолілкарбоніл (MePEG-IM). Коротше кажучи, бажано, щоб в одній модифікації застосований гідрофільний полімер, наприклад ПЕГ, з одного кінця завершувався інертною групою, зокрема метокси- або етоксигрупою. Згодом полімер активують на іншому кінці у реакції з підхожим активатором, таким як галогеніди ціанурової кислоти (наприклад, хлорид, бромід або фторид ціанурової кислоти), діімідазол, ангідридний реагент (наприклад, ангідрид дигалосукцинату, такий як ангідрид дибромсукцинату), ацилазид, п-діазоній-бензиловий ефір, 3-(п-діазонійфенокси)-2гідроксипропіловий ефір) і подібні. Для утворення пептидної сполуки, дериватизованої з полімером, потім проводили реакцію активованого полімеру з пептидною сполукою, запропонованою даним винаходом. Альтернативно, для реакції з полімером можна активувати функціональну групу пептидних сполук, запропонованих даним винаходом, або приєднати дві групи у ході узгодженої реакції сполучення з використанням відомих методів сполучення. Фахівці з вдячністю оцінять те, що пептидні сполуки, запропоновані винаходом, можна дериватизувати з ПЕГ, використовуючи численні інші схеми реакцій, відомі та використовувані професіоналами у цій галузі. При використанні для діагностичних цілей пептидні сполуки, запропоновані винаходом, переважно позначали мітками, що піддаються виявленню, а, відповідно, пептидні сполуки без таких міток служили проміжними продуктами у приготуванні мічених пептидних сполук. Бажаними пептидними сполуками є: 4 UA 99254 C2 5 10 15 20 25 30 35 40 45 (1) сполуки з молекулярною масою меншою, ніж приблизно 8,3-21 г (5000 дальтон), як мономери, так і димери або олігомери, а також (2) сполуки зі спорідненістю до зв'язування з TPO-R, вираженою через IC50, що не перевищує приблизно 100 ммоль, де нуль або більше пептидильних [--C(O)NR--] ланок (зв'язків) були заміщені непептидильними ланками, наприклад --СН2-карбаматною ланкою [--CH2 --OC(O)NR--], фосфонатною ланкою, --СН2-сульфонамідною ланкою [--CH2 --S(O)2 NR-], карбамідною ланкою [--NHC(O)NH--], ланкою --CH2 –вторинного аміну або алкільованою пептидною ланкою [-6 6 C(O)NR -- де R є нижчим алкілом]; 1 пептиди, у яких N-кінець дериватизований до групи --NRR , до групи --NRC(O)R, до групи -1 NRC(O)OR, до групи --NRS(O)2 R, до групи --NHC(O)NHR, де R і R є воднем або нижчим 1 алкілом за умови, що один із радикалів R і R не є воднем; до сукцинімідної групи; до бензилоксикарбоніл--NH-- (CBZ--NH--)-групи або до бензилоксикарбоніл--NH--групи, яка містить від 1 до 3 замісників у фенільному кільці, вибраних з групи, що складається із нижчого алкілу, нижчого алкокси-, хлоро- та бромозамісника; або 2 2 пептиди, у яких С-кінець дериватизований до --C(O)R , де R вибрано з групи, що містить 3 4 3 4 нижчий алкокси- та --NR R -радикал, де R і R є незалежно обраними з групи, до якої входить водень або нижчий алкіл. Було виявлено, що основна пептидна сполука може містити таку послідовність амінокислот (SEQ ID NO: 2): X1 × 2 X3 × 4 X5 × 6 X7, де X1 означає C, L, M, P, Q, V; X2 означає F, K, L, N, Q, R, S, T або V; X 3 означає C, F, I, L, M, R, S, V або W; X4 означає будь-яку з 20 L-амінокислот генетичного коду; X5 означає A, D, E, G, K, M, Q, R, S, T, V або Y; X6 означає -(2-нафтил)-аланін (2-Nal) та X7 означає C, G, I, K, L, M, N, R або V. У бажаній модифікації основна пептидна сполука містить таку послідовність амінокислот (SEQ ID NO:3): X8 G X1 × 2 X3 × 4 X5 (2-Nal) X7, де Х1 - Х7 означають вказані вище залишки, а кожний залишок Х 8 незалежно вибрано з 20 Lамінокислот генетичного коду, їхніх стереоізомерних D-амінокислот, а також амінокислот, які не зустрічаються в природі. У більш бажаній модифікації основна пептидна сполука містить таку послідовність амінокислот (SEQ ID NO:4): X9 × 8 G X1 × 2 X3 × 4 X5 (2-Nal) X7, де X9 означає A, C, E, G, I, L, M, P, R, Q, S, T або V; і X 8 означає A, C, D, E, K, L, Q, R, S, T або V. У більш бажаному випадку X9 означає A або I, а X8 означає D, E або K. Найбільш бажаною пептидною сполукою є (SEQ ID NO:5): I E G P T L R Q (2-Nal) L A A R (Sar), де (Sar) означає саркозин. В іншій модифікації пептидну сполуку димеризують або олігомеризують для збільшення спорідненості та/або активності пептидної сполуки. Найбільш бажаною пептидною сполукою є 29-мерний пептид, який містить два ідентичні 14-мери, з'єднані лізинамідним залишком. Отже, найбільш бажаною пептидною сполукою є (SEQ ID NO: 6, яка тут також згадується під назвою "Сполука ТПО № 1"): I E G P T L R Q (2-Nal) L A A R (Sar) \ 50 K(NH2) / I E G P T L R Q (2-Nal) L A A R (Sar) Більш бажаною пептидною сполукою є пегільований варіант сполуки ТПО № 1. Пегільована форма може включати залишок з 20000 МПЕГ, ковалентно зв'язаний із кожним N-кінцевим ізолейцином. Приклад повної молекулярної структури такої сполуки докладно показаний нижче: 5 UA 99254 C2 MPEG O H N N H H2N O O O O O H N N N H OH OH O H N N H O O H N N H O O HN NH O O O MPEG H N N H N H 10 15 20 25 30 35 40 O H N N H N H H N N H NH N O O O O NH HN NH OH H N O OH O O 5 O H N N H HN NH2 O O O H N O N H H2N N H N N O H2N O O H N N H O HN H2N O H N N H O NH2 NH2 (Ця сполука згадується у даному тексті під назвою "Пегільована сполука ТПО № 1"). Повна хімічна назва пегільованої сполуки ТПО № 1: Метоксиполіетиленгліколь20000-пропіоніл-L-ізолейцил-L-глутаміл-L-гліцил-L-проліл-Lтреоніл-L-лейцил-L-аргініл-L-глутамініл-L-2-нафтилаланіл-L-лейцил-L-аланіл-L-аланіл-L-аргінілL-саркозил-Ne-(метоксиполіетиленгліколь20000-пропіоніл-L-ізолейцил-L-глутаміл-L-гліцил-Lпроліл-L-треоніл-L-лейцил-L-аргініл-L-глутамініл-L-2-нафтилаланіл-L-лейцил-L-аланіл-L-аланілL-аргініл-L-саркозил-)-лізинамід. Пегільована сполука ТПО № 1 складається з двох ідентичних пептидних ланцюгів по 14 амінокислот; ланцюги сполучені лізинамідним залишком, а до кожного N-кінця приєднаний поліетиленгліколевий (ПЕГ) ланцюг з молекулярною масою приблизно 3,3Е-20 г (20000 дальтон). Молекулярна маса вихідного пептиду без ПЕГ складає 5,5Е-21 г (3295 дальтон), а з двома ланцюгами ПЕГ – приблизно 7,2Е-20 г (43295 дальтон). Пегільована сполука ТПО № 1 має скорочену молекулярну структуру (MPEG-Ile-Glu-Gly-Pro-Thr-Leu-Arg-Gln-(2-Nal)-Leu-AlaAla-Arg-(Sar))2-Lys-NH2, де (2-Nal) означає β-(2-нафтил)аланін, (Sar) означає саркозин, а MPEG означає метоксиполіетиленгліколь (ММ приблизно 3,3Е- 20 г (20000 дальтон)). Одна чи кілька пептидних сполук, зокрема пегільовані пептидні сполуки, включаючи їхні фармацевтично прийнятні еквіваленти (які в сукупності згадуються в цьому документі під назвами "пептидні сполуки", "пептидні сполуки ТПО" або "сполуки ТПО, запропоновані винаходом"), є придатними для запобігання та лікування хвороб, опосередкованих ТПО, зокрема для лікування та запобігання анемії. Отже, винахід пропонує метод лікування та/або запобігання анемії, який відрізняється тим, що пацієнт, хворий на анемію, або пацієнт, у якого припускають розвиток анемії, приймає, чи йому вводять терапевтично або профілактично ефективну дозу чи кількість пептидної сполуки, запропонованої цим винаходом. Винахід також передбачає фармацевтичні композиції, які містять одну або більше пептидних сполук, описаних тут, а також фізіологічно прийнятний носій. Ці фармацевтичні композиції можуть бути у різноманітних формах, включаючи лікарські форми для перорального прийому, а також порошки і розчини для інгаляцій і розчини для ін'єкцій та інфузій. На фіг. 1 показано вплив лікування пегільованою сполукою ТПО № 1 на рівні гемоглобіну, як викладено у Прикладі 1. На фіг. 2 показано вплив лікування пегільованою сполукою ТПО № 1 на кількість червоних клітин крові, як викладено у Прикладі 1. На фіг. 3 показано вплив лікування пегільованою сполукою ТПО № 1 на гематокрит, як викладено у Прикладі 1. На фіг. 4 показано вплив лікування пегільованою сполукою ТПО № 1 на масу тіла, як викладено у Прикладі 1. На фіг. 5 показано вплив лікування пегільованою сполукою ТПО № 1 на рівні гемоглобіну, як викладено у Прикладі 2. На фіг. 6 показано вплив лікування пегільованою сполукою ТПО № 1 на кількість червоних клітин крові, як викладено у Прикладі 2. На фіг. 7 показано вплив лікування пегільованою сполукою ТПО № 1 на гематокрит, як викладено у Прикладі 2. На фіг. 8 показано вплив лікування пегільованою сполукою ТПО № 1 на масу тіла, як викладено у Прикладі 2. 6 UA 99254 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фіг. 9 показано вплив лікування пегільованою сполукою ТПО № 1 на рівні гемоглобіну, як викладено у Прикладі 3. На фіг. 10 показано вплив лікування пегільованою сполукою ТПО № 1 на кількість червоних клітин крові, як викладено у Прикладі 3. На фіг. 11 показано вплив лікування пегільованою сполукою ТПО № 1 на гематокрит, як викладено у Прикладі 3. На фіг. 12 показано вплив лікування пегільованою сполукою ТПО № 1 на масу тіла, як викладено у Прикладі 3. На фіг. 13 показано вплив лікування пегільованою сполукою ТПО № 1 на гематокрит, як викладено у Прикладі 4. На фіг. 14 показано вплив лікування пегільованою сполукою ТПО № 1 на масу тіла, як викладено у Прикладі 4. На фіг. 15 показано вплив лікування пегільованою сполукою ТПО № 1 на масу тіла, як викладено у Прикладі 5. На фіг. 16 показано гаданий механізм антианемічної дії пегільованої сполуки ТПО № 1. На фіг. 17 показано деякі аспекти гаданого диференційованого впливу пегільованої сполуки ТПО № 1 на різні лінії гемопоетичних клітин. На фіг. 18А та 18Б показано вплив лікування пегільованою сполукою ТПО № 1 на тромбоцити та гематокрит у мишей, яким вводили карбоплатин, як викладено у Прикладі 6. На фіг. 19 показано вплив лікування пегільованою сполукою ТПО № 1 на відкладення фібриногену та формування згустків крові у зрізах мозку мишей, яким вводили карбоплатин, як викладено у Прикладі 6. На фіг. 20 показано вплив пегільованої сполуки ТПО № 1 на активацію TPO-R людини у клітинах Baf/3, як викладено у Прикладі 7. На фіг. 21 показано, що пегільована сполука ТПО № 1 дозозалежним способом активувала клітини Baf/3, які рекомбінантно експресували TPO-R людини, як викладено в Прикладі 7. Опис конкретних модифікацій Викладені далі визначення подано для того, щоб пояснити та визначити зміст і межі застосування різних термінів, використаних у цьому документі для опису винаходу. "Агоніст" означає біологічно активний ліганд, який зв'язується зі своїм комплементарним біологічно активним рецептором й активує останній, щоб викликати біологічну відповідь у рецепторі або підсилити наявну до того активність рецептора. "EC50" й "ефективна концентрація 50 %” означає таку концентрацію агоніста, яка викликає 50 % максимально можливої ефективної відповіді для цього агоніста. "IC50" й "інгібіторна концентрація 50 %” означає таку концентрацію конкуруючого ліганду, за якої останній заміщує 50 % специфічного зв'язування агоніста. "Фармацевтично прийнятні еквіваленти" включають, без обмеження, фармацевтично прийнятні солі, солі приєднання кислот, складні ефіри, аміди, гідрати, метаболіти, попередники лікарських засобів та ізостери. Очікується, що багато фармацевтично прийнятних еквівалентів мають активність in vitro чи in vivo, таку ж саму або подібну до активності пептидних сполук, запропонованих винаходом. "Фармацевтично прийнятні солі" означають солі нетоксичних лужних металів, лужноземельних металів та амонійні солі, які зазвичай використовують у фармацевтичній промисловості, включаючи солі натрію, калію, літію, кальцію, магнію, барію, амонію та протамінцинку, які готують загальновідомими в галузі методами. Термін також включає нетоксичні солі приєднання кислот, які загалом утворюють в реакції пептидних сполук, запропонованих винаходом, з придатною органічною або неорганічною кислотою. Типові солі включають гідрохлорид, гідробромід, сульфат, бісульфат, ацетат, оксалат, валерат, олеат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, напсилат тощо. "Фармацевтично прийнятні солі приєднання кислот" означають солі, які зберегли біологічну ефективність та властивості вільних основ, які не є біологічно чи іншим чином непридатними і які утворені в реакціях з неорганічними кислотами, наприклад соляною, бромоводневою, сірчаною, азотною, фосфорною кислотами тощо, а також з органічними кислотами, такими як оцтова, пропіонова, гліколева, піровиноградна, щавлева, яблучна, малонова, янтарна, малеїнова, фумарова, винна, лимонна, бензойна, корична, мигдалева, метансульфонова, етансульфонова, п-толуолсульфонова, саліцилова кислоти тощо. Опис фармацевтично прийнятних солей приєднання кислот як попередників лікарських засобів див. у Bundgaard, H., згаданому вище. "Фармацевтично прийнятний ефір" означає ті ефіри, які після гідролізу ефірного зв'язку зберігають біологічну ефективність та властивості карбонової кислоти або спирту і не є 7 UA 99254 C2 5 10 15 20 25 30 35 40 45 50 55 60 біологічно чи іншим чином непридатні. Опис фармацевтично прийнятних ефірів як попередників лікарських засобів дивись у Bundgaard, H., ed., Design of Prodrugs, Elsevier Science Publishers, Amsterdam (1985). Ці ефіри типово утворюють з відповідної карбонової кислоти та спирту. Як правило, утворити ефір можна загальноприйнятими методами синтезу (див., наприклад, March Advanced Organic Chemistry, 3rd Ed., John Wiley & Sons, New York (1985) с. 1157 і цитовані там джерела, а також Mark et al. Encyclopedia of Chemical Technology, John Wiley & Sons, New York (1980)). Спиртова складова ефіру загалом включає (і) С 2-С12 аліфатичний спирт, який може містити або не містити один або кілька подвійних зв'язків і розгалужений вуглецевий ланцюг, чи (іі) C7-C12 ароматичний або гетероароматичний спирт. Даний винахід також передбачає використання тих композицій, що одночасно є як описаними тут ефірами, так і їхніми фармацевтично прийнятними солями, отриманими внаслідок приєднання кислот. "Фармацевтично прийнятний амід" означає ті аміди, які після гідролізу амідного зв'язку зберігають біологічну ефективність і властивості карбонової кислоти чи аміну та не є біологічно чи іншим чином непридатні. Опис фармацевтично прийнятних амідів як попередників лікарських засобів див. у Bundgaard, H., ed., Design of Prodrugs, Elsevier Science Publishers, Amsterdam (1985). Ці аміди типово утворюють із відповідної карбонової кислоти та аміну. Загалом отримати амід можна загальноприйнятими методами синтезу (див., наприклад, March Advanced Organic Chemistry, 3rd Ed., John Wiley & Sons, New York (1985) с. 1152 та Mark et al. Encyclopedia of Chemical Technology, John Wiley & Sons, New York (1980)). Даний винахід також передбачає використання тих композицій, що є одночасно як описаними тут амідами, так і їхніми фармацевтично прийнятними солями, отриманими шляхом приєднання кислот. Термін "фармацевтично або терапевтично прийнятний носій" означає середовище-носій, яке не перешкоджає біологічній активності активних інгредієнтів і не є токсичним для організмугосподаря або пацієнта. "Стереоізомери" означають хімічні сполуки, які мають однакові молекулярну масу, хімічний склад та будову, але різне розташування атомів у групах. Тобто, певні ідентичні хімічні функціональні групи мають різну орієнтацію в просторі, і тому в чистому вигляді вони мають здатність обертати площину поляризованого світла. Однак деякі чисті стереоізомери можуть мати настільки незначне оптичне обертання, що його неможливо виявити сучасними приладами. Пептидні сполуки, запропоновані даним винаходом, можуть мати один або кілька асиметричних атомів вуглецю, тому вони формують різноманітні стереоізомери. Всі стереоізомери входять в обсяг винаходу. Термін "терапевтично або фармацевтично ефективна кількість" стосовно композицій, запропонованих даним винаходом, означає кількість композиції, достатню для того, щоб викликати бажаний біологічний результат. Такий результат може виявлятися в частковому послабленні прояву ознак, симптомів або усуненні причин хвороби чи досягненні інших бажаних змін у біологічній системі. У даному винаході як результат застосування ефективної кількості композиції зазвичай зростає продукування червоних клітин крові. Назви амінокислотних залишків у пептидах скорочено таким чином: фенілаланін - Phe або F; лейцин - Leu або L; ізолейцин - Ile або I; метіонін - Met або M; валін - Val або V; серин - Ser або S; пролін - Pro або P; треонін - Thr або T; аланін - Ala або A; тирозин – Tyr або Y; гістидин - Hабо H; глутамін - Gln або Q; аспарагін - Asn або N; лізин - Lys або K; аспарагінова кислота - Asp або D; глутамінова кислота - Glu або E; цистеїн - Cys або C; триптофан - Trp або W; аргінін - Arg або R та гліцин - Gly або G. Крім того, Bu означає бутокси, Bzl означає бензил, СНА означає циклогексиламін, Ас означає ацетил, Ме означає метил, Pen означає пеніциламін, Aib означає аміноізомасляну кислоту, Nva означає норвалін, Abu означає аміномасляну кислоту, Thi означає тієнілаланін, OBn означає o-бензил і hyp означає гідроксипролін. Окрім пептидів, які складаються лише з амінокислот, що трапляються в природі, винахід також передбачає пептидоміметики або аналоги пептидів. Аналоги пептидів звичайно використовують у фармацевтичній промисловості як непептидні лікарські речовини з властивостями, подібними до властивостей пептидів, які є шаблонами для створення аналогів. Такі типи непептидних сполук позначають терміном "пептидні міметики", або "пептидоміметики" (Fauchere, J. Adv. Drug Res. 15:29 (1986); Veber and Freidinger TINS p.392 (1985); та Evans et al. J. Med. Chem. 30:1229 (1987); кожне з джерел включено у цей документ шляхом посилання. Пептидні міметики, подібні за структурою до терапевтично застосовуваних пептидів, можна використати для досягнення аналогічного чи посиленого терапевтичного або профілактичного ефекту. Як правило, пептидоміметики подібні за структурою до еталонних поліпептидів (тобто до поліпептидів, які мають біологічну або фармакологічну активність), наприклад до рецепторзв'язувальних поліпептидів, які трапляються у природі; однак пептидоміметики мають один або кілька пептидних зв'язків, вибірково заміщених на зв'язки, обрані з-поміж --CH2 NH--, --CH2 S--, - 8 UA 99254 C2 5 10 15 20 25 30 35 40 45 50 55 CH2 --CH2 --, --CH=CH-- (цис і транс), --COCH2 --, --CH(OH)CH2 -- і --CH2 SO--, за допомогою загальновідомих у галузі методів, які детальніше описано у таких джерелах: Spatola, A. F. у Chemistry and Biochemistry of Amino Acids, Peptides, and Proteins, B. Weinstein, eds., Marcel Dekker, New York, с. 267 (1983); Spatola, A. F., Vega Data (March 1983), Vol. 1, Issue 3, Peptide Backbone Modifications (загальний огляд); Morley, Trends Pharm Sci (1980) с. 463-468 (загальний огляд); Hudson, D. et al., Int J Pept Prot Res 14:177-185 (1979) (--CH2 NH--, CH2 CH2 --); Spatola et al. Life Sci 38:12431249 (1986) (--CH2 --S); Hann J. Chem. Soc Perkin Trans. I 307-314 (1982) (--CH--CH--, цис і транс); Almquist et al. J. Med. Chem. 23:1392-1398 (1980) (--COCH2 --); Jennings-White et al. Tetrahedron Lett 23:2533 (1982) (--COCH2 --); Szelke et al. European Appln. EP 45665 CA (1982): 97:39405 (1982) (--CH(OH)CH2 --); Holladay et al. Tetrahedron Lett 24:4401-4404 (1983) (-C(OH)CH2 --); і Hruby Life Sci 31:189-199 (1982) (--CH2 --S--); кожне з джерел включено в цей текст шляхом посилання. Найбільш бажаною непептидною ланкою є --CH2 NH--. Такі пептидні міметики можуть мати значні переваги над модифікаціями поліпептиду, зокрема більш рентабельне виробництво, більшу хімічну стабільність, посилені фармакологічні властивості (період напіввиведення, абсорбція, активність, сила дії тощо), змінена специфічність (наприклад, широкий спектр біологічної активності), зменшення антигенності тощо. Мічення пептидоміметиків звичайно включає ковалентне приєднання однієї або кількох міток безпосередньо або через місток (наприклад, амідну групу) у дозволеному положенні(положеннях), які передбачені даними про кількісну залежність структура-активність та/або молекулярним моделюванням. Такі дозволені положення, як правило, є положеннями, які не утворюють прямого контакту з макромолекулою(ами) (наприклад, молекулами з надродини імуноглобулінів), з якими пептидоміметик зв'язується, щоб викликати терапевтичний ефект. Дериватизація (наприклад, мічення) пептидоміметиків не повинна суттєво перешкоджати їхній бажаній біологічній або фармакологічній активності. Зазвичай міметики пептидів, що зв'язуються з рецептором, зв'язуються з тим самим рецептором з вищою спорідненістю і мають біологічну активність, яку можна виявити (тобто є агоністами або антагоністами однієї чи кількох фенотипових змін, опосередкованих рецептором). Систематичну заміну однієї чи кількох амінокислот в консенсусній послідовності на Dамінокислоту того ж типу (наприклад, заміна D-лізину на L-лізин) можна використати для створення більш стабільних пептидів. Крім того, конформаційно обмежені пептиди, які містять консенсусну послідовність або яким властиве значною мірою ідентичне варіювання консенсусних послідовностей, можна утворити відомими серед фахівців методами (Rizo and Gierasch Ann. Rev. Biochem. 61:387 (1992), включено у цей документ шляхом посилання), наприклад додаванням внутрішніх залишків цистеїну, здатних утворювати внурішньомолекулярні дисульфідні містки, які циклізують пептид. "Мітка, яку можна виявити" стосується речовин, які у випадку ковалентного приєднання до пептидних сполук, запропонованих винаходом, дозволяють виявити пептидну сполуку in vivo в організмі пацієнта, якому ввели цю пептидну сполуку. Придатні мітки, які можна виявити, є загальновідомими і включають, для прикладу, радіоізотопи, флуоресцентні мітки (наприклад, флуоресцеїн) тощо. Використання конкретної мітки, яку можна виявити, не має істотного значення. Її вибирають залежно від кількості мітки, яку буде застосовано, а також токсичності застосованої мітки у такій кількості. Фахівцям галузі добре відомий спосіб вибору мітки відповідно до таких факторів. Ковалентне приєднання мітки, яку можна виявити, до пептидної сполуки здійснюють традиційними і добре відомими серед фахівців методами. Наприклад, коли в якості мітки, яку 125 125 можна виявити, використовують радіоізотоп І, можна ковалентно приєднати І до пептидної сполуки включенням амінокислоти тирозину в пептидну сполуку із наступним йодуванням 32 останньої… Подібним чином у пептидну сполуку можна ввести Р як фосфатний фрагмент, наприклад, через гідроксильну групу в пептидній сполуці, використовуючи звичайні хімічні процеси. Об'єктом цього винаходу є пептидні сполуки, які зв'язуються із TPO-R та активують його або іншим чином діють як агоністи ТПО. Ці пептидні сполуки включають "головні" пептидні сполуки й "еквівалентні", або "похідні", пептидні сполуки, побудовані таким чином, щоб мати аналогічну або подібну до головних пептидних сполук молекулярну структуру чи форму, але відрізнятися від них або за чутливістю до гідролізу чи протеолізу та/або за іншими біологічними властивостями, наприклад, підвищеною спорідненістю до рецептора. Даний винахід також пропонує композиції, що містять ефективну кількість агоністів ТПО, зокрема пептидних сполук, придатних для лікування анемії. 9 UA 99254 C2 5 10 15 20 25 30 35 40 45 50 55 60 Пептидні сполуки, запропоновані винаходом, також можна вводитиь теплокровним тваринам, включаючи людину, для активації TPO-R in vivo. Таким чином, даний винахід містить методи терапевтичного лікування анемії, що передбачають введення пептидних сполук, запропонованих винаходом, у кількостях, достатніх для імітації дії ТПО на TPO-R in vivo. Активність пептидних сполук, запропонованих даним винаходом, можна оцінити in vitro або in vivo, наприклад з допомогою наведених тут аналізів чи однієї з багатьох моделей, описаних в McDonald Am. J. of Pediatric Hematology/Oncology 14:8-21 (1992); вказане джерело включено в цей текст шляхом посилання. Згідно з однією з модифікацій, композиції, запропоновані даним винаходом, є придатними для лікування анемії, пов'язаної з пересадкою кісткового мозку, променевою терапією або хіміотерапією. Пептидні сполуки звичайно вводять профілактично перед хіміотерапією, променевою терапією, пересадкою кісткового мозку або після таких впливів. Таким чином, даний винахід також пропонує фармацевтичні композиції, що містять в ролі активних інгредієнтів щонайменше одну з пептидних сполук, запропонованих винаходом, у поєднанні з фармацевтичним носієм або розчинником. Пептидні сполуки, запропоновані даним винаходом, можна вводити перорально, через легені, парентеральним (внутрішньом'язовими, внутрішньовенними (в/в) або підшкірними ін'єкціями), інгаляційним (у формі дрібного порошку), трансдермальним, назальним, вагінальним, ректальним або сублінгвальним шляхами і виготовляти у відповідних до кожного шляху введення лікарських формах. Див., наприклад, Bernstein et al. PCT Patent Publication No. WO 93/25221; Pitt et al. PCT Patent Publication No. WO 94/17784; і Pitt et al. European Patent Application 613,683; кожне з джерел включено у цей документ шляхом посилання. Тверді лікарські форми для перорального введення включають капсули, таблетки, пілюлі, порошки та гранули. У таких твердих лікарських формах активна пептидна сполука містить домішки щонайменше одного інертного фармацевтично прийнятного носія, наприклад сахарози, лактози або крохмалю. Загальноприйнято включати в такі лікарські форми додаткові речовини, які не є інертними розчинниками, наприклад змащувальні речовини, такі як магнію стеарат. Такі лікарські форми, як капсули, таблетки і пілюлі, також можуть містити буферні речовини. Таблетки і пілюлі додатково можуть бути покриті кишковорозчинною оболонкою. Рідкі лікарські форми для перорального введення включають фармацевтично прийнятні емульсії, розчини, суспензії, сиропи. Еліксири містять інертні розчинники, які зазвичай використовують в галузі, наприклад воду або фізіологічний розчин. Крім таких інертних розчинників, композиції також можуть містити допоміжні речовини, як наприклад: зволожувачі, емульгатори та речовини, що суспендують, підсолоджувачі, смакові добавки і ароматизатори. Відповідно до даного винаходу, препарати для парентерального введення включають стерильні водні та неводні розчини, суспензії або емульсії. Прикладами неводних розчинників чи наповнювачів є пропіленгліколь, поліетиленгліколь, рослинні олії, зокрема оливкова і кукурудзяна олії, желатин та органічний ефір, придатний для ін'єкцій, такий як етилолеат. Такі лікарські форми можуть також містити допоміжні речовини, як наприклад: консерванти, зволожувачі, емульгатори й агенти для диспергування. Їх можна стерилізувати, наприклад фільтруванням через фільтри, які затримують бактерії, включенням у композиції речовин, що стерилізують, опроміненням або нагріванням композицій. Такі лікарські форми також можна виготовляти, використовуючи стерильну воду або якесь інше стерильне середовище, безпосередньо перед застосуванням. Композиції для ректального або вагінального введення є переважно супозиторіями, які, на додаток до активної речовини, можуть містити наповнювачі, наприклад кокосове масло або віск для супозиторіїв. Композиції для назального або сублінгвального введення також готують з додаванням стандартних загальновідомих в галузі наповнювачів. Композиції, запропоновані винаходом, також можуть бути мікрокапсульовані, наприклад, методом Tice і Bibi (у Treatise on Controlled Drug Delivery, ed. A. Kydonieus, Marcel Dekker, N.Y. (1992), с. 315-339). Композиції, які містять пептидні сполуки, можна вводити для профілактики та/або терапевтичного лікування. Для терапевтичного застосування композиції вводять пацієнту, що вже страждає від захворювання, описаним вище способом у кількостях, достатніх для лікування або принаймні часткового призупинення симптомів хвороби та її ускладнень. Відповідна кількість препарату для досягнення цього визначена тут як "терапевтично ефективна доза". Кількості, достатні для такого застосування, будуть залежати від тяжкості хвороби, ваги та загального стану пацієнта. Для профілактичного застосування композиції, які містять пептидні сполуки, запропоновані винаходом, вводять пацієнту зі схильністю до певного захворювання або з підвищеним якимось 10 UA 99254 C2 5 10 15 20 25 30 35 40 іншим чином ризиком виникнення такого захворювання. Відповідну кількість препарату визначено як "профілактично активну дозу". За такого застосування точні кількості знову ж таки залежать від стану здоров'я і ваги пацієнта. Кількості агоніста ТПО, необхідні для ефективної терапії, будуть залежати від багатьох різноманітних факторів, які включають спосіб введення, мішень дії, фізіологічний стан пацієнта та призначення інших лікарських препаратів. Таким чином, лікувальні дози слід титрувати для досягнення оптимального рівня безпеки й ефективності. Зазвичай дозування, які використовують in vitro, можуть вказати на необхідні кількості цих реагентів для застосування in situ. Дослідження на тваринах ефективних доз для лікування конкретних розладів надасть подальші прогнозовані вказівки щодо дозування для людини. Різносторонні міркування з цього приводу описано, наприклад, у Gilman et al. (eds), Goodman and Gilman's: The Pharmacological Basis of Therapeutics, 8th ed., Pergamon Press (1990); і Remington's Pharmaceutical Sciences, 7th ed., Mack Publishing Co., Easton, Pa. (1985); кожне з джерел включено у цей текст шляхом посилання. Пептидні сполуки, запропоновані даним винаходом, є ефективними у лікуванні анемії, коли їх призначають у діапазоні доз від приблизно 1 мкг до приблизно 300 мкг/кг маси тіла на день. Застосування певної дози регулюється шляхом введення, а також рішенням лікуючого лікаря залежно від таких факторів, як важкість захворювання, вік, загальний стан пацієнта тощо. Приклади Тваринні моделі Спостерігали за впливом пегільованої сполуки ТПО № 1 на мишей, яким вводили карбоплатин. У всіх прикладах, наведених тут, готували основний розчин пегільованої сполуки ТПО № 1 концентрацією 10 мг/мл у стерильному фізіологічному розчині. Для змішування препарат поміщали в ротаційний шейкер на 15 хвилин при 200 об/хв. Цей метод використовували для розчинення пегільованої сполуки ТПО № 1 без утворення піни. Основний розчин фільтрували через фільтр "GV Millex" (0,22 мкм). Потім із цього основного розчину готували кінцевий розчин для введення, використовуючи стерильний фізіологічний розчин. Основний розчин і розчин для введення готували свіжими у день використання. Приклад 1 Спостерігали вплив пегільованої сполуки ТПО № 1 на тривалість та важкість анемії, викликаної введенням мишам карбоплатину; цей вплив виявляли за змінами рівнів гемоглобіну, кількості червоних клітин крові та гематокриту. У цьому дослідженні пегільовану сполуку ТПО № 1 вводили мишам з поступовим підвищенням дози через день після введення дози карбоплатину, щоб охарактеризувати можливий дозозалежний ефект на різні параметри еритроцитів. Групам мишей внутрішньочеревно вводили карбоплатин або середовище (фізіологічний розчин з фосфатним буфером, PBS) у дні -2 та -1, як показано нижче. Попередньо визначили, що оптимальною дозою карбоплатину для того, щоб викликати тромбоцитопенію в мишей лінії BALB/c, є фракціонована загальна доза 120 мг/кг, яку вводили два дні поспіль у вигляді щоденної ін'єкції (тобто 2 × 60 мг/кг). Через день після введення другої дози карбоплатину групам мишей вводили пегільовану сполуку ТПО № 1 або середовище (стерильний фізіологічний розчин, SS; 0,9 % хлорид натрію без консервантів) внутрішньовенною (болюсною) ін'єкцією, як показано у Таблиці 1. Об'єм дози для введення розраховували залежно від маси тварини (100 мкл/10 г маси тіла). 45 Таблиця 1 Групи лікування: Гр. N Премедикація (внутрішньочеревно), дні -2 і -1 Дослідний зразок Доза (в/в), день 0 1 10 Середовище (PBS) Середовище (SS) Плацебо 2 20 Карбоплатин Середовище (SS) Плацебо 3 20 Карбоплатин 4 20 Карбоплатин Пегільована сполука ТПО № 1 Пегільована сполука ТПО № 1 11 300 мкг/кг 1000 мкг/кг Забір крові Евт. 5 мишей на 5 та 11 день Евт. 5 мишей на 5, 7 та 9 день Евт. 5 мишей на 5, 7, 9 та 11 день Евт. 5 мишей на 5, 7, 9 та 11 день UA 99254 C2 Продовження таблиці 1 5 Пегільована сполука ТПО № 1 20 Карбоплатин 3000 мкг/кг Евт. 5 мишей на 5, 7, 9 та 11 день Гр. = Група; Евт = піддано евтаназії 5 10 15 20 25 30 35 40 На 5, 7, 9 та 11 день п'ять мишей з кожної групи зважували, а потім піддавали евтаназії шляхом асфіксії в атмосфері СО2 і знекровлювали пункцією серця. Зразки крові переносили в окремі мікроконтейнери з ЕДТА (корок бузкового кольору) для гематологічних досліджень. Контрольні групи мишей (5) було піддано тим самим процедурам на 5 та 11 день. Результати показано на фігурах 1-4. Дані представлено у графічній формі як групові середні +стандартна похибка середнього (SEM). Уведення мишам тільки карбоплатину спричиняло зменшення рівнів гемоглобіну приблизно на 20 % на 11 день. Усі дози пегільованої сполуки ТПО № 1 інгібували таке зменшення. Незначні зменшення кількості ЧКК та гематокриту також були пов'язані з уведенням карбоплатину. Пегільована сполука ТПО № 1 інгібувала цей ефект, однак статистичної оцінки ефекту не проводили. Миші у всіх групах, яким вводили тільки карбоплатин або карбоплатин разом з різними дозами пегільованої сполуки ТПО № 1, втрачали вагу на 5, 7 та 9 дні порівняно з днем 0. Аналіз вимірювання маси тіла в популяції мишей за 11-денний період дослідження вказує на те, що введення лише карбоплатину спричиняло помітне зменшення маси тіла і що пегільована сполука ТПО № 1 у всіх проаналізованих дозах сприяла відновленню втраченої маси тіла. У мишей, яким вводили тільки карбоплатин, на 5 день починала змінюватись поведінка і зовнішній вигляд. Деякі миші набували згорбленого положення та виглядали млявими. У багатьох мишей були забруднені аногенітальні ділянки. Уведення пегільованої сполуки ТПО № 1 зменшувало появу, частоту та ступінь прояву цих симптомів, очевидно, дозозалежним способом. Приклад 2 Досліджували можливість сенсибілізації пегільованою сполукою ТПО № 1 гемопоетичних стовбурових клітин кісткового мозку мишей до токсичного впливу карбоплатину. У цьому дослідженні дозу пегільованої сполуки ТПО № 1 вводили мишам протягом 7 днів до або одразу після введення дози карбоплатину. Ще одній групі вводили пегільовану сполуку ТПО № 1 як до, так і після введення карбоплатину. Також спостерігали вплив таких режимів дозування на гематологічні параметри. Групам мишей внутрішньочеревно вводили карбоплатин або середовище (фізіологічний розчин з фосфатним буфером, PBS) у дні 7 та 8, як показано нижче. Попередньо визначили, що оптимальною дозою карбоплатину для того, щоб викликати тромбоцитопенію в мишей лінії BALB/c, є фракціонована загальна доза в 120 мг/кг, яку вводили два дні поспіль у вигляді щоденної ін'єкції (тобто 2 × 60 мг/кг). За сім днів до введення першої дози або через одну (1) годину після введення другої дози карбоплатину групам мишей вводили пегільовану сполуку ТПО № 1 (300 мкг/кг) або середовище (стерильний фізіологічний розчин, SS; 0,9 % хлорид натрію без консервантів) внутрішньовенною (болюсною) ін'єкцією, як показано в Таблиці 2. Іншій групі вводили пегільовану сполуку ТПО № 1 перед (день 0) та після (день 8, t=1год) дози карбоплатину. Розрахунок всіх доз проводили залежно від маси тварини (100 мкл/10 г маси тіла). Таблиця 2 Схема дослідження: Гр. N 1 10 2 Доза (в/в), день 0 Середовище (*SS) Середовище 20 (*SS) Карбоплатин (CBPL) Доза (в/в), [60 мг/кг, у 2 день 8 дозах](внутрішньочеревно), (1 год. після 2-ї дози дні 7 і 8 CBPL) Забір крові; Евт. 5 мишей у дні Середовище (PBS) Середовище (*SS) 14 і 26 Карбоплатин Середовище (*SS) 14, 18, 22 і 26 12 UA 99254 C2 Продовження таблиці 2 3 4 10 15 20 25 30 35 40 45 20 5 5 Пегільована 20 сполука ТПО №1, Карбоплатин 300 мкг/кг Пегільована 20 сполука ТПО №1, Карбоплатин 300 мкг/кг Середовище (*SS) Середовище (*SS) 14, 18, 22 і 26 Пегільована сполука ТПО №. 1, 14, 18, 22 і 26 300 мкг/кг Пегільована сполука ТПО № 1, 14, 18, 22 і 26 300 мкг/кг Карбоплатин На 14, 18, 22 та 26 день п'ять мишей з кожної групи зважували, а потім піддавали евтаназії шляхом асфіксії в атмосфері СО2 і знекровлювали пункцією серця. Зразки крові переносили в окремі мікроконтейнери з ЕДТА (корок бузкового кольору) для гематологічних досліджень. Контрольні групи мишей (5) піддавали тим самим процедурам на 14 та 26 день. Результати показано на фігурах 5-8. Дані представлено у графічній формі як групові середні +SEM. Уведення мишам лише карбоплатину спричиняло зменшення (приблизно на 18 %) рівнів гемоглобіну, кількості ЧКК та гематокриту в мишей, що вижили, на 18 та 22 дні у порівнянні з контрольними групами. Такому зменшенню запобігало введення пегільованої сполуки ТПО № 1 на 8 день (через одну годину після введення другої дози карбоплатину) з/без введення додаткової дози пегільованої сполуки ТПО № 1 в день 0. Однак введення пегільованої сполуки ТПО № 1 лише в день 0 виявилось недостатньо, щоб вплинути на викликані карбоплатином зміни вказаних параметрів еритроцитів. У всіх мишей із контрольної групи між 7 і 26 днями спостерігали нормальний приріст маси тіла, тоді як у всіх мишей, яким вводили тільки карбоплатин, спостерігали незначну втрату маси тіла (у середньому близько 4 %). У всіх групах, яким вводили карбоплатин одночасно з різними дозами пегільованої сполуки ТПО № 1, маса тіла мишей не змінювалась або спостерігався її нормальний приріст між 7 та 26 днями. Аналіз вимірювань маси тіла протягом періоду дослідження вказує на те, що введення карбоплатину було найважливішим чинником зменшення маси тіла, яке спостерігали в мишей, а супутнє введення пегільованої сполуки ТПО № 1 запобігало цій втраті маси, однак статистичного аналізу не проводили. Відмінності у масі тіла, які спостерігали між 7 днем (перед введенням карбоплатину) та 26 днем (закінченням дослідження), представлено на фіг. 8. Усі миші в контрольних групах мали нормальний вигляд упродовж періоду дослідження. У мишей, яким вводили тільки карбоплатин, вже на 12 день починали з'являтися зміни у зовнішньому вигляді та поведінці з частими ознаками згорбленості та неохайності. Багато мишей, яким вводили карбоплатин (з/без введення пегільованої сполуки ТПО № 1), набували згорбленого положення та виглядали неохайно протягом другої половини періоду дослідження. Очевидно, уведення пегільованої сполуки ТПО № 1 на 8 день з/без додаткового введення у день 0 затримувало появу цих симптомів, а введення у дні 0 і 8 також зменшувало їхню важкість та тривалість. Приклад 3 Спостерігали вплив пегільованої сполуки ТПО № 1 на тривалість та важкість анемії після застосування режимів дозування, за якихпегільовану сполуку ТПО № 1 вводили у різний час після введення карбоплатину. У цьому дослідженні відповідну кількість пегільованої сполуки ТПО № 1 вводили мишам черз одну (1) годину, один (1) день, чотири (4) дні після введення дози карбоплатину. Групам мишей внутрішньочеревно вводили карбоплатин або середовище (фізіологічний розчин з фосфатним буфером, PBS) у дні -1 та 0, як показано нижче. Попередньо визначили, що оптимальною дозою карбоплатину для того, щоб викликати тромбоцитопенію в мишей лінії BALB/c, є фракціонована доза 120 мг/кг, яку вводили два дні поспіль у вигляді щоденних ін'єкцій (тобто 2 × 60 мг/кг). Через годину (день 0), один день (день 1) чи чотири дні (день 4) після введення другої дози карбоплатину групам мишей вводили пегільовану сполуку ТПО № 1 (300 мкг/кг) або середовище (стерильний фізіологічний розчин, SS, 0,9 % хлорид натрію без консервантів) в/в (болюсною) ін'єкцією, як показано у Таблиці 3. Об'єм введеної дози розраховували залежно від маси тварини (100 мкл/10 г маси тіла). 13 UA 99254 C2 Таблиця 3 Групи лікування: Премедикація [2 × 60 мг/кг], (внутрішньочеревно), дні 1і0 Гр. N 1 10 Середовище (PBS) 2 20 Карбоплатин 3 20 Карбоплатин 4 20 Карбоплатин 5 20 Карбоплатин Дослідний зразок Середовище (SS) Середовище (SS) Пегільована сполука ТПО № 1 Пегільована сполука ТПО № 1 Пегільована сполука ТПО № 1 Доза (в/в) Забір крові Евт. 5 мишей на Плацебо 6 і 12 день Плацебо 6, 8, 10 і 12 дні 300 мкг/кг, день 0 6, 8, 10 і 12 дні 300 мкг/кг, день 1 6, 8, 10 і 12 дні 300 мкг/кг, день 4 6, 8, 10 і 12 дні Гр. = Група; Евт. = піддано евтаназії 5 10 15 20 25 30 35 На 6, 8, 10 та 12 день п'ять мишей із кожної групи зважували, а потім піддавали евтаназії шляхома асфіксії в атмосфері СО2 і знекровлювали пункцією серця. Зразки крові переносили в окремі мікроконтейнери з ЕДТА (корок бузкового кольору) для гематологічних досліджень. Контрольні групи мишей (5) піддавали тим самим процедурам на 6 та 12 день. Результати показано на фіг. 9-12. Дані представлено у графічній формі як групові середні +SEM. Уведення мишам тільки карбоплатину спричиняло суттєве у порівнянні з контрольними групами зменшення (приблизно на 47 %) рівнів гемоглобіну, кількості ЧКК та гематокриту в мишей, що вижили (2 миші), яке спостерігали на 12 день. Такому зменшенню запобігало введення пегільованої сполуки ТПО № 1 у день 0 (через 1 годину після введення карбоплатину) та день 1. Однак введення пегільованої сполуки пегільованого ТПО № 1 в день 4 виявилось недостатньо, щоб вплинути на викликані карбоплатином зміни вказаних параметрів еритроцитів. Миші у всіх групах, яким вводили тільки карбоплатин або карбоплатин разом із різними дозами пегільованої сполуки ТПО № 1, втрачали вагу на 6, 8, 10 та 12 дні у порівнянні з днем -1. Аналіз вимірювань маси тіла мишей за період дослідження вказує на те, що головним чинником зменшення маси тіла був карбоплатин. Очевидно, введення пегільованої сполуки ТПО № 1 у день 0, день 1 або день 4 не впливало на втрату ваги, пов'язану з уведенням карбоплатину, однак статистичного аналізу не проводили. Зменшення маси тіла, яке спостерігали між 1 та 10 днями, представлено на фіг. 11. Усі миші в контрольних групах мали нормальний вигляд упродовж періоду дослідження. У мишей, яким вводили тільки карбоплатин, вже на 2 день починали з'являтися зміни у зовнішньому вигляді та поведінці з частими ознаками згорбленості та проявами млявості. Багато мишей, яким вводили карбоплатин (з/без введення пегільованої сполуки ТПО № 1), набували згорбленого положення та виглядали млявими протягом другої половини періоду дослідження. Деякі з цих мишей мали забруднені аногенітальні ділянки. Інші нечасті симптоми включали виснажений вигляд, відвисання повік і прояви аномальної поведінки. Очевидно, уведення пегільованої сполуки ТПО № 1 не чинило значного впливу на появу, частоту або важкість цих симптомів, однак детального аналізу не проводили. Спостерігали, що запобігти анемії, спричиненій карбоплатином, можна, вводячи дози пегільованої сполуки ТПО № 1 не пізніше, ніж за 24 години після хіміотерапії. Ці дані вказують на те, що введення пегільованої сполуки ТПО № 1 має мієлопротекторний ефект, який не обмежується мегакаріоцитарною лінією. Приклад 4 Спостерігали здатність пегільованої сполуки ТПО № 1 діяти як фактор виживання клітин мегакаріоцитарної та еритроцитарної ліній у мишей, яким вводили карбоплатин; цю здатність виявляли за змінами гематологічних параметрів. У попередніх дослідженнях було виявлено, що навіть такі низькі дози пегільованої сполуки ТПО № 1, як 300 мкг/кг, запобігають анемії, 14 UA 99254 C2 5 10 викликаній карбоплатином. У даному дослідженні вивчали вплив нижчих доз пегільованої сполуки ТПО № 1 (тобто 30, 100 та 300 мкг/кг) на виживання клітин еритроцитарної лінії, щоб охарактеризувати залежність "доза-ефект" для цього впливу. Групам мишей внутрішньочеревно вводили карбоплатин або середовище (фізіологічний розчин з фосфатним буфером, PBS) у дні -1 та 0, як показано нижче. Попередньо визначили, що оптимальною дозою карбоплатину для того, щоб викликати тромбоцитопенію у мишей лінії BALB/c, є фракціонована доза у 120 мг/кг, яку вводили два дні поспіль у вигляді щоденних ін'єкцій (тобто 2 × 60 мг/кг). Приблизно через одну годину після введення другої дози карбоплатину групам мишей вводили пегільовану сполуку ТПО № 1 або середовище (стерильний фізіологічний розчин, SS, 0,9 % хлорид натрію без консервантів) в/в (болюсною) ін'єкцією, як показано у Таблиці 4. Об'єм введеної дози визначали залежно від маси тварини (100 мкл/10 г маси тіла). Таблиця 4 Групи лікування: Премедикація (внутрішньочеревно), Дні -1 і 0 Гр. N 1 10 Середовище (PBS) 2 15 Карбоплатин 3 15 Карбоплатин 4 15 Карбоплатин 5 15 Карбоплатин Дослідний зразок Середовище (SS) Середовище (SS) Пегільована сполука ТПО № 1 Пегільована сполука ТПО № 1 Пегільована сполука ТПО № 1 Доза (в/в) День 0 Плацебо Плацебо Забір крові Евт. 5 мишей на 6 та 12 день Евт. 5 мишей на 6, 8 і 12 день 30 мкг/кг Евт. 5 мишей на 6, 8 і 12 день 100 мкг/кг Евт. 5 мишей на 6, 8 і 12 день 300 мкг/кг Евт. 5 мишей на 6, 8 і 12 день Гр. = Група; Евт = піддано евтаназії 15 20 25 30 35 На 6, 8 і 12 день п'ять мишей з кожної досліджуваної групи зважували, а потім піддавали евтаназії в атмосфері СО2 і знекровлювали пункцією серця. Зразки крові переносили в окремі мікроконтейнери з ЕДТА (корок бузкового кольору) для гематологічних досліджень. Контрольні групи мишей (5) піддавали тим самим процедурам на 6 та 12 день. Результати показано на фіг. 13-14. Уведення мишам тільки карбоплатину спричиняло зменшення рівнів гемоглобіну більш ніж на 25 % на 12 день. Усі дози пегільованої сполуки ТПО № 1 повністю інгібують таке зменшення. Пегільована сполука ТПО № 1 також ефективно інгібує зменшення числа ЧКК та кількості гематокриту, спричинене введенням карбоплатину. По суті, всі миші у всіх групах, яким вводили тільки карбоплатин або карбоплатин разом з різними дозами пегільованої сполуки ТПО № 1 втрачали вагу на 6, 8 та 12 дні порівняно з днем 1. Аналіз вимірювання маси тіла мишей за 13-денний період дослідження показує, що введення тільки карбоплатину спричиняє помітне зменшення маси тіла. Очевидно, що пегільована сполука ТПО № 1 не виявляє впливу на втрату або відновлення маси тіла в цьому дослідженні. Миші, яким вводили тільки карбоплатин, почали демонструвати змінену поведінку і зовнішній вигляд на 4 день. Деякі з мишей набували згорбленого положення та виглядали млявими. У багатьох мишей також були рідкі випорожнення. Незначна кількість тварин виглядала млявою, а ще в кількох у випорожненнях була кров. Уведення пегільованої сполуки ТПО № 1 зменшувало появу, частоту та важкість цих симптомів, очевидно, дозозалежним способом. З даних про кількість тромбоцитів у периферійній крові та визначення інших гематологічних параметрів випливає, що функція пегільованої сполуки ТПО № 1 – підтримувати виживання клітин еритроцитарної лінії у мишей, яким вводили карбоплатин. Виявлено, що всі дози пегільованої сполуки ТПО № 1 на 12 день повністю усували наслідки анемії, спричиненої карбоплатином. Ці результати свідчать про неоднакову для клітин мегакаріоцитарної і 15 UA 99254 C2 5 10 еритроцитарної ліній здатність сприймати/відповідати на ефекти "підтримки виживання", викликані пегільованою сполукою ТПО № 1. ПРИКЛАД 5 Групам мишей двома циклами із проміжком у 10 днів вводили хіміотерапевтичну речовину (карбоплатин). Кожен цикл складався із двох послідовних днів уведення карбоплатину (тобто 70 мг/кг/день вводили у дні 1 і 0 та у дні 10 і 11), як показано нижче. Доза карбоплатину, використана для цих досліджень виживання, перевищувала максимально стерпну дозу (тобто 120 мг/кг; вводили по 60 мг/кг/день протягом 2 днів підряд). Через одну годину після введення другої дози карбоплатину в кожному циклі (тобто дні 0 та 11) групам мишей вводили пегільовану сполуку ТПО № 1 (100 мкг/кг) або середовище (стерильний фізіологічний розчин, SS, 0,9 % хлорид натрію без консервантів) в/в (болюсною) ін'єкцією, як показано нижче. Об'єм введеної дози розраховували в залежності від маси тварин (100 мкл/10 г маси тіла). Схема дослідження: Гр. Премедикація (внутрішньочеревно), дні -1 і 0, дні 10 і 11 N Доза (в/в) Дослідний зразок, ~ 1 год. після 2-ї дози 100 мкг/кг CBPL для кожного (в/в) циклу 1 25 30 35 плацебо, дні 0 і 11 25 Карбоплатин (70 мг/кг) Розчинник (*SS) плацебо, дні 0 і 11 3 20 Розчинник (*SS) 2 15 25 Розчинник (PBS) 25 Карбоплатин (70 мг/кг) Пегільована сполука ТПО № 1 100 мкг/кг, дні 0 і 11 Забір крові / аналіз Евт. 5 мишей на 7, 10, 18, 21 і 28 дні 7,10, 18, 21 і 28 дні 7, 10, 18, 21 і 28 дні На 7, 10, 18, 21 та 28 дні п'ять мишей з кожної дослідної групи (25 мишей/група) піддавали евтаназії шляхом асфіксії в атмосфері СО 2 і знекровлювали пункцією серця. Зразки крові переносили в окремі мікроконтейнери з ЕДТА (корок бузкового кольору) для гематологічних досліджень. Контрольні групи мишей, яким вводили лише середовище, піддавали такій самій процедурі. Результати показано на фіг. 15. Уведення мишам карбоплатину протягом двох циклів призводило до розвитку помірної анемії, яку спостерігали між 10 і 21 днями, в той час як у мишей, яким протягом двох циклів вводили карбоплатин та пегільовану сполуку ТПО № 1, значення гематокриту впродовж цього періоду були подібними до відповідних значень для контрольної групи. Цікаво, що серед не використаних для гематологічного аналізу мишей у групі, якій вводили тільки карбоплатин, 7 мишей померло між 4 та 18 днями, тоді як у групі, яка отримувала комбіновану терапію, за цей же період померла тільки 1 миша; причому більшість смертей припадала на період анемії. Ці результати свідчать про те, що спричинена карбоплатином анемія може сприяти смерті мишей, яких піддали інтенсивній хіміотерапії, і що пегільована сполука ТПО № 1 може підвищувати виживання мишей, запобігаючи розвитку анемії. Приклад 6 Для механістичних досліджень групам мишей протягом 2 днів підряд (дні -1 та 0) вводили середовище або карбоплатин, з поступовим збільшенням дози (тобто 60, 70 або 80 мг/кг). Приблизно через годину після введення другої дози карбоплатину групам мишей вводили пегільовану сполуку ТПО № 1 (100 мкг/кг) або середовища (фізіологічний розчин, SS, 0,9 % хлорид натрію без консервантів) в/в (болюсною) ін'єкцією, як показано у Таблиці 5. Таблиця 5 Схема дослідження: Гр. N 1 2 3 4 3 3 3 3 Дозування CBPL, Дні -1 і 0 (внутрішньочеревно) Середовище (PBS) Карбоплатин (60 мг/кг) Карбоплатин (70 мг/кг) Карбоплатин (80 мг/кг) Введення (в/в), день 1, 1 год. після CBPL Середовище (*SS) Середовище (*SS) Середовище (*SS) Середовище (*SS) 16 Забір крові / аналіз Евт. 3 мишей на День 15 День 15 День 15 День 15 UA 99254 C2 Продовження таблиці 5 5 15 20 25 30 35 40 45 3 Карбоплатин (70 мг/кг) 7 10 Карбоплатин (60 мг/кг) 6 5 3 3 Карбоплатин (80 мг/кг) Пегільована сполука ТПО № 1 День 15 (100 мкг/кг) Пегільована сполука ТПО № 1 День 15 (100 мкг/кг) Пегільована сполука ТПО № 1 День 15 (100 мкг/кг) На 15 день мишей у всіх дослідних групах піддали евтаназії шляхом асфіксії в атмосфері СО2 і знекровили пункцією серця. Зразки крові перенесли в окремі мікроконтейнери з ЕДТА (корок бузкового кольору) для гематологічних досліджень. Крім того, деякі органи (включаючи головний мозок) контрольних мишей та мишей, яким вводили карбоплатин 2 × 70 мг/кг з/без супутнього введення пегільованої сполуки ТПО № 1, ізолювали та піддали гістологічному дослідженню. Зрізи цих тканин досліджували імуногістохімічним методом на фібриноген/фібрин. Уведення тільки карбоплатину з поступовим підвищенням дози призводило до значного зменшення кількості тромбоцитів у мишей, які отримували 2 × 70 мг/кг на 15 день, і дозозалежного зниження показника гематокриту (НСТ) у мишей, яким вводили 60 та 70 мг/кг тільки карбоплатину. Уведення пегільованої сполуки ТПО № 1 повністю інгібувало таке зменшення кількості тромбоцитів та ЧКК, спричинене карбоплатином. Слід також зауважити, що всі миші, яким вводили 2 × 80 мг/кг лише карбоплатину, були виявлені мертвими або піддані евтаназії (були при смерті) до закінчення дослідження. Цікаво, що всі миші, яким вводили 2 × 80 мг/кг карбоплатину і пегільовану сполуку ТПО № 1, залишились живими до запланованого закінчення дослідження і не проявляли ознак тромбоцитопенії чи анемії на 15 день. Гістологічні дослідження головного мозку контрольних мишей показали дрібні кровоносні судини, які мали звичайний вигляд. Багато судин містили червоні клітини крові і характеризувались слабким забарвленням у тесті на виявлення фібриногену. Слабке внутрішньосудинне забарвлення у тесті на фібриноген/фібрин було очікуваним у контрольних мишей, оскільки фібриноген є природним компонентом плазми. Зрізи головного мозку мишей, яким вводили тільки карбоплатин (2 × 70 мг/кг), містили невеликі кровоносні судини, повністю закупорені речовиною, яка характеризувалась інтенсивним позитивним забарвленням у тесті на фібриноген/фібрин. Такі мікротромби часто спостерігали у зрізах тканин усіх мишей з групи, якій вводили дану дозу. Дрібні кровоносні судини в зрізах головного мозку мишей, яким вводили карбоплатин з пегільованою сполукою ТПО № 1, виглядали нормальними або мали трохи темніше забарвлення у тесті на фібриноген/фібрин порівняно з контрольною групою. На всю групу за даною дозою було виявлено єдиний випадок мікротромбування. Результати цього дослідження свідчать, що випадки мікротромбування спричиняє хіміотерапія, і, оскільки припускають, що мікротромби сприяють механічному лізису ЧКК, ці судинні події, ймовірно, є чинниками анемії, викликаної хіміотерапією. До того ж, здатність пегільованої сполуки ТПО № 1 запобігати розвитку таких тромботичних подій може бути складовою механізму, за допомогою якого ця речовина попереджує розвиток анемії, викликаної хіміотерапією. Нарешті, мікротромботичні події також могли спричинитись до смерті мишей, яким вводили високі хіміотерапевтичні дози. Отже, здатність пегільованої сполуки ТПО № 1 запобігати розвитку цих тромботичних подій може підвищувати виживання тварин, яким вводили високі хіміотерапевтичні дози і вказану сполуку. На фіг. 18А і 18Б показано вплив введення пегільованої сполуки ТПО № 1 на кількість тромбоцитів та гематокриту в мишей, яким вводили карбоплатин [як викладено в Прикладі 6]. На фіг. 19 показано, що введення пегільованої сполуки ТПО № 1 зменшує депонування фібриногену та утворення згустків крові в зрізах мозку мишей, яким вводили карбоплатин, як викладено в Прикладі 6. Передбачуваний механізм дії На фіг. 16 зображено гаданий механізм антианемічного впливу пегільованої сполуки ТПО № 1. Як видно з фіг. 16, хіміотерапія викликає ушкодження ендотелію дрібних кровоносних судин і пригнічує гемопоез. За відсутності пегільованої сполуки ТПО № 1 швидко розвивається тромбоцитопенія, оскільки тромбоцити у кров'яному руслі активуються зміненим ендотелієм і відкладаються на стінках дрібних кровоносних судин. Змінені тромбоцити, продуковані ушкодженим кістковим мозком, сприяють цьому процесу. Активовані тромбоцити викликають 17 UA 99254 C2 5 10 15 20 25 30 депонування фібрину на внутрішніх стінках пошкоджених судин, і розвиваються мікроангіопатичні тромби. Ці мікроангіопатичні тромби є медіаторами механічного руйнування червоних клітин крові, сприяючи розвитку анемії, спричиненої хіміотерапією. Супутнє введення пегільованої сполуки ТПО № 1 інгібує ушкодження ендотелію кровоносних судин, викликані хіміотерапією, та/або сприяє антитромботичним та профібринолітичним властивостям тромбоцитів кров'яного русла. Мікроангіопатичні тромби не утворюються, і підтримується структурна цілісність червоних клітин крові. Вплив пегільованої сполуки ТПО № 1 на клітинипопередники мегакаріоцитів у кістковому мозку сприяє продукуванню нормальних тромбоцитів. Завдяки цьому впливу підтримується гемостаз і попереджується розвиток анемії. На фіг. 17 показано деякі аспекти гаданого диференційованого впливу пегільованої сполуки ТПО № 1 на різні лінії гемопоетичних клітин. Приклад 7 Аналіз зв'язування Активність пептидних сполук можна визначити, використовуючи стандартні методи аналізу відносної інтенсивності люмінесценції. Для аналізу використовують, наприклад, рекомбінантні клітини мишей зі стабільною експресією рецептора ТПО людини і конструкції, що складається з гена-репортера люциферази, поміщеного під промотор fos. Аналіз можна виконати таким чином: приблизно протягом 18 годин позбавлені сироватки клітини Baf/3 hTPOr fos/lux, які експресують рецептор ТПО людини, c-mpl (hTPOr), і люциферазну репортерну конструкцію, піддають дії зростаючих концентрацій rhTPO або пептидної сполуки. Після цього клітини інкубують у середовищі, яке містить субстрат люциферази, і вимірюють люмінесценцію клітин за допомогою люмінометра. Як показано на фіг. 20, пегільована сполука ТПО № 1 дозозалежним способом активувала клітини Baf/3 з рекомбінантною експресією TPO-R людини. Як видно з фіг. 21, коли клітини стимулювали пегільованою сполукою ТПО № 1, то спостерігали сильнішу активацію TPO-R, ніж у випадку стимулювання тією ж концентрацією ТПО. EC50 для пегільованої сполуки ТПО № 1 складала близько 5 пікомоль. Хоча вище в деталях описано лише бажані модифікації винаходу, спеціалісти оцінять можливість застосовувати інші його модифікації та варіанти, не відступаючи від суті і запланованого об'єму винаходу. ФОРМУЛА ВИНАХОДУ 35 40 45 1. Спосіб попередження розвитку анемії після лікування, що передбачає введення суб'єкту, який потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру: І Е G P T L R Q (2-Nal) L A A R (Sar) (SEQ ID NO:5). 2. Спосіб за п. 1, який відрізняється тим, що вказане лікування вибране з групи, що складається з лікування цитотоксичними засобами, протипухлинними засобами та радіаційним опроміненням. 3. Спосіб за п. 1, який відрізняється тим, що вказана ефективна кількість складає від приблизно 1 мкг до приблизно 300 мкг/кг ваги тіла на день. 4. Спосіб лікування анемії, що передбачає стадію введення суб’єкту, що потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру: І Е G P T L R Q (2-Nal) L A A R (Sar) (SEQ ID NO:5). 5. Застосування ефективної кількості пептидної сполуки ТПО для одержання лікарського засобу для лікування анемії, причому вказана пептидна сполука ТПО містить наступну структуру: І Е G P T L R Q (2-Nal) L A A R (Sar) (SEQ ID NO:5). 6. Спосіб попередження розвитку анемії після лікування, що передбачає введення суб'єкту, який потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру: 18 UA 99254 C2 MPEG N H O H N H 2N N N H O O O O O H N OH O H N N H O O H N N H O OH HN H 2N O H N N H O H N N H O NH O H N N O N H H 2N H 2N O O H N O H N H N O O MPEG H N N H N N H 10 O N H O O NH O O NH 2 HN OH O O N H N NH O NH 2 HN OH O 5 N H N H NH H N O O H N NH 2 O HN O , де MPEG являє собою метоксиполіетиленгліколь, що має молекулярну вагу приблизно 20000 Дальтон. 7. Спосіб за п. 6, який відрізняється тим, що вказане лікування вибране з групи, що складається з лікування цитотоксичними засобами, протипухлинними засобами та радіаційним опроміненням. 8. Спосіб за п. 6, який відрізняється тим, що вказана ефективна кількість складає від приблизно 1 мкг до приблизно 300 мкг/кг ваги тіла на день. 9. Спосіб лікування анемії, що передбачає стадію введення суб’єкту, що потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру: MPEG N H O H N H 2N N N H O O O O O H N OH O H N N H O O H N N H O OH HN H 2N O H N N H O H N N H O NH O H N N O N H H 2N H 2N O O H N O H N O O MPEG H N N H N N H O O N H H N O H N O H N N H N H N H NH N O O O NH O O HN OH NH 2 O HN O NH 2 NH O O OH HN NH 2 , де MPEG являє собою метоксиполіетиленгліколь, що має молекулярну вагу приблизно 20000 Дальтон. 19 UA 99254 C2 10. Застосування ефективної кількості пептидної сполуки ТПО для одержання лікарського засобу для лікування анемії, причому вказана пептидна сполука ТПО містить наступну структуру: MPEG N H O H N H 2N N N H O O O O O H N OH O H N N H O O H N N H O OH HN H 2N O H N N H O H N N H O NH O H N N O N H H 2N H 2N O O H N O O O MPEG H N N H 10 15 20 25 30 N N H H N O O N H N H N H N H NH N O O O NH O O HN OH NH 2 NH O O 5 H N H N O O H N NH 2 O HN O OH HN NH 2 , де MPEG являє собою метоксиполіетиленгліколь, що має молекулярну вагу приблизно 20000 Дальтон. 11. Спосіб попередження розвитку анемії після лікування, що передбачає введення суб'єкту, який потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру: І Е G Р Т L R Q (2-Nal) L A A R (Sar) \ K(NH2) / І Е G Р Т L R Q (2-Nal) L A A R (Sar). 12. Спосіб за п. 11, який відрізняється тим, що вказане лікування вибране з групи, що складається з лікування цитотоксичними засобами, протипухлинними засобами та радіаційним опроміненням. 13. Спосіб за п. 11, який відрізняється тим, що вказана ефективна кількість складає від приблизно 1 мкг до приблизно 300 мкг/кг ваги тіла на день. 14. Спосіб лікування анемії, що передбачає стадію введення суб’єкту, що потребує цього, ефективної кількості пептидної сполуки ТПО, що містить наступну структуру: І Е G Р Т L R Q (2-Nal) L A A R (Sar) \ K(NH2) / І Е G Р Т L R Q (2-Nal) L A A R (Sar). 15. Застосування ефективної кількості пептидної сполуки ТПО для одержання лікарського засобу для лікування анемії, причому вказана пептидна сполука ТПО містить наступну структуру: І Е G Р Т L R Q (2-Nal) L A A R (Sar) \ K(NH2) / І Е G Р Т L R Q (2-Nal) L A A R (Sar). 20 UA 99254 C2 21 UA 99254 C2 22 UA 99254 C2 23 UA 99254 C2 24 UA 99254 C2 25 UA 99254 C2 26 UA 99254 C2 27 UA 99254 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of tpo peptide compound for treating anemia
Автори англійськоюYurkow Edward J., Makdonal'd Brayan R., Weis Jeffery K.
Назва патенту російськоюПрименение пептидного соединения тпо для лечения анемии
Автори російськоюЮрков Эдвард Дж., Макдональд Брайан Р., Уэйс Джеффри К.
МПК / Мітки
МПК: A61P 7/06, A61K 38/18
Мітки: пептидної, тпо, застосування, лікування, анемії, сполуки
Код посилання
<a href="https://ua.patents.su/34-99254-zastosuvannya-peptidno-spoluki-tpo-dlya-likuvannya-anemi.html" target="_blank" rel="follow" title="База патентів України">Застосування пептидної сполуки тпо для лікування анемії</a>
Попередній патент: Залізнична гальмівна колодка з посиленою боковиною
Наступний патент: Самохідна сільськогосподарська робоча машина
Випадковий патент: Спосіб лікування вперше виявленого деструктивного туберкульозу легень












