Спосіб одержання похідних 3-[4-[2-(феноксазин-10-іл)метокси]феніл]пропіонової кислоти (варіанти) та проміжні сполуки для їх отримання
Номер патенту: 60386
Опубліковано: 15.10.2003
Автори: Потлапаллі Раджендер Кумар, Маміллапаллі Рамабхадра Сарма, Сіріпрагада Махендер Рао, Чебійям Прабхакар, Гаддам Ом Редді, Батчу Чандра Секхар
Формула / Реферат
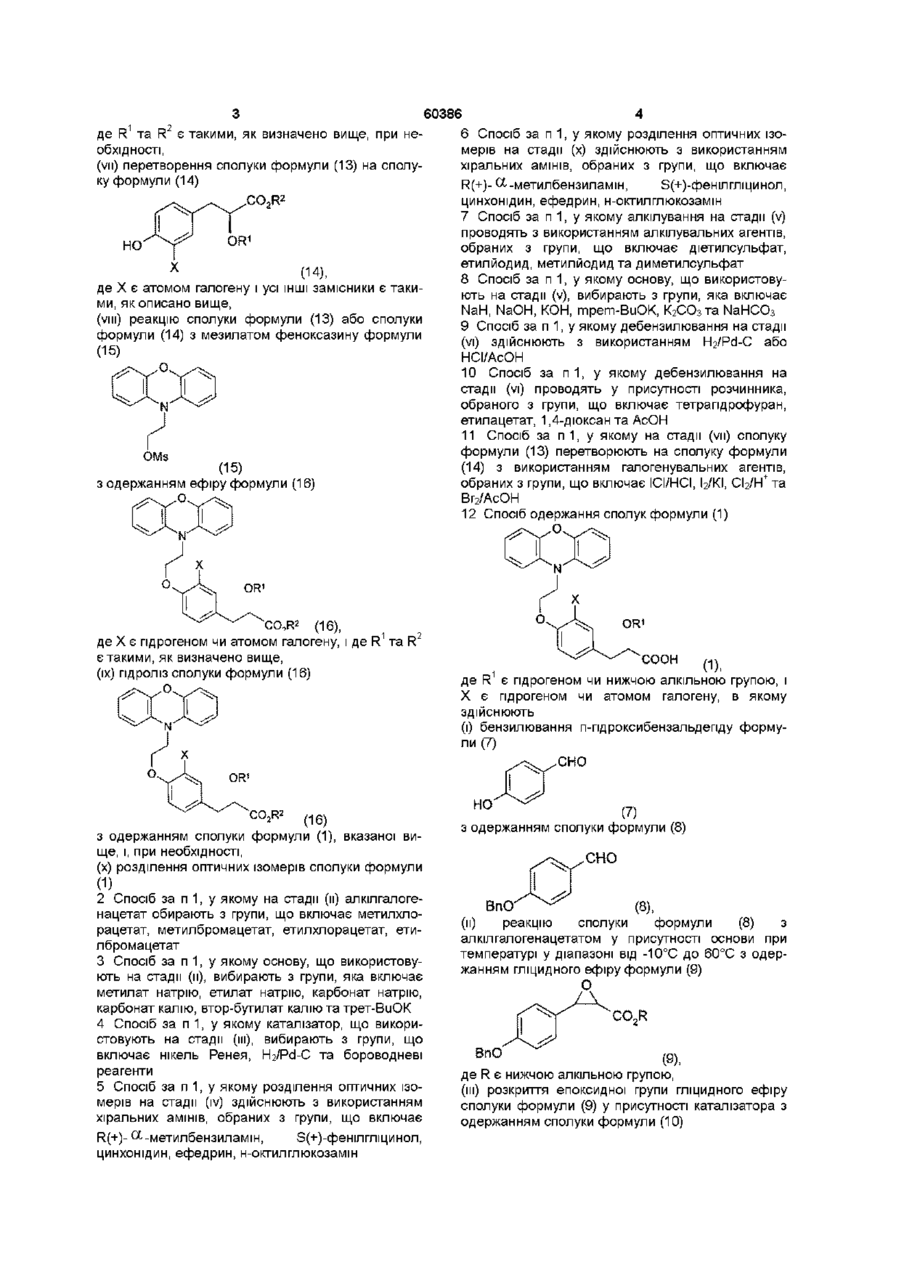
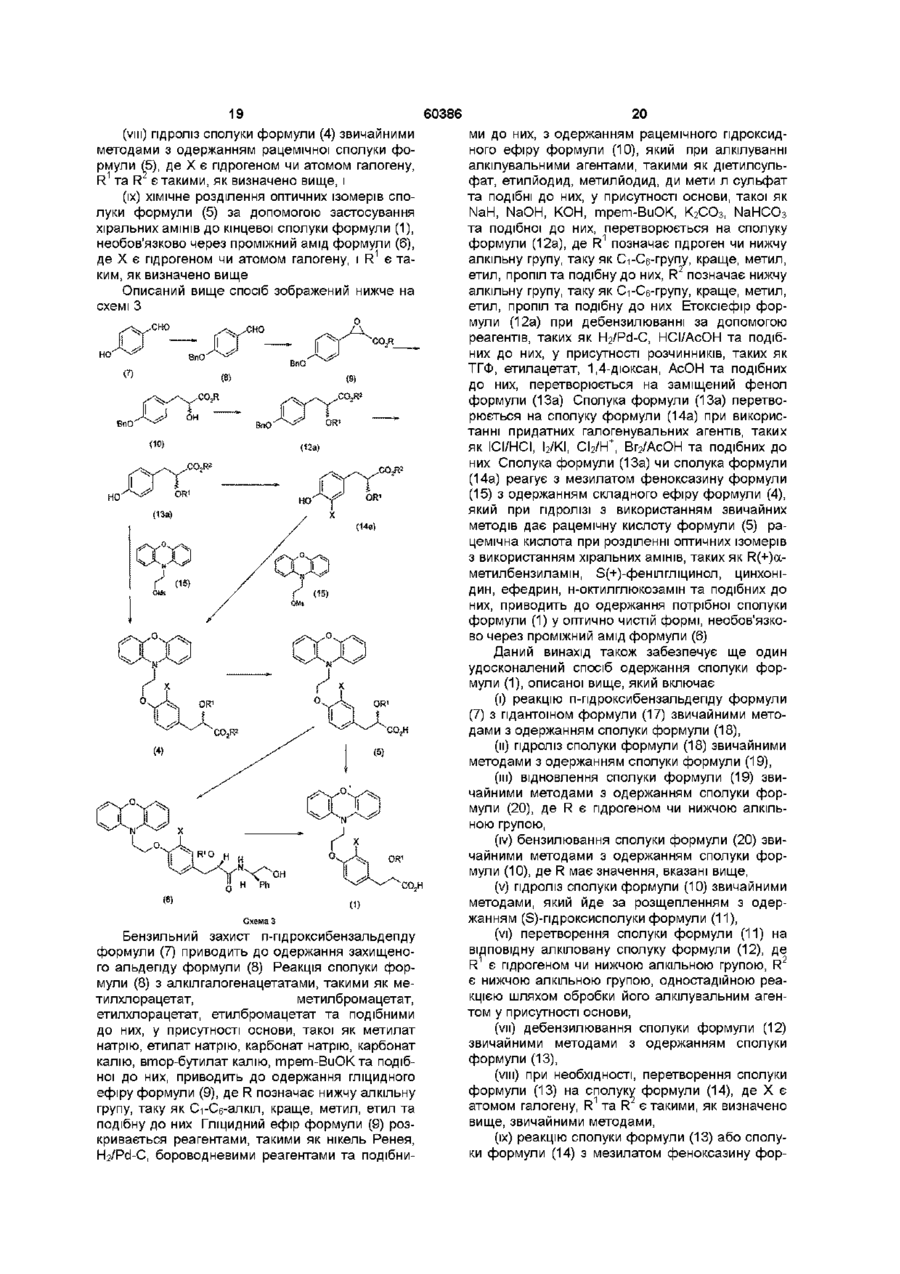
1. Спосіб одержання сполуки формули (1)
(1),
де R1 є гідрогеном чи нижчою алкільною групою, і Х є гідрогеном чи атомом галогену, в якому здійснюють:
(і) бензилювання п-гідроксибензальдегіду формули (7)
(7)
з одержанням сполуки формули (8)
(8),
(іі) реакцію сполуки формули (8) з алкілгалогенацетатом у присутності основи при температурі у діапазоні від -10°С до 60°С з одержанням гліцидного ефіру формули (9)
(9),
де R є нижчою алкільною групою,
(ііі) розкриття епоксидної групи гліцидного ефіру сполуки (9) у присутності
каталізатора з одержанням сполуки формули (10)
(10),
де R є таким, як описано вище,
(iv) гідроліз сполуки формули (10), який йде за розділенням оптичних ізомерів
одержаної сполуки з одержанням (S)-гідроксисполуки формули (11)
(11),
(v) перетворення сполуки формули (11) у присутності основи з одержанням сполуки формули (12)
(12),
де R1 є гідрогеном чи нижчим алкілом, і R2 є нижчою алкільною групою,
(vi) дебензилювання сполуки формули (12) з одержанням сполуки формули (13)
(13),
де R1 та R2 є такими, як визначено вище, при необхідності,
(vii) перетворення сполуки формули (13) на сполуку формули (14)
(14),
де Х є атомом галогену і усі інші замісники є такими, як описано вище,
(viii) реакцію сполуки формули (13) або сполуки формули (14) з мезилатом феноксазину формули (15)
(15)
з одержанням ефіру формули (16)
(16),
де Х є гідрогеном чи атомом галогену, і де R1 та R2 є такими, як визначено вище,
(іх) гідроліз сполуки формули (16)
(16)
з одержанням сполуки формули (1), вказаної вище, і, при необхідності,
(х) розділення оптичних ізомерів сполуки формули (1).
2. Спосіб за п.1, у якому на стадії (іі) алкілгалогенацетат обирають з групи, що включає метилхлорацетат, метилбромацетат, етилхлорацетат, етилбромацетат.
3. Спосіб за п.1, у якому основу, що використовують на стадії (іі), вибирають з групи, яка включає метилат натрію, етилат натрію, карбонат натрію, карбонат калію, втор-бутилат калію та трет-ВuОК.
4. Спосіб за п.1, у якому каталізатор, що використовують на стадії (ііі), вибирають з групи, що включає нікель Ренея, H2/Pd-C та бороводневі реагенти.
5. Спосіб за п.1, у якому розділення оптичних ізомерів на стадії (iv) здійснюють з використанням хіральних амінів, обраних з групи, що включає R(+)--метилбензиламін, S(+)-фенілгліцинол, цинхонідин, ефедрин, н-октилглюкозамін.
6. Спосіб за п.1, у якому розділення оптичних ізомерів на стадії (х) здійснюють з використанням хіральних амінів, обраних з групи, що включає R(+)--метилбензиламін, S(+)-фенілгліцинол, цинхонідин, ефедрин, н-октилглюкозамін.
7. Спосіб за п.1, у якому алкілування на стадії (v) проводять з використанням алкілувальних агентів, обраних з групи, що включає діетилсульфат, етилйодид, метилйодид та диметилсульфат.
8. Спосіб за п.1, у якому основу, що використовують на стадії (v), вибирають з групи, яка включає NaH, NaOH, КОН, mpem-BuOK, К2СО3 та NaHCO3.
9. Спосіб за п.1, у якому дебензилювання на стадії (vi) здійснюють з використанням H2/Pd-C або НСl/АсОН.
10. Спосіб за п.1, у якому дебензилювання на стадії (vi) проводять у присутності розчинника, обраного з групи, що включає тетрагідрофуран, етилацетат, 1,4-діоксан та АсОН.
11. Спосіб за п.1, у якому на стадії (vii) сполуку формули (13) перетворюють на сполуку формули (14) з використанням галогенувальних агентів, обраних з групи, що включає ІСl/НСl, І2/КІ, Сl2/Н+ та Вr2/АсОН.
12. Спосіб одержання сполук формули (1)
(1),
де R1 є гідрогеном чи нижчою алкільною групою, і Х є гідрогеном чи атомом галогену, в якому здійснюють:
(і) бензилювання п-гідроксибензальдегіду формули (7)
(7)
з одержанням сполуки формули (8)
(8),
(іі) реакцію сполуки формули (8) з алкілгалогенацетатом у присутності основи при температурі у діапазоні від -10°С до 60°С з одержанням гліцидного ефіру формули (9)
(9),
де R є нижчою алкільною групою,
(ііі) розкриття епоксидної групи гліцидного ефіру сполуки формули (9) у присутності каталізатора з одержанням сполуки формули (10)
(10),
де R є таким, як описано вище,
(iv) алкілування сполуки формули (10) у присутності основи з одержанням сполуки формули (12а)
(12a),
де R1 є гідрогеном чи нижчим алкілом, і R2 є нижчою алкільною групою,
(v) дебензилювання сполуки формули (12а) з одержанням сполуки формули (13а)
(13a),
де R1 та R2 є такими, як визначено вище, при необхідності,
(vi) перетворення сполуки формули (13а) на сполуку формули (14а)
(14a),
де Х є атомом галогену, і R1 та R2 є такими, як визначено вище,
(vii) реакцію сполуки формули (13а) або сполуки формули (14а) з мезилатом феноксазину формули (15)
(15)
з одержанням сполуки формули (4)
(4),
де Х є гідрогеном чи атомом галогену, і де R1 та R2 є такими, як визначено вище,
(viii) гідроліз сполуки формули (4) з одержанням рацемічної сполуки формули (5)
(5),
де Х є гідрогеном чи атомом галогену, R1 та R2 є такими, як визначено вище,
(iх) хімічне розділення оптичних ізомерів сполуки формули (5) з одержанням сполуки формули (1), необов'язково через проміжний амід формули (6)
(6),
де Х є гідрогеном чи атомом галогену, і R1 є таким, як визначено вище.
13. Спосіб за п.12, у якому алкілгалогенацетат вибирають з групи, що включає метилхлорацетат, метилбромацетат, етилхлорацетат та етилбромацетат.
14. Спосіб за п.12, у якому основу, що використовують на стадії (іі), вибирають з групи, яка включає метилат натрію, етилат натрію, карбонат натрію, карбонат калію, втор-бутилат калію та трет-BuOK.
15. Спосіб за п.12, у якому каталізатор, що використовують на стадії (ііі), вибирають з групи, яка включає нікель Ренея, H2/Pd-C та бороводневі реагенти.
16. Спосіб за п.12, у якому алкілування на стадії (iv) проводять з використанням
алкілувальних агентів, обраних з групи, що включає діетилсульфат, етилйодид, метилйодид та диметилсульфат.
17. Спосіб за п.12, у якому основу, що використовують на стадії (iv), вибирають з групи, яка включає NaH, NaOH, КОН, тpeт-BuOK, К2СО3 та NаНСО3.
18. Спосіб за п.12, у якому дебензилювання на стадії (v) здійснюють з використанням H2/Pd-C або НСl/АсОН.
19. Спосіб за п.12, у якому дебензилювання на стадії (v) проводять у присутності розчинника, обраного з групи, що включає тетрагідрофуран, етилацетат, 1,4-діоксан та АсОН.
20. Спосіб за п.1, у якому на стадії (vii) сполуку формули (13) перетворюють на сполуку формули (14) з використанням галогенувальних агентів, вибраних з групи, що включає ІСІ/НСl, І2/КІ, Сl2/H+ та Вr2/АсОН.
21. Спосіб за п.12, у якому розділення оптичних ізомерів на стадії (іх) здійснюють з використанням хіральних амінів, вибраних з групи, що включає R(+)--метилбензиламін, S(+)-фенілгліцинол, цинхонідин, ефедрин, н-октилглюкозамін.
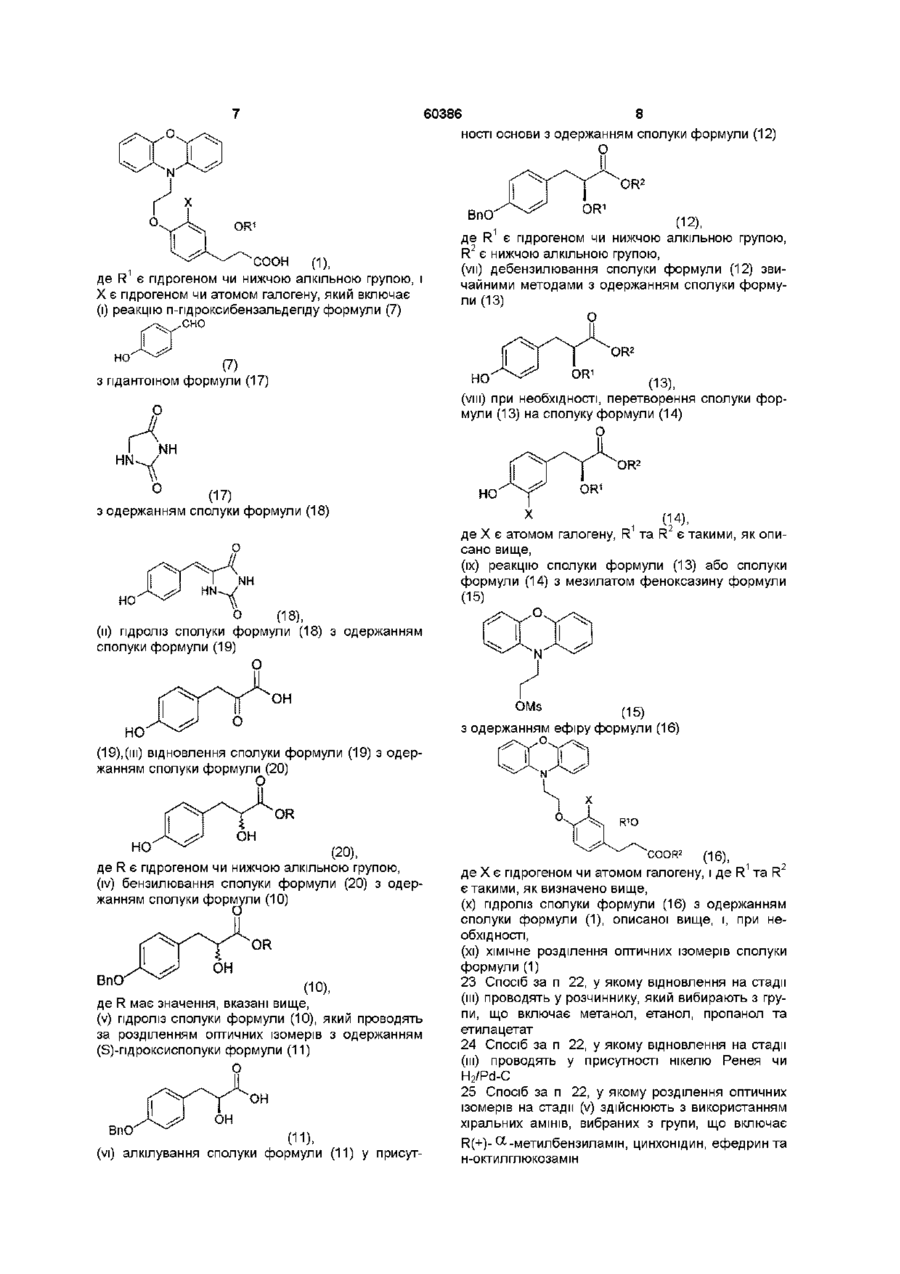
22. Спосіб одержання сполуки формули (1)
(1),
де R1 є гідрогеном чи нижчою алкільною групою, і Х є гідрогеном чи атомом галогену, який включає:
(і) реакцію п-гідроксибензальдегіду формули (7)
(7)
з гідантоїном формули (17)
(17)
з одержанням сполуки формули (18)
(18),
(іі) гідроліз сполуки формули (18) з одержанням сполуки формули (19)
(19),
(ііі) відновлення сполуки формули (19) з одержанням сполуки формули (20)
(20),
де R є гідрогеном чи нижчою алкільною групою,
(iv) бензилювання сполуки формули (20) з одержанням сполуки формули (10)
(10),
де R має значення, вказані вище,
(v) гідроліз сполуки формули (10), який проводять за розділенням оптичних ізомерів з одержанням (S)-гідроксисполуки формули (11)
(11),
(vi) алкілування сполуки формули (11) у присутності основи з одержанням сполуки формули (12)
(12),
де R1 є гідрогеном чи нижчою алкільною групою, R2 є нижчою алкільною групою,
(vii) дебензилювання сполуки формули (12) звичайними методами з одержанням сполуки формули (13)
(13),
(viii) при необхідності, перетворення сполуки формули (13) на сполуку формули (14)
(14),
де Х є атомом галогену, R1 та R2 є такими, як описано вище,
(іх) реакцію сполуки формули (13) або сполуки формули (14) з мезилатом феноксазину формули (15)
(15)
з одержанням ефіру формули (16)
(16),
де Х є гідрогеном чи атомом галогену, і де R1 та R2 є такими, як визначено вище,
(х) гідроліз сполуки формули (16) з одержанням сполуки формули (1), описаної вище, і, при необхідності,
(хі) хімічне розділення оптичних ізомерів сполуки формули (1).
23. Спосіб за п. 22, у якому відновлення на стадії (ііі) проводять у розчиннику, який вибирають з групи, що включає метанол, етанол, пропанол та етилацетат.
24. Спосіб за п. 22, у якому відновлення на стадії (ііі) проводять у присутності нікелю Ренея чи H2/Pd-C.
25. Спосіб за п. 22, у якому розділення оптичних ізомерів на стадії (v) здійснюють з використанням хіральних амінів, вибраних з групи, що включає R(+)--метилбензиламін, цинхонідин, ефедрин та н-октилглюкозамін.
26. Спосіб за п. 22, у якому розділення оптичних ізомерів на стадії (хі) здійснюють з використанням хіральних амінів, вибраних з групи, що включає R(+)--метилбензиламін, S(+)-фенілгліцинол, цинхонідин, ефедрин та н-октилглюкозамін.
27. Спосіб за п. 22, у якому алкілування на стадії (vi) проводять з використанням алкілувальних агентів, вибраних з групи, що включає діетилсульфат, етилйодид, метилйодид та диметилсульфат.
28. Спосіб за п. 22, у якому основу, що використовують на стадії (vi), вибирають з групи, яка включає NaH, NaOH, КОН, трет-BuOK, К2СО3 та NаНСО3.
29. Спосіб за п. 22, у якому дебензилювання на стадії, (vii) здійснюють з використанням H2/Pd-C або НСl/АсОН.
30. Спосіб за п. 22, у якому дебензилювання на стадії (vii) проводять у присутності розчинника, вибраного з групи, що включає тетрагідрофуран, етилацетат, 1,4-діоксан та АсОН.
31. Спосіб за п. 22, у якому перетворення на стадії (viii) проводять з використанням галогенувальних агентів, вибраних з групи, що включає ІСl/НСІ, І2/КІ, Сl2/H+ та Вr2/АсОН.
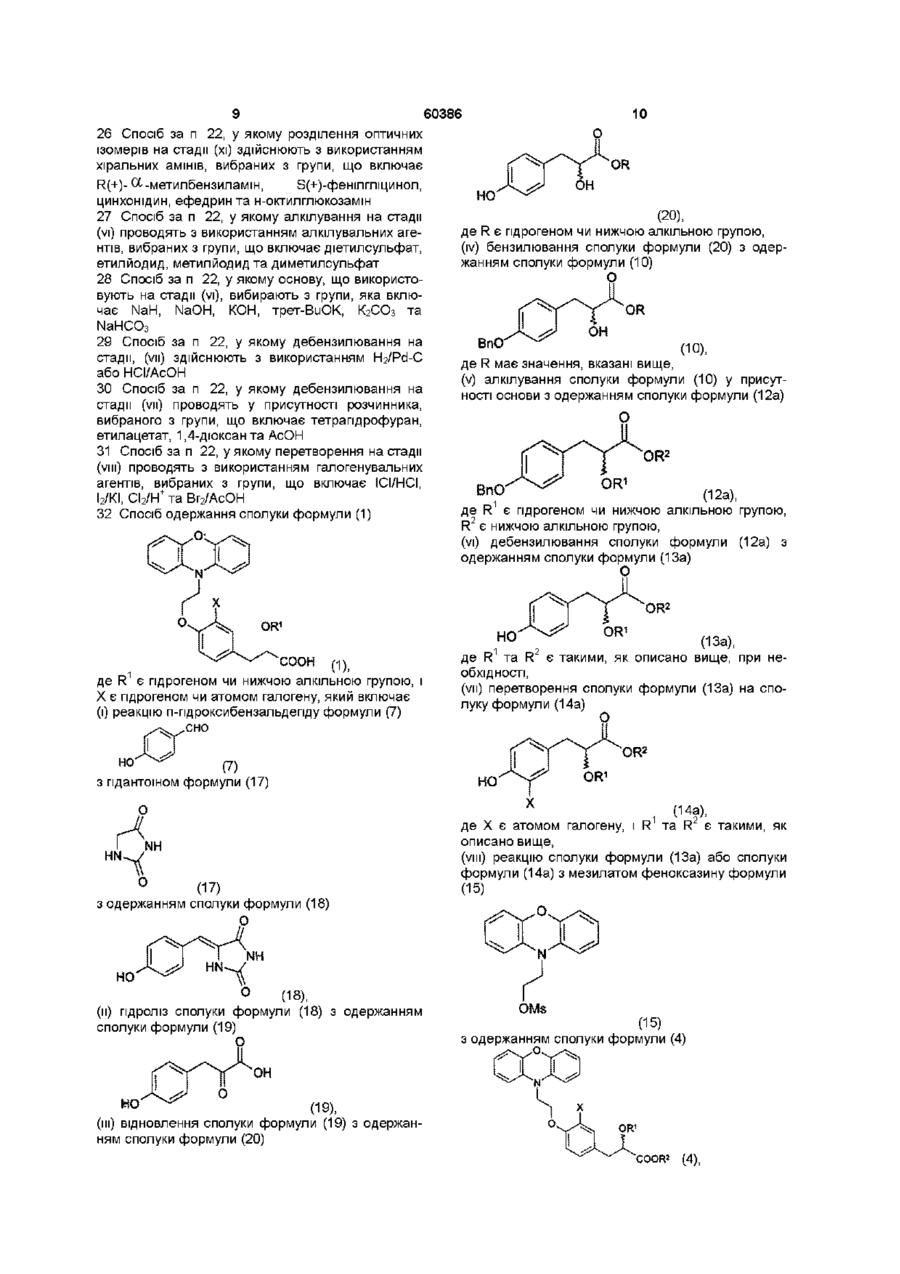
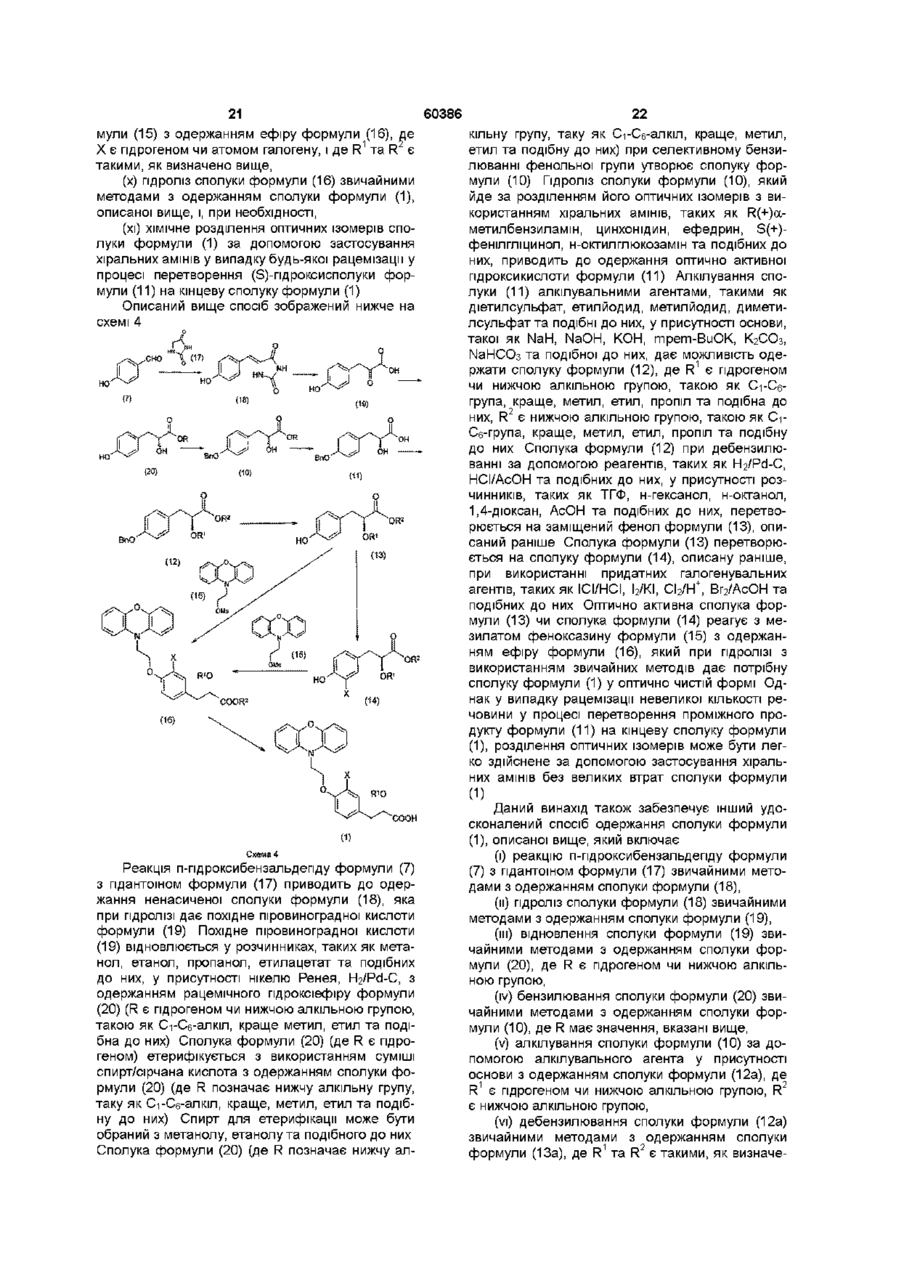
32. Спосіб одержання сполуки формули (1)
(1),
де R1 є гідрогеном чи нижчою алкільною групою, і Х є гідрогеном чи атомом галогену, який включає:
(і) реакцію п-гідроксибензальдегіду формули (7)
(7)
з гідантоїном формули (17)
(17)
з одержанням сполуки формули (18)
(18),
(іі) гідроліз сполуки формули (18) з одержанням сполуки формули (19)
(19),
(ііі) відновлення сполуки формули (19) з одержанням сполуки формули (20)
(20),
де R є гідрогеном чи нижчою алкільною групою,
(iv) бензилювання сполуки формули (20) з одержанням сполуки формули (10)
(10),
де R має значення, вказані вище,
(v) алкілування сполуки формули (10) у присутності основи з одержанням сполуки формули (12а)
(12a),
де R1 є гідрогеном чи нижчою алкільною групою, R2 є нижчою алкільною групою,
(vi) дебензилювання сполуки формули (12а) з одержанням сполуки формули (13а)
(13a),
де R1 та R2 є такими, як описано вище, при необхідності,
(vii) перетворення сполуки формули (13а) на сполуку формули (14а)
(14a),
де Х є атомом галогену, і R1 та R2 є такими, як описано вище,
(viii) реакцію сполуки формули (13а) або сполуки формули (14а) з мезилатом феноксазину формули (15)
(15)
з одержанням сполуки формули (4)
(4),
де Х є гідрогеном чи атомом галогену, і де R1 та R2 є такими, як визначено вище,
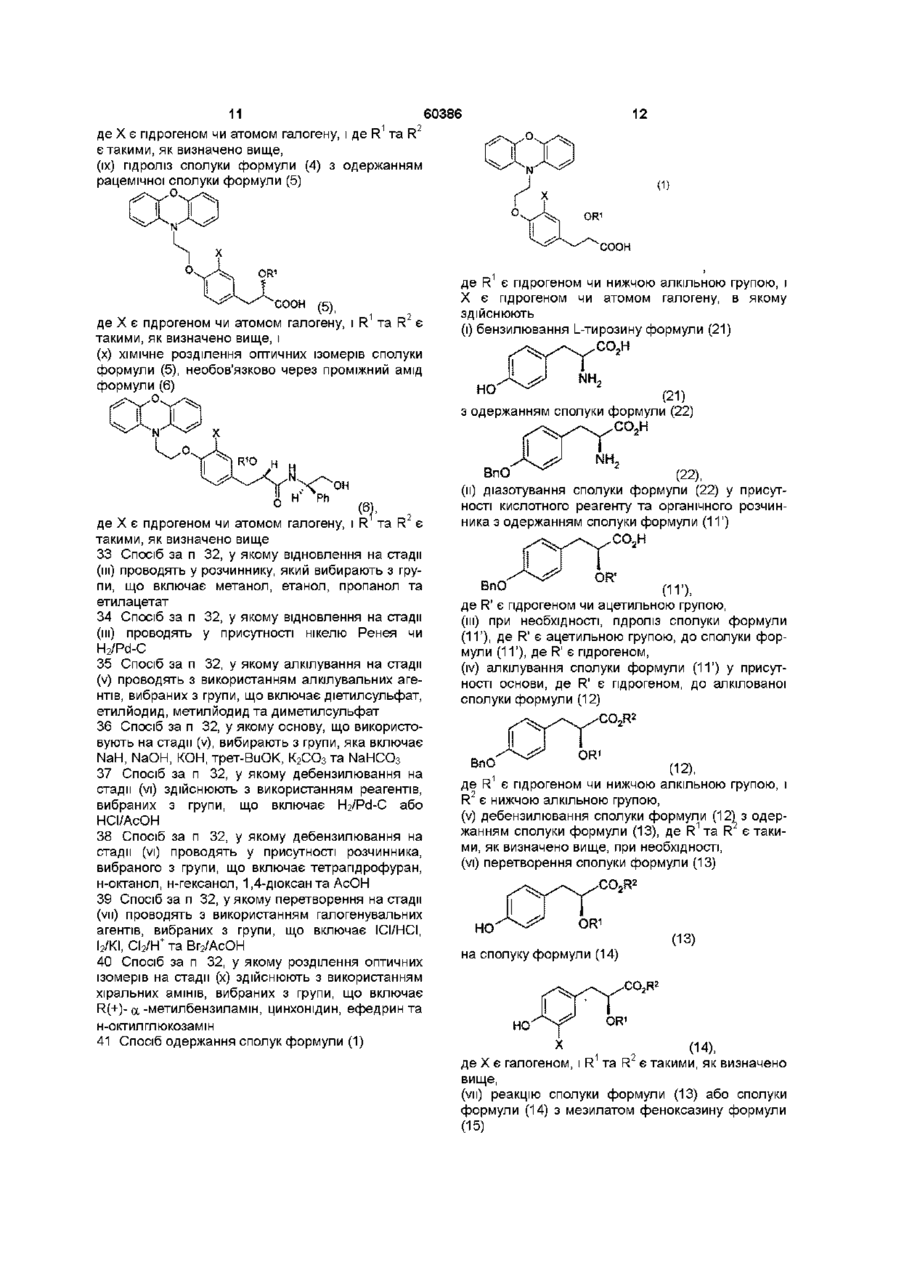
(іх) гідроліз сполуки формули (4) з одержанням рацемічної сполуки формули (5)
(5),
де Х є гідрогеном чи атомом галогену, і R1 та R2 є такими, як визначено вище, і
(х) хімічне розділення оптичних ізомерів сполуки формули (5), необов'язково через проміжний амід формули (6)
(6),
де Х є гідрогеном чи атомом галогену, і R1 та R2 є такими, як визначено вище.
33. Спосіб за п. 32, у якому відновлення на стадії (ііі) проводять у розчиннику, який вибирають з групи, що включає метанол, етанол, пропанол та етилацетат.
34. Спосіб за п. 32, у якому відновлення на стадії (ііі) проводять у присутності нікелю Ренея чи H2/Pd-C.
35. Спосіб за п. 32, у якому алкілування на стадії (v) проводять з використанням алкілувальних агентів, вибраних з групи, що включає діетилсульфат, етилйодид, метилйодид та диметилсульфат.
36. Спосіб за п. 32, у якому основу, що використовують на стадії (v), вибирають з групи, яка включає NaH, NaOH, КОН, трет-BuOK, К2СО3 та NaHCO3.
37. Спосіб за п. 32, у якому дебензилювання на стадії (vi) здійснюють з використанням реагентів, вибраних з групи, що включає H2/Pd-C або НСl/АсОН.
38. Спосіб за п. 32, у якому дебензилювання на стадії (vi) проводять у присутності розчинника, вибраного з групи, що включає тетрагідрофуран, н-октанол, н-гексанол, 1,4-діоксан та АсОН.
39. Спосіб за п. 32, у якому перетворення на стадії (vii) проводять з використанням галогенувальних агентів, вибраних з групи, що включає ІСІ/НСl, І2/КІ, Cl2/H+ та Вr2/АсОН.
40. Спосіб за п. 32, у якому розділення оптичних ізомерів на стадії (х) здійснюють з використанням хіральних амінів, вибраних з групи, що включає R(+)--метилбензиламін, цинхонідин, ефедрин та н-октилглюкозамін.
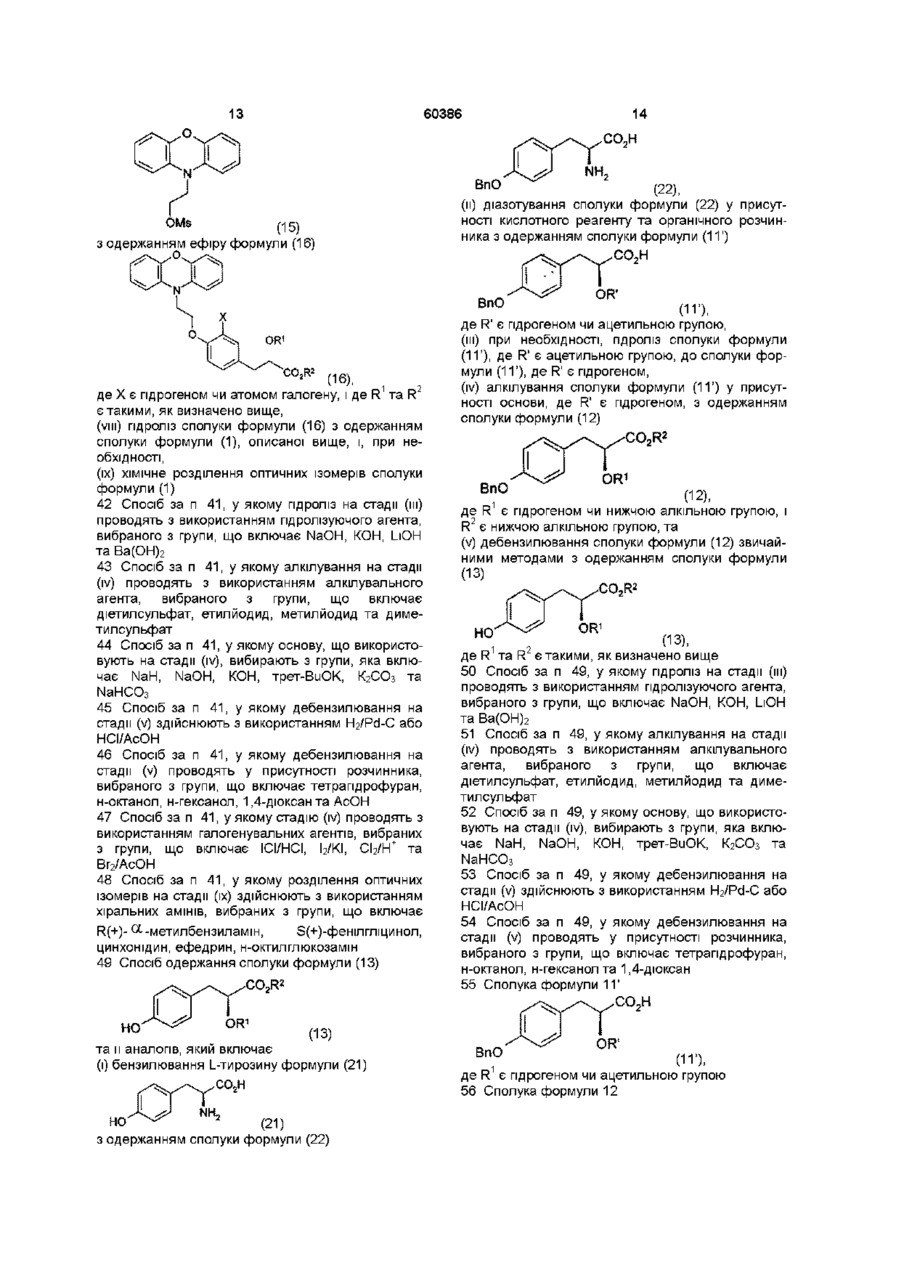
41. Спосіб одержання сполук формули (1)
,
де R1 є гідрогеном чи нижчою алкільною групою, і Х є гідрогеном чи атомом галогену, в якому здійснюють:
(і) бензилювання L-тирозину формули (21)
(21)
з одержанням сполуки формули (22)
(22),
(іі) діазотування сполуки формули (22) у присутності кислотного реагенту та органічного розчинника з одержанням сполуки формули (11’)
(11’),
де R' є гідрогеном чи ацетильною групою,
(ііі) при необхідності, гідроліз сполуки формули (11’), де R' є ацетильною групою, до сполуки формули (11’), де R' є гідрогеном,
(iv) алкілування сполуки формули (11’) у присутності основи, де R' є гідрогеном, до алкілованої сполуки формули (12)
(12),
де R1 є гідрогеном чи нижчою алкільною групою, і R2 є нижчою алкільною групою,
(v) дебензилювання сполуки формули (12) з одержанням сполуки формули (13), де R1 та R2 є такими, як визначено вище, при необхідності,
(vi) перетворення сполуки формули (13)
(13)
на сполуку формули (14)
(14),
де X є галогеном, і R1 та R2 є такими, як визначено вище,
(vii) реакцію сполуки формули (13) або сполуки формули (14) з мезилатом феноксазину формули (15)
(15)
з одержанням ефіру формули (16)
(16),
де Х є гідрогеном чи атомом галогену, і де R1 та R2 є такими, як визначено вище,
(viii) гідроліз сполуки формули (16) з одержанням сполуки формули (1), описаної вище, і, при необхідності,
(іх) хімічне розділення оптичних ізомерів сполуки формули (1).
42. Спосіб за п. 41, у якому гідроліз на стадії (ііі) проводять з використанням гідролізуючого агента, вибраного з групи, що включає NаОН, КОН, LiOH та Ba(OH)2.
43. Спосіб за п. 41, у якому алкілування на стадії (iv) проводять з використанням алкілувального агента, вибраного з групи, що включає діетилсульфат, етилйодид, метилйодид та диметилсульфат.
44. Спосіб за п. 41, у якому основу, що використовують на стадії (iv), вибирають з групи, яка включає NaH, NaOH, КОН, трет-BuOK, К2СО3 та NаНСО3.
45. Спосіб за п. 41, у якому дебензилювання на стадії (v) здійснюють з використанням H2/Pd-C або НСl/АсОН.
46. Спосіб за п. 41, у якому дебензилювання на стадії (v) проводять у присутності розчинника, вибраного з групи, що включає тетрагідрофуран, н-октанол, н-гексанол, 1,4-діоксан та АсОН.
47. Спосіб за п. 41, у якому стадію (iv) проводять з використанням галогенувальних агентів, вибраних з групи, що включає ІСl/НСl, I2/KI, Cl2/H+ та Вr2/АсОН.
48. Спосіб за п. 41, у якому розділення оптичних ізомерів на стадії (іх) здійснюють з використанням хіральних амінів, вибраних з групи, що включає R(+)--метилбензиламін, S(+)-фенілгліцинол, цинхонідин, ефедрин, н-октилглюкозамін.
49. Спосіб одержання сполуки формули (13)
(13)
та її аналогів, який включає:
(і) бензилювання L-тирозину формули (21)
(21)
з одержанням сполуки формули (22)
(22),
(іі) діазотування сполуки формули (22) у присутності кислотного реагенту та органічного розчинника з одержанням сполуки формули (11')
(11’),
де R' є гідрогеном чи ацетильною групою,
(ііі) при необхідності, гідроліз сполуки формули (11’), де R' є ацетильною групою, до сполуки формули (11’), де R' є гідрогеном,
(iv) алкілування сполуки формули (11’) у присутності основи, де R' є гідрогеном, з одержанням сполуки формули (12)
(12),
де R1 є гідрогеном чи нижчою алкільною групою, і R2 є нижчою алкільною групою, та
(v) дебензилювання сполуки формули (12) звичайними методами з одержанням сполуки формули (13)
(13),
де R1 та R2 є такими, як визначено вище.
50. Спосіб за п. 49, у якому гідроліз на стадії (ііі) проводять з використанням гідролізуючого агента, вибраного з групи, що включає NaOH, КОН, LiOH та Ва(ОН)2.
51. Спосіб за п. 49, у якому алкілування на стадії (iv) проводять з використанням алкілувального агента, вибраного з групи, що включає діетилсульфат, етилйодид, метилйодид та диметилсульфат.
52. Спосіб за п. 49, у якому основу, що використовують на стадії (iv), вибирають з групи, яка включає NaH, NaOH, КОН, трет-BuOK, К2СО3 та NаНСО3.
53. Спосіб за п. 49, у якому дебензилювання на стадії (v) здійснюють з використанням H2/Pd-C або HCl/AcOH.
54. Спосіб за п. 49, у якому дебензилювання на стадії (v) проводять у присутності розчинника, вибраного з групи, що включає тетрагідрофуран, н-октанол, н-гексанол та 1,4-діоксан.
55. Сполука формули 11'
(11’),
де R1 є гідрогеном чи ацетильною групою.
56. Сполука формули 12
(12),
де R1 є гідрогеном чи нижчою алкільною групою, і R2 є нижчою алкільною групою.
57. Сполука формули 14
(14),
де R1 є гідрогеном чи нижчою алкільною групою, і R2 є нижчою алкільною групою, і Х є атомом галогену.
58. Сполука за пп. 56 чи 57, де R1 є С1-С6-алкілом.
59. Сполука за пп. 56 чи 57, де R2 є С1-С6-алкілом.
Текст
1 Спосіб одержання сполуки формули (1) .0. СНО ВпО (8)] (м) реакцію сполуки формули (8) з алкіл гал о ге нацетатом у присутності основи при температурі у діапазоні від -10°С до 60°С з одержанням гліцидного ефіру формули (9) О ВпО (9), де R є нижчою алкільною групою, (їм) розкриття епоксидної групи гліцидного ефіру сполуки (9) у присутності каталізатора з одержанням сполуки формули (10) CO.R ВпО де R є таким, як описано вище, (iv) гідроліз сполуки формули (10), який йде за розділенням оптичних ізомерів одержаної сполуки з одержанням (S)пдроксисполуки формули (11) о (О 00 со о (О СООН (1) ] де R1 є гідрогеном чи нижчою алкільною групою, і X є гідрогеном чи атомом галогену, в якому ЗДІЙСНЮЮТЬ (і) бензилювання п-пдроксибензальдепду формули (7) ХНО ВпО (v) перетворення сполуки формули (11) у присутності основи з одержанням сполуки формули (12) ,CO,R2 ВпО 0 R 1 (), де R1 є гідрогеном чи нижчим алкілом, і R2 є нижчою алкільною групою, (vi) дебензилювання сполуки формули (12) з одержанням сполуки формули (13) U) з одержанням сполуки формули (8) OR1 (13), 60386 де R1 та R2 є такими, як визначено вище, при необхідності, (VII) перетворення сполуки формули (13) на сполуку формули (14) соя2 1 O R (14), де X є атомом галогену і усі ІНШІ замісники є такими, як описано вище, (VIM) реакцію сполуки формули (13) або сполуки формули (14) з мезилатом феноксазину формули (15) Os M (15) з одержанням ефіру формули (16) -О. (16), де X є гідрогеном чи атомом галогену, і де R1 та R2 є такими, як визначено вище, (їх) гідроліз сполуки формули (16) 6 Спосіб за п 1, у якому розділення оптичних ізомерів на стадії (х) здійснюють з використанням хіральних амінів, обраних з групи, що включає R(+). Ct-метилбензиламін, 3(+)-фенілгліцинол, цинхонідин, ефедрин, н-октилглюкозамш 7 Спосіб за п 1, у якому алкілування на стадії (v) проводять з використанням алкілувальних агентів, обраних з групи, що включає дієти л сульфат, етилйодид, метилйодид та диметилсульфат 8 Спосіб за п 1, у якому основу, що використовують на стадії (v), вибирають з групи, яка включає NaH, NaOH, КОН, mpem-BuOK, К 2 С 0 3 т а NaHCO 3 9 Спосіб за п 1, у якому дебензилювання на стадії (vi) здійснюють з використанням b^/Pd-C або НСІ/АсОН 10 Спосіб за п 1 , у якому дебензилювання на стадії (vi) проводять у присутності розчинника, обраного з групи, що включає тетрапдрофуран, етилацетат, 1,4-дюксан та АсОН 11 Спосіб за п 1, у якому на стадії (vn) сполуку формули (13) перетворюють на сполуку формули (14) з використанням галогенувальних агентів, обраних з групи, що включає ІСІ/НСІ, Ь/КІ, СЬ/Н + та Вг 2 /АсОН 12 Спосіб одержання сполук формули (1) .О. OR1 СООН (1), де R є гідрогеном чи нижчою алкільною групою, і X є гідрогеном чи атомом галогену, в якому 1 ЗДІЙСНЮЮТЬ (і) бензилювання п-пдроксибензальдепду ли (7) форму .СНО CO,R2 (16) з одержанням сполуки формули (1), вказаної вище, і, при необхідності, (х) розділення оптичних ізомерів сполуки формули (1) 2 Спосіб за п 1, у якому на стадії (м) алкілгалогенацетат обирають з групи, що включає метилхлорацетат, метил б ром ацетат, етил хлорацетат, етилбромацетат 3 Спосіб за п 1, у якому основу, що використовують на стадії (м), вибирають з групи, яка включає метилат натрію, етилат натрію, карбонат натрію, карбонат калію, втор-бутилат калію та трет-ВиОК 4 Спосіб за п 1, у якому каталізатор, що використовують на стадії (мі), вибирають з групи, що включає нікель Ренея, b^/Pd-C та бороводневі реагенти 5 Спосіб за п 1, у якому розділення оптичних ізомерів на стадії (iv) здійснюють з використанням хіральних амінів, обраних з групи, що включає R(+). Ct-метилбензиламін, 3(+)-фенілгліцинол, цинхонідин, ефедрин, н-октилглюкозамш U) з одержанням сполуки формули (8) ВпСГ v (8), (м) реакцію сполуки формули (8) з алкілгалогенацетатом у присутності основи при температурі у діапазоні від -10°С до 60°С з одержанням гліцидного ефіру формули (9) О CO2R БпО (9), де R є нижчою алкільною групою, (їм) розкриття епоксидної групи гліцидного ефіру сполуки формули (9) у присутності каталізатора з одержанням сполуки формули (10) 60386 BnO (Ю), де R є таким, як описано вище, (iv) алкілування сполуки формули (10) у присутності основи з одержанням сполуки формули (12а) О QR2 OR1 ВпО" ~ — (12а), 1 2 де R є гідрогеном чи нижчим алкілом, і R є нижчою алкільною групою, (v) дебензилювання сполуки формули (12а) з одержанням сполуки формули (13а) О OR2 OR і 1 ( 1 3 а ) 2 ' де R та R є такими, як визначено вище, при необхідності, (vi) перетворення сполуки формули (13а) на сполуку формули (14а) О OR2 OR1 (14а), де X є атомом галогену, і R1 та R2 є такими, як визначено вище, (VII) реакцію сполуки формули (13а) або сполуки формули (14а) з мезилатом феноксазину формули (15) -О. OMs (15) з одержанням сполуки формули (4) .0. OR1 COOR* (4), 1 ? де X є гідрогеном чи атомом галогену, і де R та R є такими, як визначено вище, (VIM) гідроліз сполуки формули (4) з одержанням рацемічної сполуки формули (5) 5 OR СО2Н де X є гідрогеном чи атомом галогену, R та R є такими, як визначено вище, (їх) хімічне розділення оптичних ізомерів сполуки формули (5) з одержанням сполуки формули (1), необов'язково через проміжний амід формули (6) .о. ), де X є гідрогеном чи атомом галогену, і R1 є таким, як визначено вище 13 Спосіб за п 12, у якому алкілгалогенацетат вибирають з групи, що включає метил хлорацетат, метил б ром ацетат, етил хлорацетат та етилбромацетат 14 Спосіб за п 12, у якому основу, що використовують на стадії (м), вибирають з групи, яка включає метилат натрію, етилат натрію, карбонат натрію, карбонат калію, втор-бутилат калію та трет-ВиОК 15 Спосіб за п 12, у якому каталізатор, що використовують на стадії (їм), вибирають з групи, яка включає нікель Ренея, b^/Pd-C та бороводневі реагенти 16 Спосіб за п 12, у якому алкілування на стадії (iv) проводять з використанням алкілувальних агентів, обраних з групи, що включає дієти л сульфат, етилйодид, метилйодид та диметилсульфат 17 Спосіб за п 12, у якому основу, що використовують на стадії (iv), вибирають з групи, яка включає NaH, NaOH, КОН, трет-ВиОК, К2СО3 та NaHCO3 18 Спосіб за п 12, у якому дебензилювання на стадії (v) здійснюють з використанням b^/Pd-C або НСІ/АсОН 19 Спосіб за п 12, у якому дебензилювання на стадії (v) проводять у присутності розчинника, обраного з групи, що включає тетрапдрофуран, етилацетат, 1,4-дюксан та АсОН 20 Спосіб за п 1, у якому на стадії (vn) сполуку формули (13) перетворюють на сполуку формули (14) з використанням галогенувальних агентів, вибраних з групи, що включає ІСІ/НСІ, Ь/КІ, СУИ+ та Вг2/АсОН 21 Спосіб за п 12, у якому розділення оптичних ізомерів на стадії (їх) здійснюють з використанням хіральних амінів, вибраних з групи, що включає R(+)- а -метилбензиламш, 3(+)-фенілгліцинол, цинхонідин, ефедрин, н-октилглюкозамш 22 Спосіб одержання сполуки формули (1) 60386 ності основи з одержанням сполуки формули (12) О OR2 OR ВпО OR1 'COOH 1 (12), де R є гідрогеном чи нижчою алкільною групою, R2 є нижчою алкільною групою, (VII) дебензилювання сполуки формули (12) звичайними методами з одержанням сполуки формули (13) О 1 (1), де R1 є гідрогеном чи нижчою алкільною групою, і X є гідрогеном чи атомом галогену, який включає (і) реакцію п-пдроксибензальдепду формули (7) хно OR* но U) з пдантоіном формули (17) -• (13)і (VIM) при необхідності, перетворення сполуки формули (13) на сполуку формули (14) О О NH о но OR1 OR2 OR1 (17) з одержанням сполуки формули (18) Х (14), де X є атомом галогену, R1 та R2 є такими, як описано вище, (їх) реакцію сполуки формули (13) або сполуки формули (14) з мезилатом феноксазину формули (15) (18), (м) гідроліз сполуки формули (18) з одержанням сполуки формули (19) О О OMs (15) з одержанням ефіру формули (16) (19),(їм) відновлення сполуки формули (19) з одержанням сполуки формули (20) О ОН (20), де R є гідрогеном чи нижчою алкільною групою, (iv) бензилювання сполуки формули (20) з одержанням сполуки формули (10) ВпО ОН (Ю), де R має значення, вказані вище, (v) гідроліз сполуки формули (10), який проводять за розділенням оптичних ізомерів з одержанням (З)-пдроксисполуки формули (11) о ВпО ОН (11), (vi) алкілування сполуки формули (11) у присут COOR2 (16), де X є гідрогеном чи атомом галогену, і де R1 та R2 є такими, як визначено вище, (х) гідроліз сполуки формули (16) з одержанням сполуки формули (1), описаної вище, і, при необхідності, (хі) хімічне розділення оптичних ізомерів сполуки формули (1) 23 Спосіб за п 22, у якому відновлення на стадії (їм) проводять у розчиннику, який вибирають з групи, що включає метанол, етанол, пропанол та етилацетат 24 Спосіб за п 22, у якому відновлення на стадії (їм) проводять у присутності нікелю Ренея чи H2/Pd-C 25 Спосіб за п 22, у якому розділення оптичних ізомерів на стадії (v) здійснюють з використанням хіральних амінів, вибраних з групи, що включає R(+). (Х.метилбензиламін, цинхонідин, ефедрин та н-октилглюкозамш 60386 10 26 Спосіб за п 22, у якому розділення оптичних ізомерів на стадії (хі) здійснюють з використанням хіральних амінів, вибраних з групи, що включає R(+). Ct-метилбензиламін, 3(+)-фенілгліцинол, цинхонідин, ефедрин та н-октилглюкозамш 27 Спосіб за п 22, у якому алкілування на стадії (vi) проводять з використанням алкілувальних агентів, вибраних з групи, що включає дієти л сульфат, етилйодид, метилйодид та диметилсульфат 28 Спосіб за п 22, у якому основу, що використовують на стадії (vi), вибирають з групи, яка включає NaH, NaOH, КОН, трет-BuOK, К 2 СО 3 та NaHCO 3 29 Спосіб за п 22, у якому дебензилювання на стадії, (VII) здійснюють з використанням b^/Pd-C або НСІ/АсОН 30 Спосіб за п 22, у якому дебензилювання на стадії (VII) проводять у присутності розчинника, вибраного з групи, що включає тетрапдрофуран, етилацетат, 1,4-дюксан та АсОН 31 Спосіб за п 22, у якому перетворення на стадії (VIM) проводять з використанням гал о ге ну вальних агентів, вибраних з групи, що включає ІСІ/НСІ, І2/КІ, СІ 2 /Н + та Вг 2 /АсОН 32 Спосіб одержання сполуки формули (1) ОН (20), де R є гідрогеном чи нижчою алкільною групою, (iv) бензилювання сполуки формули (20) з одержанням сполуки формули (10) О ОН ВпО (Ю), де R має значення, вказані вище, (v) алкілування сполуки формули (10) у присутності основи з одержанням сполуки формули (12а) О QR2 OR 1 (12а ), де R1 є гідрогеном чи нижчою алкільною групою, R2 є нижчою алкільною групою, (vi) дебензилювання сполуки формули (12а) з одержанням сполуки формули (13а) О OR2 1 OR ~СООН OR 1 (1)] де R1 є гідрогеном чи нижчою алкільною групою, і X є гідрогеном чи атомом галогену, який включає (і) реакцію п-пдроксибензальдепду формули (7) ,сно но 1 (13а), ? де R та R є такими, як описано вище, при необхідності, (VII) перетворення сполуки формули (13а) на сполуку формули (14а) О (7) OR1 з пдантоіном формули (17) О NH О (17) з одержанням сполуки формули (18) О (18), (м) гідроліз сполуки формули (18) з одержанням сполуки формули (19) О (їм) відновлення сполуки формули (19) з одержанням сполуки формули (20) (14а), де X є атомом галогену, і R1 та R2 є такими, як описано вище, (VIM) реакцію сполуки формули (13а) або сполуки формули (14а) з мезилатом феноксазину формули (15) -О. OMs (15) з одержанням сполуки формули (4) осо 1 OO () RR 4 C* , O 12 11 60386 1 2 де X є гідрогеном чи атомом галогену, і де R та R є такими, як визначено вище, (їх) гідроліз сполуки формули (4) з одержанням рацемічної сполуки формули (5) (1) соон 1 де R є гідрогеном чи нижчою алкільною групою, і X є гідрогеном чи атомом галогену, в якому ХООН (5), 1 2 де X є гідрогеном чи атомом галогену, і R та R є такими, як визначено вище, і (х) хімічне розділення оптичних ізомерів сполуки формули (5), необов'язково через проміжний амід формули (6) ЗДІЙСНЮЮТЬ (і) бензилювання L-тирозину формули (21) СО2Н NH, но (21) з одержанням сполуки формули (22) со г н ч 2 де X є гідрогеном чи атомом галогену, і R та R є такими, як визначено вище 33 Спосіб за п 32, у якому відновлення на стадії (їм) проводять у розчиннику, який вибирають з групи, що включає метанол, етанол, пропанол та етилацетат 34 Спосіб за п 32, у якому відновлення на стадії (їм) проводять у присутності нікелю Ренея чи H2/Pd-C 35 Спосіб за п 32, у якому алкілування на стадії (v) проводять з використанням алкілувальних агентів, вибраних з групи, що включає дієти л сульфат, етилйодид, метилйодид та диметилсульфат 36 Спосіб за п 32, у якому основу, що використовують на стадії (v), вибирають з групи, яка включає NaH, NaOH, КОН, трет-BuOK, К 2 СО 3 та NaHCO 3 37 Спосіб за п 32, у якому дебензилювання на стадії (vi) здійснюють з використанням реагентів, вибраних з групи, що включає H2/Pd-C або НСІ/АсОН 38 Спосіб за п 32, у якому дебензилювання на стадії (vi) проводять у присутності розчинника, вибраного з групи, що включає тетрапдрофуран, н-октанол, н-гексанол, 1,4-дюксан та АсОН 39 Спосіб за п 32, у якому перетворення на стадії (VM) проводять з використанням гал о ге ну вальних агентів, вибраних з групи, що включає ІСІ/НСІ, І2/КІ, СІ2/Н+та Вг2/АсОН 40 Спосіб за п 32, у якому розділення оптичних ізомерів на стадії (х) здійснюють з використанням хіральних амінів, вибраних з групи, що включає R(+)-а-метилбензиламш, цинхонідин, ефедрин та н-октилглюкозамш 41 Спосіб одержання сполук формули (1) ВпО " (22), (м) діазотування сполуки формули (22) у присутності кислотного реагенту та органічного розчинника з одержанням сполуки формули (11') ВпО де R' є гідрогеном чи ацетильною групою, (їм) при необхідності, гідроліз сполуки формули (11'), де R' є ацетильною групою, до сполуки формули (11'), де R' є гідрогеном, (iv) алкілування сполуки формули (11') у присутності основи, де R' є гідрогеном, до алкілованої сполуки формули (12) OR' ВпО (12), де R1 є гідрогеном чи нижчою алкільною групою, і R2 є нижчою алкільною групою, (v) дебензилювання сполуки формули (12) з одержанням сполуки формули (13), де R1 та R2 є такими, як визначено вище, при необхідності, (vi) перетворення сполуки формули (13) н о ^ OR1 на сполуку формули (14) (13) OR1 X (14), де X є галогеном, і R та R є такими, як визначено вище, (VM) реакцію сполуки формули (13) або сполуки формули (14) з мезилатом феноксазину формули (15) 13 60386 14 ВпО OMs (15) з одержанням ефіру формули (16) .0. (22), (м) діазотування сполуки формули (22) у присутності кислотного реагенту та органічного розчинника з одержанням сполуки формули (11 і ) ,со,н 1 OR ВпО (16), 1 2 де X є гідрогеном чи атомом галогену, і де R та R є такими, як визначено вище, (VIM) гідроліз сполуки формули (16) з одержанням сполуки формули (1), описаної вище, і, при необхідності, (їх) хімічне розділення оптичних ізомерів сполуки формули (1) 42 Спосіб за п 4 1 , у якому гідроліз на стадії (їм) проводять з використанням пдролізуючого агента, вибраного з групи, що включає NaOH, KOH, LiOH та Ва(ОН) 2 43 Спосіб за п 4 1 , у якому алкілування на стадії (iv) проводять з використанням алкіл у вального агента, вибраного з групи, що включає діетилсульфат, етилйодид, метилйодид та димети л сульфат 44 Спосіб за п 4 1 , у якому основу, що використовують на стадії (iv), вибирають з групи, яка включає NaH, NaOH, KOH, трет-BuOK, К 2 СО 3 та NaHCO 3 45 Спосіб за п 4 1 , у якому дебензилювання на стадії (v) здійснюють з використанням H2/Pd-C або НСІ/АсОН 46 Спосіб за п 4 1 , у якому дебензилювання на стадії (v) проводять у присутності розчинника, вибраного з групи, що включає тетрапдрофуран, н-октанол, н-гексанол, 1,4-дюксан та АсОН 47 Спосіб за п 4 1 , у якому стадію (iv) проводять з використанням галогенувальних агентів, вибраних з групи, що включає ІСІ/НСІ, І2/КІ, СІ 2 /Н + та Вг 2 /АсОН 48 Спосіб за п 4 1 , у якому розділення оптичних ізомерів на стадії (їх) здійснюють з використанням хіральних амінів, вибраних з групи, що включає R(+). Ct-метилбензиламін, 3(+)-фенілгліцинол, цинхонідин, ефедрин, н-октилглюкозамш 49 Спосіб одержання сполуки формули (13) CO,R НО 2 (11і). де R' є гідрогеном чи ацетильною групою, (їм) при необхідності, гідроліз сполуки формули (11'), де R' є ацетильною групою, до сполуки формули (11'), де R' є гідрогеном, (iv) алкілування сполуки формули (11') у присутності основи, де R' є гідрогеном, з одержанням сполуки формули (12) -CO 2 R 2 ВпО (12), де R1 є гідрогеном чи нижчою алкільною групою, і R2 є нижчою алкільною групою, та (v) дебензилювання сполуки формули (12) звичайними методами з одержанням сполуки формули (13) CO 2 R 2 OR 1 1 де R та R є такими, як визначено вище 50 Спосіб за п 49, у якому гідроліз на стадії (їм) проводять з використанням пдролізуючого агента, вибраного з групи, що включає NaOH, KOH, LiOH та Ва(ОН) 2 51 Спосіб за п 49, у якому алкілування на стадії (iv) проводять з використанням алкіл у вального агента, вибраного з групи, що включає діетилсульфат, етилйодид, метилйодид та димети л сульфат 52 Спосіб за п 49, у якому основу, що використовують на стадії (iv), вибирають з групи, яка включає NaH, NaOH, KOH, трет-BuOK, К 2 СО 3 та NaHCO 3 53 Спосіб за п 49, у якому дебензилювання на стадії (v) здійснюють з використанням H2/Pd-C або НСІ/АсОН 54 Спосіб за п 49, у якому дебензилювання на стадії (v) проводять у присутності розчинника, вибраного з групи, що включає тетрапдрофуран, н-октанол, н-гексанол та 1,4-дюксан 55 Сполука формули 11' согн OR1 (13) та и аналогів, який включає (і) бензилювання L-тирозину формули (21) ,со„н НО — * (21) з одержанням сполуки формули (22) (13), ? ВпО OR' V • У. де R є гідрогеном чи ацетильною групою 56 Сполука формули 12 15 60386 16 2 CO2R 2 CQ,R OR1 02), де R є гідрогеном чи нижчою алкільною групою, і 2 R є нижчою алкільною групою 57 Сполука формули 14 Даний винахід стосується удосконаленого способу одержання нових антидіабетичних сполук формули (І) СООН 0) де R1 є гідрогеном чи нижчою алкільною групою, і X є гідрогеном чи атомом галогену У заявці на патент US 09/012585 описується спосіб одержання нових антидіабетичних сполук формули (1) Описаний у цій заявці спосіб включає перетворення альдегіду формули (2), де X є таким, як описано вище, на сполуку формули (3) де усі позначення є такими, як описано вище, і R є нижчою алкільною групою, відновлення сполуки формули (3) з одержанням сполуки формули (4), гідроліз сполуки формули (4) з одержанням кислоти формули (5), перетворення кислоти формули (5) на амід формули (6) і гідроліз аміду з одержанням сполуки формули (1), де X та R є такими, як описано вище Спосіб представлений на схемі 1, наведеній нижче ,0 Суть винаходу Отже, головною задачею даного винаходу є конвергентний синтез сполук формули (1) X (14), де R є гідрогеном чи нижчою алкільною групою, і 2 R є нижчою алкільною групою, і X є атомом галогену 1 58 Сполука за пп 56 чи 57, де R є Сі-Сє-алкілом 2 59 Сполука за пп 56 чи 57, де R є Сі-Сє-алкілом Іншою задачею даного винаходу є конвергентний та стереоселективний синтез сполук формули (1), а також комерційне застосовний процес Іншою задачею даного винаходу є розробка способу синтезу сполук формули (1) шляхом одержання адитивної солі хірального аміну після гідролізу, який приводить до одержання одного ізомеру проміжного продукту, який потім може бути перетворений на потрібний ізомер формули (1) У випадку рацемізацм невеликої КІЛЬКОСТІ речовини у процесі перетворення проміжного продукту на кінцеву сполуку формули (1), розділення оптичних ізомерів може бути легко здійснено за допомогою застосування хіральних амінів без великих втрат сполук формули (1) ВІДПОВІДНО, даний винахід спрямований на спосіб одержання сполук формули (1), де R1 позначає атом гідрогену чи нижчу алкільну групу, таку як Сі-Сб-групу, краще, метил, етил, пропіл та подібну до них, X є атомом гідрогену чи атомом галогену, таким як хлор, бром чи йод, який включає (і) бензил ювання п-пдроксибензальдепду формули (7) звичайними методами з одержанням сполуки формули (8), (м) реакцію сполуки формули (8) з алкілгалогенацетатом у присутності основи при температурі у діапазоні від -10°С до 60°С (конденсація Дарзена) з одержанням гліцидного ефіру формули (9), де R позначає нижчу алкільну групу, (їм) розкриття епоксидної групи гліцидного ефіру сполуки (9) звичайними методами з одержанням сполуки формули (10), де R є таким, як описано вище, (iv) гідроліз сполуки (10) звичайними методами, який йде за розділенням оптичних ізомерів кінцевої сполуки з одержанням (З)-пдрокси сполуки формули (11), (v) перетворення сполуки формули (11) на відповідну алкіловану сполуку формули (12), де R1 є гідрогеном чи нижчим алкілом, R2 є нижчою алкільною групою, одностадійною реакцією шляхом обробки його алкілувальним агентом у присутності основи, (vi) дебензилювання сполуки формули (12) звичайними методами з одержанням сполуки формули (13), де R1 та R2 є такими, як визначено вище, при необхідності, (VII) перетворення сполуки формули (13) на сполуку формули (14), де X є атомом галогену і усі ІНШІ позначення є такими, як описано вище, 60386 18 17 звичайними методами, активної пдроксикислоти формули (11), яка при алкілуванні алкілувальними агентами, такими як (VIM) реакцію сполуки формули (13) або сподієти л сульфат, етилйодид, метилйодид, димелуки формули (14) з мезилатом феноксазину тилсульфат та подібними до них, у присутності формули (15) з одержанням ефіру формули (16), 1 основи, такої як NaH, NaOH, KOH, mpem-BuOK, де X є гідрогеном чи атомом галогену, і де R та 2 K2CO3, ЫаНСОз та подібної до них, перетворюR є такими, як визначено вище, 1 ється на сполуку формули (12), де R є гідрогеОх) гідроліз сполуки формули (16) звичайнином чи нижчою алкільною групою, такою як С-і-Сєми методами з одержанням сполуки формули (1), група, краще метил, етил, пропіл та подібна до вказаної вище, і, при необхідності, 2 них, R є нижчою алкільною групою, такою як d (х) хімічне розділення оптичних ізомерів споСє-група, краще, метил, етил, пропіл та подібна луки формули (1) за допомогою застосування до них Сполука формули (12) при дебензилюхіральних амінів у випадку рацемізацм у процесі ванні за допомогою реагентів, таких як H2/Pd-C, перетворення (З)-пдроксисполуки формули (11) НСІ/АсОН та подібні од них, у присутності розна кінцеву сполуку формули (1) чинників, таких як ТГФ, етилацетат, 1,4-дюксан, Описаний вище спосіб зображений нижче на АсОН та подібних до них, перетворюється на схемі 2 заміщений фенол формули (13) Сполука формуР ли (13) перетворюється на сполуку формули (14) при використанні придатних галогенувальних агентів, таких як ІСІ/НСІ, І2/КІ, СІ2/Н+, Вг2/АсОН та подібних до них Оптично активна сполука формули (13) чи сполука формули (14) реагує з мезилатом феноксазину формули (15) з одержанням ефіру формули (16), який при гідролізі з використанням звичайних методів дає потрібну сполуку формули (1) у оптично чистій формі Однак у випадку рацемізацм невеликої КІЛЬКОСТІ речовини у процесі перетворення проміжного продукту формули (11) на кінцеву сполуку формули (1), розділення оптичних ізомерів може бути легко здійснене за допомогою застосування хіральних амінів, таких, як описано вище, без великих втрат сполуки формули (1) Схша 2 Бензильний захист п-пдроксибензальдепду формули (7) приводить до одержання захищеного альдегіду формули (8) Реакція сполуки формули (8) з алкілгалогенацетатами, такими як мети л хлорацетат, метил б ром ацетат, етил хлорацетат, етил б ром ацетат та подібні до них, у присутності основи, такої як метилат натрію, етилат натрію, карбонат натрію, карбонат калію, втор-бутилат калію, mpem-ВиОКта подібні до них, приводить до одержання гліцидного ефіру формули (9), де R позначає нижчу алкільну групу, таку як Сі-Сє-алкіл, краще, метил, етил та подібну до них Гліцидний ефір формули (9) розкривається реагентами, такими як нікель Ренея, bb/Pd-C, бороводневими реагентами та подібними до них реагентами з одержанням рацемічного пдроксіефіру формули (10) Гідроліз ефіру формули (10), який йде за розділенням його оптичних ізомерів з використанням хіральних амінів, таких як Р(+)а-метилбензиламш, 3(+)-фенілгліцинол, цинхонідин, ефедрин, н-октилглюкозамш та подібних до них, приводить до одержання оптично Даний винахід також забезпечує інший удосконалений спосіб одержання сполук формули (1), описаних вище, який включає (і) бензил ювання п-пдроксибензальдепду формули (7) звичайними методами з одержанням сполуки формули (8), (м) реакцію сполуки формули (8) з алкілгалогенацетатом у присутності основи при температурі у діапазоні від -10°С до 60°С (конденсація Дарзена) з одержанням гліцидного ефіру формули (9), де R позначає нижчу алкільну групу, (їм) розкриття епоксидної групи гліцидного ефіру сполуки (9) звичайними методами з одержанням сполуки формули (10), де R має значення, наведені вище, (iv) алкілування сполуки формули (10) за допомогою алкілувального агента у присутності основи з одержанням сполуки формули (12а), де R1 позначає гідроген чи нижчий алкіл, R2 позначає нижчу алкільну групу, (v) дебензилювання сполуки формули (12а) звичайними методами з одержанням сполуки формули (13а), де R1 та R2 є такими, як визначено вище, при необхідності, (vi) перетворення сполуки формули (13а) на сполуку формули (14а), де X є атомом галогену, і R1 та R2 є такими, як описано вище, звичайними методами, (VM) реакцію сполуки формули (13а) або сполуки формули (14а) з мезилатом феноксазину формули (15) з одержанням ефіру формули (4), де X є гідрогеном чи атомом галогену, і де R1 та R2 є такими, як визначено вище, 60386 19 (VIM) гідроліз сполуки формули (4) звичайними методами з одержанням рацемічної сполуки формули (5), де X є гідрогеном чи атомом галогену, R1 та R є такими, як визначено вище, і (їх) хімічне розділення оптичних ізомерів сполуки формули (5) за допомогою застосування хіральних амінів до кінцевої сполуки формули (1), необов'язково через проміжний амід формули (6), де X є гідрогеном чи атомом галогену, і R1 є таким, як визначено вище Описаний вище спосіб зображений нижче на схемі З (10) (12а) НО С03Н со,н Схема З Бензильний захист п-пдроксибензальдепду формули (7) приводить до одержання захищеного альдегіду формули (8) Реакція сполуки формули (8) з алкілгалогенацетатами, такими як мети л хлорацетат, метил б ром ацетат, етил хлорацетат, етил б ром ацетат та подібними до них, у присутності основи, такої як метилат натрію, етилат натрію, карбонат натрію, карбонат калію, втор-бутилат калію, mpem-ВиОКта подібної до них, приводить до одержання гліцидного ефіру формули (9), де R позначає нижчу алкільну групу, таку як Сі-Сє-алкіл, краще, метил, етил та подібну до них Гліцидний ефір формули (9) розкривається реагентами, такими як нікель Ренея, bb/Pd-C, бороводневими реагентами та подібни 20 ми до них, з одержанням рацемічного пдроксидного ефіру формули (10), який при алкілуванні алкілувальними агентами, такими як діетилсульфат, етилйодид, метилйодид, ди мети л сульфат та подібні до них, у присутності основи, такої як NaH, NaOH, KOH, mpem-BuOK, K2CO3, NaHCO3 та подібної до них, перетворюється на сполуку формули (12а), де R1 позначає гідроген чи нижчу алкільну групу, таку як Сі-Сє-групу, краще, метил, етил, пропіл та подібну до них, R2 позначає нижчу алкільну групу, таку як Сі-Сє-групу, краще, метил, етил, пропіл та подібну до них Етоксіефір формули (12а) при дебензилюванні за допомогою реагентів, таких як b^/Pd-C, HCI/AcOH та подібних до них, у присутності розчинників, таких як ТГФ, етилацетат, 1,4-дюксан, АсОН та подібних до них, перетворюється на заміщений фенол формули (13а) Сполука формули (13а) перетворюється на сполуку формули (14а) при використанні придатних галогенувальних агентів, таких як ІСІ/НСІ, І2/КІ, СІ2/Н+, Вгз/АсОН та подібних до них Сполука формули (13а) чи сполука формули (14а) реагує з мезилатом феноксазину формули (15) з одержанням складного ефіру формули (4), який при гідролізі з використанням звичайних методів дає рацемічну кислоту формули (5) рацемічна кислота при розділенні оптичних ізомерів з використанням хіральних амінів, таких як R(+)aметилбензиламш, 3(+)-фенілгліцинол, цинхонідин, ефедрин, н-октилглюкозамш та подібних до них, приводить до одержання потрібної сполуки формули (1) у оптично чистій формі, необов'язково через проміжний амід формули (6) Даний винахід також забезпечує ще один удосконалений спосіб одержання сполуки формули (1), описаної вище, який включає (і) реакцію п-пдроксибензальдепду формули (7) з пдантоіном формули (17) звичайними методами з одержанням сполуки формули (18), (м) гідроліз сполуки формули (18) звичайними методами з одержанням сполуки формули (19), (їм) відновлення сполуки формули (19) звичайними методами з одержанням сполуки формули (20), де R є гідрогеном чи нижчою алкільною групою, (iv) бензилювання сполуки формули (20) звичайними методами з одержанням сполуки формули (10), де R має значення, вказані вище, (v) гідроліз сполуки формули (10) звичайними методами, який йде за розщепленням з одержанням (З)-пдроксисполуки формули (11), (vi) перетворення сполуки формули (11) на відповідну алкіловану сполуку формули (12), де R1 є гідрогеном чи нижчою алкільною групою, R2 є нижчою алкільною групою, одностадійною реакцією шляхом обробки його алкілувальним агентом у присутності основи, (VM) дебензилювання сполуки формули (12) звичайними методами з одержанням сполуки формули (13), (VIM) при необхідності, перетворення сполуки формули (13) на сполуку формули (14), де X є атомом галогену, R1 та R є такими, як визначено вище, звичайними методами, (їх) реакцію сполуки формули (13) або сполуки формули (14) з мезилатом феноксазину фор 60386 22 21 мули (15) з одержанням ефіру формули (16), де кільну групу, таку як Сі-Сє-алкіл, краще, метил, 1 X є гідрогеном чи атомом галогену, і де R та R є етил та подібну до них) при селективному бензитакими, як визначено вище, люванні фенольної групи утворює сполуку формули (10) Гідроліз сполуки формули (10), який (х) гідроліз сполуки формули (16) звичайними йде за розділенням його оптичних ізомерів з виметодами з одержанням сполуки формули (1), користанням хіральних амінів, таких як R(+)aописаної вище, і, при необхідності, метилбензиламш, цинхонідин, ефедрин, S(+)(хі) хімічне розділення оптичних ізомерів спофенілгліцинол, н-октилглюкозамш та подібних до луки формули (1) за допомогою застосування них, приводить до одержання оптично активної хіральних амінів у випадку будь-якої рацемізаци у гідрокси кислоти формули (11) Алкілування спопроцесі перетворення (З)-пдроксисполуки форлуки (11) алкілувальними агентами, такими як мули (11) на кінцеву сполуку формули (1) діетилсульфат, етилйодид, метилйодид, диметиОписаний вище спосіб зображений нижче на лсульфатта подібні до них, у присутності основи, схемі 4 такої як NaH, NaOH, КОН, mpem-BuOK, K2CO3, ЫаНСОз та подібної до них, дає можливість оде1 ржати сполуку формули (12), де R є гідрогеном чи нижчою алкільною групою, такою як С-і-Сєгрупа, краще, метил, етил, пропіл та подібна до них, R2 є нижчою алкільною групою, такою як d Сє-група, краще, метил, етил, пропіл та подібну до них Сполука формули (12) при дебензилюванні за допомогою реагентів, таких як H2/Pd-C, НСІ/АсОН та подібних до них, у присутності розчинників, таких як ТГФ, н-гексанол, н-октанол, 1,4-дюксан, АсОН та подібних до них, перетворюється на заміщений фенол формули (13), описаний раніше Сполука формули (13) перетворюється на сполуку формули (14), описану раніше, при використанні придатних галогенувальних агентів, таких як ІСІ/НСІ, І2/КІ, СІ2/Н+, Вг2/АсОН та подібних до них Оптично активна сполука формули (13) чи сполука формули (14) реагує з мезилатом феноксазину формули (15) з одержанням ефіру формули (16), який при гідролізі з використанням звичайних методів дає потрібну OR' сполуку формули (1) у оптично чистій формі Однак у випадку рацемізацм невеликої КІЛЬКОСТІ речовини у процесі перетворення проміжного продукту формули (11) на кінцеву сполуку формули (16) (1), розділення оптичних ізомерів може бути легко здійснене за допомогою застосування хіральних амінів без великих втрат сполуки формули (1) соон (1) Схема 4 Реакція п-пдроксибензальдепду формули (7) з пдантоіном формули (17) приводить до одержання ненасиченої сполуки формули (18), яка при гідролізі дає похідне піровиноградної кислоти формули (19) Похідне піровиноградної кислоти (19) відновлюється у розчинниках, таких як метанол, етанол, пропанол, етилацетат та подібних до них, у присутності нікелю Ренея, H2/Pd-C, з одержанням рацемічного пдроксіефіру формули (20) (R є гідрогеном чи нижчою алкільною групою, такою як Сі-Сб-алкіл, краще метил, етил та подібна до них) Сполука формули (20) (де R є гідрогеном) етерифікується з використанням суміші спирт/сірчана кислота з одержанням сполуки формули (20) (де R позначає нижчу алкільну групу, таку як Сі-Сб-алкіл, краще, метил, етил та подібну до них) Спирт для етерифікації може бути обраний з метанолу, етанолу та подібного до них Сполука формули (20) (де R позначає нижчу ал Даний винахід також забезпечує інший удосконалений спосіб одержання сполуки формули (1), описаної вище, який включає (і) реакцію п-пдроксибензальдепду формули (7) з пдантоіном формули (17) звичайними методами з одержанням сполуки формули (18), (м) гідроліз сполуки формули (18) звичайними методами з одержанням сполуки формули (19), (їм) відновлення сполуки формули (19) звичайними методами з одержанням сполуки формули (20), де R є гідрогеном чи нижчою алкільною групою, (iv) бензилювання сполуки формули (20) звичайними методами з одержанням сполуки формули (10), де R має значення, вказані вище, (v) алкілування сполуки формули (10) за допомогою алкілувального агента у присутності основи з одержанням сполуки формули (12а), де R1 є гідрогеном чи нижчою алкільною групою, R2 є нижчою алкільною групою, (vi) дебензилювання сполуки формули (12а) звичайними методами з одержанням сполуки формули (13а), де R1 та R2 є такими, як визначе 60386 23 но вище, при необхідності, (VII) перетворення сполуки формули (13а) на сполуку формули (14а), де X є атомом галогену, і R1 та R2 є такими, як визначено вище, звичайними методами, (VIM) реакцію сполуки формули (13а) або сполуки формули (14а) з мезилатом феноксазину формули (15) з одержанням ефіру формули (4), де X є гідрогеном чи атомом галогену, R1 та R2 є такими, як визначено вище, (їх) гідроліз сполуки формули (4) звичайними методами з одержанням рацемічної сполуки формули (5), де X позначає гідроген чи атом галогену, і R1 та R2 є такими, як визначено вище, (х) хімічне розділення оптичних ізомерів сполуки формули (5) за допомогою застосування хіральних амінів до кінцевої сполуки формули (1), необов'язково через проміжний амід формули (6), де X є гідрогеном чи атомом галогену, і R1 та R2 є такими, як визначено вище Описаний вище спосіб зображений нижче на схемі 5 17 1) (7! (8 1) 1 о (1Э) Схема 5 Реакція п-пдроксибензальдепду формули (7) з пдантоіном формули (17) приводить до одержання ненасиченої сполуки формули (18), яка при гідролізі дає похідне піровиноградної кислоти формули (19) Похідне піровиноградної кислоти (19) відновлюється у розчинниках, таких як метанол, етанол, пропанол, етилацетат та подібних 24 до них, у присутності нікелю Ренея, bb/Pd-C, з одержанням рацемічно'го пдроксіефіру формули (20) (R позначає гідроген чи нижче алкільну групу, таку як Сі-Сб-алкіл, краще метил, етил та подібна до них) Сполука формули (20) (де R позначає гідроген) етерифікується з використанням суміші спирт/сірчана кислота з одержанням сполуки формули (20) (де R позначає нижчу алкільну групу, таку як Сі-Сє-алкіл, краще, метил, етил та подібну до них) Спирт для етерифікації може бути обраний з метанолу, етанолу та подібного до них Сполука формули (20) (де R позначає нижчу алкільну групу, таку як Сі-Сє-алкіл, краще, метил, етил та подібну до них) при селективному бензилюванні фенольної групи утворює сполуку формули (10), яка при алкілуванні алкілувальними агентами, такими як д і етил сульфат, етилйодид, метилйодид, диметилсульфат та подібні до них, у присутності основи, такої як NaH, NaOH, КОН, mpem-BuOK, K2CO3, МаНСОз та подібної до них, перетворюється на сполуку формули (12а), де R1 є гідрогеном чи нижчою алкільною групою, такою як Сі-Сб-група, краще, метил, етил, пропіл та подібна до них, R2 є нижчою алкільною групою, такою як СІ-Сб-група, краще, метил, етил, пропіл та подібна до них Сполука формули (12а) при дебензилюванні за допомогою реагентів,, таких як bb/Pd-C, НСІ/АсОН та подібних до них, у присутності розчинників, таких як ТГФ, н-октанол, нгексанол, 1,4-дюксан, АсОН та подібних до них, перетворюється на заміщений фенол формули (13а) Сполука формули (13а) перетворюється на сполуку формули (14а) при використанні придатних галогенувальних агентів, таких як ІСІ/НСІ, Ь/КІ, СІ2/Н+, Вгг/АсОН та подібних до них Сполука формули (13а) чи сполука формули (14а) реагує з мезилатом феноксазину формули (15) з одержанням ефіру формули (4), який при гідролізі з використанням звичайних методів та розділенні оптичних ізомерів з використанням хіральних амінів, таких як R(+)a-MeTHn6eH3nnaMiH, S(+)фенілгліцинол, цинхонідин, ефедрин, ноктилглюкозамш та подібних до них, дає потрібну сполуку формули (1) у оптично чистій формі Далі винахід забезпечує інший удосконалений спосіб одержання сполук формули (1), описаних вище, який включає (і) селективне бензилювання L-тирозину формули (21) звичайними методами з одержанням сполуки формули (22), (м) діазотування сполуки формули (22) у присутності кислотного реагенту та органічного розчинника з одержанням сполуки формули (11і) (де R' є гідрогеном чи ацетильною групою), (їм) при необхідності, гідроліз сполуки формули (11і) (де R' позначає ацетильну групу) з утворенням сполуки формули (11і) (де R' є гідрогеном), звичайними методами, (iv) перетворення сполуки формули (11і) (де R' є гідрогеном) на алкіловану сполуку формули (12), де R1 є гідрогеном чи нижчою алкільною групою, R2 є нижчою алкільною групою, одностадійною реакцією шляхом обробки його алкілу вальним агентом у присутності сильної основи, (v) дебензилювання сполуки формули (12) звичайними методами з одержанням сполуки 25 60386 26 1 2 формули (13), де R та R є такими, як визначено нижчою алкільною групою, такою як Сі-Сє-алкіл, вище, при необхідності, краще, метил, етил, пропіл та подібна до них, в одну стадію, що досягається при використанні (vi) перетворення сполуки формули (13) на 1 алкілувальних агентів, таких як д і етил сульфат, сполуку формули (14), де X є галогеном, і R та 2 етилйодид, метилйодид, ди метил сульфат та поR є такими, як визначено вище, звичайними медібних до них, у присутності сильної основи, такої тодами, як NaH, NaOH, KOH, mpem-BuOK, K2CO3, NaHCO3 (VM) реакцію сполуки формули (13) або сполута подібної до них Дебензилювання сполуки форки формули (14) з мезилатом феноксазину формули (12) звичайними методами з використанням мули (15) з одержанням ефіру формули (16), де 1 H2/Pd-C, HCI/AcOH та подібних до них систем у X є гідрогеном чи атомом галогену, і де R та R є присутності розчинників, таких як ТГФ, н-гексанол, такими, як визначено вище, н-октанол, 1,4-дюксан, АсОН та подібних до них, (VIM) гідроліз сполуки формули (16) звичайниприводить до одержання потрібної ключової проми методами з одержанням сполуки формули (1), міжної сполуки формули (13) з дуже добрим вихоописаної вище, і, при необхідності, дом (95%) і чистотою (95%) Сполука формули (13) Qx) рацемічна сполука формули (1) може буперетворюється на сполуку формули (14) при вити ХІМІЧНО розділена на оптичні ізомери за допокористанні придатних гал о ген увал ь них агентів, могою хіральних амінів таких як ІСІ/НСІ, І2/КІ, СІ2/Н+, Вг2/АсОН та подібних Спосіб представлений нижче на схемі 6 до них Оптично активна сполука формули (13) чи ,.СО,Н -. СО.Н ^ ^ ^СО,Н Л сполука формули (14) реагує з мезилатом феноксазину формули (15) з одержанням складного ефіру формули (16), який при гідролізі з використанням звичайних методів дає потрібну сполуку формули (1) у оптично чистій формі з виходом 95% Однак, у випадку рацемізацм невеликої КІЛЬКОСТІ речовини, розщеплення може бути легко здійснене за допомогою застосування хіральних амінів, таких як R(+)a-MeTHn6eH3nnaMiH, S(+)фенілгліцинол, цинхонідин, ефедрин, ноктилглюкозамш та подібних до них 4 c A oN A ^ o (1) Схема 6 Спосіб за даним винаходом починається з селективного бензилювання L-тирозину формули (21) з одержанням сполуки формули (22) Діазотування сполуки формули (22) у кислому середовищі з використанням кислот, таких як сірчана кислота, НСІ, оцтова кислота та подібних до них, у придатному органічному розчиннику, такому як СНСІз, 1,4-дюксан, ТГФ, ацетон та подібних до них, приводить до одержання сполук формули (11і) (де R є гідрогеном чи ацетильною групою) з більш ніж 98% єн (енанті о мерного надлишку) Гідроліз сполуки формули (11') (де R є ацетильною групою) до сполуки формули (11і) (де R' є гідрогеном) може бути проведений з використанням звичайних пдролізуючих агентів, таких як NaOH, KOH, LiOH, Ва(ОН)2 та подібні до них Перетворення сполуки формули (11і) (де R' є гідрогеном) на алкіловану сполуку формули (12), де R1 є гідрогеном чи нижчою алкільною групою, такою як Сі-Сє-алкіл, краще, метил, етил, пропіл та подібна до них, R є Даний винахід також забезпечує інший удосконалений спосіб одержання сполук формули (13), де R1 є гідрогеном чи нижчою алкільною групою, R2 є нижчою алкільною групою, який включає (і) селективне бензилювання L-тирозину формули (21) звичайними методами з одержанням сполуки формули (22), (м) діазотування сполуки формули (22) у присутності кислотного реагенту та органічного розчинника з одержанням сполуки формули (11і) (де R' є гідрогеном чи ацетильною групою), при необхідності, (мі) гідроліз сполуки формули (11і) (де R' є ацетильною групою) до сполуки формули (11і) (де R' є гідрогеном) звичайними методами, і (iv) перетворення сполуки формули (11 ) (де R є гідрогеном) на сполуку формули (12), де R1 є гідрогеном чи нижчою алкільною групою, R є нижчою алкільною групою, одностадійною реакцією шляхом обробки сполуки алкілувальним агентом у присутності сильної основи, (v) дебензилювання сполуки формули (12) звичайними методами з одержанням сполуки формули (13), де R та R2 є такими, як визначено вище Спосіб представлений нижче на схемі 7 ЛО,Н Спосіб за даним винаходом починається з 27 селективного бензилювання L-тирозину формули (21) з одержанням сполуки формули (22) Діазотування сполуки формули (22) за кислих умов з використанням кислот, таких як сірчана кислота, НСІ, оцтова кислота та подібних до них, у придатному органічному розчиннику, такому як СНСІз, 1,4-дюксан, ТГФ, ацетон та подібних до них, приводить до одержання сполуки формули (11і) (де R' є гідрогеном чи ацетильною групою) з більш ніж 98% єн (енантюмерний надлишок) Гідроліз сполуки формули (11і) (Де R' є ацетильною групою) до сполуки формули (11і) (де R' є гідрогеном) може бути проведений з використанням звичайних пдролізуючих агентів, таких як NaOH, КОН, LiOH, Ba(OH)2 та подібні до них Перетворення сполуки формули (11і) (де R' є гідрогеном) на алкіловану сполуку формули (12), де R1 є гідрогеном чи нижчою алкільною групою, такою як Сі-Сб-алкіл, краще, метил, етил, пропіл та подібна до них, R2 є нижчою алкільною групою, такою як Сі-Сб-алкіл, краще, метил, етил, пропіл та подібна до них, проходить в одну стадію, що досягається при використанні алкілувальних агентів, таких як діетилсульфат, етилйодид та подібних до них, у присутності сильної основи, такої як NaH, NaOH, КОН, mpem-ВиОКта подібної до них Дебензилювання сполуки формули (12) звичайними методами з Нг/РсІ-С, НСІ/АсОН та подібними до них у присутності розчинників, таких як ТГФ, н-гексанол, н-октанол, 1,4-дюксан, АсОН та подібних до них, приводить до одержання потрібної сполуки формули (13) з дуже добрим виходом (95%) і чистотою (95%) ВІДОМОСТІ, ЯКІ підтверджують можливість здійснення винаходу Даний винахід детально описаний у прикладах, наведених нижче, які лише ілюструють способи і, отже, не обмежують об'єм винаходу Приклад 1 Стадія і Одержання 4-бензилоксибензальдепду формули (8) 4-Гідроксибензальдепд формули (7) (100г), карбонат калію (226г) та диметилформамід (500мл) поміщають до колби і перемішують 15хв Потім при кімнатній температурі додають бензилхлорид (114г) і реакційну масу перемішують при тій самій температурі протягом 8-10 год За протіканням реакції спостерігають за даними ТШХ Після закінчення реакції реакційну масу виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою, а потім 10% водним розчином гідроксиду натрію Розчинник видаляють у вакуумі, і одержаний залишок розтирають у порошок з петролейним ефіром і одержують вказану у заголовку сполуку формули (8) (160-165г, 93-95%) Стадія и Одержання етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) 4-Бензилоксибензальдепд формули (8) (100г), одержаний згідно з методом, описаним вище на стадії (і), додають до розчину етилату натрію (64г) у абсолютному етанолі після додання етил хлорацетату (87г) протягом 30-45хв , підтримуючи температуру навколишнього середо 60386 28 вища Реакційну суміш перемішують при цій самій температурі 3-5год За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і перемішують протягом 5-10 хвилин Одержану таким чином тверду речовину відфільтровують, промивають водою і сушать з одержанням названої сполуки формули (9) (126-129г, 90-92%) Стадія їм Одержання рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) Суміш етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) (125г), одержаного згідно з методикою, описаною вище на стадії (м), каталізатора 5% Pd/C (12,5г) та 1,4дюксану (750мл) гідрують при кімнатній температурі при тиску водню 34,5-68,9кПа (5-1 Opsi) протягом 10-15 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (10) (100-105г, 8083%) Стадія iv Одержання 3(-)-2-гідрокси-3-(4бензилокеифеніл)пропюновоі кислоти формули (11) Суміш рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) (100г), одержаного згідно з методикою, описаною вище на стадії (їм), та 10% водного розчину гідроксиду натрію (500мл) перемішують при кімнатній температурі протягом 1-2 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш підкислюють розведеною соляною кислотою при 15-20°С і одержану таким чином тверду речовину відфільтровують і промивають водою з одержанням рацемічної 2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти (72-77г, 8085%) До розчину рацемічної 2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти (75г), одержаної згідно з методикою, описаною вище, у етилацетаті (1,1л) додають R(+)aметилбензиламш (33г) і перемішують цю суміш при кімнатній температурі протягом 2-4 годин Одержану таким чином тверду речовину* відфільтровують і регенерують кислоту шляхом підкислення з одержанням 3(-)-2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11) (33-35г, 44-47%) R(+)a-riflpoKCHKHcnoTy, одержану з маточного розчину, рацемізують і змішують з наступними порціями для повторного розчинення Загальний вихід, одержаний за допомогою кількох повторень цього процесу, склав -90-95% Стадія v Одержання 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) До суспензії гідриду натрію (60% суспензія у маслі, 13г) у диметилформаміді (70мл) додають розчин 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11) (35г), одержаної згідно з методикою, описаною вище на стадії (iv), у диметилформаміді 29 (105мл) при 5-10°С протягом приблизно 15-30 хвилин Після досягнення кімнатної температури у реакційній суміші підтримують цю температуру 1-3 години Протягом приблизно 2-3 годин повільно додають етилйодид (62г), підтримуючи температуру на рівні 25-30°С За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і видаляють розчинник при зниженому тиску з одержанням S(-)-aето кс і етил о во го ефіру формули (12) (41-42г, 9899%) Стадія vi Одержання 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) Суміш 3(-)-етил-2-етокси-3-(4бензилрксифеніл)пропюнату формули (12) (40г), одержаного згідно з методикою, описаною вище на стадії (v), каталізатора 5% Pd/C (8г) та тетрапдрофурану (120мл) піддають гідруванню при кімнатній температурі та 344,7-413,7кПа (50-60psi) тиску водню протягом 8-12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і розчинник видаляють при зниженому тиску з одержанням дебензилованого продукту формули (13) (28-29г, 97-98%) С т а д і я VII Одержання 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропюнату формули (16) Суміш 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) (25г), одержаного згідно з методикою, описаною вище на стадії (vi), метансульфонату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну масу виливають у льодяну воду і відокремлюють шар толуолу, при цьому водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі з одержанням названої сполуки формули (16) (4647г, 98-99%), у вигляді маслянистої речовини С т а д і я VIM Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До суміші 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етоксипропюнату формули (16) (45г), одержаного згідно з методикою, описаною вище на стадії (vn), та метанолу (225мл) при кімнатній температурі повільно додають 10% водний розчин гідроксиду натрію (225мл) протягом приблизно 10-15 хвилин Реакційну суміш перемішують при тій самій температурі протягом 2-4 годин За протіканням реакції стежать за допомогою ТШХ Після завершення гідролізу сполуки формули (16) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною соляною кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску, зменшив їх 60386 ЗО об'єм удвічі, і обробляють активованим вугіллям Фільтрація активованого вугілля з подальшою концентрацією толуолу до ~50мл і осадження петролейним ефіром приводить до одержання названої сполуки формули (1) (38-39г, 90-92%) Приклад 2 Стадія і Одержання 4-бензилоксибензальдепду формули (8) 4-Гідроксибензальдепд формули (7) (100г), карбонат калію (226г) та диметилформамід (500мл) поміщають до реакційної колби і перемішують протягом 15 хвилин Потім при кімнатній температурі додають бензилхлорид (114г) і реакційну масу перемішують при тій самій температурі протягом 8-10 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну, суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають 10% водним розчином гідроксиду натрію, а потім водою Розчинник видаляють при зниженому тиску і одержаний залишок розтирають з петролейним ефіром з одержанням названої сполуки формули (8) (160-165г, 93-95%) Стадія и Одержання етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) 4-Бензилоксибензальдепд формули (8) (100г), одержаний згідно з методикою, описаною вище на стадії (і), додають до розчину етилату натрію (64г) в абсолютному етанолі, а потім протягом приблизно 30-45 хвилин додають етилхлорацетат (87г), підтримуючи температуру навколишнього середовища Реакційну суміш перемішують при цій самій температурі 3-5 год За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і перемішують протягом 5-10 хвилин Одержану таким чином тверду речовину відфільтровують, промивають водою і сушать з одержанням названої сполуки формули (9) (126-129г, 90-92%) Стадія їм Одержання рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) Суміш етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) (125г), одержаного згідно з методикою, описаною вище на стадії (м), каталізатора 5% Pd/C (12,5г) та 1,4дюксану (750мл) гідрують при кімнатній температурі при тиску водню 34,5-68,9кПа (5-1 Opsi) протягом 10-15 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і розчинник видаляють при зниженому тиску з одержанням названої сполуки формули (10) (1 GO-105r, 8083%) Стадія iv Одержання рацемічного етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12а) До суспензії гідриду натрію (60% суспензія у маслі, 7,5г) у диметилформаміді (70мл) при 510°С додають розчин рацемічного етил-2пдрокси-3-(4-бензилоксифеніл)пропюнату формули (10) (40г), одержаного згідно з методикою, 60386 31 описаною вище на стадії (їм), у диметилформаміді (105мл) протягом приблизно 15-30 хвилин Після досягнення кімнатної температури у реакційній суміші підтримують цю температуру 1-3 годин Протягом приблизно 2-3 годин повільно додають етил йодид (36г), підтримуючи температуру на рівні 25-30°С За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і розчинник видаляють при зниженому тиску з одержанням названої сполуки формули (12а) (47-48г, 98-99%) Стадія v Одержання рацемічного етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13а) Суміш рацемічного етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12а) (40г), одержаного згідно з методикою, описаною вище на стадії (iv), каталізатора 5% Pd/C (8г) та тетрапдрофурану (120мл) піддають гідруванню при кімнатній температурі та тиску водню 344,7413,7кПа (50-60psi) протягом 8-12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і розчинник видаляють при зниженому тиску з одержанням названої сполуки формули (13а) (28-29г, 97-98%) Стадія vi Одержання рацемічного етил-3-[4-[2(феноксазин-10-іл)етокси]феніл]-2етоксипропюнату формули (4) Суміш рацемічного етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13а) (25г), одержаного згідно з методикою, описаною вище на стадії (v), метансульфонату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну масу виливають у льодяну воду і відокремлюють шар толуолу, при цьому водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі з одержанням названої сполуки формули (4) (4647г, 98-99%), у вигляді маслянистої речовини С т а д і я VII Одержання рацемічної 3-[4-[2-(феноксазин10-іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (5) До суміші рацемічного етил-3-[4-[2(феноксазин-10-іл)етокси]феніл]-2етоксипропюнату формули (4) (45г), одержаного згідно з методикою, описаною вище на стадії (vi), та метанолу (225мл) при кімнатній температурі повільно додають 10% водний розчин гідроксиду натрію (225мл) протягом приблизно 10-15 хвилин Реакційну суміш перемішують при цій самій температурі протягом 2-4 годин За протіканням реакції стежать за допомогою ТШХ Після завершення гідролізу сполуки формули (4) реакційну масу розводять 225мл води і промивають толуолом для видалення домішок Водний шар підкислюють розведеною соляною кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при знижено 32 му тиску, зменшив їх об'єм удвічі, і обробляють активованим вугіллям Фільтрація активованого вугілля з подальшою концентрацією толуолу до ~50мл і осадження петролейним ефіром приводять до одержання рацемічної кислоти формули (5) у вигляді твердої речовини бруднувато-білого кольору, яку відфільтровують і сушать при кімнатній температурі (~30°С) (38-39г, 90-92%) С т а д і я VIM Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До розчину рацемічної 3-[4-[2-(феноксазин10-іл)етокси]феніл]-2-етоксипропановоі кислоти формули (5) (35г), одержаної згідно з методикою, описаною вище на стадії (vn), у етилацетаті (525мл) додають Р(+)-а-метилбензиламш (10г) і суміш перемішують при кімнатній температурі протягом 2-4 годин Одержану таким чином тверду речовину відфільтровують і регенерують кислоту шляхом підкислення з одержанням (15-17г, 44-47%) 3(-)-а-етоксикислоти формули (1) R(+)aетоксикислоту, одержану з маточного розчину, рацемізують і змішують з наступними порціями для повторного розчинення Загальний вихід, одержаний за допомогою кількох повторень цього процесу, склав -90-95% Приклад З Стадія і Одержання 4-бензилоксибензальдепду формули (8) 4-Гідроксибензальдепд формули (7) (100г), карбонат калію (226г) та ацетон (500мл) поміщають до реакційної колби і перемішують протягом 15 хвилин Потім при кімнатній температурі додають бензилбромід (154г) і реакційну масу перемішують при цій самій температурі протягом 810 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають 10% водним розчином гідроксиду натрію, а потім водою Розчинник видаляють при зниженому тиску і одержаний залишок розтирають з петролейним ефіром з одержанням названої сполуки формули (8) (160-165г, 93-95%) Стадія и Одержання етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) 4-Бензилоксибензальдепд формули (8) (100г), одержаний згідно з методикою, описаною вище на стадії (і), додають до розчину етилату натрію (64г) у сухому метанолі, а потім протягом приблизно 30-45 хвилин додають метилхлорацетат (87г), підтримуючи температуру навколишнього середовища Реакційну суміш перемішують при цій самій температурі 3-5 год За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і перемішують протягом 5-10 хвилин Одержану таким чином тверду речовину відфільтровують, промивають водою і сушать з одержанням названої сполуки формули (9) (126-129г, 90-92%) Стадія їм Одержання рацемічного етил-2-пдрокси-3-(4 33 бензилоксифеніл)пропюнату формули (10) Суміш етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) (125г), одержаного згідно з методикою, описаною вище на стадії (м), каталізатора нікелю Ренея (12,5г) та 1,4-дюксану (750мл) гідрують при кімнатній температурі при тиску водню 206,8-275,8кПа (3040psi) протягом 8-10 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і розчинник видаляють при зниженому тиску з одержанням названої сполуки формули (10) (100-105г, 8083%) Стадія iv Одержання 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11) Суміш рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) (100г), одержаного згідно з методикою, описаною вище на стадії (їм), та 10% водного розчину гідроксиду натрію (500мл) перемішують при кімнатній температурі протягом 1-2 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш підкислюють розведеною соляною кислотою при 15-20°С і одержану таким чином тверду речовину відфільтровують і промивають водою з одержанням рацемічної 2-пдроксикислоти (72-77г, 80-85%) До розчину рацемічної 2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти (75г), одержаної згідно з методикою, описаною вище, у етилацетаті (1,1л) додають 3(+)а-фенілгліцинол (38г) і суміш перемішують при кімнатній температурі протягом 2-4 годин Одержану таким чином тверду речовину відфільтровують і регенерують кислоту шляхом підкислення з одержанням S(-)а-пдроксикислоти формули (11) (33-35г, 44-47%) Р(+)а-пдроксикислоту, одержану з маточного розчину, рацемізують і змішують з наступними порціями для повторного розчинення Загальний вихід, одержаний за допомогою кількох повторень цього процесу, склав -90-95% Стадія v Одержання 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) До суміші 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11) (35г), одержаної згідно з методикою, описаною вище на стадії (iv), гідроксиду калію (18г), 1,4-дюксану (350мл) та води (175мл) при 60°С додають діетилсульфат (38г) протягом приблизно 1-2 годин Реакційну суміш перемішують при цій самій температурі протягом 15-20 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (12) (3435г, 80-82%) Стадія vi Одержання 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) Суміш 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) (40г), 60386 34 одержаного згідно з методикою, описаною вище на стадії (v), 5% Pd/C (8г) та 1,4-дюксану (200мл) піддають гідруванню при кімнатній температурі та тиску водню 344,7-413,7кПа (50-60psi) протягом 12-15 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і розчинник видаляють при зниженому тиску з одержанням дебензилованої сполуки формули (13) (28-29г, 97-98%) С т а д і я VII Одержання 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропюнату формули (16) Суміш 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) (25г), одержаного згідно з методикою, описаною вище на стадії (vi), метансульфонату формули (15) (32г), карбонату калію (36г) та диметилформаміду (125мл) кип'ятять зі зворотним холодильником протягом 3-6 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну масу виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі з одержанням названої сполуки формули (16) (46-47г, 98-99%), у вигляді маслянистої речовини С т а д і я VIM Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До суміші 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етоксипропюнату формули (16) (45г), одержаного згідно з методикою, описаною вище на стадії (vn), та метанолу (225мл) при кімнатній температурі повільно додають 10% водний розчин гідроксиду натрію (225мл) протягом приблизно 10-15 хвилин Реакційну суміш перемішують при тій самій температурі протягом 2-4 годин За протіканням реакції стежать за допомогою ТШХ Після завершення гідролізу сполуки формули (16) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною соляною кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску, зменшив їх об'єм удвічі, і обробляють активованим вугіллям Фільтрація активованого вугілля з подальшою концентрацією толуолу до ~50мл і осадження петролейним ефіром (~30°С) приводить до одержання сполуки формули (1) (38-39г, 90-92%) Приклад 4 Стадія і Одержання 4-бензилоксибензальдепду формули (8) 4-Гідроксибензальдепд формули (7) (100г), карбонат калію (226г) та ацетон (500мл) поміщають до реакційної колби і перемішують протягом 15 хвилин Потім при кімнатній температурі додають бензилбромід (154г) і перемішують реакційну масу при цій самій температурі протягом 810 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають 10% водним розчином гідроксиду натрію, а 35 60386 36 потім водою Розчинник видаляють при зниженому тиску і одержаний залишок розтирають з петролейним ефіром з одержанням 4бензилоксибензальдепду формули (8) (160-165г, 93-95%) Стадія и Одержання етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) 4-Бензилоксибензальдепд формули (8) (100г), одержаний згідно з методикою, описаною вище на стадії (і), додають до розчину метилату натрію (64г) у сухому метанолі, а потім протягом приблизно 30-45 хвилин додають метилхлорацетат (87г), підтримуючи температуру навколишнього середовища Реакційну суміш перемішують при цій самій температурі 3-5 год За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і перемішують протягом 5-10 хвилин Одержану таким чином тверду речовину відфільтровують, промивають водою і сушать з одержанням названої сполуки формули (9) (126-129г, 90-92%) реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і розчинник видаляють при зниженому тиску з одержанням названої сполуки формули (13а) (28-29г, 97-98%) Стадія vi Одержання рацемічного етил-3-[4-[2(феноксазин-10-іл)етокси]феніл]-2етоксипропюнату формули (4) Суміш рацемічного етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13а) (25г), одержаного згідно з методикою, описаною вище на стадії (v), метансульфонату формули (15) (32г), карбонату калію (36г) та диметилсульфоксиду (125мл) нагрівають при 80-100°С протягом 6-8 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну масу виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі з одержанням названої сполуки формули (4) (46-47г, 98-99%) у вигляді маслянистої речовини Стадія їм Одержання рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) Суміш етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) (125г), одержаного згідно з методикою, описаною вище на стадії (м), нікелю Ренея (12,5г) та 1,4-дюксану (750мл) гідрують при кімнатній температурі при тиску водню 206,8-275,8кПа (30-40psi) протягом 8-10 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і розчинник видаляють при зниженому тиску з одержанням названої сполуки формули (10) (100-105г, 80-83%) Стадія iv Одержання рацемічного етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12а) Суміш рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) (70г), одержаного згідно з методикою, описаною вище на стадії (їм), гідроксиду калію (26г), диметилсульфоксиду (280мл) та молекулярних сит (36г) перемішують при кімнатній температурі 15 хвилин При кімнатній температурі повільно додають етилйодид (110г) протягом приблизно 15 хвилин Реакційну суміш перемішують при цій самій температурі протягом 15-20 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (12а) (61-63г, 80-82%) Одержання рацемічної 3-[4-[2-(феноксазин10-іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (5) До суміші рацемічного етил-3-[4-[2(феноксазин-10-іл)етокси]феніл]-2етоксипропюнату формули (4) (45г), одержаного згідно з методикою, описаною вище на стадії (vi), та метанолу (225мл) при кімнатній температурі повільно додають 10% водний розчин гідроксиду натрію (225мл) протягом приблизно 10-15 хвилин Реакційну суміш перемішують при цій самій температурі протягом 2-4 годин За протіканням реакції стежать за допомогою ТШХ Після завершення гідролізу сполуки формули (4) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною соляною кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску, зменшив їх об'єм удвічі, і обробляють активованим вугіллям Фільтрація активованого вугілля з подальшою концентрацією толуолу до ~50мл і осадження петролейним ефіром приводять до одержання рацемічної кислоти формули (5) у вигляді твердої речовини бруднувато-білого кольору, яку відфільтровують і сушать при кімнатній температурі (~30°С) (38-39г, 90-92%) Стадія v Одержання рацемічного етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13а) Суміш рацемічного етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12а) (40г), одержаного згідно з методикою, описаною вище на стадії (iv), каталізатора 5% Pd/C (8г) та 1,4дюксану (200мл) піддають гідруванню при кімнатній температурі та тиску водню 344,7-413,7кПа (50-60psi) протягом 8-12 годин За протіканням С т а д і я VII С т а д і я VIM Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До розчину рацемічної 3-[4-[2-(феноксазин10-іл)етокси]феніл]-2-етоксипропановоі кислоти формули (5) (35г), одержаної згідно з методикою, описаною вище на стадії (vn), у ацетоні (350 мл) додають 3(+)-фенілгліцинол (11,5г) і суміш перемішують при кімнатній температурі протягом 2-4 годин Одержану таким чином тверду речовину відфільтровують і регенерують кислоту шляхом підкислення з одержанням 3(-)-а-етоксикислоти формули (1) (15-17г, 44-47%) R(+)aетоксикислоту, одержану з маточного розчину, рацемізують і змішують з наступними порціями 37 для повторного розчинення Загальний вихід, одержаний за допомогою кількох повторень цього процесу, склав -90-95% Приклад 5 Стадія і Одержання 4-бензилоксибензальдепду формули (В) 4-Гідроксибензальдепд формули (7) (100г), карбонат калію (226г) та диметилформамід (500мл) поміщають до реакційної колби і перемішують протягом 15 хвилин Потім додають при кімнатній температурі бензилхлорид (114г) і реакційну масу перемішують при цій самій температурі протягом 8-10 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають 10% водним розчином гідроксиду натрію, а потім водою Розчинник видаляють при зниженому тиску і одержаний залишок розтирають з петролейним ефіром з одержанням названої сполуки формули (8) (160165г, 93-95%) Стадія и Одержання етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) Суміш 4-бензилоксибензальдепду формули (8) (100г), одержаного згідно з методикою, описаною вище на стадії (і), карбонату калію (260г), диметилформаміду (500мл), етил хлорацетату (86г) та броміду тетрабутиламонію (1г) перемішують при кімнатній температурі протягом 30-45 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і перемішують протягом 5-10 хвилин Одержану таким чином тверду речовину відфільтровують, промивають водою і сушать з одержанням названої сполуки формули (9) (126-129г, 90-92%) Стадія їм Одержання рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) Суміш етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) (125г), одержаного згідно з методикою, описаною вище на стадії (м), каталізатора 5% Pd/C (12,5г) та 1,4дюксану (750мл) гідрують при кімнатній температурі при тиску водню 34,5-68,9кПа (5-1 Opsi) протягом 10-15 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (10) (100-105г, 8083%) Стадія iv Одержання 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11) Суміш рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) (100г), одержаного згідно з методикою, описаною вище на стадії (їм), та 10% водного розчину гідроксиду натрію (500мл) перемішують при кімнатній температурі протягом 1-2 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш підкислюють 60386 38 розведеною соляною кислотою при 15-20°С і одержану таким чином тверду речовину відфільтровують і промивають водою з одержанням рацемічної 2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти (72-77г, 8085%) До розчину рацемічної 2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти (75г), одержаної згідно з методикою, описаною вище, у етилацетаті (1,1л) додають н-октилглюкозамін (81г) і суміш перемішують при кімнатній температурі протягом 2-4 годин Одержану таким чином тверду речовину відфільтровують і регенерують кислоту шляхом підкислення з одержанням S(-)а-пдроксикислоти формули (11) (33-35г, 44-47%) Р(+)а-пдроксикислоту, одержану з маточного розчину, рацемізують і змішують з наступними порціями для повторного розчинення Загальний вихід, одержаний за допомогою кількох повторень цього процесу, склав -90-95% Стадія v Одержання 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) До суспензії гідриду натрію (60% суспензія у маслі, 13г) у диметилформаміді (70мл) при 510°С додають розчин 3(-)-2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11) (35г), одержаної згідно з методикою, описаною вище на стадії (iv), у диметилформаміді (105мл) протягом приблизно 15-30 хвилин Після досягнення кімнатної температури у реакційній суміші, підтримують цю температуру 1-3 години Протягом приблизно 2-3 годин повільно додають етилйодид (62г), підтримуючи температуру на рівні 25-30°С За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (12) (41-42г, 98-99%) Стадія vi Одержання 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) Суміш 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) (40г), одержаного згідно з методикою, описаною вище на стадії (v), каталізатора 5% Pd/C (8г) та тетрапдрофурану (120мл) піддають гідруванню при кімнатній температурі та тиску водню 344,7413,7кПа (50-60psi) протягом 8-12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і видаляють розчинник при зниженому тиску з одержанням сполуки формули (13) (28-29г, 9798%) С т а д і я VII Одержання 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропюнату формули (16) Суміш 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) (25г), одержаного згідно з методикою, описаною вище на стадії (vi), метансульфонату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 39 15-20 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну масу виливають «у льодяну воду і відокремлюють шар толуолу, при цьому водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі з одержанням названої сполуки формули (16) (4647г, 98-99%), у вигляді маслянистої речовини С т а д і я VIM Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До суміші 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етоксипропюнату формули (16) (45г), одержаного згідно з методикою, описаною вище на стадії (vn), та метанолу (225мл) при кімнатній температурі повільно додають 10% водний розчин гідроксиду натрію (225мл) протягом приблизно 10-15 хвилин Реакційну суміш перемішують при тій самій температурі протягом 2-4 годин За протіканням реакції стежать за допомогою ТШХ Після завершення гідролізу сполуки формули (16) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною соляною кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску, зменшив їх об'єм удвічі, і обробляють активованим вугіллям Фільтрація активованого вугілля з подальшою концентрацією толуолу до ~50мл і осадження петролейним ефіром (~30°С) приводить до одержання названої сполуки формули (1) (38-39г, 9092%) Приклад 6 Стадія і Одержання 4-бензилоксибензальдепду формули (8) 4-Гідроксибензальдепд формули (7) (100г), карбонат калію (226г) та диметилформамід (500мл) поміщають до реакційної колби і перемішують протягом 15 хвилин Потім при кімнатній температурі додають бензилхлорид (114г) і реакційну масу перемішують при цій самій температурі протягом 8-10 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають 10% водним розчином гідроксиду натрію, а потім водою Розчинник видаляють при зниженому тиску і одержаний залишок розтирають з петролейним ефіром з одержанням названої сполуки формули (8) (160-165г, 93-95%) Стадія и Одержання етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) Суміш 4-бензилоксибензальдепду формули (8) (100г), одержаного згідно з методикою, описаною вище на стадії (і), карбонату калію (260г), диметилформаміду (500мл), етил хлорацетату (86г) та броміду тетрабутиламонію (1г) перемішують при кімнатній температурі протягом 30-45 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і перемішують 60386 40 протягом 5-10 хвилин Одержану таким чином тверду речовину відфільтровують, промивають водою і сушать з одержанням названої сполуки формули (9) (126-129г, 90-92%) Стадія їм Одержання рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) Суміш етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) (125г), одержаного згідно з методикою, описаною вище на стадії (м), 5% Pd/C (12,5г) та 1,4-дюксану (750мл) гідрують при кімнатній температурі при тиску водню 34,5-68,9кПа (5-1 Opsi) протягом 1015 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і розчинник видаляють при зниженому тиску з одержанням названої сполуки формули (10) (100-105г, 80-83%) Стадія iv Одержання рацемічного етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12а) До суспензії гідриду натрію (60% суспензія у маслі, 7,5г) у диметилформаміді (70мл) при 510°С додають розчин рацемічного етил-2пдрокси-3-(4-бензилоксифеніл)пропюнату формули (10) (40г), одержаного згідно з методикою, описаною вище на стадії (їм), у диметилформаміді (105мл) протягом приблизно 15-30 хвилин Після досягнення кімнатної температури у реакційній суміші підтримують цю температуру 1-3 години Протягом приблизно 2-3 годин повільно додають етилйодид (36г), підтримуючи температуру на рівні 25-30°С За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (12а) (47-48г, 98-99%) Стадія v Одержання рацемічного етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13а) Суміш рацемічного етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12а) (40г), одержаного згідно з методикою, описаною вище на стадії (iv), 5% Pd/C (8г) та тетрапдрофурану (120мл) піддають гідруванню при кімнатній температурі та тиску водню 344,7-413,7кПа (50-60psi) протягом 8-12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і розчинник видаляють при зниженому тиску з одержанням названої сполуки формули (13а) (28-29г, 97-98%) Стадія vi Одержання рацемічного етил-3-[4-[2(феноксазин-10-іл)етокси]феніл]-2етоксипропюнату формули (4) Суміш рацемічного етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13а) (25г), одержаного згідно з методикою, описаною вище на стадії (v), метансульфонату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну масу виливають у льодяну воду і екстрагу 60386 42 41 ють толуолом Об'єднані органічні екстраісги проСтадія и мивають водою і концентрують у вакуумі з одерОдержання 4-пдроксифеніл піровиноградної жанням рацемічного ефіру формули (4) (46-47г, кислоти формули (19) 98-99%), у вигляді маслянистої речовини До 5-(4-пдроксибензаль)пдантошу формули С т а д і я VII (18) (7,5г, 0,367моль), одержаного згідно з методикою, описаною вище на стадії (і), повільно доОдержання рацемічної 3-[4-[2-(феноксазиндають гідроксид натрію (20%, 2,1л) Реакційну 10-іл)етокси]феніл]-2-етокси-пропановоі кислоти суміш нагрівають до 160-170°С 3 години За проформули (5) тіканням реакції стежать за допомогою ТШХ ПісДо суміші рацемічного етил-3-[4-[2ля завершення реакції реакційну суміш охоло(феноксазин-10-іл)етокси]феніл]-2джують до 0-5°С і підкислюють 12Н НСІ етоксипропюнату формули (4) (45г), одержаного Реакційну суміш підлуговують бікарбонатом назгідно з методикою, описаною вище на стадії (vi), трію і промивають діетиловим ефіром Водний та метанолу (225мл) при кімнатній температурі шар підкислюють 12Н НСІ і екстрагують діетилоповільно додають 10% водний розчин гідроксиду вим ефіром Об'єднані ефірні шари сушать з оденатрію (225мл) протягом приблизно 10-15 хвиржанням сирового продукту Сировий продукт лин Реакційну суміш перемішують при цій самій (10г) перекристалізовують з водної соляної кистемпературі протягом 2-4 годин За протіканням лоти з одержанням названої сполуки формули реакції стежать за допомогою ТШХ Після завершення гідролізу сполуки формули (4) реакційну (19) (6,5г, 65%) масу розводять водою (225мл) і промивають тоСтадія їм луолом для видалення домішок Водний шар підОдержання рацемічного етил-2-пдрокси-3-(4кислюють розведеною соляною кислотою і екстпдроксифеніл)пропюнату формули (20) рагують толуолом Об'єднані органічні екстракти 4-Гідроксифенілпіровиноградну кислоту фопромивають водою і концентрують при зниженормули (19) (30г, 0,166моль), одержану згідно з му тиску, зменшив їх об'єм удвічі, і обробляють методикою, описаною вище на стадії (м), розчиактивованим вугіллям Фільтрація активованого няють у етилацетаті (500мл), додають 5%-вим вугілля з наступною концентрацією толуолу до вмістом Pd-C (5,0г) і гідрують при тиску водню ~50мл і осадження петролейним ефіром приво413,7кПа (60psi) За протіканням реакції стежать дять до одержання рацемічної кислоти формули за допомогою ТШХ Після завершення реакції (5) у вигляді бруднувато-білої твердої речовини, відфільтровують каталізатор і упарюють розчиняку відфільтровують і сушать при кімнатній темник з одержанням рацемічної 2-пдрокси-3-(4пературі (~30°С) (38-39г, 90-92%) пдроксифеніл)пропюновоі кислоти (28г, 93%) С т а д і я VIM Рацемічну 2-пдрокси-3-(4Одержання 3(-)-3-[4-[2-(феноксазин-10пдроксифеніл)пропюнову кислоту (30г, іл)етокси]феніл]-2-етокси-пропановоі кислоти 0,164моль), одержану згідно з методикою, описаформули (1) ною вище, розчинену у 5%-вому етанольному розчині сірчаної кислоти (600мл), кип'ятять зі До розчину рацемічної 3-[4-[2-(феноксазинзворотним холодильником 6 годин Реакційну 10-іл)етокси]феніл]-2-етоксипропановоі кислоти суміш охолоджують до кімнатної температури і формули (5) (35г), одержаної згідно з методикою, концентрують Одержаний залишок розводять описаною вище на стадії (vn), у етилацетаті етилацетатом і промивають водою Етилацетат(525мл) додають н-октил глюкозам і н (24,5г) і суний шар відокремлюють і упарюють з одержанміш перемішують при кімнатній температурі проням рацемічного етил-2-пдрокси-3-(4тягом 2-4 годин Одержану таким чином тверду пдроксифеніл)пропюнату формули (20) (24г, речовину відфільтровують і регенерують кислоту 75%) шляхом підкислення з одержанням S(-)-aетоксикислоти формули (1) (15-17г, 44-47%) Стадія iv Р(+)а-етоксикислоту, одержану з маточного розОдержання рацемічного етил-2-пдрокси-3-(4чину, рацемізують і змішують з наступними порбензилоксифеніл)пропюнату формули (10) ціями для повторного розчинення Загальний Рацемічний етил-2-пдрокси-3-(4вихід, одержаний за допомогою кількох повтопдроксифеніл)пропюнат формули (20) (5г, рень цього процесу, склав -90-95% 0,025моль), одержаний згідно з методикою, описаною вище на стадії (їм), бензилхлорид (3,54г, Приклад 7 0,028моль), карбонат калію (8,0г, 0,058моль) поСтадія і міщають у диметилформамід (ЮОмл) і переміОдержання 5-(4-пдроксибензаль)пдантошу шують при кімнатній температурі 12 годин За формули (18) протіканням реакції стежать за допомогою ТШХ Суміш 4-пдроксибензальдепду (100г, Після завершення реакції до реакційної суміші 0,819моль), пдантошу (90г, 0,9моль) та піперидидодають льодяну воду і екстрагують її діетилону (165мл) нагрівають до 130°С 1 годину За провим ефіром Об'єднані ефірні екстракти упарютіканням реакції стежать за допомогою ТШХ Пісють з одержанням рацемічного етил-2-пдрокси-Зля завершення реакції реакційну суміш (4-бензилоксифеніл)пропюнату формули (10) охолоджують до 60°С і додають 3,2л води Реак(5,5г, 76%) ційну суміш підкислюють 12Н НСІ Тверду речовину, що випала до осаду, відфільтровують і Стадія v промивають холодною водою з одержанням наОдержання 3(-)-2-гідрокси-3-(4званої сполуки формули (18) (147г, 88%), (Org бензилоксифеніл)пропюновоі кислоти формули Syn vol V, рр 627) (11) 43 Суміш рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) (100г), одержаного згідно з методикою, описаною вище на стадії (iv), та 10% водного розчину гідроксиду натрію (500мл) перемішують при кімнатній температурі протягом 1-2 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш підкислюють розведеною соляною кислотою при 15-20°С і одержану таким чином тверду речовину відфільтровують і промивають водою з одержанням рацемічної 2-пдроксикислоти (72-77г, 80-85%) До розчину рацемічної етил-2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти (75г), одержаної згідно з методикою, описаною вище, у етилацетаті (1,1л) додають R(+)-aметилбензиламш (33г) і суміш перемішують при кімнатній температурі протягом 2-4 годин Одержану таким чином тверду речовину відфільтровують і регенерують кислоту шляхом підкислення з одержанням 3(-)-2-пдрокси-3-(4бензилоксифеніл)проііюновоі кислоти формули (11) (33-35г, 44-47%), Щ+)-а-пдрокси кислоту, одержану з маточного розчину, рацемізують і змішують з наступними порціями для повторного розчинення Загальний вихід, одержаний за допомогою кількох повторень цього процесу, склав -90-95% Стадія vi Одержання 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) До суспензії гідриду натрію (60% суспензія у маслі, 13г) у диметилформаміді (70мл) при 510°С додають розчин 3(-)-2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11) (35г), одержаної згідно з методикою, описаною вище на стадії (v), у диметилформаміді (105мл) протягом приблизно 15-30 хвилин Після досягнення кімнатної температури у реакційній суміші, підтримують цю температуру 1-3 години Протягом приблизно 2-3 годин повільно додають етил йодид (62г), підтримуючи температуру на рівні 25-30°С За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (12) (41-42г, 98-99%) С т а д і я VII Одержання 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) Суміш 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) (40г), одержаного згідно з методикою, описаною вище на стадії (vi), каталізатора 5% Pd/C (8г) та тетрапдрофурану (120мл) піддають гідруванню при кімнатній температурі та тиску водню 344,7413,7кПа (50-60psi) протягом 8-12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (13) (28-29г, 97-98%) С т а д і я VIM Одержання 3(-)-етил-3-[4-[2-(феноксазин-10 60386 44 іл)етокси]феніл]-2-етокси-пропюнату формули (16) Суміш 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) (25г), одержаного згідно з методикою, описаною вище на стадії (vn), метансульфонату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну масу виливають у льодяну воду і відокремлюють шар толуолу, при цьому водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі з одержанням названої сполуки формули (16) (4647г, 98-99%), у вигляді маслянистої речовини Стадія їх Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До суміші 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етоксипропюнату формули (16) (45г), одержаного згідно з методикою, описаною вище на стадії (VIM), та метанолу (225мл) при кімнатній температурі повільно додають 10% водний розчин гідроксиду натрію (225мл) протягом приблизно 10-15 хвилин Реакційну суміш перемішують при тій самій температурі протягом 2-4 годин За протіканням реакції стежать за допомогою ТШХ Після завершення гідролізу сполуки формули (16) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною соляною кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску, зменшив їх об'єм удвічі, і обробляють активованим вугіллям Фільтрація активованого вугілля з наступною концентрацією толуолу до ~50мл і осадження петролейним ефіром приводить до одержання названої сполуки формули (1) (38-39г, 90-92%) Приклад 8 Стадія і Одержання 5-(4-пдроксибензаль)пдантошу формули (18) Суміш 4-пдроксибензальдепду (100г, 0,819моль), пдантошу (90г, 0,9моль) та піперидину (165мл) нагрівають до 130°С 1 годину За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш охолоджують до 60°С і додають 3,2л води Реакційну суміш підкислюють 12Н НСІ Тверду речовину, що випала до осаду, відфільтровують і промивають холодною водою, одержуючи названу сполуку формули (18) (147г, 88%), (Org Syn Vol V, рр 627) Стадія и Одержання 4-пдроксифеніл піровиноградної кислоти формули (19) До 5-(4-пдроксибензаль)пдантошу формули (18) (7,5г, 0,367моль), одержаного згідно з методикою, описаною вище на стадії (і), повільно додають гідроксид натрію (20%, 2,1л) Реакційну суміш нагрівають до 160-170°С 3 години За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш охоло 45 джують до 0-5°С і підкислюють 12Н НСІ Реакційну суміш підлуговують бікарбонатом натрію і промивають діетиловим ефіром Водний шар підкислюють 12Н НСІ і екстрагують діетиловим ефіром Об'єднані ефірні шари сушать з одержанням сирового продукту Сировий продукт (10г) перекристалізовують з водної соляної кислоти з одержанням названої сполуки формули (19) (6,5г, 65%) Стадія ї м Одержання рацемічного етил-2-пдрокси-3-(4пдроксифеніл)пропюнату формули (20) 4-Гідроксифенілпіровиноградну кислоту формули (19) (30г, 0,166моль), одержану згідно з методикою, описаною вище на стадії (м), розчиняють у етанолі (500мл), додають 5% Pd-C (5,0г) і гідрують при тиску водню 413,7кПа (60psi) За протіканням реакції стежать за допомогою ТШХ Після завершення реакції відфільтровують каталізатор і упарюють розчинник з одержанням рацемічного етил-2-пдрокси-3-(4пдроксифеніл)пропюнату формули (20) (28г, 93%) Стадія iv Одержання рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) Рацемічний етил-2-пдрокси-3-(4пдроксифеніл)пропюнат формули (20) (5г, 0,025моль), одержаний згідно з методикою, описаною вище на стадії (їм), бензилхлорид (3,54 г, 0,028 моль), карбонат калію (8,0 г, 0,058 моль) поміщають у диметилформамід (ЮОмл) і перемішують при кімнатній температурі 12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції до реакційної суміші додають льодяну воду і екстрагують її діетиловим ефіром Об'єднані ефірні екстракти упарюють з одержанням рацемічного етил-2-пдрокси-З(4-бензилоксифеніл)пропюнату формули (10) (5,5г, 76%) Стадія v Одержання 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11) Суміш рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) (100г), одержаного згідно з методикою, описаною вище на стадії (iv), та 10% водного розчину гідроксиду натрію (500мл) перемішують при кімнатній температурі протягом 1-2 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш підкислюють розведеною соляною кислотою при 15-20°С і одержану таким чином тверду речовину відфільтровують і промивають водою з одержанням рацемічної 2-пдроксикислоти (72-77г, 80-85%) До розчину рацемічної етил-2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти (75г), одержаної згідно з методикою, описаною вище, у етилацетаті (1,1л) додають R(+)-aметилбензиламш (33г) і перемішують суміш при кімнатній температурі протягом 2-4 годин Одержану таким чином тверду речовину відфільтровують і регенерують кислоту шляхом підкислення з одержанням 3(-)-2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули 60386 46 (11) (33-35г, 44-47%) Щ+)-а-пдрокси кислоту, одержану з маточного розчину, рацемізують і змішують з наступними порціями для повторного розчинення Загальний вихід, одержаний за допомогою кількох повторень цього процесу, склав -90-95% Стадія vi Одержання 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) До суспензії гідриду натрію (60% суспензія у маслі, 13г) у диметилформаміді (70мл) при 510°С додають розчин 3(-)-2-пдрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11) (35г), одержаної згідно з методикою, описаною вище на стадії (v), у диметилформаміді (105мл) протягом приблизно 15-30 хвилин Після досягнення кімнатної температури у реакційній суміші, підтримують цю температуру 1-3 години Протягом приблизно 2-3 годин повільно додають етил йодид (62г), підтримуючи температуру на рівні 25-30°С За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (12) (41-42г, 98-99%) С т а д і я VII Одержання 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) Суміш 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) (40г), одержаного згідно з методикою, описаною вище на стадії (vi), каталізатора 5% Pd/C (8г) та тетрапдрофурану (120мл) піддають гідруванню при кімнатній температурі та тиску водню 344,7413,7кПа (50-60psi) протягом 8-12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (13) (28-29г, 97-98%) С т а д і я VIM Одержання 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропюнату формули (16) Суміш 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) (25г), одержаного згідно з методикою, описаною вище на стадії (vn), метансульфонату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну масу виливають у льодяну воду і відокремлюють шар толуолу, при цьому водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі з одержанням названої сполуки формули (16) (4647г, 98-99%), у вигляді маслянистої речовини Стадія їх Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До суміші 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етоксипропюнату формули 47 (16) (45г), одержаного згідно з методикою, описаною вище на стадії (VIM), та метанолу (225мл) при кімнатній температурі повільно додають 10% водний розчин гідроксиду натрію (225мл) протягом приблизно 10-15 хвилин Реакційну суміш перемішують при тій самій температурі протягом 2-4 годин За протіканням реакції стежать за допомогою ТШХ Після завершення гідролізу сполуки формули (16) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною соляною кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску, зменшив їх об'єм удвічі, і обробляють активованим вугіллям Фільтрація активованого вугілля з наступною концентрацією толуолу до ~50мл і осадження петролейним ефіром приводить до одержання названої сполуки формули (1) (38-39г, 90-92%) Приклад 9 Стадія і Одержання 5-(4-пдроксибензаль)пдантошу формули (18) Суміш 4-пдроксибензальдепду (100г, 0,819моль), пдантошу (90г, 0,9моль) та піперидину (165мл) нагрівають до 130°С 1 годину За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш охолоджують до 60°С і додають 3,2л води Реакційну суміш підкислюють 12Н НСІ Тверду речовину, що випала до осаду, відфільтровують і промивають холодною водою з одержанням названої сполуки формули (18) (147г, 88%), (Од Syn Vol V, pp 627) Стадія и Одержання 4-пдроксифеніл піровиноградної кислоти формули (19) До 5-(4-пдроксибензаль)пдантошу формули (18) (7,5г, 0,367моль), одержаного згідно з методикою, описаною вище на стадії (і), повільно додають гідроксид натрію (20%, 2,1л) Реакційну суміш нагрівають до 160-170°С 3 години За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш охолоджують до 0-5°С і підкислюють 12Н НСІ Реакційну суміш підлуговують бікарбонатом натрію і промивають діетиловим ефіром Водний шар підкислюють 12Н НСІ і екстрагують діетиловим ефіром Об'єднані ефірні шари сушать з одержанням сирового продукту Сировий продукт (10г) перекристалізовують з водної соляної кислоти з одержанням названої сполуки формули (19) (6,5г, 65%) Стадія їм Одержання рацемічного етил-2-пдрокси-3-(4пдроксифеніл)пропюнату формули (20) 4-Гідроксифенілпіровиноградну кислоту формули (19) (30г, 0,166моль), одержану згідно з методикою, описаною вище на стадії (м), розчиняють у етилацетаті (500мл), додають 5% Pd-C (5,0г) і гідрують при тиску водню 413,7кПа (60psi) За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і упарюють розчинник з одержанням рацемічної 2-пдрокси-3-(4пдроксифеніл)пропюновоі кислоти (28г, 93%) 60386 48 Рацемічну 2-пдрокси-3-(4пдроксифеніл)пропюнову кислоту (30г, 0,164моль), одержану згідно з методикою, описаною вище, розчинену у 5%-вому етанольному розчині сірчаної кислоти (600мл), кип'ятять зі зворотним холодильником 6 годин Реакційну суміш охолоджують до кімнатної температури і концентрують Одержаний залишок розводять етилацетатом і промивають водою Етилацетатний шар відокремлюють і упарюють з одержанням рацемічного етил-2-пдрокси-3-(4пдроксифеніл)пропюнату формули (20) (24г, 75%) Стадія iv Одержання рацемічного ет*ил-2-пдрокси-3(4-бензилоксифент)пропюнату формули (10) Рацемічний етил-2-пдрокси-3-(4пдроксифеніл)пропюнат формули (20) (5г, 0,025моль), одержаний згідно з методикою, описаною вище на стадії (їм), бензилхлорид (3,54г, 0,028моль), карбонат калію (8,0г, 0,058моль) поміщають у диметилформамід (ЮОмл) і перемішують при кімнатній температурі 12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції до реакційної суміші додають льодяну воду і екстрагують її діетиловим ефіром Об'єднані ефірні екстракти упарюють з одержанням рацемічного етил-2-пдрокси-З(4-бензилоксифеніл)пропюнату формули (10) (5,5г, 76%) Стадія v Одержання рацемічного етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12а) До суспензії гідриду натрію (60% суспензія у маслі, 7,5г) у диметилформаміді (70мл) при 510°С додають розчин рацемічного етил-2пдрокси-3-(4-бензилоксифеніл)пропюнату формули (10) (40г), одержаного згідно з методикою, описаною вище на стадії (iv), у диметилформаміді (105мл) протягом приблизно 15-30 хвилин Після досягнення кімнатної температури у реакційній суміші, підтримують цю температуру 1-3 години Протягом приблизно 2-3 годин повільно додають етилйодид (36г), підтримуючи температуру на рівні 25-30°С За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (12а) (47-48г, 98-99%) Стадія vi Одержання рацемічного етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13а) Суміш рацемічного етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12а) (40г), одержаного згідно з методикою, описаною вище на стадії (v), каталізатора 5% Pd/C (8г) та тетрапдрофурану (120мл) піддають гідруванню при кімнатній температурі та тиску водню 344,7413,7кПа (50-60psi) протягом 8-12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (13а) (28-29г, 97-98%) 49 С т а д і я VII Одержання рацемічного етил-3-[4-[2(феноксазин-10-іл)етокси]феніл]-2етоксипропюнату формули (4) Суміш рацемічного етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13а) (25г), одержаного згідно з методикою, описаною вище на стадії (vi), метансульфонату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну масу виливають у льодяну воду і відокремлюють шар толуолу, при цьому водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі з одержанням рацемічного ефіру формули (4) (4647г, 98-99%), у вигляді маслянистої речовини С т а д і я VIM Одержання рацемічної 3-[4-[2-(феноксазин10-іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (5) До суміші рацемічного етил-3-[4-[2(феноксазин-10-іл)етокси]феніл]-2етоксипропюнату формули (4) (45г), одержаного згідно з методикою, описаною вище на стадії (vn), та метанолу (225мл) при кімнатній температурі повільно додають 10% водний розчин гідроксиду натрію (225мл) протягом приблизно 10-15 хвилин Реакційну суміш перемішують при цій самій температурі протягом 2-4 годин За протіканням реакції стежать за допомогою ТШХ Після завершення гідролізу сполуки формули (4) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною соляною кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску, зменшив їх об'єм удвічі, і обробляють активованим вугіллям Фільтрація активованого вугілля з наступною концентрацією толуолу до ~50мл і осадження петролейним ефіром приводять до одержання рацемічної кислоти формули (5) у вигляді бруднувато-білої речовини, яку відфільтровують і сушать при кімнатній температурі (~30°С) (38-39г, 90-92%) Стадія їх Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До розчину рацемічної 3-[4-[2-(феноксазин10-іл)етокси]феніл]-2-етоксипропановоі кислоти формули' (5) (35г), одержаної згідно з методикою, описаною вище на стадії (VIM), у етилацетаті (525мл) додають Р(+)-а-метилбензиламш (10г) і суміш перемішують при кімнатній температурі протягом 2-4 годин Одержану таким чином тверду речовину відфільтровують і регенерують кислоту шляхом підкислення з одержанням (15-17г, 44-47%) 3(-)-а-етоксикислоти формули (1) R(+)а-етоксикислоту, одержану з маточного розчину, рацемізують і змішують з наступними порціями для повторного розчинення Загальний вихід, одержаний за допомогою кількох повторень цього процесу, склав -90-95% Приклад 10 60386 50 Стадія і Одержання 5-(4-пдроксибензаль)пдантошу формули (18) Суміш 4-пдроксибензальдепду (100г, 0,819моль), пдантошу (90г, 0,9моль) та піперидину (165мл) нагрівають до 130°С 1 годину За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш охолоджують до 60°С і додають 3,2л води Реакційну суміш підкислюють 12Н НСІ Тверду речовину, що випала до осаду, відфільтровують і промивають холодною водою, одержуючи названу сполуку формули (18) (147г, 88%), (Org Syn Vol V, рр 627) Стадія и Одержання 4-пдроксифеніл піровиноградної кислоти формули (19) До 5-(4-пдроксибензаль)пдантошу формули (18) (7,5г, 0,367моль), одержаного згідно з методикою, описаною вище на стадії (і), повільно додають гідроксид натрію (20%, 2,1л) Реакційну суміш нагрівають до 160-170°С 3 години За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш охолоджують до 0-5°С і підкислюють 12Н НСІ Реакційну суміш підлуговують бікарбонатом натрію і промивають діетиловим ефіром Водний шар підкислюють 12Н НСІ і екстрагують діетиловим ефіром Об'єднані ефірні шари сушать з одержанням сирового продукту Сировий продукт (10г) перекристалізовують з водної соляної кислоти з одержанням названої сполуки формули (19) (6,5г, 65%) Стадія їм Одержання рацемічного етил-2-пдрокси-3-(4пдроксифеніл)пропюнату формули (20) 4-Гідроксифенілпіровиноградну кислоту формули (19) (30г, 0,166моль), одержану згідно з методикою, описаною вище на стадії (м), розчиняють у метанолі (500мл), додають 5% Pd-C (5,0г) і гідрують при тиску водню 413,7кПа (60psi) За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і упарюють розчинник з одержанням рацемічного 2-пдрокси-3-(4пдроксифеніл)пропюнату формули (20) (28г, 93%) Стадія iv Одержання рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) Рацемічний етил-2-пдрокси-3-(4пдроксифеніл)пропюнат формули (20) (5г, 0,025моль), одержаний згідно з методикою, описаною вище на стадії (їм), бензилхлорид (3,54г, 0,028моль), карбонат калію (8,0г, 0,058моль) поміщають у диметилформамід (ЮОмл) і перемішують при кімнатній температурі 12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції до реакційної суміші додають льодяну воду і екстрагують її діетиловим ефіром Об'єднані ефірні екстракти упарюють з одержанням рацемічного етил-2-пдрокси-З(4-бензилоксифеніл)пропюнату формули (10) (5,5г, 76%) Стадія v Одержання рацемічного етил-2-етокси-3-(4 60386 51 бензилоксифеніл)пропюнату формули (12а) До суспензії гідриду натрію (60% суспензія у маслі, 7,5г) у диметилформаміді (70мл) при 510°С додають розчин рацемічного етил-2пдрокси-3-(4-бензилоксифеніл)пропюнату формули (10) (40г), одержаного згідно з методикою, описаною вище на стадії (iv), у диметилформаміді (105мл) протягом приблизно 15-30 хвилин Після досягнення кімнатної температури у реакційній суміші, підтримують цю температуру 1-3 години Протягом приблизно 2-3 годин повільно додають етилйодид (36г), підтримуючи температуру на рівні 25-30°С За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають водою і видаляють розчинник при зниженому тиску з одержанням рацемічного 2-ето кс і етилового ефіру формули (12а) (47-48г, 98-99%) Стадія vi Одержання рацемічного етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13а) Суміш рацемічного етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12а) (40г), одержаного згідно з методикою, описаною вище на стадії (v), каталізатора 5% Pd/C (8г) та тетрапдрофурану (120мл) піддають гідруванню при кімнатній температурі та тиску водню 344,7413,7кПа (50-60psi) протягом 8-12 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції каталізатор відфільтровують і видаляють розчинник при зниженому тиску з одержанням названої сполуки формули (13а) (28-29г, 97-98%) С т а д і я VII Одержання рацемічного етил-3-[4-[2(феноксазин-10-іл)етокси]феніл]-2етоксипропюнату формули (4) Суміш рацемічного етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13а) (25г), одержаного згідно з методикою, описаною вище на стадії (vi), метансульфонату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну масу виливають у льодяну воду і відокремлюють шар толуолу, при цьому водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі з одержанням рацемічного ефіру формули (4) (4647г, 98-99%), у вигляді маслянистої речовини С т а д і я VIM Одержання рацемічної 3-[4-[2-(феноксазин10-іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (5) До суміші рацемічного етил-3-[4-[2(феноксазин-10-іл)етокеи]феніл]-2етоксипропюнату формули (4) (45г), одержаного згідно з методикою, описаною на стадії (vn), та метанолу (225мл) при кімнатній температурі повільно додають 10% водний розчин гідроксиду натрію (225мл) протягом приблизно 10-15 хвилин Реакційну суміш перемішують при цій самій температурі протягом 2-4 годин За протіканням 52 реакції стежать за допомогою ТШХ Після завершення гідролізу сполуки формули (4) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною соляною кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску, зменшив їх об'єм удвічі, і обробляють активованим вугіллям Фільтрація активованого вугілля з наступною концентрацією толуолу до ~50мл і осадження петролейним ефіром приводять до одержання рацемічної кислоти формули (5) у вигляді бруднувато-білої речовини, яку відфільтровують і сушать при кімнатній температурі (~30°С) (38-39г, 90-92%) Стадія їх Одержання (2S5),N(1S)-3-[4-[2-№eHOKca3HH10-іл)етокси]феніл]-2-етокси-М-(2-пдрокси-1фенілетил)пропанаміду формули (6) Рацемічну 3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етоксипропанову кислоту формули (5) (55г, 0,13моль), одержану згідно з методикою, описаною вище на стадії (VIM), S(+)-2фенілгліцинол (18г, 0,13моль) та 1пдроксибензотіазол (18г, 0,13моль) розчиняють у етилацетаті (800мл) До вищеописаної реакційної суміші додають дициклогексилкарбодммід (29,5г, 0,14моль), розчинений у етилацетаті (200мл), і перемішують її протягом 3 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції дициклогексилсечовину відфільтровують, а етилацетатний шар промивають водою і упарюють з одержанням сирового продукту Сировий продукт розчиняють у етилацетаті і осаджують петролейним ефіром, одержуючи названу сполуку формули (6) (29г, 82%) Стадія х Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси пропанової кислоти формули (1) (2S),N(1S)-3-[4-[2-№eHOKca3HH-10іл)етокси]феніл]-2-етокси-М-(2-пдрокси-1фенілетил)пропанамід формули (6) (50г, 0,09моль), одержаний згідно з методикою, описаною вище на стадії (їх), розчинений у 1,4-дюксані (1650мл), додають до ЗМ сірчаної кислоти (2,5л) і кип'ятять зі зворотним холодильником 16 годин За протіканням реакції стежать за допомогою ТШХ Після завершення реакції реакційну суміш екстрагують етилацетатом Об'єднані органічні екстракти промивають водою, бікарбонатом та 1Н соляною кислотою і концентрують, одержуючи названу у заголовку сполуку формули (1) (31г, 79%) Приклад 11 Стадія і Одержання (S)-2-aMiHO-3-(4бензилоксифеніл)пропюновоі кислоти формули (22) До розчину L-тирозину формули (21) (18,1г) у 2Н розчині NaOH (115мл) додають розчин сульфату купруму (12,5г CuSO4 у 50мл води) і нагрівають при 60°С протягом 1,5 години Реакційну суміш охолоджують до кімнатної температури і додають метанол (350мл) та 2Н NaOH (12,5мл), а потім по краплях додають бромистий бензил 53 (12мл) Реакційній масі дають нагрітись до кімнатної температури Осад відфільтровують і промивають, одержуючи при цьому вказану, у заголовку сполуку у вигляді не зовсім білого твердого продукту (18,5г, 66,8%) (Ref Bodansky & Воdansky, pp 50) Стадія и Одержання 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (1Г) До розчину S(-)-2-aMiHO-3-(4бензилоксифеніл)пропюновоі кислоти формули (22) (10г), одержаної згідно з методикою, описаною вище на стадії (і), у льодяній оцтовій кислоті (200мл) та хлороформі (50мл) при 0-5°С повільно протягом 1 години додають ізоаміл нітрит (13,51мл) і перемішують протягом 2 годин при кімнатній температурі За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну суміш розводять водою і сполуку екстрагують хлороформом Об'єднані органічні шари промивають водою і концентрують, одержуючи 3(-)-2-ацетоксикислоту у вигляді білої твердої речовини (13г, 78%) Суміш 3(-)-2-ацетокси-3-(4бензилоксифеніл)пропюновоі кислоти (5,0г), одержаної згідно з процедурою, описаною вище, та 10% розчину гідроксиду натрію (40мл) перемішують при кімнатній температурі протягом 8 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну суміш розводять водою, підкислюють розведеною НСІ до рН 3 і продукт екстрагують хлороформом, випарювання розчинника дає вказану у заголовку сполуку формули (11і) у ВИГЛЯДІ білої твердої речовини (3,7г, 85,4%) Стадія їм Одержання є(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) До перемішуваного розчину 3(-)-2-пдрокси-3(4-бензилоксифеніл)пропюновоі кислоти формули (11і) (2Г), одержаної згідно з методикою, описаною вище на стадії (м), у диметилсульфоксиді при кімнатній температурі додають КОН (3,32г) і перемішують протягом 1 години, потім додають йодистий етил (4,5г) і продовжують перемішування ще протягом 2 годин при кімнатній температурі За перебігом реакції спостерігають за даними ТШХ Після завершення реакції реакційну суміш екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують, одержуючи названу у заголовку сполуку формули (12) у вигляді сиропоподібної рідини (2,9г, 87%) Стадія iv Одержання 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) Розчин 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) (12г), одержаного згідно з процедурою, описаною вище на стадії (мі), у етилацетаті (120мл), 10% Pd-C (2,1г) піддають гідруванню при тиску водню 344,7-413,7кПа (50-60psi) при кімнатній температурі протягом ЗО годин За протіканням реакції стежать за даними ТШХ Після завершення реакції каталізатор відфільтровують, розчинник видаляють при зниженому тиску, одержуючи сполуку 60386 54 формули (13) (8,2г, 95%) Стадія v Одержання 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропюнату формули (16) Суміш 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) (25г), одержаного згідно з процедурою, описаною вище на стадії (iv), мезилату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну масу виливають у льодяну воду, відокремлюють толуольний шар, водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі, одержуючи названу у заголовку сполуку формули (16) (46-47г, 98-99%), у вигляді маслянистої речовини Стадія vi Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До суміші 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етоксипропюнату формули (16) (45г), одержаного згідно з методикою, описаною вище на стадії (v), та метанолу (225мл) повільно додають при кімнатній температурі протягом 10-15 хвилин водний 10% розчин гідроксиду натрію (225мл) Реакційну суміш перемішують при тій самій температурі протягом 2-4 годин За протіканням реакції спостерігають за даними ТШХ Після ПОВНОГО гідролізу сполуки формули (16) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною хлористоводневою кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску до половини об'єму, обробляють активованим вугіллям Вугілля відфільтровують, потім випарюють толуол до ~50мл, і в результаті утворення осаду при обробці петролейним ефіром одержують названу у заголовку сполуку формули (1) (38-39г, 90-%) Приклад 12 Стадія і Одержання (S)-2-aMiHO~3-(4бензилоксифеніл)пропюновоі кислоти формули (22) До розчину L-тирозину формули (21) (18,1г) у 2Н розчині NaOH (115мл) додають розчин сульфату купруму (12,5г CuSO4 у 50мл води) і нагрівають при 60°С протягом 1,5 години Реакційну суміш охолоджують до кімнатної температури і додають метанол (350мл) та 2Н NaOH (12,5мл), а потім по краплях бромистий бензил (12мл) Реакційній суміші дають нагрітись до кімнатної температури Осад відфільтровують і промивають, одержують вказану у заголовку сполуку у вигляді не зовсім білої твердої речовини (18,5г, 66,8%) (Ref Bodansky & Bodansky, pp 50) Стадія и Одержання 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11і) До перемішуваного при 0°С розчину S(-)-2 55 аміно-3-(4-бензилоксифеніл)-пропюновоі кислоти формули (22) (300г), одержаної згідно з процедурою, описаною вище на стадії (і), у тетрапдрофурані (1,8л) та розведеній H2SO4 (75мл у 1,2л води) повільно додають розчин NaNCb (210мг у 400мл НгО) при температурі між 0°С та 15°С Після завершення додавання NaNO2 реакційну суміш витримують при температурі нижче 25°С протягом 3 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну масу екстрагують холодним хлороформом чи дихлорметаном (DCM) Органічні екстракти концентрують і залишок очищають, промиваючи дизопропіловим ефіром, одержують вказану у заголовку сполуку формули (11і) у вигляді від не зовсім білої до жовтуватої твердої речовини (145г, 48,3%) Стадія їм Одержання 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) До суспензії 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11і) (2г), одержаної згідно з методикою, описаною вище на стадії (м), додають К2СО3 (5,1г) у толуолі (20мл), діетилсульфат (2,8г) і нагрівають зі зворотним холодильником з пасткою ДінаСтарка протягом 12 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну суміш охолоджують, фільтрують і концентрують Сполуку очищають хроматографією на колонці, одержують вказану у заголовку сполуку формули (12) у вигляді сиропоподібної рідини блідо-жовтого кольору (1,23г, 65%) Стадія iv Одержання 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) Розчин 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) (12г), одержаного згідно з процедурою, описаною вище на стадії (їм), у етилацетаті (120мл), у присутності 10% Pd-C (2,1г) піддають гідруванню при тиску водню 344,7-413,7кПа (50-60psi) при кімнатній температурі протягом ЗО годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції каталізатор відфільтровують, розчинник видаляють при зниженому тиску, одержують вказану у заголовку сполуку формули (13) (8,2г, 95%) Стадія v Одержання 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропюнату формули (16) Суміш 3(-)-етил-2-етокси-3-(4пдроксифєніл)пропюнату формули (13) (25г), одержаного згідно з процедурою, описаною вище на стадії (iv), мезилату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну масу виливають у льодяну воду, толуольний шар відокремлюють, у той час як водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі, одержують названу у заголовку сполуку формули (16) 60386 56 (46-47г, 98-99%), у вигляді маслянистої речовини Стадія vi Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До суміші 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етоксипропюнату формули (16) (45г), одержаного згідно з процедурою, описаною вище на стадії (v), та метанолу (225мл) повільно додають при кімнатній температурі протягом 10-15 хвилин водний 10% розчин гідроксиду натрію (225мл) Реакційну суміш перемішують при тій самій температурі протягом 2-4 годин За протіканням реакції спостерігають за даними ТШХ Після ПОВНОГО гідролізу сполуки формули (16) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною хлористоводневою кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску до половини об'єму та обробляють активованим вугіллям Вугілля відфільтровують, потім випарюють толуол до приблизно 50мл, і в результаті утворення осаду при обробці петролейним ефіром одержують названу у заголовку сполуку формули (1) (38-39г, 90-92%) Приклад 13 Стадія і Одержання (S)-2-aMiHO-3-(4бензилоксифеніл)пропюновоі кислоти формули (22) До розчину L-тирозину формули (21) (18,1г) у 2Н розчині NaOH (115мл) додають розчин сульфату купруму (12,5г CuSO4 у 50мл води) і нагрівають при 60°С протягом 1,5 години Реакційну суміш охолоджують до кімнатної температури і додають метанол (350мл) та 2Н NaOH (12,5мл), а потім по краплях додають бромистий бензил (12мл) Реакційній масі дають нагрітись до кімнатної температури Осад відфільтровують і промивають, одержують вказану у заголовку сполуку у вигляді не зовсім білої твердої речовини (18,5г, 66,8%) (Ref Bodansky & Bodansky, pp 50) Стадія и Одержання 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (1Г) До перемішуваного при 0°С розчину S(-)-2аміно-3-(4-бензилоксифеніл)-пропюновоі кислоти формули (22) (300г), одержаної згідно з процедурою, описаною вище на стадії (і), у тетрапдрофурані (1,8л) та розведеній H2SO4 (75мл у 1,2л води) повільно додають розчин NaNO2 (210мг у 400мл води) при температурі від 0°С до 15°С Після закінчення додавання NaNO2 реакційну суміш витримують при температурі нижче 25°С протягом 3 годин За протіканням реакції спостерігають за даними ТШХ, Після завершення реакції реакційну масу екстрагують холодним хлороформом чи дихлорметаном Органічні екстракти концентрують і залишок очищають промиванням дмзопропіловим ефіром, одержують вказану у заголовку сполуку формули (11і) у вигляді від не зовсім білої до жовтуватої твердої речовини (145г, 48,3%) 57 Стадія їм Одержання 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) До перемішуваного розчину 3(-)-2-пдрокси-3(4бензилоксифеніл)пропюновоі кислоти формули (11і) (5,0Г), одержаної згідно з методикою, описаною вище на стадії (м), у метилізобутилкетоні (ЗОмл) при кімнатній температурі додають К2СО3 (25,0г) та діетилсульфат (7,07г) і нагрівають при КИП'ЯТІННІ ЗІ зворотним холодильником протягом 24 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну суміш фільтрують і фільтрат концентрують Одержану таким чином тверду речовину екстрагують етилацетатом Об'єднані органічні екстракти промивають водою, сушать і концентрують, одержують неочищену речовину Неочищену речовину очищають хроматографією на колонці, одержують вказану у заголовку сполуку формули (12) у вигляді сиропоподібної рідини (5,8г, 87%) Стадія iv Одержання 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) Розчин 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) (12г), одержаного згідно з процедурою, описаною вище на стадії (мі), у етилацетаті (120мл), 10% Pd-C (2,1г) піддають гідруванню при тиску водню 344,7-413,7кПа (50-60psi) при кімнатній температурі протягом ЗО годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції каталізатор відфільтровують, розчинник відганяють при зниженому тиску, одержують вказану у заголовку сполуку формули (13) (8,2г, 95%) Стадія v Одержання 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропюнату формули (16) Суміш 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) (25г), одержаного згідно з процедурою, описаною вище на стадії (iv), мезилату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну масу виливають у льодяну воду, толуольний шар відокремлюють, у той час як водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують у вакуумі, одержують названу у заголовку сполуку формули (16) (46-47г, 98-99%), у вигляді маслянистої речовини Стадія vi Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До суміші 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етоксипропюнату формули (16) (45г), одержаного згідно з процедурою, описаною вище на стадії (v), та метанолу (225мл) додають повільно при кімнатній температурі протягом 10-15 хвилин водний 10% розчин гідроксиду натрію (225мл) Реакційну суміш перемішують при тій самій температурі протягом 2-4 годин За 60386 58 протіканням реакції спостерігають за даними ТШХ Після ПОВНОГО гідролізу сполуки формули (16) реакційну масу розводять водою (225мл) і промивають толуолом до видалення домішок Водний шар підкислюють розведеною хлористоводневою кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску до половини об'єму та обробляють активованим вугіллям Вугілля відфільтровують, концентрують толуол до приблизно 50мл, і, в результаті утворення осаду при обробці петролейним ефіром, одержують вказану у заголовку сполуку формули (1) (38-39г, 90-92%) Приклад 14 Стадія і Одержання (S)-2-aMiHO-3-(4бензилоксифеніл)пропюновоі кислоти формули (22) До розчину L-тирозину формули (21) (18,1г) у 2Н розчині NaOH (115мл) додають розчин сульфату купруму (12,5г CuSO4 у 50мл води) і нагрівають при 60°С протягом 1,5 години Реакційну суміш охолоджують до кімнатної температури і додають метанол (350мл) та 2Н NaOH (12,5мл), а потім по краплях додають бромистий бензил (12мл) Реакційній суміші дають нагрітись до кімнатної температури Осад відфільтровують і промивають, одержують вказану у заголовку сполуку у вигляді не зовсім білої твердої речовини (18,5 г, 66,8%) (Ref Bodansky & Bodansky, pp 50), Стадія и Одержання 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (1Г) До перемішуваного при 0°С розчину S(-)-2аміно-3-(4-бензилоксифеніл)-пропюновоі кислоти формули (22) (300г), одержаної за методикою, описаною вище на стадії (і), у тетрапдрофурані (1,8л) та розведеній H2SO4 (75мл у 1,2л води) при перемішуванні повільно додають при температурі від 0°С до 15°С розчин NaNO2 (210мг у 400мл води) Після завершення додавання NaNO2 реакційну масу витримують при температурі нижче 25°С протягом 3 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну суміш екстрагують холодним хлороформом чи дихлорметаном Органічні екстракти концентрують і залишок очищають, промиваючи дизопропіловим ефіром, одержують названу у заголовку сполуку формули (11і) у ВИГЛЯДІ ВІД не зовсім білої до блідо-жовтої твердої речовини (145г, 48,3%) Стадія їм Одержання 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) До суспензії NaH (2,7г) у тетрапдрофурані (200мл) при 0°С при перемішуванні повільно протягом ЗО хвилин додають розчин (3)-2-пдрокси-3(4-бензилоксифеніл)пропюновоі кислоти формули (11і) (10Г), одержаної згідно з процедурою, описаною вище на стадії (м), у тетрапдрофурані (50мл), потім додають етилйодид (18,1г) протягом біля 1 години і дають температурі піднятись до кімнатної протягом приблизно 2 годин За протіканням реакції спостерігають за даними ТШХ 59 Після завершення реакції реакційну суміш виливають у льодяну воду і сполуку екстрагують толуолом Об'єднані органічні екстракти промивають водою, сушать і концентрують, одержують вказану у заголовку сполуку формули (12) у вигляді сиропоподібної рідини, забарвленої у блідокоричневий колір (11,2г, 85,9%) Стадія iv Одержання 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) Розчин 3(-)-етил-2-етокси-3-(4бензилоксифеніл)пропюнату формули (12) (12г), одержаного згідно з процедурою, описаною вище на стадії (їм), у етилацетаті (120мл), у присутності 10% Pd-C (2,1г) піддають гідруванню при тиску водню 344,7-413,7кПа (50-60psi) при кімнатній температурі протягом ЗО годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції каталізатор відфільтровують, розчинник видаляють при зниженому тиску, одержуючи при цьому вказану у заголовку сполуку формули (13) (8,2г, 95%) Стадія v Одержання 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропюнату формули (16) Суміш 3(-)-етил-2-етокси-3-(4пдроксифеніл)пропюнату формули (13) (25г), одержаного згідно з процедурою, описаною вище на стадії (iv), мезилату формули (15) (32г), карбонату калію (36г) та толуолу (250мл) кип'ятять зі зворотним холодильником протягом 15-20 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну масу виливають у льодяну воду і відокремлюють толуольний шар, у той час як водний шар екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску, одержують вказану у заголовку сполуку формули (16) (46-47г, 98-99%), у вигляді маслянистої речовини Стадія vi Одержання 3(-)-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етокси-пропановоі кислоти формули (1) До суміші 3(-)-етил-3-[4-[2-(феноксазин-10іл)етокси]феніл]-2-етоксипропюнату формули (16) (45г), одержаного згідно з процедурою, описаною вище на стадії (v), та метанолу (225мл) додають водний 10% розчин гідроксиду натрію повільно при кімнатній температурі протягом 1015 хвилин Реакційну суміш перемішують при тій самій температурі протягом 2-4 годин За перебігом реакції спостерігають за даними ТШХ Після повного гідролізу сполуки формули (16) реакційну масу розводять водою (225мл) і промивають толуолом для видалення домішок Водний шар підкислюють розведеною хлористоводневою кислотою і екстрагують толуолом Об'єднані органічні екстракти промивають водою і концентрують при зниженому тиску до половини об'єму та обробляють активованим вугіллям Вугілля відфільтровують, толуол упарюють до приблизно 50мл, і після обробки петролейним ефіром одержують вказану у заголовку сполуку формули (1) (38-39г, 90-92%) 60386 60 Приклад 15 Стадія і Одержання 4-бензилоксибензальдепду формули (8) 4-Гідроксибензальдепд формули (7) (100г), карбонат калію (226г) та диметилформамід (500мл) поміщають до реакційної посудини і перемішують протягом 15 хвилин Потім додають бензилхлорид (114г) при кімнатній температурі і реакційну масу перемішують при цій самій температурі протягом 8-10 годин За протіканням реакції спостерігають за допомогою ТШХ Після закінчення реакції реакційну суміш виливають у льодяну воду і екстрагують толуолом Об'єднані органічні екстракти промивають 10% водним розчином гідроксиду натрію, потім водою Розчинник видаляють при зниженому тиску, залишок, що одержують при цьому, розтирають з петролейним ефіром і одержують вказану у заголовку сполуку формули (8) (160-165г, 93-95%) Стадія и Одержання етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) 4-Бензилоксибензальдепд формули (8) (100г), одержаний згідно з процедурою, описаною вище на стадії (і), додають до розчину етоксиду натрію (64г) у абсолютному етанолі, потім додають етил хлорацетат (87г) протягом 30-45 хвилин, підтримуючи температуру навколишнього середовища Реакційну суміш перемішують при тій самій температурі протягом 3-5 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну суміш виливають у льодяну воду і перемішують протягом 510 хвилин Одержану при цьому тверду речовину відфільтровують, промивають водою і сушать, одержують вказану у заголовку сполуку формули (9) (126-129г, 90-92%) Стадія їм Одержання рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) Суміш етил-2,3-епокси-3-(4бензилоксифеніл)пропюнату формули (9) (125г), одержаного згідно з процедурою, описаною вище на стадії (м), каталізатора 5% Pd/C (12,5г) та 1,4дюксану (750мл) піддають гідруванню при кімнатній температурі при тиску водню 34,5-68,9кПа (510psi) протягом 10-15 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції каталізатор відфільтровують, розчинник видаляють при зниженому тиску і одержують вказану у заголовку сполуку формули (10) (100-105г, 80-83%) Стадія iv Одержання 3(-)-2-гідрокси-3-(4бензилоксифеніл)пропюновоі кислоти формули (11) Суміш рацемічного етил-2-пдрокси-3-(4бензилоксифеніл)пропюнату формули (10) (100г), одержаного згідно з процедурою, описаною вище на стадії (їм), та 10% водного розчину гідроксиду натрію (500мл) перемішують при кімнатній температурі протягом 1-2 годин За протіканням реакції спостерігають за даними ТШХ Після завершення реакції реакційну суміш підкислюють розведеною хлористоводневою кислотою при 15
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for preparation of 3-[4-[2-(phenoxazine-10-yl)methoxy]phenyl]propionic acid derivatives (variants) and intermediary compounds for preparation thereof
Назва патенту російськоюСпособ получения производных 3-[4-[2-(феноксазин-10-ил)метокси]фенил]пропионовой кислоты (варианты) и промежуточные соединения для их получения
МПК / Мітки
МПК: C07C 67/31, C07C 51/347, C07D 265/38
Мітки: спосіб, одержання, отримання, 3-[4-[2-(феноксазин-10-іл)метокси]феніл]пропіонової, кислоти, сполуки, проміжні, варіанти, похідних
Код посилання
<a href="https://ua.patents.su/35-60386-sposib-oderzhannya-pokhidnikh-3-4-2-fenoksazin-10-ilmetoksifenilpropionovo-kisloti-varianti-ta-promizhni-spoluki-dlya-kh-otrimannya.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних 3-[4-[2-(феноксазин-10-іл)метокси]феніл]пропіонової кислоти (варіанти) та проміжні сполуки для їх отримання</a>
Попередній патент: Композиція інгредієнтів для бальзаму “финарос”
Наступний патент: Устєвий пристрій ліквідації прихватів
Випадковий патент: Спосіб діагностики біологічних параметрів у тканинах органів експериментальних тварин