Спосіб (варіанти) одержання заміщених 4-феніл-4-ціаноциклогексанових кислот та проміжні сполуки
Номер патенту: 58533
Опубліковано: 15.08.2003
Автори: Аллен Ендрю, Вебб Кевін, Дідеріх Енн Марі, Ліу Лі, Мендельсон Вілфорд
Формула / Реферат
1. Спосіб одержання сполуки формули І
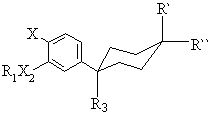 , (I)
, (I)
де R1 є -(CR4R5)nC(O)О(CR4R5)mR6, -(CR4R5)nC(O)NR4(CR4R5)mR6, -(CR4R5)nO(CR4R5)mR6 або (CR4R5)rR6, де алкільні залишки можуть бути необов'язково заміщені одним або більше галогенами;
m має значення від 0 до 2;
n має значення від 1 до 4;
r має значення від 0 до 6;
R4 і R5 є незалежно вибраними з водню або С1-2алкілу;
R6 є водень, метил, гідроксил, арил, галогенозаміщений арил, арилоксиС1-3алкіл, галогенозаміщений арилоксиС1-3алкіл, інданіл, інденіл, С7-11поліциклоалкіл, тетрагідрофураніл, фураніл, тетрагідропіраніл, піраніл, тетрагідротієніл, тієніл, тетрагідротіопіраніл, тіопіраніл, С3-6циклоалкіл або С4-6циклоалкіл, що містить один або два ненасичені зв'язки, де циклоалкільні та гетероциклічні залишки можуть бути необов'язково заміщені від 1 до 3 метильними групами або однією етильною групою; при цьому:
a) якщо R6 є гідроксил, то m має значення 2; або
b) якщо R6 є гідроксил, то r має значення від 2 до 6; або
c) якщо R6 є 2-тетрагідропіраніл, 2-тетрагідротіопіраніл, 2-тетрагідрофураніл або 2-тетрагідротієніл, то m має значення 1 чи 2; або
d) якщо R6 є 2-тетрагідропіраніл, 2-тетрагідротіопіраніл, 2-тетрагідрофураніл або 2-тетрагідротієніл, то r має значення від 1 до 6;
e) якщо n=1 і m=0, то R6 відмінний від Н у -(CR4R5)nO(CR4R5)mR6;
Х є YR2, галоген, нітро, NН2 або форміламін;
Х2 є О або NR8;
Y є О або S(O)m';
m'=0,1 або 2;
R2 є незалежно вибраним із -СН3 чи –СН2СН3, необов'язково заміщених 1 або більше галогенами;
R3 є водень, галоген, С1-4алкіл, CH2NHC(O)C(O)NH2, галогенозаміщений С1-4алкіл, -CH=CR8'R8', циклопропіл, необов'язково заміщений R8', CN, OR8, CH2OR8, NR8R10, CH2NR8R10, C(Z')H, С(O)ОR8, C(O)NR8R10 або C![]() CR8';
CR8';
R8‘ є водень або С1-4алкіл, необов'язково від 1 до 3 заміщений фтором;
R8' є R8 або фтор;
R10 є OR8 або R11;
R11 є водень або С1-4алкіл, необов'язково від 1 до 3 заміщений фтором;
Z' є О, NOR8, NCN, C(-CN)2, CR8CN, CR8NO2, CR8C(O)OR8, CR8C(O)NR8R8, C(-CN)NO2 або C(-CN)C(O)NR8R8;
R' та R" є незалежно воднем або -С(O)ОН;
який відрізняється тим, що він включає обробку сполуки формули II
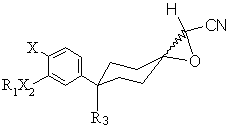 , (II)
, (II)
де R1, R3, Х2 та Х є тими ж, що й у формулі (І), кислотою Льюіса у водному розчині при температурі приблизно 60-100°С необов'язково в інертній атмосфері протягом часу, достатнього для протікання реакції до кінця.
2. Спосіб згідно з п. 1, який відрізняється тим, що R1X2 є циклопентилокси, а Х є метокси.
3. Сполука формули ІІ(а) або ІІ(b)
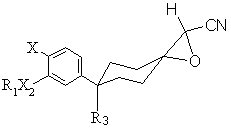 ІІ(а),
ІІ(а), 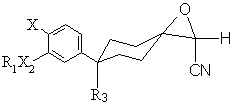 ІІ(b),
ІІ(b),
R1 є -(CR4R5)nC(O)(CR4R5)mR6, -(CR4R5)nC(O)NR4(CR4R5)mR6, -(СR4R5)nО(СR4R5)mR6 або (CR4R5)rR6, де алкільні залишки можуть бути необов'язково заміщені одним або більше галогенами;
m має значення від 0 до 2;
n має значення від 1 до 4;
r має значення від 0 до 6;
R4 та R5 є незалежно вибраними з водню або С1-2алкілу;
R6 є водень, метил, гідроксил, арил, галогенозаміщений арил, арилоксиС1-3алкіл, галогенозаміщений арилоксиС1-3алкіл, інданіл, інденіл, С7-11поліциклоалкіл, тетрагідрофураніл, фураніл, тетрагідропіраніл, піраніл, тетрагідротієніл, тієніл, тетрагідротіопіраніл, тіопіраніл, С3-6циклоалкіл або С4-6циклоалкіл, що містить один або два ненасичені зв'язки, де циклоалкільні та гетероциклічні залишки можуть бути необов'язково заміщені від 1 до 3 метильними групами або однією етильною групою; при цьому:
a) якщо R6 є гідроксил, то m=2; або
b) якщо R6 є гідроксил, то r має значення від 2 до 6; або
c) якщо R6 є 2-тетрагідропіраніл, 2-тетрагідротіопіраніл, 2-тетрагідрофураніл або 2-тетрагідротієніл, то m=1 чи 2; або
d) якщо R6 є 2-тетрагідропіраніл, 2-тетрагідротіопіраніл, 2-тетрагідрофураніл або 2-тетрагідротієніл, то r має значення від 1 до 6;
e) якщо n=1 і m=0, то R6 відмінний від Н в -(CR4R5)nO(CR4R5)mR6;
Х є YR2, галоген, нітро, NH2 або форміламін;
Х2 є О або NR8;
Y є О або S(O)m';
m'=0; 1 або 2;
R2 є незалежно вибраним із -СН3 чи -СН2СН3, необов'язково заміщених одним або більше галогенами;
R3 є водень, галоген, С1-4алкіл, СН2NНС(O)С(O)NН2, галогенозаміщений С1-4алкіл, CH=CR8'R8', циклопропіл, необов'язково заміщений R8', CN, OR8, CH2OR8, NR8R10, CH2NR8R10, C(Z')H, C(O)OR8, C(O)NR8R10 або C![]() CR8';
CR8';
R8 є водень або С1-4алкіл, необов'язково від 1 до 3 заміщений фтором;
R8' є R8 або фтор;
R10 є ОR8 або R11;
R11 є водень або С1-4 алкіл, необов'язково від 1 до 3 заміщений фтором;
Z' є О, NOR8, NCN, C(-CN)2, CR8CN, CR8NO2, CR8C(O)OR8, CR8C(O)NR8R8, C(-CN)NO2 aбo C(-CN)C(O)NR8R8.
4. Сполука згідно з п. 3, яка відрізняється тим, що R1X2 є циклопентилокси, а Х є метокси.
5. Спосіб згідно з пп. 1 або 2, який відрізняється тим, що кислотою Льюіса є бромід літію, вода присутня в кількості принаймні 2 еквівалентів відносно епоксиду і реакційну суміш нагрівають до приблизно 90-95°С впродовж приблизно 8 годин.
6. Спосіб одержання сполуки формули (І)
 , (I)
, (I)
R1 є -(CR4R5)rR6, де алкільні залишки можуть бути незаміщені або заміщені одним або більше галогенами;
r має значення від 0 до 6;
R4 та R5 незалежно вибрані з водню або С1-2алкілу;
R6 є С3-6циклоалкіл, де циклоалкільна група може бути незаміщена або заміщена від 1 до 3 метильними групами або однією етильною групою;
Х є YR2;
Х2 є О;
Y є О або S(O)m';
m' становить 0, 1 або 2;
R2 незалежно вибраний з -СН3 або –СН2СН3, незаміщених або заміщених одним або більше галогенами;
R3 є CN; та
R' та R" є незалежно водень або -С(O)ОН; який відрізняється тим, що проводять:
а) реагування сполуки формули II
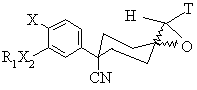 , II
, II
де R1, R2, та Х є тими ж самими, що й у формулі (І), з принаймні приблизно 1,5 еквівалентами кислоти Льюіса при температурі від приблизно 60°С до 100°С необов'язково в інертній атмосфері;
Т є CN або SO2 R, де R є С1-6алкіл або С0-3алкілфеніл;
причому сполуку формули (II) одержують шляхом
b) реагування кетону формули А
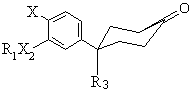 ,(III)
,(III)
де R1, R3, X2 та X є тими ж самими, що й у формулі (І), з молярним надлишком хлороацетонітрилу, неорганічною основою, каталітичною кількістю бензилтриетиламонію хлориду в розчиннику, що змішується з водою;
причому сполуку формули (А) одержують шляхом
с) декарбоксиляції складного бета-кетоефіру формули В
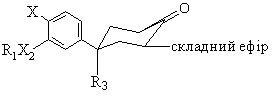 , (B)
, (B)
де R1, R3, X2 та X є тими ж самими, що й у формулі (І), шляхом нагрівання розчину складного бета-кетоефіру з диметилсульфоксидом до приблизно 150°С;
причому складний бета-кетоефір формули В одержують шляхом
d) циклізації пімелату формули С
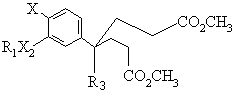 , (C)
, (C)
де R1, R3, X2 та Х є тими ж самими, що й у формулі (І), за допомогою приблизно 2 еквівалентів сильної основи при температурі приблизно 75°С, причому сполуку формули С одержують шляхом
е) реагування нітрилу формули D
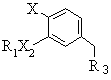 , (D)
, (D)
де R1, R3, Х2 та X є тими ж самими, що й у формулі (І), з алкілакрилатом при 3-4 разовому молярному надлишку в присутності каталітичної кількості тритону-В, причому сполуки формули (D) одержують шляхом
f) реагування сполуки формули (Е)
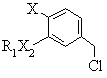 , (E)
, (E)
де R1, Х2 та Х є тими ж самими, що й у формулі (І), з приблизно 50% молярного надлишку ціаніду лужного металу, причому сполуки формули (Е) одержують шляхом:
g) реагування алкоголю формули (F)
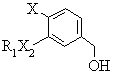 , (F)
, (F)
де R1, Х2 та Х є тими ж самими, що й у формулі (І), з надлишком хлористоводневої кислоти, причому сполуки формули (F) одержують шляхом:
h) відновлення альдегіду формули (G)
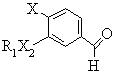 ,(G)
,(G)
де R1, X2 та Х є тими ж самими, що й у формулі (І), причому відновлення проводять, використовуючи неорганічний відновлюваний агент.
7. Спосіб згідно з п. 6, який відрізняється тим, що в стадії а) кислотою Льюіса є бромід літію, присутні принаймні приблизно 2 еквіваленти води та реакційну суміш нагрівають до приблизно 90-95°С впродовж приблизно 8 годин.
8. Спосіб згідно з п. 6, який відрізняється тим, що в стадії b) неорганічною основою є водний гідроксид калію, розчинником, що змішується з водою, є тетрагідрофуран, а реакцію проводять при температурі приблизно 0°С.
9. Спосіб згідно з п. 6, який відрізняється тим, що в стадії с) сильною основою є метоксид натрію, який присутній в кількості приблизно 1,5 молярних еквівалентів, а реакцію проводять при температурі приблизно від 70 до 75°С впродовж 2 годин.
10. Спосіб згідно з п. 6, який відрізняється тим, що стадії с) та d) сполучені шляхом циклізації пімелату реакцією його з метоксидом натрію, декарбоксиляції одержаного в результаті складного бета-кетоефіру без ізолювання його шляхом додавання диметилсульфоксиду до розчину, що містить ефір, і нагрівання цього розчину до приблизно 145°С впродовж 2 годин.
11. Спосіб згідно з п. 10, який відрізняється тим, що після завершення стадії реакції циклізації реакційну суміш охолоджують до приблизно кімнатної температури та рН відрегульовують до значення 6,8-7,2 перед додаванням диметилсульфоксиду.
12. Спосіб згідно з п. 6, стадія е), який відрізняється тим, що алкілакрилатом є метилакрилат.
13. Спосіб згідно з п. 6, стадія f), який відрізняється тим, що ціанідом лужного металу є ціанід натрію, а реакцію проводять при температурі приблизно 55°С.
14. Спосіб згідно з п. 6, стадія h), який відрізняється тим, що відновлювальним агентом є борогідрид натрію.
15. Спосіб згідно з будь-яким із пп. 6-14, який відрізняється тим, що у формулі (І) R1 є циклопентил, Y є кисень, a R5 є метил.
16. Спосіб одержання сполуки формули І(а) чи І(b), або їх суміші
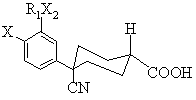 , (Ia)
, (Ia) 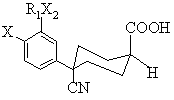 , (Ib)
, (Ib)
де X є OR2,
R2 незалежно вибраний із –СН3 або –СН2СН3, необов'язково заміщених одним або більше галогенами;
R1 є -(CR4R5)rR6, r має значення від 0 до 6;
R4 та R5 незалежно вибрані із водню або С1-2алкілу;
R6 є С3-6циклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою; та
Х2 є О; який відрізняється тим, що він включає обробку ацилнітрилу формули (V) водою
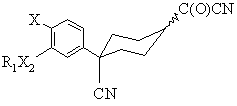 , (V)
, (V)
де Х та R1X2 є тими ж самими, що й у формулах (Іа) та (Ib).
17. Спосіб згідно з п. 16, який відрізняється тим, що сполука формули (V) є сполукою формули (Va)
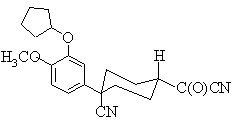 , (Va)
, (Va)
і результатом є утворення сполуки формули (Іа).
18. Спосіб згідно з п. 16, який відрізняється тим, що сполука формули (V) є сполукою формули (Vb)
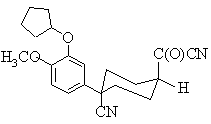 , (Vb)
, (Vb)
і результатом є утворення сполуки формули (Іb).
19. Спосіб одержання сполуки формули (V)
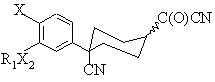 , (V)
, (V)
де Х є OR2,
R2 незалежно вибраний з –СН3 або –СН2СН3, необов'язково заміщених одним або більше галогенами;
R1 є -(CR4R5)rR6, r має значення від 0 до 6;
R4 та R5 незалежно вибрані з водню або С1-2алкілу;
R6 є С3-6циклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою; та
Х2 є О;
який відрізняється тим, що він включає витримку сполуки формули (Z)
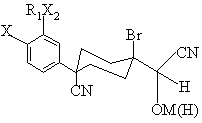 , (Z)
, (Z)
де Х та R1X2 є тими ж самими, що й у формулі (V),
М є Li або Мg, а група (Н) є водень,
у розчині при приблизно кімнатній температурі впродовж часу, достатнього для впливу конверсії.
20. Спосіб згідно з п. 19, який відрізняється тим, що формула (Z) є формулою фіг. 1
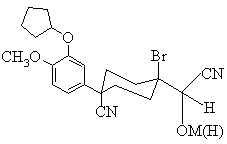 , Фіг. 1
, Фіг. 1
де М є Li або Мg, а (Н) є водень.
21. Сполука формули (Z), яка є проміжною для утворення сполуки формули (1)
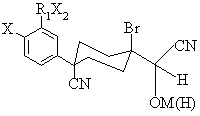 , (Z)
, (Z)
де X є OR2;
R2 незалежно вибраний із –СН3 або –СН2СН3, необов'язково заміщених одним або більше галогенами;
R1 є -(CR4R5)rR6, r має значення від 0 до 6;
R4 та R5 незалежно вибрані з водню або С1-2алкілу;
R6 є С3-6циклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою; та Х3 є О.
22. Сполука формули (Z) згідно з п. 21, яка є
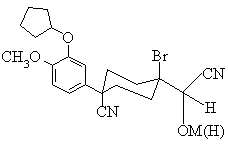 ,
,
де М є Li або Мg, а (Н) є водень.
23. Спосіб одержання сполуки формули (Z)
 , (Z)
, (Z)
де X є OR2,
R2 незалежно вибраний із –СН3 або –СН2СН3, необов'язково заміщених одним або більше галогенами;
R1 є -(CR4R5)rR6;
r має значення від 0 до 6;
R4 та R5 незалежно вибрані з водню або С1-2алкілу;
R6 є С3-6циклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою; та
Х2 є О;
який відрізняється тим, що він включає обробку епоксиду формули (II)
 , (ІІ)
, (ІІ)
де Х та R1X2 ті самі, що й у формулі (Z), а Т є CN або SО2R, де R є С1-6алкіл або С0-3алкілфеніл, кислотою Льюіса у безводних умовах.
24. Спосіб згідно з п. 23, який відрізняється тим, що кислотою Льюіса є LiBr.
25. Спосіб згідно з пп. 22 або 23, який відрізняється тим, що епоксид формули (II) має структуру, подану фігурою 2
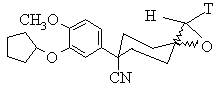 , Фіг. 2
, Фіг. 2
де Т є CN або р-толілсульфоніл.
26. Сполука формули (IV), яка є проміжною для утворення сполук формули (1)
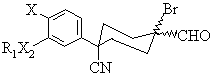 , (IV)
, (IV)
де Х є OR2,
R2 незалежно вибраний із –СН3 або –СН2СН3, необов'язково заміщених одним або більше галогенами;
R1 є -(CR4R5)rR6;
r має значення від 0 до 6;
R4 та R5 незалежно вибрані з водню або С1-2алкілу;
R6 є С3-6циклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою; та Х2 є О.
27. Сполука формули (IV) згідно з п. 26, яка відрізняється тим, що Х є метокси, R1 є циклопентил, а Х2 є кисень.
28. Спосіб одержання сполуки формули (Іа) або (Іb)
 , (Іа)
, (Іа)  , (Ib)
, (Ib)
де X є OR2;
R2 незалежно вибраний із –СН3 або –СН2СН3, необов'язково заміщених одним або більше галогенами;
R1 є -(СR4R5)rR6;
r має значення від 0 до 6;
R4 та R5 незалежно вибрані із водню або С1-2алкілу;
R6 є С3-6циклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою;
та Х2 є О;
який відрізняється тим, що він включає обробку альдегіду формули (IV)
 , (IV)
, (IV)
де Х та R1X2 є такими ж, як і в формулах І(а) та І(b), ціанідом лужного металу.
29. Спосіб згідно з п. 28, який відрізняється тим, що ціанідом є LiCN.
30. Спосіб згідно з пп. 28 або 29, який відрізняється тим, що у формулі (IV) Х є метокси, R1 є циклопентил, a X2 є кисень.
31. Спосіб одержання ацилнітрилу формули (V)
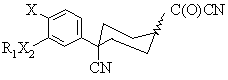 ,
,
де Х є OR2;
R2 незалежно вибраний із –СН3 або –СН2СН3, необов'язково заміщених одним або більше галогенами;
R1 є -(CR4R5)rR6;
r має значення від 0 до 6;
R4 та R5 незалежно вибрані із водню або С1-2алкілу;
R6 є С3-6циклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою; та Х2 є О;
який відрізняється тим, що він включає обробку альдегіду формули (IV)
 , (IV)
, (IV)
де Х та R1X2 є тими ж самими, що й у формулі (V), LiCN та каталітичною кількістю диметилформаміду.
32. Спосіб збагачення цис-4-ціано-4(3-циклопентилокси-4-метоксифеніл)-r-циклогексанкарбонової кислоти, утвореної із суміші цис- і транс-ізомерів кислоти, який відрізняється тим, що він має у своєму складі кристалізацію цис-ізомеру, по суті вільного від транс-ізомеру, із розчину цис- та транс-ізомерів у гексан/ етилацетаті.
33. Спосіб згідно з п. 32, який відрізняється тим, що суміш цис/транс ізомерів розчиняють в етилацетаті та гексані.
34. Спосіб згідно з п. 33, який відрізняється тим, що суміш цис/транс ізомерів розчиняють в етилацетаті, а потім додають гексан.
35. Спосіб згідно з п. 34, який відрізняється тим, що розчин цис/транс ізомерів в етилацетаті нагрівають зі зворотним холодильником, охолоджують і потім додають гексан, після чого проводять кристалізацію.
Текст
1 Спосіб одержання сполуки формули І де Ri є -(CR4R5)nC(O)O(CR4R5)rnR6, (CR4R5)nC(O)NR4(CR4R5)mR6, (CR 4 R 5 ) n O(CR 4 R 5 )rnR6 або (CR 4 R 5 ) r R6, де алкільні залишки можуть бути необов'язково заміщені одним або більше галогенами, m має значення від 0 до 2, п має значення від 1 до 4, г має значення від 0 до 6, R4 і Rs є незалежно вибраними з водню або Сі гал кіл у, R6 є водень, метил, гідроксил, арил, галогенозаміщений арил, арилоксиСі залкіл, галогенозаміщений арилоксиСі залкіл, інданіл, інденіл, С7 пполіциклоалкіл, тетрапдрофураніл, фураніл, тетрапдропіраніл, піраніл, тетрапдротієніл, ТІЄНІЛ, тетрапдротюпіраніл, тюпіраніл, Сз бЦиклоалкіл або С 4 бЦиклоалкіл, що містить один або два ненасичені зв'язки, де циклоалкільні та гетероциклічні залишки можуть бути необов'язково заміщені від 1 до 3 метильними групами або однією етильною групою, при цьому a) якщо R6 є гідроксил, то m має значення 2, або b) якщо R6 є гідроксил, то г має значення від 2 до 6, або c) якщо R6 є 2-тетрапдропіраніл, тетрапдротюпіраніл, 2-тетрапдрофураніл або тетрапдротієніл, то m має значення 1 чи 2, або d) якщо R6 є 2-тетрапдропіраніл, тетрапдротюпіраніл, 2-тетрапдрофураніл або тетрапдротієніл, то г має значення від 1 до 6, 2222 є) якщо п=1 і m=0, TO R6 ВІДМІННИЙ ВІД Н у X є YR2, галоген, нітро, ІЧНг або форміламін, Х 2 є О або NR 8 , Y є О або S(O) m , m - 0 , 1 або 2, R2 є незалежно вибраним із -СНз чи -СН2СН3, необов'язково заміщених 1 або більше галогенами, R3 є водень, галоген, Сі 4 алкіл, CH2NHC(O)C(O)NH2, галогенозаміщений Сі 4 алкіл, -CH=CR 8 R 8 , циклопропіл, необов'язково заміщений R 8 , CN, OR 8 , CH 2 OR 8 , NR 8 Rio, C H 2 N R 8 R i 0 , C(Z')H, C(O)OR 8 , C ( O ) N R 8 R i 0 a 6 o C = CR 8 , R8 є водень або Сі 4 алкіл, необов'язково від 1 до З заміщений фтором, R8 є R8 або фтор, R-іо є OR 8 або R n , R11 є водень або Сі 4 алкіл, необов'язково від 1 до З заміщений фтором, Z' є О, NOR8, NCN, C(-CN)2, CR8CN, 8 2 CR8C(O)OR8, CR8C(O)NR8R8, C(-CN)NO2 або С(CN)C(O)NR8R8, R' та R" є незалежно воднем або -С(О)ОН, який відрізняється тим, що він включає обробку сполуки формули II CN, RO н •N C о де R-і, R3, Хг та X є тими ж, що й у формулі (І), кислотою Льюіса у водному розчині при температурі приблизно 60-100°С необов'язково в інертній атмосфері протягом часу, достатнього для протікання реакції до кінця О со го ю 00 Ю 58533 2 Спосіб згідно з п 1, який відрізняється тим, що R1X2 є циклопентилокси, а X є метокси 3 Сполука формули ІІ(а) або ІІ(Ь) н •N C a), R X 12 R1 є -(CR4R5)nC(O)(CR4R5)rnR6, (CR4R5)nC(O)NR4(CR4R5)mR6, (CR 4 R 5 ) n O(CR 4 R 5 )rnR6 або (CR 4 R 5 ) r R6, де алкільні залишки можуть бути необов'язково заміщені одним або більше галогенами, m має значення від 0 до 2, п має значення від 1 до 4, г має значення від 0 до 6, R4 та Rs є незалежно вибраними з водню або Сі гал кіл у, R6 є водень, метил, гідроксил, арил, галогенозаміщений арил, арилоксиСі залкіл, галогенозаміщений арилоксиСі залкіл, інданіл, інденіл, С7 пполіциклоалкіл, тетрапдрофураніл, фураніл, тетрапдропіраніл, піраніл, тетрапдротієніл, ТІЄНІЛ, тетрапдротюпіраніл, тюпіраніл, Сз бЦиклоалкіл або С 4 бЦиклоалкіл, що містить один або два ненасичені зв'язки, де циклоалкільні та гетероциклічні залишки можуть бути необов'язково заміщені від 1 до 3 метильними групами або однією етильною групою, при цьому a) якщо R6 є гідроксил, то т = 2 , або b) якщо R6 є гідроксил, то г має значення від 2 6, або c) якщо R6 є 2-тетрапдропіраніл, тетрапдротюпіраніл, 2-тетрапдрофураніл або тетрапдротієніл, то т = 1 чи 2, або d) якщо R6 є 2-тетрапдропіраніл, тетрапдротюпіраніл, 2-тетрапдрофураніл або тетрапдротієніл, то г має значення від 1 до 6, є) якщо п=1 і т=0, то до 2222 R6 ВІДМІННИЙ ВІД Н В X є YR2, галоген, нітро, ІЧНг або форміламін, Х 2 є О або NR8, Y є О або S(O) m , m - 0 , 1 або 2, R2 є незалежно вибраним із -СНз чи -СН2СН3, необов'язково заміщених одним або більше галогенами, R3 є водень, галоген, Сі 4 алкіл, CH2NHC(O)C(O)NH2, галогенозаміщений Сі 4 алкіл, CH=CR 8 R 8 , циклопропіл, необов'язково заміщений R8, CN, OR 8 , CH 2 OR 8 , NR 8 Rio, CH 2 NR 8 Rio, C(Z')H, C(O)OR 8 , C(0)NR 8 Rio або С - CR 8 , R8 є водень або Сі 4 алкіл, необов'язково від 1 до З заміщений фтором, R8 є R8 або фтор, R-іо є OR 8 або Rn, R11 є водень або Сі 4 алкіл, необов'язково від 1 до 3 заміщений фтором, Z' є О, NOR 8 , NCN, C(-CN)2, CR 8 CN, CR 8 NO 2 , CR 8 C(O)OR 8 , CR 8 C(O)NR 8 R 8 , C(-CN)NO 2 або С(CN)C(O)NR 8 R 8 4 Сполука згідно з п 3, яка відрізняється тим, що R1X2 є циклопентилокси, а X є метокси 5 Спосіб згідно з пп 1 або 2, який відрізняється тим, що кислотою Льюіса є бромід ЛІТІЮ, вода присутня в КІЛЬКОСТІ принаймні 2 еквівалентів відносно епоксиду і реакційну суміш нагрівають до приблизно 90-95°С впродовж приблизно 8 годин 6 Спосіб одержання сполуки формули (І) (І) Ri є -(CR4Rs)rR6, де алкільні залишки можуть бути незаміщені або заміщені одним або більше галогенами, г має значення від 0 до 6, R4 та Rs незалежно вибрані з водню або Сі гал кіл у, R6 є Сз бЦиклоалкіл, де циклоалкільна група може бути незаміщена або заміщена від 1 до 3 метильними групами або однією етильною групою, X є YR2, Х2єО, Y є О або S(O) m , гтї становить 0, 1 або 2, R2 незалежно вибраний з -СНз або -СЬЬСНз, незаміщених або заміщених одним або більше галогенами, R3 є CN, та R' та R" є незалежно водень або -С(О)ОН, який відрізняється тим, що проводять а) реагування сполуки формули II Т X CN де R-і, R2, та X є тими ж самими, що й у формулі (І), з принаймні приблизно 1,5 еквівалентами кислоти Льюіса при температурі від приблизно 60°С до 100°С необов'язково в інертній атмосфері, Т є CN або SO2 R, де R є Сі єалкіл або Co залкілфеніл, причому сполуку формули (II) одержують шляхом Ь) реагування кетону формули А 58533 ОН де R-i, R3, Хгта X є тими ж самими, що й у формулі (І), з молярним надлишком хлороацетонітрилу, неорганічною основою, каталітичною КІЛЬКІСТЮ бензилтриетиламонію хлориду в розчиннику, що змішується з водою, причому сполуку формули (А) одержують шляхом с) декарбоксиляцм складного бета-кетоефіру формули В складний ефір (В) де R-i, R3, Хгта X є тими ж самими, що й у формулі (І), шляхом нагрівання розчину складного бетакетоефіру з диметилсульфоксидом до приблизно 150°С, причому складний бета-кетоефір формули В одержують шляхом d) циклізації пімелату формули С X. со 2 сн 3 со 2 сн 3 де R-i, R3, Хгта X є тими ж самими, що й у формулі (І), за допомогою приблизно 2 еквівалентів сильної основи при температурі приблизно 75°С, причому сполуку формули С одержують шляхом є) реагування нітрилу формули D X. де R-i, R3, Хгта X є тими ж самими, що й у формулі (І), з алкілакрилатом при 3-4 разовому молярному надлишку в присутності каталітичної КІЛЬКОСТІ тритону-В, причому сполуки формули (D) одержують шляхом f) реагування сполуки формули (Е) X де R-i, Хгта X є тими ж самими, що й у формулі (І), з приблизно 50% молярного надлишку ціаніду лужного металу, причому сполуки формули (Е) одержують шляхом д) реагування алкоголю формули (F) (F) де R-i, Хгта X є тими ж самими, що й у формулі (І), з надлишком хлористоводневої кислоти, причому сполуки формули (F) одержують шляхом h) відновлення альдегіду формули (G) X де R-i, Хгта X є тими ж самими, що й у формулі (І), причому відновлення проводять, використовуючи неорганічний відновлюваний агент 7 Спосіб згідно з п 6, який відрізняється тим, що в стадії а) кислотою Льюіса є бромід ЛІТІЮ, присутні принаймні приблизно 2 еквіваленти води та реакційну суміш нагрівають до приблизно 90-95°С впродовж приблизно 8 годин 8 Спосіб згідно з п 6, який відрізняється тим, що в стадії Ь) неорганічною основою є водний гідроксид калію, розчинником, що змішується з водою, є тетрапдрофуран, а реакцію проводять при температурі приблизно 0°С 9 Спосіб згідно з п 6, який відрізняється тим, що в стадії с) сильною основою є метоксид натрію, який присутній в КІЛЬКОСТІ приблизно 1,5 молярних еквівалентів, а реакцію проводять при температурі приблизно від 70 до 75°С впродовж 2 годин 10 Спосіб згідно з п 6, який відрізняється тим, що стадії с) та d) сполучені шляхом циклізації пімелату реакцією його з метоксидом натрію, декарбоксиляцм одержаного в результаті складного бета-кетоефіру без ізолювання його шляхом додавання диметилсульфоксиду до розчину, що містить ефір, і нагрівання цього розчину до приблизно 145°С впродовж 2 годин 11 Спосіб згідно з п 10, який відрізняється тим, що після завершення стадії реакції циклізації реакційну суміш охолоджують до приблизно кімнатної температури та рН відрегульовують до значення 6,8-7,2 перед додаванням диметилсульфоксиду 12 Спосіб згідно з п 6, стадія є), який відрізняється тим, що алкілакрилатом є метилакрилат 13 Спосіб згідно з п 6, стадія f), який відрізняється тим, що ціанідом лужного металу є ціанід натрію, а реакцію проводять при температурі приблизно 55°С 14 Спосіб згідно з п 6, стадія п), який відрізняється тим, що відновлювальним агентом є боропдрид натрію 15 Спосіб згідно з будь-яким із пп 6-14, який відрізняється тим, що у формулі (І) Ri є циклопентил, Y є кисень, a Rs є метил 16 Спосіб одержання сполуки формули І(а) чи І(Ь), або їх суміші 58533 (O)CN H CN соон C N (la) СООН CN fleXeOR2, R2 незалежно вибраний із -СНз або -СН2СН3, необов'язково заміщених одним або більше галогенами, Ri є -(CR4Rs)rR6, r має значення від 0 до 6, R4 та Rs незалежно вибрані із водню або Сі гал кіл у, R6 є Сз бЦиклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою, та Хг є О, який відрізняється тим, що він включає обробку ацилнітрилу формули (V) водою t .00 fleXeOR2, R2 незалежно вибраний з -СНз або -СН2СН3, необов'язково заміщених одним або більше галогенами, Ri є -(CR4Rs)rR6, r має значення від 0 до 6, R4 та Rs незалежно вибрані з водню або Сі гал кіл у, R6 є Сз бЦиклоалкіл,який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою, та Х2єО, який відрізняється тим, що він включає витримку сполуки формули (Z) Вг CN C(O)CN .00 де X та R1X2 є тими ж самими, що й у формулах (Іа) та (ІЬ) 17 Спосіб згідно з п 16, який відрізняється тим, що сполука формули (V) є сполукою формули (Va) де Х т а R1X2 є тими ж самими, що й у формулі (V), М є Li або Мд, а група (Н) є водень, у розчині при приблизно кімнатній температурі впродовж часу, достатнього для впливу конверсії 20 Спосіб згідно з п 19, який відрізняється тим, що формула (Z) є формулою фіг 1 сн 3 о CN Н C(O)CN CN (Va) де М є Li або Mg, a (H) є водень 21 Сполука формули (Z), яка є проміжною для утворення сполуки формули (1) і результатом є утворення сполуки формули (Іа) 18 Спосіб згідно з п 16, який відрізняється тим, що сполука формули (V) є сполукою формули (Vb) C(O)CN CN (Vb) і результатом є утворення сполуки формули (ІЬ) 19 Спосіб одержання сполуки формули (V) fleXeOR2, R2 незалежно вибраний із -СНз або -СН2СН3, необов'язково заміщених одним або більше галогенами, Ri є -(CR4Rs)rR6, r має значення від 0 до 6, R4 та Rs незалежно вибрані з водню або Сі гал кіл у, R6 є Сз бЦиклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою, та Хз є О 58533 10 22 Сполука формули (Z) згідно з п 2 1 , я к а є ЄНО сн 3 о fleXeOR2, C N де М є Li або Mg, a (H) є водень 23 Спосіб одержання сполуки формули (Z) fleXeOR2, R2 незалежно вибраний із -СНз або -СН2СН3, необов'язково заміщених одним або більше галогенами, Ri є -(CR 4 R 5 )rR 6 , г має значення від 0 до 6, R4 та Rs незалежно вибрані з водню або Сі гал кіл у, R6 є Сз бЦиклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою, та Х2єО, який відрізняється тим, що він включає обробку епоксиду формули (II) т , (I I) де X та R1X2 ті самі, що й у формулі (Z), а Т є CN або SO2R, де R є Сі єалкіл або Co залкілфеніл, кислотою Льюіса у безводних умовах 24 Спосіб згідно з п 23, який відрізняється тим, що кислотою Льюіса є LiBr 25 Спосіб згідно з пп 22 або 23, який відрізняється тим, що епоксид формули (II) має структуру, подану фігурою 2 СН,О н Н соон (Іа) СООН X CN fleXeOR2, X CN R2 незалежно вибраний із -СНз або -СН2СН3, необов'язково заміщених одним або більше галогенами, Ri є -(CR 4 R 5 )rR 6 , г має значення від 0 до 6, R4 та Rs незалежно вибрані з водню або Сі гал кіл у, R6 є Сз бЦиклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою, та Хг є О 27 Сполука формули (IV) згідно з п 26, яка відрізняється тим, що X є метокси, Ri є циклопентил, а Хг є кисень 28 Спосіб одержання сполуки формули (Іа) або (ІЬ) .(ІЬ) R2 незалежно вибраний із -СНз або -СН2СН3, необов'язково заміщених одним або більше галогенами, Ri є -(CR 4 R 5 )rR 6 , г має значення від 0 до 6, R4 та Rs незалежно вибрані із водню або Сі гал кіл у, R6 є Сз бЦиклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою, та Х 2 є О, який відрізняється тим, що він включає обробку альдегіду формули (IV) Т CN Фіг 2 де Т є CN або р-толілсульфоніл 26 Сполука формули (IV), яка є проміжною для утворення сполук формули (1) єно де X та R1X2 є такими ж, як і в формулах І (а) та І(Ь), ціанідом лужного металу 29 Спосіб згідно з п 28, який відрізняється тим, що ціанідом є LiCN 30 Спосіб згідно з пп 28 або 29, який відрізняється тим, що у формулі (IV) X є метокси, Ri є циклопентил, а Хг є кисень 31 Спосіб одержання ацилнітрилу формули (V) 58533 11 C(O)CN fleXeOR2, R2 незалежно вибраний із -СНз або -СН2СН3, необов'язково заміщених одним або більше галогенами, Ri є -(CR4R5)rR6, г має значення від 0 до 6, R4 та Rs незалежно вибрані із водню або Сі гал кіл у, R6 є Сз єциклоалкіл, який може бути необов'язково заміщений від 1 до 3 метильними групами або однією етильною групою, та Хг є О, який відрізняється тим, що він включає обробку альдегіду формули (IV) 12 де X та R1X2 є тими ж самими, що й у формулі (V), LiCN та каталітичною КІЛЬКІСТЮ диметилформаміДУ 32 Спосіб збагачення цис-4-ціано-4(3циклопентилокси-4-метоксифеніл)-гциклогексанкарбонової кислоти, утвореної із суміші цис-1 транс-ізомерів кислоти, який відрізняється тим, що він має у своєму складі кристалізацію цисізомеру, по суті вільного від транс-ізомеру, із розчину цис- та транс-ізомерів у гексан/ етилацетаті 33 Спосіб згідно з п 32, який відрізняється тим, що суміш цис^ранс ізомерів розчиняють в етилацетаті та гексані 34 Спосіб згідно з п 33, який відрізняється тим, що суміш цис^ранс ізомерів розчиняють в етилацетаті, а потім додають гексан 35 Спосіб згідно з п 34, який відрізняється тим, що розчин цис^ранс ізомерів в етилацетаті нагрівають зі зворотним холодильником, охолоджують і потім додають гексан, після чого проводять кристалізацію єно Цей винахід охоплює проміжні продукти та хід синтезу для одержання 4-ціано-4-(3циклопентилокси-4-метоксифеніл)циклогексановоі кислоти та її аналогів Ця кислота і зазначені її аналоги є селективними інгібіторами каталітичної ділянки ізоферменту фосфодіестерази із найменуванням IV (тут і далі PDE IV), і таким чином ці кислоти є корисними при лікуванні ряду захворювань, які можуть бути полегшені шляхом впливу на фермент PDE IV та його підтипи Бронхіальна астма є комплексним, багатофакторним захворюванням, яке характеризується оборотним звуженням дихальних шляхів та пперреактивністю дихального тракту до ЗОВНІШНІХ подразників Ідентифікацію нових терапевтичних агентів для астми проводити складно через той факт, що за розвиток захворювання несуть відповідальність різноманітні медіатори Таким чином, здається мало імовірним, що усунення дії одного медіатору може мати значний ефект на всі три компоненти хронічної астми Альтернативою до "медіаторного підходу" Є регулювання активності клітин, відповідальних за патофізіологію захворювання Один із таких шляхів полягає в підвищенні рівнів сАМР (аденозин 3',5'-монофосфат циклічний) Виявилось, що циклічний AMP є другим месенджером для широкого кола гормонів, нейротрансмітерів та ЛІКІВ, [Krebs Endocrinology Proceeding of the 4th International Congress Excerpta Medica, 1729, 1973] Коли ВІДПОВІДНИЙ агоніст зв'язується зі специфічним рецептором поверхні клітини, то активується аденілатциклаза, яка перетворює Мд2+АТР на сАМР у прискореному темпі Циклічний AMP модулює активність більшості, якщо не всіх, клітин, які спричиняють патофізіоло гію зовнішньої (алергічної) астми Таким чином, підвищення рівню сАМР може спричиняти благотворні ефекти, які включають 1) розслаблення гладкої мускулатури дихальних шляхів, 2) інгібування вивільнення медіатору опасистих клітин, 3) пригнічення нейтрофільної дегрануляцм, 4) інгібування базофільної дегрануляцм, і 5) інгібування активації моноцитів та макрофагів Звідси витікає, що сполуки, які активують аденілатциклазу або інгібують фосфодіестеразу мусять бути ефективними для пригнічення невідповідної активації гладкої мускулатури дихальних шляхів та різноманітних запалених клітин Принциповим клітинним механізмом інактивації сАМР є гідроліз 3іфосфодіефірного зв'язку одним або більше ізоферментами, які відносяться до сімейства циклічних нуклеотидних фосфодіестераз (PDE) Нещодавно було показано, що певний циклічний нуклеотидний фосфодіестеразний (PDE) ізофермент, PDE IV, є відповідальним за розпад сАМР у гладкій мускулатурі дихальних шляхів і запалених клітинах [Torphy, "Phosphodiesterase Isozymes Potential Targets for Novel Anti-asthmatic Agents" in New Drugs for Asthma, Barnes, ed IBC Technical Services Ltd , 1989] Дослідження показали, що інгібування цього ферменту призводить не тільки до розслаблення гладкої мускулатури дихальних шляхів, а ще й пригнічує дегрануляцію опасистих клітин, базофілів та нейтрофілів разом з інгібуванням активації моноцитів та нейтрофілів Крім того, благотворні впливи інгібіторів PDE IV значно посилюються, якщо активність аденілатциклази клітин-мішеней підвищена ВІДПОВІДНИМИ гормонами або паракринними гормонами у випадку in vivo Таким чином, інгібітори PDE IV можуть бути ефективними в астматичних легенях, де рівні про 14 13 58533 стагландину Ег і простацикліну (активаторів аденітетрапдротюпіраніл, тюпіраніл, Сз єциклоалкіл або латциклази) підвищені Такі сполуки можуть відС 4 єциклоалкіл, що містить один або два ненасикрити унікальний ПІДХІД до фармакотерапії бронхічені зв'язки, де циклоалкільні та гетероциклічні альної астми і надавати значні терапевтичні залишки можуть бути необов'язково заміщені від 1 переваги порівняно з засобами, що в даний час є до 3 метальними групами або однією стильною на ринку групою, Процес та проміжні продукти цього винаходу при цьому передбачають засоби для виробництва певних 4а) якщо R6 - гідроксил, то m = 2, або заміщених-4-(3,4б) якщо R6 - гідроксил, то г має значення від 2 до 6, або дизаміщенихфеніл)циклогексанових кислот, які є корисними при лікуванні астми та інших хвороб, які в) якщо R6 2-тетрапдропіраніл, можуть бути полегшені шляхом впливу на фертетрапдротюпіраніл, 2-тетрапдрофураніл або мент PDE IV та його підтипи Кінцеві продукти, що тетрапдратієніл, то m = 1 або 2, або викликають особливий інтерес, повністю описані в г) якщо R6 2-тетрапдропіраніл, патенті US 5 552 483, який опубліковано 3 вересня тетрапдротюпіраніл, 2-тетрапдрофураніл або 1996 р Інформація та пояснення, наведені в ньотетрапдротієніл, то г має значення від 1 до 6 му, через те, що ця інформація та ці пояснення д) якщо п = 1 і m = 0, то R6 ВІДМІННИЙ ВІД Н В необхідні для розуміння даного винаходу та в цій практиці в цілому, включені сюди як посилання X є YR2, галоген, нітро, ІЧНг або форміламін, Цей винахід відноситься до способу одержанХ 2 є О або NR 8 , ня сполуки формули І Y є О або S(O) m , (І) Ri є -(CR4R5)nC(O)O(CR4R5)rnR6, (CR4R5)nC(O)NR4(CR4R5)mR6, (CR4R5)nO(CR4R5)rnR6 або (CR4R5)rR6, де алкільні залишки можуть бути необов'язково заміщені одним або більше галогенами, m має значення від 0 до 2, п має значення від 1 до 4, г має значення від Одо 6, R4 і Rs є незалежно вибраними серед водню або Сі 2 алкілу, R6 є водень, метил, гідроксил, арил, галогенозаміщений арил, арилоксиСі залкіл, галогенозаміщений арилоксиСі залкіл, інданіл, інденіл, С7 пполіциклоалкіл, тетрапдрофураніл, фураніл, тетрапдропіраніл, піраніл, тетрапдротієніл, ТІЄНІЛ, п ї = 0, 1 або 2, R2 є незалежно вибраним із -СНз чи -СН2СН3, необов'язково заміщених 1 або більше галогенами, R3 є водень, галоген, Сі 4 алкіл, CH2NHC(O)C(O)NH2, галогенозаміщений Сі 4 алкіл, -CH=CR 8 R 8 , циклопропіл, необов'язково заміщений R 8 , CN, OR 8 , CH 2 OR 8 , NR 8 Rio, C H 2 N R 8 R i 0 , C(Z')H, C(O)OR 8 , C(0)NR 8 Rio або C=CR 8 , R8 є водень або Сі 4 алкіл, необов'язково від 1 до 3 заміщений фтором, R8 є R8 або фтор, R-іо є OR 8 або R n , R11 є водень або Сі 4 алкіл, необов'язково від 1 до 3 заміщений фтором, Z' є О, NR 9 , NOR 8 , NCN, C(-CN) 2 CR 8 CN, CR 8 NO 2 , CR 8 C(O)OR 8 , CR 8 C(O)NR 8 R 8 , C(-CN)NO 2 , C(-CN)C(O)OR 9 або C(-CN)C(O)NR 8 R 8 , R' та R" є незалежно воднем або -С(О)ОН, який включає обробку сполуки формули ІІ(а) або ІІ(Ь) о де R-і, R3, Хг та X є тими ж, як у формулі (І), бромідом ЛІТІЮ або бромідом магнію в полярному розчиннику при температурі приблизно 60° 100°С, необов'язково в інертній атмосфері протягом часу, достатнього для протікання реакції до кінця Цей винахід також стосується сполук формули II самих по собі Інший аспект цього винаходу стосується способу одержання кетону формули III в одній посудині, починаючи з ізованіліну, R1X2 де Ri, R3, Хгта X є тими ж, як у формулі (І), що більш повно описано нижче І, нарешті, третій аспект цього винаходу стосу 15 58533 ється процесу приготування сполуки формули (І), який включає обробку сполуки формули (IV) із застосуванням ціаніду лужного металу, наприклад, LiCN, у сумісному розчиннику, такому як диметилформамід, який містить в малій пропорції воду, 16 тетрапдротюпіраніл, 2-тетрапдрофураніл або тетрапдротієніл, то m = 1 чи 2, або г) якщо R6 2-тетрапдропіраніл, тетрапдротюпіраніл, 2-тетрапдрофураніл або тетрапдротієніл, то г має значення від 1 до 6, 222 д) якщо п = 1 і m = 0, то R6 ВІДМІННИЙ ВІД Н В (IV) де, у формулі III, R-i, Х т а Х2 є тими ж, як у формулі (І) Подальше втілення цього винаходу стосується процесу одержання сполуки формули (І), який включає обробку ацилнітрилу формули V водою C(())CN (V) Групи X, Хг та Ri у формулі (V) є тими ж, як у формулі І Нарешті, подальше втілення цього винаходу стосується сполук формули II RiX2 (И) Ri є -(CR4R5)nC(O)O(CR4R5)rnR6, (CR4R5)nC(O)NR4(CR4R5)mR6, (CR 4 R 5 ) n O(CR 4 R 5 )rnR6 або -(CR 4 R 5 ) r R6, де алкільні залишки можуть бути необов'язково заміщені одним або більше галогенами, m має значення від 0 до 2, п має значення від 1 до 4, г має значення від 0 до 6, R4 і Rs є незалежно вибраними серед водню або Сі галкілу, R6 є водень, метил, гідроксил, арил, галогенозаміщений арил, арилоксиСі залкіл, галогенозаміщений арилоксиСі залкіл, інданіл, інденіл, С7 пполіциклоалкіл, тетрапдрофураніл, фураніл, тетрапдропіраніл, піраніл, тетрапдротієніл, ТІОНІЛ, тетрапдротюпіраніл, тюпіраніл, Сз єциклоалкіл або С 4 бЦиклоалкіл, що містить один або два ненасичені зв'язки, де циклоалкільні та гетероциклічні залишки можуть бути необов'язково від 1 до 3 заміщені метильними групами або однією етильною групою, при цьому а) якщо R6 - гідроксил, то m = 2, або б) якщо R6 - гідроксил, то г має значення від 2 до 6, або в) якщо R6 2-тетрапдропіраніл, 2 X є YR2, галоген, нітро, Nbb або форміламін, Х 2 є О або NR 8 , Y є О або S ( O ) m , гтї є 0, 1 або 2, R2 є незалежно вибраним із -СНз або -СН2СН3, необов'язково заміщених 1 або більше галогенами, R3 є водень, галоген, Сі 4 алкіл, CH2NHC(O)C(O)NH2, галогенозаміщений Сі 4 алкіл, -CH=CR 8 Rs, циклопропіл, необов'язково заміщений R 8 , CN, OR 8 , CH 2 OR 8 , NR 8 Rio, C H 2 N R 8 R i 0 , C(Z')H, C(O)OR 8 , C(0)NR 8 Rio або C=CR 8 , R8 є водень або Сі 4 алкіл, необов'язково від 1 до 3 заміщений фтором, R8 є R8 або фтор, Rio є OR 8 або R n , R11 є водень або Сі 4 алкіл, необов'язково від 1 до 3 заміщений фтором, Z' є О, NR 9 , NOR 8 , NCN, C(-CN) 2 CR 8 CN, CR 8 NO 2 , CR 8 C(O)OR 8 , CR 8 C(O)NR 8 R 8 , C(-CN)NO 2 , C(-CN)C(O)OR 9 або C(-CN)C(O)NR 8 R 8 та T є CN або SO2R, де R є Сі єалкіл або Co залкілфеніл Цей спосіб передбачає дев'ятиступінчастий синтез для одержання певних 4-заміщених-4(3,4дизаміщенихфеніл)циклогексанових кислот Вихідною речовиною є ізованілін, З-пдрокси-4метоксибензальдепд, або його аналог Під "аналогом" мається на увазі інший замісник у 3 і/або 4 позиції, що відповідає визначенням Ri, R3, Х2 та X у визначенні формули (І) Сполуки, що одержують за цим процесом, є інгібіторами PDE IV Вони є корисними при лікуванні ряду хвороб, як описано у патенті US 5552438 який опубліковано 3 вересня 1996 року Переважними сполуками, які можна одержати за цим способом є наступні Переважними Ri замісниками в сполуках усіх зазначених формул є СЬЬ-циклопропіл, СН2-С5 бЦиклоалкіл, С 4 бЦиклоалкіл, що незаміщено або заміщено ОНС7 пполіциклоалкілом, (3- або 4циклопентил), феніл, тетрапдрофуран-3-іл, бензил або Сі 2алил, що незаміщено або одно- або більше заміщено фтором, -(СЬІ2)і зС(0)0(СН2)о 2СН3, (СН 2 )і зО(СН 2 )о 2 СНз і -(СН 2 ) 2 4 ОН Переважними X групами для формул (І), (II) або (III) є такі, де X є YR2 та Y є киснем Переважною Хг групою для формули (І) є така, де Хг є киснем Переважними R2 групами є Сі галкіл, незаміщений або одноабо більше заміщений галогенами Атомами галогену є переважно фтор і хлор, більш переважно фтор Більш переважними R2 групами є такі, де R2 є метил або фторозаміщені алкіли, особливо Сі галкіли, такі як -CF3, -CHF2 або -CH2CHF2 залишки Найбільш переважними є CHF21 -СНз залишки Найбільш переважними є такі сполуки, де Ri є -СНг-циклопропіл, циклопентил, 3пдроксициклопентил, метил або CF2H, X є YR2, Y є 17 58533 18 кисень, Х2 є кисень, та R2 є CF2H або метил, і R3 є ристані специфічні приклади, що ілюструють загаCN льну методологію, яка використовується в цьому Характерна схематика цього процесу наведевинаході на у Схемі І В цьому графічному поясненні вико СХЕМА І НзСО Ізованілін 1-1 12 СНзСЫ, T r i t o n ^ д 13 О Р NO e aM 1-5 14 НзСО н 3 со. О NSH a, OC, Ml O Г 1-6 сы О О 1-7 Н LB ir DMF/ CH 3 CN L СО 2 Н Формула 19 58533 20 НзСО ВІДПОВІДНО ДО Схеми І, ізованілін, З-пдрокси-4метоксибензальдепд, є легко доступним вихідним матеріалом Він може бути алкілований RiX залишком (Х=СІ, Вг і І), як показано, за допомогою цик лопентилхлориду Реакційну посудину спочатку продувають інертним газом, наприклад, азотом Після ЦЬОГО ДО посудини вводять полярний розчинник, такий як DMF, потім - ізованілін, потім 21 58533 RiX аддукт і якусь основу Використовують близько 2 еквівалентів RiX аддукту по відношенню до ізованіліну Використовують також близько 2 еквівалентів основи, знов таки по відношенню до ізованіліну Основою може бути будь-яка неорганічна основа або карбонат Тут це проілюстровано на прикладі карбонату калію Вміст посудини нагрівають до приблизно 125°С протягом приблизно від 90 до 120 хвилин, за цей час реакція має пройти до кінця Вміст посудини охолоджують до навколишньої температури, фільтрують для видалення неорганічних солей і промивають спиртом, таким як метанол Цей фільтрат містить альдегід, означений як 1-1 Потім альдегід відновлюють до спирту з використанням неорганічного відновника Для цього цей фільтрат з вищезгаданої реакції обробляють боропдридом натрію, і в результаті здійснення процесу одержують бажаний спирт 1-2 з максимальним виходом по відношенню до ізованіліну 97% Це досягається охолодженням фільтрату до приблизно 0°С, після чого додають відновник, тут боропдрид натрію Використовують приблизно від 0,25 до 0,5 еквівалентів цього відновника Температуру підтримують близько 0°С під час додавання відновника та протягом наступних приблизно ЗО 40 хвилин Потім ДОЗВОЛЯЄТЬСЯ ПІДВИЩИТИ температуру приблизно до кімнатної температури, після чого до реакційної посудини додають близько половини еквівалента НСІ Спирт потім екстрагують органічним розчинником, проілюстровано на прикладі толуолу, і промивають розбавленим бікарбонатом натрію Верхній органічний шар, що містить спирт, після цього обробляють надлишком концентрованої соляної кислоти при температурі навколишнього середовища для одержання після процесу бажаного бензилхлориду 1-3 Хлорид виділяються у вигляді w/w розчину в амідному розчиннику, проілюстровано на прикладі DMF, і обробляють приблизно 50% молярним надлишком ціаніду натрію при помірно підвищеній температурі, тут проілюстровано при 55°С Це дає бажаний нітрил 1-4 Нітрил виділяються у вигляді w/w розчину у відповідному розчиннику, такому як безводний ацетонітрил, та використовують безпосередньо у наступній стадії До розчину нітрилу додають метилакрилат Його охолоджують приблизно до -10°Ста повільно обробляють Triton-B в каталітичній КІЛЬКОСТІ, В тому ж розчиннику, що використовувався для розчинення нітрилу Метилакрилат додають в 3-4кратному надлишку Реакція завершується через ЗО - 45 хвилин після додавання акрилату, и продукт, пімелат, 1-5 виділяють у вигляді w/w розчину в толуолі та обробляють приблизно 2 еквівалентами метилату натрію при близько 75°С для одержання продукту, р-кето-ефіру, 1-6 Реакційний розчин охолоджують та нейтралізують до рН 7 неорганічною кислотою, такою як 6N соляна кислота В розчин додають диметилсульфоксид, хлорид натрію, воду і нагрівають, наприклад, до при 22 близно 150°С, щоб спричинити декарбоксилацію для одержання 1-7 Кетон, 1-7, виділяють із системи розчинників у вигляді білуватого осаду Дикарбонітрил 1-8 одержують із кетону шляхом обробки кетону хлороацетонітрилом в присутності неорганічної основи та каталітичної КІЛЬКОСТІ хлориду бензилтриетиламонію (ВТЕАС) Кетон додають до суміші сильної основи (водний гідроксид калію) та змішуваного з водою розчиннику, такого як тетрапдрофуран Додають незначний надлишок хлорацетонітрилу при зниженій приблизно до 0°С чи близько до такої температури Реакцію проводять при приблизно такій самій температурі протягом всього часу реакції, як правило, близько 1 години Продукт виділяють, як правило, він є кристалічним Дикарбонітрил перетворюють на циклогексанкарбоксильну кислоту із застосуванням кислотного каталізатора Льюіса, для одержання в ході реакції кислоти необхідна також вода Без води проміжні продукти 1-10а та 1-10Ь можуть димеризуватися Цю реакцію проводять шляхом введення в посудину розчинників, як приклад в цьому випадку наведені DMF, ацетонітрил і вода, та кислоти Льюіса (близько 1,5 еквівалентів), проілюстровано на прикладі LiBr, продування посудини інертним газом, додавання дикарбонітрилу Па або lib, або суміші На та lib і нагрівання посудини та и вмісту приблизно до 100°С протягом багатьох годин, прикладом є 8 годин Кислоту виділяють загальноприйнятими способами Треба зазначити, що ця реакція, яка є перетворенням епоксиду на кислоту, включає декілька проміжних продуктів, які немає потреби виділяти Виявлено, що обробка епоксиду LiBr дає проміжні продукти 1-9а та 1-9Ь Проміжний продукт 1-9а утворюється при введенні в реакційну посудину LiBr Але проміжний продукт 1-9а перетворюється знову на епоксид при зазначених умовах реакції Проміжний продукт 1-9Ь також утворюється, але, очевидно, швидко вступає в реакцію із утворенням проміжних продуктів, таких як енолат А, 1-10а і 110Ь і так далі, які приводять до продукту реакції Таким чином, схоже, утворюються 1-9а і 1-9Ь, але 1-9а перетворюється знову на епоксид, який в решті решт утворює 1-9Ь, котрий потім перетворюється на ІНШІ проміжні продукти на шляху утворення кислот 1 -11а і 1-11Ь Наведене у дужках позначення "ОМ(Н)" в 1-9а і 1-9Ь означає спиртову сіль металу або спирт сам по собі, залежно від умов реакції Гадаємо, що проміжний продукт 1-9Ь перетворюється на ацилонітрили з формулами 110а і 1 -10Ь через запропонований проміжний продукт, зазначений у дужках Існування запропонованого проміжного продукту, який зазначено у дужках, (енолату) не було повністю підтверджене І, незважаючи нате, що ацилнітрили 1-10а та 1-10Ь не спостерігалися безпосередньо, є непрямий доказ існування цих сполук завдяки тому факту, що був виділений продукт біс-конденсацм димер В, і про аналогічні сполуки повідомлялося, що схожий біс-конденсат є продуктом ацилнітрилу 23 58533 24 C(O)CN Аг Ar ЫОа/b Аг CN CN Димер А Відомо, ЩО димери, такі як димер А, утворюються із сполук, подібних ацилнітрилам 1-10а/Ь, у присутності HCN (Thesing, J , Witzel, D , Brehm, A Angew Chem 1956, 68, 425, and Hunig, S , Schaller, R Angew Chem Int Ed Engl 1982, 21, 36) І у доповнення, були виготовлені достовірні зразки проміжних продуктів 1-10а і 1 -1 Ob, і виявилося, що вони перетворюються на кислоти 1-11а і 1-11Ь під дією води Екваторіальний ізомер 1-10а Димер В перетворився на кислоту в співвідношенні екваторіальний/аксіальний приблизно 98 2, у той час, як аксіальний ізомер 1-10а ізомеризувався з переважанням екваторіального ізомеру 1-11а (77 23) Вважається, що аксіальний ацилнітрил перетворюється на екваторіальний ацилнітрил через запропонований у дужках проміжний енолат Друга, наступна схема реакції ілюструє одержання кислоти формули (І) із бромоальдепду формули (IV) Схема З 3-2 LiCN, D M F ....-_ —~+95°C (1-Па/Ь) (1-lOa/b) Наступні приклади мають проілюструвати особливості винаходу, але не обмежити його Те, що оговорене у винаході, зазначається далі у формулі, яка додається Специфічні приклади Приклад 1 Одержання З-циклопентилокси-4метоксибензальдепду 12л круглодонна колба, обладнана зверху мі шалкою, внутрішнім термометром та зворотним холодильником із входом для азоту, була продута азотом У колбу ввели диметилформамід (2,4л), ізованілін (350г, 2,3 моль, 1 еквівалент), циклопентилхлорид (481г, 4,6 моль, 2,0 еквівалента) та карбонат калію (634г, 4,6 моль, 2,0 еквівалента) Інтенсивно перемішану суспензію нагріли до 125°С протягом двох годин або до зникнення ізованіліну Реакційну суміш охолодили до 20 - 30°С і відфіль 25 трували для видалення неорганічних солей Осад на фільтрі промили метанолом (1,0л) Чистий, світло-коричневий фільтрат (DMF та метанол), який містить продукт, 3циклопентилокси-4-метоксибензальдепд, використовували безпосередньо у наступній стадії (вихід розчину 100%) Приклад 2 Одержання З-циклопентилокси-4метоксибензилового спирту 12л круглодонна колба, обладнана зверху мішалкою, внутрішнім термометром та зворотним холодильником із входом для азоту, була продута азотом У колбу ввели диметилформамід (2,4л), метанол (1,0л) і 3циклопентилокси-4-метоксибензальдепд (506г, 2,3 моль, 1 еквівалент) Вміст колби охолодили до температури від 0 до 5°С, з наступним додаванням бор гідриду натрію (32,2г, 0,85 моль, 0,37 еквівалента) Реакційну суміш витримали при температурі від 0 до 5°С протягом ЗО хв, та підвищили температуру до 20 - 25°С, витримали 2 години або до зникнення альдегіду Протягом 20 хвилин додавали розчин 6N соляної кислоти (195мл, 1,17 моль, 0,51 еквівалента) Реакційну суміш концентрували під зниженим тиском та охолоджували до 20 - 25°С У колбу ввели деюнізовану воду (1,9л), і толуол (1,9л) Шари розділили, виділили органічний шар і ДВІЧІ промили деюнізованою водою (2 х 800мл) Продукт, З-циклопентилокси-4метоксибензиловий спирт збирали у вигляді розчину в толуолі (вихід розчину 97%) та використовували безпосередньо у наступній стадії Приклад З Одержання 4-хлорметил-2-циклопентилокси1-метоксибензену 12л круглодонна колба, обладнана зверху мішалкою, внутрішнім термометром та зворотним холодильником із входом для азоту, була продута азотом У колбу ввели 3циклопентилокси-4-метоксибензиловий спирт (495г, 2,2 моль, 1 еквівалент) у розчині толуолу У інтенсивно перемішану реакційну суміш при 22°С додали концентровану НСІ (600г, 2,75 еквівалента) Реакційну суміш витримали при температурі від 20 до 25°С протягом ЗО хвилин Верхній органічний шар відокремили, а нижній кислотний шар викинули До верхнього органічного шару додали 10%-ний розчин бікарбонату натрію (550г, 0,65 моль, 0,36 еквівалента) та t-бутилметиловий ефір (814г) Вміст колби інтенсивно перемішали та залишили відстоюватися Продукт, 4-хлорметил-2циклопентилокси-1-метоксибензен, виділили у вигляді розчину у толуолі і t-бутилметиловому ефірі (вихід розчину 96,8%) Його безпосередньо використовували у наступній стадії Приклад 4 Одержання 4-ціанометил-2-циклопентилокси1-метоксибензену 12л круглодонна колба, обладнана зверху мішалкою та дистилятором, була продута азотом В колбу ввели 4-хлорметил-2-циклопентилокси-1метоксибензен (519г, 2,15 моль, 1,0 еквівалент) у розчині толуолу і t-бутилметилового ефіру Реакційну суміш концентрували при зниженому тиску до залишку У 12л колбу додали DMF (1,44кг) і ціанід натрію (142г, 2,9 моль, 1,35 еквівалента) Реакційну суміш нагріли до 55°С на 6 год або до 26 передбачуваного завершення зникнення бензилхлориду Реакційну суміш концентрували під зниженим тиском до залишку До колби ввели tбути л метиловий ефір (2,30кг) і деюнізовану воду (800мл) Вміст колби інтенсивно перемішали та залишили відстоятися Верхній органічний шар ВІДДІЛИЛИ, тричі промили деюнізованою водою (3 х 800мл) та концентрували при атмосферному тиску до залишку До колби ввели ацетонітрил (1,26кг) і дистиляція тривала до збору додаткових 400мл розчиннику Продукт, 4-ціанометил-2циклопентилокси-1-метоксибензен, було виділено у вигляді розчину в ацетонітрилі (вихід 92,2%) Його безпосередньо використовували у наступній стадії Приклад 5 Одержання диметил-4-ціано-4-(3циклопентилокси-4-метоксифеніл)пімелату 12л круглодонна колба, обладнана зверху мішалкою, внутрішнім термометром та зворотним холодильником із входом для азоту, була продута азотом У колбу ввели розчин 4-ціанометил-2циклопентилокси-1 -метоксибензену (460г, 1,99 моль, 1,0 еквівалент) в ацетонітрилі і метилакрілат (520г, 6,0 моль, 3,0 еквівалента) Вміст колби охолодили до -10°С У краплинну лійку з урівноваженим тиском ввели ацетонітрил (1,1л) і гідроксид бензилтриметиламонію (40% w/w розчин у метанолі, 25г, 0,06 моль, 0,03 еквівалента) Вміст краплинної лійки додали у колбу Спостерігалося виділення тепла, і після перемішування протягом ЗО хвилин вміст колби охолодили до 20°С Реакційну суміш концентрували під зниженим тиском до залишку До залишку додали толуол (2,6л) Цей розчин диметил-4-ціано-4-(3-циклопентилокси-4метоксифеніл)пімелату (вихід розчину 90%) безпосередньо використовували у наступній стадії 58533 Приклад 6 Одержання 4-ціано-4-(3-циклопентилокси-4метоксифеніл)циклогексан-1-ону 12л круглодонна колба, обладнана зверху мішалкою, внутрішнім термометром та зворотним холодильником із входом для азоту, була продута азотом У колбу ввели розчин диметил-4-ціано-4(3-циклопентилокси-4-метоксифеніл)пімелату (720г, 1,78 моль, 1 еквівалент) у толуолі і метилат натрію (25 ваг % у метанолі, 545г, 2,67 моль, 1,5 еквівалента) Реакційну суміш нагріли до 70 - 75°С на 2 години або до передбачуваного завершення зникнення пімелату Реакційну суміш охолодили до 25°С Додали розчин 6N соляної кислоти, щоб досягти рН 6,8 - 7,2 Реакційну суміш концентрували під вакуумом до залишку У колбу ввели диметилсульфоксид (3,3л), деюнізовану воду (250мл) і хлорид натрію (250г) Вміст колби нагріли до 145 - 155°С і витримали при цій температурі 2 години Реакційну суміш охолодили і концентрували під вакуумом до залишку До залишку додали воду (1,9л), етилацетат (1,25л) і t-бутилметиловий ефір (620мл) Розчин перемішали та залишили відстоюватися Шари розділили, і водний шар повторно екстрагували етилацетатом (1,25л) Змішані органічні шари ДВІЧІ промили деюнізованою водою (2 х 2,5л) Органічний шар відокремили і концентрували під зниженим тиском до залишку До цього залишку додали 27 58533 ізопропанол (1,66л) і нагріли для утворення розчину з наступним повільним введенням гексану (1,66л) Суспензію охолоджували до 5°С на протязі ЗО хвилин і витримали при 0 - 5°С 2 години Продукт відфільтрували і промили 50 - 50 ізопропанолгексановою сумішшю (840мл) при 0°С Продукт висушили для одержання 4-ціано-4-(3циклопентилокси-4-метоксифеніл)циклогексан-1ону (315г, 56% від пімелату) Приклад 7 Одержання цис-(+/-)-6-[3 -(циклопентилокси)-4метоксифеніл]-1-оксобіцикло [2 5] октан-2,6дикарбонітрилу 5л круглодонна колба, обладнана зверху мішалкою, внутрішнім термометром та входом для азоту, була продута азотом У колбу ввели 50% розчин гідроксиду калію (220г) і тетрапдрофуран (550мл) Під час перемішування при кімнатній температурі ввели хлорид бензилтриетиламонію (8,1г, 0,035 моль, 0,05 еквівалента) Розчин охолодили до 0°С У краплинну лійку з урівноваженим тиском ввели розчин, що містив тетрапдрофуран (550мл), 4-ціано-4-(3-циклопентилокси-4метоксифеніл)циклогексан-1-он (230г, 0,73 моль, 1,0 еквівалент) і хлорацетонітрил (59г, 0,78 моль, 1,07 еквівалент) при кімнатній температурі Під час перемішування вмісту колби при 0°С, протягом 15 хвилин до нього додавали розчин із краплинної лійки з урівноваженим тиском Протягом 1 години підтримували температуру між 0 і 5°С та вели перемішування Реакційну суміш нагріли до 25°С та розвели водою (900мл) і етилацетатом (900мл) Розчин перемішали і залишили відстоюватися на ЗО хвилин Шари розділили, органічний шар відокремили і концентрували вакуумною дистиляцією до залишку Додали метанол (540мл) і нагріли розчин до 40°С Під час охолодження до 20°С тривалістю 90 хвилин було додано гексан (540мл) Охолодження продовжили, і продукт почав кристалізуватися при 10°С Далі суспензію охолодили до -5°С і витримали при -5 - 0°С протягом двох годин Продукт відфільтрували і промили 50-50 метанол-гексановою сумішшю (300мл) при 0°С Продукт висушили для одержання цис-(+/-)-6-[3(циклопентилокси)-4-метоксифеніл]-1оксобіцикло[2 5]октан-2,6-дикарбонітрилу (190г, 73%) у вигляді білої кристалічної речовини Приклад 8 Одержання 1-9а В 12-ти драхмову склянку із шийкою з різьбою, що закривається пробкою, ввели диглім (5,92г) і епоксинітрил (0,70г, 1 екв) із прикладу 7 Цю суміш перемішували при нагріві на масляній бані протягом 5 хвилин Потім додали МдВгг-бЬЬО (0,906г, 1,55 екв) Через 3 години вихідна речовина виявлена не була Реакційну суміш охолодили, потім змішали із 5%-ною водною лимонною кислотою/етилацетатом, шари збовтали і розділили Друга екстракція ефіром/етилацетатом дала деякий колір, що переходив у органічний шар, але наступна екстракція кольору не мала Органічні фракції з'єднали і промили водою і соляним розчином, та висушили за допомогою MgSO4 Продукт кристалізували із гексану, т пл 151 - 152°С Елементний аналіз С - 58,20, Н - 5,82, Вг 28 18,44, N - 6,46, знайдено С - 58,32, Н - 5,73, Вг 18,48, N - 6,34 Структура підтвердилася при рентгеноструктурному аналізі кристалічного зразка, одержаного з метилового спирту Приклад 9 Одержання 1-9Ь До Мд (0,189г, 2,02 екв) (відшліфований за допомогою ступки та пестика) в ефірі додали 1,2диброметан (1,55г, 2,06 екв) у невеликому об'ємі ефіру для ініціації реакції Грін'яра Коли більша частина магнію була використана і з етаном більше не спостерігалось ніяких змін, реакційну суміш перемішували додаткові 0,5 год при кімнатній температурі, після чого до неї додали епоксид із прикладу 7 (1,41 г, 1 екв ) в мінімальній КІЛЬКОСТІ сухого тетрапдрофурану при навколишній температурі Після близько 70 годин при кімнатній температурі були виявлені і бромоціаноспирт (1-9Ь), і бромоціанопдрин (1-9а) у співвідношенні 6 1 Продукт 1-9Ь виділили у вигляді масла за допомогою препаративної HPLC Структура була підтверджена шляхом вуглецевого та протонного NMR Приклад 10 Одержання сполуки 3-1 - епокисульфону До 25мл круглодонної колби, обладнаної магнітним мішальним стержнем і гумовою прокладкою додали 1,00г 4-ціано-4-(3-циклопентилокси-4метоксифеніл)циклогексан-1-ону, 0,70г хлорометил-р-толилсульфому, і 7мл тетрапдрофурану Все це перемішали, потім додали Змл 50% w/w водного NaOH і бензилтриметильний ланцюг (0,05г) Цю суспензію інтенсивно перемішували протягом 2 годин при кімнатній температурі Реакційний розчин перемістили у ділильну лійку, до якої додали 50мл етилацетату і підкислили 6N НСІ Органічний шар зібрали, промили 2х деюнізованою водою, висушили за допомогою MgSO4 та профільтрували для видалення солей Приклад 11 Одержання сполуки 3-2 - бромоальдепду До Мд (0,048г, 1,03 екв, 0,021 моль) (відшліфований за допомогою ступки та пестика) в ефірі додали 1,2-дибромоетан (0,40г, 1,06 екв, 0,02 моль) в атмосфері азоту До ефіру добавили дві краплі йоду, щоб розпочати реакцію, після чого реакційну суміш обережно розігріли Після утворення сполуки Грін'яра реакційну колбу охолодили до приблизно 5°С і ввели епоксисульфон із прикладу 10 (0,93г, 1 екв, 0,002 моль) в ефірі/метиленхлориді Реакційну суміш піддали TLC (умови силікагель з циклогексаном толуол ацетонітріл оцтова кислота 40 40 20 4) Реакційну суміш перемішували при 5°С протягом 2 годин Продукт ВІДДІЛИЛИ шляхом введення води та ефіру/ТВМЕ до реакційної суміші і відділення органічного шару Його промили водою і соляним розчином та висушили за допомогою MgSO4 Випарювання дало масло, яке одразу ж хроматографовували через 40г силікагелю із застосуванням суміші гексану і етилацетату (5 - 40% етилацетату) Це дало чисте масло (0,49г), що містило, як показав протонний NMR, приблизно рівні пропорції екваторіального та аксіального ізомерів Мас-спектр показав наявність молекулярного юну при т/е 405, що МІСТИТЬ 1 атом брому [C20H24BrNO3] 29 58533 Приклад 12 Одержання с-4-ціано-4-(3-циклопентилокси-4метоксифеніл)-г-циклогексанкарбоновоі кислоти 5л круглодонна колба, обладнана зверху мішалкою, внутрішнім термометром та зворотним холодильником із входом для азоту, була продута азотом У колбу ввели диметилформамід (580г), ацетонітрил (480г), бромід ЛІТІЮ (72Г, 0,83 моль, 1,62 еквівалента) і деюнізована вода (20г, 1,1 моль, 2,2 еквівалента) Розчин перемішали в атмосфері азоту при 25 - 30°С, після чого додали цис-(+/-)-6-[3-(циклопентилокси)-4-метоксифеніл]1-оксобіцикло[2,5]октан-2,6-дикарбонітрил (180г, 0,51 моль, 1,0 еквівалент) Реактор нагріли до 90 95°С на 8 годин або до передбачуваного завершення зникнення епоксинітрилу Вміст колби охолодили до 20°С, після чого додали розчин гідроксиду натрію (92г гідроксиду натрію, 2,3 моль, 4,5 еквівалента, що розчинено у 200мл деюнізованої води) Суспензію перемішували при 20°С протягом ЗО хвилин, після чого додали гіпохлорит натрію (600мл, 0,46 моль, 0,9 еквівалента) Вміст колби перемішували протягом 90 хвилин, після чого додали t-бутилметиловий ефір (2,27кг) і 6N НСІ (644мл, 3,86 моль, 7,5 еквівалентів) Нижній водний шар знов екстрагували t-бутилметиловим ефіром (454г), а змішаний органічний шар промили 4 рази деюнізованою водою (4 х 800мл) Органічний шар концентрували до залишку У колбу ввели етилацетат (900г) і нагріли із зворотним холодильником Вміст колби охолодили до 50°С, після чого додали гексан (672г) Вміст колби охолодили до 0°С і витримали 1 годину Продукт відфільтрували і промили холодними етилацетатом/гексаном (1/9, 175г) Продукт висушили для одержання с-4-ціано4-(3-циклопентилокси-4-метоксифеніл)-гциклогексанкарбонової кислоти (125г, 69%) у вигляді білуватого порошку Приклад 13 Одержання хлориду с-4-ціано-4-(3циклопентилокси-4-метоксифеніл)-гциклогексанкарбонової кислоти Комп'ютерна верстка А Крулевський ЗО У колбі з однією шийкою, обладнаній для продування азотом, змішали с-4-ціано-4-(3циклопентилокси-4-метоксифеніл)-гциклогексанокарбонову кислоту (1,372г, 1 екв, 0,004 моль) і оксалилхлорид (4,568г, 9 екв , 0,036 моль) Потім додали одну краплю диметилформаміду Цю суміш перемішували при навколишній температурі протягом ночі Після випарювання під високим вакуумом одержали продукт, зазначений у заголовку Приклад 14 Одержання форми 1 -10а - 4-ціано-4-(3циклопентилокси-4-метоксифеніл)-гциклогексанацилнітрилу У колбі зразок хлориду кислоти (0,217г, 0,006 моль, 1 екв), що одержано у прикладі 12, розчинили у CDCI3 (2,34мл) До цього розчину (охолодженого до 5°С) додали триметилсилілцианід (0,07г, 1,3 екв , 0,008 моль) і каталітичну КІЛЬКІСТЬ Znb (0,004г) Цей розчин кип'ятили із зворотним холодильником протягом ночі При цьому вихід продукту, зазначеного в заголовку, становив 0,211г IR COCN, v 2220см \ С=О, v 1720см 1 Ізомеричну чистоту 1-10а визначали шляхом пдролізування ацилнітрилу у теплій воді, продукт є по суті чистою сполукою 1 -11 а Приклад15 Одержання форми 1 -10Ь - 4-ціано-4-(3циклопентилокси-4-метоксифеніл)-гциклогексанацилнітрилу В експерименті, аналогічному до прикладу 14, аксіальну карбонову кислоту було перетворено на хлорид кислоти з використанням оксалилхлориду і каталітичної КІЛЬКОСТІ диметилформаміду Хлорид кислоти було перетворено безпосередньо на ВІДПОВІДНИЙ ацилнітрил, 1 -10Ь, ізомер сполуки, одержаної в прикладі 14 Ізомеричну чистоту аналізували шляхом пдролізування ацилнітрилу при перемішуванні його в теплій воді протягом 20 годин Аналітичне визначення при HPLC виявило, що >96% продукту має форму 1-10Ь Підписано до друку 05 09 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds and processes for preparation of substituted 4-phenyl-4-cyanocyclohexanoic acids
Назва патенту російськоюСоединения и способы изготовления замещенных 4-фенил-4-цианоциклогексановых кислот
МПК / Мітки
МПК: C07C 255/46, A61P 11/06, C07C 253/30, C07B 61/00, C07C 253/34, C07C 255/31, C07D 303/00, A61K 31/277
Мітки: заміщених, спосіб, проміжні, 4-феніл-4-ціаноциклогексанових, кислот, варіанти, сполуки, одержання
Код посилання
<a href="https://ua.patents.su/15-58533-sposib-varianti-oderzhannya-zamishhenikh-4-fenil-4-cianociklogeksanovikh-kislot-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Спосіб (варіанти) одержання заміщених 4-феніл-4-ціаноциклогексанових кислот та проміжні сполуки</a>
Попередній патент: Протитромбоцитна та антиатерогенна фармацевтична композиція, яка містить тієнпіридинову похідну та інгібітор hmg-koa редуктази
Наступний патент: Похідні 2,3-(1н, 4н)-хіноксаліндіону, фармацевтична комозиція, спосіб лікування, проміжна сполука (варіанти), спосіб одержання сполуки (варіанти)
Випадковий патент: Спосіб оцінки зносу та стійкості лезового різального інструмента












