Ліпофільні похідні жирних кислот, фармацевтична композиція та композиція для сільського господарства або садівництва, спосіб модифікування активності та спосіб одержання ліпофільної похідної
Номер патенту: 65557
Опубліковано: 15.04.2004
Автори: ДАЛЕН Аре, Мюрен Фінн, Берретсен Бернт, Саннволл Маріт Ліланн
Формула / Реферат
1. Ліпофільна похідна біологічно активної сполуки, що містить в молекулярній структурі одну або декілька функціональних груп, вибраних з груп спирту, простого ефіру, фенілу, аміно, амідо, тіолу, карбонової кислоти та складного ефіру карбонової кислоти, інша, ніж нуклеозид або нуклеозидна похідна, яка відрізняється тим, що в структурі її молекули принаймні одна указана функціональна група цієї біологічно активної сполуки замінена на ліпофільну групу, вибрану з груп формули: RCOO-, RCONH-, RCOS-, RCH2O-, RCH2NH-, -COOCH2R, -CONHCH2R та -SCH2R, де R являє собою ліпофільний фрагмент, вибраний з цис-8-гептадеценілу, транс-8-гептадеценілу, цис-10-нонадеценілу та транс-10-нонадеценілу.
2. Ліпофільна похідна за п. 1, де указана біологічно активна сполука являє собою сполуку, що має терапевтичну активність в медицині або в ветеринарії.
3. Ліпофільна похідна за п. 2, де указана біологічно активна сполука являє собою адренокортикостероїд.
4. Ліпофільна похідна за п. 3, де адренокортикостероїд вибраний з бетаметазону, кортизону, дексаметазону, флуоцинолону, флудрокортизону, гідрокортизону, метилпреднізолону, преднізолону, триамцинолону, епрозинолу, параметазону, преднізону, беклометазону та орципреналіну.
5. Ліпофільна похідна за п. 4, де указаний адренокортикостероїд вибраний з преднізолону та бетаметазону.
6. Ліпофільна похідна за п. 5, яка являє собою: 11,17,21-тригідроксипрегна-1,4-дієн-3,20-діон-21-елаїдат,
9-фтор-11, 17,21 -тригідрокси-16-метилпрегна-1,4-дієн-3,20-діон-21 -елаїдат.
7. Ліпофільна похідна за п. 2, де указана біологічно активна сполука являє собою нестероїдний протизапальний лікарський засіб (НПЗЗ).
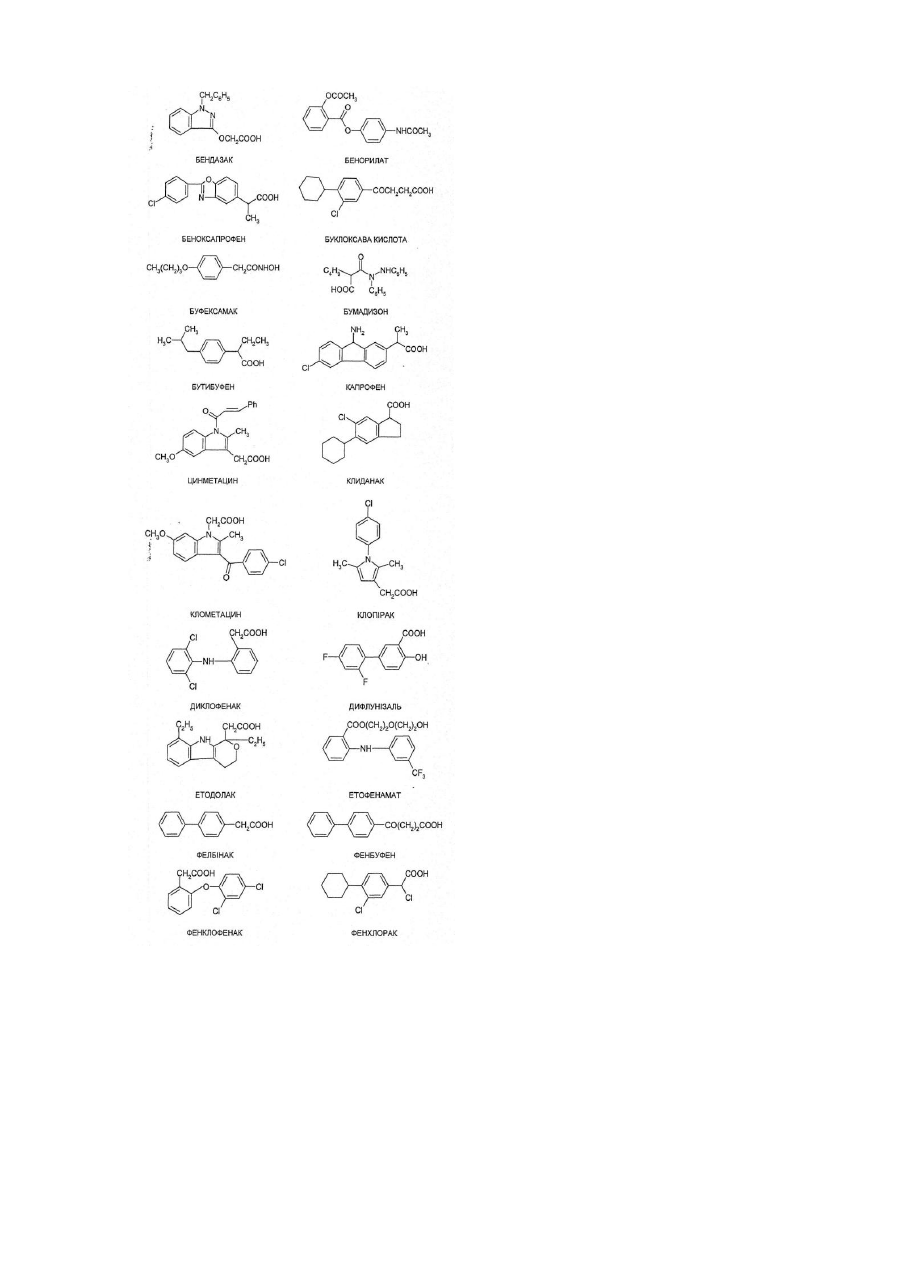
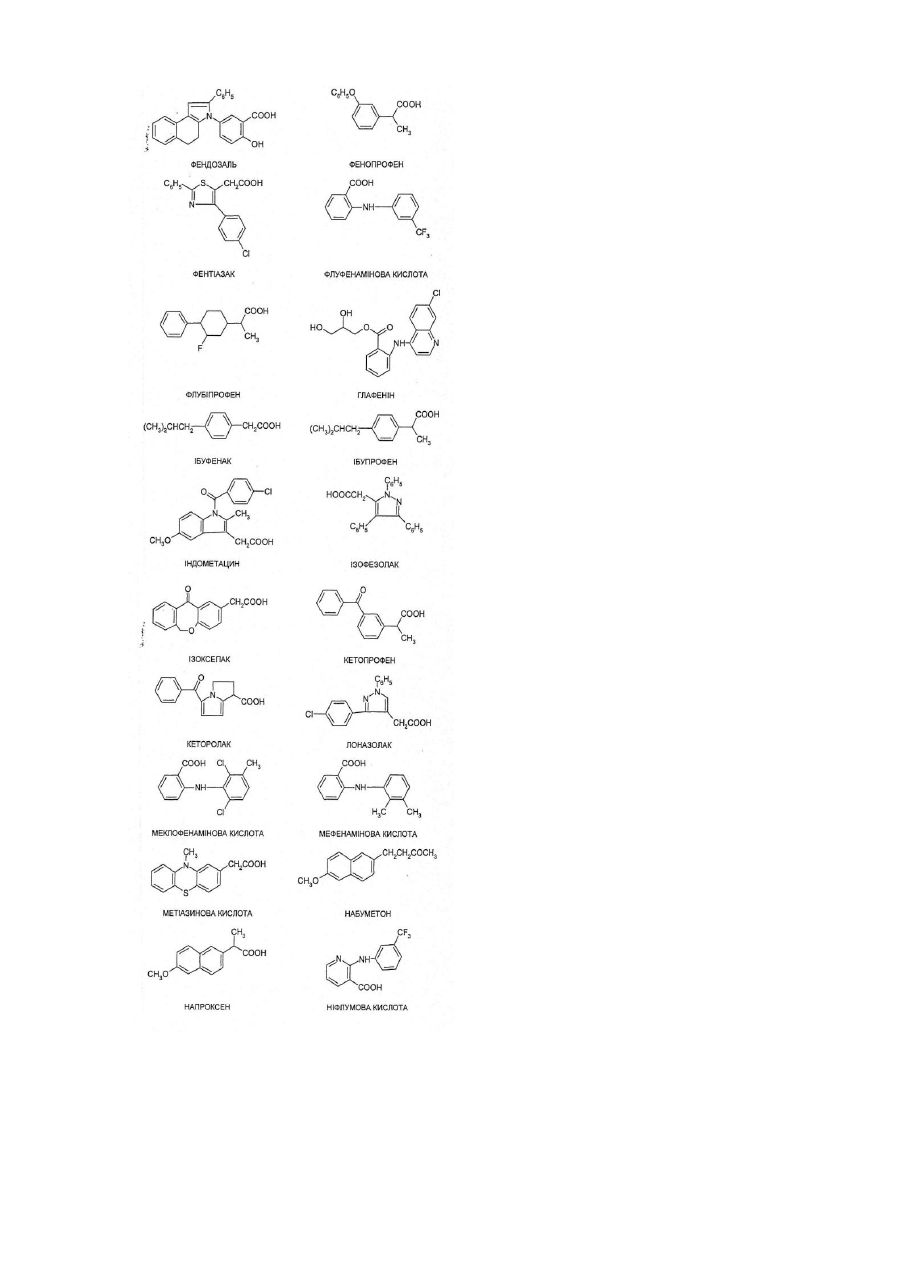
8. Ліпофільна похідна за п. 8, де указаний НПЗЗ вибирають з ацеметацину, алкофенаку, амфенаку, аспірину, бендазаку, бенорилату, беноксапрофену, букломової кислоти, буфексамаку, бумадизону, бутибуфену, капрофену, цинметацину, кліданаку, клометацину, клорипаку, диклофенаку, дифлунізалу, етодолаку, етофенамату, фелбінаку, фенбуфену, фенклофенаку, фенклораку, фендозолу, фенопрофену, фентіазаку, флуфенамової кислоти, флурбіпрофену, глафеніну, ібуфенаку, ібупрофену, індометацину, ізофезолаку, ізоксепаку, кетопрофену, кеторолаку, лоназолаку, меклофенамової кислоти, мефанамової кислоти, метіазинової кислоти, набуметону, напроксену, ніфлумової кислоти, оксаметацину, оксапрозину, піразолаку, піроксикаму, протизинової кислоти, саліцилової кислоти, суліндаку, сургаму, тенідапу, теноксикаму, тіараміду, тіноридину, толфенамової кислоти, толметину та зомепіраку.
9. Ліпофільна похідна за п. 8, де указаний НПЗЗ вибирають з диклофенаку, індометацину, напроксену та піроксикаму.
10. Ліпофільна похідна за п. 8, яка являє собою: цис-9'-октадеценіловий складний ефір [2-(2,6-дихлорфеніл)аміно]бензолоцтової кислоти,
(цис-9-октадеценіл)амід 1 -(п-хлорбензоїл)-5-метокси-2-метиліндол-3-оцтової кислоти,
(цис-9'-октадеценіл)амід S-(+)-2-(6-метокси-2-нафтил)пропіонової кислоти,
цис-9'-октадеценіловий складний ефір S-(+)-2-(6-метокси-2-нафтил)пропіонової кислоти,
4-0-(транс-9'-октадеценоїл)-2-метил-N-(2-піридил)-2Н-1,2-бензолтіазон-3-карбоксамід-1,1-діоксид,
4-0-(цис-11'-ейкозеноїл)-2-метил-N-(2-піридил)-2Н-1,2-бензотіазон-3-карбоксамід-1,1-діоксид,
цис-9'-октадеценіловий складний ефір 2-гідроксибензойної кислоти,
2-(цис-9'-октадеценоксі)етилбензоат,
2-(цис-9'-октадеценокси)бензойна кислота,
етиловий складний ефір S-(+)-2-(6-[цис-9'-октадеценокси]-2-нафтил)пропіонової кислоти,
S-(+)-2-(6-[цис-9'-октадеценокси]-2-нафтил)пропіонова кислота.
11. Ліпофільна похідна за п. 2, де указана біологічно активна сполука являє собою протипухлинний лікарський засіб.
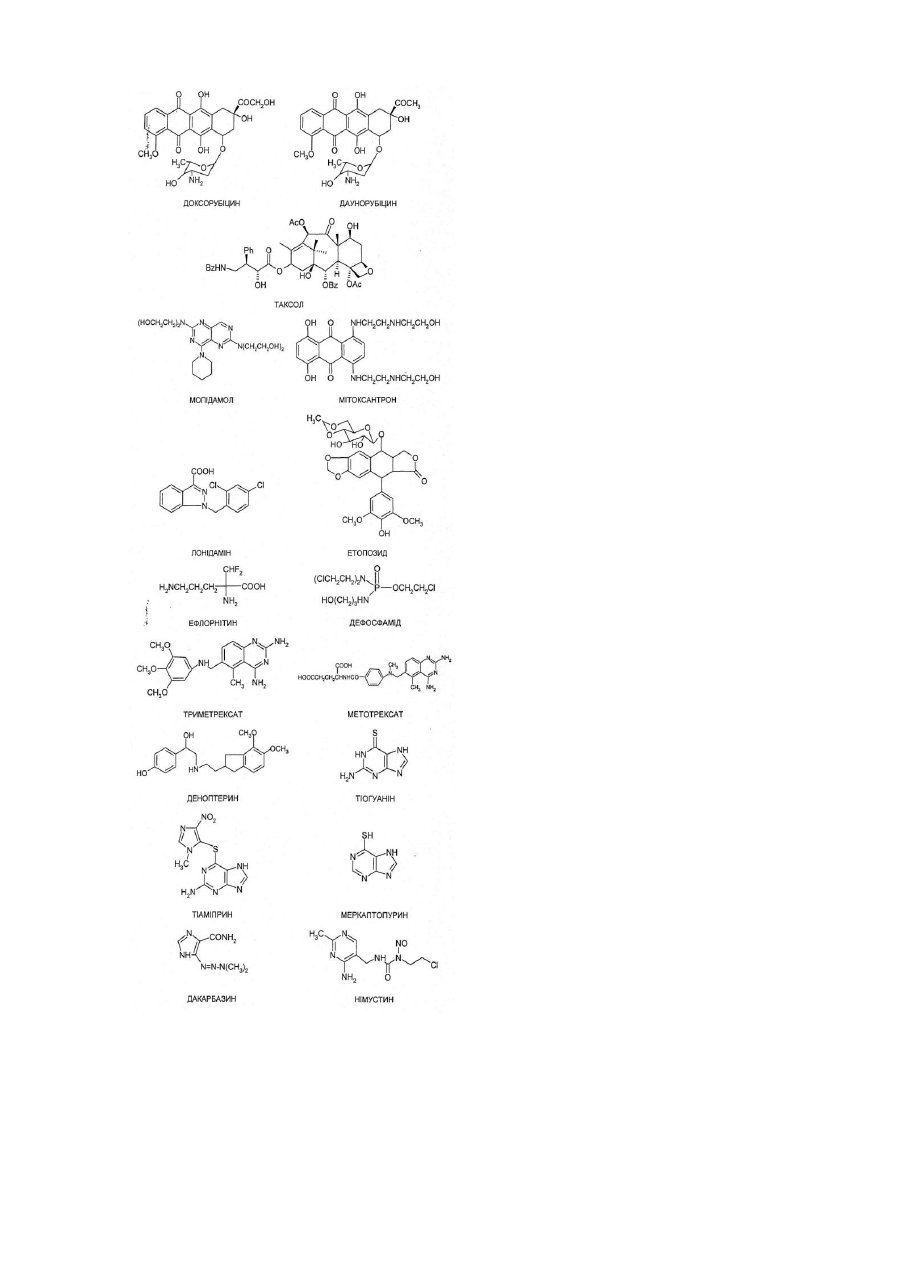
12. Ліпофільна похідна за п. 11, де указаний протипухлинний лікарський засіб вибирають з мегестролу, медроксипрогестерону, гексесролу, трилостану, аміноглутетіміду, епітіостанолу, калустерону, 2-етилгідразиду подофілинової кислоти, пірарубіцину, доксорубіцину, даунорубіцину, таксолу, мопідамолу, мітоксантрону, лонідаміну, етопозиду, ефлорнітину, дефосаміду, триметрексату, метотрексату, деоптерину, тіогуаніну, тіаміпрену, меркаптопурину, дакарбазину, німустину, хлорозотокіну, мелфалану, естрамустину, циклофосфаміду, хлорамбуцилу та триметіолмеламіну.
13. Ліпофільна похідна за п. 12, де указаний протипухлинний лікарський засіб вибирають з хлорамбуцилу, мелфалану та таксолу.
14. Ліпофільна похідна за п. 12, яка являє собою: хлорамбуцилолеїловий складний ефір,
мелфаланамід елаїдинової кислоти,
таксол-2'-елаїдат,
даунорубіцинамід елаїдинової кислоти,
доксорубіцинамід елаїдинової кислоти,
даунорубіцинолеїлкарбамат,
доксорубіцинолеїлкарбамат.
15. Ліпофільна похідна за п. 2, де указана біологічно активна сполука являє собою протимікробний агент.
16. Ліпофільна похідна за п. 15, де указаний протимікробний агент вибирають з оксациліну, ампіциліну, амоксициліну, цефалексину, цефалотину, цефалоспорину, доксицикліну, хлорамфеніколу, п-аміно-саліцилової кислоти, етамботолу, ципофлоксацину, енрофлоксацину, дифлоксацину та данофлоксацину.
17. Ліпофільна похідна за п. 16, де указаний протимікробний агент вибирають з п-аміно-саліцилової кислоти, хлорамфеніколу, оксациліну та ампіциліну.
18. Ліпофільна похідна за п. 16, яка являє собою: елаїдиновий складний ефір п-аміно-саліцилової кислоти,
4-(елаїдамідо)саліцилову кислоту,
хлорамфеніколовий складний ефір елаїдинової кислоти,
олеїловий складний ефір оксациліну,
ампіцилінамід елаїдинової кислоти,
олеїловий складний ефір ампіциліну.
19. Ліпофільна похідна за п. 2, де указана біологічно активна сполука являє собою антипаразитарний лікарський засіб.
20. Ліпофільна похідна за п. 19, де указаний антипаразитарний лікарський засіб вибирають з амодіаквіну, гідроксихлороквіну, мефлоквіну, мепакрину, декоквінату, зоалену, сполуки формули:
та сполуки формули:
.
21. Ліпофільна похідна за п. 19, яка являє собою: 7-хлор-4-{4-[етил(2-елаїдоїл-оксіетил)аміно]-метилбутиламіно}-хінолон.
22. Ліпофільна похідна за п. 2, де указана біологічно активна сполука являє собою ЦНС лікарський засіб.
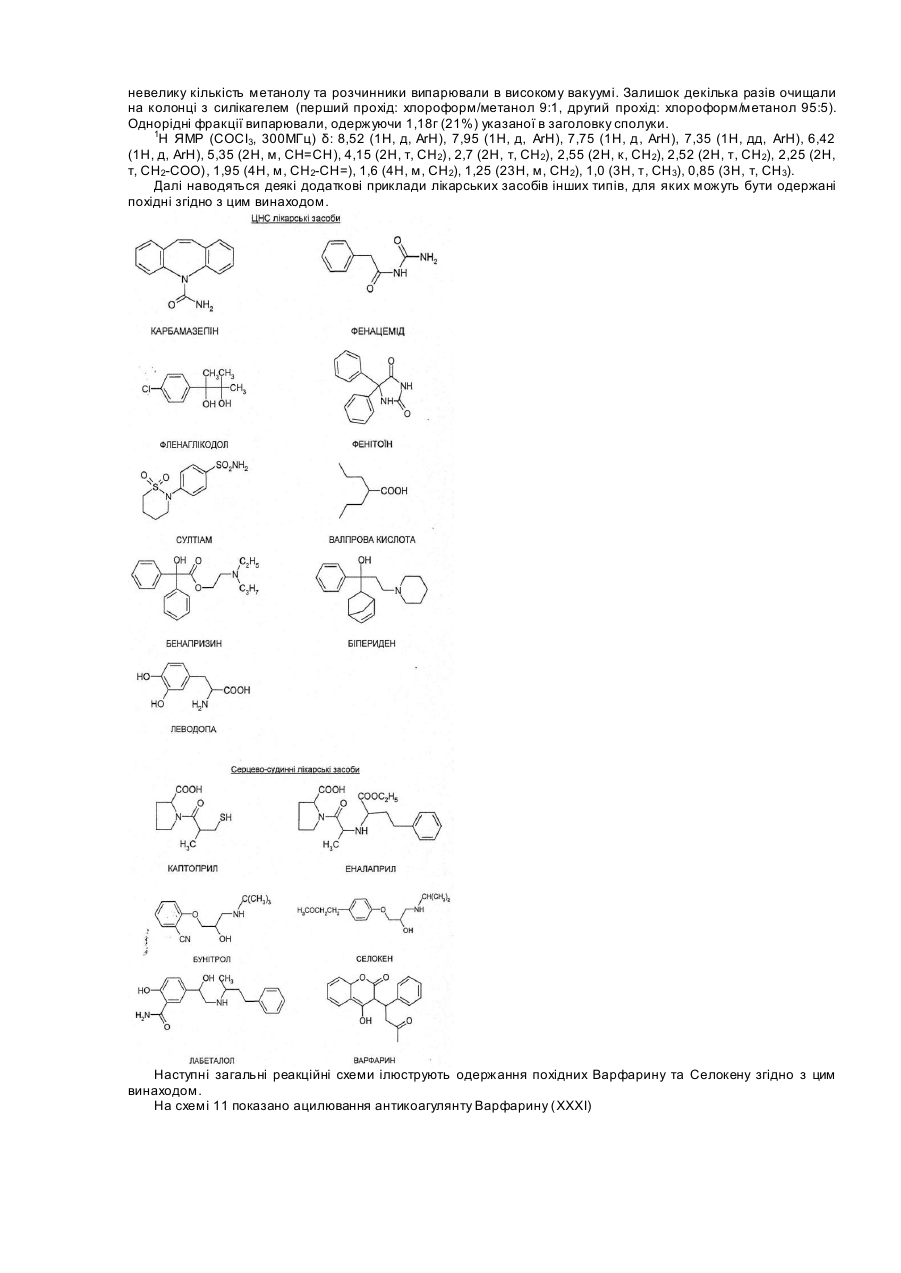
23. Ліпофільна похідна за п. 22, де указаний ЦНС лікарський засіб вибирають з карбамезепіну, фенацеміду, фенаглікодолю, фенітоїну, сульфтіаміну, вальпроєвої кислоти, бенапіразину, біперидену та леводопи.
24. Ліпофільна похідна за п. 2, де указана біологічно активна сполука являє собою серцево-судинний лікарський засіб.
25. Ліпофільна похідна за п. 24, де указаний серцево-судинний лікарський засіб вибирають з каптоприлу, еналаприлу, бунітролу, селокену, лабеталолу та селокену.
26. Ліпофільна похідна за п. 24, яка являє собою: 3-(-ацетонілбензил)-4-елаїдоїлоксикумарин.
27. Ліпофільна похідна за п. 1, де указана біологічно активна сполука являє собою агрохімікат.
28. Ліпофільна похідна за п. 27, де указаний агрохімікат являє собою пестицид, фунгіцид або гербіцид.
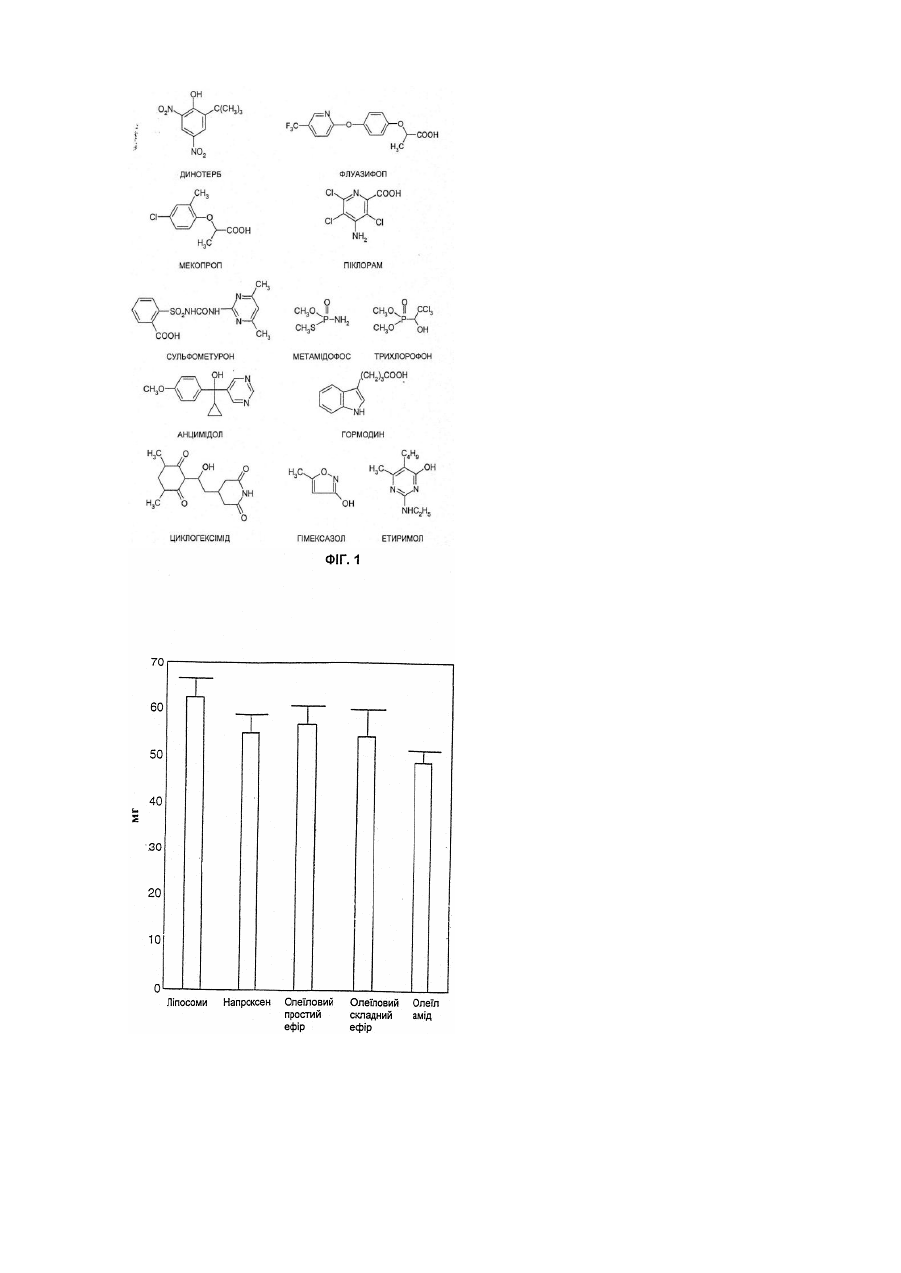
29. Ліпофільна похідна за п. 28, де указаний агрохімікат вибирають з амінотриазолу, азуламу, беназоліну, бромофеноксиму, бромоксинілу, 2,4-Д, ДИКАМБИ, дихлобутразолу, динотербу, флуазифопу, мекопропу, піклораму, сульфометурону, метамідофосу, трихлорофону, анцимідолу, гормодину, циклогексіміду, гімексазолу та етиримолу.
30. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 2-25 та фармацевтично прийнятний носій або ексципієнт.
31. Композиція, для застосування в сільському господарстві або садівництві, що містить сполуку за будь-яким з пп. 28-30, носій або їх розріджувач.
32. Спосіб модифікування активності біологічно активної сполуки, що містить в молекулярній структурі одну або декілька функціональних груп, вибраних з груп спирту, простого ефіру, фенілу, аміно, амідо, тіолу, карбонової кислоти та складного ефіру карбонової кислоти, іншої, ніж нуклеозид або аналог нуклеозиду, що включає заміну принаймні однієї указаної функціональної групи указаної біологічно активної сполуки на ліпофільну групу, вибрану з груп формули: RCOO-, RCONH-, RCOS-, RCH2O-, RCH2NH-, -COOCH2R, -CONHCH2R та –SCH2R, де R являє собою ліпофільний фрагмент, вибраний з цис-8-гептадеценілу, транс-8-гептадеценілу, цис-10-нонадеценілу та транс-10-нонадеценілу.
33. Спосіб одержання ліпофільної похідної за п. 1, який відрізняється тим, що указану біологічно активну сполуку вводять у взаємодію з цис- або транс-n-9-мононенасиченою жирною кислотою, жирним спиртом або жирним аміном, що мають довжину ланцюга від 18 до 20 вуглеводневих атомів, або з реакційноздатною похідною такої жирної кислоти, жирного спирту або жирного аміну.
Текст
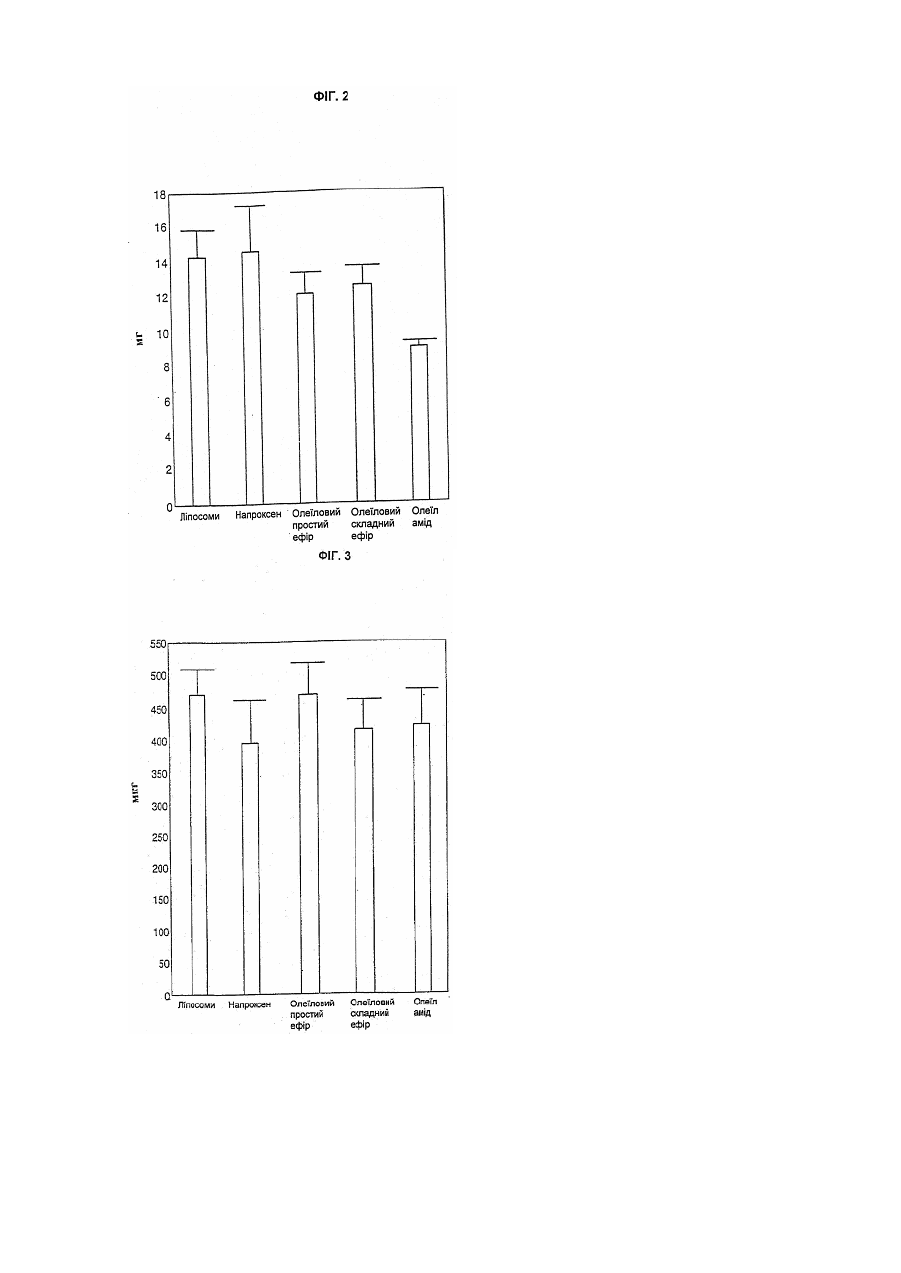
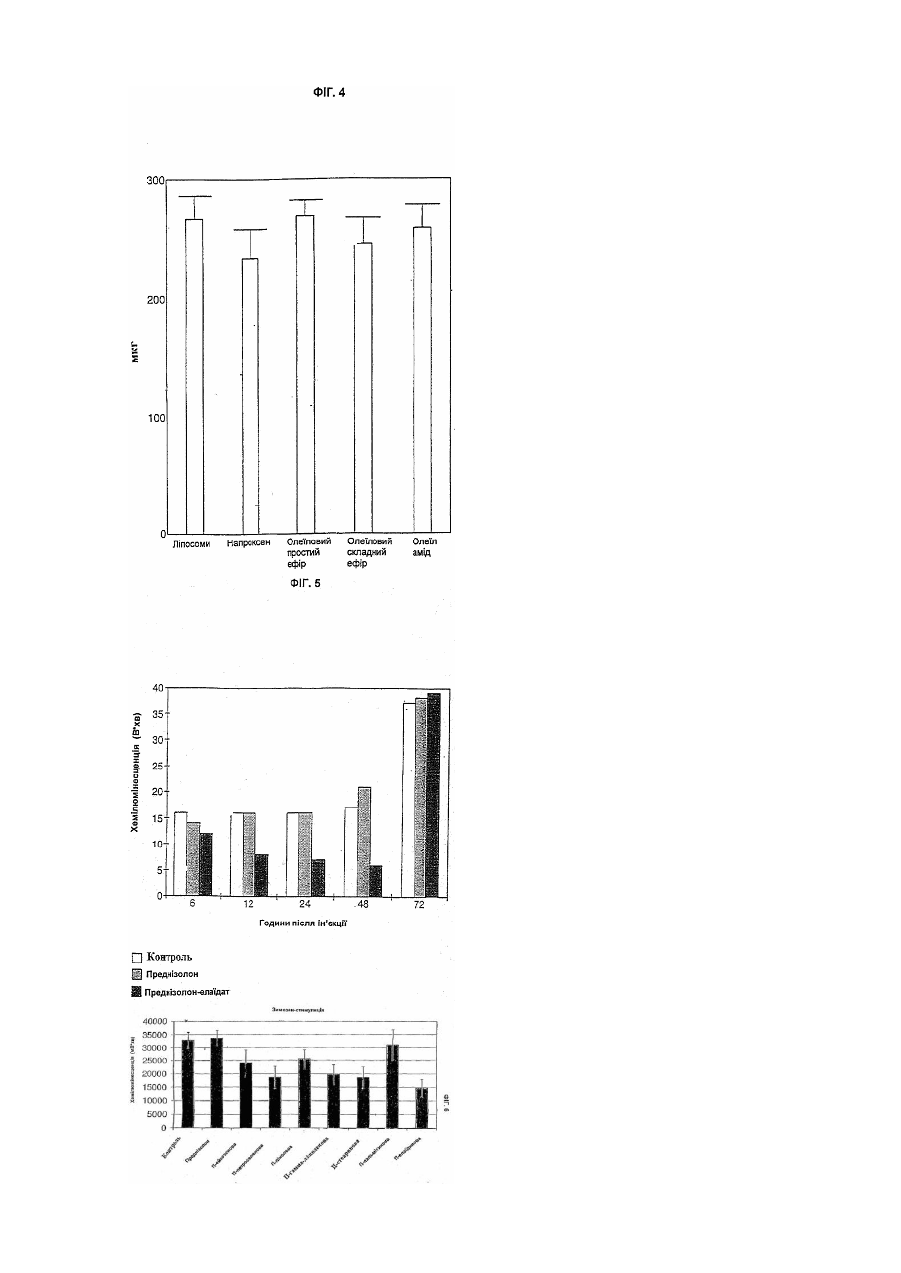
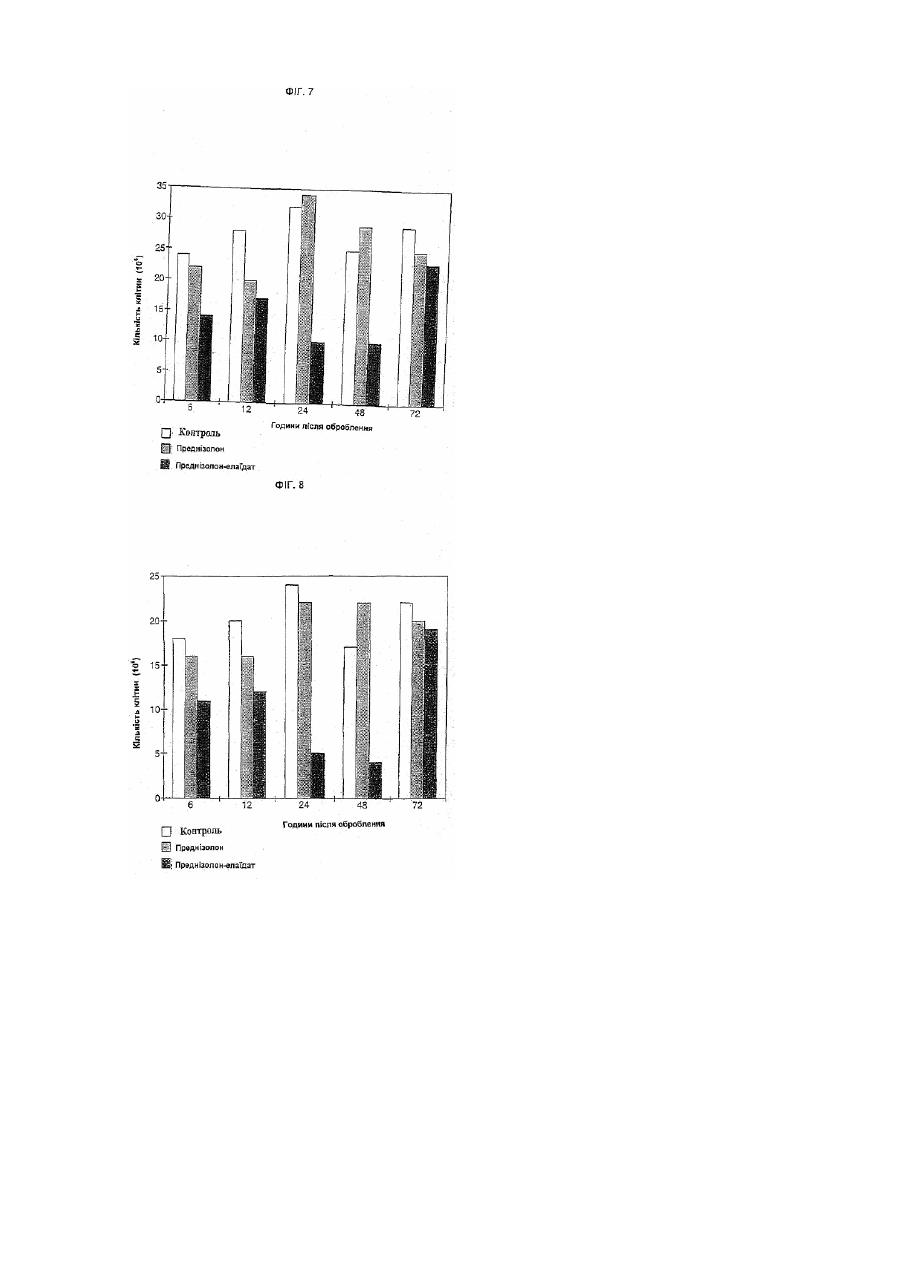
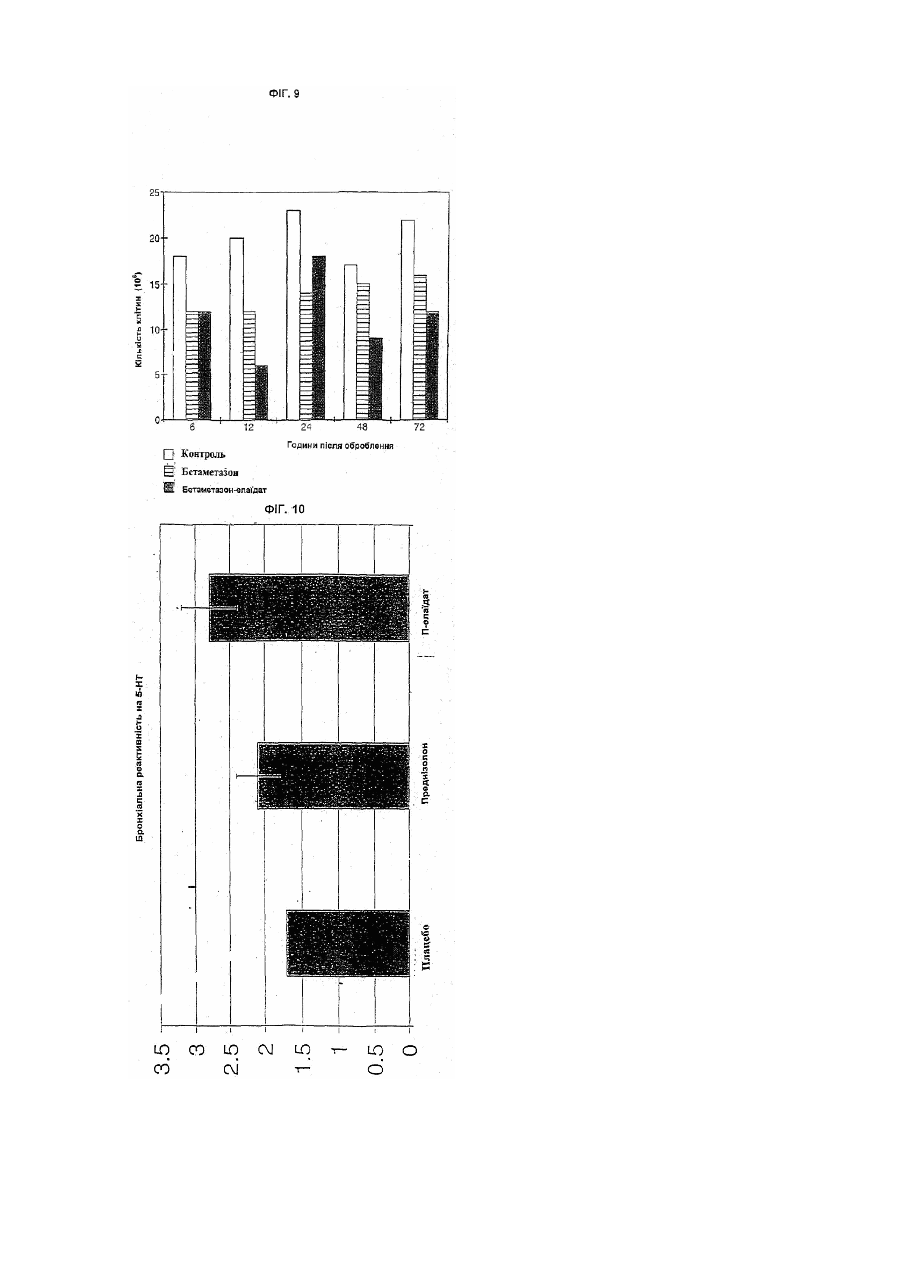
Цей винахід належить до біологічно активних сполук і він стосується розробки способів одержання їх хімічних похідних, способу, при якому властивості багатьох біологічно активних сполук, таких як лікарські засоби та агрохімікати, можуть бути модифіковані сприятливим чином. Медичне товариство проявляє великий інтерес до вивчення та вдосконалення ефективності транспорту лікарських засобів до місця їх дії у пацієнта. Робота в цьому напрямку була головним чином зосереджена на резорбції лікарського засобу з кишечнику в периферичний кровотік, хоч транспорт через інші біологічні бар'єри часто відіграє важливу роль в досягненні необхідного терапевтичного ефекту при лікуванні безлічі захворювань, таких як рак, інфекції, запалення, захворювання ЦНС (центральної нервової системи) і т.д. Транспорт через клітинну мембрану часто є головною перешкодою для досягнення оптимальної дії терапевтичної сполуки. На протязі останніх десятиліть стала дуже поширеною стійкість до дії лікарських засобів при лікуванні злоякісних та інфекційних захворювань, і тепер вона розглядається як серйозна клінічна проблема. Розвиток лікарської стійкості може бути пов'язаний з декількома механізмами, але дуже часто належить до запуску звичайних механізмів, при яких мікроорганізми та клітини усувають токсичні сполуки до субтоксичного рівня. Одним з прикладів є розвиток численної лікарської стійкості (ЧЛС) в ракових клітинах. В цьому випадку ЧЛС часто належить до клітинного мембранного протеїнового насоса, за допомогою якого клітини досягають дуже ефективного виведення токсичних сполук. В клінічній ситуації, тобто при лікуванні пухлини цитостатичними лікарськими засобами, клітини з найпотужнішим протеїновим насосом можуть вибірково залишатися життєздатними, а ці клітини можуть швидко розростатися в нову пухлину, яка може виявитися стійкою до лікування безліччю різних лікарських препаратів. Подібні механізми дії можуть виявитися відповідальними за недостатній позитивний ефект, що спостерігається в інших терапевтичних галузях, наприклад, для антималярійних лікарських засобів. Відомо декілька способів спроб обійти механізми резистентності в клінічній практиці. Наприклад, використовувалось спів введення блокатора Са 2+ каналів, такого як верапаміл, або імуномодулюючого агента типу циклоспорину. Однак дотепер не повідомлялося про істотні покращення. В літературі є декілька пропозицій підвищення терапевтичного індексу, біодоступності, проходження через мембрану, цілезазначення органу і т.п. лікарських сполук шляхом сполучення цих сполук з жирними кислотами, таким чином, що вони утворюють або хімічно зв'язані похідні, або фізичні суміші. Так, наприклад, в ЕР-А-393920 показано, що противірусні нуклеозиди та нуклеозидні аналоги, для яких одержані похідні з довголанцюговими (аж до С 16) ацильними групами, мають перевагу в порівнянні з вихідними сполуками. Вказується, що фрагмент жирної кислоти в цих молекулах переважно являє собою поліненасичену жирну кислоту, таку як g-ліноленова або ліноленова кислота. В US-A-3920630 показано, що 2,2'-ангідро-арацитидин та його 5'-О-ацилати мають таку ж загальну біологічну та терапевтичну активність як противірусні агенти, як і сам арацитидин. Особливо відзначається сполука 2,2'-ангідро-5'-О-олеїл-арацитидин. В ЕР-А-56265 розкрито складні ефіри арабіно-фуранозилтиміну (Ara T) з насиченими кислотами, які мають 1-17 С-атомів. З PCT/WO90/00555 відомі ліпідні похідні, зв'язані, особливо через фосфатну гр упу, з 5'-положенням пентозної групи нуклеозиду. Ме та одержання таких похідних полягала в наданні нуклеозидам більшої ліпофільності, щоб вони могли включатися в ліпосоми, які вибірково поглинаються мікрофагами та моноцитами, клітинами, які, як встановлено, дають притулок ВІЛ вірусу. Встановлено, що таким чином досягається ефект доставки в тканини-мішені. Противірусна та протиракова активність нуклеозидних аналогів безпосередньо пов'язана з внутрішньоклітинним фосфорилуванням лікарського засобу, що вводиться. Це біохімічне перетворення звичайно здійснюється за рахунок вірусних та/або клітинних ферментів. Для покращення дії в WO96/25421 розкриті фосфоліпідні похідні нуклеозидів з насиченими або ненасиченими жирними кислотами з відносно коротким ланцюгом (С14 або коротшим). В цій галузі також проводився пошук для покращення характеристик інших класів фармацевтичних речовин шляхом одержання їх похідних з жирними кислотами. Наприклад, в WO96/22303 вказано, що фармокінетичний профіль та принцип доставки декількох різноманітних категорій терапевтичних сполук (кортикостероїди, опіоїди та опіоїдні антагоністи, противірусні нуклеозиди, циклоспорини та споріднені циклопептиди, фоліатні антагоністи, попередники катехоламіну та катехоламіни, та алкілуючі агенти, що містять групу карбонової кислоти) може бути змінений шляхом кон'югування їх з однією-трьома ацильними похідними жирних кислот шляхом використання групи лінкер/спейсер, яка включає похідну трометаміну або етаноламіну. Переважною жирною кислотою є пальмітинова кислота. З праць H.Bundgaard et aL, (International Journal of Pharmaceutics, 43,101-110,1988) і V.R.Shanbhag et al., (Journal of Pharmaceutical Sciences, 149, Vol. 81, №2, лютий 1992) відомі ліпофільні пролікарські препарати декількох НПЗЗ (нестероїдні протизапальні лікарські засоби). На додаток до пролікарського аспекту повідомляється про зменшення подразнення шлунково-кишкового тракту. ЕР-А-0195570 пропонує, що введення гамма-ліноленової та дигомо-гамма-ліноленової кислоти в поєднанні з НПЗЗ зменшує побічну дію, що чинять НПЗЗ, які приймають тривалий час. В патенті США 5284876 пропонується застосування амідів доксозагексаєнової кислоти та допаміну як пероральних пролікарських засобів при лікуванні захворювань ЦНС. З PCT/US94/02880 та PCT/SE96/00122 відомі фізичні суміші, що містять жирні кислоти/похідні жирних кислот, які використовуються як так звані підсилювачі проникності як при шкірному, так і при пероральному введенні. Як показано, багато з цих попередніх пропозицій стосуються похідних жирних кислот противірусних нуклеозидів та нуклеозидних аналогів. Дійсно, недивно, що вони повинні бути саме такими, оскільки давно відомо, що деякі поліненасичені жирні кислоти атакують віруси. В ЕР-А-0642525 самі автори цього винаходу вказують, що антивірусна дія нуклеозидів та нуклеозидних аналогів може бути значно підсилена за рахунок взаємодії з олеїновою кислотою (цис-9-октадеценова кислота), елаїдиновою кислотою (транс-9-октадеценова кислота), цис-11-ейкозеновою кислотою або транс-11-ейкозеновою кислотою, яка призводить до утворення відповідних складних 5'-О-моноефірів. Авторами показано, що позитивний ефект, який може бути одержаний у випадку цих чотирьох конкретних мононенасичених ω-9 С18 або С20 жирних кислот перевершує аналогічний результат, який одержують звичайно за допомогою одержання похідних жирних кислот. Авторами несподівано встановлено у зв'язку з цим винаходом, що властивості численних різноманітних біологічно активних сполук можуть бути вигідним способом модифіковані шляхом одержання їх похідних з ω-9 С18 або С20 мононенасиченими жирними кислотами. Таким чином, цей винахід забезпечує спосіб підвищення ефективності, наприклад, багатьох лікарських засобів та агрохімікатів, який може широко використовуватися, але при цьому є простим. В цілому цей винахід в одному своєму аспекті забезпечує ліпофільну похідну біологічно активної сполуки, що містить в молекулярній структурі одну або декілька функціональних груп, вибраних з груп спирту, простого ефіру, фенілу, аміно, амідо, тіолу, карбонової кислоти та складного ефіру карбонової кислоти, іншого, ніж нуклеозид або нуклеозидний аналог, вказана ліпофільна похідна характеризується молекулярною структурою, в якій принаймні одна указана функціональна група указаної біологічно активної сполуки замінена на ліпофільну груп у, вибрану з груп формули: RCOO-, RCONH-, RCOS-, RCH2O-, RCH2NH-, -COOCH2R, CONHCH2R та -SCH2R, де R являє собою ліпофільний фрагмент, вибраний з цис-8-гептадеценілу, транс-8гептадеценілу, цис-10-нонадеценілу та транс-10-нонадеценілу. В одному з переважних варіантів цього винаходу біологічну дію терапевтичної сполуки покращують шляхом одержання похідних сполук з n-9 C18 або С20 мононенасиченою жирною кислотою. Далі наведено детальне обговорення застосування цього винаходу в галузі лікарських засобів, вибраних з наступних груп: 1. протиракові лікарські засоби; 2. протизапальні лікарські засоби: НПЗЗ адренокортикостероїди; 3. антибіотики та інші антибактеріальні агенти; 4. протипаразитарні лікарські засоби; 5. ЦНС лікарські засоби; 6. серцево-судинні лікарські засоби та 7. антикоагулянти. Однак цей винахід є широко застосовуваним до будь-якої сполуки, яка є фармакологічно активною та має в молекулі одну або декілька функціональних груп, здатних з'єднуватися з n-9 C18 або С20 мононенасиченою жирною кислотою. Таким чином, наприклад, цей винахід також може бути використаний для поліпшення біологічної дії лікарських сполук, таких, наприклад, як анальгетинки, фунгіциди, сполуки проти гіперліпідемії, протиблювотні лікарські засоби та ді ArHостичні лікарські засоби. Ліпофільні похідні терапевтично активних сполук згідно з цим винаходом можуть бути скомпоновані з фармацевтично прийнятними носіями та ексципієнтами звичайними способами, які широко відомі фахівцям. Дозування повинне корелювати з дозуваннями вихідного лікарського засобу, хоч у випадках, де ліпофільні похідні за винаходом значно підсилюють дію вихідного лікарського засобу, дозування, можливо, може бути знижене в порівнянні зі звичайним рівнем. Хоч позитивний ефект цього винаходу був продемонстрований на добре відомих лікарських засобах, передбачається, що аналогічні поліпшення, очевидно, будуть проявлятися і на інших лікарських засобах, які ще знаходяться в стані розробки. Інакше кажучи, постульоване пояснення поліпшених властивостей, що спостерігалися для ліпофільних похідних за винаходом, є загальним і не обмежене будь-яким специфічним механізмом терапевтичної активності. Авторами встановлено, що особливо цінною властивістю, яку проявляють деякі з ліпофільних похідних терапевтично активних сполук згідно з цим винаходом, є те, що вони переборюють стійкість до лікарських засобів. Не зв’язуючись з якою-небудь теорією, передбачається, що ліпофільні похідні за цим винаходом взаємодіють якимось чином з мембраною протеїнових насосів так, що клітини інгібуються від виведення активних (токсичних) сполук, таким чином даючи можливість зберігати концентрацію активних сполук на терапевтично вигідному рівні на протязі тривалого періоду. В будь-якому випадку, цей винахід також дає можливість для боротьби з явищем лікарської стійкості шляхом сумісного введення вихідного лікарського засобу та ліпофільної похідної цього лікарського засобу у відповідності з цим винаходом. Відповідним чином, вихідний лікарський засіб та його ліпофільна похідна можуть бути присутніми в одному і тому ж фармацевтичному препараті для полегшення введення, хоч в деяких випадках може виявитися переважним мати окремі дозувальні форми вихідного лікарського засобу та його ліпофільної похідної. Дозвання ліпофільної похідної відносно дозування вихідного лікарського засобу може бути визначене відповідними тестами, але звичайно воно коливається від 1:1 до 1000:1 за вагою. Як вказано раніше, винахід, взагалі, може бути застосований до будь-якої сполуки, яка має біологічну активність, і не лише до лікарських засобів. Іншим економічно значущим класом біологічно активних сполук є продукти, що застосовуються в сільському господарстві та садівництві, наприклад, пестициди, фунгіциди та гербіциди. Агрохімікати дуже відрізняються як за структурою, так і за типами їх дії. Наприклад, є декілька добре відомих шляхів поглинання; наприклад, рослини можуть поглинати активну сполуку або через кореневу систему, або безпосередньо листям або стеблами рослини, тоді як пестицид може поглинатися або через атаковану шкідником рослину, або шляхом безпосереднього контакту. Встановлено, що ліпофільні похідні агрохімікатів у відповідності з цим винаходом мають посилений потенціал поглинання як рослинами, так і комахами та іншими шкідниками. Більше тогоі Ці похідні допомагають переборювати стійкість до пестицидів, яка як і стійкість до лікарських засобів, являє собою все зростаючу проблему. Інші класи біологічно активних сполук, для яких вигідно можуть бути одержані похідні згідно з цим винаходом, включають харчові та поживні добавки, такі як консерванти, ароматизатори та пряно-смакові речовини. Ліпофільні похідні за цим винаходом можуть бути одержані взаємодією молекул вихідних лікарських засобів або інших біологічно активних сполук з цис- або транс-n-9 мононенасиченою жирною кислотою, жирним спиртом або жирним аміном, що мають довжину ланцюга від 18 до 20 атомів вуглецю, або з реакційноздатною похідною такої жирної кислоти, жирного спирту або жирного аміну, наприклад, хлорангідридами кислот, реакційноздатними складними ефірами, галогенідами або їм подібними. Позначення n-9 вказує, що ненасичений зв'язок розташований між 9 і 10 положеннями, рахуючи від кінцевого вуглецю ліпідного фрагмента. Таким чином, можуть використовуватися жирні кислоти (та спирти, та аміни, що є їх похідними), які являють собою цис-9-октадеценову кислоту (олеїнову кислоту), транс-9-октадеценову кислоту (елаїдинову кислоту), цис-11-ейкозенову кислоту та транс-11-ейкозенову кислоту. Реакції взаємодії між вихідною біологічно активною сполукою та жирною кислотою, жирним спиртом або жирним аміном можуть бути виконані різноманітними способами, відомимифахівцям в цій галузі. Коли в вихідній молекулі присутні дві або більше здатні до утворення похідних функціональні групи, то для досягнення потрібної селективності на стадіях взаємодії можуть використовуватися захисні групи або модифіковані методи синтезу. Звичайно, ступінь протікання реакції може контролюватися з використанням тонкошарової хроматографії (ТШХ) з придатними системами розчинників. Коли за даними ТШХ реакція завершується, то продукт звичайно екстрагують органічним розчинником та очищають хроматографією та/або перекристалізацією з придатною системою розчинників. Коли в вихідній речовині присутні більше однієї гідроксильної, аміно, тіолової групи або групи карбонової кислоти, то може бути одержана суміш алкілованих або ацилованих сполук. Індивідуальні сполуки, що є моно- або поліпохідними, потім можуть бути виділені, наприклад, хроматографією. Часто реакція взаємодії може бути виконана в одну стадію та, звичайно, ліпофільні похідні можуть бути виділені як кристали з гарним профілем стабільності, що корисно для успішного одержання за Галеном кінцевого фармацевтичного продукту. Способи одержання, які можуть використовуватися згідно з цим винаходом, проілюстровані наведеними нижче схемами реакцій, а також робочими прикладами, що є далі в цьому описі. Далі винахід буде додатково детально описаний у зв'язку з декількома різними типами лікарських засобів. Протизапальні лікарські засоби. Ряд важких захворювань, таких як ревматоїдний артрит, остеоартрит, синдром Бехтерева, системний червоний вовчак (SLE), астма, подагра і т.д. є результатом аномальної імунної відповіді, що викликає запальну реакцію. Запальний процес включає ряд випадків, які можуть бути викликані багатьма збудниками, наприклад, антиген-антитіло взаємодіями, інфекційними агентами, ішемією і т.д. На мікроскопічному рівні відповідь звичайно супроводжується клінічними ознаками еритематозу, набряком, підвищеною больовою чутливістю (гіпералгезія) та болем. Запальні захворювання лікують, головним чином, трьома типами лікарських засобів, а саме: НПЗЗ (нестероїдні протизапальні лікарські засоби) (також іноді називають аспіриноподібними лікарськими засобами), імунопригнічуючими лікарськими засобами (наприклад, метотрексат, циклофосфамід, а останнім часом також циклоспорин) та адренокортикостероїдами (гідрокортизон, преднізолон і т.п.). Лікування в основному подавляє біль та/або інтенсивність протікання на початку хвороби. Режим тривалості лікування часто обмежений побічною дією через високе дозування та/або тривалого періоду лікування. Оборотна непрохідність дихальних шляхів - астма, є найзвичайнішим з дихальних захворювань. Ступінь бронхіальної гіпервідповіді звичайно контролюється або понижується при регулярній інгаляції адренокортикостироїдами та/або бронходилаторами. Більшість режимів лікування забезпечують в середньому 2-3 години терапевтичного ефекту. Для більшості респіраторних аерозолів абсорбція (препарату) фактично еквівалентна абсорбції при парентеральному або пероральному введенні. Лікування є паліативним завдяки протизапальній та імунопригнічуючій дії. Для тривалого лікування слід застосовувати найменші дози, які будуть знижувати побічну дію. У випадку важких приступів астми внутрішньовенно вводять метилпреднізолон сукцинат натрію з наступним пероральним введенням аж до 10 днів. Гостре загострення астми часто лікують широким курсом кортикостероїдів, що вводяться перорально. Останнім часом в режимі лікування бронхіальної астми істотно зросло введення кортикостероїдів, що інгалюються. Беклометазон, дипропіонат, трамцинолон ацетонід або флунізолід можуть або скоротити тривалість курсу кортикостероїдів, що вводяться перорально, або повністю замінити його. При використанні лікарських засобів в дозах, які рекомендуються, спостерігається менше пригнічення функції надниркової залози. Застосування стероїдів при місцевому лікуванні хронічної астми може звичайно здійснюватися за допомогою інгаляторів. Це обмежує ризик появи серйозних побічних дій при систематичному застосуванні. Щоб гарантувати швидку та селективну дію при місцевому введенні, є істотним приєднання та взаємодія з рецепторами на ендотеліальних клітинах бронхів. Похідні жирних кислот за цим винаходом, які мають здатність закріплювати активний лікарський препарат на клітинах, можуть додатково поліпшити переваги, що забезпечуються місцевим застосуванням. Запалення дихальних шляхів розглядається як характерна відмітна особливість смертельних приступів астми, і аналогічні зміни були виявлені при бронхіальній біопсії навіть у випадку м'якших приступів астми. Сильні астматичні приступи пов'язані з напливом клітин зони запалення, в основному альвеолярних макрофагів, в ди хальні шляхи. Така ситуація абсолютно аналогічна гіперреакції дихальних шляхів, викликаній вірусами. Макрофаги можуть вивільняти реакційноздатні кисневі частинки, які збільшують легеневу опірність та викликають вивільнення гістаміну. Моделі, на яких вимірюють пригнічення клітин зони запалення в цілому та макрофагів зокрема, можуть використовуватися для оцінки ефективності можливих протиастматичних лікарських засобів. Для вимірювання вивільнення реакційноздатних кисневих частинок може використовуватися хемілюмінесценція. Як показано нижче, наплив клітин зони запалення в очеревину пацюків, в основному макрофагів, знижується під дією адренокортикостероїдних похідних за цим винаходом. Активність клітин зони запалення при стимуляції також знижується і таке пониження активності спостерігається на протязі тривалішого періоду після лікування у випадку цих похідних в порівнянні з вихідними лікарськими засобами. Похідні активні принаймні на протязі 48 годин після лікування. Така тривала активність може дати значну перевагу при лікуванні астми. Природні гормони часто так швидко руйнуються in vivo, що, коли не робити часті ін'єкції, то .досягається незначна терапевтична користь; шляхом сполучення таких молекул або синтетичних аналогів, що імітують природні сполуки, з жирними кислотами, описаними в цьому винаході, фармакокінетична поведінка може бути змінена для поліпшення терапевтичної користі. Це обґрунтовано і при системному, і при місцевому введеннях. Приклади адренокортикостероїдів та інших протиасматичних лікарських засобів, для яких можуть бути одержані похідні у відповідності з цим винаходом, включають: Більшість звичайно використовуваних при лікуванні запальних захворювань лікарських засобів являють собою НПЗЗ. Часто використовується безліч різноманітних продуктів цього класу, лідерами є диклофенак (вольтарен), піроксикам (фелден) та похідні саліцилової кислоти. НПЗЗ являють собою протизапальні, анальгетичні та жарознижувальні лікарські засоби, але їх головним клінічним використанням є лікування запальних захворювань. НПЗЗ в основному забезпечують симптоматичне послаблення болю та запалення, що пов'язані з цими захворюваннями, але вони не купірують розвиток патологічних пошкоджень тканин у важких випадках. Ні один з відомих на сьогодні продуктів типу НПЗЗ істотно не зменшує утворення гранулематозних тканин. Хоч зменшення вмісту гранулематозної рідини і спостерігається, але цей ефект не відбивається в одночасному зменшенні вмісту гранулематозної твердої речовини. Головний спосіб дії цих лікарських засобів полягає в інгібуванні біосинтезу простогландину (інгібування циклосигенази). Розподіл та фармакокінетичні властивості кожного агента важливо впливають на активність лікарського засобу. Також припускається, що це є причиною великої різноманітності реакцій індивідуальних пацієнтів на різні НПЗЗ лікарські засоби, навіть коли вони належать до одного і того ж хімічного типу. Наприклад, повідомляється про великі коливання в толерантності до різних похідних пропіонової кислоти. Головною властивістю НПЗЗ є їх здатність інгібувати циклоксигеназу та таким чином біосинтез PGG2 і PGH2, та всі похідні ейкозаноїди (PGI2, TXB 2, PGE 2 і т.д.). З іншого боку, не відомо про інгібування НПЗЗ ліпоксигенази (принаймні в такому ж ступені) і отже про їх вплив на синтез лейкотриєнів (LTB4 і LTC4). Простогландини PGI2 тa PGE2 відіграють важливу роль в запальному процесі. Вони викликають набряки та можливо збільшують проникність судин. PGI2 є головним фактором болю, що виникає при запальних захворюваннях. Лейкотриєни являють собою важливі медіатори на другій та третій фазах запальної атаки, і, оскільки НПЗЗ не інгібують ліпоксигеназу в достатньому терапевтичному ступені, вони не впливають на дегенеративну частин у запального захворювання. НПЗЗ чинять побічну дію, яка іноді може виявитися важкою. Найзвичайнішою виявленою побічною дією є укривання виразками шлункового або кишкового тракту і, як наслідок цього, біль, нудота, печія та іноді крововилив та анемія. Ці дії корелюються з інгібуванням біосинтезу простогландинів. Через відсутність PGI2Ta TXB 2 тромбоцити крові втрачають здатність до агрегації, що, в свою чергу, призводить до збільшення часукровотечі. В багатьох випадках ясно, що НПЗЗ не мають переважної дії при розвитку ревматоїдного захворювання, та є свідчення для припущення, що при певних обставинах вони навіть можуть прискорювати процес захворювання. Це проявляється в вигляді важкої втрати зв'язуючої речовини внаслідок підвищеного руйнування хрящів. Інші побічні дії, такі як затримка солі та води, гіперкаліємія та зниження ниркового току крові, також пов'язвні з інгібуванням синтезу простогландину та можуть призвести до неможливості лікування. У деяких пацієнтів гіперчутливість до аспірину, яка може призвести до анафілактичного шоку, виключає лікування аспіриноподібними лікарськими засобами. Вихідні НПЗЗ можуть являти собою будь-яку сполуку, яка може бути віднесена до класу нестероїдних протизапальних лікарських засобів і яка має одну або декілька здатних до утворення похідних груп, вибраними з груп спирту, простого ефіру, фенолу, аміну (первинного, вторинного або третинного), амідо, тіолу, карбонової кислоти та складного ефіру карбонової кислоти. Відомі на сьогодні НПЗЗ цього класу включають такі сполуки: Як показано вище, ряд відомих НПЗЗ містить більше однієї здатної до утворення похідних групи, визначених раніше типів. В ци х випадках одна або декілька таких функціональних гр уп можуть бути замінені на ліпофільну групу у відповідності з цим винаходом, і, коли є дві або більше ліпофільних групи, вони можуть бути однаковими або різними ліпофільними групами. Ліпофільні похідні протизапальних лікарських засобів за цим винаходом можуть бути одержані взаємодією вихідного лікарського засобу з цис- або транс-n-9 мононенасиченою жирною кислотою, жирним спиртом або жирним аміном, що мають довжину ланцюга від 18 до 20 атомів вуглецю, або з реакційноздатними похідними такої жирної кислоти, жирного спирту або жирного аміну, наприклад, хлорангідридами кислот, реакційноздатними складними ефірами, галогенами та мезилатами. Позначення n-9 вказує на те, що ненасичений зв'язок розташований між 9 і 10 положеннями, рахуючи від кінцевого вуглецю ліпідного фрагмента. Таким чином можуть використовуватися жирні кислоти (та спирти, та аміни, що є їх похідними), які являють собою цис-9-октадеценову кислоту (олеїнову кислоту), транс-9-октадеценову кислоту (елаїдинову кислоту), цис-11-ейктаенову кислоту та транс-11-ейкозенову кислоту. Реакції взаємодії між вихідним лікарським засобом та жирною кислотою, жирним спиртом або жирним аміном можуть бути виконані різноманітними способами, відомими фахівцям в цій галузі. Якщо в вихідному лікарському засобі є дві або більше здатних до утворення похідних функціональних групи, то для досягнення потрібної селективності на стадіях взаємодії можуть використовуватися захисні групи або модифіковані методи синтезу. Звичайно, ступінь протікання реакції може контролюватися з використанням тонкошарової хроматографії (ТШХ) з придатними системами розчинників. Коли за даними ТШХ реакція закінчується, продукт звичайно екстрагують органічним розчинником та очищають хроматографією та/або перекристалізацією з придатної системи розчинників. Якщо в вихідному НПЗЗ присутня більш ніж одна гідроксильна, аміно, тіолова групи або групи карбонової кислоти, то може бути одержана суміш алкілованих або ацилованих сполук. Індивідуальні сполуки, що є моно- або поліпохідними, потім можуть бути вилучені, наприклад, хроматографією. Способи одержання, які можуть використовуватися згідно з цим винаходом, проілюстровані наведеними нижче реакційними схемами, а також прикладами, які йдуть далі в описі. Перша реакційна схема ілюструє одержання похідних саліцилової кислоти. Оброблення саліцилату натрію мезилатом жирного спирту (R'-OMs) дає складний ефір саліцилової кислоти (І). Модифікація цієї реакції приводить до складного ефіру-2-простого ефіру саліцилової кислоти (II), в кому вуглеводневий залишок в складному ефірі та в простому ефірі є однаковими. Цей продукт переважніше одержують шляхом алкілування етилсаліцилату (IV) з одержанням 2-простого ефіру етилсаліцилату (V) з наступним гідролізом етилового складного ефіру, що приводить до утворення 2-простого ефіру саліцилової кислоти (III). Сполучення цих способів робить можливим одержання продуктів діаддуктів формули II, але з різними замісниками в складному ефірі та простому ефірі. Друга реакційна схема ілюструє одержання похідних (дериватизацію) напроксену. Складноефірну (VII) або амідну (VIII) по хідну напроксену одержують з напроксену (VI) та відповідного спирту або аміну (R'-OH або R'-NH2) з використанням реагентів для взаємодії, таких як Ν,Ν'дициклогексилкарбодіімід (DCC) або тетрафторборат О-(1Н-бензотриазол-1-іл)-N,N,N',N'-тетраметилуроніуму (TBTU). Аналоги простого ефіру з довгим ланцюгом (XII) одержують з напроксену з використанням початкового деметилювання ароматичного 6-метилового простого ефіру, одержуючи продукт (IX) з наступною етерифікацією бокового ланцюга пропіонової кислоти (X). Алкілування фенольного фрагмента (XI) та гідроліз етилового складного ефіру дають продукт (XII). Сполучення цих способів дає можливість одержувати діаддукти, в яких вуглеводневі залишки в простому ефірі та складному ефірі або аміді є або однаковими, або різними. Третя реакційна схема ілюструє одержання похідних піроксаму. Піроксамовий складний ефір (XIV) одержують з піроксаму (XIII) та відповідного хлорангідриду жирної кислоти (R'COCI). Можливе ацилювання амідного азоту піроксаму та виділено невелику кількість Nацилованого, а також діацилованого продуктів. Ідентичність основного продукту (XIV) підтверджена з використанням прогресивного методу ЯМР. Четверта реакційна схема ілюструє одержання похідних диклофенаку. Складний ефір (XVI) або амід (XVII) диклофенаку одержують з диклофенаку (XV) та відповідного спирту або аміну (R-OH або R-NH2) з використанням реагентів сполучення, таких як DCC або TBTU. Ізомерний амід (XVIII) може бути одержаний з відповідної жирної кислоти R'-COOH та XV з використанням TBTU як реагенту сполучення. П'ята реакційна схема ілюструє одержання похідних бетаметазону (XIX) та преднізолону (XX). Багато стероїдів одночасно мають первинні, вторинні та третинні спиртові функції, які можуть бути всі перетворені в складні ефіри. Селективність, однак, достатньо висока і первинний спирт може бути проетерифікований за допомогою DCC як реагенту сполучення або шляхом безпосереднього використання хлорангідриду жирної кислоти. Тіопохідні за цим винаходом можуть бути одержані з використанням способів, аналогічних указаним вище на реакційних схемах. Одержання конкретних ліпофільних похідних протизапальних лікарських засобів згідно з винаходом проілюстровано наступними прикладами, а в прикладах 6 та 7 проілюстровано одержання проміжних сполук. Приклад 1 (Цис-9'-октадеценіловий) складний ефір 2-гідроксибензойної кислоти До суспензії гідриду натрію (60%) (0,21г, 5,25x10-3моль) в 40мл безводного N.N-диметилформаміду додавали 2-гідроксибензойну кислоту (саліцилову кислоту) (0,726г, 5,25x10-3моль) та суміш перемішували при 80°С в атмосфері N2 на протязі 1 години. Додавали цис-9-октадеценолмезилат (1,82г, 5,25x10-3моль) та перемішування продовжували на протязі 22 годин. Охолоджену реакційну суміш концентрували та залишок розчиняли в 100 мл хлороформу. Органічну фазу промивали водою, розбавленим бікарбонатом натрію та сольовим розчином. Висушену фазу випарювали досуха та сирий продукт очищали на колонці з силікагелем з використанням як елююючої системи 5% простого ефіру в гексані. Однорідні фракції випарювали, одержуючи 1,3г (64%) указаної в заголовку сполуки. 1 Н ЯМР (CDCI3. 300МГц) δ: 10,85 (1Н, с, ОН), 7,85 (1Н, д, АrН), 7,45 (1Н, т, АrН), 6,95 (1Н, д, АrН), 6,85 (1Н, т, АrН), 5,35 (2Н, м, СН=СН ), 4,32 (2Н, т, СН2-ОСО), 1,95 (4Н, м, СН2-С=), 1,75 (2Н, м, СН2-С-О), 1,25 (22Н, м, СН2), 0,85 (3Н, т, СН3). Приклад 2 2-(Цис-9'-октадеценокси)-етилбензоат До суспензії гідриду натрію (60%) (0,206г, 5,15x10-3моль) в 40мл Ν,Ν-диметилформаміду додавали 2гідроксиетилбензоат (0,86г, 5,15x10-3моль) та суміш перемішували при 80°С в атмосфері Ν 2 на протязі 1 години. Додавали цис-9-октадеценолмезилат (1,78г, 5,15x10-3моль) та перемішування продовжували на протязі 40 годин. Охолоджену реакційну суміш випарювали в високому вакуумі та обробляли залишок хлороформом і водою. Висушену органічну фазу концентрували та сирий продукт очищали на колонці з силікагелем, елююючи 5%-ним простим ефіром в гексані. Збирали однорідні фракції, одержуючи 1,11г (52%) указаної в заголовку сполуки. 1 НЯМР(СОСІ3 , 300МГц) δ: 7,75(1Η, д, АrН), 7,42 (1Η, τ, АrН), 6,95 (2Н, м, АrН), 5,35 (2Н, м, СН=СН), 4,35 (2Н, к, СН2-ОСО), 4,0 (2Н, т, СН2-ОАr), 1,95 (4Н, м, СН2-С=), 1,8 (2Н, м, СН2-С-ОАr), 1,48 (2Н, м, -СН2-), 1,35 (3Н, т, СН3-С-ОСО), 1,25 (20Н, м, СН2), 0,85 (3Н, т, СН3). 13 С ЯМР (CDCI3, 75МГц) δ: 165,5 (COO), 158,43 (Аr С-2), 132,98 (Аr С-4), 131,38 (Аr C-6), 129,83 та 129,69 (C=C), 120,81 (Аr С-1), 119,83 (Аr С-5), 112,97 (Аr С-3), 68,75 (СН2-ОАr), 60,58 (CH2-OCO), 31,82, 29,68, 29,40, 29,23, 29,16, 27,12, 25,92, 22,59 (СН2), 14,22 (СН3-С-ОСО), 14,00 (СН3). Приклад 3 2-(Цис-9'-октадеценокси)-бензойна кислота До суспензії 2-(цис-9'-октадеценокси)-етилбензоату (1,11г, 2,66 х10-3моль) в 25мл етанолу та 50мл води додавали гідроксид літію (2,0г) і реакційну суміш перемішували при 90°С на протязі 6 годин. Етанол відганяли та додавали 100мл хлороформу. Обережно додаючи 5н НСІ, доводили рН до 7 та органічну фаз у промивали водою. Після вилучення розчинника продукт очищали на колонці з силікагелем з використанням як елююючої системи 2%-ного метанолу в хлороформі. Одержували 1,0г (96%) указаної в заголовку сполуки. 1 Н ЯМР (CDCI3, 300МГц) δ: 8,15 (1Н, д, АrН), 7,53 (1Н, т, АrН), 7,10 (1Н, т, АrН), 7,03 (1Н, д, АrН), 5,35 (2Н, м, СН=СН), 4,25 (2Н, т, СН2-ОАr), 1,95 (4Н, м, СН2-С=), 1,92 (2Н, м, СН2-С-ОАr), 1,55-1,15 (22Н, м, -СН2-), 0,85 (3Н, т, СН3). 13 С ЯМР (CDCI3, 75МГц) δ: 165,44 (COO), 157,48 (Аr С-2), 134,81 (Аr С-4), 133,42 (Аr C-6), 129,80 та 129,51 (C=C), 121,79 (Аr С-5), 117,50 (Аr С-1), 112,47 (Аr С-3), 70,05 (CH2-OAr), 31,73, 29,59, 29,52, 29,36, 29,15, 29,02, 28,98, 28,75, 27,04, 26,99, 25,58, 22,50 (CH2), 13,93 (СН3). Приклад 4 (Цис-9'-октадеценіл)амід 1-(п-хлорбензоїл)-5-метокси-2-метиліндол-3-оцтової кислоти До розчину 1-(п-хлорбензо"іл)-5-метокси-2-метиліндол-3-оцтової кислоти (індометоцин) (0,56г, 1,56x103 моль) та TBTU (0,51г, 1,56x10-3моль) в 6мл безводного Ν,Ν-диметилформаміду додавали Ν,Νдіізопропілетиламін (0,53мл, 3,12x10-3моль) та реакційну суміш перемішували в атмосфері N2 при кімнатній температурі на протязі 30 хвилин. Додавали розчин цис-9-октадеценіламіну (0,42г, 1,56x10-3моль) в 6мл безводного Ν,Ν-диметилформаміду та перемішування продовжували на протязі 3 годин. Розчинник випарювали в високому вакуумі та залишок розподіляли між хлороформом і водою. Висушену органічну фазу концентрували та продукт очищали на колонці з силікагелем з використанням як елююючої системи 2% метанолу в хлороформі. Однорідні фракції випарювали, одержуючи 1,05г указаної в заголовку сполуки, яка містить деяку кількість ДМФ. Продукт розчиняли в простому ефірі. Промивали водою, органічну фазу сушили та випарювали, одержуючи 0,88г (92%) указаної в заголовку сполуки. 1 Н ЯМР (CDCI3, 300МГц) δ: 7,68 (2Н, д, АrН), 7,48 (2Н, д, АrН), 6,85 (2Н, м, АrН), 6,70 (1Н, дд, АrН), 5,60 (1Н, ушир.т., NHCO), 5,35 (2Н, м, СН=СН), 3,85 (3Н, с, СН3О-Аr), 3,65 (2Н, с, Аr-СН2-СО), 3,18 (2Н, к, CH2-NH-), 2,40 (3Н, с, СН3-Аr), 1,95 (4Н, м, СН2-С=), 1,1-1,4 (24Н, м, СН2), 0,85 (3Н, т, СН3). Приклад 5 (Цис-9'-октадеценіл)амід 8(+)-2-(6-метокси-2-нафтил)пропіонової кислоти (напроксен олеїламід) До розчину напроксену (1,65г, 7,15x10-3моль) та TBTU (2,30г, 7,15 x10-3моль) в 20мл безводного Ν,Νдиметилформаміду додавали Ν,Ν-діізопропілетиламін (2,45мл, 14,3x10-3моль) та реакційну суміш перемішували під N2 при кімнатній температурі на протязі 30 хвилин. Додавали розчин 1-аміно-цис-9октадецену (1,91г, 7,15х10-3моль) в 25мл безводного Ν,Ν-диметилформаміду та перемішування продовжували на протязі 3 годин. Розчинник випарювали в високому вакуумі та залишок розподіляли між хлороформом і водою. Висушену органічну фазу концентрували та продукт очищали на колонці з силікагелем, використовуючи як елююючу систему 3%-ний метанол у хлороформі. Однорідні фракції випарювали, одержуючи 2,77г (81%) указаної в заголовку сполуки. 1 Н ЯМР (СОСІ3, 300МГц) δ: 7,68 (3Н, м, АrН), 7,35 (1Н, д, АrН), 7,12 (2Н. м, ArH), 5,35 (ЗН, м, СН=СН та NHCO), 3,92 (3Н, с, СН3-ОАr), 3,65 (1Н, к, СН), 3,15 (2Н, дт, СН2-NHCO), 1,95 (4Н, м, СН2-С=), 1,6 (3Н, д, СН3), 1,25 (24Н, м, СН2), 0,85 (3Н, т, СН3). 13 С ЯМР (CDCI3, 75МГц) δ: 174,09 (CONH), 157,58 (Аr С-6), 136,59 (Аr С-10), 133,59 (Аr C-9), 129,82 та 129,67 (C=C), 129,02 (Аr С-8), 128,85 (Аr С-2), 127,35 (Аr C-1), 126,22 (Аr C-3), 125,96 (Ar C-4), 119,00 (Аr C-7), 105,47 (Ar C-5), 55,16 (CH3-OAr), 46,92 (СН), 39,55 (CH2-NH), 31,80, 29,66, 29,62, 29,40, 29,29, 29,22, 29,08, 27,10, 26,67, 22,58 (CH2), 18,43 (СН3-СН), 14,03 (СН3-СН2). Приклад 6 S(+)-2-(6-гідрокси-2-нафтил)пропіонова кислота До добре перемішуваної суспензії гідриду натрію (60%) (12,9г, 0,336моль) в 150мл безводного Ν,Νдиметилформаміду додавали краплями розчин етантіолу (24,3мл, 0,328моль) в 300мл Ν,Νдиметилформаміду. Повільно додавали розчин напроксену (15г, 0,065моль) в 150мл Ν,Ν-диметилформаміду та реакційну суміш нагрівали при 150°С на протязі 3 годин. Прозорий розчин охолоджували та регулювали рН (2-3) за допомогою 3,5н НСІ. Розчинники випарювали в високому вакуумі та залишок обробляли сумішшю 150мл діетилового ефіру та 90мл води. Твердий залишок відфільтровували та фільтрат концентрували. Залишок обробляли сумішшю 90мл хлороформу та 90мл води і витримували в холодильнику на протязі 24 годин. Білий осад відфільтровували, промивали та сушили, одержуючи 10,1г (72%) указаної в заголовку сполуки. 1 Н ЯМР (ДMCO-d6 , 300МГц) δ: 12,25 (1Н, с, СООН), 9,65 (1Н, с, Аr-ОН), 7,75 (1Н, д, АrН), 7,65 (2Н, м, АrН), 7,31 (1Н, д, АrН), 7,05 (2Н, м, АrН), 3,75 (1Н, к, СН), 1,45 (3Н, д, СНз). Приклад 7 Етиловий складний ефір S(+)-2-(6-гідрокси-2-нафтил)пропіонової кислоти До розчину S(+)-2-(6-гідрокси-2-нафтил)пропіонової кислоти (5,0г, 23x10-3моль) в 1200мл безводного етанолу додавали п-толуолсульфонову кислоту (0,2г) та реакційну суміш нагрівали до кипіння зі зворотним холодильником на протязі 24 годин. Охолоджену суміш перемішували з порціями твердого NaHCO3. Розчин фільтрували та розчинник випарювали. Залишок розчиняли в хлороформі та промивали водою. Органічну фазу концентрували та сирий продукт елюювали через колонку з силікагелем 2%-ним метанолом у хлороформі. Однорідні фракції давали 4,8г (80%) указаної в заголовку сполуки. 1 НЯМР (СОСІ3, 300МГц) δ: 7,65 (3Н, м, АrН), 7,35 (1Н, дд, АrН), 7,05 (2Н, м, АrН), 5,25 (1Н, ушир.с, Аr-ОН), 4,15 (2Н, к, СН2-ОСО), 3,82 (1Н, к, СН), 1,58 (3Н, д, СН3), 1,23 (3Н, т, СН3-С-О). Приклад 8 Етиловий складний ефір S(+)-2-(6-[цис-9'-октадеценокси]-2-нафтил)-пропіонової кислоти До суспензії гідриду натрію (60%) (0,47г, 11,8х10-3моль) в 350мл безводного Ν,Ν-диметилформаміду додавали етиловий ефір S(+)-2-(6-гідрокси-2-нафтил)-пропіонової кислоти та реакційну суміш перемішували в Ν2 при кімнатній температурі на протязі 2 годин. Додавали розчин цис-9-октадеценолмезилату (3,91г, 10,7x103 моль) в 5мл Ν,Ν-диметилформаміду та перемішування продовжували на протязі 48 годин. Розчинник випарювали в високому вакуумі та залишок обробляли хлороформом та водою. Висушену органічну фазу концентрували та сирий продукт очищали на колонці з силікагелем, елююючи хлороформом. Однорідні фракції дали 2,93г (56%) указаної в заголовку сполуки. 1 Н ЯМР (CDCI3, 300МГц) δ: 7,65 (3Н, м, АrН), 7,40 (1Н, д, АrН), 7,10 (2Н, м, АrН), 5,35 (2Н, м, СН=СН), 4,12 (2Н, к, СН2-ОСО), 4,05 (2Н, т, СН2-ОАr), 3,82 (1Н, к, СН),1,95 (4Н, м, СН2-С=), 1,85 (м, СН2С-ОАr), 1,55 (3Н, д, СН3-СН), 1,45-1,20 (22Н, м, СН2), 1,20 (3Н, т, СН3-С-О), 0,85 (3Н, т, СН3-СН2). 13 С ЯМР (CDCI3, 75МГц) δ: 174,67 (COO), 157,08 (Аr С-6), 135,65 (Аr С-10), 133,67 (Ar C-9), 129,94 та 129,79 (C=C), 129,14 (Аr С-8), 128,80 (Аr С-2), 127,01 (Аr С-1), 126,11 (Аr С-3), 125,84 (Аr С-4), 119,23 (Аr С-7), 106,32 (Аr С-5), 67,98 (CH2-OAr), 60,70 (CH 2-OCO), 45,45 (CH), 31,89, 29,74, 29,50, 29,46, 29,38, 29,31, 29,22, 27,18, 26,08, 22,67 (CH2), 18,59 (CH 3-CH), 14,10 (СН3-СН2та СН3-С-О). Приклад 9 S(+)-2-(6-[цис-9'-октадеценокси]-2-нафтил)- пропіонова кислота (олеїловий простий ефір напроксену) Розчин етилового складного ефіру S(+)-2-(6-[цис-9'-октадеценокси]-2-нафтил)-пропіонової кислоти (3,79г, 7,67x10-3моль) в 115мл тетрагідрофурану та 25мл 1М NaOH перемішували при кімнатній температурі на протязі 10 днів. Додавали 17мл 1М НСІ та розчинники випарювали. Залишок поглинали хлороформом та водою і рН доводили до 1 1М НСІ. Органічну фазу промивали водою, сушили (MgSO4) та концентрували, одержуючи 3,25г (94%) указаної в заголовку сполуки. 1 Н ЯМР (CDCI3, 300МГц) δ: 7,61 (3Н, м, АrН), 7,35 (1Н, д, АrН), 7,10 (2Н, м, АrН), 5,35 (2Н, м, СН=СН), 4,03 (2Н, т, СН2-ОАr), 3,80 (1Н, к, СН), 1,95 (4Н, м, СН2-С=), 1,82 (м, СН2-С-ОАr), 1,52 (3Н, д, СН3-СН), 1,55-1,20 (22Н, м, СН2), 0,85 (3Н, т, СН3-СН2). 13 С ЯМР (CDCI3, 75МГц) δ: 180,96 (СООН), 157,07 (Аr С-6), 135,19 (Аr С-10), 133,72 (Аr С-9), 129,95 та 129,80 (С=С), 129,17 (Аr С-8), 128,76 (Аr С-2), 127,01 (Аr С-1), 126,17 (Аr С-3), 126,02 (Аr С-4), 119,18 (Аr С-7), 106,30 (Аr С-5), 67,98 (СН2-ОАr), 45,57 (СН), 31,90, 29,76, 29,49, 29,43, 29,32, 29,25, 27,20, 26,11, 22,68 (СН2), 18,18 (СН3-СН), 14,11 (СН3-СН2). Приклад 10 4-0-(транс-9'-октадеценоїл)-2-метил-N(2-піридил)-2Н-1,2-бензотіазин-3-карбоксамід-1,1-діоксид До розчину 4-гідрокси-2-метил-N-(2-піридил)-2Н-1,2-бензотіазин-3-карбокс-амід-1,1-діоксиду (піроксикам) (2,5г, 7,54x10-3моль) в 25мл безводного Ν,Ν-диметилформаміду додавали 2мл розчину транс-9октадеценоїлхлориду (2,2г, 7,53x10-3моль) в 20мл дихлорметану та реакційну суміш перемішували в Ν 2 при кімнатній температурі. Розчин хлорангідриду кислоти, що залишився, додавали порціями по 2мл з 2годинними інтервалами. Після закінчення загального часу реакції, що складав 80 годин, розчинники випарювали в високому вакуумі. Залишок розчиняли в 200 мл простого ефіру та промивали водою і невеликою кількістю NaHCO3 (водн.). Висушен у (MgSO 4) органічну фазу концентрували та сирий продукт очищали на колонці з силікагелем, елююючи етилацетатом/гексаном (40:60). Збирали однорідні фракції та випарювали їх, одержуючи 3,06г твердої речовини, яку нагрівали при кипінні зі зворотним холодильником в пентані/простому ефірі та охолоджену суміш витримували при 4°С на протязі ночі. Тверду речовину відфільтровували, промивали пентаном та сушили, одержуючи 3,5г (78%) указаної в заголовку сполуки. 1 Н ЯМР (ДМСО-d6, 300МГц) δ: 10,9 (1Н, с, ΝΗ), 8,38 (1Н, д, АrН), 8,08 (1Н, д, АrН), 7,7-8,0 (5Н, м, АrН), 7,20 (1Н, ушир.т, АrН), 5,35 (2Н, м, СН-СН), 3,1 (3Н, с, N-CH 3), 2,61 (2Н, т, СН2-СОО), 1,95 (4Н, м, СН2-С=), 1,45 (2Н, м, СН2-С-СОО), 0,95-1,4 (20Н, м, СН2), 0,85 (3Н, т, СН3). 13 С Я МР (ДМСО-d 6, 75 МГц) δ: 170,86 (COO), 158,44 (CONH), 150,93 (C-2, пір.), 148,10 (C-6, пір.), 138,33 (C4, пір.), 135,30 (C-4), 132,84 (C-9), 131,67 (C-6), 130,84 (C-7), 130,03 та 130,01 (C=C), 128,72 (C-3), 128,49 (C10), 124,45 (C-8), 122,21 (C-5), 120,51 (C-5, пір.), 114,35 (C-3, nip.), 34,65 (N-CH3), 33,28, 31,97, 31,28, 29,02, 28,93 28,84, 28,71, 28,51, 28,40, 28,25, 24,17, 22,10 (CH2), 13,91 (CH 3). Приклад 11 Цис-9'-октадеценіловий складний ефір [2-(2,6-дихлорфеніл)аміно]бензолоцтової кислоти До розчину натрієвої солі [2-(2,6-дихлорфеніл)аміно]бензолоцтової кислоти (диклофенак) (0,48г, 1,6x10-3 моль) в 15мл дихлорметану та 3мл Ν,Ν-диметилформаміду додавали оцтову кислоту (0,09мл, 1,6x10-3моль), цис-9-октадецен-1-ол (0,42г, 1,6x10-3моль), 4-диметиламінопіридин (ДМАП) (50мг) та DCC (0,34г, 1,7x10-3моль) та реакційну суміш перемішували при 0°С на протязі 6 годин та при кімнатній температурі на протязі 48 годин. Білий осад відфільтровували та промивали дихлорметаном. Органічну фазу промивали водою, сушили (MgSO4), концентрували та очищали на колонці з силікагелем, елююючи етилацетатом/гексаном (40:60). Однорідні фракції давали 0,45г (53%) указаної в заголовку сполуки у ви гляді безбарвної рідини. 1 Н ЯМР (CDCI3, 300МГц) δ: 7,35 (2Н, м, АrН), 7,25 (1Н, АrН), 7,15 (1Н, м, АrН), 6,95 (2Н, м, АrН), 6,58 (1Н, м, АrН), 5,35 (2Н, м, СН=СН), 4,15 (2Н, т, СН2-О), 3,82 (1Н, с, Аr-СН2-СОО), 2,0 (4Н, м, СН2-С=), 1,65 (2Н, м, СН2С-О), 1,25 (22Н, м, СН2), 0,95 (3Н, т, СН3) Приклад 12 4-0-(цис-11'-ейкозено'іл)-2-метил-N(2-піридил)-2Н-1,2-бензотіазин-3-карбоксамід-1,1-діоксид До розчину 4-гщрокси-2-метил-N(2-піридил)-2Н-1,2-бензотіазин-3-карбоксамід-1,1-діоксиду (піроксикам) (0,3г, 0,990x10-3моль) в 3мл безводного Ν,Ν-диметилформаміду додавали 1,5мл розчину цис-11ейкозеноїлхлориду (0,29г, 0,90x10-3моль) в 2,5мл дихлорметану та реакційну суміш перемішували в Ν 2 при кімнатній температурі. Розчин хлорангідриду кислоти, що залишився, додавали через 2 години. Після закінчення загального часу реакції, що складав 80 годин, розчинники випарювали в високому вакуумі. Залишок розчиняли в 40мл діетилового ефіру та промивали водою і невеликою кількістю NaHCO3 (водн.). Висушен у (MgSO4) органічну фазу концентрували та сирий продукт очищали на колонці з силікагелем, елююючи етилацетатом/гексаном (40:60). Однорідні фракції збирали та випарювали, одержуючи 0,42г (75%) указаної в заголовку сполуки. 1 Н ЯМР (ДMCO-d6. 300МГц) δ: 10,9 (1Н, с, ΝΗ), 8,38 (1Н, д, АrН), 8,08 (1Н, д, АrН), 7,7-8,0 (5Н, м, АrН), 7,20 (1Н, ушир.т, АrН), 5,35 (2Н, м, СН=СН), 3,1 (3Н, с, N-CH 3), 2,61 (2Н, т, СН2-СОО), 1,95 (4Н, м, СН2-С=), 1,45 (2Н, м, СН2-С-СОО), 0,95-1,4 (24Н, м, СН2), 0,85 (3Н, т, СН3). 13 С Я МР (ДМСО-d 6, 75 МГц) δ: 170,84 (COO), 158,43 (CONH), 150,92 (C-2, пір.), 148,19 (C-6, пір.), 138,31 (C4, пір.), 135,30 (C-4), 131,65 (C-6), 130,82 (C-7), 129,58 (C=C),128,69 (C-3), 128,46 (C-10), 124,43 (C-8), 122,19 (C-5), 120,47 (C-5, пір.), 114,35 (C-3, пір.), 34,65 (N-СН3), 33,29, 31,28, 29,11, 28,84, 28,70, 28,60, 28,27, 26,58, 24,17, 22,09 (CH2), 13,89 (СН3). Приклад 13 Цис-9'-октадеценіловий складний ефір S(+)-2-(6-метокси-2-нафтил)-пропіонової кислоти До розчину S(+)-2-(6-метокси-2-нафтил)-пропіонової кислоти (напроксен) (0,15г, 0,65ммоль) в 10мл дихлорметану додавали цис-9-октадеценол (0,18г, 0,67ммоль), DCC (0,13г, 0,67ммоль), 4диметиламінопіридин (ДМАП) (20мг) та реакційну суміш перемішували в N2 при кімнатній температурі на протязі 3 годин. Білий осад, що утворився, відфільтровували та промивали дихлорметаном. Розчинник випарювали та продукт очищали на колонці з силікагелем з використанням як елюєнта дихлорметану. Однорідні фракції давали 0,25г (80%) указаної в заголовку сполуки. 1 Н ЯМР (CDCI3, 300МГц) δ: 7,7 (3Н, м, АrН), 7,42 (1Н, д, АrН), 7,08 (2Н, м, АrН), 5,35 (3Н, м, СН=СН ), 4,07 (2Н, т, СН2-ОСО), 3,9 (3Н, с, СН3-ОАr), 3,87 (1Н, к, СН), 1,95 (2Н, м, СН2-С=), 1,25 (22Н, м, СН2), 0,85 (3Н, т, СН3). Приклад 14 11b,17a,21-тригідроксипрегна-1,4-дієн-3,20-діон-21-елаїдат До розчину 11b,17a,21-тригідроксипрегна-1,4-дієн-3,20-діону (преднізолон) (6,0г, 15,9ммоль) в 200мл безводного діоксану та 6,5мл піридину додавали хлорангідрид елаїдинової кислоти (8,0г, 26,6ммоль) та реакційну суміш перемішували при 10°С на протязі 3 годин. Додавали невелику кількість метанолу та розчинники випарювали в високому вакуумі. Залишок розподіляли між простим ефіром та водою. Органічну фазу промивали винною кислотою (водн.), NaHCO3 (водн.) та водою. Висушену органічну фазу концентрували та продукт очищали на колонці з силікагелем з використанням як елююючої системи гептану/етилацетату/метанолу (64:32:4). Однорідні фракції випарювали, одержуючи 9,18г (90%) указаної в заголовку сполуки. 1 Н ЯМР (CDCI3, 300МГц) δ: 7,25 (1Н, ушир.д, СН=), 6,25 (1Н, дд, СН=), 6,0 (1Н, ушир.с, СН=), 5,38 (2Н, м, СН=СН), 4,92 (2Н, к, СН2), 2,41 (2Н, т, СН2-СО), 1,95 (4Н, м, СН2-СН=), 0,87 (3Н, т, СН3), 2,8-0,95 (42Н, м). Приклад 15 9-фтор-11b,17a,21-тригідрокси-16b-метилпрегна-1,4-дієн-3,20-діон-21-елаїдат До суспензії 9-фтор-11b,17a,21 -тригідрокси-16b-метилпрегна-1,4-дієн-3,20-діону (бетаметазон) (0,9г, 2,3ммоль) в 40мл безводного діоксану та 1мл піридину додавали хлорангідрид елаїдинової кислоти (1,13г, 3,03ммоль) та реакційну суміш перемішували при температурі навколишнього середовища на протязі 48 годин. Додавали невелику кількість метанолу та розчинники випарювали в високому вакуумі. Залишок розподіляли між простим ефіром та водою. Органічну фазу промивали винною кислотою (водн.), NaHCO3 (водн.) та водою. Висушену органічну фаз у концентрували та продукт очищали на колонці з силікагелем з використанням як елююючої системи гептану/ етилацетату/метанолу (64:32:4). Фракції, що містять домішки, очищали повторно та однорідні фракції випарювали, одержуючи 1,02г (65%) указаної в заголовку сполуки. 1 Н ЯМР (СОСІ3, 300МГц) δ: 7,22 (1Н, д, СН=), 6,31 (1Н, дд, СН=), 6,10 (1Н, ушир.с, СН=), 5,38 (2Н, м, СН=СН), 4,92 (2Н, к, СН2), 2,41 (2Н, т, СН2-СО), 1,95 (4Н, м, СН2-СН=), 1,18 (3Н, д, СН3), 0,87 (3Н, т, СН3), 2,80,95 (40Н, м). Ліпофільні похідні за цим винаходом можуть вводитися системно при лікуванні захворювань, при яких звичайно призначають НПЗЗ та інші протизапальні лікарські засоби, або ентерально, або парентерально. При ентеральному введенні, яке є переважним, сполуки за винаходом можуть бути введені в склад препаративних форм, наприклад, м'яких або твердих желатинових капсул, таблеток, гранул, крупинок або порошків, драже, сиропів, суспензій або розчинів. При парентеральному введенні придатними є препаративні форми сполук за винаходом у вигляді ін'єкційних або інфузійних розчинів, суспензій або емульсій. Фармацевтичні композиції за цим винаходом можуть бути одержані звичайними способами. Таким чином, препаративні форми можуть містити інертні або фармакодинамічні активні добавки. Таблетки або гранули, наприклад, можуть містити, як це прийнято, зв'язуючі агенти, наповнювачі, носії або розріджувачі. Рідкі препаративні форми можуть бути, наприклад, у ви гляді стерильного розчину. Капсули можуть містити матеріал наповнювача або агент загущення на додаток до активного інгредієнта. Крім того, можуть також бути присутніми добавки, що покращують смак, поряд з речовинами, які звичайно використовуються як консервуючі, стабілізуючі, вологозатримувальні та емульгуючі агенти, солі для варіювання осмотичного тиску, буфери і інші добавки. Якщо бажано, фармацевтичні препаративні форми сполук за винаходом можуть містити антиоксидант, наприклад, токоферол, N-метил-токоферамін, бутилований гідроксианізол, аскорбінову кислоту або бутилований гідрокситолуол. Дозування сполуки, що вводиться, згідно з винаходом, буде змінюватися в залежності від природи захворювання пацієнта, який піддається лікуванню, стадії його розвитку, способу застосування та шляху введення, а також від вимог пацієнта. В загальному, денна доза при системній терапії для середньої дорослої людини буде складати приблизно 0,1-100мг/кг від ваги тіла/день, переважно 0,5-30мг/кг/день. Винахід, крім того, належить до способу лікування запального захворювання, яке викликає біль та/або супроводжується жаром, яке включає введення принаймні однієї сполуки за винаходом пацієнту-людині, що потребує такого лікування. Переважними на сьогодні ліпофільними похідними протизапальних лікарських засобів за цим винаходом є ті, для яких вихідним лікарським засобом служить напроксен. Зокрема, встановлено, що олеїловий простий ефір напроксену, олеїловий складний ефір напроксену та напроксенолеїламід мають кращу протизапальну дію в порівнянні з самим напроксеном. На моделях тварин in vi vo ці похідні продемонстрували кращу дію на першій фазі запалення щодо зменшення вмісту гранулематозної рідини. Навіть більш дивним ефектом було зменшення сухої ваги гранулематозної тканини, особливо у випадку напроксенолеїламіду. Це означає зменшення ушкодження тканини, що не досягається при лікуванні відомими НПЗЗ. Ефект мав порядок, який може очікуватися лише при використанні терапевтичної дози стероїдів. Також зменшувалося руйнування хрящів, що є серйозною побічною дією НПЗЗ. Об'єднання цих відкриттів, наприклад, безпосередньої покращеної·дії, що проявляється як зменшення сухої ваги гранульоми та зменшення руйнування хрящів, істотно збільшує терапевтичний індекс похідних напроксену. Тварини, які піддавались лікуванню похідними напроксену, також були менш агресивними, ніж ті, які піддавались лікуванню вихідними сполуками. Це чітко показує, що похідні чинять істотно меншу побічну дію на шлунково-кишковий тракт. Не пов'язуючись з якою-небудь певною теорією, припускається, що посилена протизапальна дія може бути пов'язана з ліпофільною природою, яка призводить до посиленого поглинання клітинами, або з дією, зовсім особливою, ніж у випадку напроксену. Хвости жирних кислот, додані до напроксену, можуть діяти як пастки реакційноздатних кисневих частинок (РКЧ), що може діяти проти запалення за допомогою безлічі механізмів. Наприклад, пошкодження тканини буде інгібуватися в результаті захисту РКЧ-чутливи х інгібіторів протеази, це буде запобігати утворенню ендогенних антигенів, які генеруються окисним пошкодженням протеїнів, а захист гіалуронової кислоти від деполімеризації буде запобігати генерації антигенних факторів. На імплантованому хрящі напроксен, як і інші НПЗЗ, мають тенденцію до збільшення втрат протеоглікану та колагену. Навпаки, справжні похідні напроксену не проявили тенденції до збільшення втрат протеоглікану або колагену з хрящів. Так як гадають, що інгібування циклооксигенази відповідальне за шкідливу дію НПЗЗ на хрящі, і так як похідні напроксену розділяють разом з напроксеном здатність інгібувати цей фермент, то припускається, що їх великий розмір та ліпофільна природа призводять до їх виключення з хрящової матриці. Далі докладно описані експерименти, що ілюструють посилену протизапальну дію цих похідних напроксену. Біологічна дія Модель in vivo Використовувана модель in vivo індукованого гранульомою руйнування хряща включала імплантування стерильного, обгорнутого бавовною хряща головки стегна пацюка на спину миші. Бавовна провокує гранолематозну відповідь з наочним включенням Т-клітин, що призводить до втрати матричних сполук з імплантованого хряща. Як спосіб тестування потенційних протиартритних агентів ця модель має декілька певних переваг. Вона включає хронічне ерозійне захворювання з кількісними біохімічними кінцевими точками для визначення втрат хрящової матриці. Протизапальна активність може бути оцінена за сирою та сухою масою бавовняної гранульоми, хондропротекторна активність може бути визначена за вмістом глікозаміноглікану та гідроксипроліну (індикаційні дані для протеоглікану та колагену, відповідно) в імплантованому хрящі. Гранульома є дискретною та може бути вилучена, при необхідності, для оцінки різних медіаторів або ферментів. Групам самок (n=10) мишей ТО (21±4г) проводили підшкірне імплантування обгорнутого бавовною хряща головки стегна. Через 2 тижні імплантанти вилучали. Бавовна провокувала гранулематозну відповідь із вторинним вивільненням протеоглікану з імплантованого хряща. Оцінювали дію перорального щоденного введення еквімолярних кількостей напроксену (30мг/кг) та похідних напроксену (60мг/кг) на розвиток гранульоми та вміст хрящового протеоглікану. Сполуки використовували в вигляді препаративної ліпосомної форми з пустими лізосомами як носія-контролю. 15мг/кг ліпосомну композицію одержували шляхом 1:1 (в/в) змішування певних ліпідних похідних (в ДМСО) та лецитину (в етанолі) в буфері гліцерин/стерильна вода з наступним діалізом для вилучення розчинників. 7,5мг/мл ліпосомну композицію НПЗЗ сполук, для яких не проводили утворення похідних, одержували шляхом додання конкретної сполуки до пустих ліпосом в гліцерині/стерильній воді. Результати були проаналізовані за допомогою програми INSTAT з використанням Mahn-Whithney та значеннями р, скоректованими для зв'язки. Значення p
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel derivatives of fatty acids
Автори англійськоюMyhren, Finn, BOERRETZEN BERNT, Dalen Are
Назва патенту російськоюНовые производные жирных кислот
Автори російськоюБЕРРЕТСЕН Бернт, Дален Аре
МПК / Мітки
МПК: A61P 35/00, C07D 487/04, C07C 69/72, A01N 37/36, C07D 473/24, C07D 233/90, C07H 17/04, C07C 69/734, C07D 305/00, C07D 417/12, C07D 231/56, C07C 229/42, C07H 5/00, A61K 31/505, C07C 65/00, A61K 31/519, A01N 57/28, A61K 31/52, C07D 239/42, A61K 31/565, C07H 15/252, A61K 31/426, A61K 31/675, C07D 473/38, C07C 69/88, A61K 31/7042, A61K 31/567, A61K 31/53, C07C 59/00, A61P 29/00, A61K 31/337, A61K 31/416, C07J 71/00, A61K 31/573, C07D 251/70, C07C 235/34, A61K 31/57, C07D 317/70, A61K 31/704, C07D 211/88, C07D 475/00, A01N 37/34, A01N 61/00, C07J 3/00, C07J 7/00, A01N 47/24, C07J 5/00, C07C 69/84
Мітки: модифікування, фармацевтична, одержання, активності, садівництва, похідні, спосіб, композиція, похідної, жирних, кислот, господарства, ліпофільної, ліпофільні, сільського
Код посилання
<a href="https://ua.patents.su/35-65557-lipofilni-pokhidni-zhirnikh-kislot-farmacevtichna-kompoziciya-ta-kompoziciya-dlya-silskogo-gospodarstva-abo-sadivnictva-sposib-modifikuvannya-aktivnosti-ta-sposib-oderzhannya-lipof.html" target="_blank" rel="follow" title="База патентів України">Ліпофільні похідні жирних кислот, фармацевтична композиція та композиція для сільського господарства або садівництва, спосіб модифікування активності та спосіб одержання ліпофільної похідної</a>