Похідні 3-ціано-4-(4-тетрагідропіранфеніл)піридин-2-ону
Номер патенту: 99124
Опубліковано: 25.07.2012
Автори: Сід-Нюнез Хосе Марія, МакДональд Грегор Джеймс, Трабанко-Суарез Андрес Авеліно, Дюве Ґійом Альбер Як'юес
Формула / Реферат
1. Сполука формули
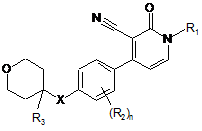 , (I)
, (I)
у тому числі будь-яка її стереохімічно ізомерна форма, де
R1 - С4-6алкіл або С1-3алкіл, заміщений С3-7циклоалкілом;
R2 - гідроген, галоген або трифлуорметил;
R3 - гідроген або С1-4алкіл, заміщений гідроксилом;
Х - О або NH;
n - ціле число 1 або 2;
або її фармацевтично прийнятні солі або сольвати,
де сполукою не є
--R1
![]()
--R3
--X--
![]()
![]()
--H
![]()
![]()
![]()
--H
![]()
![]()
![]()
--H
![]()
![]()
![]()
--H
![]()
![]()
![]()
--H
![]()
2. Сполука за п. 1, де R1 - С4-6алкіл.
3. Сполука за п. 2, де R1 - 1-бутил або 3-метил-1-бутил.
4. Сполука за п. 1, де R1 - С1-3алкіл, заміщений С3-7циклоалкілом.
5. Сполука за п. 4, де R1 - циклопропілметил або 2-(циклопропіл)-1-етил.
6. Сполука за будь-яким з попередніх пунктів, де R2 - гідроген.
7. Сполука за будь-яким з пп. 1-5, де R2 - галоген.
8. Сполука за будь-яким з пп. 1-5, де R2 - трифлуорметил.
9. Сполука за будь-яким з попередніх пунктів, де R3 - гідроген.
10. Сполука за будь-яким з пп. 1-8, де R3 - С1-4алкіл, заміщений гідроксилом.
11. Сполука за п. 10, де R3 - СН2ОН.
12. Сполука за будь-яким з пп. 1-11, де Х - О.
13. Сполука за будь-яким з пп. 1-11, де Х - NH.
14. Сполука за будь-яким з попередніх пунктів, де n = 1.
15. Сполука за будь-яким з пп. 1-13, де n = 2.
16. Сполука за будь-яким з пп. 1-14, де n = 1, a R2 не є гідрогеном та розташований у мета-позиції відносно піридинонової групи.
17. Сполука за п. 1, де R1 - 1-бутил, 3-метил-1-бутил, циклопропілметил чи 2-(циклопропіл)-1-етил; R2 - гідроген, флуор, хлор чи трифлуорметил; R3 - гідроген; n = 1.
18. Сполука за п. 1, яка є вибраною з групи:

--R1
![]()
--R3
--X--
![]()
![]()
--H
![]()
![]()
![]()
--H
![]()
![]()
![]()
--H
![]()
![]()
![]()
--H
![]()
![]()
![]()
--H
![]()
![]()
![]()
--H
![]()
![]()
![]()
--H
![]()
або її фармацевтично прийнятна сіль або сольват.
19. Сполука за будь-яким з пп. 1-18 для застосування як медикаменту.
20. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-18 та фармацевтично прийнятний носій або розріджувач.
21. Застосування сполуки за будь-яким з пп. 1-18 для виробництва медикаменту для лікування або попередження стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією позитивного алостеричного модулятора mGluR2.
22. Застосування сполуки за будь-яким з пп. 1-18 для виробництва медикаменту для лікування або попередження розладу центральної нервової системи, вибраного з групи: розлад з компонентом тривоги, психотичні розлади, розлади особистості, пов'язані з речовинами розлади, розлади харчування, розлади настрою, мігрень, епілепсія або конвульсивні розлади, дитячі розлади, когнітивні розлади, нейродегенерація, нейротоксичність та ішемія.
23. Застосування за п. 22, де розладом центральної нервової системи є розлад з компонентом тривоги, вибраний з групи: агорафобія, генералізований розлад з компонентом тривоги (GAD), обсесивно-компульсивний розлад (OCD), розлад панічного типу, посттравматичний стресовий розлад (PTSD), соціальна фобія та інші фобії.
24. Застосування за п. 22, де розладом центральної нервової системи є психотичний розлад, вибраний з групи: шизофренія, галюцинаційний розлад, шизоафективний розлад, шизофреноподібний розлад та індукований речовинами психотичний розлад.
25. Застосування за п. 22, де розладом центральної нервової системи є розлад особистості, вибраний з групи: обсесивно-компульсивний розлад особистості та шизоїдний, шизоподібний розлад.
26. Застосування за п. 22, де розладом центральної нервової системи є пов'язаний з речовинами розлад, вибраний з групи: зловживання алкоголем, залежність від алкоголю, алкогольна абстиненція, маячний стан при алкогольній абстиненції, індукований алкоголем психотичний розлад, залежність від амфетамінів, амфетамінова абстиненція, залежність від кокаїну, кокаїнова абстиненція, залежність від нікотину, нікотинова абстиненція, залежність від опіоїдів та опіоїдна абстиненція.
27. Застосування за п. 22, де розладом центральної нервової системи є розлад харчування, вибраний з групи: нервово-психічна анорексія та нейрогенна булімія.
28. Застосування за п. 22, де розладом центральної нервової системи є розлад настрою, вибраний з групи: біполярні розлади (І та II), циклотимічний розлад, депресія, психічна депресія, глибокий депресивний розлад та індукований речовиною розлад настрою.
29. Застосування за п. 22, де розладом центральної нервової системи є мігрень.
30. Застосування за п. 22, де розладом центральної нервової системи є епілепсія або конвульсивний розлад, вибраний з групи: генералізована неконвульсивна епілепсія, генералізована конвульсивна епілепсія, мала епілепсія, велика епілепсія, часткова епілепсія з втратою або без втрати притомності, дитячі спазми, епілепсія часткової продовжуваності та інші форми епілепсії.
31. Застосування за п. 22, де розладом центральної нервової системи є дитячий розлад.
32. Застосування за п. 31, де дитячим розладом є розлад з дефіцитом уваги/гіперактивністю.
33. Застосування за п. 22, де розладом центральної нервової системи є когнітивний розлад, вибраний з групи: маячний стан, індукований речовинами стійкий маячний стан, деменція, деменція внаслідок ВІЛ-хвороби, деменція внаслідок хвороби Хантінгтона, деменція внаслідок хвороби Паркінсона, деменція типу Альцгеймера, індукована речовинами стійка деменція та помірне когнітивне порушення.
34. Застосування за п. 22, де розлад центральної нервової системи вибраний з групи: неспокій, шизофренія, мігрень, депресія та епілепсія.
35. Застосування сполуки за будь-яким з пп. 1-18 у комбінації з ортостеричним агоністом mGluR2 для виробництва медикаменту для лікування або попередження стану за будь-яким з пп. 21-34 у ссавця, у тому числі людини.
36. Спосіб отримання сполуки за п. 1, який відрізняється тим, що здійснюють:
реакції інтермедіату формули (II), де
Y - група, придатна для опосередкованого Pd сполучення з бороновими кислотами або бороновими естерами,
з інтермедіатом формули (III), де
R4 та R5 - гідроген або С1-4алкіл, або де R4 та R5 можуть разом утворювати двовалентний радикал формули -СН2СН2-, -СН2СН2СН2- або -С(СН3)2С(СН3)2-,
у придатному реакційно інертному розчиннику, у присутності придатної основи та придатного каталізатора при нагріванні
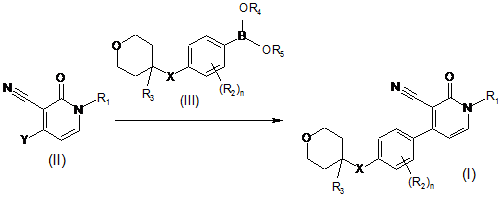 ,
,
де R1, R2, R3, X та n визначено у п. 1;
або, якщо бажано, подальше перетворення сполуки формули (І) одна в одну відомими з рівня техніки перетвореннями; або, крім того, якщо бажано, перетворення сполуки формули (І), у терапевтично активну нетоксичну кислотно-адитивну сіль обробкою кислотою, або навпаки, перетворення кислотно-адитивної солі у вільну основу обробкою лугом; або, якщо бажано, отримання її стереохімічно ізомерних форм.
Текст
Реферат: Заявлений винахід стосується сполуки, зокрема похідних піридинону формули O N N R1 O X R3 (R2)n , (І) UA 99124 C2 (12) UA 99124 C2 у тому числі будь-яких їх стереохімічно ізомерних форм або їх фармацевтично прийнятних солей або сольватів, де усі радикали є визначеними у описі та формулі винаходу. Сполуки згідно з винаходом є позитивними алостеричними модуляторами метаботропних рецепторів глутамату - підтипу 2 (mGluR2), котрі є корисними для лікування або попередження неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією, та хвороб, у котрих є задіяним підтип метаботропних рецепторів mGluR2. Зокрема, такі хвороби є розладами центральної нервової системи, вибраними з групи: неспокій, шизофренія, мігрень, депресія та епілепсія. Винахід також стосується фармацевтичних композицій та способів отримання таких сполук та таких композицій, а також застосування таких сполук для попередження та лікування таких хвороб, у котрих є задіяним mGluR2. UA 99124 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується нових похідних піридин-2-ону, котрі є позитивними алостеричними модуляторами метаботропного рецептору глутамату підтип 2 (“mGluR2”) та котрі є корисними для лікування або попередження неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією, та хворобами, у котрих є задіяним підтип mGluR2 метаботропних рецепторів. Винахід також стосується фармацевтичних композицій, що містять такі сполуки, способів отримання таких сполук та таких композицій, та застосування таких сполук для попередження або лікування неврологічних та психіатричних розладів та хвороби, у котрих mGluR2 є задіяним. Глутамат є головним амінокислотним нейротрансмітером у центральній нервовій системі ссавців. Глутамат грає головну роль у ряді фізіологічних функцій, як-то навчання та пам’ять, але також почуттєве сприйняття, розвиток синаптичої пластичності, моторний контроль, дихання, та регулювання серцево-судинної функції. Більш того, глутамат є у центрі кількох відмінних неврологічних та психіатричних хвороб, де є дисбаланс у глутаматергічній нейротрансмісії. Глутамат опосередковує синаптичну нейротрансмісію активацією каналів іонотропних рецепторів глутамату (іGluR), та NМDА, АМРА та каїнатних рецепторів, котрі є відповідними за швидку передачу збудження. На додаток, глутамат активує метаботропні рецептори глутамату (mGluR), котрі мають більшу модуляторну роль, що сприяє точному регулюванню синаптичної ефективності. Глутамат активує mGluR зв’язуванням з великим зовнішньоклітинним амінокінцевим доменом рецептору, названим тут ортостеричним зв’язувальним сайтом. Це зв’язування індукує конформаційну зміну рецептору, що призводить до активації G-білку та шляхів внутрішньоклітинної передачі сигналів. Підтип mGluR2 є негативно сполученим з аденілат-циклазою через активацію Gγі-білку, та його активація призводить до інгібування вивільнення глутамату у синапсі. У центральній нервовій системі (ЦНС), рецептори mGluR2 є головним чином поширеними у корі головного мозку, таламічних регіонах, додатковій зачиняльній луковиці, гіпокампі, мигдалевидній залозі та хвостатій шкаралупі. Активування mGluR2 було показано у клінічних дослідженнях як ефективне для лікування розладів з компонентом тривоги. На додаток, активування mGluR2 у різних тваринних моделях було показано як ефективне, а тому представляє потенційно новий терапевтичний підхід для лікування шизофренії, епілепсії, наркоманії/залежності від ліків, хвороби Паркінсона, болю, розладів сну та хвороби Хантингтона. Зараз більшість наявних фармакологічних засобів, що націлюють mGluR, є ортостеричними лігандами, котрі активують кілька членів родини, оскільки вони є структурними аналогами глутамату. Новим шляхом розробки селективних сполук, що діють на mGluR, є ідентифікування сполук, що діють за алостеричними механізмами, модулюючи рецептор зв’язуванням з сайтом відмінним від високозбереженого ортостеричного зв’язувального сайту. Позитивні алостеричні модулятори mGluR з’явилися нещодавно як нові фармакологічні об’єкти, що дають цю привабливу альтернативу. Різні сполуки описані як позитивні алостеричні модулятори mGluR2. WО2004/092135 (NРS & Аstrа Zеnеса), WО2004/018386, WО2006/014918 та WО2006/015158 (Меrсk), WО2001/56990 (Еlі Lіllу) та WО2006/030032 (Аddех & Jаnssеn Рhаrmасеutіса) описують відповідно похідні феніл-сульфонаміду, ацетофенону, інданону, піридилметилу сульфонаміду та піридинону як позитивні алостеричні модулятори mGluR2. Жодна з конкретних розкритих сполук не є структурно спорідненою зі сполуками винаходу. WО2007/104783 описує похідні 1,4-дизаміщеного 3-ціано-піридону, що є позитивними алостеричними модуляторами метаботропних рецепторів підтипу 2 (“mGluR2”). Продемонстровано, що такі сполуки не активують рецептор самі. Точніше, вони розблоковують рецептор для створення максимальної реакції на концентрацію глутамату, котрий сам індукує мінімальну реакцію. Мутаційний аналіз продемонстрував недвозначно, що зв’язування позитивних алостеричних модуляторів mGluR2 не відбувається на ортостеричному сайті, але замість на алостеричному сайті, розташованому у семі-трансмембранному регіоні рецептору. Дані від тварин підказують, що позитивні алостеричні модулятори mGluR2 мають дію у моделях неспокою та психозу, подібну отриманій з ортостеричними агоністами. Алостеричні модулятори mGluR2 були показаними як активні у потенцированому страхом переляку, та в індукованих стресом моделях гіпертермії неспокою. Більш того, такі сполуки були показаними як активні у скасуванні індукованої кетаміном або амфетаміном гіперлокомоції, та у скасуванні індукованого амфетаміном порушення інгібування виникнення імпульсу у моделі шизофренії від 1 UA 99124 C2 5 10 15 20 дії акустичного переляку (J. Рhаrmасоl. Ехр. Тhеr. 2006, 318, 173-185; Рsусhорhаrmасоlоgу 2005, 179, 271-283). Нещодавні дослідження тварин крім того виявили, що селективний позитивний алостеричний модулятор метаботропного рецептору глутамату підтипу 2 біфеніл-інданон (ВІNА) блокує модель психозу від галюциногенних ліків, підтримуючи стратегію націлювання рецепторів mGluR2 для лікування глутаматергічної дисфункції у шизофренії (Моl. Рhаrmасоl. 2007, 72, 477-484). Позитивні алостеричні модулятори полегшують потенціювання реакції глутамату, але вони, як також показано, потенціюють реакцію на ортостеричні агоністи mGluR2 як-то LY379268 або DСG-ІV. Ці дані дають свідчення про ще один новий терапевтичний підхід для лікування вищезгаданих неврологічних та психіатричних хвороб із задіяним mGluR2 із застосуванням комбінації позитивного алостеричного модулятору mGluR2 разом з ортостеричним агоністом mGluR2. Представлені сполуки характеризуються центральною групою піридин-2-ону, заміщеного у позиції 3 ціано, а у позиції 4 необов’язково заміщеним фенілом, котрий є у свою чергу заміщеним у позиції 4 заміщеним піридинілоксилом. Представлені сполуки є потужними позитивними алостеричними модуляторами mGluR2 та виявляють поліпшений профіль серцево-судинної безпечності. Винахід стосується сполук, що мають модуляторну активність стосовно метаботропного рецептору глутамату 2. Заявлений винахід стосується сполуки формули (І), O N N R1 O X (R2)n R3 25 30 35 (І), у тому числі будь-якої її стереохімічно ізомерної форми, де R1 – С4-6алкіл, або С1-3алкіл, заміщений С3-7циклоалкілом; R2 – гідроген, галоген або трифлуорметил; R3 – гідроген або С1-4алкіл, заміщений гідроксилом; Х – О або NН; n – ціле число 1 або 2; або її фармацевтично прийнятної солі або сольвату. Заявлений винахід також стосується застосування сполуки формули (І) або будь-якої її підгрупи для виробництва медикаменту для лікування або попередження, зокрема для лікування, стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією алостеричного модулятору mGluR2, зокрема позитивного алостеричного модулятору. Втіленням заявленого винаходу є такі сполуки формули (І) O N N R1 O X R3 40 45 (R2)n (І), у тому числі будь-які їх стереохімічно ізомерні форми, де R1 – С4-6алкіл, або С1-3алкіл, заміщений С3-7циклоалкілом; R2 – гідроген, галоген або трифлуорметил; R3 – гідроген або С1-4алкіл, заміщений гідроксилом; Х – О або NН; n – ціле число 1 або 2; або їх фармацевтично прийнятні солі або сольвати; 2 UA 99124 C2 за умови, що нею не є O N 2 3 O X R3 4 N R1 1 6 5 R2 --R1 35 40 O --Н N H --Н N H --Н N H Втіленням заявленого винаходу є такі сполуки формули (І), де R 1 – С4-6алкіл, зокрема С4як-то, наприклад, 1-бутил, 2-метил-1-пропіл, 3-метил-1-бутил; зокрема 1-бутил або 3метил-1-бутил. Втіленням заявленого винаходу є такі сполуки формули (І), де R 1 – С1-3алкіл, заміщений С3циклоалкілом, зокрема циклопропілметил або 2-(циклопропіл)-1-етил, більш конкретно 7 циклопропілметил. Втіленням заявленого винаходу є такі сполуки формули (І) або будь-яка їх підгрупа, яку вищезгадано у втіленні, де R2 – гідроген. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де R2 – галоген, зокрема флуор або хлор. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де R2 – трифлуорметил. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де R3 – гідроген. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де R3 – С1-4алкіл, заміщений гідроксилом; зокрема, де R3 – СН2ОН. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де Х – О. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де Х – NН. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 1. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 2. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 1, а R 2 є іншим, ніж гідроген, та вказаний R2 розташовано у мета-позиції відносно піридинонової групи. Втіленням заявленого винаходу є такі сполуки формули (І) або кожного разу, коли можливо, будь-яка їх підгрупа, яку вищезгадано у втіленні, де n = 1, а R 2 є іншим, ніж гідроген, та вказаний R2 розташовано в орто-позиції відносно піридинонової групи. Втіленням заявленого винаходу є такі сполуки формули (І), де R 1 – С4-6алкіл, зокрема 1бутил або 3-метил-1-бутил; або С1-3алкіл, заміщений С3-7циклоалкілом, зокрема циклопропілметил або 2-(циклопропіл)-1-етил; R2 – гідроген, флуор, хлор або трифлуорметил; R3 – гідроген; 5алкіл, 30 --Н 3-Сl 25 N H 3-F 20 --Н 2-F 15 --Х- 2-F 10 --R3 Н 5 R2 3 UA 99124 C2 n = 1. Втіленням заявленого винаходу є сполука формули (І) вибрана з групи: O N R1 N 2 3 O X 4 R3 1 6 5 R2 --R1 --R3 --Х- 3-F --Н N H 3-Сl --Н N H 3-СF3 --Н N H 3-Сl --Н O 3-Сl --Н O 3-Сl --Н N H 3-СF3 --Н N H Н --Н N H 2-F --Н O 2-F --Н N H 3-F --Н N H 3-Сl 5 R2 --Н N H або її фармацевтично прийнятна сіль або сольват. Втіленням заявленого винаходу є сполука формули (І) вибрана з групи: O N R1 N 2 3 O X R3 4 1 6 5 R2 4 UA 99124 C2 --R1 40 --Н N H --Н O --Н O --Н N H 3-СF3 35 N H 3-Сl 30 --Н 3-Сl 25 N H 3-Сl 20 --Н 3-СF3 15 --Х- 3-Сl 10 --R3 3-F 5 R2 --Н N H або її фармацевтично прийнятна сіль або сольват. Позначення С1-3алкілу як групи або частини групи визначає насичений, нерозгалужений або розгалужений вуглеводневий радикал, що має від 1 до 3 атомів карбону, як-то метил, етил, 1пропіл та 1-метил-1-етил. Переважно С1-3алкіл – метил. Позначення С1-4алкілу як групи або частини групи визначає насичений, нерозгалужений або розгалужений вуглеводневий радикал, що має від 1 до 4 атомів карбону як-то метил, етил, пропіл, 1-метил-1-етил, 1-бутил, 2-метил-1-пропіл. Переважно, С1-4алкіл – метил. Позначення С4-6алкілу як групи або частини групи визначає насичений, нерозгалужений або розгалужений вуглеводневий радикал, що має від 4 до 6 атомів карбону як-то 1-бутил, 2-метил1-пропіл, 1-пентил, 2-метил-1-бутил, 3-метил-1-бутил, 1-гексил тощо. Переважно С4-6алкіл – 1бутил. Позначення С4-5алкілу як групи або частини групи визначає насичений, нерозгалужений або розгалужений вуглеводневий радикал, що має 4 або 5 атомів карбону як-то 1-бутил, 2-метил-1пропіл, 1-пентил, 2-метил-1-бутил, 3-метил-1-бутил тощо. Позначення С3-7циклоалкіл визначає насичений, циклічний вуглеводневий радикал, що має від 3 до 7 атомів карбону, як-то циклопропіл, циклобутил, циклопентил, циклогексил та циклогептил. Переважно С3-7циклоалкіл – циклопропіл. Позначення галоген стосується флуору, хлору, брому та йоду. Для терапевтичного застосування, солі сполук формули (І) є тими, де протиіон є фармацевтично прийнятним. Однак, солі кислот та основ, котрі є фармацевтично неприйнятними, можуть також знайти застосування, наприклад, в отриманні або очистці фармацевтично прийнятної сполуки. Усі солі, фармацевтично прийнятні або ні, є у межах заявленого винаходу. Фармацевтично прийнятні солі, як визначено, містять терапевтично активні нетоксичні форми кислотно-адитивних солей, які сполуки формули (І) є здатними утворювати. Вказані солі можна отримати обробкою основної форми сполуки формули (І) прийнятними кислотами, наприклад, неорганічними кислотами, як-то галогенідна кислота, зокрема хлоридна кислота, бромідна кислота, сульфатна кислота, нітратна кислота та фосфатна кислота; органічними кислотами, як-то оцтова кислота, гідроксіоцтова кислота, пропанова кислота, молочна кислота, піровиноградна кислота, щавлева кислота, малонова кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, яблучна кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, бензенсульфонова кислота, птолуєнсульфонова кислота, цикламова кислота, саліцилова кислота, п-аміносаліцилова кислота та памова кислота. Навпаки, вказані форми солей кислот можна перетворити у форму вільної основи обробкою прийнятною основою. Сполуки формули (І), що містять кислотні протони, можна також перетворити у їх терапевтично активні нетоксичні форми солей основ обробкою прийнятними органічними та неорганічними основами. Прийнятні форми солей основ містять, наприклад, солі амонію, солі 5 UA 99124 C2 5 10 15 20 25 30 35 40 45 50 55 60 лужних та лужноземельних металів, зокрема, солі літію, натрію, калію, магнію та кальцію, солі з органічними основами, наприклад, бензатином, N-метил-D-глюкаміном, гібраміном, та солі з амінокислотами, наприклад, аргініом та лізином. Навпаки, вказані форми солей основ можна перетворити у форми вільних кислот обробкою прийнятною кислотою. Фармацевтично прийнятні форми кислотно-адитивних солей сполук формули (І) є кращими фармацевтично прийнятними формами солей сполук формули (І). Термін сольват охоплює форми з доданим розчинником, а також їх фармацевтично прийнятні солі, котрі сполуки формули (І) здатні утворювати. Прикладами таких форм з доданим розчинником є, наприклад, гідрати, алкоголяти тощо. Треба розуміти, що деякі сполук формули (І) та їх солі та сольвати можуть містити один або більше центрів хіральності та існувати як стереохімічно ізомерні форми. Термін «стереохімічно ізомерні форми”, як застосовувано далі, визначає усі можливі ізомерні форми, що можуть мати сполуки формули (І). Якщо не вказане інше, хімічна назва сполуки позначає суміш усіх можливих стереохімічно ізомерних форм, вказані суміші містять усі діастереомери та енантіомери базової молекулярної структури. Але винахід також стосується кожної з індивідуальних ізомерних форм формули (І) та їх солей або сольватів, по суті вільних, тобто асоційованих з менше, ніж 10%, переважно менше, ніж 5%, зокрема менше, ніж 2% та найкраще менше, ніж 1% інших ізомерів. Тому, коли сполуку формули (І), наприклад, позначено як (R), це означає, що сполука є по суті вільною від (S) ізомеру. Зокрема, стереогенні центри можуть мати R- або S-конфігурацію; замісники на двовалентних циклічних (частково) насичених радикалах можуть мати цис- або трансконфігурацію. За номенклатурною домовленістю САS, коли два стереогенні центри відомої абсолютної конфігурації є представленими у сполуці, R або S ідентифікатор встановлюють (на основі правил Кана-Інгольда-Прелога) відносно найнижче нумерованого хірального центру, опорного центру. Конфігурацію другого стереогенного центру позначають, застосовуючи відповідні ідентифікатори [R*,R*] або [R*,S*], де R* завжди позначено як опорний центр, а [R*,R*] показує центри з однаковою хіральністю та [R*,S*] показує центри небажаної хіральності. Наприклад, якщо найнижче нумерований хіральний центр у сполуці має S конфігурацію, а другий центр є R, стереоідентифікатор слід позначати як S-[R*,S*]. Якщо застосовують “” та “β”: позиція заміснику найвищої першочерговості на асиметричному атомі карбону у кільцевій системі, що має найнижчий номер у кільці, є довільно завжди в “” позиції середньої площини, визначеної кільцевою системою. Позиція заміснику найвищої першочерговості на іншому асиметричному атомі карбону у кільцевій системі (атом гідрогену у сполуках формули (І)) відносно позиції заміснику найвищої першочерговості на опорному атомі є позначеним “”, якщо він є на тій же ділянці середньої площини, визначеної кільцевою системою, або “β”, якщо він є на іншій ділянці середньої площини, визначеної кільцевою системою. Кожного разу, при застосовуванні далі, термін "сполуки формули (І)" або будь-яка їх підгрупа, також охоплює їх стереохімічно ізомерні форми, їх фармацевтично прийнятні солі та їх сольвати. Особливе значення мають сполуки формули (І), котрі є стереохімічно чистими. У рамках цієї заявки елемент, зокрема при згадувані відносно сполук формули (І), охоплює усі ізотопи та суміші ізотопів цього елементу, природно існуючого або синтетично створеного, з природним надлишком або в ізотопно збагаченій формі. Зокрема, коли гідроген є згаданим, він 1 2 3 11 12 13 14 стосується Н, Н, Н або їх суміші; коли карбон є згаданим, він стосується С, С, С, С або 13 14 15 їх суміші; коли нітроген є згаданим, він стосується N, N, N або їх суміші; коли оксиген є 14 15 16 17 18 згаданим, він стосується О, О, О, О, О або їх суміші; та коли флуор є згаданим, він 18 19 стосується F, F або їх суміші. Сполуки згідно з винаходом тому також охоплюють сполуки з одним або більше ізотопами одного або більше елементів, та їх суміші, охоплюючи радіоактивні сполуки, також названі радіоміченими сполуками, де один або більше нерадіоактивних атомів заміщено одним з його радіоактивних ізотопів. Зокрема, радіоактивний атом є вибраним з групи: гідроген, карбон, нітроген, сульфур, оксиген та галоген. Переважно, радіоактивний атом є вибраним з групи: гідроген, карбон та галоген. Зокрема, радіоактивний ізотоп є вибраним з 3 11 18 122 123 125 131 75 76 77 82 групи: Н, С, F, І, І, І, І, Вr, Вr, Вr та Вr. Переважно, радіоактивний ізотоп є 3 11 18 вибраним з групи: Н, С та F. Кожного разу, при застосовуванні раніше або далі, ці замісники можуть бути вибраними, кожний незалежно, з вищенаведеного переліку, призначеними є усі можливі комбінації, котрі є хімічно можливими. Лінії від замісників у кільцевих системах показують, що зв’язок може бути приєднаним до будь-якого з придатних кільцевих атомів. 6 UA 99124 C2 5 10 Загалом, сполуки формули (І) можна отримати нижченаведеним способом 1. Спосіб 1 Сполуки формули (І) можна отримати реакцією інтермедіату формули (ІІ), де Y – група, придатна для опосередкованого Рd сполучення з бороновими кислотами або бороновими естерами, як-то, наприклад, галоген або трифлат, з інтермедіатом формули (ІІІ), де R 4 та R5 – гідроген або С1-4алкіл, або, де R4 та R5 можуть разом утворювати, наприклад, двовалентний радикал формули –СН2СН2-, -СН2СН2СН2-, або -С(СН3)2С(СН3)2-, згідно зі схемою реакцій (1). Реакцію можна проводити у придатному реакційно-інертному розчиннику, як-то, наприклад, 1,4діоксан або суміші інертних розчинників, як-то, наприклад, 1,4-діоксан/ДМФ, у присутності придатної основи, як-то, наприклад, водного NаНСО3 або Nа2СО3, придатного каталізатору, якто, наприклад, Рd-комплексного каталізатору, як-то, наприклад, Рd(РРh3)4, при нагріванні реакційної суміші при 150 ºС мікрохвильовим опроміненням, протягом, наприклад, 10 хвилин. У схемі реакцій (1), усі параметри є визначеними у формулі (І) або визначеними тут вище. Схема реакцій (1) 15 OR4 B OR5 O X N (R2)n R3 O N R1 O (II) X R3 25 30 35 40 R1 N Y 20 O N (III) (I) (R2)n Сполуки формули (І) та деякі з інтермедіатів у заявленому винаході можуть містити асиметричний атом карбону. Чисті стереохімічно ізомерні форми вказаних сполук та вказаних інтермедіатів можна отримати відомими способами. Наприклад, діастереоізомери можна відокремлювати фізичними способами, як-то селективна кристалізація або хроматографія, наприклад, зустрічно-струменеве розподілення, хіральна рідинна хроматографія тощо. Енантіомери можна отримати з рацемічної суміші спершу перетворенням вказаної рацемічної суміші придатним відокремлювальним агентом, як-то, наприклад, хіральною кислотою, у суміш діастереомерних солей або сполук; тоді фізичним відокремленням вказаної суміші діастереомерних солей або сполук, наприклад, селективною кристалізацією або хроматографією, наприклад, рідинною хроматографією тощо; та зрештою перетворенням вказаних відокремлених діастереомерних солей або сполук у відповідні енантіомери. Чисті стереохімічно ізомерні форми можна також отримати з чистих стереохімічно ізомерних форм прийнятних інтермедіатів та вихідних матеріалів, за умови, що проміжні реакції відбуваються стереоспецифічно. Альтернативний спосіб відокремлення енантіомерних форм сполук формули (І) та інтермедіатів охоплює рідинну хроматографію або СКР (Суперкритичну рідинну) хроматографію, зокрема з хіральною стаціонарною фазою. Деякі з інтермедіатів та вихідних матеріалів є відомими сполуками та можуть бути комерційно доступними або їх можна отримати відомими способами. Інтермедіати можна також отримати нижченаведеними способами 2 – 11. Спосіб 2 Інтермедіати формули (ІІ), де Y – галоген, де вказані інтермедіати представлені формулою (ІІ-а), можна отримати реакцією інтермедіату формули (ІV) з придатним галогенувальним агентом, як-то, наприклад, Р(=О)Вr3. Реакцію можна проводити у придатному реакційноінертному розчиннику, як-то, наприклад, ДМФ, при помірно підвищеній температурі, як-то, наприклад, 110 ºС. У схемі реакцій (3), усі параметри є визначеними у формулі (І). 7 UA 99124 C2 Схема реакцій (2) 5 10 Спосіб 3 Інтермедіати формули (ІІ), де Y – трифлат, де вказані інтермедіати представлені формулою (ІІ-b), можна отримати реакцією інтермедіату формули (ІV) з трифлатним ангідридом (також названий трифлуорметансульфоновий ангідрид) згідно зі схемою реакцій (4). Реакцію можна проводити у придатному реакційно-інертному розчиннику, як-то, наприклад, дихлорметан, у присутності придатної основи, як-то, наприклад, піридин при низькій температурі, як-то, наприклад, -78 ºС. У схемі реакцій (3), усі параметри є визначеними у формулі (І). Схема реакцій (3) O N N R1 O OO O S S CF3 F3C O O HO N O S F3 C R1 O (IV) 15 20 O N (II-b) Спосіб 4 Інтермедіати формули (ІV) можна отримати відомими способами реакцією інтермедіату формули (V) з придатним реагентом для розщеплення метил-етеру, як-то, наприклад, NаОН, у придатному розчиннику, як-то, наприклад, вод, при помірно підвищеній температурі, як-то, наприклад, 100 ºС. У схемі реакцій (4), усі параметри є визначеними у формулі (І). Схема реакцій (4) O N R1 N O N NaOH N O R1 HO (V) (IV) 25 30 Спосіб 5 Інтермедіати формули (V) можна отримати відомими способами реакцією комерційно доступного 4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрилу з алкілувальним агентом формули (VІ), як-то, наприклад, циклопропілметилбромід, згідно зі схемою реакцій (5). Реакцію можна проводити в інертному розчиннику, як-то, наприклад, ацетонітрил, з придатною основою, як-то, наприклад, К2СО3, та, необов’язково сіллю йоду, як-то, наприклад, КІ, при помірно підвищеній температурі, як-то, наприклад, 120 ºС. У схемі реакцій (5), усі параметри є визначеними у формулі (І) та Z – придатна відщеплювана група, як-то, наприклад, галоген, наприклад, бром. 35 Схема реакцій (5) O N NH Z R1 (VI) O N N O O (V) 8 R1 UA 99124 C2 5 10 15 Спосіб 6 Інтермедіати формули (ІІІ) можна отримати відомими способами реакцією інтермедіату формули (VІІ), де галогеном може бути хлор, бром або йод, з придатним джерелом бору, як-то, наприклад, біс(пінаколято)дибор, у присутності придатного каталізатору, як-то паладієвого каталізатору, як-то, наприклад, 1,1´-біс(дифенілфосфіно)фероценпаладій(ІІ)дихлорид, згідно зі схемою реакцій (6). Реакцію можна проводити в інертному розчиннику, як-то, наприклад, дихлорметан, у присутності придатної солі, як-то, наприклад, калію ацетат, при помірно підвищеній температурі, як-то, наприклад, 110ºС, протягом, наприклад, 16 годин. Альтернативно, інтермедіати формули (ІІІ) можна також отримати відомими способами обміну метал-галоген та наступною реакцією з прийнятним джерелом бору з інтермедіатів формули (VІІ). Далі, наприклад, реакцією інтермедіату формули (VІІ) з літійорганічною сполукою, як-то, наприклад, н-бутиллітієм, при помірно низькій температурі, як-то, наприклад, – 40 ºС, в інертному розчиннику, як-то, наприклад, ТГФ, а потім з прийнятним джерелом бору, якто, наприклад, триметоксиборан. У схемі реакцій (6), усі параметри є визначеними у формулі (І), та R 4 та R5 є визначеними тут вище. Схема реакцій (6) O O X R3 20 25 OR4 B OR5 halo X (R2)n (R2)n R3 (III) (VII) Спосіб 7 Інтермедіати формули (VІІ), де Х – NН та R3 – гідроген, де вказані інтермедіати представлені формулою (VІІ-а), можна отримати відомими способами реакцією анілінового інтермедіату формули (VІІІ-а) із тетрагідро-4Н-піран-4-оном згідно зі схемою реакцій (7). Реакцію можна проводити у присутності придатного відновнику, як-то, наприклад, натрію гідрид, в інертному розчиннику, як-то, наприклад, 1,2-дихлоретан, при помірно низькій температурі, як-то, наприклад, 25 ºС протягом, наприклад, 3 доби. У схемі реакцій (7), усі параметри є визначеними у формулі (І), а галогеном може бути хлор, бром або йод. 30 Схема реакцій (7) 35 40 Спосіб 8 Інтермедіати формули (VІІ), де Х – О та R3 – гідроген, де вказані інтермедіати представлені формулою (VІІ-b), можна отримати відомими способами реакцією фенольного інтермедіату формули (VІІІ-b) з тетрагідро-4-піранолом згідно зі схемою реакцій (8). Реакцію можна проводити у присутності фосфіну, як-то, наприклад, трифенілфосфіну, та придатного агенту сполучення для сполучень типу Міцунобу, як-то, наприклад, ди-трет-бутилазодикарбоксилат, в інертному розчиннику, як-то, наприклад, дихлорметан, при помірно низькій температурі, як-то, наприклад, 25 ºС протягом, наприклад, 2 годин. У схемі реакцій (8), усі параметри є визначеними у формулі (І), а галогеном може бути хлор, бром або йод. Схема реакцій (8) 9 UA 99124 C2 O halo halo O + HO (R2)n O O (VIII-b) 5 (R2)n (VII-b) Спосіб 9 Інтермедіати формули (VІІ) можна також отримати відомими способами з інтермедіату типу аніліну формули (ІХ) реакцією типу Сандмейера згідно зі схемою реакцій (9). У схемі реакцій (9), усі параметри є визначеними у формулі (І), а галогеном може бути хлор, бром або йод. Схема реакцій (9) 10 15 Спосіб 10 Інтермедіати формули (ІХ) можна отримати відомими способами з нітро-інтермедіату формули (Х) відновленням нітрогрупи до аміногрупи відомими способами як-то каталітичне гідрування або застосування станум(ІІ) хлориду дигідрату як відновнику, згідно зі схемою реакцій (10). У схемі реакцій (10), усі параметри є визначеними у формулі (І), а галогеном може бути хлор, бром або йод. Схема реакцій (10) O + N O X R3 NH2 O O X (R2)n R3 (R2)n (IX) (X) 20 25 30 Спосіб 11 Інтермедіати формули (Х) можна отримати відомими способами реакцією інтермедіату формули (ХІ) з придатним тетрагідропіранільним інтермедіатом формули (ХІІ), як-то, наприклад, тетрагідро-4-піранол, згідно зі схемою реакцій (11). Реакцію можна проводити у присутності придатної основи, як-то, наприклад, цезію карбонат, в інертному розчиннику, як-то, наприклад, тетрагідрофуран, при помірно підвищеній температурі, як-то, наприклад, 140 ºС, протягом, наприклад, 16 годин. У схемі реакцій (11), усі параметри є визначеними у формулі (І), а галогеном може бути хлор, бром або йод. Схема реакцій (11) Фармакологія 10 UA 99124 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки згідно з цим винаходом є позитивними алостеричними модуляторами метаботропних рецепторів глутамату, зокрема вони є позитивними алостеричними модуляторами mGluR2. Сполуки заявленого винаходу не виявляють зв’язування з сайтом розпізнавання глутамату, сайтом ортостеричного ліганду, але замість цього з алостеричним сайтом у семи-трансмембранному регіоні рецептору. У присутності глутамату або агоністу mGluR2, сполуки згідно з цим винаходом збільшення реакції mGluR2. Сполуки згідно з винаходом, як очікують, діють на mGluR2 на основі їх здатності збільшувати реакцію таких рецепторів на глутамат або агоністи mGluR2, посилюючи реакцію рецептору. Звідси, заявлений винахід стосується сполуки згідно з заявленим винаходом для застосування як медикаменту, а також до застосування сполуки згідно з винаходом або фармацевтичної композиції згідно з винаходом для виробництва медикаменту для лікування або попередження, зокрема лікування, стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема його позитивних алостеричних модуляторів. Заявлений винахід також стосується сполуки згідно з заявленим винаходом або фармацевтичної композиції згідно з винаходом для застосування у виробництві медикаменту для лікування або попередження, зокрема лікування, стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема його позитивних алостеричних модуляторів. Заявлений винахід також стосується сполуки згідно з заявленим винаходом або фармацевтичної композиції згідно з винаходом для лікування або попередження, зокрема лікування, стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема його позитивних алостеричних модуляторів. Також, заявлений винахід стосується застосування сполуки згідно з винаходом або фармацевтичної композиції згідно з винаходом для виробництва медикаменту для лікування, попередження, поліпшення, контролювання або зменшення ризику різних неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією у ссавця, у тому числі людини, лікування або попередження котрих здійснюється або полегшується нейромодуляторною дією позитивних алостеричних модуляторів mGluR2. Якщо винахід стосується застосування сполуки або композиції згідно з винаходом для виробництва медикаменту, наприклад, для лікування ссавця, зрозуміло, що таке застосування слід інтерпретувати у деяких сферах як спосіб, наприклад, лікування ссавця, що полягає у застосовуванні до ссавця при потребі такого лікування, ефективної кількості сполуки або композиції згідно з винаходом. Зокрема, неврологічні та психіатричні розлади, асоційовані з глутаматною дисфункцією, охоплюють одне або більше з нижченаведених станів або хвороб: гострі неврологічні та психіатричні розлади, як-то, наприклад, недостатність головного мозку після серцевого шунтування та трансплантування, інсульт, ішемія головного мозку, травма спинного хребта, травма голови, перинатальна гіпоксія, зупинка серця, гіпоглікемічне нейронне пошкодження, деменція (у тому числі індукована СНІД деменція), хвороба Альцгеймера, хорея Хантингтона, бічний аміотрофічний склероз, пошкодження очей, ретинопатія, когнітивні розлади, ідіопатична та індукована ліками хвороба Паркінсона, спазми м’язів та розлади, асоційовані зі спастичністю м’язів, у тому числі тремор, епілепсія, конвульсії, мігрень (у тому числі головний біль при мігрені), нетримання сечі, чутливість до речовин, синдром відвикання від речовини (у тому числі опіатів, нікотину, тютюнових продуктів, алкоголю, бензодіазепінів, кокаїну, заспокійливих, снодійних засобів тощо.), психоз, шизофренія, неспокій (у тому числі генералізований розлад з компонентом тривоги, розлад панічного типу, та обсесивно-компульсивний розлад), розлади настрою (у тому числі депресія, манія, біполярні розлади), тригемінальна невралгія, втрата слуху, дзвін у вухах, дегенерація жовтої плями, блювота, набряк головного мозку, біль (у тому числі гострий та хронічний, суворий біль, важковиліковний біль, невропатичний біль, та посттравматичний біль), пізня дискінезія, розлади сну (у тому числі нарколепсія), розлад з дефіцитом уваги/гіперактивністю та розлад поведінки. Зокрема, заявлений винахід стосується застосування сполуки формули (І) для виробництва медикаменту для лікування або попередження, зокрема для лікування, розладу центральної нервової системи, вибраного з групи: розлад з компонентом тривоги, психотичні розлади, розлади особистості, пов’язані з речовинами розлади, розлади харчування, розлади настрою, мігрень, епілепсія або конвульсивні розлади, дитячі розлади, когнітивні розлади, нейродегенерація, нейротоксичність та ішемія. Переважно, розладом центральної нервової системи є розлад з компонентом тривоги, вибраний з групи: агорафобія, генералізований розлад з компонентом тривоги (GАD), 11 UA 99124 C2 5 10 15 20 25 30 35 40 45 50 55 60 обсесивно-компульсивний розлад (ОСD), розлад панічного типу, посттравматичний стресовий розлад (РТSD), соціальна фобія та інші фобії. Переважно, розладом центральної нервової системи є психотичний розлад, вибраний з групи: шизофренія, галюцинаційний розлад, шизоафективний розлад, шизофреноподібний розлад та індукований речовинами психотичний розлад Переважно, розладом центральної нервової системи є розлад особистості, вибраний з групи: обсесивно-компульсивний розлад особистості та шизоїдний, шизоподібний розлад. Переважно, розладом центральної нервової системи є пов’язаний з речовинами розлад, вибраний з групи: зловживання алкоголем, залежність від алкоголю, алкогольна абстиненція, маячний стан при алкогольній абстиненції, індукований алкоголем психотичний розлад, залежність від амфетамінів, амфетамінова абстиненція, залежність від кокаїну, кокаїнова абстиненція, залежність від нікотину, нікотинова абстиненція, залежність від опіоїдів та опіоїдна абстиненція. Переважно, розладом центральної нервової системи є розлад харчування, вибраний з групи: нервово-психічна анорексія та нейрогенна булімія. Переважно, розладом центральної нервової системи є розлад настрою, вибраний з групи: біполярні розлади (І ТА ІІ), циклотимічний розлад, депресія, психічна депресія, глибокий депресивний розлад та індукований речовиною розлад настрою. Переважно, розладом центральної нервової системи є мігрень. Переважно, розладом центральної нервової системи є епілепсія або конвульсивний розлад, вибраний з групи: генералізована неконвульсивна епілепсія, генералізована конвульсивна епілепсія, мала епілепсія, велика епілепсія, часткова епілепсія з порушенням або без порушення притомності, дитячі спазми, епілепсія часткової продовжуваності та інші форми епілепсії. Переважно, розладом центральної нервової системи є розлад з дефіцитом уваги/гіперактивністю. Переважно, розладом центральної нервової системи є когнітивний розлад, вибраний з групи: маячний стан, індукований речовинами стійкий маячний стан, деменція, деменція внаслідок ВІЛ-хвороби, деменція внаслідок хвороби Хантингтона, деменція внаслідок хвороби Паркінсона, деменція типу Альцгеймера, індукована речовинами стійка деменція та помірне когнітивне порушення. З вищезгаданих розладів лікування неспокою, шизофренії, мігрені, депресії, та епілепсії особливо важливим. Зараз, четверте видання Dіаgnоstіс & Stаtіstісаl Маnuаl оf Меntаl Dіsоrdеrs (DSМ-ІV) від Аmеrісаn Рsусhіаtrіс Аssосіаtіоn пропонує діагностичний засіб для ідентифікації розладів, описаних тут. Спеціалісту ясно, що альтернативні номенклатури та системи класифікації для неврологічних та психіатричних розладів, описаних тут, існують та розвиваються з прогресом медицини та науки. Оскільки такі позитивні алостеричні модулятори mGluR2, у тому числі сполуки формули (І), посилюють реакцію mGluR2 на глутамат, це є перевагою, що представляє способи використання ендогенного глутамату. Оскільки позитивні алостеричні модулятори mGluR2, у тому числі сполуки формули (І), посилюють реакцію mGluR2 на агоністи, зрозуміло, що заявлений винахід стосується лікування неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією застосуванням ефективної кількості позитивного алостеричного модулятору mGluR2, у тому числі сполуки формули (І), у комбінації з агоністом mGluR2. Сполуки заявленого винаходу можна застосовувати у комбінації з одними або більше іншими ліками у лікуванні, попередженні, контролі, поліпшенні або зменшенні ризику хвороб або станів, для котрих сполуки формули (І) або інші ліки можуть мати корисність, де комбінація ліків разом є безпечною або більш ефективною, ніж ці ліки поодинці. Фармацевтичні композиції Винахід також стосується фармацевтичної композиції, що містить фармацевтично прийнятний носій або розріджувач та, як активний інгредієнт, терапевтично ефективну кількість сполуки згідно з винаходом, зокрема сполуки формули (І), у тому числі її стереохімічно ізомерної форми, або її фармацевтично прийнятної солі або сольвату. Сполуку згідно з винаходом, зокрема сполуку формули (І), у тому числі її стереохімічно ізомерні форми, або її фармацевтично прийнятні солі або сольвати, або будь-яку її підгрупу або комбінацію можна формувати у різні фармацевтичні форми для застосування. Прийнятними є усі композиції, звичайно застосовувані для систематично застосовуваних ліків. Для отримання фармацевтичних композицій згідно з цим винаходом, ефективну кількість 12 UA 99124 C2 5 10 15 20 25 30 35 40 45 50 55 60 певної сполуки, необов’язково у формі солі, як активного інгредієнту, комбінують ефективну кількість певної сполуки, необов’язково у формі солі, як активного інгредієнту, комбінують у суміш з фармацевтично прийнятним носієм або розріджувачем, котрі можуть мати багато форм залежно від форми препарату для застосування. Ці фармацевтичні композиції є бажаними в окремій дозованій формі, придатній, зокрема, для застосування перорально, ректально, підшкірно, парентеральними ін’єкціями або інгаляцією. Наприклад, при виготовленні композиції у пероральній дозованій формі, можна застосовувати будь-яке зі звичайних фармацевтичних середовищ, як-то, наприклад, вода, гліколі, олії, спирти тощо у випадку пероральних рідких препаратів, як-то, наприклад, суспензії, сиропи, еліксири, емульсії та розчини; або тверді носії, як-то, наприклад, крохмалі, цукри, каолін, розріджувачі, лубриканти, зв’язуючі, дезинтегратори тощо у випадку порошків, пілюль, капсул та таблеток. Внаслідок легкості застосування пероральне застосування є кращим, а таблетки та капсули є найпереважними пероральними формами одиничних доз, у котрих тверді фармацевтичні носії є звичайно застосовуваними. Для парентеральних композицій носій звичайно містить стерильну воду, принаймні у великій частині, хоча інші інгредієнти, наприклад, для розчинності, можна уводити. Наприклад, можна отримати придатні для ін’єкцій розчини, у котрих носій охоплює фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину та розчину глюкози. Придатні для ін’єкцій суспензії можна отримати також, у котрих можна застосовувати прийнятні рідкі носії, суспендувальні агенти тощо. Також охоплені препарати твердих форм, що є призначеними для перетворення безпосередньо перед застосуванням у препарати рідких форм. У композиціях, придатних для підшкірного застосування, носій необов’язково містить агент посилення проникності та/або придатний змочувальний агент, необов’язково комбінований з придатними добавками будь-якої природи у незначній пропорції, ці добавки не дають значного шкідливого впливу на шкіру. Вказані добавки можуть полегшувати застосування до шкіри та/або можуть бути корисними для отримання бажаних композицій. Ці композиції можна застосовувати різними шляхами, наприклад, як трансдермальний пластир та мазь. Є особливо переважним формувати вищезгадані фармацевтичні композиції в одиничні дозовані форми для легкості застосування та однаковості дозування. Одинична дозована форма, як застосовано тут, стосується фізично дискретних одиниць, придатних як окремі дози, кожна одиниця містить попередньо визначену кількість активного інгредієнту, розраховану для створення бажаної терапевтичної дії в асоціації з потрібним фармацевтичним носієм. Прикладами таких форм одиничних доз є таблетки (у тому числі надрізані чи покриті таблетки), капсули, пілюлі, пакетики порошку, облатки, супозиторії, придатні для ін’єкцій розчини або суспензії тощо, та їх розділені кратні кількості. Точне дозування та частота застосування залежить від конкретної застосовуваної сполуки формули (І), конкретного лікованого стану, суворості лікованого стану, віку, маси, статі, ступеню розладу та загального фізичного стану конкретного пацієнта, а також інших застосовуваних ліків, як добре відомо спеціалістам. Більш того, є свідоцтво, що вказана ефективна добова кількість може бути зменшеною або збільшеною залежно від реакції лікованої особи та/або залежно від оцінки лікарем сполуки згідно з цим винаходом. Залежно від режиму застосування, фармацевтична композиція містить від 0,05 – 99 мас.%, переважно від 0,1 – 70 мас.%, більше переважно від 0,1 – 50 мас.% активного інгредієнту, та, від 1 – 99,95 мас.%, переважно від 30 до 99,9 мас.%, більше переважно від 50 до 99,9 мас.% фармацевтично прийнятного носія, усі відсотки є на основі загальної маси композиції. Як вже згадано, винахід також стосується фармацевтичної композиції, що містить сполуку згідно з винаходом та одні або більше інших ліків у лікуванні, попередженні, контролі, поліпшенні або зменшенні ризику хвороб або станів, для котрих сполуки формули (І) або інші ліки можуть мати корисність, а також застосування такої композиції для виробництва медикаменту. Заявлений винахід також стосується комбінації сполуки згідно з заявленим винаходом та ортостеричного агоністу mGluR2. Заявлений винахід також стосується такої комбінації для застосування як медикаменту. Заявлений винахід також стосується продукту, що містить (а) сполуку згідно з заявленим винаходом, її фармацевтично прийнятну сіль або сольват, та (b) ортостеричний агоніст mGluR2, як комбінований препарат для одночасного, роздільного або послідовного застосування у лікуванні або попередженні стану у ссавця, у тому числі людини, лікування або попередження котрого здійснюється або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема позитивних алостеричних модуляторів mGluR2. Відмінні ліки такої комбінації або продукту можуть бути комбінованими в окремий препарат разом з фармацевтично прийнятними носіями або розріджувачами, або вони можуть бути в окремих препаратах разом з фармацевтично прийнятними носіями або розріджувачами. 13 UA 99124 C2 5 Наступні приклади є призначеними для ілюстрації, але не для обмеження рамок заявленого винаходу. Експериментальна частина Кілька способів отримання сполук згідно з цим винаходом є ілюстрованими у нижченаведених прикладах. Якщо не вказане інше, усі вихідні матеріали були отриманими від комерційних постачальників та застосовуваними без очистки. Конкретно, наступні скорочення можна застосовувати у прикладах та в описі: ДХМ ДМФ Еt2О ЕtОАс ВЕРХ РХ-МС МеОН мл хвил ммоль Рd(РРh3)4 ТГФ 10 15 Усі посилання на розсіл стосуються насиченого водного розчину NаСl. Якщо не вказане інше, усі температури є вираженими у °С. Усі реакції проводили у неінертній атмосфері при кімнатній температурі, якщо не вказане інше. Реакції з мікрохвильовим нагріванням проводили в одно-режимному мікрохвильовому реакторі ЕmrуsТМ Орtіmіzеr (Реrsоnаl Сhеmіstrу А.В., зараз Віоtаgе) або у багато-режимному мікрохвильовому реакторі МісrоSYNТН Lаbstаtіоn (Міlеstоnе, Іnс.). А. ОТРИМАННЯ ІНТЕРМЕДІАТІВ Приклад А,1 Метансульфонової кислоти 2-циклопропіл-етил естер (інтермедіат 1) O O S 20 25 (дихлорметан) (диметилформамід) (діетилетер) (етилацетат) (високоефективна рідинна хроматографія) (рідинна хроматографія-мас-спектроскопія) (метанол) (мілілітри) (хвилин) (мілімоль) (тетракіс(трифенілфосфін)паладій(0)) (тетрагідрофуран) O До розчину 2-циклопропіл-етанолу (15,1 г, 175,3 ммоль) та триетиламіну (48,6 мл, 350,6 ммоль) у дихлорметані (300 мл), при 0 ºС, додавали метансульфонілхлорид (20,35 мл, 262,9 ммоль) краплями та суміш тоді перемішували при кімнатній температурі протягом 2 годин. Додавали воду та шари відокремлювали. Органічну фазу сушили (Nа 2SО4) та випарювали у вакуумі, отримуючи сирий інтермедіат 1 (100 %), що застосовували без очистки. Приклад А,2 1-Циклопропілметил-4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 2) O N N 30 35 O До розчину 4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрилу (12,2 г, 81,48 ммоль) в ацетонітрилі (250 мл) додавали бромметил-циклопропан (11 г, 81,48 ммоль) та калію карбонат (22,48 г, 162,9 ммоль) та суміш гріли при 110 ºС протягом 24 годин. Суміш охолоджували до кімнатної температури та твердий матеріал відфільтровували. Фільтрат випарювали до сухого стану та утворений сирий залишок тоді розтирали у порошок з діетил-етером, отримуючи чистий інтермедіат 2 (15,72 г, 94%) як білий твердий матеріал. Приклад А,3 1-(2-Циклопропіл-етил)-4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 3) 40 14 UA 99124 C2 O N N O 5 10 До розчину 4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрилу (19,81 г, 131,98 ммоль) в ацетонітрилі (520 мл) додавали інтермедіат 1 (34,36 г, 171,57 ммоль) та калію карбонат (56,73 г, 410,3 ммоль) та суміш гріли при 105 ºС протягом 12 годин. Суміш охолоджували до кімнатної температури та твердий матеріал відфільтровували. Фільтрат випарювали до сухого стану. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ ЕtОАс до 20% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 3 (13,18 г, 46 %). Приклад А,4 1-Бутил-4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 4) O N N O 15 20 До розчину 4-метокси-2-оксо-1,2-дигідро-піридин-3-карбонітрилу (20 г, 133 ммоль) в ацетонітрилі (800 мл) додавали 1-бромбутан (15,8 мл, 146 ммоль) та калію карбонат (36,7 г, 266 ммоль) та суміш гріли при 110 ºС протягом 24 годин. Суміш охолоджували до кімнатної температури та твердий матеріал відфільтровували. Фільтрат випарювали до сухого стану та утворений сирий залишок тоді розтирали у порошок з діетил-етером, отримуючи чистий інтермедіат 4 (27,39 г, >99%) як білий твердий матеріал. Приклад А,5 1-Циклопропілметил-4-гідрокси-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 5) N O N HO 25 30 35 Інтермедіат 2 (15,7 г, 76,8 ммоль) додавали при кімнатній температурі до 1 Н водного розчину натрію гідроксиду (300 мл) та ТГФ (50 мл). Реакційну суміш гріли при 140 ºС (температура оливної бані) протягом 16 годин. Суміш охолоджували до кімнатної температури та ТГФ головним чином випарювали у вакуумі. Водний шар охолоджували до 0 ºС та підкислювали додаванням водної 2 Н НСl, доводили рН приблизно до 3, при цьому осаджувався білий твердий матеріал. Твердий матеріал відфільтровували, промивали Еt 2О та сушили у вакуумі, отримуючи інтермедіат 5 як білий твердий матеріал (10,44 г, 71%), що було застосовано без очистки. Приклад А,6 1-(2-Циклопропіл-етил)-4-гідрокси-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 6) N O N HO 40 Інтермедіат 3 (13,18 г, 60,4 ммоль) додавали при кімнатній температурі до 0,5 Н водного розчину натрію гідроксиду (221 мл). Реакційну суміш гріли при 110 ºС (температура оливної бані) протягом 12 годин. Суміш охолоджували до 0 ºС та підкислювали додаванням водної 2Н НСl, доводили рН приблизно до 3, при цьому осаджувався білий твердий матеріал. Твердий матеріал відфільтровували, промивали Еt2О та сушили у вакуумі, отримуючи інтермедіат 6 як білий твердий матеріал (11,24 г, 91%), що було застосовано без очистки. 15 UA 99124 C2 Приклад А,7 1-Бутил-4-гідрокси-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 7) O N N HO 5 10 15 Інтермедіат 4 (27,39 г, 133 ммоль) додавали при кімнатній температурі до 1 Н водного розчину натрію гідроксиду (500 мл) та ТГФ (100 мл). Реакційну суміш гріли при 110 ºС (температура оливної бані) протягом 24 годин. Суміш охолоджували до кімнатної температури та розчинник випарювали у вакуумі до зменшення об’єму приблизно до 250 мл. Водний шар тоді охолоджували до 0 ºС та підкислювали додаванням водної 2Н НСl, доводили рН приблизно до 3, при цьому осаджувався білий твердий матеріал. Твердий матеріал відфільтровували, промивали Еt2О та сушили у вакуумі, отримуючи інтермедіат 7 як білий твердий матеріал (25 г, 98%), що було застосовано без очистки. Приклад А,8 4-Бром-1-циклопропілметил-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 8) O N N Br 20 25 До розчину інтермедіату 5 (10,4 г, 54,67 ммоль) у ДМФ (250 мл) додавали фосфор(ІІІ) оксибромід (31,3 г, 109,3 ммоль) та суміш гріли при 110 ºС протягом 1,5 годин. Після охолодження у льодяній бані розчин розподіляли між водою та ЕtОАс. Після трьох екстракцій ЕtОАс комбіновані органічні фракції промивали розсолом, сушили над МgSО 4 та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 8 (8,83 г, 64 %). Приклад А,9 4-Бром-1-(2-циклопропіл-етил)-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 9) O N N Br 30 35 До розчину інтермедіату 6 (6,0 г, 29,37 ммоль) у ДМФ (150 мл) додавали фосфор(ІІІ) оксибромід (16,84 г, 58,75 ммоль) та суміш гріли при 110 ºС протягом 3 годин. Після охолодження у льодяній бані розчин розподіляли між водою та ЕtОАс. Після трьох екстракцій ЕtОАс комбіновані органічні фракції промивали розсолом, сушили над Nа 2SО4 та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 9 (7,0 г, 89 %). Приклад А,10 4-Бром-1-бутил-2-оксо-1,2-дигідро-піридин-3-карбонітрил (інтермедіат 10) 40 O N N Br 45 До розчину інтермедіату 7 (39 г, 203 ммоль) у ДМФ (600 мл) додавали фосфор(ІІІ) оксибромід (116 г, 406 ммоль) та суміш гріли при 110 ºС протягом 1,5 годин. Після охолодження у льодяній бані розчин розподіляли між водою та ЕtОАс. Після трьох екстракцій ЕtОАс 16 UA 99124 C2 5 комбіновані органічні фракції промивали розсолом, сушили над Nа 2SО4 та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 10 (36,7 г, 72 %). Приклад А,11 (4-Бром-2-флуор-феніл)-(тетрагідро-піран-4-іл)-амін (інтермедіат 11) O Br F N H 10 15 Суміш 4-бром-2-флуор-феніламіну (1 г, 5,26 ммоль), тетрагідро-4Н-піран-4-ону (0,73 мл, 7,89 ммоль), та натрію триацетоксиборогідриду (1,66 г, 7,89 ммоль) в 1,2-дихлоретані (50 мл) перемішували при кімнатній температурі протягом 72 годин. Суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали дихлорметаном. Комбіновані фільтрати промивали NаНСО3 (водний насичений розчин), сушили над Nа2SО4 та випарювали до сухого стану. Сирий продукт, так отриманий, очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН(NН3) до 5%). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 11 як жовту оливу (1,44 г, 100 %). Приклад А,12 (4-Бром-2-хлор-феніл)-(тетрагідро-піран-4-іл)-амін (інтермедіат 12) 20 O Br Cl N H 25 30 Суміш 4-бром-2-хлор-феніламін (4 г, 19,37 ммоль), тетрагідро-4Н-піран-4-он (2,69 мл, 29,05 ммоль), сушили молекулярними ситами 4 Å (2 г) та натрію триацетоксиборогідриду (6,12 г, 29,05 ммоль) в 1,2-дихлоретані (100 мл) перемішували при кімнатній температурі протягом 72 годин. Суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали дихлорметаном. Комбіновані фільтрати промивали NаНСО 3 (водний насичений розчин), сушили над Nа2SО4 та випарювали до сухого стану. Сирий продукт, так отриманий, очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН(NН 3) до 5%). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 12 як коричневу оливу (4,83 г, 86 %). Приклад А,13 (4-Бром-2-трифлуорметил-феніл)-(тетрагідро-піран-4-іл)-амін (інтермедіат 13) Br O N H F F F 35 40 45 Суміш 4-бром-2-трифлуорметил-феніламіну (0,88 г, 3,66 ммоль), тетрагідро-4Н-піран-4-ону (0,5 мл, 5,49 ммоль), сушили молекулярними ситами 4 Å (1 г) та натрію триацетоксиборогідриду (1,15 г, 5,49 ммоль) в 1,2-дихлоретані (30 мл) перемішували при кімнатній температурі протягом 72 годин. Суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали дихлорметаном. Комбіновані фільтрати промивали NаНСО 3 (водний насичений розчин), сушили над Nа2SО4 та випарювали до сухого стану. Сирий продукт, так отриманий, очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН(NН 3) до 5%). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 13 як жовту оливу (1,11 г, 99 %). Приклад А,14 4-(4-Бром-2-хлор-фенокси)-тетрагідро-піран (інтермедіат 14) 17 UA 99124 C2 O Cl Br O 5 10 Суміш 4-бром-2-хлор-фенолу (4 г, 19,28 ммоль), тетрагідро-4-піранолу (2,20 мл, 23,13 ммоль) та трифенілфосфіну на полімерній підкладці (17,29 г, 39,29 ммоль; від Аrgоnаut, 2,23 ммоль/г) суспендували у дихлорметані (250 мл) та тоді охолоджували до 0 ºС. Ди-трет-бутил азадикарбоксилат (6,65 г, 28,92 ммоль) додавали порціями та реакційну суміш гріли до кімнатної температури та струшували протягом 2 годин. Смолу відфільтровували та промивали дихлорметаном. Комбіновані фільтрати випарювали до сухого стану. Сирий продукт, так отриманий, очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН(NН 3) до 2%). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 14 як безбарвну оливу (5,38 г, 95 %). Приклад А,15 [2-Флуор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]-(тетрагідро-піран-4-іл)-амін (інтермедіат 15) 15 O F O B O N H 20 25 До розчину інтермедіату 11 (0,7 г, 2,55 ммоль) в 1,4-діоксані (4,5 мл) та ДМФ (0,5 мл) додавали біс(пінаколято)дибор (0,77 г, 3,06 ммоль) та калію ацетат (0,75 г, 7,65 ммоль). Суміш дегазували та тоді додавали [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,062 г, 0,07 ммоль). Реакційну суміш гріли при 150 ºС протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали ЕtОАс. Комбіновані органічні екстракти промивали розсолом, сушили над Nа2SО4, та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 15 (100%) як сирий матеріал, що було застосовано без очистки. Приклад А,16 [2-Хлор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]-(тетрагідро-піран-4-іл)-амін (інтермедіат 16) 30 O Cl O B O N H 35 40 До розчину інтермедіату 12 (2 г, 6,88 ммоль) в 1,4-діоксані (10,8 мл) та ДМФ (1,2 мл) додавали біс(пінаколято)дибор (2,09 г, 8,25 ммоль) та калію ацетат (2,02 г, 20,64 ммоль). Суміш дегазували та тоді додавали [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,16 г, 0,2 ммоль). Реакційну суміш гріли при 150 ºС протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали ЕtОАс. Комбіновані органічні екстракти промивали розсолом, сушили над Nа 2SО4, та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 16 (100%) як сирий матеріал, що було застосовано без очистки. Приклад А,17 (Тетрагідропіран-4-іл)-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-2-трифлуорметилфеніл]-амін (інтермедіат 17) 45 18 UA 99124 C2 O B O O N H F 5 10 F F До розчину інтермедіату 13 (1,11 г, 3,42 ммоль) в 1,4-діоксані (4,5 мл) та ДМФ (0,5 мл) додавали біс(пінаколято)дибор (1,04 г, 4,1 ммоль) та калію ацетат (1,00 г, 10,26 ммоль). Суміш дегазували та тоді додавали [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,083 г, 0,1 ммоль). Реакційну суміш гріли при 150 ºС протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали ЕtОАс. Комбіновані органічні екстракти промивали розсолом, сушили над Nа 2SО4, та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 17 (100%) як сирий матеріал, що було застосовано без очистки. Приклад А,18 4-[2-Хлор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-фенокси]-тетрагідро-піран (інтермедіат 18) 15 O O B Cl O O 20 25 30 До розчину інтермедіату 14 (2 г, 6,85 ммоль) в 1,4-діоксані (10,8 мл) та ДМФ (1,2 мл) додавали біс(пінаколято)дибор (2,01 г, 8,23 ммоль) та калію ацетат (2,01 г, 20,55 ммоль). Суміш дегазували та тоді додавали [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,16 г, 0,2 ммоль). Реакційну суміш гріли при 150 ºС протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали ЕtОАс. Комбіновані органічні екстракти промивали розсолом, сушили над Nа 2SО4, та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 18 (100%) як сирий матеріал, що було застосовано без очистки. В. Отримання кінцевих сполук Приклад В,1 1-Циклопропілметил-4-[3-флуор-4-(тетрагідро-піран-4-іламіно)-феніл]-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 1) N O N O F N H 35 До розчину інтермедіату 15 (0,8 г, 2,55 ммоль) в 1,4-діоксані (3 мл) та насиченому розчині Nа2СО3 (3 мл) додавали інтермедіат 8 (0,58 г, 2,31 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,26 мг, 0,23 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 ºС протягом 10 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат промивали розсолом, сушили над Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш 19 UA 99124 C2 5 тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 30% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 1 (0,241 г, 30%). Приклад В,2 1-Циклопропілметил-4-[3-хлор-4-(тетрагідро-піран-4-іламіно)-феніл]-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 2) O N N O Cl N H 10 15 До розчину інтермедіату 16 (0,57 г, 1,7 ммоль) в 1,4-діоксані (2 мл) та насиченого розчину Nа2СО3 (2 мл) додавали інтермедіат 8 (0,43 г, 1,7 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,19 мг, 0,17 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 ºС протягом 10 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат промивали розсолом, сушили над Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 30% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 2 (0,103 г, 16 %). Приклад В,3 1-Циклопропілметил-2-оксо-4-[4-(тетрагідро-піран-4-іламіно)-3-трифлуорметил-феніл]-1,2дигідро-піридин-3-карбонітрил (сполука 3) 20 O N N O N H F 25 30 F F До розчину інтермедіату 17 (0,63 г, 1,69 ммоль) в 1,4-діоксані (3 мл) та насиченого розчину Nа2СО3 (3 мл) додавали інтермедіат 8 (0,42 г, 1,69 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,19 мг, 0,17 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 ºС протягом 10 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат промивали розсолом, сушили над Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 30% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 3 (0,59 г, 9 %). Приклад В,4 4-[3-Хлор-4-(тетрагідро-піран-4-ілокси)-феніл]-1-(2-циклопропіл-етил)-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 4) N O N O O 35 Cl До розчину інтермедіату 18 (0,57 г, 1,7 ммоль) в 1,4-діоксані (2 мл) та насиченого розчину Nа2СО3 (2 мл) додавали інтермедіат 9 (0,45 г, 1,7 ммоль). Утворений розчин дегазували азотом 20 UA 99124 C2 5 та до цього додавали Рd(РРh3)4 (0,19 мг, 0,17 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 ºС протягом 10 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат промивали розсолом, сушили над Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 30% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 4 (0,108 г, 17 %). Таблиця 1 наводить сполуки формули (І), що отримували згідно з одним з вищезгаданих прикладів (Пр. №). O N 2 3 O X R3 10 4 N R1 1 6 5 R2 Таблиця 1 Сп. № Пр. № 1 --R3 --Х- В1 3-F --Н N H В2 3-Сl --Н N H 3 В3 3-СF3 --Н N H 4 В4 3-Сl --Н O 5 В4 3-Сl --Н O 6 В1 3-Сl --Н N H 7 В3 3-СF3 --Н N H 8 В1 Н --Н N H 9 В4 2-F --Н O 10 В1 2-F --Н N H 11 В1 3-F --Н N H 12 20 R2 2 15 --R1 В1 3-Сl --Н N H С. Аналітична частина Для РХ-МС-охарактеризування сполук заявленого винаходу, було застосовано нижченаведений спосіб. РХ-МС – загальний спосіб Вимір ВЕРХ проводили, застосовуючи НР 1100 від Аgіlеnt Тесhnоlоgіеs, що містить насос (з чотирьох частин або бінарний) з дегазатором, автовідбірником, термостатованою колонкою, детектором з діодною матрицею (DАD) та колонкою, як визначено у відповідних нижченаведених способах. Потік з колонки розводили до детектору МС. Детектор МС було сформовано з джерелом іонізації електророзпиленням. Азот було застосовано як газ для 21 UA 99124 C2 5 10 15 20 розпилення. Джерело температури тримали при 140 С. Збір даних проводили за допомогою програми МаssLуnх-Ореnlуnх. Спосіб 1 На додаток до загального способу: Зворотно-фазову ВЕРХ проводили на картриджі ХDВС18 (1,8 мкм, 2,1 х 30 мм) від Аgіlеnt, зі швидкістю потоку 1 мл/хвил, при 60ºС. Застосовуваними умовами градієнту є: 90 % А (0,5 г/л розчин амонію ацетату), 5 % В (ацетонітрил), 5 % С (метанол) до 50 % В та 50 % С у 6,5 хвилин, до 100 % В при 7 хвилин та урівноваження до початкових умов при 7,5 хвилин до 9,0 хвилин. Об’єм уведення 2 мкл. Мас-спектри високого розділення (час проходження, ТОF) отримували тільки у режимі позитивної іонізації скануванням від 100 до 750 у 0,5 с, застосовуючи час витримки 0,1 с. Напруга капілярної голки була 2,5 кВ та напруга конуса була 20 В. Лейцин-енкефалін був стандартною речовиною, застосовуваною для калібрування. Спосіб 2 На додаток до загального способу: Зворотно-фазову ВЕРХ проводили на колонці АСЕ-С18 (3,0 мкм, 4,6 х 30 мм) від Аdvаnсеd Сhrоmаtоgrарhу Тесhnоlоgіеs, зі швидкістю потоку 1,5 мл/хвил, при 40 ºС. Застосовуваними умовами градієнту є: 80 % А (0,5 г/л розчин амонію ацетату), 10 % В (ацетонітрил), 10 % С (метанол) до 50 % В та 50 % С у 6,5 хвилин, до 100 % В при 7 хвилин та урівноваження до початкових умов при 7,5 хвилин до 9,0 хвилин. Об’єм уведення 5 мкл. Мас-спектри високого розділення (час проходження, ТОF) отримували тільки у режимі позитивної іонізації скануванням від 100 до 750 у 0,5 с, застосовуючи час витримки 0,1 с. Напруга капілярної голки була 2,5 кВ для режиму позитивної іонізації та напруга конуса була 20 В. Лейцин-енкефалін був стандартною речовиною, застосовуваною для калібрування. Визначення точки плавлення Визначення точки плавлення проводили на приладі Меttlеr FР62. 25 Таблиця 2 Аналітичні дані (Rt означає час утримування у хвилин; + (МН) означає протоновану масу сполуки (вільна основа) Сп. № 1 2 3 4 5 6 7 8 9 10 11 12 Точка плавлення (ºС) 249,5 розкладається розкладається розкладається нв >300 нв 195 136 нв нв розкладається (МН) 368 384 418 399 401 398 432 352 371 384 384 400 + Rt (хвил) 3,56 3,81 4,17 4,26 4,58 4,20 4,44 3,64 4,04 4,22 4,21 4,48 РХ-МС спосіб 1 1 1 1 1 1 1 1 2 2 1 1 нв означає не визначено 30 35 D. Фармакологічні приклади Суміш 4-бром-2-хлор-фенолу (4 г, 19,28 ммоль), тетрагідро-4-піранолу (2,20 мл, 23,13 ммоль) та трифенілфосфіну на полімерній підкладці (17,29 г, 39,29 ммоль; від Аrgоnаut, 2,23 ммоль/г) суспендували у дихлорметані (250 мл) та тоді охолоджували до 0 ºС. Ди-трет-бутил азадикарбоксилат (6,65 г, 28,92 ммоль) додавали порціями та реакційну суміш гріли до кімнатної температури та струшували протягом 2 годин. Смолу відфільтровували та промивали дихлорметаном. Комбіновані фільтрати випарювали до сухого стану. Сирий продукт, так отриманий, очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/МеОН(NН 3) до 2%). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат 14 як безбарвну оливу (5,38 г, 95 %). Приклад А,15 [2-Флуор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]-(тетрагідро-піран-4-іл)-амін (інтермедіат 15) 22 UA 99124 C2 O O B F O N H 5 10 15 До розчину інтермедіату 11 (0,7 г, 2,55 ммоль) в 1,4-діоксані (4,5 мл) та ДМФ (0,5 мл) додавали біс(пінаколято)дибор (0,77 г, 3,06 ммоль) та калію ацетат (0,75 г, 7,65 ммоль). Суміш дегазували та тоді додавали [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,062 г, 0,07 ммоль). Реакційну суміш гріли при 150 ºС протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали ЕtОАс. Комбіновані органічні екстракти промивали розсолом, сушили над Nа 2SО4, та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 15 (100%) як сирий матеріал, що було застосовано без очистки. Приклад А,16 [2-Хлор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]-(тетрагідро-піран-4-іл)-амін (інтермедіат 16) O O B Cl O N H 20 25 30 До розчину інтермедіату 12 (2 г, 6,88 ммоль) в 1,4-діоксані (10,8 мл) та ДМФ (1,2 мл) додавали біс(пінаколято)дибор (2,09 г, 8,25 ммоль) та калію ацетат (2,02 г, 20,64 ммоль). Суміш дегазували та тоді додавали [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,16 г, 0,2 ммоль). Реакційну суміш гріли при 150 ºС протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали ЕtОАс. Комбіновані органічні екстракти промивали розсолом, сушили над Nа 2SО4, та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 16 (100%) як сирий матеріал, що було застосовано без очистки. Приклад А,17 (Тетрагідропіран-4-іл)-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-2-трифлуорметилфеніл]-амін (інтермедіат 17) O B O O N H F 35 40 F F До розчину інтермедіату 13 (1,11 г, 3,42 ммоль) в 1,4-діоксані (4,5 мл) та ДМФ (0,5 мл) додавали біс(пінаколято)дибор (1,04 г, 4,1 ммоль) та калію ацетат (1,00 г, 10,26 ммоль). Суміш дегазували та тоді додавали [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,083 г, 0,1 ммоль). Реакційну суміш гріли при 150 ºС протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали ЕtОАс. Комбіновані органічні екстракти промивали розсолом, сушили над Nа 2SО4, та розчинник випарювали у 23 UA 99124 C2 5 вакуумі, отримуючи бажаний боронатний інтермедіат 17 (100%) як сирий матеріал, що було застосовано без очистки. Приклад А,18 4-[2-Хлор-4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-фенокси]-тетрагідро-піран (інтермедіат 18) O O B Cl O O 10 15 20 До розчину інтермедіату 14 (2 г, 6,85 ммоль) в 1,4-діоксані (10,8 мл) та ДМФ (1,2 мл) додавали біс(пінаколято)дибор (2,01 г, 8,23 ммоль) та калію ацетат (2,01 г, 20,55 ммоль). Суміш дегазували та тоді додавали [1,1’-біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ); комплекс з ДХМ (1:1) (0,16 г, 0,2 ммоль). Реакційну суміш гріли при 150 ºС протягом 10 хвилин мікрохвильовим опроміненням. Після охолодження до кімнатної температури суміш фільтрували через шар діатомової землі. Шар діатомової землі промивали ЕtОАс. Комбіновані органічні екстракти промивали розсолом, сушили над Nа2SО4, та розчинник випарювали у вакуумі, отримуючи бажаний боронатний інтермедіат 18 (100%) як сирий матеріал, що було застосовано без очистки. В. Отримання кінцевих сполук Приклад В,1 1-Циклопропілметил-4-[3-флуор-4-(тетрагідро-піран-4-іламіно)-феніл]-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 1) N O N O F N H 25 30 35 До розчину інтермедіату 15 (0,8 г, 2,55 ммоль) в 1,4-діоксані (3 мл) та насиченому розчині Nа2СО3 (3 мл) додавали інтермедіат 8 (0,58 г, 2,31 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,26 мг, 0,23 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 ºС протягом 10 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат промивали розсолом, сушили над Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 30% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 1 (0,241 г, 30%). Приклад В,2 1-Циклопропілметил-4-[3-хлор-4-(тетрагідро-піран-4-іламіно)-феніл]-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 2) N O N O Cl N H 40 До розчину інтермедіату 16 (0,57 г, 1,7 ммоль) в 1,4-діоксані (2 мл) та насиченого розчину Nа2СО3 (2 мл) додавали інтермедіат 8 (0,43 г, 1,7 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,19 мг, 0,17 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 ºС протягом 10 хвилин. Утворену охолоджену 24 UA 99124 C2 5 реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат промивали розсолом, сушили над Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 30% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 2 (0,103 г, 16 %). Приклад В,3 1-Циклопропілметил-2-оксо-4-[4-(тетрагідро-піран-4-іламіно)-3-трифлуорметил-феніл]-1,2дигідро-піридин-3-карбонітрил (сполука 3) O N N O N H F F F 10 15 20 До розчину інтермедіату 17 (0,63 г, 1,69 ммоль) в 1,4-діоксані (3 мл) та насиченого розчину Nа2СО3 (3 мл) додавали інтермедіат 8 (0,42 г, 1,69 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,19 мг, 0,17 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 ºС протягом 10 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат промивали розсолом, сушили над Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 30% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 3 (0,59 г, 9 %). Приклад В,4 4-[3-Хлор-4-(тетрагідро-піран-4-ілокси)-феніл]-1-(2-циклопропіл-етил)-2-оксо-1,2-дигідропіридин-3-карбонітрил (сполука 4) N O N O O Cl 25 30 До розчину інтермедіату 18 (0,57 г, 1,7 ммоль) в 1,4-діоксані (2 мл) та насиченого розчину Nа2СО3 (2 мл) додавали інтермедіат 9 (0,45 г, 1,7 ммоль). Утворений розчин дегазували азотом та до цього додавали Рd(РРh3)4 (0,19 мг, 0,17 ммоль). Реакційну суміш тоді гріли у мікрохвильовій шафі у герметичній тубі при 150 ºС протягом 10 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат промивали розсолом, сушили над Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ до ДХМ/ЕtОАс до 30% як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку 4 (0,108 г, 17 %). Таблиця 1 наводить сполуки формули (І), що отримували згідно з одним з вищезгаданих прикладів (Пр. №). 35 25 UA 99124 C2 O N 2 3 O X R3 4 N R1 1 6 5 R2 Таблиця 1 Сп. № Пр. № 1 В1 3-F --Н N H В2 3-Сl --Н N H В3 3-СF3 --Н N H В4 3-Сl --Н O 5 В4 3-Сl --Н O 6 В1 3-Сl --Н N H 7 В3 3-СF3 --Н N H 8 В1 Н --Н N H 9 В4 2-F --Н O 10 В1 2-F --Н N H 11 В1 3-F --Н N H 12 20 --Х- 4 15 --R3 3 10 R2 2 5 --R1 В1 3-Сl --Н N H С. Аналітична частина Для РХ-МС-охарактеризування сполук заявленого винаходу, було застосовано нижченаведений спосіб. РХ-МС – загальний спосіб Вимір ВЕРХ проводили, застосовуючи НР 1100 від Аgіlеnt Тесhnоlоgіеs, що містить насос (з чотирьох частин або бінарний) з дегазатором, автовідбірником, термостатованою колонкою, детектором з діодною матрицею (DАD) та колонкою, як визначено у відповідних нижченаведених способах. Потік з колонки розводили до детектору МС. Детектор МС було сформовано з джерелом іонізації електророзпиленням. Азот було застосовано як газ для розпилення. Джерело температури тримали при 140 С. Збір даних проводили за допомогою програми МаssLуnх-Ореnlуnх. Спосіб 1 На додаток до загального способу: Зворотно-фазову ВЕРХ проводили на картриджі ХDВС18 (1,8 мкм, 2,1 х 30 мм) від Аgіlеnt, зі швидкістю потоку 1 мл/хвил, при 60ºС. Застосовуваними умовами градієнту є: 90 % А (0,5 г/л розчин амонію ацетату), 5 % В (ацетонітрил), 5 % С (метанол) до 50 % В та 50 % С у 6,5 хвилин, до 100 % В при 7 хвилин та урівноваження до початкових умов при 7,5 хвилин до 9,0 хвилин. Об’єм уведення 2 мкл. Мас-спектри високого розділення (час проходження, ТОF) отримували тільки у режимі позитивної іонізації 26 UA 99124 C2 5 10 15 скануванням від 100 до 750 у 0,5 с, застосовуючи час витримки 0,1 с. Напруга капілярної голки була 2,5 кВ та напруга конуса була 20 В. Лейцин-енкефалін був стандартною речовиною, застосовуваною для калібрування. Спосіб 2 На додаток до загального способу: Зворотно-фазову ВЕРХ проводили на колонці АСЕ-С18 (3,0 мкм, 4,6 х 30 мм) від Аdvаnсеd Сhrоmаtоgrарhу Тесhnоlоgіеs, зі швидкістю потоку 1,5 мл/хвил, при 40 ºС. Застосовуваними умовами градієнту є: 80 % А (0,5 г/л розчин амонію ацетату), 10 % В (ацетонітрил), 10 % С (метанол) до 50 % В та 50 % С у 6,5 хвилин, до 100 % В при 7 хвилин та урівноваження до початкових умов при 7,5 хвилин до 9,0 хвилин. Об’єм уведення 5 мкл. Мас-спектри високого розділення (час проходження, ТОF) отримували тільки у режимі позитивної іонізації скануванням від 100 до 750 у 0,5 с, застосовуючи час витримки 0,1 с. Напруга капілярної голки була 2,5 кВ для режиму позитивної іонізації та напруга конуса була 20 В. Лейцин-енкефалін був стандартною речовиною, застосовуваною для калібрування. Визначення точки плавлення Визначення точки плавлення проводили на приладі Меttlеr FР62. Таблиця 2 Аналітичні дані (Rt означає час утримування у хвилин; + (МН) означає протоновану масу сполуки (вільна основа) Сп. № Точка плавлення (ºС) 1 249,5 2 розкладається 3 розкладається 4 розкладається 5 нв 6 >300 7 нв 8 195 9 136 10 нв 11 нв 12 розкладається нв означає не визначено 20 25 30 35 40 (МН) 368 384 418 399 401 398 432 352 371 384 384 400 + Rt (хвил) 3,56 3,81 4,17 4,26 4,58 4,20 4,44 3,64 4,04 4,22 4,21 4,48 РХ-МС спосіб 1 1 1 1 1 1 1 1 2 2 1 1 D. Фармакологічні приклади Сполуки, запропоновані у заявленому винаході є позитивними алостеричними модуляторами mGluR2. Ці сполуки потенціюють реакції глутамату зв’язуванням з алостеричним сайтом іншим, ніж сайт зв’язуванням глутамату. Реакція mGluR2 на концентрацію глутамату є збільшеною, коли є представленими сполуки формули (І). Сполуки формули (І), як припускають, мають по суті вплив на mGluR2 на основі їх здатності посилювати функцію рецептору. Поведінка позитивних алостеричних модуляторів, тестованих стосовно mGluR2, застосовуючи 35 аналіз зв’язування [ S]GТРγS описаний нижче, котрі є придатними для ідентифікації таких сполук, а більш конкретно сполук формули (І), є показаною у таблиці 3. 35 Аналіз зв’язування [ S]GТРγS 35 Аналіз зв’язування [ S]GТРγS є функціональним аналізом на основі мембран, застосовуваним до дослідження функції сполученого з G-білком рецептору (GРСR), за 35 допомогою чого вимірюють уведення негідролізовуваної форми GТР, [ S]GТРγS (гуанозин 35 5’-трифосфат, мічений гамма-емітуючим S),. Субодиниця G-білку γ каталізує обмін гуанозин 35 5’-дифосфату (GDР) гуанозин трифосфатом (GТР) та активацію GРСR агоністом, [ S]GТРγS, стає уведеним та не може бути розщепленим для продовження циклу обміну (Наrреr (1998) Сurrеnt Рrоtосоls іn Рhаrmасоlоgу 2,6,1-10, Jоhn Wіlеу & Sоns, Іnс.). Кількість уведення 35 радіоактивного [ S]GТРγS є прямим виміром активності G-білку та звідси можна визначати активність агоністу. Рецептори mGluR2, як показано, преференційно сполучаються з Gγі-білком, кращим сполученням для цього способу, та звідси він є широко застосовуваним для дослідження активації рецепторів mGluR2 у лініях рекомбінантних клітин та тканинах (Sсhаffhаusеr еt аl 2003, Ріnkеrtоn еt аl, 2004, Мutеl еt аl (1998) Jоurnаl Nеurосhеmіstrу. 71:2558-64; Sсhаffhаusеr еt аl (1998) Моlесulаr Рhаrmасоlоgу 53:228-33). Тут ми описуємо 27 UA 99124 C2 35 5 10 15 20 25 30 35 40 45 50 застосування аналізу зв’язування [ S]GТРγS, застосовуючи мембрани від клітин, трансфектованих рецептором людини mGluR2 та адаптованих згідно з Sсhаffhаusеr еt аl ((2003) Моlесulаr Рhаrmасоlоgу 4:798-810) для визначення властивостей сполук згідно з цим винаходом стосовно позитивної алостеричної модуляції (РАМ). Отримання мембран СНО-клітини культивували не до злиття та стимулювали 5 мМ бутиратом протягом 24 годин, перед промиванням буферованим фосфатом фізіологічним розчином, та тоді збиранням вискоблюванням у гомогенізаційному буфері (50 мМ Трис-НСl буфер, рН 7,4, 4°С). Лізати клітин швидко гомогенізували (15 с), застосовуючи гомогенізатор ultrа-turrах. Гомогенат центрифугували при 23 500 х g протягом 10 хвилин та супернатант викидали. Гранулу ресуспендували у 5 мМ Трис-НСl, рН 7,4 та центрифугували знов (30 000 х g, 20 хвил, 4°С). Кінцеву гранулу ресуспендували у 50 мМ ГЕПЕС, рН 7,4 та зберігали при -80°С у прийнятних аліквотах перед застосування. Концентрацію білку визначали способом Бредфорда (Віо-Rаd, USА) з альбуміном бичачої сироватки як стандартом. 35 Аналіз зв’язування [ S]GТРγS Вимір позитивної алостеричної модуляторної активності mGluR2 тест-сполук у мембранах, що містять mGluR2 людини, проводили, застосовуючи заморожені мембрани, що розморожували та швидко гомогенізували перед попередньою інкубацією у 96-лункових мікропланшетах (15 мкг/лунку, 30 хвилин, 30°С) у буфері для аналізу (50 мМ ГЕПЕС рН 7,4, 100 мМ NаСl, 3 мМ МgСl2, 50 мкМ GDР, 10 мкг/мл сапоніну) зі збільшуваними концентраціями позитивного алостеричного модулятору (від 0,3 нМ до 50 мкМ) та мінімальною попередньо визначеною концентрацією глутамату (РАМ-аналіз), або без доданого глутамату. Для РАМаналізу, мембрани попередньо інкубували з глутаматом при ЕК25 концентрації, тобто концентрації, що дає 25 % максимальної реакції на глутамат, та є у згоді з опублікованими 35 даними (Ріn еt аl. (1999) Еur. J. Рhаrmасоl. 375:277-294). Після додавання [ S]GТРγS (0,1 нМ) до загального об’єму реакційної суміші 200 мкл, мікропланшети швидко струшували та далі 35 інкубували для уведення [ S]GТРγS при активації (30 хвилин, 30 °С). Реакцію припиняли швидким вакуумним фільтрування через скляні фільтр-планшети (96-лункові фільтр-планшети GF/В Unіfіltеr, Реrkіn-Еlmеr, Dоwnеrs Grоvе, USА) мікропланшет, застосовуючи збирач клітин 96лункового фільтр-планшету (Fіltеrmаtе, Реrkіn-Еlmеr, USА), та тоді промиванням три рази 300 мкл охолодженого льодом промивного буферу (Nа2РО4,2Н20 10 мМ, NаН2РО4.Н20 10 мМ, рН = 7,4). Фільтри тоді сушили на повітрі, та 40 мкл сцинтиляційної рідини (Місrоsсіnt-О) додавали до 35 кожної лунки, та зв’язаний з мембранами [ S]GТРγS вимірювали у зчитувачі сцинтиляції 96лункового фільтр-планшету (Тор-Соunt, Реrkіn-Еlmеr, USА). Неспецифічне зв’язування 35 [ S]GТРγS визначають у присутності холодного 10 мкМ GТР. Кожну криву створювали принаймні один раз, застосовуючи дублікатний зразок на точку даних та при 11 концентраціях. Дані аналізу Криві концентрація-реакція репрезентативних сполук заявленого винаходу у присутності доданої ЕК25 агоністу глутамату mGluR2 для визначення позитивної алостеричної модуляції (РАМ), створювали, застосовуючи програму Рrіsm GrарhРаd (Grарh Раd Іnс, Sаn Dіеgо, USА). Криві підганяли за чотирьох-параметричним логістичним рівнянням (Y=Нижня межа + (Верхня-нижня межа)/(1+10^((LоgЕК50-Х)*коефіцієнт Хілла), визначаючи величини ЕК50. ЕК50 є концентрацією сполуки, що викликає половину максимального потенціювання реакції глутамату. Це розраховують відніманням максимальних реакцій глутамату у присутності повністю насичувальної концентрації позитивного алостеричного модулятору від реакції глутамату у відсутності позитивного алостеричного модулятору. Концентрації, що створюють половину максимальної дії, тоді розраховують як ЕК 50. Таблиця 3. Фармакологічні дані для сполуки згідно з винаходом. Усі сполуки тестували у присутності агоністу глутамату mGluR2 при попередньо визначеній концентрації ЕК25 для визначення позитивної алостеричної модуляції (GТРγS-РАМ). Показані величини є середніми від подвійних величин для 11-концентрацій, принаймні з одного експерименту. Усі тестовані сполуки показували величину рЕК 50 (-lоgЕК50) більше, ніж 5,0. Похибка визначення величини рЕК50 для окремого експерименту є оціненою як приблизно 0,3 lоg-одиниці. 55 28
ДивитисяДодаткова інформація
Назва патенту англійською3-cyano-4-(4-tetrahydropyran-phenyl)-pyridin-2-one derivatives
Автори англійськоюCid-Nunez, Jose, Maria, Trabanco-Suarez, Andres, Avelino, Macdonald, Gregor, James, Duvey, Guillaume, Albert, Jacques
Назва патенту російськоюПроизводные 3-циано-4-(4-тетрагидропиранфенил)пиридин-2-она
Автори російськоюСид-Нюнез Хосе Мария, Трабанко-Суарез Андрес Авелино, Макдональд Грегор Джеймс, Дюве Гийом Альбер Якьюэс
МПК / Мітки
МПК: A61P 25/28, C07D 405/12, A61K 31/4545
Мітки: 3-ціано-4-(4-тетрагідропіранфеніл)піридин-2-ону, похідні
Код посилання
<a href="https://ua.patents.su/35-99124-pokhidni-3-ciano-4-4-tetragidropiranfenilpiridin-2-onu.html" target="_blank" rel="follow" title="База патентів України">Похідні 3-ціано-4-(4-тетрагідропіранфеніл)піридин-2-ону</a>












