Заміщені (6-ацетил-8-ціано-5-метил-3-оксо-7-арил-2,3-дигідро-7н-тіазоло[3,2-а]піридин-2-іл)оцтові кислоти і спосіб їх одержання
Номер патенту: 96107
Опубліковано: 26.09.2011
Автори: Чебанов Валентин Анатолійович, Андрющенко Анастасія Юріївна, Збруєв Олександр Ігоревич, Афанасіаді Людмила Михайлівна
Формула / Реферат
1. Заміщені (6-ацетил-8-ціано-5-метил-3-оксо-7-арил-2,3-дигідро-7H-тіазоло[3,2-а]піридин-2-іл)оцтові кислоти загальної формули
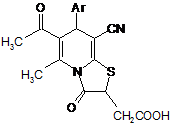 ,
,
де Аr = C6H5, 4-NO2-C6H4, 4-Cl-C6H4, 4-CH3-C6H4, 4-CH3O-C6H4.
2. Спосіб одержання заміщених (6-ацетил-8-ціано-5-метил-3-оксо-7-арил-2,3-дигідро-7H-тіазоло[3,2-а]піридин-2-іл)оцтових кислот загальної формули
 ,
,
де Аr = C6H5, 4-NO2-C6H4, 4-Cl-C6H4, 4-CH3-C6H4, 4-CH3O-C6H4,
який відрізняється тим, що конденсують рівномолярні кількості ацетилацетону з ціанотіоацетамідом і ароматичним альдегідом формули АrСНО в органічному розчиннику - етанолі, у присутності каталізатора - морфоліну, при кімнатній температурі протягом 2,5-3 годин, виділяють продукт 10 % соляною кислотою і одержаний піридинтіон кип'ятять з малеїновим ангідридом у льодяній оцтовій кислоті упродовж 4-5 годин до утворення цільового продукту, який перекристалізовують із суміші гептан-дихлоретан у співвідношенні 2:1.
Текст
1. Заміщені (6-ацетил-8-ціано-5-метил-3-оксо7-арил-2,3-дигідро-7H-тіазоло[3,2-а]піридин-2іл)оцтові кислоти загальної формули 2 Винахід стосується галузі органічної хімії, а саме заміщених (6-ацетил-8-ціано-5-метил-3-оксо7-арил-2,3-дигідро-7H-тіазоло[3,2-]піридин-2-іл) оцтових кислот загальної формули І і способу їх одержання. 3 O 96107 Спосіб одержання відомого аналога формули II складається із 2-х стадій і здійснюється за схемою: Ar CN H3C H3C N O 4 S NHAr H3C CH2COOH ,І де Аr = C6H5, 4-NO2-C6H4, 4-Cl-C6H4, 4-CH3C6H4, 4-CH3O-C6H4. Складні гетероциклічні сполуки, що містять у своєму складі тіазольний та піридиновий фрагмент, привертають увагу хіміків-синтетиків. Наявність двох фармакофорних фрагментів обумовлює перспективність пошуку і розробки доступних і простих способів одержання сполук формули І речовин з різними видами біологічної активності, що визначає корисність з точки зору фармакологічної і медичної хімії. Так, тіазольний фрагмент входить як складова частина у вітамін В1 (тіамін), який призначають при порушеннях функцій нервової системи. У вигляді тіаміну пірофосфату (кокарбоксилази) він бере участь у важливих процесах метаболізму, використовується при лікуванні цукрового діабету, склерозу, для нормалізації серцевого ритму. Відомий структурний аналог сполук формули І, що заявляються, - 2-ацетоніліден-3-арил-5карбоксиметилтіазолідин-4-он загальної формули II CH2COOH II. На думку авторів, на першій стадії реакції, імовірно, ацілюється амідна група ариламідів ацетилтіооцтової кислоти, а потім ациламід на другій стадії циклізується в 2-ацетоніліден-3-арил-5карбоксиметил-тіазолідин-4-он формули II. До розплаву ариламіду ацетилтіооцтової кислоти додають еквімолярну кількість малеїнового ангідриду. Розплавлену суміш нагрівають при 93103 °С упродовж 1 години. Одержані при охолоджені тіазолідини перекристалізовують із спирту. Виходи кінцевих продуктів складають 50-62 %. Недоліком способу одержання відомого аналога формули II є проведення синтезу у розплавленому стані, що забруднює кінцевий продукт побічними речовинами (особливо при наявності електроноакцепторних замісників) і значно знижує виходи цільових продуктів. Відомий структурний аналог сполук формули І, що заявляються, - 6-ацетил-5-метил-7-феніл2,3,4,7-тетрагідротіазоло[3,2-]піридин-8карбонітрил формули III C6H5 H3C H3C III і спосіб його одержання [Дяченко В.Д. // Ж. орган. химии. - 2006, 42, вып. 5. - С. 741-750]. Недоліком структури відомого аналога формули III є обмежена можливість модифікації сполуки, що не дозволяє одержувати великий асортимент гетероциклічних сполук для біології і медицини. Спосіб одержання відомого аналога формули III складається із 2-х стадій і здійснюється за схемою: CH2COOH , ІІ де Аr = C6H5, 4-Cl-C6H4, 4-CH3-C6H4, 4-CH3OC6H4, і спосіб їх одержання [Борисевич А.Н., Пелькис П.С. Химия гетероцикл. соедин. - 1971, №7. С. 1001-1002]. Структура сполук формули II містить один фармакофорний фрагмент - тіазолідиноновий, що обмежує можливості модифікації відомої структури і одержання широкого набору потенційних біологічно активних речовин і нових хімічних сполук з різними корисними властивостями. CNCH2CSNH2 C6H5 H2N EtOH H3C C CH2 NH2 C CH3 Br-CH2-CH2-Br На першій стадії суміш рівномолярних кількостей феніліденмалононітрилу, ціанотіоацетаміду і 0,1-0,2 мл піперидину в етанолі перемішують при 25 °С 3-4 години. Осад відфільтровують, проми CH3 , 3 h H3 C H2N NH2 BuOH H3C III . вають етанолом і гексаном, перекристалізовують із нітрометану і одержують чистий 4-феніл-2,6діаміно-3,5-діціано-4Н-тіопіран з кількісним виходом і т.пл. 181-183 °С. 5 96107 На другій стадії рівномолярні кількості одержаного тіопірану, ацетилацетону і Nметилморфоліну у бутанолі кип'ятять 3 години. Після охолодження реакційної суміші додають при перемішуванні 1,2-диброметан і залишають на 24 години, після чого розбавляють рівним об'ємом води. Осад промивають водою, етанолом і гексаном. Одержують 6-ацетил-5-метил-7феніл-2,3,4,7-тетрагідротіазоло[3,2-]піридин-8карбонітрил з т.пл. 182-184 °С і виходом 72 % після перекристалізації із ацетонїтрилу. Загальний час синтезу складає 27-30 годин. Недоліком способу одержання відомого аналога формули III є тривалість технологічного процесу, необхідність очистки продуктів на кожній стадії, використання для перекристалізації вогнеі вибухонебезпечного розчинника - нітрометану, і токсичного ацетонітрилу. В процесі синтезу також спостерігається виділення агресивного газу - броміду водню, який спричиняє алергічні реакції і потребує утилізації. Відомий структурний аналог сполук формули І, що заявляються - 5-метил-3-оксо-7-(4 6 хлорфеніл)-8-ціано-6-етоксикарбоніл-2,3,4,7тетрагідротіазоло[3,2-]піридин формули IV C2H5O IV і спосіб його одержання [Краузе А., Дубурс Г. Химия гетероцикл. соедин. - 1996, № 8. - С. 11341135]. Недоліком структури відомого аналога формули IV є обмежена можливість одержання нових хімічних сполук за участі нітрильної групи у піридиновому фрагменті. Спосіб одержання сполуки формули IV складається з двох стадій і реалізується за схемою: CH3COOH C2H5O NH2 EtOH C2H5O C2H5O H3C H3C H3C IV На першій стадії етиловий ефір 4-(4хлорфеніл)-5-ціано-6-меркапто-2-метил-1,4дигідропіридин-3-карбонової кислоти алкілують карбамоїлметилйодидом в етанолі у присутності каталізатора - піперидину. Реакційну суміш нагрівають 0,08 години при температурі кипіння розчинника на водяній бані і додають 2 мл 3М НСl в етанолі. При охолодженні одержують етиловий ефір 6-карбамоїлметилсульфаніл-4-(4хлорфеніл)-5-ціано-2-метил-1,4-дигідропіридин-3карбонової кислоти з температурою плавлення 193-195 °С і виходом 72 %. На другій стадії одержаний продукт кип'ятять в оцтовій кислоті упродовж 8 годин, охолоджують, промивають водою, сушать. Вихід 5-метил3-оксо-7-(4-хлорфеніл)-8-ціано-6-етоксикарбоніл2,3,4,7-тетрагідротіазоло[3,2-]піридину складає 25 %. Т.пл. 154-156 °С. Загальний час синтезу 910 годин. Недоліком способу одержання відомого аналога формули IV є низький вихід кінцевого продукту, що обмежує його використання для одержання речовин відомої структури навіть у лабораторних умовах. В основу винаходу поставлено задачу пошуку нової структури сполук у низці заміщених тіазолопіридинілоцтових кислот з широкою варіацією замісників у всіх фрагментах молекули, а також . розробки доступного способу їх одержання, який дозволяє підвищити вихід і якість цільових продуктів. Рішення поставленої задачі забезпечується розробкою заміщених (6-ацетил-8-ціано-5-метил3-оксо-7-арил-2,3-дигідро-7Н-тіазоло[3,2]піридин-2-іл)оцтових кислот - сполук формули І Ar O CN H3C H3C N O S CH2COOH ,І де Аr=C6H5, 4-NO2-C6H4, 4-Cl-C6H4, 4-CH3C6H4, 4-CH3O-C6H4. Рішення поставленої задачі забезпечується також тим, що в способі одержання заміщених (6ацетил-8-ціано-5-метил-3-оксо-7-арил-2,3дигідро-7H-тіазоло[3,2-]піридин-2-іл)оцтових кислот загальної формули І 7 O 96107 Ar CN H3C H3C N O S CH2COOH ,І де Аr=C6H5, 4-NO2-C6H4, 4-Cl-C6H4, 4-CH3C6H4, 4-CH3O-C6H4, згідно з винаходом, конденсують рівномолярні кількості ацетилацетону з ціанотіоацетамідом і ароматичним альдегідом формули АrСНО в органічному розчиннику - етанолі, у присутності каталізатора - морфоліну, при кімнатній температурі протягом 2,5-3 годин, виділяють продукт 10 % соляною кислотою і одержаний піридинтіон кип'ятять з малеїновим ангідридом у льодяній оцтовій кислоті упродовж 4-5 годин до утворення цільового продукту, який перекристалізовують із суміші гептан-дихлоретан у співвідношенні 2:1. Вибір як компонентів реакції конденсації ароматичних альдегідів, малеїнового ангідриду, каталізатора - морфоліну, органічного розчинника - льодяної оцтової кислоти, дозволяє здійснити синтез у 2 стадії: першу стадію - при кімнатній температурі в етанолі протягом 2,5-3 годин, другу стадію - при кип'ятінні у льодяній оцтовій кислоті упродовж 4-5 годин. Варіювання компонентів реагуючої суміші, їх мольні співвідношення, каталізатор основного характеру, середовище для проведення процесу утворення цільових продуктів - все це виявляється на чистоті кінцевих речовин, після перекристалізації із суміші гептан-дихлоретан. Тіазолопіридинілоцтові кислоти, одержані за способом, що заявляється, достатньо чисті, що підтверджуєть1 ся даними Н ЯМР спектроскопії. Експериментально було встановлено, що для одержання чистого продукту з максимальним HCl 8 виходом оптимальною є перекристалізація сполук формули І із суміші гептан-дихлоретан у співвідношенні 2:1. Легкість протікання реакції і ступінь перетворення вихідних продуктів у кінцеві визначається часом здійснення технологічного процесу: 2,5-3 години на першій стадії реакції і 4-5 годин на другій стадії. Загальний час реакції складає 6,5-8 годин. Реакція за цей часовий період проходить повністю з високими виходами 53-87 %. В залежності від замісників в арильному радикалі, зв'язаному з піридиновим фрагментом, спосіб, що заявляється, дозволяє широко модифікувати хімічну структуру цільових продуктів і одержувати великий набір заміщених тіазолопіридинілоцтових кислот. Цьому сприяє і нітрильна група у положенні 8 піридинового фрагменту. Крім того, завдяки наявності вільної карбоксильної групи ці сполуки необхідні при рішенні низки практичних задач у препаративному органічному синтезі, наприклад у синтезі хлорангідридів, амідів, ефірів, амінів, що відкриває можливості одержання нових похідних тіазолопіридинілоцтових кислот з модифікованою структурою - потенційних біологічно активних речовин. Наявність полярної функціональної карбоксильної групи приводить не тільки до підвищення розчинності в органічних розчинниках, у тому числі і неполярних (гексан, гептан), але і у лужних розчинах. Так, тіазолопіридинілоцтові кислоти, одержані за способом, що заявляється, у лужних середовищах утворюють водорозчинні натрієві або калієві солі. Ця властивість може бути використана при проведенні біологічних тестів у водних середовищах. У таблиці дано порівняльні характеристики способу, що заявляється, і способів одержання структурних аналогів II, III, IV. Спосіб, що заявляється, здійснюється за схемою: CH3COOH C2H5OH H2N Суміш, що складається з 10 ммоль ароматичного альдегіду, 10 ммоль ацетилацетону, 10 ммоль ціанотіоацетаміду і 15 ммоль морфоліну у 15 мл етанолу, перемішують при кімнатній температурі протягом 2,5-3 годин, після чого підкислюють 10 % розчином соляної кислоти до pH 5. Осад, що випадає, відфільтровують, промивають етанолом і гексаном. Потім 5 ммоль одержаного 4-арил-5-ацетил6-метил-3-ціано-3,4-дигідропіридин-2(1Н)-тіону і 5 ммоль малеїнового ангідриду кип'ятять в 10 мл льодяної оцтової кислоти протягом 4-5 годин до утворення цільового продукту, який перекристалізовують із суміші гептан-дихлоретан у співвід . ношенні 2:1. Загальна тривалість синтезу складає приблизно 6,5-8 годин. Нижче наведено приклади конкретного виконання. Приклад 1. Одержання (6-ацетил-8-ціано-5метил-3-оксо-7-феніл-2,3-дигідро-7H-тіазоло[3,2]піридин-2-іл)оцтової кислоти Суміш, що складається із 1,06 г бензальдегіду, 1 г ацетилацетону, 1 г ціанотіоацетаміду і 1,3 г морфоліну у 15 мл етанолу, перемішують при температурі 20 °С протягом 2,5 годин, після чого підкислюють 10 % розчином соляної кислоти до pH 5. Осад відфільтровують, промивають етанолом і гексаном. 9 96107 Реакційну масу, що складається із 1,3 г 4феніл-5-ацетил-6-метил-3-ціано-3,4дигідропіридин-2(1Н)-тіону, одержаного на першій стадії, і 0,5 г малеїнового ангідриду кип'ятять у 10 мл льодяної оцтової кислоти упродовж 4 годин. Охолоджують, осад відфільтровують і перекристалізовують із суміші гептан-дихлоретан (2:1). Т.пл. 184-187 °С, вихід 1,6 г (87 %). 1 Спектр Н ЯМР (DMSO-D6): 2,02 (с) і 2,08 (с) (3Н, С(6)-СН3), 2,33 (с) і 2,39 (с) (3Н, 5-СОСН3), 4,35 (с) і 4,48 (с) (1H, С(3)-Н), 5,0 (с, 1Н, C(4)-H), 7,0-7,5 (м, 5Н, АrН). Приклад 2. Одержання (6-ацетил-8-ціано-5метил-3-оксо-7-(4-хлорфеніл)-2,3-дигідро-7Hтіазоло[3,2-]піридин-2-іл)оцтової кислоти Одержують аналогічно прикладу 1. Для реакції беруть на першій стадії 1,4 г 4хлорбензальдегіду, на другій стадії 0,52 г 4-(4хлорфеніл)-5-ацетил-6-метил-3-ціано-3,4дигідропіридин-2-(1Н)-тіону. Т.пл. 194-196 °С, вихід 0,51 г (74 %). 1 Спектр Н ЯМР (DMSO-D6): 2,12 (с) і 2,14 (с) (3Н, С(6)-СН3), 2,30 (с, 3Н, 5-СОСН3), 4,41 (с) і 4,48 (с) (1Н, С(3)-Н), 4,85 (с, 1Н, C(4)-H), 7,24-7,44 (м, 4Н, АrН). Приклад 3. Одержання (6-ацетил-8-ціано-5метил-3-оксо-7-(4-нітрофеніл)-2,3-дигідро-7Hтіазоло[3,2-]піридин-2-іл)оцтової кислоти Одержують аналогічно прикладу 1. Для реакції беруть на перший стадії 0,76 г 4нітробензальдегіду, на другій стадії 0,1 г 4-(4нітрофеніл)-5-ацетил-6-метил-3-ціано-3,4дигідропіридин-2-(1Н)-тіону. Т.пл. 139-141 °С, вихід 0,07 г (53 %). 1 Спектр Н ЯМР (DMSO-D6): 2,04 (с) і 2,14 (с) (3Н, С(6)-СН3), 2,34 (с) і 2,42 (с) (3Н, 5-СОСН3), 4,58 (с) і 4,68 (с) (1Н, С(3)-Н), 5,13 (с, 1Н, С(4)-Н), 7,45 (д), 7,52 (д), 8,2 (д) (4Н, АrН). 10 Приклад 4. Одержання (6-ацетил-8-ціано-5метил-3-оксо-7-(4-метоксифеніл)-2,3-дигідро-7Нтіазоло[3,2-]піридин-2-іл)оцтової кислоти. Одержують аналогічно прикладу 1. Для реакції беруть на першій стадії 1,36 г 4метоксибензальдегіду, на другій стадії 1,42 г 4-(4метоксифеніл)-5-ацетил-6-метил-3-ціано-3,4дигідропіридин-2-(1Н)-тіону. Т.пл. 148-150 °С, вихід 1,17 г (62 %). 1 Спектр H ЯМР (DMSO-D6): 2,01 (с) і 2,09 (с) (3Н, С(6)-СН3), 2,31 (с) і 2,39 (с) (3Н, 5-СОСН3), 3,55 (с, 3Н, ОСН3), 4,32 (с) і 4,45 (с) (1Н, С(3)-Н), 4,88 (с, 1Н, C(4)-H), 6,87-7,47 (м, 4Н, АrН). Приклад 5. Одержання (6-ацетил-8-ціано-5метил-3-оксо-7-(4-метилфеніл)-2,3-дигідро-7Нтіазоло[3,2-]піридин-2-іл)оцтової кислоти. Одержують аналогічно прикладу 1. Для реакції беруть на першій стадії 1,45 г 4-толуїлового альдегіду, на другій стадії 1,35 г 4-(4метилфеніл)-5-ацетил-6-метил-3-ціано-3,4дигідропіридин-2-(1H)-тіону. Т.пл. 136-138 °С, вихід 1,03 г (57 %). 1 Спектр Н ЯМР (DMSO-D6): 1,95 (с, 3Н, АrСН3), 2,01 (с) і 2,07 (с) (3Н, С(6)-СН3), 2,30 (с) і 2,37 (с) (3Н, 5-СОСН3), 4,34 (с) і 4,46 (с) (1H, С(3)Н), 4,85 (с, 1H, C(4)-H), 6,96-7,41 (м, 4Н, АrН). Як видно із даних таблиці і опису матеріалів, що заявляються, технічне рішення, що пропонується, має наступні переваги: - тривалість синтезу складає 6,5-8 годин; - висока якість і вихід кінцевих продуктів (вихід складає 53-87 %); - можливість варіювання у молекулі сполук формули І замісників різної електронної природи. Спосіб одержання сполук формули І простий і доступний у технологічному відношенні і може легко відтворюватися як у лабораторних, так і у промислових умовах. Таблиця Кількість стадій процесу Спосіб, що заявляється 2 Одержання сполук формули II 2 Одержання сполук формули III 2 Одержання сполук формули IV 2 Розчинник Етанол, льодяна оцтова кислота У розплаві при 93-103 °С Тривалість процесу, год Вихід, Використання вибухонебезпечних % і токсичних розчинників 6,5-8 53-87 1 50-62 Етанол, бутанол 27-30 72 Нітрометан - вогне- і вибухонебезпечний розчинник; ацетонітрил токсичний Етанол, оцтова кислота 9-10 25 Комп’ютерна верстка Д. Шеверун Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted (6-acetyl-8-cyano-5-methyl-3-oxo-7-aryl-2,3-dihydro-7h-tiazolo[3,2-a]pyridin-2-yl)acetic acids and a process for the preparation thereof
Автори англійськоюZbruiev Oleksandr Ihorevych, Chebanov Valentyn Anatoliiovych, Andriuschenko Anastasia Yuriivna, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюЗамещенные (6-ацетил-8-циано-5-метил-3-оксо-7-арил-2,3-дигидро-7н-тиазоло[3,2-а]пиридин-2-ил)уксусные кислоты и способ их получения
Автори російськоюЗбруев Александр Игоревич, Чебанов Валентин Анатолиевич, Андрющенко Анастасия Юрьевна, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 513/04
Мітки: одержання, 6-ацетил-8-ціано-5-метил-3-оксо-7-арил-2,3-дигідро-7н-тіазоло[3,2-а]піридин-2-іл)оцтові, спосіб, кислоти, заміщені
Код посилання
<a href="https://ua.patents.su/5-96107-zamishheni-6-acetil-8-ciano-5-metil-3-okso-7-aril-23-digidro-7n-tiazolo32-apiridin-2-iloctovi-kisloti-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Заміщені (6-ацетил-8-ціано-5-метил-3-оксо-7-арил-2,3-дигідро-7н-тіазоло[3,2-а]піридин-2-іл)оцтові кислоти і спосіб їх одержання</a>
Попередній патент: Спосіб (варіанти) і пристрій (варіанти) розподілу ресурсів позитивних/негативних квітирувань у висхідній лінії зв’язку
Наступний патент: Способи і пристрій ldpc-декодування
Випадковий патент: Вільновихровий насос









