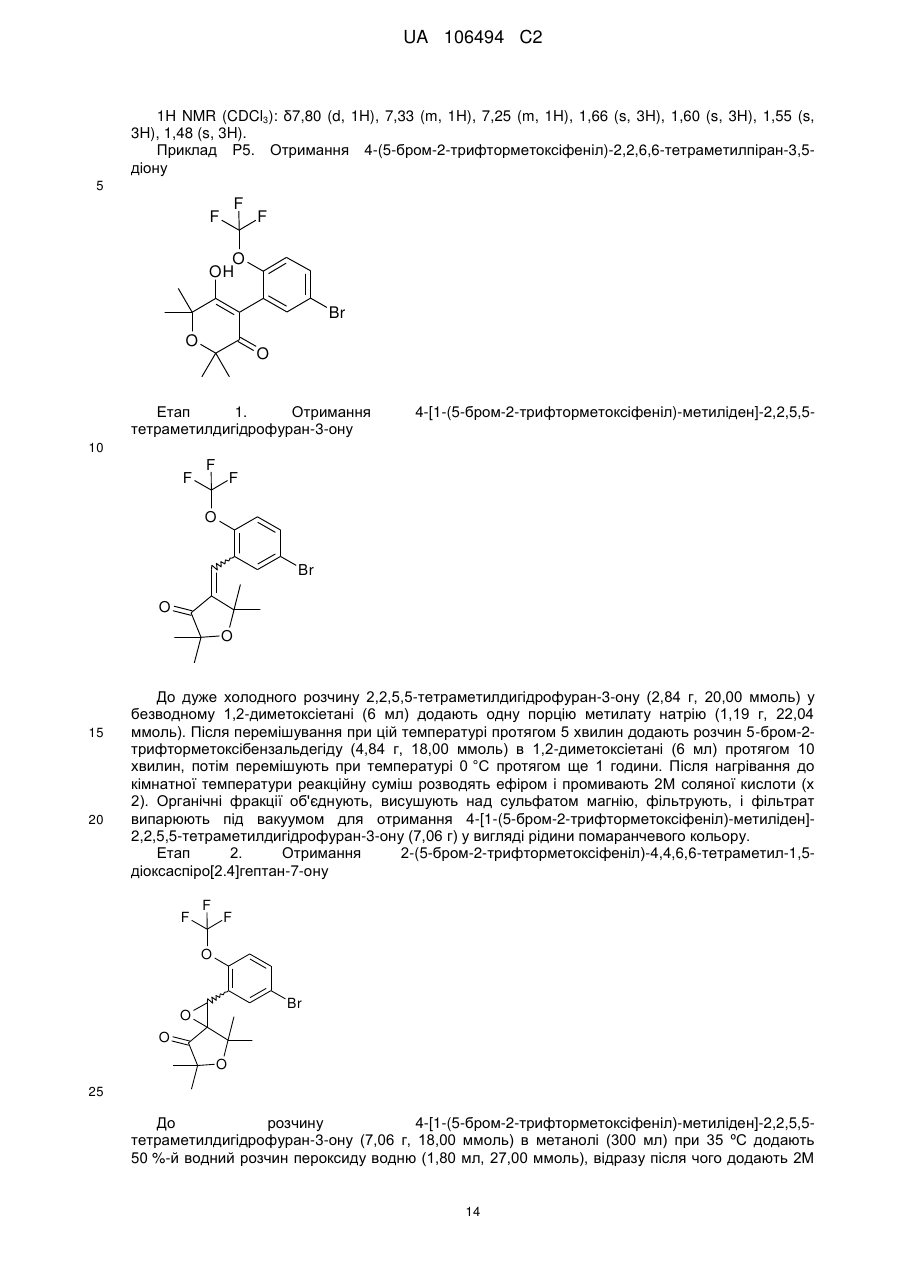
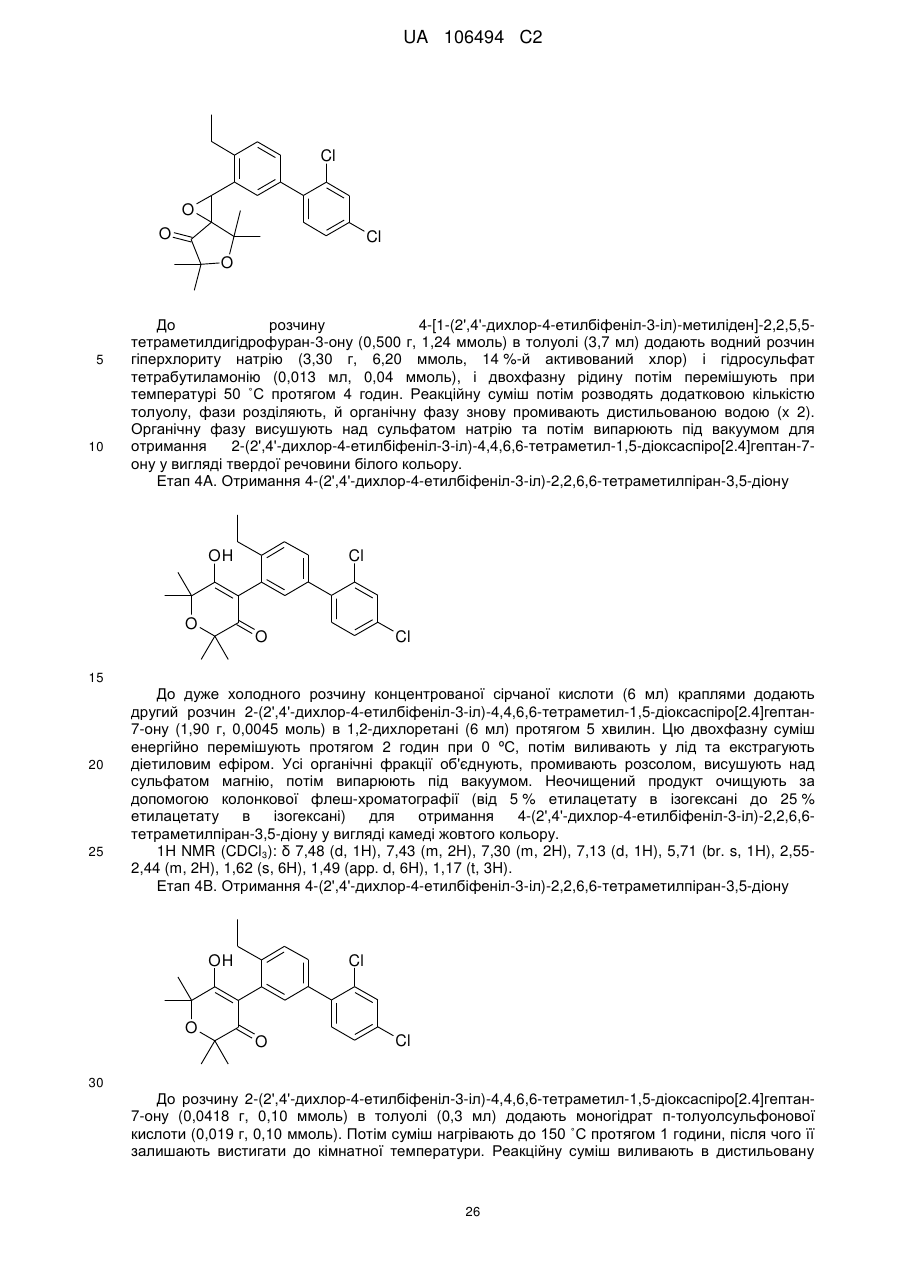
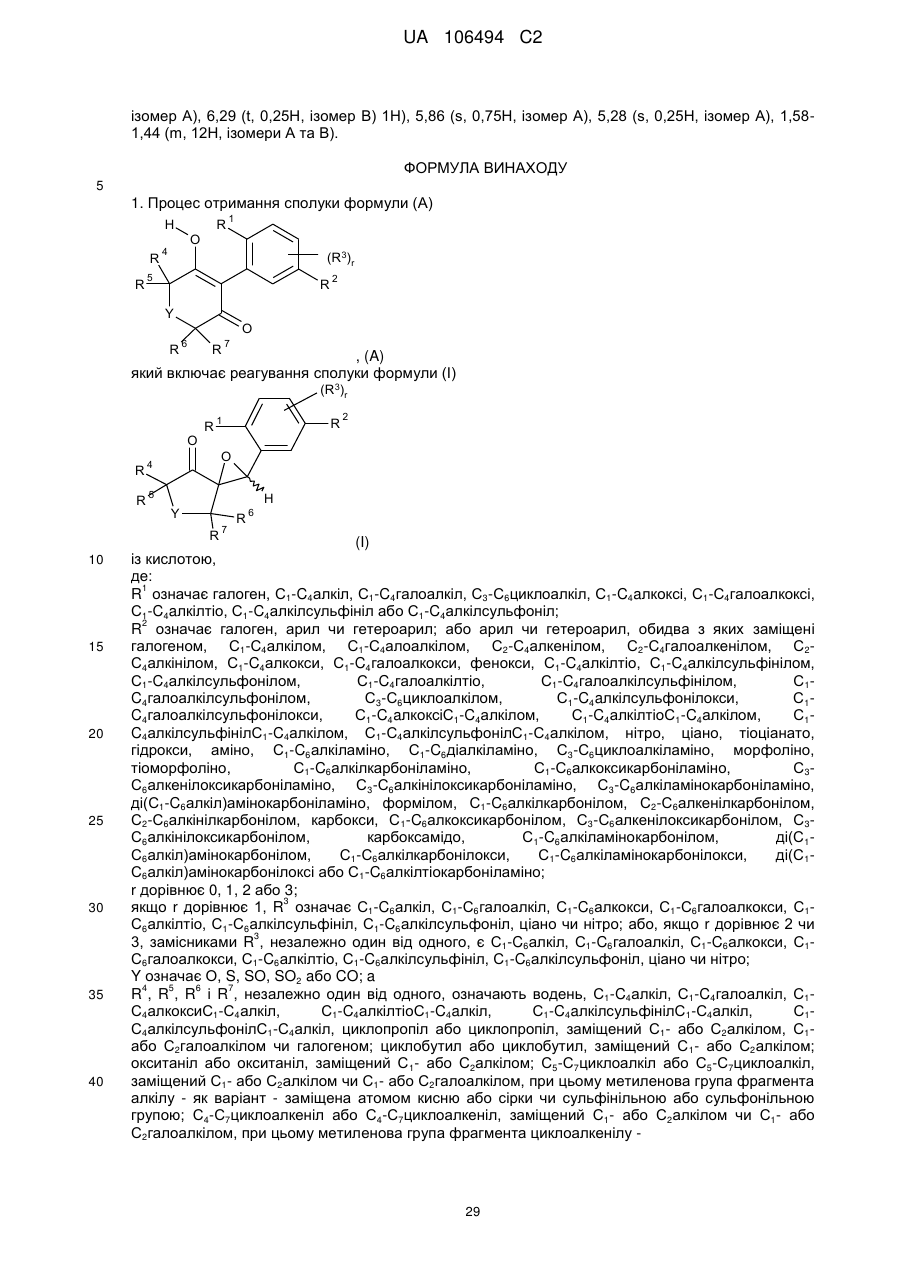
Спіроепоксиди як проміжні продукти синтезу
Формула / Реферат
1. Процес отримання сполуки формули (А)
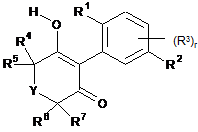 (A)
(A)
який включає реагування сполуки формули (І)
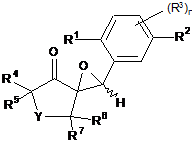 (I)
(I)
із кислотою,
де:
R1 означає галоген, С1-C4алкіл, С1-C4галоалкіл, С3-С6циклоалкіл, С1-C4aлкоксі, С1-С4галоалкоксі, С1-C4aлкілтіо, С1-C4алкілсульфініл або С1-C4алкілсульфоніл;
R2 означає галоген, арил чи гетероарил; або арил чи гетероарил, обидва з яких заміщені галогеном, С1-С4алкілом, С1-С4алоалкілом, С2-С4алкенілом, С2-С4галоалкенілом, С2-С4алкінілом, С1-C4алкокси, С1-C4галоалкокси, фенокси, С1-C4алкілтіо, С1-C4алкілсульфінілом, С1-C4алкілсульфонілом, С1-C4галоалкілтіо, С1-C4галоалкілсульфінілом, С1-C4галоалкілсульфонілом, С3-С6циклоалкілом, С1-C4aлкілсульфонілокси, С1-C4галоалкілсульфонілокси, С1-C4aлкоксиС1-C4алкілом, С1-C4алкілтіоС1-C4алкілом, С1-C4алкілсульфінілС1-C4алкілом, С1-С4алкілсульфонілС1-С4алкілом, нітро, ціано, тіоціанато, гідрокси, аміно, С1-C6алкіламіно, С1-C6діалкіламіно, С3-С6циклоалкіламіно, морфоліно, тіоморфоліно, С1-C6алкілкарбоніламіно, С1-С6алкоксикарбоніламіно, С3-С6 алкенілоксикарбоніламіно, С3-С6алкінілоксикарбоніламіно, С3-C6 алкіламінокарбоніламіно, ді(С1-C6алкіл)амінокарбоніламіно, формілом, С1-C6алкілкарбонілом, С2-С6алкенілкарбонілом, С2-С6алкінілкарбонілом, карбокси, С1-C6алкоксикарбонілом, С3-С6алкенілоксикарбонілом, С3-С6алкінілоксикарбонілом, карбоксамідо, С1-C6алкіламінокарбонілом, ді(С1-С6алкіл)амінокарбонілом, С1-С6алкілкарбонілокси, С1-C6алкіламінокарбонілокси, ді(С1-С6алкіл)амінокарбонілоксі або С1-C6алкілтіокарбоніламіно;
r дорівнює 0, 1, 2 або 3;
якщо r дорівнює 1, R3 означає С1-C6алкіл, С1-С6галоалкіл, С1-C6алкокси, С1-С6галоалкокси, С1-С6алкілтіо, С1-С6алкілсульфініл, С1-C6алкілсульфоніл, ціано чи нітро; або, якщо r дорівнює 2 чи 3, замісниками R3, незалежно один від одного, є С1-C6алкіл, С1-C6галоалкіл, С1-C6алкокси, С1-С6галоалкокси, С1-C6алкілтіо, С1-C6алкілсульфініл, С1-C6алкілсульфоніл, ціано чи нітро;
Y означає О, S, SO, SO2 aбo CO; a
R4, R5, R6 і R7, незалежно один від одного, означають водень, С1-C4алкіл, С1-C4галоалкіл, С1-С4алкоксиС1-С4алкіл, С1-C4алкілтіоС1-C4aлкіл, С1-C4aлкілсульфінілС1-С4алкіл, С1-С4алкілсульфонілС1-С4алкіл, циклопропіл або циклопропіл, заміщений С1- або С2алкілом, С1- або С2галоалкілом чи галогеном; циклобутил або циклобутил, заміщений С1- або С2алкілом; окситаніл або окситаніл, заміщений С1- або С2алкілом; С5-С7циклоалкіл або С5-С7циклоалкіл, заміщений С1- або С2алкілом чи С1- або С2галоалкілом, при цьому метиленова група фрагмента алкілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; С4-С7циклоалкеніл або С4-С7циклоалкеніл, заміщений С1- або С2алкілом чи С1- або С2галоалкілом, при цьому метиленова група фрагмента циклоалкенілу -
як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; циклопропілС1-C5алкіл або циклопропілС1-C5алкіл, заміщений С1- або С2алкілом, С1- або С2галоалкілом або галогеном; циклобутилС1-C5алкіл або циклобутилС1-С5алкіл, заміщений С1- або С2алкілом; окситанілС1-C5алкіл або окситанілС1-С5алкіл, заміщений С1- або С2алкілом; С5-С7 циклоалкілС1-C5алкіл або С5-С7циклоалкілС1-C5алкіл, заміщений С1- або С2алкілом чи С1- або С2галоалкілом, при цьому метиленова група фрагмента циклоалкілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; С4-С7-циклоалкенілС1-C5 алкіл або С4-C7циклоалкенілС1-C5алкіл, заміщений С1- або С2алкілом чи С1- або С2галоалкілом, при цьому метиленова група фрагмента циклоалкенілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; феніл або феніл, заміщений С1-C4алкілом, С1-C4алкокси, С1-C4галоалкілом, галогеном, нітро, ціано, С1-C4алкілтіо, С1-С4алкілсульфінілом, С1-C4алкілсульфонілом або С1-C4алкілкарбонілом; бензил або бензил, заміщений С1-C4алкілом, С1-C4алкокси, С1-С4галоалкілом, галогеном, нітро, ціано, С1-C4алкілтіо, С1-C4алкілсульфінілом, С1-C4алкілсульфонілом або С1-C4алкілкарбонілом; гетероарил або гетероарил, заміщений С1-C4алкілом, С1-С4алкокси, С1-С4галоалкілом, галогеном, нітро, ціано, С1-С4алкілтіо, С1-C4алкілсульфінілом, С1-C4алкілсульфонілом або С1-C4алкілкарбонілом; або
R4 і R5 або R6 і R7 з'єднуються, утворюючи 5-7-членне насичене або ненасичене кільце, в якому метиленова група - як варіант - заміщена атомом кисню або сірки, чи 5-7-членне насичене або ненасичене кільце, заміщене С1- або С2алкілом, де метиленова група кільця - як варіант - заміщена атомом кисню або сірки; або
R4 і R7 з'єднуються для утворення 5-7-членного насиченого або ненасиченого кільця, незаміщеного або заміщеного С1- або С2алкілом, C1- або С2алкокси, С1- або С2алкокси С1- або С2алкілом, гідрокси, галогеном; фенілу або фенілу, заміщеного С1-C4алкілом, С1-C4алкокси, С1-C4галоалкілом, галогеном, нітро, ціано, С1-C4алкілтіо, С1-C4алкілсульфінілом, С1-C4алкілсульфонілом або С1-С4алкілкарбонілом; гетероарилу або гетероарилу, заміщеного С1-C4алюлом, С1-C4алкокси, С1-C4галоалкілом, галогеном, нітро, ціано, С1-C4алкілтіо, С1-C4алкілсульфінілом, С1-C4алкілсульфонілом або С1-C4алкілкарбонілом;
та в якій:
під "арилом" слід розуміти феніл або нафтил; а
під "гетероарилом" слід розуміти тієніл, фурил, піроліл, ізоксазоліл, оксазоліл, оксетаніл, ізотіазоліл, тіазоліл, піразоліл, імідазоліл, триазоліл, тетразоліл, піридил, піримідиніл, піразиніл, триазиніл, оксадіазоліл, тіадіазоліл чи піридазиніл, або, де це необхідно, N-оксид чи сіль цих сполук.
2. Процес за п. 1, де R1 означає галоген, С1-С4алкіл, С1-С4галоалкіл, С3-С6циклоалкіл або С1-C4-галоалкоксі.
3. Процес за будь-яким з пп. 1 або 2, де R2 означає галоген, арил чи гетероарил; або арил чи гетероарил, обидва з яких заміщені галогеном, С1-C4алкілом, С1-C4галоалкілом, фенокси, С2-С4алкенілом, С2-С4галоалкенілом, С2-С4алкінілом, С1-C4алкокси, С1-C4галоалкокси, С1-C4алкілтіо, С1-C4алкілсульфінілом, С1-C4алкілсульфонілом, С1-С4галоалкілтіо, С1-С4галоалкілсульфінілом, С1-C4галоалкілсульфонілом, нітро або ціано.
4. Процес за будь-яким з пп. 1 або 2, де R2 означає феніл, тієніл, фурил, піроліл, ізоксазоліл, оксазоліл, ізотіазоліл, тіазоліл, піразоліл, імідазоліл, триазоліл, тетразоліл, піридил, піримідиніл, піразиніл, триазиніл, піридазиніл, оксадіазоліл чи тіадіазоліл, або N-оксид чи сіль цих сполук, при цьому такі кільця незаміщені або заміщені галогеном, С1-C4алкілом, С1-C4галоалкілом, С2-С4алкенілом, С2-С4галоалкенілом, С2-С4алкінілом, С1-C4алкокси, С1-C4галоалкокси, С1-C4алкілтіо, С1-C4алкілсульфінілом, С1-C4алкілсульфонілом, С1-C4галоалкілтіо, С1-C4галоалкілсульфінілом, С1-С4галоалкілсульфонілом, нітро або ціано.
5. Процес за п. 1 або 2 , де R2 означає феніл чи піридил, або феніл чи піридил, обидва з яких заміщені галогеном, нітро, ціано, С1-C2галкілом, С1-C2галоалкілом, С1-C2галкокси або С1-C2галоалкокси.
6. Процес за будь-яким з пп. 1 або 2, де R2 означає феніл, заміщений у пара-положенні галогеном та - як варіант - далі заміщений галогеном, нітро, С1-C2алкілом, С1-C2галоалкілом, С1-C2алкокси або С1-C2галоалкокси.
7. Процес за будь-яким з пп. 1 або 2, де R2 означає феніл, заміщений у пара-положенні хлором та - як варіант - далі заміщений галогеном, нітро, С1-C2алкілом, С1-C2галоалкілом, С1-C2алкокси або С1-C2галоалкокси.
8. Процес за будь-яким з пп. 1-7, де кожний R3 означає водень, при цьому мається на увазі, що r дорівнює 0 або R3 означає С1-С6алкіл.
9. Процес за будь-яким з пп. 1-7, де R3 означає водень, при цьому мається на увазі, що r дорівнює 0.
10. Процес за будь-яким з пп. 1-9, де R4, R5, R6 та R7, незалежно один від одного, означають водень, С1-C4алкіл, С1-С4галоалкіл, С1-C4алкоксиС1-C4алкіл, С1-С4алкілтіоС1-С4алкіл, С1-С4алкілсульфінілС1-С4алкіл, С1-С4алкілсульфонілС1-С4алкіл; С5-С7циклоалкіл або С5-С7циклоалкіл, заміщений C1- чи С2алкілом або С1- чи С2галоалкілом, і в якій метиленова група - як варіант - заміщена атомом кисню чи сірки або сульфінільною чи сульфонільною групою; або С5-С7циклоалкілС1-C5алкіл чи С5-C7циклоалкілС1-C5алкіл, заміщений С1-C2алкілом або С1- чи С2галоалкілом, і в якій метиленова група - як варіант - заміщена атомом кисню чи сірки або сульфінільною чи сульфонільною групою.
11. Процес за будь-яким з пп. 1-9, де R4, R5, R6 і R7, незалежно один від одного, означають водень, С1-C2алкіл, С1-C2галоалкіл або С1-C2алкоксиС1-C2галкіл.
12. Процес за п. 1, де
R1 означає етил, метил або циклопропіл;
R2 означає феніл або феніл, заміщений галогеном чи С1-С2алкілом;
R3 означає водень, при цьому мається на увазі, що r дорівнює 0; і
R4, R5, R6 та R7, незалежно один від одного, означають С1-C2алкіл.
13. Процес за будь-яким з пп. 1-12, де кислота означає кислоту Бренстеда або кислоту Льюїса.
14. Процес за будь-яким з пп. 1-12, де кислота означає кислоту Бренстеда, яка являє собою неорганічну або органічну кислоту.
15. Процес за будь-яким з пп. 1-14, в якому застосовують придатний розчинник, що сумісний з кислотою.
16. Процес за п. 15, де придатним розчинником є хлорований вуглеводень, спирт, ефір, ароматична сполука чи органічна кислота або суміш таких розчинників.
17. Процес за п. 16, де придатним розчинником є дихлорметан, дихлоретан, діетиловий ефір, оцтова кислота, мурашина кислота, толуол, бензол, метанол, етанол, ізопропанол чи тетрагідрофуран або суміш таких розчинників.
18. Процес за будь-яким з пп. 1-17, де температура реакції знаходиться в межах від -50 °C до 83 °C.
19. Процес за будь-яким з пп. 1-17 , де температура реакції знаходиться в межах від -50 °C до 40 °C.
20. Сполука формули І
 (I),
(I),
де
R1 означає галоген, С1-С4алкіл, С1-С4галоалкіл, С3-С6циклоалкіл, С1-С4алкокси, С1-С4галоалкокси, С1-С4алкілтіо, С1-С4алкілсульфініл або С1-С4алкілсульфоніл;
R2 означає галоген, арил чи гетероарил; або арил чи гетероарил, обидва з яких заміщені галогеном, С1-С4алкілом, С1-С4галоалкілом, С2-С4алкенілом, С2-С4галоалкенілом, С2-С4алкінілом, С1-С4алкокси, С1-С4галоалкокси, фенокси, С1-С4алкілтіо, С1-С4алкілсульфінілом, С1-С4алкілсульфонілом, С1-С4галоалкілтіо, С1-С4галоалкілсульфінілом, С1-С4галоалкілсульфонілом, С3-С6циклоалкілом, С1-С4алкілсульфонілокси, С1-С4галоалкілсульфонілокси, С1-С4алкоксиС1-С4алкілом, С1-C4алкілтіоС1-С4алкілом, С1-С4алкілсульфінілС1-C4алкілом, С1-С4алкілсульфонілС1-С4алкілом, нітро, ціано, тіоціанато, гідрокси, аміно, С1-С6алкіламіно, С1-С6діалкіламіно, С3-С6циклоалкіламіно, морфоліно, тіоморфоліно, С1-С6алкілкарбоніламіно, С1-С6алкоксикарбоніламіно, С3-С6 алкенілоксикарбоніламіно, С3-С6 алкінілоксикарбоніламіно, С1-С6 алкіламінокарбоніламіно, ди(С1-6алкіл)амінокарбоніламіно, формілом, С1-С6алкілкарбонілом, С2-С6алкенілкарбонілом, С2-С6алкінілкарбонілом, карбокси, С1-С6алкоксикарбонілом, С3-С6алкенілоксикарбонілом, С3-С6алкінілоксікарбонілом, карбоксамідо, С1-С6алкіламінокарбонілом, ди(С1-С6алкіл)амінокарбонілом, С1-С6алкілкарбонілокси, С1-С6алкіламінокарбонілокси, ди(С1-С6алкіл)амінокарбонілокси або С1-С6алкілтіокарбоніламіно;
r дорівнює 0, 1, 2 або 3;
якщо r дорівнює 1, R3 означає С1-С6алкіл, С1-С6галоалкіл, С1-С6алкокси, С1-С6галоалкокси, С1-С6алкілтіо, С1-С6алкілсульфініл, С1-С6алкілсульфоніл, ціано або нітро; чи у разі, якщо r дорівнює 2 або 3, замісниками R3, незалежно один від одного, є С1-С6алкіл, С1-С6галоалкіл, С1-С6алкокси, С1-С6галоалкокси, С1-С6алкілтіо, С1-С6алкілсульфініл, С1-С6алкілсульфоніл, ціано або нітро;
Y означає О, S, SO, SO2 або CO; a
R4, R5, R6 і R7, незалежно один від одного, означають водень, С1-С4алкіл, С1-С4галоалкіл, С1-С4алкоксиС1-С4алкіл, С1-С4алкілтіоС1-С4алкіл, С1-C4алкілсульфінілС1-С4алкіл, С1-С4алкілсульфонілС1-С4алкіл, циклопропіл або циклопропіл, заміщений С1- або С2алкілом, С1- або С2галоалкілом чи галогеном; циклобутил або циклобутил, заміщений С1- або С2алкілом; окситаніл або окситаніл, заміщений С1- або С2алкілом; С5-С7циклоалкіл або С5-С7циклоалкіл, заміщений С1- або С2алкілом чи С1- або С2галоалкілом, при цьому метиленова група фрагмента алкілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; С4-С7циклоалкеніл або С4-С7циклоалкеніл, заміщений С1- або С2алкілом чи С1- або С2галоалкілом, при цьому метиленова група фрагмента циклоалкенілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; циклопропілС1-С5алкіл або циклопропілС1-С5алкіл, заміщений С1- або С2алкілом, С1- або С2галоалкілом або галогеном; циклобутилС1-С5алкілабо циклобутилС1-С5алкіл, заміщений С1- або С2алкілом; окситанілС1-С5алкіл або окситанілС1-С5алкіл, заміщений С1- або С2алкілом; С5-С7 циклоалкілС1-С5алкіл або С1-С5циклоалкілС1-С5алкіл, заміщений С1- або С2алкілом чи С1- або С2галоалкілом, при цьому метиленова група фрагмента циклоалкілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; С4-С7циклоалкенілС1-С5 алкіл або С4-С7циклоалкенілС1-С5алкіл, заміщений С1- або С2алкілом чи С1- або С2галоалкілом, при цьому метиленова група фрагмента циклоалкенілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; феніл або феніл, заміщений С1-С4алкілом, С1-С4алкокси, С1-С4галоалкілом, галогеном, нітро, ціано, С1-С4алкілтіо, С1-С4алкілсульфінілом, С1-С4алкілсульфонілом або С1-С4алкілкарбонілом; бензил або бензил, заміщений С1-С4алкілом, С1-C4алкоксі, С1-С4галоалкілом, галогеном, нітро, ціано, С1-С4алкілтіо, С1-С4алкілсульфінілом, С1-С4алкілсульфонілом або С1-С4алкілкарбонілом; гетероарил або гетероарил, заміщений С1-С4алкілом, С1-С4алкокси, С1-С4галоалкілом, галогеном, нітро, ціано, С1-С4алкілтіо, С1-С4алкілсульфінілом, С1-С4алкілсульфонілом або С1-С4алкілкарбонілом; або
R4 і R5 або R6 і R7 з'єднуються, утворюючи 5-7-членне насичене або ненасичене кільце, в якому метиленова група - як варіант - заміщена атомом кисню або сірки, чи 5-7-членне насичене або ненасичене кільце, заміщене С1- або С2алкілом, де метиленова група кільця - як варіант - заміщена атомом кисню або сірки; або
R4 і R7 з'єднуються для утворення 5-7-членного насиченого або ненасиченого кільця, незаміщеного або заміщеного С1- або С2алкілом, С1- або С2алкокси, С1- або С2алкоксиС1- або С2алкілом, гідрокси, галогеном; фенілу або фенілу, заміщеного С1-С4алкілом, С1-С4алкокси, С1-С4галоалкілом, галогеном, нітро, ціано, С1-C4алкілтіо, С1-С4алкілсульфінілом, С1-С4алкілсульфонілом або С1-С4aлкілкарбонілом; гетероарилу або гетероарилу, заміщеного С1-С4алкілом, С1-С4алкокси, С1-С4галоалкілом, галогеном, нітро, ціано, С1-С4алкілтіо, С1-С4алкілсульфінілом, С1-С4алкілсульфонілом або С1-С4алкілкарбонілом;
та в якій:
під "арилом" слід розуміти феніл або нафтил; а
під "гетероарилом" слід розуміти тієніл, фурил, піроліл, ізоксазоліл, оксазоліл, оксетаніл, ізотіазоліл, тіазоліл, піразоліл, імідазоліл, триазоліл, тетразоліл, піридил, піримідиніл, піразиніл, триазиніл, оксадіазоліл, тіадіазоліл чи піридазиніл, або, де це необхідно, N-оксид чи сіль цих сполук.
21. Сполука за п. 20, де R1 означає галоген, С1-С4алкіл, С1-С4галоалкіл, С3-С6циклоалкіл або С1-С4-галоалкоксі.
22. Сполука за п. 20, де R2 означає галоген, арил чи гетероарил; або арил чи гетероарил, обидва з яких заміщені галогеном, С1-С4алкілом, С1-С4галоалкілом, фенокси, С2-С4алкенілом, С2-С4галоалкенілом, С2-С4алкінілом, С1-С4алкокси, С1-С4галоалкокси, С1-С4алкілтіо, С1-С4алкілсульфінілом, С1-С4aлкілсульфонілом, С1-С4галоалкілтіо, С1-С4галоалкілсульфінілом, С1-С4галоалкілсульфонілом, нітро або ціано.
23. Сполука за п. 22, де R2 означає феніл, тієніл, фурил, піроліл, ізоксазоліл, оксазоліл, ізотіазоліл, тіазоліл, піразоліл, імідазоліл, триазоліл, тетразоліл, піридил, піримідиніл, піразиніл, триазиніл, піридазиніл, оксадіазоліл чи тіадіазоліл, або N-оксид чи сіль цих сполук, при цьому такі кільця незаміщені або заміщені галогеном, С1-С4алкілом, С1-С4галоалкілом, С2-С4алкенілом, С2-С4галоалкенілом, С2-С4алкінілом, С1-С4алкокси, С1-С4галоалкокси, С1-С4алкілтіо, С1-С4алкілсульфінілом, С1-С4aлкілсульфонілом, С1-С4галоалкілтіо, С1-С4галоалкілсульфінілом, С1-С4галоалкілсульфонілом, нітро або ціано.
24. Сполука за п. 23, де R2 означає феніл чи піридил або феніл чи піридил, обидва з яких заміщені галогеном, нітро, ціано, С1-С2алкілом, С1-С2галоалкілом, С1-С2алкокси або С1-С2галоалкокси.
25. Сполука за п. 24, де R2 означає феніл, заміщений у пара-положенні галогеном і - як варіант - далі заміщений галогеном, нітро, С1-С2алкілом, С1-С2галоалкілом, С1-С2алкокси або С1-С2галоалкокси.
26. Сполука за п. 20, де R3 означає водень, при цьому мається на увазі, що r дорівнює 0, або R3 означає С1-С6алкіл.
27. Сполука за п. 20, де, якщо r дорівнює 1, R3 означає С1-С3алкіл.
28. Сполука за п. 20, де R4, R5, R6 і R7, незалежно один від одного, означають водень, С1-С4алкіл, С1-С4галоалкіл, С1-С4aлкоксиС1-C4алкіл, С1-С4алкілтіоС1-С4алкіл, С1-С4алкілсульфінілС1-С4алкіл, С1-С4алкілсульфонілС1-С4алкіл; С5-С7циклоалкіл або С5-С7циклоалкіл, заміщений С1- або С2алкілом чи С1- або С2галоалкілом, і в яких метиленова група - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; С5-С7циклоалкілС1-С5алкіл або С5-С7циклоалкілС1-С5алкіл, заміщені C1-С2алкілом чи С1- або С2галоалкілом, і в яких метиленова група - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою.
29. Сполука за п. 28, де R4, R5, R6 і R7, незалежно один від одного, означають водень, С1-С2алкіл, С1-С2галоалкіл або С1-С2алкоксиС1-С2алкіл.
30. Сполука за п. 20, де Y означає О.
31. Сполука за п. 20, де R1 означає етил, метил або циклопропіл;
R2 означає феніл або феніл, заміщений галогеном чи С1-С2алкілом;
R3 означає водень, при цьому мається на увазі, що r дорівнює 0;
R4, R5, R6 та R7, незалежно один від одного, означають С1-С2алкіл, а
Y означає О.
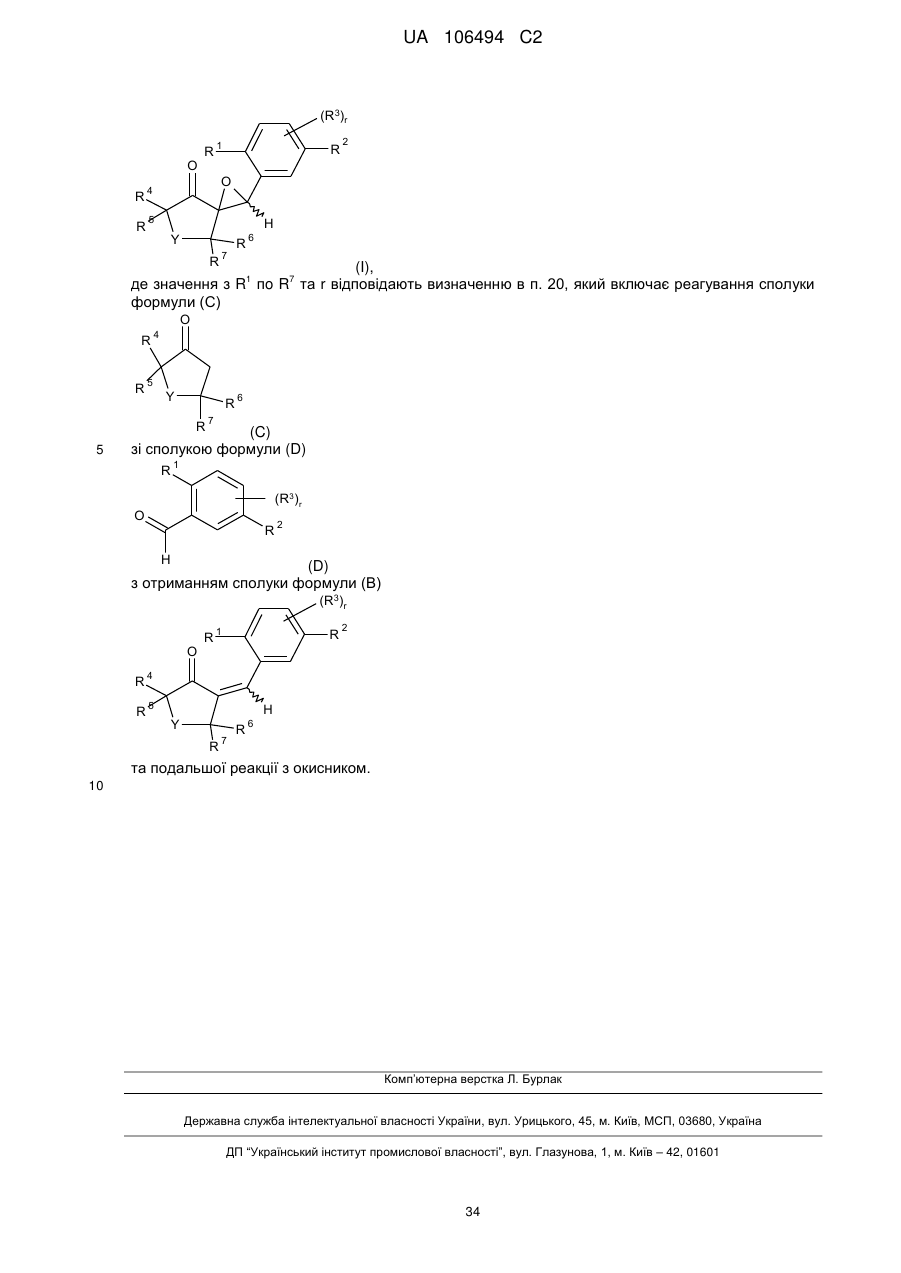
32. Процес отримання сполуки формули І
 (I),
(I),
де значення з R1 пo R7 та r відповідають визначенню в п. 20, який включає реагування сполуки формули (F)
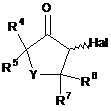 (F),
(F),
в якій Hal означає хлор, бром або йод, зі сполукою формули (D)
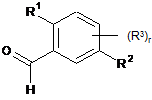 (D).
(D).
33. Процес отримання сполуки формули І
 (I),
(I),
де значення з R1 пo R7 та r відповідають визначенню в п. 20, який включає реагування сполуки формули (С)
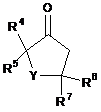 (C)
(C)
зі сполукою формули (D)
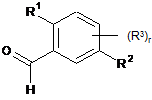 (D)
(D)
з отриманням сполуки формули (В)
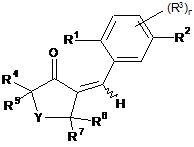
та подальшої реакції з окисником.
Текст
Реферат: Цей винахід пропонує сполуки формули І (R3)r O R 1 R 2 O 4 R R 5 H Y R 7 R 6 (I), в якій групи, що заміщуються, відповідають визначенню в п. 1 формули винаходу. Ці сполуки є проміжними продуктами, що застосовують для отримання 4-феніл-3,5-пірандіонів, 4-феніл-3,5тіопірандіонів і 6-фенілциклогексан-1,3,5-тріонів, що виявляють гербіцидну активність. 3 (R ) r 2 1 O R R O 4 R 5 R H Y 6 R 7 R UA 106494 C2 (12) UA 106494 C2 UA 106494 C2 5 10 Цей винахід стосується нових сполук, їх отримання та використання в якості проміжних продуктів для отримання заміщених 4-феніл-3,5-пірандіонів, 4-феніл-3,5-тіопірандіонів і 6фенілциклогексан-1,3,5-тріонів, що виявляють гербіцидну активність. 4-феніл-3,5-пірандіони, 4-феніл-3,5-тіопірандіони та 6-фенілциклогексан-1,3,5-тріони, які виявляють гербіцидну дію, та процес отримання цих сполук описані, наприклад, у публікації WO 08/071405. Нещодавно було виявлено, що в якості ключових проміжних продуктів у процесі отримання таких гербіцидно-активних діонів і тріонів можуть використовуватися певні заміщені епоксікетони. Цей винахід дозволяє отримувати їх із високим виходом та зі значними перевагами порівняно з відомими процесами. Відповідно, цей винахід стосується сполук формули I 3 (R ) r 2 1 O R R O 4 R 5 R H Y 6 R 7 R 15 20 25 30 35 40 45 50 (I), де 1 R означає галоген, C1-C4алкіл, C1-C4галоалкіл, C3-C6циклоалкіл, C1-C4алкоксі, C1C4галоалкоксі, C1-C4алкілтіо, C1-C4алкілсульфініл, C1-C4алкілсульфоніл; 2 R означає водень, галоген, метилсульфонілоксі, C1-C4галоалкілсульфонілоксі, птолілсульфонілоксі, як варіант - заміщені арилом або гетероарилом; r дорівнює 0, 1, 2 або 3; 3 Якщо r дорівнює 1, R означає C1-C6алкіл, C1-C6галоалкіл, C1-C6алкоксі, C1-C6галоалкоксі, C1C6алкілтіо, C1-C6алкілсульфініл, C1-C6алкілсульфоніл, ціано або нітро; або, якщо r дорівнює 2 3 або 3, заміщувачами R , незалежно один від одного, є C1-C6алкіл, C1-C6галоалкіл, C1-C6алкоксі, C1-C6галоалкоксі, C1-C6алкілтіо, C1-C6алкілсульфініл, C1-C6алкілсульфоніл, ціано або нітро; Y означає O, S, SO, SO2 або CO; 4 5 6 7 R , R , R і R , незалежно один від одного, означають водень, C1-C4алкіл, C1-C4галоалкіл, C1C4алкоксіC1-C4алкіл, C1-C4алкілтіоC1-C4алкіл, C1-C4алкілсульфінілC1-C4алкіл, C1C4алкілсульфонілC1-C4алкіл, циклопропіл або циклопропіл, заміщений C1- або C2алкілом, C1або C2галоалкілом чи галогеном; циклобутил або циклобутил, заміщений C1- або C2алкілом; окситаніл або окситаніл, заміщений C1- або C2алкілом; C5-C7циклоалкіл або C5-C7циклоалкіл, заміщений C1- або C2алкілом чи C1- або C2галоалкілом, при цьому метиленова група фрагмента алкілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; C4-C7циклоалкеніл або C4-C7циклоалкеніл, заміщений C1- або C2алкілом чи C1- або C2галоалкілом, при цьому метиленова група фрагмента циклоалкенілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; циклопропілC1-C5алкіл або циклопропілC1-C5алкіл, заміщений C1- або C2алкілом, C1- або C2галоалкілом або галогеном; циклобутилC1-C5алкіл або циклобутилC1-C5алкіл, заміщений C1- або C2алкілом; окситанілC1C5алкіл або окситанілC1-C5алкіл, заміщений C1- або C2алкілом; C5-C7 циклоалкілC1-C5алкіл або C5-C7циклоалкілC1-C5алкіл, заміщений C1-або C2алкілом чи C1- або C2галоалкілом, при цьому метиленова група фрагмента циклоалкілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; C4-C7циклоалкенілC1-C5 алкіл або C4C7циклоалкенілC1-C5алкіл, заміщений C1- або C2алкілом чи C1- або C2галоалкілом, при цьому метиленова група фрагмента циклоалкенілу - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; феніл або феніл, заміщений C1-C4алкілом, C1C4алкоксі, C1-C4галоалкілом, галогеном, нітро, ціано, C1-C4алкілтіо, C1-C4алкілсульфінілом, C1C4алкілсульфонілом або C1-C4алкілкарбонілом; бензил або бензил, заміщений C1-C4алкілом, C1-C4алкоксі, C1-C4галоалкілом, галогеном, нітро, ціано, C1-C4алкілтіо, C1-C4алкілсульфінілом, C1-C4алкілсульфонілом або C1-C4алкілкарбонілом; гетероарил або гетероарил, заміщений C1C4алкілом, C1-C4алкоксі, C1-C4галоалкілом, галогеном, нітро, ціано, C1-C4алкілтіо, C1C4алкілсульфінілом, C1-C4алкілсульфонілом або C1-C4алкілкарбонілом; або 4 5 6 7 R і R або R і R з'єднуються, утворюючи 5-7-членне насичене або ненасичене кільцее, в якому метиленова група - як варіант - заміщена атомом кисню або сірки, чи 5-7-членне насичене або ненасичене кільце, заміщене C1- або C2алкілом, де метиленова група кільця - як варіант - заміщена атомом кисню або сірки; або 1 UA 106494 C2 4 5 10 15 20 25 30 35 40 45 50 55 7 R і R з'єднуються для утворення 5-7-членного насиченого або ненасиченого кільця, незаміщеного або заміщеного C1- або C2алкілом, C1- або C2алкоксі, C1-або C2алкоксіC1- або C2алкілом, гідроксі, галогеном; фенілу або фенілу, заміщеного C1-C4алкілом, C1-C4алкоксі, C1C4галоалкілом, галогеном, нітро, ціано, C1-C4алкілтіо, C1-C4алкілсульфінілом, C1C4алкілсульфонілом або C1-C4алкілкарбонілом; гетероарилу або гетероарилу, заміщеного C1C4алкілом, C1-C4алкоксі, C1-C4галоалкілом, галогеном, нітро, ціано, C1-C4алкілтіо, C1C4алкілсульфінілом, C1-C4алкілсульфонілом або C1-C4алкілкарбонілом. Цей винахід також стосується нового процесу отримання сполук формули I. Окрім цього, винахід стосується процесу отримання 4-феніл-3,5-пірандіонів, 4-феніл-3,5тіопірандіонів і 6-фенілциклогексан-1,3,5-тріонів поданої нижче формули (A) з використанням сполук формули I в якості проміжних продуктів. У визначеннях заміщувачів сполук формули I оптимальними заміщувачами алкілу і (гало)алкільними фрагментами алкоксі, алкілтіо тощо, які містять від 1 до 6 атомів вуглецю, є переважно метил, етил, пропіл, бутил, пентил і гексил у формі їх прямих або розгалужених ізомерів. Застосовні циклоалкільні групи містять від 3 до 7 атомів вуглецю, ними є, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил і циклогептил. Перевага надається циклопропілу, циклобутилу, циклопентилу та циклогексилу. Застосовні циклоалкенові групи містять від 4 до 7 атомів вуглецю та можуть містити до 3 подвійних зв'язків. Оптимальними галогенами є фтор, хлор і бром. Оптимальними прикладами арилів є феніл і нафтил. Оптимальними прикладами гетероарилів є тієніл, фурил, пірроліл, ізоксазоліл, оксазоліл, оксетаніл, ізотіазоліл, тіазоліл, піразоліл, імідазоліл, тріазоліл, тетразоліл, піридил, піримідиніл, піразиніл, тріазиніл, оксадіазоліл, тіадіазоліл і піридазиніл і, де це необхідно, N-оксиди та солі цих сполук. Ці арили й гетероарили можуть заміщуватися одним або кількома заміщувачами, при цьому оптимальними заміщувачами є галоген, C1-C4алкіл, C1-C4галоалкіл, C2-C4алкеніл, C2C4галоалкеніл, C2-C4алкініл, C1-C4алкоксі, C1-C4галоалкоксі, C1-C4алкілтіо, C1-C4алкілсульфініл, C1-C4алкілсульфоніл, C1-C4галоалкілтіо, C1-C4галоалкілсульфініл, C1-C4галоалкілсульфоніл, нітро або ціано. 1 В оптимальній групі сполук формули I R означає галоген, C1-C4алкіл, C1-C4галоалкіл, C3C6циклоалкіл або C1-C4-галоалкоксі. 2 В іншій оптимальній групі сполук формули I R означає галоген, арил або гетероарил; чи арил або гетероарил, обидва з яких заміщені галогеном, C 1-C4алкілом, C1-C4галоалкілом, C2C4алкенілом, C2-C4галоалкенілом, C2-C4алкінілом, C1-C4алкоксі, C1-C4галоалкоксі, феноксі, C1C4алкілтіо, C1-C4алкілсульфінілом, C1-C4алкілсульфонілом, C1-C4галоалкілтіо, C1C4галоалкілсульфінілом, C1-C4галоалкілсульфонілом, C3-C6циклоалкілом, C1C4алкілсульфонілоксі, C1-C4галоалкілсульфонілоксі, C1-C4алкоксіC1-C4алкілом, C1-C4алкілтіоC1C4алкілом, C1-C4алкілсульфінілC1-C4алкілом, C1-C4алкілсульфонілC1-C4алкілом, нітро, ціано, тіоціанато, гідроксі, аміно, C1-C6алкіламіно, C1-C6діалкіламіно, C3-C6циклоалкіламіно, морфоліно, тіоморфоліно, C1-C6алкілкарбоніламіно, C1-C6алкоксікарбоніламіно, C3-C6 алкенілоксікарбоніламіно, C3-C6 алкінілоксікарбоніламіно, C1-C6 алкіламінокарбоніламіно, ди(C 1формілом, C1-C6алкілкарбонілом, C2-C6алкенілкарбонілом, C26алкіл)амінокарбоніламіно, C6алкінілкарбонілом, карбоксі, C1-C6алкоксікарбонілом, C3-C6алкенілоксікарбонілом, C3C6алкінілоксікарбонілом, карбоксамідо, C1-C6алкіламінокарбонілом, ди(C1C6алкіл)амінокарбонілом, C1-C6алкілкарбонілоксі, C1-C6алкіламінокарбонілоксі, ди(C1C6алкіл)амінокарбонілоксі або C1-C6алкілтіокарбоніламіно. 2 Оптимально R у сполуках формули I означає галоген, арил або гетероарил; чи арил або гетероарил, обидва з яких заміщені галогеном, C1-C4алкілом, C1-C4галоалкілом, феноксі, C2C4алкенілом, C2-C4галоалкенілом, C2-C4алкінілом, C1-C4алкоксі, C1-C4галоалкоксі, C1-C4алкілтіо, C1-C4алкілсульфінілом, C1-C4алкілсульфонілом, C1-C4галоалкілтіо, C1-C4галоалкілсульфінілом, C1-C4галоалкілсульфонілом, нітро або ціано. 2 Оптимальніше R означає феніл, тієніл, фурил, пірроліл, ізоксазоліл, оксазоліл, ізотіазоліл, тіазоліл, піразоліл, імідазоліл, тріазоліл, тетразоліл, піридил, піримідиніл, піразиніл, тріазиніл, піридазиніл, оксадіазоліл і тіадіазоліл, а також N-оксиди та солі цих сполук, при чому ці кільця незаміщені або заміщені галогеном, C1-C4алкілом, C1-C4галоалкілом, C2-C4алкенілом, C2C4галоалкенілом, C2-C4алкінілом, C1-C4алкоксі, C1-C4галоалкоксі, C1-C4алкілтіо, C1C4алкілсульфінілом, C1-C4алкілсульфонілом, C1-C4галоалкілтіо, C1-C4галоалкілсульфінілом, C1C4галоалкілсульфонілом, нітро або ціано. 2 У ще оптимальніших сполуках формули I R означає феніл чи піридил або феніл чи піридил, обидва з яких заміщені галогеном, нітро, ціано, C 1-C2алкілом, C1-C2галоалкілом, C1-C2алкоксі або C1-C2галоалкоксі. 2 UA 106494 C2 2 5 10 15 20 25 30 35 У групі сполук, якій надається особлива перевага, R означає феніл, заміщений у параположенні галогеном (зокрема хлором) і, як варіант, далі заміщений галогеном, нітро, C1C2алкілом, C1-C2галоалкілом, C1-C2алкоксі або C1-C2галоалкоксі. 3 Оптимально R означає водень (r дорівнює 0) або C1-C6алкіл, особливо водень. 3 Оптимально, якщо r дорівнює 1, R означає C1-C3алкіл. 4 5 6 7 Перевага надається тим сполукам формули I, у яких R , R , R і R , незалежно один від одного, означають водень, C1-C4алкіл, C1-C4галоалкіл, C1-C4алкоксіC1-C4 алкіл, C1-C4алкілтіоC1C4алкіл, C1-C4алкілсульфінілC1-C4алкіл, C1-C4алкілсульфонілC1-C4алкіл; C5-C7циклоалкіл або C5-C7циклоалкіл, заміщений C1- або C2алкілом чи C1- або C2галоалкілом, і в яких метиленова група - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою; C5-C7циклоалкілC1-C5алкіл або C5-C7циклоалкілC1-C5алкіл, заміщені C1-C2алкілом чи C1або C2галоалкілом, і в яких метиленова група - як варіант - заміщена атомом кисню або сірки чи сульфінільною або сульфонільною групою. 4 5 6 7 Оптимальніше R , R , R і R , незалежно один від одного, означають водень, C1-C2алкіл, C1C2галоалкіл або C1-C2алкоксіC1-C2алкіл. 1 2 В оптимальній групі сполук формули (I), R означає етил, метил або циклопропіл; R означає 3 4 5 6 7 феніл або феніл, заміщений галогеном або C1-C2алкілом; R означає водень, а R , R , R і R , незалежно один від одного, означають C1-C2алкіл. 1 В іншій оптимальній групі сполук формули (I) R означає метил, етил, циклопропіл, n-пропіл, 4 5 6 7 галоген, трифторметоксі, дифторметоксі та трифторметил; R , R , R і R , незалежно один від 2 одного, означають водень, метил і етил; R означає галоген, феніл, заміщений галогеном, C13 C4алкілом, C1-C4галоалкілом, C1-C4галоалкоксі або C1-C4алкоксі, R означає водень, а Y означає кисень, при чому 1 4 5 6 7 2 оптимальніше R означає етил або циклопропіл; R , R , R і R означають метил; R означає 3 феніл, один раз або двічі заміщений фтором, хлором, метоксі або метилом; R означає водень, а Y означає кисень, при чому 1 4 5 6 7 2 найоптимальніше R означає етил, R , R , R і R означають метил, R означає 4-хлорфеніл, 3 2,4-дихлорфеніл і 2-фтор-4-хлорфеніл, R означає водень, а Y означає кисень. 1 В іншій оптимальній групі сполук формули (I) R означає етил, трифторметил, циклопропіл, 4 5 6 7 дифторметоксі, трифторметоксі, фтор, бром або йод; R , R , R і R , незалежно один від одного, 2 означають водень або метил, R означає бром, 4-хлорфеніл, 2-фтор-4-хлорфеніл, 2,43 дихлорфеніл; R означає водень, а Y означає O, при чому 1 4 5 6 7 2 оптимальніше R означає етил, циклопропіл; R , R , R і R означають метил; R означає 3 бром, 4-хлорфеніл, 2-фтор-4-хлорфеніл або 2,4-дихлорфеніл, R означає H, а Y означає O. У ще одному варіанті винаходу було виявлено, що сполуки формули I можуть бути легко перетворені на 4-феніл-3,5-пірандіони, 4-феніл-3,5-тіопірандіони і 6-фенілциклогексан-1,3,5тріони поданої нижче формули (A) у присутності кислоти. Схема реакції 1 , 40 1 45 50 2 3 4 5 6 7 де Y, R , R , R , r, R , R , R і R відповідають визначенню вище. Застосовними кислотами є кислоти Бренстеда, такі як неорганічні й органічні кислоти, наприклад сірчана кислота, соляна кислота, хлорид водню, п-толуолсульфонова кислота, оцтова кислота та мурашина кислота, і кислоти Льюїса, такі як галоїдні сполуки, наприклад трифтористий бор, хлорид алюмінію, хлорид заліза, хлорид олова (IV), хлорид цинку, бромід цинку, перхлорат літію, а також трифлати металів, такі як трифлат скандію і трифлат іттербію. Можуть використовуватися також суміші цих кислот. Перетворення сполуки формули (I) у сполуку формули (A) можна вважати прикладом напівпінаколінового перегрупування (див., наприклад, M. Paulson, M. Daliya & C. Asokan, Synth. Commun. (2007), 37(5), 661-665; S. Sankararaman & J. Nesakumar, J. Chem. Soc, Perkin Trans. 1, (1999), (21), 3173-3175; K. Rehse & R. Bienfait, Archiv der Pharmazie, (1984), 317(5), 385-93; H. Kamath, A. Sahasrabudhe, B. Bapat & S. Kulkarni, Indian J. Chem., Section B: (1981), 20B(12), 1094-6; G. Buchanan & D. Jhaveri, J. Org. Chem. (1961), 26 4295-9; & H. House, Richard L. Wasson, J. Am. Chem. Soc., (1956), 78, 4394 3 UA 106494 C2 5 10 15 20 25 400), але така трансформація невідома для сполук типу (I). Умови реакцій, практичні для використання в процесі цього винаходу, аналогічні умовам, описаним у згаданій вище літературі, або можуть бути встановлені спеціалістами в цій галузі науки. Застосовними розчинниками є ті, які було вибрано за принципом сумісності з використовуваними кислотами; до них належать хлоровані вуглеводні, спирти, ефіри, ароматичні сполуки й органічні кислоти, наприклад дихлорметан, дихлоретан, діетиловий ефір, оцтова кислота, мурашина кислота, толуол, бензол, метанол, етанол, ізопропанол і тетрагідрофуран. Можуть використовуватися також суміші цих розчинників. Оптимально реакція проводиться з використанням концентрованої сірчаної кислоти в дихлоретані. Оптимальна температура реакції знаходиться в межах від -50 ºC до 83 ºC, ще оптимальніше - від -50 ºC до 40 ºC. Додатковими оптимальними умовами реакції є використання розчину перхлорату літію в ефірі в поєднанні з 0,1-100 мол. % трифлату іттербію у формі кислоти в діапазоні температур від 0 ºC до 60 ºC. Цей процес відрізняється від вищезгаданої розробки: a) доступністю вихідних матеріалів; b) короткою послідовністю реакції; c) відсутністю необхідності у високотоксичних реагентах; d) високою концентрацією речовин, які беруть участь у реакції (до 20 %, приклад P1, етап 4); e) широко - особливо у 2 і 5 позиціях - заміщуваними похідними фенілу в якості вихідних сполук; f) як правило, високим виходом продукту; і g) економічними й екологічними перевагами завдяки тому факту, що процес може використовуватися в якості часткового етапу в процедурі безперервної реакції для отримання 4феніл-3,5-пірандіонів, 4-феніл-3,5-тіопірандіонів і 6-фенілциклогексан-1,3,5-тріонів формули (A), які, як відомо, мають гербіцидні властивості. Таким чином, цей процес особливо застосовується для економічного отримання промислових об'ємів діонів і тріонів формули (A). В іншому варіанті цього винаходу сполуки формули (I) можна отримати шляхом епоксидування сполук формули (B), так як це продемонстровано в наступній схемі реакції: 3 (R ) r O 3 (R ) r 2 1 R R O 4 R R H 5 R 6 R 35 40 45 50 2 6 R 7 R (B) 1 H Y R 7 30 O 4 Y R R R 5 2 1 3 4 5 6 (I) 7 , в якій Y, R , R , R , r, R , R , R і R відповідають визначенню вище. Сполуки формули (B) є новими сполуками, які були спеціально розроблені в якості проміжних продуктів для синтезу сполук формули (I); вони становлять інший варіант цього винаходу. Епоксидування може виконуватися обробкою сполуки формули (B) застосовною окислюючою речовиною, такою як органічний перекис або гіперхлорит металу, наприклад, диметилдіоксиран, гіпохлорит натрію, перекис водню, трет-бутилпероксид або трифторнадоцтова кислота, як варіант, у поєднанні з застосовною основою (такою як гідроксид або карбонат лужного металу, гідроксид або карбонат лужноземельного металу або амінова основа, така як 1,8-діазабіцикло[5.4.0]-ундек-7-ін), як варіант - у застосовному розчиннику (такому як спирт, галогенований вуглеводень або ароматична сполука, наприклад метанол, етанол, дихлорметан або толуол) і за відповідної температури. Реакцію можна також проводити у двохфазному середовищі, де реагент міжфазного переносу також зазвичай використовується в концентрації 0,001-50 мол. %. Реагентом міжфазного переносу оптимально є сіль четвертинної амонієвої основи, краун-ефір, полиетиленгліколь або сіль фосфонію за відповідної температури. Аналогічні реакції відомі в літературі (наприклад, Коробицина І.К., Студзинский О.П., Журнал органической химии (1969), 5(8), 1493-5; A. Halasz, Z. Jambor, A. Levai, C. Nemes, T. Patonay & G. Toth, J. Chem. Soc, Perkin Trans. 1, (1996), (4), 395-400; N. Yousif, F. Gad, A. Fahmy, M. Amine & H. Sayed, Phosphorus, Sulfur and Silicon and the Related Elements (1996), 117, 11-19; T. Ooi, D. Ohara, M. Tamura & K. Maruoka, J. Am. Chem. Soc., (2004), 126(22), 6844-6845; A. Amr, H. Hayam & M. Abdulla, Archiv der Pharmazie, (2005), 338(9), 433-440; K. Drauz, S. M. Roberts, T. Geller & A. Dhanda, US6538105 B1; и L. S. Chagonda & B. A. Marples, J. Chem. Soc. Perkin 1, 1988, 875-879). Можуть використовуватися також суміші окислюючих речовин, основ і розчинників. Оптимально епоксидування здійснюється з використанням 4 UA 106494 C2 5 перекису водню та гідроксиду металу (особливо гідроксиду літію або гідроксиду натрію) в метанолі при температурі від -10 °C до 60 °C. Сполуку формули (B) можна приготувати зі сполуки формули (C) шляхом конденсації з бензальдегідом формули (D) у присутності застосовної основи, і - як варіант - у присутності застосовного розчинника (див., наприклад, A. Lagrange, S. Forestier, G Lang & B. Luppi, EP368717 A1; D. C. Rowlands, US2776239; & E. Tamate, Journal of the Chemical Society of Japan, (1957), 78, 1293-7). 3 (R ) r O R R R 4 + 5 Y R R 1 O (R3 ) r O R 6 7 R 2 R H 1 R 2 4 5 H Y R R (D) (C) R 7 6 (B) 10 15 20 25 30 35 40 Оптимально основою є гідроксид металу, такий як гідроксид натрію або гідроксид калію, чи алкоксид металу, такий як метилат натрію, етилат натрію або трет-бутилат калію. Оптимально розчинником є диметоксіетан, діоксан, тетрагідрофуран, діетиловый ефір або алкіловий спирт, такий як метанол, етанол або ізопропанол. Можуть використовуватися також суміші основ і, зокрема, розчинників. Сполуки формули (C), у якій Y означає O, є відомими сполуками (дивіться, наприклад, M. Newman & W. Reichle, Org. Synth. Coll. Vol. V., (1973), 1024; Залькинд Ю., Венус-Данилова Э. и Рябцева В., Журнал общей химии, (1950), 20, 2222-9; M. Bertrand, J. Dulcere, G. Gil, J. Grimaldi & P. Sylvestre-Panthet, Tetrahedron Letters (1976), (18), 1507-8), або можуть бути приготовлені з відомих сполук за допомогою відомих методів. Сполуки формули (C), в якій Y означає C=O, є відомими сполуками (див., наприклад, N. J. Turro, D. R. Morton, E. Hedaya, M. E. Kent, P. D'Angelo, P. Schissel, Tetrahedron Letters (1971), (27), 2535-8; P. A. Krapcho, D. R. Rao, M. P. Silvon, B. Abegaz, Journal of Organic Chemistry (1971), 36(25), 3885-90; S. N. Crane, T. J. Jenkins, D. J. Burnell,Journal of Organic Chemistry (1997), 62(25), 8722-8729; S. N. Crane, D. J. Burnell, Journal of Organic Chemistry (1998), 63(4), 1352-1355; S. N. Crane, D. J. Burnell, Journal of Organic Chemistry (1998), 63(16), 5708-5710; C. E. Elliott, D. O. Miller, D. J. Burnell, Journal of the Chemical Society, Perkin Transactions 1 (2002), (2), 217-226) або можуть бути приготовлені з відомих сполук за допомогою методів, відомих фахівцям. Сполуки формули (C), в якій Y означає S, SO або SO2, є відомими сполуками (див., наприклад, E. R. Buchman, H. Cohen, Journal of the American Chemical Society (1944), 66, 847-8; A. W. D. Avison, F. Bergel, J. W. Haworth, US2408519: K. G. Mason, M. A. Smith, E. S. Stern, EJ. A. Elvidge, Journal of the Chemical Society [Section] C: Organic (1967), (21), 2171-6; T. A. Magee, Thomas A. DE 2033454; I. Tabushi, Y. Tamaru, Z. Yoshida, T. Sugimoto, Journal of the American Chemical Society (1975), 97(10), 2886-91; P. E. Aldrich, G. H. Berezin, B. I. Dittmar, I. Bruce, DE 2516554; I. Tabushi, Y. Tamaru, Z. Yoshida, Bulletin of the Chemical Society of Japan (1978), 51(4), 1178-82; D. N. Reinhoudt, J. Geevers, W. P. Trompenaars, S. Harkema, G. J. Van Hummel, Journal of Organic Chemistry (1981), 46(2), 424-34; F. Duus, Synthesis (1985), (6-7), 672-4; J. Schatz, Science of Synthesis (2002), 9, 287-422) або можуть бути приготовлені з відомих сполук за допомогою методів, відомих фахівцям. Сполуки формули (D) або є відомими сполуками, або можуть бути приготовлені шляхом формілювання сполуки формули (E), в якій Hal означає хлор, бром або йод (оптимально бром або йод). , 45 1 2 3 в якій R , R , R і r, а також Hal означають галоген згідно з визначенням вище. Оптимальними сполуками формули (D) є сполуки формули (D1) 5 UA 106494 C2 O R 1 H (R3 ) r R 20 (D1) R 1 5 10 15 20 30 , 3 20 30 де R , R і r відповідають визначенню вище; R і R , незалежно один від одного, означають водень, метил, метоксі, фтор, хлор або бром. Сполуки формули (D), які є новими, а також нові сполуки формули (D1) були спеціально розроблені в якості проміжних продуктів для синтезу сполук формули (I) і є ще одним варіантом цього винаходу. Застосовні умови для формілювання арилгалогенідів відомі і включають, наприклад, обробку арилгалогеніду застосовним металоорганічним реагентом (таким як ізопропілхлорид магнію, n-бутиллітій, сек-бутиллітій або трет-бутиллітій) або обробку застосовним лужним чи лужноземельним металом (таким як літій або магній) у відповідному розчиннику (такому як діетиловий ефір, диметоксіетан або тетрагідрофуран). Потім отриманий реагент арильної сполуки металу вступає в реакцію з застосовним формілюючим реагентом, таким як N, Nдиметилформамід або N-формілморфолін. Як варіант, сполуку формули (D) можна отримати зі сполуки формули (E) (в якій Hal може також означати псевдогалоген, такий як трифлат) шляхом обробки карбонілюючим агентом (таким як монооксид вуглецю) у присутності застосовного каталізатора, основи й відновлюючої речовини (див., наприклад, L. Ashfield & C. Barnard, Org. Process Res. Dev., 11 (1), 39-43, 2007). Сполуки формули (E) або є відомими сполуками (див., наприклад, публікацію WO 2008/071405), або можуть бути синтезовані з відомих проміжних продуктів за допомогою стандартних хімічних перетворень. Як варіант, сполуку формули (I) можна приготувати шляхом реакції сполуки формули (F) (в якій галогеном є хлор, бром або йод, оптимально хлор або бром) зі сполукою формули (D), як це продемонстровано в наступній схемі реакції. 3 (R ) r O 1 R 4 R Hal 5 R Y + R (F) O (R3 ) r O O 4 R R R R 2 6 R 7 2 1 5 R H H Y 6 R 7 (I) R (D) 25 30 35 40 Реакцію (F) і (D) можна проводити з застосовною основою, як варіант - у застосовному розчиннику за відповідної температури. Оптимально основою є гідроксид лужного або лужноземельного металу (такий як гідроксид натрію, гідроксид літію або гідроксид калію), алкоксид лужного або лужноземельного металу (такий як метилат натрію, етилат натрію або трет-бутилат калію), карбонат лужного або лужноземельного металу (такий як карбонат калію, карбонат натрію або бікарбонат натрію), амід металу (такий як діізопропіламід літію, гексаметилдисилазид літію або 2,2,6,6-тетраметилпіперидид), металоорганічний гідрид (такий як бутил літію або етил магній бромід) або гідрид металу (такий як гідрид натрію або гідрид калію). До застосовних розчинників належать хлоровані вуглеводні, ефіри, спирти, ароматичні сполуки й різні полярні апротонні розчинники, наприклад 1,2-диметоксіетан, тетрагідрофуран, 1,4-діоксан, діетиловий ефір, дибутиловий ефір, дихлорметан, дихлоретан, ацетонітрил, диметилсульфоксид, бензол, толуол, метанол, етанол, ізопропанол або трет-бутанол; їх вибирають за принципом сумісності з основою в умовах реакції. Реакцію також можна проводити у двохфазному середовищі, де реагент міжфазного переносу також зазвичай використовується в концентрації 0,001-50 мол. %. Реагентом міжфазного переносу оптимально є сіль четвертинної амонієвої основи, краун-ефір, полиетиленгліколь або сіль фосфонію. Найоптимальніше реакцію проводять з використанням діізопропіламіду літію в тетрагідрофурані при температурі від -100 ºC до 60 ºC. Перетворення сполуки формули (F) у сполуку формули (I) 6 UA 106494 C2 5 10 15 20 25 30 можна вважати прикладом конденсації Дарзана (див., наприклад, W. N. Wassef, M. M. El-Barky, Journal of Chemical Research, Synopses (1990), (12), 402-3; J. Li, X. Liu, X. Li, Youji Huaxue (2007), 27(11), 1428-1431; Y. Tong, Y. Cheng, X. Guo, S. Wu, Hecheng Huaxue (2007), 15(1), 102-104; C. Parmenon, J. Guillard, D. Caignard, N. Hennuyer, B. Staels, V. Audinot-Bouchez, J. Boutin, C. Dacquet, A. Ktorza, M. Viaud-Massuard, Bioorganic & Medicinal Chemistry Letters (2008), 18(5), 1617-1622; H. Xiao, X. Han, J. Xiong, Faming Zhuanli Shenqing Gongkai Shuomingshu (2007), p11; J. M. Concellon, E. Bardales, R. Llavona, Journal of Organic Chemistry (2003), 68(4), 1585-1588), але така трансформація невідома для сполук типу (F). Сполуки формули (F), в якій Y означає O, або є відомими сполуками (див., наприклад, H. Richet, R. Dulou, R., G. Dupont, Bulletin de la Societe Chimique de France (1947), 693-9; H. Richet, Ann. Chim. [12] (1948), 3 317-54; Коробицина И. К., Юрьев Ю. К., Чебурков Ю. А., Лукина Э.М., Журнал общей химии (1955), 25, 734-8; I. Коробицина И. К., Юрьев Ю. К., Чебурков Ю. А., Лукина Э.М., Журнал общей химии (1955), 25, 690-702; F. Leonard, A. Wajngurt, H. Horn, Journal of Organic Chemistry (1956), 21, 1400-4; Коробицина И.К., Жукова И.Г., Кувшинова В.А., Гайдамович Н.Н., Юрьев Ю.К., Доклады Академии наук СССР (1957), 114, 327-30; Коробицина И. К., Жукова И.Г., Юрьев Ю.К., Журнал общей химии (1959), 29, 2190-6; Коробицина И. К., Родина Л.Л., Сташкова Л.М., Химия гетероциклических соединений (1966), (6), 843-7; G. Hoehne, F. Marschner, K. Praefcke, P. Weyerstahl, Chem. Ber. (1975), 108(2), 673-82; H. Saimoto, T. Hiyama, H. Nozaki, Bull. Chem. Soc. Jpn., (1983), 56(10), 3078-87; Звонок А.М., Кузьменок Н.М., Тищенко И.Г., Станишевский Л.С., Журнал общей химии (1985), 21(6), 1330-4), або можуть бути приготовлені зі сполук формули (C) за відомих умов. Сполуки формули (F), у якій Y означає S, SO і SO2, або є відомими сполуками (див., наприклад, M. Polievka, L. Uhlar, V. Patek, Petrochemia (1973), 13(5-6), 156-60; N. N. Novitskaya, B. V. Flekhter, G. M. Prokhorov, A. S. Lukmanova, G. A. Tolstikov, G. V. Leplyanin, S. A. Lange, M. V. Strashnov, SU 468920 A1; P. H. McCabe, W. Routledge, Tetrahedron Letters (1976), (1), 85-6; T. S. Chou, C. Y. Tsai, Tetrahedron Letters (1992), 33(29), 4201-4), або можуть бути приготовлені зі сполук формули (C) за відомих умов. Сполуки формули (F), в якій Y означає C=O, можна приготувати зі сполук формули (C) за аналогічних умов галогенізації. Цей винахід детальніше продемонстрований у поданих нижче прикладах, але не обмежується ними. Приклади отримання: Приклад P1. Отримання 4-(5-бром-2-етилфеніл)-2,2,6,6-тетраметилпіран-3,5-діону OH Br O 35 O Етап 1. Отримання 5-бром-2-етилбензальдегіду O Br H 40 45 До розчину 4-бром-1-етил-2-йодбензолу (31,8 г, 103 ммоль) (опис див. у публікації WO 2008/071405) в безводному тетрагідрофурані (250 мл) при -20 °C краплями додають ізопропілхлорид магнію (55 мл, 110 ммоль, 2M розчину в тетрагідрофурані) протягом 10 хвилин. Після завершення додавання реакційну суміш перемішують при температурі -20 °C протягом 3 годин, потім краплями додають безводний N, N-диметилформамід (16,0 мл, 200 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом додаткових 2,5 годин, потім залишають стояти на ніч. Додають 2M соляної кислоти (90 мл), і неочищений продукт екстрагують у дихлорметані. Органічні речовини об'єднують, висушують над сульфатом магнію, 7 UA 106494 C2 потім фільтрують, і фільтрат випарюють при зниженому тиску для отримання 5-бром-2етилбензальдегіду (21,20 г) у вигляді рідини помаранчевого кольору. Етап 2. Отримання 4-(5-бром-2-етилбензиліден)-2,2,5,5-тетраметилдигідрофуран-3-ону Br O H O 5 10 15 До дуже холодного розчину дигідро-2,2,5,5-тетраметил-3(2H)-фуранону (13,4 г, 94,34 ммоль) у безводному 1,2-диметоксіетані (32 мл) додають одну порцію метилату натрію (5,6 г, 103,8 ммоль), реакційну суміш перемішують за даної температури протягом 5 хвилин. Потім до отриманої суспензії краплями додають розчин 5-бром-2-етилбензальдегіду (20 г, 94,34 ммоль) в 1,2-диметоксіетані (32 мл) протягом 10 хвилин. Потім розчин перемішують при температурі 0 °C протягом 1 години, розводять діетиловим ефіром і промивають 2M соляної кислоти (x 2). Органічні фракції об'єднують, висушують над сульфатом магнію, фільтрують, і фільтрат випарюють під вакуумом для отримання 4-(5-бром-2-етилбензиліден)-2,2,5,5тетраметилдигідрофуран-3-ону (30,2 г) у вигляді рідини жовтого кольору. Етап 3. Отримання 2-(5-бром-2-етилфеніл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7ону Br O O H O 20 25 30 35 До розчину 4-(5-бром-2-етилбензиліден)-2,2,5,5-тетраметилдигідрофуран-3-ону (32,07 г, 95,15 ммоль) в метанолі (1570 мл) при 35 ºC додають 50 %-й водний розчин пероксиду водню (8,10 мл, 142,73 ммоль), відразу після чого додають водний розчин 2M гідроксиду літію (9,51 мл, 19,03 ммоль). Цю реакційну суміш перемішують при температурі 35 ºC рівно протягом 1 години, потім гасять насиченим метабісульфітом натрію (340 мл) і дистильованою водою (340 мл). Після перемішування при кімнатній температурі протягом 15 хвилин розчинники випарюють під вакуумом (до близько 500 мл), за цей час продукт виділяється у вигляді твердої речовини жовтого кольору. До цієї суспензії додають дистильовану воду (500 мл), і продукт виокремлюють шляхом фільтрації. Після додаткового промивання дистильованою водою тверду речовину сушать під вакуумом всю ніч для отримання 2-(5-бром-2-етилфеніл)-4,4,6,6тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону (29,30 г) у вигляді твердої речовини жовтого кольору, яка використовується в наступному етапі без очистки. 1H NMR (CDCl3): δ 7,47-7,40 (m, 2H), 7,10 (d, 1H), 4,43 (s, 1H), 2,62-2,60 (m, 2H), 1,40 (s, 3H), 1,37 (s, 3H), 1,30-1,20 (m, 6H), 0,78 (s, 3H). Етап 4. Отримання 4-(5-бром-2-етилфеніл)-2,2,6,6-тетраметилпіран-3,5-діону OH Br O O 8 UA 106494 C2 5 10 До дуже холодного розчину концентрованої сірчаної кислоти (2 мл) протягом 5 хвилин краплями додають другий розчин 2-(5-бром-2-етилфеніл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-ону (0,995 г, 2,82 ммоль) в 1,2-дихлоретані (2 мл). Цю двохфазну суміш енергійно перемішують протягом 1 години при 0 ºC, потім виливають у дуже холодну воду (15 мл). Потім цей водний розчин випарюють під вакуумом для видалення всіх органічних летючих компонентів, отримуючи тим самим сипучу тверду речовину. Тверду речовину фільтрують, сушать під вакуумом, потім промивають гексанами для отримання 4-(5-бром-2-етилфеніл)2,2,6,6-тетраметилпіран-3,5-діону (0,81 г) у вигляді твердої речовини кремового кольору. 1H NMR (CDCl3): δ7,48 (1H, dd), 7,23-7,21 (2H, m), 5,60 (1H, s), 2,45-2,33 (2H, m), 1,60 (6H, d), 1,48 (6H, d), 1,10 (3H, t). Приклад P2. Отримання 4-(5-бром-2-етилфеніл)-2,2,6-триметилпіран-3,5-діону OH Br O O 15 Етап 1. Отримання 4-бром-2,2,5-триметилдигідро-фуран-3-ону O Br O 20 25 30 До розчину ефіру 4-бром-2,2,5-триметил-2,5-дигідрофуран-3-іл оцтової кислоти (19,14 г, 0,11 ммоль) (опис див. тут: T.Hiyama et al. Bull. Chem. Soc. Jpn., 56, 3078-3087 (1983)) у безводному хлороформі (75 мл) при -20ºC протягом 45 хвилин краплями додають розчин брому (18,00 г, 0,11 моль) у безводному хлороформі (200 мл). Після перемішування при цій температурі протягом 30 хвилин реакційну суміш залишають нагріватися до кімнатної температури, потім додатково перемішують протягом 1 години. Після розведення хлороформом (250 мл) органічну фазу промивають розведеним водним розчином бікарбонату натрію, потім розсолом, після чого фази розділяють. Органічні розчинники видаляють при зниженому тиску для отримання 4-бром2,2,5-триметилдигідро-фуран-3-ону (23,50 г) у вигляді олії темно-помаранчевого кольору. Цей матеріал використовується в наступному етапі без очистки. Етап 2. Отримання 2-(5-бром-2-етилфеніл)-4,6,6-триметил-1,5-діоксаспіро[2.4]гептан-7-ону Br O O O 35 40 H До розчину діізопропіламіду літію (0,12 моль) у безводному тетрагідрофурані (150 мл) при 70 ºC додають другий розчин 4-бром-2,2,5-триметил-4,5-дигідро-3(2H)-фуранону (23,5 г, 0,11 моль) у безводному тетрагідрофурані (40 мл) з такою швидкістю, щоб утримувати внутрішню температуру нижче -65ºC. Після завершення додавання реакційну суміш перемішують при температурі -70ºC протягом додаткових 20 хвилин, потім протягом 20 хвилин краплями додають 2-етил-5-бромбензальдегід (23,9 г, 0,11 моль) у формі розчину в безводному тетрагідрофурані (40 мл). Після подальшого перемішування при -70ºC протягом 20 хвилин реакційну суміш 9 UA 106494 C2 5 10 залишають нагріватися до кімнатної температури, потім перемішують протягом додаткових 30 хвилин. Реакційну суміш потім гасять, виливаючи її в лід/воду (окислену до pH 3 2M соляної кислоти) (500 мл) і екстрагують етилацетатом (3 × 100 мл). Органічні фракції об'єднують, промивають водою та розсолом, потім висушують над сульфатом магнію. Суспензію фільтрують і фільтрат випарюють під вакуумом для отримання суміші 2-(5-бром-2-етилфеніл)4,6,6-триметил-1,5-діоксаспіро[2.4]гептан-7-ону й 2-етил-5-бромбензальдегіду (40,50 г), у приблизному співвідношенні 3:1. Цей матеріал використовується в наступному етапі без очистки. 1H NMR (CDCl3): δ 7,47 (m, 1H), 7,41 (m, 1H), 7,10 (d, 1H), 4,47 (q, 1H), 4,39 (s, 1H), 2,60 (q, 2H), 1,38 (s, 3H), 1,35 (s, 3H), 1,23 (t, 3H), 0,70 (d, 3H). Етап 3. Отримання 4-(5-бром-2-етилфеніл)-2,2,6-триметилпіран-3,5-діону OH Br O 15 20 25 30 O До дуже холодної концентрованої сірчаної кислоти (50 мл) додають розчин неочищеного 2(5-бром-2-етилфеніл)-4,6,6-триметил-1,5-діоксаспіро[2.4]гептан-7-ону (40 г) в 1,2-дихлоретані (50 мл) протягом 20 хвилин. Після подальшого перемішування при 0 ºC протягом 1 години реакційну суміш обережно виливають у лід (500 г) і дві фази розділяють. Водну фазу далі екстрагують дихлорметаном (2 × 100 мл), потім усі органічні фракції об'єднують, промивають водою й випарюють при зниженому тиску. Неочищений продукт повторно розчиняють в етилацетаті (500 мл), екстрагують у 0,5M водного розчину карбонату калію й промивають додатковою кількістю етилацетату (x 2). Водну фазу потім обережно окислюють концентрованою соляною кислотою й продукт екстрагують етилацетатом (3 × 150 мл). Органічні фракції об'єднують, промивають розсолом, потім висушують над сульфатом магнію, фільтрують і фільтрат випарюють під вакуумом. Неочищений продукт потім далі очищують за допомогою колонкової флеш-хроматографії для отримання 4-(5-бром-2-етилфеніл)-2,2,6-триметилпіран3,5-діону (14,10 г) у вигляді білої піни. 1H NMR (CDCl3): δ1,08 (m, 3H), 1,38-1,62 (m, 9H), 2,25 (m, 2H), 4,38 і 4,71 (m, 1H), 5,72 і 5,83 (2 x br. s, 1H), 7,20 (m, 2H), 7,48 (m, 1H). Приклад P3. 4-(4'-хлор-4-трифторметилбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5-діон F F F OH O O Cl Етап 1. Отримання 4'-хлор-4-трифторметил-біфеніл-3-карбальдегіду 35 F F F O H 40 Cl До суміші 3-хлор-6-трифторметилбензальдегіду (1,0 г, 4,79 ммоль), 4-хлорфеніл боронової кислоти (1,12 г, 7,19 ммоль), фосфату калію (2,03 г, 9,59 ммоль), дициклогексил-(2',6'-диметоксібіфеніл-2-іл)-фосфан (0,079 г, 0,19 ммоль) та ацетату паладію (0,022 г, 0,096 ммоль) додають 10 UA 106494 C2 5 10 дегазований толуол (9 мл), потім суміш додатково очищують за допомогою азоту. Після цього суспензію закупорюють, потім перемішують при кімнатній температурі протягом 5 хвилин і нагрівають при температурі 160 ºC протягом 1 години мікрохвильовим опроміненням. Після охолодження реакційну суміш розподіляють між 2M соляної кислоти й дихлорметаном, а потім водну фазу далі екстрагують дихлорметаном (x 2). Органічні фракції об'єднують, потім випарюють при зниженому тиску для отримання неочищеного продукту, який очищують за допомогою колонкової флеш-хроматографії (100 % гексану до 10 % етилацетату в гексанах у якості елюенту) для отримання 4'-хлор-4-трифторметил-біфеніл-3-карбальдегіду (1,78 г) у вигляді камеді помаранчевого кольору. Цей матеріал використовується безпосередньо в наступному етапі. Етап 2. Отримання 4-[1-(4'-хлор-4-трифторметилбіфеніл-3-іл)метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону F F F O Cl O 15 20 25 До дуже холодного розчину 2,2,5,5-тетраметилдигідрофуран-3-ону (0,887 г, 6,25 ммоль) в 1,2-диметоксіетані (10 мл) додають одну порцію метилату натрію (0,405 г, 7,50 ммоль). Реакційну суміш перемішують при температурі 0 ºC протягом 30 хвилин, потім краплями додають 4'-хлор-4-трифторметилбіфеніл-3-карбальдегід (1,779 г, 6,25 ммоль) у вигляді розчину в 1,2-диметоксіетані (10 мл). Реакційну суміш перемішують при температурі 0 ºC протягом 30 хвилин і потім при кімнатній температурі ще протягом 1 години, після чого її розподіляють між 1M соляної кислоти й дихлорметаном. Водну фазу знову екстрагують дихлорметаном, потім усі органічні фракції об'єднують і випарюють для отримання 4-[1-(4'-хлор-4-трифторметилбіфеніл3-іл)метиліден]-2,2,5,5-тетраметилдигідрофуран-3-ону (2,50 г) у вигляді камеді жовтого кольору. Цей матеріал використовується безпосередньо в наступному етапі. Етап 3. Отримання 2-(4'-хлор-4-трифторметилбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-ону F F F O O Cl O 30 35 40 До розчину 4-[1-(4'-хлор-4-трифторметилбіфеніл-3-іл)метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону (2,50 г, 6,12 ммоль) в метанолі (75 мл) при 35 ºC додають 50 % водний розчин пероксиду водню (0,70 мл, 12,2 ммоль), відразу після чого додають водний розчин 2M гідроксиду літію (0,76 мл, 1,52 ммоль). Цю суміш перемішують при температурі 35 ºC протягом 45 хвилин, потім залишають вистигати до кімнатної температури й гасять насиченим розчином метабісульфіту натрію. Неочищений продукт екстрагують діетиловим ефіром (x 2), потім усі органічні фракції об'єднують і висушують над сульфатом магнію. Після фільтрації фільтрат випарюють під вакуумом для отримання 2-(4'-хлор-4-трифторметилбіфеніл-3-іл)4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону (2,59 г) у вигляді камеді жовтого кольору. Цей матеріал використовується безпосередньо в наступному етапі. Етап 4. Отримання 4-(4'-хлор-4-трифторметилбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5діону 11 UA 106494 C2 F F F OH O 5 10 Cl O До дуже холодного розчину неочищеного 2-(4'-хлор-4-трифторметилбіфеніл-3-іл)-4,4,6,6тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону (2,59 г, 6,12 ммоль) в дихлоретані (25 мл) додають концентровану сірчану кислоту (5 мл), потім перемішують при цій температурі протягом 2 годин. Реакційну суміш виливають у лід, екстрагують дихлорметаном (x 2), і об'єднані органічні фракції випарюють при зниженому тиску з отриманням камеді коричневого кольору. Очистка за допомогою колонкової флеш-хроматографії (ізогексан до 30 %-го етилацетату в ізогексані у якості елюенту), а потім за допомогою оберненофазної препаративної ВЕРХ дозволяє отримати 4-(4'-хлор-4-трифторметилбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5-діон (0,370 г) у вигляді твердої речовини білого кольору. 1H NMR (CDCl3): δ7,85 (d, 1H), 7,69 (d, 1H), 7,53 (d, 2H), 7,44 (d, 2H), 7,39 (s, 1H), 1,60 (app. d, 6H), 1,48 (s, 6H). Приклад P4. Отримання 4-(5-бром-2-йодфеніл)-2,2,6,6-тетраметилпіран-3,5-діону 15 OH I Br O O Етап 1. Отримання 5-бром-2-йодбензальдегіду I O 20 25 30 35 Br H До розчину 5-бром-2-йодбензонітрилу (5,00 г, 16,00 ммоль) у безводному тетрагідрофурані (80 мл) при -0 ºC краплями додають діізобутил алюміній гідрид (16,0 мл, 16,0 ммоль, 1М розчину в толуолі) протягом 10 хвилин. Реакційну суміш перемішують при температурі -0 ºC протягом 1 години, потім залишають нагріватися до температури навколишнього середовища й перемішують усю ніч. Потім краплями додають додаткову кількість діізобутилу алюмінію гідриду (16,0 мл, 16,0 ммоль, 1M розчину в толуолі) при кімнатній температурі й реакційну суміш додатково перемішують протягом 1 години. Після обережного гасіння 2M соляної кислоти (охолодження в ванні з льодом) неочищений продукт екстрагують етилацетатом (x 2), потім усі органічні фракції об'єднують, висушують над сульфатом магнію й фільтрують. Фільтрат випарюють при зниженому тиску, потім очищують за допомогою колонкової флешхроматографії (ізогексан до 10 %-го етилацетату в ізогексановому елюенті) для отримання 5бром-2-йодбензальдегіду (0,85 г). Етап 2. Отримання 4-[1-(5-бром-2-йодфеніл)метиліден]-2,2,5,5-тетраметилдигідрофуран-3ону 12 UA 106494 C2 I Br O O 5 10 До дуже холодного розчину 2,2,5,5-тетраметилдигідрофуран-3-ону (0,388 г, 2,73 ммоль) у безводному 1,2-диметоксіетані (5 мл) додають одну порцію метилату натрію (0,177 г, 3,27 ммоль). Реакційну суміш перемішують при цій температурі протягом 5 хвилин, потім краплями додають 5-бром-2-йодбензальдегід (0,850 г, 2,73 ммоль) у вигляді розчину в 1,2-диметоксіетані (5 мл). Реакційну суміш далі перемішують при температурі 0 ºC протягом 30 хвилин, потім при кімнатній температурі протягом 1 години. Після розподілу між 1M соляної кислоти й дихлорметаном органічну фазу розділяють, а водну фазу знову екстрагують додатковою кількістю дихлорметану. Усі органічні фракції об'єднують, потім випарюють під вакуумом для отримання 4-[1-(5-бром-2-йодфеніл)метиліден]-2,2,5,5-тетраметилдигідрофуран-3-ону (1,18 г) у вигляді камеді жовтого кольору. Етап 3. Отримання 2-(5-бром-2-йодфеніл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7ону 15 I Br O O O 20 25 До розчину 4-[1-(5-бром-2-йодфеніл)метиліден]-2,2,5,5-тетраметилдигідрофуран-3-ону (1,18 г, 2,73 ммоль) в метанолі (50 мл) при 35 ºC додають 50 %-й водний розчин пероксиду водню (0,31 мл, 5,46 ммоль), відразу після чого додають 2M водного розчину гідроксиду літію (0,34 мл, 0,68 ммоль). Цю суміш перемішують при температурі 35 ºC протягом 3 годин, потім гасять насиченим водним метабісульфітом натрію й екстрагують дихлорметаном. Органічну фазу розділяють, а водну фазу екстрагують знову дихлорметаном. Усі органічні фракції об'єднують, потім випарюють при зниженому тиску для отримання 2-(5-бром-2-йодфеніл)-4,4,6,6тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону у вигляді олії, яка використовується безпосередньо в наступному етапі. Етап 4. Отримання 4-(5-бром-2-йодфеніл)-2,2,6,6-тетраметилпіран-3,5-діону OH I Br O O 30 35 До неочищеного 2-(5-бром-2-йодфеніл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону (з етапу 3) додають дуже холодну концентровану сірчану кислоту, потім реакційну суміш перемішують при кімнатній температурі протягом 30 хвилин. Після розведення з дистильованою водою продукт екстрагують дихлорметаном (x 2), потім об'єднані органічні фази випарюють при зниженому тиску. Очистка за допомогою колонкової флеш-хроматографії (20 %-го етилацетату в ізогексані до етилацетату в якості елюенту) дозволяє отримати 4-(5-бром-2-йодфеніл)-2,2,6,6тетраметилпіран-3,5-діон (0,225 г) у вигляді твердої речовини бежевого кольору. 13 UA 106494 C2 1H NMR (CDCl3): δ7,80 (d, 1H), 7,33 (m, 1H), 7,25 (m, 1H), 1,66 (s, 3H), 1,60 (s, 3H), 1,55 (s, 3H), 1,48 (s, 3H). Приклад P5. Отримання 4-(5-бром-2-трифторметоксіфеніл)-2,2,6,6-тетраметилпіран-3,5діону 5 F F F O OH Br O O Етап 1. Отримання тетраметилдигідрофуран-3-ону 4-[1-(5-бром-2-трифторметоксіфеніл)-метиліден]-2,2,5,5 10 F F F O Br O O 15 20 До дуже холодного розчину 2,2,5,5-тетраметилдигідрофуран-3-ону (2,84 г, 20,00 ммоль) у безводному 1,2-диметоксіетані (6 мл) додають одну порцію метилату натрію (1,19 г, 22,04 ммоль). Після перемішування при цій температурі протягом 5 хвилин додають розчин 5-бром-2трифторметоксібензальдегіду (4,84 г, 18,00 ммоль) в 1,2-диметоксіетані (6 мл) протягом 10 хвилин, потім перемішують при температурі 0 °C протягом ще 1 години. Після нагрівання до кімнатної температури реакційну суміш розводять ефіром і промивають 2M соляної кислоти (x 2). Органічні фракції об'єднують, висушують над сульфатом магнію, фільтрують, і фільтрат випарюють під вакуумом для отримання 4-[1-(5-бром-2-трифторметоксіфеніл)-метиліден]2,2,5,5-тетраметилдигідрофуран-3-ону (7,06 г) у вигляді рідини помаранчевого кольору. Етап 2. Отримання 2-(5-бром-2-трифторметоксіфеніл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-ону F F F O Br O O O 25 До розчину 4-[1-(5-бром-2-трифторметоксіфеніл)-метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону (7,06 г, 18,00 ммоль) в метанолі (300 мл) при 35 ºC додають 50 %-й водний розчин пероксиду водню (1,80 мл, 27,00 ммоль), відразу після чого додають 2M 14 UA 106494 C2 5 10 водного розчину гідроксиду літію (1,80 мл, 3,60 ммоль). Після перемішування при цій температурі протягом 1 години реакційну суміш залишають вистигати, потім гасять 10 %-м розчином метабісульфіту натрію (негативний тест за допомогою йодкрохмального індикаторного паперу). Реакційну суміш екстрагують діетиловим ефіром (x 3), потім органічну фазу далі промивають насиченим водним розчином бікарбонату натрію (x 2), потім розсолом. Усі органічні фракції об'єднують, висушують над сульфатом магнію, фільтрують, і фільтрат випарюють під вакуумом для отримання 2-(5-бром-2-трифторметоксіфеніл)-4,4,6,6-тетраметил1,5-діоксаспіро[2.4]гептан-7-ону (6,34 г, 86 %) у вигляді олії жовтого кольору. 1H NMR (CDCl3): δ 7,84 (s, 0,4H, ізомер A), 7,56 (s, 0,6H, ізомер B), 7,52 (d, 0,6H, ізомер B), 7,48 (d, 0,4H, ізомер A), 7,15 (d, 0,6H, ізомер B), 7,07 (d, 0,4H, ізомер A), 4,46 (m, 1H, ізомери A й B), 1,47 (s, 1,2H, ізомер A), 1,39-1,28 (m, 7,8H, ізомери A й B), 1,12 (s, 1,2H, ізомер A), 0,83 (s, 1,8H, ізомер B). Етап 3. Отримання 4-(5-бром-2-трифторметоксіфеніл)-2,2,6,6-тетраметилпіран-3,5-діону F F F O OH Br O O 15 20 25 До дуже холодного розчину концентрованої сірчаної кислоти (10 мл) краплями додають другий розчин 2-(5-бром-2-трифторметоксіфеніл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан7-ону (6,34 г, 15,00 ммоль) в 1,2-дихлоретані (10 мл) протягом 5 хвилин. Цю двохфазну суміш енергійно перемішують протягом 2 годин при 0 ºC, потім виливають у дуже холодну воду, промиваючи невеликою кількістю додаткового 1,2-дихлоретану/води. Потім цей водний розчин випарюють під вакуумом для видалення всіх органічних розчинників до утворення сипучої твердої речовини. Тверду речовину фільтрують, промивають водою, потім ізогексаном і після цього сушать під вакуумом усю ніч. Потім тверду речовину повторно розводять в етилацетаті, висушують над сульфатом магнію, фільтрують і фільтрат випарюють під вакуумом для отримання 4-(5-бром-2-трифторметоксіфеніл)-2,2,6,6-тетраметилпіран-3,5-діону (4,17 г, 68 %). 1H NMR (CDCl3): δ7,57 (dd, 1H), 7,24 (d, 2H), 1,52 (br.s, 12H). Приклад P6. Отримання 4-(4-бром-4'-хлорбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5-діону Br OH O Cl O 30 Етап 1. Отримання 4-бром-4'-хлор-біфеніл-3-карбальдегіду Br O H Cl 35 До розчину 4-бром-4'-хлор-3-йодбіфенілу (4,80 г, 0,012 моль) (опис див. у публікації WO 2008/071405) у безводному діетиловому ефірі/тетрагідрофурані (120 мл, співвідношення 1:1) при температурі -75 ºC краплями додають ізопропілхлорид магнію (18,96 мл, 15 %-й розчин у тетрагідрофурані), щоб утримати внутрішню температуру нижче -70 ºC. Після завершення 15 UA 106494 C2 5 10 додавання реакційну суміш перемішують при температурі -75 ºC протягом 2 годин, потім нагрівають до -45 ºC. Потім краплями додають безводний N, N-диметилформамід (1,71 г, 0,0184 моль), підтримуючи температуру нижче -0 ºC, потім нагріваючи до кімнатної температури й гасячи 2M соляної кислоти (60 мл). Після цього реакційну суміш розводять діетиловим ефіром, дві фази розділяють, і водну фазу екстрагують додатковою кількістю діетилового ефіру. Об'єднані органічні екстракти промивають розсолом, висушують над сульфатом магнію, фільтрують, і фільтрат випарюють під вакуумом. Неочищений продукт очищують за допомогою колонкової флеш-хроматографії (2 % етилацетату в гексановому елюенті) для отримання 4бром-4'-хлор-біфеніл-3-карбальдегіду (2,7 г, 75 %) у вигляді твердої речовини білого кольору. Етап 2. Отримання 4-[1-(4-бром-4'-хлорбіфеніл-3-іл)-метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону Br O Cl O 15 20 25 До дуже холодного розчину дигідро-2,2,5,5-тетраметилфуран-3-ону (1,37 г, (9,68 ммоль)) у безводному 1,2-диметоксіетані (10 мл) додають одну порцію метилату натрію (0,575 г, 10,60 ммоль), потім реакційну суміш перемішують при цій температурі протягом 10 хвилин. Потім до цієї суспензії краплями додають другий розчин 4-бром-4'-хлор-біфеніл-3-карбальдегіду (2,60 г, 8,80 ммоль) в 1,2-диметоксіетані (10 мл). По завершенні додавання реакційну суміш перемішують при температурі 0 °C протягом ще 1 години, потім гасять 2M соляної кислоти (50 мл). Після додаткового перемішування протягом ще однієї 1 години розчин розводять діетиловим ефіром, дві фази розділяють, і водну фазу знову екстрагують діетиловим ефіром (x 2). Потім об'єднані органічні фракції промивають розсолом, після чого висушують над сульфатом магнію, фільтрують, і фільтрат випарюють під вакуумом для отримання 4-[1-(4-бром4'-хлорбіфеніл-3-іл)-метиліден]-2,2,5,5-тетраметилдигідрофуран-3-ону (3,40 г, 92 %) у вигляді камеді жовтого кольору. Етап 3. Отримання 2-(4-бром-4'-хлорбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-ону Br O O Cl O 30 35 40 До розчину 4-[1-(4-бром-4'-хлорбіфеніл-3-іл)-метиліден]-2,2,5,5-тетраметилдигідрофуран-3ону (3,40 г, 9,03 ммоль) в метанолі (140 мл) при 35 °C додають 50 %-й воднийрозчин пероксиду водню (1,04 мл, 15,60 ммоль), відразу після чого додають 2M водного розчину гідроксиду літію (1,15 мл, 2,30 ммоль). Реакційну суміш перемішують протягом додаткових 45 хвилин при температурі 35 °C, потім залишають вистигати до кімнатної температури й гасять насиченим розчином метабісульфіту натрію. Після екстрагування продукту діетиловим ефіром (x 3) органічну фазу розділяють, промивають додатковою кількістю води, після чого висушують над сульфатом магнію. Після фільтрації фільтрат випарюють під вакуумом для отримання 2-(4бром-4'-хлорбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону (3,0 г) у вигляді твердої речовини жовтого кольору. Цей матеріал достатньо очищений для використання безпосередньо під час наступного етапу. Етап 4. Отримання 4-(4-бром-4'-хлорбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5-діону 16 UA 106494 C2 Br OH O 5 10 Cl O До дуже холодного розчину 2-(4-бром-4'-хлорбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-ону (3,00 г, 6,90 ммоль) у дихлорметані (3,5 мл) додають концентровану сірчану кислоту (6,5 мл) із такою швидкістю, щоб утримувати внутрішню температуру нижче 5 °C. Після завершення додавання реакційну суміш перемішують ще 20 хвилин, після чого краплями додають дистильовану воду (25 мл) при температурі 0 °C. Температуру реакційної суміші підтримують у діапазоні 5-0 °C протягом 5 хвилин, потім суміш випарюють під вакуумом для видалення органічних розчинників. Водну фазу фільтрують, і отриману тверду речовину розтирають із гексаном для утворення 4-(4-бром-4'-хлорбіфеніл-3-іл)-2,2,6,6-тетраметилпіран3,5-діону (2,56 г, 85 %). NMR (CDCl3): δ7,75 (d, 1H), 7,49 (d, 2H), 7,45 (dd, 1H), 7,40 (s, 2H), 7,36 (s, 1H), 5,56 (br.s, 1H), 1,65 (s, 3H), 1,58 (s, 3H), 1,53 (s, 3H), 1,47 (s, 3H). Приклад P7. Отримання 4-(5-бром-2-фторфеніл)-2,2,6,6-тетраметилпіран-3,5-діону 15 F OH Br O O Етап 1. Отримання 4-[1-(5-бром-2-фторфеніл)-метиліден]-2,2,5,5-тетраметилдигідрофуран3-ону 20 F Br O O 25 30 35 До дуже холодного розчину дигідро-2,2,5,5-тетраметилфуран-3-ону (4,56 г, 32,10 ммоль) у безводному 1,2-диметоксіетані (25 мл) додають одну порцію метилату натрію (1,91 г, 35,10 ммоль). Після перемішування при кімнатній температурі протягом 10 хвилин краплями додають другий розчин 5-бром-2-фторбензальдегіду (5,93 г, 29,10 ммоль) у безводному 1,2диметоксіетані (45 мл), потім перемішують при температурі 0 °C протягом додаткових 45 хвилин. Реакційну суміш гасять 2M соляної кислоти (50 мл), потім розводять діетиловим ефіром, і дві фази розділяють. Водну фазу далі екстрагують діетиловим ефіром (x 2), потім усі органічні фракції об'єднують, промивають розсолом і висушують над сульфатом магнію. Після фільтрації фільтрат випарюють під вакуумом для отримання 4-[1-(5-бром-2-фторфеніл)метиліден]-2,2,5,5-тетраметилдигідрофуран-3-ону (9,30 г, 96 %) у вигляді камеді жовтого кольору. Етап 2. Отримання 2-(5-бром-2-фторфеніл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7ону 17 UA 106494 C2 F Br O O O 5 10 До розчину 4-[1-(5-бром-2-фторфеніл)-метиліден]-2,2,5,5-тетраметилдигідрофуран-3-ону (9,30 г, 29,00 ммоль) в метанолі (280 мл) при 35 °C додають 50 %-й водний розчин пероксиду водню (3,36 мл, 50,40 ммоль), відразу після чого додають 2M водного розчину гідроксиду літію (3,68 мл, 7,36 ммоль). Перемішування продовжують при цій температурі протягом 1 години, потім реакційну суміш залишають вистигати до кімнатної температури, після чого гасять насиченим метабісульфітом натрію (100 мл) і екстрагують ефіром (x 3). Органічні фракції об'єднують, висушують над сульфатом магнію, фільтрують і фільтрат випарюють під вакуумом для отримання 2-(5-бром-2-фторфеніл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону (6,60 г, 68 %) у вигляді камеді жовтого кольору. Етап 3. Отримання 4-(5-бром-2-фторфеніл)-2,2,6,6-тетраметилпіран-3,5-діону F OH Br O O 15 20 25 До розчину 2-(5-бром-2-фторфеніл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону (6,60 г, 19,30 ммоль) в дихлорметані (8 мл) краплями додають другий дуже холодний розчин концентрованої сірчаної кислоти (13,8 мл), утримуючи температуру нижче 5 °C. Реакційну суміш перемішують протягом додаткових 30 хвилин, потім гасять дистильованою водою (50 мл). Після перемішування протягом додаткових 10 хвилин органічні фракції видаляють під вакуумом, потім отриманий осад фільтрують і розтирають у порошок із водою. Після промивання гексанами тверду речовину сушать для отримання 4-(5-бром-2-фторфеніл)-2,2,6,6-тетраметилпіран-3,5діону (4,30 г, 65 %). 1H NMR (CDCl3): δ7,5 (m, 1H), 7,34 (m, 1H), 7,06 (m, 1H), 5,69 (br. s, 1H), 1,56 (d, 6H), 1,52 (d, 6H). Приклад P8. Отримання 4-(4'-хлор-4-циклопропіл-2'-фторбіфеніл-3-іл)-2,2,6,6тетраметилпіран-3,5-діону F OH O O Cl 30 Етап 1. Отримання 4'-хлор-2'-фтор-4-гідроксібіфеніл-3-карбальдегіду 18 UA 106494 C2 HO F O H 5 10 15 Cl До суміші 5-бромсаліцилового альдегіду (30,0 г, 0,15 моль) 2-фтор-4-хлорфеніл боронової кислоти (30,0 г, 0,17 моль) і карбонату натрію (24,0 г, 0,23 моль) додають 1,2-диметоксіетан (225 мл) і дистильовану воду (75 мл), потім суспензію перемішують в атмосфері азоту. Опісля до цієї суміші додають хлорид [1,1’-біс(дифенілфосфіно)ферроцен]паладію(II) (4,5 г, 7,5 ммоль), потім нагрівають із використанням рефлюксу всю ніч. Після охолодження до кімнатної температури й розведення дистильованою водою (500 мл) і дихлорметаном (500 мл) дві фази розділяють, і водну фазу знову екстрагують дихлорметаном (2 × 500 мл). Органічні фракції об'єднують, промивають розсолом (800 мл), потім висушують над сульфатом магнію. Суспензію фільтрують, і фільтрат випарюють під вакуумом. Потім неочищений продукт очищують за допомогою колонкової флеш-хроматографії (5–10 % етилацетату в ізогексановому елюенті) для отримання 4'-хлор-2'-фтор-4-гідроксібіфеніл-3-карбальдегіду (33,61 г, 89 %) у вигляді твердої речовини світло-жовтого кольору. Етап 2. Отримання ефіру 4'-хлор-2'-фтор-3-формілбіфеніл-4-іл трифторметансульфонової кислоти F F O F S O O F O H 20 25 30 Cl До дуже холодної суміші 4'-хлор-2'-фтор-4-гідроксібіфеніл-3-карбальдегіду (33,60 г, 0,13 моль) і піридину (31,0 мл, 0,36 моль) у безводному дихлорметані (700 мл) краплями додають трифторметансульфоновий ангідрид (27,0 мл, 0,16 ммоль) протягом 30 хвилин, утримуючи температуру нижче 10 ˚C. Потім реакційну суміш залишають нагріватися до кімнатної температури, після чого перемішують всю ніч. Після розведення дистильованою водою (500 мл) і дихлорметаном (500 мл) два шари розділяють, і водну фазу знову екстрагують дихлорметаном (2 × 500 мл). Органічні фракції об'єднують, промивають розсолом (800 мл), потім висушують над сульфатом магнію і випарюють під вакуумом. Неочищений продукт очищають за допомогою колонкової флеш-хроматографії (10 % етилацетату в гексановому елюенті) для отримання ефіру 4'-хлор-2'-фтор-3-формілбіфеніл-4-іл трифторметансульфонової кислоти у вигляді олії жовтого кольору. Етап 3. Отримання 4'-хлор-4-циклопропіл-2'-фторбіфеніл-3-карбальдегіду F O H 35 Cl До суміші ефіру 4'-хлор-2'-фтор-3-формілбіфеніл-4-іл трифторметансульфонової кислоти (30,0 г, 0,078 моль), циклопропілборонової кислоти (8,80 г, 0,10 моль), фосфату калію (58,40 г, 0,28 моль) і броміду натрію (8,0 г, 0,078 моль) додають толуол (300 мл), потім дистильовану воду (30 мл) в атмосфері азоту. Потім до цієї суміші додають одну порцію 19 UA 106494 C2 5 10 тетракіс(трифенілфосфін) паладію (9,60 г, 8,40 ммоль), і суміш нагрівають при 100 ˚C всю ніч. Після охолодження до кімнатної температури суміш розводять дистильованою водою (500 мл) і етилацетатом (500 мл), два шари розділяють, і водну фазу знову екстрагують етилацетатом (2 × 500 мл). Органічні фракції об'єднують, промивають дистильованою водою (1 л), потім розсолом (1 л), після чого висушують над сульфатом магнію. Суспензію фільтрують, і фільтрат випарюють під вакуумом. Неочищений продукт очищують за допомогою колонкової флешхроматографії на силікагелі, потім додатково за допомогою колонкової флеш-хроматографії на лужному оксиді алюмінію (10 % етилацетату в гексані в якості елюенту) для отримання 4'-хлор4-циклопропіл-2'-фторбіфеніл-3-карбальдегіду (7,6 г, 36 %). Етап 4. Отримання 4-[1-(4'-хлор-4-циклопропіл-2'-фторбіфеніл-3-іл)метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону F O Cl O 15 20 25 До дуже холодного розчину дигідро-2,2,5,5-тетраметилфуран-3-ону (8,40 г, 0,059 моль) у безводному 1,2-диметоксіетані (75 мл) додають одну порцію метилату натрію (3,60 г, 0,066 моль), і реакційну суміш перемішують при цій температурі протягом 30 хвилин. Потім протягом 20 хвилин краплями додають розчин 4'-хлор-4-циклопропіл-2'-фторбіфеніл-3-карбальдегіду (14,80 г, 0,054 ммоль), утримуючи температуру нижче 10 °C. Реакційну суміш перемішують при цій температурі протягом 1 години, потім залишають нагріватися до кімнатної температури до її розведення діетиловим ефіром і дистильованою водою. Дві фази розділяють, і водну фазу екстрагують знову діетиловим ефіром (х 2). Органічні фракції об'єднують, промивають розсолом, потім висушують над сульфатом магнію. Суспензію фільтрують, і фільтрат випарюють під вакуумом для отримання 4-[1-(4'-хлор-4-циклопропіл-2'-фторбіфеніл-3іл)метиліден]-2,2,5,5-тетраметилдигідрофуран-3-ону (19,80 г), який достатньо очищений для безпосереднього використання на наступному етапі. Етап 5. 2-(4'-хлор-4-циклопропіл-2'-фторбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-он F O O Cl O 30 35 40 До розчину 4-[1-(4'-хлор-4-циклопропіл-2'-фторбіфеніл-3-іл)метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону (19,80 г, 0,050 ммоль) в метанолі (830 мл) при температурі 35 ºC додають 50 %-й водний розчин пероксиду водню (5,00 мл, 0,075 ммоль), відразу після чого додають розчин 2M гідроксиду літію (5,00 мл, 0,01 моль). Суміш перемішують при кімнатній температурі протягом додаткових 2 годин, потім залишають вистигати до кімнатної температури. Потім реакційну суміш гасять 10 %-м метабісульфітом натрію (негативний тест за допомогою йодкрохмального індикаторного паперу) і розводять діетиловим ефіром. Більшу частину метанолу видаляють під вакуумом, а неочищену суміш розподіляють між дистильованою водою й діетиловим ефіром. Водну фазу далі екстрагують діетиловим ефіром (x 2), потім всі органічні фракції об'єднують і промивають насиченим бікарбонатом натрію (х 2), потім розсолом. Після висушування над сульфатом магнію суспензію фільтрують, і фільтрат 20 UA 106494 C2 5 випарюють під вакуумом для отримання 2-(4'-хлор-4-циклопропіл-2'-фторбіфеніл-3-іл)-4,4,6,6тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону (18,2 г) у вигляді піни помаранчевого кольору. Цей матеріал достатньо очищений для використання безпосередньо на наступному етапі без подальшої очистки. 1H NMR (CDCl3): δ 7,48 (s, 1H), 7,39 (d, 1H), 7,32 (t, 1H), 7,24-7,12 (m, 2H), 7,00 (d, 1H), 4,76 (s, 1H), 1,84-1,76 (m, 1H), 1,42-1,26 (m, 9H), 1,11-0,96 (m, 2H), 0,88-0,79 (m, 4H), 0,78-0,71(m, 1H). Етап 6. Отримання 4-(4'-хлор-4-циклопропіл-2'-фторбіфеніл-3-іл)-2,2,6,6-тетраметилпіран3,5-діону F OH O Cl O 10 15 20 25 30 До суміші 2-(4'-хлор-4-циклопропіл-2'-фторбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-ону (18,20 г, 0,044 моль) і трифлату іттербію (2,40 г, 4,40 ммоль) додають розчин 5M перхлорату літію (приготовлений з 46 мл діетилового ефіру й 24,40 г перхлорату літію). Отриману суспензію перемішують при кімнатній температурі протягом 3 днів, потім розводять діетиловим ефіром (85 мл) і додають додаткову кількість трифлату іттербію (7,80 г, 0,014 моль). Після перемішування при кімнатній температурі протягом подальших 3 днів додають додаткову кількість трифлату іттербію (13,63 г, 0,025 моль), і реакційну суміш перемішують протягом 11 днів. На завершення додають додаткову порцію перхлорату літію (24,40 г, 0,23 моль), і реакційну суміш нагрівають при температурі 27 ºC (внутрішня температура) протягом 1 дня. Реакційну суміш розподіляють між діетиловим ефіром і дистильованою водою, дві фази розділяють, і водну фазу екстрагують діетиловим ефіром (х 2). Органічні фракції об'єднують, промивають розсолом, потім висушують над сульфатом магнію. Суспензію фільтрують, і фільтрат випарюють під вакуумом. Неочищений матеріал очищують за допомогою колонкової флеш-хроматографії (10 % етилацетату в гексанах в якості елюенту) до утворення олії, яку розтирають у порошок із гексанами для отримання 4-(4'-хлор-4-циклопропіл2'-фторбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5-діону (4,78 г) у вигляді твердої речовини білого кольору. 1H NMR (CDCl3): δ 7,47 (d, 1H), 7,38 (t, 1H), 7,23 (s, 1H), 7,21-7,12 (m, 3H), 5,68 (s, 1H), 1,75 (m, 1H), 1,62 (s, 6H), 1,49 (s, 6H), 0,92-0,82 (m, 2H), 0,81-0,75 (m, 1H), 0,61-0,53 (m, 1H). Приклад P9. Отримання 4-(2',4'-дихлор-4-циклопропілбіфеніл-3-іл)-2,2,6,6-тетраметилпіран3,5-діону Cl OH O Cl O 35 Етап 1. Отримання 2',4'-дихлор-4-гідроксібіфеніл-3-карбальдегіду HO Cl O H 40 Cl До суміші 5-бромсаліцилового альдегіду (30,0 г, 0,15 моль), 2,4-дихлорфенілборонової кислоти (32,0 г, 0,17 моль) і карбонату натрію (24,0 г, 0,23 моль) додають 1,2-диметоксіетан (225 21 UA 106494 C2 5 10 мл) і дистильовану воду (75 мл), потім суспензію перемішують в атмосфері азоту. Опісля до цієї суміші додають хлорид [1,1’-біс(дифенілфосфіно)ферроцен]паладію(II) (4,5 г, 7,5 ммоль), потім нагрівають із використанням рефлюксу всю ніч. Після охолодження до кімнатної температури й розведення дистильованою водою (500 мл) і дихлорметаном (500 мл) дві фази розділяють, і водну фазу знову екстрагують дихлорметаном (2 × 500 мл). Органічні фракції об'єднують, промивають розсолом (800 мл), потім висушують над сульфатом магнію. Суспензію фільтрують, і фільтрат випарюють під вакуумом. На завершення неочищений продукт очищують за допомогою колонкової флеш-хроматографії (10 % етилацетату в ізогексановому елюенті) для отримання 2',4'-дихлор-4-гідроксібіфеніл-3-карбальдегіду (32,73 г, 82 %) у вигляді твердої речовини світло-жовтого кольору. Етап 2. Отримання ефіру 2',4'-дихлор-3-формілбіфеніл-4-іл трифторметансульфонової кислоти F F O S O O F Cl O H Cl 15 20 25 До дуже холодної суміші 2',4'-дихлор-4-гідроксібіфеніл-3-карбальдегіду (31,70 г, 0,12 моль) і піридину (25,0 мл, 0,29 моль) у безводному дихлорметані (650 мл) краплями додають трифторметансульфоновий ангідрид (22,0 мл, 0,13 ммоль) протягом 30 хвилин, утримуючи температуру в межах 0-10 ºC. Потім реакційну суміш залишають нагріватися до кімнатної температури, після чого перемішують усю ніч. Після розведення дистильованою водою (500 мл) і дихлорметаном (300 мл) два шари розділяють, і органічну фазу далі промивають насиченим водним розчином сульфату міді (3 × 500 мл), водою (500 мл), потім розсолом (500 мл). Після висушування над сульфатом магнію, розчинник видаляють під вакуумом, і неочищений продукт очищують за допомогою колонкової флеш-хроматографії (10 % етилацетату в гексановому елюенті) для отримання ефіру 2',4'-дихлор-3-формілбіфеніл-4-іл трифторметансульфонової кислоти у вигляді олії помаранчевого кольору. Етап 3. Отримання 2',4'-дихлор-4-циклопропілбіфеніл-3-карбальдегіду Cl O H Cl 30 35 40 45 До суміші ефіру 2',4'-дихлор-3-формілбіфеніл-4-іл трифторметансульфонової кислоти (30,0 г, 0,075 моль), циклопропілборонової кислоти (8,50 г, 0,097 моль), фосфату калію (56,30 г, 0,27 моль) і броміду натрію (7,7 г, 0,075 моль) додають толуол (300 мл), потім дистильовану воду (30 мл) в атмосфері азоту. Потім до цієї суміші додають одну порцію тетракіс(трифенілфосфін) паладію (9,30 г, 0,0081 моль), і потім суміш нагрівають при 100 ˚C всю ніч. Після охолодження до кімнатної температури суміш розводять дистильованою водою (500 мл) і етилацетатом (500 мл), два шари розділяють. Водну фазу знову екстрагують етилацетатом (2 × 500 мл), потім усі органічні фракції об'єднують, промивають дистильованою водою (1 л), потім розсолом (1 л). Після висушування над сульфатом магнію суспензію фільтрують, і фільтрат випарюють під вакуумом. Неочищений продукт очищують за допомогою колонкової флеш-хроматографії на силікагелі (2-10 % етилацетату в гексанах в якості елюенту), потім додатково за допомогою колонкової флеш-хроматографії на лужному оксиді алюмінію (10 % етилацетату в гексані в якості елюенту) для отримання 2',4'-дихлор-4-циклопропілбіфеніл-3-карбальдегіду (11,7 г, 54 %). Етап 4. Отримання 4-[1-(2',4'-дихлор-4-циклопропілбіфеніл-3-іл)-метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону 22 UA 106494 C2 Cl O Cl O 5 10 15 20 До дуже холодного розчину дигідро-2,2,5,5-тетраметилфуран-3-ону (15,70 г, 0,11 моль) у безводному 1,2-диметоксіетані (285 мл) додають одну порцію метилату натрію (6,50 г, 0,12 моль), і реакційну суміш перемішують при цій температурі протягом 30 хвилин. Потім протягом 20 хвилин краплями додають розчин 2'4'-дихлор-4-циклопропілбіфеніл-3-карбальдегіду (13,70 г, 0,047 ммоль), утримуючи температуру нижче 10 °C. Реакційну суміш перемішують при цій температурі протягом 2 годин, потім залишають нагріватися до кімнатної температури до її розведення діетиловим ефіром і дистильованою водою. Дві фази розділяють, і водну фазу екстрагують знову діетиловим ефіром (х 2). Органічні фракції об'єднують, промивають розсолом, потім висушують над сульфатом магнію. Суспензію фільтрують, і фільтрат випарюють під вакуумом. Водну фазу далі окислюють за допомогою 2M соляної кислоти, потім знову екстрагують діетиловим ефіром (x 2), висушують над сульфатом магнію й випарюють під вакуумом. Усі органічні фракції об'єднують, потім розводять толуолом і азеотропною сумішшю (х 4) для отримання 4-[1-(2',4'-дихлор-4-циклопропілбіфеніл-3-іл)-метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону (20,0 г), який достатньо очищений для безпосереднього використання в наступному етапі. Етап 5. 2-(2',4'-дихлор-4-циклопропілбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-он Cl O O Cl O 25 30 35 40 До розчину 4-[1-(2',4'-дихлор-4-циклопропілбіфеніл-3-іл)-метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону (20,0 г, 0,048 моль) у метанолі (800 мл) при температурі 35 ºC додають 50 %-й водний розчин пероксиду водню (4,80 мл, 0,072 ммоль), відразу після чого додають розчин 2M гідроксиду літію (4,80 мл, 9,60 ммоль). Суміш перемішують при кімнатній температурі протягом додаткових 2 годин, потім залишають вистигати до кімнатної температури. Потім реакційну суміш гасять 10 %-м метабісульфітом натрію (негативний тест за допомогою йодкрохмального індикаторного паперу) і розводять діетиловим ефіром. Більшу частину метанолу видаляють під вакуумом, а неочищену суміш розподіляють між дистильованою водою й діетиловим ефіром. Водну фазу далі екстрагують діетиловим ефіром (x 2), потім всі органічні фракції об'єднують і промивають насиченим бікарбонатом натрію (х 2), потім розсолом. Після висушування над сульфатом магнію суспензію фільтрують, і фільтрат випарюють під вакуумом для отримання 2-(2',4'-дихлор-4-циклопропілбіфеніл-3-іл)-4,4,6,6тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону (17,80 г) у вигляді піни помаранчевого кольору. Цей матеріал достатньо очищений для використання безпосередньо на наступному етапі без подальшої очистки. 1H NMR (CDCl3): δ 7,49 (s, 1H), 7,37 (s, 1H), 7,37-7,25 (m, 2H), 7,20 (d, 1H), 6,99 (d, 1H), 4,75 (s, 1H), 1,80 (m, 1H), 1,40-1,28 (m, 9H), 1,10-0,98 (m, 2H), 0,90-0,80 (m, 4H), 0,75-0,80 (m, 1H). 23 UA 106494 C2 Етап 6. Отримання 4-(2',4'-дихлор-4-циклопропілбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5діону Cl OH O 5 10 15 20 Cl O До суміші 2-(2',4'-дихлор-4-циклопропілбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-ону (17,80 г, 0,041 моль) і трифлату іттербію (2,20 г, 4,41 ммоль) додають розчин 5M перхлорату літію (отриманий із 42 мл діетилового ефіру й 22,30 г перхлорату літію). Отриману суспензію перемішують при кімнатній температурі протягом 17 днів, на цьому етапі додають додаткову кількість діетилового ефіру (42 мл), перхлорату літію (22,3 г, 0,21 моль) і трифлату іттербію (19,8 г, 0,035 моль). Потім реакційну суміш нагрівають при температурі 27 ºC (внутрішня температура) протягом 1 дня, потім розподіляють між діетиловим ефіром і дистильованою водою. Дві фази розділяють, водну фазу екстрагують діетиловим ефіром (x 2), потім усі органічні фракції об'єднують, промивають розсолом і висушують над сульфатом магнію. Суспензію фільтрують, і фільтрат випарюють під вакуумом. Неочищений матеріал очищують за допомогою колонкової флеш-хроматографії (етилацетат/ гексан в якості елюенту) до утворення олії, яку розтирають у порошок із гексанами для отримання 4-(2',4'дихлор-4-циклопропілбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5-діону (2,80 г) у вигляді твердої речовини білого кольору. 1H NMR (CDCl3): δ 7,48 (s, 1H), 7,38 (dd, 1H), 7,29 (s, 2H), 7,16-7,11 (m, 2H), 5,69 (s, 1H), 1,76 (m, 1H), 1,61 (d, 6H), 1,49 (d, 6H), 0,92-0,86 (m, 2H), 0,82-0,76 (m, 1H), 0,62-0,54 (m, 1H). Приклад P10. Отримання 4-(2',4'-дихлор-4-етилбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5діону Cl OH O Cl O 25 Етап 1. Отримання 2',4'-дихлор-4-етилбіфеніл-3-карбальдегіду Cl O H 30 35 Cl Суспензію 5-бром-2-етилбензальдегіду (1,0 г, 4,7 ммоль), 2,4-дихлорфенілборонової кислоти (1,34 г, 7,0 ммоль) і карбонату натрію (0,99 г, 7,98 ммоль) у системі змішаних розчинників 1,2-диметоксіетану (12 мл) і дистильованої води (4 мл) перемішують в атмосфері азоту, потім продувають азотом (x 2). Після цього додають одну порцію хлориду [1,1’біс(дифенілфосфіно)ферроцен]паладію(II) (1,15 г, 1,41 ммоль), і суспензію знову продувають азотом, потім нагрівають із використанням рефлюксу всю ніч. Після охолодження до кімнатної температури реакційну суміш розводять дистильованою водою (10 мл) й екстрагують дихлорметаном (10 мл). Водну фазу знову екстрагують дихлорметаном (x 2), і на завершення об'єднані органічні фракції промивають розсолом і висушують над сульфатом магнію. 24 UA 106494 C2 5 Неочищений продукт очищують за допомогою колонкової флеш-хроматографії (ізогексан до елюенту в співвідношенні 75:25 ізогексану/етилацетату) для отримання 2',4'-дихлор-4етилбіфеніл-3-карбальдегіду у вигляді олії жовтого кольору. Етап 2. Отримання 4-[1-(2',4'-дихлор-4-етилбіфеніл-3-іл)-метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону Cl O Cl O 10 15 20 До дуже холодного розчину 2,2,5,5-тетраметилдигідрофуран-3-ону (1,15 г, 0,0081 моль) в 1,2-диметоксіетані (2 мл) додають одну порцію метилату натрію (0,481 г, 0,0089 моль). Потім реакційну суміш перемішують при цій температурі протягом 5 хвилин, після чого краплями додають другий розчин 2',4'-дихлор-4-етилбіфеніл-3-карбальдегіду (2,02 г, 0,0072 моль) в 1,2диметоксіетані (2,7 мл). Після перемішування протягом додаткових 2 годин при температурі 0 °C реакційну суміш залишають стояти на ніч при кімнатній температурі. Неочищений розчин виливають в 2M соляної кислоти й екстрагують ефіром (х 3). Органічні фракції об'єднують, промивають розсолом, висушують над сульфатом магнію та випарюють під вакуумом. Залишок очищують за допомогою колонкової флеш-хроматографії (5 % етилацетату в ізогексані до 25 % етилацетату в ізогексані) для отримання 4-[1-(2',4'-дихлор-4-етилбіфеніл-3-іл)-метиліден]2,2,5,5-тетраметилдигідрофуран-3-ону у вигляді камеді жовтого кольору. Етап 3A: Отримання 2-(2',4'-дихлор-4-етилбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-ону Cl O O Cl O 25 30 35 До розчину 4-[1-(2',4'-дихлор-4-етилбіфеніл-3-іл)-метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону (2,04 г, 0,0051 моль) у метанолі (24 мл) при температурі 55 ºC додають розчин пероксиду водню (0,43 мл, 0,0076 моль, 50 %-й водний розчин), відразу після чого додають водний розчин гідроксиду літію (0,25 мл, 0,0005 моль). Реакційну суміш нагрівають при цій температурі протягом 30 хвилин, потім швидко охолоджують до кімнатної температури й гасять насиченим тіосульфатом натрію. Неочищений продукт екстрагують діетиловим ефіром (x 3), промивають насиченим бікарбонатом натрію, потім висушують над сульфатом магнію. Залишок очищують за допомогою колонкової флеш-хроматографії (від 5 % етилацетату в ізогексані до 25 % етилацетату в ізогексані) для отримання 2-(2',4'-дихлор-4етилбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону у вигляді камеді жовтого кольору. Етап 3B. Отримання 2-(2',4'-дихлор-4-етилбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-ону 25 UA 106494 C2 Cl O O Cl O 5 10 До розчину 4-[1-(2',4'-дихлор-4-етилбіфеніл-3-іл)-метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону (0,500 г, 1,24 ммоль) в толуолі (3,7 мл) додають водний розчин гіперхлориту натрію (3,30 г, 6,20 ммоль, 14 %-й активований хлор) і гідросульфат тетрабутиламонію (0,013 мл, 0,04 ммоль), і двохфазну рідину потім перемішують при температурі 50 ˚C протягом 4 годин. Реакційну суміш потім розводять додатковою кількістю толуолу, фази розділяють, й органічну фазу знову промивають дистильованою водою (x 2). Органічну фазу висушують над сульфатом натрію та потім випарюють під вакуумом для отримання 2-(2',4'-дихлор-4-етилбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7ону у вигляді твердої речовини білого кольору. Етап 4A. Отримання 4-(2',4'-дихлор-4-етилбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5-діону Cl OH O Cl O 15 20 25 До дуже холодного розчину концентрованої сірчаної кислоти (6 мл) краплями додають другий розчин 2-(2',4'-дихлор-4-етилбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан7-ону (1,90 г, 0,0045 моль) в 1,2-дихлоретані (6 мл) протягом 5 хвилин. Цю двохфазну суміш енергійно перемішують протягом 2 годин при 0 ºC, потім виливають у лід та екстрагують діетиловим ефіром. Усі органічні фракції об'єднують, промивають розсолом, висушують над сульфатом магнію, потім випарюють під вакуумом. Неочищений продукт очищують за допомогою колонкової флеш-хроматографії (від 5 % етилацетату в ізогексані до 25 % етилацетату в ізогексані) для отримання 4-(2',4'-дихлор-4-етилбіфеніл-3-іл)-2,2,6,6тетраметилпіран-3,5-діону у вигляді камеді жовтого кольору. 1H NMR (CDCl3): δ 7,48 (d, 1H), 7,43 (m, 2H), 7,30 (m, 2H), 7,13 (d, 1H), 5,71 (br. s, 1H), 2,552,44 (m, 2H), 1,62 (s, 6H), 1,49 (app. d, 6H), 1,17 (t, 3H). Етап 4B. Отримання 4-(2',4'-дихлор-4-етилбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5-діону Cl OH O O Cl 30 До розчину 2-(2',4'-дихлор-4-етилбіфеніл-3-іл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан7-ону (0,0418 г, 0,10 ммоль) в толуолі (0,3 мл) додають моногідрат п-толуолсульфонової кислоти (0,019 г, 0,10 ммоль). Потім суміш нагрівають до 150 ˚C протягом 1 години, після чого її залишають вистигати до кімнатної температури. Реакційну суміш виливають в дистильовану 26 UA 106494 C2 воду, висушують над сульфатом натрію, потім випарюють під вакуумом для отримання 4-(2',4'дихлор-4-етилбіфеніл-3-іл)-2,2,6,6-тетраметилпіран-3,5-діону. Приклад P11. Отримання 4-(5-бром-2-дифторметоксіфеніл)-2,2,6,6-тетраметилпіран-3,5діону 5 H F F O OH Br O O Етап 1. Отримання 5-бром-2-дифторметоксібензальдегіду F H F O O H 10 15 20 Br До суспензії 5-бромсаліцилальдегіду (7,60 г, 0,038 моль) і карбонату цезію (17,30 г, 0,053 моль) у безводному N, N-диметилформаміді (55 мл) додають хлордифторацетат натрію (13,30 г, 0,087 моль), а потім дистильовану воду (10 мл). Реакційну суміш нагрівають до 100 ˚C протягом 6 годин (великі шматки твердої речовини подрібнюють за допомогою шпателя), потім залишають вистигати до кімнатної температури й гасять концентрованою соляною кислотою (15 мл). Після перемішування протягом додаткових 2 годин реакційну суміш розводять дистильованою водою й екстрагують етилацетатом (x 2). Органічні фракції об'єднують, промивають водним розчином 2M гідроксиду натрію, розсолом, потім висушують над сульфатом магнію. Суспензію фільтрують, і фільтрат випарюють під вакуумом для отримання 5бром-2-трифторметоксібензальдегіду (5,66 г), який достатньо очищений для безпосереднього використання на наступному етапі. Етап 2. Отримання 4-[1-(5-бром-2-дифторметоксіфеніл)метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону 25 F H F O Br O O 30 До дуже холодного розчину 2,2,5,5-тетраметилдигідрофуран-3-ону (3,60 г, 0,025 ммоль) в безводному 1,2-диметоксіетані (8 мл) додають одну порцію метилату натрію (1,51 г, 0,028 моль). Після перемішування при цій температурі протягом 5 хвилин додають краплями розчин 5-бром-2-дифторметоксібензальдегіду (5,66 г, 0,023 моль) у 1,2-диметоксіетані (8 мл) протягом 27 UA 106494 C2 5 10 хвилин, потім перемішують при температурі 0 °C протягом ще 1 години. Після нагрівання до кімнатної температури реакційну суміш розводять ефіром й промивають 2M соляної кислоти (x 2). Органічні фракції об'єднують, висушують над сульфатом магнію, фільтрують, і фільтрат випарюють під вакуумом для отримання 4-[1-(5-бром-2-дифторметоксіфеніл)метиліден]-2,2,5,5тетраметилдигідрофуран-3-ону (8,89 г) у вигляді олії помаранчевого кольору. Етап 3. Отримання 2-(5-бром-2-дифторметоксіфеніл)-4,4,6,6-тетраметил-1,5діоксаспіро[2.4]гептан-7-ону F H F O Br O O O 10 15 20 До розчину 4-[1-(5-бром-2-дифторметоксіфеніл)метиліден]-2,2,5,5-тетраметилдигідрофуран3-ону (8,89 г, 0,023 моль) в метанолі (380 мл) при 35 ºC додають 50 %-й водний розчин пероксиду водню (2,30 мл, 0,034 моль), відразу після чого додають 2M водного розчину гідроксиду літію (2,30 мл, 0,0046 моль). Після перемішування при цій температурі протягом 1 години реакційну суміш залишають вистигати, потім гасять 10 %-м розчином метабісульфіту натрію (негативний тест за допомогою йодкрохмального індикаторного паперу). Реакційну суміш екстрагують діетиловим ефіром (x 3),потім органічну фазу далі промивають насиченим водним розчином бікарбонату натрію (x 2), потім розсолом. Усі органічні фракції об'єднують, висушують над сульфатом магнію, фільтрують, і фільтрат випарюють під вакуумом для отримання 2-(5бром-2-дифторметоксіфеніл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан-7-ону (7,22 г) у вигляді камеді жовтого кольору. Етап 4. Отримання 4-(5-бром-2-дифторметоксіфеніл)-2,2,6,6-тетраметилпіран-3,5-діону F H F O OH Br O O 25 30 35 40 До дуже холодного розчину концентрованої сірчаної кислоти (12 мл) краплями додають другий розчин 2-(5-бром-2-дифторметоксіфеніл)-4,4,6,6-тетраметил-1,5-діоксаспіро[2.4]гептан7-ону (7,22 г, 18,00 ммоль) в 1,2-дихлоретані (12 мл) протягом 5 хвилин. Цю двохфазну суміш енергійно перемішують протягом 2 годин при температурі 0 °C, потім залишають стояти на ніч при кімнатній температурі. Реакційну суміш виливають у дуже холодну воду, промиваючи невеликою кількістю додаткового 1,2-дихлоретану/води, потім випарюють під вакуумом для видалення всіх органічних розчинників. Неочищений продукт потім екстрагують етилацетатом (x 3), після чого всі органічні фракції об'єднують, промивають розсолом і висушують над сульфатом магнію. Суспензію фільтрують, і фільтрат випарюють під вакуумом, потім очищують за допомогою колонкової флеш-хроматографії (10 % до 25 % етилацетату в гексані в якості елюенту) до утворення олії, яку розтирають з гексанами для отримання 4-(5-бром-2дифторметоксіфеніл)-2,2,6,6-тетраметилпіран-3,5-діону (2,08 г) у вигляді твердої речовини білого кольору. 1H NMR (CDCl3): δ 7,54 (dd, 0,75H, ізомер A), 7,51 (dd, 0,25H, ізомер B), 7,37 (d, 0,75H, ізомер A), 7,32 (d, 0,25H, ізомер B), 7,15 (d, 0,75H, ізомер A), 7,06 (d, 0,25H, ізомер), 6,32 (t, 0,75H, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSpiro epoxides as intermediates
Автори англійськоюScutt, James Nicholas
Автори російськоюСкатт Джеймс Николас
МПК / Мітки
МПК: C07D 309/32, C07D 493/10
Мітки: спіроепоксиди, продукти, проміжні, синтезу
Код посилання
<a href="https://ua.patents.su/36-106494-spiroepoksidi-yak-promizhni-produkti-sintezu.html" target="_blank" rel="follow" title="База патентів України">Спіроепоксиди як проміжні продукти синтезу</a>
Попередній патент: Спосіб і пристрій для деполімеризації пластмасових відходів
Наступний патент: Пристрій для знезараження баластних вод
Випадковий патент: Браслет для нарощування вій