Фармацевтична субстанція на основі мітохондріально адресованих антиоксидантів
Номер патенту: 107476
Опубліковано: 12.01.2015
Автори: Сєвєріна Інна Ісааковна, Антонєнко Юрій Ніколаєвіч, Замятін Андрєй Алєксандровіч, Скулачєв Максім Владіміровіч, Чєрняк Боріс Вікторовіч, Ташліцкій Вадім Нєроновіч, Сумбатян Наталья Владіміровна, Ягужинскій Лєв Сєргєєвіч, Скулачєв Владімір Пєтровіч, Єфрємов Євгєній Стєпановіч, Коршунова Галіна Анатольєвна
Формула / Реферат
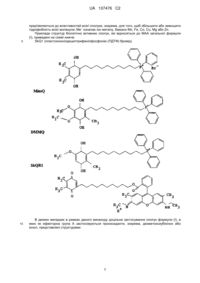
1. Мітохондріально адресований антиоксидант із заданим співвідношенням про- і антиоксидантних властивостей і описані загальною формулою (І)
![]() ,(І)
,(І)
де "А" є ефекторною групою; "L" - лінкерною групою, n - цілим числом 1-20; "В" - адресною групою, яка забезпечує адресну доставку всієї сполуки в мітохондрії, і де "А" є антиоксидантом загальної формули (II)
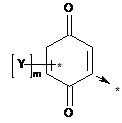 (II)
(II)
і/або його відновленою формою,
де m - ціле число 1-3; Y - метил;
"L" - лінкерна ланка, яка представлена:
а) або простим, або розгалуженим вуглеводневим ланцюгом, який, за необхідності, містить один або більше подвійних або потрійних зв'язків, або ефірний, або складноефірний, або C-S, або S-S, або пептидний зв'язок; і за необхідності, заміщений одним або більше замісниками, які переважно є алкілом, алкокси, галогеном, кетогрупою, аміногрупою;
б) або природним ізопреноїдним ланцюгом;
"В" - представлений:
а) або іоном Скулачова Sk:
Sk+ Z-,
де Sk - є ліпофільним катіоном;
Z - фармацевтично прийнятним аніоном;
б) або амфіфільним цвітер-іоном, здатним проникати всередину мітохондрій в своїй катіонній формі,
при цьому Sk+ у складі "В" може бути ліпофільною металоорганічною сполукою, а саме ліпофільним металпорфірином, який переважно має структуру:
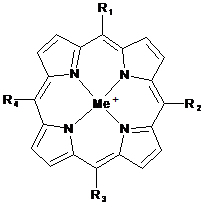 ,
,
включену до складу сполуки формули (І) через ділянки, позначені R1, R2, R3 або R4, а решта замісників R1, R2, R3 або R4 можуть бути підібрані відповідно до вимог, які пред'являються до властивостей всієї сполуки, а саме, щоб збільшити або зменшити гідрофобність всієї молекули; Ме+ означає іон металу, переважно Mn, Fe, Co, Cu, Mg або Zn,
включаючи SkQB1, SkQB1A, SkQB1B, SkQBP1, SkQB5, SkQBP5, а також їх фармацевтично прийнятні солі.
2. Мітохондріально адресований антиоксидант за п. 1, представлений SkQB1, SkQB1A, SkQB1B, SkQBP1, SkQB5, SkQBP5.
3. Спосіб отримання мітохондріально адресованого антиоксиданту загальної формули (І) в формі фармацевтичної субстанції лікарського препарату:
![]() ,(І)
,(І)
де "А" - ефекторна група; "L" - лінкерна група, n - ціле число 1-20; "В" - адресна група, яка забезпечує адресну доставку всієї сполуки в мітохондрії; і де "А" може бути антиоксидантом загальної формули (II)
 (II)
(II)
і/або його відновленою формою,
де m - ціле число 1-3; Y - метил;
"L" - лінкерна ланка, представлена:
а) або простим, або розгалуженим вуглеводневим ланцюгом, який, за необхідності, містить один або більше подвійних або потрійних зв'язків, або ефірний, або складноефірний, або C-S, або S-S, або пептидний зв'язок; і за необхідності, заміщений одним або більше замісником, який переважно є алкілом, алкокси, галогеном, кетогрупою, аміногрупою;
б) або природним ізопреноїдним ланцюгом;
"В" - представлений:
адресуючою групою виду Sk+ Z-,
де Sk - є ліпофільним катіоном;
Z - фармацевтично прийнятним аніоном;
який передбачає щонайменше одну з-поміж наступних стадій:
а) очищення за допомогою градієнтної обернено-фазової хроматографії в безсольовій безбуферній системі рухомої фази;
б) очищення за допомогою гель-фільтраційної хроматографії в етанолі;
в) очищення від окисленої форми мітохондріально адресованого антиоксиданту;
г) очищення від відновленої форми мітохондріально адресованого антиоксиданту, переважно з використанням "молекулярної пастки" відновленої форми мітохондріально адресованого антиоксиданту вищенаведеної загальної формули, де під молекулярною пасткою розуміють сполуку з кето- або хіноноподібним угрупуванням, яке має окислювально-індукційний потенціал, переважно, не менше 0,2 В за нейтральних значеннях рН і, переважно, є добре розчинним в інертному розчиннику, переважно в гептані або гексані.
4. Фармацевтична субстанція на основі мітохондріально адресованого антиоксиданту загальної формули (І)
![]() ,(І)
,(І)
де "А" - ефекторна група; "L" - лінкерна група, n - ціле число 1-20; "В" - адресна група, яка забезпечує адресну доставку всієї сполуки в мітохондрії; і де "А" є антиоксидантом загальної формули (II)
 (II)
(II)
і/або його відновленою формою,
де m - ціле число 1-3; Y - метил;
"L" - лінкерна ланка, яка представлена:
а) або простим, або розгалуженим вуглеводневим ланцюгом, який, за необхідності, містить один або більше подвійних або потрійних зв'язків, або ефірний, або складноефірний, або C-S, або S-S, або пептидний зв'язок; і за необхідності, заміщений одним або більше замісником, який переважно є алкілом, алкокси, галогеном, кетогрупою, аміногрупою;
б) або природним ізопреноїдним ланцюгом;
"В" - представлений адресуючою групою виду Sk+ Z-, де Sk - є ліпофільним катіоном; Z - фармацевтично прийнятним аніоном;
у якій співвідношення окисленої і відновленої форм знаходиться в діапазоні від 0,2 % до 99,8 % окисленої форми і в якій співвідношення окисленої і відновленої форм мітохондріально адресованого антиоксиданту зберігається протягом всього терміну придатності при дотриманні встановлених умов зберігання.
5. Фармацевтична субстанція за п. 4, яка відрізняється тим, що в ній співвідношення окисленої і відновленої форм, переважно, знаходиться в діапазоні від 50 % до 99,5 % окисленої форми.
6. Фармацевтична субстанція за п. 5, яка відрізняється тим, що в ній співвідношення окисленої і відновленої форм, переважно, знаходиться в діапазоні від 97,5 % до 99,5 % окисленої форми.
7. Фармацевтична субстанція за будь-яким з пп. 4-6, яка відрізняється тим, що в ній співвідношення окисленої і відновленої форм мітохондріально адресованого антиоксиданту зберігається протягом не менше 1 міс.
8. Фармацевтична субстанція за будь-яким з пп. 4-6, яка відрізняється тим, що в ній співвідношення окисленої і відновленої форм мітохондріально адресованого антиоксиданту зберігається протягом не менше 6 міс.
9. Фармацевтична субстанція за будь-яким з пп. 4-6, яка відрізняється тим, що в ній співвідношення окисленої і відновленої форм мітохондріально адресованого антиоксиданту зберігається протягом не менше 2-х років.
Текст
Реферат: Даний винахід належить до галузей фармацевтики, медицини, і, зокрема, стосується отримання і використання фармацевтичних субстанцій на основі мітохондріально адресованих антиоксидантів із заданим співвідношенням про- і антиоксидантних властивостей і описані загальною формулою (І) UA 107476 C2 (12) UA 107476 C2 A L B n ,(І) де "А" є ефекторною групою; "L" - лінкерною групою, n - цілим числом 1-20; "В" - адресною групою, яка забезпечує адресну доставку всієї сполуки в мітохондрії, і де "А" є антиоксидантом загальної формули (II) O Y m * * O (II) і/або його відновленою формою. UA 107476 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки, до якої відноситься винахід Даний винахід відноситься до галузі фармацевтики, медицини, і, зокрема, стосується отримання і використання фармацевтичних субстанцій на основі мітохондріально-адресованих сполук. Рівень техніки Опубліковані до цього моменту дані переконливо демонструють перспективність застосування в медицині нового класу біологічно активних речовин (див. Skualchev V.P. (2005), IUBMB Life., 57:305-10; Skulachev V.P. (2007) Biochemistry (Mosc)., 72:1385-96; Antonenko Yu.N. et al. (2008), Biochemistry (Mosc).,73:1273-87, Skulachev V.P. et al., (2009), Biochim Biophys Acta., 1787:437-61, Smith R.A. et al., (2008), Ann. N. Y. Acad. Sci., 1147:105-11, також див. WO2007046729, WO2009005386, US 6331532, EP 1047701, EP 1534720) - мітохондріальноадресованих антиоксидантів (МАА) на основі "іонів Скулачова" (термін введений Green D.E., "The electromechanochemical model for energy coupling in mitochondria", 1974, Biochem. Biophys. Acta., 346:27-78). Проте в наведених вище джерелах розкриваються результати вивчення МАА в лабораторних умовах - in vitro або на тваринних моделях. При цьому, для того, щоб яка-небудь сполука могла бути застосована як діюча речовина лікарського засобу (т.з. фармацевтична субстанція) вона повинна відповідати певним вимогам, а саме: 1. Повністю відповідати вимогам, які пред'являються національними регулюючими органами їх нормативною документацією, узагальненим у відповідних фармакопейних статтях, основними з яких є: достовірність, вміст сторонніх домішок, вміст важких металів, вміст води, вміст залишкових органічних розчинників, стерильність, метод кількісного визначення, спосіб упаковки, маркування і транспортування. 2. Зберігати протягом всього терміну придатності в межах закладених в нормативній документації показників, а також фармацевтична активність. Особлива увага повинна приділятися як загальному вмісту сторонніх домішок, так і вмісту одиничних домішок. Зокрема, одиничні домішки, які не можуть бути індивідуально виділені і всебічно охарактеризовані, не повинні становити значної частки (в більшості випадків - більше 1 %) від загального вмісту домішок. Іншим істотним ускладненням для практичного застосування МАА як фармацевтичної субстанції є той факт, що в описах винаходів, пов'язаних з МАА (див. вище), розкрита велика кількість сполук, які заявляються як мітохондріально-адресовані антиоксиданти. Проте результати експериментів (див. наприклад Antonenko Yu.N. et al. (2008), Biochemistry (Mosc).,73:1273-87), включаючи клінічні випробування, показують, що розкриті сполуки, будучи мітохондріально-адресованими, проявляють різну (іноді навіть протилежну) біологічну активність. У зв'язку з цим, як і раніше актуальною залишається проблема розробки методів конструювання біологічно активної речовини, яка має цілком визначені, заздалегідь задані, властивості, необхідні залежно від конкретного застосування даної сполуки. Також актуальним залишається прогноз властивостей і біологічної активності (в першу чергу - клінічної активності) МАА на основі "іонів Скулачова". Визначення Фармацевтична субстанція - речовина, підготовлена до застосування у складі лікарського засобу, яка відповідає вимогам фармакопеї. Іони Скулачова - ліпофільні катіони і аніони, здатні проникати крізь мембрани мітохондрій. Мітохондріально-адресовані антиоксиданти (МАА) - сполуки, здатні адресно проникати в мітохондрії і які проявляють антиоксидантну активність. Розкриття винаходу Нижче приведені аспекти винаходу: I. Даний винахід присвячений отриманню фармацевтичних субстанцій на основі мітохондріально-адресованих антиоксидантів (МАА), конструюванню і вибору певних МАА, які якнайкращим чином відповідають клінічним завданням. Зокрема, винахід стосується МАА, які є сполуками, що складаються з антиоксиданту, приєднаного через лінкерну групу до ліпофільного катіона ("іону Скулачова"). Дані МАА можуть бути представлені загальною формулою (I), приведеною нижче Загальна формула (I): сполука структури A L B (І) n , 1 UA 107476 C2 де "А" - ефекторна група; "L" - лінкерна група, n - ціле число 1-20; "B" - адресна група, яка забезпечує адресну доставку всієї сполуки в мітохондрії. При цьому "А" може бути антиоксидантом загальної формули (II) O Y m (II) * * O , 5 і/або його відновленою формою де m - ціле число 0-3; Y - однакові або різні замісники, які представлені нижчим алкілом або нижчим алкокси; або два віцинальних Y зв'язані між собою таким чином, що утворюють структуру (III): 10 O R1 (III) R2 * O 15 20 25 , і/або її відновлену форму де R1 і R2 однакові або різні замісники, які є нижчим алкілом або нижчим алкокси; "L" - лінкерна ланка, яка представлена: а) або простим або розгалуженим вуглеводневим ланцюгом, який, за необхідності, містить один або більше подвійний або потрійний зв'язок, або ефірний, або складноефірний, або С-S, або S-S, або пептидний зв'язок; і за необхідності заміщений одним або більше замісником, який бажано є алкілом, алкокси, галогеном, кето-групою, аміно-групою; б) або природним ізопреноїдним ланцюгом; "B" - представлене: а) або іоном Скулачова Sk: + Sk Z де Sk - є ліпофільним катіоном; Z - фармацевтично прийнятним аніоном; б) або амфіфільним цвіттер-іоном, здатним проникати всередину мітохондрій в своїй катіонній формі. + в) крім того, Sk у складі "В" також може бути ліпофільною метал-органічною сполукою, зокрема, ліпофільним металпорфірином, який бажано має структуру: R1 N R4 N Me + N 30 R2 N R3 яка включена до складу сполуки формули (I) через ділянки, позначені R 1, R2, R3 або R4. При цьому решта замісників R1, R2, R3 або R4 можуть бути підібрані відповідно до вимог, які 2 UA 107476 C2 5 10 пред'являються до властивостей всієї сполуки, зокрема, для того, щоб збільшити або зменшити + гідрофобність всієї молекули; Ме означає іон металу, бажано Mn, Fe, Co, Cu, Mg або Zn. Приклади структур біологічно активних сполук, які відносяться до МАА загальної формули (I), приведені на схемі нижче. SkQ1 (пластохінонілдецилтрифенілфосфонію (ПДТФ) бромід) В деяких випадках в рамках даного винаходу доцільне застосування сполук формули (I), в яких як ефекторна група А застосовуються прооксиданти, зокрема, дезметоксиубіхінон або іонол, представлені структурами: 3 UA 107476 C2 O * O OH O 5 10 Відповідні сполуки формули (I) будуть мітохондріально-адресованими прооксидантами. II. Методи і підходи для селекції Іншим аспектом даного винаходу є спосіб конструювання і/або вибору конкретної мітохондріально-адресованої сполуки. II.a Метод конструювання нових мітохондріальних антиоксидантів Вивчення хімічних, фізико-хімічних і біологічних властивостей вказаних вище сполук дозволило запропонувати новий підхід для конструювання сполук, які відносяться до класу сполук (I). З використанням запропонованої моделі стає можливим дизайн структури нових мітохондріально-адресованих антиоксидантів із заздалегідь заданими властивостями. Схема конструювання сполук, що описує в загальному вигляді запропоновану модель конструювання заданих сполук за винаходом, приведена на схемі нижче Схема моделі конструювання нових мітохондріально-адресованих антиоксидантів 15 20 25 30 35 40 де: Р1 - позиція, яка відповідає за стабільність і біологічну активність сполуки. Якщо біля цього атома вуглецю немає замісника, то така речовина є максимально ефективною як антиоксидант, але дещо нестабільна. Прикладом цього є SkQ1, який є в 10 разів активнішим антиоксидантом, ніж MitoQ. Проте, наявність у MitoQ в позиції P1 метильної групи робить його більш стабільним у порівнянні з SkQ1. Також на стабільність речовини може впливати склад лінкера "Link". Наприклад, стабільність сполуки може бути змінена при введенні в Link складноефірного зв'язку, пептидного, сульфідного або інших реакційно-здатних ділянок. Позиції Р2 і Р3 - відповідають за регуляцію взаємодії з дихальним ланцюгом мітохондрій. Якщо на одному з цих атомів вуглецю немає замісника, то така речовина може не відновлюватися дихальним ланцюгом мітохондрій, за рахунок чого сполука перетворюється на прооксидант. Той же ефект може бути досягнутий, якщо один або обидва замісники в цій позиції за своєю структурою не дозволяють дихальному ланцюгу відновлювати і/або окисляти відповідну сполуку. Замісники в тих же позиціях Р2 і Р3 можуть впливати на співвідношення прооксидантних і антиоксидантих властивостей сполуки. Присутність атомів кисню в положеннях Р 2 і Р3 може приводити до утворення внутрішнього водневого зв'язку з атомом водню ОН групи хінолу у відновленій або частково відновленій (хінольній або семіхіноній) формах антиоксиданту. Такий водневий зв'язок може ускладнювати окислення ОН групи в реакції з вільними радикалами, і активними формами кисню, що різко знижує антиоксидантні властивості речовини в порівнянні із сполукою в якій біля Р2 і Р3 немає кисню (наприклад, знаходяться метильні групи). Цим можна пояснити різницю цих властивостей у SkQ1 і MitoQ. Р4 - позиція, яка відповідає за проникну здатність біологічно активної речовини. Здатність проникати в мітохондрії залежить від заряду і гідрофобності сполуки. Наприклад, досліди на штучних мембранах показують, що сполука, з трифенілфосфонієм у позиції Р 4 мають меншу проникну здатність у порівнянні з речовинами, де в цій позиції знаходиться більш гідрофобний катіон - залишок родаміну G. 4 UA 107476 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Link" - елемент структури, який також здатний корінним чином впливати на властивості всієї сполуки. На проникну здатність сполуки може впливати довжина і склад лінкерної ланки Link (Фіг. 2). Скорочення довжини лінкера і збільшення його гідрофільності призведе до зниження проникної здатності всієї сполуки. Також модифікуючи склад ланки Link можна змінювати стабільність сполуки - введення до його складу складноефірних зв'язків, пептидних зв'язків, інших зв'язків, які мають меншу стабільність у порівнянні з С-С зв'язком, може зробити всю сполуку більш уразливою для таких клітинних ферментів, як естерази, пептидаза. Також змінюючи довжину цього елементу можна змінювати положення гідрофобної частини молекули (антиоксидантного залишку) усередині двошарової мембрани, що є важливим чинником, який визначає можливість взаємодії всієї сполуки з дихальним ланцюгом мітохондрій. Таким чином, одним з аспектів даного винаходу є метод створення структур (дизайн) мітохондріально-адресованих сполук з прогнозованою біологічною активністю. Під біологічною активністю розуміють дію на біологічні системи і їх моделі (тобто штучні безклітинні системи, субклітинні фракції і органели, клітини, ділянки тканин і органів або цілий організм), включаючи антиоксидантну дію, прооксидантну дію, роз'єднуючу дію на мітохондрії, зміну властивостей біологічних мембран, регуляторну дію через різні месенджери на різних рівнях (регуляція експресії генів, активності білків, регуляція гормонального профілю організму тощо). II.б Спосіб створення сполук з використанням комбінаторних бібліотек Іншим аспектом даного винаходу є комбінаторна бібліотека мітохондріально-адресованих сполук і методи пошуку і відбору перспективних сполук з цієї бібліотеки. Така бібліотека є набором сполук загальної формули (I), об'єктивно здатних адресно накопичуватися в мітохондріях. Сполуки для бібліотеки можуть бути синтезовані зокрема на основі загальної частини, яка є ліпофільним катіоном, сполученим з лінкером (частиною лінкера), який несе "активований" залишок, наприклад галоген, за допомогою якого здійснюється приєднання варіабельної частини сполуки. Іншими словами, бібліотека мітохондріально-адресованих сполук може бути отримана приєднанням до ліпофільного катіона бібліотеки неадресованих низькомолекулярних сполук. II.в Також аспектом винаходу є метод тестування (зокрема, якщо метод є автоматизованим або напівавтоматизованим) біологічної активності сполук бібліотеки з метою відбору сполук, які проявляють необхідну активність. Такий метод включає наступні етапи: 1) тест, який дозволяє відібрати з бібліотеки групу речовин-кандидатів; 2) побудова комбінаторної суббібліотеки на основі відібраних речовин та їх модифікацій, якщо такі можливі; 3) тестування суббібліотеки з метою відбору сполук, які найбільш виражено проявляють потрібну біологічну активність; 4) повторення етапів з 1 по 3-ій до тих пір, поки не будуть перебрані всі можливі варіанти сполук або не буде досягнута потрібна біологічна активність. Слід зазначити, що найбільш ефективним представляється комбінування декількох методів тестування біологічної активності на етапах 1 і 3, що дозволяє істотно знизити вірогідність отримання артефактних результатів. Конкретні методи тестування можуть бути адаптовані кваліфікованими фахівцями в галузі біохімії, біофізики, біоенергетики, мікробіології, молекулярної біології, клітинної біології або інших галузей сучасної біології виходячи із загальнодоступних літературних даних щодо методів роботи з комбінаторними бібліотеками і методів, приведених в описі даного винаходу (див. розділи методи тестування, методики інтерпретації результатів, експериментальні приклади). Приведені у відповідному розділі експериментальні приклади є методами тестування активності мітохондріально-адресованих сполук "в окремих пробірках" і можуть бути легко адаптовані для тестування комбінаторних бібліотек високопродуктивними методами використовуючи стандартні підходи. III. Методи тестування Ще одним аспектом даного винаходу є набір методів-тестів, які застосовуються для тестування біологічної активності нових мітохондріально-адресованих сполук загальної формули (I). При цьому тестовані сполуки можуть вивчатися як індивідуально, так і у складі комбінаторних бібліотек. До цього набору методів-тестів входять наступні методи: 1) тестування окислювально-відновних властивостей і стабільності сполук загальної формули (I) in vitro; 2) тестування проникної здатності мітохондріально-адресованих сполук на штучній "чорній" мембрані; 3) тестування захисної або ушкоджувальної дії мітохондріально-адресованих сполук на мембранні білки на моделі штучної мембрани, яка містить граміцидинові канали; 4) тестування антиоксидантної або прооксидантної дії мітохондріально-адресованих сполук 5 UA 107476 C2 5 10 15 20 25 30 35 40 45 50 55 60 на ізольовані мітохондрії; 5) тестування антиоксидантної або прооксидантної дії мітохондріально-адресованих сполук на культурах тварин, рослинних, бактерійних або дріжджових клітин; 6) тестування антиапоптозної, або антинекротичної, або проапоптозної, або пронекротичної дії мітохондріально-адресованих сполук на культурах клітин; 7) тестування накопичення мітохондріально-адресованих сполук усередині клітин; 8) тестування специфічної активності мітохондріально-адресованих сполук; під специфічною активністю в даному випадку розуміють здатність активувати або пригнічувати певні метаболічні шляхи, що, у свою чергу, може виявлятися в активації роботи певних генів на рівні транскрипції, стабільності мРНК або трансляції, на рівні модифікацій білків, які включають фосфорилювання або дефосфорилювання, протеоліз, глікозилювання, карбонілювання та інші способи зміни активності білків або білкових комплексів; активація або пригнічення метаболічних шляхів може також виявлятися в зміні інших фізіологічних параметрів клітини, а саме: зміна швидкості дихання, зміна швидкості продукування певних метаболітів, зміна швидкості споживання певних субстратів, зміна мембранного потенціалу на зовнішній мембрані, на мітохондріальній мембрані або мембранах іншої органели, зміна іонної провідності однієї або декількох з вищеперелічених мембран, зміна концентрацій певних іонів, включаючи зміну рН в цитоплазмі клітини або в інших компартментах клітини, зміна у внутріклітинному транспорті біомолекул, везикул і органел, зміна в ході клітинного циклу, зміна, яка призводить до ділення клітин, до трансформації клітин, до загибелі клітин або, навпаки, до їх виживання; 9) тестування біологічної активності сполук загальної формули (I) in vivo на тваринах або рослинах; ці тести не придатні на стадії первинного тестування комбінаторних бібліотек і можуть бути застосовані тільки для вивчення обмеженої кількості сполук. Таким чином, аспектами даного винаходу є кожен з вищеперелічених тестів, застосованих для вивчення властивостей нових сполук загальної формули (I), зокрема для прогнозування перспективності таких сполук. Під перспективністю в даному випадку розуміють перспективність практичного застосування цих сполук в медицині, біотехнології, косметології. IV. Методика інтерпретації результатів Іншим аспектом даного винаходу є методика інтерпретації результатів, які отримуються в ході тестування сполук загальної формули (I), з метою прогнозування перспективності практичного застосування сполук-кандидатів в медицині, біотехнології, косметології і з метою відбору найбільш перспективних сполук. Основним елементом даної методики є порівняння результатів тестування сполук кандидатів, з результатами тестування сполуки SkQ1, які приведені в розділі "експериментальні приклади". Дані по SkQ1, таким чином, можуть розглядатися як "точка відліку", репер, стандарт для прогнозування ефективності інших сполук загальної формули (I), оскільки SkQ1 є достатньо ефективною біологічно-активною сполукою і може бути застосована в медицині, біотехнології, косметології (див. заявки на винаходи PCT/RU2006/000394, PCT/RU2006/000546, PCT/RU2006/000547 та ін. публікації щодо SkQ1). Іншими стандартами для порівняння активності можуть служити речовини SkQR 1, MitoQ, MitoVitE, DMMQ. При цьому бажаною є можливість відновлення досліджуваної сполуки дихальним ланцюгом мітохондрій, бажано саме ферментами і ко-ферментами дихального ланцюга, і істотне превалювання у досліджуваної сполуки антиоксидантних властивостей над прооксидантними. Таким чином, сполука MitoVitE і DMMQ є свого роду "негативними" реперами і при відборі найбільш перспективних сполук - антиоксидантів слід уникати тих сполук, які схожі з ними за біологічною активністю (починаючи з рівня тестування на мітохондріях). Також негативним репером є речовина MitoQ. При відборі нових сполук на основі дослідження їх властивостей слід відбирати ті сполуки, які ближчі за своєю активністю до SkQ1 ніж до MitoQ. В першу чергу під активністю розуміють здатність проявляти антиоксидантні властивості в малих і надмалих концентраціях. Мітохондріальні адресовані антиоксиданти при підвищенні їх дози проявляють сильну прооксидантну дію на різні біологічні об'єкти (див. екпериментальні приклади а також Doughan A.K., Dikalov S.I. (2007), Antioxid. Redox Signal. 9:1825-36). При менших дозах ці сполуки проявляють антиоксидантні властивості. Таким чином, найважливішою характеристикою сполуки - мітохондріально адресованої речовини - є т.з. "вікно застосування" - тобто різниця між мінімальною концентрацією (дозою) речовини, яка вже проявляє антиоксидантні властивості та мінімальною концентрацією (дозою) речовини, яка проявляє прооксидантні властивості. Очевидно, що перевищення останньої концентрації (дози) є украй небажаним при практичному застосуванні речовини і може істотно 6 UA 107476 C2 5 10 15 20 обмежити можливість такого застосування. Методи оцінки "вікна застосування" на різних рівнях приведені в розділі експериментальні приклади. Пара сполук SkQ1-MitoQ може служити хорошим репером для оцінки перспективності досліджуваних сполук, оскільки SkQ1 має достатнє "вікно застосування", тоді як MitoQ - ні. Нижче приведена методика інтерпретації результатів тестування сполук. Методика підрозділяється на декілька етапів: 1) виходячи із результатів тестування властивостей речовин in vitro (тести 1,2,3 з розділу Методи тестування) можна оцінити антиоксидантні і прооксидантні властивості досліджуваних сполук; це дозволяє прогнозувати можливість їх застосування в галузях, де корисним є застосування прооксиданта або антиоксиданта; також тести in vitro дозволяють визначити здатність сполук-кандидатів проникати крізь біологічні мембрани, і, отже, прогнозувати біодоступність сполук, їх здібність до подолання різних бар'єрів в організмі (наприклад, гематоенцефалічного), а також і їх стабільність; 2) приклади інтерпретацій результатів тестів, які є аспектом даного винаходу, приведені в розділі "експериментальні приклади"; виходячи із цих прикладів і відповідних інтерпретацій кваліфікований фахівець в галузі біохімії, біофізики, біоенергетики, мікробіології, молекулярної біології, клітинній біології або інших галузей сучасної біології зможе правильно оцінити результати тестування речовин-кандидатів і відібрати з них найбільш перспективні і найбільш відповідні для потрібного практичного застосування. Для підтвердження здійсненності даного винаходу і вірності пропонованої моделі, були синтезовані нові мітохондріально адресовані антиоксиданти SkQ3, SkQ4, SkQ5 і SkQB1. V. Приклади сполук, перспективність яких передбачається даним винаходом: SkQ3: 25 30 35 Прогнозовані характеристики: сполука повинна мати більшу стабільність, але менш виражені антиоксидантні властивості в порівнянні з SkQ1. Можливе застосування в біотехнології рослин, мікології і мікробіології. SkQ4: Характеристики: знижена (в порівнянні з SkQ1) здатність проникати крізь біомембрани. Тим самим повинна бути понижена біодоступність препарату і понижена вираженість побічних ефектів. SkQ5: 7 UA 107476 C2 5 10 Характеристики: зменшення довжини лінкера між "іоном Скулачова" і антиоксидантом зменшує гідрофобність сполуки і може впливати на швидкість проникнення сполуки крізь мембрани. Серія сполук SKQB - з підвищеною проникною здатністю, в порівнянні з SkQ1. До цієї серії відносяться всі сполуки, в яких як "іон Скулачова" використовуються природні сполуки, наприклад, берберин. Сполуки з серії SKQB (наприклад, SkQВ1, формула якого приведена нижче) мають підвищену проникну здатність і, отже, є перспективнішими з фармацевтичної точки зору, і мають велику здатність до подолання гематоенцефалічного і гематоофтальмологічного бар'єрів. Також, сполуки серії SKQB, повинні характеризуватися менш вираженими побічними ефектами, оскільки берберин (також як і пальмітин) є природною сполукою рослинного походження. 15 SkQB1A SkQB1B 20 У загальному вигляді SKQB на основі берберину можуть бути представлені загальною формулою: 8 UA 107476 C2 SKQB: 5 10 15 20 де m - число від 0 до 3 (бажано - 2, тобто ліва частина формули є залишком пластохінону), "L" - лінкерна ланка завдовжки від 1 до 50 ланок, яка є: 1) або простим або розгалуженим вуглеводневим ланцюгом, яка містить, за необхідності, один або більше подвійний або потрійний зв'язок, або ефірний, або складноефірний, або С-S, або S-S, або пептидний зв'язок; і за необхідності заміщений одним або більше замісником, який бажано є алкілом, алкокси, галогеном, кето-групою, аміно-групою; 2) природним ізопреноїдним ланцюгом. Бажано L є залишком декану. Права частина формули сполуки є залишком берберину, приєднаним через один із атомів, які входять до його складу, до лінкера L. З'єднання може бути здійснене через С-С, С-О, С-N, СS зв'язок, зокрема складноефірний зв'язок, пептидний зв'язок, дисульфідний зв'язок. Зокрема приєднання може бути здійснене у вигляді простоефірного зв'язку, заміщаючи одну з метоксильних груп берберину. У сполуках серії SkQВ замість берберину можливе використання пальмітину. Також кращими сполуками на основі берберину і пальмітину є наступні сполуки: SkQB1: SkQP1: 9 UA 107476 C2 SkQB5: SkQP5: 5 10 15 20 Способи синтезу і опис хімічних властивостей і біологічної активності приведених вище сполук приведені в розділі "Експериментальні приклади". VI. Фармацевтичні субстанції на основі мітохондріально-адресованих антиоксидантів. Одним з аспектів даного винаходу є параметри нормативної документації, яка дозволяє застосовувати в медичній практиці фармацевтичну субстанцію на основі МАА і, зокрема, наступних показників, які включають: 1. достовірність, яка визначається, зокрема, шляхом a. спектрофотометрії в заданому діапазоні довжин хвиль і порівнянню з певними результатами дослідження спектрофотометрії зразка МАА b. ГІК - спектрометрії. Інфрачервоний спектр субстанції, знятий методом зрушеного повного внутрішнього віддзеркалення повинен мати збіг смуг поглинання із смугами поглинання спектру, що додається, за положенням і інтенсивністю смуг. c. Реакція на броміди. Хлороформний шар повинен забарвитися в жовтий колір. 2. Вміст сторонніх домішок, який визначається за допомогою методу ВЕРХ. Вміст кожної окремої домішки не більше 1,5 %. Сумарний вміст домішок не більше 4,0 %. 10 UA 107476 C2 5 10 15 20 25 30 35 40 45 50 55 60 3. Вміст важких металів (не більше 0,001 %). 4. Вміст залишкових органічних розчинників (таких як етанол, метанол і хлороформ). 5. Стерильність. 6. Кількісне визначення субстанції 7. Упакування, маркування і зберігання 8. Встановлений термін придатності На практиці відомі хінонвмісні мітохондріально-адресовані сполуки, включаючи речовини SkQ1, SkQR1, MitoQ та ін. (див. вище) існують, головним чином, в одній окисленій (хінонній) формі. При цьому за звичайних умов окислена форма здатна частково відновлюватися в хінольну форму (див. Фіг. 12). Таким чином, при використанні МАА як фармацевтичної субстанції, основною домішкою, вміст якої може досягати 5-8 % і більше, є відновлена форма МАА. Виділення і детальне дослідження цієї форми представляється важковирішуваним завданням зважаючи на її високу хімічну лабільність і схильність до складних окислювальновідновних переходів. З іншого боку, отримання фармацевтичної субстанції МАА в хінонній формі, вільній від відновленої (хінольної) форми стандартними методами хроматографічного очищення є проблематичним внаслідок схожості цих сполук. Друга проблема, з якою доводиться стикатися в процесі очищення вищенаведеної серії препаратів МАА, полягає в необхідності збереження характеристичного протиіону, наприклад іона брому. Звичайні умови проведення іонообмінної або високоефективної рідинної хроматографії (ВЕРХ) виявляються дуже жорсткими у відношенні до цих лабільних сполук і не гарантують збереження протиіону в початковій структурі. Таким чином, існуючі методи і прийоми виділення і очищення препаратів серії МАА не забезпечують необхідних параметрів чистоти для такого роду фармацевтичних субстанцій. В рамках даного винаходу це завдання вирішується за рахунок: Метод 1. Застосування нестандартного методу ВЕРХ в безсольовій безбуферній системі рухомої фази, а на завершальній стадії - гель-фільтрація висококонцентрованого розчину препарату. Метод 2. Використання "молекулярної пастки" для відновленої форми МАА у вигляді агента в неполярному розчиннику, який виконує роль ефективного індуктора окислення або конкурентного замісника хінонної форми в рівновазі хінон-хінол. Таким чином, ще одним аспектом даного винаходу є спосіб отримання МАА у формі, прийнятній для фармацевтичних субстанцій, який включає Метод 1 і/або Метод 2. VII. Також аспектом даного винаходу є покращений метод синтезу МАА на основі хінонів. Покращена методика дозволяє здійснювати промислове отримання (синтез) МАА з дешевших і доступніших компонентів, зокрема у випадку синтезу пластохінонілдецилтрифенілфосфонію (ПДТФ) броміду та інших похідних пластохінону вона дозволяє використовувати як початкову сировину не диметилгідрохінон, а 2,3-диметилфенол. Синтез включає наступні стадії: 1. Окислення 2,3-диметилфенолу (1) в 2,3-диметил-1,4-бензохінон (2) реактивом Джонса. 2. Приєднання 11-бромундеканової кислоти (3) до трифенілфосфіну з утворенням броміду (10-карбоксидецил) трифенілфосфіну (4) 3. Утворення цільової сполуки (5) в результаті реакції отриманої сполуки (4) з 2,3-диметил1,4-бензохіноном (2) у присутності нітрату срібла і персульфату амонію. Загальна схема синтезу приведена на Фігурі 13. Докладніше синтез описаний в експериментальному прикладі ЕП8. Короткий опис фігур Фіг. 1 Здатність сполук загальної формули (I) окислюватися під дією кисню (А) або супероксиду (Б), який утворюється в реакції ксантиноксидази з ксантином. Фіг. 2 Порівняння здатності сполук, які відповідають структурі (I) проникати крізь двошарову мембрану і утворювати мембранний потенціал. Для порівняння на графіці чорною лінією показані розрахункові показники для ідеально проникного монокатіону (за рівнянням Нернста). Фіг. 3 Тестування захисної або ушкоджувальної дії мітохондріально-адресованих сполук на мембранні білки на моделі штучної мембрани, яка містить граміцидинові канали. Пошкодження граміцидинових каналів стимулювалося фотоактивацією фотосенсибілізатора фталоцианіну (А) або сумішшю FeSO4, аскорбату і третбутилгідропероксиду (Б). + Фіг. 4 Накопичення SkQ1 і SKQ5 в мітохондріях, яке визначається за допомогою ТФФ електроду. Фіг. 5 Здатність мітохондрій відновлювати або окисляти SkQ1 залежно від активності компонентів дихального ланцюга. Фіг. 6 SkQ1 захищає мітохондрії в умовах окислювального стресу спричиненого сумішшю 11 UA 107476 C2 5 10 15 20 25 30 35 40 45 50 55 60 сульфату заліза з аскорбатом калію. Фіг. 7 SkQ1 і MitoQ захищає клітини від загибелі спричиненої H 2O2 (300 мкМ). Клітини інкубувалися з SkQ1 або MitoQ протягом 7 днів, після чого розсаджувалися для експерименту. Фіг. 8 Коротка передінкубація клітин HeLa з SkQR1 (2 години) знижує рівень окислювального стресу в клітинах викликаного H2O2 (300 мкМ). Дані цитофлуометрії (А) виходячи із яких були розрахована кількість клітин з низьким рівнем окислювального стресу (Б). Розрахунки проводили виходячи із даних 7 експериментів. Дані розраховували відносно групи контрольних клітин, які знаходяться на діаграмі в області низької флуоресценції DCF DA (50 % популяцій), ця група клітин приймалася за 100 % і відносно них розраховувалися показники для кожної дії. Фіг. 9 Обробка клітин SkQ1(20 нМ) протягом 7 днів захищає клітини HeLa від окислювального стресу спричиненого H2O2 (300 мкМ) Фіг. 10 Індукція люмінесценції E. coli MG1655 pLUX: PsoxS у присутності пероксиду водню (100 мкМ) і параквату (100мкМ). Фіг. 11 Індукція soxS промотору пероксидом водню (500 мкМ) і паракватом (100 мкМ) у присутності SkQ1 (10 мкМ). Фіг. 12 Рівновага хінонної та хінольної форм мітохондріально-адресованих антиоксидантів. R - лінкерна група, сполучена з ліпофільним іоном ("іоном Скулачова"). Фіг. 13 Схема покращеного методу синтезу мітохондріально-адресованого антиоксиданту ПДТФ. Здійснення винаходу - експериментальні приклади. Нижче приведені експериментальні приклади (ЕП), які покликані проілюструвати можливість застосування винаходу для розробки нових мітохондріально-адресованих сполук. Результати експериментів (тестів) також є точками відліку, які дозволяють оцінювати перспективність нових сполук, розроблених (або відібраних з комбінаторних бібліотек) фахівцями в даній галузі, які використовують даний винахід для пошуку нових мітохондріально адресованих сполук. В зв'язку з цим експериментальні приклади названі "тестуваннями", оскільки є методами тестування нових сполук. ЕП1. Тестування окислювально-відновних властивостей і стабільності сполук загальної формули (I) in vitro. Першим етапом відбору сполук, які відповідають структурі (I) є тестування їх окислювальновідновних властивостей. Саме на цьому етапі можна відбирати речовини із заданими про- або антиоксидантними властивостями. Найбільш простий спосіб відбору сполук з потенційно антиоксидантними властивостями це тестування їх здатності окислюватися під дією кисню або су пероксиду, який утворюється в реакції ксантину з ксантиноксидазою. Стабільність в часі відновлених форм SkQ1 і MitoQ досліджували методом аналізу абсолютних спектрів поглинання даних сполук в діапазоні від 240 до 310 нм, отриманих за допомогою двопроменевого спектрофотометра Pye Unicam SP1100, Англія. За розробленою методикою похідні хінонів відновлювали тетрагідроборатом натрію в середовищі вимірювання, яке містило 20мМ MOPSKOH, pH=7,6. Кювета порівняння не містила SkQ1 або MitoQ, відновник вносили до обох кювет, вимірювання проводили після закінчення виділення водню. Ступінь відновлення хінонів оцінювали за величиною площі піку методом зважування, для порівняння вимірювали абсолютне значення поглинання в максимумі при 267 нм. Отримані дані указують на те, що під дією кисню відновлена (хінольна) форма SkQ1 є стійкішою до окислення киснем повітря, ніж MitoQ (Фіг. 1а). Тим самим, SkQ1 є менш схильним до спонтанної взаємодії з киснем і утворення радикалів, що потенційно указує на його меншу токсичність для клітини. З іншого боку, коли сполуки окислювалися не киснем а супероксидом, який утворюється в результаті реакції ксантиоксидази з ксантином, SkQ1 окислювався набагато ефективніше ніж MitoQ (Фіг. 1б). Це може вказувати на те, що SkQ1 є активнішим як антиоксидант і його відновлена (активна) форма є стійкішою до спонтанного окислення киснем повітря, ніж MitoQ і проявляє велику спорідненість до супероксидного радикала. ЕП2. Тестування проникної здатності мітохондріально-адресованих сполук на штучній "чорній" мембрані Для тестування проникної здатності мітохондріально-адресованих сполук, які відповідають структурі (I) пропонується використовувати метод, який ґрунтується на здатності іонів проникати крізь двошарову фосфоліпідну мембрану, рухаючись за градієнтом концентрації. Двошарова мембрана розділяє дві камери, заповнені водним розчином, в одну з них додається досліджувана речовина. Якщо заряджена речовина здатна проникати крізь двошарову мембрану, то відбувається її швидка дифузія з камери з високою концентрації в камеру з низькою концентрації речовини, при цьому на мембрані утворюється різниця потенціалів. Для іонів, які несуть один заряд і здатних вільно проникати крізь мембрану 10 разовий градієнт 12 UA 107476 C2 5 10 15 20 25 30 35 40 45 50 55 60 концентрацій дозволяє утворювати потенціал в 60 мВ (відповідно до рівняння Нернста). Дана методика застосовувалася в різних дослідженнях із вивчення здатності іонів проникати крізь біліпідну мембрану і детально описана в статті Starkov AA, Bloch DA, Chernyak BV, Dedukhova VI, Mansurova SA, Symonyan RA, Vygodina TV, Skulachev VP, 1997, Biochem. Biophys Acta, 1318, 159-172. За допомогою цього методу нами було протестовано декілька речовин, які відповідають структурі (I), а саме SkQ1, SkQ3, SkQR1 і MitoQ. Було показано, що SkQ3 і SkQR1 -6 -4 повністю підкоряються рівнянню Нернста в концентраціях від 5×10 до 5×10 М (для SkQ3) і від -6 -5 -5 5×10 до 5×10 М (для SkQR1). У концентрації вище 5×10 М SkQR1 перестає відповідати рівнянню Нернста що, ймовірно, пов'язано з його здатністю ушкоджувати мембрану у високих концентраціях. Градієнт SkQ1 і MitoQ починає утворювати потенціал відповідно до рівняння -5 -4 Нернста при вищих концентраціях (у межах від 5×10 до 5×10 М). Таким чином, виходячи із отриманих даних можна зробити висновок про те, що SkQ1 і MitoQ мають меншу проникну здатність у порівнянні з SkQ3 або SkQR1. Цей відносно простий метод є ідеальним на стадії первинного відбору передбачуваних мітохондріально направлених сполук, які відповідають структурі (I), оскільки дозволяє швидко відібрати сполуки, які мають якнайкращу проникну здатність, тобто потенційно є найбільш біодоступними. Також була проаналізована проникна здатність сполук SkQB1 і SkQBP1. Результати аналізу показали високу проникну здатність цих сполук (яка не поступається здатності SkQ1). ЕП3. Тестування захисної або ушкоджувальної дії мітохондріально-адресованих сполук на мембранні білки на моделі штучної мембрани, яка містить граміцидинові канали. У нашій лабораторії була розроблена методика, яка дозволяє вивчати антиоксидантну активність речовин в простій системі, яка складається з двошарової мембрани, провідного білка граміцидину і фотосенсибілізатора (мітотрекера червоного, тричі сульфованого алюмофталоціаніну або фталоціаніну цинку). Суть методу полягає в здатності активних форм кисню, молекул фотосенсибілізатора, які утворюються в результаті фотоактивації, ушкоджувати граміцидинові канали, внаслідок чого провідна здатність двошарової мембрани різко падає. Окрім фотосенсибілізаторів пошкодження граміцидинових каналів можна викликати, запустивши в системі реакцію Фентона, в результаті якої утворюється високоактивний гідроксильний радикал кисню (реакція Фентона запускається сумішшю FeSO 4, аскорбата і третбутилгідропероксиду). За допомогою цієї методики нами були протестовані сполуки SkQ1, SkQ3 і MitoQ. Як видно з представлених на Фігурі3а даних фотоактивація фталоціаніну за допомогою короткого спалаху світла приводить до сильного падіння провідності мембрани унаслідок пошкодження граміцидинових каналів двошарової мембрани. Падіння провідності мембрани ефективно блокувалося за допомогою азиду натрію (високоефективної пастки синглетного кисню), а також за допомогою ферменту супероксидисмутази (яка каталізує перетворення супероксиду кисню на відносно слабоактивний пероксид водню). Ні азид натрію, ні супероксидисмутаза повністю не запобігає падінню провідності двошарової мембрани. Цей факт указує на те, що при фотоактивації фталоціаніну відбувається генерація як синглетного кисню, так і супероксиду кисню. SkQ1 в цій моделі був найбільш ефективним, тобто SkQ1 є антиоксидантом широкого спектру дії, який захищає від різних активних форм кисню. У іншій моделі, де пошкодження граміцидинових каналів стимулювали сумішшю FeSO 4, аскорбата і третбутилгідропероксиду SkQ1 також був найбільш ефективним, тоді як MitoQ і SkQ3 виявилися менш ефективними антиоксидантами (Фіг. 3б). Метод, який використовувався нами для тестування антиоксидантної здатності синтезованих нами сполук, є високо ефективним і дозволяє не тільки оцінити антиоксидантну активність сполук, але і визначити специфічність сполуки до конкретних активних форм кисню. Як еталонна речовина для цього методу було б правильно використовувати SkQ1 як найбільш ефективну сполуку, яка проявляє антиоксидантну активність до широкого спектру активних форм кисню. ЕП4. Тестування антиоксидантної або прооксидантної дії мітохондріально-адресованих сполук на ізольовані мітохондрії. Існує велика кількість методів, де як об'єкт дослідження виступають мітохондрії. Нами були підібрані найбільш інформативні методики, які дозволяють з високою мірою достовірності визначати потенційну біоактивність мітохондріально-адресованих сполук загальної формули (I). i) Тестування здатності сполук загальної формули (I) накопичуватися в мітохондріях. Здатність сполук загальної формули (I) накопичуватися в мітохондріях тестувалося за допомогою тетрафенілфосфонієвого електроду. Цей метод можна використовувати тільки для сполук загальної формули (I), в яких як адресна група використовується ліпофільний катіон тетрафенілфосфонію. За допомогою цього електроду можна вимірювати розділення тетрафенілфосфонієвого катіона (або сполук, до складу яких він входить) між матриксом 13 UA 107476 C2 5 10 15 20 25 30 35 40 45 50 55 60 мітохондрій і середовищем. Як видно на фігурі 4 SkQ1 накопичується в мітохондріях протягом 15-20 хвилин. Падіння мембранного потенціалу мітохондрій, викликане за допомогою відокремлювача окислювального фосфорилювання FCCP, приводить до виходу відносно невеликої кількості SkQ1 з мітохондрій. Враховуючи, що SkQ1 є ліпофільним катіоном (розподіл октанол: вода для SkQ1 складає 20000: 1) основна кількість SkQ1 накопичується в мітохондріальній мембрані незалежно від ступеня енергізації мітохондрій. Якщо замість SkQ1 використовувати менш ліпофільний SkQ5, то рівень незалежного накопичення помітно знижується. Дана методика дозволяє досліджувати ефективність накопичення сполук загальної формули (I) в мітохондріях, залежність швидкості їх накопичення від функціонального стану мітохондрій, а також передбачати потенційну біодоступність досліджуваних сполук. ii) Вимірювання здатності сполук загальної формули (I) відновлюватися дихальним ланцюгом мітохондрій. Ключовою перевагою мітохондріально - адресованих антиоксидантів, запропонованих в рамках цього винаходу, є їхня здатність відновлюватися дихальним ланцюгом мітохондрій. Для вивчення можливості відновлення сполук загальної формули (I) дихальним ланцюгом мітохондрій вимірювали швидкість зміни співвідношення окисленої і відновленої форм сполук у присутності субстратів дихання в середовищі виділення мітохондрій печінці щура. Вимірювання проводили у присутності мітохондрій. Експерименти показали, що SkQ1 здатний відновлюватися дихальним ланцюгом мітохондрій. Використання різних субстратів окислення показало, що SkQ1 здатний відновлюватися як комплексом I (мітохондрії енергізували, глутаматом з малатом) так і комплексом II (субстрат окислення сукцинат) (Фіг. 5а). Для виключення впливу ендогенних субстратів використовували інгібітори комплексу I - ротенон, а також інгібітор комплексу II - малонат. Інгібування комплексу II малонатом на тлі ротенону стимулювало окислення SkQ1, ймовірно комплексом III. Інгібування комплексу III міксотіазолом, у свою чергу, перешкоджало цьому окисленню, що підтверджує здатність комплексу III окисляти SkQ1 (Фіг. 5б). Окислення SkQ1 комплексом III відбувається набагато повільніше, ніж його відновлення комплексами I і II (Фіг. 5б). Отримані дані указують на те, що в енергізованих мітохондріях основна кількість SkQ1 знаходиться у відновленому стані (хінольна форма) в якому виявляється його антиоксидантні властивості. Таким чином, дана методика дозволяє досліджувати здатність сполук загальної формули (I) відновлюватися дихальним ланцюгом мітохондрій, крім того виходячи із отриманих даних можна передбачати про- або антиоксидантні властивості тестованих сполук. iii) Тестування антиоксидантної активності сполук загальної формули (I) в умовах окислювального стресу мітохондрій спричиненого сумішшю FeSO4, аскорбату. Одним з широко використовуваних методів визначення окислювального стресу в мітохондріях, в культурах клітин або в тканинах, є метод кількісного визначення малонового діальдегіду. Окислювальний стрес в цих випадках можна індукувати різними способами: третбутилгідропероксидом, гідроперекисом Кумолу, пероксидом водню, ксантин/ксантиноксидазою, сумішшю сульфату заліза з аскорбатом калію тощо. У своїх експериментах для запуску окислювального стресу ми використовували суміш сульфату заліза з аскорбатом калію. Як відомо, в процесі метаболізму мітохондрії утворюють деяку кількість H2O2, яка за фізіологічних умов не становить небезпеки, оскільки швидко утилізується різними антиоксидантними системами. Додавання до середовища, яке містить мітохондрії, сульфату заліза у поєднанні з аскорбатом калію викликає реакцію заліза з H2O2 (реакція Фентона) в 2+ 3+ результаті якої утворюється високо реакційний гідроксил радикал (Fe + Н2О2 → Fe +·ОН + ОН). У свою чергу, гідроксил радикал взаємодіє з ненасиченими жирними кислотами мембран і стимулює їх вільне радикальне окислення, що зрештою призводить до накопичення малонового діальдегіду. Подібна модель добре підходить для вивчення ефективності різних антиоксидантів, у тому числі і сполук загальної формули (I). На Фігурі 6 показані результати тестування антиоксидантної дії SkQ1. Як видно, максимальна антиоксидантна дія SkQ1 виявляється вже в концентраціях 20-50 нМ. Додавання до суспензії мітохондрій міксотіазолу (інгібітор комплексу III), перешкоджає окисленню SkQ1 комплексом III, що помітно підвищує антиоксидантну здатність SkQ1. Отримані дані підтверджують антиоксидантні здатності SkQ1, і, крім того, показують важливість здатності антиоксидантів відновлюватися дихальним ланцюгом мітохондрій. Таким чином, метод кількісного вимірювання малонового діальдегіду дозволяє з високою мірою достовірності передбачати про- або антиоксидантні властивості досліджуваних сполук, а також тестувати їх ефективні концентрації. ЕП5. Тестування антиоксидантної або прооксидантної дії мітохондріально-адресованих сполук на культурах тварин, рослинних, бактерійних або дріжджових клітин. 14 UA 107476 C2 5 10 15 20 25 30 35 40 45 50 55 60 Враховуючи велику кількість різноманітних методів тестування біологічної активності сполук в культурі клітин, в даному розділі будуть описані лише ті методи, які, завдяки своїй простоті та інформативності, найбільше придатні для первинного тестування сполук загальної формули (I). a. Тестування дії мітохондріально-адресованих сполук на культурах тваринних клітин. Як модель для тестування антиоксидантної здатності сполук загальної формули (I), нами були вибрані клітини карциноми матки людини лінії HeLa, а також нормальні диплоїдні фібробласти з шкіри і легенів людини. Тестування антиоксидантної здатності сполук проводили за допомогою методів цитофлуометрії, а також флуоресцентної мікроскопії. У попередніх експериментах для кожної з клітинних культур була підібрана оптимальна концентрація Н 2О2, яка викликає значний (60-80 %) апоптоз клітин без видимих ознак некрозу. Для визначення конденсації і фрагментації хроматину, що відбувається в клітинах при апоптозі, використовували флуоресцентний барвник Hoechst. Барвник в концентрації 1 мкг/мл додавали в кінці інкубації до живих або фіксованих клітин на 30 хвилин. Для визначення некрозу до нефіксованих клітин додавали флуоресцентний барвник пропідій йодид (PI) в концентрації 2 мкг/мл. Відсоток апоптозних і некрозних клітин визначали за допомогою підрахунку числа клітин з фрагментованим ядром і клітин, проникних для пропідій йодиду, відповідно. У експериментах з проникними мітохондріально-адресованими антиоксидантами необхідно враховувати, що, залежно від проникної здатності сполук, час необхідний для їх накопичення в мітохондріях клітин культури може бути різним. Так нами було показано, що SkQ1 і MitoQ підвищують стійкість клітин до Н 2О2 тільки у випадку, якщо клітини інкубувати з ними протягом 5-7 днів. Відокремлювач окислювального фосфорилювання FCCP, який викликає падіння мембранного потенціалу мітохондрій, перешкоджав захисній дії SkQ1 і MitoQ. Це є важливим контролем, який вказує на те, що досліджувані сполуки дійсно є мітохондріально-адресованими. SkQ1 і MitoQ, будучи мітохондріально-адресованими антиоксидантами, проявляють свою дію в надзвичайно низьких концентраціях. Так, SkQ1 проявляє свою захисну дію вже в концентрації 0,2 нМ (Фіг. 7). Як видно на Фігурі 7 SkQ1 набагато ефективніше захищає клітини від загибелі в порівнянні з MitoQ, тобто SkQ1 є ефективнішим антиоксидантом. Як і будь-які антиоксиданти SkQ1 і MitoQ мають граничні концентрації, вище за які проявляється їх прооксидантна активність, так при концентрації SkQ1 і MitoQ вище 0,5 mkM проявляється їх прооксидантна дія, яка призводить до стимуляції загибелі клітин викликаної Н2О2. Для вимірювання рівня окислювального стресу стимульованого Н 2О2, клітини забарвлювали флуоресцентним барвником DCF-DA (2',7'-дихлородигідрофлуоресцеїн діацетат), після чого вимірювали рівень флуоресценції цього барвника за допомогою цитофлуориметра. За допомогою цього методу показано, що інкубація клітин з SkQ1 або MitoQ протягом 1-5 годин не перешкоджала в клітинах окислювальному стресу спричиненому Н 2О2. В той же час SkQR1, який має вищу проникну здатність (як адресна група замість тетрафенілфосфонію використовувався гідрофобний катіон - залишок родаміну G) вже за цей час появляв антиоксидантну дію, причому в нижчих, у порівнянні з SkQ1, концентраціях (Фіг. 8 А, Б). SkQ1 (Фіг. 9) як і MitoQ (не показано) проявляли свої антиоксидантні властивості тільки через 5-7 днів інкубації з клітинами. Отримані хронологічні залежності добре співвідносяться з проникною здатністю SkQR1, SkQ1 і MitoQ (проникні здатності цих катіонів розташовуються в наступній послідовності: SkQR1 > SkQ1> MitoQ). Таким чином, методики, описані вище, дозволяють визначати здатність сполук загальної формули (I) захищати клітини від загибелі спричиненої окислювальним стресом. Крім того, дані методи можуть допомогти в прогнозі терапевтичних дозувань і часу прийому препаратів на основі сполук загальної формули (I). b. Тестування дії мітохондріально-адресованих сполук на клітинах E. coli. Для тестування про- і антиоксидантних властивостей мітохондріально-адресованих сполук загальної формули (I) був розроблений метод визначення окислювального стресу в клітинах E. coli. Для цього була створена система біосенсорів на основі генів luxAB, які кодують бактерійні люциферази, для вивчення дії проникних іонів на окислювальний стрес бактерійної клітини. Люциферази на даний час широко використовуються в роботах із молекулярної генетики (генирепортери), при біохімічних аналізах (наприклад, визначення мікрокількостей АТФ), в генноінженерних роботах (селекція), в біотехнології і екології (біосенсори) тощо. Висока чутливість, простота детектування світлового сигналу за допомогою люмінометра або сцинтиляційного лічильника, пряма пропорційність між кількістю ферменту-люциферази і інтенсивністю біолюмінесценції в межах декількох порядків величини, можливість проведення вимірювань як in vitro, так і in vivo (без руйнування клітин) і ряд інших переваг визначають можливість застосування генів люцифераз в різних генетичних і біохімічних тестах. У розробленій нами 15 UA 107476 C2 5 10 15 20 25 30 35 40 45 50 55 60 методиці використовували гени, які кодують люциферазу наземних бактерій Photorhabdus luminescens [1]. Грам-негативні бактерії Ph. luminescens є симбіонтами ентомопатогенних нематод. Люцифераза з Ph. luminescens характеризується високою термостабільністю (активна за температури до 45 °C), що полегшує використання lux-генів як репортерів. Для тестування хімічних домішок (токсикантів) у воді, ґрунті, харчових продуктах, повітрі тощо, lux-біосенсори на даний час використовуються в двох варіантах: 1) заснованому на гасінні біолюмінесценції токсикантом; 2) заснованому на індукції (посиленні) інтенсивності біолюмінесценції токсикантом. У методиках, що належать до першої групи, використовується механізм інгібуючої дії отруйних речовин, на метаболізм клітини, в основному, на дихальний ланцюг, що опосередковано впливає на люциферазну реакцію, викликаючи ослаблення інтенсивності біолюмінесценції суспензії клітин. До другої групи методик, заснованих на індукції (посиленні) біолюмінесценції клітин при дії токсиканта, відносяться різні варіанти використання специфічних регуляторних елементів, які виробляються бактеріями в процесі еволюції і які специфічно реагують на наявність в середовищі тієї або іншої хімічної речовини. Дана група біосенсорів характеризуються як специфічністю, так і високою чутливістю, оскільки визначається особливістю взаємодії білкарецептора (репресора або активатора) з хімічною сполукою. У бактерій можна виділити регуляторні системи, які специфічно реагують на токсиканти, що діють на: 1) клітинні мембрани, 2) білки, 3) хромосому (ДНК), а також 4) які індукують в клітині окислювальний стрес. Крім того, бактерії мають регуляторні системи, які специфічно реагують на важкі метали і на іони миш'яку. Як біосенсор на токсиканти, які діють на клітинні білки (наприклад, різні фенольні похідні, спирти), може бути використаний промотор grpE: PgrpE. Цей промотор в бактерійному геномі розташований перед генами "теплового шоку" і активується лише у випадку появи в клітині модифікованих, денатурованих білків. В ролі біосенсора на ДНК-тропні агенти (мітоміцин С, метилметансульфонат, діоксин, а також ультрафіолетове та іонізуюче випромінювання) використовується SOS-промотор PrecA. Репресором є білок LexA. Промотор PrecA активується лише при індукції пошкоджень в геномі, тобто в молекулах ДНК. Для детекції речовин, які індукують в клітині окислювальний стрес (які утворюють в клітині гідроксильний радикал (OH ), 2супероксид-іон-радикал (O ), перекис водню (H2O2)) використовуються промотори PkatG і PsoxS. Промотор PkatG (активатор OxyR) специфічно реагує на перекис водню, органічні пероксиди тощо. Промотор PsoxS активується у випадку появи в середовищі супероксид-іон-радикала. На основі вищеописаних, індукованих промоторів були сконструйовані lux-біосенсори. Всі промотори, які використовуються в розробленій нами методиці, з відповідними регуляторними ділянками, були отримані з генома бактерій Escherichia coli K12 MG1655 за допомогою методу PCR з використанням спеціальних, синтезованих праймерів. Як вектор використовували безпромоторний вектор з репліконом pBR322 і геном bla, який визначає резистентність до ампіциліну (селективний маркер). Вбудовування промоторної області в плазміду проводили за сайтами EcoRI-BamHI. Як lux-касети нами був обраний lux-оперон Ph. luminescens, який складається з п'яти генів, luxCDABE. Всі отримані біосенсори тестувалися на придатність для роботи з мітохондріальноадресованими антиоксидантами загальної формули (I). Як з'ясувалося мітохондріально-адресовані антиоксиданти загальної формули (I), зокрема SkQ1 і MitoQ, видно, мають високу специфічність до біосенсорів, так або інакше пов'язаних з окислювальним стресом, оскільки мають в своїй структурі похідні хінонів і з високою ефективністю накопичуються в заряджених мембранах. Тому оптимальним представляється використання pLUX: PkatG і pLUX: PsoxS біосенсорів. Фіксація пошкоджень ДНК при окислювальному стресі і вплив проникних іонів на цей процес можливі при використанні pLUX:PrecA біосенсора. pLUX:PgrpE і pLUX:Plac біосенсори, очевидно, використовуватимуться як позитивний і негативний контролі. На першому етапі тестування були підібрані умови індукції окислювального стресу, при якому відбувається максимальна індукція люмінесценції. Так, на Фігурі 10 показана здатність H2O2 і параквату індукувати біолюмінесценцію біосенсора. Індукція люмінесценції E. coli MG1655 pLUX: PkatG у присутності H2O2 стає помітною протягом 15 хвилин і досягає максимальних значень за годину (Фіг 10А). Співвідношення інтенсивності люмінесценції контрольних клітин до індукованих складає за оптимальних концентрацій H2O2 1/80. Індукція люмінесценції E. coli MG1655 pLUX: PsoxS у присутності параквату стає помітною протягом 15-20 хвилин і досягає максимальних значень за дві години (фіг 10Б). Співвідношення інтенсивності люмінесценції контрольних клітин до індукованих складає за оптимальних концентраціях параквату 1/100. 16 UA 107476 C2 5 10 15 20 25 30 35 40 45 50 На наступному етапі вже можна тестувати про- або антиоксидантні здатності сполук загальної формули (I). За допомогою біосенсорів pLUX: PkatG і pLUX: PsoxS були перевірені антиоксидантні властивості SKQ за умов окислювального стресу E. coli. Показано, що 10 мкМ SKQ ефективно рятує клітину від супероксид аніон радикалів, які з'являються в результаті окислювального стресу спричиненого перекисом водню, при цьому вказана концентрація SKQ не мала помітного впливу на окислювальний стрес викликаний паракватом (Фіг. 11). Причини подібної розбіжності можуть полягати в різних способах генерації АФК пероксидом водню і параквату. Якщо у випадку пероксиду водню, ми індукуємо окислювальний стрес на нетривалий час (Н2О2 активно розкладається ферментами антиоксидантного захисту клітини), то у випадку параквату окислювальний стрес триває набагато довше. Крім того, показано, що в клітинах E. coli активно працює система множинної фармацевтичної стійкості (MDR), що займається відкачуванням позитивних катіонів з клітини. Робота цих ферментів різко знижує ефективність SkQ1 і його аналогів. Таким чином, якщо у випадку H2O2 SkQ1 встигає захистити клітини від окислювального стресу до того як білки MDR викачають його з клітини, то у випадку параквату SkQ1 стає не ефективним. Отримані результати показали, що розроблений тест-метод є надійним і швидким інструментом для тестування про- або антиоксидантної здатності сполук загальної формули (I). ЕП6. Тестування біологічної активності сполук загальної формули (I) in vivo на тваринах і рослинах. Тестування сполук загальної формули (I) in vivo на тваринах або рослинах може відноситися тільки до тих сполук, які пройшли всі попередні тести розділу і для яких показана потенційна біологічна активність. Це пов'язано з тим, що для підготовки дослідів in vivo необхідно володіти повною інформацією про потенційні мішені дії препарату, що є необхідним для розробки моделі, на якій варто працювати дослідникові для отримання найбільш інформативних результатів. Для дослідів in vivo на стадії попереднього відбору слід використовувати найбільш прості методи, які дозволяють судити про принципову можливість препаратів проявляти біологічно активну дію. Модельним об'єктом для цих цілей можуть бути дрібні безхребетні тварини, типу рачків Ceriodaphnia affinis. Подібні об'єкти, зокрема - організми зоопланктону, служать популярним тест - об'єктом при оцінках забрудненості середовища, дослідженнях біологічної дії витяжок з матеріалів, з кормових продуктів, препаратів медичного призначення. У переважній кількості застосувань оцінки проводяться в короткочасних дослідах з урахуванням виживання, поведінки тест - об'єктів і порушення деяких фізіологічних функцій. Для виявлення ефекту слабкого впливу в хронічному режимі контролюються, крім вказаних, такі інтегральні індивідуальні показники, як ріст і розмноження. При кількісних оцінках дії хімічних агентів на тест - об'єкти в хронічному режимі виявляється феномен, який називається "фазністю" токсичного ефекту, тобто чергування пригнічення і стимуляції активності біологічної функції або розвитку структурного елементу під впливом потенційно токсичних речовин. У результаті цього багато потенційних токсикантів у деяких концентраціях можуть надавати тимчасовий стимулюючий ефект на окремі функції і на тестоб'єкти в цілому. Таким чином, важливим критерієм сприятливої дії препаратів є повна тривалість життя організмів, оскільки в цьому випадку можна виключити небезпеку потрапити в сприятливу фазу препарату, який насправді є токсичним. Було досліджено вплив препарату SkQ1 в різних концентраціях на основні життєвих функцій рачків Ceriodaphnia affinis впродовж природної тривалості їх життя з особливою увагою до стимулюючої дії препарату. У першій серії дослідів (чисельність тварин в кожній серії складала 20 особин) виживання рачків у присутності етанолу (0,79 міліграм/л) практично не відрізнялася від контрольного (Фіг. 4). При концентраціях 5,5 і 0,55 нМ SkQ1 виживання рачків була вищим ніж у контролі, а в концентрації 55 нМ - нижче. Термін загибелі фіксованої частки рачків в концентраціях SkQ1 0,55 і 5,5 нМ був підвищений весь період спостереження, а термін загибелі 50 % перевищував показник в контролі в 2 і 1,4 разу, відповідно (таблиця 1). 17 UA 107476 C2 Таблиця 1 Терміни (у добі) фіксованих величин загибелі Ceriodaphnia affinis при дії препарату SkQ1 Концентрації Контроль Етанол, 0,79 мг/л 0,55 нМ 5,5 нМ 55 нМ LT25 % 16 14 22 18 9 LT50 % 18 18 36 26 12 LT75 % 29 25 45 46 17 Середня тривалість життя рачків в концентраціях 0,55 і 5,5 нМ була вищою, ніж в контролі, в концентрації 55 нМ - нижчою, ці відмінності статистично достовірні (таблиця 2). 5 Таблиця 2 Середня тривалість життя Ceriodaphnia affinis за умови дії препарату SkQ1 Концентрація Контроль Етанол, 0,79 міліграм/л SkQ1 0,55 нМ SkQ1 5,5 нМ SkQ1 55 нМ M±m 20,2 ± 4,99 19,55 ± 5,26 33,55 ± 6,21 31,25 ± 8,11 12,85 ± 2,79 td % від контролю 0,18 3,28* 2,27* 2,52* 96,78 166,09 154,7 63,61 *- відмінність статистично достовірна 10 15 20 25 30 35 Таким чином, отримані результати указують на здатність SkQ1 сприятливо впливати на життєдіяльність дрібних безхребетних, що виражається в збільшенні тривалості їх життя. Крім того, були підібрані концентрації сполуки, які сприятливо впливають на організм, і які можуть бути застосованими в дослідах із тестування біологічної активності досліджуваних препаратів загальної формули (I) на вищих тваринах. ЕП7. Метод очищення мітохондріально-адресованого антиоксиданту з використанням "молекулярної пастки» 1. Початковий технічний продукт ПДТФ (5 г) після попереднього очищення на силікагелі в системі етанол-хлороформ (1:9) має чистоту близько 85 %. Вміст відновленої форми 8 %. Для очищення від основної маси домішок використаний метод ВЕРХ. Колонка С 18, 500×45 мм. Рухома фаза - безсольовий безбуферний водно-етанольний розчин. Режим градієнтний. Система А - 15 % етанолу, система Б - 40 % етанолу. Після відбору центральних фракцій чистота препарату складає близько 92 %. Вміст відновленої форми 6 %. Порівняльна якісна реакція на броміди початкового і очищеного продукту показує збереження іона брому після хроматографічного очищення. Аналітична ВЕРХ на колонці С18, 250×4,6 мм в системі 0,05 % трифтороцтової кислоти в 65 % ацетонітрилу у воді також демонструє приблизно однакову інтенсивність піку іона брому (на початку хроматограми) для початкового і очищеного продукту. 2. Продукт після очищення методом ВЕРХ (3,8 г), відгонки розчинника і висушування у високому вакуумі має вигляд густої прозорої олії темно-коричневого кольору. Для мінімізації вмісту відновленої форми в препараті використаний один з варіантів методу "молекулярної пастки". У колбу з олією підливають 200 мл гексану, додають 5 мл ацетону і масу інтенсивно перемішують на магнітній мішалці протягом 30 хв. Після цього обережно декантують шар розчинника. Проводять хроматографічний контроль порції злитого розчинника і олії, яка залишилася. На ВЕРХ розчинника окрім невеликого піку ацетону є тільки інтенсивний пік відновленої форми; основна окислена форма відсутня. На хроматограмі цільового продукту добре видно зменшення вмісту відновленої форми. Для подальшої мінімізації вмісту відновленої форми може бути потрібним повторення даної процедури кілька разів. Можливе проведення цієї процедури в автоматичному режимі з безперервною подачею 18 UA 107476 C2 5 10 15 20 25 30 35 40 45 50 55 свіжої порції розчинника і зливом відпрацьованого розчину. Важливо відзначити, що при проведенні даної методики абсолютно відсутні втрати основної речовини. Бром-іон зберігається. Чистота отриманого продукту складає близько 97 %. Частка відновленої форми - не більше 1,0 %. 2. Гель-хроматографія в розчині етанолу. Даний спосіб очищення зручний як фінальна стадія перед дозованим розливом концентрованого розчину препарату, висушування і поставки на зберігання. Близько 3,7 г препарату розчиняють в 5-6 мл етанолу і хроматографують на колонці 600 × 10 мм з сефадексом LH-20, заздалегідь урівноваженій абсолютним етанолом для спектрофотометрії. Відкидають головні і хвостові фракції. Чистота основної фракції - не менше 98 %. Частка відновленої форми - 0,8-0,9 %. Концентрація препарату може досягати 150-200 міліграм/мл. З таким розчином зручно проводити дозований розлив і висушування готової субстанції. ЕП8. Синтез пластохінонілдецилтрифенілфосфонію (ПДТФ) броміду Синтез включає наступні стадії: 1. Окислення 2,3-диметилфенолу (1) в 2,3-диметил-1,4-бензохінон (2) реактивом Джонса; 2. Приєднання 11-бромундеканової кислоти (3) до трифенілфосфіну з утворенням броміду (10-карбоксидецил) трифенілфосфіну (4) 3. Утворення цільової сполуки (5) в результаті реакції отриманої сполуки (4) з 2,3-диметил1,4-бензохіноном (2) у присутності нітрату срібла і персульфату амонію. Схема синтезу приведена на Фігурі 2. Синтез 2,3-диметил-1,4-бензохінону (2) До розчину 20 г (0,16 моль) 2,3 диметилфенолу в 230 мл ефіру при перемішуванні додали реактив Джонса (розчин 110 г (0,37 моль) Na2CR2O7 × 2H2O в суміші 157 мл води і 70 мл конц. сірчаної кислоти) і перемішували суміш протягом 24 годин. Екстрагували суміш ефіром, об'єднані ефірні витяжки промивали, а потім сушили прожареним сульфатом магнію, і після видалення розчинника на роторному випарнику залишок піддавали флеш-хроматографії на силікагелі в хлороформі. Вихід сполуки 2 у вигляді жовтої кристалічної речовини 8,7 г (40 %). TСХ: Rf (CHCl3) = 0.46; HPLC: τ = 17.4 min (0-90 % B for 26.4 min; А: 10 mM H3PO4, B: AсCN), 1 m.p. 58 °C (56,5-57,5 °C) ; UV (CH3OH): λmax 209 nm, 256 nm, 344 nm; ESI MS: m/z обчислене для C8H8O2 136,15; знайдене 136,2. Синтез броміду (10-карбоксидецил) трифенілфосфіну (4) До 530 міліграмів (2 ммоль) 11-бромундеканової кислоти додали 588 міліграм (2,24 ммоль) трифенілфосфіну і витримували суміш в запаяній ампулі за температури 85 °C протягом 12 години Після цього суміш піддали розділенню на колонці з силікагелем в системі хлороформ метанол (9:1). Вихід сполуки 4 у вигляді прозорої олії 895 міліграмів (85 %). ТСХ: Rf 0,52 (хлороформ - метанол, 4:1); ВЕРХ: τ = 7,28 хв. (5 - 95 % В за 11.5 хв.; А: 0,1 % водна ТФО; В: 0,1 % ТФО в ацетонітрилі); УФ спектр (0,1 % ТФО - ацетонітрил, 38:62): λmax 200 + нм, 224 нм, 268 нм; ESI MS: обчислено для С29Н36ОР: 447.6; знайдене m/z 448.2 (МН ; 100 %). Синтез [10-(4,5-диметил-3,6-диоксоциклогекса-1,4-дієн-1-іл)децилу]-трифенілфосфоніум броміду, ПДТФ броміду (5) До розчину 135 міліграмів (1 ммоль) 2,526 міліграмів (1 ммоль) 4 і 85 міліграмів (0,5 ммоль) азотнокислого срібла в 40 мл суміші ацетонітрилу і води (1:1) за температури 80-90 °C додавали розчин 228 міліграм (1 ммоль) персульфату амонію в 5 мл води. Нагрівали з перемішуванням за тієї ж температури 12 годин. Суміш розбавляли водою і екстрагували дихлорметаном. Після випаровування дихлорметану до невеликого об'єму продукт осаджували діетиловим ефіром. Розчин з осаду декантували, осад переосаджували кілька разів. В кінці осад очищали на колонці силікагелю в суміші дихлорметан - етанол (у співвідношенні 9:1). Вихід [10(4,5-диметил-3,6-диоксоциклогекса-1,4-дієн-1-іл)децил]-трифенілфосфоніум броміду (ПДТФ броміду) 35 %. ТСХ: Rf (CHCl3 - CH3OH, 4:1) = 0.66; HPLC: τ = 10.1 min (5-95 % B for 12 min; А: 0.05 % ТФО, -1 -1 B: 0.05 % ТФО in ACCN); UV (CH3OH): max 198 nm, 226 nm, 260 nm (ε260=18652 cm *M ), 352 nm; ESI MS: m/z calcd. for C36H42O2P 537.69; found 537.3. ЕП9. Синтез мітохондріальних адресованих сполук - перспективних мітохондріально адресованих антиоксидантів. Структури берберинових і пальматинових похідних SKQ: 19 UA 107476 C2 5 Схема синтезу 9,10-диметокси-13-[7-(4,5-диметил-3,6-диоксоциклогекса-1,4-дієн-1іл)гептилоксикарбоніл-метил]-5,6-дигідробензо[g]-1,3-бензодиоксоло[5,6-a]хінолізиніум броміду, 1 (броміду 13-[7-(4,5-диметил-3,6-диоксоциклогекса-1,4-дієн-1-іл)гептилоксикарбонілметил]берберину) 20 UA 107476 C2 5 10 15 Сполуку 1 отримували, виходячи з берберину бісульфату (5), який відновлювали боргідридом натрію в піридині протягом 30 хв. за кімнатної температури і після кристалізації з води з виходом 91 % отримували сполуку 6. Сполуку 6 алкілювали метиловим ефіром бромоцтової кислоти (1 година, 100 °C) з подальшим відновленням проміжної сполуки боргідридом натрію (30 хв., кімнатна температура) з утворенням сполуки 7, яку виділяли екстракцією ефіром з водного розчину (вихід 80 %) і обмилювали 1 % водно-метанольним розчином гідроксиду літію при кип'ятінні протягом 1,5 години з утворенням сполуки 8. Вихід сполуки 8 склав після кристалізації з води 61 %. Сполуку 8 переводили в цезієву сіль, яку конденсували із заздалегідь синтезованим похідним 2,3-диметил-1,4-бензохінону 9 при 60 °C протягом 48 годин. Сполуку 10 окисляли N-бромсукцинімідом (NBS) в розчині хлористого метилену протягом 1 години, після видалення надлишку NBS шляхом промивання органічної фази водою і її висушування суміш випаровували і кінцеву речовину 1 осаджували ефіром. Очищення сполуки 1 здійснювали за допомогою ВЕРХ (С 18) в градієнті ацетонітрилу, який містить 0,05 % ТФО, в 0.05 % водною ТФО від 30 до 80 %. Загальний вихід після двох останніх стадій склав 50 %. Аналогічним чином отримували сполуку 2 - 4. 21 UA 107476 C2 5 10 15 Характеристики отриманих сполук. 13-[7-(4,5-диметил-3,6-диоксоциклогекса-1,4-дієн-1-іл) гептилоксикарбоніл-метил]берберину: ТСХ: Rf (хлороформ - метанол, 65:10) = 0,16; Rf (хлороформ - метанол, 4:1) = 0,39. ВЕРХ: τ = 8,98 хв. (5-95 % B за 11 хв.; А: 0,05 % ТФО, B: 0,05 % ТФО в МеCN; Luna C18(2)' 0,46 × 15 см, -1 -1 -1 5мкм, 1 мл/хв.). УФ (етанол): max 262 нм, 350 нм (ε350=23850 cm *M ), 430 нм (ε430=5278 cm *M 1 ). ESI MS: m/z розраховане для C37H40NO8 626,72; знайдене 626,69. 13-[7-(4,5-диметил-3,6-диоксоциклогекса-1,4-дієн-1-іл) гептилоксикарбоніл-метил]пальматин: ТСХ: Rf (хлороформ - метанол, 65:10) = 0,16; Rf (хлороформ - метанол, 4:1) = 0,39. УФ (етанол): max 262 нм, 350 нм, 430 нм. ESI MS: m/z розраховане для C38H44NO8 642,76; знайдене 642,29. 13-[4-(4,5-диметил-3,6-диоксоциклогекса-1,4-дієн-1-іл) бутилоксикарбоніл-метил]берберину: ТСХ: Rf (хлороформ - метанол, 65:10) = 0,23; Rf (хлороформ - метанол, 4:1) = 0,39. ВЕРХ: ф = 7,71 хв. (5-95 % B за 11 хв.; А: 0,05 % ТФО, B: 0,05 % ТФО в МеCN; Luna C18(2)' 0,46 × 15 см, 5мкм, 1 мл/хв.). УФ (етанол): max 262 нм, 350 нм, 430 нм. ESI MS: m/z розраховане для C34H34NO8 584,64; знайдене 584,22. 13-[4-(4,5-диметил-3,6-диоксоциклогекса-1,4-дієн-1-іл) бутилоксикарбоніл-метил]пальматин: ТСХ: Rf (хлороформ - метанол, 65:10) = 0,23; Rf (хлороформ - метанол, 4:1) = 0,39. ВЕРХ: ф = 7,73 хв. (5-95 % B за 11 хв.; А: 0,05 % ТФО, B: 0,05 % ТФО в МеCN; Luna C18(2)' 0,46 × 15 см, 5мкм, 1 мл/хв.). УФ (етанол): max 262 нм, 350 нм, 430 нм. ESI MS: m/z розраховане для C35H38NO8 600,68; знайдене 600,87. 20 ФОРМУЛА ВИНАХОДУ 1. Мітохондріально адресований антиоксидант із заданим антиоксидантних властивостей і описані загальною формулою (І) A 25 L співвідношенням про і B n ,(І) де "А" є ефекторною групою; "L" - лінкерною групою, n - цілим числом 1-20; "В" - адресною групою, яка забезпечує адресну доставку всієї сполуки в мітохондрії, і де "А" є антиоксидантом загальної формули (II) O Y m * * O 30 35 40 45 (II) і/або його відновленою формою, де m - ціле число 1-3; Y - метил; "L" - лінкерна ланка, яка представлена: а) або простим, або розгалуженим вуглеводневим ланцюгом, який, за необхідності, містить один або більше подвійних або потрійних зв'язків, або ефірний, або складноефірний, або C-S, або SS, або пептидний зв'язок; і за необхідності заміщений одним або більше замісниками, які переважно є алкілом, алкокси, галогеном, кетогрупою, аміногрупою; б) або природним ізопреноїдним ланцюгом; "В" - представлений: а) або іоном Скулачова Sk: + Sk Z , де Sk - є ліпофільним катіоном; Z - фармацевтично прийнятним аніоном; б) або амфіфільним цвітер-іоном, здатним проникати всередину мітохондрій в своїй катіонній формі, + при цьому Sk у складі "В" може бути ліпофільною металоорганічною сполукою, а саме ліпофільним металпорфірином, який переважно має структуру: 22 UA 107476 C2 R1 N R4 N Me + N R2 N R3 5 10 , включену до складу сполуки формули (І) через ділянки, позначені R1, R2, R3 або R4, а решта замісників R1, R2, R3 або R4 можуть бути підібрані відповідно до вимог, які пред'являються до властивостей всієї сполуки, а саме, щоб збільшити або зменшити гідрофобність всієї молекули; + Ме означає іон металу, переважно Mn, Fe, Co, Cu, Mg або Zn, включаючи SkQB1, SkQB1A, SkQB1B, SkQBP1, SkQB5, SkQBP5, а також їх фармацевтично прийнятні солі. 2. Мітохондріально адресований антиоксидант за п. 1, представлений SkQB1, SkQB1A, SkQB1B, SkQBP1, SkQB5, SkQBP5. 3. Спосіб отримання мітохондріально адресованого антиоксиданту загальної формули (І) в формі фармацевтичної субстанції лікарського препарату: A 15 L B n ,(І) де "А" - ефекторна група; "L" - лінкерна група, n - ціле число 1-20; "В" - адресна група, яка забезпечує адресну доставку всієї сполуки в мітохондрії; і де "А" може бути антиоксидантом загальної формули (II) O Y m * * 20 25 30 35 O (II) і/або його відновленою формою, де m - ціле число 1-3; Y - метил; "L" - лінкерна ланка, представлена: а) або простим, або розгалуженим вуглеводневим ланцюгом, який, за необхідності, містить один або більше подвійних або потрійних зв'язків, або ефірний, або складноефірний, або C-S, або SS, або пептидний зв'язок; і за необхідності заміщений одним або більше замісником, який переважно є алкілом, алкокси, галогеном, кетогрупою, аміногрупою; б) або природним ізопреноїдним ланцюгом; "В" - представлений: + адресуючою групою виду Sk Z , де Sk - є ліпофільним катіоном; Z - фармацевтично прийнятним аніоном; який передбачає щонайменше одну з-поміж наступних стадій: а) очищення за допомогою градієнтної обернено-фазової хроматографії в безсольовій безбуферній системі рухомої фази; б) очищення за допомогою гель-фільтраційної хроматографії в етанолі; в) очищення від окисленої форми мітохондріально адресованого антиоксиданту; г) очищення від відновленої форми мітохондріально адресованого антиоксиданту, переважно з використанням "молекулярної пастки" відновленої форми мітохондріально адресованого антиоксиданту вищенаведеної загальної формули, де під молекулярною пасткою розуміють сполуку з кето- або хіноноподібним угрупуванням, яке має окислювально-індукційний потенціал, переважно, не менше 0,2 В за нейтральних значень рН і, переважно, є добре розчинним в інертному розчиннику, переважно в гептані або гексані. 23 UA 107476 C2 4. Фармацевтична субстанція на основі мітохондріально адресованого антиоксиданту загальної формули (І) A 5 L B n ,(І) де "А" - ефекторна група; "L" - лінкерна група, n - ціле число 1-20; "В" - адресна група, яка забезпечує адресну доставку всієї сполуки в мітохондрії; і де "А" є антиоксидантом загальної формули (II) O Y m * * O 10 15 20 25 30 (II) і/або його відновленою формою, де m - ціле число 1-3; Y - метил; "L" - лінкерна ланка, яка представлена: а) або простим, або розгалуженим вуглеводневим ланцюгом, який, за необхідності, містить один або більше подвійних або потрійних зв'язків, або ефірний, або складноефірний, або C-S, або SS, або пептидний зв'язок; і за необхідності заміщений одним або більше замісником, який переважно є алкілом, алкокси, галогеном, кетогрупою, аміногрупою; б) або природним ізопреноїдним ланцюгом; + "В" - представлений адресуючою групою виду Sk Z , де Sk - є ліпофільним катіоном; Z фармацевтично прийнятним аніоном; у якій співвідношення окисленої і відновленої форм знаходиться в діапазоні від 0,2 % до 99,8 % окисленої форми і в якій співвідношення окисленої і відновленої форм мітохондріально адресованого антиоксиданту зберігається протягом всього терміну придатності при дотриманні встановлених умов зберігання. 5. Фармацевтична субстанція за п. 4, яка відрізняється тим, що в ній співвідношення окисленої і відновленої форм, переважно, знаходиться в діапазоні від 50 % до 99,5 % окисленої форми. 6. Фармацевтична субстанція за п. 5, яка відрізняється тим, що в ній співвідношення окисленої і відновленої форм, переважно, знаходиться в діапазоні від 97,5 % до 99,5 % окисленої форми. 7. Фармацевтична субстанція за будь-яким з пп. 4-6, яка відрізняється тим, що в ній співвідношення окисленої і відновленої форм мітохондріально адресованого антиоксиданту зберігається протягом не менше 1 міс. 8. Фармацевтична субстанція за будь-яким з пп. 4-6, яка відрізняється тим, що в ній співвідношення окисленої і відновленої форм мітохондріально адресованого антиоксиданту зберігається протягом не менше 6 міс. 9. Фармацевтична субстанція за будь-яким з пп. 4-6, яка відрізняється тим, що в ній співвідношення окисленої і відновленої форм мітохондріально адресованого антиоксиданту зберігається протягом не менше 2-х років. 24 UA 107476 C2 25 UA 107476 C2 26 UA 107476 C2 27 UA 107476 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюФармацевтические субстанцыы на основе митохондриально-адресованных антиоксидантов
Автори англійськоюSkulachev, Maxim Vladimirovich, Skulachev, Vladimir Petrovich, Zamyatin, Andrei Alexandrovich, Efremov, Evgeny Stepanovich, Tashlitsky, Vadim Neronovich, Yaguzhinsky, Lev Sergeevich, Korshunova, Galina Anatolievna, Sumbatyan, Natalya Vladimirovna, Antonenko, Yury Nikolaevich, Severina, Inna Isaakovna, Chernyak, Boris Viktorovich
Автори російськоюСкулачев Максим Владимирович, Скулачев Владимир Петрович, Замятин Андрей Александрович, Ефремов Евгений Степанович, Ташлицкий Вадим Неронович, Ягужинский Лев Сергеевич, Коршунова Галина Анатольевна, Сумбатян Наталья Владимировна, Антоненко Юрий Николаевич, Северина Инна Исааковна, Черняк Борис Викторович
МПК / Мітки
МПК: A61K 31/14, A61K 31/66, A61K 31/473, A61K 31/122, A61P 39/06, A61K 31/4738
Мітки: адресованих, субстанція, антиоксидантів, фармацевтична, основі, мітохондріальної
Код посилання
<a href="https://ua.patents.su/36-107476-farmacevtichna-substanciya-na-osnovi-mitokhondrialno-adresovanikh-antioksidantiv.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична субстанція на основі мітохондріально адресованих антиоксидантів</a>
Попередній патент: Розбірна модульна платформа для установки по збору відходів
Наступний патент: Установка та спосіб теплового знешкоджування та утилізації тепла димових газів, які відходять від паливоспалювальних агрегатів, та система керування їх роботою
Випадковий патент: Робочий орган культиватора