Кристалічна форма сукцинату
Номер патенту: 114904
Опубліковано: 28.08.2017
Автори: Туфіллі Нікола, Лінденберг Крістіан, Перлберг Анетт, Хоушем Кетрин
Формула / Реферат
1. Кристалічна форма сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти формули
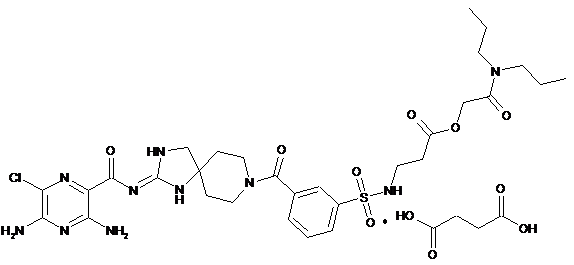 ,
,
що включає форму С, яка характеризується порошковою рентгенограмою, що включає значення кута 2-тета, вибрані з групи, що включає 7,0°±0,2, 10,6°±0,2, 14,3°±0,2, 18,2°±0,2, 18,6°±0,2, 19,2°±0,2, 21,2°±0,2, 21,8°±0,2, 24,7°±0,2, 29,0°±0,2 і 31,5°±0,2, при температурі, рівній 21-26 °C.
2. Кристалічна форма сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти формули
 ,
,
що включає форму С, яка характеризується порошковою рентгенограмою, як представлено на фіг. 7.
3. Кристалічна форма сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти формули
 ,
,
що включає форму С, яка характеризується термограмою диференціальної скануючої калориметрії, як представлено на фіг. 8.
4. Фармацевтична композиція, що містить кристалічну форму за будь-яким з пп. 1-3 і фармацевтично прийнятний носій або розріджувач.
5. Фармацевтична композиція за п. 4 у комбінації з одним або більше додатковими активними інгредієнтами.
6. Фармацевтична композиція за п. 4 або 5, яка знаходиться в придатній для вдихання формі.
7. Кристалічна форма за будь-яким з пп. 1-3 для застосування у лікуванні респіраторних захворювань, таких як муковісцидоз, первинна циліарна дискінезія, хронічний бронхіт, хронічне обструктивне захворювання легенів (ХОЗЛ), астма, інфекції дихальних шляхів (гострі та хронічні; вірусні та бактеріальні) і карцинома легенів.
8. Застосування кристалічної форми за будь-яким з пп. 1-3 для приготування лікарського засобу, призначеного для лікування респіраторних захворювань, таких як муковісцидоз, первинна циліарна дискінезія, хронічний бронхіт, хронічне обструктивне захворювання легенів (ХОЗЛ), астма, інфекції дихальних шляхів (гострі та хронічні; вірусні та бактеріальні) і карцинома легенів.
9. Спосіб лікування респіраторних захворювань, таких як муковісцидоз, первинна циліарна дискінезія, хронічний бронхіт, хронічне обструктивне захворювання легенів (ХОЗЛ), астма, інфекції дихальних шляхів (гострі та хронічні; вірусні та бактеріальні) і карцинома легенів, що включає введення пацієнту, що цього потребує, ефективної кількості кристалічної форми за будь-яким з пп. 1-3.
10. Пристрій для інгаляції, який містить кристалічну форму за будь-яким з пп. 1-3 і пристосований для її доставки шляхом введення у легені.
Текст
Реферат: Цей винахід стосується нової кристалічної форми сукцинату блокатора епітеліальних натрієвих каналів (ENaC), дипропілкарбамоїлметилового ефіру 3-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти, фармацевтичних композицій, що містять зазначену кристалічну форму, застосування зазначеної кристалічної форми і фармацевтичних композицій і способів одержання зазначеної кристалічної форми. UA 114904 C2 (12) UA 114904 C2 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої відноситься винахід Цей винахід відноситься до нової кристалічної форми сукцинату блокатора епітеліальних натрієвих каналів (ENaC), дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти, до фармацевтичних композицій, що містять зазначену кристалічну форму, до застосування зазначеної кристалічної форми і фармацевтичних композицій і до способів одержання зазначеної кристалічної форми. Рівень техніки У публікації заявки на міжнародний патент WO 2012/035158 (PCT/EP2011/066151) розкриті способи одержання блокатора ENaC, дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5диаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)-пропіонової кислоти і його сукцинату. Захворювання, опосередковувані блокуванням епітеліальних натрієвих каналів, включають захворювання, пов'язані з регулюванням об'ємів рідин, що проходять крізь епітеліальні мембрани. Наприклад, об'єм рідини на поверхні дихальних шляхів є ключовим регулятором мукоциліарного кліренсу і підтримки легенів у здоровому стані. Блокування епітеліальних натрієвих каналів буде стимулювати нагромадження рідини з боку слизової оболонки епітелію дихальних шляхів і тим самим стимулювати видалення слизу і попереджати нагромадження слизу та мокротиння на тканинах дихальних шляхів (включаючи легеневі дихальні шляхи). Такі захворювання включають респіраторні захворювання, такі як муковісцидоз, первинна циліарна дискінезія, хронічний бронхіт, хронічне обструктивне захворювання легенів (ХОЗЛ), астма, інфекції дихальних шляхів (гострі і хронічні; вірусні і бактеріальні) і карцинома легенів. Захворювання, опосередковувані блокуванням епітеліальних натрієвих каналів, також включають захворювання, що не є респіраторними, які пов'язані з аномальною регуляцією рідини, що проходить крізь епітелій, можливо, що включають аномальну фізіологію рідин, що перебувають на поверхні і захищаючих поверхню, наприклад, ксеростомію (сухість у роті) або сухий кератокон'юнктивіт (сухий кератит). Крім того, блокування епітеліальних натрієвих каналів у нирках можна використовувати для стимулювання діурезу і тим самим прояву гіпотензивного ефекту. Опис креслень На фіг. 1 наведена порошкова рентгенограма, отримана для форми A (приклад 3) і знята на дифрактометрі Bruker™ D8 з використанням випромінювання CuKα (λ=1,5418 Å). На фіг. 2 наведена отримана за допомогою диференціальної скануючої калориметрії (ДСК) термограма форми A (приклад 3) і її реєстрували за допомогою приладу Perkin Elmer Diamond DSC з алюмінієвим тиглем (Perkin Elmer, type BO14-3018); швидкість нагрівання 20 K/хв, діапазон температури: від 30 до 250C. На фіг. 3 наведений інфрачервоний спектр форми A (приклад 3) і його реєстрували за допомогою приладу Bruker Alpha у режимі порушеного повного відбиття (ППВ). При вимірюванні -1 -1 використовували наступні параметри: діапазон 400-4000 см , роздільна здатність 2 см , 64 сканування, швидкість 7,5 кГц, аподизація: за Блекманом-Харрісом, 3-членна. На фіг. 4 наведена порошкова рентгенограма, отримана для форми A (приклад 1, 2) і знята на дифрактометрі Bruker™ D8 з використанням випромінювання CuKα (λ=1,5418 Å). На фіг. 5 наведена отримана за допомогою диференціальної скануючої калориметрії (ДСК) термограма форми A (приклад 1, 2) і її реєстрували за допомогою приладу Perkin Elmer Diamond DSC з алюмінієвим тиглем (Perkin Elmer, type BO14-3018); швидкість нагрівання 20 K/хв, діапазон температури: від 30 до 250C. На фіг. 6 наведена порошкова рентгенограма, отримана для форми B (приклад 4, 5, 6, 7) і знята на дифрактометрі Bruker™ D8 з використанням випромінювання CuKα (λ=1,5418 Å). На фіг. 7 наведена порошкова рентгенограма, отримана для форми C (приклад 10) і знята на дифрактометрі Bruker™ D8 з використанням випромінювання CuKα (λ=1,5418 Å). На фіг. 8 наведена отримана за допомогою диференціальної скануючої калориметрії (ДСК) термограма форми C (приклад 10) і її реєстрували за допомогою приладу Perkin Elmer Diamond DSC з алюмінієвим тиглем (Perkin Elmer, type BO14-3018); швидкість нагрівання 20 K/хв, діапазон температури: від 30 до 250C. На фіг. 9 наведений інфрачервоний спектр форми C (приклад 10) і його реєстрували за допомогою приладу Bruker Alpha у режимі порушеного повного відбиття (ППВ). При вимірюванні -1 -1 використовували наступні параметри: діапазон 400-4000 см , роздільна здатність 2 см , 64 сканування, швидкість 7,5 кГц, аподизація: за Блекманом-Харрісом, 3-членна. На фіг. 10 наведена порошкова рентгенограма, отримана для форми C (приклад 8, 9) і знята на дифрактометрі Bruker™ D8 з використанням випромінювання CuKα (λ=1,5418 Å). 1 UA 114904 C2 5 10 15 20 25 30 35 40 На фіг. 11 наведена отримана за допомогою ДСК термограма форми C (приклад 8, 9) і її реєстрували за допомогою приладу Perkin Elmer Diamond DSC з алюмінієвим тиглем (Perkin Elmer, type BO14-3018); швидкість нагрівання 20 K/хв, діапазон температури: від 30 до 250C. Опис варіантів здійснення Розкрито три поліморфні форми (форми A, B і C) сукцинату блокатора ENaC, дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (дипропілкарбамоїлметиловий ефір 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти:бурштинова кислота=1:1). Способи одержання форми A і B описані в публікації заявки на міжнародний патент WO 2012/035158 (PCT/EP2011/066151). Отже, першим об'єктом цього винаходу є кристалічна форма сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти формули що представляє собою форму C. В одному варіанті здійснення першого об'єкта кристалічна форма по суті (в основному) складається з форми C. В іншому варіанті здійснення першого об'єкта кристалічна форма включає форму C, де зазначена форма C перебуває по суті (в основному) у чистому вигляді. В іншому варіанті здійснення першого об'єкта кристалічна форма характеризується порошковою рентгенограмою, що містить 4 або більше значень кута 2-тета, обраних із групи, що включає 7,00,2, 10,60,2, 14,30,2, 18,20,2, 18,60,2, 19,20,2, 21,20,2, 21,80,2, 24,70,2, 29,00,2 і 31,50,2, при температурі, рівній 21-26 °C. В іншому варіанті здійснення першого об'єкта кристалічна форма характеризується порошковою рентгенограмою, що містить 6 або більше значень кута 2-тета, обраних із групи, що включає 7,00,2, 10,60,2, 14,30,2,18,20,2, 18,60,2, 19,20,2, 21,20,2, 21,80,2, 24,70,2, 29,00,2 і 31,50,2, при температурі, рівній 21-26 °C. В іншому варіанті здійснення першого об'єкта кристалічна форма має порошкову рентгенограму, яка є в основному такою самою, як порошкова рентгенограма, наведена на фіг. 7. В іншому варіанті здійснення першого об'єкта кристалічна форма має отриману за допомогою диференціальної скануючої калориметрії термограмою, яка є в основному такою самою, як наведена на фіг. 8. При використанні в цьому винаході термін "по суті" і "в основному чиста" стосовно до конкретної поліморфної форми означає, що поліморфна форма містить менше 10 %, краще менше 5 %, ще краще менше 3 %, найкраще менше 1 мас. % будь-яких інших фізичних форм (поліморфних форм) сполуки. При використанні в цьому винаході "поліморфна форма" означає кристалічні форми, що мають однаковий хімічний склад, але різні розташування в просторі молекул, атомів і/або іонів, що утворюють кристал. 2 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 55 60 У цьому описі і у наведеній нижче формулі винаходу, якщо з контексту не випливає інше, термін "включає" і його варіанти, такі як « що включає" або "включаючи", слід розуміти як такий, що означає включення зазначеного цілого числа або стадії, або групи цілих чисел або стадій, але не виключення будь-якого іншого цілого числа або стадії, або групи цілих чисел або стадій. При використанні в цьому винаході термін "кристалічна форма, запропонована в цьому винаході" означає кристалічну форму, визначену в першому об'єкті або в будь-якому варіанті здійснення першого об'єкта. Другим об'єктом є фармацевтична композиція, що містить кристалічну форму, відповідну до першого об'єкта або будь-якого варіанту здійснення першого об'єкта, і фармацевтично прийнятний носій або розріджувач. В одному варіанті здійснення другого об'єкта форма C перебуває по суті (в основному) у чистому вигляді. В іншому варіанті здійснення другого об'єкта фармацевтична композиція перебуває в придатній для вдихання формі. Третім об'єктом є фармацевтична композиція, відповідна до другого об'єкта або варіанта здійснення другого об'єкта, у комбінації з одним або більшою кількістю додаткових активних інгредієнтів. Четвертим об'єктом є кристалічна форма, відповідна до першого об'єкта або будь-якого варіанта здійснення першого об'єкта, і фармацевтична композиція, відповідна до другого об'єкта або будь-якого варіанта здійснення другого об'єкта, призначена для застосування для лікування респіраторних захворювань, таких як муковісцидоз, первинна циліарна дискінезія, хронічний бронхіт, хронічне обструктивне захворювання легенів (ХОЗЛ), астма, інфекції дихальних шляхів (гострі та хронічні; вірусні та бактеріальні) і карцинома легенів. П'ятим об'єктом є застосування кристалічної форми, відповідної до першого об'єкта або будь-якого варіанта здійснення першого об'єкта, або композиції, відповідної до другого об'єкта або будь-якого варіанта здійснення другого об'єкта, для приготування лікарського засобу, призначеного для лікування респіраторних захворювань, таких як муковісцидоз, первинна циліарна дискінезія, хронічний бронхіт, хронічне обструктивне захворювання легенів (ХОЗЛ), астма, інфекції дихальних шляхів (гострі та хронічні; вірусні та бактеріальні) і карцинома легенів. Шостим об'єктом є спосіб лікування респіраторних захворювань, таких як муковісцидоз, первинна циліарна дискінезія, хронічний бронхіт, хронічне обструктивне захворювання легенів (ХОЗЛ), астма, інфекції дихальних шляхів (гострі та хронічні; вірусні та бактеріальні) і карцинома легенів, що включає введення пацієнту, що цього потребує, ефективної кількості кристалічної форми, відповідної до першого об'єкта або будь-якого варіанта здійснення першого об'єкта або фармацевтичної композиції, відповідної до другого об'єкта або будь-якого варіанта здійснення другого об'єкта. Сьомим об'єктом є прилад для інгаляції, який містить кристалічну форму, відповідну до першого об'єкта або будь-якого варіанта здійснення першого об'єкта, і пристосований для її доставки шляхом введення в легені. У деяких кращих варіантах здійснення приладом для інгаляції є прилад для інгаляції сухого порошку, наприклад, прилад для інгаляції BREEZHALER®. Показано, що нова поліморфна форма C сукцинату дипропілкарбамоїлметилового ефіру 3(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)-пропіонової кислоти термодинамічно стабільніше, ніж форма A. Форма B являє собою групу ізоморфних сольватів, які утворюються у вигляді нестабільної кристалічної форми в суспензії під час кристалізації форми A. Форма B перетворюється у форму A при сушінні. Засоби, запропоновані в цьому винаході, можна вводити будь-яким прийнятним шляхом, наприклад, перорально, наприклад, у вигляді таблетки або капсули; парентерально, наприклад, внутрішньовенно; місцево на шкіру; назально, наприклад, для лікування алергійного риніту; або, краще, шляхом інгаляції, особливо для лікування обструктивного або запального захворювання дихальних шляхів. Зокрема, засоби, запропоновані в цьому винаході, можна доставляти у вигляді складу, придатного для вдихання, для лікування ХОЗЛ, муковісцидозу або астми. Фармацевтичну композицію можна приготувати для конкретних шляхів введення, таких як пероральне введення, парентеральне введення і ректальне введення і т.п. Крім того, фармацевтичні композиції, запропоновані в цьому винаході, можна приготувати у твердій формі (включаючи без накладення обмежень капсули, таблетки, пігулки, гранули, порошки або супозиторії) або в рідкій формі (включаючи без накладення обмежень розчини, суспензії або емульсії). Фармацевтичні композиції можна піддати звичайній фармацевтичній обробці, такій як 3 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 55 60 стерилізація, і/або вони можуть містити звичайні інертні розріджувачі, мастильні агенти або буферні агенти, а також допоміжні речовини, такі як консерванти, стабілізатори, змочувальні агенти, емульгатори і буферні агенти і т.п. Звичайно фармацевтичні композиції являють собою таблетки або желатинові капсули, що включають активний інгредієнт разом з: a) розріджувачами, наприклад, лактозою, декстрозою, сахарозою, манітом, сорбітом, целюлозою і/або гліцином; b) змащувальними речовинами, наприклад, діоксидом кремнію, тальком, стеариновою кислотою, її магнієвою або кальцієвою сіллю і/або поліетиленгліколем; для таблеток також з c) сполучними, наприклад, алюмосилікатом магнію, крохмальною пастою, желатином, трагакантовою камеддю, метилцелюлозою, натрієвою сіллю карбоксиметилцелюлози і/або полівінілпіролідоном; при необхідності з d) розпушувачами, наприклад, крохмалями, агаром, альгіовою кислотою або її натрієвою сіллю або шипучими сумішами; і/або e) абсорбентами, барвниками, смаковими добавками і пісолоджувачами. На таблетки за методиками, відомими у даній галузі техніки, можна нанести плівкове покриття або ентеросолюбільне покриття. Композиції, прийнятні для перорального введення, включають ефективну кількість кристалічної форми, запропонованої в цьому винаході, у вигляді таблеток, коржиків, водних або олійних суспензій, порошків або гранул, що диспергуються, емульсій, твердих або м'яких капсул або сиропів, або еліксирів. Композиції, призначені для перорального застосування, одержують за будь-якою методикою, відомою в даній галузі техніки для приготування фармацевтичних композицій, і такі композиції можуть містити один або більше агентів, обраних із групи, що включає підсолоджувачі, смакові агенти, офарблюючі агенти і консерванти, щоб одержати фармацевтично привабливі і такі, що мають приємний смак препарат. Таблетки можуть містити активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними інертними наповнювачами, які є прийнятними для виготовлення таблеток. Цими інертними наповнювачами є, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулюючі і розпушуючі агенти, наприклад, кукурудзяний крохмаль або альгінова кислота; зв'язувальні агенти, наприклад, крохмаль, желатин або камедь акації; і мастильні агенти, наприклад, стеарат магнію, стеаринова кислота або тальк. Таблетки не містять покриття або на них за відомими методиками наносять покриття для затримки розпаду і усмоктування в шлунково-кишковому тракті, що забезпечує безперервний вплив протягом більш тривалого періоду часу. Наприклад, можна використовувати таку сповільнювану речовину, як гліцерилмоностеарат або гліцерилдистеарат. Препарати для перорального застосування також можуть являти собою капсули з твердого желатину, у яких активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або капсули з м'якого желатину, у яких активний інгредієнт змішаний з водою або олійним середовищем, наприклад, арахісовою олією, рідким парафіном або маслиновою олією. Деякі композиції для ін'єкцій являють собою ізотонічні водні розчини або суспензії, а супозиторії краще готують із емульсій або суспензій жирів. Зазначені композиції можна стерилізувати і/або додавати до них допоміжні речовини, такі як консервуючі, змочувальні або емульгуючі агенти, стимулятори розчинення, солі для регулювання осмотичного тиску і/або буферні агенти. Крім того, вони також можуть містити інші терапевтично цінні речовини. Зазначені композиції одержують за звичайними технологіями змішування, гранулювання або нанесення покриттів і вони містять приблизно 0,1-75 % або містять приблизно 1-50 % активного інгредієнта. Композиції, прийнятні для крізьшкірного введення, включають ефективну кількість кристалічної форми, запропонованої в цьому винаході, разом з прийнятним носієм. Носії, прийнятні для крізьшкірного введення, включають фармакологічно прийнятні розчинники, що усмоктуються, які сприяють проникненню крізь шкіру реципієнта. Наприклад, прилади для крізьшкірного введення являють собою пов'язку, що включає захисний шар, резервуар, що містить сполуку, необов'язково з носіями, необов'язково бар'єр, що регулює доставку сполуки крізь шкіру реципієнта із заданою швидкістю протягом пролонгованого періоду часу, і засобу закріплення приладу на шкірі. Композиції, прийнятні для місцевого введення, наприклад, на шкіру або в очі, включають водні розчини, суспензії, мазі, креми, гелі або, розпорошні композиції, наприклад, для подачі у вигляді аерозолю і т.п. Такі прилади місцевої дії є особливо прийнятними для впливу на шкіру, наприклад, для лікування раку шкіри, наприклад, для використання як профілактичні засоби у сонцезахисних кремах, лосьйонах, аерозольних препаратах і т.п. Тому вони є особливо 4 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 55 60 прийнятними для використання в засобах місцевої дії, включаючи косметичні, добре відомих у даній галузі техніки. Вони можуть містити солюбілізатори, стабілізатори, агенти, що регулюють тонічність, буферні агенти і консерванти. При використанні в цьому винаході місцеве введення також може являти собою інгаляційне або назальне введення. Звичайне введення проводять у вигляді сухого порошку (окремо або у вигляді суміші, наприклад, сухої суміші з лактозою, у вигляді сумішей з компонентами, наприклад, з фосфоліпідами) за допомогою інгалятора для сухих порошків або у вигляді аерозольного спрею, що подається з контейнера, що перебуває під тиском, за допомогою насоса розпорошувального пристрою, атомізатора або приладу типу небулайзер з використанням або без використання прийнятного пропеленту. Якщо форма активного інгредієнта для інгаляції являє собою аерозольну композицію, то прилад для інгаляції може являти собою аерозольний балончик, обладнаний клапаном, здатним подавати відміряну дозу композиції, таку як від 10 до 100 мкл, наприклад, від 25 до 50 мкл, тобто прилад, відомий, як дозуючий інгалятор. Такі аерозольні балончики і методики їх заповнення аерозольними композиціями, що перебувають під тиском, добре відомі фахівцям в галузі інгаляційної терапії. Наприклад, аерозольну композицію можна вводити з балончика з внутрішнім покриттям, наприклад, такого, як описаний в EP-A-0642992. Якщо форма активного інгредієнта для інгаляції являє собою распыляемую за допомогою пристрою типу небулайзер водну, органічну або водно/органічну дисперсію, то прилад для інгаляції може являти собою відомий розпорошувальний пристрій, типу небулайзер, наприклад, звичайний пневматичний пристрій типу небулайзер, такий як повітроструминний пристрій типу небулайзер або ультразвуковий пристрій типу небулайзер, який може містити, наприклад, від 1 до 50 мл, звичайно від 1 до 10 мл дисперсії; або ручний пристрій типу небулайзер, що іноді називається туманоутворюючим або м'яко розпорошуючим інгалятором, наприклад, пристрій з електронним керуванням, такий як AERx (Aradigm, US) або Aerodose (Aerogen), або механічний пристрій, такий як пристрій типу небулайзер RESPIMAT (Boehringer Ingelheiм), який дозволяє розпорошувати набагато менші об'єми, наприклад, від 10 до 100 мкл, ніж звичайні пристрої типу небулайзер. Якщо форма активного інгредієнта для інгаляції являє собою тонкоподрібнену речовину, то пристрій для інгаляції може являти собою, наприклад, пристрій для інгаляції сухого порошку, здатний подавати сухий порошок з капсули або блістерної упаковки, що містить сухий порошок, що включає дозовану форму сполук (A) і/або (B), або містить кілька доз пристрій для інгаляції сухого порошку (НДІП), здатний за один прийом подавати, наприклад, 3-25 мг сухого порошку, що включає дозовану форму сполук (A) і/або (B). Суха порошкоподібна композиція краще містить розріджувач або носій, такий як лактоза, і сполуку, яка сприяє захисту від погіршення характеристик препарату внаслідок впливу вологи, наприклад, стеарат магнію. Такі прийнятні пристрої для інгаляції сухого порошку включають пристрої, розкриті в US 3991761 (включаючи пристрій AEROLIZER™), WO 05/113042 (включаючи пристрій BREEZHALER™), WO 97/20589 (включаючи пристрій CERTIHALER™), WO 97/30743 (включаючи пристрій TWISTHALER™), WO 05/37353 (включаючи пристрій GYROHALER™), US6536427 (включаючи , ), пристрій DISKUS™) WO 97/25086 (включаючи пристрій DISKHALER™ WO 95/14089 , (включаючи пристрій GEMINI™) WO 03/77979 (включаючи пристрій PROHALER™) і також пристрої, розкриті в WO 08/51621, WO 09/117112 і US 2005/0183724. Цей винахід також відноситься до (A) кристалічної форми, запропонованої в цьому винаході, у придатній для вдихання формі; (B) призначеному для вдихання лікарському засобу, що включає таку кристалічну форму, запропоновану в цьому винаході, у придатній для вдихання формі разом з фармацевтично прийнятним носієм у придатній для вдихання формі; (C) фармацевтичному препарату, що включає таку кристалічну форму, запропоновану в цьому винаході, у придатній для вдихання формі разом з пристроєм для інгаляції; і (D) пристрою для інгаляції, що містить таку кристалічну форму, запропоновану в цьому винаході, у придатній для вдихання формі. Дозування засобів, запропонованих у цьому винаході, що використовуються при практичному застосуванні цього винаходу, зрозуміло, будуть мінятися в залежності, наприклад, від конкретного патологічного стану, що піддається лікуванню, необхідного ефекту і шляху введення. Звичайно добові дози, прийнятні для введення шляхом інгаляції, становлять приблизно від 0,0001 до 30 мг/кг, звичайно від 0,01 до 10 мг для одного пацієнта, а для перорального введення прийнятні добові дози звичайно становлять приблизно від 0,01 до 100 мг/кг. Цей винахід також відноситься до безводних фармацевтичних композицій і дозованих форм, що містять кристалічну форму, запропоновану в цьому винаході, як активний інгредієнт, оскільки вода може полегшувати розкладання деяких сполук. 5 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 55 60 Безводні фармацевтичні композиції і дозовані форми, запропоновані в цьому винаході, можна одержати з використанням безводних інгредієнтів або інгредієнтів, що мають низьку вологість, в умовах низької вологості. Безводну фармацевтичну композицію можна приготувати і зберігати так, щоб вона залишалася безводною. Відповідно до цього безводні композиції краще упаковувати в матеріали, для яких відомо, що вони захищають від впливу води, так щоб їх було можна включити в прийнятні набори препаратів. Приклади прийнятних пакувальних засобів включають, але не обмежуються тільки ними фольгу, що герметично запаюється, пластмаси, контейнери для разових доз (наприклад, флакони), блістерні упаковки і стрічкові упаковки. Цей винахід також відноситься до фармацевтичних композицій і дозованих форм, які включають один або більшу кількість агентів, які зменшують швидкість, з якою буде розкладатися сполука, запропонована в цьому винаході як активний інгредієнт. Такі агенти, які в цьому винаході називають "стабілізаторами", включають, але не обмежуються тільки ними, антиоксиданти, такі як аскорбінова кислота, буферні агенти, що регулюють pH, або сольові буферні агенти і т.п. Кристалічну форму, запропоновану в цьому винаході, можна вводити одночасно або до, або після одного або більшої кількості інших терапевтичних засобів. Кристалічну форму, запропоновану в цьому винаході, можна вводити окремо за допомогою того ж або іншого шляху введення або спільно в тій же фармацевтичній композиції, що й інші засоби. В одному варіанті здійснення цей винахід відноситься до продукту, що містить кристалічну форму, запропоновану в цьому винаході, і щонайменше один інший терапевтичний засіб, у вигляді об'єднаного препарату для одночасного, роздільного або послідовного застосування для лікування. В одному варіанті здійснення лікуванням є лікування захворювання або патологічного стану, опосередковуваного блокуванням епітеліальних натрієвих каналів. Продукти, що поставляються у вигляді комбінованого препарату, містять композицію, що включає кристалічну форму, запропоновану в цьому винаході, та інший терапевтичний засіб (засоби) в одній і тій самій фармацевтичній композиції, або кристалічну форму, запропоновану в цьому винаході, та інший терапевтичний засіб (засоби) в окремих формах, наприклад, у формі набору. В одному варіанті здійснення цей винахід відноситься до фармацевтичної композиції, що включає кристалічну форму, запропоновану в цьому винаході, та інший терапевтичний засіб (засоби). Фармацевтична композиція необов'язково може включати фармацевтично прийнятний інертний наповнювач, описаний вище. В одному варіанті здійснення цей винахід відноситься до набору, що містить дві або більше окремі фармацевтичні композиції, щонайменше одна з яких містить кристалічну форму, запропоновану в цьому винаході. В одному варіанті здійснення набір включає пристосування для роздільного зберігання зазначених композицій, таке як контейнер, розділений флакон або розділений пакет з фольги. Прикладом такого набору є блістерна упаковка, яку звичайно використовують для упакування таблеток, капсул і т.п. Набір, запропонований у цьому винаході, можна застосовувати для введення різних дозованих форм, наприклад, перорально і парентерально, для введення окремих композицій з різними інтервалами, або для запобігання окремих композицій одна від одної. Щоб сприяти дотриманню пацієнтом режиму лікування, набір, запропонований у цьому винаході, звичайно включає вказівки по введенню. Зокрема, кристалічна форма, запропонована в цьому винаході, має сприятливий профіль стабільності в плазмі людини. З одержанням сполук, які мають сприятливий профіль стабільності в плазмі людини, цей винахід дозволяє одержати сполуки, які ефективно блокують епітеліальні натрієві канали (ENaC) при поліпшеній фармакокінетиці. У комбінованих терапіях, запропонованих у цьому винаході, кристалічна форма, запропонована в цьому винаході, та інший терапевтичний засіб можуть бути виготовлені і/або приготовлені тим самим або різними виготовлювачами. Крім того, кристалічна форма, запропонована в цьому винаході, та інший терапевтичний засіб можуть бути об'єднані в комбінованому засобі: (i) до передачі комбінованого продукту лікарям (наприклад, у випадку набору, що включає кристалічну форму, запропоновану в цьому винаході, та інший терапевтичний засіб); (ii) самими лікарями (або під керівництвом лікаря) незадовго до введення; (iii) у самому пацієнтові, наприклад, під час послідовного введення сполуки, запропонованої в цьому винаході, та іншого терапевтичного засобу. Відповідно до цього цей винахід відноситься до застосування кристалічної форми, запропонованої в цьому винаході, для лікування захворювання або патологічного стану, опосередковуваного блокуванням епітеліальних натрієвих каналів, де лікарський засіб 6 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 приготовлений для введення разом з іншим терапевтичним засобом. Цей винахід також відноситься до застосування іншого терапевтичного засобу для лікування захворювання або патологічного стану, опосередковуваного блокуванням епітеліальних натрієвих каналів, де лікарський засіб вводять разом з кристалічною формою, запропонованою в цьому винаході. Цей винахід також відноситься до кристалічної форми, запропонованої в цьому винаході, призначеної для застосування у способі лікування захворювання або патологічного стану, опосередковуваного блокуванням епітеліальних натрієвих каналів, де кристалічна форма, запропонована в цьому винаході, приготовлена для введення разом з іншим терапевтичним засобом. Цей винахід також відноситься до іншого терапевтичного засобу, призначеного для застосування в способі лікування захворювання або патологічного стану, опосередковуваного блокуванням епітеліальних натрієвих каналів, де інший терапевтичний засіб приготовлений для введення разом з кристалічною формою, запропонованою в цьому винаході. Цей винахід також відноситься до застосування кристалічної форми, запропонованої в цьому винаході, для лікування захворювання або патологічного стану, опосередковуваного блокуванням епітеліальних натрієвих каналів, при якому пацієнта попередньо (наприклад, не пізніше, ніж за 24 год.) лікували іншим терапевтичним засобом. Цей винахід також відноситься до застосування іншого терапевтичного засобу для лікування захворювання або патологічного стану, опосередковуваного блокуванням епітеліальних натрієвих каналів, при якому пацієнта попередньо (наприклад, не пізніше, ніж за 24 год.) лікували кристалічною формою, запропонованою в цьому винаході. В одному варіанті здійснення інший терапевтичний засіб обраний із групи, що включає протизапальне, бронхолітичну, антигістамінну, протинабрякову і протикашльову лікарські речовини, краще для лікування муковісцидозу або обструктивних або запальних захворювань дихальних шляхів, таких як зазначені вище в цьому винаході, наприклад, як засоби, що підсилюють терапевтичну активність таких лікарських засобів, або як засоби, що забезпечують зниження необхідної дози або ослаблення можливих побічних ефектів таких лікарських засобів Відповідно до цього іншого об'єкта цього винаходу є комбінація блокатора епітеліальних натрієвих каналів з осмотичними засобами (гіпертонічним фізіологічним розчином, декстраном, манітом, ксилітом)+модифікатори функції CFTR (регулятор трансмембранної провідності муковісцидозу) "дикого типу" і мутантні (коректори+підсилювачі), наприклад, описані в WO2007/021982, WO2006/099256, WO2006/127588, WO2004/080972, WO2005/026137, WO2005/035514, WO2005/075435, WO2004/111014, WO2006/101740, WO2004/110352, WO2005/120497 і US2005/0176761, протизапальну, бронхолітичну, антигістамінну, протикашльову, антибіотик або ДНКазну лікарську речовину, зазначений блокатор епітеліальних натрієвих каналів і зазначена лікарська речовина перебувають в одній або різних фармацевтичних композиціях. Прийнятні модифікатори функції CFTR включають підсилювачі CFTR, зокрема, сполуку VX770 формули Прийнятні антибіотики включають макролидні антибіотики, наприклад, тобраміцин (TOBI™). Прийнятні ДНКазні лікарські речовини включають дорназу альфа (пульмозим™), високоочищенний розчин рекомбінантної дезоксирибонуклеази I людини (rhДНКаза), яка селективно розщеплює ДНК. Дорназу альфа використовують для лікування муковісцидозу. Іншими корисними комбінаціями блокаторів епітеліальних натрієвих каналів з протизапальними лікарськими засобами є комбінації з антагоністами хемокінових рецепторів, наприклад, CCR-1, CCR-2, CCR-3, CCR-4, CCR-5, CCR-6, CCR-7, CCR-8, CCR-9 і CCR10, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, краще з антагоністами CCR-5, такими як антагоністи, що випускаються фірмою Schering-Plough SC-351125, SCH-55700 і SCH-D; антагоністи, що випускаються фірмою Takeda, такі як N-[[4-[[[6,7-дигідро-2-(4-метилфеніл)-5H-бензоциклогептен8-іл]карбоніл]аміно]феніл]-метил]тетрагідро-N, N-диметил-2H-піран-4-амінійхлорид (TAK-770); і 7 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 антагоністи CCR-5, описані в патенті US 6166037 (особливо в пунктах 18 і 19 формули винаходу), WO00/66558 (особливо в пункті 8 формули винаходу), WO00/66559 (особливо в пункті 9 формули винаходу), WO04/018425 і WO04/026873. Прийнятні протизапальні лікарські засоби включають стероїди, зокрема, глюкокортикостероїди, такі як будезонід, бекламетазондипропіонат, флутиказонпропіонат, циклезонід або мометазон фуроат, або стероїди, описані в WO 02/88167, WO 02/12266, WO 02/100879, WO 02/00679 (особливо описані в прикладах 3, 11, 14, 17, 19, 26, 34, 37, 39, 51, 60, 67, 72, 73, 90, 99 і 101), WO 03/35668, WO 03/48181, WO 03/62259, WO 03/64445, WO 03/72592, WO 04/39827 і WO 04/66920; нестероїдні агоністи глюкокортикоїдного рецептора, такі як описані в DE 10261874, WO 00/00531, WO 02/10143, WO 03/82280, WO 03/82787, WO 03/86294, WO 03/104195, WO 03/101932, WO 04/05229, WO 04/18429, WO 04/19935 і WO 04/26248; антагоністи ® LTD4, такі як монтелукаст і зафірлукаст; інгібітори PDE4, такі як циломіласт (арифло GlaxoSmithKline), рофлуміласт (Byk Gulden), V-11294A (Napp), BAY19-8004 (Bayer), SCH-351591 (Schering-Plough), арофілін (Almirall Prodesfarma), PD189659/PD168787 (Parke-Davis), AWD-12281 (Asta Medica), CDC-801 (Celgene), SelCID(TM) CC-10004 (Celgene), VM554/UM565 (Vernalis), T-440 (Tanabe), KW-4490 (Kyowa Hakko Kogyo), і розкриті в WO 92/19594, WO 93/19749, WO 93/19750, WO 93/19751, WO 98/18796, WO 99/16766, WO 01/13953, WO 03/104204, WO 03/104205, WO 03/39544, WO 04/000814, WO 04/000839, WO 04/005258, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/018431, WO 04/018449, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/019944, WO 04/019945, WO 04/045607 і WO 04/037805; антагоністи аденозинового рецептора A2B, такі як описані в WO 02/42298; і агоністи бета-2 адренорецептора, такі як албутерол (салбутамол), метапротеренол, тербуталін, салметерол, фенотерол, прокатерол і, особливо, формотерол, кармотерол і їх фармацевтично прийнятні солі, і сполуки (у вільній формі або у формі солі або сольвату) формули (I), наведені в WO 0075114, цей документ включений у цей винахід як посилання, краще сполуки, наведені в прикладах, що містяться в ньому, ще краще сполука формули: що відповідає індакатеролу і його фармацевтично прийнятні солі, а також сполуки (у вільній формі або у формі солі або сольвату) формули (I), наведені в WO 04/16601, і також сполуки, наведені в EP 1440966, JP 05025045, WO 93/18007, WO 99/64035, USP 2002/0055651, WO 01/42193, WO 01/83462, WO 02/66422, WO 02/70490, WO 02/76933, WO 03/24439, WO 03/42160, WO 03/42164, WO 03/72539, WO 03/91204, WO 03/99764, WO 04/16578, WO 04/22547, WO 04/32921, WO 04/33412, WO 04/37768, WO 04/37773, WO 04/37807, WO 04/39762, WO 04/39766, WO 04/45618, WO 04/46083, WO 04/80964, WO 04/108765 і WO 04/108676. Прийнятні бронхорозширюючі лікарські засоби включають антихолінергічні або антимускаринові, зокрема, іпатропійбромід, окситропіийбромід, тіотропієві солі і CHF 4226 (Chiesi), і глікопіролат, а також описані в EP 424021, патентах US 3714357, US 5171744, WO 01/04118, WO 02/00652, WO 02/51841, WO 02/53564, WO 03/00840, WO 03/33495, WO 03/53966, WO 03/87094, WO 04/018422 і WO 04/05285. Прийнятні лікарські засоби, що мають подвійну протизапальну і бронхолітичну дію, включають подвійні агоністи бета-2 адренорецептора/антагоністи мускаринового рецептора, такі як описані в патенті US 2004/0167167, WO 04/74246 і WO 04/74812. Прийнятні антигістамінні лікарські засоби включають цетиризингідрохлорид, ацетамінофен, клемастинфумарат, прометазин, лоратидин, деслоратидин, дифенгідрамін і фексофенадингідрохлорид, активастин, астемізол, азеластин, ебастин, епінастин, мізоластин і тефенадин, а також розкриті в JP 2004107299, WO 03/099807 і WO 04/026841. При використанні в цьому винаході термін "фармацевтично прийнятний носій" включає будь-який і всі розчинники, диспергуючі середовища, покриття, поверхнево-активні речовини, антиоксиданти, консерванти (наприклад, бактерицидні агенти, фунгіцидні агенти), ізотонічні агенти, агенти, що затримують усмоктування, солі, консерванти, лікарські засоби, стабілізатори лікарських засобів, зв'язувальні, інертні наповнювачі, розпушувачі, мастильні агенти, 8 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 55 підсолоджувачі, смакові агенти, барвники і т.п. і їх комбінації, як це повинно бути відомо фахівцям у даній галузі техніки (див., наприклад, публікацію Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329). За винятком випадків, коли звичайний носій несумісний з активним інгредієнтом, мається на увазі його використання в терапевтичних або фармацевтичних композиціях. Термін "терапевтично ефективна кількість" кристалічної форми, запропонованої в цьому винаході, означає кількість кристалічної форми, запропонованої в цьому винаході, яка приводить до біологічної або медичній реакції суб'єкта, наприклад, до зменшення або інгібування активності ферменту або білка, або зм'якшує симптоми, полегшує патологічні стани, сповільнює або затримує прогресування захворювання, або попереджає захворювання і т.п. В одному необмежуючому варіанті здійснення термін "терапевтично ефективна кількість" означає кількість кристалічної форми, запропонованої в цьому винаході, яка при введенні суб'єктові ефективна (1) щонайменше для часткового ослаблення, придушення, попередження і/або полегшення протікання патологічного стану або порушення, або захворювання (i) опосередковуваного епітеліальними натрієвими каналами, або (ii) пов'язаного з активністю епітеліальних натрієвих каналів, або (iii), що характеризується активністю (нормальною або аномальною) епітеліальних натрієвих каналів; або (2) для зменшення або інгібування активності епітеліальних натрієвих каналів. В іншому необмежуючому варіанті здійснення термін "терапевтично ефективна кількість" означає кількість кристалічної форми, запропонованої в цьому винаході, який при введенні в клітину або тканину або в неклітинний біологічний матеріал або середовище ефективну щонайменше для часткового зменшення або інгібування активності епітеліальних натрієвих каналів. При використанні в цьому винаході термін "суб'єкт" означає тварину. Звичайно тваринами є ссавець. Суб'єкт також означає наприклад, приматів (наприклад, людей), корів, овець, кіз, коней, собак, кішок, кроликів, пацюків, мишей, риб, птахів і т.п. У деяких варіантах здійснення суб'єктом є примат. В інших варіантах здійснення суб'єктом є людина. При використанні в цьому винаході термін "інгібування" або "придушення" означає ослаблення або придушення даного патологічного стану, симптому або порушення, або захворювання або значне ослаблення вихідної біологічної активності або процесу. При використанні в цьому винаході термін "лікування" будь-якого захворювання або порушення в одному варіанті здійснення означає поліпшення протікання захворювання або порушення (тобто вповільнення або зупинку або ослаблення розвитку захворювання або щонайменше одного з його клінічних симптомів). В іншому варіанті здійснення "лікування" означає поліпшення щонайменше одного фізичного параметра, включаючи ті, які можуть не відчуватися пацієнтом. У ще одному варіанті здійснення "лікування" означає зміну протікання захворювання або порушення, фізичну (наприклад, стабілізацію симптому, що проявляється), фізіологічну (наприклад, стабілізацію фізикального параметра), або і те, й інше. У ще одному варіанті здійснення "лікування" означає попередження або затримку початку або розвитку, або прогресування захворювання або порушення. При використанні в цьому винаході суб'єкт "потребує" лікування, якщо лікування чинить на такий суб'єкт сприятливий біологічний або медичний вплив або поліпшить якість його життя. При використанні в цьому винаході (особливо у формулі винаходу), терміни, що використовуються в однині, включають множину, і навпаки, якщо в цьому винаході не зазначено інше і якщо це явно не суперечить контексту. Експериментальна частина Загальні умови: Мас-спектри знімали за допомогою систем РХМС з іонізацією електророзпиленням. Ними були або комбінації Agilent 1100 HPLC/мас-спектрометр Micromass Platform, або комбінації Agilent 1200 HPLC/квадрупольний мас-спектрометр Agilent 6130, або Waters Acquity UPLC з мас+ спектрометром SQD. [M+H] означають моноізотопні молекулярні маси. Спектри ЯМР знімали на спектрометрах ЯМР загального користування Bruker AVANCE 400 з використанням ICON-NMR. Спектри знімали при температурі 298K і як стандарт використовували пік розчинника. Деякі протони безпосередньо не спостерігалися внаслідок дуже великої ширини їх обмінних резонансів. Якщо не зазначено інше, умови проведення аналітичної ВЕРХ були наступними: Методика (i) Колонка Температура колонки Agilent Zorbax SB-C18 (висока роздільна здатність) 302,1 мм, 3,5 мкм 30C 9 UA 114904 C2 Елюенти Швидкість потоку Градієнтний режим B: H2O, C: ацетонітрил, обоє містять 0,1 % мурашиної кислоти 0,8 мл/хв 1 хв 5 % C; від 5 % до 95 % C за 5 хв, 3,00 хв 95 % C Методика (ii) Колонка Температура колонки Елюенти Швидкість потоку Градієнтний режим 5 SB-C18 504,6 мм, 1,8 мкм 30 °C A: H2O, B: ацетонітрил, обоє містять 0,1 % мурашиної кислоти 1 мл/хв 1 хв 2 % B; від 2 % до 70 % B за 4 хв, від 70 % до 90 % B за 0,1 хв, 4,9 хв 95 %B Методика 2minLC_v003 Колонка Температура колонки Елюенти Швидкість потоку Градієнтний режим Waters BEH C18 502,1 мм, 1,7 мкм 50 °C A: H2O, B: ацетонітрил, обоє містять 0,1 % ТФК 0,8 мл/хв 0,20 хв 5 % B; від 5 % до 95 % B за 1,30 хв, 0,25 хв 95 % B Абревіатури: br d ДХМ ДСК ДМФ ДМІ ДМСО EDCI EtOAc год. HOBt ВЕРХ РХ-МС MeOH МС m 2-MeTHF хв мл мас/мас m/z ЯМР iPrOH ч/млн PS PEAX Rt s SCX-2 t ТЕА ТФК ТГФ широкий дублет дихлорметан диференціальна скануюча калориметрія N, N-диметилформамід 1,3-диметил-2-імідазолідинон диметилсульфоксид N-(3-диметиламінопропіл)-N’-етилкарбодиімід етилацетат година(и) 1-гідроксибензотриазол високоефективна рідинна хроматографія рідинна хроматографія і мас-спектрометрія метанол мас-спектрометрія мультиплет 2-метилтетрагідрофуран хвилини мілілітр(и) відношення маса/маса відношення маси до заряду ядерний магнітний резонанс ізопропанол частинок на мільйон на основі з полімеру PE-аніонообмінник (наприклад, колонки Isolute® PE-AX, що випускаються фірмою Biotage) час утримання сінглет сильний катонообмінник (наприклад, колонки Isolute® SCX-2, що випускаються фірмою Biotage) триплет триетиламін трифтороцтова кислота тетрагідрофуран 10 UA 114904 C2 Синтез 1: Дипропілкарбамоїлметиловий ефір 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти 5 10 15 20 25 30 35 40 45 Шукану сполуку можна одержати за кожною з методик A або B. Методика A: При перемішуванні до розчину 3-(2-дипропілкарбамоїлметоксикарбонілетилсульфамоїл)бензойної кислоти (можна одержати, як у синтезі 2; 6,1 г, 12,60 ммоля) у ТГФ (50 мл) послідовно додавали воду (25 мл), N-метилморфолін (7 мл, 63 ммоля) і гідрат HOBt (2,9 г, 18,9 ммоля). Внутрішню температуру підтримували рівною або менше 20C. Додавали [1,3,8триазаспіро[4.5]дец-(2E)-іліден]-амідгідрохлорид 3,5-диаміно-6-хлорпіразин-2-карбонової кислоти (WO09/074575, приклад 38, стор. 123) (чистота 65 %, 6,3 г, 12,6 ммоля) і перемішували до утворення прозорого розчину. Додавали EDCI.HCl (3,6 г, 18,9 ммоля) і реакційну суміш перемішували при КТ (кімнатна температура) протягом 24 год. До реакційної суміші додавали 2MeTHF (200 мл) і 2 % водний розчин Na2CO3 (150 мл). Шари розділяли і водну фазу промивали додатковою кількістю 2-MeTHF (100 мл). Об'єднані органічні шари промивали 2 % водним розчином Na2CO3 (200 мл) і водою (2200 мл). Додавали ацетонітрил (100 мл) і розчин концентрували при 30 °C до об'єму, рівного 70 мл. Додавали ацетонітрил (300 мл) і розчин повторно концентрували при 30 °C до об'єму, рівного 150 мл. Розчин нагрівали при 50 °C і до отриманого розчину додавали малеїнову кислоту (1,62 г). Відразу утворювався майже білий осад, температурі давали знижуватися до КТ протягом 1 год. Тверду речовину збирали фільтруванням і одержували дипропілкарбамоїлметиловий ефір 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти у вигляді малеату; додавали ДХМ (200 мл) і 2 % водний розчин Na2CO3 (200 мл) і перемішували до повного розчинення твердої речовини. Органічний шар відокремлювали, промивали водою (2100 мл) і концентрували у вакуумі і одержували шукану + 1 сполуку. РХ-МС 722,1 [M+H] , методика (i); H ЯМР (400 МГц, ДМСО-д6) δ 9,12-7,57 (4H, шир.), 7,88 (1H, м), 7,77 (1H, м), 7,70 (1H, м), 7,68 (1H, м), 7,05-6,50 (2H, шир.с), 6,95-6,20 (1H, шир.с), 4,73 (2H, с), 3,81-3,39 (2H, м), 3,61-3,31 (2H, м), 3,43 (2H, шир.с), 3,15-3,11 (4H, м), 3,04 (2H, т), 2,51 (2H, т), 1,79-1,69 (м, 4H), 1,51-1,43 (4H, м), 0,84 (3H, т), 0,78 (3H, т). Методика B: При перемішуванні до розчину 3-(2-дипропілкарбамоїлметоксикарбонілетилсульфамоїл)бензойної кислоти (Int. AA) (6,1 г, 12,60 ммоля) у ТГФ (50 мл) послідовно додавали воду (25 мл), N-метилморфолін (7 мл, 63 ммоля) і гідрат HOBt (2,9 г, 18,9 ммоля). Внутрішню температуру підтримували рівною або менше 20 °C. Додавали [1,3,8-триазаспіро[4.5]дец-(2E)-іліден]амідгідрохлорид 3,5-диаміно-6-хлорпіразин-2-карбонової кислоти (WO09074575, приклад 38, стор. 123) (чистота 65 %, 6,3 г, 12,6 ммоля) і перемішували до утворення прозорого розчину. Додавали EDCI.HCl (3,6 г, 18,9 ммоля) і реакційну суміш перемішували при КТ протягом 24 год. До реакційної суміші додавали 2-MeTHF (200 мл) і 2 % водний розчин Na2CO3 (150 мл). Шари розділяли, і водну фазу промивали додатковою кількістю 2-MeTHF (100 мл). Об'єднані органічні шари промивали 2 % водним розчином Na2CO3 (200 мл) і водою (2200 мл). Додавали ацетонітрил (100 мл) і розчин концентрували при 30 °C до об'єму, рівного 70 мл. Додавали ацетонітрил (300 мл) і розчин повторно концентрували при 30 °C до об'єму, рівного 150 мл. Розчин нагрівали при 50 °C і до отриманого розчину додавали малеїнову кислоту (1,62 г). Відразу утворювався майже білий осад, температурі давали знижуватися до КТ протягом 1 год. Тверду речовину збирали фільтруванням і одержували дипропілкарбамоїлметиловий ефір 3-(3 11 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 {2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)-пропіонової кислоти у вигляді малеату; додавали ДХМ (200 мл) і 2 % водний розчин Na2CO3 (200 мл) і перемішували до повного розчинення твердої речовини. Органічний шар відокремлювали, промивали водою (2100 мл) і концентрували у вакуумі та + 1 одержували шукану сполуку. РХ-МС 722,1 [M+H] , методика (i).; H ЯМР (400 МГц, ДМСО-д6) δ 9,12-7,57 (4H, шир.), 7,88 (1H, м), 7,77 (1H, м), 7,70 (1H, м), 7,68 (1H, м), 7,05-6,50 (2H, шир.с), 6,95-6,20 (1H, шир.с), 4,73 (2H, с), 3,81-3,39 (2H, м), 3,61-3,31 (2H, м), 3,43 (2H, шир.с), 3,15-3,11 (4H, м), 3,04 (2H, т), 2,51 (2H, т), 1,79-1,69 (м, 4H), 1,51-1,43 (4H, м), 0,84 (3H, т), 0,78 (3H, т). Синтез 2: 3-(2-Дипропілкарбамоїлметоксикарбонілетилсульфамоїл)-бензойна кислота Шукану сполуку можна одержати за кожною з методик A або B: Методика A: Стадія 1: Дипропілкарбамоїлметиловий ефір 3-бензилоксикарбоніламінопропіонової кислоти До розчину бензилоксикарбоніламінопропіонової кислоти (22,3 г, 99,9 ммоля) у ДМФ (150 мл) додавали карбонат калію (19,3 г, 139,9 ммоля). Протягом 30 хв додавали 2-хлор-N, Nдипропілацетамід (17,7 г, 99,9 ммоля) і реакційну суміш нагрівали при 60 °C і перемішували протягом 2,5 год. Реакційній суміші давали остудитися до КТ і її розбавляли водою (500 мл) і екстрагували ізопропілацетатом (усього 500 мл). Об'єднані органічні фази промивали водою (3200 мл) і одержували розчин дипропілкарбамоїлметилового ефіру 3бензилоксикарбоніламінопропіонової кислоти в ізопропілацетаті, який додатково не розділяли. + РХ-МС; 365,2 [M+H] , методика (i). Стадія 2: Трифторацетат дипропілкарбамоїлметилового ефіру 3-амінопропіонової кислоти Розчин дипропілкарбамоїлметилового ефіру 3-бензилоксикарбоніламінопропіонової кислоти в ізопропілацетаті (33,2 г, 91,0 ммоля в рівній 129,9 г повній масі розчину) обробляли за допомогою ТФК (7,05 мл, 92,0 ммоля) і внутрішню температуру підтримували рівною 20 °C, потім додавали 10 % Pd/C (3,3 г, 50 % вологість) і перемішували в атмосфері H 2 (3 атм.) протягом 3,5 год. і одержували трифторацетат дипропілкарбамоїлметилового ефіру 3амінопропіонової кислоти. Розчин безпосередньо використовували в наступній реакції без поділу. Стадія 3: Бензиловий ефір 3-(2-дипропілкарбамоїлметоксикарбонілетилсульфамоїл)бензойної кислоти Розчин трифторацетату дипропілкарбамоїлметилового ефіру 3-амінопропіонової кислоти (25,4 г 73,8 ммоля) в ізопропілацетаті охолоджували до 0 °C і обробляли N-метилморфоліном (26,3 г, 221,5 ммоля), водою (40 мл) і ДМАП (диметиламінопіридин) (90,4 мг, 0,74 ммоля). Додавали бензиловий ефір 3-хлорсульфонілбензойної кислоти (24,1 г, 77,5 ммоля) в ізопропілацетаті (44 мл) і реакційну суміш перемішували протягом 2 год. при 0-5 °C. Шари розділяли і органічну фазу промивали насиченим водним розчином NaHCO 3 (326 мл), розбавляли водою (10 мл), значення pH встановлювали рівним 6 за допомогою 1 н розчину HCl і промивали розсолом. Отриманий розчин концентрували і одержували розчин бензилового ефіру 3-(2-дипропілкарбамоїлметоксикарбонілетилсульфамоїл)-бензойної кислоти в + ізопропілацетаті, який використовували в наступних реакціях без поділу. РХ-МС; [M+H] 505,1, методика (i) Стадія 4: Синтез 3-(2-дипропілкарбамоїлметоксикарбонілетилсульфамоїл)-бензойної кислоти Розчин бензилового ефіру 3-(2-дипропілкарбамоїлметоксикарбонілетилсульфамоїл)бензойної кислоти (5 г, 33,25 ммоля) в ізопропілацетаті (82 мл) обробляли за допомогою 10 % Pd/C (0,84 г, 50 % вологість) і перемішували в атмосфері H2 (3 атм.) протягом ночі. Каталізатор видаляли фільтруванням. До фільтрату додавали 10 % Pd/C (1,68 г, 50 % вологість) і реакційну суміш перемішували в атмосфері H2 (3 атм.) протягом 18 год. Каталізатор видаляли фільтруванням і додавали додаткову кількість 10 % Pd/C (1,68 г, 50 % вологість) і реакційну суміш перемішували в атмосфері H2 (1 атм.) протягом 18 год. Каталізатор видаляли фільтруванням і промивали ізопропілацетатом (20 мл). Об'єднані фільтрати концентрували у вакуумі і до розчину додавали гептан і перемішували при КТ протягом 2 год. потім при -2 °C 12 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом 4 год. Тверду речовину, що утворилася, збирали фільтруванням і сушили у вакуумі + при 40 °C і одержували шукану сполуку; РХ-МС; 415,1 [M+H] , методика (i). Методика B: Стадія 1: Дипропілкарбамоїлметиловий ефір 3-трет-бутоксикарбоніламінопропіонової кислоти При перемішуванні до суспензії БЕТА-ALA-OH (40,0 г, 211 ммоля) у ДМФ (200 мл) при 60C в атмосфері N2 додавали карбонат калію (40,0 г, 289 ммоля). До цієї суміші додавали 2-хлор-N, N-дипропілацетамід (36,7 г, 207 ммоля) у ДМФ (75 мл). Реакційну суміш перемішували при 60C протягом ночі. Реакційній суміші давали остудитися до КТ і її розбавляли за допомогою ДХМ (400 мл), потім водою (500 мл). Органічний шар відокремлювали і промивали розсолом (200 мл), сушили над MgSO4 і концентрували у вакуумі та одержували блідо-жовту олію. До олії додавали н-гептан (500 мл) (утворює азеотроп з ДМФ), концентрували у вакуумі і одержували + шукану сполуку; РХ-МС Rt 1,14 хв; 331,3 [M+H] , методика 2minLC_v003. Стадія 2: Дипропілкарбамоїлметиловий ефір 3-амінопропіонової кислоти До охолодженого розчину, що перемішується, дипропілкарбамоїлметилового ефіру 3-третбутоксикарбоніламінопропіонової кислоти (стадія 1) (36,5 г, 110 ммоля) у сухому діоксані в атмосфері N2 по краплях додавали 4 н розчин HCl у діоксані (18,12 мл, 597 ммоля). Отриманій суміші давали нагрітися до КТ і її перемішували протягом ночі. Розчинник видаляли у вакуумі і неочищений продукт суспендували в EtOAc (500 мл) і обробляли ультразвуком протягом 1 год. Отриманий білий осад виділяли фільтруванням і сушили у вакуумі при 40C протягом 1 год. і одержували блідо-жовту тверду речовину. Перекристалізація з EtOAc давала шукану сполуку; + РХ-МС Rt 0,77 хв; 231,2 [M+H] , методика 2minLC_v003. Стадія 3: 3-(2-Дипропілкарбамоїлметоксикарбонілетилсульфамоїл)-бензойна кислота При перемішуванні до розчину дипропілкарбамоїлметилового ефіру 3-амінопропіонової кислоти (стадія 2) (20,1 г, 75 ммоля) у ДХМ (240 мл) при 0C в атмосфері N2 додавали ДМАП (0,46 г, 3,76 ммоля), потім ТЕА (38,8 мл, 278 ммоля). Реакційну суміш обробляли розчином 3хлорсульфонілбензойної кислоти (16,6 г, 75 ммоля) у ДХМ (200 мл). Суміш перемішували при 0C протягом 1 год. і потім нагрівали до КТ протягом 1 год. Додавали воду (200 мл) і значення pH регулювали за допомогою 1 н HCl (100 мл). Органічний шар відокремлювали, сушили над MgSO4 і концентрували у вакуумі. Очищення за допомогою C18 хроматографії зі зверненою фазою при елююванні сумішшю MeCN/вода (1 % HCl) давала шуканий продукт; РХ-МС Rt 1,01 + хв; 415,2 [M+H] , методика 2minLC_v003. Приклад 1: Сукцинат дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти: Одержання кристалічної форми A 2,5 г Дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (можна одержати, як у синтезі 1; 3,47 ммоля) при 50C розчиняли в 25 мл ацетонітрилу і 1,5 мл води. Додавали 409 мг бурштинової кислоти (3,47 ммоля). Кислота відразу розчинялася і прозорий розчин охолоджували до кімнатної температури протягом 30 хв. Приблизно при 30C відбувалася кристалізація. Потім завись перемішували протягом приблизно 16 год. при кімнатній температурі. Кристали збирали фільтруванням. Осад на фільтрі промивали порціями по 9 мл суміші ацетонітрил/вода 95:5 об./об. і сушили протягом 16 год. при 50C і тиску, рівному приблизно 10 мбар. Приклад 2: Сукцинат дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти: Одержання кристалічної форми A Суміш, що містить бурштинову кислоту (0,50 г, 4,23 ммоля) і ацетон (20 г), нагрівали при 45 °C до утворення прозорого розчину і потім фільтрували (фільтр з ПТФЕ (політетрафторетилен) з отворами розміром 0,2 мкм). У другій посудині для проведення реакції дипропілкарбамоїлметиловий ефір 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (синтез 1, методика B) (3,00 г, 4,16 ммоля) і ацетон (30 г) нагрівали при 45C до утворення прозорого розчину і потім фільтрували (фільтр з ПТФЕ з отворами розміром 0,2 мкм). Розчин бурштинової кислоти (0,50 г, 4,23 ммоля) в ацетоні (20 мл) нагрівали при 45 °C протягом 1 год. і протягом 10 хв обробляли порцією розчину дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти в ацетоні (1,62 г розчину). Отриману суміш обробляли суспензією запалювальних кристалів сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5диаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл} 13 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 55 60 бензолсульфоніламіно)-пропіонової кислоти (отриманий за методикою прикладу 1, 20 мг) в ацетоні (300 мг) і перемішували при 45 °C протягом 30 хв. Розчин, що залишився, дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти в ацетоні (31,38 г) додавали до суміші протягом 5 год. і нагрівання продовжували при 45 °C протягом 1 год. Суспензію охолоджували до 25 °C протягом 1 год. і перемішували протягом ще 1 год. Суспензію фільтрували крізь скляний пористий фільтр і осад на фільтрі промивали ацетоном (25 г). Осад на фільтрі сушили при 50 °C і одержували шукану сполуку; ВЕРХ Rt 4,02 хв, 1 методика ii; H ЯМР (400 МГц, ДМСО-д6) δ 7,87 (1H, м), 7,78 (1H, м), 7,69 (1H, м), 7,68 (1H, м), 6,85 (2H, шир.с), 4,73 (2H, с), 3,84-3,20 (6H і вода, шир. максимум), 3,17-3,09 (4H, м), 3,04 (2H, т), 2,53 (2H, під ДМСО), 2,39 (4H, с), 1,80 (2H, шир.с), 1,70 (2H, шир.с), 1,55-1,37 (4H, м), 0,85 (3H, т), 0,78 (3H, т) (Примітка: Два сукцинатних протони, що обмінюються, і 3-4 кислотних резонанси NH безпосередньо не спостерігалися внаслідок дуже великої ширини їх обмінних резонансів; температура плавлення Tm (ДСК)=149 °C. Приклад 3: Сукцинат дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти: Одержання кристалічної форми A 3 г сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (можна одержати, як показано в прикладі 1 або 2) поміщали в реактор об'ємом 100 мл, обладнаний якірною мішалкою (150 об/хв), холодильником, дозуючим пристроєм і датчиком мутності. Додавали 20 г суміші ацетон/вода (92,5/7,5 мас/мас) і суміш нагрівали при 50 °C і перемішували до повного розчинення. Потім реакційну суміш охолоджували до 45 °C. Додавали 30 мг запалювальних кристалів (можна одержати, як показано в прикладі 1 або 2), суспендованих в 300 мг ацетону. Потім реакційну суміш охолоджували до 25 °C протягом 1 год. Суміш перемішували протягом 3,5 год. Потім протягом 2 год. додавали 28 мл EtOAc. Реакційну суміш додатково охолоджували до 0 °C протягом 1 год. і потім суміш перемішували протягом ночі. Реакційну суміш фільтрували крізь скляний пористий фільтр і потім отриману тверду речовину двічі промивали за допомогою 5 мл ацетону і сушили протягом 24 год. при 40 °C при тиску, рівному приблизно 1 мбар. Приклад 4: Сукцинат дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти: Одержання кристалічної форми B 3 г дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (можна одержати, як у синтезі 1) розчиняли в 22,7 г ацетону при 50C у скляному реакторі об'ємом 100 мл, обладнаному якірною мішалкою (150 об/хв). У реактор додавали 5 мл розчину бурштинової кислоти (2,94 мас. % в ацетоні). 10 мг сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти, кристалічну форму A (можна одержати, як у прикладі 1 або 2), суспендованого в 0,2 г ацетону, обробляли ультразвуком і додавали в реактор. У реактор протягом 20 год. повільно додавали ще 40 мл розчину бурштинової кислоти (2,94 мас. % в ацетоні). Потім суміш охолоджували до 20C і потім додатково перемішували протягом 19 год. Отриману суспензію фільтрували і осад на фільтрі при кімнатній температурі двічі промивали за допомогою 10 г ацетону. Приклад 5: Сукцинат дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти: Одержання кристалічної форми B 3 г дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (можна одержати, як у синтезі 1) і 0,5 г бурштинової кислоти розчиняли в суміші 28,5 г ацетону і 1,5 г води при 50C у скляному реакторі об'ємом 100 мл, обладнаному якірною мішалкою (150 об/хв). Потім розчин охолоджували до 20C. 7 мг сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти, кристалічну форму A (можна одержати, як у прикладі 1 або 2), суспендованого в 0,18 г суміші ацетон/вода 95:5 (об./об.) обробляли ультразвуком і додавали в реактор. Суміш перемішували при 20C протягом 15 год., потім охолоджували до 0C протягом 10 хв. Отриману суспензію фільтрували і осад на фільтрі при кімнатній температурі промивали за допомогою 10 г суміші ацетон/вода 95/5 (об./об.). 14 UA 114904 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 6: Сукцинат дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти: Одержання кристалічної форми B 0,536 г дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (можна одержати, як у синтезі 1) і 0,12 г бурштинової кислоти при 50C при перемішуванні магнітною мішалкою в скляній посудині розчиняли в 15,25 г 2-пропанолу. Розчин охолоджували до 20C і потім перемішували при цій температурі протягом ночі. Отриману суспензію фільтрували. Приклад 7: Сукцинат дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти: Одержання кристалічної форми B 0,535 г дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (можна одержати, як у синтезі 1) і 0,12 г бурштинової кислоти при 60C при перемішуванні магнітною мішалкою в скляній посудині розчиняли в 7,27 г метилетилкетону. Розчин охолоджували до 20C і потім перемішували при цій температурі протягом ночі. Отриману суспензію фільтрували. Приклад 8: Сукцинат дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти: Одержання кристалічної форми C 3 г дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (можна одержати, як у синтезі 1) розчиняли в 80,3 г етанолу при 60C у скляному реакторі об'ємом 100 мл, обладнаному якірною мішалкою (150 об/хв). До розчину додавали 25 мл розчину бурштинової кислоти (2,94 мас. % в етанолі), потім додавали 2,5 г води. Отриману суміш охолоджували до 30C. 5 мг запалювальних кристалів сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти, форма A (можна одержати за методикою прикладу 1 або 2), суспендованих в 0,1 г етанолу, обробляли ультразвуком і додавали в реактор. Отриману суміш перемішували протягом 96 год. (150 об/хв). Потім кристали збирали фільтруванням. Осад на фільтрі сушили протягом 24 год. при 40C і тиску, рівному 30 мбар. Приклад 9: Сукцинат дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти: Одержання кристалічної форми C 1 г дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (можна одержати, як у синтезі 1) і 0,18 г бурштинової кислоти в скляній посудині при 50C розчиняли в 7,97 г метанолу. Розчин охолоджували до 0C і потім перемішували при цій температурі протягом 24 год. Потім кристали збирали фільтруванням і протягом 3 год. сушили при 60C і тиску, рівному 1 мбар. Одержували кристали форми C від майже білого до жовтуватого кольору. Приклад 10: Сукцинат дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти: Одержання кристалічної форми C 10.1 Одержання запалювальних кристалів: У реакторі об'ємом 100 мл, обладнаному якірною мішалкою (150 об/хв), холодильником, дозуючим пристроєм і датчиком мутності, 6 г сукцинату дипропілкарбамоїлметилового ефіру 3(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)-пропіонової кислоти (можна одержати, як показано в прикладі 1 або 2) суспендували в 27 г суміші ацетон/вода (92,5/7,5 мас/мас). Суспензію нагрівали при 50 °C до розчинення матеріалу. Додавали 40 мг сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2[(E)-3,5-диаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)-пропіонової кислоти (одержували, як показано в прикладі 9) в 600 мг ацетону, яку раніше обробляли ультразвуком протягом 5 хв, і суміш перемішували протягом 6 год. Протягом 4 год. додавали 76 мл EtOAc і потім реакційну суміш охолоджували до 25 °C протягом 2 год. Осад відфільтровували і двічі промивали за допомогою 10 мл ацетону і потім сушили протягом ночі при 60 °C при тиску, рівному 10 мбар. Потім отриману тверду речовину мікронізували за допомогою спірального струминного млина при тиску, рівному 5 бар. 15 UA 114904 C2 5 10 15 20 10.2 Одержання кристалічної форми C: 3 г сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-диаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}-бензолсульфоніламіно)-пропіонової кислоти (можна одержати, як показано в прикладі 1 або 2) поміщали в реактор об'ємом 100 мл, обладнаний якірною мішалкою (150 об/хв), холодильником, дозуючим пристроєм і датчиком мутності. Додавали 29,5 г суміші ацетон/вода (92,5/7,5 мас/мас) і суміш нагрівали при 50 °C і перемішували до повного розчинення. Додавали 90 мг запалювальних кристалів (див. 10.1), суспендованих в 300 мг ацетону, і суміш перемішували протягом 4 год. Протягом 4 год. додавали 38 мл EtOAc і потім реакційну суміш перемішували протягом 2 год., потім охолоджували до 25 °C протягом 2 год. Суміш перемішували протягом ночі і потім фільтрували крізь скляний пористий фільтр. Потім отриману тверду речовину двічі промивали за допомогою 5 мл ацетону і протягом 24 год. сушили при 40 °C при тиску, рівному 10 мбар. Дослідження кристалічних форм сукцинату дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)3,5-диаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)-пропіонової кислоти: Усі порошкові рентгенограми знімали в режимі відбиття. Форма A: a) Порошкова рентгенографія a1) Порошкову рентгенограму знімали на дифрактометрі Bruker™ D8 з використанням випромінювання CuKα (λ=1,5418 Å). Отримана в такий спосіб порошкова рентгенограма сполуки прикладу 3 наведена на фіг. 1 і представлена нижче в таблиці 1, у якій наведені дані для ліній відбиття найбільш важливих ліній. Гранична погрішність для кутів 2-тета рівна 0,2. Таблиця 1 Кут 2-тета 3,2 11,0 12,7 14,0 14,9 15,3 15,6 17,5 18,8 19,3 19,8 20,1 20,4 20,8 21,5 22,2 22,6 23,1 24,0 24,3 24,7 25,6 25,9 26,1 26,4 27,0 28,3 29,0 30,5 32,8 33,8 34,7 35,6 Міжплощинна відстань [ангстреми] 27,79210 8,06447 6,94945 6,30426 5,94212 5,79615 5,69030 5,07298 4,72745 4,59524 4,47594 4,41469 4,35953 4,26419 4,13266 4,00651 3,93512 3,84491 3,70349 3,66068 3,59591 3,47462 3,44221 3,41016 3,37500 3,29534 3,15131 3,07534 2,93136 2,72599 2,64794 2,58032 2,52249 16 Інтенсивність % 100 6 9 14 6 6 6 11 18 61 9 17 16 12 9 17 18 33 8 10 5 9 12 14 8 9 7 6 16 11 6 8 6 UA 114904 C2 Продовження таблиці 1 36,7 38,7 39,2 5 2,44894 2,32439 2,29807 6 5 6 a2) Порошкову рентгенограму знімали на дифрактометрі Bruker™ D8 з використанням випромінювання CuKα (λ=1,5418 Å). Отримана в такий спосіб порошкова рентгенограма сполуки прикладу 1 або 2 наведена на фіг. 4 і представлена нижче в таблиці 2, у якій наведені дані для ліній відбиття найбільш важливих ліній. Гранична погрішність для кутів 2-тета рівна 0,2. Таблиця 2 Кут [2-тета] Міжплощинна відстань [ангстреми] 27,82660 8,08104 6,96126 6,31327 5,94185 5,80195 5,69596 5,13947 5,07677 4,73387 4,60047 4,47276 4,41948 4,36135 4,26679 4,13483 4,00989 3,93071 3,84729 3,70743 3,67477 3,59652 3,47835 3,41096 3,37922 3,29646 3,21774 3,13361 3,07785 2,93279 2,80895 2,72626 2,64887 2,58155 2,52537 3,2 10,9 12,7 14,0 14,9 15,3 15,5 17,2 17,5 18,7 19,3 19,8 20,1 20,3 20,8 21,5 22,2 22,6 23,1 24,0 24,2 24,7 25,6 26,1 26,4 27,0 27,7 28,5 29,0 30,5 31,8 32,8 33,8 34,7 35,5 17 UA 114904 C2 Продовження таблиці 2 36,3 36,7 37,1 37,5 38,2 38,7 39,2 2,47491 2,44931 2,41984 2,39660 2,35582 2,32643 2,29792 b) Елементний аналіз: Таблиця 3 Вміст води (титрування за Карлом Фішером):
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline form of a succinate salt
Автори англійськоюHowsham, Catherine, Lindenberg, Christian, Perlberg, Anett, Tufilli, Nicola
Автори російськоюХоушэм Кэтрин, Линдэнберг Кристиан, Пэрлберг Анэтт, Туфилли Никола
МПК / Мітки
МПК: C07D 471/10, A61K 31/00
Мітки: форма, кристалічна, сукцинату
Код посилання
<a href="https://ua.patents.su/36-114904-kristalichna-forma-sukcinatu.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма сукцинату</a>
Попередній патент: Електронна цигарка з підзарядкою
Наступний патент: Стельові панелі, що виготовлені з гофрованого картону
Випадковий патент: П'єзоелектричний датчик статичних зусиль












