Антрациклінові проліки, спосіб їх одержання та композиція для використання у цитостатичній терапії
Номер патенту: 56981
Опубліковано: 16.06.2003
Автори: Жессон Жан-П'єр, Кош Мішель, Рену Брижіт, Флоран Жан-Клод, Мондон Мартін, Седлацек Ганс Гаральд, Колар Ценек, Годель Жільбер, Монре Клод, Тількен Франсуа, Жакзі Жан-Клод, Геркен Манфред
Формула / Реферат
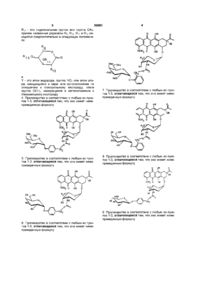
1. Антрациклиновое пролекарство, имеющее нижеприведенную формулу (І):
, (I)
в которой R1, R2 и R3, могут быть идентичными или различными, представляют собой атом водорода или гидроксильную группу;
R4 - это атом водорода, гидроксильная группа или метоксигруппа;
R - это группа -СО-СН2-R", в которой R" - это атом водорода, С1-С6алкилгруппа, гидроксильная группа, алкоксигруппа, O-ацил или арилгруппа;
R5 и R6, могут быть идентичными или различными, представляют собой атом водорода или гидроксильную группу;
R7 представляет собой атом водорода или гидроксильную группу;
R8 представляет группу -CH2-OR9 или -COOR9, где R9 - это алкилС1-С3, атом водорода или ацетилгруппа;
R10 и R11 представляют собой атом водорода, ацилзащитную группу или алкилгруппу;
R12 - это гидроксильная группа, аминовая группа, амидная группа или O-ацилзащитная группа;
СН2 бензильный находится предпочтительно в пара- или ортоположении по отношению к гликозильному кислороду; и
Y - это атом водорода, или, по меньшей мере, одна электроноакцепторная группа, выбранная преимущественно из группы, содержащей группу NO2, атом галогена и группу SO2X (где X = СН3, С6Н4-СН3, NH2, N-(алкил С1-С4)2, или NН-(алкил С1-С4), CN, ацил или СОО-алкил, и/или, по меньшей мере, одну электронодонорную группу, выбранную из группы, состоящей из групп типа O-алкил, NHCO-алкил, N(алкил)СО-алкил, S-алкил или алкил.
2. Пролекарство в соответствии с пунктом 1, отличающееся тем, что, когда Y - одна или более электроноакцепторные группы, они находятся предпочтительно в орто- и/или параположении по отношению к гликозильному кислороду, и когда Y - одна или более электронодонорные группы, они находятся предпочтительно в метаположении.
3. Пролекарство в соответствии с пунктами 1 или 2, отличающееся тем, что предпочтительные соединения формулы 1 содержат следующие радикалы:
R1, R2 и R3 - это атомы водорода;
R4 - это метоксигруппа;
R5 и R6 - это гидроксильные группы;
R - это -СО-СН3группа, или -СО-СН2OHгруппа;
R7 - это атом водорода или гидроксильная группа;
R8 - это группа -СН2-ОАc, -СН2OН, -СООМе или -СООН;
R10 и R11, которые могут быть идентичными или различными, представляют собой атом водорода или группу Ас;
R12 - это гидроксильная группа или группа ОАс; причем названные радикалы R8, R10, R11 и R12 находятся предпочтительно в следующих положениях:
и
Y - это атом водорода, группа NO2 или атом хлора, находящиеся в пара- или ортоположении по отношению к гликозильному кислороду, и/или группа ОСН3, находящаяся в метаположении к гликозильному кислороду.
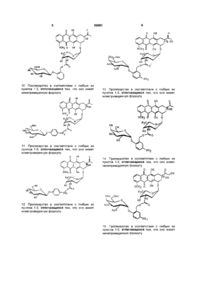
4. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
5. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
6. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
7. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
8. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
9. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
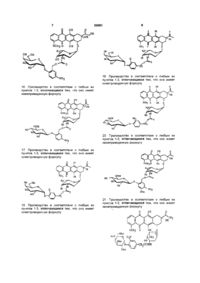
10. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
11. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
12. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
13. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
14. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
15. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
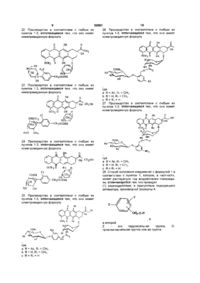
16. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
17. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
18. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
19. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
20. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
21. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
22. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
23. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
24. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
.
25. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
,
где:
а: R = Ac, R1 = СН3,
b: R = Н, R1 = СН3,
с: R = R1 = Н.
26. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
,
где :
a: R = Ac, R1 = CH3,
b: R = H, R1 = CH3,
c: R = R1 = H.
27. Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу:
,
где:
а: R = Ac, R1 = СН3,
b: R = Н, R1 = СН3,
с: R = R1 = Н.
28. Способ получения соединения с формулой 1 в соответствии с пунктом 1, которое, в частности, может распадаться под воздействием гликозидазы, отличающийся тем, что проводят:
(1) взаимодействие, в присутствии подходящего активатора, производной формулы А:
, A
в которой
Z - это гидроксильная группа, O-триалкилзилильная группа или же группа
,
в которой R8, R10, R11 и R12 имеют вышеописанные значения; R' представляет собой одну из следующих групп:
,
,
причем бензильный СН2 находится предпочтительно в пара- или ортоположении по отношению к группе фенола, которую можно модифицировать (гликозилировать или зилилировать); и Y - это атом водорода, или, по меньшей мере, одна электроноакцепторнaя группа, специально отобранная из группы, в состав которой входят группа NO2, атом галогена и группа SO2X (где Х = СН3, С6Н4-CH3, NH2, N-(C1-C4 алкил)2 или NН-С1-С4 aлкил), CN, ацил или СОО-алкил, и/или, по меньшей мере, одна электронодонорная группа, специально отобранная среди группы, в состав которой входят группы типа O-алкил, NH-CO-алкил, N(алкил)СО-алкил, S-алкил или алкил,
с антрациклином, имеющим формулу В:
, B
в которой R1, R2, R3, R4, R5, R6, R7 и R соответствуют вышеупомянутым;
(2) удаление защитных групп, присутствующих в полученных соединениях, преимущественно гидролизом, трансэстерификацией или сапонификацией; и
(3) в случае необходимости, подходящую конденсацию с моносахаридом, имеющим следующую формулу:
,
в том случае, если Z - это гидроксильная группа или O-триалкилзилильная группа, для получения антрациклинового пролекарства с формулой 1, в которой все радикалы от R1 до R12 и R соответствуют вышеупомянутым.
29. Способ в соответствии с пунктом 28, отличающийся тем, что перед выполнением операции (1), гликозилированную р-гидроксибензойную производную получают путем:
(а) сплавления крезола с моносахаридом или переацетилированным метилглюкуронатом,
(б) бензильного бромирования полученного продукта,
(в) сольволиза бромированного производного, и
(г) активации гидроксильной группы с гидроксисукцинимидилом или производным паранитрофеноксикарбонила.
30. Композиция, содержащая модифицированное антрациклиновое пролекарство, полученное в соответствии с любым из пунктов 1-27, и коньюгат фермент/опухоль специфичное антитело с формулой II:
Ab-Sp-E , (II)
в которой
Ab - это антитело или один из его фрагментов, который обладает специфичностью по отношению к антигену, ассоциированному с опухолью, или представляет собой биомолекулу, имеющую тенденцию к накоплению в опухоли, например EGF (фактор роста эпидермиса), -TGF (-трансформирующий фактор роста), PDGF (фактор роста, полученный из тромбоцитов), IGF I+II (инсулиновый фактор роста І+ІІ) или FGF а+b (фактор роста фибробластов а+b);
Е - это глюкозидаза, не обладающая иммуногеничностью или имеющая ее в крайне незначительной степени, предпочтительно, глюкозидаза млекопитающих, такая, как - или -глюкозидаза, -галактозидаза, - или -маннозидаза, -фукозидаза, N-ацетил--галактозаминидаза, N-ацетил--ацетил--глюкозаминидаза или -глюкуронидаза, и
Sp ("ветвь") - это группа, содержащая сульфид или дисульфид, имеющая формулу III или IV:
X'(S)nY' (III) ,
X'(S)n (IV),
или полипептидную "ветвь", в которой X' или Y' - это СО-R13-(N-сукцинимидо) или C(=R14)-CH2-CH2, в которой R13 – это СН2-СН2, 1,4-циклогексилиден, 1,3- или 1,4-фенилен или метоксикарбонильная или хлоро-1,4-фениленовая группы, а R14 - это атом кислорода или группа NH, и
n - 1 или 2,
предназначенная для использования в цитостатической терапии, одновременно, по отдельности или в течение какого-либо периода времени.
31. Способ по п. 28, отличающийся тем; что в качестве промежуточного соединения используют 4-бромометилфенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
32. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-формилфенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
33. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-гидроксиметилфенил 2,3,4,6-тетра-О-ацетил--D-галактопиранозид.
34. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-бромометилфенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
35. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-формилфенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
36. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-гидроксиметилфенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
37. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют метил (4-бромометилфенил 2,3,4-три-O-ацетил--D-глюкопиранозид)уронат.
38. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют метил (4-формилфенил 2,3,4-три-О-ацетил--D-глюкопиранозид)уронат.
39. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют метил (4-гидроксиметилфенил 2,3,4-три-O-ацетил--D-глюкопиранозид)уронат.
40. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют метил (2-бромометилфенил 2,3,4-три-O-ацетил--D-глюкопиранозид)уронат.
41. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют метил (2-гидроксиметилфенил 2,3,4-три-O-ацетил--D-глюкопиранозид)уронат.
42. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют метил (2-формилфенил 2,3,4-три-O-ацетил--D-глюкопиранозид)уронат.
43. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-трет-бутилдиметилзилилоксибензальдегид.
44. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-трет-бутилдиметилзилилоксибензильный спирт.
45. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют N-[2-гидроксибензилоксикарбонил]даунорубицин.
46. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-формилфенил 2,3,4,6-тетра-O-ацетил--D-глюкопиранозид.
47. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-гидроксиметилфенил 2,3,4,6-тетра-O-ацетил--D-глюкопиранозид.
48. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют N-[4-гидроксибензилоксикарбонил]даунорубицин.
49. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-метил-4-нитрофенил 2,3,4,6-тетра-О-ацетил--D-галактопиранозид.
50. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-бромометил-4-нитрофенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
51. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-дибромометил-4-нитрофенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
52. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-формил-4-нитрофенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
53. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-гидроксиметил-4-нитрофенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
54. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют метил (2-формил-4-нитрофенил 2,3,4-три-O-ацетил--D-глюкопиранозид)уронат.
55. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют метил (2-гидроксиметил-4-нитрофенил 2,3,4-три-O-ацетил--D-глюкопиранозид)уронат.
56. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-хлоро-4-метилфенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
57. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-хлоро-4-бромометилфенил 2,3,4,6-тетра-О-ацетил--D-галактопиранозид.
58. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2-хлоро-4-гидроксиметилфенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
59. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют метил (4-формил-2-нитрофенил 2,3,4-три-O-ацетил--D-глюкопиранозид)уронат.
60. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют метил (4-гидроксиметил-2-нитрофенил 2,3,4-три-O-ацетил--D-глюкопиранозид)уронат.
61. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют (4-бромометил-2-нитро)фенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
62. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют (4-гидроксиметил-2-нитро)фенил 2,3,4,6-тетра-O-ацетил--D-галактопиранозид.
63. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-гидрокси-3-хлоробензальдегид 2,3,4-три-O-ацетил--D-метилглюкуронид.
64. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют (4-гидроксиметил-2-хлоро)фенил 2,3,4-три-O-ацетил--D-метилглюкуронид.
65. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2,5-диоксопирролидин-1-ил 4-(2,3,4,6-тетра-O-ацетил--D-галактопиранозил)бензил карбонат.
66. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2,5-диоксопирролидин-1-ил 2-(2,3,4,6-тетра-O-ацетил--D-галактопиранозил)бензил карбонат.
67. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2,5-диоксопирролидин-1-ил 4-(метил(2,3,4-три-O-ацетил--D-глюкопиранозил)уронат)бензил карбонат.
68. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-нитрофенил 2-(метил(2,3,4-три-О-ацетил--D-глюкопиранозил)уронат)бензил карбонат.
69. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-нитрофенил 2-(трет-бутилдиметилзилилокси)бензил карбонат.
70. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2,5-диоксопирролидин-1-ил 4-(2,3,4,6-тетра-O-ацетил--D-глюкопиранозил)бензил карбонат.
71. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 2,5-диоксопирролидин-1-ил 4-диметил-t-гексилзилилоксибензил карбонат.
72. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-нитрофенил 2-(2,3,4,6-тетра-O-ацетил--D-галактопиранозил)-5-нитробензил карбонат.
73. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-нитрофенил 2-(метил(2,3,4-три-O-ацетил--D-глюкопиранозил)уронат)-5-нитробензил карбонат.
74. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-нитрофенил 4-метокси-5-нитро-2-(метил(2,3,4-три-O-ацетил--D-глюкопиранозил)уронат)бензил карбонат.
75. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-нитрофенил 4-(метил(2,3,4-три-O-ацетил--глюкопиранозил)уронат)-5-нитробензил карбонат.
76. Способ по п. 28, отличающийся тем, что в качестве промежуточного соединения используют 4-хлорофенил 2-(метил(2,3,4-три-О-ацетил--D-глюкопиранозил)уронат)-5-нитробензил карбонат.
Текст
1 Антрациклиновое пролекарство, имеющее нижеприведенную формулу (I) в которой R-i, R2 и R3, могут быть идентичными или различными, представляют собой атом водорода или гидроксильную группу, R4 - это атом водорода, гидроксильная группа или метоксигруппа, R - это группа -CO-Cbh-R", в которой R" - это атом водорода, Ci-Сбэлкилгруппа, гидроксильная группа, алкоксигруппа, О-ацил или арилгруппа, Rs и R6, могут быть идентичными или различными, представляют собой атом водорода или гидроксильную группу, R7 представляет собой атом водорода или гидроксильную группу, Rs представляет группу -CH2-OR9 или -COORg, где Rg - это алкилС-і-Сз, атом водорода или ацетил группа, R-іо и Rn представляют собой атом водорода, ацилзащитную группу или алкилгруппу, R-I2 - это гидроксильная группа, аминовая группа, амидная группа или О-ацил защитная группа, СЬІ2 бензильный находится предпочтительно в пара- или ортоположении по отношению к гликозильному кислороду, и Y - это атом водорода, или, по меньшей мере, одна электроноакцепторная группа, выбранная преимущественно из группы, содержащей группу NO2, атом галогена и группу SO2X (где X = СНз, С6Н4-СН3, NH2, ІЧ-(алкил СгС 4 )2, или ІЧЬЦалкил С1-С4), CN, ацил или СОО-алкил, и/или, по меньшей мере, одну электронодонорную группу, выбранную из группы, состоящей из групп типа Оалкил, NHCO-алкил, І\І(алкил)СО-алкил, S-алкил или ал кил 2 Пролекарство в соответствии с пунктом 1, отличающееся тем, что, когда Y - одна или более электроноакцепторные группы, они находятся предпочтительно в орто- и/или параположении по отношению к гликозильному кислороду, и когда Y одна или более электронодонорные группы, они находятся предпочтительно в метаположении 3 Пролекарство в соответствии с пунктами 1 или 2, отличающееся тем, что предпочтительные соединения формулы 1 содержат следующие радикалы R-i, R2 и R3 - это атомы водорода, R4 - это метоксигруппа, Rs и R6 - это гидроксильные группы, R - это -СО-СНзгруппа, или -СО-СЬЬОНгруппа, R7- это атом водорода или гидроксильная группа, R8 - это группа -СН2-ОАс, -СН2ОН, -СООМе или СООН, R-іо и Rn, которые могут быть идентичными или различными, представляют собой атом водорода или группу Ас, О 00 о> (О ю З 56981 R-I2 - это гидроксилыная группа или группа ОАс, причем названные радикалы Rs, R10, Rn и R12 находятся предпочтительно в следующих положениях P*VOAC Y - это атом водорода, группа NO2 или атом хлора, находящиеся в пара- или ортоположении по отношению к гликозильному кислороду, и/или группа ОСНз, находящаяся в метаположении к гликозильному кислороду 4 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу Р Acq I 7 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу он ОЙС 5 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 8 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 9 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 6 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 56981 10 Пролекарство в соответствии с любым из пунісгов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу он 13 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу о oiw4 б он о би о йсО 11 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 14 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу о он 12 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 15 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 56981 о он он с % 16 Пролекарство в соответствии с любым из пунісгов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 19 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу о он о оси 3 о но ш CG OH сота ^V^—-a но он о G—f \—СЙ НО 20 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 17 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу ОМе 18 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 21 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу о 0АС ) }=\ О ( —V ОАс он нс • /У-ОЦССОИ 56981 22 Пролекарство в соответствии с любым из пунісгов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу 10 26 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу Р тьосши он RO 23 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу о он сн 7 он где a R = Ac, Ri = СНз, b R= H, Ri = СН3, с R = Ri = Н 27 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу О АсО ОЛс 24 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу о он RO о он сн2он где a R = Ac, Ri = СНз, b R= H, Ri = СН3, с R = Ri = Н 28 Способ получения соединения с формулой 1 в соответствии с пунктом 1, которое, в частности, может распадаться под воздействием гликозидазы, отличающийся тем, что проводят (1) взаимодействие, в присутствии подходящего активатора, производной формулы А 25 Пролекарство в соответствии с любым из пунктов 1-3, отличающееся тем, что оно имеет нижеприведенную формулу о он CH2-O-R' ОЩ О н39 CO DR где a R = Ac, Ri = СНз, b R= H, Ri = СН3, с R = Ri = Н О Н n в которой гидроксильная группа, Z это триалкилзилильная группа или же группа О 56981 11 12 (3) в случае необходимости, подходящую конденсацию с моносахаридом, имеющим следующую формулу R10O в которой Rs, R-іо, R11 и R12 имеют вышеописанные значения, R' представляет собой одну из следующих групп причем бензильный СЬІ2 находится предпочтительно в пара- или ортоположении по отношению к группе фенола, которую можно модифицировать (гликозилировать или зилилировать), и Y - это атом водорода, или, по меньшей мере, одна электроноакцепторная группа, специально отобранная из группы, в состав которой входят группа NO2, атом галогена и группа SO2X (где X = СНз, СєН4СНз, NH2, N-(Ci-C4 алкил)2 или NH-C1-C4 алкил), CN, ацил или СОО-алкил, и/или, по меньшей мере, одна электронодонорная группа, специально отобранная среди группы, в состав которой входят группы типа О-алкил, NH-CO-алкил, І\І(алкил)СОалкил, S-алкил или алкил, с антрациклином, имеющим формулу В юг, В в которой R-i, R2, R3, R4, R5, R6, R7 и R соответствуют вышеупомянутым, (2) удаление защитных групп, присутствующих в полученных соединениях, преимущественно гидролизом, трансэстерификацией или сапонификацией, и в том случае, если Z - это гидроксильная группа или О-триалкилзилильная группа, для получения антрациклинового пролекарства с формулой 1, в которой все радикалы от Ri до R12 и R соответствуют вышеупомянутым 29 Способ в соответствии с пунктом 28, отличающийся тем, что перед выполнением операции (1), гликозилированную р-гидроксибензойную производную получают путем (а) сплавления крезола с моносахаридом или переацетил ированным метил глюкуронатом, (б) бензильного бромирования полученного продукта, (в) сольволиза бромированного производного, и (г) активации гидроксильной группы с гидроксисукцинимидилом или производным паранитрофеноксикарбонила 30 Композиция, содержащая модифицированное антрациклиновое пролекарство, полученное в соответствии с любым из пунктов 1-27, и коньюгат фермент/опухоль специфичное антитело с формулой II Ab-Sp-E, (II) в которой АЬ - это антитело или один из его фрагментов, который обладает специфичностью по отношению к антигену, ассоциированному с опухолью, или представляет собой биомолекулу, имеющую тенденцию к накоплению в опухоли, например EGF (фактор роста эпидермиса), a -TGF (а трансформирующий фактор роста), PDGF (фактор роста, полученный из тромбоцитов), IGF I+II (инсулиновый фактор роста I+II) или FGF а+Ь (фактор роста фибробластов а+Ь), Е - это глюкозидаза, не обладающая иммуногеничностью или имеющая ее в крайне незначительной степени, предпочтительно, глюкозидаза млекопитающих, такая, как а - или рглюкозидаза, а -галактоз ид аза, а - или рманнозидаза, а -фукозидаза, N-ацетил- а галактозаминидаза, N-ацетил- р-ацетил- а глюкозаминидаза или р-глюкуронидаза, и Sp ("ветвь") - это группа, содержащая сульфид или дисульфид, имеющая формулу III или IV X'(S) n r (III), X'(S)n (IV), или полипептидную "ветвь", в которой X' или Y' ЭТО СО^із-(г\І-СуКЦИНИМИДО) ИЛИ C(=Ri4)-CH2-CH2, в которой R-із - это СН2-СН2, 1,4-циклогексилиден, 1,3- или 1,4-фенилен или метоксикарбонильная или хлоро-1,4-фениленовая группы, a Rn - это атом кислорода или группа NH, и п -1 или 2, 56981 14 13 47 Способ по п 28, отличающийся тем, что в предназначенная для использования в цитостатикачестве промежуточного соединения используют ческой терапии, одновременно, по отдельности 4-гидроксиметилфенил 2,3,4,6-тетра-О-ацетил- рили в течение какого-либо периода времени D-глюкопиранозид 31 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют 48 Способ по п 28, отличающийся тем, что в 4-бромометилфенил 2,3,4,6-тетра-О-ацетил- a -Dкачестве промежуточного соединения используют галактопиранозид |\|-[4-гидроксибензилоксикарбонил]даунорубицин 32 Способ по п 28, отличающийся тем, что в 49 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют 4-формилфенил 2,3,4,6-тетра-О-ацетил- a -D2-метил-4-нитрофенил 2,3,4,6-тетра-О-ацетил- а галактопиранозид D-галактопиранозид 33 Способ по п 28, отличающийся тем, что в 50 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют 4-гидроксиметилфенил 2,3,4,6-тетра-О-ацетил-а 2-бромометил-4-нитрофенил 2,3,4,6-тетра-ОD-галактопиранозид ацетил-а -D-галактопиранозид 34 Способ по п 28, отличающийся тем, что в 51 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют 2-бромометилфенил 2,3,4,6-тетра-О-ацетил- a -D2-дибромометил-4-нитрофенил 2,3,4,6-тетра-Огалактопиранозид ацетил-а -D-галактопиранозид 35 Способ по п 28, отличающийся тем, что в 52 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют 2-формилфенил 2,3,4,6-тетра-О-ацетил- a -D2-формил-4-нитрофенил 2,3,4,6-тетра-О-ацетилгалактопиранозид а -D-галактопиранозид 36 Способ по п 28, отличающийся тем, что в 53 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют 2-гидроксиметилфенил 2,3,4,6-тетра-О-ацетил-а 2-гидроксиметил-4-нитрофенил 2,3,4,6-тетра-ОD-галактопиранозид ацетил-а -D-галактопиранозид 37 Способ по п 28, отличающийся тем, что в 54 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют метил (4-бромометилфенил 2,3,4-три-О-ацетил-рметил (2-формил-4-нитрофенил 2,3,4-три-Оацетил- р-О-глюкопиранозид)уронат О-глюкопиранозид)уронат 38 Способ по п 28, отличающийся тем, что в 55 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют метил (4-формилфенил 2,3,4-три-О-ацетил- p-Dметил (2-гидроксиметил-4-нитрофенил 2,3,4-триО-ацетил- р-О-глюкопиранозид)уронат глюкопиранозид)уронат 39 Способ по п 28, отличающийся тем, что в 56 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют метил (4-гидроксиметилфенил 2,3,4-три-О-ацетил2-хлоро-4-метилфенил 2,3,4,6-тетра-О-ацетил-а Р-О-глюкопиранозид)уронат D-галактопиранозид 40 Способ по п 28, отличающийся тем, что в 57 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют 2-хлоро-4-бромометилфенил 2,3,4,6-тетра-Ометил (2-бромометилфенил 2,3,4-три-О-ацетил-рацетил-а -D-галактопиранозид О-глюкопиранозид)уронат 58 Способ по п 28, отличающийся тем, что в 41 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют 2-хлоро-4-гидроксиметилфенил 2,3,4,6-тетра-Ометил (2-гидроксиметилфенил 2,3,4-три-О-ацетилацетил-а -D-галактопиранозид Р-О-глюкопиранозид)уронат 59 Способ по п 28, отличающийся тем, что в 42 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют метил (4-формил-2-нитрофенил 2,3,4-три-Ометил (2-формилфенил 2,3,4-три-О-ацетил- p-Dацетил- р-О-глюкопиранозид)уронат глюкопиранозид)уронат 60 Способ по п 28, отличающийся тем, что в 43 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют метил (4-гидроксиметил-2-нитрофенил 2,3,4-три2-трет-бутилдиметилзилилоксибензальдегид О-ацетил- р-О-глюкопиранозид)уронат 44 Способ по п 28, отличающийся тем, что в 61 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют 2-трет-бутилдиметилзилилоксибензильный спирт (4-бромометил-2-нитро)фенил 2,3,4,6-тетра-О45 Способ по п 28, отличающийся тем, что в ацетил-а -D-галактопиранозид качестве промежуточного соединения используют |\|-[2-гидроксибензилоксикарбонил]даунорубицин 62 Способ по п 28, отличающийся тем, что в 46 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют качестве промежуточного соединения используют (4-гидроксиметил-2-нитро)фенил 2,3,4,6-тетра-О4-формилфенил 2,3,4,6-тетра-О-ацетил- p-Dацетил-а -D-галактопиранозид глюкопиранозид 56981 16 15 63 Способ по п 28, отличающийся тем, что в 2,5-диоксопирролидин-1-ил 4-(2,3,4,6-тетра-Окачестве промежуточного соединения используют ацетил-р-О-глюкопиранозил)бензил карбонат 4-гидрокси-З-хлоробензальдегид 2,3,4-три-О71 Способ по п 28, отличающийся тем, что в ацетил-р-О-метилглюкуронид качестве промежуточного соединения используют 64 Способ по п 28, отличающийся тем, что в 2,5-диоксопирролидин-1-ил 4-диметил-1> качестве промежуточного соединения используют гексилзилилоксибензил карбонат (4-гидроксиметил-2-хлоро)фенил 2,3,4-три-О72 Способ по п 28, отличающийся тем, что в ацетил-р-О-метилглюкуронид качестве промежуточного соединения используют 4-нитрофенил 2-(2,3,4,6-тетра-О-ацетил- a -D65 Способ по п 28, отличающийся тем, что в галактопиранозил)-5-нитробензил карбонат качестве промежуточного соединения используют 73 Способ по п 28, отличающийся тем, что в 2,5-диоксопирролидин-1-ил 4-(2,3,4,6-тетра-Окачестве промежуточного соединения используют ацетил-а -О-галактопиранозил)бензил карбонат 4-нитрофенил 2-(метил(2,3,4-три-О-ацетил- p-D66 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют глюкопиранозил)уронат)-5-нитробензил карбонат 2,5-диоксопирролидин-1-ил 2-(2,3,4,6-тетра-О74 Способ по п 28, отличающийся тем, что в ацетил-а -О-галактопиранозил)бензил карбонат качестве промежуточного соединения используют 67 Способ по п 28, отличающийся тем, что в 4-нитрофенил 4-метокси-5-нитро-2-(метил (2,3,4качестве промежуточного соединения используют три-О-ацетил- р-О-глюкопиранозил)уронат)бензил 2,5-диоксопирролидин-1-ил 4-(метил(2,3,4-три-Окарбонат ацетил-р-О-глюкопиранозил)уронат)бензил кар75 Способ по п 28, отличающийся тем, что в бонат качестве промежуточного соединения используют 68 Способ по п 28, отличающийся тем, что в 4-нитрофенил 4-(метил(2,3,4-три-О-ацетил- ркачестве промежуточного соединения используют глюкопиранозил)уронат)-5-нитробензил карбонат 4-нитрофенил 2-(метил(2,3,4-три-О-ацетил- p-D76 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют глюкопиранозил)уронат)бензил карбонат 4-хлорофенил 2-(метил(2,3,4-три-О-ацетил- p-D69 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют глюкопиранозил)уронат)-5-нитробензил карбонат 4-нитрофенил 2-(третбутилдиметилзилилокси)бензил карбонат 70 Способ по п 28, отличающийся тем, что в качестве промежуточного соединения используют Изобретение касается гликозилированных пролекарств, способа их получения и использования, в отдельности или в сочетании с опухольспецифичными коньюгатами, в частности, для лечения рака, и может быть использовано для получения лекарств, предназначенных для лечения заболеваний, затрагивающих активированные макрофаги, гранулоциты, тромбоциты или опухолевые клетки человека Более конкретно, данное изобретение касается пролекарств, в состав которых входят модифицированные антрациклины, которые могут расщепляться, в частности, под воздействием названных опухоль-специфичных иммуноферментных коньюгатов, и образовывать цитотоксические вещества, действующие на опухолевые клетки Комбинация пролекарства с коньюгатами фермент/моноклональные антитела в качестве лекарственного препарата уже было описано в литературе В общем, рассматриваемые антитела, действующие на видовую ткань, и ковалентне связанные с ферментом, способным расщеплять пролекарство, сначала вводятся соответствующему животному, и, в особенности, человеку, после чего производится введение пролекарства, которое и может активироваться ферментом Пролекарство преобразуется в цитотоксин под воздействием коньюгата фермент/антитело, при крепленного к определенной ткани, и цитотоксин оказывает цитотоксическое действие на названную ткань В заявке на международный патент WO 81/01145, поданной от имени Фонда университета штата Иллинойс (University of Illinois Foundation), описываются пролекарства, которые могут активироваться гидролитическими пролекарствами, и даются пять критериев наибольшей эффективности пролекарства (1) в области опухоли должно присутствовать достаточное количество активирующего фермента, необходимого для выделения цитотоксических уровней антиопухолевого агента в области опухоли, (2) пролекарство не должно активироваться в других областях, помимо области опухоли, (3) пролекарство должно представлять собой подходящий субстрат для фермента, ассоциированного с опухолью, при физиологических условиях, (4) пролекарство должно быть нетоксичным или значительно менее токсичным по сравнению с активируемым антиопухолевым агентом, и (5) у активируемого вещества должен быть короткий период биологического полураспада, так чтобы токсические эффекты сосредоточились только в опухоли Более подробно, в упомянутой патентной заявке содержится заявление о том, что антиопухолевым агентам можно придать специфичность к опухоли путем добавления пептида, который пре 56981 18 17 вратит данный агент в пролекарство, остающееся ткани, расщепляет пролекарство, образуя цитофармакологически неактивным, но которое можно токсическое активное соединение Если говорить избирательно активировать только на участке более определенно, в коньюгатах феропухоли с помощью фермента, который в больших мент/антитело содержатся алкалинфосфатаза количествах присутствует в зоне опухоли (актива(АФ), амидаза пенициллина V (AF1V), или цитозинторы плазмин и плазминоген) Последовательдеаминаза (ЦД), и которые используются в соченость аминокислот на пептидном участке пролетании с 4'-фосфатэтопозидом и его производными карства такова, что она претерпит (или 7-(2-аминоэтилфосфат)митомицин), с N-(pферментативное расщепление со стороны антигидроксифеноксиацетил)адриамицином, или с 5опухолевого агента, вызванное такими протеазафтороцитозином, соответственно, в качестве проми, как активаторы плазмин или плазминоген, лекарства обеспечивая выход антиопухолевого агента в акОднако у системы в вышеупомянутой патенттивной форме в область опухоли ной заявке имеется недостаток, который заключается в том, что в ней используется либо циркулиПролекарства, которые могут активироваться рующий фермент, а именно алкалинфосфатаза, гидролитическими ферментами, могут иметь способная активировать пролекарство на ранней структуру, в которой пептидная и а нти опухолевая стадии циркуляции, либо экзогенный фермент, части ковалентне связаны посредством соединикоторый способен усиливать феномен интолетельного звена, структура которого такова, что рантности (нетерпимости) или сенситизации ферментативное расщепление пептида со стороны соединительного звена немедленно приведет к В международной патентной заявке WO разрушению его связи с антиопухолевой частью 90/07929 заявителя AKZO NV, описывается способ активации пролекарства на специфичных учаОднако, пролекарства, описанные в упомянустках in vivo у животного с использованием коньютой заявке на международной патент, могут быть гата активатора и мишень-специфичного использованы только для лечения рака, при котовещества, причем "активаторная" часть дает возром наблюдается усиленное образование ферможность пролекарству превратиться в фармакоментов, а именно, протеаз, на участке опухоли, логически активное вещество В качестве активакроме того, эти активирующие 'ферменты, способтора должен выступать фермент человеческого ные расщеплять пролекарство, описанное в упопроисхождения, например, лизозим, который или мянутой заявке, не обнаруживаются в достаточполностью отсутствует в системе кровообращеном количестве у заболевшего раком человека, ния, или же присутствует в очень небольших копоэтому эти пролекарства не обеспечивают треличествах, и естественные (природные) субстраты буемую избирательную токсичность (К D Bagкоторого также отсутствуют в системе кровообраshawe, Br J Cancer, 1987, 56, 531) щения или на поверхности "клеток - не мишеней" В заявке на международный патент WO Мишень-специфичное вещество представляет 88/07378, поданной от имени CANCER REсобой антитело, действующее против опухольSEARCH CAMPAIGN TECHNOLOGY LTD , описыспецифичного (т е специфичного для опухоли) вается терапевтическая система, содержащая и антигена В частности, в состав пролекарства моконьюгат фермент/антитело, и пролекарство, кожет входить антрациклин (например, доксорубиторое может активироваться ферментом Антитецин), модифицированный олигомером хитина, ло в коньюгате фермент/антитело распознает связанным с антрациклином через посредство опухоль-специфичный антиген, и фермент приобаминогруппы на карбониле Сіз антрациклина или ретает способность 'превратить пролекарство в же на гликозилированной его части цитотоксичный агент ч Упомянутая патентная заявка утверждает, что предпочтительнее использовать ферменты, полученные не от млекопитающих, с целью предотвращения преждевременного высвобождения цитотоксичного агента, вызываемого эндогенными ферментами Более определенно, в данной патентной заявке описываются модифицированные азотные горчицы, такие, как р-бис-^(2-хлороэтил)аминобензилглютаминовая кислота и ее производные, которые могут превращаться в азотные горчицы в присутствии карбоксипептидаз, и антрациклины, у которых концевая аминогруппа превращается в амид в присутствии аминокислоты Однако у этих пролекарств есть существенный недостаток, который заключается в том, что они сохраняют свою значительную цитотоксичность В заявке на европейский патент 302 473 также дано описание лечебной системы, включающей два компонента, в которых коньюгат фермент/антитело, расположенный на опухолевой Однако, у системы, предлагаемой в вышеупомянутой международной патентной заявке, имеется один недостаток, а именно в ней происходит выход не собственно доксорубицина, а его производной - Dox-/GlcNAc)i или Dox-(GlcNAc)s, с одной стороны, это уже не пролекарство, строго говоря, а с другой стороны, что касается этих производных, то здесь мы сталкиваемся с нехваткой как фармакологических, так и токсикологических данных Из вышеприведенного со всей очевидностью следует, что основными недостатками упомянутых систем являются 1) что касается выбора ферментов - нежелательное расщепление пролекарства (циркулирующий, т е участвующий в кровообращении фермент), - расщепление пролекарства, ассоциированное с образованием большого количества фермента на участке опухоли, и - применение экзогенных ферментов, спосэбных усиливаїь явления янтолерантности или сенеитизации, и 56981 20 19 2) что касается выбора пролекарства орто-положении к группе гликозила, и - присущая собственно пролекарству цитотокY это атом водорода, или, по меньшей мерс, сичность, привлекающая электроны группа, выбранная преимущественно из группы, состоящей из группы - образование производных антрациклина, N02, атома галогена и группы SO2X (где Х= -СНз, фармакологическое и токсическое действия котоС8Н4-СН3, NH2, N-(Ci-C4 алкила)2 или NH-C1-C4 рых недостаточно хорошо известны, и алкила), -CN, ацш а или СОО-алкила, и/или по - применение пролекарства, имеющего два меньшей мере, одной электрон-передающей групотделения (субстрат для фермента + цитотоксипы, выбранной из группы, содержащей группы ческий агент), которое усиливает стерическую типа О-алкил, NHCO-алкил, І\І(алкил)СО-алкил, S(пространственную) или электронную интерфеалкила или алкила ренцию с реакцией расщепления фермента Заявитель поставил задачу создания пролеВ данном изобретении под группами алкила и карств, способных к превращению в фармаколоацила подразумеваются группы, имеющие в своем гически активные вещества в присутствии соотсоставе от одного до шести атомов углерода ветствующего ферментативного коньюгата, В соответствии с одним из преимущественных которое бы отвечало практическим требованиям вариантов осуществления изобретения, когда Y лучше, чем ныне существующие пролекарства, в представляет собой одну или более привлекаютом, чтобы они были устойчивыми, и в том, чтобы щую электроны группу, они находятся предпочтиони не усиливали стерическую или электронную тельно в орто- или пара-положении по отношению интерференцию во время реакции расщепления к гликозильному кислороду, а когда Y - одна или фермента, а также, чтобы они образовывали акболее отдающая электроны группа, последние тивное цитотоксическое вещество только на учанаходятся в предпочтительно мета-положении стке опухоли В соответствии с изобретением Данное изобретение касается антрапиклино- когда бензил СЬЬ находится в ортовых пролекарств, характеризующихся тем, что они положении по отношению к названному гликоимеют нижеприведенную формулу I зильному кислороду, Y находится в паран. положении и представляет собой атом водорода или электрон-привлекающую группу, и/или находится в мета-положении и представляет собой атом водорода или электрон-огдающую группу, - когда бензил СЬЬ находится в параположении, Y наводится в орто-положении и представляет собой атом водорода или же электрон-привлекающую группу, и/или находится в мета-положении и представляет собой атом водорода или же электрон-отдающую группу Таким образом, получают пара- или ортогидроксибензилкарбаматные производные антрациклина, у которых группа фенола скрыта, и которые, как оказалось, способны расщепляться в фармакологически активный цитотоксичный ан.OR. y / ~ ^ 4 трациклин и моносахарид как при гликозидазовых —' конъюгатах, так и при гликозидаза/опухоль спеY L i цифичных лигандных конъюгатах, и которые можв которой но отличить от соединений, описанных в заявке на R-i, F 2 и R3, которые могут быть идентичными ? европейский патент №0410366 или различаться, представляют собой Составы соединений с формулой 1, согласно атом водорода или гидроксильную группу, изобретению, включают их различные изомеры F 4 - атом водорода, гидроксильная группа или ? В соответствии с изобретением, атрациклинометокси-группа, вые пролекарства, имеющие 3 отделения, т е R - это группа CO-CH2-R", в которой R" - это состоящие из антрациклина, саморазрушающейся атом водорода, алкил-группа С-і-Сє, гидроксильная ветви (пара- или ортобензилкарбамата), и фергруппа, алкокси-группа, О-ацильная группа или ментативного субстрата (моносахарида), имеют арил-группа, следующие преимущества Rs и R6, которые могут быть идентичными или - они предупреждают вероятность нераспоразличными, представляют собой атомы водорознавания фермента/субстрата, да или гидроксильную группу, - они позволяют избежать проблемы стеричеR7 - это атом водорода или гидроксильная ской или электронной интерференции во время группа, реакции расщепления фермента, и Rs - это группа -CH2-OR9 или группа COORg, - соединение между аминогруппой сахара и Огде Rg - это алкил С-і-Сз, атом водорода или ацегетеросидичным связующим веществом позволяет тил-группа, осуществиться ферментативной "атаке" и, в то же R-іо и Rn - это атомы водорода, ацилвремя, обеспечивает молекулу с достаточным защитная группа или алкил-группа, объемом для существенного уменьшения цитоR-I2 - это гидроксильная группа, аминогруппа, токсичности пролекарства амидогруппа или О-ацил-защитная группа, бензил-СНг предпочтительно находится в пара- или Преимущественно, как уже отмечалось выше, 21 промежуточная ветвь является предпочтительно пара- или орто-гидроксибензил карбаматом, и выход активного антрациклина из пролекарства с 3 отделениями определяется двумя процессами 1) степенью ферментативного гидролиза, и 2) степенью расщепления саморазрушающейся ветви, которые, в сущности, взаимосвязаны, поскольку вышеназванная саморазрушающаяся ветвь оказывает огромное влияние и на степень ферментативного гидролиза, и на степень его расщепления (см приведенную ниже схему А) 56981 22 (А) в котором Z - это гидроксильная группа, или О - триалкилсилильная группа или группа R10 Sniyme В соответствии со следующим преимущественным вариантом выполнения предпочтительные соединения формулы I содержат следующие радикалы R-i, R2 и R3 являются атомами водорода, R4 - это метокси-группа, Rs и R6 - гидроксильные группы, R - это -СО-СНз группа или -СО-СН2ОН группа, R7 - это атом водорода или гидроксильная группа, R8 - это -СН2-ОАс, -СН2ОН, -СООМе или СООН группа, R-іо и Rn, которые могут быть идентичными или различными, представляют собой атомы водорода или Ас-группу, R-I2 - это гидроксильная группа или ОАсгруппа, причем, вышеназванные радикалы Rs, R10, Rn и R-I2 предпочтительно находятся в следующих положениях и Y представляет собой атом водорода, группу NO2 или атом хлора в пара- или орто-позиции по отношению к гликозильному кислороду, и/или группа ОСНз находится в мета- позиции по отношению к гликозильному кислороду Настоящее изобретение касается способа получения соединения с вышеуказанной формулой I, которое может распадаться на гликозидазу, и характеризующегося тем, что он включает 1) соединение, при необходимости в присутствии соответствующего стимулятора, производной с формулой А R 0 0 R L 1 R12 в которой R6, R-іо, Rn и R-I2 имеют значения как описано выше, R представляет одну из следующих групп о бензил -СН2 находится предпочтительно в пара- или отро-позиции по отношению к группе фенола, которую можно модифицировать (гликозилировать или силилировать), и Y - это атом водорода, или, по меньшей мере, одна электрон-привлекающая группа, выбранная преимущественно из группы, содержащей группу N02, атом галогена и группу SO2X (где Х= -СНз, Сє -Н4-СН3, NH2, N-(d-C4anKHn)2 или NH-C r C 4 алкил), -CN, ацил или СОО-алкил, и/или, по меньшей мере, одна из электрон-отдающих групп, выбранная из группы, содержащей группы типа О-алкил, N Н-СО -ал кил, N (ал кил)СО-ал кил, S-ал кил ил и алкил, с антрациклином формулы В (В) где R-і, R2, R3, R4, R5, R6, R7 и R представляют собой вышеописанные соединения, 2) удаление защитных групп, присутствующих в получаемых соединениях, преимущественно по способу гидролиза, трансэстерификации или сапонификации, и 3) при необходимости, подходящую конденсацию с моносахаридом, имеющим следующую 23 24 56981 формулу а10 о 42 в случае, если Z - это гидроксильная группа или О-триалкилсилильная группа, для получения антрациклинового пролекарства с формулой І, в которой все радикалы от Ri, до R12 и R соответствуют описанным выше Если Z является О-триалкилзилильной группой, она преимущественно десилируется фтористым тетрабутиламмиаком, например, перед конденсацией с моносахаридом В соответствии с еще одним преимущественным вариантом выполнения данного изобретения соединение с формулой А представляет собой гликозилированную гидроксибензильную производную с формулой Ai оі*Ч У"1 ч R10 О О / V Л СХЕМА В ,СН2 - 0 - R (Ai) В которой Rs, R-іо, R11, R12, R' и Y соответствуют описанным выше соединениям, что дает, после соединения с антрациклином с формулой В, антрациклиновое пролекарство с формулой I как описано выше, в соответствии со схемами I, II, III, IV, VI, X, XI, XIV, XV и XVI, приведенными ниже U ю 56981 25 'Ой И 1) II II L J U СХЕМА Ш УГ СХЕМА Ш В 27 56981 28 •sї a:¥a; n и us te СХЕМА JV /З U U СХЇ;МЛ Х! СХЕМА Vi U 29 ЗО 56981 СХЕМА XIV CXCWA XIV DC D U C J O A B N T S B C TI i C R O A S M f ООЖЖОВІСШ LE PIOUVEiBSTBiASE СХЕМА XVI 56981 32 лой А представляет собой зилилированную производную с формулой Аг ас я: I I I I СП - о (Аз) где R' - вышеописанное соединение, a Z - это Одиметилтексилзил ильная группа или 0-третбутилд и метил зил ильная группа, которая дает, после соединения с антрациклином формулы В и конденсированием с подходящим моносахаридом, антрациклиновое пролекарство с формулой I как описано выше, в соответствии со схемами V и YII, которые описывают способ получения зилилированных производных перед их конденсированием с подходящим моносахаридом єно rD S B M' [—29 RH » L J O СХЕМА XVI В соответствии с одним преимущественным получением этого варианта выполнения, перед стадией (I), получают гликозилированную ргидроксибензильную производную путем а) слияния крезола с моносахаридом или парацетилированным метил-глюкуронатом, 0) бензильного бромирования полученного продукта, в) сольволиза бромированнои производной, и г) активации гидроксильной группы производной гидроксисакцинимидилом или паранитрофеноксикарбонилом В соответствии со следующим вариантом выполнения данного способа, соединение с форму CXEMAV к 33 56981 СХЕМА VIII «3,5 СХЬМА Vli Согласно еще одному способу реализации описанного в данном изобретении способа, соединение с формулой А представляет собой гликозилированную ортогидроксибензильную производную с формулой Аз 51 RC O =H 52 R HO - 2H C O H0 C j НО C O! OR І (Аз) где Rs, R-іо, R11, R12 и R' - вышеописанные соединения, Y находится в пара-позиции и представляет собой группу NO2 или атом галогена, а в мета-позиции и является атомом водорода или метокси-группой, которая дает, после соединения с антрацикллином с формулой В, антрациклиновое пролекарство с формулой I как описано выше, в которой бензил СЬІ2 находится в орто-позиции по отношению к гликозильному кислороду в соответствии со схемами VIII, IX, XII и XIII, приведенными ниже СХЕМА ІХ I I O < H l і 5ia R-Ac Е.|«СНа 35 56981 к = До к, е си. СХЕМА XII - со - 0 _// а * сне 31 О R0 L к 03 0 Е = So R, - ОН, В2е Я • R, * 8 1 СН 3 СХЕМА ХШ Настоящее изобретение относится также к продуктам, в состав которых входят антрациклиновое пролекарство в соответствии с изобретением, и коньюгат фермент/опухоль-специфичное антитело с формулой II, Ab-Sp-E, в котором АЬ - это антитело или один из его фрагментов, 36 обладающий специфичностью по отношению к антигену, ассоциированному с опухолью, или же представляет собой биомолекулу, имеющую тенденцию к накоплению в опухоли, такую, как EGF (фактор роста эпидермиса), a-TGF (aтрансформирующий фактор роста), PDGF (фактор роста, полученный из тромбоцитов), IGFI+П (инсулиноподобный фактор роста I+II) или FGF а+Ь (фактор роста фибробластов а+Ь), Е - это глюкозидаза, которая либо не иммуногенична, либо крайне мало иммуногенична, предпочтительно - глюкозидаза млекопитающих, такая, как а- или р-глюкозидаза, а-галактоз ид аза, а- или р-маннозидаза, а-фукозидаза, N-ацетил-агалактозаминидаза, N-ацетил-р- и N-ацетил-аглюкозаминидаза или р -глюкуронидаза, и Sp (ветвь) представляет собой группу, содержащую сульфид или дисульфид, с формулой Щ или IV X'(S)nY (III) X'(S)n (IV) или полипептидная ветвь, в которой Xі ИЛИ Y - это -СО^із-(г\І-сукцинимидо)- или C(=Ri4)-CH2-CH2-, где R13 - это - СН2-СН2, 1,4- циклогексилиден, 1,3- или 1,4-фенилен или метоксикарбонил- или хлоро-1, 4-фениленовая группы, и RM - атом кислорода или группа NH, а также Y - это -C(=Ru)-CH2-CH2, где Rn имеет значения, описанные выше, а п равно 1 или 2, для использования при цитостатической терапии одновременно, отдельно или равномерно в течение какого-либо промежутка времени В соответствии с изобретением, и антрациклиновое пролекарство, и коньюгат фермент/антитело, могут быть ассоциированы, по крайней мере, с одним фармацевтически приемлемым наполнителем Такой коньюгат фермент/антитело более подробно описан в немецкой патентной заявке 39 35016 9, поданной от имени BOEHRING Соединение между ферментом и антителом, фрагментом антитела или биомолекулой осуществляют с помощью способа, описанного в литературе (А Н Blair and T I Ghose, Immunology Methods, 1983, 59, 129-143, T I Ghose at al , Methods in Enzymol , 1983, 19, 280-333) При этом происходит первоначальная функционализация фермента посредством его аминогруппы с применением сукцинимидила Nмалеимидо-алкилидена, - циклоалкилидена -, или -арилен-1-карбоксилата, у которых двойная связь малеимидной группы вступает в реакцию с HSгруппой функционал изированного антитела, фрагментом антитела или биомолекулой, с последующим образованием тиоэфирной группы Коньюгаты антитело/фермент можно готовить с использованием моноклональных антител, описанных в европейской патентной заявке 141 079, предпочтительно, антител 431/26, 250/183, 704/152 и 494/32 Специфичность этих антител к антигенам, ассоциированным с опухолями, уже была продемонстрирована на животных и человеке с помощью способов иммуносцинтиграфии и иммунохимии Для получения опухоль-специфичных ферментативных конъюгатов возможно очищать нижеупомянутые ферменты, полученные из идентифицированного источника, с использованием 37 методики, описанной в литературе - а-галактозидазу из печени человека (Dean К G and Sweeley С С, 1979, J Biol Chem , 254, 994-1000), - р-глюкуронидазу из печени человека (Но К 1, 1985, ВВА, 827, 197-206), альфа-І_-фукозидазу из печени человека (Dawson G, Tsay G, 1977, Arch Biochem Biophys, 184, 12-23), - а-маннозидазу из плаценты человека (Noeske С, Mersmann G, 1983, Hoppe Seylers Z Physiol Chem , 364, 1645-1651), - а-глюкозидазу из слизистой оболочки желудка человека (Asp N G , Gudmand-Hoeyer E, Christiansen Р М , Dahlquist А , 1974, Scand J Clin Lab Invest, 33, 239-245), - р-глюкозидазу из печени человека (Daniels L В, Coyle Р J , ChiaY В, Glew R Н, 1981, J Biol Chem , 256, 13004-13013), - р-глюкоцереброзидазу из плаценты человека (Furbish F S , BlairH E , Shiloach J , Pentcheu P G , Brady R O, 1977, Proc Natl Acad Sci USA, 74, 3560-3563), - a-N-ацетилглюкозаминидазу из плаценты человека (Roehrborn W , Von Figura К, 1978, Hoppe Seylers Z Phisiol Chem , 359, 1353-1362), - p-N-ацетилглюкозаминидазу из амниотической мембраны человека (Orlacchio A , Emihani С , Di Renzo G С , Cosmi E V , 1986, Clin Chim Acta, 159,279-289), - a-N-ацетилгалактозаминидазу по способу Salvayre R , Negre A , Maret A , Douste-Blazy L , 1984, Pathol Biol (Pans), 32, 269-284 Гликолитическую активность коньюгата фермент/опухоль-специфичное антитело определяли путем сравнения с р-нитрофенил глюкозидаами при оптимальной рН С целью определения эффективности последовательного и сочетанного применения коньюгата фермент/антитело и пролекарства, конъюгат вводили трансплантированым мышам, а затем, после того, как уровень ферментов в плазме понижался практически до нуля, осуществляли введение модифицированного антрациклина (пролекарство), в ходе последующих наблюдений была предпринята попытка установить, прекратился ли рост опухоли и наблюдается ли возвращение в предыдущее состояние Пролекарства 7,14, 48b, 49b, 60 и 75Ь, а также ацетаты 6, 13, 48а, 49а, 59 и 75а, которые гидролизуются in vivo под воздействием ферментов, образуя одно из вышеупомянутых пролекарств, представляют собой а-галактозиды, пролекарства 22, 27с, 54с, 64с, 70с, 78Ь и 83с являются рглюкуронидами, пролекарство 37 и его ацетат 36 р-глюкозиды Эти пролекарства преимущественно расщепляются, образуя даунорубицин или доксорубицин в присутствии соответствующего коньюгата как описано выше Неожиданным оказалось то, что описываемая в настоящем изобретении композиция, включающая пролекарство с тремя отделами и коньюгат, находящийся в составе которого фермент является нециркулирующим ферментом человеческого происхождения, позволяет решить как проблему иммунологической толерантности и специфично 56981 38 сти деис- зия на участке опухоли, так и, как уже говорил г,ъ выше, избежать стерической или электронной интерференции во время расщепления фермента Неожиданно также то, что пролекарства с тремя отделениями, описываемые в настоящем изобретении, оказались способными к расщеплению активированными макрофагами, гранулоцитами, тромбоцитами или опухолевыми клетками человека В сущности, эти активированные клетки высвобождают р-глюкуронидазу, которая способна эффективно (путем гидролиза) расщеплять соединения глюкуронил/саморазрушающуюся ветвь/лекарство Такие пролекарства можно затем непосредственно применять при лечении заболеваний, вызывающих активированные макрофаги, гарнулоциты, тромбоциты или опухолевые клетки человека Помимо вышеупомянутых приготовлений, в настоящем изобретении содержатся такие получения, которые станут очевидными после следующего опирання примеров реализации способа, составляющего предмет настоящего изобретения Следует, однако, четко представлять себе, что данные примеры приводятся исключительно для иллюстрации предмета изобретения, и ни в коей мере не должны служить в качестве ограничения Пример I синтез N-(4гидроксибензилоксикарбонил)-даунорубицин a-Dгалактопиранозида (7) В соответствии со схемой I связывание пентаО-ацетил-О-галактопиранозы с паракрезолом осуществляется путем слияния в присутствии ZnCb или ZnCb в смеси АсОН/АсгО Бензиловое бромирование полученного соединения (I) выполняется или в присутствии Nбромосукцинимида (NBS) с фотохимической активацией для получения только соединения 2, или в присутствии NBS и перекиси бензоила для получения, главным образом, соединения 2 и небольшого количества производной альдегида 3 Вытеснение бромина из производной 2 производится в ацетоне или в эфир/ацетоне с (или без) (ВизЭп)2 для получения производной 4, тогда как восстановление производной альдегида 3 с бромгидридом натрия позволяет получить соединение 4 Активация группы ОН в производной 4 осуществляется с использованием N-сукцинимидил хлороформата или дисукцинимидил карбоната (DSC) На следующей стадии связывание производной 5 с даунорубицином осуществляется в DMF в присутствии Et3N, и снимается защита с производной N-гидроксибензилкарбонила 6, с помощью трансестерификации, образуя при этом требуемую производную 7 1) 4-метилфенил 2,3,4,6-тетра-О-ацетилальфа-О-галактопиранозид (I) Способы получения Способ 1 смешивают 8 9г р-крезола, 8 9г пента-О-ацетил-О-галаклопиранозы и 0 56г ZnCb, нагревают до 160°С и выдерживают при этой температуре в течение ЗОмин, в соответствии с способом HELFERICH После охлаждения до 60°С в 56981 40 39 реакционную среду добавляют 400мл CH2CL2 с сушивают испарением для получения 1,64г пропоследующей двукратной отмывкой в 400 мл водя дукта С помощью импульсной хроматографии и в растворе гидроксида натрия (=1N) до тех пор, (растворитель гексак/этилацетат 80/20 по объепока водная фаза не становится практически бесму) получают 1,74г смеси монобромированной цветной И, наконец, органическую фазу отмывапроизводной 2 и соответствующей дибромированют в 400мл воды, высушивают на безводном ной производной, что позволяет выделить 0,08г сульфате натрия, а затем высушивают на безводчистого соединения 3 ном сульфате натрия, а затем высушивают испа- Соединение 2 С21Н25О10ВГ M =517 М р = 20 1 рением на водяной бане (температура 35-40°С), 187°С (СС14) [a] D = +26° (с 1, CHCI3) H NMR при этом образуется осадок массой 7 08 г (выход (270 MHz, CDCI3) 5 ppm 1,94 (s, ЗН), 2,07 (s, ЗН), 1 1 = 70%) С помощью хроматографии на колонке 4,06 (dd, 1Н, J = 12, J = 7 Hz), (dd, 1H, J = 12, J = 1 1 60Н двуокиси кремния (растворитель гексан/этил 12, J = 6 Hz), 4,32 (dd, 1H, J = 7, J = 6, J" = 1 Hz), 1 ацетат 90/10 по объему) получают 2 9г соедине4,49 (s, 2HO), 5,29 (dd, 1H, J = 10, J = 4 Hz), 5,55 1 1 ния I (выход = 29%) и 1 17г его р-аномера (выход = (dd, 1H, J = 4, J = 1 Hz), 5,60 (dd, 1H, J = 10, J = 12%) 4Hz), 5,78 (d, 1H, J = 4 Hz), 7,02 (d, 2H, J = 8 Hz), 7,33 (d, 2H, J = 8 Hz) MS (DIC/NH3) m/z 536 Способ II 11 г пента-О-ацетил-О(M+NH4)-, 534 (M+NH4)-, 456, 331 галактопиранозы, 11г р-крезола и 2 4г ZnCI растворяют в 8мл смеси уксусной кислоты и уксусного 3) 4-формилфенил 2,3,4,6-тетра-О-ацетилангидрида (95/5 по объему) с последующим наальфа-О-галактопиранозид (3) C21H24O11 M = 452 1 гревом до 120°С Обратный поток поддерживается ТН NMR (270 MHz, CDCb) 6 ppm 1 91 (s, 3H), 2,03 в течение 2 часов После того как при пониженном (s, 3H), 2,06 (s, 3H), 2,20 (s, 3H), 4,09 (m, 2H), 4,28 давлении произойдет испарение растворителя, в (dd, 1H, J = 7, J1 = 6, J1 = 1 Hz), 5,30 (dd, 1H, J = 10, осадок добавляют 120мл CH2CI2 Органический J 1 = 4 Hz), 5,52 (m, 2H), 5,88 (d, 1H, J = 4 Hz), 7,17 раствор промывается сначала водой, затем рас(d, 2H, J = 8 Hz), 7,83 (d, 2H, J = 8 Hz), 9,89 (s, 1H) твором гидроксида натрия (=1N) и, наконец, снова MS (DIC/NH3) m/z 470 (M+NH4)-, 331 водой перед высушиванием на безводном суль4) 4-гидроксиметилфенил 2,3,4,6-тетра-Офате натрия, после чего сушат испарением при ацетил-О-альфа-галактопиранозид (4) пониженном давлении При этом образуется сы- Способ получения рой (неочищенный) остаток массой 7г (выход = Раствор 1,89г соединения 2 в 80мл ацетона 64%) После очистки на колонке 60Н двуокиси смешивают с равным объемом 0,1 N водного раскремния (растворитель гексан/этил ацетат 70/30 твора нитрата серебра Затем смесь перемешипо объему), получают продукт 1 при выходе в 13% вают при 25°С в течение 2 часов, после чего ацеи его р-аномер с выходом 6 5% тон испаряют при пониженном давлении, а оставшуюся водную фазу экстрагируют с CH2CI2 Соединение 1 С22Н26О10 М = 438 М р = 163 Затем полученный экстракт отмывают водой и 165°С [a] D 2 0 = + 164° (с 1, СНСІз) 1Н NMR (270 высушивают на безводном сульфате натрия, MHz, CDCI3) ppm 1,90 (s, ЗН), 2,02 (s,3H), 2,08 фильтруют и испаряют при пониженном давлении (s,3H), 2,19 (s, ЗН), 2, ЗН), 2,28 (s, ЗН), 4,00 (dd, 1H, Полученный таким образом сухой остаток очищаJ = 12, J = 6 Hz), 4,40 (ddd, 1H, J = 7, J1 = 5, J" = 1 ют с помощью импульсной хроматографии на коHz), 5,27 (dd, 1H, J = 10, J1 = 4 Hz), 5,54 (dd, 1H, J = лонке двуокиси гремния (растворитель гек4, J1 = 1 Hz),5,57 (dd, 1H, J = 4, J1 = 1 Hz), 5,57 (dd, сан/этил а цетат 60/40 по объему) Получается 1H, J = 10, J1 = 4 Hz), 5,73 (d, 1H, J = 4 Hz), 6,90 (d, продукт 4 (0 94г) с выходом в 56% 2H, J = 8Hz), 7,10 (d, 2H, J = 8 Hz) MS (DIC/NH3) m/z 456 (M+NH4)-, 331 С2іН2бОіі М = 454 М р - 153°С (CH2CI2) [a]D2° 2) 4-бромометилфенил 2,3,4,6-тетра-О= + 144,5° (с 1, СНСІз) 'Н NMR (270 MHz, CDCI3) 5 ацетил-а-О-галактониранозид (2) ppm 1,73 (1Н, exch D20), 1,96 (s, ЗН), 2,03 (s, ЗН), 2,08 (s, ЗН), 2,17 (s, ЗН), 4,07 (dd, 1H, J = 12, J1 = - Способ получения 1 7Hz), 4,09 (dd, 1H, J = 12, J = 6 Hz), 4,35 (dd, 1H, J 1) по способу фотохимической активации 1 = 7, J = 6, J" = 1 Hz), 4,64 (s, 2H), 5,28 (dd, 1H J = К раствору 1 (2,5г) в 100мл тетрахлорида уг10, J1 = 4 Hz), 5,51 (dd, 1H, J = 4, J1 = 1 Hz), 5,54 лерода добавляют 1,02г N-бромосукцинимида, и (dd, 1H, J = 10, J1 = 4 Hz), 5,60 (d, 1H, J = 4 Hz), полученную смесь подают обратным потоком при 7,04 (d, 2H, J = 8 Hz), 7,30 (d, 2H, J = 8 Hz), MS 80°С с одновременным облучением светом (DIC/NH3) m/z 472 (M+NH4)-, 331 (1000W) в течение 15мин Посте охлаждения реакционную среду фильтруют с целью удаления 5) 2,5-диксопирролидин-1-ил 4-(2,3,4,6-тетраосажденного сукцинимида, а инфильтрат затем О-ацетил-альфа-О-галактопиранозил)бензил кариспаряют при пониженном давлениидля получебонат (5) ния 3,23г сухого остатка После очистки на колонСоединение 4 преобразуется в сукцинимид о ке 60Н двуокиси кремния (растворитель геккарбонат путем связывания с сукцинимидил хлосан/этил ацетат 70/30 по объему) выделяется роформ атом 2,45г (соединения) 2 (выход = 83%) а) Получение сукцинимидил хлоросЬормага v 2)по способу активации перекиси бензоила Раствор N-гидроксисукцинчмида (2г) в 11мл этанола смешивают с раствором гидроксида каК раствору продукта 1 (1г) в 40мл тетрахлорилия (1г) в 30мл этанола Образующийся продукт да углерода добавляют 0,8г N-бромосукцинимида отфильтровывают, отмывают эфиром и высушии 0,8г перекиси бензоила Реакционную среду повают за ночь при 40°С в вакууме При этом обрадают обратным потоком в течение 3 часов После зуется 2,40г соли калия N-сукцинимида (выход охлаждения ее фильтруют с целью удаления оса94%) жденного сукцинимида, а затем инфильтрат вы 56981 42 41 К Змл 20%-раствора СОСЬ добавляют 200мг Раствор (9мг) (соединения) 6 в 1мл 0 1N месоли калия N-сукцинимида в толуоле при 5°С с танолата натрия перемешивают и экспонируют постоянным перемешиванием После перемешипри 0°С в течение 15 мин Среду нейтрализуют + вания в течение 2 часов образовавшийся хлорид добавлением смолы Amberhte IRG 120Н с послекалия отфильтровывают, а инфильтрат затем исдующей фильтрацией Инфильтрат высушивают паряют при пониженном давлении Остаток расиспарением при пониженном давлении, получая творяют в эфире, после чего образуется твердый при этом 6 7 мг чистого соединения 7 (выход = белый осадок, состоящий из дисукцинимидил кар89%) боната, который затем отфильтровывают ИнСоединение 7 C41H45NO18 M = 839, аморф2 Ь фильтрат высушивают испарением при пониженный [a]D ° =+243° (с 0,1, МеОН) И NMR (270 ном давлении, после чего образуется 150 мг MHz, CD3OD) 5 ppm 1,34 (d, ЗН ), 1,50-4,00 (m, сукцинимидил хлороформата (выход = 54%) 11Н) 4,50-5,50 (m, 9H), 7,06 (d, 2H, J = 8 Hz), 7,23 (d, 2H, J = 8 Hz), 7,30-7,60 (m, 3H), MS (DIC/NH3) 6) Получение сукцинимидокарбоната m/z 571, 554, 459, 383,286, 164 К 117мг сукцинимидил хлороформата и 0 05мл пиридина в 8мл этил ацетата добавляют Пример 2 Синтез N-[2-(a-O150мг соединения 4 Смесь перемешивают в тегалактопиранозил)чение 48 часов при комнатной температуре с побензилоксикарбонил]даунорубицина (14) следующей фильтрацией, а затем полученный Согласно схеме-диаграмме II, требуемый проинфильтрат испаряют при пониженном давлении, дукт (14) получают, используя глюкозид 8 в качев результате чего получается 189мг соединения 5 стве стартового (начального) материала и с по(выход = 96%) мощью той же самой последовательности реакций, которая описана в Примере 1, а именно C26H29O15N M = 595 Lac [a]D2° = +142° (с 1, (1) бензильное бромирование, (2) сольволиз броСНСІз) 'Н NMR (270 MHz, CDCI3) 5 ppm 1,90 (s, мированной производной, (3) активация группы ЗН), 2,03 (s, ЗН), 2,007 (s,3H), 2,16 (s, 3H), 2,83 (s, ОН сукцинимидил хлороформатом, и (4) связыва4H), 4,07 (dd, 1H, J = 12, J1 = 7 Hz), 4,11 (dd, 1H, J = ние (соединения) 12 с даунорубицином и снятие 12, J1 = 6 Hz), 4,30 (dd, 1H, J = 7, J1 = 6, J" = 1 Hz), защиты с групп ОН в сахарном остатке 5,26 (s, 2H), 5,29 (dd, 1H, J = 10, J1 = 4 Hz), 5,51 (dd, 1H, J = 4, J1 = 1 Hz), 5,55 (dd, 1H, J = 10, J1 = 4 Hz), 1) 2-Бромометилфенил 2,3,4, б-тетра-О5,77 (d, 1H, J = 4 Hz), 7,07 (d, 2H, J = 8 Hz), 7,33 (d, ацетил-а-О-галактопиранозид (9) Способ получе2H, J = 8 Hz), MS (DIC/NH3) m/z 613 (M+NH4)-, 437 ния 348 331 Из 2-метилфенил 2,3,4,6-тетра-О-ацетил-а-О6)М-[4-(2,3,4,6-тетра-О-ацетил-альфа-Огалактопиранозида 8 (см Р М Dey, Chemistry and галактопиранозил)-бензилоксикарбоIndustry (London), 39, 1637, 1967), используя для нил]даунорубицин (6) этой цели NBS/CCI4 (выход = 80%) -Способ получения Соединение 9 1 20мг даунорубицина растворяют в 0,8мл диС21Н25ВЮ10 М = 517 ТН NMR (200 MHz, метилформамида К полученному раствору доCDCI3) 6 ppm 1,96 (s, ЗН), 2,04 (s, ЗН), 2,11 (s, бавляют 23мг (соединения) 5 и одну каплю триЗН), 2,19 (s, ЗН), 4,14 (m, 2H), 4,40 (t, 1H, J = б этиламина, постоянно перемешивая (при Hz),4,60 (ABq, 2H, J = 9 Hz), 5,38 (dd, 1H, J = 11 и 4 экспозиции с аргоном) в течение 10 минут при Hz), 5,50-5,75 (m, 2H), 5,85 (d, 1H, J = 4 Hz), 7,00комнатной температуре 7,40 (m, 4H) Реакционную среду разбавляют этилацета2) 2-гидроксиметилфенил 2,3,4,6-тетра-Отом, а затем экстрагируют с насыщенным раствоацетил-а-О-галактопиранозид (II) -Способы полуром NaCI чения Органическую фазу высушивают испарением а) из (соединения) 9 с использованием АдІЧОз при пониженном давлении 50мг полученного та(ВЫХОД = 21%), ким образом сухого остатка очищают на колонке б) из (соединения) 10 с использованием 60Н двуокиси кремния (растворитель ацеNaBH4/THF/MeOH (выход = 80%), тон/циклогексан 45/55 по объему), получая при Соединение 11 этом 13мг ожидаемого продукта 6 (выход = 32%) С21Н26ВЮіі М = 454 М р = 9б°С 1Н MMR (200 MHz, CDCI3) 6 ppm 1,98 (s ЗН), 2,03 (s, ЗН), Соединение 6 C49H53NO22 M = 1007 аморф2,09 (s, ЗН), 2,19 (s, ЗН), 4,15 (m, 2H), 4,43 (t, 1H, J ный [a] D =+278° (с 0,7, CHCI3) 'H NMR (270 MHz, = 6 Hz), 4,57 (d, 1H, J = 12,5 Hz), 4,89 (d, 1H, J = DMSO) 5 ppm 1,08 (d, ЗН J=7 Hz), 1,40-2,20 12 5 Hz) 5,30-5,60 (m, 3H), 5,72 (d, 1H, J = 4 Hz), (m, 4H) 1,76 (s, 3H), 1,91 (s, 3H), 1,96 (s, 3H),2,08 7,00-7,40 (m, 4H) (s, 3H), 2,20 (s, 3H), 2,91 (s, 4H) 3,31 (m 1H), 3,66 (dd, 1H, J = 12, J'=8 J" = 4 Hz), 3,93-4,00 (m, 5H), 3 ) 2-формилфенил 2,3,4, б-тетра-О-ацетия-а4,13 (dd, 1H, J = 7, J 1 = 4 Hz), 4,30 (dd, 1H, J = 7, Г О-галактопиранозид (10) 6, J " - 1 Hz), 4,70 (d, 1H, J = 6 Hz) 4,88'(m, 3H), 5,10 Способ получения (dd, 1H, J = 10, J 1 = 4 Hz), 5,17 (m, 1H), 5,37 (m, Из соединения 8 путем бронирования и по2H), 5,53 (s, 1H), 5,74 (d, 1H, J=4 Hz), 6,84 (d, 1H, J следующего использования АдІЧОз (выход = 52%) =8 Hz), 7,03 (d, 2H, J = 8 Hz), 7,26 (d, 2H, J = 8 Hz), Соединение 10 7,64 (m, 1H), 7,88 (m, 2H) MS (DIC/NH3) m/z 1025 С21Н24О11 М = 452 THNMR (200 MHz, CDCI3) (M+MH4), 376 5 ppm 2,00 (s, ЗН), 2,06 (s, ЗН), 2,08 (s, ЗН), 2,19 (s, ЗН), 4,18 (m, 2H), 4,43 (t, 1H, J = 6 Hz), 5,38 (d, 7) N- [ 4- (a-D-галактопиранозил ) бензилокси1H, J = 11 Hz), 5,40-5,60 (m, 2H), 5,84 (d, 1H, J = 4 карбонил ] даунорубицин (7) Hz), 7,19 (t, 1H, J = 8 Hz) 7,30 (d 1H, J = 8 Hz) 7,58 Получение 56981 43 + (-t, 1H, J = 8Hz), 7,91 (d, 1H, J = 8Hz), 10,56 (s, 1H) 521 (M+NH4) 4) 2,5-диоксопирролидин-1-ил 2-(2,3,4,б-тетраО-ацетил-а-О-галаісгопиранозил)бензил карбонат (12) Способ получения Из соединения 11 путем использования сукиинимидил хлороформата (далее см получение соединения 5, выход = 72%) Соединение 12 C26H29NO15, M=595 HNMR (200MHz, CDCI3) 5 ppm 1,98 (s, ЗН), 1,99 (s, ЗН), 2,06 (s, ЗН), 2,17 (s, ЗН), 2,87 bs, 4H), 4,15 (m, 2H), 4,43 (t, 1H, J = 6 Hz), 5,16 (d, 1H, J = 12 Hz), 5,33 (dd, 1H, J = 12 и 4 Hz), 5,40-5,90 (m, 5H), 7,10 (t, 1H, J = 8 Hz) 7,20-7,50 (t, 3H) 5) N-[2-(2,3,4, б-тетра-0-ацетил-а-Огалактопиранозил ) -бензилоксикарбонил ] даучорубицин (13) Способ получения Из соединения 12 и даунорубицина (выход = 85%) в соответствии с режимом, описанным для соединения 6 Соединение 13 М р = 130°С [D] D 2 0 =+216° (С 0,25, CHCI3) C49H53NO22 М = 1007 1 Н NMR (200 MHz, CDCI3) 5 ppm 1,87(s, ЗН), 2,00 (s, ЗН), 2,08 (s, ЗН), 2,12 (s, ЗН), 2,41 (s, ЗН), 2,94 (d 1Н, J = 18 Hz) 3,23 (d, 1H, J = 18 Hz), 3,66 (s, 1H), 3,70-4,20 (m, 6H), 4,08 (s, 3H), 5,10 (ABq, 2H, J = 9 Hz), 5,20-5,70 (m, 7H), 5,85 (d, 1H, J = 4 Hz), 7,00-7,50 (m, 4H), 7,78 (t, 1H, J = 8 Hz), 8,03 (d, 1H, J = 8 Hz), 13,28 (s, 1H), 13,98 (s, 1H) 6) N- [ 2- ( a-D-галактопиранозил ) бензилоксикарбонил і даунорубицин (14) Способ получения Из соединения'13 с использованием MeONa (кат)/МеОН (см способ получения (соединения) 7, выход = 83%) C41H45NO18 М = 839 М р =130°С Пример 3 синтез М-(4гидроксибензилоксикарбонил)-даунорубицин p-Dглюкуронида (22) В соответствии со схемой-диаграммой III, связывание метил-пер-О-ацетил-О-глюкуроната с паракрезолом выполняется в растворе CH2CI2 в присутствии TMSOTf в качестве катализатора Соединение 22 затем приготавливается с использованием той же самой последовательности реакций, которая описана в Примерах 1 и 2, за исключением дополнительного снятия защиты с карбометокси-группы, что достигается смешиванием в МеОН в присутствии ВаО 1) Метил (4-бромометилфенил 2,3,4-три-Оацетил- [3 -О-глюкопиранозид)уронат (16) Это соединение получают (выход = 79%) по способу, описанному при получении (соединения) 2 (см Пример 1) из метил (4-метилфенил 2,3,4три-О-ацетил-0-глюкопиранозид)уроната (15), который, в свою очередь, получают по способу G N Bollenback, J Am Ghem Soo , 1955, 77, 33103315 С20Н23О10ВГ M-503 M p - 144-14б°С (этанол) [a]D2° =+3° (C 0,85, CHCI3 IR (CDCb) 1758 cm 1 (CO) 1 H NMR (90 MHz, CDCI2) 5 ppm 2,00 (s, 9H), 3,66 (s, 3H), 4,16 (m, 1H), 4,43 (s, 2H), 5,035,36 (m, 4H), 6,89-7,33 (AB, 4H) MS (DIC/NH3) m/z 44 2) Метил (4-гид,роксиметилфенил 2,3,4-три-Оацетил- [3 -О-глюкопиранозид)уронат (18) и метил (4-формилфенил 2,3,4-три-О-ацетил[3 -Dглюкопиранозид)уронат (17) Эти соединения получают из (соединения) 16 (1 2г, 2 3 ммоль) с помощью способа, приведенного выше для получения (соединения ) 4 (Пример 1 ) Хроматография остатка на силикагеле с использованием смеси гексан/эти л ацетат (2 1 по объему) в качестве элемента (растворителя) позволяет выделить некоторую часть стартового материала 16 (100мг), 18 (650мг, 38%), а затем и 17 (200мг, 12%) Соединение 18 2 С20Н24О11 М=440 М р = 134-136°С [a]D ° = 1 45° (с 0,55, СНСІз) IR (KBr) 3556 c m (ОН), 1758 см 1 (СО) 1 Н NMR (90 MHz, CDCb) 5 ppm 1,96 (s, 9H), 3,63 (s, ЗН), 3,96-4,20 (m, 2H), 4,53 (s, 2H), 4,96-5,33 (m, 4H), 7,20 и 6,86 (AB, 4H) MS (DIG/NH3) m/z 458 (M+NH4)+ Соединение 17 C20H22O11 M=438 М р = 170-172°С [a]D2° =31° (с 0,95, СНСІз) IR (CDCI3) 1758 cm 1 (C=0, ел эфир) 1698cm 1 (C=0, PhCHO) 1 H NMR (90 MHz, CDCI3) 6 ppm 2,12 (s, 9H), 3,72 (s, 3H), 4,21-4,39 (m, 1H), 5,30-5,56 (m, 4H), 7,07-8,03 (d, 4H) 9,91 (s, 1H) MS(DIG/NH3) m/z 456 (N+MH4) 3) 2,5-диоксипирролидин-1-ил 4-(метил (2,3,4три-о-ацетил-бета-О-глюкокиранозил) уронат) бензил карбонат (19) - Способ получения (получения) Раствор (соединения) 18 (170мг, 0 39 нмоль) и триэтиламин (54мкл, 0 39 нмоль) в ангидридном (безводном) метиленхлориде (4мл) добавляют по капле в присутствии аргона к раствору DSC (197мг, 0 77 нмоль) в 8 мл ацетонитрила После перемешивания в течение 24х часов при комнатной температуре среду фильтруют, а инфильтрат концентрируют до сухого состояния Таким образом, получается продукт 19 в форме бесцветного сиропа Соединение 19 C25H27NO15 M = 581 [a]D2° =-31° (с 0,85, СНСІз) IR (CDCI3) 1747 c m 1 (C=O) 1 H NMR (90 MHz, COCI3) 5 ppm 2,08 (s, 9H) 2,82 (s, 4H), 3,73 (s, 1H), 4,24 (d, 1H, J -9), 5,13-5,44 (m, 6H), 6,967,44 (m, 4H) MS (DIG/NH3) m/z 599 (N+MH4) 4) N-[4-(MeTnn (2,3,4-три-О-ацетил-бета-Оглюкопиранозил)уронат) бензилоксикарбонил ] даунорубицин (20) - Способ получения С помощью способа, описанного для (получения соединений) 6 и 13 (выход = 70% (см Примеры 1 и 2) Соединение 20 Аморфный продукт C4sH5i022 M=993 [а]р20 = +112° (с 0,6, СНСІз) 1 Н NMR (250 MHz, CDCI3) 5 ppm 1,32 (d, ЗН J = 6 Hz), 1,74 (s, 1H), 1,77 and 1,95 (AB, 2H, J - 5, J' = 12), 2,07 (3s, 9H), 2,12-2,38 (AB, 2H), 2,44 (s, 3H), 2,97 and 3,26 (AB, 1H, J = 20), 3,70 (m, 1H), 3,73 (s, 3H)3 3,92 (обширн s, 1H), 4,12 (s, 3H), 4,19 (m, 1H), 5,00 (s 2H) 5,14 (d 1H, J = 7) 5,68 (dd, J =3, J = 7, 1H), 5,53 (d, 1H, J = 3,5), 6,98 and 7,28 (AB, 4H, J = 8), 7,43 (d, 1H,J=8),7,83 (t, 1H, J=J' = 8), 8,07 (d, 1H, J = 8), 13,33 and 14,00 (2s, 2H) MS (FAB), m/z 1016 (M+NA) 5) М-[4-(метил (p-O 45 глюкопиранозил)уронат)бензилоксикарбонил]даунорубицин (21) Это соединение получают после обработки (соединения) 20 MeONa/leOH (см получение соединений 7 и 14, Примеры 1 и 2, выход = 78%) Сироп красного цвета 20 С42Н45О19 М-867 [ a ] D = +140° (, 0,02, СН 3 ОН) MS (252C FPD) m/z 890 (M+N-) 6) N-(4гидроксибензилоксикарбонил)даунорубицин [3-D глюкуронид (22) Соединение 21 (2,7мг) растворяют в 0 2мл МеОН, и полученный раствор перемешивают в течение Зх часов при комнатной температуре в присутствии оксида бария Затем среду нейтрализуют добавлением смолы Amberhte + IR 50Н и, после фильтрации, концентрируют при пониженном давлении 1,8мг чистого (соединения) 22 выделяют осаждением в смеси МеOH/Et2O/reKcaH С41Н43О19 - М = 853 [a] D 2 0 = +2° (с 0 06, МеОН) Пример 4 синтез К-[2-( р -D-глюкопиранозил)уроновая кислота) бензилоксикарбонил] даунорубицина (27с) В соответствии со схемой-диаграммой IV, метил (2-бромометилфенил 2,3,4-три-о-ацетил-р-Оглюкопиранозид)уронат 23, полученный из метил (2-метилфенил 2,3,4-три-О-ацетил-р-0глюкопиранозил)уроната по способу G N Bollenback et al , J Am Ghem Soc , 1955 ZZ, 3310, преобразуется в продукт 24 (и/или продукт 25), после чего продукт 24 превращается в продукт 26 В этом случае для связывания ветви с антрациклином карбонат 26 приготавливают с помощью имеющегося в свободной продаже 4-нитрофенил хлороформата Соединение 27с (требуемое пролекарство) получают затем способом, описанным выше в Примерах 1, 2 и 3 1) Метил (2-бромометилфенил 2,3,4-три-оацетил-р-О-глюкопиранозид)уронат (23) - Способ получения Раствор метил (2-метилфенил 2,3,4-три-Оацетил-р-О-глюкопиранозид-ил)уронат (940мг, 2 2 ммоль) (см G I Bollenback, J Am Ghem Soo , 77, 3310-3315, 1955), MBS (509мг, 2,86 ммоль) и 52мг перекиси бензоила в 25мл ССЦ подают обратным потоком в течение 12 часов После стандартной экстракции и очистки на колонке двуокиси кремния (кварц) выделяют 880мг (80%) (соединения) 23 Соединение 23 С20Н23ВЮ10 М=503 ЬИ NMR (200 MHz, CDCI3) 5 ppm 2,05 (s, ЗН), 2,07 (s, ЗН), 2,11 (s, ЗН), 3,74 (s, ЗН), 4,19 (d, 1H, J = 9 Hz), 4,35 и 4,65 (2d, CH 2 , J = 12 Hz), 5,23 (m, 1H), 5,38 (ra, 3H), 7,05 (m, 2H), 7,32 (m, 2H) 2) метил (2-гидроксиметилфенил 2,3,4-три-оацетил-р-О-глюкопиранозид)уронат (24) и метил (2-формилфенил 2,3,4-три-о-ацетил-р-Оглюкопиранозид) уронат (25) Способ получения Раствор бромированной производной 23 (690мг, 1,37 ммоль) в 14 мл водного раствора ацетона (50/50) перемешивают в течение 2х часов в присутствии 631 мг (3,7 ммоль) АдІЧОз- После фильтрации и стандарі ной экстракции 80мг аль 56981 46 дегида 25 (13%) и 340мг спирта 24 (56%) выделяют с помощью хроматографии на силикагеле Характеристики (соединения) 24 2 С20Н24О11 М=440 М р = 143-147°С [a] D ° = 26° (с 0,9, СНСІз) NMR (200 MHz, CBCI3) 2,05 (s, 333Н), 2,07 (s, ЗН), 2,11 (s, ЗН), 3,72 (s, ЗН), 4,13 (d, 1H, J - 9 Hz, H-5), 4,48 and 4,77 (2d, J = 12,5 Hz, 2H), 5,15 (d, J = 7,2 Hz 1H), 5,35 (m, 3H), 7,02 (d, J = 8, Hz, 1H), 7,11 (t, J = 7,2 Hz, 1H), 7,29 (d, J = 6,8 Hz, 1H), 7,34 (t, J = 7,4 Hz, 1H) ppm IR (CH 2 CI 2 ) 3540, 3030, 2960, 1760, 1605, 1590, 1490, 1455, 1 1440, 1375, 1225, 1140, 1090, 1075, 1040 c m SM + + (FAB ) m/z 463 (M+Na) Соединение 25 1 C20H22O11 M-438 TH NMR (200 MHz, CDCI3) 5 ppm 2,08 (s, 9H), 3,75 (s, 3H), 4,25 (d, 1H, 3=9 Hz), 5,34 (m, 4H), 7,15 (t, 1H, J = 8 6 Hz), 7,25 (d, 1H, J = 7,3 Hz), 7,58 (t, 1H J = 7 Hz), 7,26 (d, 1H, J = 7,6 Hz), 10,34 (s, 1H) 3) 4-нитрофенил 2-(метил (2,3,4-три-О-ацетилр-О-глюкопиранозил)уронат)бензил карбонат (26) - Способ получения Раствор 24 (33мг, 0,075 ммоль) в 0,021мл пиридина и 0,2мл этилацетата перемешивают в течение 12 часов при комнатной температуре в присутствии 46мг (0,22 ммоль) паранитрофенил хлороформата После фильтрации и испарения растворителей, и очистки на кварцевой пластине получают 45мг (соединения) 26 (количественный выход) Соединение 26 C 2 7H 2 7Oi5 М = 605 М р = 67-70°С [ a ] D 2 0 = +2° (с 1, СНСІз) 1'Н NMR (200MHz, CDCI3) 5 ppm 2,07 (s, 9H), 3,74 (s, ЗН), 4,24 (обширный d, J = 8,5 Hz, H-5), 5,3 (m, 6H), 7,10 (m, 2H) 7,39 (m, 4H), 8,27 (d, J = 9 Hz, 2H) 4) N-[2-(Me™i (2,3,4-три-О-ацетил-р-Оглюкопиранозил)уронат)бензилоксикарбонил]даунорубицин (27а) -Способ получения Раствор даунорубицина (15 8мг, 0 03 ммоль), гликозид 26 (1,1экв, 19,8мг) и Et 3 N (3,6мг, 1,2экв) в 0,1мл DMF перемешивают в течение 12ти часов После стандартной экстракции и очистки на кварцевой пластине получили 27мг (67%) соединения 26 Соединение 27а С48Н51О22 М=993 М р = 153-155°С [a] D 2 ° = 122° (с 0,4, СНСІз) 1'Н NMR (200 MHz, CDCI3) 5 ppm, 1,31 (d, ЗН, J = 6,4 Hz), 2,06 (s, 6H), 2,09 (s, 3H), 2,42 (s, 3H), 2,91 и 3,24 (2d, J = 19 Hz, 2H), 3,60 (s, 3H), 4,08 (s, 3H), 4,20 (m, 2H) 5,00-5,32 (m, 8H) 7,05 (m, 2H), 7,26 (m, 2H), 7,38 (d, J = 7,4 Hz, 1H), 7,77 (t, J = 7,4 Hz, 1H) 8,03 (d, J = 7,4 Hz, 1H), 13,24 (s, 1H), 12,57 (s, 1H) MS [M+K]-= 1032 5) N-[2-(MeTHn (p-Dглюкопиранозил)уронат)бензиокеикарбонил] даунорубицин (27Ъ) Получают после обработки соединения 27а MeONa/MeOH (см получение 7 и 14, Примеры 1 и 2) Твердое соединение красного цвета С42Н45О19 N М=867 6) N -[2-(( р -О-глюкопиранозил)уроновая кислота)бензилоксикарбонил] даунорубицин (27с) Получают путем обработки соединения 27Ь ВаО или К2СО3 (см получение соединения 22 в Примере 3) Твердое соединение красного цвета С41Н43О19 М= 853 56981 48 47 Пример 5 синтез N-[2C13H22O2S1 М=238 ЬИ NMR (200 MHz, CDCI3) 5 ppm 0,30 (s, 6H), 1,06 (s, 9H), 2,67 (s, 1H), 4,70 (s, гидроксибешидоксикарбонилі-даунорубицина (32) 2Н), 6,86 (d, J = 8 Hz, 1H), 6,97 (t, J = 8 Hz, 1H), В соответствии со схемой-диаграммой V по7,20 (t, J = 8 Hz, 1H), 7,33 (d, J = 8 Hz, 1H), оизводную 32 приготавливали путем синтеза из производной 28 (2-терт5) 4-нитрофенил 2-(тертбутилдиметилзилилокси)бензил карбонат (30) бутилдиметилзилилоксибензальдегид), которая восстанавливается в присутствии NaBbU, образуя 6) Способ получения при этом соединение 29, активацией с 4Спиртовое соединение 29 (135мг, 0 56 ммоль) нитрофенил хлороформатом, после чего образурастворяют в этилацетате (0 82мл) Затем добавется производная 30, которая конденсируется с ляют пиридин (0 081 мл) с последующей добавкой даунорубицином, затем путем снятия защиты с KF 4-нитрофенил хлороформата (275мг, 2 4экв ) Пополучают продукт 32, или же с помощью ферменсле экспозиции в течение ночи при комнатной тативного гидролиза продукта 14 (см Пример 2) с температуре растворитель выпаривается С приа-галактозидазой менением хроматографии на силикагеле получают карбонат 30 (206мг, 91%) 1) N- [ 2-гидроксибензилоксикарбонил ] даунорубицин (32) Характеристики соединения 30 а) Ферментативный гидролиз 14 C2oH25N06Si М=403 ЬИ NMR (200 MHz, Соединение 14 (1мг) растворяют в 0 02мл CDCI3) 5 ppm 0,27 (s, 6H), 1,03 (s, 9H), 5,32 (s, 2Н), 6,86 (d, J = 8 Hz, 1H), 6,96 (t, J = 8 Hz, 1H), 7,1DMF затем добавляют 1мл ЮОмМ раствора 7,5 (m, 4H), 8,21 (d, J = 8 Hz, 2H) HEPES в дистиллированной воде После добавления а-галактоз ид азы (2 ед , ЕС 3 2 1 22, Sigma, 5) N- [2-(терт-бутилдиметилзилштокси) бензиn° G-8507) реакционную смесь перемешивают в локсикарбонил ] -даунорубицин (31) течение 2 часов при 35°С После гидролиза и эксСпособ получения тракции получают соединение 32 Раствор (соединения) 30 (8 3мг, 0 022 ммоль), даунорубицин (9 6мг, 0 018 ммоль) и триэтанолаб) Гидролиз (соединения) 31 мин (0 018мл) в DMF (0 1мл) перемешивают в теЗшшлированную производную 31 (2мг, 0 0025 чение 4х часов при комнатной температуре После ммоль) растворяют в THF (0 1мл) Затем добавстандартной экстракции с помощью способа хроляют 0 2мл водного раствора KF (в концентрации матографии удается выделить (соединения) 31 0 1 г/мл) После 12-часовой экспозиции при ком(6мг, 41%) и 32 (4 5мг, 36%) натной температуре с помощью стандартной экстракции получают (соединение) 32 Соединение 31 Характеристики (соединения) 32 C35H35NO13 C41H49NO13S1 М=791 'И NMR (200 MNz, М=677 ЬИ NMR (200 MHz, CDCI3) 5 ppm 1,26 (d, J CDCI3) 5 ppm 0,20 (s, 6H), 0,96 (s, 9H), 1,30 (d, J = = 6 Hz, 3H), 2,42 (s, 3H), 2,89 (d, J = 20 Hz, 1H), 6Hz, 1H), 2,42 (s, 3H), 2,9 (m, 2H), 3,24 (d, J = 20 3,24 (d, J=20 Hz, 1H), 3,61 (s, 1H), 4,07 (s, 3H), 4,43 Hz, 1H), 3,65 (обширный s, 1H), 3,90 (обширный s, (s, 1H), 5,00 (s, 2H), 5,28 (обширный s, 1H), 5,47 (d, 1H), 4,09 (s, 3H), 4,48 (s, 1H), 5,06 (s, 2H), 5,28 (s, J -2 Hz, 1H), 6,7-7,3 (m, 4H), 7,40 (d, J = 8, Hz, 1H), 1H), 5,52 (d, J = 2 Hz, 1H), 6,8-7,0 (m, 4H), 7,42 (d, J 7,80 (t, J = 8 Hz, 1H), 8,00 (d, J = 8 Hz, 1H), 8,78 (s, = 8 Hz, 1H), 7,80 (t, J=8 Hz, 1H), 8,03 (d, J = 8 Hz, 1H), 13,27(5, 1H), 13,96(s, 1H) 1H), 13,3l(s,1H), 14,0 (s, 1H) Продукт 32 можно преимущественно конденПример 6 синтез І\І-[4-(р-О-глюкопиранозил)сировать с сахаром -при этом получаются продукбензшюксикарбонил] даунорубицина (37) ты 27а, 27Ь или 27с В соответствии со схемой-диаграммой VI, катализ фазового перехода применяется для кон2) 2-тертденсирования перацетил-а-О-глюкозы с рбутилдиметилзилилоксибензальдегид (28) гидроксибензальдегидом, и глюкозид 33 превра3) Способ получения щается в соединение 37 в соответствии с ПримеРаствор 2-гидроксибензальдегида (500мг, рами 1, 2, 3, 4 или 5, приведенными выше 0 44мл, 4 09 ммоль), имидазола (685мг) и тертбутилдиметилзилил хлорида (680мг) в DMF пере1) 4-формилфенил 2,3,4,6-тетра-0-ацетил- р мешивают в течение 24х часов при комнатной D-глюкопиранозид (33) Способ получения температуре После гидролиза и стандартной экс2,3,4,6-тетра-О-ацетил-а-бромоглюкозу (2г, 4 8 тракции с использованием способа хроматограммоль) растворяют в 20 мл хлороформа Смесь рфии получают (соединение) 28 (890мг, 93%) гидроксибензальдегида (585мг, 4 8 ммоль) и бромида бензилтриэтичаммония (1,1 г), предвариСоединение 28 тельно растворенную в 1 25N раствора гидроксиCi 3 H 2 o0 2 Si М=236 ьИ NMR (200 MNz, CDCI3) да натрия (10мл), добавляют к вышеупомянутому 5 ppm 0,28 (s, 6H), 1,00 (s, 9H), 0,91 (d, J = 8Hz, раствору, а реакционную среду подают обратным 1H), 7,02 (t, J = 8 Hz, IH), 7,46 (t, J = 8 Hz, IH), 7,81 потоком в течение 24 часов Экстракция произво(d, J = 8Hz, IH), 10,47 (s, 1H) дится с 50мл воды Полученную органическую 4) 2-терт-бутилдиметилзилилоксибензиловый фазу последовательно промывают 1N раствором спирт (29) NaOH (2х50мл), раствором HCI (1N), а затем воСпособ получения дой, после чего высушивают и концентрируют до Раствор (соединения) 28 (200мг) в метаноле сухого состояния Полученный таким образом не(5 5мл), содержащий NaBH4 (28мг), перемешивают очищенный продукт рекрасталлизируют из этанов течение 1 часа при комнатной температуре Пола, образуя при этом (соединение) 33 (0 5г, 23%) сле гидролиза и стандартной экстракции получают (соединение) 29 (140мг, 68%) Соединение 33 Соединение 29 С 2 іН2 4 Оц М=452 М р = 150-152°С [a]D2° = 56981 50 49 л 1 В ходе реакции MeONa (кат МеОН с соеди28° (с 0,5, СНСІз) IR (CDCI3) 1757 c m (C=O, 1 1 нением 36 (91%) получают (соединение) 37 в виде сложный эфир ), 1698см (CO, альдегид ) H красного сиропа NMR (90 MHz, CDCI3) 5 ppm 2,09 (s, 12H), 3,99 (m, 20 1H), 4,22 (AB, 1H), 5,13-5,48 (m, 4H), 7,15 и 7,89 C41H45O18N M=839 [a] D =+200° (с 0,001, 1 (AB, 4H, j=12 Hz), 9,96 (s, IH) MS (DIG) m/z 470 СНзОН) IR (KBr) 3422cm (ОН), MS (FAB) m/z + (M+NH4)+ 838 (М+1) 2) 4-гидроксиметилфенил 2,3,4,6-тетра-0Пример 7, Получение N-[4ацетил- p -D-глюкопиранозид (34) Способ получегидроксибензилоксикарбонил]даунорубицина (38) ния В соответствии со схемой-диаграммой VII, производное 38 приготавливается или путем синЕго получают из (соединения) 33 с помощью теза, или с помощью ферментативного гидролиза способа, используемого для получения (соединев соответствии с Примером 5 (производное 32) ния) II из (соединения) 10 (см Пример 2), и кристаллизуют из этанола (выход = 92%) 1) N- ^-гидроксибензилоксикарбонил] даунорубицин (38) Соединение 34 2 С2іН2бОц М=454 М р = 102-103°С [a]D ° = Соединение 37 (Змг, 3 68 мкмоль) растворяют 1 18° (с 0,5, СНСІз) IR (CDCI3) 1757cm (С-О, сложв буферном растворе ацетата натрия рН5 5, 1 ный эфир ), Н NMR (200 MHz, CDCI3) 5 ppm (0 46мл), и добавляют суспензию фермента 1,98-2,03 (4s, 12Н, 4 ОАс), 3,75-3,84 (m, IH, H-5), (20мкл, 5ед p-D-глюкозидазы (20мг p-D4,11 (AB, Jgem = 6 Hz, Н-6а), 4,57 (s, 1H, OH), 4,99глюкозидазы в 400мкл воды) плюс 80мкл этанола) 5,25 (m, 4H, H-l, H-2, H-3 и H-4), 6,92 и 7,24 (AB, J при 37°С в течение 15мин Ферментативная реакg m = 8 Hz, 4H, Ph) MS (DIG) m/z 472 (M+NH4) e ция завершается Смесь фильтруют, растворители выпаривают, а - осадок хроматографируют на 3) 2,5-диоксопирролидйн-1-ил 4-(2,3,4,6-тетрасиликагеле с помощью смеси CH2CI2/CH3OH (9 1 0-ацетил- p -О-глюкопиранозил)бензил карбонат по объему) Выделяемся ч-істая производное 38 (35) (1 5мг, 60%) в форме вязкой жидкости красного 4) Способ получения цвета Способ А путем активации соединения 34 (617мг, 1 36 ммоль) с сукцинимидил хлороформаС35Н35О13 М=676 том (см получение соединения 5, Пример 1) ПоСоединение 38 можно преимущественно конлучается чистый продукт 35 (780мг, 95%) денсировать с другим сахаром (производной глюкуроновой кислоты, например) для получения Способ Б путем активации соединения 34 с продуктов 20 21 или 22 DSC (См получение (соединения) 19, Пример 3) (выход = 80%) 5) 4-диметил-тексизилилоксибензойный спирт (39) Соединение 35 C26H29O15N М=595 М р = 164°С [a]D2° = -18° 2 8г (4172 ммоль) имидазола добавляют к (с 0,9, СНСІз) IR (КВг) 1791 c m 1 (C=O), 1 H NMR раствору 4-гидроксибензойного спирта (2 55г, 20 6 (200 MHz, CDCI3) 6 ppm 2,02 (4s, 12H), 2,77 (S, ммоль) в 25мл безводного DMF Смесь переме4Н), 3,81 (m, 1Н), 4,14 (AB, J = 12 Hz, 1H), 4,24 (AB, шивают прикомнатной температуре до тех пор, J = 5 Hz, 1H), 5,02-5,31 (m, 6H), 6,95-7,31 (AB, J = пока не получается чистый (прозрачный) раствор, 12 Hz, 4H) MS(DIC/NH3) m/z 613(M+NH 4 ) + после чего в присутствии аргона охлаждают до 0°С Затем добавляют 4 4мл (22 6 ммоль) хлорида 4) N- [4- (2,3,4,6-тетра-0-ацетил- p -Dt- гексилдиметилзилила После перемешивания в глюкопиранозил )-бензилоксикарбонил] даунорутечение 48 часов при 0°С органическую фазу отбицин (36) мывают водой, высушивают на Na2SO4 и испаряют - Способ получения при пониженном давлении с образованием (соПутем конденсации соединения 35 (26мг, 0 04 единения) 39 (3 7г, 68%) в форме резины ммоль) с даунорубицином (20мг, 0 04 ммоль) (см получение (соединений) 6 и 13, Примеры 1 и 2) C15H53O26O2S1 M=266,44 IR (CDCI3) 3304cm 1 Чистое производное 36 (25мг, 90%) выделяется в (ОН), 2960cm 1 (СН) 1 Н NMR (90 MHz, CDCI3) 5 форме красного шеллака ppm 0,00 (s, 6H, CH3Si), 0,83 (d, 6H, CH3CCS1, J = 20 5 Hz), 0,83 (d, 6H, CH3CS1), 1,50 (m, 1H, CHCSi), Соединение 36 C49H53O22N М= 1007 [a] D = 4,50 (s, 2H, CH2Ph), 6,67-7,03 (AB, J9em = 6 Hz, 4H, 135° (с 0,04, СНСІз) IR (CDCI3) 3435 crri (ОН), Ph) MS (DIG) m/z 284 (M+NH4)+ 1758cm 1 (СО) Н NMR (400 MHz, COCI3) 5 ppm 1 29 (d, ЗН J = 5 Hz), 1,79 (AB, 1H, J = 3,5 Hz), 1,91 3) 2,5-диоксопирролидин-1-ил 4-диметил(AB, 1H, Jgem = 14 Hz), 2,07 (4s, 12H), 2,15 (AB, тексизилил-оксибензил карбонат (40) 1,85г (10 1H, J = 3,5 Hz), 2,35 (AB, 1H, J=12Hz), 2,50 (s, 3H), ммоль) соединения 35 и 0,8мл пиридина добав2,95 (AB, 1H, J = 18 Hz), 3,25 (AB, 1H, J = 18Hz), ляют к раствору DSC (1,39г, 5 ммоль) в безводном 3,70 (m, 1H), 3,84-3,90 (m, 1H), 3,92 (1H, OH), 4,11 этилацетате (50мл) После перемешивания в те(s, 3H, OMe), 4,17 (AB, 1H, 3 - 2 Hz), 4,24 (m, 1H), чение 24 часов при комнатной температуре смесь 4,30 (AB, 1H, J = 12 Hz), 5,00 (s 2H) 5,08 (d, 1H, J = фильтруют, а (ин)фильтрат конденсируют при 7 Hz) 5,14 (d, 1H J = 8,5 Hz), 5,17 (t, 1H, J = J' = 10 пониженном давлении, после чего образуется (соHz), 5,24-5,34 (m, 3H), 5,23 (dd, 1H, Н-Г, J < 0 5 Hz, единение) 40 (1,84г, 91%) в форме резины J1 = 3,5 Hz), 6,96 и 7,28 (AB, 4H), 7,42 (d, 1H, J = 8 C20H29O6S1N M=407,52 IR (CDCI3) 2961cm 1 Hz), 7,82 (t, J = J' = 8 Hz), 8,07 (d, 1H, J = 8 Hz), (СН), 1296cm 1 (CO) 1 H NMR (90 MHz, CDCI3) 6 13,25 (s, 1H), 14,00(5 1H) MS (DIC/NH3) m/z 1026 ррт 0,00 (s, 6H, CH3Si), 0,80 (d, 6H, CH3CCSi, 3=5 (M+NH4)+ Hz), 0,80 (s, 6H, CH3CSi), 1,50 (m, 1H, CHCSi), 2,73 (s, 4H, CH2CO), 4,57 (s, 2H, CH2Ph), 7,16 (AB, 4H, 5) N- [4- (p -D-глюкопиранозил) бензилоксиPh, Jgem = 6 Hz) MS (DIG) m/z 425 (M+NH4)+ карбонил] даунорубицин (37) 51 56981 4) N- [ 4- (диметил-тексизилилокси) бензилоксикарбонил ] даунорубицин (41) 76 мкл (0,73 ммоль) EtsN добавляют к смеси соединения 40 (29мг, 0,073 ммоль) и дауномицинона (20мг, 0,043 ммоль), растворенной в 0,4мл безводного DMF, после перемешивания в течение 5мин при комнатной температуре производится экстракция с етилацетатом Полученный раствор отмывают насыщенным раствором хлорида натрия и высушивают на Na2SO4 с последующим концентрированием при пониженном давлении В результате получается (соединение) 41 (24мг, 70%) в форме сиропа красного цвета 20 C43H52S1N M=819 [ a ] D =53° (с 0,03, СНСІз) IR 1 1 (CDCI 3 ) 3597-3439СГП (ОН) 2960 c m (СН), 1 1 1 7 6 2 c m (CO) H NMR (250 MHz, CDCI3) 5 ррт 0,00 (m, 6H, CH 3 Si), 0,82 (s, 6H, J = 5 Hz), 0,82 (s, 6Н), 1,27 (d, 3h, J = 6 Hz), 1,62 (m, 3H) 2,36 (s, 3H), 2,89 И 3,20 (AB, 2H, J - 6 Hz) 3,93 (s, 1H), 4,04 (s, 3H), 4,20 (m, 1H), 4,40 (m, 1H), 4,62 (s, 2H), 5,52 (s, 1H) 5,33 (d, 1H, J = 3 Hz) 5,49 (dd, 1H, J = 2, J' < 0,5 Hz), 6,95 И 7,19 (AB, 4H, J = 3 Hz), 734 (d, 1H, J = 9 Hz) MS (DIG) m/z 837 (M+NH 4 ) Пример 8 синтез І\І-[2-(а-О-галактопиранозил)5-нитробензилоксикарбо-нил]даунорубицина (48b)) и І\І-[2-(а-О-галакто-пиранозил)-5нитробензилокси-карбонил] доксорубицина (49Ь) В соответствии со схемой-диаграммой VIII, катализируемое SnCU гликосидирование 5-нитро-окрезола с перацетил-D-галактозой позволяет получить производную 42 С помощью бензильного бромирования, с использованием NBS в ССЦ, получают смесь (соединений) 43 и 44 Путем гидролиза дибромированной производной 44 получают альдегид 45, который можно восстановить с NABH4 в производную 46, тогда как гидролиз производной 43 дает смесь (соединений) 45 и 46 Для активации производной 46 используют 4-нитрофенил формат, а путем соединения 47 с даунорубицином и доксорубицином удается получить, соответственно, соединения 48а и 49а 1) 2-метил-4-нитрофенил 2,3,4, б-тетра-оацетил-а-О-галактопиранозид (42) К раствору 2-метил-4-нитрофенола (см J S Anderson and K C B r o e n , Synthetic Commun , J3, 233-236, 1983) и 1,2,3,4,б-пента-о-ацетил- p -1 галактозы (1г, 2,56 ммоль) медленно добавляют SnCU и экспонируют при комнатной температуре Реакционную смесь затем перемешивают в присутствии азота в течение 12 часов при 60°С После проведения гидролиза в ледяной воде, экстракции с CH2CI2 и последующей отмывки насыщенным раствором биокарбоната натрия и водой получают (соединение) 42, которое затем очищают хроматографией на силикагеле (выход = 45%) C21H25NO12 М=483 М Р = 1 6 б ° С [ a ] D 2 0 + 1 8 4 ° ( c 0,56, СНСІз) IR (СНСІз) 3030, 2960, 2925, 2860, 1745, 1580, 1520,1490, 1370, 1345, 1 2 2 0 c m 1 1 H NMR (200 MHz, CDCIs) 5 ppm, 1,96 (s, 3H), 2,05 (s, 3H), 2,09 (s, 3H) 2,19 (s, 3H), 2,36 (s, 3H), 4,13 (m, 2H), 4,28 (m, 1H), 5,85 (d, J = 4 Hz, 1 H), 7,21 (d, J = 9 Hz, 1H), 8,10 (s, 1H and d, J-9 Hz, 1H) 2) 2-бромометил-4-нитрофенил 2,3,4,6-тетраО-ацетил-а-В-галактопиранозид (43) 52 Способ получения Получают из (соединения) 42 с помощью NBS (1,5зкв )/ССЦ (см получение соединений 2 и 9, Пример 1, выход = 51%) Соединение 43 С21Н24ВПМО12 М = 562 Н NMR (200 MHZ, CDCI3) 5 ppm 1,96 (s, ЗН), 2,06 (s, ЗН), 2,12 (s, ЗН), 2,20 (s, ЗН), 4,13 (m, 2H), 4,32 (t, J = 6 Hz, 1H), 4,59 (ABq, J = 9 Hz, 2H), 5,38 (dd, J = 12 И 4 Hz, 1H), 5,5-5,8 (m, 2H), 5,99 (d, J = 4 Hz, 1H), 7,28 (d, J = 9 Hz, 1H), 8,20 (d, J = 9 Hz, 1H), 8,29 (s, 1H) 3) 2-дибромометил-4-нитрофенил 2,3,4,6тетра-о-ацетил-альфа -D-галактопиранозид (44) -Способ получения а) из (соединения) 49 с помощью NBS (1,5экв )/ССЦ (выход - 27% ), б) из (соединения) 42 с помощью NBS (4 экв )/ССЦ (выход = 60-90%) Соединение 44 C2iH 2 3Br 2 NOi2 M = 641 М р = 70°С [ a ] D 2 0 =+143° (с 0,47, CHCI 3 ) IR (CHCI 3 ) 3030, 3020, 2960, 2860, 1745, 1620, 1590, 1525, 1480, 1425, 1370, 1345, 1220, 1130, 1110,1075, 1040cm 1 1 Н NMR (200 MHz, CDCI3) 5 ppm 1,97 (s, ЗН), 2,06 (s, ЗН), 2,13 (s, ЗН), 2,20 (s, ЗН), 4,13 (m, 2Н), 4,31 (t, J = 6 Hz, 1H), 5,3-5,7 (m, 3H), 5,93 (d,J = 14 Hz, 1H), 7,01 (s, 1H), 7,29 (d, J = 9 Hz, 1H), 8,20 (d, J = 9 H z ) , 8,75 (s, 1H) 4) 2-формил-4-нитрофенил 2,3,4,6-тетра-оацетил-альфа-п-га-лактопиранозид (45) - Способ получения а) из (соединения) 43 с использованием AgNO 3 (выход = 15%), б) из (соединения) 44 с использованием AgNO 3 (выход = 83%), Соединение 45 C21H23NO13 М = 497 М р = 180°С [ a ] D 2 0 =+97° (с 2, CHCI 3 ) IR (CHCI 3 ) 3030, 2960, 2930, 2880, 2860, 1745, 1610, 1590, 1530, 1480, 1430, 1370 1345, 1220, 1180, 1125, 1110,1075, 1045cm i 1 H NMR (200 MHz, CDCI3) 5 ppm 1,98 (s, ЗН), 2,05 (s, ЗН), 2,08 (s, ЗН), 2,20 (s, ЗН), 4,13 (m, 2H), 4,35 (t, J = 6 Hz, TH), 5,3-5,6 (m, 3H), 5,99 (d, J = 4 Hz, 1H), 7,46 (d, J = 9 Hz, 1H), 8,41 (dd, J = 9 a n d 2 H z , 1H), 10,52 (s, 1H) 5) 2-гидроксиметил-4-нитрофенил 2,3,4,6тетра-О-ацетил-альфа-галактопиранозид (46) - Способ получения а) из (соединения) 43 с использованием AgNO3 (выход = 19%) (см получение (соединений) 11 и 18), 6) из (соединения) 45 с использованием МаВШ/ТНР/МеОН (выход = 73%) Соединение 46 C21H25NO13 М = 499 М р = 140°С [ a ] D 2 0 - 1 5 2 ° (сО,42, СОСІз) IR (CDCI3) 3700, 3600, 3030, 2970, 2940, 2860, 1750, 1630, 1625, 1595, 1585, 1370, 1350, 1210, 1130, 1110,1075, 1 0 3 5 c m 1 NMR (200 MHz, CHCI3) 5 ppm 1,97 (s, 3H), 2,05 (s, 3H), 2,10 (s, 3H), 2,19 (s, 3H), 4,12 (m, 3H), 4,33 (t, J = 6 Hz, 1H), 4,71 (d, J - 14 Hz, 1H), 4,89 (d, J = 14 Hz, 1H), 5,35-5,6 (m, 3H), 5,87 (d, J = 2 Hz, 1H), 7,28 (d, J = 9 Hz, 1H), 8,19(dd, J = 9 and 2Hz,1H), 8,32 (d, J = 2 H z , 1H) б) 4-нитрофенил 2-(2,3,4"6-тетра-о-ацетилальфа-в-галакто-пиранозил)-5-нитробешил карбонат (47) -Способ получения Из (соединения) 46 и р-нитрофенил хлороформата (выход = 52%) 53 56981 1 Соединение 47 C28H28N2O17 M =664 'Н NMR (200 MHz, CDCI3) 5 ppm 1,93 (s, 3H), 2,04 (s, 3H), 2,09 (s, 3H), 2,19 (s, 3H), 4,12 (m, 2H), 4,30 (t, J = 6 Hz, 1H), 5,3-5,6 (m, 5H), 5,93 (a, J - 4 Hz, 1H), 7,34 (d, J = 9 Hz, 1H), 7,44 (d, J = 9 Hz, 1H), 8,2 8,4 (m 4H) 7) N-[2-(2,3,4, б-тетра-о-ацетил-a-Dгалаїсгопиранозил) -5-нитробензилоксикарбонил ] даунорубицин (48а) - Способ получения Из (соединения) 47 и даунорубицина (см получение (соединения) 6, Пример 1, выход = 31%) Соединение 48 Ь C49H52N2O24 М = 1052 И NMR (200 MHz, CDCI3) 5 ppm 1,86 (s, ЗН), 2,02 (s, ЗН), 2,08 (s, ЗН), 2,14 (s, ЗН), 2,39 (s, ЗН), 2,94 (d, J-20 Hz, 1H), 3,23 (d, J = 20 Hz, 11H), 3,60 (s, 1H), 4,08 (s, 3H), 5,02 (d, J = 12 Hz, 1H), 5,21 (d, J = 12 Hz, 1H), 5,35,8 (m, H), 5,93 (d, J = 4 Hz, 1H), 7,18 (d, J = 9 Hz, 1H), 7,40 (d, J = 8 Hz, 1H), 7,80 (t, J = 8 Hz, 1H), 8,02 (d, J = 8 Hz, 1H), 8,17 (dd, J = 9 И 2Hz, 1H), 8,26 (обширн s, 1H) И 13,99 (s, 1H) 8) N[2-( a-D-галаісгопиранозил) -5нитробензилоксикарбо-нил]даунорубицин (48b) -Способ получения Из (соединения) 48а с использованием МеONa (кат)/МеОН (выход = 83%) Соединение 48Ь аморфное C41H44N2O20 М = 884 М р = 140°С (деком п) 9) N-[2-(2,3,4, б-тетра-о-ацетил-a-Dгалактопиранозил) -5-нитробензилоксик чрбонил] доксорубицин (49а) - Способ получения Из (соединения) 47 и доксорубицина Выход = 13% Соединение 49а C49H52N2O25 М= 1068 1 UNMR (200MHz, CDCI3) 5 ppm 1,86 (s, ЗН), 2,01 (s, ЗН), 2,09 (s, ЗН), 2,13 (S, ЗН), 2,99 (S, 1H), 3,03 (d, J = 20 Hz, 1H), 3,29 (d, J - 20 Hz, 1H), 4,10 (s, 3H), 4,59 (s, 1H), 4,74 (s, 1H), 5,07 (d, J -12 Hz, 1H), 5,22 (d, J = 12 Hz, 1H), 5,3-5,8 (m, H), 5,95 (d, J = 4 Hz, 1H), 7,17 (d, J = 9 Hz, 1H), 7,40 (d, J = 8 Hz, 1H), 7,80 (t, J = 8 Hz, 1H), 8,03 (d, J-8 Hz, 1H), 8,18 (dd, J - 9 and 2 Hz, 1H), 8,27 (обширн s, 1H) 13,28 (s, 1H), 14,0 (s, 1H) 10) N- [ 2-( a-D-галактопиранозил) -5нитробензилокгакарбонил] доксорубицин (49b) Получают обработкой (соединения) 49а МеONa/MeOH (см получение (соединений) 7 и 14, Примеры 1 и 2) Твердое красное вещество C41H44N2O21 M = 900 Пример 9 Синтез І\І-[2-((р-О-глюкогаІранозил)уроновая кислота )-5нитробензилоксикарбонил]даунорубицина (54с) В соответствии со схемой-диаграммой IX, бромид метил (перацетил-бета-Dглюкопиранозил)уроната конденсируется с 2гидрокси-5-нитробензальдегидом в присутствии АдгО при комнатной температуре Гликозид 51 (выход = 46%) превращается в производную 52 (NaBH4/THF/MeOH, выход - 70%) и активированную производную 52, т е (производную) 53 (выход = 73%), которая, вступая в реакцию с даунорубицином, позволяет получить производную 54а (выход = 62%) 1) метил (2-формил-4-нитрофенил 2,3,4, -трио-ацетил-р-О-глюкопиранозид)уронат (51) 54 -Способ получения Раствор бромида метил (2,3,4-три-о-ацетилбета-О-глюкопиранозил)уроната (1,45г, 3,64 ммоль) и 2-гидрокси-5-нитробензальдегида (609мг, 3 64 ммоль) в 22мл ацетонитрила, содержащего оксид серебра (173г, 5 6 ммоль), перемешивали в течение 4х часов при комнатной температуре После фильтрации реакционной среды и испарения фильтрата с помощью импульсной хроматографии удается получить 800мг (соединения) 51 (выход = 46%) Соединение 51 2 C20H21NO13 М=483Мр = 173-174°С [a]D °-52° (с 1, СНСІз) IR (CH2CI2) 3060, 2960, 1755, 1690, 1 1 1590, 1530, cm HNMR (200 MHz, CDCI3) 5 ppm 2,09 (s, 9H), 3,73 (s, ЗН), 4,40 (d, H-5, J = 8,5 Hz), 5,5 (m, 4H), 7,32 (d, 1H, J = 9,1 Hz), 8,42 (dd, 1H, J 9 1 и 3 Hz), 8,67 (d, 1H, J = 3 Hz), 10,31 (s, 1H) 2) Метил (2-гидроксим дил-4-нитрофенил 2,3,4,-три-о-ацетил-р-О-глюкопиранозид)уронат (52) -Способ получения Из (соединения) 51 с помощью NaBH4/THF/MeOH (выход = 70%) Соединение 52 C20H23NO13 М =485 М р = 137-145°С [a]D2°34° (с 0,7, СНСІз) IR (CH2CI2) 3600, 3570, 3060, 2960, 1755, 1620, 1590, 1525, 1485, 1435, 1370, 1340, 1230, 1075, 1040, 900 cm 1 1TH NMR (200 MHz, CDCI3) 5 ppm 2,07 (s, ЗН), 2,08 (S, ЗН), 2,10 (s, ЗН), 2,95 (ОН), 3,72 (s, ЗН), 4,30 (d, H-5, J - 8,7 Hz), 4,61 and 4,72 (ABq, 2H, J = 13,8 Hz), 5,32 (m, 4H), 7,08 (d, 1H, J = 9 Hz), 8,12 (dd, 1H, J - 9 И J = 2,7 Hz), 8,27 (с, 1Н, J = 2,7 Hz), SM(FAB+) m/z 508 (M+Na)+ 3) 4-нитрофенил 2-(метил (2,3,4,-три-о-ацетилР-О-глюко-пиранозил)уронат)-5-нитробензил карбонат (53) -Способ получения Из (соединения) 52 и паранитрофенил хлороформата (выход = 73%) Соединение 53 C27H26N2O16 М =634 М р = 154-155°С [a]D2°-=34,5° (с 1, СНСІз) IR (СН2СЬ) 2960, 2880, 1760,1620, 1595, 1525, 1490, 1370, 1345, 1230, 1215, 1080, 1040, 860cm 1 ЬИ NMR (200 MHz, CDCI3) 5 ppm 2,08 and 2,09 (2s, 9H), 3,74 (s, 3H), 4,36 (обшир, d, 1H, J = 8,7 Hz) 5,36 (m, 6H), 7,23 (d, 1H, J = 9,1 Hz), 7,43 (d, 2H, J - 8,3 Hz) 8,26 (m, 4H) 4) N-[2-(Me™i (2,3,4-три-о-ацетил-р-Оглюкопиранозил) уронат)-5нитробензилоксикарбонил] даунорубицин (54а) -Способ получения Из (соединения) 53 и даунорубицина (выход = 62%) Соединение 54а C48H50O24N2 M = 1038 М р = 142-145°С [a] D 2 0 +115° (с 0,6, CHCI3) IR (СН2СІ2) 2950, 1755, 1720, 1710, 1620, 1580, 1525, 1345, 1230, 1210, 1110 1080, 1035cm 1ТН NMR (200 MHz, CDCI3) 5 ppm 1,32 (d, ЗН, J = 7,3 Hz), 2,09 И 2,11 (2s, 9H), 2,43 (s, ЗН), 2,93 И 3,24 (ABq, 2H, J = 19 Hz), 3,59 (s, ЗН), 4,30 (m, 2H), 4,51 (s, 1H), 4,96 И 5,11 (ABq, 2H, J = 13 Hz), 5,20 И 5,60 (m, 6H), 7,14 (d, 1H, J = 8,5Hz), 7,41 (d, 1H, J - 8 Hz), 7,79 (t, 1H, J = 8 Hz), 8,05 (d, 1H, J = 8 Hz), 8,21 (2H), 12,15 (s, 1H), 12,91 (s,1H) 5) N-[2-(MeTnn (р-О-глюкопиранозил)уронат)-5нитробен-зилоксикарбонил] даунорубицин (54b) Из (соединения) 54а с MeONa/MeOH (см по 56 55 56981 лучение (соединений 7 и 14, Примеры 1 и 2) Монобромированием соединения 55 с фотоТвердое красное вещество химической активацией (см получение соединения 2, выход = 80%) C42H44N2O21 М = 912 NMR (CD3COCD3) 5 Соединение 56 ррт 2,37 (s, ЗН), 3,70 (s, ЗН), 6,50 (d, J = 7,5 Hz, 1 1Н), 7,32 (d, J - 7,4 Hz, 1H), 7,60 (d, J = 7,4 Hz 1H), С21Н24О10СІВГ М = 551,5 -ТН NMR (270 MHz, 7,89 (m, 2H), 8,19 (m, 2H), 13,30 (s, 1H), 1415 (S, CDCI3) 5 ppm 2,00 (s, ЗН), 2,03 (s, ЗН), 2,12 (s, 1H) ЗН), 2,18 (s, ЗН) 4,09 (dd, 1H, J = 12, J' = 7 Hz), 1 4,14(dd, 1H, J = 12, J = 6 Hz), 4,42 (s, 2H), 4,50 6) І\І-[2-((р-О-глюкопиранозил)уроновая кисло1 (ddd, 1H, J = 7, J = 6, J" = 1 Hz), 5,27 (dd, 1H, J = та )-5-нитро1 1 10, J =4 Hz), 5,58 (m, 1H), 5,60 (dd, 1H, J = 10, J = бензилоксикарбонил]даунорубицин(54с) 4 Hz), 5,80 (d, 1H, J =4 Hz), 7 13 (d, 1H J = 8 Hz), Из (соединения) 54Ь и ВаО (см получение 7,22 (dd, 1H, J = 8, J" = 2 Hz), 7,42 (d, 1H, J = 2 Hz) (соединения) 22 в Примере 3) Твердое красное MS (DIC/NH3) m/z 571 (M+NH4) , 569 (M+NH4) , вещество, C41H42N2O21 M = 898 490, 331 Пример 10 Синтез N-((p-D3) 2-хлоро-4-гидроксиметилфенил 2,3,4,6глюкопиранозил)уроновая кислота)-5тетра-о-ацетил-а-О-галактопиранозид (57) нитробензилоксикарбонил]доксорубицина (83с) -Способ получения 1) ІЧ-[2-(метил (2,3,4-три-о-ацетил-р-ОИз (соединения) 56 (см получение (соединеглюкопиранозил)уронат) -5-нитробензшюксиния) 4, выход = 34% ) карбонил ]доксорубицин (83а) Соединение 57 -Способ получения C21H25O11CI М = 488 5 ЬИ NMR (270 MHz, Из (соединения) 53 и доксорубицина (выход = CDCI3) 5 ppm 1,98 (s, ЗН), 2,04 (s, ЗН), 2,10 (s, 65%) ЗН), 2,18 (s, ЗН) 4,09 (dd, IH, J = 12, J' = 7 Hz), 4,14 Соединение 83а C48H50N2O25 М = 1054 F = (dd, 1H, J -12, J' = 6 Hz), 4,49 (ddd, 1H, J = 7, J' = 6, 162-167°С (dec), [a] D 2 0 122° (с 0,5, CHCI3) IR J" = 1Hz), 4,64 (s, 2H), 5,26 (dd, 1H, J = 10, J' = 4 (CHzCh) 1757, 1720, 1618, 1580, 1525, 1410, 1370, Hz), 5,58 (m, 1H), 5,60 (dd, 1H, J = 10, J' = 4 Hz), 1344, 1230cm 1 NMR (200 MHz, CDCI3) 5 ppm 1,30 5,77 (d, 1H, J =4 Hz), 7,15 (d, 1H, J = 8 Hz), 7,20 (dd (d, 3H, J - 7,3 Hz), 2,06 И 2,08 (2s, 9H), 2,94 И 3,23 1H, J = 8, J1 = 2 Hz), 7,42 (d, 1H, J = 2 Hz) MS (ABq, 2H, J = 19 Hz) 3,60 (s, 3H), 4,06 (s, 3H), 4,28 (DIC/NH3) m/z 506 (M+NH4)+, 472, 331 (d, 1H, J = 9 Hz), 5,03 (ABq, 2H, J - 13 Hz), 5,27 4) 2,5-диоксопирролидин-1-ил З-хлоро-45,51 (m, 6H), 7,11 (d, IH, J = 8 Hz), 7,99 (d, 1H, J = 8 (2,3,4,6-тетра-о-ацетил-а-О-галактопиранозил) Hz), 8,15 (m, 2H), 12,62-(s, 1H), 13,15 (s, 1H, бензил карбонат (58) 2) ІЧ-[2-(метил (p-D-глюкопиранозил) уронат )-Способ получения 5-нитро-бензилоксикарбонил] доксорубицин (83b) Из (соединения) 57 и дисукцинимидил карбо-Способ получения ната (DSC) (см получение (соединения) 19, ПриИз (соединения) 83а с MeONa/MeOH (см помер 3) лучение (соединений) 7 и 14, Пример 1 и 2) Необходимо отметить, что из-за своей неусСоединение 83b C42H44N2O22 = 928 F= тойчивости соединение 58 не подлежит очистке и 180°С (dec), [a] D 0° (с 0,5, CHCI3), NMR (200 MHz, выделению на колонке двуокиси кремния (кварца) CD3COCO3) 5 ppm 1,29 (d, ЗН, J = 7,3 Hz), 3,79 (s, Соединение 58 C26H28CINOi5 M= 629 5 ЗН), 4,07 (s, ЗН), 6,09 (d, NH), 7,12 (d, 1H, J = 8 6 5) N- [З-хлоро-4- (2,3,4, б-тетра-о-ацетилHz) 7,41 (d, 1H, J = 8 Hz), 7,79 (t, 1H, J = 8 Hz), 8,00 альфа-в-галактопи-ранозил) бензилоксикарбонил] (d, 1H, J = 8 Hz), 8,16 (m, 2H), 12,75 (s, 1H), 13,25 даунорубицин ( 5 9 ) (s, 1H) -Способ получения 3) І\І-[2-((р-О-глюкопиранозил)уроновая кислоСвязыванием (соединения) 58 с даунорубицита)-5-нитро-бензилоксикарбонил] доксорубицин ном (см получение (соединения) 6, выход = 20%) (83с) 1 Соединение 59 C49H52CINO22 М = 1041 5 'Н - Способ получения NMR (270 MHz, DMSO) 5 ppm 1,12 (d, ЗН, J = 7 Из (соединения) 83Ь с NAOH или эстеразой из Hz), 1,48 (m, 1H), 1,88 (m, 2H), 1,98 (s, 3H), 2,02 (s, печени свиньи (КФ 3 1 1 1 ) -Соединение 83с 3H), 2,04 (s, 3H), 2,15 (s, 3H), 2,23 (m, 1H), 2,25 (s, красное твердое вещество, C41H42N2O22 M = 914 3H), 2,76 (m, 1H), 2,96 (m, 1H), 3,50-4,20 (m, 5H), Пример 11 1) 2-хлоро-4-метилфенил 2,3,4, б4,00 (s, 3H), 4,44 (m, 1H) 4,72 (m, 1H) 4,90 (m, 3H) тетра-о-ацетил-а-О-галактопиранозид (55) 5,20 (m, 1H) 5,32 (m, 1H) 5,43 (m, 2H) 5,53 (s, 1H) -Способ получения Из 2,3,4,6-тетра-о-ацетил5,85 (d, 1H, J = 4 Hz), 6,94 (m, 1H) 7,23 (m, 2H) 7,47 a-D-галактопиранозы и 2-хл о ро-4-метил фенол (d, 1H, J = 2 Hz), 7,66 (m, 1H) 7,92 (m, 2H) MS (см получение (соединения) 1, выход = 40%) (DIC/NH3) m/z 1060(M+NH4)+, 506, 331 1 Соединение 55 C21H25O10CI М = 472 5 - 'Н 6 ) N-1 З-хлоро-4- ( a-D-галактопиранозил) бенNMR (270 MHz, CDCI3) 5 ppm 2,02 (s, ЗН), 2,06 (s, зилоксикарбонил] даунорубицин (60) ЗН), 2,14 (s, ЗН), 2,20 (s, ЗН) 2,32 (s, ЗН), 4,12 (dd, -Способ получения 1Н, J-12, J1 = 7 Hz), 4,17 (dd, 1H, J = 12, J = 6 1 Из (соединения) 59 (см получение (соединеHz),4,54 (ddd, 1H, J = 7, J = 6, J" = 1 Hz), 5,29 (dd, ния) 7, выход = 91%) 1H, J = 10, J 1 =4 Hz), 5,61 (m, 1H), 5,63 (dd, 1H, J = Пример 12 Синтез N-[3-HHTpo-4-((p-D10, J1 = 4 Hz), 5,76 (d, 1H, J = 4 Hz), 8,16 (m, 2H), глюкопиранозил)уроновая кислота) бечзилокси12,75 (s, 1H), 13,25 (s, 1H) карбонил] даунорубицин (64с) 2 ) 2-хлоро-4-бромометилфенил 2,3,4,6-тетра1) Метил (4-формил-2-нитрофенил 2,3,4-три-со-ацетил-а-0 -галактопиранозид (56) ацетил-р-О-глюкопиранозид) уронат(61) -Способ получения ч 57 -Способ получения Из раствора бромида метил (2,3,4,-три-оацетил-О-глюкопиранозил)уроната (5,3г), з-нитрор-гидроксибенчальдегида(3,55 г) и оксида серебра (15, 45г) при условиях, описанных в получении (соединения) 51 После применения способов импульсной хроматографии и кристаллизации получают 5,35г (80%) чистого (соединения) 61 Соединение 61 C20H21NO13 М = 483 М р = 172-173°С [ a ] D 2 0 = + 10° (с 1, СНСІз) IR (lac) 1760, 1 2 3 0 c m 1 ТН NMR (250 MHz, CDCI3) 5 ppm 2,16 (s, 3H), 2,12 (s, 3H), 2,07 (s, 3H), 3,71 (s, 3H, OMe), 4,33 (dl_, 1H, J - 8,2 Hz), 5,45-5,25 (m, 4H), 7,49 (dl_, 1H, J = 7,5 Hz), 8,08 (dd, 1H, J = 7,5, J 1 = 1,8 Hz), 8,31 (dd, 1H, J = 1,8 Hz), 9,97 (s, 1H) MS (DIC/NH3) m/z 501 (M+NH 4 ) + 2) Метил (4-гидроксиметил-2-нитрофенил 2,3,4-три-О-ацетип-р-0-глюкопиранозид)уронат (62) -Способ получения Из (соединения) 61 с помощью NaBH 4 /THF/MeOH (выход = 72%) Соединение 62 C20H23NO13 М - 485 М р = 173-174°С [a] D 2 ° = + 10° (с 1, СНСІз) 1'Н NMR 5 ppm 2,08 (s, 6H), 2,01 (s, ЗН), 3,63 (s, ЗН), 4,12 (d, 1H, J = 8 Hz), 4,62 (s, 2H), 5,35-5,02 (m, 4H), 7,21 (d, 1H, J = 7 Hz), 7,39 (cLcL, IH, J = 7 Hz, J 1 = 1,8 Hz), 7,65 (d, 1H, J = 1,8 Hz) MS(DIC/NH 3 ) m/z 503 (M+NH 4 ) + 3) І\І-[3-нитро-4-(метил(2,3,4-три-о-ацетил-р-Оглюкопиранозил)уронат) бензилоксикарбонил ]даунорубицин (64а) -Способ получения Карбонат 63 получают в качестве промежуточного подукта из (соединения) 62 и DSC, он не очищается, а мгновенно вступает в дальнейшую реакцию с даунорубицином при условиях, описанных для получения (соединения) 54, Соединение 64а' C48H50N2O24 М = 1038 М р 137-138°С [a] D 2 ° = +88° (о 0,5, хлороформ) IR (CDCI 2 ) 1760, 1720, 1220СГП-1 ЬИ NMR , 6 ppm 1,30 (d, ЗН, J = б Hz), 1,75 (m, 2H), 2,12 (s, 3H), 2,10 (s, 3H), 2,13 (s, 3H,), 2,45 (s, 3H), 3,00 (d, 1H, J = 20 Hz), 3,30 (d, 1H, J = 20 Hz), 3,75 (s, 3H), 4,14 (s, 3H), 4,26 (m, 2H), 4,47 (s, 1H), 5,08 (s, 2H), 5,10-5,47 (m, 4H), 5,58 (d, 1H), 7,50 (1H), 8,05 (1H), 14,00 (s, 1H), 13,30 (s, 1H) 4) N(4-гидрокси-Знитробензилоксикарбоннл)даунорубицин-р-Опгюкопиранозид (64b) Из соеданения 64а с меОН/MeONa (см получение соединений 7 и 14, Примеры 1 и 2) Твердое вещество красного цвета C42H44N2O12 M = 912 5) N- (4-гидрокси-З-нитробензилоксикарбонил) даунорубицин-р-О-глюкопиранозид (64с) Из соединения 64Ь и ВаО или КагСОз (см получение соединения 22 в Примере 3) Твердое вещество красного цвета C41H42N2O21 M = 898 Пример 13 Синтез ІЧ-[4-метокси-5-иитро-2-((рО-глюкопиранозил)уроновая кислота)бензилоксикарбонил]даунорубицина (68с) В соответствии со схемой-диаграммой XII, в ходе АдгО-катализируемого гликосидирования 2гидрокси-4-метокси-5-нитробензальдегида с бромидом метил (перацетил-бета-О-глюкопиранозил)уроната получается соединение 65, которое затем превращается в производную 68с с помощью спо 56981 58 соба, описанного в Примере 9 1) Метил (2-формил-5-метокси-4-нитрофенил 2,3,4-три-о-ацетил-бета-О-глюкопиранозид)уронат (65) Это соединение получают с выходом 53% с помощью способа, использованного для получения соединения 51 (см Пример 9) Соединение 65 C21H23NO14 М = 513 М р = 159°С [a] D 2 ° =-83° (о 0,95, СНСІз) IR (СНСІз) 3080, ЗОЮ, 1765, 1695 1620, 1580, 1450, 1375, 1300,1220, 1080 1 0 4 5 c m 1 1 ТН NMR (200 MHz, CDCI3) 5 ppm 2,08 (s, 6H), 2,10 (s, 3H), 3,74 (s, 3H), 4,04 (s, 3H), 4,39 (d, 1H, J = 9 Hz), 5,39 (m, 4H), 6,92 (s, 1H), 8,43 (s, 1H), 10,16 (s, 1H) 2) Метил (2-гидроксиметил 5-метокси-4нитрофенил 2,3,4-три-о-ацетил-р-Оглюкопиранозид) уронат (66) Приготавливается из соединения 65 с использованием NaBKU/THF/MeOH (выход = 30%) Соединение 66 C21H25NO14 M = 514 М р 176°С [ a ] D 2 0 = -61° (0 1,05, СНСІз) IR (CHCI3) 3560, 3040, 2960, 1760, 1625, 1590 1530,1445, 1375, 1350,1290, 1220, 1075 1040cm 1 TH NMR (200 MHz, CDCI3) 5 ppm 2,07 (s, ЗН), 2,09 (s, ЗН), 2,13 (s, ЗН), 3,72 (s, ЗН), 3,96 (s, ЗН), 4,27 (1H), 4,50 and 4,63 (qAB, 2H, J - 12,9 Hz), 5,23 (m, 4H), 6,99 (s, 1H),7,99(s, 1H) 3) 4-нитрофенил 4-метокси-5-нитро-2- (метил (2,3,4-три-О-ацетил-р-0-глюкопиранозил)уронат бензил карбонат (67) Получают из соединения 66 и 4-нитрофенил хлороформата (выход = 74%) Соединение 67 C28H28N2O18 М = 680 М р - 90°0 [ a ] D 2 0 =-47° (с 1,05, СНСІз) IR (СНСІз) 3020, 2960, 1745, 1615, 1575, 1435, 1340, 1280, 1205, 1068, 1030, 895, 852cm 1 1TH NMR (200 MHz, CDCI3) 5 ppm 2,06 (s, 3H), 2,07 (s, 3H), 2,09 (s, 3H), 3,75 (в, ЗН), 3,98 (s, ЗН), 4,35 (1H), 5,14 И 5,24 (qAB, 2H, J = 12 Hz), 5,39 (m, 4H), 6,92 (s, 1H), 7,43 (d, 2H, J - 9,1 Hz), 8,09 (s, 1H), 8,30 (d, 2H, J =9 1 Hz) 4) N-[4-MeTOKCH-5-HHTpo-2- (метил (2,3,4-три-оацетил-р-О-глюкопиранозил) уронат) бензилоксикарбонил] даунорубицин (68а) Получают из соединения 67 и дауяорубицина (выход - 83%) Соединение 68а C49H52N2O25 M = 1068 М р 153°С (декомп) [ c ] D 2 0 = +105° (с 0,24, СНСІз) 1'Н NMR (200 MHz, CDCI3) 5 ppm 1,31 (d, ЗН, J =7 Hz), 2,07 and 2,12 (2s, 9H), 2,42 (s, 3H), 3,24 (qAB, 2H, J = 18,7 Hz), 3,62 (s, 3H), 3,94 (s, 3H), 4,08 (s, 3H), 4,93 (qAB, 2H), 6,88 (s, 1H), 7,39 (d, 1H, J =8 Hz), 7,77 (t, 1H, J = 8 Hz), 7,94 (s, 1H), 8,03-(d, 1H J =8 Hz), 9,59 (s, 1H) 5) N-[4-MeTOKCH-5-HHTpo-2(метил (P-Dглюкопиранозил)-уронат) бензилоксикарбонил] даунорубицин (68b) Получают из соединения 68а (выход = 91%) с помощью MeONa//MeOH (-20°C, 12 часов) Соединение 68b C43H46N2O22 М = 942 М р = 176-177°С [a] D 2 0 = +1° (с 0,19 CHCI3) IR (CHCI3) 3000, 1750, 1720, 1710, 1620, 1580, 1520, 1440, 1410, 1365, 1345,1280cm1 ЬИ NMR (200 MHz, CD3OD) 5 ppm 2,43 (s, ЗН), 3,10 (qAB, 2H), 3,79 (s, ЗН), 3,95 (s, ЗН), 4,08 (s, ЗН), 6,28 (d, 1H), 6,87 (s, 1Н), 7,46 (d, 1Н, J = 8 Hz), 7,83 (d, 1H, J - 8 Hz), 59 56981 8,02 (m, 2H) SM (FAB+) m/z 109 6) Ы-[4-метокси-5нитро-2-( (р-О-глюкопиранозил)уроновая кислота) бензилоксикарбонил] даунорубицин (68с) Получение из 68Ь с помощью Na2CCO3/MeOH/H2O Соединение 68с твердое вещество красного цвета C42H44N2O22- M = 928 Пример 14 Синтез N-[2-((p-Dглюкопиранозил)уроновая кислота) -5-хлоробензилоксикарбонил] даунорубицина (82с) 1) Метил (2-формил-4-хлорофенил 2,3,4-триО-ацетил-р-О-глюкопиранозид) уронат (79) Это соединение получают (выход = 41%) с помощью способа, описанного для (получения соединения) 51 (см Пример 9) Соединение 79 С20Н21СЮ11 М = 472,5, F = 20 156-157°С, [ a ] D = -39° (с 1, CHCI 3 ), IR (CH 2 CI 2 ) 2940, 2870, 1755, 1680, 1585, 1 4 6 5 , c m 1 NMR (200 MHz, CDCI3) 5 р р т 2,09 (s, 3H), 3,74 (s, 3H), 4,25 (d, 1Н, J = 8,5 Hz), 5,30 ( т , 4Н), 7,10 (d, 1H, J = 8,5 Hz), 7,53 (dd, 1Н, J = 8,5 И 2 5 Hz), 7,80 (d, 1Н, J = 2 5 Hz), 10,27 (s, 1H) 2) Метил (2-гидроксиметил-4-хлорофенил 2,3,4-три-О-ацетил-р-0-глюкопиранозид) уронат (80) Это соединение получают из соединения 79 с использованием NaBH4/THF/MeOH (выход = 70%) Соединение 80 С20Н23СЮ11, М = 474 5, F = 120°С, [ a ] D 2 0 = -20° (с 0 9 CHCI 3 ) , IR (CH 2 CI 2 ) 3050, 2980, 1750, 1470, 1415, 1250, 1 2 2 0 c m 1 , NMR (200 MHz, CDCI3) 6 ppm 2 06 (s, 3H) 2 07 (s, 3H), 2,11 (s, 3H), 3,71 (s, 3H) 4,14 (d, 1H, J = 9 Hz), 4,3 И 4,72 (ABq, 2H, J = 13 Hz), 5,11 (d, 1H, J-6,5 Hz), 5,34 (m, 3H), 6,94 (d, 1H, J - 8,7 Hz), 7,23 (dd, 1H, J - 8,7 И 2,5 Hz), 7,36 (d, 1H, J = 2,5 Hz) 3) 4-хлорофенил 2-(метил (2,3,4-три-О-ацетилР-О-глюкопиранозил)уронат)-5-нитробензил карбонат (81) -Способ получения Из соединения 80 и 4-нитрофенил хлороформата (выход = 50%) Соединение 81 С27Н26СЮ14, М = 623 5 , F= 136°С, NMR (200 MHz, CDCI3) 5 ppm 2,08 (s, 9H), 3,74 (s, ЗН), 4,22 (d, большой, 1Н, J = 8,7 Hz), 5,30 (m, 6H), 7,03 (d, 1H, J = 8 2 Hz), 7,30 (m, 4H), 8,30 (d, 2H, J = 8,3 Hz) 3) ІЧ-[2-(метил (2,3,4~три-о-ацетил-р-Оглюкопиранозил) уронат )-5-хлоробензилоксикарбонил] даунорубицин (82а) -Способ получения Из соединения 81 и даунорубицина (выход = 73%) Соединение 81 C48H50CINO22, М - 1027 5 , F = 155°С (dec), [ a ] D 2 0 125° (с 0,24, CHCI 3 ) , IR (CH 2 CI 2 ) 1755, 1715, 1610, 1 5 7 5 c m 1 , NMR (200 MHz, CDCI3) 5 ppm 1,31 (d, ЗН, J = 7 Hz), 2,05 (s, 9H), 2,08 (s, 3H), 2,42 (s,3H), 2,94 И 3 75 (ABq, 2H, J = 19 Hz), 3,62 (s, 3H), 4,06 (s, 3H), 4,20 (m, 2H), 4,53 (обшир, s, 1H), 4,96 (обшир, s, 2H), 5,15-5,52 (m, 6H), 7,00 (d, 1H, J = 8 Hz), 7,20 (m, 2H), 7,40 (d, 1H, J = 8 Hz), 7,79 (t, 1H, J = 8 - 67 -Hz), 8,05 (d, 1H, J = 8 Hz) 5) N-[2-(MeTnn (р-О-глюкопиранозил)уронат)-5хлоро-бензилоксикарбонил] даунорубицин (82b) -Способ получения Из соединения 82а с использованием Ме 60 ONa/MeOH (см получение соединелий 7 и 14, Примеры 1 и 2), выход = 47% Соединение 82Ь красное твердое вещество C42H44CINO19 М = 901 5 , F- 1б7-170°С , [ a ] D 0° (с 0 03, МеОН), NMR (200 MHz, CDCI3) 5 ppm 2,42 (s, ЗН), 2,96 И 3 23 (ABq, 2H, J - 18 Hz), 3,79 (s, ЗН), 4,07 (s, ЗН), 5,89 (d, NH), 6,99 (обшир, d, 1H, J - 8 Hz), 7,20 (обшир, d, 1H, J - 8 Hz), 7,33 (s, 1H), 7,41 (d, 1H, J =8 Hz), 7,80 (t, 1H, J = 8 Hz), 8,03 (d, 1H, J = 8 H z ) 6) ^[2-((р-О-глюкопкранозил)уроновая кислота)-5-хлоро-бензилоксикарбонил] даунорубицин (82с) -Способ получения Из соединения 82b с использованием Na2CO3 (см получение (соединения) 22, Пример 3) Соединение 82с твердое вещество красного цвета C41H42CINO19 M = 887,5 Пример 15 Синтез N-14-гидрокси-З-нитробензилоксикарбонил) доксорубицин p-Dглюкуронида (70с) 1) 4-нитро-фенил 4-(метил (2,3,4-три-Оацетил-р-глюкопиранозил) уронат)-5-нитро-бензил карбонат (69) -Способ получения Из соединения 62 и паранитрофенил хлороформата (выход = 47%) Соединение 69 C27H26N2O17, М = 650 F = 126°С [ a ] D 2 0 =+ 12° (с 0,1, СНСІз) IR (KBr)vmax 1730 (СО, Эфир), 1210 , 1 Н NMR (90 MHz, CDCI3) 5 ppm 7,81 (d, 1Н, J = 5 Hz), 7,54 dd, 1H, J = 8 4 Hz), 7,30 (d, 1H, J - 8,4 Hz), 5,36-5,29 (m, 3H), 5,18 (d, 1H, J = 6,7 Hz), 4,72 (s, 2H), 4,20 (d, 1H, J = 8,4 Hz), 3,74 (s, 3H), 2,12 (s, 3H), 2,06 (s, 3H), 2,05 (s, 3H), SM (DCI/NH3) m/z (M+18) + , 668, 503, 443 2) ^[3-нитро-4-(метил(2,3,4-три-О-ацетил-р-0глюкопиранозил)уронат)-бензилоксикарбонил] доксорубицин (70а) -Способ получения Из соединения 69 и доксорубицина (выход = 6%) Соединение 70а C48H50O25N2, М= 1 054, F 20 114°С [ a ] D =+ 121° (с 0,05, CHCI 3 ) IR (KBr)vmax 1760, 1730, 1220 "Н NMR (250 MHz, CDCI3) 5 ppm 13 90 (s, 1H, ОН фенол), 13,15 (s, 1H, ОН фенол), 8,00- 7,20 (m, 6H а р о м ) , 5,47 (s, 1H), 5,29-5,16 ( т , 5Н), 4,97 (s, 2Н), 4,73 (s, 2Н), 4,20-4,15 ( т , 2Н), 4,21 (s, ЗН), 3,80 (br s, 1H), 3,72 (s, ЗН), 3,68 (s, 1Н), 3,19(d, 1H,J= 19 Hz), и 2,91 (d, 1H, J = 19 Hz), 2,30 (d, 1H, J = 13,6 Hz), 2,15 (s, 3H), 2,10(d, 1H, J= 13,6 Hz), 2,07 (s, 6H), 1,83 ( b r s , 2H), 1,27 (d, 1H, J = 5,4Hz) 4) ^[3-нитро-4-(метил (p-D-глюкопиранозил) уронат)-бензилоксикарбонил] доксорубицин (70b) 5) Способ получения Соединение 20а (1 48г) растворяют в безводном DMF (20мл) Затем добавляют 200мл безводного МеОН После охлаждения при 0°С добавляют 18мл 1М MeONa с последующим перемешиванием в течение 1 часа при 0°С Среду нейтрализуют добавлением метанолового раствора АсОН (10%) при 0°С После высушивания испарением и импульсной хроматографии (растворитель СН 2 СІ 2 /Ме0Н 90 10) получают 500мг чистого (соединения) 70Ь Соединение 70Ь
ДивитисяДодаткова інформація
Назва патенту англійськоюAnthracycline prodrugs, a method for preparing thereof and a composition to be used in cytostatic therapy
Назва патенту російськоюАнтрациклиновые пролекарства, способ их получения и композиция для использования в цитостатической терапии
МПК / Мітки
МПК: A61K 38/46, C07H 15/252, A61K 31/704, A61K 31/70, A61K 38/22, A61P 35/00, C07F 7/18, A61P 43/00, A61K 31/7028, C07H 15/203, A61K 31/7034, A61K 39/395, C07H 15/26
Мітки: спосіб, цитостатичній, антрациклінові, проліки, композиція, використання, одержання, терапії
Код посилання
<a href="https://ua.patents.su/36-56981-antraciklinovi-proliki-sposib-kh-oderzhannya-ta-kompoziciya-dlya-vikoristannya-u-citostatichnijj-terapi.html" target="_blank" rel="follow" title="База патентів України">Антрациклінові проліки, спосіб їх одержання та композиція для використання у цитостатичній терапії</a>
Попередній патент: Спосіб отримання амінонітрилів та діамінів
Наступний патент: Співполімери, які здатні біологічно розкладатися, спосіб їх одержання
Випадковий патент: Пристрій для збирання та знищення шкідників