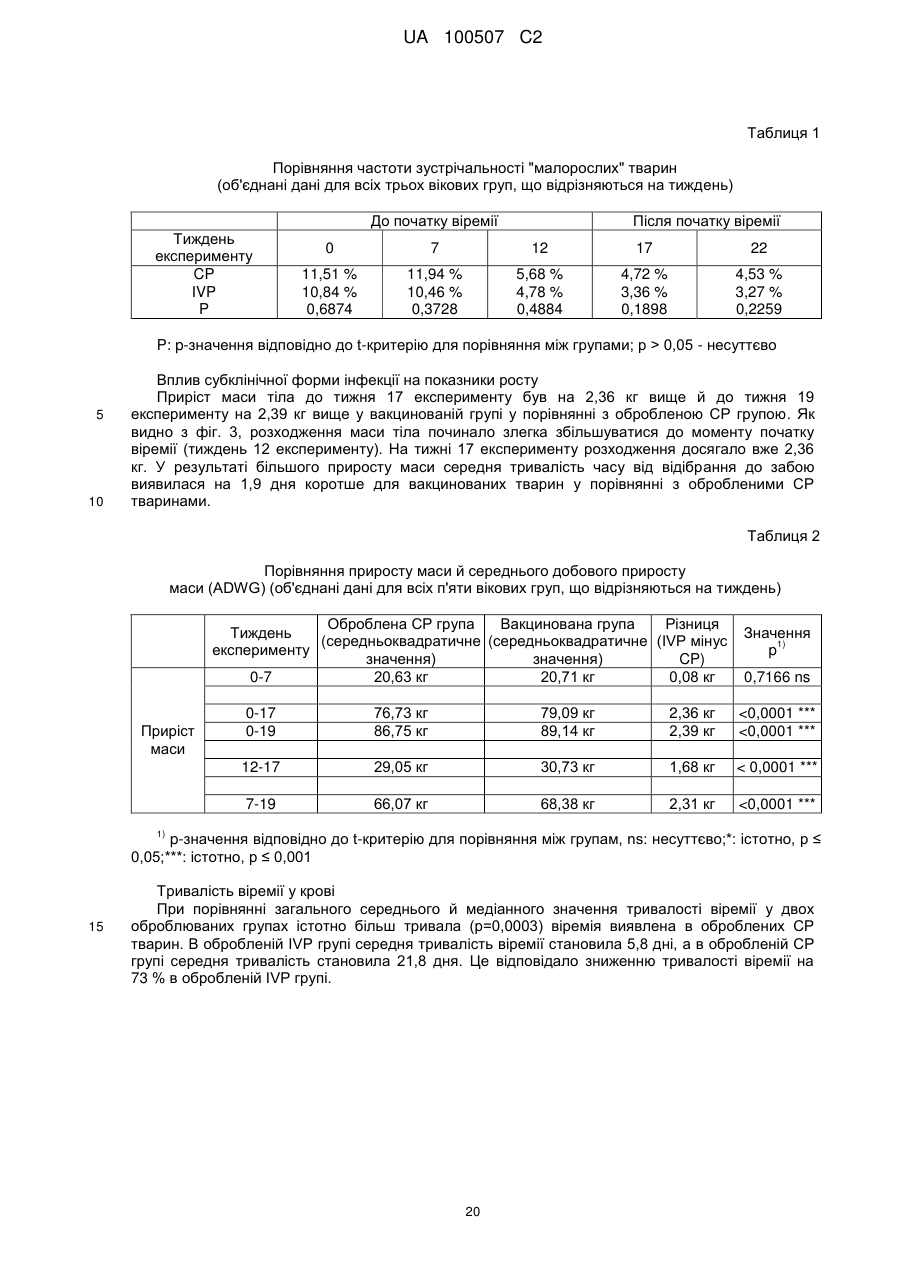
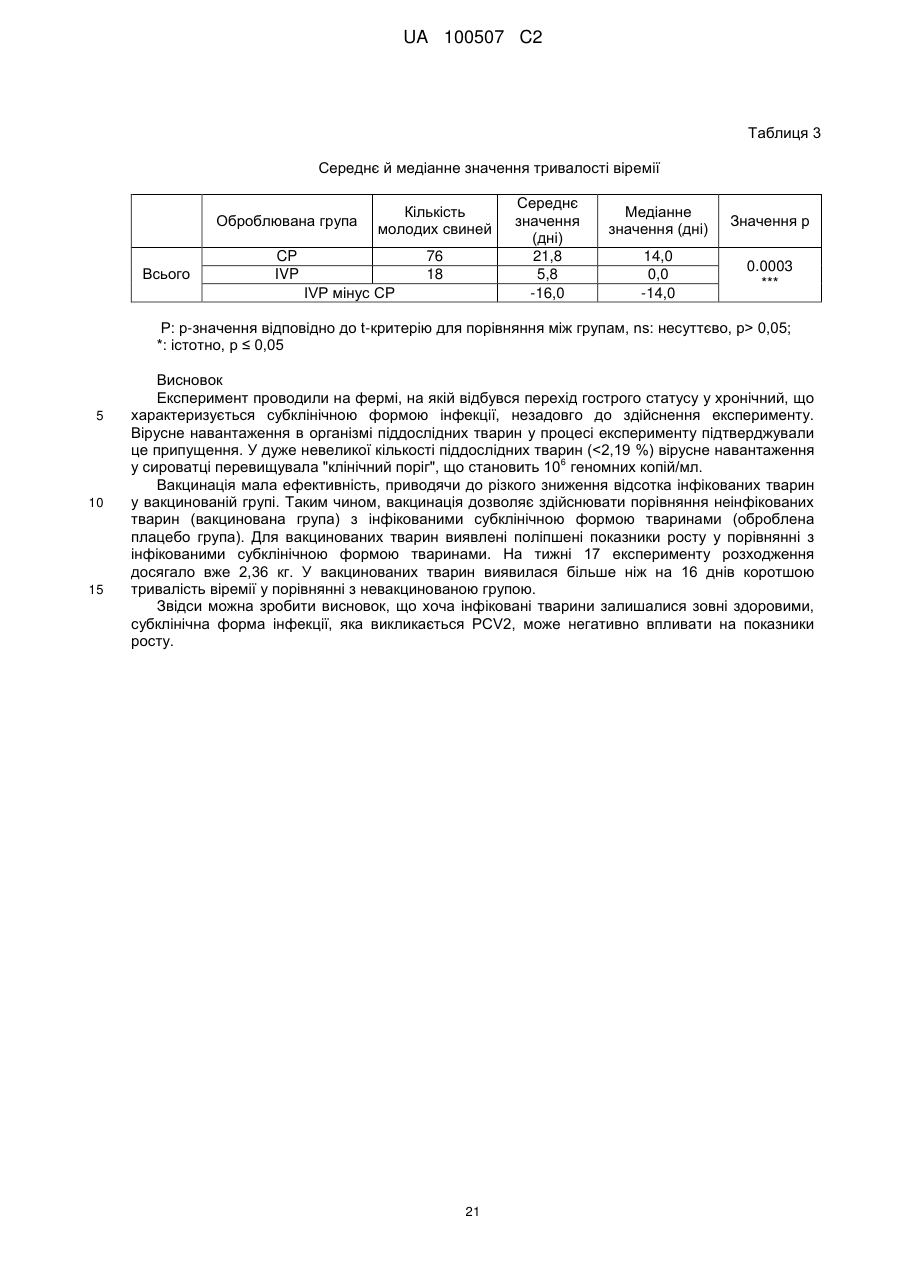
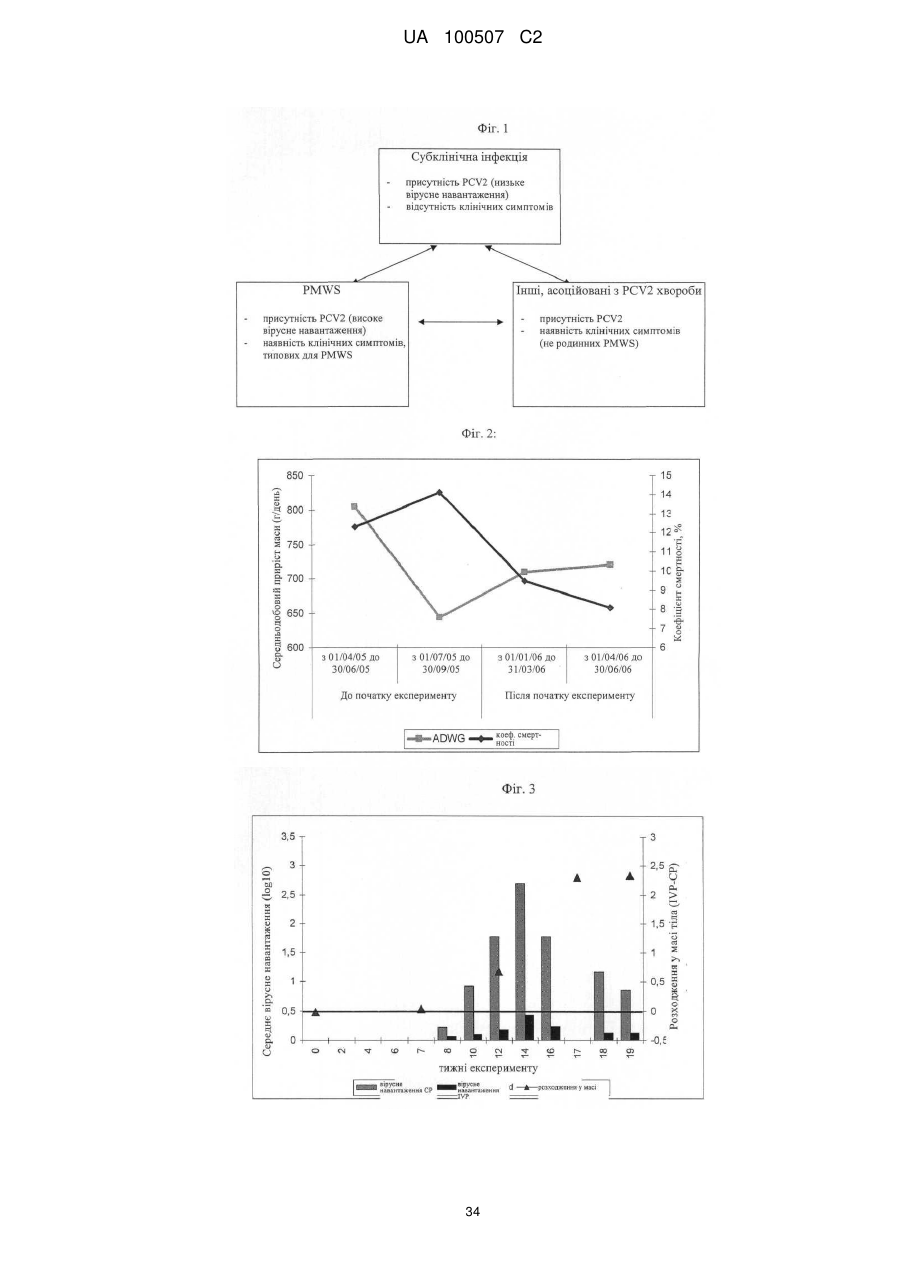
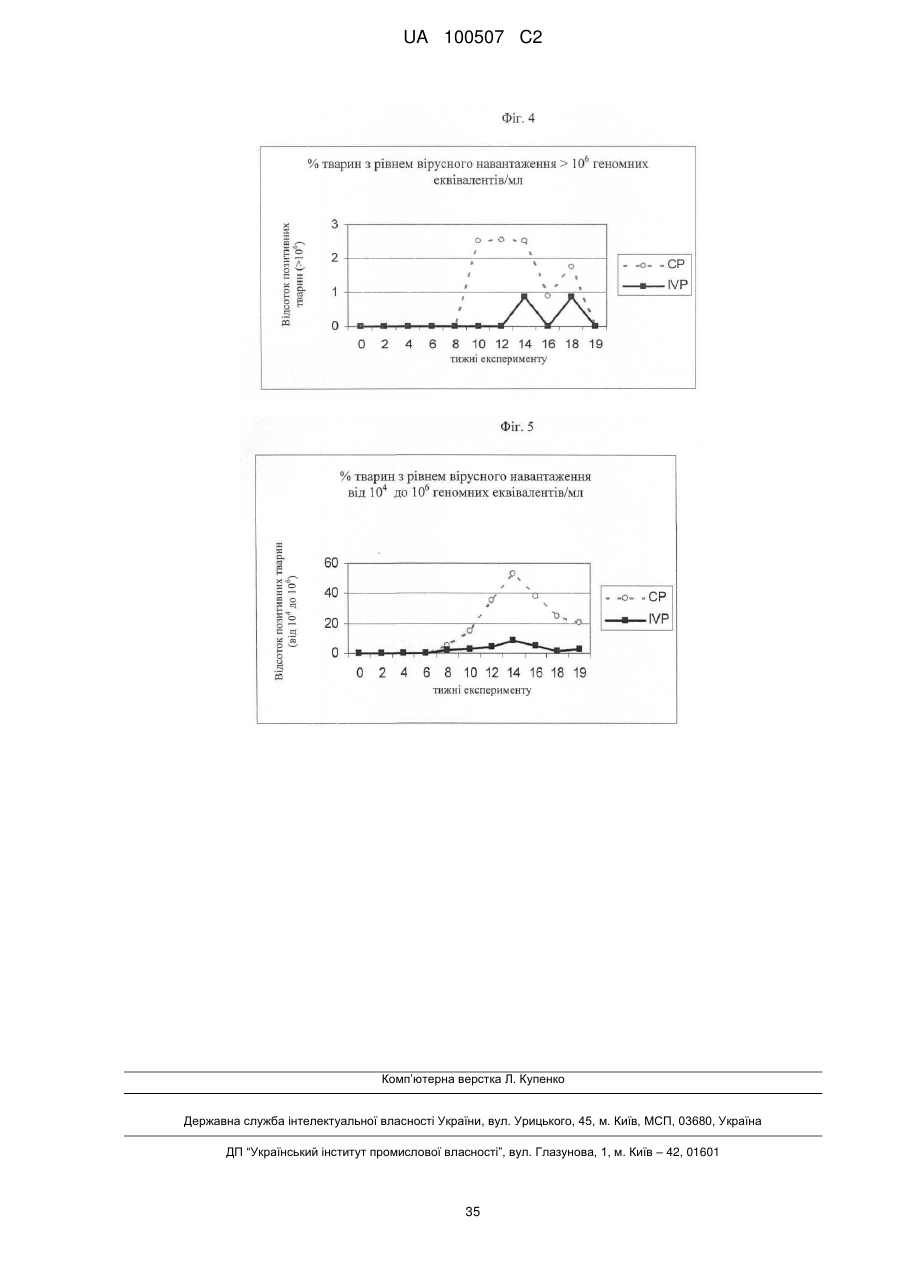
Попередження й лікування субклінічної форми хвороб, які викликаються цирковірусом свиней (pcvd)
Номер патенту: 100507
Опубліковано: 10.01.2013
Автори: Кіксмьоллер Маріон, Фрайін фон Ріхтхофен Ізабелль, Лішевскі Аксель, Ельберс Кнут, Фахінгер Вікі, Орвеллон Франсуа-Ксавьє
Формула / Реферат
1. Спосіб лікування субклінічної форми інфекції, яка викликається PCV2, у індивідуальної свині або групи свиней, який полягає в тому, що вводять у терапевтично ефективній кількості білок ОРС-2 PCV2 або імуногенну композицію, що містить білок ОРС-2 PCV2, свині, яка потребує такого введення, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється рівнем вірусного навантаження в організмі індивідуальної свині менше 106 геномних копій PCV2 на мл сироватки.
2. Спосіб за п. 1, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється тим, що максимум 20 % тварин у череді має вірусні титри, що перевищують 106 геномних копій на мл сироватки.
3. Спосіб за п. 1 або п. 2, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється тим, що вірус зберігається в череді протягом щонайменше 6 тижнів.
4. Спосіб за будь-яким з пп. 1-3, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється відсутністю захворюваності або невисоким коефіцієнтом захворюваності, що становить менше 25 % від PCV2-позитивних тварин у череді.
5. Спосіб за будь-яким з пп. 2-4, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється невисоким коефіцієнтом смертності, що становить менше 20 % від PCV2-позитивних тварин у череді.
6. Спосіб зменшення порушення росту через субклінічну форму інфекції, яка викликається PCV2, який полягає в тому, що вводять у терапевтично ефективній кількості білок ОРС-2 PCV2 або імуногенну композицію, що містить білок ОРС-2 PCV2, свині, яка потребує такого введення, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється рівнем вірусного навантаження в організмі індивідуальної свині менше 106 геномних копій PCV2 на мл сироватки.
7. Спосіб зниження кількості свиней з вірусним навантаженням, що перевищує 106 геномних копій на мл сироватки, у групі свиней (череді), інфікованих субклінічною формою PCV2, який полягає в тому, що вводять у терапевтично ефективній кількості білок ОРС-2 PCV2 або імуногенну композицію, що містить білок ОРС-2 PCV2, свині, яка потребує такого введення, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється рівнем вірусного навантаження в організмі індивідуальної свині менше 106 геномних копій PCV2 на мл сироватки.
8. Спосіб зниження виділення вірусу з носа й/або тривалості віремії у свиней, інфікованих субклінічною формою PCV2, який полягає в тому, що вводять у терапевтично ефективній кількості білок ОРС-2 PCV2 або імуногенну композицію, що містить білок ОРС-2 PCV2, свині, яка потребує такого введення,в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється рівнем вірусноіо навантаження в організмі індивідуальної свині менше 106 геномних копій PCV2 на мл сироватки.
9. Спосіб за будь-яким з пп. 1-8, в якому білок ОРС-2 PCV2 являє собою поліпептид, гoмoлогiчний щонайменше на 80 % ОРС-2 PCV2.
10. Спосіб за будь-яким з пп. 1-9, в якому зазначений білок ОРС-2 PCV-2 являє собою рекомбінантний бакуловірус, який експресує білок ОРС-2 PCV2.
11. Спосіб за будь-яким з пп. 1-10, в якому білок ОРС-2 PCV2 являє собою Ingelvac® CircoFLEXТМ.
12. Спосіб за будь-яким з пп. 1-11, в якому тварина являє собою свиню.
13. Застосування білка ОРС-2 PCV2 або імуногенної композиції, що містить білок ОРС-2 PCV2, для готування лікарського засобу, призначеного для лікування субклінічної форми інфекції, яка викликається PCV2, у індивідуальної свині або групи свиней, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється рівнем вірусного навантаження в організмі індивідуальної свині менше 106 геномних копій PCV2 на мл сироватки, і в якому лікарський засіб вводять у терапевтично ефективній кількості свині, яка потребує такого введення.
14. Застосування за п. 13, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється тим, що максимум 20 % тварин у череді має вірусні титри, що перевищують 106 геномних копій на мл сироватки.
15. Застосування за п.13 або п. 14, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється тим, що вірус зберігається у череді протягом щонайменше 6 тижнів.
16. Застосування за будь-яким з пп. 13-15, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється відсутністю захворюваності або невисоким коефіцієнтом захворюваності, що становить менше 25 % від PCV2-позитивних тварин у череді.
17. Застосування за будь-яким з пп. 14-16, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється невисоким коефіцієнтом смертності, що становить менше 20 % від PCV2-позитивних тварин у череді.
18. Застосування білка ОРС-2 PCV2 або імуногенної композиції, що містить білок ОРС-2 PCV2, для готування лікарського засобу, призначеного для зменшення порушення росту через субклінічну форму інфекції, яка викликасться PCV2, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється рівнем вірусного навантаження в організмі індивідуальної свині менше 106 геномних копій PCV2 на мл сироватки, і в якому лікарський засіб вводять у терапевтично ефективній кількості свині, яка потребує, такого введення.
19. Застосування білка ОРС-2 PCV2 або імуногенної композиції, що містить білок ОРС-2 PCV2, для готування лікарського засобу, призначеного для зниження кількості свиней з вірусним навантаженням, що перевищує 106 геномних копій на мл сироватки, у групі свиней (череді), інфікованих субклінічною формою PCV2, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється рівнем вірусного навантаження в організмі індивідуальної свині менше 106 геномних копій PCV2 на мл сироватки, і в якому лікарський засіб вводять у терапевтично ефективній кількості свині, яка потребує такого введення.
20. Застосування білка ОРС-2 PCV2 або імуногенної композиції, що містить білок ОРС-2 PCV2, для зниження виділення вірусу з носа й/або тривалості віремії у свиней, інфікованих субклінічною формою PCV2, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється рівнем вірусного навантаження в організмі індивідуальної свині менше 106 геномних копій PCV2 на мл сироватки, і в якому лікарський засіб вводять у терапевтично ефективній кількості свині, яка потребує такого введення.
21. Застосування за будь-яким з пп. 13-21, в якому білок ОРС-2 PCV2 являє собою поліпептид, гомологічний щонайменше на 80 % ОРС-2 PCV2.
22. Застосування за будь-яким з пп. 13-21, в якому зазначений білок ОРС-2 PCV-2 являє собою рекомбінантний бакуловірус, який експресує білок ОРС-2 PCV2.
23. Застосування за будь-яким з пп. 13-22, в якому білок ОРС-2 PCV2 являє собою Ingelvac® CircoFLEXТМ.
24. Застосування за будь-яким з пп. 13-23, в якому тварина являє собою свиню.
Текст
Реферат: Винахід стосується лікування субклінічної форми інфекції, яка викликається PCV2, у індивідуальної свині або групи свиней, який полягає в тому, що вводять у терапевтично ефективній кількості білок ОРС-2 PCV2 або імуногенну композицію, що містить білок ОРС-2 PCV2, свині, яка потребує такого введення, в якому субклінічна форма інфекції, яка викликається PCV2, відрізняється рівнем вірусного навантаження в організмі індивідуальної 6 свині менше 10 геномних копій PCV2 на мл сироватки. UA 100507 C2 (12) UA 100507 C2 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перелік послідовностей У дану заявку входить перелік послідовностей у паперовій і електронній версії, сутність і зміст яких включені у даний опис як посилання. Перелік послідовностей ідентичний переліку, включеному у WO 06/072065. Передумови створення винаходу Область техніки, до якої відноситься винахід Даний винахід відноситься до застосування імуногенної композиції, що містить антиген цирковіруса свиней типу 2 (PCV2), для попередження й лікування субклінічних (хронічних) форм, які викликають PCV2 інфекцій у тварин, переважно у молодих (не досягли полової зрілості) свиней. Опис відомого рівня техніки Цирковірус свиней типу 2 (PCV2) являє собою невеликий (діаметром 17-22 нм) ДНКовий вірус, що немає оболонки, з ікосаедральною структурою, який несе одноланцюговий кільцевий геном. Послідовність PCV2 приблизно на 80 % ідентична послідовності цирковіруса свиней типу 1 (PCV1). Однак у цей час установлено, що на відміну від PCV1, що, як правило, є невірулентним, зараження свиней PCV2 асоційовано з рядом хворобливих синдромів, які у цілому позначають як хвороби, які викликаються цирковірусом свиней (PCVD) (відомі також як цирковірус-асоційовані захворювання свиней (PCVAD)) (Allan і ін., IPVS Congress, 2006). Як правило, основним клінічним проявом PCVD вважається синдром післявід'ємного мультисистемного виснаження (PMWS) (Harding і ін., Swine Health Prod; 5, 1997, сс. 201-203; Kennedy і ін., J Comp Pathol; 122, 2000, сс. 9-24). З літератури відомо декілька інших потенційно родинних станів, включаючи комплекс респіраторних хвороб свиней (PRDC), синдром свинячого дерматиту й нефропатії (PDNS), зниження репродуктивної функції, гранулематозні ентерити й, можливо, уроджений тремор (CT-AII) і перинатальний міокардит (Chae, Veterinary J., 169, 2005, сс. 326-336). PCVD вражає молодих свиней віком 5-22 тижня. З клінічної точки зору PCVD характеризується виснаженням, блідістю шкіри, хирлявістю, респіраторним дистрес-синдромом, діареєю, жовтяницею й розлиттям жовчі. У деяких уражених захворюванням свиней проявляється комбінація всіх симптомів, у той час як в інших свиней проявляються тільки один або два із зазначених симптомів (Muirhead, Vet. Rec., 150, 2002, с. 456). Коефіцієнти смертності у свиней, інфікованих PCV2, можуть досягати 50 %. При розкритті трупа виявляють також мікроскопічні й макроскопічні ушкодження багатьох тканин і органів, причому найбільше часто ушкодження зустрічаються у лімфоїдних органах (Allan і Ellis, J Vet. Diagn. Invest., 12, 2001, сс. 3-14). Виявлено виражену кореляцію між рівнем нуклеїнової кислоти або антигену PCV2 і серйозністю мікроскопічних лімфоїдних ушкоджень (Brunborg, 2004). Крім того, виявлена кореляція між рівнем нуклеїнової кислоти або антигену в крові й серйозністю клінічних симптомів (Brunborg, 2004; Liu, 2000; Olvera, 2004). Встановлено, що у молодих свиней, що 6 страждають PCVD, рівень вірусного навантаження перевищував 10 геномных еквівалентів на мл. На відміну від клінічно виражених проявів хвороб, які викликаються PCV2, вважається, що субклінічні форми інфекцій, які викликаються PCV2, присутні у тих тварин, які інфіковані PCV2, але мають клінічно бессимптомне протікання. У цілому, існує взаємозв'язок між цими формами інфекцій, які викликаються PCV2, оскільки субклінічні форми інфекцій можуть легко переходити у PCVD, і тому тварини, які видужують, можуть залишатися постійно зараженими протягом тривалого періоду часу (хронічно) (див. фіг. 1). У сучасних дослідженнях продемонстровано, що субклінічні форми інфекцій, які викликаються PCV2, часто зустрічаються. Наявність субклінічної форми інфекцій продемонстровано як експериментально, так і в польових умовах. У лабораторних дослідах можна продемонструвати, що викликана PCV2 інфекція індивідуальних молодих свиней не завжди пов'язана із клінічними симптомами або ушкодженнями (Harms и др., Vet. Pathol., 38, 2001, сс. 528-539). Крім того, у декількох польових дослідах установлено, що захворюваність інфікованих PCV2 серопозитивних черед вище, ніж захворюваність черед, уражених PCVD (Olvera и др., J. Virol. Methods, 117, 2004, сс. 75-80). Часто череди, в яких виявлений гострий спалах PCVD залишаються інфікованими PCV2 без прояву помітних клінічних симптомів. У літературі прийнято позначати також цю субклінічну (постійну) форму зараження череди як "хронічну" інфекцію (Burch D., Pig International, 2006). Економічна роль PCV2 в інфікованих субклінічною формою чередах, якщо це має місце, є невідомою, і раніше ніколи не була описана. Зокрема, поки не відомо й не встановлено, чи можуть субклінічні форми інфекцій, які викликаються PCV2, впливати на показники росту тварин або на загальний стан здоров'я в цілому уражених тварин. 1 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 Підходи до лікування інфекцій, які викликаються PCV2, засновані на застосуванні ДНКвакцини, описані в US 6703023. У WO 03/049703 описане одержання живої химерної вакцини, що містить каркас PCV1, у якому ген каркаса PCV1 замінений на імуногенний ген патогенних штамів PCV2. У WO 99/18214 описано кілька штамів PCV2 і процедури одержання вбитої вакцини проти PVC2. Однак відсутні дані про їхню ефективність. Ефективна субодинична вакцина на основі ОРС-2 (відкрита рамка зчитування 2) описана у WO 06/072065. Кожна із зазначених вакцин призначена для застосування з метою вакцинації/лікування свиней або молодих свиней старше 3 тижнів. Для жодної із зазначених вакцин не описане застосування для профілактики або лікування тварин із субклінічною формою інфекції, яка викликається PCV2. Крім того, не описано, що такі вакцини можуть викликати імунітет проти інфекції, яка викликається PCV2 у груп тварин із субклінічною формою захворювання й поліпшувати показники їхнього росту. Короткий опис креслень На кресленнях показано: на фіг. 1 - різні форми інфекцій, які викликаються PCV2, на фіг. 2 - коефіцієнт смертності й середньодобовий приріст маси у період відгодівлі, визначений на дослідній фермі до й після початку експерименту, на фіг. 3 - динаміка розходження між масою тіла (IVP-CP (обробка досліджуваним ветеринарним продуктом/контрольним продуктом)) і середнім рівнем вірусного навантаження (log10) у процесі експерименту, 6 на фіг. 4 - порівняння відсотка тварин з рівнем вірусного навантаження > 10 геномних еквівалентів/мл сироватки в обох оброблюваних групах, 46 на фіг. 5 - порівняння відсотка тварин з рівнем вірусного навантаження у сироватці 10 10E геномних еквівалентів /мл сироватки в обох оброблюваних групах. Докладний опис винаходу Клінічний прояв інфекцій, які викликаються PCV2, асоційовано з різними синдромами захворювання. Залежно від форми прояву вираження родинного PCV2 захворювання клінічні симптоми гострої інфекції, яка викликається PCV2, можуть являти собою один або декілька з наступних показників: a) істотне підвищення коефіцієнта смертності (підвищення на 4-20 %), б) істотне підвищення частоти зустрічальності "малорослих" тварин (підвищення на 5-50 %) або в) інші симптоми клінічного прояву, такі як респіраторні симптоми, діарея, блідість шкіри, жовтяниця, хирлявість (коефіцієнт захворюваності 4-60 %). Крім того, високі вірусні титри, що 6 7 перевищують 10 або 10 на мл сироватки або тканини, є характерною ознакою у більшості тварин з гострими симптомами PCVD. Крім гострої інфекції, яка викликається PCV2, субклінічна форма інфекцій, які викликаються PCV2, що відрізняється відсутністю захворюваності або низьким коефіцієнтом захворюваності, стає все більше й більше розповсюдженою. У деяких випадках гостра інфекція, яка викликається PCV2, може переходити у субклінічну форму інфекції, яка викликається PCV2. Однак субклінічні форми інфекцій можуть також мати місце без наявності яких-небудь попередніх симптомів гострої інфекції, яка викликається PCV2. При створенні винаходу зненацька було встановлено, що субклінічна форма інфекції, яка викликається PCV2, впливає на характеристики зовні здорових молодих свиней, зокрема на показник росту молодих свиней. Навіть, якщо при субклінічній формі в інфікованих тварин не розвиваються типові клінічні симптоми, які дозволяють ідентифікувати PCVD, або в них виявлений лише невисокий рівень захворюваності, ці тварини у значній мірі уражені субклінічною формою інфекції, яка викликається PCV2. Субклінічна форма інфекцій, які викликаються PCV2, у молодих свиней приводить до помітної втрати приросту маси (див. приклад 3). Як відзначалося раніше, в існуючих до теперішнього часу прототипах відсутні дані про те, що субклінічна форма інфекцій, які викликаються PCV2, робить який-небудь вплив на здоров'я, зокрема показник росту молодих свиней. Крім того, при створенні винаходу зненацька було встановлено, що зниження приросту маси, обумовлене субклінічною формою інфекції, яка викликається PCV2, можна зменшувати шляхом лікування/вакцинації тварин, які придбали субклінічну форму захворювання, антигеном PCV2 (наприклад, див. приклад 3). Таким чином, при створенні винаходу не тільки було встановлено, що субклінічна форма інфекцій, які викликаються PCV2, впливає на показник росту молодих свиней, але отримані також дані про те, що такий негативний вплив можна істотно знижувати шляхом лікування/вакцинації тварин антигеном PCV2. Інакше кажучи, навіть, якщо з існуючого рівня техніки відомий феномен субклінічної форми інфекцій, при створенні винаходу вперше були отримані дані про те, що - субклінічна форма інфекції, яка викликається PCV2, що виявляється іноді у польових умовах, може робити істотний вплив на показник росту молодих свиней; 2 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 - вакцинація уражених субклінічною формою молодих свиней або черед за допомогою антигену PCV2 може істотно знижувати негативний вплив цієї субклінічної форми інфекції, яка викликається PCV2. Таким чином, одним з об'єктів даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у тварини або групи тварин, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу у такому введенні. «Субклінічна форма інфекції, яка викликається PCV2,» у контексті даного опису характеризується I) вірусним навантаженням в організмі індивідуальної тварини, що 6 зберігається протягом всього життя на рівні нижче 10 геномних копій PCV2 на мл сироватки, II) низькою відносною кількістю PCV2-позитивних тварин у групі або череді з вірусними титрами, 6 що перевищують 10 геномних копій на мл сироватки, III) збереженням вірусу у групі або череді протягом щонайменше 6 тижнів, переважно щонайменше 8 тижнів, більш переважно щонайменше 10 тижнів, найбільш переважно щонайменше 12 тижнів, IV) відсутністю типових клінічних симптомів у PCV2-позитивної тварини, V) відсутністю або лише невисоким коефіцієнтом захворюваності у групі тварин або череді PCV2-позитивних тварин і/або VI) невисоким коефіцієнтом смертності у групі тварин або череді PCV2-позитивних тварин. Поняття "низька відносна кількість PCV2-позитивних тварин", що використовується вище як критерій II), означає, що менше 20 %, переважно менше 15 %, ще більш переважно менше 10 %, ще більш переважно менше 8 %, ще більш переважно менше 6 %, ще більш переважно менше 4 %, найбільш переважно менше 3 % PCV2-позитивних тварин у групі тварин або у 6 череді мають вірусні титри, що перевищують 10 геномних копій на мл сироватки. Інакше кажучи, поняття "низька відносна кількість PCV2-позитивних тварин у групі тварин або у череді, 6 які мають вірусні титри, що перевищують 10 геномних копій на мл сироватки" означає також, що більше 80 %, переважно більше 85 %, ще більш переважно більше 90 %, ще більш переважно більше 92 %, ще більш переважно більше 94 %, ще більш переважно більше 96 %, найбільш переважно більше 97 % PCV2-позитивних тварин у групі або череді мають вірусні 6 титри нижче 10 геномних копій PCV2 на мл сироватки. Поняття "PCV2-позитивний" у контексті даного опису означає, але, не обмежуючись тільки зазначеним, що тварина містить кількість геномних еквівалентів PCV2, що виявляються, (тобто вірусних копій) у зразку (1 мл сироватки або 1 мг тканини). Кількість геномних еквівалентів PCV2, що виявляються, означає, що геномні еквіваленти PCV2 можна виявляти за допомогою аналізу на основі полімеразної ланцюгової реакції (ПЛР). Зразок вважається ПЛР-позитивним, якщо два незалежних зразки дають позитивний результат за даними ПЛР при такому аналізі. Методи кількісної оцінки PCV2 за допомогою ПЛР-аналізу добре відомі у даній області. Фактично кількісну оцінку геномних еквівалентів PCV2 здійснювали/здійснюють за допомогою методу, описаного у Brunborg і ін., J. Virol Methods 122, 2004, сс. 171-178. Для ампліфікації PCV2 застосовували/застосовують праймери PCV2-84-1265U21 і PCV2-84-1319L21. Такий метод можна застосовувати як референс-аналіз у випадку будь-яких сумнівів. Поняття "збереження вірусу" у контексті даного опису означає, що заражена тварина має 4 вірусне навантаження щонайменше 10 вірусних копій PCV2 на мл сироватки протягом зазначеного вище періоду часу, тобто щонайменше 6 тижнів або більше. Понятие "відсутність типових клінічних симптомів у PCV2-позитивної тварини" у контексті даного опису означає відсутність будь-яких видимих клінічних симптомів, які за нормою асоційовані із клінічним проявом інфекції, яка викликається PCV2, що дозволяє точно й недвозначно ідентифікувати інфекцію, яка викликається PCV2, тільки на основі типового клінічного прояву. Ці клінічні симптоми відповідають відомим для PCVD, зокрема являють собою блідість шкіри, хирлявість, респіраторний дистрес-синдром, діарею, жовтяницю або розлиття жовчі. Поняття "невисокий коефіцієнт захворюваності" у контексті даного опису є показником відсутності клінічних симптомів, які дозволяють ідентифікувати гостру інфекцію, яка викликається PCV2, за її клінічним проявом. Це є також показником присутності субклінічної форми інфекції, яка викликається PCV2. Поняття "невисокий коефіцієнт захворюваності" у контексті даного опису відноситься до відсотка тварин зі зміненим загальним станом здоров'я. Поняття "змінений загальний стан здоров'я" у контексті даного опису відноситься до наявності одного або декількох пов'язаних з PCVD клінічних симптомів, таких як наявність "малорослих" тварин (до яких у контексті даного опису відносяться тварини, у яких маса тіла на 25 % нижче, ніж середня маси тварин такої ж вікової групи), блідість шкіри, хирлявість, респіраторний дистрес-синдром, діарея, жовтяниця або розлиття жовчі. Таким чином, "невисокий коефіцієнт захворюваності" у контексті даного опису означає, що у менше 25 %, переважно у менше 20 %, 3 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 більш переважно у менше 15 %, ще більш переважно у менше 12 %, ще більш переважно у менше 10 %, ще більш переважно у менше 8 %, ще більш переважно у менше 6 %, найбільш переважно у менше 4 % тварин у групі тварин або у череді виявлений один або кілька клінічних симптомів PCVD, переважно виявлено наявність "малорослих" тварин, як визначено вище, блідості шкіри, хирлявості, респіраторного дистрес-синдрома, діареї, жовтяниці або розлиття жовчі. Поняття "відсутність коефіцієнта захворюваності" у контексті даного опису означає, що менше чим у 1 % PCV2-позитивних тварин у групі тварин або череді виявлений один або кілька клінічних симптомів PCVD, переважно виявлено наявність "малорослих" тварин, як визначено вище, блідості шкіри, хирлявості, респіраторного дистрес-синдрома, діареї, жовтяниці або розлиття жовчі. Поняття "невисокий коефіцієнт смертності" у контексті даного опису означає, але, не обмежуючись тільки зазначеним, що коефіцієнт смертності PCV2-позитивних тварин у групі тварин або череді становить менше 20 %, переважно менше 15 %, більш переважно менше 12 %, ще більш переважно менше 10 %, ще більш переважно менше 8 %, ще більш переважно менше 6 %, найбільше переважно менше 4 %. Поняття "якому потрібно таке введення" або "якому потрібно таке лікування" у контексті даного опису означає, що введення/лікування асоційоване із профілактикою здоров'я або з будь-яким іншим позитивним впливом на здоров'я тварин, що одержують антиген PCV2. Відповідно до кращого варіанта здійснення винаходу приймається, що субклінічна форма інфекції, яка викликається PCV2, відноситься до випадку, що задовольняє щонайменше критерію I) "вірусне навантаження в організмі індивідуальної тварини, що зберігається протягом 6 всього життя на рівні нижче 10 геномних копій PCV2 на мл сироватки", критерію II) "низька відносна кількість PCV2-позитивних тварин у групі або череді з вірусними титрами, що 6 перевищують 10 геномних копій на мл сироватки", або критерію III) "збереження вірусу у групі або череді протягом щонайменше 6 тижнів, переважно щонайменше 8 тижнів, більш переважно щонайменше 10 тижнів, найбільше переважно щонайменше 12 тижнів". Найбільш переважно приймається, що субклінічна форма інфекції, яка викликається PCV2, відноситься до випадку, що задовольняє зазначеним вище критеріям I) і II). У випадках, коли критерій I) і/або критерій II) об'єднані із критерієм III) "збереження вірусу в групі або череді протягом щонайменше 6 тижнів, переважно щонайменше 8 тижнів, більш переважно щонайменше 10 тижнів, найбільше переважно щонайменше 12 тижнів" або у будьяких інших випадках, що задовольняють критерію III), як зазначено вище, то субклінічна форма інфекції розглядається як "хронічна субклінічна форма інфекції, яка викликається PCV2". Іншим об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у якому субклінічна форма інфекції, яка викликається PCV2, 6 відрізняється вірусним навантаженням в організмі індивідуальної тварини на рівні нижче 10 геномних копій PCV2 на мл сироватки, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні. Переважно субклінічна форма інфекції, яка 6 викликається PCV2, відрізняється також присутністю менше 20 % тварин, що несуть більше 10 , 7 переважно більше 10 вірусних копій PCV2 на мл сироватки, у групі тварин або череді й/або відрізняється збереженням вірусу в такій групі або череді протягом щонайменше 6 тижнів, переважно щонайменше 8 тижнів, більш переважно щонайменше 10 тижнів, найбільш переважно щонайменше 12 тижнів. Більш переважно така субклінічна форма інфекції відрізняється також відсутністю яких-небудь клінічних симптомів в індивідуальної PCV2позитивної тварини, як визначено вище, відсутністю або невисоким коефіцієнтом захворюваності, як визначено вище, і/або невисоким коефіцієнтом смертності, як визначено вище. Наступним об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у якому субклінічна форма інфекції, яка викликається PCV2, відрізняється вірусним навантаженням в організмі індивідуальної тварини, що може зберігатися 6 протягом всього його життя на рівні нижче 10 геномних копій PCV2 на мл сироватки, у відсутності якого-небудь введення антигену PCV2, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні. Переважно субклінічна форма інфекції, яка викликається PCV2, відрізняється також присутністю менше 20 % тварин у групі 6 7 тварин або в череді, які мають вірусні титри, що перевищують 10 , переважно 10 вірусних копій PCV2 на мл сироватки, і/або відрізняється збереженням вірусу у такій групі або череді протягом щонайменше 6 тижнів, переважно щонайменше 8 тижнів, більш переважно щонайменше 10 4 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 тижнів, найбільш переважно щонайменше 12 тижнів. Більш переважно така субклінічна форма інфекції відрізняється також відсутністю яких-небудь клінічних симптомів в індивідуальної PCV2позитивної тварини, як визначено вище, відсутністю або невисоким коефіцієнтом захворюваності, як визначено вище, і/або невисоким коефіцієнтом смертності, як визначено вище. Таким чином, наступним об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у якому субклінічна форма інфекції, яка викликається PCV2, відрізняється присутністю менше 20 % тварин у групі тварин або в череді, 6 7 які мають вірусні титри, що перевищують 10 , переважно 10 вірусних копій PCV2 на мл сироватки, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні. Переважно субклінічна форма інфекції, яка викликається PCV2, відрізняється також збереженням вірусу у такій групі або череді протягом щонайменше 6 тижнів, переважно щонайменше 8 тижнів, більш переважно щонайменше 10 тижнів, найбільш переважно щонайменше 12 тижнів. Більш переважно така субклінічна форма інфекції відрізняється також відсутністю яких-небудь клінічних симптомів в індивідуальної PCV2-позитивної тварини, як визначено вище, відсутністю або невисоким коефіцієнтом захворюваності, як визначено вище, і/або невисоким коефіцієнтом смертності, як визначено вище. Наступним об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у якому субклінічна форма інфекції, яка викликається PCV2, відрізняється збереженням вірусу у такій групі або череді протягом щонайменше 6 тижнів, переважно щонайменше 8 тижнів, більш переважно щонайменше 10 тижнів, найбільш переважно щонайменше 12 тижнів. Переважно така субклінічна форма інфекції, яка викликається PCV2, відрізняється також відсутністю яких-небудь клінічних симптомів в індивідуальної PCV2-позитивної тварини, як визначено вище, відсутністю або невисоким коефіцієнтом захворюваності, як визначено вище, і/або невисоким коефіцієнтом смертності, як визначено вище. Ще одним об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у якому субклінічна форма інфекції, яка викликається PCV2, відрізняється відсутністю яких-небудь клінічних симптомів в індивідуальної PCV2-позитивної тварини, як визначено вище, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні. Переважно субклінічна форма інфекції, яка викликається PCV2, відрізняється також відсутністю або невисоким коефіцієнтом захворюваності, як визначено вище, і/або невисоким коефіцієнтом смертності, як визначено вище. Більш переважно субклінічна форма інфекції, яка викликається PCV2, відрізняється також тим, що вірусне навантаження в організмі індивідуальної тварини зберігається протягом всього його життя на 6 рівні нижче 10 геномних копій PCV2 на мл сироватки й/або низькою відносною кількістю PCV26 позитивних тварин у групі або череді, які мають вірусні титри, що перевищують 10 геномних копій на мл сироватки. Ще одним об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у якому субклінічна форма інфекції, яка викликається PCV2, відрізняється відсутністю або невисоким коефіцієнтом захворюваності у групі тварин або череді, переважно на рівні, що не перевищує 25 % або нижче, як визначено вище, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні. Переважно субклінічна форма інфекції, яка викликається PCV2, відрізняється також тим, що вірусне навантаження в 6 організмі індивідуальної тварини зберігається протягом всього його життя на рівні нижче 10 геномних копій PCV2 на мл сироватки й/або низькою відносною кількістю PCV2-позитивних 6 тварин у групі або череді, які мають вірусні титри, що перевищують 10 геномних копій на мл сироватки. Наступним об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у якому субклінічна форма інфекції, яка викликається PCV2, відрізняється невисоким коефіцієнтом смертності, як визначено вище, переважно на рівні, що не перевищує 20 % або нижче, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні. Переважно субклінічна форма інфекції, яка викликається PCV2, відрізняється також тим, що вірусне навантаження в організмі індивідуальної тварини 6 зберігається протягом всього його життя на рівні нижче 10 геномних копій PCV2 на мл сироватки й/або низькою відносною кількістю PCV2-позитивних тварин у групі або череді, які 5 UA 100507 C2 6 5 10 15 20 25 30 35 40 45 50 55 60 мають вірусні титри, що перевищують 10 геномних копій на мл сироватки. Введення в ефективній кількості антигену PCV2 тваринам або групі тварин, які мають субклінічну форму інфекції, яка викликається PCV2, приводить до підвищення приросту маси у цих тварин у процесі періоду відгодівлі, до зниження кількості тварин з рівнем вірусного 4 6 навантаження, що становить 10 -10 геномних копій на мл сироватки, до зниження виділення вірусу через ніс і/або зниженню тривалості віремії. Таким чином, наступним об'єктом даного винаходу є також спосіб зниження втрати приросту маси у тварин із субклінічною формою інфекції, яка викликається PCV2, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні. Переважно середній приріст маси зростає у період з 10 по 22 тиждень життя більше ніж на 1,5 кг у порівнянні з невакцинованими тваринами. Поняття "у процесі періоду відгодівлі" у контексті даного опису означає, але, не обмежуючись тільки зазначеним, тварин віком від 1 до 36 тижнів, переважно від 10 до 28 тижнів. Поняття "тварини із субклінічною формою інфекції, яка викликається PCV2" у контексті даного опису відноситься до індивідуальної тварини, що стає субклінічно інфікованою PCV2, але відноситься також до групи тварин, де більшість тварин у цій групі стають субклінічно інфікованими PCV2. Таким чином, поняття "тварини із субклінічною формою інфекції, яка викликається PCV2" відноситься як до I) "тварин із субклінічною формою інфекції, яка викликається PCV2", так і до II) "тварин череди, де череда субклінічно інфікована PCV2". Таким чином, ще одним об'єктом даного винаходу є спосіб зниження кількості тварин з 4 6 рівнем вірусного навантаження, що становить 10 -10 геномних копій на мл сироватки, у групі тварин (череді), субклінічно інфікованій PCV2, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні. Краща кількість тварин з рівнем вірусного 4 6 навантаження, що становить 10 -10 геномних копій на мл сироватки, може знижуватися в результаті вакцинації антигеном PCV2 до менше чим 30 %, переважно до менше чим 20 %, ще більш переважно до менше чим 10 %, найбільш переважно до менше чим 5 %, у той час як у невакцинованій контрольній групі субклінічно інфікованих тварин (з рівнем вірусного 4 6 навантаження, що становить 10 -10 геномних копій на мл сироватки) більше ніж в 40 % 4 6 виникають титри PCV2, складові від 10 до 10 геномних копій на мл сироватки. Таким чином, ще одним об'єктом даного винаходу є також спосіб зниження кількості тварин 6 із клінічно значимим рівнем вірусного навантаження (що перевищує 10 геномних копій на мл сироватки) у групі тварин (череді), субклінічно інфікованої PCV2, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні. Краща кількість тварин з 6 рівнем вірусного навантаження, що перевищує 10 геномних копій на мл сироватки, можна знижувати у результаті вакцинації антигеном PCV2 до менше чим 10 %, переважно до менше чим 5 %, ще більш переважно до менше чим 4 %, ще більш переважно до менше чим 3 %, ще більш переважно до менше чим 2 %, найбільш переважно до менше чим 0,5 %. Таким чином, ще одним об'єктом даного винаходу є також спосіб зниження виділення вірусу через ніс, зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні. Як описано вище, вакцинація/лікування тварин із субклінічною формою інфекції, яка викликається PCV2, приводить до вкорочення фази віремії у порівнянні з невакцинованими контрольними тваринами. Середнє вкорочення тривалості віремії становило 17 днів у порівнянні з невакцинованими контрольними тваринами цього ж виду. Таким чином, ще одним об'єктом даного винаходу є також спосіб зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, який полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні, де лікування або профілактика приводять до вкорочення фази віремії на 5 або більше днів, переважно 6 або більше днів, ще більш переважно 7 або більше днів, ще більш переважно 8 або більше днів, ще більш переважно 9 або більше днів, ще більш переважно 10 або більше днів, ще більш переважно 12 або більше днів, ще більш переважно 14 або більше днів, найбільш переважно більше 16 днів, у порівнянні з невакцинованими контрольними тваринами цього ж виду. Поняття "антиген" у контексті даного опису відноситься до амінокислотної послідовності, що викликає імунну відповідь у хазяїна. Антиген у контексті даного опису включає повнорозмірну послідовність будь-яких білків PCV2, їхніх аналогів або їхніх імуногенних фрагментів. Поняття 6 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 "імуногенний фрагмент" означає фрагмент білка, що містить один або декілька епітопів і в результаті цього викликає імунна відповідь у хазяїна. Такі фрагменти можна ідентифікувати за допомогою кожного із численних методів картирування епітопів, добре відомих у даній області (див., наприклад, Epitope Mapping Protocols in Methods in Molecular Biology, том 66, під ред. Glenn E. Morris, з Humana Press, Totowa, New Jersey, 1996). Наприклад, лінійні епітопи можна виявляти, наприклад, здійснюючи конкурентний синтез великої кількості пептидів на твердих підкладках, де пептиди відповідають фрагментам молекули білка, і, піддаючи пептиди взаємодії з антитілами, при цьому пептиди залишаються прикріпленими до підкладок. Такі методи відомі у даній області й описані, наприклад в US 4708871; в Geysen і ін., Proc. Natl. Acad. Sci. USA 81, 1984, сс. 3998-4002; Geysen і ін., Molec. Immunol. 23, 1986, сс. 709-715. Аналогічно цьому, конформаційні епітопи легко можна ідентифікувати шляхом визначення просторової конформації амінокислот, наприклад, за допомогою рентгенівської кристалографії й 2-мірного ядерного магнітного резонансу (див., наприклад, Epitope Mapping Protocols, вище). Поняття включає також синтетичні антигени, наприклад, поліепітопи, що фланкують епітопи й інші отримані методами рекомбінації або синтезу антигени (див., наприклад, Bergmann і ін., Eur. J. Immunol. 23, 1993, сс. 2777-2781; Bergmann і ін., J. Immunol. 157, 1996, сс. 3242-3249; Suhrbier A., Immunol, і Cell Biol. 75, 1997, сс. 402-408; Gardner і ін., 12th World AIDS Conference, Geneva, Switzerland (12-а Всесвітня конференція по СНІДу Женева, Швейцарія) 28 червня-3 липня 1998 р.). Поняття "імунна відповідь" відноситься, але не обмежуючись тільки зазначеним, до формування в хазяїні кліткової- і/або антитіло-опосередкованої імунної відповіді на антиген, композицію або вакцину, що представляють інтерес. Як правило, "імунна відповідь" включає, але, не обмежуючись тільки ними, одну або декілька з наступних реакцій: виробництво або активацію антитіл, B-клітин, T-клітин-хелперів, T-клітин-супресорів і/або цитотоксичних T-клітин, специфічно спрямованих на антиген або антигени, включений(і) у композицію або вакцину, що представляють інтерес. Переважно організм-хазяїн повинен виробляти або терапевтичну, або захисну імунологічну (вторинну імунну) відповідь так, щоб підвищувалася стійкість до нової інфекції й/або знижувалася клінічна серйозність захворювання. Таку захисну дію можна виявляти або по зниженню рівня або серйозності, або за відсутністю одного або декількох симптомів, асоційованих з інфекціями, які викликаються PCV2, у хазяїна, уповільненню появи вірусу в крові (віремія), зниженню персистентності вірусу, зниженню загального вірусного навантаження й/або зниженню вірусної екскреції. Поняття "імуногенна композиція" або "вакцина" (обоє поняття є синонімами) у контексті даного опису відносяться до будь-якої фармацевтичної композиції, що містить антиген PCV2, при цьому, композицію можна застосовувати для попередження або лікування захворювання або стану, асоційованого з інфекцією, яка викликається PCV2, у тварини. Краща імуногенна композиція може індукувати, стимулювати або підвищувати імунну відповідь на PCV2. Під це поняття підпадають як субодиничні імуногенні композиції, описані нижче, так і композиції, які містять вбиті (повністю знешкоджені) або ослаблені й/або інактивовані PCV2. Таким чином, іншим об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, спосіб підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається 4 PCV2, спосіб зниження кількості тварин з рівнем вірусного навантаження, що становить від 10 6 до 10 геномних копій на мл сироватки, спосіб зниження кількості тварин з рівнем вірусного 6 навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, спосіб зниження виділення вірусу з носа, спосіб зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, спосіб зниження коефіцієнта захворюваності у субклінічно інфікованій череді, спосіб зниження коефіцієнта смертності у субклінічно інфікованій череді, у кожному випадку полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні, де імуногенна композиція являє собою субодиничну імуногенну композицію, композицію, що містить повністю знешкоджені або ослаблені й/або інактивовані PCV2. У контексті даного опису поняття "субодинична імуногенна композиція" відноситься до композиції, що містить щонайменше один імуногенний поліпептид або антиген, але не всі антигени, які виведені або являються гомологами антигену PCV2. Така композиція практично вільна від інтактного PCV2. Таким чином, "субодиничну імуногенну композицію" одержують щонайменше із частково очищених або фракціонованих (переважно практично очищених) імуногенних поліпептидів з PCV2 або їх рекомбіантних аналогів. Субодинична імуногенна композиція може містити субодиницю антигену або антигенів, що представляють інтерес, які 7 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 практично вільні від інших антигенів або поліпептидів з PCV2 або є фракціонованими. Краща імуногенна субодинична композиція містить білок ОРС-2 PCV2, описаний нижче. Найбільш кращими є імуногенні субодиничні композиції, які містять будь-який з антигенів PCV2, що представлені у WO 06/072065, яка повністю включена у даний опис як посилання. Таким чином, наступним об'єктом винаходу є імуногенна композиція, як вона визначена в контексті даного опису, що найбільш переважно містить поліпептид або його фрагмент, експресований ОРС-2 PCV2. ДНК ОРС-2 PCV2 і білок, які застосовують відповідно до винаходу для готування композицій і за допомогою способів, запропонованих у винаході, являє собою висококонсервативний домен в ізолятах PCV2 і тому відповідно до винаходу будь-яка ОРС-2 PCV2 повинна бути ефективною як джерело ДНК ОРС-2 PCV і/або поліпептиду. Кращим білком ОРС-2 PCV2 є білок, послідовність якого представлена в SEQ ID NO: 11 у WO 06/072065. Іншим кращим поліпептидом ОРС-2 PCV є поліпептид, послідовність якого представлена в SEQ ID NO: 5 у WO 06/072065. Однак фахівцям у даній області повинно бути очевидно, що послідовність може варіюватися в межах 6-10 % відповідно до поняття гомології послідовностей і усе ще зберігати антигенні характеристики, які роблять її прийнятною для включення в імуногенні композиції. Антигенні характеристики імунологічної композиції можна оцінювати, наприклад, шляхом експериментів за контрольним зараженням, описаних у прикладі 4 WO 06/072065. Крім того, антигенні характеристики модифікованого антигену усе ще зберігаються, коли модифікований антиген забезпечує щонайменше 70 %, переважно 80 %, більш переважно 90 % захисного імунітету у порівнянні з білком ОРС-2 PCV2, що кодується полінуклеотидною послідовністю, представленою в SEQ ID NO:3 або SEQ ID NO:4 у WO 06/072065. Таким чином, іншим об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, спосіб підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається 4 PCV2, спосіб зниження кількості тварин з рівнем вірусного навантаження, що становить від 10 6 до 10 геномних копій на мл сироватки, спосіб зниження кількості тварин з рівнем вірусного 6 навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, спосіб зниження виділення вірусу з носа, спосіб зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, спосіб зниження коефіцієнта захворюваності у субклінічно інфікованій череді, спосіб зниження коефіцієнта смертності у субклінічно інфікованій череді, у кожному випадку полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, що має потребу в такому введенні, де антиген PCV2 являє собою антигенний білок ОРС-2 PCV2, що забезпечує щонайменше 70 %, переважно 80 %, більш переважно 90 % захисного імунітету у порівнянні з білком ОРС-2 PCV2, що кодується полінуклеотидною послідовністю, представленою в SEQ ID NO:3 або SEQ ID NO:4 у WO 06/072065. Переважно білок ОРС-2 PCV2 має послідовність, представлену в SEQ ID NO: 11 або SEQ ID NO: 5 у WO 06/072065. У деяких варіантах імуногенні ділянки білка ОРС-2 PCV2 застосовують в якості антигенного компонента в імуногенній композиції, що містить антиген PCV2. Поняття "імуногенна ділянка" у контексті даного опису відноситься до форм або фрагментів білка, які вкорочені й/або мають заміни, й/або полінуклеотида ОРС-2 PCV2 відповідно. Переважно такі форми або фрагменти, які вкорочені й/або мають заміни, повинні містити щонайменше 6 суміжних амінокислот з повнорозмірного поліпептиду ОРС-2. Більш переважно форми або фрагменти, які вкорочені й/або мають заміни, повинні містити щонайменше 5, переважно 8, більш переважно 10, більш переважно щонайменше 15 і ще більш переважно щонайменше 19 суміжних амінокислот з повнорозмірного поліпептиду ОРС-2 PCV. Дві кращі в цьому плані послідовності представлені у вигляді SEQ ID NO: 9 і SEQ ID NO:10 у WO 06/072065. Варто розуміти також, що зазначені послідовності можуть являти собою частину більш великих фрагментів або вкорочених форм. Як зазначено вище, кращим є також будь-який поліпептид ОРС-2 PCV2, що кодується нуклеотидними послідовностями SEQ ID NO: 3 або SEQ ID NO: 4. Крім того, як повинно бути очевидно фахівцям у даній області, ця послідовність може варіюватися в межах 6-20 % відповідно до поняття гомології послідовностей і усе ще зберігати антигенні характеристики, які роблять її прийнятною для включення в імуногенні композиції. У деяких варіантах форми або фрагменти, які вкорочені й/або мають заміни, поліпептиду ОРС-2 PVC2 застосовують як антигенний компонент у композиції. Переважно такі форми або фрагменти, які вкорочені й/або мають заміни, повинні містити щонайменше 18 суміжних нуклеотидів з повнорозмірною нуклеотидною послідовністю ОРС-2 PVC2, наприклад, SEQ ID NO: 3 або SEQ ID NO: 4. Більш переважно форми або фрагменти, які вкорочені й/або мають заміни, повинні містити щонайменше 30, більш переважно щонайменше 45 і ще більш переважно щонайменше 57 8 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 суміжних нуклеотидів з повнорозмірною нуклеотидною послідовністю ОРС-2 PVC2, наприклад, представленою в SEQ ID NO: 3 або SEQ ID NO: 4. Поняття "ідентичність послідовностей", як відомо в даній області, відноситься до споріднення між двома або більшою кількістю поліпептидних послідовностей або двома або більшою кількістю полінуклеотидних послідовностей, а саме між референс-послідовністю й розглянутою послідовністю, що підлягає порівнянню з референс- послідовністю. Ідентичність послідовностей визначають шляхом порівняння даної послідовності з референс-послідовністю після оптимального вирівнювання послідовностей для одержання найбільш високого ступеня подібності послідовностей, що визначають за сумісністю відрізків зазначених послідовностей. Після вирівнювання ідентичність послідовностей оцінюють за підставами, що перебувають в однакових положеннях (по типу "положення з положенням"), наприклад, послідовності є "ідентичними" у певному положенні, якщо в цьому положенні нуклеотиди або амінокислотні залишки ідентичні. Загальну кількість таких ідентичних положень потім ділять на загальну кількість нуклеотидів або залишків у референс-послідовності, одержуючи % ідентичності послідовностей. Ідентичність послідовностей легко можна розраховувати за допомогою відомих методів, включаючи, але, не обмежуючись тільки ними, описані в: Computational Molecular Biology, під ред. Lesk A. N., з Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, під ред. Smith D.W., з, Academic Press, New York, 1993; Computer Analysis of Sequence Data, частина I, під ред. Griffin A.M. і Griffin H. G., з Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinge G., з Academic Press, 1987; Sequence Analysis Primer, під ред. Gribskov M. і Devereux J., з M. Stockton Press, New York, 1991; і Carillo H. і Lipman, D., SIAM J. Applied Math., 48, 1988, с. 1073, змісти яких включені у даний опис як посилання. Кращі методи визначення ідентичності послідовностей створені так, щоб одержувати найбільшу відповідність між досліджуваними послідовностями. Методи визначення ідентичності послідовностей приведені в систему у доступних громадськості комп'ютерних програмах, які дозволяють визначати ідентичність послідовностей для розглянутих послідовностей. Прикладами таких програм є, але, не обмежуючись тільки ними, пакет програм GCG (Devereux J. і ін., Nucleic Acids Research, 12(1), 1984, с. 387), BLASTP, BLASTN і FASTA (Altschul S. F. і ін., J. Molec. Biol., 215, 1990, сс. 403-410). Програма BLASTX є доступною громадськості від NCBI і інших джерел (BLAST Manual, Altschul S. і ін., NCVI NLM NIH Bethesda, MD 20894, Altschul S. F. і ін., J. Molec. Biol., 215, 1990, сс. 403-410), змісти яких включені у даний опис як посилання). Ці програми дозволяють здійснювати оптимальне вирівнювання послідовностей за допомогою прийнятих за замовчуванням значень, таких як вага пролому, для того, що одержувати найбільш високий рівень ідентичності послідовностей для розглянутої послідовності й референс- послідовності. Як ілюстрація: коли згадується полінуклеотид, нуклеотидна послідовність якого щонайменше на 85 %, переважно на 90 %, ще більш переважно на 95 % "ідентична послідовності" нуклеотидної референс-послідовності, то мається на увазі, що нуклеотидна послідовність даного полінуклеотида ідентична референспослідовності за винятком того, що дана полінуклеотидна послідовність може включати аж до 15, переважно аж до 10, ще більш переважно аж до 5 точкових мутацій на кожні 100 нуклеотидів нуклеотидної референс-послідовності. Інакше кажучи, для того, щоб полінуклеотид мав нуклеотидну послідовність, ідентичну щонайменше на 85 %, переважно на 90 %, ще більш переважно на 95 % з нуклеотидною референс- послідовністю, аж до 15 %, переважно 10 %, ще більш переважно 5 % нуклеотидів у референс-послідовності можна вилучати шляхом делеції або заміняти на інший нуклеотид, або аж до 15 % нуклеотидів, переважно 10 %, ще більш переважно 5 % від загальної кількості нуклеотидів у референс-послідовності можна вбудовувати у референс-послідовність. Ці мутації референс-послідовності можуть мати місце на 5'- або 3'-кінці нуклеотидної референс-послідовності або у будь-якому положенні між цими кінцями, або перебуваючи індивідуально серед нуклеотидів у референс- послідовності, або у вигляді однієї або декількох суміжних груп у референс- послідовності. Аналогічно цьому, коли згадують поліпептид, амінокислотна послідовність якого ідентична щонайменше, наприклад на 85 %, переважно на 90 %, ще більш переважно на 95 % амінокислотній референспослідовності, то мають на увазі, що розглянута амінокислотна послідовність поліпептиду ідентична референс- послідовності за винятком того, що розглянута поліпептидна послідовність може включати аж до 15, переважно аж до 10, ще більш переважно аж до 5 амінокислотних замін на кожні 100 амінокислот амінокислотної референс-послідовності. Інакше кажучи, для одержання даної поліпептидної послідовності, що щонайменше на 85 %, переважно на 90 %, ще більш переважно на 95 % ідентична послідовності амінокислотної референс-послідовності, аж до 15 %, переважно аж до 10 %, ще більш переважно аж до 5 % амінокислотних залишків у референс-послідовності можна вилучати шляхом делеції або заміняти на іншу амінокислоту, 9 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 або аж до 15 % амінокислот, переважно аж до 10 %, ще більше переважно аж до 5 % від загальної кількості амінокислотних залишків у референс-послідовності можна вбудовувати у референс-послідовність. Ці зміни референс-послідовності можуть мати місце на аміно- або карбоксикінці амінокислотної референс-послідовності або у будь-якому положенні між цими кінцевими положеннями, або перебуваючи індивідуально серед залишків у референспослідовності, або у вигляді однієї або декількох суміжних груп у референс- послідовності. Переважно положення залишків, які є неідентичними, відрізняються консервативними амінокислотними замінами. Однак консервативні заміни не відносять до сумісних при визначенні ідентичності послідовностей. Визначення "гомології послідовностей" у контексті даного опису відноситься до методу визначення подібності двох послідовностей. Для визначення гомології послідовностей дві або більшу кількість послідовностей піддають оптимальному вирівнюванню й при необхідності інтродукують проломи. На відміну від оцінки ідентичності послідовностей при визначенні гомології послідовностей консервативні амінокислотні заміни вважають такими, що задовольняють умовам гомології. Інакше кажучи, для того, щоб поліпептид або полінуклеотид мав 95 %-ву гомологію послідовності з референс-послідовністю, 85 %, переважно 90 %, ще більш переважно 95 % амінокислотних залишків або нуклеотидів у референс-послідовності повинні відповідати або містити консервативну заміну на іншу амінокислоту або нуклеотид, або кількість амінокислот або нуклеотидів, що становить аж до 15 %, переважно аж до 10 %, ще більш переважно аж до 5 % від загальної кількості амінокислотних залишків або нуклеотидів, не включаючи консервативні заміни, у референс-послідовності можна вбудовувати у референспослідовність. Переважно гомологічна послідовність містить щонайменше ділянку, що складається з 50, ще більш переважно з 100, ще більш переважно з 250, ще більш переважно з 500 нуклеотидів. Поняття "консервативна заміна" відноситься до заміни амінокислотного залишку або нуклеотида на інший амінокислотний залишок або нуклеотид, що має подібні характеристики або властивості, включаючи розмір, гідрофобність тощо, у результаті чого загальна функціональність не змінюється істотно. Поняття "виділений" означає "змінений людиною" щодо його стану, який зустрічається в природних умовах, тобто, якщо він зустрічається в природі, то його змінюють або видаляють із природного оточення, або здійснюють і те, і інше. Наприклад, полінуклеотид або поліпептид, який зустрічається в природних умовах у живому організмі, не є "виділеним", але цей же полінуклеотид або поліпептид, відділений від матеріалу, разом з яким він присутній у своєму природному стані, є "виділеним" відповідно до поняття, яке застосовується в описі. Таким чином, іншим об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, спосіб підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається 4 PCV2, спосіб зниження кількості тварин з рівнем вірусного навантаження, що становить від 10 6 до 10 геномних копій на мл сироватки, спосіб зниження кількості тварин з рівнем вірусного 6 навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, спосіб зниження виділення вірусу з носа, спосіб зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, спосіб зниження коефіцієнта захворюваності у субклінічно інфікованій череді, спосіб зниження коефіцієнта смертності у субклінічно інфікованій череді, у кожному випадку полягає в тому, що вводять у терапевтично ефективній кількості білок ОРС-2 PCV2 тварині, що має потребу в такому введенні, де білок ОРС-2 PCV2 являє собою будь-який із зазначених вище білків. Переважно білок ОРС-2 PCV2 являє собою: I) поліпептид, що містить послідовність, представлену в SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 9, SEQ ID NO: 10 або SEQ ID NO: 11 у WO 06/07065; II) будь-який поліпептид, який щонайменше на 80 % гомологічний поліпептиду, зазначеному в I); III) будь-який імуногенний фрагмент поліпептидів, зазначених в I) і/або II); IV) імуногенний фрагмент, зазначений в III), який містить щонайменше 5, переважно 8, ще більш переважно 10 суміжних амінокислот, що входять у послідовності, представлені в SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 9, SEQ ID NO: 10 або SEQ ID NO: 11 у WO 06/072065; V) поліпептид, що кодується ДНК, який містить послідовність, представлену в SEQ ID NO: 3 або SEQ ID NO: 4 у WO 06/072065; VI) будь-який поліпептид, що кодується полінуклеотидом, який щонайменше на 80 % гомологічний полінуклеотиду, зазначеному в V); VII) будь-який імуногенний фрагмент поліпептидів, які кодуються полінуклеотидом, 10 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 зазначеним в V) і/або VI); VIII) імуногенний фрагмент, зазначений в VII), де полінуклеотид, який кодує імуногенний фрагмент, містить щонайменше 30 суміжних нуклеотидів, що входять у послідовності, які представлені в SEQ ID NO: 3 або SEQ ID NO: 4 у WO 06/072065. Переважно будь-який із зазначених імуногенних фрагментів має імуногенні характеристики білка ОРС-2 PCV2, що кодується послідовностями, які представлені в SEQ ID NO: 3 або SEQ ID NO: 4 у WO 06/07065. Таким чином, відповідно до наступного об'єкта винаходу білок ОРС-2 PCV2 утримується в імуногенній композиції з таким рівнем включення антигену, що є ефективним для лікування тварин із субклінічною формою інфекції, яка викликається PCV2. Переважно рівень включення білка ОРС-2 PCV2 відповідає щонайменше 0,2 мкг антигену/мл кінцевої імуногенної композиції (мкг/мл), більш переважно від приблизно 0,2 до приблизно 400 мкг/мл, ще більш переважно від приблизно 0,3 до приблизно 200 мкг/мл, ще більш переважно від приблизно 0,35 до приблизно 100 мкг/мл, ще більш переважно від приблизно 0,4 до приблизно 50 мкг/мл, ще більш переважно від приблизно 0,45 до приблизно 30 мкг/мл, ще більш переважно від приблизно 0,6 до приблизно 15 мкг/мл, ще більш переважно від приблизно 0,75 до приблизно 8 мкг/мл, ще більш переважно від приблизно 1,0 до приблизно 6 мкг/мл, ще більш переважно від приблизно 1,3 до приблизно 3,0 мкг/мл, ще більш переважно від приблизно 1,4 до приблизно 2,5 мкг/мл, ще більш переважно від приблизно 1,5 до приблизно 2,0 мкг/мл і найбільш переважно приблизно 1,6 мкг/мл. Згідно ще одному об'єкту винаходу рівень включення антигену ОРС-2 PCV становить щонайменше 0,2 мкг білка ОРС-2 PCV2, описаного вище, на дозу кінцевої антигенної композиції (мкг/дозу), більш переважно від приблизно 0,2 до приблизно 400 мкг/дозу, ще більш переважно від приблизно 0,3 до приблизно 200 мкг/дозу, ще більш переважно від приблизно 0,35 до приблизно 100 мкг/дозу, ще більш переважно від приблизно 0,4 до приблизно 50 мкг/дозу, ще більш переважно від приблизно 0,45 до приблизно 30 мкг/дозу, ще більш переважно від приблизно 0,6 до приблизно 15 мкг/дозу, ще більш переважно від приблизно 0,75 до приблизно 8 мкг/дозу, ще більш переважно від приблизно 1,0 до приблизно 6 мкг/дозу, ще більш переважно від приблизно 1,3 до приблизно 3,0 мкг/дозу, ще більш переважно від приблизно 1,4 до приблизно 2,5 мкг/дозу, ще більш переважно від приблизно 1,5 до приблизно 2,0 мкг/дозу й найбільш переважно приблизно 1,6 мкг/дозу. Поліпептид ОРС-2 PCV2, який застосовується в імуногенній композиції, запропонованій у даному винаході, можна одержувати будь-яким методом, включаючи виділення й очищення ОРС-2 PCV2, стандартний метод синтезу білків і метод рекомбінантної ДНК. Кращі методи одержання поліпептиду ОРС-2 PCV2 представлені у WO 06/072065, сутність і зміст якої повністю включені у даний опис як посилання. У цілому, метод полягає в наступному: заражають чутливі клітини рекомбінантним вірусним вектором, який містить послідовності ДНК ОРС-2 PCV2, що кодуються, експресують поліпептид ОРС-2 PCV2 за допомогою рекомбінантного вірусу й виділяють експресивний поліпептид ОРС-2 PCV2 із супернатанта шляхом фільтрації, та інактивують загальноприйнятим методом, переважно використовуючи бінарний етиленімін (БЕІ), який потім нейтралізують для припинення процесу інактивації. Поняття "імуногенна композиція" у контексті даного опису відноситься також до композиції, що містить I) будь-який білок ОРС-2 PCV2, описаний вище, переважно у зазначених вище концентраціях, і II) щонайменше частину вірусного вектора, який експресує зазначений білок ОРС-2 PCV2, переважно рекомбінантного бакуловіруса. Крім того, імуногенна композиція може містити I) будь-який з білків ОРС-2 PCV2, описаних вище, переважно у зазначених вище концентраціях, II) щонайменше частину вірусного вектора, який експресує білок ОРС-2 PCV2, переважно рекомбінантного бакуловіруса, і III) частину супернатанта клітинної культури. Таким чином, іншим об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, спосіб підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається 4 PCV2, спосіб зниження кількості тварин з рівнем вірусного навантаження, що становить від 10 6 до 10 геномних копій на мл сироватки, спосіб зниження кількості тварин з рівнем вірусного 6 навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, спосіб зниження виділення вірусу з носа, спосіб зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, спосіб зниження коефіцієнта захворюваності у субклінічно інфікованій череді, спосіб зниження коефіцієнта смертності у субклінічно інфікованій череді, у кожному випадку полягає в тому, що вводять у терапевтично ефективній кількості білок ОРС-2 PCV2 тварині, яка має потребу в такому введенні, де антиген PCV2 являєсобою рекомбінантний ОРС-2 PCV2, який переважно експресується у бакуловірусі 11 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОРС-2 PCV2. Переважно рекомбінантні або ті, що експресуються у бакуловірусі, ОРС-2 PCV2 мають зазначену вище послідовність. Поняття "імуногенна композиція" у контексті даного опису відноситься також до композиції, що містить I) будь-який з білків ОРС-2 PCV2, описаних вище, переважно у зазначених вище концентраціях, II) щонайменше частину вірусного вектора, який експресує зазначений білок ОРС-2 PCV2, переважно рекомбінантного бакуловіруса, і III) частину клітинної культури, де приблизно 90 % компонентів мають розмір менше 1 мкм. Поняття "імуногенна композиція" у контексті даного опису відноситься також до композиції, що містить I) будь-який з білків ОРС-2 PCV2, описаних вище, переважно у зазначених вище концентраціях, II) щонайменше частину вірусного вектора, який експресує зазначений білок ОРС-2 PCV2, III) частину клітинної культури, IV) інактивуючий агент, призначений для інактивації рекомбінантного вірусного вектора, переважно БЕІ, де приблизно 90 % компонентів I)-III) мають розмір менше 1 мкм. Переважно БЕІ є присутнім у концентраціях, які ефективні для інактивації бакуловіруса, переважно від 2 до приблизно 8мм БЕІ, переважно приблизно 5мм БЕІ. Поняття "імуногенна композиція" у контексті даного опису відноситься також до композиції, що містить I) будь-який з білків ОРС-2 PCV2, описаних вище, переважно у зазначених вище концентраціях, II) щонайменше частину вірусного вектора, який експресує зазначений білок ОРС-2 PCV2, III) частину клітинної культури, IV) інактивуючий агент, призначений для інактивації рекомбінантного вірусного вектора, переважно БЕІ, і V) нейтралізуючий агент, призначений для припинення інактивації, який опосередкований інактивуючим агентом, де приблизно 90 % компонентів I)-III) мають розмір менше 1 мкм. Переважно, якщо інактивуючий агент являє собою БЕІ, то зазначена композиція містить тіосульфат натрію у кількостях, еквівалентних кількості БЕІ. Поліпептид включають у композицію, яку можна вводити тварині, чутливій до інфекції, яка викликається PCV2. У кращих варіантах у композицію можна включати додаткові компоненти, відомі фахівцям у даній області (див. також Remington's Pharmaceutical Sciences, 18-і изд., з Mack Publ., Easton, 1990). Крім того, до складу композиції можуть входити один або декілька прийнятних для застосування у ветеринарії носіїв. У контексті даного опису поняття "прийнятний для застосування у ветеринарії носій" включає, але, не обмежуючись тільки ними, будь-які з перерахованих або всі розчинники, дисперсійні середовища, матеріали для нанесення покриття, ад'юванти, стабілізатори, розріджувачі, консерванти, антибактеріальні й протигрибкові агенти, агенти для надавання ізотонічності, агенти, що сповільнюють адсорбцію тощо. У кращому варіанті здійснення винаходу імуногенна композиція містить білок ОРС-2 PCV2, описаний вище, переважно у зазначених вище концентраціях, який змішують із ад'ювантом, переважно карбополом, і фізіологічним розчином. Фахівцям у даній області повинно бути очевидно, що композиція, яку застосовують відповідно до винаходу, може включати відомі придатні для ін'єкції фізіологічно прийнятні стерильні розчини. Для готування готового до застосування розчину для парентеральної ін'єкції або інфузії широко використовують водні ізотонічні розчини, такі, наприклад, як фізіологічний розчин або відповідні розчини білків плазми. Крім того, імуногенні композиції й вакцини, запропоновані у даному винаході, можуть включати розріджувачі, агенти для надавання ізотонічності, стабілізатори або ад'юванти. Розріджувачі можуть являти собою воду, фізіологічний розчин, декстрозу, етанол, гліцерин тощо. Агенти для надавання ізотонічності можуть являти собою серед іншого хлорид натрію, декстрозу, маніт, сорбіт і лактозу. Стабілізатори являють собою серед іншого альбумін і солі лужних металів і етилендіамінтетраоцтової кислоти. Поняття "ад'юванти" у контексті даного опису може відноситися до гідроксиду алюмінію й фосфату алюмінію, сапонінам, таким, наприклад, як Quil A, QS-21 (фірма Cambridge Biotech Inc., Кембрідж, шт. Массачусетс), GPI-0100 (фірма Galenica Pharmaceuticals, Inc., Бірмінгем, шт. Алабама), емульсії вода-в-олії, емульсії олія-у-воді, емульсії вода-в-олії-у-воді. Основою емульсії може бути, зокрема, легка рідка парафінова олія (яка відповідає Європейській фармакопеї); ізопреноїдна олія, така як сквалан або сквален; олія, що утворилася в результаті олігомеризації алкенів, насамперед ізобутена або децена; ефіри кислот або спиртів, які містять лінійну алкільну групу, більш конкретно рослинні олії, етилолеат, ди(каприлат/капрат) пропіленгліколя, три(каприлат/капрат) гліцерини або діолеат пропіленгліколя; ефіри розгалужених жирних кислот або спиртів, зокрема, ефіри ізостеаринової кислоти. Олії застосовують у сполученні з емульгаторами для одержання емульсії. Емульгатори переважно являють собою неіоногенні поверхнево-активні речовини, насамперед складні ефіри сорбітана, маніда (наприклад, безводний манітолеат), гліколя, полігліцерину, пропіленгліколя й олеїнової, 12 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 ізостеаринової, рицинолеїнової або гідроксистеаринової кислоти, які необов'язково є етоксилованими, і блок-сополімери поліоксипропілена-поліоксіетилена, зокрема продукти типу Pluronic, насамперед L121 (див. Hunter і ін., The Theory and Practical Application of Adjuvants, під ред. Stewart-Tull D. E. S., з John Wiley and Sons, NY, сс. 51-94, 1995 і Todd і ін., Vaccine 15, 1997, сс. 564-570). Наприклад, можна застосовувати SPT-емульсію, описану на с. 147 в: "Vaccine Design, The Subunit and Adjuvant Approach", під ред. M. Powell і M. Newman, з Plenum Press, 1995, і емульсію MF59, описану на с. 183 у цій же публікації. Іншим прикладом ад'юванта є сполука, вибрана з полімерів акрилової або метакрилової кислоти й сополімерів малеїнового ангідриду й алкенільного похідного. Кращими ад'ювантами є полімери акрилової або метакрилової кислоти, насамперед, зшиті з простими поліалкеніловими ефірами цукрів або багатоатомних спиртів. Ці сполуки відомі за назвою карбомери (Phameuropa, т. 8, № 2 червня 1996 р.). Фахівцям у даній області як посилання можна запропонувати US 2909462, у якому описані зазначені акрилові полімери, зшиті з полігідроксилованою сполукою, що має щонайменше 3 гідроксильні групи, переважно не більше 8, при цьому атоми водню щонайменше трьох гідроксильних груп заміщені ненасиченими аліфатичними радикалами, які мають щонайменше 2 атоми вуглецю. Кращими є радикали, які містять від 2 до 4 атомів вуглецю, наприклад, вінільні, алільні й інші ненасичені групи ряду етилену. Ненасичені радикали можуть самі містити інші замісники, такі як метил. Найбільш кращими є продукти, що надходять у продаж за назвою карбопол (фірма BF Goodrich, шт. Огайо). Їх зшивають із алілцукрозою або алілпентаерітрітолом. Серед них насамперед варто згадати карбопол 974P, 934P і 971P. Найбільш кращим для застосування є карбопол 971P. Найбільш переважно застосовують карбопол, зокрема можна застосовувати карбопол 971P, переважно у кількостях від приблизно 500 мкг до приблизно 5 мг на дозу, ще більш переважно в кількості від приблизно 750 мкг до приблизно 2,5 мг на дозу й найбільш переважно в кількості приблизно 1 мг на дозу. Іншими придатними ад'ювантами є, але, не обмежуючись тільки ними, система RIBIад'ювантів (фірма Ribi Inc.), блок-сополімери (фірма CytRx, Атланта, шт. Джорджія), SAF-M (фірма Chiron, Емерівіллe, шт. Каліфорнія), монофосфорил-ліпід A, ад'ювант на основі аміну ліпіду аврідина, термолабільний ентеротоксин E. coli (рекомбінантний або нерекомбінантний), токсин холери, IMS 1314 або мураміл-дипептид. Переважно ад'ювант додають у кількості від приблизно 100 мкг до приблизно 10 мг на дозу. Ще більш переважно ад'ювант додають у кількості від приблизно 100 мкг до приблизно 10 мг на дозу. Ще більш переважно ад'ювант додають у кількості від приблизно 500 мкг до приблизно 5 мг на дозу. Ще більш переважно ад'ювант додають у кількості від приблизно 750 мкг до приблизно 2,5 мг на дозу. Найбільш переважно ад'ювант додають у кількості приблизно 1 мг на дозу. Крім того, композиція може включати один або декілька фармацевтично прийнятних носіїв. У контексті даного опису поняття "фармацевтично прийнятний носій" включає будь-який з перерахованих або всі розчинники, дисперсійні середовища, матеріали для нанесення покриття, стабілізатори, розріджувачі, консерванти, антибактеріальні й протигрибкові агенти, агенти для надавання ізотонічності, агенти, що сповільнюють адсорбцію тощо. Найбільш переважно композиція, запропонована у винаході, містить білок ОРС-2 PCV2, виділений із супернатанта культивованих in vitro клітин, де зазначені клітини інфікують рекомбінантним вірусним вектором, що містить ДНК ОРС-2 PCV2 і експресує білок ОРС-2 PCV2, і де зазначену клітинну культуру обробляють від приблизно 2 до приблизно 8мМ БЕІ, переважно приблизно 5мМ БЕІ, для інактивації вірусного вектора й нейтралізуючим агентом, взятим в еквівалентній концентрації, переважно розчином тіосульфату натрію у кінцевій концентрації від приблизно 2 до приблизно 8мМ, переважно приблизно 5мМ. Даний винахід відноситься також до застосування імуногенної композиції для підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається PCV2, зниження кількості тварин з рівнем вірусного навантаження, 4 6 що становить від 10 до 10 геномних копій на мл сироватки, зниження кількості тварин з рівнем 6 вірусного навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, зниження виділення вірусу з носа, зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, зниження коефіцієнта захворюваності у субклінічно інфікованій череді, зниження коефіцієнта смертності у субклінічно інфікованій череді, де імуногенна композиція містить I) будь-який з білків ОРС-2 PCV2, описаних вище, переважно у зазначених вище концентраціях, II) щонайменше частину вірусного вектора, який експресує зазначений білок ОРС-2 PCV2, III) частину клітинної культури, IV) інактивуючий агент, 13 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 призначений для інактивації рекомбінантного вірусного вектора, переважно БЕІ, і V) нейтралізуючий агент, призначений для припинення інактивації, опосередкованої інактивуючим агентом, переважно тіосульфат натрію у кількостях, еквівалентних кількості БЕІ; і VI) прийнятний ад'ювант, переважно карбопол 971 у зазначених вище кількостях, де приблизно 90 % компонентів I)-III) мають розмір менше 1 мкм. Згідно ще одному об'єкту винаходу зазначена імуногенна композиція містить також фармацевтично прийнятну сіль, переважно фосфат, у фізіологічно прийнятних концентраціях. Краще значення pH зазначеної імуногенної композиції доводять до фізіологічного значення pH, тобто приблизно до рівня від 6,5 до 7,5. У контексті даного опису імуногенна композиція являє собою також композицію, що містить в одному мл: I) щонайменше 1,6 мкг білка ОРС-2 PCV2, описаного вище, II) щонайменше частину бакуловіруса, який експресує зазначений білок ОРС-2 PCV2, III) частину клітинної культури, IV) приблизно від 2 до 8мМ БЕІ, V) тіосульфат натрію у кількостях, еквівалентних кількості БЕІ, і VI) приблизно 1 мг карбопола 971, і VII) фосфат у фізіологічно прийнятній концентрації, де приблизно 90 % компонентів I)-III) мають розмір менше 1 мкм, і значення pH зазначеної імуногенної композиції доведено приблизно до 6,5-7,5. Імуногенні композиції можуть містити також один або декілька інших імуномодулуючих агентів, таких, наприклад, як інтерлейкіни, інтерферони або інші цитокіни. Імуногенні композиції можуть містити також гентаміцин і мертіолат. Хоча фахівець у даній області легко може визначати кількості й концентрації ад'ювантів і добавок, які можна застосовувати у контексті даного винаходу, у даному винаході запропоновані композиції, що містять від приблизно 50 до приблизно 2000 мкг ад'юванта й переважно приблизно 250 мкг/мл дози композиції вакцини. Так, імуногенна композиція, запропонована у винаході, являє собою також композицію, що містить від приблизно 1 до приблизно 60 мкг/мл антибіотиків і більш переважно менше приблизно 30 мкг/мл антибіотиків. У контексті даного опису імуногенна композиція являє собою також композицію, що містить I) будь-який з білків ОРС-2 PCV2, описаних вище, переважно у зазначених вище концентраціях, II) щонайменше частину вірусного вектора, який експресує зазначений білок ОРС-2 PCV2, III) частину клітинної культури, IV) інактивуючий агент, призначений для інактивації рекомбінантного вірусного вектора, переважно БЕІ, і V) нейтралізуючий агент, призначений для припинення інактивації, опосередкованої інактивуючим агентом, переважно тіосульфат натрію у кількостях, еквівалентних кількості БЕІ; VI) прийнятний ад'ювант, переважно карбопол 971 у зазначених вище кількостях; VII) соляний буфер у фармацевтично прийнятній концентрації, переважно фосфат, і VIII) протимікробну діючу речовину, де приблизно 90 % компонентів I)-III) мають розмір менше 1 мкм. Поняття "імуногенна композиція" у контексті даного опису відноситься також до Ingelvac® TM CircoFLEX (фірма Boehringer Ingelheim Vetmedica Inc, Сант-Хосе, шт. Міссурі, США), CircoVac® (фірма Merial SAS, Ліон, Франція), CircoVent (фірма Intervet Inc., Моллсборо, шт. Делавер, США) або Suvaxyn PCV-2 One Dose® (фірма Fort Dodge Animal Health, Канзас-Сіті, шт. Канзас, США). Таким чином, ще одним об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, спосіб підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається PCV2, спосіб зниження кількості тварин з рівнем вірусного навантаження, що 4 6 становить від 10 до 10 геномних копій на мл сироватки, спосіб зниження кількості тварин з 6 рівнем вірусного навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, спосіб зниження виділення вірусу з носа, спосіб зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, спосіб зниження коефіцієнта захворюваності у субклінічно інфікованій череді, спосіб зниження коефіцієнта смертності у субклінічно інфікованій череді, у кожному випадку полягає в тому, що вводять в ефективній кількості антиген PCV2 тварині, яка має потребу в такому введенні, де TM імуногенна композиція, що містить антиген PCV2, являє собою Ingelvac® CircoFLEX , TM CircoVac®, CircoVent і/або Suvaxyn PCV-2 One Dose®, переважно Ingelvac® CircoFLEX . Поняття "ефективна кількість антигену PCV2" у контексті даного опису означає, але, не обмежуючись тільки зазначеним, кількість антигену, що викликає або може викликати імунну відповідь у тварини, якій вводять антиген PCV2 в ефективній дозі. Ефективна кількість залежить від інгредієнтів вакцини й схеми введення. Як правило, коли в комбінованій вакцині застосовують препарат інактивованого вірусу або модифікованого живого 2,0 9,0 вірусу, то вакцину застосовують у кількості, що становить від приблизно 10 до приблизно 10 3,0 8,0 TCID50 на дозу, переважно від приблизно 10 до приблизно 10 TCID50 на дозу, більш 4,0 8,0 переважно від приблизно 10 до приблизно 10 TCID50 на дозу. Зокрема, коли у вакцинах 14 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосовують модифікований живий PCV2, то рекомендована доза, призначена для введення 3,0 чутливій тварині, становить переважно від приблизно 10 TCID50 (середня цитопатогена доза, 6,0 що інфікує 50 % клітин) /дозу до приблизно 10 TCID50/дозу й більш переважно від приблизно 4,0 5,0 10 TCID50/дозу до приблизно 10 TCID50/дозу. У цілому, кількість антигену повинна становити 2,0 9,0 3,0 6,0 від приблизно 0,2 до 5000 мкг і від 10 до 10 TCID50, переважно від 10 до 10 TCID50, більш 4,0 5,0 переважно від 10 до 10 TCID50, при застосуванні очищеного антигену. Субодиничні вакцини, як правило, вводять із рівнем включення антигену, що становить щонайменше 0,2 мкг антигену на дозу, переважно від приблизно 0,2 до приблизно 400 мкг/дозу, ще більш переважно від приблизно 0,3 до приблизно 200 мкг/дозу, ще більш переважно від приблизно 0,35 до приблизно 100 мкг/дозу, ще більш переважно від приблизно 0,4 до приблизно 50 мкг/дозу, ще більш переважно від приблизно 0,45 до приблизно 30 мкг/дозу, ще більш переважно від приблизно 0,6 до приблизно 16 мкг/дозу, ще більш переважно від приблизно 0,75 до приблизно 8 мкг/дозу, ще більш переважно від приблизно 1,0 до приблизно 6 мкг/дозу, ще більш переважно від приблизно 1,3 до приблизно 3,0 мкг/дозу. Встановлено, що отриманий від матері імунітет забезпечує певний ступінь захисту від інфекції, яка викликається PCV2, й клінічних захворювань, пов'язаних з інфекцією, яка викликається PCV2. Встановлено, що зазначений захист залежить від титру антитіл: як правило, більш високі титри забезпечують захисну дію, а при більш низьких титрах вона відсутня (McKeown і ін., Clin. Diagn. Lab. Immunol., 12, 2005, сс. 1347-1351). Встановлено, що середній час напівжиття антитіл у відлучених від матері тварин становить 19,0 днів, і вікно розпаду пов'язаних з пасивною імунізацією антитіл до PCV2 у популяції є відносно широким (Opriessnig і ін., J. Swine Health Prod. 12, 2004, сс. 186-191). Присутність отриманих від матері антитіл не тільки може забезпечувати певний ступінь захисту від вірусної інфекції, що однак є непрогнозованим, але так само, як відомо, впливає на ефективність імунізації. При створенні винаходу зненацька було встановлено, що присутність антитіл до PCV, зокрема титрів антитіл до PCV2 аж до 1:1000, не робить впливу на ефективність лікування PCV2. Таким чином, ще одним об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, спосіб підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається 4 PCV2, спосіб зниження кількості тварин з рівнем вірусного навантаження, що становить від 10 6 до 10 геномних копій на мл сироватки, спосіб зниження кількості тварин з рівнем вірусного 6 навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, спосіб зниження виділення вірусу з носа, спосіб зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, спосіб зниження коефіцієнта захворюваності у субклінічно інфікованій череді, спосіб зниження коефіцієнта смертності у субклінічно інфікованій череді, у кожному випадку полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, тварині, яка має потребу в такому введенні, де тварина в момент вакцинації має антитіла до PCV2, переважно тварина в момент вакцинації має титр, що виявляється, антитіла до PCV2, який становить аж до 1:100, переважно перевищуючий 1:100, ще більш переважно перевищуючий 1:250, ще більш переважно перевищуючий 1:500, ще більш переважно перевищуючий 1:640, ще більш переважно перевищуючий 1:750, найбільш переважно перевищуючий 1:1000. Переважно зазначений титр антитіл до PCV2 можна визначати й оцінювати кількісно за допомогою специфічного імунного аналізу антитіл до PCV2, переважно аналізу, описаного у прикладі 2. Методи виявлення й кількісної оцінки антитіл до PCV2 добре відомі у даній області. Наприклад, виявлення й кількісну оцінку антитіл до PCV2 можна здійснювати за допомогою методу непрямої імунофлуоресценції, описаного в Magar і ін., Can. J. Vet Res.; 64, 2000, сс. 184186 або в Magar і ін., J. Comp. Pathol.; 123, 2000, сс. 258-269. Інші методи кількісної оцінки антитіл до PCV2 описані в Opriessnig і ін., 37-th Annual Meeting of the American Association of Swine Veterinarians (37-ий Щорічний з'їзд американської асоціації по ветеринарії свиней), 2006 р.). Крім того, у прикладі 2 описаний також непрямий імунофлуоресцентний аналіз, який може застосовувати фахівець у даній області. У випадку спірних результатів і при будь-яких сумнівах варто мати на увазі, що зазначені у даному описі титри антитіл до PCV2 відносяться до титрів, які встановлені/можуть бути встановлені за допомогою аналізу, описаного у прикладі 2. Таким чином, ще одним об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, спосіб підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається 4 PCV2, спосіб зниження кількості тварин з рівнем вірусного навантаження, що становить від 10 6 до 10 геномних копій на мл сироватки, спосіб зниження кількості тварин з рівнем вірусного 15 UA 100507 C2 6 5 10 15 20 25 30 35 40 45 50 55 60 навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, спосіб зниження виділення вірусу з носа, спосіб зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, спосіб зниження коефіцієнта захворюваності у субклінічно інфікованій череді, спосіб зниження коефіцієнта смертності у субклінічно інфікованій череді, у кожному випадку полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, молодій тварині, яка має потребу в такому введенні. Поняття "молода тварина" у контексті даного опису відноситься до тварини віком від 1 до 22 днів. Переважно під поняттям молода тварина мають на увазі тварину віком від 1 до 20 днів. Більш переважно під поняттям "молода тварина" мають на увазі тварину віком від 1 до 15 днів, ще більш переважно віком від 1 дня до 14 днів, ще більш переважно віком від 1 до 12 днів, ще більш переважно віком від 1 до 10 днів, ще більш переважно віком від 1 до 8 днів, ще більш переважно віком від 1 до 7 днів, ще більш переважно віком від 1 до 6 днів, ще більш переважно віком від 1 до 5 днів, ще більш переважно віком від 1 до 4 днів, ще більш переважно віком від 1 до 3 днів, ще більш переважно віком від 1 до 2 днів, найбільш переважно тварину віком 1 день. Через повсюдне поширення PCV2 у польових умовах більша частина молодих поросят є серопозитивними у відношенні PCV2. Таким чином, згідно ще одному об'єкту винаходу молоді тварини в день вакцинації/обробки мають титр, що виявляється, антитіл до PCV2 на рівні аж до 1:100, переважно перевищуючий 1:100, ще більш переважно перевищуючий 1:250, ще більш переважно перевищуючий 1:500, ще більш переважно перевищуючий 1:640, ще більш переважно перевищуючий 1:750, найбільш переважно перевищуючий 1:1000, у день вакцинації/обробки. Композицію, запропоновану у винаході, можна вводити внутрішньошкірно, внутрішньотрахеально або внутрішньопіхвово. Переважно композицію варто вводити внутрішньом'язово або інтраназально, найбільш переважно внутрішньом'язово. Може виявитися кращим вводити описані вище фармацевтичні композиції в організм тварини внутрішньовенно або шляхом ін'єкції безпосередньо у тканини-мішені. Для системного введення кращими є внутрішньовенний, внутрішньосудинний, внутрішньом'язовий, інтраназальний, внутрішньоартеріальний, внутрішньочеревинний, оральний або внутрішньоболонковий шляхи введення. Більше локальне введення можна здійснювати підшкірно, інтрадермально, внутрішньошкірно, внутрішньосерцево, внутрішньочасточково, інтрамедулярно, внутрішньолегенево або безпосередньо у тканину, що підлягає обробці, або у прилеглу область (сполучна, кісткова, м'язова, нервова, епітеліальна тканина). Залежно від необхідної тривалості й ефективності лікування композиції, запропоновані у винаході, можна вводити один або кілька разів, а також періодично, наприклад, з інтервалом в один день протягом декількох днів, тижнів або місяців і з використанням різних доз. Переважно щонайменше одну дозу описаної вище імуногенної композиції вводять внутрішньом'язово суб'єктові, що має потребу в цьому. Ще одним об'єктом винаходу є антиген PCV2 або імуногенна композиція, що містить будь-який описаний вище антиген PCV2, яку фасують у пухирці й вводять із розрахунку від одного (1) мл до п'яти (5) мл на дозу, переважно 1 мл на дозу. Таким чином, ще одним об'єктом даного винаходу є імуногенна композиція об'ємом від 1 до 5 мл, переважно 1 мл, що містить описаний вище антиген PCV-2, призначена для профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у тварини або групи тварин (череди), підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається PCV2, зниження кількості тварин з 4 6 рівнем вірусного навантаження, що становить від 10 до 10 геномних копій на мл сироватки, 6 зниження кількості тварин з рівнем вірусного навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, зниження виділення вірусу з носа, зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, зниження коефіцієнта захворюваності у субклінічно інфікованій череді, зниження коефіцієнта смертності у субклінічно інфікованій череді, при цьому в кожному випадку вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, яка містить антиген PCV2, тварині, що має потребу в такому введенні. Даний винахід відноситься також до способу профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у тварини або групи тварин (череди), способу підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається PCV2, способу зниження 4 6 кількості тварин з рівнем вірусного навантаження, що становить від 10 до 10 геномних копій на мл сироватки, способу зниження кількості тварин з рівнем вірусного навантаження, що 6 перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, способу зниження виділення вірусу з носа, способу зниження тривалості віремії у тварин із субклінічною 16 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 формою інфекції, яка викликається PCV2, способу зниження коефіцієнта захворюваності у субклінічно інфікованій череді, способу зниження коефіцієнта смертності у субклінічно інфікованій череді, у кожному випадку полягає в тому, що вводять у терапевтично ефективній кількості, що становить 1-5 мл, переважно 1 мл антиген PCV2 або імуногенну композицію, яка містить антиген PCV2, тварині, що має потребу в такому введенні. Згідно ще одному об'єкту винаходу здійснюють щонайменше одне додаткове введення щонайменше однієї дози імуногенної композиції, описаної вище, тварині, що має потребу в цьому, де друге або будь-яке додаткове введення здійснюють щонайменше через 14 днів після першого або будь-якого іншого попереднього введення. Переважно імуногенну композицію вводять у сполученні з агентом, що стимулює імунітет. Переважно зазначений агент, що стимулює імунітет, вводять щонайменше двічі. Переважно між першим і другим або будь-яким наступним введенням агента, що стимулює імунітет, повинно пройти щонайменше 3 дні, більш переважно щонайменше 5 днів, ще більш переважно щонайменше 7 днів. Переважно агент, що стимулює імунітет, вводять щонайменше через 10 днів, переважно 15 днів, ще більш переважно 20 днів, ще більш переважно щонайменше 22 дня, після первісного введення імуногенної композиції, запропонованої у винаході. Кращим агентом, що стимулює імунітет, є, наприклад, гемоціанін лімфи завитки (KLH), переважно емульгований за допомогою неповного ад'юванта Фрейнда (KLH/ICFA). Однак, як повинно бути очевидно, можна застосовувати будь-який інший агент, що стимулює імунітет, відомий фахівцеві у даній області. Поняття "агент, що стимулює імунітет" у контексті даного опису відноситься до будь-якого агента або композиції, що/яка може "запускати" імунну відповідь, переважно без ініціації або підвищення специфічної імунної відповіді, наприклад, імунної відповіді на специфічний патоген. Крім того, прийнято вводити агент, що стимулює імунітет, у прийнятній дозі. Даний винахід відноситься також до застосування антигену PCV2 або імуногенної композиції, що містить антиген PCV2, для готування лікарського засобу, призначеного для профілактики й лікування хронічної інфекції, яка викликається PCV2, у тварини або групи тварин (череди), з метою підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається PCV2, зниження кількості тварин з рівнем 4 6 вірусного навантаження, що становить від 10 до 10 геномних копій на мл сироватки, зниження 6 кількості тварин з рівнем вірусного навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, зниження виділення вірусу з носа й зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, зниження коефіцієнта захворюваності у субклінічно інфікованій череді, зниження коефіцієнта смертності у субклінічно інфікованій череді. Переважно антиген PCV2 являє собою рекомбінантний антиген, TM переважно ОРС-2 PCV2, ще більш переважно Ingelvac® CircoFLEX . Поняття "тварина" у контексті даного опису включає свиню, молоду (не досягла полової зрілості) свиню або порося. Таким чином, ще одним об'єктом даного винаходу є спосіб профілактики й лікування субклінічної форми інфекції, яка викликається PCV2, у молодих свиней, спосіб підвищення середнього приросту маси у тварини або групи тварин (череда) із субклінічною формою інфекції, яка викликається PCV2, спосіб зниження кількості тварин з рівнем вірусного 4 6 навантаження, що становить від 10 до 10 геномних копій на мл сироватки, спосіб зниження 6 кількості тварин з рівнем вірусного навантаження, що перевищує 10 геномних копій на мл сироватки, у субклінічно інфікованій череді, спосіб зниження виділення вірусу з носа, спосіб зниження тривалості віремії у тварин із субклінічною формою інфекції, яка викликається PCV2, спосіб зниження коефіцієнта захворюваності у субклінічно інфікованій череді, спосіб зниження коефіцієнта смертності у субклінічно інфікованій череді, у кожному випадку полягає в тому, що вводять у терапевтично ефективній кількості антиген PCV2 або імуногенну композицію, що містить антиген PCV2, молодим свиням, які мають потребу в такому введенні. Переважно антиген PCV2 або імуногенна композиція, що містить антиген PCV2, являють собою будьякий/будь-яку з перерахованих вище, найбільш переважно антиген PCV2 являє собою Ingelvac® TM CircoFLEX . Докладний опис кращих варіантів здійснення винаходу Нижче в прикладах представлені кращі матеріали й процедури, які застосовуються у даному винаході. Хоча при втіленні на практиці й перевірці даного винаходу можна застосовувати будьякі методи й матеріали, аналогічні або еквівалентні представленим у даному описі, нижче описані кращі методи, пристрої й матеріали. Однак варто розуміти, що ці приклади дані тільки з метою ілюстрації й не спрямовані на обмеження загального обсягу винаходу. Приклад 1 Одержання антигену ОРС-2 PCV2 17 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 60 Початкові культури клітин лінії SF+, узяті з культури, що зберігається у рідкому азоті, вирощували в середовищі Excell 420 (фірма JRH Biosciences, Inc., Ленекса, шт. Канзас) у суспензії в стерильних обертових колбах при постійному перемішуванні. Культури вирощували в обертових колбах об'ємом від 100 до 250 мл, що містять від 25 до 150 мл безсироваткового 6 середовища Excell 420. Коли клітини розмножувалися до клітинної щільності 1,0-8,0 × 10 6 клітин/мл, їх розділяли, переносячи у нові судини, використовуючи щільність посіву 0,5-1,5 × 10 клітин/мл. Наступні культури, що розмножуються, вирощували в обертових колбах об'ємом аж до 36 л або біореакторах з нержавіючої сталі об'ємом аж до 300 л протягом 2-7 днів при 2529 °C. Після посіву колби інкубували при 27 °C протягом 4 год. Потім у кожну колбу вносили рекомбінантний бакуловірус, що містить ген ОРС-2 PCV2 (SEQ ID NO: 4). Рекомбінантний бакуловірус, що містить ген ОРС-2 PCV2, створювали відповідно до методу, описаному у WO 06/072065. Після внесення бакуловіруса колби інкубували при 27±2 °C протягом 7 днів і перемішували при 100 об/хв протягом цього часу. Колби закривали вентильованими кришками, що пропускають повітряний потік. Після інкубації отриманий супернатант збирали, фільтрували для видалення клітинного дебріса й інактивували. Для інактивації супернатанта його температуру доводили до 37±2 °C і до супернатанту додавали бінарний етиленімін (БЕІ) до кінцевої концентрації 5мМ. Наступне перемішування зразка продовжували протягом 72-96 год. Додавали 1,0M розчин тіосульфату натрію до кінцевої мінімальної концентрації 5мМ для нейтралізації будь-яких залишкових кількостей БЕІ. Після інактивації ОРС-2 PCV2 забуферували фосфатним буфером і додавали карбопол до досягнення концентрації приблизно 0,5-2,5 мг/дозу. Кінцева доза містила приблизно 16 мкг антигену ОРС-2 PCV2. Приклад 2 Імуноаналіз антитіл до PCV-2 Клітини лінії PK15 (наприклад, ATCC CCL-33) або VIDO R1, описані у WO 02/07721, висівали у 96-ямковий планшет (приблизно 20000-60000 клітин на ямку). Клітини заражали ізолятом PCV2, коли конфлюентність моношарів досягала приблизно 65-85 %. Заражені клітини інкубували протягом 48 год. Середовище видаляли й ямки відмивали двічі ЗФР. Буфер для відмивання відкидали й клітини обробляли холодним фіксатором, що представляє собою суміш 50/50 метанол/ацетон (~100 мкл/ямку) протягом приблизно 15 хв при температурі приблизно 20 °C. Фіксатор відкидали й планшети сушили на повітрі. Готували серійні розведення свинячої сироватки у ЗФР, додавали у планшети й інкубували, даючи антитілам, якщо вони були присутні у зразках сироватки, зв'язуватися, протягом приблизно 1 год. при 36,51 °C. Крім того, паралельно оцінювали серійні розведення, позитивні відносно антитіл до PCV2, і негативні контрольні зразки (зразки, що представляють собою позитивний контроль і негативний контроль). Потім планшети відмивали тричі ЗФР. ЗФР відкидали. Потім планшети забарвлювали козячим антисвинячим антитілом, який поступає у продаж, кон'югованим з ФІТЦ, розведеним у співвідношенні 1:100 у ЗФР, і інкубували протягом приблизно 1 год. при 36,51 °C, що давало можливість виявляти антитіла, пов'язані із зараженими клітинами. Після завершення інкубації мікропланшети вилучали з інкубатора, кон'югат відкидали й планшети відмивали двічі ЗФР. Планшети оцінювали за допомогою УФ-мікроскопа й індивідуальні ямки позначали як позитивні або негативні. Для оцінки тест-системи використовували зразки, що представляють собою позитивний контроль і негативний контроль. Якщо результати, отримані для контролів, перебували в очікуваних межах, то результати досліду приймалися як прийнятні з позицій методу оцінки параметрів. Титри сироваткових антитіл розраховували на основі найбільшого розведення, при якому спостерігався специфічний IFA (метод непрямої імунофлуоресценції)реактивність, і визначали кількість позитивних ямок для кожного розведення, або розраховували кінцеве значення TCID50 за допомогою відповідної формули Ріда-Менча. Приклад 3 TM Ефективність ОРС-2 PCV2 ORF-2 (Ingelvac® CircoFLEX ) відносно лікування хронічної інфекції, яка викликається PCV2 Завдання й план експерименту У цьому експерименті використовували звичайних молодих свиней, що належать до п'яти послідовних вікових груп, які відрізняються одна від іншої за віком на один тиждень, кожна з яких включала приблизно 300 тварин. Тварин нарівно розділяли з урахуванням початкової маси тіла й приналежності до певного приплоду на дві оброблювані групи. У день відібрання одну групу (n=775) вакцинували за допомогою Ingelvac® CircoFLEX, що містить мінімальну кількість антигену, який вивільняється, а іншій групі поросят (n=773) вводили контрольний продукт (фізіологічний розчин). Вакцину й контрольний продукт (CP) вводили у вигляді однієї дози 18 UA 100507 C2 5 10 15 20 25 30 35 40 45 50 55 об'ємом 1 мл внутрішньом'язово у праву шийну зону поросят віком приблизно 21 день. Одержували дані про живу масу всіх піддослідних тварин індивідуально. Здійснювали клінічні обстеження у відношенні асоційованих з PCV2 симптомів і фіксували для кожної тварини відхилення від нормального загального стану здоров'я. Зразки сироватки й виділення з носа аналізували кількісно за допомогою полімеразної ланцюгової реакції (ПЛР) відносно присутності PCV2. Крім того, титри антитіл до PCV2 у всіх піддослідних тварин у момент вакцинації й в 5 % цих же попередньо відібраних піддослідних тварин аналізували титруванням методом непрямої імунофлуоресценції (IFAT), описаним у прикладі 2. Підтвердження хронічного (субклінічна форма) статусу у місці проведення експерименту: Вперше PCVD діагностований на фермі за 4 місяці до здійснення експерименту. Коефіцієнт смертності становив 14,1 % і ідентифікована присутність "малорослих" тварин у відгодівельному господарстві. Показник росту виявився відносно невисоким (644 г/д). Присутність інфекцій, які викликаються PCV2, підтверджено гістологічною оцінкою. У зразку легені виявлена інтерстиціальна пневмонія й в ушкодженнях за допомогою ІГХ (імуногістохімії) виявлений PCV2. Як видно з фіг. 1, коефіцієнт смертності у процесі відгодівлі істотно знижувався з 14,1 % до 8,1 %, що дозволяє припустити перехід гострої інфекції, яка викликається PCVD, у субклінічну форму інфекції. Підтвердження субклінічної форми інфекції у піддослідних тварин Результати, отримані в процесі експерименту, підтверджували перехід у субклінічну форму інфекції на фермі. Для піддослідних тварин були характерні домінуюча субклінічна форма вірусного навантаження, невисокий коефіцієнт смертності (нижче 10 %) і невисокий коефіцієнт захворюваності (нижче 10 %). Результати Віремія Найбільша відносна кількість тварин, у яких виявлена віремія, виявлений на тижні 14 експерименту, при цьому 55,5 % тварин з виявленою віремією виявлений у групі, обробленій CP, і приблизно 10 % тварин з виявленою віремією виявлений у вакцинованій групі. Як видно з фіг. 4 і 5, більшість тварин в обох оброблюваних групах мали лише субклінічну форму вірусного 4 6 навантаження (що відповідає 10 -10 геномних еквівалентів на мл). Найбільша відносна 6 кількість тварин з відповідною клінічній формі навантаженням PCV2 (>10 геномних еквівалентів на мл) становило 2,52 % для оброблених CP тварин і 0,87 % для вакцинованих тварин. Смертність Коефіцієнт смертності до й після початку віремії був відносно невисоким. До початку віремії коефіцієнт смертності становив 1,55 % у групі вакцинованих тварин і 2,19 % у групі оброблених CP тварин. Після початку віремії виявлено підвищення коефіцієнта смертності у групі оброблених CP тварин (з 1,55 % до 3,02 %), у той час як коефіцієнт смертності у групі вакцинованих тварин трохи зменшився у порівнянні з моментом часу до початку віремії (з 2,19 % до 1,98 %). Розходження коефіцієнта смертності між двома оброблюваними групами до й після початку віремії не досягали статистично значущого рівня. Клінічні симптоми До початку віремії лише кілька клінічних симптомів виявлено в обох оброблюваних групах, частота зустрічальності яких становила менше 1 % для кожного з аналізованих параметрів. Початок віремії супроводжувався одночасно зараженням PRRSV і Mycoplasma hyopneumoniae. Однак ні PCV2, ні інші коінфікуючі патогени не викликали серйозних клінічних симптомів. Так, відносна кількість тварин з респіраторними симптомами, такими як кашель і/або задишка, становила лише 3,9 % і 0,7 % в обробленій CP групі й 3,0 % і 0,4 % у вакцинованій групі. Частота зустрічальності інших клінічних ознак становила у всіх випадках менше 1 % і не виявлено розходжень між оброблюваними групами. Частота зустрічальності "малорослих" тварин Ніякої істотної різниці не виявлено у частоті зустрічальності "малорослих" тварин між вакцинованою й обробленою плацебо групами у кожній з відповідних моментів часу проведення зважування. У цілому, після початку PCV2-віремії частота зустрічальності "малорослих" тварин, як правило, була низькою в обох оброблюваних групах (3,3-4,7 %). 19 UA 100507 C2 Таблиця 1 Порівняння частоти зустрічальності "малорослих" тварин (об'єднані дані для всіх трьох вікових груп, що відрізняються на тиждень) До початку віремії Тиждень експерименту CP IVP P Після початку віремії 0 7 12 17 22 11,51 % 10,84 % 0,6874 11,94 % 10,46 % 0,3728 5,68 % 4,78 % 0,4884 4,72 % 3,36 % 0,1898 4,53 % 3,27 % 0,2259 P: p-значення відповідно до t-критерію для порівняння між групами; p > 0,05 - несуттєво 5 10 Вплив субклінічної форми інфекції на показники росту Приріст маси тіла до тижня 17 експерименту був на 2,36 кг вище й до тижня 19 експерименту на 2,39 кг вище у вакцинованій групі у порівнянні з обробленою CP групою. Як видно з фіг. 3, розходження маси тіла починало злегка збільшуватися до моменту початку віремії (тиждень 12 експерименту). На тижні 17 експерименту розходження досягало вже 2,36 кг. У результаті більшого приросту маси середня тривалість часу від відібрання до забою виявилася на 1,9 дня коротше для вакцинованих тварин у порівнянні з обробленими CP тваринами. Таблиця 2 Порівняння приросту маси й середнього добового приросту маси (ADWG) (об'єднані дані для всіх п'яти вікових груп, що відрізняються на тиждень) Оброблена CP група Вакцинована група Різниця Тиждень (середньоквадратичне (середньоквадратичне (IVP мінус експерименту значення) значення) CP) 0-7 20,63 кг 20,71 кг 0,08 кг Значення 1) p 0,7166 ns 0-17 0-19 76,73 кг 86,75 кг 79,09 кг 89,14 кг 2,36 кг 2,39 кг
ДивитисяДодаткова інформація
Назва патенту англійськоюPrevention and treatment of sub-clinical pcvd
Автори англійськоюFachinger, Vicky, Elbers, Knut, Kixmoeller, Marion, Orveillon, Francois-Xavier, Freiin von Richthofen, Isabelle, Lischewski, Axel
Назва патенту російськоюПредупреждение и лечение субклинической формы болезней, вызываемых цирковирусом свиней (pcvd)
Автори російськоюФахингер Вики, Эльберс Кнут, Киксмеллер Марион, Орвеллон Франсуа-Ксавье, Фрайин фон Рихтхофен Изабелль, Лишевски Аксель
МПК / Мітки
МПК: A61D 99/00, A61K 39/12, A61P 31/20
Мітки: лікування, цирковірусом, форми, субклінічної, pcvd, викликаються, попередження, свиней, хвороб
Код посилання
<a href="https://ua.patents.su/37-100507-poperedzhennya-jj-likuvannya-subklinichno-formi-khvorob-yaki-viklikayutsya-cirkovirusom-svinejj-pcvd.html" target="_blank" rel="follow" title="База патентів України">Попередження й лікування субклінічної форми хвороб, які викликаються цирковірусом свиней (pcvd)</a>
Попередній патент: Ланцюгове колесо для ланцюгових приводів та його застосування в ланцюговому скребковому конвеєрі
Наступний патент: Інкапсульований пікоплатин для орального введення
Випадковий патент: Пристрій для нагрівання рідини