Морфолінопіримідини та їх застосування в терапії
Номер патенту: 109010
Опубліковано: 10.07.2015
Автори: Ніссінк Йоханнес Вілхелмус Марія, Фут Кевін Майкл, Тьорнер Пол
Формула / Реферат
1. Сполука формули (І):
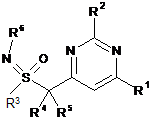 , (І)
, (І)
де:
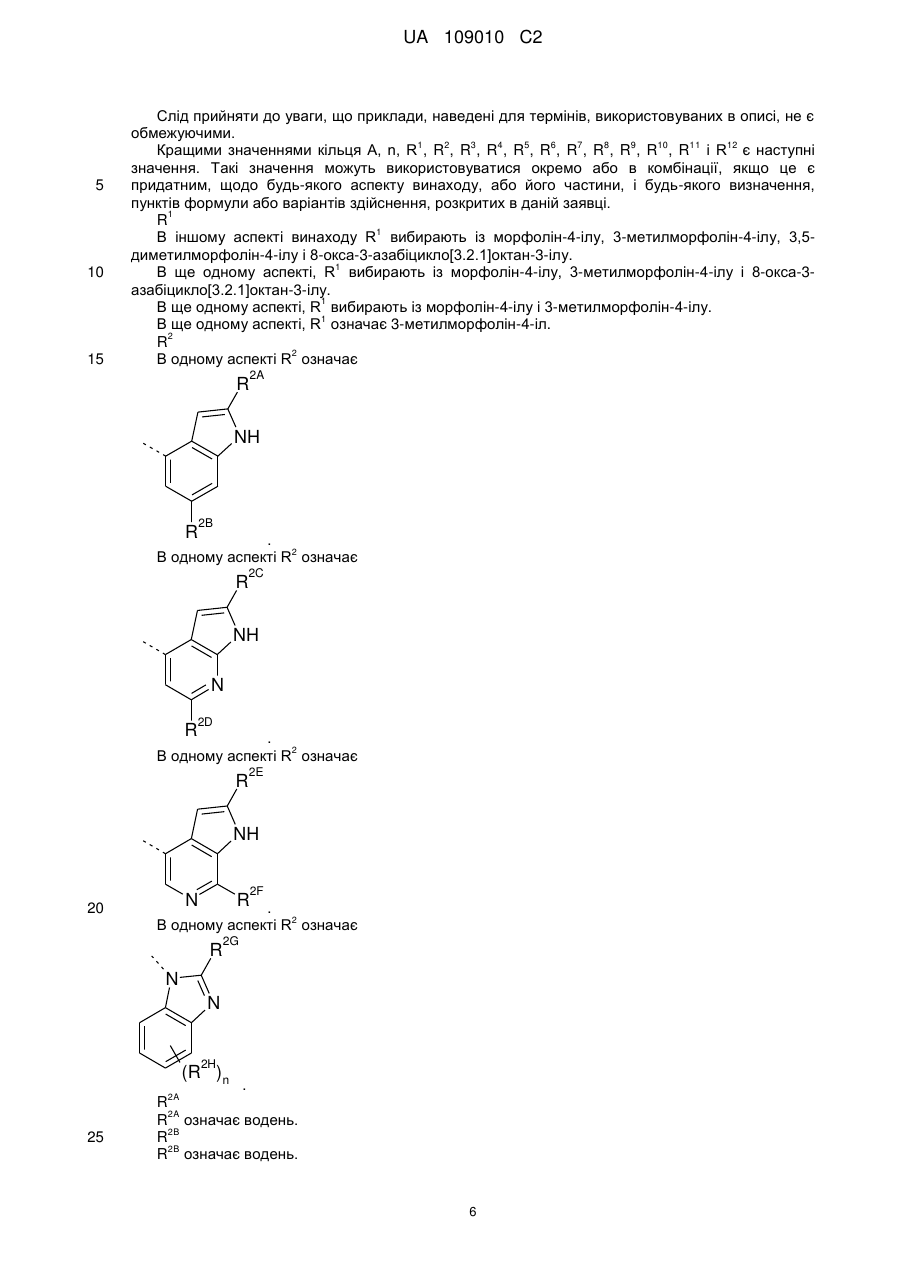
R1 вибирають із морфолін-4-ільної та 3-метилморфолін-4-ільної групи;
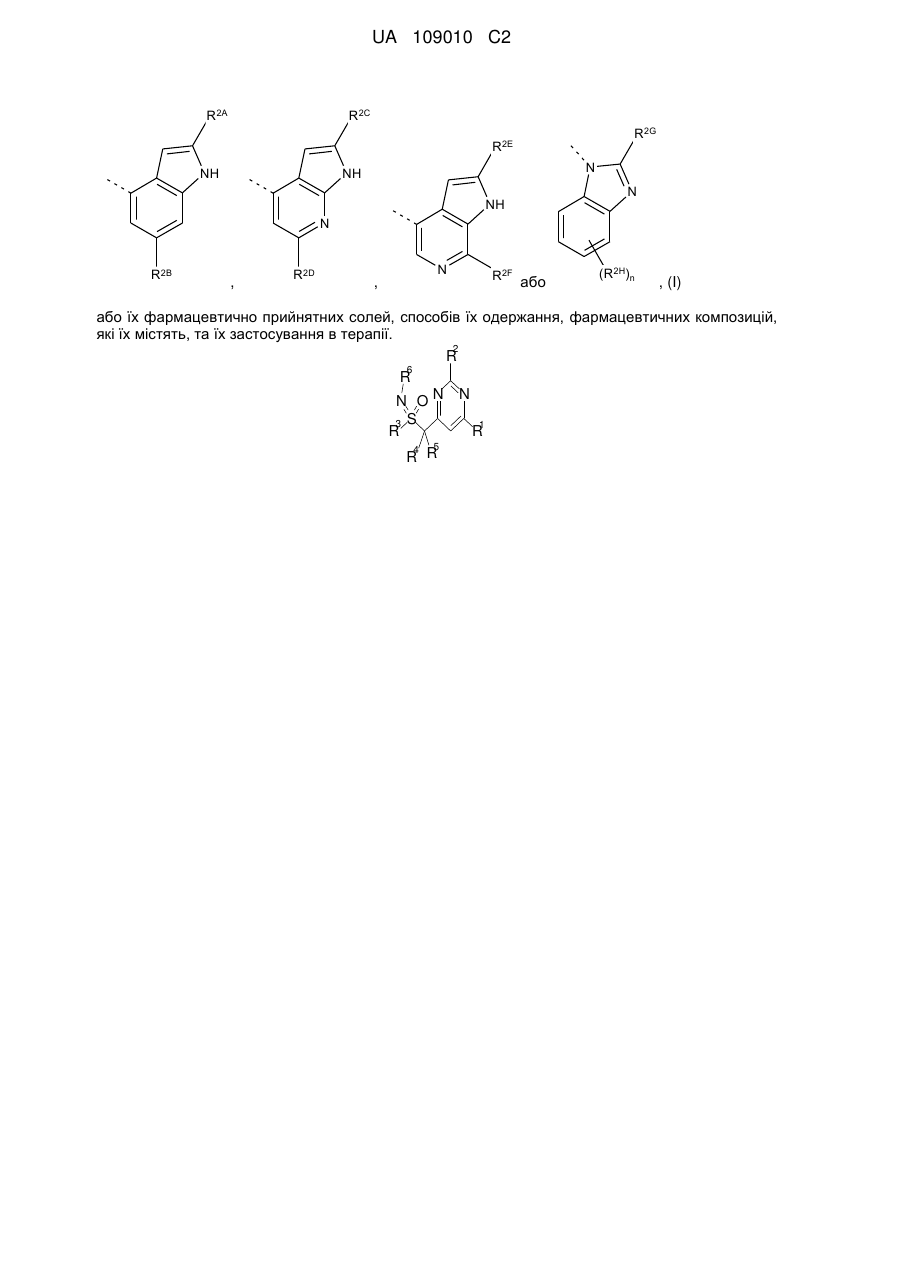
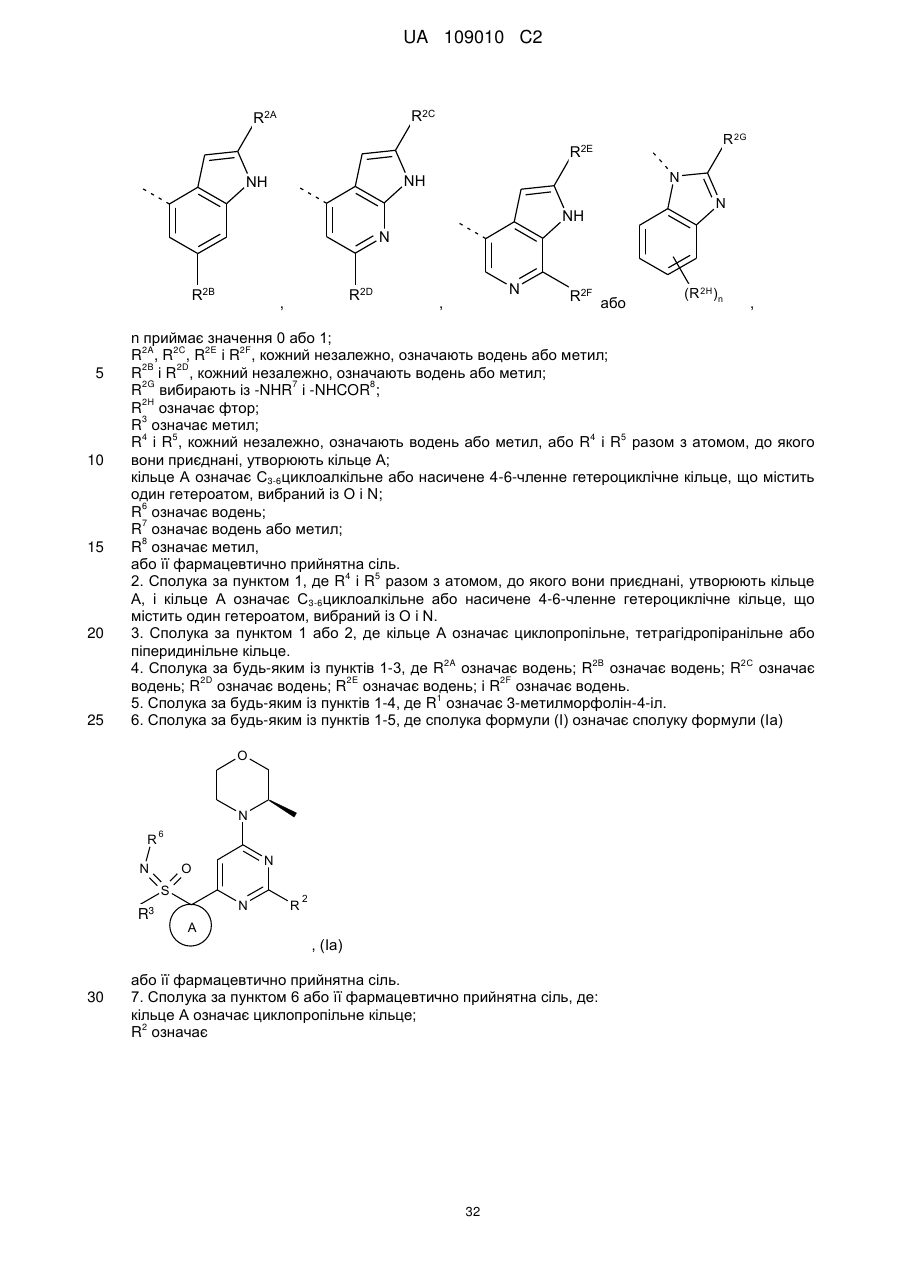
R2 означає
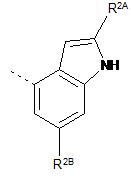 ,
,  ,
,  або
або  ,
,
n приймає значення 0 або 1;
R2A, R2C, R2E і R2F, кожний незалежно, означають водень або метил;
R2B і R2D, кожний незалежно, означають водень або метил;
R2G вибирають із -NHR7 і -NHCOR8;
R2H означає фтор;
R3 означає метил;
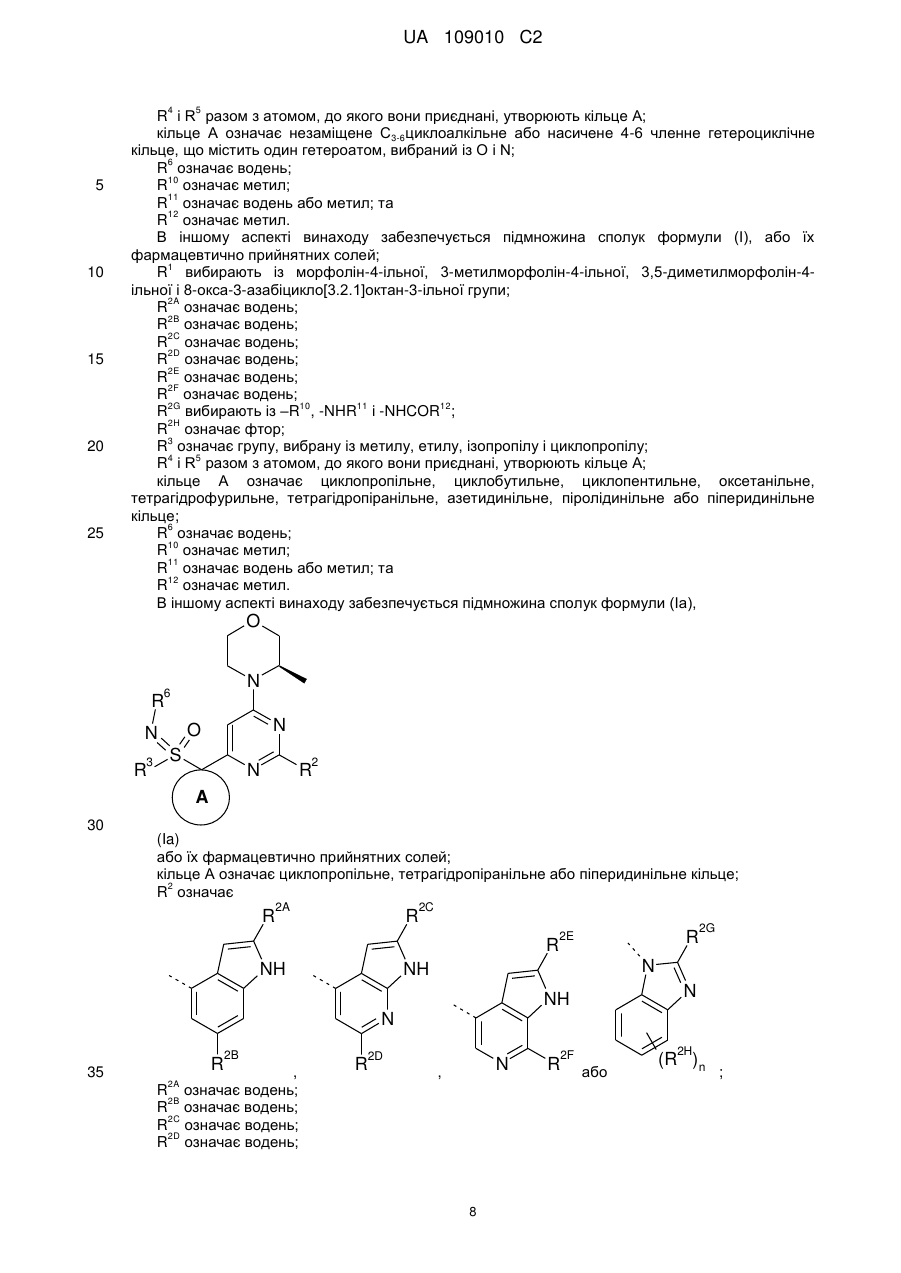
R4 і R5, кожний незалежно, означають водень або метил, або R4 і R5 разом з атомом, до якого вони приєднані, утворюють кільце А;
кільце А означає С3-6циклоалкільне або насичене 4-6-членне гетероциклічне кільце, що містить один гетероатом, вибраний із О і N;
R6 означає водень;
R7 означає водень або метил;
R8 означає метил,
або її фармацевтично прийнятна сіль.
2. Сполука за пунктом 1, де R4 і R5 разом з атомом, до якого вони приєднані, утворюють кільце А, і кільце А означає С3-6циклоалкільне або насичене 4-6-членне гетероциклічне кільце, що містить один гетероатом, вибраний із О і N.
3. Сполука за пунктом 1 або 2, де кільце А означає циклопропільне, тетрагідропіранільне або піперидинільне кільце.
4. Сполука за будь-яким із пунктів 1-3, де R2A означає водень; R2B означає водень; R2С означає водень; R2D означає водень; R2E означає водень; і R2F означає водень.
5. Сполука за будь-яким із пунктів 1-4, де R1 означає 3-метилморфолін-4-іл.
6. Сполука за будь-яким із пунктів 1-5, де сполука формули (І) означає сполуку формули (Іа)
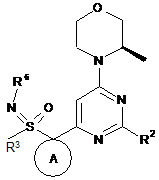 , (Іа)
, (Іа)
або її фармацевтично прийнятна сіль.
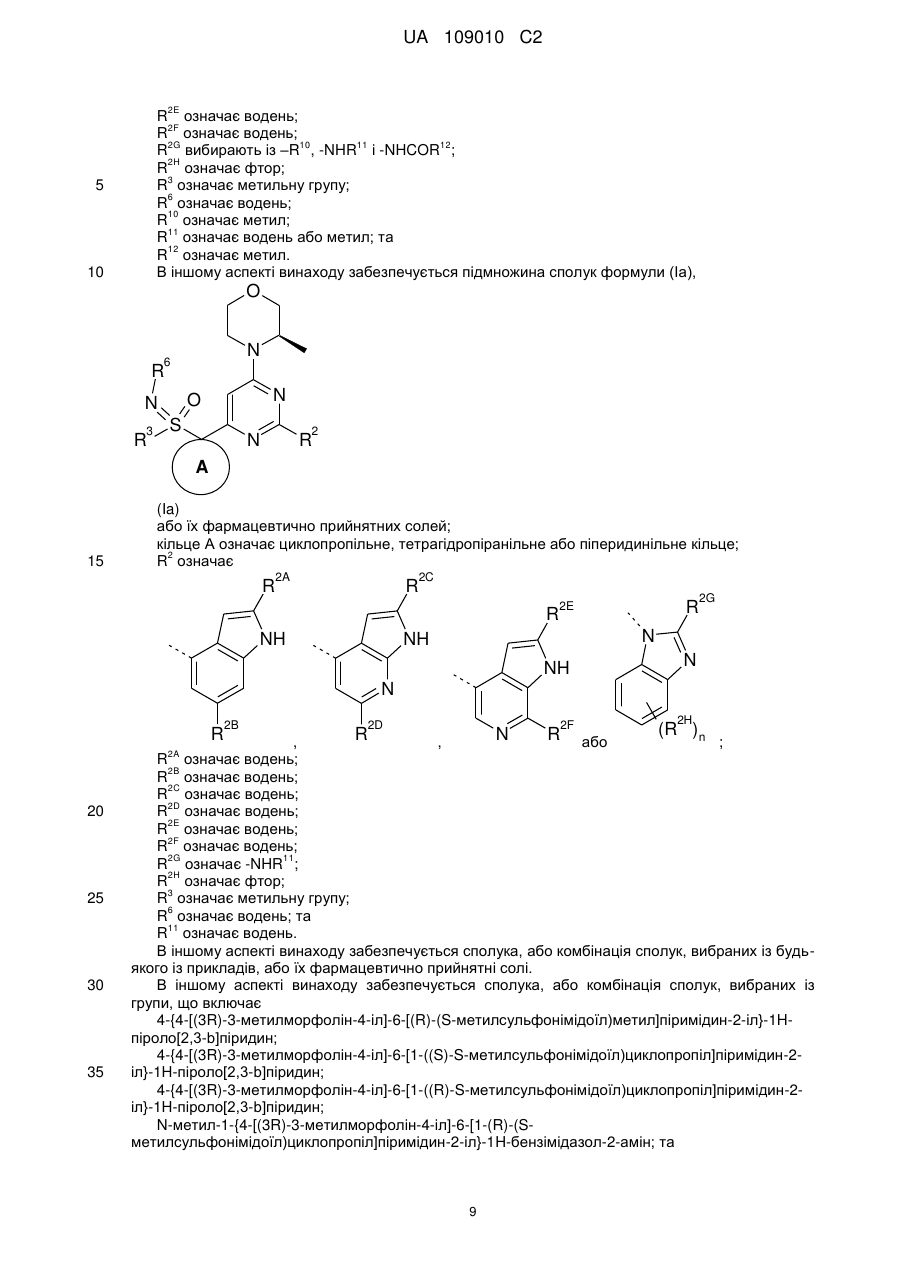
7. Сполука за пунктом 6 або її фармацевтично прийнятна сіль, де:
кільце А означає циклопропільне кільце;
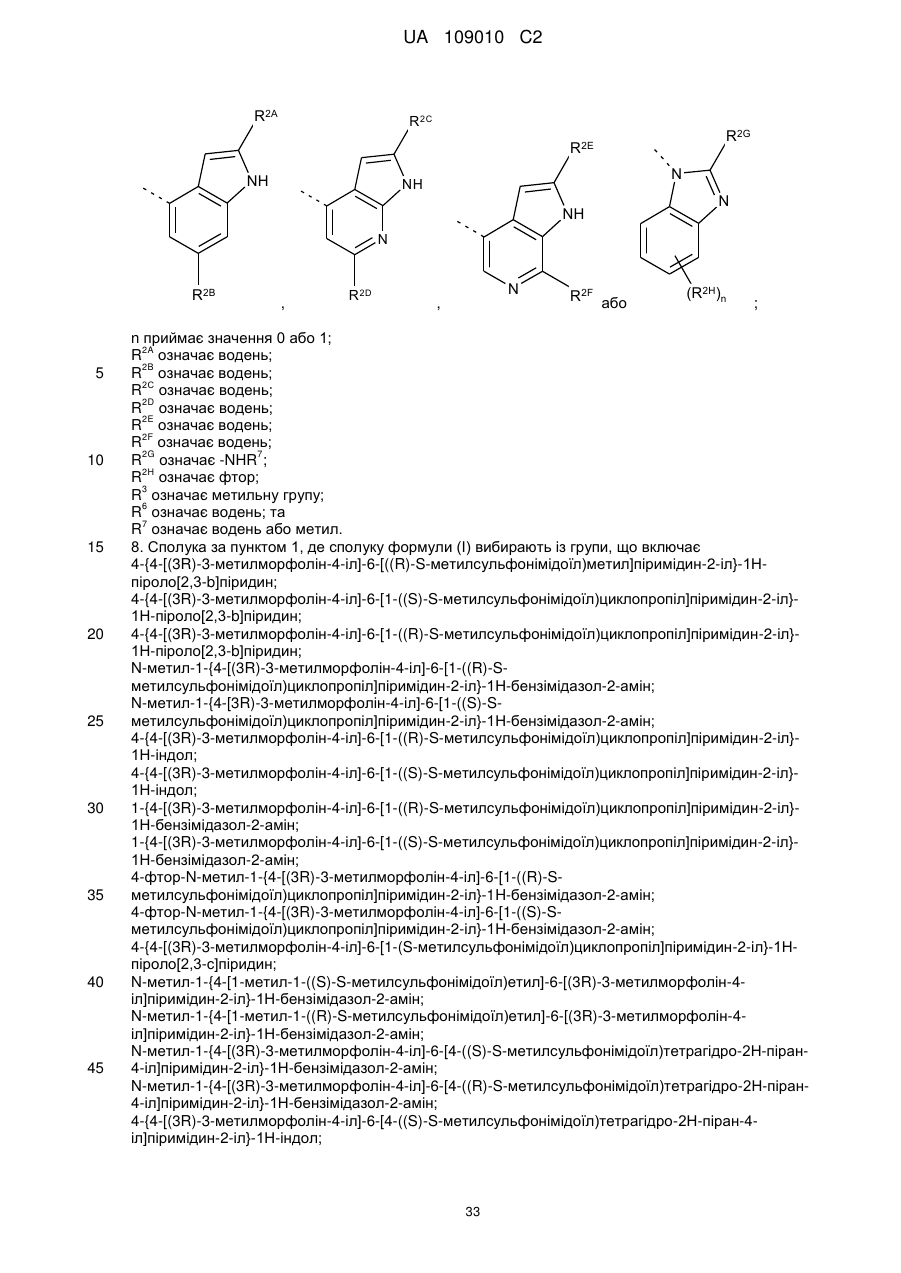
R2 означає
 ,
, 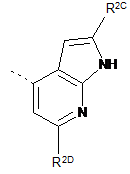 ,
, 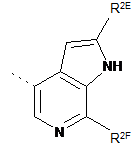 або
або  ;
;
n приймає значення 0 або 1;
R2A означає водень;
R2B означає водень;
R2С означає водень;
R2D означає водень;
R2E означає водень;
R2F означає водень;
R2G означає -NHR7;
R2H означає фтор;
R3 означає метильну групу;
R6 означає водень; та
R7 означає водень або метил.
8. Сполука за пунктом 1, де сполуку формули (І) вибирають із групи, що включає
4-{4-[(3R)-3-метилморфолін-4-іл]-6-[((R)-S-метилсульфонімідоїл)метил]піримідин-2-іл}-1Н-піроло[2,3-b]піридин;
4-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((S)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-піроло[2,3-b]піридин;
4-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((R)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-піроло[2,3-b]піридин;
N-метил-1-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((R)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
N-метил-1-{4-[3R)-3-метилморфолін-4-іл]-6-[1-((S)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
4-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((R)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-індол;
4-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((S)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-індол;
1-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((R)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
1-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((S)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
4-фтор-N-метил-1-{4-[(3R)-3-мeтилмopфoлiн-4-iл]-6-[1-((R)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1H-бензімідазол-2-амін;
4-фтор-N-метил-1-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((S)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
4-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-(S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-піроло[2,3-с]піридин;
N-метил-1-{4-[1-метил-1-((S)-S-метилсульфонімідоїл)етил]-6-[(3R)-3-метилморфолін-4-іл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
N-метил-1-{4-[1-метил-1-((R)-S-метилсульфонімідоїл)етил]-6-[(3R)-3-метилморфолін-4-іл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
N-метил-1-{4-[(3R)-3-метилморфолін-4-іл]-6-[4-((S)-S-метилсульфонімідоїл)тетрагідро-2Н-піран-4-іл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
N-метил-1-{4-[(3R)-3-метилморфолін-4-іл]-6-[4-((R)-S-метилсульфонімідоїл)тетрагідро-2Н-піран-4-іл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
4-{4-[(3R)-3-метилморфолін-4-іл]-6-[4-((S)-S-метилсульфонімідоїл)тетрагідро-2Н-піран-4-іл]піримідин-2-іл}-1Н-індол;
4-фтор-N-метил-1-{4-[1-метил-1-((S)-S-метилсульфонімідоїл)етил]-6-[(3R)-3-метилморфолін-4-іл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
4-фтор-N-метил-1-{4-[1-метил-1-((R)-S-метилсульфонімідоїл)етил]-6-[(3R)-3-метилморфолін-4-іл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
6-фтор-N-метил-1-{4-[1-метил-1-((R)-S-метилсульфонімідоїл)етил]-6-[(3R)-3-метилморфолін-4-іл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
5-фтор-N-метил-1-{4-[1-метил-1-((R)-S-метилсульфонімідоїл)етил]-6-[(3R)-3-метилморфолін-4-іл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
5-фтор-N-метил-1-{4-[1-метил-1-((S)-S-метилсульфонімідоїл)етил]-6-[(3R)-3-метилморфолін-4-іл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
6-фтор-N-метил-1-{4-[1-метил-1-((S)-S-метилсульфонімідоїл)етил]-6-[(3R)-3-метилморфолін-4-іл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
6-фтор-N-метил-1-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((R)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
5-фтор-N-метил-1-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((R)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-бензімідазол-2-амін;
5-фтор-N-метил-1-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((S)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-бензімідазол-2-амін та
6-фтор-N-метил-1-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((S)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-бензімідазол-2-амін,
або її фармацевтично прийнятна сіль.
9. Сполука за пунктом 1, де сполукою формули (І) є 4-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((S)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-піроло[2,3-b]піридин.
10. Сполука за пунктом 1, де сполукою формули (І) є 4-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((R)-S-метилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1Н-піроло[2,3-b]піридин.
11. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким одним або декількома пунктами 1-10 для застосування при лікуванні злоякісного новоутворення.
12. Фармацевтична композиція, що містить сполуку формули (І) або її фармацевтично прийнятну сіль за будь-яким одним або декількома пунктами 1-10 у сполучені з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
13. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким із пунктів 1-10 для приготування лікарського засобу для запобігання або лікування тих пухлин, які чутливі до інгібування ATR-кінази.
Текст
Реферат: Винахід стосується піримідинільних сполук формули (І) R R 6 N N O S R3 2 N R R 2 де R : 4 R 1 5 , (I) UA 109010 C2 ОПИС ДО ПАТЕНТУ НА ВИНАХІД (12) UA 109010 C2 R2A R2C R2G R2E NH N NH NH N N R2B , R2D N , R2F або (R2H)n , (I) або їх фармацевтично прийнятних солей, способів їх одержання, фармацевтичних композицій, які їх містять, та їх застосування в терапії. 2 R 6 R N ON N 3 R S 1 R 5 4 R R UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується піримідинільних сполук, способів їх одержання, фармацевтичних композицій, які їх містять, і їх застосування в терапії, наприклад, для лікування проліферативного захворювання, такого як злоякісне новоутворення, і зокрема при захворюванні, опосередкованому атаксія-телеангіектазія мутованими й RAD-3 спорідненими інгібіторами протеїнкіназ, які звичайно позначаються як ATR. ATR (також відома як Frap-споріднений білок 1; FRP1; MEC1; SCKL; SECKL1) протеїн кіназа є представником сімейства білків PI3-кіназо-подібної кінази (PIKK), які залучені в репарацію й підтримку геному і його стабільність (огляд в Cimprich K.A. і Cortez D. 2008, Nature Rev. Mol. Cell Biol. 9:616-627). Ці білки координують реакції-відповіді на ушкодження ДНК, стрес і порушення клітинного циклу. Дійсно ATM і ATR, два представники сімейства білків, спільно використовують декілька нижчерозташованих субстратів, які самі розпізнають компоненти клітинного циклу й механізми репарації ДНК, наприклад, Chk1, BRCA1, p53 (Lakin ND і ін.,1999, Oncogene; Tibbets RS і ін., 2000, Genes & Dev.). У той час як субстрати ATM і ATR є в істотній мірі загальними, тригер для активації каскаду передачі сигналів не є загальним і ATR головним чином відповідає на затримані реплікаційні вилки (Nyberg K.A. і ін., 2002, Ann. Rev. Genet. 36:617-656; Shechter D. і ін… 2004, DNA Repair 3:901-908) і великі ділянки ушкодження ДНК, такі як ті, які утворюються під впливом ультрафіолетового (УФ) випромінювання (Wright J.A. і ін., 1998, Proc. Natl. Acad. Sci. USA, 23:7445-7450) або уф-міметичного засобу, 4-нітрохінолін-1-оксиду, 4NQO (Ikenaga M. і ін… 1975, Basic Life Sci. 5b, 763-771). Мутації ATR гена є рідкісними й життєздатність може зберігатися тільки в гетерозиготних або гіпоморфних умовах. Очевидний взаємозв'язок між мутаціями ATR гена й захворюванням тільки в декількох пацієнтів із синдромом Секела, який характеризується уповільненням росту й мікроцефалією (O'driscoll M і ін., 2003 Nature Genet. тому 3, 497-501). Порушення ATR шляху приводять до нестабільності геному, тоді як ATR активується більшістю хіміотерапій злоякісних новоутворень (Wilsker D і ін., 2007, Mol. Cancer Ther. 6(4) 1406-1413). Крім того, дуплікація ATR гена була описана як фактора ризику при рабдоміосаркомах (Smith L і ін., 1998, Nature Genetics 19, 39-46). ATR є важливим для життєздатності клітин, які реплікуються, і активується при S-фазі для регуляції відпалювання ділянок реплікації й репарації ушкоджених реплікаційних вилок (Shechter D і ін., 2004, Nature cell Biology том 6 (7) 648-655). Ушкодження реплікаційних вилок може виникати при впливі на клітини клінічно релевантних цитотоксичних засобів, таких як гідроксисечовина (HU) і платина (O'connell і Cimprich 2005; 118, 1-6). Навпаки, сенсибілізацію до хіміотерапевтичних засобів можна здійснювати шляхом модуляції активності ATR. Отже, вважають, що інгібування ATR може виявитися ефективним підходом для майбутнього лікування злоякісного новоутворення (Collins I. і Garret M.D., 2005, Curr. Opin. Pharmacol., 5:366-373; Kaelin W.G. 2005, Nature Rev. Cancer, 5:689-698). Зараз відсутні клінічні прецеденти для засобів, націлених на ATR, хоча засоби, націлені на нижчерозташовану сигнальну вісь, тобто Chk1, зараз проходять клінічну оцінку (огляд в Janetka J.W. і ін… Curr Opin Drug Discov Devel, 2007, 10:473-486). Проте, ушкодження ДНК, індуковане впливом на пухлинні клітини цитотоксичних хіміотерапевтичних засобів, таких як гідроксисечовина й продукти платини, підвищує ушкодження реплікаційних вилок, тригера для активації ATR і його передачі сигналів у різні процеси, критичні для клітин. Проводили біологічну оцінку здатності інгібіторів ATR сенсибілізувати різні хіміотерапії. Відзначали сенсибілізацію пухлинних клітин до хіміотерапевтичних засобів в аналізах росту клітин і використовували для оцінки того, наскільки добре слабкі інгібітори ATR (такі як кофеїн) будуть сенсибілізувати пухлинні клітини до цитотоксичних агентів. (Wilsker D.і ін., 2007, Mol Cancer Ther. 6 (4)1406-1413; Sarkaria J.N. і ін., 1999, Cancer Res. 59, 4375-4382). Крім того, зменшення активності ATR за допомогою мірнк або ATR "кнок-ін", використовуючи домінантнонегативну форму ATR у злоякісних клітинах, приводить до сенсибілізації пухлинних клітин до дій різних терапевтичних або експериментальних засобів, таких як антиметаболіти (5-FU, гемцитабін, гідроксисечовина, метотрексат, томудекс), алкілуючі засоби (цисплатин, мітоміцин C, циклофосфамід, MMS) або індуктори дволанцюгових розривів (доксорубіцин, іонізуюче випромінювання) (Cortez D. і ін… 2001, Science, 294:1713-1716; Collis S.J. і ін., 2003, Cancer Res. 63:1550-1554; Cliby W.A. і ін., 1998, EMBO J. 2:159-169). Додатковий фенотипічний аналіз, описаний для визначення активності специфічних інгибуючих ATR сполук, являє собою профіль клітинного циклу (PJ Hurley, D Wilsker і F Bunz, Oncogene, 2007, 26, 2535-2542). Було показано, що клітини, дефіцитні за ATR, мають ушкоджену регуляцію клітинного циклу й інші характерні профілі, зокрема наступний цитотоксичний клітинний інсульт. Крім того, припускають інші реакції-відповіді між пухлинними й нормальними тканинами у відповідь на модуляцію ATR осі й це забезпечує додаткове 1 UA 109010 C2 5 10 15 терапевтичне втручання за допомогою молекул інгібіторів ATR (Rodrıguez-bravo V і ін., Cancer Res., 2007, 67, 11648-11656). Інша очевидна корисність Atr-специфічних фенотипів сполучається з концепцією синтетичної летальності й спостереженням, що пухлинні клітини, які дефіцитні в G1 контрольних точках, зокрема p53 дефіцитні, є чутливими до інгібування ATR активності, що приводить до передчасної конденсації хроматину (PCC) і клітинної загибелі (Ngheim і ін., PNAS, 98, 9092-9097). У цій ситуації, S-фаза реплікації ДНК відбувається, але не завершується перед ініціацією M-фази внаслідок ушкодження проміжних контрольних точок, що приводить до клітинної загибелі внаслідок відсутності ATR передачі сигналів. G2/M контрольна точка є ключовим регуляторним контролем, що задіює ATR (Brown E J. і Baltimore D., 2003, Genes Dev. 17, 615-628) і існує компроміс між цією контрольною точкою й запобіганням ATR передачі сигналів на його нижчерозташовані партнери, що приводить до PCC. Отже, геном дочірніх клітин буде аномальним і життєздатність клітин втрачається (Ngheim і ін., PNAS, 98, 9092-9097). Таким чином, ATR інгібітори мають потенціал сенсибілізувати пухлинні клітини до іонізуючого випромінювання або хіміотерапевтичних засобів, що ініціюють ушкодження ДНК, мають потенціал індукувати селективне знищення пухлинних клітин, а також індукувати синтетичну летальність у піднаборах пухлинних клітин з дефектами у реакції-відповіді на ушкодження ДНК. Відповідно до першого аспекту даного винаходу, забезпечується сполука формули (I): 2 R 6 R O N N 3 R S 4 20 25 N R 1 R 5 R (I) де: 1 R вибирають із морфолін-4-ільної, 3,6-дигідро-2H-піран-4-ільної, 8-окса-3азабіцикло[3.2.1]октан-3-ільної і 3-окса-8-азабіцикло[3.2.1]октан-8-ільної групи, де вищевказана група необов'язково заміщена однією або декількома C 1-3алкільними групами, де алкільна група необов'язково може бути заміщена одним або декількома атомами фтору; 2 R означає R 2A R 2C R NH 2G R 2E N NH NH N N R 30 35 40 2B R 2D N R 2F 2H (R )n , , або ; 2A 2C 2E 2F R , R , R і R , кожний незалежно, означають водень або метил; 2B 2D 7 8 9 R і R , кожний незалежно, означають водень, метил, CN, -NR R , -OR ; 2G 10 11 12 R вибирають із –R , -NHR і –NHCOR ; 2H R означає фтор; 3 R означає групу, вибрану із метилу, етилу, ізопропілу і циклопропілу; 4 5 4 5 R і R , кожний незалежно, означають водень або метил, або R і R разом з атомом, до якого вони приєднані, утворюють кільце A; кільце A означає C3-6циклоалкільне або насичене 4-6 членне гетероциклічне кільце, що містить один гетероатом, вибраний із O і N; 6 R означає водень або C1-3алкіл; 7 8 R і R , кожний незалежно, означають водень або групу, вибрану із C1-3алкілу, C2-3алкенілу, C2-3алкінілу, C3-6карбоциклілу, C3-6карбоциклілC1-3алкілу, 4-6 членного гетероциклілу і 4-6 членного гетероциклілC1-3алкілу, де зазначена група необов'язково заміщена одним або декількома замісниками, що вибрані із оксо, галогену, ціано, гідрокси, аміно, гідроксіC 1-3алкілу, ціаноC1-3алкілу, C1-3алкокси, циклопропілокси, C1-3алканоїлу, C1-3алкоксикарбонілу, 2 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 C1-3алкіламіно, (C1-3алкіл)2аміно, C1-3алкіл-S(O)a-, де a приймає значення 0-2, сульфамоїлу, карбамоїлу, N-(C1-3алкіл)сульфамоїлу, N, N-(C1-3алкіл)2сульфамоїлу, N-(C1-3алкіл)карбамоїлу і N, 7 8 N-(C1-3алкіл)2карбамоїлу, або R і R разом з атомом, до якого вони приєднані, утворюють насичене 4-6 членне гетероциклічне кільце, що містить один гетероатом - азот і необов'язково один гетероатом, вибраний із O і N, причому зазначене кільце необов'язково заміщене одним або декількома замісниками, що вибрані із оксо, галогену, ціано, гідрокси, аміно, дифторметилу, C1-3алкілу, гідроксіC1-3алкілу, ціаноC1-3алкілу, C1-3алкокси, циклопропілметилу, циклопропілу, циклопропілокси, C1-3алканоїлу, C1-3алкоксикарбонілу, C1-3алкіламіно, (C1-3алкіл)2аміно, C13алкіл-S(O)a-, де a приймає значення 0-2, сульфамоїлу, карбамоїлу, N-(C1-3алкіл)сульфамоїлу, N, N-(C1-3алкіл)2сульфамоїлу, N-(C1-3алкіл)карбамоїлу і N, N-(C1-3алкіл)2карбамоїлу; та 9 R означає водень або групу, вибрану із C1-3алкілу, C2-3алкенілу, C2-3алкінілу, C3-6карбоциклілу, C3-6карбоциклілC1-3алкілу, 4-6 членного гетероциклілу і 4-6 членного гетероциклілC1-3алкілу, де зазначена група необов'язково заміщена одним або декількома замісниками, що вибрані із оксо, галогену, ціано, гідрокси, аміно, гідроксіC 1-3алкілу, ціаноC13алкілу, C1-3алкокси, циклопропілокси, C1-3алканоїлу, C1-3алкоксикарбонілу, C1-3алкіламіно, (C1-3алкіл)2аміно, C1-3алкіл-S(O)a-, де a приймає значення 0-2, сульфамоїлу, карбамоїлу, N-(C1-3алкіл)сульфамоїлу, N, N-(C1-3алкіл)2сульфамоїлу, N-(C1-3алкіл)карбамоїлу і N, N-(C1-3алкіл)2карбамоїлу; 10 R означає водень, метил, етил, дифторметил, метоксиметил або ціанометил; 11 R означає водень, гідроксил, метокси, метил, етил, ізопропіл, циклопропіл, гідроксіетил, метоксіетил, 2-гідрокси-1-метилетил, 2-гідроксипропіл, дифторметил або оксетаніл; 12 R означає метил, етил, ізопропіл, циклопропіл або гідроксиметил, або її фармацевтично прийнятна сіль. Визначені сполуки формули (I) здатні існувати в стереоізомерних формах. Слід розуміти, що винахід охоплює всі геометричні та оптичні ізомери сполук формули (I) і їх суміші, включаючи рацемати. Таутомери та їх суміші також становлять аспект даного винаходу. Сольвати та їх суміші також становлять аспект даного винаходу. Наприклад, придатним сольватом сполуки формули (I) є, например, гідрат, такий як напівгідрат, моногідрат, дигідрат або тригідрат або їх альтернативна кількість. Даний винахід стосується сполук формули (I), як визначено в даній заявці, а також їх солей. Солі для застосування у фармацевтичних композиціях будуть фармацевтично прийнятними солями, але інші солі також можуть використовуватися для одержання сполук формули (I) і їх фармацевтично прийнятних солей. Фармацевтично прийнятні солі за винаходом можуть включати, наприклад, солі приєднання кислот сполук формули (I), як визначено в даній заявці, які є достатньо основними для утворення таких солей. Такі солі приєднання кислот включають, але не обмежуючись тільки ними, такі солі, як фумарат, метансульфонат, гідрохлорид, гідробромід, цитрат і малеат, і солі, утворені з фосфорною й сірчаною кислотою. Додатково, якщо сполуки формули (I) є достатньо кислотними, то солі являють собою лужні солі й приклади включають, але не обмежуючись тільки ними, сіль лужного металу, наприклад, натрію або калію, сіль лужноземельного металу, наприклад, кальцію або магнію, або сіль органічного аміну, наприклад, триетиламіну, етаноламіну, діетаноламіну, триетаноламіну, морфоліну, Nметилпіперидину, N-етилпіперидину, дибензиламіну або амінокислот, таких як лізин. Сполуки формули (I) також можуть забезпечуватися у вигляді складних ефірів, здатних до гідролізу в умовах in vivo. Складний ефір сполуки формули (I), який здатний до гідролізу в умовах in vivo, що містить карбоксильну або гідроксильну групу, являє собою, наприклад, фармацевтично прийнятний складний ефір, який розщеплюється в організмі людини або тварину з утворенням вихідної кислоти або спирту. Такі складні ефіри можуть ідентифікуватися шляхом введення досліджуваній тварині, наприклад, внутрішньовенно тестованої сполуки й наступного визначення тестованої сполуки в рідині організму тварини. Підходящі фармацевтично прийнятні складні ефіри для карбоксильної групи включають C1алкоксиметилові складні ефіри, наприклад, метоксиметил, C 1-6алканоїлоксиметилові складні 6 ефіри, наприклад, півалоїлоксиметиловий, фталідилові складні ефіри, C 3складні ефіри, наприклад, 18циклоалкоксикарбонілоксиC1-6алкілові циклогексилкарбонілоксіетил, 1,3-діоксолен-2-онілметилові складні ефіри, наприклад, 5-метил1,3-діоксолен-2-онілметил, і C1-6алкоксикарбонілоксіетилові складні ефіри, наприклад, 1метоксикарбонілоксіетил; і можуть утворюватися будь-якою карбоксильною групою в сполуках згідно із даним винаходом. Підходящі фармацевтично прийнятні складні ефіри для гідроксильної групи включають неорганічні складні ефіри, такі як фосфатні складні ефіри (включаючи фосфорамідні циклічні складні ефіри) і α-ацилоксіалкілові прості ефіри й споріднені сполуки, які в результаті 3 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 розщеплення складного ефіру при гідролізі в умовах in vivo утворюють вихідну (і) гідроксильну (і) групу (и). Приклади α-ацилоксіалкілових простих ефірів включають ацетоксиметокси й 2,2диметилпропіонілоксиметокси. Прикладами груп, які утворюють складні ефіри, здатні до гідролізу в умовах in vivo, для гідроксильної групи є C 1-10алканоїл, наприклад, форміл, ацетил, бензоїл, фенілацетил, заміщений бензоїл і фенілацетил; C1-10алкоксикарбоніл (для одержання алкілкарбонатних складних ефірів), наприклад, етоксикарбоніл; ди-C1-4алкілкарбамоїл і N-(диC1-4алкіламіноетил)-N-C1-4алкілкарбамоїл (для одержання карбаматів); ди-C1-4алкіламіноацетил і карбоксіацетил. Прикладами кільцевих замісників на фенілацетилі й бензоїлі є амінометил, C14алкіламінометил і ди-(C1-4алкіл)амінометил, і морфоліно або піперазино, зв'язані за допомогою кільцевого атома азоту через метиленову сполучну групу з 3-му або 4-му положенням бензоїльного кільця. Іншими складними ефірами, здатними до гідролізу в умовах in vivo, які становлять інтерес, включають, наприклад, RAC(O)OC1-6алкіл-CO-, де RA являє собою, наприклад, бензилокси-C1-4алкіл, або феніл. Підходящими замісниками на фенільній групі в таких складних ефірах є, наприклад, 4-C1-4піперазино-C1-4алкіл, піперазино-C1-4алкіл і морфоліно-C1-4алкіл. Сполуки формули (I) також можуть вводитися у вигляді проліків, які розпадаються в організмі людини або тварини з утворенням сполуки формули (I). З рівня техніки відомі різні форми проліків. Приклади таких проліків наведені в: a) Design of Prodrugs, за ред. H. Bundgaard, (Elsevier, 1985) и Methods in Enzymology, том 42, с. 309-396, під ред. K. Widder, і ін. (Academic Press, 1985); b) A Textbook of Drug Design and Development, під ред. Krogsgaard-larsen і H. Bundgaard, частина 5 "Design and Application of Prodrugs", під ред. H. Bundgaard с. 113-191 (1991); c) H. Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992); d) H. Bundgaard, і ін., Journal of Pharmaceutical Sciences, 77, 285 (1988); і e) N. Kakeya, і ін., Chem Pharm Bull, 32, 692 (1984). У даному винаході загальний термін "Cp-qалкіл" охоплює як прямоланцюгові, так і розгалужені алкільні групи. Проте, посилання на конкретні алкільні групи, такі як "пропіл", є специфічним тільки для варіантів із прямим ланцюгом (тобто, н-пропіл і ізопропіл) і посилання на конкретні алкільні групи з розгалуженим ланцюгом, такі як "трет-бутил", є специфічним тільки для варіантів з розгалуженим ланцюгом. Префікс Cp-q в Cp-qалкілі й інших термінах (де p і q являють собою цілі числа) вказує інтервал атомів вуглецю, які містяться в групі, наприклад, C1-4алкіл включає C1алкіл (метил), C2алкіл (етил), C3алкіл (пропіл як н-пропіл й ізопропіл) і C4алкіл (н-бутил, втор-бутил, ізобутил і третбутил). Термін Cp-qалкокси включає –O-Cp-qалкільні групи. Термін Cp-qалканоїл включає –C(O)алкільні групи. Термін "гало" ("галоген") включає фтор, хлор, бром і йод. "Карбоцикліл" являє собою насичену, ненасичену або частково насичену моноциклічну кільцеву систему, яка містить від 3 до 6 кільцевих атомів, де кільцева CH2 група може бути замінена C=O групою. "Карбоцикліл" включає "арил", "Cp-qциклоалкіл" і "Cp-qциклоалкеніл". "арил" являє собою ароматичну моноциклічну карбоциклільну кільцеву систему. "Cp-qциклоалкеніл" являє собою ненасичену або частково насичену моноциклічну карбоциклільну кільцеву систему, яка містить принаймні 1 зв'язок C=C і де кільцева CH 2 група може бути замінена C=O групою. "Cp-qциклоалкіл" являє собою насичену моноциклічну карбоциклільну кільцеву систему й де кільцева CH2 група може бути замінена C=O групою. "Гетероцикліл" являє собою насичену, ненасичену або частково насичену моноциклічну кільцеву систему, яка містить від 3 до 6 кільцевих атомів, з яких 1, 2 або 3 кільцевих атомів вибрані з азоту, сірки або кисню, де кільце може бути зв'язане за допомогою атома вуглецю або азоту й де вказаний кільцевий атом азоту або сірки може бути окиснений і де кільцева CH 2 група може бути замінена C=O групою. "Гетероцикліл" включає "гетероарил", "циклогетероалкіл" і "циклогетероалкеніл". "Гетероарил" являє собою ароматичний моноциклічний гетероцикліл, що переважно має 5 або 6 кільцевих атомів, у якому 1, 2 або 3 кільцевих атомів вибрані з азоту, сірки або кисню, де атом азоту або атом сірки може бути окиснений. "Циклогетероалкеніл" являє собою ненасичену або частково насичену моноциклічну гетероциклільну кільцеву систему, яка переважно має 5 або 6 кільцевих атомів, де 1, 2 або 3 кільцевих атомів вибрані з азоту, сірки або кисню, де кільце може бути зв'язане за допомогою атома вуглецю або азоту й де вказаний кільцевий атом азоту або сірки може бути окиснений і де кільцева CH2 група може бути замінена C=O групою. 4 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Циклогетероалкіл" являє собою насичену моноциклічну гетероциклічну кільцеву систему, яка переважно має 5 або 6 кільцевих атомів, де 1, 2 або 3 кільцевих атомів вибрані з азоту, сірки або кисню, де кільце може бути зв'язане за допомогою атома вуглецю або азоту й де вказаний кільцевий атом азоту або сірки може бути окиснений і де кільцева CH 2 група може бути замінена C=O групою. У даній заявці можуть застосовуватися складені терміни для описів груп, що містять більше однієї функціональної групи. Якщо спеціально не вказано інакше, то такі терміни слід розуміти, як прийнято в даній галузі техніки. Наприклад, карбоциклілC p-qалкіл містить Cp-qалкіл, заміщений карбоциклілом, гетероциклілCp-qалкіл містить Cp-qалкіл, заміщений гетероциклілом, і біс(Cpqалкіл)аміно містить аміно, заміщений 2 C p-qалкільними групами, які можуть бути однаковими або різними. ГалоCp-qалкіл являє собою Cp-qалкільну групу, яка заміщена 1 або декількома галогеновими замісниками й переважно 1, 2 або 3 галогеновими замісниками. Аналогічно, інші загальні терміни, що містять галоген, такі як галоC p-qалкокси, можуть містити 1 або декілька галогенових замісників і переважно 1, 2 або 3 галогенових замісників. ГідроксиCp-qалкіл являє собою Cp-qалкільну групу, яка заміщена 1 або декількома гідроксильними замісниками й переважно 1, 2 або 3 гідрокси замісниками. Аналогічно, інші загальні терміни, що містять гідрокси, такі як гідроксиCp-qалкокси, можуть містити 1 або декілька й переважно 1, 2 або 3 гідрокси замісників. Cp-qалкоксиCp-qалкіл являє собою Cp-qалкільну групу, яка заміщена 1 або декількома C pqалкокси замісниками й переважно 1, 2 або 3 C p-qалкокси замісниками. Аналогічно, інші загальні терміни, що містять Cp-qалкокси, такі як Cp-qалкоксиCp-qалкокси, можуть містити 1 або декілька Cp-qалкокси замісників і переважно 1, 2 або 3 Cp-qалкокси замісників. Якщо необов'язкові замісники вибирають із "1 або 2", з "1, 2, або 3" або з "1, 2, 3 або 4" груп або замісників, то мається на увазі, що це визначення охоплює всі замісники, які вибрані з однієї з конкретних груп, тобто всі замісники є однаковими, або замісники, які вибрані із двох або більше вказаних груп, тобто замісники не є однаковими. Сполуки згідно із даним винаходом названі за допомогою комп'ютерного програмного забезпечення (ACD/Name версія 10.0). "Проліферативне (і) захворювання (я)” включають злоякісне (і) захворювання (я), такі як рак, а також незлоякісне (і) захворювання (я), такі як запальні захворювання, обструктивні захворювання дихальних шляхів, імунні захворювання або серцево-судинні захворювання. Придатні значення для будь-якої групи R або для будь-якої частини або будь-якого замісника таких груп включають: для C1-3алкілу: метил, етил, пропіл і изо-пропіл; для C1-6алкілу: C1-3алкіл, бутил, 2-метилпропіл, трет-бутил, пентил, 2,2-диметилпропіл, 3метилбутил і гексил; для C3-6циклоалкілу: циклопропіл, циклобутил, циклопентил і циклогексил; для C3-6циклоалкілC1-3алкілу: циклопропілметил, циклопропілетил, циклобутилметил, циклопентилметил і циклогексилметил; для арилу: феніл; для арилC1-3алкілу: бензил і фенетил; для карбоциклілу: арил, циклогексеніл і C 3-6циклоалкіл; для галогену: фтор, хлор, бром і йод; для C1-3алкокси: метокси, етокси, пропокси і ізопропокси; для C1-6алкоксилу: C1-3алкокси, бутокси, трет-бутокси, пентилокси, 1-етилпропокси і гексилокси; для C1-3алканоїлу: ацетил і пропаноїл; для C1-6алканоїлу: ацетил, пропаноїл і 2-метилпропаноїл; для гетероарилу: піридиніл, імідазоліл, піримідиніл, тієніл, піроліл, піразоліл, тіазоліл, тіазоліл, триазоліл, оксазоліл, ізоксазоліл, фураніл, піридазиніл і піразиніл; для гетероарилC1-3алкілу: піролілметил, піролілетил, імідазолілметил, імідазолілетил, піразолілметил, піразолілетил, фуранілметил, фуранілетил, тієнілметил, тієнілетил, піридинілметил, піридинілетил, піразинілметил, піразинілетил, піримідинілметил, піримідинілетил, піримідинілпропіл, піримідинілбутил, імідазолілпропіл, імідазолілбутил, 1,3,4триазолілпропіл і оксазолілметил; для гетероциклілу: гетероарил, піролідиніл, піперидиніл, піперазиніл, ацетидиніл, морфолініл, дигідро-2H-піраніл, тетрагідропіридин і тетрагідрофураніл; для насиченого гетероциклілу: оксетаніл, піролідиніл, піперидиніл, піперазиніл, ацетидиніл, морфолініл, тетрагідропіраніл і тетрагідрофураніл. 5 UA 109010 C2 5 10 15 Слід прийняти до уваги, що приклади, наведені для термінів, використовуваних в описі, не є обмежуючими. 1 2 3 4 5 6 7 8 9 10 11 12 Кращими значеннями кільця A, n, R , R , R , R , R , R , R , R , R , R , R і R є наступні значення. Такі значення можуть використовуватися окремо або в комбінації, якщо це є придатним, щодо будь-якого аспекту винаходу, або його частини, і будь-якого визначення, пунктів формули або варіантів здійснення, розкритих в даній заявці. 1 R 1 В іншому аспекті винаходу R вибирають із морфолін-4-ілу, 3-метилморфолін-4-ілу, 3,5диметилморфолін-4-ілу і 8-окса-3-азабіцикло[3.2.1]октан-3-ілу. 1 В ще одному аспекті, R вибирають із морфолін-4-ілу, 3-метилморфолін-4-ілу і 8-окса-3азабіцикло[3.2.1]октан-3-ілу. 1 В ще одному аспекті, R вибирають із морфолін-4-ілу і 3-метилморфолін-4-ілу. 1 В ще одному аспекті, R означає 3-метилморфолін-4-іл. 2 R 2 В одному аспекті R означає R 2A NH R 2B . 2 В одному аспекті R означає R 2C NH N R 2D . 2 В одному аспекті R означає R 2E NH 2F R . N 20 2 В одному аспекті R означає 2G R N N 2H (R )n 25 . 2A R 2A R означає водень.2B R 2B R означає водень. 6 UA 109010 C2 2C 5 10 15 20 25 30 35 40 45 50 55 60 R 2C R означає водень. 2D R 2D R означає водень. 2E R 2E R означає водень. 2F R 2F R означає водень. 2G R 2G 10 11 12 В одному аспекті винаходу R вибирають із –R , -NHR і -NHCOR . 2G 10 В одному аспекті винаходу R означає –R . 2G 11 В одному аспекті винаходу R означає –NHR . 2G 12 В одному аспекті винаходу R означає –NHCOR . 3 R 3 В одному аспекті винаходу R означає групу, вибрану із метилу, етилу, ізопропілу і циклопропілу. 3 В іншому аспекті винаходу R означає метил. 4 5 R іR 4 5 В одному аспекті винаходу R і R означають водень. 4 5 В одному аспекті винаходу R і R означають метил. 4 5 В одному аспекті винаходу R і R разом з атомом, до якого вони приєднані, утворюють кільце A. Кільце A В одному аспекті винаходу кільце A означає незаміщене C 3-6циклоалкільне або насичене 4-6 членне гетероциклічне кільце, що містить один гетероатом, вибраний із O і N. В іншому аспекті кільце A означає циклопропільне, циклобутильне, циклопентильне, оксетанільне, тетрагідрофурильне, тетрагідропіранільне, азетидинільне, піролідинільне або піперидинільне кільце. В іншому аспекті кільце A означає циклопропільне, циклобутильне, циклопентильне, тетрагідропіранільне або піперидинільне кільце. В іншому аспекті кільце A означає циклопропільне, циклопентильне, тетрагідропіранільне або піперидинільне кільце. В іншому аспекті кільце A означає циклопропільне, тетрагідропіранільне або піперидинільне кільце. В іншому аспекті кільце A означає піперидинільне кільце. В іншому аспекті кільце A означає тетрагідропіранільне кільце. В іншому аспекті кільце A означає циклопропільне кільце. 6 R 6 В одному аспекті R означає водень. 10 R 10 В одному аспекті R означає метил. 11 R 11 В одному аспекті R означає водень або метил. 11 В одному аспекті R означає метил. 11 В одному аспекті R означає водень. 12 R 12 В одному аспекті R означає метил. В одному аспекті винаходу забезпечується підмножина сполук формули (I), або їх фармацевтично прийнятних солей; 1 R вибирають із морфолін-4-ільної, 3-метилморфолін-4-ільної, 3,5-диметилморфолін-4ільної і 8-окса-3-азабіцикло[3.2.1]октан-3-ільної групи; 2A R означає водень; 2B R означає водень; 2C R означає водень; 2D R означає водень; 2E R означає водень; 2F R означає водень; 2G 10 11 12 R вибирають із –R , -NHR і -NHCOR ; 2H R означає фтор; 3 R означає групу, вибрану із метилу, етилу, ізопропілу і циклопропілу; 7 UA 109010 C2 4 5 10 15 20 25 5 R і R разом з атомом, до якого вони приєднані, утворюють кільце A; кільце A означає незаміщене C3-6циклоалкільне або насичене 4-6 членне гетероциклічне кільце, що містить один гетероатом, вибраний із O і N; 6 R означає водень; 10 R означає метил; 11 R означає водень або метил; та 12 R означає метил. В іншому аспекті винаходу забезпечується підмножина сполук формули (I), або їх фармацевтично прийнятних солей; 1 R вибирають із морфолін-4-ільної, 3-метилморфолін-4-ільної, 3,5-диметилморфолін-4ільної і 8-окса-3-азабіцикло[3.2.1]октан-3-ільної групи; 2A R означає водень; 2B R означає водень; 2C R означає водень; 2D R означає водень; 2E R означає водень; 2F R означає водень; 2G 10 11 12 R вибирають із –R , -NHR і -NHCOR ; 2H R означає фтор; 3 R означає групу, вибрану із метилу, етилу, ізопропілу і циклопропілу; 4 5 R і R разом з атомом, до якого вони приєднані, утворюють кільце A; кільце A означає циклопропільне, циклобутильне, циклопентильне, оксетанільне, тетрагідрофурильне, тетрагідропіранільне, азетидинільне, піролідинільне або піперидинільне кільце; 6 R означає водень; 10 R означає метил; 11 R означає водень або метил; та 12 R означає метил. В іншому аспекті винаходу забезпечується підмножина сполук формули (Ia), O N 6 R 3 R N O N S 2 N R A 30 (Ia) або їх фармацевтично прийнятних солей; кільце A означає циклопропільне, тетрагідропіранільне або піперидинільне кільце; 2 R означає R 2A R 2C R NH 2G R 2E N NH N NH N 35 R 2B , 2A R означає водень; 2B R означає водень; 2C R означає водень; 2D R означає водень; R 2D N , 8 R 2H 2F або (R )n ; UA 109010 C2 2E R означає водень; 2F R означає водень; 2G 10 11 12 R вибирають із –R , -NHR і -NHCOR ; 2H R означає фтор; 3 R означає метильну групу; 6 R означає водень; 10 R означає метил; 11 R означає водень або метил; та 12 R означає метил. В іншому аспекті винаходу забезпечується підмножина сполук формули (Ia), 5 10 O N 6 R 3 R N O N S 2 N R A 15 (Ia) або їх фармацевтично прийнятних солей; кільце A означає циклопропільне, тетрагідропіранільне або піперидинільне кільце; 2 R означає R 2A R 2C R NH 2G R 2E N NH NH N N R 20 25 30 35 2B R 2D N R 2F 2H (R )n , , або ; 2A R означає водень; 2B R означає водень; 2C R означає водень; 2D R означає водень; 2E R означає водень; 2F R означає водень; 2G 11 R означає -NHR ; 2H R означає фтор; 3 R означає метильну групу; 6 R означає водень; та 11 R означає водень. В іншому аспекті винаходу забезпечується сполука, або комбінація сполук, вибраних із будьякого із прикладів, або їх фармацевтично прийнятні солі. В іншому аспекті винаходу забезпечується сполука, або комбінація сполук, вибраних із групи, що включає 4-{4-[(3R)-3-метилморфолін-4-іл]-6-[(R)-(S-метилсульфонімідоїл)метил]піримідин-2-іл}-1Hпіроло[2,3-b]піридин; 4-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((S)-S-метилсульфонімідоїл)циклопропіл]піримідин-2іл}-1H-піроло[2,3-b]піридин; 4-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((R)-S-метилсульфонімідоїл)циклопропіл]піримідин-2іл}-1H-піроло[2,3-b]піридин; N-метил-1-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-(R)-(Sметилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1H-бензімідазол-2-амін; та 9 UA 109010 C2 5 10 N-метил-1-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-(S)-(Sметилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1H-бензімідазол-2-амін, або їх фармацевтично прийнятні солі. 2 Сполуку формули (I) можна одержати із сполуки формули (II), де L означає відхідну групу (таку як галоген або -SMe, і т.д.), за реакцією зі сполукою формули (IIIa), (IIIb) або (IIIc), де X означає придатну групу (таку як залишок боронової кислоти або складного ефіру) за присутності придатного Pd каталізатора і фосфінового ліганду в придатному розчиннику, такому як суміш N, N-диметилформаміду, диметоксіетану, води і етанолу, в придатних умовах, таких як нагрівання в мікрохвильовому реакторі. Альтернативно, сполуку формули (I) можна одержати із сполуки 2 формули (II), де L означає відхідну групу (таку як галоген або -SMe, і т.д.), за реакцією зі сполукою формули (IIId), за присутності придатної основи, такої як NaH, Na 2CO3, Cs2CO3 або K2CO3, в придатному розчиннику, такому як N, N-диметилформамід або N, N-диметилацетамід або за присутності придатного Pd каталізатора і фосфінового ліганду в придатному розчиннику, такому як діоксан. 2A R NH X N 2B R (IIIb) 6 25 30 2F 2H (R )n O N S 4 6 R R 2 R N O N 1 5 (IIId) (IIIc) 2 R 20 N R N L N 15 X R R 3 NH R H 2D (IIIa) R 2G R N NH X 2E 2C R R 3 R N S N 1 4 R 5 R R (I) (II) Слід прийняти до уваги, що сполуку формули (I) можна перетворити на іншу сполуку формули (I) із застосуванням умов, добре відомих в даній галузі техніки. Сполуки формул (IIIa), (IIIb), (IIIc) і (IIId) або доступні для придбання, або добре відомі в даній галузі техніки. Слід прийняти до уваги, що сполуку формули (II) можна перетворити на іншу сполуку формули (II) за допомогою таких методик, як окиснення, алкілування, відновне амінування і т.д., які або перераховані вище або відомі із літератури. 6 4 5 Сполуку формули (II), де R означає водень і R і R утворюють кільце A, можна одержати за реакцією сполуки формули (IV), де PG означає придатну захисну групу, таку як трифторацетамід, зі сполукою формули (V), де A означає 2-6 членний, необов'язково заміщений, алкіленовий ланцюг, в якому 1 вуглець може бути необов'язково замінений на O, N 1 або S, і де L означає відхідну групу (таку як галоген, тозил, мезил і т.д.) з наступним видаленням захисної групи за присутності придатної основи, такої як гідрид натрію або третбутилат калію в придатному розчиннику, такому як тетрагідрофуран або N, Nдиметилформамід, або шляхом використання водного розчину гідроксиду натрію і придатного розчинника, такого як ДХМ або толуол, з придатним агентом фазового переносу, таким як бромід тетрабутиламонію. 10 UA 109010 C2 1 A L 2 1 L R O N N N S 3 L R O N N (V) 2 6 L PG R R N S 3 1 1 R A (IV) 5 (II) 6 4 5 Сполуку формули (II), де R означає водень і R і R обидва означають метил, можна одержати за реакцією сполуки формули (IV), де PG означає придатну захисну групу, таку як 1 трифторацетамід, зі сполукою формули (Va), де L означає відхідну групу (таку як галоген, тозил, мезил і т.д.) з наступним видаленням захисної групи за присутності придатної основи, такої як гідрид натрію або трет-бутилат калію, в придатному розчиннику, такому як тетрагідрофуран або N, N-диметилформамід. 1 Me L 2 O N N 3 R S 2 6 L PG (Va) L R O N N N 3 1 R R N S 1 R R4 R 5 (IV) 10 (II) Сполуку формули (IV), де PG означає придатну захисну групу, таку як трифторацетамід, можна одержати за реакцією сполуки формули (VI) з імінойоданом (VII), який може бути одержаний in situ із йодбензолдіацетату і трифторацетаміду в придатному розчиннику, такому як ДХМ за присутності придатної основи, такої як оксид магнію, і каталізатора, такого як ацетат родію. O I 2 F F L 3 R O + S N F N (VII) N 1 R F F O N O N 3 S R (VI) 15 20 25 F 2 L N 1 R (IV) 4 5 6 Сполуку формули (I), де R , R і R означають водень, можна одержати за реакцією сполуки 2 формули (IV), де L означає відхідну групу (таку як галоген або -SMe, і т.д.), зі сполукою формули (IIIa), (IIIb) або (IIIc), де X означає придатну групу (таку як боронова кислота або складний ефір) за присутності придатного Pd каталізатора і фосфінового ліганду в придатному розчиннику, такому як суміш N, N-диметилформаміду, диметоксіетану, води і етанолу, в придатних умовах, таких як нагрівання в мікрохвильовому реакторі, і з наступним видаленням 4 5 6 трифторацетамідної захисної групи. Альтернативно, сполуку формули (I), де R , R і R 2 означають водень, можна одержати за реакцією сполуки формули (IV), де L означає відхідну групу (таку як галоген або -SMe, і т.д.), зі сполукою формули (IIId), за присутності придатної основи, такої як NaH, Na2CO3, Cs2CO3 або K2CO3, в придатному розчиннику, такому як N, Nдиметилформамід або N, N-диметилацетамід, або за присутності придатного Pd каталізатора і фосфінового ліганду в придатному розчиннику, такому як діоксан, з наступним видаленням трифторацетаміду. Сполуку формули (VI) можна одержати за реакцією сполуки формули (VIII) із застосуванням умов, добре відомих в даній галузі техніки. 11 UA 109010 C2 2 2 L N L N S 3 R 3 1 R R N O + S N 1 R (VIII) 5 (VI) 4 Сполуку формули (VIII), можна одержати за реакцією сполуки формули (IX), де L означає відхідну групу (таку як галоген, тозил, мезил і т.д.), зі сполукою формули (X), необов'язково за присутності придатної основи, такої як триетиламін, і розчинника, такого як N, Nдиметилформамід. 2 2 L L N N 3 R 4 L SH N 1 3 R R S N 1 R (IX) (X) (VIII) Сполуку формули (IX), можна одержати за реакцією сполуки формули (XI) із застосуванням умов, добре відомих в даній галузі техніки. 2 2 L L N N N HO 10 15 20 1 R N L4 1 R (XI) (IX) Сполуку формули (XI), можна одержати за реакцією сполуки формули (XII) із застосуванням умов, добре відомих в даній галузі техніки. 2 L 2 L a N N R N N O 1 R HO 1 R O (XII) (XI) 1 Сполуку формули (XII), де R означає N-приєднаний гетероцикл, такий як морфолін, можна одержати за реакцією сполуки формули (XIII) з циклічним аміном, таким як морфолін, необов'язково за присутності придатної основи, такої як триетиламін, в придатному розчиннику, 1 такому як ДХМ. Сполуку формули (XII), де R означає C-приєднаний гетероцикл, такий як дигідропіран, можна одержати за реакцією сполуки формули (XIII) з придатним 1 металоорганічним реагентом (таким як боронова кислота R B(OH)2 або складний ефір 1 боронової кислоти R B(OR)2 і т.д.) за присутності придатного металевого каталізатора (такого як паладій або мідь) в придатному розчиннику, такому як 1,4-діоксан. 2 2 L L a N R O a N 5 L O N R O N 1 R O (XII) (XIII) 1 Сполуки формули (XIII), циклічні аміни, боронові кислоти {R B(OH)2} і складні ефіри 1 боронової кислоти {R B(OR)2} або доступні для придбання, або добре відомі в даній галузі техніки. 12 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 Слід врахувати, що якщо Кільце А, являє собою гетероциклічне кільце, що містить атом азоту, то цей атом азоту може бути підходяще захищений (наприклад, третбутоксикарбаматною або бензильною групою) і що захисна група може бути вилучена й, при необхідності, подальша реакція здійснена на азоті (наприклад, алкілування, відновне амінування або амідування) на будь-якій стадії синтезу. Також слід врахувати, що певні різні кільцеві замісники в сполуках згідно із даним винаходом можуть бути введені за допомогою стандартних реакцій ароматичного заміщення або отримані шляхом модифікації звичайних функціональних груп як перед, так і безпосередньо після способів, описаних вище, і по суті включені у варіант здійснення способу згідно з винаходом. Наприклад, сполуки формули (I) можуть бути перетворені в інші сполуки формули (I) за допомогою стандартних реакцій ароматичного заміщення або за допомогою загальноприйнятих модифікацій функціональних груп. Такі реакції й модифікації включають, наприклад, введення замісника за допомогою реакції ароматичного заміщення, відновлення замісників, алкілування замісників і окиснення замісників. Реагенти й умови реакцій для таких методик добре відомі в галузі хімії. Конкретними прикладами реакцій ароматичного заміщення є введення нітрогрупи за допомогою концентрованої азотної кислоти, введення ацильної групи за допомогою, наприклад, ацилгалогеніду й кислоти Л'юіса (такої як трихлорид алюмінію) в умовах Фріделя Крафта; введення алкільної групи за допомогою алкілгалогеніду й кислоти Л'юіса (такої як трихлорид алюмінію) в умовах Фріделя Крафта; і введення галогенової групи. Конкретними прикладами модифікацій є окиснення нітрогрупи до аміногрупи, наприклад, шляхом каталітичної гідрогенізації з нікелевим каталізатором або обробкою залізом у присутності соляної кислоти при нагріванні; окиснення алкілтіогрупи до алкілсульфінілу або алкілсульфонілу. Також слід врахувати, що при здійсненні деяких реакцій, описаних у даному винаході, може бути необхідним/бажаним захищати будь-які чутливі групи в сполуках. Приклади, коли такий захист необхідний або бажаний й підходящі способи захисту відомі фахівцеві в даній галузі хімії. Можуть застосовуватися звичайні захисні групи відповідно до стандартних способів (див., наприклад, T.W. Green, Protective Groups in Organic Synthesis, John Wiley і Sons, 1991). Таким чином, якщо реагуючі речовини містять, такі групи, як аміногрупа, карбоксильна група або гідроксильна група, то може бути бажаним захищати таку групу в деяких реакціях, описаних у даному винаході. Підходящою захисною групою для аміногрупи або алкіламіногрупи є, наприклад, ацильна група, наприклад, алканоїльна група, така як ацетил, алкоксикарбонільна група, наприклад, метоксикарбонільна, етоксикарбонільна або трет-бутоксикарбонільна група, арилметоксикарбонільна група, наприклад, бензилоксикарбоніл, або ароїльна група, наприклад, бензоїл. Умови зняття захисту для вищезгаданих захисних груп головним чином залежать від вибору захисної групи. Так, наприклад, ацильна група, така як алканоїльна або алкоксикарбонільна група або ароїльна група можуть бути відщеплені, наприклад, шляхом гідролізу з підходящою основою, такою як гідроксид лужного металу, наприклад, гідроксид літію або натрію. Альтернативно, ацильна група, така як трет-бутоксикарбонільна група може бути відщеплена, наприклад, шляхом обробки підходящою кислотою, такою як соляна, сірчана або фосфорна кислота або трифтороцтова кислота й арилметоксикарбонільна група, така як бензилоксикарбонільна група, може бути відщеплена, наприклад, шляхом гідрування в присутності каталізатора, такого як паладій на вугіллі, або шляхом обробки кислотою Л'юіса, наприклад, трис(трифторацетатом) бору. Підходящою альтернативною захисною групою для первинної аміногрупи є, наприклад, фталоїльна група, яка може бути відщеплена шляхом обробки алкіламіном, наприклад, диметиламінопропіламіном, або гідразином. Підходящою захисною групою для гідроксильної групи є, наприклад, ацильна група, наприклад, алканоїльна група, така як ацетил, ароїльна група, наприклад, бензоїл, або арилметильна група, наприклад, бензил. Умови зняття захисту для вищезгаданих захисних груп головним чином будуть залежати від вибору захисної групи. Так, наприклад, ацильна група, така як алканоїльна або ароїльна група, може бути відщеплена, наприклад, за допомогою гідролізу з підходящою основою, такою як гідроксид лужного металу, наприклад гідроксид літію або натрію. Альтернативно, арилметильна група, така як бензильна група, може бути відщеплена, наприклад, шляхом гідрування в присутності каталізатора, такого як паладій на вугіллі. Підходящою захисною групою для карбоксильної групи є, наприклад, естерифікована група, наприклад, метильна або етильна група, яка може бути відщеплена, наприклад, шляхом гідролізу з основою, такою як гідроксид натрію, або, наприклад, трет-бутильна група, яка може бути відщеплена, наприклад, шляхом обробки кислотою, наприклад, органічною кислотою, такою як трифтороцтова кислота, або, наприклад, бензильна група, яка може бути відщеплена, 13 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, шляхом гідрування в присутності каталізатора, такого як паладій на вугіллі. Захисні групи можуть бути відщеплені на будь-якій підходящій стадії синтезу за допомогою звичайних методик, добре відомих в галузі хімії. Багато проміжних продуктів, розкриті в даній заявці, є новими й вони забезпечуються як подальша характерна особливість винаходу. Біологічні дослідження Наступні дослідження можна використовувати для оцінки дії сполук згідно із даним винаходом як інгібіторів ATR кінази. (a) Аналіз ферменту -ATR ATR для застосування в дослідженні ферменту в умовах in vitro одержували з ядерного екстракту Hela (CIL Biotech, Mons, Belgium) шляхом імунопреципітації із кролячою поліклональною антисироваткою, збільшеною до амінокислот 400–480 з ATR (Tibbetts RS і ін., 1999, Genes Dev. 13:152-157) наступний буфер, що містить (25 мм HEPES (pН7,4), 2 мМ MgСl2, 250 мМ NaСl, 0,5 мМ EDTA, 0,1 мМ Na3VO4, 10 % об./ об. гліцерин, і 0,01 % об./ об. Твін 20). Комплекси ATR-антитіло виділяли з ядерного екстракту шляхом інкубування з білком Aсефарозних кульок (Sigma, № P3476) протягом 1 години і потім шляхом центрифугування для відновлення кульок. У лунку планшета на 96-лунок, 10 мкл ATR-вмісних сефарозних кульок інкубували з 1 мкг субстрату глутатіон S-трансфераза–p53N66 (NH2-кінцевих 66 амінокислот p53, спряженого із глутатіон S-трансферазою, експресували в E.coli) у буфері для дослідження ATR (50 мМ HEPES (pН 7,4), 150 мМ NaСl, 6 мМ MgСl2, 4 мМ MnСl2, 0,1 мМ Na3VO4, 0,1 мМ DTT, і 10 % (об./ об.) гліцерин) при 37 °C у присутності або відсутності інгібітора. Після обережного перемішування протягом 10 хвилин, ATP додавали до кінцевої концентрації 3 мкM і реакцію продовжували при 37 °C додатково протягом 1 години. Реакцію зупиняли шляхом додавання 100 мкл PBS і реакцію переносили в білий світлонепроникний покритий глутатіоном планшет на 96 лунок (NUNC № 436033) і інкубували протягом при 4 °C. Потім цей планшет промивали в допомогою PBS/0,05 % (об./ об.) Твін 20, блотували насухо, і аналізували шляхом стандартної техніки ELISA (імуносорбентний аналіз із ферментною міткою) з фосфо-серин 15 p53 (16G78) антитілом (Cell Signaling Technology, № 9286). Виявлення фосфорилованого субстрату глутатіон S-трансфераза–p53N66 здійснювали в комбінації з козячим анти-мишиним кон'югованим з пероксидазою хрону вторинним антитілом (Pierce, № 31430). Поліпшений хемілюмінесцентний розчин (NEN, Boston, MA) використовували для одержання сигналу й виявлення хемілюмінесценції здійснювали за допомогою планшет-рідера Topcount (Packard, Meriden, CT). Потім отриманий розрахований % ферментативної активності (Activity Base, IDBS) використовували для визначення значень IC 50 для сполук (IC50 розглядали як концентрацію, при якій активність ферменту інгібована на 50 %). (b) Клітинні аналізи - ATR ATM і ATR мають різні, що перекриваються, відповіді на ушкодження ДНК. Вони повинні діяти разом і відповіді повинні бути скоординованими. Обидва шляхи можуть активуватися іонізуючим випромінюванням, однак тільки ATR активується за допомогою УФ. Оскільки Уфобробка незручна для застосування в клітинному аналізі з високою пропускною здатністю, то для активації ATR шляху відповіді на ушкодження ДНК вибирали Уф-міметичний 4NQ0 (Sigma). Chk1, нижчерозташована протеїнкіназа ATR, відіграє вирішальну роль у контролюванні контрольної точки ушкодження ДНК. Активація Chk1 задіює фосфорилування Ser317 і Ser345 (розглядається як краща мішень для фосфорилування /активації за допомогою ATR). У цьому дослідженні вимірювали зниження фосфорилування Chk1 (Ser 345) у клітинах аденокарциноми ободової кишки HT29 з наступним лікуванням за допомогою й УФ-міметичного 4NQ0. Діапазон доз сполук створювали шляхом розведення в 100 % ДМСО й потім додатково в середовищі для дослідження (EMEM, 10 %FCS, 1 % глутамін), використовуючи диспергуючий інструмент 4 Labcyte Echo Acoustic. Клітини поміщали в планшети Costar на 384 лунки при концентрації 910 клітин на мл в 40 мкл EMEM, 10 %FCS, 1 %глутамін і вирощували протягом 24 годин. Після додавання сполуки клітини інкубували протягом 60 хвилин. Потім додавали кінцеву концентрацію 3 мкM 4NQ0 (приготовлену в 100 % ДМСО), використовуючи Labcyte Echo і клітини інкубували додатково протягом 60 хвилин. Після цього клітини фіксували шляхом додавання 40 мкл 3,7 % об./ об. розчину формальдегіду протягом 20 хвилин. Після видалення фіксатора, клітини промивали за допомогою PBS і пермеалізували в 40 мкл PBS, що містять TM 0,1 % Тритон X-100. Потім клітини промивали й додавали 15 мкл розчину первинного антитіла (pChk1 Ser345), і планшети інкубували при 4 °C протягом ночі. Після цього первинне антитіло вимивали, і додавали 20 мкл розчину вторинного антитіла (козяче анти–кроляче Alexa Fluor 488, Invitrogen) і додавали 1 мкM Hoechst 33258 (Invitrogen) протягом 90 хвилин при кімнатній 14 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 температурі. Планшети промивали й залишали в 40 мкл PBS. Потім планшети аналізували на приладі Arrayscan Vti для визначення інтенсивностей фарбування, і одержували відповіді залежно від дози й використовували для визначення значень IC 50 для сполук. (c) Клітинний - SRB аналіз Потенціюючий фактор (PF50) для сполук являє собою ступінь кратності підвищення дії хіміотерапевтичного засобу, коли використовують у комбінації з інгібітором ATR. Специфічно, його розраховували у вигляді співвідношення IC50 росту контрольних клітин у присутності хіміотерапевтичного засобу, звичайно карбоплатину, розділеного на IC50 росту клітин у присутності цього засобу й інгібітора ATR, що представляє інтерес. Для цього, HT29 клітини висівали при підходящій щільності для забезпечення експонентного росту під час дослідження (звичайно 1000-1500 клітин) у кожну лунку планшета на 96 лунок, в об'ємі 80 мкл і інкубували протягом при 37C. Після цього, клітини дозували або за допомогою ДМСО наповнювача, або обробляли з тестованими сполуками при фіксованих концентраціях (звичайно 1, 0,3 & 0,1 мкM). Після інкубування протягом однієї години при 37C, клітини додатково обробляли за допомогою хіміотерапевтичного засобу з дозовою відповіддю в 10 точках, ґрунтуючись на його відомій чутливості (звичайно 30-0,001 мкг/мл карбоплатину). Клітини залишали для росту протягом 5 днів при 37 °C, після цього ріст клітин оцінювали за допомогою аналізу із сульфородаміном B (SRB) (Skehan, P і ін., 1990 New colorimetric cytotoxic assay for anticancer-drug screening. J. Natl. Cancer Inst. 82, 1107-1112.). Специфічно, середовище видаляли й клітини фіксували з 100 мкл охолодженої на льоді 10 % (мас./ об.) трихлороцтової кислоти. Після цього планшети інкубували при 4 °C протягом 20 хвилин перед промиванням 4 рази за допомогою води. Потім кожну лунку фарбували за допомогою 100 мкл 0,4 % (мас./ об.) SRB в 1 % оцтовій кислоті протягом 20 хвилин перед додатковим промиванням 4 рази з 1 % оцтовою кислотою. Після цього планшети висушували протягом 2 годин при кімнатній температурі й барвник солюбілізували шляхом додавання 100 мкл Трис-основи pН 8,5 у кожну лунку. Планшети струшували перед вимірюванням оптичної щільності при 564 нм (OD564). Для розрахунків PF50, OD564 значення, отримані для кривої залежності доза-ефект хіміотерапевтичного засобу, виражали у вигляді відсотка значення, отриманого для клітин, оброблених тільки наповнювачем. Аналогічним чином, для дії як контролю для включення інгібітора ATR, значення для хіміотерапевтичного засобу, тестованого в комбінації з фіксованою концентрацією ATR інгібітора, виражали у вигляді відсотка значення, отриманого для клітин, оброблених відповідною концентрацією ATR інгібітора окремо. Із цих внутрішньоконтрольованих кривих, розраховували IC50 значення й PF50 визначали у вигляді співвідношення цих значень, як описано вище. Сполуки порівнювали, використовуючи PF50 значення при концентраціях ATR інгібітора, які проявляють мінімальне інгібування росту самостійно. Наступні аналізи можна використовувати для вимірювання дії сполук згідно із даним винаходом як інгібіторів mTOR кінази. Аналіз на фермент - mTOR кіназу (Echo) У цьому дослідженні використовували технологію AlphaScreen (Gray і ін., Analytical Biochemistry, 2003, 313: 234-245) для визначення здатності тестованих сполук інгібувати фосфорилування шляхом рекомбінантного mTOR. C-кінцеве усікання mTOR, що включає амінокислотні залишки 1362-2549 mTOR (EMBL рег. № L34075), стабільно експресували у вигляді FLAG-міченого злиття в клітинах HEK293, як описано Vilella-bach і ін., Journal of Biochemistry, 1999, 274, 4266-4272. HEK293 FLAG-мічену mTOR (1362-2549) стабільну клітинну лінію за стандартною методикою підтримували при 37 °C з 5 % CO2 до злиття 70-90 % у модифікованому за способом Дульбеко ростовому середовищі Ігла (DMEM; Invitrogen Limited, Paisley, UK № каталогу 41966-029), що містить 10 % інактивовану нагріванням фетальну телячу сироватку (FCS; Sigma, Poole, Dorset, UK, № каталогу F0392), 1 % L-глутамін (Gibco, № каталогу 25030-024) і 2 мг/мл Генетицин (G418 сульфат; Invitrogen Limited, UK № каталогу 10131-027). Після експресії в клітинній лінії HEK293 ссавців, експресований білок очищали за допомогою FLAG епітопної мітки згідно зі стандартними методиками очищення. Тестовані сполуки готували у вигляді 10 мМ вихідних розчинів у ДМСО й розводили ДМСО, як потрібно, одержуючи діапазон кінцевих концентрацій для дослідження. Аліквоти (120 нл) кожного розведення сполуки акустично диспергували, використовуючи Labcyte Echo 550, у лунку Greiner білого полістирольного планшета на 384 лунки низького об'єму (LV) (Greiner Bioone). 12.12 мкл суміш рекомбінантного очищеного mTOR ферменту, 2 мкM біотинілованого пептидного субстрату (Biotin-Ahx-Lys-Lys-Ala-Asn-Gln-Val-Phe-Leu-Gly-Phe-Thr-Tyr-Val-Ala-ProSer-Val-Leu-Glu-Ser-Val-Lys-Glu-NH2; Bachem UK Ltd), ATФ (20 мкM) і буферний розчин [що містить Трис-HCl pН7,4 буфер (50 мМ), EGTA (0,1 мМ), бичачий сироватковий альбумін (0,5 15 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 мг/мл), DTT (1,25 мМ) і хлорид марганцю (10 мМ)] інкубували при кімнатній температурі протягом 120 хвилин. Контрольні лунки, що генерують максимальний сигнал, який відповідає максимальній активності ферменту, готували за допомогою 100 % ДМСО замість тестованої сполуки. Контрольні лунки, які генерують мінімальний сигнал, що відповідає повністю інгібованому ферменту, готували шляхом додавання LY294002 (100 мкМ) сполуки. Ці досліджувані розчини інкубували протягом 2 годин при кімнатній температурі. Кожну реакцію зупиняли шляхом додавання 5 мкл суміші EDTA (150 мМ), бичачого сироваткового альбуміну (BSA; 0,5 мг/мл) і Трис-hcl pН7,4 буфера (50 мМ), що містить p70 S6 Кіназу (T389) 1A5 моноклональне антитіло (Cell Signalling Technology, № каталогу 9206B) і додавали AlphaScreen стрептавідин-донорні й білок A акцепторні кульки (200 нг; Perkin Elmer, № каталогу 6760617 відповідно) і досліджувані планшети залишали протягом ночі при кімнатній температурі в темряві. Генеровані сигнали, отримані при порушенні лазерним світлом при 680 нм, аналізували за допомогою приладу Packard Envision. Фосфорилований біотинілований пептид утворювався in situ у результаті опосередкованого mTOR фосфорилування. Фосфорилований біотинілований пептид, який асоційований з AlphaScreen стрептавідин-донорними кульками, утворює комплекс із p70 S6 Кіназа (T389) 1A5 моноклональним антитілом, яке асоційовано з AlphaScreen білок A акцепторними кульками. При збудженні лазерним світлом при 680 нм, комплекс донорна кулька: акцепторна кулька генерує сигнал, який можна виміряти. Отже, наявність активності mTOR кінази приводить до аналізованого сигналу. У присутності інгібітора mTOR кінази, інтенсивність сигналу зменшується. Інгібування ферменту mTOR для даної тестованої сполуки виражали у вигляді значення IC50. Клітинний - фосфо-ser473 Akt аналіз У цьому дослідженні визначали здатність тестованих сполук інгібувати фосфорилування серину 473 в Akt, що оцінюється за допомогою методики Acumen Explorer (Acumen Bioscience Limited), планшет-рідера, який може застосовуватися для швидкого кількісного аналізу характерних властивостей зображень, отриманих шляхом лазерного сканування. Клітинну лінію аденокарциноми молочної залози людини MDA-MB-468 (LGC Promochem, Teddington, Мідлсекс, UK, кат. № HTB-132) підтримували, як прийнято, при 37 °C з 5 % CO2 аж до конфлюентності 70–90 % в DMEM, що містить 10 % інактивовану нагріванням фетальну телячу сироватку й 1 % L-глутамін. Для цього дослідження, клітини відокремлювали від культуральної колби за допомогою "Accutase" (Innovative Cell Technologies Inc., Сан-Дієго, CA, USA; кат. № AT104) за допомогою 4 стандартних методик культур тканини і ресуспендували в середовищі з одержанням 3.75 × 10 клітин/мл. Аліквоти (40 мкл) клітин висівали в кожну лунку чорного 384-лункового планшета (Greiner, кат. № 781091) з одержанням густини ~15000 клітин/лунку. Клітини інкубували впродовж ночі при 37 °C з 5 % CO2 для забезпечення можливості їх адгезії. В день 2, клітини обробляли тестованими сполуками і інкубували впродовж 2 годин при 37 °C з 5 % CO2. Тестовані сполуки підготовляли у вигляді 10 мМ вихідних розчинів в ДМСО. Дозування сполук виконували із застосуванням акустичної диспергуючої системи (Labcyte Echo® Liquid Handling Systems (Labcyte Inc. 1190 Боррегас-Авеню, Саннівейл, Каліфорнія 94089 США). Як контроль з мінімальною відповіддю кожний планшет містив лунки, що вміщають кінцеву концентрацію 100 мкm LY294002 (Calbiochem, Бістон, UK, кат. №. 440202). Як контроль з максимальною відповіддю лунки містили 1 % ДМСО замість тестованої сполуки. Після інкубування вміст планшетів фіксували шляхом обробки 1,6 % водним розчином формальдегіду (Sigma, Poole, Дорсет, UK, кат. № F1635) при кімнатній температурі протягом 1 години. Усі наступні етапи відсмоктування й промивання здійснювали за допомогою промивача лункового планшета Tecan (швидкість відсмоктування 10 мм/с). Фіксуючий розчин видаляли й вміст планшетів промивали забуференим фосфатом фізіологічним розчином (PBS; 80 мкл; Gibco, кат. № 10010015). Вміст планшетів обробляли протягом 10 хвилин при кімнатній температурі аліквотою (20 мкл) буфера для проникності клітин, що полягає із суміші PBS і 0,5 % Tween-20. "Проникаючий" буфер видаляли й неспецифічні зв'язувальні ділянки блокували шляхом обробки протягом 1 години при кімнатній температурі аліквотою (20 мкл) блокувального буфера, що складається з 5 % сухого сепарованого молока ["Marvel" (зареєстрована торговельна марка); Premier Beverages, Стаффорд, GB] у суміші PBS і 0,05 % Tween-20. "Блокувальний" буфер видаляли й клітини інкубували протягом 1 години при кімнатній температурі з розчином кролячого анти фосфо-akt (Ser473) антитіла (20 мкл на лунку; Cell Signalling, Hitchin, Хертц, U.K., кат. № 9277), який розводили 1:500 в "блокувальному" буфері. Клітини промивали три рази в суміші PBS і 0,05 % Tween-20. Після цього клітини інкубували 16 UA 109010 C2 5 10 15 протягом 1 години при кімнатній температурі з Alexafluor488 міченим козячим антикролячим Igg (20 мкл на лунку; Molecular Probes, Invitrogen Limited, Пейслі, UK, кат. № A11008), який розводили 1:500 в "блокувальному" буфері. Клітини 3 рази промивали сумішшю PBS і 0,05 % Tween-20. У кожну лунку додавали аліквоту PBS (50 мкл) і планшети запечатували чорними герметиками для планшет, визначали й аналізували флуоресцентний сигнал. Аналізували дані відповідної дозозалежної флуоресценції, отримані для кожної сполуки, і ступінь інгібування серину 473 в Akt виражали у вигляді значення IC50. Сполуки, які проявляють зменшену активність по відношенню mTOR, можуть поліпшувати цільові ефекти. Незважаючи на те, що фармакологічні властивості сполук формули (I), як очікувалося, відрізняються у зв'язку зі структурними відмінностями, у цілому, вважають, що активність, яка проявляється сполуками формули (I), може бути продемонстрована в наступних концентраціях або дозах в одному або декількох з вищевказаних дослідів (a) - (d):Дослід (a):- IC50 відносно ATR кінази менше, ніж 10 мкM, зокрема 0,001 - 1 мкM для багатьох сполук. Наступні приклади тестували в ферментному аналізі, Дослід (a): Приклад ATR середнє IC50 мкM 1.01 2.02 2.03 0.03403 0.003747 0.004864 ATR кількість індивідуальних тестів 3 3 3 Наступний Приклад тестували в клітинному SRB аналізі, Дослід (d) 20 Клітина HT29 HT29 HT29 25 30 35 40 45 Лікування Карбоплатин Карбоплатин + 0.3 мкM Приклад 2.03 Карбоплатин + 0.1 мкM Приклад 2.03 Кількість індивідуальних тестів 2 IC50 мкг/мл С.О. 11.75 1.24 2 0.63 0.06 18.77 2 2.00 0.27 5.88 PF50 Примітка: середні позначає середні геометричні значення. Сполуки можуть додатково відбиратися на основі їх додаткових біологічних або фізичних властивостей, які можуть бути виміряні за допомогою технік, відомих у даній галузі, і які можна використовуватися для оцінки або відбору сполук для терапевтичного або профілактичного застосування. Сполуки згідно із даним винаходом є сприятливими, оскільки вони проявляють фармакологічну активність. Зокрема, сполуки згідно із даним винаходом модулюють ATR кіназу. Інгібуючі властивості сполук формули (I) можна продемонструвати за допомогою дослідних методик, наведених у даній заявці, і в експериментальному розділі. Таким чином, сполуки формули (I) можуть використовуватися для лікування (терапевтичного або профілактичного) станів /захворювань у людей і тварин, що відрізняються від людини, які опосередковуються ATR кіназою. Винахід також забезпечує фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль, як визначено в даній заявці, у комбінації з фармацевтично прийнятним розріджувачем або носієм. Композиції за винаходом можуть знаходитися у формах, які підходять для перорального застосування (наприклад, у вигляді таблеток, коржів, твердих або м'яких капсул, водних або масляних суспензій, емульсій, диспергованих порошків або гранул, сиропів або еліксирів), для місцевого введення (наприклад, у вигляді кремів, мазей, гелів, водних або масляних розчинів або суспензій), для введення шляхом інгаляції (наприклад, у вигляді тонкоподрібненого порошку або рідкого аерозолю), для введення шляхом вдування (наприклад, у вигляді тонкоподрібненого порошку), або для парентерального введення (наприклад, у вигляді стерильного водного або масляного розчину для внутрішньовенного, підшкірного, внутрішньоочеревинного або внутрішньом'язового введення, або у вигляді супозиторію для ректального введення). Композиції за винаходом можуть бути отримані звичайними способами при використанні звичайних фармацевтичних наповнювачів, добре відомих у даній галузі. Tаким чином, 17 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 композиції, призначені для перорального введення, можуть містити, наприклад, один або декілька барвників, підсолоджувачів, ароматизаторів і/або консервантів. Кількість активного компонента, яка необхідна для одержання одиничної лікарської форми в комбінації з одним або декількома наповнювачами, головним чином залежить від організму, який піддається лікуванню, і конкретного шляху введення. Наприклад, лікарська форма, призначена для перорального введення людині, як правило, містить, наприклад, від 1 мг до 1 г активної речовини (більш переважно від 1 до 250 мг, наприклад, від 1 до 100 мг) у комбінації з підходящою й прийнятною кількістю наповнювачів, яка може змінюватися від приблизно 5 до приблизно 98 % від загальної маси композиції. Доза сполуки формули (I) для лікування або профілактики звичайно змінюється залежно від природи й тяжкості хворобливого стану, віку й статі тварини або людини, і шляхи введення, і визначається відповідно до добре відомих підходів у медицині. Сполуку формули (I), яка застосовується для лікування або профілактики, звичайно вводиться в добовій дозі в інтервалі, наприклад, від 1 мг/кг до 100 мг/кг ваги тіла пацієнта, і, при необхідності, може бути розділена на декілька прийомів. У цілому, при парентеральному введенні застосовуються більш низькі дози. Так, наприклад, для внутрішньовенного введення звичайно застосовують дозу в інтервалі, наприклад, від 1 мг/кг до 25 мг/кг ваги тіла. Подібним чином, для введення шляхом інгаляції застосовується доза в інтервалі, наприклад, від 1 мг/кг до 25 мг/кг ваги. Звичайно, стандартна лікарська доза містить приблизно від 10 мг до 0,5 г сполуки згідно із даним винаходом. Як вказується в даній заявці, відомо, що ATR кіназа бере участь в утворенні пухлин, а також у різних інших захворюваннях. Нами було виявлено, що сполуки формули (I) мають ефективну протипухлинну дію, яку, як вважають, одержують шляхом інгібування ATR кінази. Таким чином, сполуки згідно із даним винаходом є цінними як протипухлинні засоби. Зокрема, сполуки згідно із даним винаходом є цінними як антипроліферативні, апоптотичні і/або анти-інвазивні засоби для стримування поширення та/або лікування сóлідного та/або рідкого пухлинного захворювання. Переважно, сполуки згідно із даним винаходом, як очікують, є придатними для запобігання або лікування тих пухлин, які чутливі до інгібування ATR. Крім того, сполуки згідно із даним винаходом, як очікують, є придатними для запобігання або лікування тих пухлин, які опосередковують тільки або частково за допомогою ATR. Отже, сполуки можуть застосовуватися для одержання інгібуючої дії по відношенню до ATR ферменту в теплокровної тварини, яка потребує такого лікування. Як вказано в даній заявці, інгібітори ATR кінази повинні бути терапевтично цінними для лікування проліферативного захворювання, такого як злоякісне новоутворення, і, зокрема, сóлідних пухлин, таких як карцинома й саркоми й лейкозів і лімфолейкозів і зокрема, для лікування, наприклад, раку молочної залози, ободової і прямої кишки, легені (включаючи дрібноклітинний рак легені, не-дрібноклітинний рак легені й бронхоальвеолярний рак) і передміхурової залози, і раку жовчних проток, кістки, сечового міхура, голови й шиї, нирок, печінки, шлунково-кишкової тканини, стравоходу, яєчника, підшлункової залози, шкіри, яєчок, щитовидної залози, матки, шийки матки й зовнішніх жіночих статевих органів, і лейкозів [включаючи гострий лімфоїдний лейкоз (ГЛЛ) і хронічний мієлоїдний лейкоз (ХМЛ)], множинної мієломи й лімфом. Протиракові дії, які в такий спосіб придатні для лікування злоякісного новоутворення в пацієнта, включають, але не обмежуючись тільки ними, протипухлинні дії, швидкість відповіді, час до прогресування захворювання й коефіцієнт виживаності. Протипухлинні дії способу лікування згідно із даним винаходом включають, але не обмежуючись тільки ними, інгібування росту пухлини, затримку росту пухлини, регресію пухлини, зменшення пухлини, збільшення часу до повторного росту пухлини при припиненні лікування, уповільнення прогресування захворювання. Протиракові дії включають профілактичне лікування, а також лікування існуючого захворювання. Інгібітор ATR кінази, або його фармацевтично прийнятна сіль також можуть бути придатними для лікування пацієнтів зі злоякісними новоутвореннями, включаючи, але не обмежуючись тільки ними, гематологічні злоякісні пухлини, такі як лейкоз, множинна мієлома, лімфоми, такі як хвороба Ходжкіна, не-ходжкінські лімфоми (включаючи лімфому із клітин зони мантії), і мієлодиспластичні синдроми, а також сóлідні пухлини і їх метастази, такі як рак молочної залози, рак легенів (не-дрібноклітинний рак легені (NSCL), дрібноклітинний рак легені (SCLC), плоскоклітинний рак), рак ендометрію, пухлини центральної нервової системи, такі як гліоми, дизембріопластична нейроепітеліальна пухлина, мультиформна гліобластома, змішані гліоми, медулобластома, ретинобластома, нейробластома, гермінома й тератома, злоякісні новоутворення шлунково-кишкового тракту, такі як рак шлунка, рак стравоходу, 18 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 печінковоклітинний (печінки) рак, холангіокарциноми, рак ободової і товстої кишки, злоякісні новоутворення тонкого кишечнику, рак підшлункової залози, рак шкіри, такий як меланоми (зокрема метастатична меланома), рак щитовидної залози, злоякісні новоутворення голови й шиї й злоякісні новоутворення слинних залоз, передміхурової залози, яєчок, яєчників, шийки матки, матки, зовнішніх жіночих статевих органів, сечового міхура, нирки (включаючи нирковоклітинний рак, світло-клітинна й ниркова онкоцитома), плоскоклітинний рак, саркоми, такі як остеогенна саркома, хондросаркома, лейоміосаркома, саркома м'яких тканин, саркома Юінга, шлунково-кишкова стромальна пухлина (GIST), саркома Капоши, і злоякісні новоутворення в дітей, такі як рабдоміосаркоми й нейробластоми. Сполуки відповідно до даного винаходу й способи лікування, які включають введення або застосування інгібітора ATR кінази, або її фармацевтично прийнятної солі, є надзвичайно придатними, як очікують, для лікування пацієнтів з раком легенів, раком передміхурової залози, меланомою, раком яєчників, раком молочної залози, раком ендометрію, раком нирок, раком шлунка, саркомами, раком голови й шиї, пухлинами центральної нервової системи і їх метастазами, а також для лікування пацієнтів з гострим мієлолейкозом. Відповідно до подальшого аспекту винаходу забезпечується сполука формули (I), або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування як лікарський засіб в теплокровної тварини, такої як людина. Відповідно до подальшого аспекту винаходу, забезпечується сполука формули (I), або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування для одержання антипроліферативної дії в теплокровної тварини, такої як людина. Відповідно до подальшого аспекту винаходу, забезпечується сполука формули (I), або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування для одержання апоптотичної дії в теплокровної тварини, такої як людина. Відповідно до подальшого варіанта здійснення винаходу забезпечується сполука формули (I), або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування в теплокровної тварини, такої як людина, як антиінвазивний засіб для стримування поширення та/або лікування проліферативного захворювання, такого як злоякісне новоутворення. Відповідно до подальшого аспекту винаходу, забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для одержання антипроліферативної дії в теплокровної тварини, такої як людина. Відповідно до подальшого варіанта цього аспекту здійснення винаходу, забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування для одержання антипроліферативної дії в теплокровної тварини, такої як людина. Відповідно до подальшого аспекту винаходу, забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для одержання апоптотичної дії в теплокровної тварини, такої як людина. Відповідно до подальшого варіанта цього аспекту здійснення винаходу, забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування для одержання апоптотичної дії в теплокровної тварини, такої як людина. Відповідно до подальшого варіанта здійснення винаходу забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування в теплокровної тварини, такої як людина, як антиінвазивний засіб для стримування поширення та/або лікування проліферативного захворювання, такого як злоякісне новоутворення. Відповідно до подальшого варіанта цього аспекту здійснення винаходу, забезпечується спосіб одержання антипроліферативної дії в теплокровної тварини, такої як людина, яка потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, як визначено в даній заявці. Відповідно до подальшого варіанта цього аспекту здійснення винаходу, забезпечується спосіб одержання антиінвазивної дії шляхом стримування поширення та/або лікування сóлідного пухлинного захворювання в теплокровної тварини, такої як людина, яка потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, як визначено в даній заявці. Відповідно до подальшого аспекту винаходу забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування для запобігання або лікування проліферативного захворювання, такого як злоякісне новоутворення, у теплокровної тварини, такої як людина. 19 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до подальшого варіанта цього аспекту здійснення винаходу, забезпечується спосіб запобігання або лікування проліферативного захворювання, такого як злоякісне новоутворення, у теплокровної тварини, такої як людина, яка потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, як визначено в даній заявці. Відповідно до подальшого аспекту винаходу забезпечується сполука формули (I), або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування для запобігання або лікування тих пухлин, які чутливі до інгібування ATR кінази. Відповідно до подальшого варіанта цього аспекту здійснення винаходу, забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування для запобігання або лікування тих пухлин, які чутливі до інгібування ATR кінази. Відповідно до подальшого варіанта цього аспекту здійснення винаходу, забезпечується спосіб запобігання або лікування тих пухлин, які чутливі до інгібування ATR кінази, який включає введення вказаній тварині ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, як визначено в даній заявці. Відповідно до подальшого аспекту винаходу забезпечується сполука формули (I), або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування для забезпечення інгібуючої дії по відношенню до ATR кінази. Відповідно до подальшого варіанта цього аспекту здійснення винаходу, забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування для забезпечення інгібуючої дії по відношенню до ATR кінази. Відповідно до подальшого аспекту винаходу також забезпечується a спосіб забезпечення інгібуючої дії по відношенню до ATR кінази, який включає введення ефективної кількості сполуки формули I, або її фармацевтично прийнятної солі, як визначено в даній заявці. Відповідно до подальшого варіанта здійснення винаходу забезпечується сполука формули I, або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування для лікування злоякісного новоутворення, запальних захворювань, обструктивних захворювань дихальних шляхів, імунних захворювань або серцево-судинних захворювань. Відповідно до подальшого варіанта здійснення винаходу забезпечується сполука формули I, або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування для лікування сóлідних пухлин, таких як карциноми й саркоми, і лейкозів і лімфолейкозів. Відповідно до подальшого варіанта здійснення винаходу забезпечується сполука формули I, або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування для лікування раку молочної залози, ободової і прямої кишки, легені (включаючи дрібноклітинний рак легені, не-дрібноклітинний рак легені й бронхоальвеолярний рак) і передміхурової залози. Відповідно до подальшого варіанта здійснення винаходу забезпечується сполука формули (I), або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування для лікування раку жовчних проток, кістки, сечового міхура, голови й шиї, нирок, печінки, шлунковокишкової тканини, стравоходу, яєчника, підшлункової залози, шкіри, яєчок, щитовидної залози, матки, шийки матки й зовнішніх жіночих статевих органів, і лейкозів (включаючи ГЛЛ і ХМЛ), множинної мієломи й лімфом. Відповідно до подальшого варіанта здійснення винаходу забезпечується сполука формули (I), або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування для лікування раку жовчних проток, кістки, сечового міхура, голови й шиї, нирок, печінки, шлунковокишкової тканини, стравоходу, яєчника, ендометрію, підшлункової залози, шкіри, яєчок, щитовидної залози, матки, шийки матки й зовнішніх жіночих статевих органів, і лейкозів (включаючи ГЛЛ і ХМЛ), множинної мієломи й лімфом. Відповідно до подальшого варіанта здійснення винаходу забезпечується сполука формули (I), або її фармацевтично прийнятна сіль, як визначено в даній заявці, для застосування для лікування раку легенів, раку передміхурової залози, меланоми, раку яєчників, раку молочної залози, раку ендометрію, раку нирки, раку шлунка, сарком, раку голови й шиї, пухлин центральної нервової системи і їх метастаз, а також для лікування гострого мієлоїдного лейкозу. Відповідно до подальшого варіанта здійснення винаходу забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування для лікування злоякісного новоутворення, запальних захворювань, обструктивних захворювань дихальних шляхів, імунних захворювань або серцево-судинних захворювань. 20 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до подальшого варіанта здійснення винаходу забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування для лікування сóлідних пухлин, таких як карциноми й саркоми, і лейкозів і лімфолейкозів. Відповідно до подальшого варіанта здійснення винаходу забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування для лікування раку молочної залози, ободової і прямої кишки, легені (включаючи дрібноклітинний рак легені, не-дрібноклітинний рак легені й бронхоальвеолярний рак) і передміхурової залози. Відповідно до подальшого варіанта здійснення винаходу забезпечується застосування сполукиформули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування для лікування раку жовчних проток, кістки, сечового міхура, голови й шиї, нирок, печінки, шлунково-кишкової тканини, стравоходу, яєчника, підшлункової залози, шкіри, яєчок, щитовидної залози, матки, шийки матки й зовнішніх жіночих статевих органів, і лейкозів (включаючи ГЛЛ і ХМЛ), множинної мієломи й лімфом. Відповідно до подальшого варіанта здійснення винаходу забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, як визначено в даній заявці, для приготування лікарського засобу для застосування для лікування раку легенів, раку передміхурової залози, меланоми, раку яєчників, раку молочної залози, раку ендометрію, раку нирки, раку шлунка, сарком, раку голови й шиї, пухлин центральної нервової системи і їх метастаз, а також для лікування гострого мієлоїдного лейкозу. Відповідно до подальшого варіанта здійснення винаходу забезпечується спосіб лікування злоякісного новоутворення, запальних захворювань, обструктивних захворювань дихальних шляхів, імунних захворювань або серцево-судинних захворювань у теплокровної тварини, такої як людина, яка потребує такого лікування, який включає введення ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, як визначено в даній заявці. Відповідно до подальшого варіанта здійснення винаходу забезпечується спосіб лікування сóлідних пухлин, таких як карциноми й саркоми, і лейкозів і лімфолейкозів у теплокровної тварини, такої як людина, яка потребує такого лікування, який включає введення ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, як визначено в даній заявці. Відповідно до подальшого варіанта здійснення винаходу забезпечується спосіб лікування раку молочної залози, ободової і прямої кишки, легені (включаючи дрібноклітинний рак легені, не-дрібноклітинний рак легені й бронхоальвеолярний рак) і передміхурової залози в теплокровної тварини, такої як людина, яка потребує такого лікування, який включає введення ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, як визначено в даній заявці. Відповідно до подальшого варіанта здійснення винаходу забезпечується спосіб лікування раку жовчних проток, кістки, сечового міхура, голови й шиї, нирок, печінки, шлунково-кишкової тканини, стравоходу, яєчника, підшлункової залози, шкіри, яєчок, щитовидної залози, матки, шийки матки й зовнішніх жіночих статевих органів, і лейкозів (включаючи ГЛЛ і ХМЛ), множинної мієломи й лімфом у теплокровної тварини, такої як людина, яка потребує такого лікування, який включає введення ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, як визначено в даній заявці. Відповідно до подальшого варіанта здійснення винаходу забезпечується спосіб лікування раку легені, раку передміхурової залози, меланоми, раку яєчників, раку молочної залози, раку ендометрію, раку нирки, раку шлунка, сарком, раку голови й шиї, пухлин центральної нервової системи і їх метастаз, і гострого мієлоїдного лейкозу, у теплокровної тварини, такої як людина, яка потребує такого лікування, який включає введення ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, як визначено в даній заявці. Як вказано в даній заявці, на дії сполуки формули (I) в умовах in vivo можуть виявляти часткові впливи один або декілька метаболітів, які утворюються в організмі людини або тварину після введення сполуки формули (I). Винахід надалі стосується комбінованих терапій, у яких сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтичну композицію або препарат, що містить сполуку формули (I), вводять одночасно або послідовно або у вигляді комбінованого препарату з іншим лікуванням, застосовуваним для контролю онкологічного захворювання. Зокрема, лікування, розкрите в даній заявці, може застосовуватися у вигляді монотерапії або, додатково до сполук згідно із даним винаходом, можна застосовувати загальноприйняті хірургічні методи або радіотерапію або хіміотерапію. Таким чином, сполуки згідно із даним 21 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходом також можна використовувати в комбінації з існуючими терапевтичними засобами для лікування злоякісного новоутворення. Такі засоби, використовувані в комбінації, включають: (i) антипроліферативні/протипухлинні лікарські засоби і їх комбінації, які застосовуються в онкології, такі як алкілуючі засоби (наприклад, цис-платин, карбоплатин, циклофосфамід, азотний іприт, мельфалан, хлорамбуцил, бусульфан і нітрозосечовини); антиметаболіти (наприклад, антифолати, такі як фторпіримідини, такі як 5-фторурацил і тегафур, ралтитрексед, метотрексат, арабінозид цитозину, гідроксисечовина й гемцитабін); протипухлинні антибіотики (наприклад, антрацикліни, такі як адріаміцин, блеоміцин, доксорубіцин, дауноміцин, епірубіцин, ідарубіцин, мітоміцин-c, дактиноміцин і мітраміцин); антимітотичні засоби (наприклад, алкалоїди барвінку, такі як вінкристин, вінбластин, віндезин і вінорелбін і таксоїди, такі як паклітаксел і таксотер); і інгібітори топоізомерази (наприклад, епіподофілотоксини, такі етопозид і теніпозид, амсакрин, топотекан і камфотецин); (ii) цитостатичні засоби, такі як антиестрогени (наприклад, тамоксифен, тореміфен, ралоксифен, дролоксифен і йодоксифен), інгібітори рецептори естрогену (наприклад, фульвестрант), антиандрогени (наприклад, бікалутамід, флутамід, нілутамід і ципротерон ацетат), антагоністи LHRH або агоністи LHRH (наприклад, гозерелін, лейпрорелін і бузерелін), прогестогени (наприклад, мегестрол ацетат), інгібітори ароматази (наприклад, анастрозол, летрозол, воразол і ексеместан) і інгібітори 5α-редуктази, такі як фінастерид; (iii) антиінвазивні засоби (наприклад, інгібітори сімейства c-src кінази, такі як 4-(6-хлор-2,3метилендіоксіаніліно)-7-[2-(4-метилпіперазин-1-іл)етокси]-5-тетрагідропіран-4-ілоксихіназолін (AZD0530; міжнародна патентна заявка WO 01/94341) і N-(2-хлор-6-метилфеніл)-2-{6-[4-(2гідроксіетил)піперазин-1-іл]-2-метилпіримідин-4-іламіно}тіазол-5-карбоксамід (дазатиніб, BMS354825; J. Med. Chem., 2004, 47, 6658-6661), і інгібітори металопротеїнази, такі як маримастат, і інгібітори функції рецептора урокіназного активатора плазміногену); (iv) інгібітори дії фактора росту: наприклад, такі інгібітори включають антитіла до фактора росту й антитіла до рецептора фактора росту (наприклад, анти-erbB2 антитіло трастузумаб [Herceptin™] і анти-erbB1 антитіло цетуксимаб [C225]); такі інгібітори також включають, наприклад, інгібітори тирозинкінази, наприклад, інгібітори сімейства фактора росту епідермісу (наприклад, інгібітори EGFR сімейства тирозинкінази, такі як N-(3-хлор-4-фторфеніл)-7-метокси6-(3-морфолінопропокси)хіназолін-4-амін (гефітиніб, ZD1839), N-(3-етинілфеніл)-6,7-біс(2метоксіетокси)хіназолін-4-амін (ерлотиніб, OSI-774) і 6-акриламідо-N-(3-хлор-4-фторфеніл)-7-(3морфолінопропокси)хіназолін-4-амін (CI 1033) і інгібітори erbb2 тирозинкінази, такі як лапатиніб), інгібітори сімейства фактора росту гепатоцитів, інгібітори сімейства фактора росту похідних тромбоцитів, такі як іматиніб, інгібітори серин/треонін кінази (наприклад, інгібітори Ras/Raf передачі сигналів, такі як інгібітори фарнезилтрансферази, наприклад, сорафеніб (BAY 439006)), і інгібітори передачі сигналів у клітинах за допомогою MEK і/або Akt кіназ; (v) антиангіогенні речовини, такі як ті, які інгібують дію фактора росту ендотелію судин, [наприклад, антитіло до фактора росту клітин ендотелію судин бевацизумаб (Avastin™) і інгібітори VEGF рецепторної тирозинкінази, такі як 4-(4-бром-2-фтораніліно)-6-метокси-7-(1метилпіперидин-4-ілметокси)хіназолін (ZD6474; приклад 2 у заявці WO 01/32651), 4-(4-фтор-2метиліндол-5-ілокси)-6-метокси-7-(3-піролідин-1-ілпропокси)хіназолін (AZD2171; приклад 240 у заявці WO 00/47212), ваталаніб (PTK787; WO 98/35985) і SU11248 (сунітиніб; WO 01/60814), і сполуки, які діють за іншим механізмом (наприклад, ліномід, інгібітори дії інтегрину αvβ3 і ангіостатин)]; (vi) речовини, які пошкоджують судини, такі як комбретастатин A4 і сполуки, описані в міжнародних заявках на патент WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 і WO 02/08213; (vii) антисмислова терапія, наприклад, яка спрямована на мішені, перераховані вище, такі як ISIS 2503, антисмисловий засіб проти гена ras; (vii) способи генної терапії, включаючи способи заміни аберантних генів, такі як способи аберації p53 або аберації BRCA1 або BRCA2, GDEPT (пролікарська терапія, спрямована на ген ферменту), способи з використанням деамінази цитозину, тімідинкінази або бактеріальної нітроредуктази й способи підвищення стійкості пацієнта до хіміотерапії або радіотерапії, такі як генна терапія резистентності до багатьох лікарських засобів; і (ix) імунотерапевтичні підходи, включаючи, способи підвищення імуногенності пухлинних клітин пацієнта в умовах ex vivo і in vivo, такі як трансфекція цитокінами, такими як інтерлейкін 2, інтерлейкін 4 або фактор стимуляції колоній гранулоцитів-макрофагів, способи зниження активності T-клітин, способи з використанням трансфектованих імунних клітин, таких як цитокінтрансфектовані дендритні клітини, способи з використанням цитокін-трансфектованих ліній 22 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 пухлинних клітин і способи з використанням анти-ідіотипічних антитіл. Відповідно до подальшого аспекту винаходу забезпечується застосування сполуки формули (I), або її фармацевтично прийнятної солі, для приготування лікарського засобу для застосування як допоміжного засобу при лікуванні злоякісного новоутворення або для потенціювання пухлинних клітин для лікування за допомогою іонізуючої радіації або хіміотерапевтичних засобів Відповідно до іншого аспекту винаходу, забезпечується сполука формули (I), або її фармацевтично прийнятна сіль, у комбінації з іонізуючою радіацією або хіміотерапевтичними засобами, для застосування для лікування злоякісного новоутворення. Далі винахід пояснюється з посиланням на наступні ілюстративні приклади Якщо спеціально не вказано інакше, то вихідні речовини були комерційно доступними. Усі розчинники й комерційно доступні реагенти були "чистими для аналізу" і їх застосовували в отриманому вигляді. Загальні експерименти Далі винахід ілюструється за допомогою наступних прикладів, у яких, у цілому: (i) дії здійснювали при кімнатній температурі (КT), тобто в інтервалі від 17 до 25C і в атмосфері інертного газу, такого як N2 або Ar, якщо спеціально не вказано інакше; (ii) у цілому, за здійсненням реакцій спостерігали за допомогою тонкошарової хроматографії (TШХ) і/або аналітичної високоефективної рідинної хроматографії (ВЕРХ), яка звичайно зв'язана з мас-спектрометром (РХМС). Час реакцій, який вказаний, не є неодмінно мінімально досяжним; (iii) при необхідності, органічні розчини висушували над безводним MgSO 4 або Na2SO4, процедури обробки здійснювали за допомогою традиційних методик розділення фаз або шляхом застосування SCX, як описано в (xiii), упарювання здійснювали або за допомогою роторного упарювання у вакуумі або в Genevac HT-4 / EZ-2 або Biotage V10; (iv) виходи, якщо представлені, не є обов'язково максимально досяжними, і при необхідності, реакції повторювали, якщо необхідна більша кількість продукту реакції; (v) у цілому, структуру кінцевих продуктів формули (I) підтверджували за допомогою ядерного магнітного резонансу (ЯМР) і/або мас-спектральних технік; дані електророзпилювального мас-спектру одержували, використовуючи Waters ZMD або Waters ZQ ЖХ/мас-спектрометр, що визначає як дані позитивних іонів, так і негативних іонів, і в цілому, тільки іони, що стосуються вихідної структури, представлені; значення протонного ЯМР хімічного зсуву вимірювали на дельта-шкалі, використовуючи або Bruker DPX300 спектрометр, що працює при напруженості поля 300 МГц, Bruker DRX400, що працює при 400 МГц, Bruker DRX500, що працює при 500 МГц, або Bruker AV700, що працює при 700 Мгц. Якщо спеціально 6 не вказано інакше, ЯМР спектри одержували при 400 МГц в d -диметилсульфоксиді. Використовували наступні скорочення: s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет; br, широкий; qn, квінтет; (vi) Якщо спеціально не вказано інакше, сполуки, що містять асиметричний атом вуглецю та/або сірки, не розділяли; (vii) Проміжні сполуки необов'язково повністю очищати, але їх структури і чистоту оцінювали за допомогою ТСХ, аналітичної ВЕРХ, та/або Ямр-аналізу та/або мас-спектрометрії; (viii) якщо спеціально не вказано інакше, колонкову флеш-хроматографію (FCC) здійснювали діоксиді кремнію Merck Kieselgel (арт. 9385) або на картриджах Silicycle (40-63 мкм діоксиду кремнію, вага 4-330 г) або на картриджах Grace resolv (4 – 120 г) або вручну або автоматизоване, використовуючи систему Isco Combi Flash Companion або подібну систему; (ix) Препаративну ВЕРХ із оберненою фазою (ОФ ВЕРХ) здійснювали на діоксиді кремнію із оберненою фазою C18, наприклад, на препаративній колонці із оберненою фазою Waters "Xterra" або "Xbridge" (5 мкм діоксиду кремнію, діаметр 19 мм, довжина 100 мм) або на препаративній колонці із оберненою фазою Phenomenex "Gemini" або "AXIA" (5 мкм діоксиду кремнію, 110A, діаметр 21,1 мм, довжина 100 мм), використовуючи суміші із знижуваною полярністю як елюент, наприклад [що містять 0.1-5 % мурашину кислоту або 1-5 % водний гідроксид амонію (d=0,88)] як розчинник A і ацетонітрил як розчинник B або MeОН: MeCN 3:1; звичайна процедура може бути представлена в такий спосіб: градієнт розчинника протягом 9,5 хвилин, при 25 мл за хвилину, від 85:15 (або альтернативне співвідношення, якщо це є підходящим) суміші розчинників A і B відповідно до 5:95 суміші розчинників A і B; (x) використовували наступні методи аналітичної ВЕРХ; як правило, використовували діоксид кремнію із оберненою фазою при швидкості потоку приблизно 1 мл / хвилину й виявлення здійснювали шляхом електророзпилювальної мас-спектрометрії й шляхом Уфабсорбції при довжині хвилі 254 нм. Аналітичну ВЕРХ здійснювали на діоксиді кремнію із оберненою фазою C18, на препаративній колонці із оберненою фазою Phenomenex "Gemini" (5 23 UA 109010 C2 5 10 15 мкм діоксид кремнію, 110 A, діаметр 2 мм, довжина 50 мм), використовуючи суміші із знижуваною полярністю як елюент, наприклад, суміші із знижуваною полярністю води (що містять 0,1 % мурашину кислоту або 0,1 % аміак) як розчинник A і ацетонітрил як розчинник B або MeОН: MeCN 3:1. Звичайний метод аналітичної ВЕРХ може бути представлений у такий спосіб: градієнт розчинника протягом 4 хвилин, при приблизно 1 мл за хвилину, від 95:5 суміші розчинників A і B відповідно до 5:95 суміші розчинників A і B; (xi) Якщо певні сполуки одержували у вигляді солі приєднання кислоти, наприклад, моногідрохлоридної солі або ди-гідрохлоридної солі, то стехіометрія солі ґрунтується на кількості й природі лужних груп у сполуці, точну стехіометрію солі звичайно не визначали, наприклад, за допомогою даних елементного аналізу; (xii) Якщо в реакціях вказано на застосування мікрохвиль, то використовували один з наступних реакторів: Biotage Initiator, Personal Chemistry Emrys Optimizer, Personal Chemistry Smithcreator або CEM Explorer; (xiii) Сполуки очищали за допомогою сильної катіонообмінної хроматографії (SCX), використовуючи Isolute SPE флеш SCX-2 колонку (International Sorbent Technology Limited, Mid Glamorgan, UK); (xiv) Додатково до вищевказаних скорочень, використовували наступні скорочення: ДМФА ДХМ конц. N, N-диметилформамід дихлорметан концентрований фторид тетра бутиламонію етилацетат 1,2-диметоксіетан ацетонітрил діетиловий ефір оцтовий ангідрид година(-и) TBAF EtOAc DME MeCN Et2O Ac2O год. 20 DMA ТГФ m/z NMP 1-метилпіролідин-2-он DIPEA MeOH TBAB DBU DMAP EtOH н N, N-диметилацетамід тетрагідрофуран пік(-и) мас-спектрометрії N, N-діізопропілетиламін метанол бромід тетра н-бутиламонію 1,8-діазабіцикло[5.4.0]ундец-7-ен 4-диметиламінопіридин етанол Приклад 1.01 4-{4-[(3R)-3-Метилморфолін-4-іл]-6-[(R)-(S-метилсульфонімідоїл)метил]піримідин-2-іл}-1Hпіроло[2,3-b]піридин O N HN N O S NH N N 25 30 35 40 (R)-3-Метил-4-(6-((R)-S-метилсульфонімідоїлметил)-2-(1-тозил-1H-піроло[2,3-b]піридин-4іл)піримідин-4-іл)морфолін (98 мг, 0.18 ммоль) розчиняли в MeOH (10 мл) і ДХМ (10 мл) і нагрівали до 50 °C. Потім додавали 2M водний розчин гідроксиду натрію (0.159 мл, 0.32 ммоль) і нагрівання продовжували впродовж 5 годин. Реакційну суміш упарювали і залишок розчиняли в суміші DME:вода:MeCN 2:1:1 (4 мл) і потім очищали за допомогою препаративної ВЕРХ, використовуючи суміші з полярнісю, що знижується, води (що містить 1 % NH3) і MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали і залишок розтирали з Et 2O (1 мл) з 1 одержанням зазначеної у заголовку сполуки (34.6 мг, 49 %); H ЯМР (400 МГц, CDCl3) 1.40 (3H, d), 3.17 (3H, s), 3.39 (1H, tt), 3.62 (1H, td), 3.77 (1H, dd), 3.85 (1H, d), 4.08 (1H, dd), 4.18 (1H, d), 4.37-4.48 (2H, q), 4.51 (1H, s), 6.59 (1H, s), 7.35 (1H, t), 7.46 (1H, d), 8.06 (1H, d), 8.42 (1H, d), + 10.16 (1H, s); m/z: (ES+) MH , 387.19. (R)-3-Метил-4-(6-((R)-S-метилсульфонімідоїлметил)-2-(1-тозил-1H-піроло[2,3-b]піридин-4іл)піримідин-4-іл)морфолін, використовуваний як вихідна речовина, може бути одержаний наступним чином: a) (R)-3-метилморфолін (7.18 г, 71.01 ммоль) і триетиламін (12.87 мл, 92.31 ммоль) додавали до метил 2,4-дихлорпіримідин-6-карбоксилату (14.70 г, 71.01 ммоль) в ДХМ (100 мл). Одержувану суміш перемішували при КТ впродовж 18 годин. Додавали воду (100 мл), шари розділяли і екстрагували за допомогою ДХМ (3 × 75 мл). Об'єднану органіку сушили над MgSO 4, 24 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 концентрували в вакуумі і залишок розтирали з Et2O з одержанням (R)-метил 2-хлор-6-(31 метилморфоліно)піримідин-4-карбоксилату (14.77 г, 77 %); H ЯМР (400 МГц, CDCl3) 1.35 (3H, d), 3.34 (1H, td), 3.55 (1H, td), 3.70 (1H, dd), 3.81 (1H, d), 3.97 (3H, s), 4.03 (1H, dd), 4.12 (1H, br s), + 4.37 (1H, br s), 7.15 (1H, s); m/z: (ESI+) MH , 272.43. Рідини концентрували на силікагелі і очищали за допомогою хроматографії на силікагелі, елююючи градієнтом 20-40 % EtOAc в ізогексані. Фракції, що містять продукт, поєднували і упарювали з одержанням (R)-метил 2-хлор-6-(3-метилморфоліно)піримідин-4-карбоксилату 1 (1.659 г, 9 %); H ЯМР (400 МГц, CDCl3) 1.35 (3H, d), 3.33 (1H, td), 3.55 (1H, td), 3.69 (1H, dd), 3.80 + (1H, d), 3.97 (3H, s), 4.03 (1H, dd), 4.12 (1H, br s), 4.36 (1H, br s), 7.15 (1H, s); m/z: (ESI+) MH , 272.43. b) Борогідрид літію, 2M в ТГФ (18 мл, 36.00 ммоль), при 0 °C впродовж 20 хвилин під азотом по краплям додавали до (R)-метил 2-хлор-6-(3-метилморфоліно)піримідин-4-карбоксилату (16.28 г, 59.92 ммоль) в ТГФ (200 мл). Одержуваний розчин перемішували при 0 °C впродовж 30 хвилин і потім дозволяли йому нагрітися до КТ і перемішували впродовж додаткових 18 годин. Додавали воду (200 мл) і ТГФ упарювали. Водний шар екстрагували за допомогою EtOAc (2 × 100 мл) і органічні фази поєднували, сушили над MgSO 4 і потім упарювали з одержанням (R)-(2хлор-6-(3-метилморфоліно)піримідин-4-іл)метанолу (14.54 г, 100 %), який використовували на 1 наступній стадії без очищення; H ЯМР (400 МГц, CDCl3) 1.32 (3H, d), 2.65 (1H, br s), 3.25-3.32 (1H, m), 3.51-3.57 (1H, m), 3.67-3.70 (1H, m), 3.78 (1H, d), 3.98-4.09 (2H, m), 4.32 (1H, br s), 4.59 + (2H, s), 6.44 (1H, s); m/z: (ESI+) MH , 244.40. c) Метансульфонілхлорид (4.62 мл, 59.67 ммоль) при 25 ºC впродовж 5 хвилин по краплям додавали до (R)-(2-хлор-6-(3-метилморфоліно)піримідин-4-іл)метанолу (14.54 г, 59.67 ммоль) і триетиламіну (8.32 мл, 59.67 ммоль) в ДХМ (250 мл). Одержуваний розчин перемішували при 25 °C впродовж 90 хвилин. Реакційну суміш гасили водою (100 мл) і екстрагували за допомогою ДХМ (2 × 100 мл). Органічні фази поєднували, сушили над MgSO 4, фільтрували і упарювали з одержанням (R)-(2-хлор-6-(3-метилморфоліно)піримідин-4-іл)метилметансульфонату (20.14 г, 1 105 %), який використовували на наступній стадії без додаткового очищення; H ЯМР (400 МГц, CDCl3) 1.33 (3H, d), 3.13 (3H, s), 3.27-3.34 (1H, m), 3.51-3.57 (1H, m), 3.66-3.70 (1H, m), 3.79 (1H, + d), 3.99-4.03 (2H, m), 4.34 (1H, br s), 5.09 (2H, d), 6.52 (1H, s); m/z: (ESI+) MH , 322.83. d) Йодид літію (17.57 г, 131.27 ммоль) додавали до (R)-(2-хлор-6-(3метилморфоліно)піримідин-4-іл)метилметансульфонату (19.2 г, 59.67 ммоль) в діоксані (300 мл) і нагрівали до 100 °C впродовж 2 годин під азотом. Реакційну суміш гасили водою (200 мл) і екстрагували за допомогою EtOAc (3 × 200 мл). Органічні шари поєднували і промивали 2M розчином бісульфіту натрію (400 мл), водою (400 мл), соляним розчином (400 мл) сушили над MgSO4 і потім упарювали. Залишок розтирали з Et2O з одержанням (R)-4-(2-хлор-61 (йодметил)піримідин-4-іл)-3-метилморфоліну (13.89 г, 66 %); H ЯМР (400 МГц, CDCl3) 1.32 (3H, d), 3.28 (1H, td), 3.54 (1H, td), 3.69 (1H, dd), 3.78 (1H, d), 3.98 – 4.02 (2H, m), 4.21 (2H, s), 4.29 (1H, + br s), 6.41 (1H, s); m/z: (ESI+) MH 354.31. Маточні розчини концентрували і розтирали з Et 2O з одержанням додаткової порції (R)-4-(21 хлор-6-(йодметил)піримідин-4-іл)-3-метилморфоліну (2.46 г, 12 %); H ЯМР (400 МГц, CDCl3) 1.32 (3H, d), 3.28 (1H, td), 3.54 (1H, td), 3.69 (1H, dd), 3.78 (1H, d), 3.98 – 4.02 (2H, m), 4.21 (2H, s), + 4.30 (1H, s), 6.41 (1H, s); m/z: (ESI+) MH , 354.31. Альтернативно, ця стадія може бути проведена наступним чином: (R)-(2-Хлор-6-(3-метилморфоліно)піримідин-4-іл)метилметансульфонат (80 г, 248.62 ммоль) і йодид літію (83 г, 621.54 ммоль) розчиняли в діоксані (300 мл) і потім нагрівали при 107 °C впродовж 1 години. Реакційну суміш гасили водою (250 мл), екстрагували за допомогою EtOAc (3 × 250 мл), органічний шар сушили над MgSO 4, фільтрували і упарювали. Залишок розчиняли в ДХМ і додавали Et2O, суміш пропускали через силікагель (4 дюйма) і елюювали за допомогою Et2O. Фракції, що містять продукт, упарювали і залишок потім розтирали з Et 2O з одержанням твердої речовини, яку збирали шляхом фільтрування і сушили в вакуумі з одержанням (R)-4-(2+ хлор-6-(йодметил)піримідин-4-іл)-3-метилморфоліну (75 г, 86 %); m/z: (ESI+) MH , 354.27. e) (R)-4-(2-Хлор-6-(йодметил)піримідин-4-іл)-3-метилморфолін (17.0 г, 48.08 ммоль) розчиняли в ДМФА (150 мл), до розчину додавали метантіолат натрію (3.37 г, 48.08 ммоль) і реакційну суміш перемішували впродовж 1 години при 25 °C. Реакційну суміш гасили водою (50 мл) і потім екстрагували за допомогою Et2O (3 × 50 мл). Органічний шар сушили над MgSO 4, фільтрували і потім упарювали. Залишок очищали за допомогою флеш-хроматографії на силікагелі, елююючи градієнтом 50-100 % EtOAc в ізогексані. Чисті фракції упарювали з одержанням (R)-4-(2-хлор-6-(метилтіометил)піримідин-4-іл)-3-метилморфоліну (12.63 г, 96 %); + m/z: (ES+) MH , 274.35. f) (R)-4-(2-Хлор-6-(метилтіометил)піримідин-4-іл)-3-метилморфолін (12.63 г, 46.13 ммоль) 25 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчиняли в ДХМ (100 мл), до розчину однією порцією додавали mCPBA (7.96 г, 46.13 ммоль) і реакційну суміш перемішували впродовж 10 хвилин при 25 °C. Додавали додаткову порцію mCPBA (0.180 г). Реакційну суміш гасили насиченим розчином Na 2CO3 (50 мл) і екстрагували за допомогою ДХМ (3 × 50 мл). Органічний шар сушили над MgSO 4, фільтрували і потім упарювали. Залишок розчиняли в ДХМ (80 мл) в 150 мл конічній колбі, яку поміщали в лабораторний стакан, що містить діетиловий ефір (200 мл), і систему покривали лабораторною плівкою і потім залишали на 3 дні. Одержані кристали відфільтровували, дробили і піддавали дії ультразвуку з Et2O. Методику кристалізації повторювали з одержанням (R)-4-(2-хлор-6-((R)1 метилсульфінілметил)піримідин-4-іл)-3-метилморфоліну у вигляді білих голок (3.87 г, 29 %); H ЯМР (400 МГц, CDCl3) 1.33 (3H, d), 2.62 (3H, s), 3.30 (1H, td), 3.53 (1H, td), 3.68 (1H, dd), 3.76 (2H, dd), 3.95 (1H, d), 4.00 (1H, dd), 4.02 (1H, s), 4.32 (1H, s), 6.42 (1H, s). Рідину, що залишилася від першої дифузії пари, очищали за допомогою флешхроматографії на силікагелі, елююючи градієнтом 0-5 % MeOH в ДХМ. Чисті фракції упарювали з одержанням (R)-4-(2-хлор-6-((S)-метилсульфінілметил)піримідин-4-іл)-3-метилморфоліну у 1 вигляді жовтогарячої смоли (5.70 г, 43 %); H ЯМР (400 МГц, CDCl3) 1.33 (3H, d), 2.62 (3H, d), 3.29 (1H, td), 3.54 (1H, td), 3.68 (1H, dd), 3.73-3.82 (2H, m), 3.94 (1H, dd), 4.00 (2H, dd), 4.33 (1H, s), 6.42 (1H, s). g) Йодбензолдіацетат (484 мг, 1.50 ммоль) додавали на повітрі до (R)-4-(2-хлор-6-((R)метилсульфінілметил)піримідин-4-іл)-3-метилморфоліну (290 мг, 1.00 ммоль), 2,2,2трифторацетаміду (226 мг, 2.00 ммоль), оксиду магнію (0.045 мл, 4.00 ммоль) і димеру ацетату родію(II) (11.06 мг, 0.03 ммоль) в ДХМ (10 мл). Одержувану суспензію перемішували при КТ впродовж 18 годин. Реакційну суміш фільтрували і до фільтрату додавали силікагель (3 г), і розчинник видаляли в вакуумі. Одержуваний порошок очищали за допомогою флешхроматографії на силікагелі, елююючи градієнтом 20-50 % EtOAc в ізогексані. Чисті фракції упарювали з одержанням N-[({2-хлор-6-[(3R)-3-метилморфолін-4-іл]піримідин-41 іл}метил)(метил)окидо-l6-сульфаніліден]-2,2,2-трифторацетаміду (387 мг, 96 %); H ЯМР (400 МГц, CDCl3) 1.33 (3H, d), 3.21-3.38 (1H, m), 3.42 (3H, d), 3.45-3.57 (1H, m), 3.61-3.70 (1H, m), 3.78 (1H, d), 4.01 (1H, dd), 3.90-4.15 (1H, br s), 4.30 (1H, s), 4.64 (1H, dd), 4.84 (1H, dd), 6.49 (1H, d); + m/z: (ESI+) MH , 401.01 і 402.92. h) Дихлорбіс(трифенілфосфін)паладій(II) (8.10 мг, 0.01 ммоль) додавали однією порцією до N-[({2-хлор-6-[(3R)-3-метилморфолін-4-іл]піримідин-4-іл}метил)(метил)окидо-l6-сульфаніліден]2,2,2-трифторацетаміду (185 мг, 0.46 ммоль), 2M водного розчину Na 2CO3 (0.277 мл, 0.55 ммоль) і 4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1-тозил-1H-піроло[2,3-b]піридину (193 мг, 0.48 ммоль) в суміші DME:вода 4:1 (5 мл) при КТ. Реакційну суміш перемішували при 90 °C впродовж 1 години, фільтрували і потім очищали за допомогою препаративної ВЕРХ, використовуючи суміші з полярнісю, що знижується, води (що містить 1 % NH3) і MeCN як елюенти. Фракції, що містять цільову сполуку, упарювали з одержанням (R)-3-метил-4-(6-((R)-Sметилсульфонімідоїлметил)-2-(1-тозил-1H-піроло[2,3-b]піридин-4-іл)піримідин-4-іл)морфоліну 1 (102 мг, 41 %); H ЯМР (400 МГц, CDCl3) 1.33 (3H, d), 3.21-3.38 (1H, m), 3.42 (3H, d), 3.45-3.57 (1H, m), 3.61-3.70 (1H, m), 3.78 (1H, d), 4.01 (1H, dd), 3.90-4.15 (1H, br s), 4.30 (1H, s), 4.64 (1H, + dd), 4.84 (1H, dd), 6.49 (1H, d); m/z: (ESI+) MH , 541.35 4-(4,4,5,5-Тетраметил-1,3,2-діоксаборолан-2-іл)-1-тозил-1H-піроло[2,3-b]піридин, використовуваний як вихідна речовина, може бути одержаний наступним чином: a) В 3 л закріплену посудину завантажували перокси-3-хлорбензойну кислоту (324 г, 1444.67 ммоль), порціями додаючи до 1H-піроло[2,3-b]піридину (150 г, 1244.33 ммоль) в DME (750 мл) і гептані (1500 мл) при 20 °C впродовж 1 години під азотом. Одержувану завись перемішували при 20 °C впродовж 18 годин. Осад збирали за допомогою фільтрування, промивали сумішшю DME / гептан (1/2 5 об.) (750 мл) і сушили в вакуумі при 40 °C з одержанням 1H-піроло[2,3b]піридин 7-оксид 3-хлорбензоату (353 г, 97 %) у вигляді кремової твердої речовини, яку 1 використовували без додаткового очищення; H ЯМР (400 МГц, ДМСО-d6) 6.59 (1H, d), 7.07 (1H, dd), 7.45 (1H, d), 7.55 (1H, t), 7.65 (1H, dd), 7.70 (1H, ddd), 7.87-7.93 (2H, m), 8.13 (1H, d), 12.42 (1H, s), 13.32 (1H, s). b) 2M розчин карбонату калію (910 мл, 1819.39 ммоль) по краплям додавали до перемішуваної зависі 1H-піроло[2,3-b]піридин 7-оксид 3-хлорбензоату (352.6 г, 1212.93 ммоль) у воді (4.2 об.) (1481 мл) при 20 °C впродовж 1 години, встановлюючи значення pH на 10. До одержуваної зависі завантажували воду (2 об.) (705 мл), перемішували при 20 °C впродовж 1 години. Завись охолоджували до 0 °C впродовж 1 години і фільтрували, тверду речовину промивали водою (3 об., 1050 мл) і сушили в вакуумній печі при 40 °C над P2O5 впродовж ночі з 1 одержанням 1H-піроло[2,3-b]піридин 7-оксиду (118 г, 73 %); H ЯМР (400 МГц, ДМСО-d6) 6.58 + (1H, d), 7.06 (1H, dd), 7.45 (1H, d), 7.64 (1H, d), 8.13 (1H, d), 12.44 (1H, s); m/z: (ES+) (MH+MeCN) , 26 UA 109010 C2 5 10 15 20 25 30 35 40 45 50 176.03. c) В 3 л закріплену посудину в атмосфері азоту завантажували метансульфоновий ангідрид (363 г, 2042.71 ммоль), порціями додаючи до 1H-піроло[2,3-b]піридин 7-оксиду (137 г, 1021.36 ммоль) і броміду тетраметиламонію (236 г, 1532.03 ммоль) в ДМФА (10 об.) (1370 мл), охолодженому до 0 °C, впродовж 30 хвилин під азотом. Одержувану суспензію перемішували при 20 °C впродовж 24 годин. Реакційну суміш гасили водою (20 об., 2740 мл) і значення pH реакційної суміші встановлювали на 7 за допомогою 50 % гідроксиду натрію (прибл. 200 мл). Завантажували воду (40 об., 5480 мл) і суміш охолоджували до 10 °C впродовж 30 хвилин. Тверду речовину відфільтровували, промивали водою (20 об., 2740 мл) і тверду речовину розчиняли в суміші ДХМ/метанол (4:1, 2000 мл), сушили над MgSO 4 і упарювали із забезпеченням світло-коричневої твердої речовини. Тверду речовину вносили в гарячий метанол (2000 мл) і по краплям додавали воду, до тих пір, поки розчин не стане мутним, і залишали на нічь. Тверду речовину відфільтровували і відкидали, розчин упарювали і тверду речовину перекристалізовували із MeCN (4000 мл). Тверду речовину відфільтровували і промивали за допомогою MeCN з одержанням 4-бром-1H-піроло[2,3-b]піридину (68.4 г, 34 %) у 1 вигляді рожевої твердої речовини; H ЯМР (400 МГц, ДМСО-d6) 6.40-6.45 (1H, m), 7.33 (1H, d), + 7.57-7.63 (1H, m), 8.09 (1H, t), 12.02 (1H, s); m/z: (ES+) MH , 198.92. Сирі маточні розчини очищали за допомогою системи Companion RF (обернено-фазова C18, 415 г колонка), використовуючи суміші з полярнісю, що знижується, води (що містить 1 % NH3) і MeCN як елюенти (починаючи з 26 % і аж до 46 % MeCN). Фракції, що містять цільову сполуку, упарювали з одержанням 4-бром-1H-піроло[2,3-b]піридину (5.4 г, 3 %) у вигляді рожевої твердої 1 речовини; H ЯМР (400 МГц, ДМСО-d6) 6.43 (1H, dd), 7.33 (1H, d), 7.55-7.66 (1H, m), 8.09 (1H, d), + 12.03 (1H, s); m/z: (ES+) MH , 199.22. d) Гідроксид натрію (31.4 мл, 188.35 ммоль) додавали до 4-бром-1H-піроло[2,3-b]піридину (10.03 г, 50.91 ммоль), тозилхлориду (19.41 г, 101.81 ммоль) і гідросульфату тетрабутиламонію (0.519 г, 1.53 ммоль) в ДХМ (250 мл) при КТ. Одержувану суміш перемішували при КТ впродовж 1 години. Реакцію гасили за допомогою додавання насиченого водного NH 4Cl, органічний шар видаляли і водний шар додатково екстрагували за допомогою ДХМ (3 × 25 мл). Об'єднану органіку промивали соляним розчином (100 мл), сушили над Na 2SO4 і потім концентрували при зниженому тиску. Залишок очищали за допомогою флеш-хроматографії на силікагелі, елююючи градієнтом 0-20 % EtOAc в ізогексані. Чисті фракції упарювали з одержанням 4-бром-1-тозил1 1H-піроло[2,3-b]піридину (14.50 г, 81 %); H ЯМР (400 МГц, CDCl3) 2.38 (3H, s), 6.64 (1H, d), 7.28 + (2H, d), 7.36 (1H, d), 7.78 (1H, d), 8.06 (2H, d), 8.22 (1H, d); m/z: (ES+) MH , 353.23. e) 1,1'-Біс(дифенілфосфіно)ферроцендихлорпаладій(II) (3.37 г, 4.13 ммоль) додавали однією порцією до 4-бром-1-тозил-1H-піроло[2,3-b]піридину (14.5 г, 41.28 ммоль), біс(пінаколато)дибору (20.97 г, 82.57 ммоль) і ацетату калію (12.16 г, 123.85 ммоль) в безводному ДМФА (300 мл) при КТ. Одержувану суміш перемішували під азотом при 90 °C впродовж 24 годин. Після охолодження до КТ, 1 н. водний NaOH додавали до тих пір, поки водний шар не досягне значення pH 10. Водний шар промивали за допомогою ДХМ (1 л), обережно підкисляли до pH 4 за допомогою 1 н. водної HCl, і потім екстрагували за допомогою ДХМ (3 × 300 мл). Органічний шар концентрували при зниженому тиску з одержанням темно-коричневої твердої речовини. Тверду речовину розтирали з діетиловим ефіром, відфільтровували і сушили з одержанням 4(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1-тозил-1H-піроло[2,3-b]піридину (7.058 г, 43 %); 1 H ЯМР (400 МГц, CDCl3) 1.36 (12H, s), 2.35 (3H, s), 7.01 (1H, d), 7.22 (2H, d), 7.52 (1H, d), 7.74 + (1H, d), 8.03 (2H, m), 8.42 (1H, d); m/z: (ES+) MH , 399.40. Маточні розчини концентрували в вакуумі і залишок розтирали в ізогексані, відфільтровували і сушили з одержанням додаткового зразка 4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1-тозил-1H-піроло[2,3-b]піридину (3.173 г, 1 19 %); H ЯМР (400 МГц, CDCl3) 1.36 (12H, s), 2.35 (3H, s), 7.01 (1H, d), 7.23 (2H, d), 7.52 (1H, d), + 7.74 (1H, d), 8.03 (2H, d), 8.42 (1H, d); m/z: (ES+) MH , 399.40. Приклад 2.01 і Приклад 2.02 4-{4-[(3R)-3-Метилморфолін-4-іл]-6-[1-((S)-S-метилсульфонімідоїл)циклопропіл]піримідин-2іл}-1H-піроло[2,3-b]піридин і 4-{4-[(3R)-3-метилморфолін-4-іл]-6-[1-((R)-Sметилсульфонімідоїл)циклопропіл]піримідин-2-іл}-1H-піроло[2,3-b]піридин 27 UA 109010 C2 O N HN O N S HN N O NH N N O S NH N N 5 10 15 20 25 30 35 40 45 50 N (3R)-3-Метил-4-(6-(1-(S-метилсульфонімідоїл)циклопропіл)-2-(1-тозил-1H-піроло[2,3b]піридин-4-іл)піримідин-4-іл)морфолін (1.67 г, 2.95 ммоль) розчиняли в суміші DME:вода 4:1 (60 мл) і нагрівали до 50 °C. Потім додавали 2M водний розчин гідроксиду натрію (2.58 мл, 5.16 ммоль) і нагрівання продовжували впродовж 18 годин. Реакційну суміш підкисляли за допомогою 2M HCl (~2 мл) до pH5. Реакційну суміш упарювали досуха і залишок розчиняли в EtOAc (250 мл), і промивали водою (200 мл). Органічний шар сушили над MgSO 4, фільтрували і упарювали на силікагелі (10 г). Одержуваний порошок очищали за допомогою флешхроматографії на силікагелі, елююючи градієнтом 0-7 % MeOH в ДХМ. Чисті фракції упарювали і залишок очищали за допомогою препаративної хіральної хроматографії на колонці ChiralCel OJ, елююючи ізократично 50 % ізогексаном в EtOH/MeOH (1:1) (модифікованим TEAA) як елюент. Фракції, що містять цільову сполуку, упарювали досуха з одержанням (3R)-3-метил-4-(6-(1-((R)S-метилсульфонімідоїл)циклопропіл)-2-(1H-піроло[2,3-b]піридин-4-іл)піримідин-4-іл)морфоліну 1 6 (0.441 г, 36 %) як сполуки, що елююється першою; H ЯМР (400 МГц, ДМСО-d ) 1.28 (3H, d), 1.40-1.58 (3H, m), 1.70-1.80 (1H, m), 3.10 (3H, d), 3.23-3.27 (1H, m), 3.51 (1H, dt), 3.66 (1H, dd), 3.80 (2H, d), 4.01 (1H, dd), 4.21 (1H, d), 4.56 (1H, s), 6.99 (1H, s), 7.22 (1H, dd), 7.54-7.61 (1H, m), + 7.94 (1H, d), 8.33 (1H, d), 11.75 (1H, s); m/z: (ES+) MH , 413.12. та (3R)-3-метил-4-(6-(1-((S)-S-метилсульфонімідоїл)циклопропіл)-2-(1H-піроло[2,3-b]піридин1 4-іл)піримідин-4-іл)морфоліну (0.538 г, 44 %) як сполуки, що елююється другою; H ЯМР (400 6 МГц, ДМСО-d ) 1.29 (3H, d), 1.51 (3H, m), 1.70-1.82 (1H, m), 3.11 (3H, s), 3.28 (1H, m, прихований під піком води), 3.48-3.60 (1H, m), 3.68 (1H, dd), 3.75-3.87 (2H, m), 4.02 (1H, dd), 4.19 (1H, d), 4.60 (1H, s), 7.01 (1H, s), 7.23 (1H, dd), 7.51-7.67 (1H, m), 7.95 (1H, d), 8.34 (1H, d), 11.76 (1H, s).; m/z: + (ES+) MH , 413.12. (3R)-3-Метил-4-(6-(1-(S-метилсульфонімідоїл)циклопропіл)-2-(1-тозил-1H-піроло[2,3b]піридин-4-іл)піримідин-4-іл)морфолін, використовуваний як вихідна речовина, може бути одержаний наступним чином: a) (R)-4-(2-Хлор-6-(метилтіометил)піримідин-4-іл)-3-метилморфолін 1M в ДХМ (28.0 мл, 28 ммоль) додавали до mCPBA (6.90 г, 28.00 ммоль) в ДХМ (80 мл). Одержуваний розчин перемішували при КТ впродовж 20 хвилин. Реакційну суміш гасили розчином метабісульфату натрію (100 мл, 10 % мас./мас.), екстрагували за допомогою ДХМ (3 × 50 мл), органічний шар сушили над MgSO4, фільтрували і потім упарювали на силікагелі (50 г). Одержуваний порошок очищали за допомогою флеш-хроматографії на силікагелі, елююючи градієнтом 0-5 % MeOH в ДХМ. Чисті фракції упарювали досуха з одержанням (3R)-4-(2-хлор-6(метилсульфінілметил)піримідин-4-іл)-3-метилморфоліну (5.88 г, 73 %), який використовували на наступній стадії без додаткового очищення. b) Йодбензолдіацетат (6.54 г, 20.29 ммоль) додавали до (3R)-4-(2-хлор-6(метилсульфінілметил)піримідин-4-іл)-3-метилморфоліну (5.88 г, 20.29 ммоль), 2,2,2трифторацетаміду (4.59 г, 40.58 ммоль), оксиду магнію (3.27 г, 81.16 ммоль) і димеру ацетату родію(II) (0.224 г, 0.51 ммоль) в ДХМ (169 мл) на повітрі. Одержувану суспензію перемішували при КТ впродовж 3 днів. Додавали додаткову кількість 2,2,2-трифторацетаміду (1.15 г, 10.15 ммоль), оксиду магнію (0.818 г, 20.29 ммоль), димеру ацетату родію(II) (0.056 г, 0.13 ммоль) і йодбензолдіацетату (1.64 г, 5.07 ммоль) і суспензію перемішували при КТ впродовж додаткових 24 годин. Реакційну суміш фільтрували і до фільтрату додавали силікагель (3 г), і потім суміш упарювали. Одержуваний порошок очищали за допомогою флеш-хроматографії на силікагелі, елююючи градієнтом 20-50 % EtOAc в ізогексані. Фракції, що містять продукт, упарювали і залишок розтирали з сумішшю ізогексан/метил-трет-бутиловий ефір з одержанням твердої речовини, яку збирали шляхом фільтрування і сушили в вакуумі з одержанням N-[({2-хлор-6[(3R)-3-метилморфолін-4-іл]піримідин-4-іл}метил)(метил)окидо-l6-сульфаніліден]-2,2,21 трифторацетаміду (6.64 г, 82 %); H ЯМР (400 МГц, CDCl3) 1.33 (3H, d), 3.28 (1H, dd), 3.43 (3H, d), 3.46-3.59 (1H, m), 3.62-3.71 (1H, m), 3.79 (1H, d), 3.90-4.50 (2H, br s), 4.21 (1H, s), 4.66 (1H, dd), + 4.86 (1H, dd), 6.50 (1H, d); m/z: (ES+) MH , 401.01, 402.93. c) Гідроксид натрію (50 мл, 937.57 ммоль) додавали до N-[({2-хлор-6-[(3R)-3-метилморфолін 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMorpholino pyrividines and their use in therapy
Автори англійськоюFoote, Kevin, Michael, Nissink, Johannes, Wilhelmus, Maria, Turner, Paul
Автори російськоюФут Кэвин Майкл, Ниисинк Йоханнес Вилхулмус Мария, Тёрнер Пол
МПК / Мітки
МПК: A61P 35/00, A61K 31/505, C07D 413/14, C07D 471/04
Мітки: застосування, морфолінопіримідини, терапії
Код посилання
<a href="https://ua.patents.su/37-109010-morfolinopirimidini-ta-kh-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Морфолінопіримідини та їх застосування в терапії</a>
Попередній патент: Спосіб одержання збагаченого екстракту з листя рослини vitis vinifera l.
Наступний патент: Синергічна гербіцидна композиція, яка містить клопіралід і флорасулам
Випадковий патент: Спосіб оцінки ризику розвитку кардіоваскулярних порушень у хворих на артеріальну гіпертензію з ожирінням