Похідні азабіциклічних карбоксамідів, їх одержання і їх застосування в терапії
Номер патенту: 102837
Опубліковано: 27.08.2013
Автори: Маланда Андре, Дюбуа Лоран, Еванно Яннік, Машнік Давід
Формула / Реферат
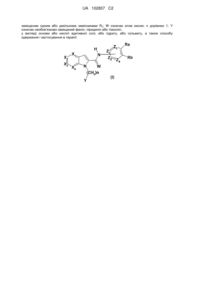
1. Сполука, що відповідає загальній формулі (І):
 , (I)
, (I)
в якій:
або X1, Х2, Х3 і Х4 означають незалежно один від одного групу C-R1;
або, з Х1, Х2, Х3 і Х4, один з Х3 і Х4 означає атом азоту, а інші незалежно один від одного означають групу C-R1;
R1 вибирають з атома водню, атома галогену, С1-С6-фторалкілу або -Sі(С1-С6-алкіл)3;
n дорівнює 1;
Y означає феніл, можливо заміщений однією або декількома групами, вибраними з атома галогену, С1-С6-алкілу або С1-С6-фторалкілу; або Y означає піридиніл або тіазоліл;
W означає атом кисню;
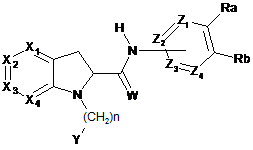
при цьому групу
вибирають з груп
 ,
, 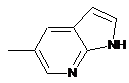 ,
,  ,
, 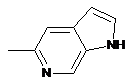 ,
, 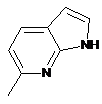 ,
,
при цьому один з Z1, Z2, Z3 і Z4 означає атом азоту і можливо знаходиться в окисненій формі; причому ці групи можливо заміщені R2 і R3;
R2 означає атом водню;
R3, якщо він зв'язаний з атомом вуглецю, означає атом водню або оксогрупу;
R3, якщо він зв'язаний з атомом азоту, означає атом водню, С1-С6-алкіл або С1-С6-алкіл-С(О)-;
у вигляді основи або адитивної кислотної солі або у вигляді гідрату або сольвату.
2. Сполука формули (І) за п. 1, в якій Х1, Х2, Х3 і Х4 означають незалежно один від одного групу C-R1; при цьому R1 такий, як визначено в загальній формулі (І) за п. 1;
у вигляді основи або адитивної кислотної солі або у вигляді гідрату або сольвату.
3. Сполука формули (І) за п. 1, в якій, серед Х1, Х2, Х3 і Х4, один з Х3 і Х4 означає атом азоту, інші означають незалежно один від одного групу C-R1; при цьому R1 такий, як визначено в загальній формулі (І) за п. 1;
у вигляді основи або адитивної кислої солі або у вигляді гідрату або сольвату.
4. Сполука формули (І), вибирана з групи, що складається з наступних сполук:
N-(1-ацетил-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-(3-фторбензил)-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-(3-фторбензил)-1Н-індол-2-карбоксаміду,
N-(2,3-дигідро-1H-піроло[2,3-b]піридин-5-іл)-5-фтор-1-(3-фторбензил)-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[3,2-b]піридин-6-іл)-5-фтор-1-(3-фторбензил)-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[(3-метилфеніл)метил]-1H-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2-карбоксаміду,
N-(1H-піроло[2,3-с]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1H-піроло[2,3-b]піридин-2-карбоксаміду,
N-(7-окси-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду,
N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1-метил-1H-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2-карбоксаміду,
N-(1-метил-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2-карбоксаміду,
N-(1-метил-1Н-піроло[2,3-b]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2-карбоксаміду,
N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-метилфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-метилфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[(3-метилфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(3-метилфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1H-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-метилфеніл)метил]-1Н-піроло[2,3-b]піридин-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(3-метилфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[[(3-трифторметил)феніл]метил]-1Н-піроло[2,3-b]піридин-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2-карбоксаміду,
N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксаміду,
N-(1-метил-1H-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(піридин-3-іл)метил]-1Н-індол-2-карбоксаміду,
N-(1H-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(тіазол-2-іл)метил]-1H-піроло[2,3-b]піридин-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(тіазол-2-іл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(тіазол-2-іл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[(тіазол-2-іл)метил]-1Н-індол-2-карбоксаміду,
N-(1H-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(тіазол-2-іл)метил]-1H-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[(тіазол-2-іл)метил]-1Н-індол-2-карбоксаміду,
N-(1H-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксамiду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(піридин-4-іл)метил]-1H-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(піридин-4-іл)метил]-1Н-піроло[2,3-b]піридин-2-карбоксаміду,
N-(2-оксо-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксаміду,
N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-1-[(3-фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-1-[(3-фторфеніл)метил]-1H-піроло[2,3-с]піридин-2-карбоксаміду,
N-(1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксаміду,
N-(1-метил-1H-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксаміду.
5. Сполука, вибрана з групи, яка включає:
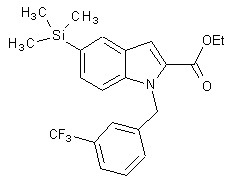 , (IIa)
, (IIa) 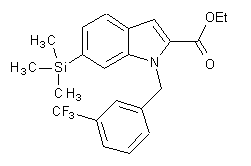 , (IIb)
, (IIb) 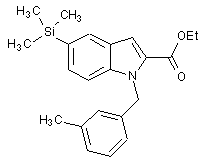 , (IIc)
, (IIc) 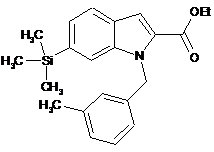 , (IId)
, (IId)  , (IIe)
, (IIe) 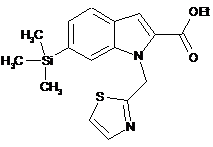 , (IIf)
, (IIf) 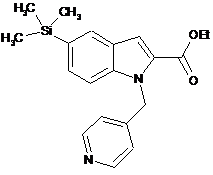 , (IIg)
, (IIg) 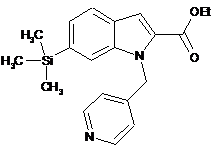 (IIh).
(IIh).
6. Лікарський засіб, який містить сполуку формули (І) за будь-яким з пп. 1-4 або її адитивну сіль з фармацевтично прийнятною кислотою або гідрат, або сольват сполуки формули (І).
7. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-4 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт.
8. Застосування сполуки формули (І) за будь-яким з пп. 1-4 для одержання лікарського засобу, призначеного для попередження або лікування патологічних станів, в яких беруть участь рецептори типу TRPV1.
9. Застосування сполуки формули (І) за будь-яким з пп. 1-4 для одержання лікарського засобу, призначеного для попередження або лікування болю, запалення, метаболічних порушень, урологічних порушень, гінекологічних порушень, шлунково-кишкових порушень, захворювань дихальних шляхів, псоріазу, свербежу, подразнень шкіри, очей або слизових, герпесу, оперізувального лишаю, розсіяного склерозу, депресії, раку.
Текст
Реферат: Винахід стосується сполук загальної формули (І) H X2 X3 X1 N Z2 Z3 X4 N Ra Z1 Z4 Rb W (CH2)n Y , (I) в якій Х1, Х2, Х3 і Х4 означають незалежно один від одного атом азоту або групу C-R1; Z1, Z2, Z3 i Z4 означають незалежно один від одного атом азоту або групу C-R2; Ra і Rb утворюють разом з атомами вуглецю, з якими вони зв'язані, п'ятичленний цикл, при цьому вказаний цикл містить атом азоту і атоми вуглецю, цей цикл є частково насиченим або ненасиченим і можливо UA 102837 C2 (12) UA 102837 C2 заміщеним одним або декількома замісниками R3; W означає атом кисню; n дорівнює 1; Y означає необов’язково заміщений феніл, піридиніл або тіазоліл; у вигляді основи або кислої адитивної солі, або гідрату, або сольвату, а також способу одержання і застосування в терапії. UA 102837 C2 5 10 У документах WO 2006/024776, WO 2006/072736, WO 2007/010144, WO 2007/010138 описані похідні біциклічних карбоксамідів, які мають активність антагоніста або агоніста in vitro і in vivo відносно рецепторів типу TRPV1 (або VR1). На даний час існує потреба в нових лігандах рецептів типу TRPV1, що є більш досконалими відносно функціональної активності, метаболічного профілю і/або профілю безпеки. Даний винахід відповідає цій потребі, пропонуючи похідні азабіциклічних карбоксамідів, які мають активність антагоніста або агоніста in vitro і in vivo відносно рецепторів типу TRPV1 (або VR1). Першим об'єктом винаходу є сполуки нижченаведеної загальної формули (I). Іншим об'єктом винаходу є способи одержання сполук загальної формули (I). Іншим об'єктом винаходу є застосування сполук загальної формули (I), зокрема в лікарських засобах або фармацевтичних композиціях. Сполуки за винаходом відповідають загальній формулі (I): , в якій: Х1, Х2, Х3 і Х4 означають незалежно один від одного атом азоту або групу С-R1; При умові, що, коли один з Х1, Х2, Х3 і Х4 означає атом азоту, інші відповідають групі С-R1; Z1, Z2, Z3 і Z4 означають незалежно один від одного атом азоту, атом вуглецю або групу С 15 R2; 20 25 30 35 40 45 50 при цьому щонайменше один з Z1, Z2, Z3 і Z4 означає атом азоту; і один з Z1, Z2, Z3 і Z4 означає атом вуглецю, зв'язаний з атомом азоту аміду або тіоаміду формули (I); Rа і Rb утворюють разом в атомами вуглецю, з якими вони зв'язані, 5-членний цикл, причому цей цикл містить атом азоту і атоми вуглецю, цей цикл є частково насиченим або ненасиченим і можливо заміщеним одним або декількома замісниками R 3; W означає атом кисню або сірки; N дорівнює 0, 1, 2 або 3; Y означає арил або гетероарил, можливо заміщений однією або декількома групами, вибраними з атома галогену, С1-С6-алкілу, С3-С7-циклоалкілу, С3-С7-циклоалкіл-С1-С3-алкілену, С1-С6-фторалкілу, гідрокси, С1-С6-алкокси, С3-С7-циклоалкілокси, С3-С7-циклоалкіл-С1-С6алкілен-О, С1-С6-фторалкокси, ціано, С(О)NR4R5, нітро, NR4R5, С1-С6-тіоалкілу, тіолу, -S(О)-С1С6-алкілу, -S(О)2-С1-С6-алкілу, SO2NR4R5, NR6C(О)R7, NR6SO2R8, С(О)NR4R5, °C(О)NR4R5, -Si(С1-С6-алкіл)3, -SF5, арил-С1-С5-алкілену або арилу, гетероарил-С1-С5-алкілену або гетероарилу; причому С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6алкокси, С3-С7-циклоалкілокси, С3-С7-циклоалкіл-С1-С6-алкілен-О можливо заміщені групою гідрокси, С1-С6-алкокси або NR4R5, при цьому арильна і гетероарильна групи можливо заміщені одним або декількома замісниками R9, однаковими або відмінними один від одного; R1 вибирають з атома водню, атома галогену, С1-С6-алкілу, С3-С7-циклоалкілу, С3-С7циклоалкіл-С1-С3-алкілену, С1-С6-фторалкілу, арилоксі-С1-С6-алкілу, гетероарилоксі-С1-С6алкілу, арил-С1-С3-алкіленоксі-С1-С6-алкілу, гетероарил-С1-С3-алкіленоксі-С1-С6-алкілу, арилтіоС1-С6-алкілу, гетероарилтіо-С1-С6-алкілу, арил-С1-С3-алкілентіо-С1-С6-алкілу, гетероарил-С1-С3алкілентіо-С1-С6-алкілу, С1-С6-алкокси, С3-С7-циклоалкілокси, С3-С7-циклоалкіл-С1-С3алкіленокси, С1-С6-фторалкокси, ціано, С(О)NR4R5, нітро, NR4R5, С1-С6-тіоалкілу, С3-С7циклоалкілтіо, С3-С7-циклоалкіл-С1-С3-алкілентіо, -S(О)-С1-С6-алкілу, -S(О)-С3-С7-циклоалкілу, S(О)-С1-С3-алкілен-С3-С7-циклоалкілу, С1-С6-алкіл-S(О)2, С1-С6-фторалкіл-S(О)2, С3-С7циклоалкіл-S(О)2-, С3-С7-циклоалкіл-С1-С3-алкілен-S(О)2-, SO2NR4R5, -Si-(С1-С6-алкіл)3, -SF5, NR6C(О)R7, NR6SO2R8, С(О)NR4R5, °C(О)NR4R5, арилу, гетероарилу, арил-С1-С5-алкілену, гетероарил-С1-С5-алкілену, арилокси, арилтіо, гетероарилокси або гетероарилтіо; причому гетероарил або арил можливо заміщені одним або декількома замісниками R 9, однаковими або різними; 1 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 R2 означає атом водню, атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси, С3-С7-циклоалкілокси, С3-С7-циклоалкіл-С1-С3алкілен-О, гідрокси, тіол, С1-С6-фторалкокси; R3, якщо він зв'язаний з атомом вуглецю, означає атом водню, групу гідрокси, тіол, С 1-С6алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси, С3-С7циклоалкілокси, С3-С7-циклоалкіл-С1-С3-алкіленокси, С1-С6-алкоксі-С1-С3-алкілен, С3-С7циклоалкілоксі-С1-С3-алкілен, С3-С7-циклоалкіл-С1-С3-алкіленоксі-С1-С3-алкілен, С(О)NR4R5, С(О)О-С1-С6-алкіл, СО2Н або групу оксо або тіо, при цьому С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси, С3-С7-циклоалкілокси, С3-С7циклоалкіл-С1-С3-алкіленокси, С1-С6-алкоксі-С1-С3-алкілен, С3-С7-циклоалкілоксі-С1-С3-алкілен, С3-С7-циклоалкіл-С1-С3-алкіленоксі-С1-С3-алкілен можуть бути заміщені групою гідрокси, С1-С6алкокси або NR4R5; або R3, якщо він зв'язаний з атомом азоту, означає атом водню, С 1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, арил-С(О)-, С1-С6-алкіл-С(О)-, С3-С7циклоалкіл-С(О)-, С3-С7-циклоалкіл-С1-С3-алкілен-С(О)-, С1-С6-фторалкіл-С(О)-, арил-S(О), С1С6-алкіл-S(О)-, С1-С6-фторалкіл-S(О)-, арил-S(О)2-, С1-С6-алкіл-S(О)2-, С1-С6-фторалкіл-S(О)2-, С3-С7-циклоалкіл-S(О)2-, С3-С7-циклоалкіл-С1-С3-алкілен-S(О)2-, С1-С6-алкіл-О-С(О)-, арил-С1-С3алкіл-О-С(О)-, С3-С7-циклоалкіл-О-С(О)-, С3-С7-циклоалкіл-С1-С3-алкілен-О-С(О)-, С1-С6фторалкіл-О-С(О)-, арил-О-С(О)-, гетероарил-О-С(О)-, гетероарил або арил, при цьому гетероарил і арил можливо заміщені одним або декількома замісниками R 9, при цьому С1-С6алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл можливо заміщені групою гідрокси, С1-С6-алкокси або NR4R5; R4 і R5 означають незалежно один від одного атом водню або С 1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С5-алкілен або арил, або R4 і R5 утворюють разом з атомом азоту, з яким вони зв'язані, азетидин, піролідин, піперидин, азепін, морфолін, тіоморфолін, піперазин, гомопіперазин, при цьому група NR 4R5 можливо заміщена С1-С6алкілом, С3-С7-циклоалкілом, С3-С7-циклоалкіл-С1-С3-алкіленом, арил-С1-С6-алкіленом, арилом, гетероарилом, арил-S(О)2-, С1-С6-алкіл-S(О)2-, С1-С6-фторалкіл-S(О)2, С3-С7-циклоалкіл-S(О)2-, С3-С7-циклоалкіл-С1-С3-алкілен-S(О)2-, арил-С(О)-, С1-С6-алкіл-С(О)-, С3-С7-циклоалкіл-С(О)-, С3-С7-циклоалкіл-С1-С3-алкілен-С(О)-, С1-С6-фторалкіл-С(О)-, гідрокси, С1-С6-алкокси, С3-С7циклоалкілокси, С3-С7-циклоалкіл-С1-С3-алкіленокси, С1-С6-фторалкілом, арилоксі-С1-С6алкіленом, арилокси, гетероарилоксі-С1-С6-алкіленом, гетероарилокси; R6 і R7 означають незалежно один від одного атом водню або С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С6-алкілен або арил, при цьому арил можливо заміщений одним або декількома замісниками, вибираними з атома галогену, С 1-С6-алкілу, С3С7-циклоалкілу, С3-С7-циклоалкіл-С1-С3-алкілену, С1-С6-фторалкілу, С1-С6-алкокси, С3-С7циклоалкокси, С3-С7-циклоалкіл-С1-С3-алкіленокси, С1-С6-фторалкокси, нітро або ціано; або R6 і R7 утворюють разом 4-7-членний лактам, що містить атом азоту або групу С(О), з якою вони зв'язані; R8 означає С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С6алкілен або арил, при цьому арил можливо заміщений одним або декількома замісниками, вибираними з атома галогену, С1-С6-алкілу, С3-С7-циклоалкілу, С3-С7-циклоалкіл-С1-С3-алкілену, С1-С6-фторалкілу, С1-С6-алкокси, С3-С7-циклоалкілокси, С3-С7-циклоалкіл-С1-С3-алкіленокси, С1С6-фторалкокси, нітро або ціано; або R6 і R8 утворюють разом 4-7-членний сультам, що містить атом азоту або групу S(О) 2, з якою вони зв'язані; R9 означає атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1С6-фторалкіл, С1-С6-алкокси, С3-С7-циклоалкілокси, С3-С7-циклоалкіл-С1-С3-алкіленокси, С1-С6фторалкокси, причому ці групи можливо заміщені групою ОН, С 1-С6-алкокси або NR4R5; або R9 означає групу нітро, ціано або NR4R5. У сполуках загальної формули (I): - один або декілька атомів сірки можуть бути в окисленій формі (S(О) або S(О) 2); - один або декілька атомів азоту можуть бути в окисленій формі (N-оксид). Сполуки формули (I) можуть містити один або декілька асиметричних атомів вуглецю. Таким чином, вони можуть бути у формі енантіомерів або діастереоізомерів. Ці енантіомери, діастереоізомери, а також їх суміші, включаючи рацемічні суміші, стосуються винаходу. Сполуки формули (I) можуть бути у вигляді основ або кислотних адитивних солей. Такі адитивні солі стосуються винаходу. 2 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ці солі можна одержувати за допомогою фармацевтично прийнятних кислот, але солі інших кислот, придатних, наприклад, для очищення або виділення сполук формули (I), також стосуються винаходу. Сполуки формули (I) можуть бути у вигляді гідратів або сольватів, а саме у вигляді асоціацій або комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати і сольвати також стосуються винаходу. У рамках даного винаходу - атом галогену означає фтор, хлор, бром або йод; - Ct-Cz означає вуглецевий ланцюжок, який може містити від t до z атомів вуглецю, де t і z можуть приймати значення від 1 до 7; наприклад, C1-C3 це вуглецевий ланцюжок, який може містити від 1 до 3 атомів вуглецю; - алкіл означає лінійну або розгалужену насичену аліфатичну групу, як приклади можна назвати метил, етил, пропіл, ізопропіл, бутил, ізобутил, третбутил, пентил і т. д.; - алкілен означає двовалентну лінійну або розгалужену насичену групу, наприклад, C1-C3алкілен означає двовалентний вуглецевий ланцюжок, що містить від 1 до 3 атомів вуглецю, лінійний або розгалужений, більш конкретно метилен, етилен, 1-метилетилен, пропілен; - циклоалкіл означає алкільну групу, циклічну, насичену або частково ненасичену, як приклади можна назвати циклопропіл, циклобутил, циклопентил, циклогесил і т. д.; - циклоалкілокси означає -О-циклоалкільний радикал, в якому циклоалкільна група така, як указано вище; - фторалкіл означає алкільну групу, один або декілька атомів водню якої заміщені атомом фтору; - алкокси означає -О-алкільний радикал, в якому алкільна група така, як указано вище; - фторалкокси означає алкоксигрупу, один або декілька атомів водню якої заміщені атомом фтору; - тіоалкіл або алкілтіо означає -S-алкільний радикал, в якому алкільна група така, як указано вище; - арил означає ароматичну моно- або біциклічну групу, що містить від 6 до 10 атомів вуглецю, як приклади арильної групи можна назвати феніл або нафтил; - гетероарил означає 5-12-членну ароматичну моно- або біциклічну групу, що містить від 1 до 5 гетероатомів, вибираних з О, S або N. Як приклади моноциклічного гетероарилу можна назвати імідазоліл, піразоліл, тіазоліл, оксазоліл, ізотіазоліл, ізоксазоліл, фураніл, тіофеніл, оксадіазоліл, тіадіазоліл, триазоліл, тетразоліл, піридиніл, піразиніл, піримідиніл, піридазиніл, тіазиніл. Як приклади біциклічного гетероарилу можна назвати індоліл, ізоіндоліл, бензофураніл, бензотіофеніл, бензоксазоліл, бензімідазоліл, індазоліл, бензотіазоліл, ізобензофураніл, ізобензотіазоліл, піроло[2,3-с]піридиніл, піроло[2,3-b]піридиніл, піроло[3,2-b]піридиніл, піроло[3,2-с]піридиніл, піроло[1,2-а]піридиніл, хінолеїніл, ізохінолеїніл, цинолініл, хіназолініл, хіноксалініл, піроло[1,2-а]імідазоліл, імідазо[1,2-а]піридиніл, імідазо[1,2-а]піридазиніл, імідазо[1,2-с]піримідиніл, імідазо[1,2-а]піримідиніл, імідазо[1,2-а]піразиніл, імідазо[4,5b]піразиніл, імідазо[4,5-b]піридиніл, імідазо[4,5-с]піридиніл, піразоло[2,3-а]піридиніл, піразоло[2,3-а]піримідиніл, піразоло[2,3-а]піразиніл. - "оксо" означає "=О"; - "тіо" означає "=S". Зі сполук загальної формули (I), що є об'єктами винаходу, перша підгрупа сполук складається із сполук, в яких Х1, Х2, Х3 і Х4 означають незалежно один від одного групу С-R1, причому R1 такий, як визначено відносно загальної формули (I). Зі сполук загальної формули (I), що є об'єктами винаходу, друга підгрупа сполук складається із сполук, в яких один з Х1, Х2, Х3 і Х4 означає атом азоту, інші Х1, Х2, Х3 і Х4 означають незалежно один від одного групу С-R1, причому R1 такий, як визначено відносно загальної формули (I). Зі сполук загальної формули (I), що є об'єктами винаходу, третя підгрупа сполук складається із сполук, в яких з Х1, Х2, Х3 і Х4 один з Х3 і Х4 означає атом азоту, а інші означають незалежно один від одного групу С-R1, причому R1 такий, як визначено відносно загальної формули (I). Зі сполук загальної формули (I), що є об'єктами винаходу, четверта підгрупа сполук складається із сполук, в яких R1 вибирають з атома водню, атома галогену, С1-С6-фторалкілу або -Si(С1-С6-алкіл)3. Зі сполук загальної формули (I), що є об'єктами винаходу, п'ята підгрупа сполук складається із сполук, в яких R1 вибирають з атома водню, атома фтору, групи CF3 або Si(CH3)3. 3 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 Зі сполук загальної формули (I), що є об'єктами винаходу, шоста підгрупа сполук складається із сполук, в яких n дорівнює 1. Зі сполук загальної формули (I), що є об'єктами винаходу, сьома підгрупа сполук складається із сполук, в яких Y означає арил або гетероарил, можливо заміщений однією або декількома групами, вибраними з атома галогену, С1-С6-алкілу або С1-С6-фторалкілу. Зі сполук загальної формули (I), що є об'єктами винаходу, восьма підгрупа сполук складається із сполук, в яких Y означає феніл, можливо заміщений однією або декількома групами, вибраними з атома галогену, С1-С6-алкілу або С1-С6-фторалкілу; або Y означає піридиніл або тіазоліл. Зі сполук загальної формули (I), що є об'єктами винаходу, дев'ята підгрупа сполук складається із сполук, в яких Y означає феніл, можливо заміщений атомом фтору, метилом або CF3; або Y означає піридиніл або тіазоліл. Зі сполук загальної формули (I), що є об'єктами винаходу, десята підгрупа сполук складається із сполук, в яких Y означає феніл, можливо заміщений атомом фтору, метилом або CF3. Зі сполук загальної формули (I), що є об'єктами винаходу, одинадцята підгрупа сполук складається із сполук, в яких W означає атом кисню. Зі сполук загальної формули (I), що є об'єктами винаходу, дванадцята підгрупа сполук складається із сполук, в яких Z1, Z2, Z3 і Z4 означають незалежно один від одного атом азоту, атом вуглецю або групу CR2, при цьому один з Z1, Z2, Z3 і Z4 означає атом азоту і може бути в окисленій формі; один з Z1, Z2, Z3 і Z4 означає атом вуглецю, зв'язаний з атомом азоту аміду або тіоаміду формули (I); і обидва інших з Z1, Z2, Z3 і Z4 означають групу C-R2; при цьому R2 є таким, як визначено відносно формули (I). Зі сполук загальної формули (I), що є об'єктами винаходу, тринадцята підгрупа сполук складається із сполук, в яких Z1, Z2, Z3 і Z4 означають незалежно один від одного атом азоту, атом вуглецю або групу CR2, при цьому один з Z1, Z2, Z3 і Z4 означає атом азоту і може бути в окисленій формі; один з Z1, Z2, Z3 і Z4 означає атом вуглецю, зв'язаний з атомом азоту аміду або тіоаміду формули (I); і обидва інших з Z1, Z2, Z3 і Z4 означають групу СН. Зі сполук загальної формули (I), що є об'єктами винаходу, чотирнадцята підгрупа сполук складається із сполук, в яких Ra і Rb утворюють разом з атомами вуглецю, з якими вони зв'язані, п'ятичленний цикл, причому цей цикл містить атом азоту і атоми вуглецю, цей цикл є частково насиченим або ненасиченим і можливо заміщеним одним або декількома замісниками R 3; R3, якщо він зв'язаний з атомом вуглецю, означає атом водню або оксогрупу; R3, якщо він зв'язаний з атомом азоту, означає атом водню, С 1-С6-алкіл або С1-С6-алкілС(О)-. Зі сполук загальної формули (I), що є об'єктами винаходу, п'ятнадцята підгрупа сполук складається із сполук, в яких Ra і Rb утворюють разом з атомами вуглецю, з якими вони зв'язані, п'ятичленний цикл, причому цей цикл містить атом азоту і атоми вуглецю, цей цикл є частково насиченим або ненасиченим і можливо заміщеним одним або декількома замісниками R 3; R3, якщо він зв'язаний з атомом вуглецю, означає атом водню або оксогрупу; R3, якщо він зв'язаний з атомом азоту, означає атом водню, метил або СН 3-С(О)-. Зі сполук формули (I), що є об'єктами винаходу, шістнадцята підгрупа сполук складається із сполук, в яких групу вибирають з груп 4 UA 102837 C2 причому ці групи можливо заміщені R2 і R3, як указано вище відносно загальної формули (I). Зі сполук загальної формули (I), що є об'єктами винаходу, сімнадцята підгрупа сполук складається із сполук, в яких групу 5 10 15 вибирають з груп причому один з Z1, Z2, Z3 і Z4 означає атом азоту і можливо знаходиться в окисленій формі; при цьому ці групи можливо заміщені R2 і R3, як указано відносно загальної формули (I); R2 означає атом водню; R3, якщо він зв'язаний з атомом вуглецю, означає атом водню або оксогрупу; R3, якщо він зв'язаний з атомом азоту, означає атом водню, С1-С6-алкіл або С1-С6-алкілС(О)-. Зі сполук загальної формули (I), що є об'єктами винаходу, вісімнадцята підгрупа сполук складається із сполук, в яких групу вибирають з наступних груп 5 UA 102837 C2 Зі сполук загальної формули (I), що є об'єктами винаходу, дев'ятнадцята підгрупа сполук складається із сполук, в яких групу 5 вибирають з груп причому ці групи можливо заміщені R2 і R3, як указано вище відносно загальної формули (I). Зі сполук загальної формули (I), що є об'єктами винаходу, двадцята підгрупа сполук складається із сполук, в яких групу 10 15 20 вибирають з груп причому один з Z1, Z2, Z3 і Z4 означає атом азоту і можливо знаходиться в окисленій формі; при цьому ці групи можливо заміщені R2 і R3, як указано відносно загальної формули (I); R2 означає атом водню; R3, якщо він зв'язаний з атомом вуглецю, означає атом водню або оксогрупу; R3, якщо він зв'язаний з атомом азоту, означає атом водню, С 1-С6-алкіл або С1-С6-алкілС(О)-. Зі сполук загальної формули (I), що є об'єктом винаходу, двадцять перша підгрупа сполук складається із сполук, в яких групу вибирають з наступних груп 6 UA 102837 C2 5 10 15 Зі сполук загальної формули (I), що є об'єктом винаходу, двадцять друга підгрупа сполук складається із сполук, в яких наведені вище визначення Х 1, Х2, Х3 і Х4, n, Y, W, Z1, Z2, Z3 і Z4, Ra і Rb комбінуються. Зі сполук загальної формули (I), що є об'єктом винаходу, двадцять третя підгрупа сполук складається із сполук, в яких або Х1, Х2, Х3 і Х4 означають незалежно один від одного групу С-R1; або з Х1, Х2, Х3 і Х4 один з Х3 і Х4 означає атом азоту, а інші незалежно один від одного означають групу С-R1; R1 вибирають з атома водню, атома галогену, С1-С6-фторалкілу або -Si(С1-С6-алкіл)3; n дорівнює 1; Y означає феніл, можливо заміщений однією або декількома групами, вибираними з атома галогену, С1-С6-алкілу або С1-С6-фторалкілу; або Y означає піридиніл або тіазоліл; W означає атом кисню; при цьому групу вибирають з груп 20 25 30 35 при цьому один з Z1, Z2, Z3 і Z4 означає атом азоту і можливо знаходиться в окисленій формі; причому ці групи можливо заміщені R2 і R3, як указано вище відносно загальної формули (I); R2 означає атом водню; R3, якщо він зв'язаний з атомом вуглецю, означає атом водню або оксогрупу; R3, якщо він зв'язаний з атомом азоту, означає атом водню, С 1-С6-алкіл або С1-С6-алкілС(О)-. Зі сполук загальної формули (I), що є об'єктом винаходу, двадцять четверта підгрупа сполук визначена так, що сполуки, в яких Х1, Х2, Х3 і Х4 означають незалежно один від одного групу С-R1; R1 вибирають з атома водню, атома галогену, С1-С6-алкілу, С1-С6-фторалкілу, С1-С6-алкокси, С1-С6-фторалкокси, NR4R5, С1-С6-тіоалкілу, фенілу або ізоксазолілу, при цьому фенільна група можливо заміщена одним або декількома замісниками R9, однаковими або різними; R4 і R5 означають незалежно один від одного атом водню або С1-С6-алкіл, W означає атом кисню; n дорівнює 0; Y означає феніл, можливо заміщений одним або декількома замісниками R 9, однаковими або різними, або Y означає ізоксазол; R9 означає атом галогену, С1-С6-алкіл, С1-С6-алкокси, ціано; група 7 UA 102837 C2 означає групу D: 5 10 15 20 в якій L означає атом водню, атом галогену або С1-С6-алкокси; п'ятичленний цикл є частково насиченим або ненасиченим; J означає N або С=О; якщо J означає N, то Е і G означають незалежно один від одного групу С=О або СН 2; якщо J означає С=О, то один з Е і G означає групу С=О або СН2, а інший з Е і G означає групу N-R'; R' означає атом водню, С1-С6-алкіл або арил-С(О)-, при цьому арильна група можливо заміщена однією або декількома С1-С6-алкільнимі групами; виключені. Зі сполук загальної формули (I), що є об'єктом винаходу, двадцять п'ята підгрупа сполук складається із сполук, в яких Х1, Х2, Х3 і Х4 означають незалежно один від одного групу С-R1; і R1 вибирають з атома водню, атома галогену, більш конкретно атома фтору. Зі сполук загальної формули (I), що є об'єктом винаходу, двадцять шоста підгрупа сполук складається із сполук, в яких n дорівнює 1; і Y означає арил, більш конкретно феніл, можливо заміщений одним або декількома атомами галогену, більш конкретно фтору. Зі сполук загальної формули (I), що є об'єктом винаходу, двадцять сьома підгрупа сполук складається із сполук, в яких W означає атом кисню. Зі сполук формули (I), що є об'єктом винаходу, двадцять восьма підгрупа сполук складається із сполук, в яких групу вибирають з груп 25 30 35 при цьому ці групи можливо заміщені R2 і R3, як визначено вище в загальній формулі (I). З сполук загальної формули (I), що є об'єктом винаходу, двадцять дев'ята підгрупа сполук складається із сполук, в яких Х1, Х2, Х3 і Х4 означають незалежно один від одного групу С-R1; і R1 вибирають з атома водню, атома галогену, більш конкретно атома фтору, n дорівнює 1; Y означає арил, більш конкретно феніл, можливо заміщений одним або декількома атомами галогену, більш конкретно фтору; W означає атом кисню; групу вибирають з груп 8 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 причому ці групи можливо заміщені R2 і R3, як визначено вище в загальній формулі (I). Зі сполук загальної формули (I), що є об'єктом винаходу, більш конкретно можна назвати наступні: 1) N-(1-ацетил-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-(3-фторбензил)-1Н-індол2-карбоксамід, 2) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-(3-фторбензил)-1Н-індол-2-карбоксамід, 3) N-(2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-(3-фторбензил)-1Н-індол-2карбоксамід, 4) N-(1Н-піроло[3,2-b]піридин-6-іл)-5-фтор-1-(3-фторбензил)-1Н-індол-2-карбоксамід, 5) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[(3-метилфеніл)метил]-1Н-індол-2-карбоксамід, 6) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід, 7) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід, 8) N-(1Н-піроло[2,3-с]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід, 9) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-піроло[2,3b]піридин-2-карбоксамід, 10) N-(7-окси-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2карбоксамід, 11) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Ніндол-2-карбоксамід, 12) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2карбоксамід, 13) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Нпіроло[2,3-b]піридин-2-карбоксамід, 14) N-(1-метил-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Ніндол-2-карбоксамід, 15) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2карбоксамід, 16) N-(1-метил-1Н-піроло[2,3-b]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2карбоксамід, 17) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід, 18) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-метилфеніл)метил]-1Н-індол-2карбоксамід, 19) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-метилфеніл)метил]-1Н-індол-2карбоксамід, 20) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[(3-метилфеніл)метил]-1Н-індол-2карбоксамід, 21) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(3-метилфеніл)метил]-1Н-індол-2карбоксамід, 22) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-метилфеніл)метил]-1Н-піроло[2,3b]піридин-2-карбоксамід, 23) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(3-метилфеніл)метил]-1Н-індол-2карбоксамід, 24) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід, 25) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід, 26) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[[(3-трифторметил)феніл]метил]-1Нпіроло[2,3-b]піридин-2-карбоксамід, 27) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2карбоксамід, 9 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 28) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід, 29) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(піридин-3-іл)метил]-1Н-індол-2карбоксамід, 30) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(тіазол-2-іл)метил]-1Н-піроло[2,3b]піридин-2-карбоксамід, 31) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(тіазол-2-іл)метил]-1Н-індол-2карбоксамід, 32) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(тіазол-2-іл)метил]-1Н-індол-2карбоксамід, 33) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[(тіазол-2-іл)метил]-1Н-індол-2карбоксамід, 34) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(тіазол-2-іл)метил]-1Н-індол-2карбоксамід, 35) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[(тіазол-2-іл)метил]-1Н-індол-2-карбоксамід, 36) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід, 37) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід, 38) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід, 39) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід, 40) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксамід, 41) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(піридин-4-іл)метил]-1Н-піроло[2,3b]піридин-2-карбоксамід, 42) N-(2-оксо-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Ніндол-2-карбоксамід, 43) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-індол-2карбоксамід, 44) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-1-[(3-фторфеніл)метил]-1Н-піроло[2,3с]піридин-2-карбоксамід, 45) N-(1Н-піроло[2,3-b]піридин-5-іл)-1-[(3-фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід, 46) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксамід, 47) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(піридин-4-іл)метил]-1Ніндол-2-карбоксамід. Далі в тексті під відокремлюваною групою розуміють групу, яку можна легко відділити від молекули шляхом розриву гетеролітичного зв'язку з відділенням електронної пари. Таким чином, цю групу можна легко замінювати іншою групою в ході реакції заміщення, наприклад. Такими відокремлюваними групами є, наприклад, галогени або активована гідроксигрупа, така як метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат і т. д. Приклади відокремлюваних груп, а також посилання на їх одержання наведені в "Advances in Organic th chemistry", J. March, 5 Edition, Wiley Interscience, 2001. Далі в тексті під захисною групою розуміють групу, яку можна миттєво включити в хімічну структуру з метою тимчасової інактивації частини молекули в процесі реакції і яку можна легко видалити на подальшому етапі синтезу. Приклади захисних груп, а також посилання на їх rd властивості наведені в T.W. Greene, P.G.M. Wutz, 3 Edition, Wiley Interscience 1999. Згідно з винаходом сполуки загальної формули (I) можна одержати способом, який ілюструє наступна загальна схема 1: Схема 1 10 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки загальної формули (I) можна одержати взаємодією сполуки загальної формули (II), в якій Х1, Х2, Х3 і Х4, n, Y і W такі, як визначено вище в загальній формулі (I), і В відповідає гідроксильній групі, з аміном загальної формули (III), в якій Z 1, Z2, Z3 і Z4, Ra і Rb такі, як визначено вище в загальній формулі (I), і D відповідає аміногрупі, в присутності зв'язуючого агента, такого як діалкілкарбодіімід, гексафторфосфат [(бензотриазол-1іл)оки][три(піролідино)]фосфонію, діетилціанофосфонат або будь-який інший зв'язуючий агент, відомий фахівцю, можливо в присутності основи, такої як триетиламін, в розчиннику, такому як, наприклад, диметилформамід. Сполуку загальної формули (II), в якій В означає С1-С6-алкоксил, можна перетворювати в сполуку загальної формули (II), де В означає гідроксильну групу, за допомогою основи, такої як гідроксид натрію або гідроксид калію, розчиненої в розчиннику, такому як етанол. Сполуку загальної формули (II), де В означає гідроксильну групу, можна потім перетворювати в сполуку загальної формули (II), де В означає атом хлору, під дією хлоруючого агента, такого як тіонілхлорид, в розчиннику, такому як дихлорметан. Сполуки загальної формули (I) можна одержати взаємодією сполуки загальної формули (II), в якій Х1, Х2, Х3 і Х4, n, Y і W такі, як визначено вище в загальній формулі (I), і В відповідає атому хлору, з аміном загальної формули (III), в якій Z1, Z2, Z3, Z4, Ra і Rb такі, як визначено вище в загальній формулі (I), і D відповідає аміногрупі, взаємодією в розчині в розчиннику, такому як дихлорметан або толуол. Сполуки загальної формули (I) можна одержати взаємодією сполуки загальної формули (II), в якій Х1, Х2, Х3, Х4, n, Y і W такі, як визначено вище в загальній формулі (I), і В відповідає С 1-С6алкоксильній групі, з амідидом, одержаним з загальної формули (III), в якій Z 1, Z2, Z3, Z4, Ra і Rb такі, як визначено вище в загальній формулі (I), і D відповідає аміногрупі, з металоорганічною сполукою, такою як триметилалюміній. Цю взаємодію можна здійснювати в розчиннику, такому як толуол. Виходячи із сполуки загальної формули (II), в якій В означає NH 2, W означає атом кисню і Х1, Х2, Х3, Х4, n і Y такі, як визначено вище в загальній формулі (I), сполуку загальної формули (I) можна одержати взаємодією із сполукою загальної формули (III), в якій Z 1, Z2, Z3, Z4, Ra і Rb такі, як визначено вище в загальній формулі (I), і D відповідає відокремлюваній групі, такій як визначено вище, такій як атом брому або трифталат, наприклад, способом, аналогічним описаному в J. Am. Chem. Soc. 2001, 123(31), 7727, або способами, описаними в літературі або відомими фахівцю, в присутності солі міді в каталітичній кількості, в присутності каталітичної кількості ліганду міді, такого як діамін, всі загалом в присутності основи, такої як карбонат калію, в розчиннику, такому як діоксан. На схемі 1 сполуки загальної формули (II) і інші реактиви, коли спосіб їх одержання не описаний, продаються, описані в літературі або одержані аналогічно зі способами, описаними в літературі (D. Knittel Synthesis 1985, 2, 186; T.M. Williams J. Med. Chem. 1993, 36(9), 1291; JP2001151771A2, WO 2006/024776, WO 2006/072736, WO 2007/010144, WO 2007/010138, WO 2007088277, наприклад). Сполуки загальної формули (III) і інші реактиви, коли спосіб їх одержання не описаний, продаються, описані в літературі або одержані аналогічно зі способами, описаними в літературі (Tetrahedron Lett. 1987, 1589, Synthesis 2005, 15, 2503, Synthesis 2008, 2, 201, WO 2006040520). Сполуки загальної формули (II) або (I), в якій один з Х 1, Х2, Х3 або Х4 відповідає атому вуглецю, заміщеному алкільною групою, можна одержати реакцією сполучення, каталізованою металом, таким як паладій або залізо, здійснюваною з використанням відповідних сполук загальних формул (II) або (I), заміщених атомом галогену, таким як хлор, в присутності, наприклад, галогеніду алкілмагнію або галогеніду алкіл цинку, способами, описаними в літературі (A. Furstner et al. J. Am. Chem Soc 2002, 124(46), 13856; G. Queguiner et al., J. Org. Chem 1998, 63(9), 2892), наприклад, або відомими фахівцю. Сполуки загальної формули (II) або (I), в якій один з Х 1, Х2, Х3 або Х4 відповідає атому вуглецю, заміщеному ціаногрупою, арилом або гетероарилом, можна одержати реакцією сполучення, каталізованою металом, таким як паладій, здійснюваною з використанням відповідних сполук загальної формули (II) або (I), заміщених, наприклад, атомом брому, в присутності ціаніду триметилсилілу, арилборонової кислоти або гетероарилборонової кислоти, або будь-яким іншим способом, описаним в літературі або відомим фахівцю. Сполуки загальної формули (I) або (II), в якій один з Х 1, Х2, Х3 або Х4 відповідає атому вуглецю, заміщеному групою NR4R5, NR6COR7 або NR6SO2R8, можна одержати з відповідних сполук загальної формули (I) або (II), заміщених, наприклад, атомом брому, реакцією сполучення з аміном, амідом або сульфонамідом відповідно в присутності основи, фосфіну і каталізатора на основі паладію способами, описаними в літературі або відомими фахівцю. 11 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 Сполуки загальної формули (I) або (II), заміщені групою С(О)NR 4R5, можна одержати з відповідних сполук загальної формули (I) або (II), заміщених, наприклад, ціаногрупою, способами, описаними в літературі або відомими фахівцю. Сполуки загальної формули (I) або (II), заміщені -S(О)алкільною або -S(О)2-алкільною групою, можна одержати окисленням відповіднихсполук загальної формули (II) або (I), заміщених тіоалкілом, способами, описаними в літературі або відомими фахівцю. Сполуки загальної формули (II) або (I), заміщені групою NR 4R5, NR6COR7 або NR6SO2R8, можна одержати з відповідних сполук загальної формули (II) або (I), заміщених нітрогрупою, наприклад, відновленням з подальшим ацилюванням або сульфонілуванням способами, описаними в літературі або відомими фахівцю. Сполуки загальної формули (II) або (I), заміщені групою SO 2NR4R5, можна одержати способом, аналогічним описаному в Pharmazie 1990, 45, 346, або способами, описаними в літературі або відомими фахівцю. Сполуки загальної формули (I) або (II), в якій W означає атом сірки, можна, наприклад, одержати взаємодією відповідних сполук загальної формули (I) або (II), в яких W означає атом кисню, з реагентом, таким як реагент Лавессона. Зі сполук загальної формули (I), в яких R3 відповідає захисній групі, зв'язаній з азотом, такій як ацетил, етоксикарбоніл, третбутилоксикарбоніл або бензилоксикарбоніл, може бути знятий захист хімічними способами, відомими фахівцю, для одержання сполук загальної формули (I), де R3 є атомом водню. Сполуки загальної формули (I), в яких щонайменше один з Z 1, Z2, Z3 і Z4 означає N-оксид, можна, наприклад, одержати взаємодією відповідних сполук загальної формули (I), в яких щонайменше один з Z1, Z2, Z3 і Z4 означає атом азоту, з реагентом, таким як метахлорпербензойна кислота. Сполуки загальної формули (II) зі схеми 1, в яких щонайменше один з Х 1, Х2, Х3 або Х4 означає групу С-R1, де R1 відповідає групі -Si(C1-C6-алкіл)3 і В означає C1-C6-алкоксильну групу, можна одержати, наприклад, способом, який ілюструє схема 2. Схема 2 Відповідно до цього способу сполуки загальної формули (II), такі, що n дорівнює 1, 2 або 3, одержують взаємодією відповідних сполук загальної формули (VI) з реагентом загальної формули (VIII), в якій GP означає відокремлювану групу, таку як атом хлору, брому або йоду, і n дорівнює 1, 2 або 3. Реакція утворення сполук загальної формули (II) може проводитися в присутності основи, такої як гідрид натрію або карбонат калію, в полярному розчиннику, такому як диметилформамід, диметилсульфоксид або ацетон (n=1: Kolasa Т. Bioorg. Med. Chem. 1997, 5(3) 507, n=2: Abramovitch R., Synth. Commun., 1995, 25(1), 1). Якщо сполука загальної формули (VIII) така, що n дорівнює 1, 2 або 3 і GP означає гідроксильну групу, сполуки загальної формули (II) можна одержати взаємодією сполуки загальної формули (VI) і сполуки загальної формули (VIII) в присутності фосфіну, такого як, наприклад, трифенілфосфін, і реагенту, такого як, наприклад, діетилазодикарбоксилат, в розчині в розчиннику, такому як дихлорметан або терагідрофуран (O. Mitsonobu, Synthesis, 1981, 1-28). Аналогічним чином сполуки загальної формули (II) можна одержати взаємодією сполуки загальної формули (VI) і сполуки загальної формули (VIII) в присутності фосфіну, нанесеного на смолу, і реагенту, такого як, наприклад, діізопропілазодикарбоксилат, в розчині в розчиннику, такому як дихлорметан або тетрагідрофуран. Якщо сполука загальної формули (VIII) така, що n дорівнює 0 і GP означає відокремлювану групу, таку як атом хлору, брому або йоду, реакцію утворення сполук загальної формули (II) можна проводити шляхом застосування і адаптації способів, описаних S.L. Buchwald et al. (J. Am. Chem. Soc., 2001, 123, 7727 і 2002, 124, 11684), переважно в інертній атмосфері в основному середовищі, наприклад, в присутності трифосфату калію, в присутності солі міді, такої як йодид міді, можливо в присутності добавки, такої як N,N'-диметилциклогексан-1,2діамін, всі загалом в органічному розчиннику, такому як толуол. 12 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 Сполуки загальної формули (VI) одержують з ароматичних і гетероароматичних альдегідів, заміщених силанілом загальної формули (IV), в якій Х 1, Х2, Х3 або Х4 такі, як визначені в загальній формулі (I), і один з них відповідає силанілу, взаємодією з алкілазидоацетатом загальної формули (VII), в якій В означає С1-С6-алкоксильну групу, таку, наприклад, як етилазидоацетат, в присутності основи, такої як етоксид натрію, в розчиннику, такому як етанол або метанол, для одержання алкілазидо-2-цинаматів загальної формули (V). Ці останні потім перетворюють в складні індольні або азаіндольні ефіри з кип'ятінням із зворотним холодильником розчинника, наприклад, в ксилені або толуолі шляхом адаптації протоколів, описаних в літературі (Hemetsberger et al. Monatsh.Chem., 1969, 100, 1599 1970, 101, 161; Р. Roy et al. Synthesis., 2005, 16, 2751-2757; R. Guilard et al., J. Heterocyclic. Chem., 1981, 18, 1365-1377; W. Rees et al., J. Chem. Soc, perkin trans 1, 1984, 2189-2196; Р. Molina et al., J. Org. Chem., 2003, 68(2), 489-499; З. Мoody et al., J. Chem. Soc., Perkin trans. 1 1984, 2189-2196; J. Sawyer et al. J. Med. Chem, 2005, 48, 893-896; D. Tanner Synlett 2006, 18, 3140-3144). Як альтернатива сполуки загальної формули (VI) можна одержати шляхом розкладання алкілазидо-2-цинамату загальної формули (V) в присутності димерного комплексу родію в розчиннику, такому як толуол, при температурі від 25 °C до 60 °C шляхом адаптації протоколів, описаних в літературі (Tom G. Drivers et al. J.Med.Chem, 2007, 129, 7500-7501; J. Sawyer et al. J. Med. Chem, 2005, 48, 893-896). Ароматичні або гетероароматичні альдегіди, заміщені силанілом загальної формули (IV), якщо вони не є комерційно доступними, можна одержати з відповідних ароматичних або гетероароматичних альдегідів, переважно прихованих, у формі ацеталю, наприклад, заміщених атомом галогену, такого як бром або йод, в положенні, в якому силаніл повинен вводитися: - наприклад, шляхом взаємодії з дисиланом, таким як гексаметилдисилан, в присутності каталітичної кількості металевого комплексу, переважно комплексу паладію, як, наприклад, тетракис(трифенілфосфін)паладій, без розчинника або в розчиннику, переважно полярному, як, наприклад, гексаметилфосфорамід, в присутності основи, такої як, наприклад, карбонат калію, при температурі від 20 °C до температури кипіння розчинника (адаптація протоколів, описаних в літературі: J.Babin et al., J.organometal.Chem., 1993, 446(1-2), 135-138; Е. Shirakawa еt al. Chem. Commun., 2000,1895-1896; L. Goossen et al. Synlett, 2000, 1801-1803; Н. Matsumoto et al. J. organometal. Chem., 1975, 85, C1, FR2677358); - наприклад, взаємодією з дисиланом, таким як гексаметилдисилан, в присутності сильної основи, як, наприклад, метоксид калію або натрію, в полярному розчиннику, як, наприклад, гексаметилфосфоротриамід (НМРТ), при температурі близько 20 °C (адаптація протоколів, описаних в літературі: A.I. Meyers еt al., J. Org Chem., 1977, 42(15), 2654-2655; K.Ishimaru et al., Heterocycles, 2001, 55(8), 1591-1597). Ароматичні або гетероароматичні альдегіди, заміщені силанілом загальної формули (IV), якщо вони не є комерційно доступними, можна також одержати з відповідних дигалогенованих ароматичних або гетероароматичних сполук, таких як дибромоване похідне, в положенні, в якому силаніл повинен вводитися шляхом обміну з органометалом, як, наприклад, н-бутиллітій. Утворені таким чином металеві ароматичні або гетероароматичні сполуки можуть потім взаємодіяти з органогалогеносиланами або перетворюватися в форміловані похідні за допомогою адаптації способів, описаних в літературі: Bao-Hui Ye et al., Tetrahedron., 203, 59, 3593-3601; Р. Pierrat et al., Synlett 2004, 13, 2319-2322; K.T. Warner et al. Heterocycles 2002, 58, 383; D. Deffieux et al., J. organometal. Chem., 194, 13(6), 2415-2422; WO 2005080328; S.G. Davies et al., J. Chem. Soc, perkin trans 1 1991, 501, G. Queguiner et al., J. Org. Chem., 1981,46, 44944497; G.Breton et al. Tetrahedron 2000, 56(10), 1349-1360; S. De Montis et al., Tetrahedron 2004, 60(17), 3915-3920; L. Buchwald et al., J. Am. Chem.Soc., 1998, 120, 4960-4976). Відповідно до одного зі своїх аспектів винахід також стосується сполук загальних формул (IIa), (IIb), (IIc), (IId), (IIe), (IIf), (IIg) і (IIh), в яких Et означає етил. Ці сполуки придатні як проміжні сполуки синтезу сполук формули (I). 13 UA 102837 C2 5 10 15 20 25 30 35 40 45 Складні ефіри (IIa), (IIb), (IIc), (IId), (IIe), (IIf), (IIg) і (IIh) одержують способами, описаними в прикладах 9, 10 14, 16, 21, 38, 40 і 41. Нижченаведені приклади описують одержання деяких сполук за винаходом. Ці приклади ілюструють даний винахід, не обмежуючи його. Номери сполук в прикладах відповідають номерам в таблиці 1. Структури одержаних сполук підтверджені елементарними мікроаналізами, аналізами РХ-МС (рідинна хроматографія в поєднанні з мас-спектрометрією) і спектрами ІЧ або ЯМР. Приклад 1 (сполука 1) N-(1-ацетил-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Ніндол-2-карбоксамід 1.1 5-Фтор-1-(3-фторбензил)-1Н-індол-2-карбонова кислота Вводять водний розчин гідроксиду натрію, одержаний з 1,15 г (28,92 ммоль) таблетки гідроксиду натрію в 50 мл води, в розчин 7,6 г (24,10 ммоль) 5-фтор-1-(3-фторбензил)-1Н-індол2-етилкарбоксилату (WO 2006/024776) в 241 мл етанолу. Суміш нагрівають протягом двох годин, потім концентрують при зниженому тиску. Одержану тверду речовину обробляють в 200 мл води. Розчин промивають два рази по 100 мл простого етилового ефіру, підкисляють шляхом послідовного додавання невеликих кількостей концентрованої соляної кислоти, потім екстрагують за допомогою 200 мл етилацетату. Нарешті, органічну фазу промивають два рази по 100 мл води, один раз 50 мл насиченого розчину хлориду натрію, сушать над сульфатом магнію і концентрують при зниженому тиску. Після сушіння при 50 °C при зниженому тиску одержують 6,4 г цільового продукту у вигляді твердої речовини, який використовують як такий в подальшому синтезі. 1.2 1-Ацетил-5-аміно-2,3-дигідро-1Н-піроло[2,3-b]піридин Інтенсивно перемішують протягом 6 годин при кімнатній температурі і під тиском 5 атмосфер водню суспензію 0,43 г (2,08 ммоль) 1-ацетил-2,3-дигідро-5-нітро-1Н-піроло[2,3b]піридину (Tetrahedron Lett. 1987, 1589) і 0,044 г 10 % паладію на вугіллі в 15 мл етанолу. Після закінчення цього часу суспензію фільтрують через целіт і фільтрат концентрують при зниженому тиску до одержання 0,24 г цільового продукту у вигляді твердої речовини. PF=193-195 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,5 (с, 1H); 6,93 (с, 1H); 5 (с, 2H); 3,91 (д×д, 2H); 2,95 (д×д, 2H); 2,49 (с, 3H). 1.3 N-(1-ацетил-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторбензил)метил]1Н-індол-2-карбоксамід (сполука 1) У перемішуваний при 20 °C розчин 0,28 г (0,97 ммоль) 5-фтор-1-(3-фторбензил)-1Н-індол-2карбонової кислоти, одержаної на стадії 1.1, 186 мг (0,97 ммоль) хлоргідрату N-(3диметиламінопропіл)-N'-етилкарбодііміду (EDAC) і 131 мг (0,97 ммоль) 1-гідроксибензотриазолу (НОВТ) в 15 мл DMF вводять 206 мг (1,17 ммоль) 1-ацетил-5-аміно-2,3-дигідро-1Н-піроло[2,3b]піридину, одержаного на стадії 1.2. Реакційну суміш перемішують протягом 14 годин при 20 °C, потім концентрують при зниженому тиску. Одержаний продукт обробляють в 100 мл води. Потім суспензію екстрагують три рази по 30 мл етилацетату. Об'єднані органічні фази промивають два рази по 20 мл води, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержаний продукт очищають хроматографією на кремнієвій колонці, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 290 мл цільового продукту. PF=186-188 °C. 14 UA 102837 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,4 (с, 1H); 8,07 (с, 1H); 7,6 (м, 1H); 7,56 (м, 1H); 7,43 (с, 1H); 7,33 (м, 1H); 7,19 (м, 1H); 7,08 (м, 1H); 6,90 (м, 2H); 5,9 (с, 2H); 4,05 (д?д, 2H); 3,12 (д×д, 2H); 2,51 (с, 3H). Приклад 2 (сполука 2) N-[1Н-піроло[2,3-b]піридин-5-іл]-5-фтор-1-(3-фторбензил)-1Н-індол-2-карбоксамід Одержання здійснюють аналогічно способу, описаному в прикладі 1.3, з 0,4 г (1,39 ммоль) 5фтор-1-(3-фторбензил)-1Н-індол-2-карбонової кислоти, одержаної на стадії 1.1, і 0,22 г (1,67 ммоль) 5-аміно-1Н-піроло[2,3-b]піридину (Synthesis 2005, 15, 2503). Таким чином, виділяють 0,44 г цільового продукту у вигляді білої твердої речовини. PF=266-267 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,55 (с, 1H); 10,37 (с, 1H); 8,45 (с, 1H); 8,31 (с, 1H); 7,6 (м, 1H); 7,53 (м, 1H); 7,45 (м, 2H); 7,3 (м, 1H); 7,17 (м, 1H); 7,05 (м, 1H); 6,92 (м, 2H); 6;45 (с, 1H); 5,9 (с, 2H). Приклад 3 (сполука 3) N-[2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл]-5-фтор-1-(3-фторбензил)-1Н-індол-2карбоксамід Вводять по краплях 0,62 мл (8,96 ммоль) ацетилхлориду в розчин, перемішуваний при 0 °C, 0,2 г (0,45 ммоль) сполуки 1, описаної на стадії 1.3, в 4 мл метанолу. Потім реактор закривають і суміш струшують протягом 30 хвилин при 20 °C, потім протягом 16 годин при 70 °C. Після закінчення цього часу суміш концентрують при зниженому тиску, потім обробляють 100 мл етилацетату і 50 мл насиченого розчину гідрогенокарбонату натрію. Органічну фазу відділяють, промивають насиченим розчином хлориду натрію, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержаний продукт очищають хроматографією на кремнієвій колонці, елююючи сумішшю дихлорметану і метанолу. Таким чином, виділяють 108 г цільового продукту. PF=230-232 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,19 (с, 1H); 7,98 (с, 1H); 7,6 (с, 1H); 7,55 (м, 2H); 7,34 (м, 2H); 7,19 (м, 1H); 7,09 (м, 1H); 6,9 (м, 2H); 6,22 (с, 1H); 5,9 (с, 2H); 3,5 (д?д, 2H); 3,01 (д×д, 2H). Приклад 4 (сполука 4) N-[1Н-піроло[2,3-b]піридин-6-іл]-5-фтор-1-(3-фторбензил)-1Н-індол-2-карбоксамід Одержання здійснюють способом, аналогічним описаному в прикладі 1.3, з 0,4 г (1,39 ммоль) 5-фтор-1-(3-фторбензил)-1Н-індол-2-карбонової кислоти, одержаної на стадії 1.1, і 0,22 г (1,67 ммоль) 6-аміно-1Н-піроло[3,2-b]піридину (адезис). Таким чином, виділяють 0,22 г цільового продукту у вигляді білої твердої речовини. PF=277-278 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,49 (с, 1H); 10,58 (с, 1H); 8,29 (м, 2H); 7,88 (с, 1H); 7,6 (м, 2H); 7,42 (с, 1H); 7,32 (м, 1H); 7,1 (м, 3H); 6,94 (м, 2H); 5,91 (с, 2H). Приклад 5 (сполука 36) N-[1Н-піроло[2,3-b]піридин-5-іл]-5-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід 5.1 5-Трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2-етилкарбоксилат У розчин 333 мг (1,29 ммоль) 5-трифторметил-1Н-індол-2-етилкарбоксилату в 5 мл сухого толуолу, що знаходиться в інертній атмосфері, вводять при кімнатній температурі 283 мг (2,59 ммоль) 4-піридинілметанолу і 0,92 г (3,826 ммоль) (ціанометилен)трибутилфосфорану (СМВР). Реакційну суміш перемішують при 110 °C протягом 15 хвилин, потім концентрують досуха. Реакційну необроблену речовину потім очищають флеш-хроматографією на кремнієвій колонці, елююючи сумішшю гептану і етилацетату до одержання 386 мг цільового 5-трифторметил-1[(піридин-4-іл)метил]-1Н-індол-2-етилкарбоксилату у вигляді білої твердої речовини. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,46 (д, 2H); 8,22 (с, 1H); 7,80 (д, 1H); 7,62 (д, 1H); 7,58 (с, 1H); 6,93 (д, 2H); 5,95 (с, 2H); 4,28 (кв., 2H); 1,26 (т, 3H). + РХ-МС: 349 [М+Н] . 5.2 N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід У розчин 150 мг (0,43 ммоль) 5-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2етилкарбоксилату, одержаного згідно з протоколом, описаним на попередній стадії, і 69 мг (0,52 моля) піроло[2,3-b]піридин-5-іламіну в 1,5 мл сухого толуолу, що знаходиться в інертній атмосфері, вводять по краплях при 0 °C 0,32 мл (0,645 ммоль) розчину триметилалюмінію (2М/толуол). Реакційну суміш перемішують при 110 °C протягом 15 годин, потім концентрують при зниженому тиску. Необроблену реакційну речовину потім розводять 50 мл нормального розчину HCl і 100 мл етилацетату. Органічну фазу відділяють, промивають 50 мл насиченого 15 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчину натрію хлориду, потім сушать над сульфатом натрію і концентрують при зниженому тиску. Одержаний продукт очищають хроматографією на кремнієвій колонці. Одержують 147 мг цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,62 (с, 1Н); 10,62 (с, 1Н); 8,47 (д, 2H); 8,42 (с, 1H), 8,29-8,24 (м, 2H); 7,76 (д, 1H); 7,66 (с, 1H); 7,58 (дд, 1H); 7,46 (т, 1H); 7,03 (д, 2H); 6,45-6,43 (м, 1H); 6,00 (с, 2H). + РХ-МС: 436 [M+Н] . PF=216-217 °C. Приклад 6 (сполука 5) N-[1Н-піроло[2,3-b]піридин-5-іл]-6-фтор-1-[(3-метилфеніл)метил]-1Н-індол-2-карбоксамід 6.1 Метилу 5-фтор-1-[(3-метилфеніл)метил]-1Н-індол-2-карбоксилат Одержання цієї сполуки здійснюють аналогічно способу, описаному в прикладі 5.1, шляхом взаємодії 475 мг (2,459 ммоль) метилу 6-фтор-1Н-індол-2-карбоксилату з 0,59 мл (4,918 ммоль) 3-метилфенілметанолу в присутності 0,92 г (3,826 ммоль) (ціанометилен)трибутилфосфорану (СМВР). Одержану необроблену суміш потім очищають флеш-хроматографією на кремнієвій колонці в суміші гептану і етилацетату до одержання 539 мг цільового продукту у вигляді безбарвного масла. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,76 (дд, 1H); 7,46 (дд, 1H); 7,40 (с, 1H); 7,14 (т, 1H); 7,06-6,99 (м, 2H); 6,89 (с, 1H); 6,75 (д, 1H); 5,78 (с, 2H); 3,81 (с, 3H); 2,21 (с, 3H). + РХ-МС: 298 [M+Н] . 6.2 N-[1Н-піроло[2,3-b]піридин-5-іл]-5-фтор-1-[(3-метилфеніл)метил]-1Н-індол-2-карбоксамід (сполука 5) Сполуку 5 одержують способом, аналогічним описаному на стадії 5.2, шляхом взаємодії 200 мг (0,673 ммоль) метилу 5-фтор-1-[(3-метилфеніл)метил]-1Н-індол-2-карбоксилату, одержаного згідно з протоколом, описаним на стадії 6.1, з 107 мг (0,807 ммоль) піроло[2,3-b]піридин-5іламіну в присутності 0,5 мл (1,01 ммоль) розчину триметилалюмінію (2М/толуол). Продукт виділяють фільтрацією до одержання 107 мг цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,61 (с, 1H); 10,45 (с, 1H); 8,44 (д, 1H); 8,32 (д, 1H); 7,76 (дд, 1H); 7,47-7,42 (м, 3H); 7,14 (т, 1H); 7,05-6,98 (м, 3H); 6,86 (д, 1H); 6,45 (м, 1H); 5,82 (с, 2H); 2,20 (с, 3H). PF=310-311 °C. Приклад 7 (сполука 30) N-[1Н-піроло[2,3-b]піридин-5-іл]-5-трифторметил-1-[(тіазол-2-іл)метил]-1Н-піроло[2,3b]піридин-2-карбоксамід 7.1 5-Трифторметил-1-[(тіазол-2-іл)метил]-1Н-піроло[2,3-b]піридин-2-етилкарбоксилат Одержання цієї сполуки здійснюють способом, аналогічним описаному в прикладі 5.1, шляхом взаємодії 390 мг (1,51 ммоль) 5-трифторметил-1Н-піроло[2,3-b]піридин-2етилкарбоксилату (WO 2008107543) з 348 мг (3,02 ммоль) тіазол-2-ілметанолу в присутності 0,92 г (3,826 ммоль) (ціанометилен)трибутилфосфорану (СМВР). Реакційну суміш потім очищають флеш-хроматографією на кремнієвій колонці в суміші гептану і етилацетату до одержання 446 мг цільового продукту у вигляді безбарвного масла. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,84 (с, 1H); 8,69 (с, 1H); 7,67 (д, 1H), 7,60 (д, 1H), 7,54 (с, 1H); 6,22 (с, 2H); 4,32 (кв., 2H); 1,28 (т, 3H). + РХ-МС: 356 [M+Н] . 7.2 N-[1Н-піроло[2,3-b]піридин-5-іл]-5-трифторметил-1-[(тіазол-2-іл)метил]-1Н-піроло[2,3b]піридин-2-карбоксамід (сполука 30) Сполуку 30 одержують способом, аналогічним описаному на стадії 5.1, шляхом взаємодії 186 мг (0,523 ммоль) 5-трифторметил-1-[(тіазол-2-іл)метил]-1Н-піроло[2,3-b]піридин-2етилкарбоксилату, одержаного згідно з протоколом, описаним на стадії 7.1, з 84 мг (0,628 ммоль) піроло[2,3-b]піридин-5-іламіну в присутності 0,39 мл (0,785 ммоль) розчину триметилалюмінію (2М/толуол). Продукт виділяють фільтрацією до одержання 144 мг цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,70 (с, 1H); 10,76 (с, 1H); 8,81-8,76 (м, 2H); 8,47 (с, 1H); 8,35 (с, 1H); 7,67-7,58 (м, 3H); 7,50-7,49 (м, 1H); 6,49-6,47 (м, 1H); 6,29 (с, 2H). + РХ-МС: 443 [M+Н] . PF=274-275 °C. Приклад 8 (сполука 37) N-[1Н-піроло[2,3-b]піридин-5-іл]-6-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід 8.1 Метилу 6-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксилат 16 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цю сполуку одержують способом, аналогічним описаному в прикладі 5.1, шляхом взаємодії 500 мг (2,056 ммоль) метилу 6-трифторметил-1Н-індол-2-карбоксилату з 449 мг (4,11 ммоль) 4піридинілметанолу в присутності 0,92 г (3,826 ммоль) (ціанометилен)трибутилфосфорану (СМВР). Реакційну необроблену суміш потім очищають флеш-хроматографією на кремнієвій колонці в суміші гептану і етилацетату до одержання 407 мг цільового продукту у вигляді твердої речовини бежевого кольору. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,46 (д, 2H); 8,09 (с, 1H); 7,99 (д, 1H); 7,54 (с, 1H), 7,46 (д, 1H); 6,90 (д, 2H); 6,00 (с, 2H); 3,82 (с, 3H). + РХ-МС: 335 [M+Н] . 8.2 N-[1Н-піроло[2,3-b]піридин-5-іл]-6-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід (сполука 37) Сполуку 37 одержують способом, аналогічним описаному на стадії 5.2, шляхом взаємодії 150 мг (0,449 ммоль) метилу 6-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксилату, одержаного на попередній стадії, з 72 мг (0,538 ммоль) піроло[2,3-b]піридин-5-іламіну в присутності 0,34 мл (0,674 ммоль) розчину триметилалюмінію (2М/толуол). Продукт виділяють фільтрацією до одержання 99 мг цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,71 (с, 1H); 10,72 (с, 1H); 8,77 (д, 2H); 8,45 (д, 1H), 8,30 (д, 1H); 8,12 (с, 1H); 8,06 (д, 1H); 7,76 (с, 1H); 7,52-7,47 (м, 4H); 6,45 (м, 1H); 6,23 (с, 2H). + РХ-МС: 436 [M+Н] . PF=311-313 °C. Приклад 9 (сполука 6) N-[1Н-піроло[2,3-b]піридин-5-іл]-6-триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід 9.1 2-Азидо-3-(4-триметилсилілфеніл)етилпропеноат У колбу об'ємом 100 мл, яка забезпечена магнітної мішалкою і знаходиться в атмосфері азоту, вводять 1,26 г (54,96 ммоль) натрію і 30 мл безводного етанолу. Реакційну суміш перемішують при кімнатній температурі до одержання однорідного розчину. У цей розчин, охолоджений до -10 °C, вводять по краплях розчин, що містить 16,83 мл (54,96 ммоль) етилазидоацетату (34 % в СН2Cl2) і 5 г (27,48 ммоль) 4-триметилсилілбензальдегіду в 5 мл етанолу. Потім реакційну суміш перемішують при 0 °C протягом 4 годин. Реакційне середовище піддають гідролізу шляхом додавання при інтенсивному перемішуванні 100 мл розчину хлориду амонію (30 % водного). Продукт екстрагують три рази по 50 мл етилацетату. Об'єднані органічні фази промивають два рази по 20 мл води, сушать над сульфатом натрію і концентрують при зниженому тиску. Одержане масло очищають хроматографією на колонці з силікагелем, елююючи сумішшю гептану і дихлорметану. Одержують 4,96 г цільового продукту у вигляді масла жовтого кольору. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,6 (д, 2H); 7,35 (д, 2H); 6,7 (с, 1H); 4,1 (кв., 2H); 1,1 (т, 3H); 0 (с, 9H). 9.2 6-Триметилсиліл-1Н-індол-2-етилкарбоксилат У розчин 1,0 г (3,14 ммоль) 2-азидо-3-(4-триметилсилілфеніл)-етилпропеноату, одержаного на попередній стадії, в 20 мл сухого толуолу, що знаходиться в інертній атмосфері, вводять 0,17 г (0,16 ммоль) димерного комплексу гептафторбутирату диродію (II). Реакційну суміш потім перемішують протягом 12 годин при 70 °C. Після повернення до кімнатної температури реакційну суміш фільтрують через силікагель, елююючи етилацетатом. Потім фільтрат концентрують при зниженому тиску. Залишок очищають хроматографією на колонці з силікагелем, елююючи сумішшю гептану і дихлорметану. Одержують 0,61 г цільового продукту у вигляді порошку бежевого кольору. PF=127-129 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,7 (с, 1H); 7,41 (дд, 1H); 7,39 (д, 1H); 6,97 (дд, 1H); 6,88 (д, 1H); 4,1 (кв., 2H); 1,1 (т, 3H); 0,0 (с, 9H). 9.3 6-Триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2-етилакарбоксилат (сполука IIb) Одержання цієї сполуки здійснюють способом, аналогічним описаному в прикладі 5.1, шляхом взаємодії 500 мг (1,913 ммоль) 6-триметилсиліл-1Н-індол-2-етилкарбоксилату з 0,52 мл (3,826 ммоль) 3-(трифторметил)фенілметанолу в присутності 0,92 г (3,826 ммоль) (ціанометилен)трибутилфосфорану (СМВР). Одержаний необроблений реакційний продукт потім очищають флеш-хроматографією на колонці з силікагелем в суміші гептану і етилацетату до одержання 720 мг цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,49-7,45 (м, 2H); 7,36-7,33 (м, 2H); 7,25 (т, 1H); 7,12 (с, 1H); 7,047,00 (м, 2H); 5,73 (с, 2H); 4,04 (кв., 2H); 1,03 (т, 3H); 0,00 (с, 9H). 17 UA 102837 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 РХ-МС: 420 [M+Н] . 9.4 N-[1Н-піроло[2,3-b]піридин-5-іл]-6-триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід (сполука 6) Сполуку 6 одержують способом, аналогічним описаному на стадії 5.2, шляхом взаємодії 200 мг (0,477 ммоль) 6-триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2етилкарбоксилату, одержаного відповідно до протоколу, описаного на попередній стадії, з 76 мг (0,572 ммоль) піроло[2,3-b]піридин-5-іламіну в присутності 0,36 мл (0,716 ммоль) розчину триметилалюмінію (2М/толуол). Продукт одержують шляхом очищення флеш-хроматографією на колонці з силікагелем в суміші гептану і етилацетату. Одержують 163 мг цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,60 (с, 1H); 10,49 (с, 1H); 8,45 (д, 1H); 8,32 (д, 1H); 7,74-7,68 (м, 3H); 7,51-7,43 (м, 5H); 7,28 (д, 1H); 7,45-7,44 (м, 1H); 6,01 (с, 2H); 0,25 (с, 9H). + РХ-МС: 507 [M+Н] . PF=251-252 °C. Приклад 10 (сполука 7) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід 10.1 1-Бром-3-триметилсилілбензол У розчин 10 г (42,39 ммоль) 1,3-дибромбензолу в 80 мл безводного Et2O, який охолоджений до -78 °C і знаходиться в атмосфері азоту, вводять по краплях при перемішуванні протягом 30 хвилин 26,49 мл (42,39 ммоль) розчину BuLi (1,5М/гексан). Після 30 хвилин додаткового перемішування при -78 °C в реакційну суміш вводять по краплях 5,96 мл (46,63 ммоль) TMSCI. Перемішування підтримують при вказаній температурі протягом 90 хвилин, а потім реакційну суміш піддають гідролізу шляхом введення 15 мл води. Продукт екстрагують етилацетатом (3×50 мл). Об'єднані органічні фази промивають насиченим водним розчином NaCl (2×25 мл), сушать над Na2SO4, фільтрують і випарюють при зниженому тиску. Одержаний необроблений реакційний продукт потім очищають хроматографією на колонці з силікагелем, елююючи гептаном до одержання 9,3 г цільового 1-бром-3-триметилсилілбензолу у вигляді безбарвного масла. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 5,75 (с, 1H), 7,46 (м, 1H), 7,4 (м, 1H), 7,22 (т, 1H), 0,2 (с, 9H). 10.2 3-Триметилсилілбензальдегід У розчин 5 г (21,89 ммоль) 1-бром-3-триметилсилілбензолу, одержаного відповідно до протоколу, описаного на попередній стадії, в 40 мл безводного Et2O, який охолоджений до -0 °C, і знаходиться в атмосфері азоту, вводять по краплях при перемішуванні протягом 30 хвилин 16,36 мл (26,18 ммоль) BuLi (1,6М/гексан). Перемішування продовжують додатково протягом 30 хвилин при 0 °C, потім підтримують при кімнатній температурі протягом 90 хвилин. 2,69 мл (34,91 ммоль) DMF, розведеного в 17 мл безводного Et2O, потім вводять в реакційну суміш. Через 3 години перемішування при кімнатній температурі реакційну суміш піддають гідролізу при 0 °C шляхом послідовного введення 10 мл концентрованого розчину HCl і 100 мл води. Продукт екстрагують 3×50 мл CH2Cl2. Об'єднані органічні фази промивають 100 мл води, сушать над Na2SO4, фільтрують і випарюють при зниженому тиску. Необроблений реакційний продукт очищають флеш-хроматографією на колонці з силікагелем, елююючи з градієнтом від 10 до 20 % CH2Cl2 в гептані до одержання 1,82 г цільового 3-триметилсилілбензальдегіду у вигляді жовтого масла. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,01 (с, 1H); 8,0 (с, 1H); 7,85 (д, 1H); 7,8 (д, 1H); 7,5 (дд, 1H) 0,3 (с, 9H). 10.3 2-Азидо-3-(3-триметилсилілфеніл)етилпропеноат У розчин 2 г (87,5 ммоль) натрію в 30 мл безводного EtOH, який підтримується в атмосфері азоту і охолоджений до -10 °C, вводять по краплях суміш 31,4 мл (87,5 ммоль) етилазидоацетату (34 % в CH2Cl2) і 3,9 г (21,87 ммоль) 3-триметилсилілбензальдегіду, одержаного відповідно до протоколу, описаного на попередній стадії, розведеного в 3 мл EtOH. Реакційну суміш перемішують при 0 °C протягом 4 годин. Потім її піддають гідролізу шляхом введення при інтенсивному перемішуванні 100 мл водного розчину NH 4Cl (30 %). Водну фазу екстрагують 3×50 мл AcOEt. Об'єднані органічні фази промивають водою, сушать над Na 2SO4 і концентрують при зниженому тиску. Необроблений реакційний продукт очищають хроматографією на колонці з силікагелем, елююючи ізократичною сумішшю гептану і CH 2Cl2 (80/20). Таким чином одержують 1,7 г цільового 2-азидо-3-(3триметилсилілфеніл)етилпропеноату у вигляді жовтого масла. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,9 (д, 1H); 7,8 (с, 1H); 7,4 (д, 1H); 7,3 (дд, 1H); 6,9 (с, 1H); 4,2 (кв., 2H); 1,2 (т, 3H); 0,15 (с, 9H). + МС: [МН] = 289. 18 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 10.4 5-Триметилсиліл-1Н-індол-2-етилкарбоксилат У розчин 1,7 г (5,90 ммоль) 2-азидо-3-(3-триметилсилілфеніл)-етилпропеноату, одержаного відповідно до процедури, описаної на попередній стадії, в 25 мл сухого толуолу, що знаходиться в інертній атмосфері, вводять 0,62 г (0,59 ммоль) димерного комплексу гептафторбутирату диродію (II). Реакційну суміш перемішують протягом 7 годин при 40 °C. Другу порцію 0,62 г (0,59 ммоль) димерного комплексу гептафторбутирату диродію (II) вводять в реакційну суміш, підтримуючи перемішування і температуру 40 °C протягом 1 години додатково. Після повернення до кімнатної температури реакційну суміш фільтрують через силікагель, елююючи толуолом. Потім фільтрат концентрують при зниженому тиску. Одержану зеленувату тверду речовину розтирають декілька разів в мінімальній кількості гептану до одержання білого порошку. Останній сушать при зниженому тиску до одержання 0,87 г цільового 5-триметилсиліл1Н-індол-2-етилкарбоксилату у вигляді білого порошку. PF=114-115 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,7 (с, 1H); 7,35 (д, 1H); 7,25 (д, 1H); 7,0 (с, 1H); 4,2 (кв., 2H); 1,2 (т, 3H); 0,15 (с, 9H). РХ-МС: [МН] = 260. 10.5 5-Триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2-етилкарбоксилат (сполука IIа) Цю сполуку одержують способом, аналогічним описаному на стадії 5.1, шляхом взаємодії 0,49 г (1,87 ммоль) 5-триметилсиліл-1Н-індол-2-етилкарбоксилату з 0,51 мл (3,749 ммоль) 3(трифторметил)фенілметанолу в присутності 0,9 г (3,749 ммоль) (ціанометилен)трибутилфосфорану (СМВР). Необроблений реакційний продукт очищають хроматографією на колонці з силікагелем, елююючи сумішшю гептану і етилацетату до одержання 730 мг цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,90 (с, 1H); 7,62-7,57 (м, 2H); 7,51-7,43 (м, 3H); 7,40 (с, 1H); 7,17 (д, 1H); 5,92 (с, 2H); 4,28 (кв., 2H); 1,26 (т, 3H); 0,27 (с, 9H). + РХ-МС: 420 [М+Н] . 10.6 N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід (сполука 7) Сполуку 7 одержують способом, аналогічним описаному на стадії 5.2, шляхом взаємодії 200 мг (0,477 ммоль) 5-триметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2етилкарбоксилату, одержаного відповідно до протоколу, описаного на стадії 10,5, з 76 мг (0,572 ммоль) піроло[2,3-b]піридин-5-іламіну в присутності 0,36 мл (0,716 ммоль) розчину триметилалюмінію (2М/толуол). Продукт одержують фільтруванням до одержання 107 мг цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,51 (с, 1H); 10,38 (с, 1H); 8,34 (д, 1H); 8,21 (д, 1H); 7,80 (с, 1H); 7,51-7,41 (м, 3H); 7,38-7,30 (м, 4H); 7,26-7,23 (м, 1H); 6,36-6,34 (м, 1H); 5,87 (с, 2H); 0,19 (с, 9H). + РХ-МС: 507 [М+Н] . PF=199-200 °C. Приклад 11 (сполука 42) N-(2-оксо-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол2-карбоксамід 11.1 Хлорид 5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбонової кислоти Цей продукт одержують шляхом нагрівання протягом 3 годин розчину 10 г (34,81 ммоль) 5фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбонової кислоти, одержаної на стадії 1.1, і 25,4 мл (0,348 ммоль) сульфонілхлориду в 174 мл толуолу. Після закінчення цього часу реакційну суміш концентрують при зниженому тиску. Одержану суміш обробляють відразу в два прийоми в 10 мл толуолу, потім концентрують при зниженому тиску. Продукт використовують в подальшому синтезі без стадії додаткового очищення. 11.2 N-(2-оксо-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл]-5-фтор-1-[(3-фторфеніл)метил]-1Ніндол-2-карбоксамід (сполука 42) При кімнатній температурі протягом 24 годин перемішують розчин 1,3 г (4,25 ммоль) хлориду 5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбонової кислоти, одержаної на попередній стадії, 2,1 мл (14,9 ммоль) триетиламіну і 1,45 (4,68 ммоль) дибромгідрату 5-аміно2-оксо-2,3-дигідро-1Н-піроло[2,3-b]піридину (US 2005256125) в 42,5 мл дихлорметану. Після закінчення цього часу суміш перекидають в 200 мл води. Додають 100 мл дихлорметану, потім відділяють органічну фазу, яку промивають два рази по 50 мл води і концентрують при зниженому тиску. Одержаний продукт очищають хроматографією на кремнієвій колонці, елююючи сумішшю етилацетату і дихлорметану. Очищений таким чином продукт обробляють в 19 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 60 100 мл гарячого метанолу, одержану суспензію фільтрують. Фільтрат концентрують при зниженому тиску до одержання 0,4 г цільового продукту. PF=272-275 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,94 (с, 1H); 10,49 (с, 1H); 8,32 (с, 1H); 7,95 (с, 1H); 7,6 (м, 1H); 7,55 (м, 1H); 7,41 (с, 1H); 7,31 (м, 1H); 7,17 (м, 1H); 7,05 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 3,58 (с, 2H). Приклад 12 (сполука 19) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-метилфеніл)метил]-1Н-індол-2карбоксамід Цю сполуку одержують відповідно до протоколу, аналогічного описаному в прикладі 5. МР: 311-312 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,6 (с, 1H); 10,6 (с, 1H); 8,5 (с, 1H); 8,35 (с, 1H); 8,2 (с, 1H); 7,8 (д, 1H); 7,55 (м, 2H); 7,5 (м, 1H); 7,15 (т, 1H); 7,0 (м, 2H); 6,9 (д, 1H); 6,5 (д, 1H); 5,9 (с, 2H); 2,2 (с, 3H). Приклад 13 (сполука 20) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[(3-метилфеніл)метил]-1Н-індол-2карбоксамід Цю сполуку одержують відповідно до протоколу, аналогічного описаному в прикладі 5. МР: 278-279 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,7 (с, 1H); 10,6 (с, 1H); 8,5 (с, 1H); 8,4 (с, 1H); 8,05 (с, 1H); 7,95 (д, 1H); 7,50 (м, 2H); 7,45 (д, 1H); 7,15 (т, 1H); 7,05 (д, 1H); 7,0 (с, 1H); 6,9 (д, 1H); 6,5 (с, 1H); 5,95 (с, 2H); 2,2 (с, 3H). Приклад 14 (сполука 21) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(3-метилфеніл)метил]-1Н-індол-2карбоксамід 14.1 5-Триметилсиліл-1-[(3-метилфеніл)метил]-1Н-індол-2-етилкарбоксилат (сполука IIc) Цю сполуку одержують способом, аналогічним описаному на стадії 5.1, шляхом взаємодії 5триметилсиліл-1Н-індол-2-етилкарбоксилату, одержаного способом, описаним на стадії 10.4, з (3-метилфеніл)метанолом в присутності (ціанометилен)трибутилфосфорану (СМВР). Необроблену реакційну речовину потім очищають флеш-хроматографією на колонці з силікагелем до одержання цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,87 (с, 1H); 7,55 (д, 1H); 7,43 (д, 1H); 7,36 (с, 1H); 7,13 (т, 1H); 7,01 (д, 1H); 6,91 (с, 1H); 6,73 (д, 1H); 5,80 (с, 2H); 4,29 (кв., 2H); 2,21 (с, 3H); 1,29 (т, 3H); 0,26 (с, 9H). 14.2 N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(3-метилфеніл)-метил]-1Н-індол-2карбоксамід (сполука 21) Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 327-328 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,6 (с, 1H); 10,4 (с, 1H); 8,5 (с, 1H); 8,3 (с, 1H); 7,9 (с, 1H); 7,55 (д, 1H); 7,45 (м, 1H); 7,4 (м, 2H); 7,15 (т, 1H); 7,0 (м, 2H); 6,9 (д, 1H); 6,45 (д, 1H); 5,85 (с, 2H); 2,2 (с, 3H); 0,3 (с, 9H). Приклад 15 (сполука 22) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-метилфеніл)метил]-1Н-піроло[2,3b]піридин-2-карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 305-306 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,6 (с, 1H); 10,6 (с, 1H); 8,8 (с, 1H); 8,7 (с, 1H); 8,4 (с, 1H); 8,3 (с, 1H); 7,55 (с, 1H); 7,5 (м, 1H); 7,1 (т, 1H); 7,0 (м, 2H); 6,9 (д, 1H); 6,5 (д, 1H); 6,0 (с, 2H); 2,2 (с, 3H). Приклад 16 (сполука 23) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(3-метилфеніл)метил]-1Н-індол-2карбоксамід 16.1 6-Триметилсиліл-1-[(3-метилфеніл)метил]-1Н-індол-2-етилкарбоксилат (сполука IId) Цю сполуку одержують способом, аналогічним описаному на стадії 5.1, шляхом взаємодії 6триметилсиліл-1Н-індол-2-етилкарбоксилату, одержаного способом, описаним на стадії 9.2, з (3-метилфеніл)метанолом в присутності (ціанометилен)трибутилфосфорану (СМВР). Необроблену реакційну речовину потім очищають флеш-хроматографією на колонці з силікагелем до одержання цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,71-7,68 (м, 2H); 7,33 (с, 1H); 7,24-7,21 (м, 1H); 7,14-7,11 (м, 2H); 7,09-7,0 (м, 1H); 6,81-6,79 (м, 1H); 5,85 (с, 2H); 4,30 (кв., 2H); 2,21 (с, 3H); 1,17 (т, 3H), 0,25 (с, 9H). 20 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 60 16.2 N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(3-метилфеніл)-метил]-1Н-індол-2карбоксамід (сполука 23) Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 202-203 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,6 (с, 1H); 10,45 (с, 1H); 8,5 (с, 1H); 8,35 (с, 1H); 7,7 (м, 2H); 7,5 (д, 1H); 7,35 (м, 1H); 7,25 (д, 1H); 7,15 (т, 1H); 7,1 (с, 1H); 7,0 (д, 1H); 6,95 (д, 1H); 6,45 (с, 1H); 5,9 (с, 2H); 2,2 (с, 3H); 0,25 (с, 9H). Приклад 17 (сполука 24) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметилсиліл-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 247-248 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,65 (с, 1H); 10,7 (с, 1H); 8,5 (с, 1H); 8,35 (с, 1H); 8,25 (с, 1H); 7,9 (д, 1H); 7,7-7,5 (м, 6H); 7,4 (м, 1H); 6,5 (м, 1H); 6,1 (с, 2H). Приклад 18 (сполука 25) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 334-335 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,6 (с, 1H); 10,6 (с, 1H); 8,49 (с, 1H); 8,30 (с, 1H); 8,1 (с, 1H); 8,0 (д, 1H); 7,6-7,4 (м, 6H); 7,35 (м, 1H); 6,45 (м, 1H); 6,1 (с, 2H). Приклад 19 (сполука 26) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[[(3-трифторметил)феніл]метил]-1Нпіроло[2,3-b]піридин-2-карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 273-274 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,65 (с, 1H); 10,7 (с, 1H); 8,85 (с, 1H); 8,75 (с, 1H); 8,45 (с, 1H); 8,3 (с, 1H); 7,65-7,35 (м, 6H); 6,5 (м, 1H); 6,1 (с, 2H). Приклад 20 (сполука 27) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[[(3-трифторметил)феніл]метил]-1Н-індол-2карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 288-289 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,6 (с, 1H); 10,45 (с, 1H); 8,45 (д, 1H); 8,25 (д, 1H); 7,8 (м, 1H); 7,65-7,45 (м, 6H); 7,35 (м, 1H); 7,05 (м, 1H); 6,45 (м, 1H); 5,95 (с, 2H). Приклад 21 (сполука 31) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(тіазол-2-іл)метил]-1Н-індол-2карбоксамід 21.1 6-Триметилсиліл-1-[(тіазол-2-іл)метил]-1Н-індол-2-етилкарбоксилат (сполука IIf) Цю сполуку одержують способом, аналогічним описаному на стадії 5.1, шляхом взаємодії 6триметилсиліл-1Н-індол-2-етилкарбоксилату, одержаного способом, описаним на стадії 9.2, з (тієніл-2-іл)метанолом в присутності (ціанометилен)трибутилфосфорану (СМВР). Необроблену реакційну речовину потім очищають флеш-хроматографією на колонці з силікагелем до одержання цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,76 (с, 1H); 7,65-7,61 (м, 2H); 7,52 (д, 1H); 7,28 (с, 1H); 7,22 (с, 1H); 6,09 (с, 2H); 4,23 (кв., 2H); 1,22 (т, 3H); 0,2 (с, 9H). 21.2 N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(тіазол-2-іл)метил]-1Н-індол-2карбоксамід (сполука 31) Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 269-270 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,6 (с, 1H); 10,45 (с, 1H); 8,45 (д, 1H); 8,35 (д, 1H); 7,85 (с, 1H); 7,75 (м, 2H); 7,6 (д, 1H); 7,45 (м, 2H); 7,3 (д, 1H); 6,45 (м, 1H); 6,2 (с, 2H); 0,3 (с, 9H). Приклад 22 (сполука 41) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(піридин-4-іл)метил]-1Н-піроло[2,3b]піридин-2-карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 296-298 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,8 (д, 2H); 8,6 (д, 2H); 8,4 (с, 1H); 8,30 (с, 1H); 7,75 (с, 1H); 7,5 (м, 1H); 7,35 (д, 2H); 6,45 (м, 1H); 6,1 (с, 2H). Приклад 23 (сполука 8) 21 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 60 N-(1Н-піроло[2,3-с]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 203-204 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,5 (с, 1H); 10,59 (с, 1H); 8,57 (с, 1H); 8,25 (с, 1H); 7,52 (м, 4H); 7,31 (м, 1H); 7,15 (м, 1H); 7,03 (м, 1H); 6,92 (м, 2H); 6,5 (м, 1H); 5,92 (с, 2H). Приклад 24 (сполука 9) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-піроло[2,3b]піридин-2-карбоксамід Цю сполуку одержують способом, описаним в прикладі 1.3. МР: 319-320 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,65 (с, 1H); 10,7 (с, 1H); 8,82 (с, 1H); 8,73 (с, 1H); 8,42 (с, 1H); 8,3 (с, 1H); 7,6 (с, 1H); 7,5 (с, 1H); 7,31 (м, 1H); 7,09 (м, 1H); 6,98 (м, 2H); 6,49 (м, 1H); 6,01 (с, 2H). Приклад 25 (сполука 10) N-(7-окси-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2карбоксамід Цю сполуку одержують шляхом перемішування протягом 30 годин при 20 °C суміші 0,5 г (1,24 моля) сполуки 2 (приклад 2) в присутності 0,66 г (2,74 ммоль) метахлорпербензойної кислоти в 130 мл дихлорметану. Після закінчення цього часу суміш виливають в 200 мл води і 200 мл дихлорметану. Органічну фазу відділяють, промивають один раз 100 мл насиченого розчину гідрогенокарбонату натрію, два рази по 100 мл води, сушать над сульфатом магнію, потім концентрують при зниженому тиску. Одержаний продукт очищають хроматографією на колонці з силікагелем, виділяють 0,13 г цільового продукту. МР: 260-263 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 12,41 (с, 1H); 10,6 (с, 1H); 8,59 (с, 1H); 8,03 (с, 1H); 7,6 (м, 2H); 7,42 (м, 2H); 7,31 (м, 1H); 7,19 (м, 1H); 7,05 (м, 1H); 6,93 (м, 2H); 6,59 (с, 1H); 5,89 (с,2H). Приклад 26 (сполука 12) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2карбоксамід 26.1 5-Фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід У суспензію, при перемішуванні при 20 °C, 2 г (6,96 ммоль) 5-фтор-1-[(3-фторфеніл)метил]1Н-індол-2-карбонової кислоти, одержаної на стадії 1.1, в 80 мл сухого толуолу, вводять 5,08 мл (69,62 ммоль) тіонілхлориду. Реакційну суміш перемішують протягом 2 годин при нагріванні із зворотним холодильником, потім концентрують при зниженому тиску. Одержаний продукт обробляють 10 мл дихлорметану і цей розчин виливають по краплях в розчин 9,12 мл (69,62 ммоль) 30 % аміаку у воді. Реакційну суміш перемішують протягом 14 годин при 20 °C. Після закінчення цього часу одержують за допомогою фільтрації тверду речовину, яку подрібнюють в 50 мл простого діізопропілового ефіру. Після фільтрації і сушіння при зниженому тиску одержують 0,58 г цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,11 (ушир. пік, 1H); 7,5 (м, 3H); 7,32 (м, 1H); 7,25 (с, 1H); 7,09 (м, 2H); 6,89 (м, 2H); 5,91 (с, 2H). 26.2 N-(1-метилпіроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2карбоксамід (сполука 26) У колбу під тиском, забезпечену магнітною мішалкою, вводять 0,4 г (1,4 ммоль) аміду, одержаного на попередній стадії, 0,32 г (1,54 ммоль) 5-бром-1-метилпіроло[2,3-b]піридину (heterocycles 2003, 60(4) 865), 0,08 г (0,42 ммоль) йодиду міді, 0,39 г (2,79 ммоль) карбонату калію і 10 мл сухого діоксану. Суспензію дегазують, потім додають 53 мг (0,46 ммоль) трансциклогексан-1,2-діаміну, закривають колбу і нагрівають до 120 °C при перемішуванні протягом 16 годин. Після закінчення цього часу в середовище вводять 50 мл етилацетату і 50 мл води. Водну фазу відділяють, потім екстрагують 2×30 мл етилацетату. Органічні фази об'єднують, промивають 50 мл води, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержаний продукт очищають хроматографією на кремнієвій колонці, елююючи сумішшю дихлорметану і ацетону, потім перекристалізовують в ізопропіловий спирт. МР: 203-204 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,51 (с, 1H); 8,51 (с, 1H); 8,36 (с, 1H); 7,59 (м, 2H); 7,55 (с, 1H); 7,46 (с, 1H); 7,32 (м, 1H); 7,19 (м, 1H); 7,08 (м, 1H); 6,93 (м, 2H); 6,49 (с, 1H); 5,9 (с, 2H); 3,82 (с, 3H). Приклад 27 (сполука 11) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-індол2-карбоксамід Цю сполуку одержують способом, аналогічним описаному в прикладі 26. 22 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 60 МР: 249-250 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,5 (с, 1H); 8,36 (с, 1H); 8,22 (с, 1H); 7,81 (м, 1H); 7,6 (м, 2H); 7,54 (с, 1H); 7,32 (м, 1H); 7,07 (м, 1H); 6,97 (м, 2H); 6,49 (с, 1H); 5,99 (с, 2H); 3,82 (с, 3H). Приклад 28 (сполука 13) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Нпіроло[2,3-b]піридин-2-карбоксамід Цю сполуку одержують способом, аналогічним описаному в прикладі 26. МР: 237-238 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,69 (с, 1H); 8,82 (с, 1H); 8,76 (с, 1H); 8,49 (с, 1H); 8,33 (с, 1H); 7,62 (с, 1H); 7,53 (д, 1H); 7,32 (м, 1H); 7,07 (м, 1H); 6,99 (м, 2H); 6,5 (д, 1H); 6,00 (с, 2H); 3,82 (с, 3H). Приклад 29 (сполука 14) N-(1-метил-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Ніндол-2-карбоксамід 29.1 5-Бром-2,3-дигідро-1-метилпіроло[2,3-b]піридин У суспензію, перемішувану при 0 °C в інертній атмосфері, 0,48 г (12,06 ммоль) 60 % гідриду натрію в 5 мл диметилформаміду, вводять по краплях розчин 5-бром-2,3-дигідро-1Н-піроло[2,3b]піридину в 10 мл диметилформаміду. Суміш перемішують протягом 15 хвилин при 0 °C, потім при 20 °C протягом 45 хвилин. Потім додають в цю суспензію, перемішувану при 0 °C, розчин 0,77 мл (12,06 ммоль) йодиду метилу в 5 мл диметилформаміду. Потім суміш перемішують протягом 48 годин. Після цього в суміш додають 50 мл води і 50 мл етилацетату. Водну фазу відділяють, потім екстрагують 3×30 мл етилацетату. Органічні фази збирають, промивають 2×50 мл води, потім концентрують при зниженому тиску. Одержаний продукт очищають хроматографією на кремнієвій колонці, елююючи сумішшю дихлорметану і метанолу. Таким чином одержують 0,97 г цільового продукту. + РХ-МС: 213 [M+Н] . 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,81 (с, 1H); 7,39 (с, 1H); 3,46 (т, 2H); 2,94 (т, 2H); 2,82 (с, 3H). 29.2 N-(1-метил-2,3-дигідро-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Ніндол-2-карбоксамід (сполука 14) Цю сполуку одержують способом, аналогічним описаному в прикладі 26. МР: 189-191 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,21 (с, 1H); 8,06 (с, 1H); 7,65 (с, 1H); 7,57 (м, 2H); 7,35 (м, 2H); 7,18 (м, 1H); 7,05 (м, 1H); 6,91 (м, 2H); 5,9 (с, 2H); 3,42 (т, 2H); 2,95 (т, 2H); 2,85 (с, 3H). Приклад 30 (сполука 15) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід Цю сполуку одержують способом, аналогічним описаному в прикладі 26. МР: 211-212 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,49 (с, 1H); 8,51 (с, 1H); 8,35 (с, 1H); 7,79 (д, 1H); 7,54 (м, 6H); 7,39 (м, 1H); 7,31 (м, 1H); 7,19 (м, 1H); 6,47 (с, 1H); 6,0 (с, 2H); 3,84 (с, 3H). Приклад 31 (сполука 28) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід Цю сполуку одержують способом, аналогічним описаному в прикладі 26. МР: 176-177 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,51 (с, 1H); 8,7-8,4 (ушир. пік + с, 3H); 8,35 (с, 1H); 7,59 (м, 2H); 7,5 (м, 2H); 7,2 (м, 2H); 7,09 (ушир. пік, 1H); 6,48 (с, 1H); 5,91 (с, 2H); 3,85 (с, 3H). Приклад 32 (сполука 29) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(піридин-3-іл)метил]-1Н-індол-2карбоксамід Цю сполуку одержують способом, аналогічним описаному в прикладі 26. МР: 214-215 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,52 (с, 1H); 8,51 (с, 1H); 8,46 (с, 2H); 8,37 (с, 1H); 7,69 (м, 1H); 7,55 (м, 4H); 7,34 (м, 1H); 7,19 (м, 1H); 6,49 (с, 1H); 5,95 (с, 2H); 3,82 (с, 3H). Приклад 33 (сполука 16) N-(1-метилпіроло[2,3-b]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід 33.1 6-Бром-1-метилпіроло[2,3-b]піридин Цю сполуку одержують способом, аналогічним описаному в прикладі 29.1, з комерційного 6бром-1Н-піроло[2,3-b]піридину. + РХ-МС: 211[M+Н] . 23 UA 102837 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,92 (д, 1H); 7,53 (с, 1H); 7,28 (д, 1H); 6,5 (с, 1H); 3,82 (с, 3H). 33.2 N-(1-метилпіроло[2,3-b]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2карбоксамід (сполука 16) Цю сполуку одержують способом, аналогічним описаному в прикладі 26 з одержаного на попередній стадії 6-бром-1-метилпіроло[2,3-b]піридину. МР: 189-191 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,8 (с, 1H); 7,99 (д, 1H); 7,81 (д, 1H); 7,59 (м, 2H); 7,53 (м, 1H); 7,45 (с, 1H); 7,32 (м, 1H); 7,18 (м, 1H); 7,05 (м, 1H); 6,91 (м, 2H); 6,49 (с, 1H); 5,93 (с, 2H); 3,84 (с, 3H). Приклад 34 (сполука 17) N-(1-метил-1-Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[[(3-трифторметил)феніл]метил]-1Ніндол-2-карбоксамід Цю сполуку одержують способом, аналогічним описаному в прикладі 26. МР: 181-182 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,56 (с, 1H); 8,5 (с, 1H); 8,32 (с, 1H); 7,45-7,7 (м, 7H); 7,38 (м, 1H); 7,15 (м, 1H); 6,48 (с, 1H); 6,0 (с, 2H); 3,79 (с, 3H). Приклад 35 (сполука 18) N-(1-метил-1-Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(3-метилфеніл)метил]-1Н-індол-2карбоксамід Цю сполуку одержують способом, аналогічним описаному в прикладі 26. МР: 185-186 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,51 (с, 1H); 8,5 (с, 1H); 8,37 (с, 1H); 7,56 (м, 3H); 7,4 (с, 1H); 7,16 (м, 2H); 7,0 (м, 2H); 6,87 (м, 1H); 6,48 (с, 1H); 5,87 (с, 2H); 3,82 (с, 3H); 2,2 (с, 3H). Приклад 36 (сполука 32) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(тіазол-2-іл)метил]-1Н-індол-2карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному прикладі 5. МР: 218-219 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,9 (с, 1H); 10,75 (с, 1H); 8,6 (с, 1H); 8,5 (с, 1H); 8,2 (с, 1H); 7,95 (д, 1H); 7,7 (д, 1H); 7,65 (м, 3H); 7,5 (м, 1H); 6,55 (м, 1H); 6,2 (с, 2H). Приклад 37 (сполука 33) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-трифторметил-1-[(тіазол-2-іл)метил]-1Н-індол-2карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 165-166 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,8 (с, 1H); 10,7 (с, 1H); 8,6 (с, 1H); 8,45 (с, 1H); 8,2 (с, 1H); 7,95 (д, 1H); 7,75 (д, 1H); 7,6 (м, 2H); 7,5 (м, 2H); 6,55 (м, 1H); 6,3 (с, 2H). Приклад 38 (сполука 34) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(тіазол-2-іл)метил]-1Н-індол-2карбоксамід 38.1 5-Триметилсиліл-1-[(тіазол-2-іл)метил]-1Н-індол-2-етилкарбоксилат (сполука IIe) Цю сполуку одержують згідно з протоколом, аналогічним описаному на стадії 5.1, шляхом взаємодії 5-триметилсиліл-1Н-індол-2-етилкарбоксилату, одержаного способом, описаним на стадії 10.4, з (тієніл-2-іл)метанолом в присутності (ціанометилен)трибутилфосфорану (СМВР). Необроблену реакційну речовину потім очищають флеш-хроматографією на колонці з силікагелем до одержання цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 7,80 (с, 1H); 7,64 (д, 1H); 7,61 (д, 1H); 7,51 (д, 1H); 7,40 (д, 1H); 7,30 (с, 1H); 6,04 (с, 2H) 4,24 (кв., 2H); 1,23 (т, 3H); 0,19 (с, 9H). 38.2 N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(тіазол-2-іл)метил]-1Н-індол-2карбоксамід (сполука 34) Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 213-214 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,7 (с, 1H); 10,45 (с, 1H); 8,5 (д, 1H); 8,35 (д, 1H); 7,9 (с, 1H); 7,75-7,65 (м, 2H); 7,6 (д, 1H); 7,5-7,4 (м, 3H); 6,5 (м, 1H); 6,2 (с, 2H); 0,3 (с, 9H). Приклад 39 (сполука 35) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[(тіазол-2-іл)метил]-1Н-індол-2-карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 255-256 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,6 (с, 1H); 10,45 (с, 1H); 8,45 (д, 1H); 8,35 (д, 1H); 7,75 (м, 2H); 7,65-7,45 (м, 4H); 7,05 (м, 1H); 6,45 (м, 1H); 6,2 (с, 2H). 24 UA 102837 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 40 (сполука 38) N-(1-Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід 40.1 6-Триметилсиліл-1-[(піридин-2-іл)метил]-1Н-індол-2-етилкарбоксилат Цю сполуку одержують способом, аналогічним описаному на стадії 5.1, шляхом взаємодії 6триметилсиліл-1Н-індол-2-етилкарбоксилату, одержаного способом, описаним на стадії 9.2, з (піридин-2-іл)метанолом в присутності (ціанометилен)трибутилфосфорану (СМВР). Необроблену реакційну речовину потім очищають флеш-хроматографією на колонці з силікагелем до одержання цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,2 (д, 2H); 7,49 (д, 1H); 7,42 (с, 1H); 7,15 (с, 1H); 7,05 (д, 1H); 6,70 (д, 2H); 5,68 (с, 2H); 4,01 (кв., 2H); 1,01 (т, 3H); 0,0 (с, 9H). 40.2 N-(1Н-піроло[2,3-b]піридин-5-іл)-6-триметилсиліл-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід (сполука 38) Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 235-236 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,45 (м, 3H); 8,30 (д, 1H); 7,75 (д, 1H); 7,65 (с, 1H); 7,5 (м, 2H); 7,3 (д, 1H); 7,0 (д, 2H); 6,45 (д, 1H); 6,0 (с, 2H); 0,25 (с, 9H). Приклад 41 (сполука 39) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід 41.1 5-Триметилсиліл-1-[(піридин-4-іл)метил]-1Н-індол-2-етилкарбоксилат (сполука IIg) Цю сполуку одержують способом, аналогічним описаному на стадії 5.1, шляхом взаємодії 5триметилсиліл-1Н-індол-2-етилкарбоксилату, одержаного способом, описаним на стадії 10.4, з (піридин-2-іл)метанолом в присутності (ціанометилен)трибутилфосфорану (СМВР). Необроблену реакційну речовину потім очищають флеш-хроматографією на колонці з силікагелем до одержання цільового продукту. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,37 (д, 2H), 7,83 (с, 1H), 7,47 (д, 1H), 7,37 (д, 1H), 7,34 (с, 1H), 6,84 (д, 2H), 5,80 (с, 2H), 4,18 (кв., 2H), 1,18 (т, 3H), 0,19 (с, 9H). 41.2 N-(1Н-піроло[2,3-b]піридин-5-іл)-5-триметилсиліл-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід (сполука 39) Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 279-281 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 8,45 (м, 3H); 8,30 (д, 1H); 7,9 (с, 1H); 7,6-7,35 (м, 4H); 7,0 (д, 2H); 6,45 (м, 1H); 5,9 (с, 2H); 0,3 (с, 9H). Приклад 42 (сполука 40) N-(1Н-піроло[2,3-b]піридин-5-іл)-6-фтор-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 284-286 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,6 (с, 1H); 10,4 (с, 1H); 8,45 (д, 2H); 8,4 (д, 1H); 8,3 (с, 1H); 7,8 (м, 1H); 7,55 (с, 1H); 7,45 (м, 2H); 7,0 (м, 3H); 6,45 (м, 1H); 5,9 (с, 2H). Приклад 43 (сполука 43) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-(3-фторбензил)-1Н-індол-2-карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 1.3. МР: 286-287 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,61 (с, 1H); 10,62 (с, 1H); 8,47 (с, 1H); 8,35 (с, 1H); 8,21 (с, 1H); 7,82 (д, 1H); 7,6 (м, 2H); 7,5 (с, 1H); 7,33 (м, 1H); 7,08 (м, 1H); 6,98 (м, 2H); 6,48 (с, 1H); 5,98 (с, 2H). Приклад 44 (сполука 44) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-1-[(3-фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 26. МР: 225-227 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,8 (с, 1H); 9,08 (с, 1H); 8,49 (д, 1H); 8,38 (д, 1H); 8,27 (д, 1H); 7,72 (д, 1H); 7,55 (д, 1H); 7,47 (с, 1H); 7,32 (м, 1H); 7,02 (м, 3H); 6,45 (м, 1H); 5,95 (с, 2H); 3,82 (с, 3H). Приклад 45 (сполука 45) N-(1Н-піроло[2,3-b]піридин-5-іл)-1-[(3-фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 26. МР: 270-271 °C. 25 UA 102837 C2 1 5 10 15 20 25 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,62 (с, 1H); 10,68 (с, 1H); 9,04 (с, 1H); 8,49 (д, 1H); 8,38 (д, 1H); 8,28 (д, 1H); 7,73 (д, 1H); 7,4 (м, 3H); 7,05 (м, 3H); 6,49 (с, 1H); 6,01 (с, 2H). Приклад 46 (сполука 46) N-(1Н-піроло[2,3-b]піридин-5-іл)-5-фтор-1-[(піридин-4-іл)метил]-1Н-індол-2-карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 259-260 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 11,6 (с, 1H); 10,5 (с, 1H); 8,48 (м, 3H); 8,3 (с, 1H); 7,55 (м, 2H); 7,48 (м, 2H); 7,18 (м, 1H); 7,02 (м, 2H); 6,45 (с, 1H); 5,95 (с, 2H). Приклад 47 (сполука 47) N-(1-метил-1Н-піроло[2,3-b]піридин-5-іл)-5-трифторметил-1-[(піридин-4-іл)метил]-1Н-індол-2карбоксамід Цю сполуку одержують згідно з протоколом, аналогічним описаному в прикладі 5. МР: 213-214 °C. 1 H-ЯМР (ДМСО-D6) δ (м.ч.): 10,63 (с, 1H); 8,49 (м, 3H); 8,35 (с, 1H); 8,27 (с, 1H); 7,78 (д, 1H); 7,7 (с, 1H); 7,6 (д, 1H); 7,52 (д, 1H); 7,04 (м, 2H); 6,49 (с, 1H); 6,02 (с, 2H); 3,82 (с, 3H). Нижченаведена таблиця 1 ілюструє хімічні структури і фізичні властивості декількох прикладів сполук за винаходом. На цій таблиці: - в колонці "PF (°С)" вказані точки плавлення продуктів в градусах Цельсія (°С); - всі сполуки знаходяться у формі вільної основи; - W означає атом кисню, - Z2 визначать атом вуглецю, зв'язаний з атомом азоту аміду формули (I); - n дорівнює 1, - R означає замісник фенільної групи, - "Ме" означає метильну групу. 26 UA 102837 C2 27 UA 102837 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAzabicyclic carboxamide derivatives, preparation thereof and therapeutic use thereof
Автори англійськоюDubois, Laurent, Evanno, Yannick, Machnik, David, Malanda, Andre
Назва патенту російськоюПроизводные азабициклических карбоксамидов, их получение и их применение в терапии
Автори російськоюДюбуа Лоран, Эванно Янник, Машник Давид, Маланда Андрэ
МПК / Мітки
МПК: C07D 471/04, A61P 29/00, A61P 31/00, A61P 11/00, A61K 31/437
Мітки: одержання, терапії, азабіциклічних, карбоксамідів, похідні, застосування
Код посилання
<a href="https://ua.patents.su/40-102837-pokhidni-azabiciklichnikh-karboksamidiv-kh-oderzhannya-i-kh-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні азабіциклічних карбоксамідів, їх одержання і їх застосування в терапії</a>
Попередній патент: Радіохвильовий структуроскоп для геофізичних досліджень
Наступний патент: Спосіб підготовки металевих деталей до холодної обробки тиском
Випадковий патент: Керований динамічний електромагнітний гасник коливань