Спосіб отримання інгенол-3-ангелату
Номер патенту: 111827
Опубліковано: 24.06.2016
Автори: Груе-Серенсен Гуннар, Лян Сіфу, Петерсен Андерс Кларскоу, Хегберг Томас, Хорнеман Анне Марія
Формула / Реферат
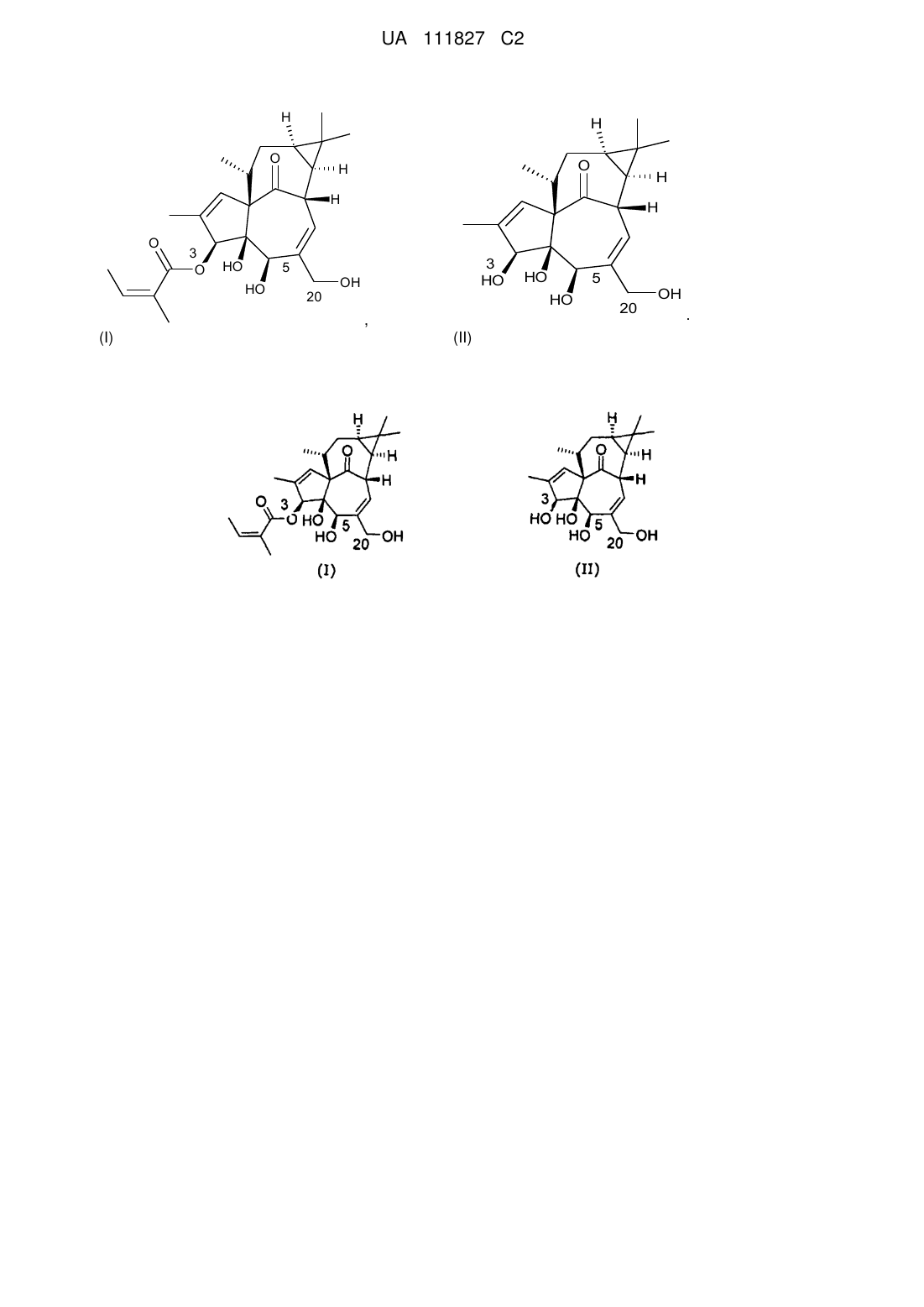
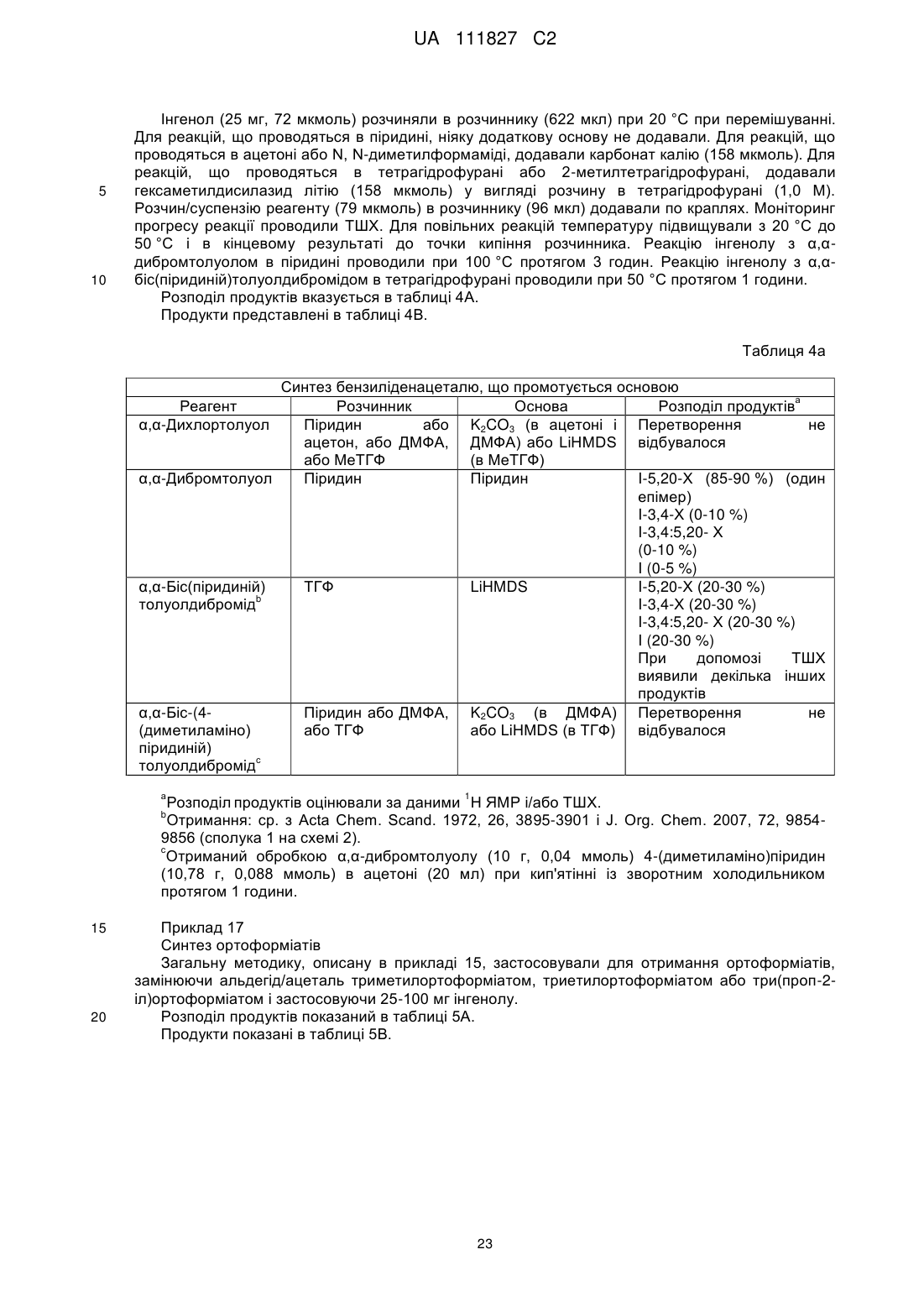
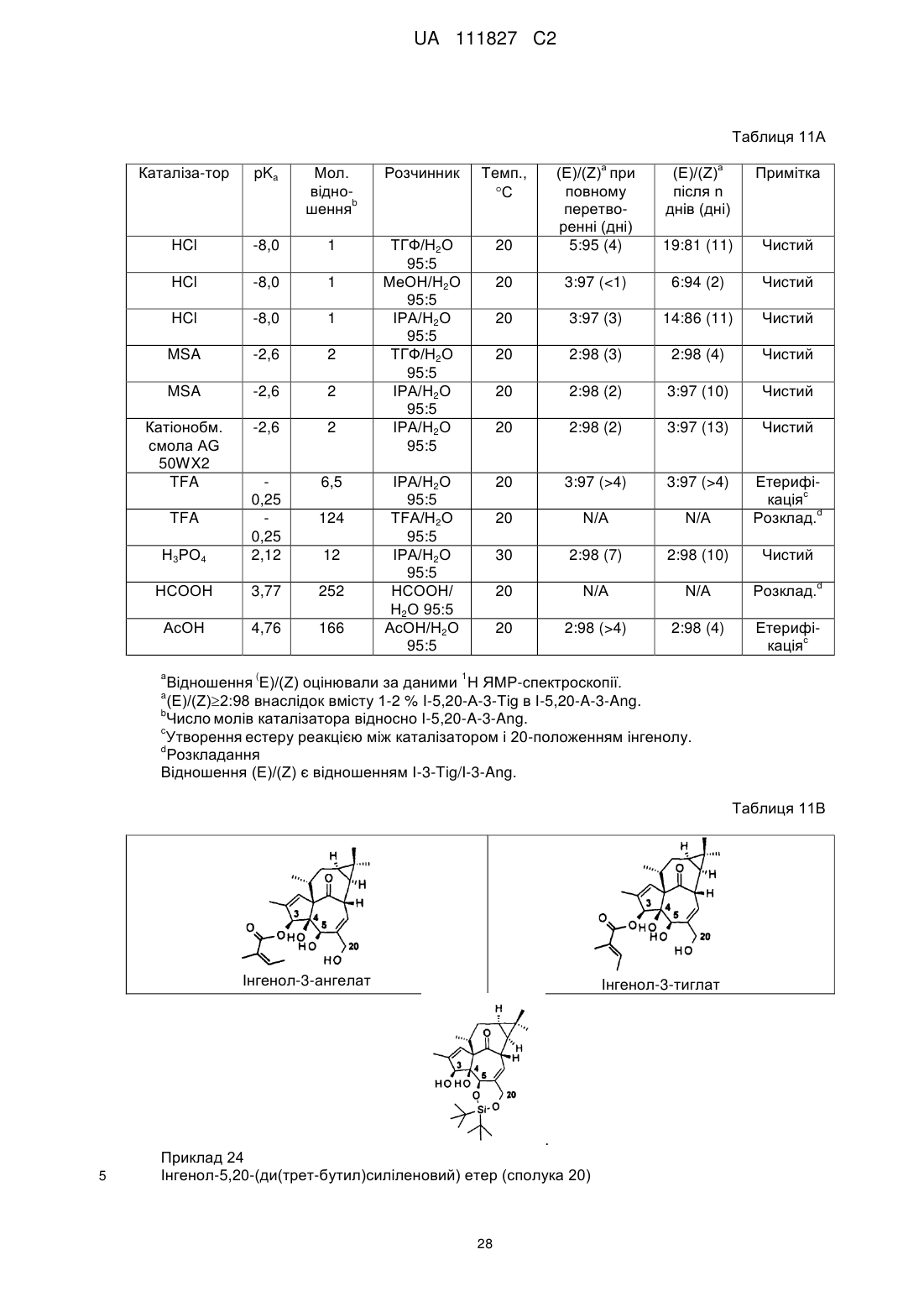
1. Спосіб отримання інгенол-3-ангелату (1aR,2S,5R,5aS,6S,8aS,9R,10aR)-5,5а-дигідрокси-4-(гідроксиметил)-1,1,7,9-тетраметил-11-оксо-1а,2,5,5а,6,9,10,10а-октагідро-1Н-2,8а-метаноциклопента[a]циклопропа[е]циклодецен-6-ілового естеру 2-метил-2(Z)-бутенової кислоти (I) з інгенолу (II),
 ,
,
 ,
,
(I)
(II)
що включає наступні стадії:
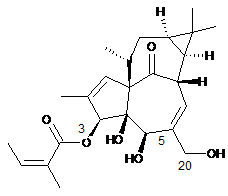
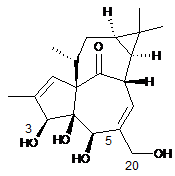
(а) реакція однієї або обох гідроксильних груп в положеннях 5 і 20 інгенолу з прийнятними гідроксилзахисними агентами, однаковими або різними, з отриманням сполуки загальної формули (III) або (IV)
 ,
,
 ,
,
(III)
(IV)
в яких R1 являє собою водень або гідроксилзахисну групу і R2 являє собою водень або гідроксилзахисну групу, за умови, що R1 і R2 одночасно не являють собою водень, або в яких D являє собою дигідроксилзахисну групу,
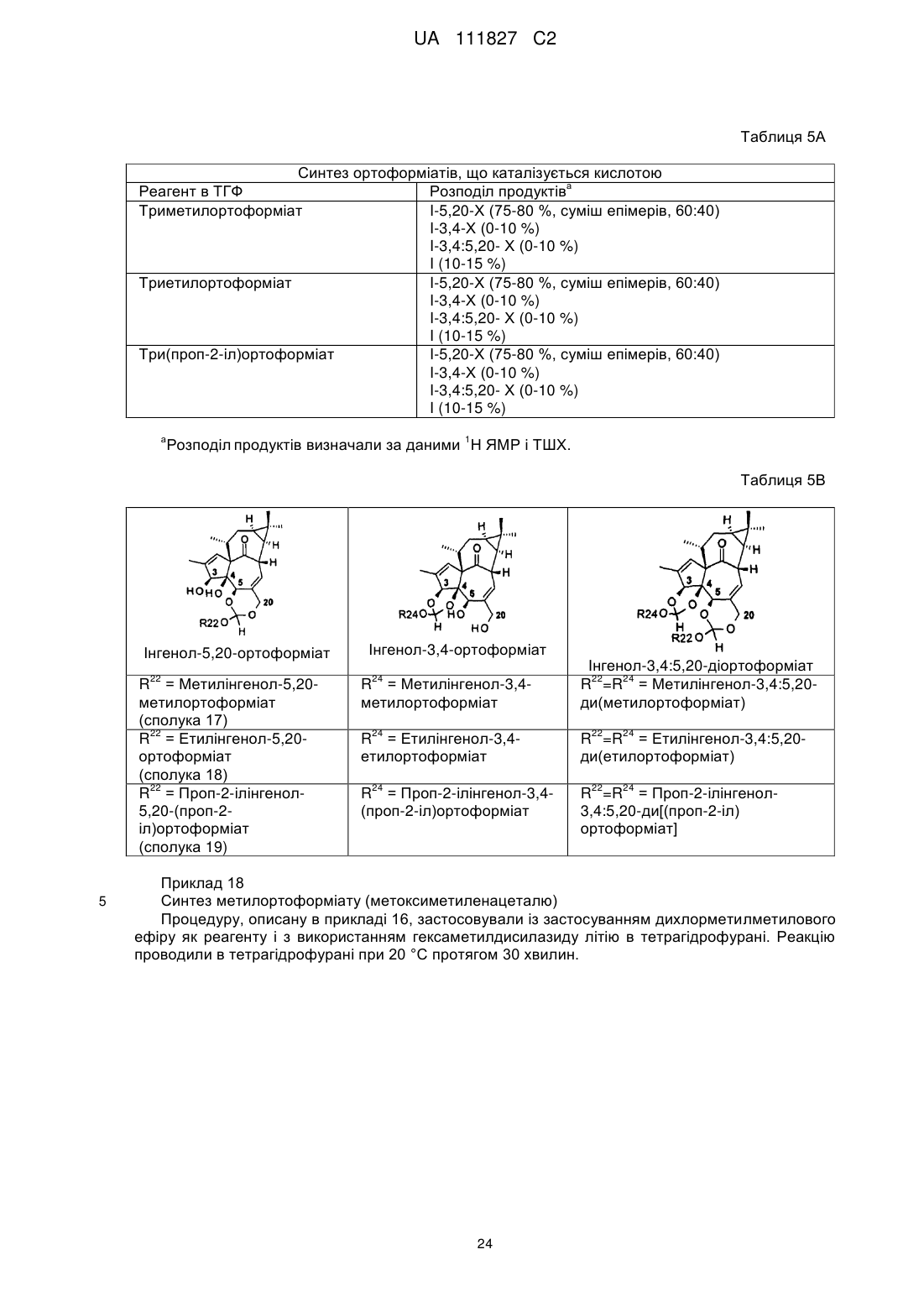
(b) етерифікація гідроксильної групи в положенні 3 сполук (III) або (IV) з отриманням сполук загальної формули (V) або (VI)
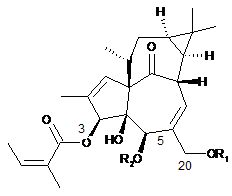 ,
,
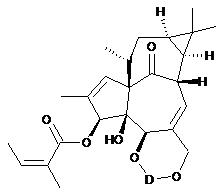 ,
,
(V)
(VI)
в яких R1, R2 і D мають значення, вказані вище, і
(с) видалення гідроксилзахисних груп R1 і/або R2 у сполуці (V) або D у сполуці (VI) з отриманням інгенол-3-ангелату (I).
2. Спосіб отримання інгенол-3-ангелату (1aR,2S,5R,5aS,6S,8aS,9R,10aR)-5,5а-дигідрокси-4-(гідроксиметил)-1,1,7,9-тетраметил-11-оксо-1а,2,5,5а,6,9,10,10а-октагідро-1Н-2,8а-метаноциклопента[a]циклопропа[е]циклодецен-6-ілового естеру 2-метил-2(Z)-бутенової кислоти (I) з інгенолу (II)
 ,
,
 ,
,
(I)
(II)
який включає стадію
(f) селективної естерифікації 3-гідроксильної групи сполуки (II) з отриманням інгенол-3-ангелату (I).
3. Спосіб за п. 1, де R1 являє собою водень або етерну, ацетальну, кетальну, силільну етерну, естерну, карбонатну або сульфенатну групу, що є гідроксилзахисною групою, і R2 може являти собою водень або етерну, ацетальну, кетальну, силільну етерну, естерну, карбонатну або сульфенатну групу, що є гідроксилзахисною групою.
4. Спосіб за п. 1, де D являє собою ацетальну, кетальну, діацетальну, дикетальну, ортоестерну, силільну, боронатну або карбонатну групу, що є дигідроксилзахисною групою.
5. Спосіб за п. 1 або 3, де R1 вибраний з групи, що складається з водню або [(3,4-диметоксибензил)окси]метилу, гваяколметилу, 2-метоксіетоксиметилу, тетрагідропіранілу, тетрагідрофуранілу, 1-етоксіетилу, 1-метил-1-метоксіетилу, алілу, пренілу, п-метоксибензилу, трифенілметилу, 2-(триметилсиліл)етоксиметилу, триетилсилілу, триізопропілсилілу, трет-бутилдиметилсилілу, диметилізопропілсилілу, діетилізопропілсилілу, трет-бутилдифенілсилілу, трифенілсилілу, ацетилу, хлорацетилу, феноксіацетилу або ангелоїлу.
6. Спосіб за п. 1, 3 або 4, де R2 вибраний з групи, що складається з водню або [(3,4-диметоксибензил)окси]метилу, гваяколметилу, 2-метоксіетоксиметилу, тетрагідропіранілу, тетрагідрофуранілу, 1-етоксіетилу, 1-метил-1-метоксіетилу, алілу, пренілу, п-метоксибензилу, трифенілметилу, 2-(триметилсиліл)етоксиметилу, триетилсилілу, триізопропілсилілу, трет-бутилдиметилсилілу, диметилізопропілсилілу, діетилізопропілсилілу, трет-бутилдифенілсилілу, трифенілсилілу, ацетилу, хлорацетилу, феноксіацетилу або ангелоїлу.
7. Спосіб за п. 1 або 4, де D вибраний з групи, що складається з ізопропілідену, циклопентилідену, циклогексилідену, п-метоксибензилідену, метоксиметилену, 2-оксациклопентилідену, 2,3-диметоксибутан-2,3-діїлу, 1,2-диметоксициклогексан-1,2-діїлу, октагідро[2,2']дипіран-2,2'-діїлу, ди-трет-бутилсилілену, 1,3-(1,1,3,3-тетраізопропілдисилоксанілідену), фенілборонату, 3-пентилідену, 2,4-диметил-3-пентилідену, 2,6-диметил-4-гептилідену, 3,3-диметил-2-бутилідену, 1-феніл-1-етилідену, бензилідену, 2,4-диметоксибензилідену, 4-нітробензилідену, 2,4,6-триметилбензилідену, 2,2-диметил-1-пропілідену, етоксиметилену або ізопропоксиметилену.
8. Спосіб за п. 1, 3 або 5, де R1 являє собою гідроксилзахисну групу і R2 являє собою водень.
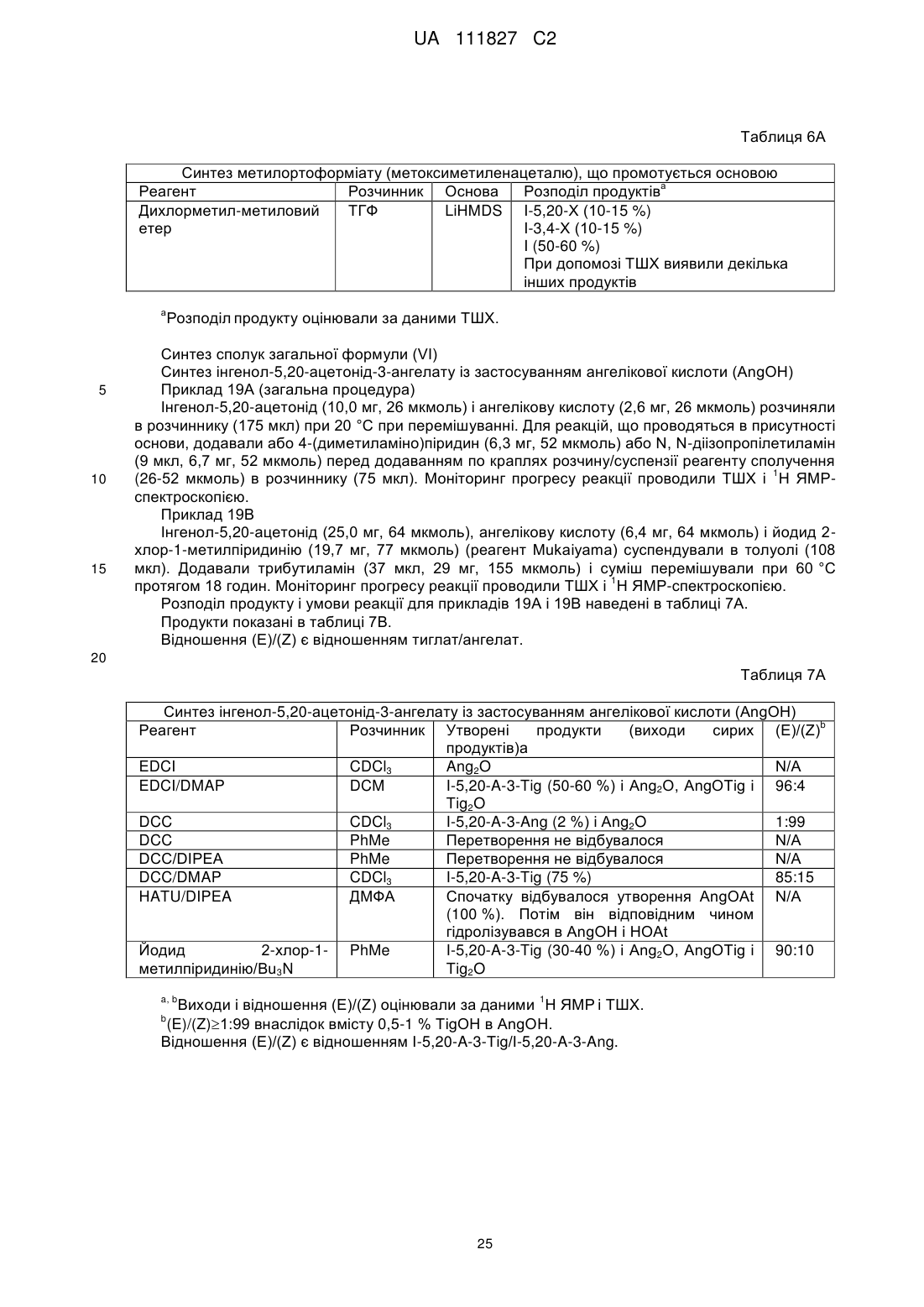
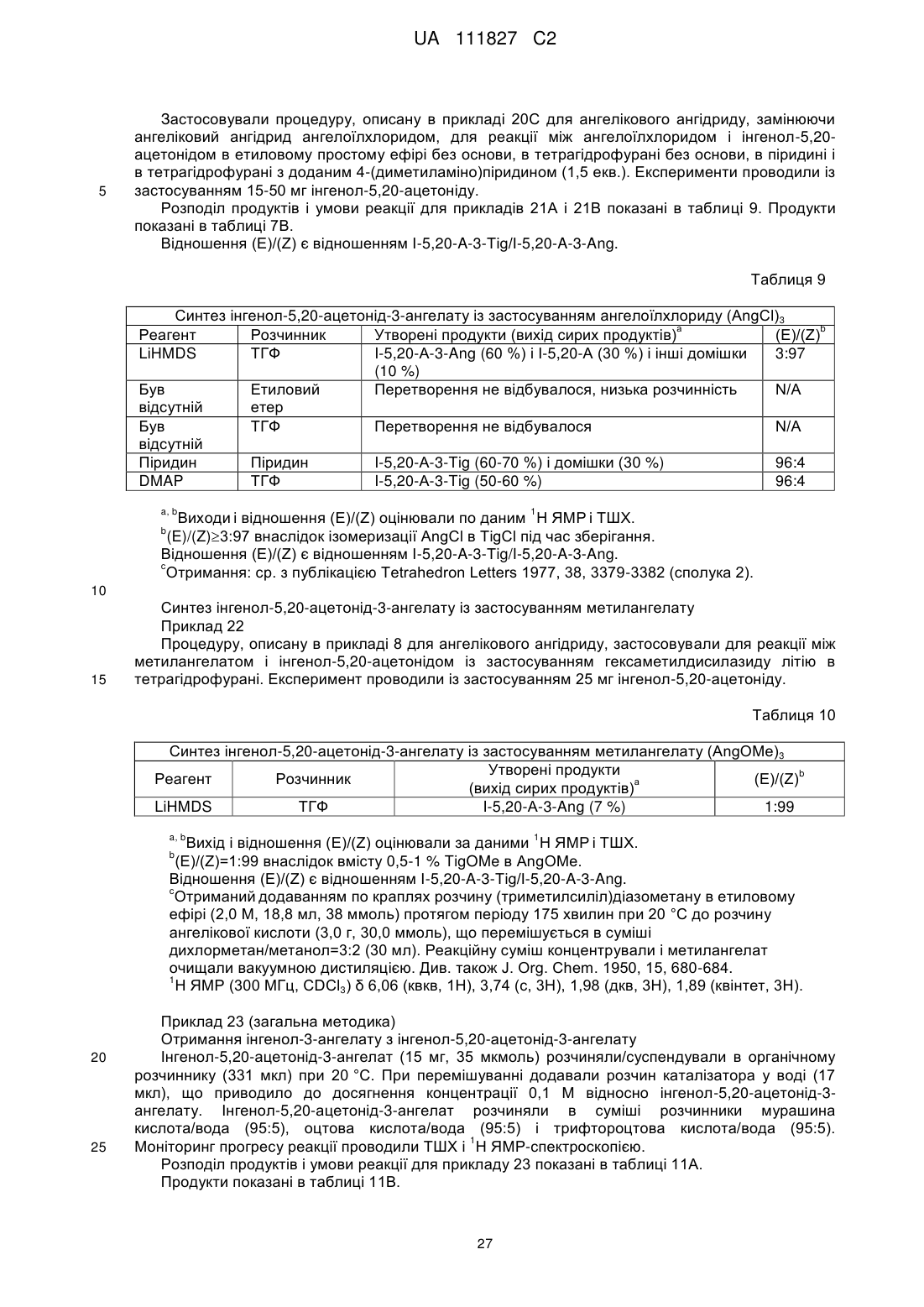
9. Спосіб за п. 1 або 3-8, де стадія (b) являє собою реакцію сполуки (III) або (IV), в якій R1, R2 і D мають значення, вказані вище, з ангеліковою кислотою в присутності реагенту сполучення або ферменту.
10. Спосіб за п. 1 або 3-9, де стадія (b) являє собою реакцію сполуки (III) або (IV), де R1, R2 і D мають значення, вказані вище, з ангеліковою кислотою в присутності реагенту сполучення.
11. Спосіб за п. 1 або 3-10, де стадія (b) являє собою реакцію сполуки (III) або (IV), де R1, R2 і D мають значення, вказані вище, з ангеліковою кислотою в присутності N,N'-дициклогексилкарбодііміду, гексафторфосфату N,N,N',N'-тетраметил-О-(7-азабензотриазол-1-іл)уронію, гідрохлориду N-(3-диметиламінопропіл)-N'-етилкарбодііміду, N-(3-диметиламінопропіл)-N'-етилкарбодііміду або йодиду 2-хлор-1-метилпіридинію.
12. Спосіб за п. 1 або 3-8, де стадія (b) являє собою реакцію сполуки (III) або (IV), де R1, R2 і D мають значення, вказані вище, з активованим похідним ангелікової кислоти.
13. Спосіб за п. 1, 3-8 або 12, де стадія (b) являє собою реакцію сполуки (III) або (IV), де R1, R2 і D мають значення, вказані вище, з метилангелатом, ангелоїлхлоридом, ангідридом ангелікової кислоти, [(Z)-2-метилбут-2-еноїл]-2,4,6-трихлорбензоатом або змішаним ангідридом ангелікової кислоти і 4-нітробензойної кислоти.
14. Спосіб за п. 1 або 3-8, де стадія (b) являє собою реакцію сполуки (III) або (IV), де R1, R2 і D мають значення, вказані вище, з галогенангідридом ангелікової кислоти або ангідридом ангелікової кислоти, або змішаним ангідридом ангелікової кислоти.
15. Спосіб за п. 1, 3-8 або 14, де стадія (b) являє собою реакцію сполуки (III) або (IV), де R1, R2 і D мають значення, вказані вище, з ангелоїлхлоридом, ангідридом ангелікової кислоти, [(Z)-2-метилбут-2-еноїл]-2,4,6-трихлорбензоатом або змішаним ангідридом ангелікової кислоти і 4-нітробензойної кислоти.
16. Сполука загальної формули (V):
 ,
,
(V)
де R1 і R2 кожний являє собою водень або гідроксилзахисну групу, вибрану з триетилсилілу, триізопропілсилілу, трет-бутилдиметилсилілу, диметилізопропілсилілу, діетилізопропілсилілу, трет-бутилдифенілсилілу, трифенілсилілу, хлорацетилу і феноксіацетилу;
при умові, що R1 і R2 одночасно не можуть бути атомами водню.
17. Сполука за п. 16, в якій R1 являє собою гідроксилзахисну групу і R2 являє собою водень.
18. Сполука за п. 16, яка являє собою 3-ангелат інгенол-20-(трет-бутилдиметилсиліловий) етер.
19. Сполука загальної формули (VI):
 ,
,
(VI)
де D являє собою діалкілсилілен або 1,3-(1,1,3,3-тетраізопропілдисилоксаніліден).
20. Сполука за п. 19, в якій D являє собою ди-трет-бутилсилілен або 1,3-(1,1,3,3-тетраізопропілдисилоксаніліден).
21. Сполука за п. 19 або 20, яка являє собою 3-ангелат інгенол-20-(трет-бутилдиметилсиліловий) етер.
22. Сполука загальної формули (III):
 ,
,
(III)
де R1 і R2 незалежно являють собою водень або гідроксилзахисну групу, вибрану з триетилсилілу, триізопропілсилілу, трет-бутилдиметилсилілу, диметилізопропілсилілу або діетилізопропілсилілу,
за умови, що R1 і R2 одночасно не можуть бути атомами водню;
і за умови, що R1 не являє собою трет-бутилдиметилсиліл.
23. Сполука загальної формули IV:
 ,
,
(IV)
де D являє собою діалкілсилілен або 1,3-(1,1,3,3-тетраізопропілдисилоксаніліден).
24. Сполука за п. 23, в якій D являє собою ди-трет-бутилсилілен або 1,3-(1,1,3,3-тетраізопропілдисилоксаніліден).
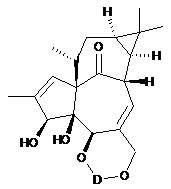
25. Сполука за п. 23, яка являє собою інгенол-5,20-(ди(трет-бутил)силіленовий) етер.
Текст
Реферат: Даний винахід стосується способів отримання інгенол-3-ангелату (І) з інгенолу (II). Крім того, винахід стосується проміжних продуктів, застосовних для синтезу інгенол-3-ангелату (І) з інгенолу (II), і способів отримання вказаних проміжних продуктів. UA 111827 C2 (12) UA 111827 C2 H H O O H H H O 3 O HO 5 HO 20 H 3 HO OH 5 HO , (I) HO (II) 20 OH . UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід стосується способів отримання інгенол-3-ангелату ((1aR, 2S, 5R, 5aS, 6S, 8aS, 9R, 10aR)-5,5a-дигідрокси-4-(гідроксиметил)-1,1,7,9-тетраметил-11-оксо-1а, 2,5,5а, 6,9,10,10а-октагідро-1Н-2,8а-метаноциклопента[a]циклопропа[е]циклодецен-6-ілового естеру 2метил-2(Z)-бутенової кислоти; PEP005, мебутату інгенолу)) з інгенолу. Даний винахід стосується далі нових проміжних продуктів і способів синтезу проміжних продуктів, що використовуються для отримання інгенол-3-ангелату. Рівень техніки винаходу Інгенол-3-ангелат (ΡΕΡ005, мебутат інгенолу) є активатором протеїнкінази С в фазі III клінічної розробки для лікування старечого кератозу. Дана сполука знаходиться також в фазі II випробувань як кандидат для лікарського засобу для лікування немеланомного раку шкіри [Ogbourne, S. M; Anti-cancer Drugs, (2007), 18, 357-62]. Сполуку інгенол-3-ангелат (PEP005) [Sayed, M.D. et al.; Experienta (1980), 36, 1206-1207] можна виділити з різних видів молочаю, і зокрема з Euphorbia peplus [Hohmann, J. et al.; Planta Med., (2000), 66, 291-294] і Euphorbia drummondii екстракцією з подальшою хроматографією, як описано в патенті США 7449492. Згідно з цією процедурою, екстракція 17 кг свіжого Euphorbia peplus дає 7 г сирого масла, які потім треба очищати ВЕРХ з отриманням чистого інгенол-3ангелату. Спосіб очищення не ідеально підходить для отримання у великих масштабах, оскільки хлорофіл, який в іншому випадку може перенестися спільно з інденол-3-ангелатом, потрібно видаляти з екстракту перед кінцевою стадією очищення. Тому вихід інгенол-3-ангелату екстракцією з Euphorbia peplus з подальшою хроматографією є надто низьким. Тому може бути бажаним альтернативний спосіб отримання інгенол-3-ангелату, який є також прийнятним для отримання його у великих масштабах. Інгенол є природним продуктом, який легко витягується з легко доступного насіння Euphorbia lathyris [Appendino, G. et al., J. Nat. Prod. (1999), 62, 76-79]. Оскільки частина присутнього різного естеру інгенолу під час процедури екстракції гідролізується і тому кількість виділеного інгенолу збільшується, це робить інгенол більш доступним, ніж інгенол-3-ангелат [Appendino, G. et al., J. Nat. Prod. (1999), 62, 76-79; Girin, М.А. et al., J. Chromatogr., (1993), 637, 206-208]. Інгенол або естер інгенолу можна також виявити в інших видах Euphorbia, наприклад інгенол або естер інгенолу були також виявлені в Е. аcrurensis, Е. аntiquorum, Е. biglandulosa, Е. canariensis, Е. cooperi, Е. cotinifolia, Е. deightonii, Е. desmondi, Е. drupifera, Е. ebracteolata, Е. esula, Е. helioscopia, Е. hermentiana, Е. iberica, Е. ingens, Е. jolkini, Е. kamerunica, Е. kansui, Е. leuconeura, Е. matabelensis, Е. megalantha, Е. millii, Е. myrsinites, Е. nematocypha, Е. nubica, Е. palustris, Е. peplus, Е. petiolata, Е. pilosa, Е. quadrialata, Е. quinquecostata, Е. resinifera, Е. royleana, Е. seguieriana, Е. serrata, Е. sieboldiana, Е. tirucalli, Е. triangularis, Е. trigona. Крім того, інгенол є комерційно доступним, наприклад, від LC Laboratories, 165 New Boston Street, Woburn, MA 01801, USA. Інгенол раніше застосовували як відправну точку для напівсинтетичного отримання 3-естеру інгенолу [Sorg, В. еt al., Z. Naturforsch., (1982), 37B, 748-756] і похідного 3естеру інгенолу [Appendino et al., Eur. J. Org. Chem. (1999), 3413; Opferkuch et al., Z. Naturforschung, (1981), 36B, 878]. Проте, отримання інгенол-3-ангелату і похідних інгенол-3ангелату з інгенолу не було описане. Отримання ангелатних естерів не є безпосереднім, оскільки ангелікова кислота і ангелатні естери мають тенденцію до ізомеризації подвійного зв'язку з утворенням тиглатного естеру, як в присутності, так і за відсутності основи [Beeby, Р., Tetrahedron Lett. (1977), 38, 3379-3382, Hoskins, W.M., J. Chem. Soc. Perkin Trans. 1, (1977), 538544, Bohlmann, F. еt al., Chem. Ber. (1970), 103, 561-563]. Крім того, похідні інгенолу, як відомо, розкладаються в присутності кислоти [Appendino et al., Eur. J. Org. Chem. (1999), 3413]. Крім того, 3-естер інгенолу легко перегруповується з утворенням 5-естерів інгенолу і 20-естерів інгенолу. Це особливо виявляється у разі ефірів карбонових кислот з коротким ланцюгом [Sorg, В. еt al., Z. Naturforsch., (1982), 37B, 748-756]. Спосіб очищення, описаний раніше для очищення 3-естерів інгенолу, що утворюються перегрупуванням побічних продуктів [Sorg, В. et al., Z. Naturforsch., (1982), 37B, 748-756], не є прийнятним для крупномасштабного отримання інгенол3-ангелату. Суть винаходу Задачею даного винаходу є спосіб синтезу інгенол-3-ангелату (PEP005), що масштабується, виходячи з інгенолу. Даний винахід пропонує нові способи отримання інгенол-3-ангелату з інгенолу. Даний винахід стосується далі нових проміжних продуктів для отримання інгенол-3ангелату. Таким чином, в одному аспекті винахід стосується способів отримання інгенол-3-ангелату (I) з інгенолу (II). 1 UA 111827 C2 У іншому аспекті винахід стосується способу отримання інгенол-3-ангелату (1aR, 2S, 5R, 5aS, 6S, 8aS, 9R, 10aR)-5,5а-дигідрокси-4-(гідроксиметил)-1,1,7,9-тетраметил-11-оксо-1а, 2,5,5а, 6,9,10,10а-октагідро-1Н-2,8а-метаноциклопента[a]циклопропа[е]циклодецен-6-ілового ефіру 2метил-2(Z)-бутенової кислоти) (I) з інгенолу (II), 5 10 15 20 25 , що містить наступні стадії: (а) реакція однієї або обох гідроксильних груп в положеннях 5 і 20 інгенолу з прийнятними гідроксилзахисними агентами, однаковими або різними, з отриманням сполуки загальної формули (III) або (IV), тобто захист однієї або обох гідроксильних груп в положеннях 5 і 20 інгенолу захисною групою з отриманням сполуки загальної формули (III) або (IV) , в яких R1 являє собою водень або гідроксилзахисну групу і R 2 являє собою водень або гідроксилзахисну групу або R1 являє собою гідроксилзахисну групу і R 2 являє собою водень або гідроксилзахисну групу або в яких D являє собою дигідроксилзахисну групу, (b) етерифікація сполук (III) або (IV) з отриманням сполук загальної формули (V) або (VI), тобто етерифікація гідроксильної групи в положенні 3 сполук (III) або (IV) з отриманням сполук загальної формули (V) або (VI) , в яких R1, R2 і D мають значення, вказані вище, і (с) видалення гідроксилзахисних груп R1, або R1 або R2, або D в сполуках (V) або (VI) з отриманням інденол-3-ангелату (I). В іншому аспекті винахід стосується способу отримання інгенол-3-ангелату (1aR, 2S, 5R, 5aS, 6S, 8aS, 9R, 10aR)-5,5а-дигідрокси-4-(гідроксиметил)-1,1,7,9-тетраметил-11-оксо-1а, 2,5,5а, 6,9,10,10а-октагідро-1Н-2,8а-метаноциклопента[a]циклопропа[е]циклодецен-6-ілового ефіру 2метил-2(Z)-бутенової кислоти) (I) з інгенолу (II) , що містить наступні стадії: (d) етерифікація інгенолу (II) з отриманням сполуки формули (VII) 2 UA 111827 C2 5 10 15 20 25 30 35 40 , в якій R3 являє собою водень або ангелоїл, тобто етерифікацію 3- і 20-гідроксильних груп і необов'язково етерифікацію 5-гідроксильної групи інгенолу (II) з отриманням сполуки формули (VII) і (е) розщеплення ангелатного естеру або ефірів в положенні 20 або в положеннях 5 і 20 сполуки (VII) з отриманням інгенол-3-ангелату (I). У наступному аспекті винахід стосується способу отримання інгенол-3-ангелату (1aR, 2S, 5R, 5aS, 6S, 8aS, 9R, 10aR)-5,5а-дигідрокси-4-(гідроксиметил)-1,1,7,9-тетраметил-11-оксо-1а, 2,5,5а, 6,9,10,10а-октагідро-1Н-2,8а-метаноциклопента[a]циклопропа[е]циклодецен-6-ілового ефіру 2-метил-2(Z)-бутенової кислоти) (I) з інгенолу (II) , що містить стадію (f) селективної етерифікації 3-гідроксильної групи сполуки (II) з отриманням інгенол-3ангелату (I). В іншому аспекті винахід стосується сполуки загальної структури (V), в якій R 1 являє собою водень або гідроксилзахисну групу і R2 являє собою водень або гідроксилзахисну групу; за умови, що R1 і R2 одночасно не являють собою водень, і за умови, що R1 і R2 не являє собою ацетил; і за умови, що R1 і R2 не являє собою 2-[(2-амінобензоїл)аміно]бензоїл; і за умови, що R1 не являють собою деканоїл; і за умови, що R1 не являють собою 3-феніл-2-пропеноїл. В іншому аспекті винахід стосується сполуки загальної структури (VI), в якій D являє собою дигідроксилзахисну групу, за умови, що D не являє собою ізопропіліден. В іншому аспекті винахід стосується сполуки загальної формули III, в якій R 1 і R2 незалежно являють собою водень або етерну, ацетальну, кетальну, етерну силільну групу або сульфенатну групу, що є гідроксилзахисною групою; за умови, що R1 і R2 не являють собою водень; і за умови, що R1 не являє собою трифенілметил; і за умови, що R1 не являє собою трет-бутилдиметилсиліл. В іншому аспекті винахід стосується сполуки загальної формули IV, в якій D являє собою дигідроксилзахисну групу; за умови, що D не являє собою ізопропіліден. Докладний опис винаходу Визначення Передбачається, що всі терміни є зрозумілими, оскільки вони повинні бути зрозумілі фахівцеві в даній галузі. Передбачається, що термін "гідроксилзахисний агент" означає реагент, який при прийнятних умовах реагує з гідроксильною групою з утворенням гідроксилзахисної групи. Передбачається, що термін "гідроксилзахисна група" включає будь-яку групу, яка утворює похідне гідроксильної групи, яке стійке в умовах реакцій, що плануються, де вказану гідроксилзахисну групу потім необов'язково можна селективно видалити. Вказане похідне гідроксилу можна отримати селективною реакцією гідроксилзахисного агента з гідроксильною групою. 3 UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 Передбачається, що термін "гідроксилзахисна група" має таке ж значення, як і термін "гідроксилзахисна група". Етерні похідні, такі як аліловий етер, преніловий етер, п-метоксибензиловий етер, трифенілметиловий етер, 2-триметилсилілетиловий етер, трет-бутиловий етер, цинаміловий етер, пропаргіловий етер, п-метоксифеніловий етер, бензиловий етер, 3,4диметоксибензиловий етер, 2,6-диметоксибензиловий етер, о-нітробензиловий етер, пнітробензиловий етер, 4-(триметилсилілметил)бензиловий етер, 2-нафтилметиловий етер, дифенілметиловий етер, (4-метоксифеніл)фенілметиловий етер, (4фенілфеніл)фенілметиловий етер, п, п'-динітробензгідриловий етер, 5-дибензосубериловий етер, трис-(4-трет-бутилфеніл)метиловий етер, (α-нафтил)дифенілметиловий етер, пметоксифенілдифенілметиловий етер, ди(п-метоксифеніл)фенілметиловий етер, три(пметоксифеніл)метиловий етер або 9-(9-феніл)ксантеніловий етер є прикладами гідроксилзахисних груп. Гідроксилзахисні групи у вигляді етерних похідних включають також алкоксіалкілові етери (ацеталі і кеталі), такі як 1-етоксіетиловий етер, 1-метил-1-метоксіетиловий етер, [(3,4диметоксибензил)окси]метиловий етер, гваяколметиловий етер, 2-метоксіетоксиметиловий етер, 2-(триметилсиліл)етоксиметиловий етер, тетрагідропіраніловий етер, тетрагідрофураніловий етер, метоксиметиловий етер, бензилоксиметиловий етер, пметоксибензилоксиметиловий етер, п-нітробензилоксиметиловий етер, онітробензилоксиметиловий етер, (4-метоксифенокси)метиловий етер, трет-бутоксиметиловий етер, 4-пентенілоксиметиловий етер, силоксиметиловий етер, 1-метоксициклогексиловий етер, 4-метокситетрагідропіраніловий етер, 1-[(2-хлор-4-метил)феніл]-4-метоксипіперидин-4-іловий етер, 1-(2-фторфеніл)-4-метоксипіперидин-4-іловий етер, 1-(4-хлорфеніл)-4-метоксипіперидин4-іловий етер або 1-метил-1-бензилоксіетиловий етер. Гідроксилзахисні групи у вигляді етерних похідних включають також тіоацеталі і тіокеталі, такі як тетрагідротіопіраніловий етер, 4-метокситетрагідротіопіраніловий етер, тетрагідротіофураніловий етер або 1,3-бензодитіолан-2-іловий етер. Гідроксилзахисні групи включають також силілові етерні похідні, такі як триметилсиліловий етер, триетилсиліловий етер, триізопропілсиліловий етер, трет-бутилдиметилсиліловий етер, диметилізопропілсиліловий етер, діетилізопропілсиліловий етер, дифенілметилсиліловий етер, трифенілсиліловий етер, диметилгексилсиліловий етер, 2-норборнілдиметилсиліловий етер, трет-бутилдифенілсиліловий етер, (2-гідроксистирил)диметилсиліловий етер, (2гідроксистирил)діізопропілсиліловий етер, трет-бутилметоксифенілсиліловий етер або третбутоксидифенілсиліловий етер. Гідроксилзахисні групи включають також естер гідроксильних груп, такий як ацетатний ефір, хлорацетатний ефір, трифторацетатний ефір, феноксіацетатний ефір, форміатний ефір, бензоїлформіатний ефір, дихлорацетатний ефір, трихлорацетатний ефір, метоксіацетатний ефір, п-хлорфеноксіацетатний ефір, фенілацетатний ефір, 3-фенілпропіонатний ефір, 4пентеноатний ефір, 4-оксопентаноатний ефір, півалоатний ефір, кротонатний ефір, 4метоксикротонатний ефір, ангелатний ефір, бензоатний ефір або п-фенілбензоатний ефір. Гідроксилзахисні групи включають також карбонати гідроксильних груп, такі як метоксиметилкарбонат, 9-флуоренілметилкарбонат, метилкарбонат, етилкарбонат, 2,2,2трихлоретилкарбонат, 2-(триметилсиліл)етилкарбонат, вінілкарбонат, алілкарбонат або пнітрофенілкарбонат. Гідроксилзахисні групи включають також сульфенати гідроксильних груп, такі як 2,4динітрофенілсульфенат. Дигідроксилзахисною групою є будь-яка група, яка утворює похідне діолу, яке є стабільним в умовах передбачуваних реакцій, де вказану дигідроксилзахисну групу потім необов'язково можна селективно видалити. Вказане дигідроксилпохідне можна отримати селективною реакцією дигідроксилзахисного агента з діолом. Кетальні похідні, такі як ізопропіліденкеталь (ацетонід), циклопентиліденкеталь, циклогексиліденкеталь, циклогептиліденкеталь, кеталь бензофенону, 1-третбутилетиліденкеталь або 1-фенілетиліденкеталь, 3-пентиліденкеталь, 2,4-диметил-3пентиліденкеталь, 2,6-диметил-4-гептиліденкеталь, 3,3-диметил-2-бутиліденкеталь; і ацетальні похідні, такі як бензиліденацеталь, 2,4-диметоксибензиліденацеталь, 4-нітробензиліденацеталь, 2,4,6-триметилбензиліденацеталь, 2,2-диметил-1-пропіліденацеталь, метиленацеталь, етиліденацеталь, п-метоксибензиліденацеталь, трет-бутилметиліденацеталь, 3(бензилокси)пропіліденацеталь, ацеталь акролеїну, 2-нітробензиліденацеталь, мезитиленацеталь або ацеталь 2-нафтальдегіду, є прикладами дигідроксилзахисних груп. 4 UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 Інші дигідроксилзахисні групи включають циклічні ортоефіри- або ортоефіри, такі як метоксиметиленацеталь, етоксиметиленацеталь, 2-оксациклопентиліденортоефір або ізопропоксиметиленацеталь. Інші дигідроксилзахисні групи включають бісацетальні похідні, такі як бутан-2,3-бісацеталь або циклогексан-1,2-діацеталь; або диспірокеталі, такі як октагідро[2,2']біпіранілкеталь. Інші дигідроксилзахисні групи включають силілпохідні, такі як ди-трет-бутилсилілен-, діалкілсилілен-, 1,3-(1,1,3,3-тетраізопропілдисилоксаніліден)-, 1,1,3,3-тетра-третбутоксидисилоксаніліден-метилен-біс-(діізопропілсиланоксаніліден)- або 1,1,4,4-тетрафеніл-1,4дисиланіліденпохідні. Дигідроксилзахисні групи включають також циклічні карбонати. Інші дигідроксилзахисні групи включають циклічні боронати, такі як фенілборонат, метилборонат або етилборонат. Гідроксилзахисні групи і дигідроксилзахисні групи включають також нанесені на тверду фазу захисні групи. Нанесені на тверду фазу реагенти, що застосовуються для введення нанесених на тверду фазу захисних груп, можуть включати, наприклад, зв'язаний з полімером 2хлортритилхлорид для введення нанесеної на тверду фазу тритилзахисної групи або ацетилполістирольну смолу або 4-(4-гідроксифеніл)бутан-2-он, осаджений на смолу, для отримання осаджених на тверду фазу кетальзахисних груп. Всі необмежувальні приклади гідроксилзахисних груп і дигідроксилзахисних груп, включені в об'єм даного винаходу, можна, наприклад, знайти в публікації "Protective Groups in Organic Synthesis", 4th ed. P.G.M. Wuts; T.W. Greene, John Wiley, 2007, page 16-366, і в публікації P.J. Kocienski, "Protecting Groups", 3rd ed. G. Тhieme, 2003, які таким чином включені як посилання. Ангелікова кислота є 2-метил-2(Z)-бутеновою кислотою. Тиглінова кислота є 2-метил-2(Е)-бутеновою кислотою. Передбачається, що термін "алкіл" означає радикал, що отримується, коли один атом водню видаляють у вуглеводню. Вказаний алкіл містить 1-20, переважно 1-12, наприклад, 1-6 атомів вуглецю. Цей термін включає підкласи нормальних алкілів (н-алкілів), вторинних і третинних алкілів, таких як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, пентил і ізопентил. Передбачається, що термін "алкеніл" означає радикал, що отримується, коли один атом водню видаляють у вуглеводню, що містить щонайменше один подвійний зв'язок С=С. Вказаний алкеніл містить 3-12, переважно 3-6 атомів вуглецю, наприклад, являє собою аліл. Передбачається, що термін "алкілгалогенід" означає молекулу загальної формули R-X, де R являє собою необов'язково заміщену алкільну групу, яка має вказане вище значення, і X являє собою будь-який галогенний замісник, такий як хлор, бром або йод. Передбачається, що термін "алкенілгалогенід" означає молекулу загальної формули R-X, де R являє собою необов'язково заміщену алкенільну групу, яка має вказане вище значення, і Х являє собою будь-який галогенний замісник, такий як хлор, бром або йод. Передбачається, що термін "алкокси" означає радикал формули -OR', в якій R' являє собою алкіл, що указується вище, наприклад, метокси, етокси, н-пропокси, ізопропокси, бутокси і т.д. Передбачається, що термін "алкоксиалкіл" означає алкільний радикал, який має вказане вище значення і який заміщений алкоксирадикалом, який має вказане вище значення, тобто R'O-R'-, де кожний R' являє собою алкіл, який має вказане вище значення, причому R' можуть бути однаковими або різними, наприклад, метоксиметил, етоксиметил. Передбачається, що термін "алкоксіалкілгалогенід" означає молекулу загальної формули R'O-R'-Х, в якій кожний R' являє собою алкіл, який має вказане вище значення, причому R' можуть бути однаковими або різними, і Х являє собою будь-який галогенний замісник, такий як хлор, бром або йод, наприклад, метоксиметилхлорид, етоксиметилхлорид. Передбачається, що термін "алкілкарбоніл" означає радикал формули -C(О)-R', в якій R' являє собою алкіл, який має вказане вище значення, наприклад, ацетил. Передбачається, що термін "алкенілкарбоніл" означає радикал формули -C(О)-R', в якій R' являє собою алкеніл, який має вказане вище значення, наприклад, ангелоїл. Передбачається, що термін "арил" означає радикал формули Ar-, отриманий, коли один атом водню видаляють у циклічної вуглецевмісної сполуки з делокалізованою (4n+2)-πелектронною системою, n дорівнює цілому числу >0, переважно 1 або 2. Прикладами Ar- є феніл, 2,4,6-трихлорфеніл, 4-нітрофеніл. Передбачається, що термін "арилалкіл" означає радикал формули Ar-R"-, де Ar-R" являє собою алкільний радикал, який має вказане вище значення, заміщений ароматичним радикалом, наприклад, бензил. 5 UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 60 Передбачається, що термін "галогенангідрид кислоти" означає молекулу загальної формули R'-C(О)-X або Ar-C(О)-Х, в якій R' являє собою необов'язково заміщений алкіл або алкеніл, який має вказане вище значення, Ar являє собою необов'язково заміщений арил, який має вказане вище значення, і Х являє собою галоген, такий як хлор, бром або йод, що указується в контексті. Прикладами галогенангідридів кислот є ацетилхлорид, хлорацетилхлорид, феноксіацетилхлорид, бензоїлхлорид, 2,4,6-трихлорбензоїлхлорид, 4-нітробензоїлхлорид або ангелоїлхлорид. Передбачається, що термін "ангідрид кислоти" означає молекулу загальної формули R'C(О)-О-C(О)-R' або Ar-C(О)-О-C(О)-Ar, в якій R' являє собою необов'язково заміщений алкіл або алкеніл, який має вказане вище значення, і Ar являє собою необов'язково заміщений арил, який має вказане вище значення. Прикладами ангідридів кислот є оцтовий ангідрид, ангеліковий ангідрид, бензойний ангідрид або 2,4,6-трихлорбензойний ангідрид. Передбачається, що термін "змішаний ангідрид" означає молекулу загальної формули RC(О)-О-C(О)-R" або Ar-C(О)-О-C(О)-R', в якій R- і R'- є різними і R' і R" являють собою необов'язково заміщений алкіл або алкеніл, який має вказане вище значення, і Ar являє собою необов'язково заміщений арил, який має вказане вище значення. Прикладами "змішаних ангідридів" є ангелоїл-2,4,6-трихлорбензойний ангідрид або ангелоїл-4-нітробензойний ангідрид. Передбачається, що термін "алкоксикарбоніл" означає радикал формули R'-O-C(О)-, в якій R' являє собою алкіл, який має вказане вище значення, наприклад, метоксикарбоніл, етоксикарбоніл, н-пропоксикарбоніл, ізопропоксикарбоніл, трет-бутоксикарбоніл і т.д. Передбачається, що термін "арилсульфеніл" означає радикал формули Ar-S(О)-, в якій Arмає вказані вище значення, наприклад, 2,4-динітрофенілсульфеніл. Передбачається, що термін "діол" означає молекулу, що містить дві або більше гідроксильних груп, в якій дві гідроксильні групи не приєднані до одного і того ж атому вуглецю. Звичайно діолзахисні групи застосовують для захисту 1,2-діолів і/або 1,3-діолів. Прикладами "діолів" є інгенол або інгенол-3-ангелат. Передбачається, що термін "активоване похідне кислоти" означає похідне кислоти, яке при вибраних умовах реакції будуть реагувати легше, ніж відповідна кислота, зі спиртом з утворенням естеру. Прикладами "активованих похідних кислот" є галогенангідриди кислот, ангідриди кислот, "змішані ангідриди", метилангелат або вінілангелат. Передбачається, що термін "реагент сполучення" означає реагент, який буде сприяти утворенню ефіру з кислоти і спирту за допомогою зв'язування води. Прикладами "реагентів зв'язування" є дициклогексилкарбодіімід (DCC), йодид 1-метил-2-хлорпіридинію, HBTU (Обензотриазол-1-іл)гексафторфосфат N, N,N',N'-тетраметилуронію), DMTMM (хлорид 4-(4,6диметокси-1,3,5-триазин-2-іл)-4-метилморфолінію), HATU (гексафторфосфат Ν,Ν,Ν’,Ν’тетраметил-О-(7-азабензотриазол-1-іл)уронію), EDCI (гідрохлорид N-(3-диметиламінопропіл)-N'етилкарбодііміду). Передбачається, що термін "активатор" означає реагент, який буде сприяти утворенню ефіру з кислоти або активованого похідного кислоти і спирту шляхом видалення кислоти з реакційної суміші. Прикладами "активаторів" є триетиламін, N, N-діізопропілетиламін, піридин або лутидин. Передбачається, що термін "каталізатор" означає сполуку, яка при субстехіометричній або стехіометричній кількості або при надлишку буде прискорювати реакцію без її витрачання. Прикладом каталізатора є DMAP (4-(N, N-диметиламіно)піридин) або 1-гідроксибензотриазол. Передбачається, що термін "ферментативний каталіз" означає каталіз хімічних реакцій спеціалізованими білками, званими ферментами. Прикладами ферментів є ліпази, естерази, протеази або кутинази. Передбачається, що термін "естераза" означає фермент, який здатний каталізувати розщеплення естеру на кислоту і спирт. Передбачається, що термін "ліпаза" означає фермент, який здатний каталізувати гідроліз ліпідів. Ліпази часто здатні гідролізувати естери, які не є ліпідами. Прикладом ліпази є ліпаза В Candida antarctica. Передбачається, що термін "ангелат" означає ефір ангелікової кислоти. Передбачається, що термін "етерифікація" означає реакцію, в якій гідроксильна група сполучається з прийнятним реагентом, тобто сполучається з карбоновою кислотою або похідним карбонової кислоти при прийнятних умовах реакції, з утворенням естеру. Передбачається, що термін "гідроксилзахисна група у вигляді простого ефіру" означає гідроксилзахисну групу, в якій гідроксильна група, яка повинна бути захищена, є частиною простої ефірної групи. 6 UA 111827 C2 5 10 15 20 25 30 35 Передбачається, що термін "гідроксилзахисна група у вигляді естеру" означає гідроксилзахисну групу, в якій гідроксильна група, яка повинна бути захищена, є частиною складної ефірної групи. Передбачається, що термін "гідроксилзахисна група у вигляді ацеталю" означає гідроксилзахисну групу, в якій гідроксильна група, яка повинна бути захищена, є частиною ацетальної групи. Передбачається, що термін "гідроксилзахисна група у вигляді кеталю" означає гідроксилзахисну групу, в якій гідроксильна група, яка повинна бути захищена, є частиною кетальної групи. Передбачається, що термін "гідроксилзахисна група у вигляді простого силілового ефіру" означає гідроксилзахисну групу, в якій гідроксильна група, яка повинна бути захищена, є частиною групи простого силілового ефіру. Передбачається, що термін "гідроксилзахисна група у вигляді сульфенату" означає гідроксилзахисну групу, в якій гідроксильна група, яка повинна бути захищена, є частиною сульфенатної групи. Передбачається, що термін "гідроксилзахисна група у вигляді боронату" означає гідроксилзахисну групу, в якій гідроксильна група, яка повинна бути захищена, є частиною боронатної групи. Передбачається, що термін "гідроксилзахисна група у вигляді карбонату" означає гідроксилзахисну групу, в якій гідроксильна група, яка повинна бути захищена, є частиною карбонатної групи. Варіанти здійснення В одному варіанті здійснення винахід стосується способів отримання інгенол-3-ангелату (I) з інгенолу (II), у якого одна або декілька гідроксильних груп захищені гідроксилзахисними групами або дигідроксилзахисними групами. В одному варіанті здійснення винахід стосується способу отримання інгенол-3-ангелату (1aR, 2S, 5R, 5aS, 6S, 8aS, 9R, 10aR)-5,5а-дигідрокси-4-(гідроксиметил)-1,1,7,9-тетраметил-11оксо-1а, 2,5,5а, 6,9,10,10 а-октагідро-1Н-2,8а-метаноциклопента[a]циклопропа[е]циклодецен-6ілового ефіру 2-метил-2(Z)-бутенової кислоти) (I) з інгенолу (II), , що містить наступні стадії: (а) захист однієї або обох гідроксильних груп в положеннях 5 і 20 інгенолу захисною групою з отриманням сполуки загальної формули (III) або (IV) , в якій R1 являє собою гідроксилзахисну групу і R 2 являє собою водень або гідроксилзахисну групу або в якій D являє собою дигідроксилзахисну групу, (b) етерифікація сполук (III) або (IV) з отриманням сполук загальної формули (V) або (VI) 7 UA 111827 C2 5 , в яких R1, R2 і D мають значення, описані вище, і (с) видалення гідроксилзахисних груп R1 або R1 або R2, або D у сполук (V) або (VI) з отриманням інгенол-3-ангелату (I). В іншому варіанті здійснення винахід стосується способу отримання інгенол-3-ангелату (1aR, 2S, 5R, 5aS, 6S, 8aS, 9R, 10aR)-5,5а-дигідрокси-4-(гідроксиметил)-1,1,7,9-тетраметил-11оксо-1а, 2,5,5а, 6,9,10,10а-октагідро-1Н-2,8а-метаноциклопента[a]циклопропа[е]циклодецен-6ілового ефіру 2-метил-2(Z)-бутенової кислоти) (I) з інгенолу (II) , 10 15 20 25 що містить наступні стадії: (d) етерифікація інгенолу (II) з отриманням сполуки формули (VII) , в якій R3 являє собою водень або ангелоїл, і (е) розщеплення ангелатного ефіру(ів) в положенні 20 або в положеннях 5 і 20 сполуки (VII) з отриманням інгенол-3-ангелату (I). В іншому варіанті здійснення винахід стосується способу отримання інгенол-3-ангелату (1aR, 2S, 5R, 5aS, 6S, 8aS, 9R, 10aR)-5,5а-дигідрокси-4-(гідроксиметил)-1,1,7,9-тетраметил-11оксо-1а, 2,5,5а, 6,9,10,10а-октагідро-1Н-2,8а-метаноциклопента[a]циклопропа[е]циклодецен-6ілового ефіру 2-метил-2(Z)-бутенової кислоти) (I) з інгенолу (II) , що містить наступні стадії: (f) селективна етерифікація 3-гідроксильної групи сполуки (II) з отриманням інгенол-3ангелату (I). В одному варіанті здійснення R1 може являти собою водень або R1 може являти собою етерну, ацетальну, кетальну, силільну етерну, складноефірну, карбонатну або сульфенатну групу, що є гідроксилзахисною групою, і R 2 може являти собою водень або етерну, ацетальну, 8 UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 60 кетальну, силільну етерну, складноефірну, карбонатну або сульфенатну групу, що є гідроксилзахисною групою. Наприклад, R1 може бути вибраний з групи, що складається з водню, [(3,4диметоксибензил)окси]метилу, гваяколметилу, 2-метоксіетоксиметилу, тетрагідропіранілу, тетрагідрофуранілу, 1-етоксіетилу, 1-метил-1-метоксіетилу, алілу, пренілу, п-метоксибензилу, трифенілметилу, 2-(триметилсиліл)етоксиметилу, триетилсилілу, триізопропілсилілу, третбутилдиметилсилілу, диметилізопропілсилілу, діетилізопропілсилілу, трет-бутилдифенілсилілу, трифенілсилілу, ацетилу, хлорацетилу, феноксіацетилу або ангелоїлу. R2 може бути, наприклад, вибраний з групи, що складається з водню або [(3,4диметоксибензил)окси]метилу, гваяколметилу, 2-метоксіетоксиметилу, тетрагідропіранілу, тетрагідрофуранілу, 1-етоксіетилу, 1-метил-1-метоксіетилу, алілу, пренілу, п-метоксибензилу, трифенілметилу, 2-(триметилсиліл)етоксиметилу, триетилсилілу, триізопропілсилілу, третбутилдиметилсилілу, диметилізопропілсилілу, діетилізопропілсилілу, трет-бутилдифенілсилілу, трифенілсилілу, ацетилу, хлорацетилу, феноксіацетилу або ангелоїлу. В іншому варіанті здійснення D може являти собою ацетальну, кетальну, діацетальну, дикетальну, ортоефірну, силільну, боронатну або карбонатну групу, що є дигідроксилзахисною групою. Наприклад, D може бути вибраний з групи, що складається з ізопропілідену, циклопентилідену, циклогексилідену, п-метоксибензилідену, метоксиметилену, 2оксациклопентилідену, 2,3-диметоксибутан-2,3-діїлу, 1,2-диметоксициклогексан-1,2-діїлу, октагідро[2,2']біпіран-2,2'-діїлу, ди-трет-бутилсилілену, 1,3-(1,1,3,3тетраізопропілдисилоксанілідену), фенілборонату, 3-пентилідену, 2,4-диметил-3-пентилідену, 2,6-диметил-4-гептилідену, 3,3-диметил-2-бутилідену, 1-феніл-1-етилідену, бензилідену, 2,4диметоксибензилідену, 4-нітробензилідену, 2,4,6-триметилбензилідену, 2,2-диметил-1пропілідену, етоксиметилену або ізопропоксиметилену. У конкретному варіанті здійснення R 1 являє собою гідроксилзахисну групу і R2 являє собою водень. В іншому конкретному варіанті здійснення R3 являє собою водень. В іншому варіанті здійснення винахід стосується способу, в якому стадія (b) містить реакцію сполуки (III) або (IV), де R1, R2 і D мають значення, вказані вище, з ангеліковою кислотою в присутності реагенту сполучення або ферменту. В іншому варіанті здійснення винахід стосується способу, в якому стадія (b) містить реакцію сполуки (III) або (IV), у якій R1, R2 і D мають значення, вказані вище, з ангеліковою кислотою в присутності реагенту сполучення. У варіанті здійснення реагент конденсації вибраний з групи, що складається з DCC, HATU, EDCI або йодиду 2-хлор-1-метилпіридинію. В іншому варіанті здійснення винахід стосується способу, в якому стадія (b) містить реакцію сполуки (III) або (IV), у якого R1, R2 і D мають значення, вказані вище, з активованим похідним ангелікової кислоти. У варіанті здійснення активоване похідне ангелікової кислоти вибране з групи, що складається з метилангелату, ангелоїлхлориду, ангідриду ангелікової кислоти, [(Z)-2-метилбут2-еноїл]-2,4,6-трихлорбензоату або ангелоїл-4-нітробензоїлангідриду. В іншому варіанті здійснення винахід стосується способу, в якому стадія (b) містить реакцію сполуки (III) або (IV), у якій R1, R2 і D мають значення, вказані вище, з галогенангідридом ангелікової кислоти або з ангідридом ангелікової кислоти, або зі змішаним ангідридом ангелікової кислоти. У варіанті здійснення галогенангідридом ангелікової кислоти є ангелоїлхлорид. У варіанті здійснення змішаним ангідридом ангелікової кислоти є [(Z)-2-метилбут-2-еноїл]2,4,6-трихлорбензоат або ангелоїл-4-нітробензоїлангідрид. У варіанті здійснення винахід стосується сполуки загальної формули (V), в якій R 1 являє собою водень або етерну, ацетальну, кетальну, силільну етерну, складноефірну, карбонатну або сульфенатну групу, що є гідроксилзахисною групою, і R2 являє собою водень або етерну, ацетальну, кетальну, силільну етерну, складноефірну, карбонатну або сульфенатну групу, що є гідроксилзахисною групою. У варіанті здійснення винахід стосується сполуки загальної формули (V), в якій R1 і R2 незалежно являють собою водень або [(3,4-диметоксибензил)окси]метил, гваяколметил, 2метоксіетоксиметил, тетрагідропіраніл, тетрагідрофураніл, 1-етоксіетил, 1-метил-1-метоксіетил, аліл, преніл, п-метоксибензил, трифенілметил, 2-(триметилсиліл)етоксиметил, триетилсиліл, триізопропілсиліл, трет-бутилдиметилсиліл, диметилізопропілсиліл, діетилізопропілсиліл, третбутилдифенілсиліл, трифенілсиліл, хлорацетил або феноксіацетил. 9 UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 У варіанті здійснення винахід стосується сполуки загальної формули (V), в якій R1 являє собою гідроксилзахисну групу і R2 являє собою водень. У варіанті здійснення винахід стосується сполуки, вибраної з групи, що складається з 3ангелату інгенол-20-(трет-бутилдиметилсилілового) ефіру. У варіанті здійснення винахід стосується сполуки загальної формули (VI), в якій D являє собою ацетальну, кетальну, діацетальну, дикетальну, ортоефірну, силільну, боронатну або карбонатну дигідроксилзахисну групу. У варіанті здійснення винахід стосується сполуки загальної формули (VI), в якій D представляє циклопентиліден, циклогексиліден, п-метоксибензиліден, метоксиметилен, 2оксациклопентиліден, 2,3-диметоксибутан-2,3-діїл, 1,2-диметоксициклогексан-1,2-діїл, октагідро[2,2']біпіран-2,2'-діїл, ди-трет-бутилсилілен, 1,3-(1,1,3,3тетраізопропілдисилоксаніліден), фенілборонат, 3-пентиліден, 2,4-диметил-3-пентиліден, 2,6диметил-4-гептиліден, 3,3-диметил-2-бутиліден, 1-феніл-1-етиліден, бензиліден, 2,4диметоксибензиліден, 4-нітробензиліден, 2,4,6-триметилбензиліден, 2,2-диметил-1-пропіліден, етоксиметилен або ізопропоксиметилен. У варіанті здійснення винахід стосується сполуки, вибраної з групи, що складається з 3-ангелату інгенол-5,20-(ди(трет-бутил)силіленового) ефіру. У варіанті здійснення винахід стосується сполуки загальної формули (IV), в якій D являє собою ацетальну, кетальну, діацетальну, дикетальну, ортоефірну, силільну, боронатну або карбонатну групу, що є дигідроксилзахисною групою. У варіанті здійснення винаходу стосується сполуки загальної формули (IV), в якій D являє собою циклопентиліден, циклогексиліден, п-метоксибензиліден, метоксиметилен, 2оксациклопентиліден, 2,3-диметоксибутан-2,3-діїл, 1,2-диметоксициклогексан-1,2-діїл, октагідро[2,2']дипіран-2,2'-діїл, ди-трет-бутилсилілен, 1,3-(1,1,3,3тетраізопропілдисилоксаніліден), фенілборонат, 3-пентиліден, 2,4-диметил-3-пентиліден, 2,6диметил-4-гептиліден, 3,3-диметил-2-бутиліден, 1-феніл-1-етиліден, бензиліден, 2,4диметоксибензиліден, 4-нітробензиліден, 2,4,6-триметилбензиліден, 2,2-диметил-1-пропіліден, етоксиметилен або ізопропоксиметилен. У варіанті здійснення винахід стосується сполуки, вибраної з групи, що складається з інгенол-5,20-(3-пентиліден)кеталю, інгенол-5,20-(2,4-диметил-3-пентиліден)кеталю, інгенол-5,20-(2,6-диметил-4-гептиліден)кеталю, інгенол-5,20-циклопентиліденкеталю, інгенол-5,20-циклогексиліденкеталю, інгенол-5,20-(3,3-диметил-2-бутиліден)кеталю, інгенол-5,20-(1-феніл-1-етиліден)кеталю, інгенол-5,20-бензиліденацеталю, інгенол-5,20-(4-метоксибензиліден)ацеталю, інгенол-5,20-(2,4-диметоксибензиліден)ацеталю, інгенол-5,20-(4-нітробензиліден)ацеталю, інгенол-5,20-(2,4,6-триметилбензиліден)ацеталю, інгенол-5,20-(2,2-диметил-1-пропіліден)ацеталю, інгенол-5,20-метилортоформіату, інгенол-5,20-етилортоформіату, інгенол-5,20-(проп-2-іл)ортоформіату або інгенол-5,20-(ди(трет-бутил)силіленового) ефіру. У варіанті здійснення винахід стосується сполуки загальної структури (VII), в якій R 3 являє собою водень або ангелоїл. У варіанті здійснення винахід стосується застосування сполуки загальної формули (III), (IV), (V) або (VI) як проміжного продукту отримання інгенол-3-ангелату. Синтетичні способи Сполуки загальних формул (III) і (IV) можна, наприклад, синтезувати реакцією сполуки (II) з гідроксилзахисним агентом або дигідроксилзахисним агентом згідно з способами, добре відомими фахівцеві в даній галузі техніки, такими як способи, описані в публікації "Protective Groups in Organic Synthesis", 4th ed. P.G.M. Wuts; T.W. Greene, John Wiley, 2007 або P.J. Kocienski, "Protecting groups", 3rd ed. G. Thieme, 2003 і посиланнях, цитованих в них. Наприклад, сполука (III), у якій R 1 являє собою трифенілметил і R2 являє собою водень або трифенілметил, можна синтезувати реакцією сполуки (II) з трифенілметилвмісним реагентом, таким як фторборат трифенілметилпіридинію або трифенілметилхлорид у прийнятному 10 UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчиннику, такому як піридин, N, N-диметилформамід або дихлорметан, в присутності або за відсутності основи [наприклад, Opferkuch et al., Z. Naturforschung, (1981), 36B, 878]. Сполука (III), у якій R1 являє собою арилалкіл або алкеніл, такий як п-метоксибензил або аліл, і R2 являє собою водень або арилалкіл, або алкеніл, можна, наприклад, синтезувати реакцією сполуки (II) з алкілгалогенідом або алкенілгалогенідом, таким як пметоксибензилгалогенід або алілгалогенід у прийнятному розчиннику, такому як N, Nдиметилформамід або тетрагідрофуран, необов'язково в присутності прийнятної основи, такої як карбонат калію. Сполука (III), у якій R1 являє собою алкоксіалкіл, такий як метоксиметил або 2метоксіетоксиметил і R2 являє собою водень або алкоксіалкіл, такий як метоксиметил або 2метоксіетоксиметил, можна, наприклад, синтезувати реакцією сполуки (II) з алкоксіалкілгалогенідом, таким як метоксиметилхлорид або 2-метоксіетоксиметихлорид, у прийнятному розчиннику, такому як тетрагідрофуран або дихлорметан, необов'язково в присутності прийнятної основи, такої як N, N-діізопропілетиламін. Сполука (III), у якій R1 являє собою 2-тетрагідропіраніл і R2 являє собою водень або 2тетрагідропіраніл, можна, наприклад, синтезувати реакцією сполуки (II) з дигідропіраном у прийнятному розчиннику, такому як дихлорметан або ацетонітрилі, в присутності прийнятної кислоти, такої як п-толуолсульфонова кислота. Сполука (III), у якій R1 являє собою силіл і R2 являє собою водень або силіл, можна, наприклад, синтезувати реакцією сполуки (II) з силілхлоридом, таким як третбутилдиметилсилілхлорид, трет-бутилдифенілсилілхлорид або триізопропілсилілхлорид, у прийнятному розчиннику, такому як N, N-диметилформамід, піридин, дихлорметан, тетрагідрофуран або ацетонітрил, необов'язково в присутності прийнятної основи, такої як імідазол, триетиламін, N, N-діізопропілетиламін, 4-(N, N-диметиламіно)піридин або 2,6-лутидин, або реакцією сполуки (II) з силілтрифлатом, таким як третбутилдиметилсилілтрифторметансульфонат, у прийнятному розчиннику, такому як дихлорметан, необов'язково в присутності прийнятної основи, такої як триетиламін. Сполука (III), у якій R1 являє собою алкілкарбоніл або алкенілкарбоніл, такий як ацетил, хлорацетил або феноксіацетил або ангелоїл, і R2 являє собою водень або алкілкарбоніл, або алкенілкарбоніл, можна, наприклад, синтезувати реакцією сполуки (II) з відповідним хлорангідридом кислоти, таким як ацетилхлорид, хлорацетилхлорид або феноксіацетилхлорид, або ангелоїлхлорид, або реакцією сполуки (II) з ангідридом кислоти, таким як оцтовий ангідрид, хлороцтовий ангідрид або феноксіоцтовий ангідрид, або ангідрид ангелікової кислоти, у прийнятному розчиннику, такому як піридин або дихлорметан, необов'язково в присутності прийнятної основи, такої як N, N-діізопропілетиламін або 4-(N, N-диметиламіно)піридин, або реакцією сполуки (II) з донором ацилу, таким як вінілацетат або хлороцтовий ангідрид, або вінілангелат, необов'язково в присутності ферменту як каталізатора. Сполуку (III), у якій R1 являє собою алкоксикарбоніл, такий як метоксикарбоніл або 9флуоренілметоксикарбоніл і R2 являє собою водень або алкоксикарбоніл, такий як метоксикарбоніл або 9-флуоренілметоксикарбоніл, можна, наприклад, синтезувати реакцією сполуки (II) з відповідним алкілхлорформіатом у прийнятному розчиннику, такому як піридин або дихлорметан, необов'язково в присутності прийнятної основи, такої як триетиламін або Ν,Ν,Ν’Ν'-тетраметилендіамін. Сполуку (III), у якій R1 являє собою арилсульфеніл, такий як 2,4-динітрофенілсульфеніл і R2 являє собою водень або арилсульфеніл, такий як 2,4-динітрофенілсульфеніл, можна, наприклад, синтезувати реакцією сполуки (II) з необов'язково заміщеним сульфенілхлоридом, таким як 2,4-динітрофенілсульфенілхлорид, у прийнятному розчиннику, такому як дихлорметан, необов'язково в присутності прийнятної основи, такої як піридин. Сполуку (IV), у якій D являє собою ацеталь, такий як бензиліденацеталь, можна, наприклад, синтезувати реакцією сполуки (II) з альдегідом, таким як бензальдегід, або диметоксіацеталем, таким як диметилацеталь бензальдегіду, у прийнятному розчиннику, такому як дихлорметан або N, N-диметилформамід, або ТГФ, в присутності прийнятної кислоти, такої як птолуолсульфокислота; або бензиліденацеталь, можна, наприклад, отримати реакцією сполуки (II) з похідним α,α-дигалогентолуолу, таким як, наприклад, α,α-дибромтолуол або α,αбіспіридиній)толуолдибромід, у прийнятному розчиннику, такому як піридин, ДМФА або ТГФ, в присутності прийнятної основи, такої як K2СО3 або LiHMDS. Сполуку (IV), у якій D являє собою кеталь, такий як ізопропіліденкеталь, можна, наприклад, синтезувати реакцією сполуки (II) з кетоном, таким як ацетон, або диметоксикеталем, таким як 2,2-диметоксипропан, у прийнятному розчиннику, такому як дихлорметан або N, Nдиметилформамід, або ТГФ, в присутності прийнятної кислоти, такої як п-толуолсульфонова 11 UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислота або метансульфонова кислота. Ацетон і 2,2-диметоксипропан можуть також діяти як розчинники. Сполука (IV), у якій D являє собою бісацеталь, такий як бутан-2,3-бісацеталь або циклогексан-1,2-діацеталь, або диспірокеталі, такий як октагідро[2,2']біпіранілкеталь, можна отримати реакцією сполуки (II) з 2,2,3,3-тетраметоксибутаном або циклогексан-1,2-діоном і триметилортоформіатом в присутності прийнятної кислоти, такої як п-толуолсульфонова кислота, у прийнятному розчиннику, такому як метанол, або реакцією з бісдигідропіраном в присутності прийнятної кислоти, такої як п-толуолсульфонова кислота, у прийнятному розчиннику, такому як дихлорметан. Сполука (IV), у якій D являє собою циклічний ортоефір, такий як метоксиметиленацеталь або 2-оксациклопентиліденортоефір, можна, наприклад, синтезувати реакцією сполуки II з ортоефіром, таким як триметилортоформіат, у прийнятному розчиннику, такому як дихлорметан, в присутності кислоти, такої як п-толуолсульфонова кислота; або реакцією сполуки II з дигалогенметилалкіловим простим ефіром, таким як, наприклад, дихлорметилметиловий ефір, у прийнятному розчиннику, такому як ДМФА або ТГФ, в присутності прийнятної основи, такої як LiHMDS або K2СО3. Сполуку (IV), у якій D являє собою силіл, такий як ди-трет-бутилсилілен, можна, наприклад, синтезувати реакцією сполуки II з діалкілсилілдихлоридом або діалкілсилілдитрифлатом, таким як ди-трет-бутилсилілдитрифлат, в розчиннику, такому як ацетонітрил, дихлорметан або N, Nдиметилформамід, необов'язково в присутності основи, такої як триетиламін або 2,6-лутидин. Сполуку (IV), у якій D являє собою карбоніл, можна, наприклад, синтезувати реакцією сполуки (II) з фосгеном або N, N'-карбонілдіімідазолом в піридині. Сполуку (IV), у якій D являє собою боронат, такий як фенілборонат, можна наприклад, синтезувати реакцією сполуки (II) з фенілбороновою кислотою в піридині. Синтез сполук загальної формули (III) і (IV) із сполуки (II) можна провести як в реакторі періодичної дії, так і в проточному реакторі, такому як, наприклад, Alfa Laval ART® Plate Reactor 37. Реагенти для введення гідроксилзахисних груп R1, R2 або D можуть бути реагентами, нанесеними на тверді фази, такими як, наприклад, зв'язаний з полімером 2-хлортритилхлорид, ацетилполістирольна смола або 4-(4-гідроксифеніл)бутан-2-он на основі смол. Сполуки загальної формули (III) і (IV) можна етерифікувати в положенні 3 для отримання сполук загальної формули (V) і (VI) реакцією сполуки (III) або (IV) з ангеліковою кислотою в присутності реагенту сполучення або з активованими похідними ангелікової кислоти. Сполуки (II) можна етерифікувати для отримання сполук загальної формули (VII) реакцією сполуки (II) з ангеліковою кислотою в присутності реагенту сполучення або з активованими похідними ангелікової кислоти. Сполуки можна отримати згідно, але без обмеження вказаним, способів етерифікації, описаних в публікації "Esterification" by J. Otera, Wiley-VCH, 2003, яка включена в контекст як посилання, і посиланнях, цитованих в ній. Наприклад, сполуку (V), (VI) або (VII) можна синтезувати реакцією сполуки (III), (IV) або (II) з активованим похідним ангелікової кислоти, таким як ангелоїлгалогенід, таким як ангелоїлхлорид. Етерифікація реакцією з ангелоїлхлоридом може відбуватися без активатора, або вона може відбуватися в присутності основи, такої як піридин або триетиламін, LiHMDS або DMAP, у прийнятному розчиннику, такому як, наприклад, піридин або ТГФ. Приклади синтезу естеру ангелікової кислоти із застосуванням ангелоїлхлориду можна, наприклад, знайти в Beeby, P.J., Tetrahedron Lett., (1977), 38, 3379-3382. Сполуку (V), (VI) або (VII), можна, наприклад, синтезувати реакцією сполуки (III), (IV) або (II) з активованим похідним ангелікової кислоти, таким як ангеліковий ангідрид. Етерифікація реакцією з ангеліковим ангідридом може відбуватися без каталізатора або в присутності кислотного каталізатора з використанням кислоти, такої як перхлорна кислота або кислота Льюїса, така як трифлат скандію(III) або трифлат вісмуту(III), або в присутності основи, такої як гідрокарбонат натрію або триетиламін, LiHMDS, NaHMDS, KHMDS, піридин, карбонат цезію або DMAP, у прийнятному розчиннику, такому як, наприклад, ТГФ, MeCN, піридин або МТВЕ. Приклади синтезу ефіру ангелікової кислоти із застосуванням ангідриду ангелікової кислоти можна, наприклад, знайти в публікації Hartmann, В. et al.; Tetrahedron Lett., (1991), 32, 5077-5080 або в JP2008127287. Сполуку (V), (VI) або (VII) можна, наприклад, синтезувати реакцією сполуки (III), (IV) або (II) з активованим похідним ангелікової кислоти, таким як змішаний ангідрид, такий як ангідрид ангелікової і трихлорбензойної кислот, такий як ангідрид ангелікової і 2,4,6-трихлорбензойної кислот. Етерифікація реакцією зі змішаним ангідридом може відбуватися без каталізатора або в присутності кислотного каталізатора із застосуванням кислоти, такої як перхлорна кислота або 12 UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 кислота Льюїса, така як трифлат скандію(III) або трифлат вісмуту(III), або в присутності основи, такої як гідрокарбонат натрію або триетиламін, у прийнятному розчиннику, такому як, наприклад, толуол. Приклади синтезу ефіру ангелікової кислоти із застосуванням змішаного ангідриду ангелікової і трихлорбензойної кислот, наприклад, можна знайти в публікації Hartmann, В. et al.; Tetrahedron Lett. (1991), 32, 5077-5080, або Ball, В., Org. Lett., (2007), 9, 663666. Сполуку (V), (VI) або (VII) можна, наприклад, синтезувати реакцією сполуки (III), (IV) або (II) з ангеліковою кислотою в присутності реагенту сполучення. Ангелікову кислоту можна етерифікувати в присутності реагенту сполучення, такого як карбодіімід, такий як дициклогексилкарбодіімід або EDCI (гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодііміду) з каталізаторами або без каталізаторів, таких як 1-гідроксибензотриазол. Приклади синтезу ефіру ангелікової кислоти із застосуванням дициклогексилкарбодііміду з каталізаторами або без каталізаторів можна, наприклад, знайти в публікації Hoskins, W.M., J. Chem. Soc. Perkin Trans. 1, (1977), 538-544. Іншими реагентами сполучення для етерифікації можуть бути, наприклад, солі 2-галоген-1-алкілпіридинію, такі як йодид 1-метил-2-хлорпіридинію йодид, або похідні гідроксибензотриазолу, такі як HBTU (гексафторфосфат О-(бензотриазол-1-іл)-N, N,N',N'тетраметилуронію), або HATU (гексафторфосфат N, N,N",N’-тетраметил-О-(7-азабензотриазол1-іл)уронію), або похідні триазину, такі як DMTMM (хлорид 4-(4,6-диметокси-1,3,5-триазин-2-іл)4-метилморфолінію). Прийнятними розчинниками можуть бути метиленхлорид, толуол, ДМФА або ТГФ. У стадії етерифікації можна також застосовувати реагенти сполучення, осаджені на твердому носії, описані в публікаціях [Nаm, N.-H., Journal of Cоmbinatorial Chemistry, (203), 5, 479-545, або "Esterification" by J. Otera, Wiley-VCH, 2003], які включені таким чином як посилання. Сполуку (V), (VI), (VII) або (I) можна, наприклад, синтезувати реакцією сполуки (III), (IV) або (II) з донором ангелоїлу, таким як ангідрид ангелікової кислоти, ефір ангелікової кислоти, такий як вінілангелат, або тіоефір ангелікової кислоти, в присутності ферменту, такого як ліпаза або естераза. Приклади етерифікації похідного інгенолу, що каталізується ліпазою, можна знайти в публікації Teng, R.W., Fitoterapia, (2009), 80, 233-236, яка включена таким чином як посилання. Синтез сполук загальної формули (V) і (VI) із сполуки загальної формули (III) і (IV) можна виконувати як в реакторі періодичної дії, так і в проточному реакторі. Реагентами для синтезу сполук загальної формули (V) і (VI) із сполуки загальної формули (III) і (IV) можуть бути реагенти, осаджені на тверду фазу. Інгенол-3-ангелат (I) можна синтезувати селективним видаленням захисних груп, R1 і R2 або D, у сполук загальної структури V або VI згідно з способами, добре відомими фахівцеві в даній галузі, для зняття захисту гідроксил- або дигідроксилзахисних груп, наприклад, способами, описаними в публікаціях "Protective Groups in Organic Synthesis", 4th ed. P.G.M. Wuts; T.W. Greene, John Wiley, 2007 або P.J. Kocienski, "Protecting Groups", 3rd ed. G. Тhieme, 2003, які включені таким чином за допомогою посилання і посилань, цитованих в них. Інгенол-3-ангелат (I) можна синтезувати селективним видаленням ангелоїльних груп з положення 20 або з положень 5 і 20 сполуки загальної структури (VII). Наприклад, сполуку (I) можна синтезувати із сполуки (V), у якій R 1 являє собою водень або алкіл, такий як трифенілметил, і R2 являє собою водень або трифенілметил, взаємодією сполуки (V) з прийнятною кислотою, такою як мурашина кислота або трифтороцтова кислота, у прийнятному розчиннику, такому як етер, метанол або дихлорметан. Сполуку (I) можна, наприклад, синтезувати із сполуки (V), у якій R1 являє собою водень або алкіл, такий як п-метоксибензилметил або аліл і R2 являє собою водень або пметоксибензилметил або аліл, реакцією сполуки (V) з 2,5-дихлор-5,6-диціано-п-бензохіноном (DDQ) в дихлорметані. Алільну групу можна також видалити ізомеризацією олефіну у вініловий етер реакцією з каталізатором перехідним металом, таким як каталізатор Вілкінсона (родій(I)трис(трифенілфосфін)хлорид), з подальшим відщепленням вінілового простого ефіру в присутності води. Сполуку (I) можна, наприклад, синтезувати із сполуки (V), у якій R 1 являє собою водень або алкоксіалкіл, такий як 2-метоксіетоксиметил і R2 являє собою водень або алкоксіалкіл, такий як 2-метоксіетоксиметил, відщепленням ацетальної частини R1 і/або R2, наприклад, відщепленням, що каталізується кислотою, кислотою Льюїса, такою як бромід цинку(II) або хлорид титану(IV), у прийнятному розчиннику, такому як дихлорметан. Сполуку (I), можна, наприклад, синтезувати із сполуки (V), у якій R 1 являє собою водень або алкоксіалкіл, такий як 2-тетрагідропіраніл, і R2 являє собою водень або алкоксіалкіл, такий як 2тетрагідропіраніл, відщепленням ацетальної частини R1 і/або R2, наприклад, відщепленням, що 13 UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 60 каталізується кислотою, в присутності прийнятної кислоти, такої як п-толуолсульфонова кислота, у прийнятному розчиннику, такому як метанол. Сполуку (I) можна, наприклад, синтезувати із сполуки (V), у якій R 1 являє собою водень або силіл, такий як трет-бутилдиметилсиліл, і R2 являє собою водень або силіл, такий як третбутилдиметилсиліл, реакцією сполуки (V) з прийнятною кислотою, такою як хлорид водню, у прийнятному розчиннику, такому як метанол, або реакцією з джерелом фториду, таким як фторид тетра-н-бутиламонію або тетрафторсилан, у прийнятному розчиннику, такому як тетрагідрофуран або ацетонітрил. Сполуку (I) можна, наприклад, синтезувати із сполуки (V), у якій R 1 являє собою водень або алкілкарбоніл, такий як ацетил або хлорацетил, і R2 являє собою водень або алкілкарбоніл, такий як ацетил або по хлорацетил, гідролізом складноефірної частини R 1 і/або R2 ферментативним каталізом із застосуванням такого ферменту, як ліпаза, або гідролізом складноефірної частини R1 і/або R2 у прийнятному розчиннику, такому як метанол або вода, і в присутності прийнятної основи, такої як карбонат калію, або в присутності прийнятної кислоти, такої як хлорид водню. Сполуку (I) можна, наприклад, синтезувати із сполуки V, у якій R 1 являє собою водень або алкоксикарбоніл, такий як 9-флуоренілметоксикарбоніл, і R2 являє собою водень або алкоксикарбоніл, такий як 9-флуоренілметоксикарбоніл, відщепленням карбонатної частини R 1 і/або R2 в присутності прийнятної основи, такого як триетиламін, у прийнятному розчиннику, такому як піридин. Сполуку (I) можна, наприклад, синтезувати із сполуки (V), у якій R 1 являє собою атом водню або 2,4-динітрофенілсульфеніл і R2 являє собою атом водню або 2,4-динітрофенілсульфеніл, відщепленням сульфенатної частини R1 і/або R2 нуклеофілом, таким як ціанід натрію, у прийнятному розчиннику, такому як метанол. Сполуку (I) можна, наприклад, синтезувати із сполуки (VI), у якій D являє собою ацеталь, такий як бензиліденацеталь, відщепленням ацетальної частини в присутності прийнятної кислоти, такої як оцтова кислота, трифтороцтова кислота або п-толуолсульфонова кислота, у прийнятному розчиннику, такому як вода, дихлорметан або метанол. Сполуку (I) можна, наприклад, синтезувати із сполуки (VI), у якій D являє собою кеталь, такий як ізопропіліденкеталь, відщепленням кетальної частини в присутності прийнятної кислоти, такої як водний розчин хлориду водню, оцтова кислота, трифтороцтова кислота, птолуолсульфонова кислота, осаджена на твердий носій п-толуолсульфонова кислота, метансульфонова кислота, фосфорна кислота або мурашина кислота, у прийнятному розчиннику, такому як метанол, ТГФ або ізопропанол. Сполуку (I) можна, наприклад, синтезувати із сполуки (VI), у якій D являє собою циклічний ортоефір, такий як метоксиметиленацеталь, відщепленням ортоефірної частини в присутності прийнятної кислоти, такої як водний розчин хлориду водню або оцтова кислота, у прийнятному розчиннику, такому як діоксан або вода. Сполуку (I) можна, наприклад, синтезувати із сполуки (VI), у якій D являє собою силіл, такий як ди-трет-бутилсилілен, реакцією сполуки (VI) з джерелом фториду, таким як фторид тетра-нбутиламонію або тетрафторсилан, у прийнятному розчиннику, такому як тетрагідрофуран або ацетонітрил. Сполуку (I) можна, наприклад, синтезувати із сполуки (VI), у якій D являє собою карбоніл, відщепленням карбонатної частини в присутності прийнятної основи, такої як піридин, у прийнятному розчиннику, такому як вода, або гідролізом, що каталізується ферментом, в присутності ферменту, такого як ліпаза або естераза. Сполуку (I) можна, наприклад, синтезувати із сполуки (VI), у якій D являє собою боронат, такий як фенілборонат, переетерифікацією з діолом, таким як 1,3-пропандіол. Синтез сполуки (I) із сполук загальної формули (V) і (VI) можна виконувати як в реакторі періодичної дії, так і в проточному реакторі. Реагентами для синтезу сполуки (I) із сполуки загальної формули (V) і (VI) можуть бути реагенти, нанесені на тверду фазу. Сполуку (I) можна, наприклад, синтезувати із сполуки (VII), у якій R 3 являє собою ангелоїл або водень, гідролізом, що каталізується ферментом, складноефірної частини в 20-положенні або в 5- і 20-положеннях в присутності ферменту, такого як ліпаза або естераза. У ще одному аспекті даний винахід стосується сполуки загальної структури (V), в якій R1 являє собою гідроксилзахисну групу і R2 являє собою атом водню або гідроксилзахисну групу, або сполуки загальної структури (VI), в якій D являє собою дигідроксилзахисну групу, або сполуки загальної структури (VII), в якій R3 являє собою водень або ангелоїл. ПРИКЛАДИ Загальні положення 14 UA 111827 C2 5 10 15 20 25 30 35 40 45 50 55 60 Всі застосовувані вихідні речовини є комерційно доступними, якщо не описано інакше. Для 1 спектрів протонного ядерного магнітного резонансу ( H ЯМР) величини хімічних зсувів (δ) (в м.ч.) вказуються відносно внутрішнього стандарту тетраметилсилану (δ=0,00). Наводиться величина мультиплету, або певного дублету (д), триплету (т), квартету (кв.), або діапазон значень (м). Всі застосовувані органічні розчинники були безводними, якщо не вказане інше. Флеш-хроматографію проводили на силікагелі. Як елюенти застосовували прийнятні суміші етилацетату, дихлорметану, метанолу, петролейного ефіру (т. куп. 40-60С) і гептану, якщо не вказано інше. Абревіатури Bu3N: трибутиламін CDI: 1,1'-карбонілдіімідазол Cs2CО3: карбонат цезію DCC: N, N'-дициклогексилкарбодіімід DIPEA: N, N-діізопропілетиламін DMAP: 4-(диметиламіно)піридин EDCI: гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодііміду HATU: гексафторфосфат N, N,N',N'-тетраметил-O-(7-азабензотриазол-1-іл)уронію HCl: хлористоводнева кислота HOAt: 3Н-[1,2,3]триазоло[4,5-b]піридин-3-ол K2CO3: карбонат калію KHMDS: гексаметилдисилазид калію LiHMDS: гексаметилдисилазид літію MSA: метансульфонова кислота NaHMDS: гексаметилдисилазид натрію TEA: триетиламін CDCl3: дейтерохлороформ DCM: дихлорметан ДМФА: N, N-диметилформамід IPA: 2-пропанол (ізопропіловий спирт) MeCN: ацетонітрил MeТГФ: 2-метилтетрагідрофуран МТВЕ: метил-трет-бутиловий ефір PhMe: толуол TFA: трифтороцтова кислота ТГФ: тетрагідрофуран I: Інгенол I-3-Ang: інгенол-3-ангелат I-3-Tig: інгенол-3-тиглат I-3,4-A: інгенол-3,4-ацетонід I-5,20-A: інгенол-5,20-ацетонід I-3,4:5,20- А: інгенол-3,4:5,20-діацетонід I-5,20-A-3-Ang: інгенол-5,20-ацетонід-3-ангелат I-5,20-A-3-Tig: інгенол-5,20-ацетонід-3-тиглат I-3,4-X: інгенол-3,4-ацеталь/кеталь I-5,20-X: інгенол-5,20-ацеталь/кеталь I-3,4:5,20-X: інгенол-3,4:5,20- діацеталь/дикеталь AngOH: ангелікова кислота Аng2О: ангеліковий ангідрид AngOMe: метилангелат AngCl: ангелоїлхлорид AngIm: ангелоїлімідазолід AngOAt: ангелоїловий ефір HOAt AngOTig: ангелоїлтиглат TigOH: тиглінова кислота Tig2О: тигліновий ангідрид TigOMe: метилтиглат TigCl: тиглоїлхлорид 1 H ЯМР: протонний ядерний магнітний резонанс ТШХ: тонкошарова хроматографія Екв: еквіваленти 15 UA 111827 C2 N/А: непридатний 5 10 15 20 25 30 35 40 45 50 . Отримання інгенол-5,20-ацетоніду (сполука 1) Приклад 1 Інгенол (1,00 г, 2,30 ммоль) розчиняли в розчині моногідрату п-толуолсульфонової кислоти в ацетоні (0,47 мг/мл, 22,5 мл). Розчин перемішували при кімнатній температурі протягом 25 хв. До цього розчину додавали насичений водний розчин гідрокарбонату натрію (0,2 мл). Отриману суміш концентрували у вакуумі. Залишок переносили в насичений розчин солі і екстрагували етилацетатом. Об'єднані органічні фази сушили над сульфатом натрію і концентрували у вакуумі. Залишок очищали флеш-хроматографією (гептан/етилацетат, 19:1>гептан/етилацетат, 0:1), отримуючи при цьому вказану в заголовку сполуку у вигляді білої твердої речовини (616 мг, 69 %). Див. також: Opferkuch, H.J. et al., Z. Naturforsch. 1981, 36b, 878-887 (сполука 4). 1 H ЯМР (300 МГц, CDCl3) δ 5,91 (кв., J=1,5 Гц, 1H), 5,82-5,77 (м, 1H), 4,25 (д, J=4,5 Гц, 1H), 4,20-4,07 (м, 3H), 3,93 (с, 1H), 3,51 (с, 1H), 2,57-2,41 (м, 2H), 2,25 (ддд, J=15,7, 8,4, 2,9 Гц, 1H), 1,85 (д, J=1,5 Гц, 3H), 1,77 (дт, J=15,8, 5,9 Гц, 1H), 1,41 (с, 3H), 1,35 (с, 3H), 1,13 (с, 3H), 1,05 (с, 3H), 1,00-0,87 (м, 4H), 0,70 (тд, J=8,4, 6,4 Гц, 1H). Приклад 2 Інгенол (7,0 г, 20,1 ммоль) розчиняли в розчині моногідрату п-толуолсульфонової кислоти в ацетоні (0,2 мг/мл, 200 мл). Розчин перемішували при кімнатній температурі протягом 1,5 годин (контроль проводили ТШХ). До цього розчину додавали насичений водний розчин гідрокарбонату натрію (2,0 мл). Отриману суміш фільтрували. Фільтрат концентрували у вакуумі. Залишок розчиняли в етилацетаті (20 мл). До цього розчину додають петролейний ефір (40 мл). Суміш залишали на 2 години. Кристали відділяли фільтруванням і сушили, отримуючи при цьому 4,5 г вказаної в заголовку сполуки. Маточний розчин очищали хроматографією (петролейний ефір/етилацетат, 2:1-0:1), отримуючи при цьому додатково 1,2 г вказаної в заголовку сполуки і 0,6 г інгенолу, що не прореагував. Загальний вихід був 73 %, або 81 % з обліком виділеного інгенолу. Приклад 3 Сухий інгенол (15,00 г, 90 %, 38,75 ммоль) розчиняли в ацетоні (630 мл) при перемішуванні і розчин нагрівали до 45 °C. Додавали розчин метансульфонової кислоти (0,745 г, 7,75 ммоль) в ацетоні (10 мл) протягом 5 секунд. Розчин перемішували при 45 °C протягом додаткових 95 секунд перед додаванням розчину триетиламіну (1,35 мл, 0,98 г, 9,69 ммоль) в ацетоні (10 мл) протягом 5 секунд. Суміш охолоджували до 20С і додавали етилацетат (500 мл). Велику частину розчинника реакції (650 мл) відганяли у вакуумі. До розчину, що залишився, додавали воду (200 мл) і суміш перемішували протягом 2 хвилин. Водний шар видаляли і промивання водою повторювали ще раз, перш ніж органічну фазу концентрували у вакуумі. Сирий продукт 1 містив 84 % вказаної в заголовку сполуки при визначенні H ЯМР-спектроскопією. Залишок розчиняли в толуолі (75 мл) нагріванням до температури флегми з подальшим повільним охолоджуванням до 5 °C. Після 4-годинного витримування суміші кристали, що утворилися, відфільтровували, промивали при 5 °C толуолом (2×5 мл) і сушили у вакуумі при 20 °C до постійної маси. Через 18 годин отримували інгенол-5,20-ацетонід (8,97 г). . Приклад 4 Отримання [(Z)-2-метилбут-2-еноїл]-2,4,6-трихлорбензоату Ангелікову кислоту (601 мг, 6,0 ммоль) розчиняли в дихлорметані (3,0 мл) в атмосфері аргону. При 5-10 °C протягом 1 хв. додавали діізопропілетиламін (1,23 мл, 7,20 ммоль). До цього розчину додавали 2,4,6-трихлорбензоїлхлорид (1,12 мл, 7,20 ммоль) при 3-6 °C протягом 4 хв. Після того, як реакційний розчин перемішували при 2 °C протягом 45 хв., додавали петролейний ефір (9,0 мл). Отриману суспензію очищали флеш-хроматографією (петролейний 16 UA 111827 C2 5 10 15 20 25 30 35 40 45 ефір/дихлорметан, 3:1), отримуючи при цьому вказану в заголовку сполуку у вигляді білої твердої речовини (605 мг, 33 %). 1 H ЯМР (300 МГц, CDCl3) δ 7,40 (с, 2H), 6,42 (кв.кв., J=7,4, 1,5 Гц, 1H), 2,09 (дкв., J=7,4, 1,5 1 Гц, 3H), 1,97 (р, J=1,5 Гц, 3H. (дані Н ЯМР див. також в публікації Matthew, В et al.; Org Lett. 2007, 9, 663-666). . Приклад 5 Отримання ангелікового ангідриду До розчину ангелікової кислоти (5 г, 50 ммоль) в дихлорметані (100 мл) додавали N, N'дициклогексилкарбодіімід (8,6 мл, 60 % розчин в ксилолі, 25 ммоль) при кімнатній температурі. Реакційну суміш перемішували при цій температурі протягом 1 години. Осад відфільтровували. Фільтрат концентрували у вакуумі. Залишок очищали хроматографією (петролейний ефір/етилацетат, 10:1), отримуючи при цьому 4,3 г вказаної в заголовку сполуки у вигляді масла (94 %). 1 Н ЯМР (300 МГц, CDCl3) δ 6,37-6,25 (м, 2H), 2,06 (дкв., J=7,4, 1,5 Гц, 6H), 1,97-1,93 (м, 6Н).) . Отримання інгенол-5,20-ацетонід-3-ангелату (сполуки 2) Приклад 6А Суміш інгенол-5,20-ацетоніду (233 мг, 0,60 ммоль), [(Z)-2-метилбут-2-еноїл]-2,4,6трихлорбензоату (231 мг, 0,75 ммоль) і гідрокарбонату натрію* (75,6 мг, 0,90 ммоль) в толуолі (2,5 мл) перемішували при 100 °C протягом 22 годин. Потім суміш фільтрували і промивали толуолом. Фільтрат концентрували у вакуумі. Залишок очищали флеш-хроматографією (гептан/етилацетат, 19:1 → гептан/етилацетат, 3:2), отримуючи при цьому вказану в заголовку сполуку у вигляді білої твердої речовини (215 мг, вихід 76 %). *За відсутності гідрокарбонату натрію отриманий продукт містив 2-3 % інгенол-5,20ацетонід-3-тиглат. 1 Н ЯМР (300 МГц, CDCl3) δ 6,13-6,03 (м, 2H), 5,81-5,75 (м, 1H), 5,66 (с, 1H), 4,27-4,08 (м, 3H), 4,02 (с, 1H), 3,19 (с, 1H), 2,68-2,53 (м, 1H), 2,27 (ддд, J=15,8, 9,1, 3,0 Гц, 1H), 2,02-1,95 (м, 3H), 1,94-1,87 (м, 3H), 1,81-1,68 (м, 4H), 1,47 (с, 3H), 1,43 (с, 3H), 1,09 (с, 3H), 1,05 (с, 3H), 0,98 (д, J=7,1 Гц, 3H), 0,90 (дд, J=11,9, 8,4 Гц, 1H), 0,69 (тд, J=8,7, 6,4 Гц, 1H).) Приклад 7 Суміш інгенол-5,20-ацетоніду (1,32 г, 3,40 ммоль), ангелікового ангідриду (0,72 г, 3,94 ммоль) і карбонату цезію (1,66 г, 5,10 ммоль) в ацетонітрилі (26 мл) перемішували при кімнатній температурі протягом 2 годин. Суміш розчиняли в дихлорметані (30 мл) і промивали водою. Водну фазу екстрагували три рази дихлорметаном (3×4 мл). Об'єднані органічні фази сушили над сульфатом натрію і концентрували у вакуумі. Залишок очищали хроматографією (петролейний ефір/етилацетат, 8:1), отримуючи при цьому 1,46 г вказаної в заголовку сполуки (91 %) у вигляді білої твердої речовини. Приклад 8 Інгенол-5,20-ацетонід (10,00 г, 25,74 ммоль) розчиняли в тетрагідрофурані (100 мл) при перемішуванні і розчин охолоджували до 10-15 °C. Протягом періоду 10 хвилин додавали розчин гексаметилдисилазиду літію в тетрагідрофурані (1,0 М, 29,6 мл, 29,6 ммоль). Потім протягом 15 хвилин додавали розчин ангелікового ангідриду (5,51 мл, 5,62 г, 30,8 ммоль) в тетрагідрофурані (70 мл). Додавали етилацетат (200 мл) і велику частину розчинника реакції (200 мл) відганяли у вакуумі. До розчину, що залишився, додавали воду (75 мл) і суміш перемішували протягом 2 хвилин. Водний шар видаляли і промивання водою повторювали ще раз, перед тим як органічну фазу концентрували у вакуумі. Залишок розчиняли в метанолі (61 мл) нагріванням до температури кипіння з подальшим повільним охолоджуванням до 5 °C. Після витримування суміші протягом 4 годин кристали, що утворилися, відфільтровували, 17 UA 111827 C2 промивали при 5 °C метанолом (2×5 мл) і сушили у вакуумі при 20 °C до постійної маси. Через 18 годин отримували інгенол-5,20-ацетонід-3-ангелат (8,78 г). 5 10 15 20 25 30 35 40 45 50 55 Отримання інгенол-3-ангелату (сполуки 3) Приклад 9 Розчин інгенол-5,20-ацетонід-3-ангелату (7 мг, 0,015 ммоль) в метанолі, який містив 1 % концентрованого водного розчину хлористоводневої кислоти, перемішували при кімнатній температурі протягом 1 години. Розчин розбавляли етиловим ефіром. Додавали воду. Після розділення фаз водну фазу екстрагували етиловим ефіром. Об'єднані органічні фази сушили і концентрували у вакуумі. Залишок очищали хроматографією (петролейний ефір/етилацетат, 1:1), отримуючи при цьому продукт (4 мг, вихід 63 %). 1 Н ЯМР (300 МГц, CDCl3) δ 6,17 (квкв, J=7,3, 1,4 Гц, 1H), 6,02-6,02 (м, 2H), 5,54 (с, 1H), 4,29 (д, J=4,5 Гц, 1H), 4,22-4,01 (м, 4H), 3,42 (с, 1H), 2,60-2,46 (м, 1H), 2,40-2,17 (м, 2H), 2,02 (квд, J=7,2, 1,4 Гц, 3H), 1,95-1,91 (м, 3H), 1,83-1,68 (м, 4H), 1,09 (с, 3H), 1,05 (с, 3H), 1,01-0,82 (м, 4H), 0,77-0,61 (м, 1H). Приклад 10 Розчин інгенол-5,20-ацетонід-3-ангелату (1,46 г, 3,10 ммоль) в метанолі (30 мл), який містив 0,5 % концентрованого водного розчину хлористоводневої кислоти, перемішували при кімнатній температурі протягом 1 години. Потім розчин розбавляли толуолом і промивали водою. Водну фазу екстрагували етиловим ефіром. Об'єднані органічні фази сушили і концентрували у вакуумі. Залишок очищали хроматографією (петролейний ефір/етилацетат, 1:1-0:1), отримуючи при цьому продукт (1,20 г, 90 %), який містив 2 % інгенол-3-триглату. Розділення інгенолангелату і інгенолтиглату поєднанням методів препаративна ВЕРХ/МС Розділення поєднанням методів препаративна ВЕРХ/МС проводили на системі Dionex APS з двома препаративними насосами PP150 і мас-спектрометром Thermo MSQ Plus. Колонка: XТerra С-18, 150×19 мм, 5 мкм; Завантаження: 50 мг інгенолангелату в 0,35 мл ацетонітрилу; Система розчинників: елюент А: розчин 0,1 % НСООН в Н2О, елюент В: розчин 0,1 % НСООН в ацетонітрилі; швидкість потоку: 18 мл/хв.; проведення досліду: застосування суміші 40 % А/60 % В; ізократичні умови протягом 20 хв. Фракції зібрали на основі іонних слідів відповідних іонів (MС-детектор: MSQ від Dionex) і PDA-сигналу (240-400 нм; детектор UVD 340 U від Dionex). Приклад 11 Інгенол-5,20-ацетонід-3-ангелат (47,1 мг, 0,10 ммоль) розчиняли в тетрагідрофурані (0,47 мл) в атмосфері аргону. При охолоджуванні льодом додавали водний розчин хлористоводневої кислоти (4 M, 4,7 мкл). Розчин перемішували при кімнатній температурі протягом 24 годин. Розчин концентрували у вакуумі. Залишок очищали флеш-хроматографією (гептан/етилацетат, 5:1 → гептан/етилацетат 1:1), отримуючи при цьому вказану в заголовку сполуку (30,8 мг, вихід 72 %) крім вихідної речовини (6,1 мг, 13 %). Приклад 12 Інгенол-5,20-ацетонід-3-ангелат (6,00 г, 12,75 ммоль) суспендували в 2-пропанолі (152 мл) і перемішували при 20 °C. Додавали розчин фосфорної кислоти (15,00 г, 153 ммоль) у воді (8 мл) і суспензію нагрівали до 30-35 °C. Прозорий розчин, що утворився, перемішували протягом 7 днів. Реакційну суміш охолоджували до 20 °C і розбавляли метил-трет-бутиловим ефіром (500 мл). Додавали воду (100 мл) і суміш перемішували протягом 2 хвилин. Водний шар видаляли і промивання водою повторювали чотири рази перед тим, як органічну фазу концентрували у вакуумі. Додавали метил-трет-бутиловий ефір (200 мл) з подальшим концентруванням. Сирий продукт містив >95 % інгенол-3-ангелату. Залишок розчиняли в ацетонітрилі (20 мл) нагріванням до температури флегми. Розчин охолоджували до 5 °C. Після витримування 24 години при 5 °C осаджений продукт відділяли фільтруванням, промивали при 5 °C ацетонітрилом (2×5 мл) і сушили у вакуумі при 20 °C до постійної маси. Через 18 годину отримували інгенол-3-ангелат (3,91 г). Отримання сполук загальної формули (IV) з інгенолу Приклад 13 18 UA 111827 C2 5 Отримання симетричних кеталів Процедуру, описану в прикладі 1 для синтезу інгенол-5,20-ацетоніду, застосовували для отримання симетричних кеталів, замінюючи ацетон на 3-пентанон, 2,4-диметил-3-пентанон, 2,6диметил-4-гептанон, циклопентанон або циклогексанон, і застосовуючи інгенол в кількості 25-50 мг. Розподіл продуктів показаний в таблиці 1А. Продукти показані в таблиці 1B. Таблиця 1А Синтез симетричних кеталів, що каталізується кислотою а Реагент і розчинник Розподіл продуктів Пропанон (ацетон) I-5,20-А (70-75 %) I-3,4-А (5-10 %) I-3,4:5,20- А (10-15 %) I (5-10 %) 3-Пентанон I-5,20-Х (70-75 %) I-3,4-Х (5-10 %) I-3,4:5,20- Х (10-15 %) I (5-10 %) 2,4-Диметил-3-пентанон I-5,20-Х (0-5 %) I-3,4-Х (0-5 %) I-3,4:5,20- Х (0-5 %) I (90-95 %) 2,6-Диметил-4-гептанон I-5,20-Х (15-20 %) I-3,4-Х (15-20 %) I-3,4:5,20- Х (0-5 %) I (60-65 %) Циклопентанон I-5,20-Х (70-75 %) I-3,4-Х (5-10 %) I-3,4:5,20- Х (10-15 %) I (5-10 %) Циклогексанон I-5,20-Х (70-75 %) I-3,4-Х (5-10 %) I-3,4:5,20- Х (10-15 %) I (5-10 %) а 1 Розподіл продуктів визначали за даними Н ЯМР і/або ТШХ. Таблиця IB Інгенол-3,4-кеталь Інгенол-5,20-кеталь 11 12 R =R = метилінгенол5,20-ацетонід 11 12 R =R = етилінгенол5,20-(3пентиліден)кеталь (сполука 4) 11 12 R =R = проп-2ілінгенол-5,20-(2,4диметил-3 13 14 13 14 13 14 R =R = метилінгенол3,4-ацетонід R =R = етилінгенол-3,4(3-пентиліден)кеталь R =R = проп-2-ілінгенол3,4-(2,4-диметил-3пентиліден)кеталь 19 Інгенол-3,4:5,20- дикеталь 11 12 13 14 11 12 13 14 R =R =R =R = метилінгенол-3,4:5,20діацетонід 11 12 13 14 R =R =R =R = етилінгенол-3,4:5,20-ди-[(3пентиліден)кеталь] R =R =R =R = проп-2ілінгенол-3,4:5,20-ди-[(2,4диметил-3 UA 111827 C2 пентиліден)кеталь (сполука 5) 11 12 R =R =2-метилпроп-1ілінгенол-5,20-(2,6диметил-4гептиліден)кеталь (сполука 6) 11 12 R R = СН2СН2СН2СН2 інгенол5,20-циклопентиліденкеталь (сполука 7) 11 12 R R = СН2СН2СН2СН2СН2 інгенол-5,20циклогексиліден-кеталь 5 пентиліден)кеталь] 13 14 R =R =2-метилпроп-1ілінгенол-3,4-(2,6диметил-4гептиліден)кеталь R11=R12=R13=R14=2метилпроп-1-ілінгенол3,4:5,20-ди-[(2,6-диметил-4гептилиден)кеталь] 13 14 R R =R R = СН2СН2СН2СН2 інгенол3,4:5,20ди(циклопентиліден-кеталь) 13 14 R R =R R = СН2СН2СН2СН2СН2 інгенол3,4:5,20-ди(циклогексиліденкеталь) R R = СН2СН2СН2СН2 інгенол-3,4циклопентиліденеталь R R = СН2СН2СН2СН2СН2 інгенол-3,4циклогексиліден-кеталь 11 12 13 14 11 12 13 14 Приклад 14 Отримання несиметричних кеталів Загальну процедуру, описану в прикладі 15, застосовували для отримання несиметричних кеталів, замінюючи ацеталь/альдегід на 3,3-диметил-2-бутанон, ацетофенон або (1,1диметоксіетил)бензол і застосовуючи 25-50 мг інгенолу. Розподіл продуктів показаний в таблиці 2А. Продукти показані в таблиці 2B. Таблиця 2А Синтез несиметричних кеталів, що каталізується кислотою а Реагент в ТГФ Розподіл продуктів 3,3-Диметил-2-бутанон I-5,20-Х (20-30 %) I-3,4-Х (20-30 %) I-3,4:5,20- Х (10-20 %) I (30-40 %) При аналізі ТШХ спостерігали декілька інших продуктів Ацетофенон Перетворення не відбувалося (1,1-Диметоксіетил)бензол I-5,20-Х (10-20 %) I-3,4-Х (30-40 %) I-3,4:5,20- Х (10-20 %) I (30-40 %) При аналізі ТШХ спостерігали декілька інших продуктів а 1 Розподіл продуктів визначали за даними Н ЯМР і/або ТШХ. 10 20 UA 111827 C2 Таблиця 2B Інгенол-5,20-кеталь 12 R =1,1диметилетилінгенол-5,20(3,3-диметил-2бутиліден)кеталь (сполука 9) 12 R = фенілінгенол-5,20(1-феніл-1етилиден)кеталь (сполука 10) 5 10 Інгенол-3,4-кеталь Інгенол-3,4:5,20-дикеталь 14 R =R =1,1диметилетилінгенол3,4:5,20-ди-[(3,3-диметил2-бутиліден)кеталь] 14 R =R = фенілінгенол3,4:5,20-ди-[(1-феніл-1етиліден)кеталь] R =1,1диметилетилінгенол-3,4(3,3-диметил-2бутиліден)кеталь R = фенілінгенол-3,4-(1феніл-1-етиліден)кеталь 12 14 12 14 Приклад 15 (загальна процедура) Отримання ацеталів Інгенол (25 мг, 72 мкмоль) розчиняли в тетрагідрофурані (622 мкл) при 20 °C. При перемішуванні додавали розчин моногідрату п-толуолсульфонової кислоти в тетрагідрофурані (50 мг/мл, 0,26 М, 96 мкл, 25 мкмоль). Додавали альдегід/ацеталь (86 мкмоль) і моніторинг прогресу реакції проводили ТШХ. Представлені дані отримували після часу реакції 21 година. Розподіл продуктів показаний в таблиці 3А. Продукти показані в таблиці 3B. Таблиця 3А Синтез ацеталів, що каталізується кислотою а Розподіл продуктів I-5,20-Х (65-70 %) (Один епімер) I-3,4-Х (5-10 %) I-3,4:5,20- Х (10-15 %) I (10-15 %) 1 При аналізі ТШХ і Н ЯМР не спостерігали присутності епімерів Бензальдегіддиметилацеталь I-5,20-Х (45-50 %) (Один епімер) I-3,4-Х (5-10 %) I-3,4:5,20- Х (10-15 %) I (30-35 %) При аналізі ТШХ не спостерігали присутності епімерів. При аналізі ТШХ спостерігали декілька інших продуктів. 4-Метоксибензальдегід I-5,20-Х (10-20 %) I-3,4-Х (10-15 %) I-3,4:5,20- Х (5-10 %) I (60-70 %) При аналізі ТШХ не спостерігали присутності епімерів. 2,4-Диметоксибензальдегід I-5,20-Х (10-15 %) I-3,4-Х (5-10 %) I-3,4:5,20- Х (5-10 %) I (70-75 %) При аналізі ТШХ спостерігали присутність одного іншого продукту. 4-Нітробензальдегід I-5,20-Х (15-20 %) I-3,4-Х (5-10 %) Реагент в ТГФ Бензальдегід 21 UA 111827 C2 2,4,6-Триметилбензальдегід Триметилацетальдегід I-3,4:5,20- Х (5-10 %) I (65-70 %) При аналізі ТШХ не спостерігали присутності епімерів. I-5,20-Х (15-20 %) I-3,4-Х (0-5 %) I-3,4:5,20- Х (10-15 %) I (65-70 %) При аналізі ТШХ не спостерігали присутності епімерів. I-5,20-Х (45-50 %) I-3,4-Х (10-15 %) I-3,4:5,20-Х (10-15 %) I (25-30 %) При аналізі ТШХ не спостерігали присутності епімерів. а 1 Розподіл продуктів визначали за даними Н ЯМР і/або ТШХ. Таблиця 3B Інгенол-3,4-ацеталь Інгенол-5,20-ацеталь 12 R = фенілінгенол-5,20бензиліденацеталь (сполука 11) 12 R =4метоксифенілінгенол5,20-(4метоксибензиліден) ацеталь (сполука 12) 12 R =2,4диметоксифенілінгенол5,20-(2,4-диметоксибензиліден)ацеталь (сполука 13) 12 R =4-нітрофенілінгенол5,20-(4-нітробензиліден) ацеталь (сполука 14) 12 R =2,4,6триметилфенілінгенол5,20-(2,4,6-триметилбензиліден)ацеталь (сполука 15) 12 R =1,1диметилетилінгенол-5,20(2,2-диметил-1пропіліден)ацеталь (сполука 16) 14 R = фенілінгенол-3,4бензиліденацеталь 14 R =4метоксифенілінгенол-3,4(4-метоксибензиліден) ацеталь 12 R =2,4диметоксифенілінгенол3,4-(2,4-диметоксибензиліден)ацеталь 14 R =4-нітрофенілінгенол3,4-(4-нітробензиліден) ацеталь 14 R =2,4,6триметилфенілінгенол3,4-(2,4,6-триметилбензиліден)ацеталь 14 R =1,1диметилетилінгенол-3,4(2,2-диметил-1пропіліден)ацеталь Приклад 16 (загальна процедура) Синтез бензиліденацеталю 22 Інгенол-3,4:5,20-діацеталь 12 14 12 14 R =R = фенілінгенол3,4:5,20ди(бензиліденацеталь) 12 14 R =R =4метоксифенілінгенол3,4:5,20-ди-[(4метоксибензиліден) ацеталь] R =R =2,4диметоксифенілінгенол3,4:5,20-ди-[(2,4диметоксибензиліден)ацеталь] 12 14 R =R =4нітрофенілінгенол3,4:5,20-ди-[(4нітробензиліден) ацеталь] 12 14 R =R =2,4,6триметилфенілінгенол3,4:5,20-ди-[(2,4,6триметилбензиліден) ацеталь] 12 14 R =R =1,1диметилетилінгенол3,4:5,20-ди-[(2,2-диметил1-пропіліден)ацеталь] UA 111827 C2 5 10 Інгенол (25 мг, 72 мкмоль) розчиняли в розчиннику (622 мкл) при 20 °C при перемішуванні. Для реакцій, що проводяться в піридині, ніяку додаткову основу не додавали. Для реакцій, що проводяться в ацетоні або N, N-диметилформаміді, додавали карбонат калію (158 мкмоль). Для реакцій, що проводяться в тетрагідрофурані або 2-метилтетрагідрофурані, додавали гексаметилдисилазид літію (158 мкмоль) у вигляді розчину в тетрагідрофурані (1,0 М). Розчин/суспензію реагенту (79 мкмоль) в розчиннику (96 мкл) додавали по краплях. Моніторинг прогресу реакції проводили ТШХ. Для повільних реакцій температуру підвищували з 20 °C до 50 °C і в кінцевому результаті до точки кипіння розчинника. Реакцію інгенолу з α,αдибромтолуолом в піридині проводили при 100 °C протягом 3 годин. Реакцію інгенолу з α,αбіс(піридиній)толуолдибромідом в тетрагідрофурані проводили при 50 °C протягом 1 години. Розподіл продуктів вказується в таблиці 4А. Продукти представлені в таблиці 4B. Таблиця 4а Синтез бензиліденацеталю, що промотується основою а Розчинник Основа Розподіл продуктів Піридин або K2CO3 (в ацетоні і Перетворення не ацетон, або ДМФА, ДМФА) або LiHMDS відбувалося або МеТГФ (в МеТГФ) α,α-Дибромтолуол Піридин Піридин I-5,20-Х (85-90 %) (один епімер) I-3,4-Х (0-10 %) I-3,4:5,20- Х (0-10 %) I (0-5 %) α,α-Біс(піридиній) ТГФ LiHMDS I-5,20-Х (20-30 %) b толуолдибромід I-3,4-Х (20-30 %) I-3,4:5,20- Х (20-30 %) I (20-30 %) При допомозі ТШХ виявили декілька інших продуктів α,α-Біс-(4Піридин або ДМФА, K2CO3 (в ДМФА) Перетворення не (диметиламіно) або ТГФ або LiHMDS (в ТГФ) відбувалося піридиній) с толуолдибромід Реагент α,α-Дихлортолуол а 1 Розподіл продуктів оцінювали за даними Н ЯМР і/або ТШХ. Отримання: ср. з Acta Chem. Scand. 1972, 26, 3895-3901 і J. Org. Chem. 2007, 72, 98549856 (сполука 1 на схемі 2). с Отриманий обробкою α,α-дибромтолуолу (10 г, 0,04 ммоль) 4-(диметиламіно)піридин (10,78 г, 0,088 ммоль) в ацетоні (20 мл) при кип'ятінні із зворотним холодильником протягом 1 години. b 15 20 Приклад 17 Синтез ортоформіатів Загальну методику, описану в прикладі 15, застосовували для отримання ортоформіатів, замінюючи альдегід/ацеталь триметилортоформіатом, триетилортоформіатом або три(проп-2іл)ортоформіатом і застосовуючи 25-100 мг інгенолу. Розподіл продуктів показаний в таблиці 5А. Продукти показані в таблиці 5B. 23 UA 111827 C2 Таблиця 5А Синтез ортоформіатів, що каталізується кислотою а Реагент в ТГФ Розподіл продуктів Триметилортоформіат I-5,20-Х (75-80 %, суміш епімерів, 60:40) I-3,4-Х (0-10 %) I-3,4:5,20- Х (0-10 %) I (10-15 %) Триетилортоформіат I-5,20-Х (75-80 %, суміш епімерів, 60:40) I-3,4-Х (0-10 %) I-3,4:5,20- Х (0-10 %) I (10-15 %) Три(проп-2-іл)ортоформіат I-5,20-Х (75-80 %, суміш епімерів, 60:40) I-3,4-Х (0-10 %) I-3,4:5,20- Х (0-10 %) I (10-15 %) а 1 Розподіл продуктів визначали за даними Н ЯМР і ТШХ. Таблиця 5B Інгенол-5,20-ортоформіат 22 R = Метилінгенол-5,20метилортоформіат (сполука 17) 22 R = Етилінгенол-5,20ортоформіат (сполука 18) 22 R = Проп-2-ілінгенол5,20-(проп-2іл)ортоформіат (сполука 19) 5 Інгенол-3,4-ортоформіат 24 R = Метилінгенол-3,4метилортоформіат Інгенол-3,4:5,20-діортоформіат 22 24 R =R = Метилінгенол-3,4:5,20ди(метилортоформіат) 24 R =R = Етилінгенол-3,4:5,20ди(етилортоформіат) 24 R =R = Проп-2-ілінгенол3,4:5,20-ди[(проп-2-іл) ортоформіат] R = Етилінгенол-3,4етилортоформіат R = Проп-2-ілінгенол-3,4(проп-2-іл)ортоформіат 22 24 22 24 Приклад 18 Синтез метилортоформіату (метоксиметиленацеталю) Процедуру, описану в прикладі 16, застосовували із застосуванням дихлорметилметилового ефіру як реагенту і з використанням гексаметилдисилазиду літію в тетрагідрофурані. Реакцію проводили в тетрагідрофурані при 20 °C протягом 30 хвилин. 24 UA 111827 C2 Таблиця 6А Синтез метилортоформіату (метоксиметиленацеталю), що промотується основою а Реагент Розчинник Основа Розподіл продуктів Дихлорметил-метиловий ТГФ LiHMDS I-5,20-Х (10-15 %) етер I-3,4-Х (10-15 %) I (50-60 %) При допомозі ТШХ виявили декілька інших продуктів а Розподіл продукту оцінювали за даними ТШХ. 5 10 15 Синтез сполук загальної формули (VI) Синтез інгенол-5,20-ацетонід-3-ангелату із застосуванням ангелікової кислоти (AngОH) Приклад 19А (загальна процедура) Інгенол-5,20-ацетонід (10,0 мг, 26 мкмоль) і ангелікову кислоту (2,6 мг, 26 мкмоль) розчиняли в розчиннику (175 мкл) при 20 °C при перемішуванні. Для реакцій, що проводяться в присутності основи, додавали або 4-(диметиламіно)піридин (6,3 мг, 52 мкмоль) або N, N-діізопропілетиламін (9 мкл, 6,7 мг, 52 мкмоль) перед додаванням по краплях розчину/суспензії реагенту сполучення 1 (26-52 мкмоль) в розчиннику (75 мкл). Моніторинг прогресу реакції проводили ТШХ і Н ЯМРспектроскопією. Приклад 19B Інгенол-5,20-ацетонід (25,0 мг, 64 мкмоль), ангелікову кислоту (6,4 мг, 64 мкмоль) і йодид 2хлор-1-метилпіридинію (19,7 мг, 77 мкмоль) (реагент Mukaiyama) суспендували в толуолі (108 мкл). Додавали трибутиламін (37 мкл, 29 мг, 155 мкмоль) і суміш перемішували при 60 °C 1 протягом 18 годин. Моніторинг прогресу реакції проводили ТШХ і H ЯМР-спектроскопією. Розподіл продукту і умови реакції для прикладів 19A і 19B наведені в таблиці 7А. Продукти показані в таблиці 7В. Відношення (Е)/(Z) є відношенням тиглат/ангелат. 20 Таблиця 7A Синтез інгенол-5,20-ацетонід-3-ангелату із застосуванням ангелікової кислоти (AngOH) b Реагент Розчинник Утворені продукти (виходи сирих (Е)/(Z) продуктів)а EDCI CDCl3 Ang2O N/А EDCI/DMAP DCM I-5,20-A-3-Tig (50-60 %) і Ang2O, AngOTig і 96:4 Tig2O DCC CDCl3 I-5,20-A-3-Ang (2 %) і Ang2O 1:99 DCC PhMe Перетворення не відбувалося N/А DСС/DIPEA PhMe Перетворення не відбувалося N/А DCC/DMAP CDCl3 I-5,20-A-3-Tig (75 %) 85:15 HATU/DIPEA ДМФА Спочатку відбувалося утворення AngOAt N/А (100 %). Потім він відповідним чином гідролізувався в AngOH і HOAt Йодид 2-хлор-1- PhMe I-5,20-A-3-Tig (30-40 %) і Ang2O, AngOTig і 90:10 метилпіридинію/Bu3N Tig2O a, b 1 Виходи і відношення (Е)/(Z) оцінювали за даними H ЯМР і ТШХ. (E)/(Z)1:99 внаслідок вмісту 0,5-1 % TigOH в AngOH. Відношення (Е)/(Z) є відношенням I-5,20-A-3-Тig/I-5,20-A-3-Ang. b 25 UA 111827 C2 Таблиця 7B Інгенол-5,20-ацетонід-3-тиглат Інгенол-5,20-ацетонід-3-ангелат 5 10 15 20 Синтез інгенол-5,20-ацетонід-3-ангелату із застосуванням ангелікового ангідриду Приклад 20А Процедуру для синтезу інгенол-5,20-ацетонід-3-ангелату, описану в прикладі 8, застосовували для реакції гексаметилдисилазиду літію в метил-трет-бутиловому ефірі, гексаметилдисилазиду літію в тетрагідрофурані, гексаметилдисилазиду натрію в тетрагідрофурані і гексаметилдисилазиду калію в тетрагідрофурані із застосуванням від 25 мг до 10 г інгенол-5,20-ацетоніду. Приклад 20B Експериментальна процедура для синтезу інгенол-5,20-ацетонід-3-ангелату із застосуванням карбонату цезію описана в прикладі 7. Приклад 20C (загальна методика) Інгенол-5,20-ацетонід (15,0 мг, 39 мкмоль) розчиняли в піридині (386 мкл) або тетрагідрофурані (386 мкл) при 20 °C при перемішуванні. Для реакції, що проводиться в піридині, додавали ангеліковий ангідрид (10,6 мг, 58 мкмоль). Для реакції, що проводиться в тетрагідрофурані, перед додаванням ангелікового ангідриду (10,6 мг, 58 мкмоль) додавали 4(диметиламіно)піридин (7,1 мг, 58 мкмоль). Моніторинг прогресу реакції проводили з допомогою 1 ТШХ і H ЯМР-спектроскопії. Розподіл продуктів і умови реакції для прикладів 20А, 20В і 20С показані в таблиці 8А. Продукти показані в таблиці 7В. Відношення (Е)/(Z) є відношенням I-5,20-A-3-Тig/I-5,20-A-3-Ang. Таблиця 8 Синтез інгенол-5,20-ацетонід-3-ангелату із застосуванням ангелікового ангідриду (Ang 2O) а b Реагент Розчинник Утворені продукти (виходи сирих продуктів) (Е)/(Z) LiHMDS МТВЕ I-5,20-А-3-Ang (>95 %), більш повільне перетворення в 2:98b МТВЕ, ніж в ТГФ через низьку розчинність LiHMDS ТГФ Швидке і повне перетворення в I-5,20-А-3-Ang (>95 %) 2:98 NaHMDS ТГФ I-5,20-А-3-Ang (>95 %), більш повільне перетворення, ніж 2:98 перетворення з LiHMDS, що вимагає більший надлишок реагентів KHMDS ТГФ I-5,20-А-3-Ang (>90 %), більш повільне і менш повне 2:98 перетворення, ніж перетворення з LiHMDS і NaHMDS Cs2CO3 MeCN I-5,20-А-3-Ang (>95 %) 2:98 Піридин Піридин I-5,20-А-3-Tig (55 %) 96:4 DMAP ТГФ I-5,20-А-3-Tig (55 %) 96:4 a, b 1 Виходи і відношення (Е)/(Z) оцінювали за даними H ЯМР і ТШХ. (E)/(Z)2:98 внаслідок вмісту 1,5-2 % AngOTig в Ang2O. Відношення (Е)/(Z) є відношенням I-5,20-A-3-Тig/I-5,20-A-3-Ang. b 25 30 Синтез інгенол-5,20-ацетонід-3-ангелату із застосуванням ангелоїлхлориду Приклад 21A Процедуру, описану в прикладі 8 для ангелікового ангідриду, застосовували для реакції між ангелоїлхлоридом і інгенол-5,20-ацетонідом із застосуванням гексаметилдисилазиду літію в тетрагідрофурані. Експеримент проводили із застосуванням 25 мг інгенол-5,20-ацетоніду. Приклад 21B 26 UA 111827 C2 5 Застосовували процедуру, описану в прикладі 20C для ангелікового ангідриду, замінюючи ангеліковий ангідрид ангелоїлхлоридом, для реакції між ангелоїлхлоридом і інгенол-5,20ацетонідом в етиловому простому ефірі без основи, в тетрагідрофурані без основи, в піридині і в тетрагідрофурані з доданим 4-(диметиламіно)піридином (1,5 екв.). Експерименти проводили із застосуванням 15-50 мг інгенол-5,20-ацетоніду. Розподіл продуктів і умови реакції для прикладів 21А і 21В показані в таблиці 9. Продукти показані в таблиці 7В. Відношення (Е)/(Z) є відношенням I-5,20-A-3-Тig/I-5,20-A-3-Ang. Таблиця 9 Синтез інгенол-5,20-ацетонід-3-ангелату із застосуванням ангелоїлхлориду (AngCl)3 а b Реагент Розчинник Утворені продукти (вихід сирих продуктів) (Е)/(Z) LiHMDS ТГФ I-5,20-А-3-Ang (60 %) і I-5,20-А (30 %) і інші домішки 3:97 (10 %) Був Етиловий Перетворення не відбувалося, низька розчинність N/А відсутній етер Був ТГФ Перетворення не відбувалося N/А відсутній Піридин Піридин I-5,20-А-3-Tig (60-70 %) і домішки (30 %) 96:4 DMAP ТГФ I-5,20-А-3-Tig (50-60 %) 96:4 a, b 1 Виходи і відношення (Е)/(Z) оцінювали по даним H ЯМР і ТШХ. (E)/(Z)3:97 внаслідок ізомеризації AngCl в TigCl під час зберігання. Відношення (Е)/(Z) є відношенням I-5,20-A-3-Тig/I-5,20-A-3-Ang. с Отримання: ср. з публікацією Tetrahedron Letters 1977, 38, 3379-3382 (сполука 2). b 10 15 Синтез інгенол-5,20-ацетонід-3-ангелату із застосуванням метилангелату Приклад 22 Процедуру, описану в прикладі 8 для ангелікового ангідриду, застосовували для реакції між метилангелатом і інгенол-5,20-ацетонідом із застосуванням гексаметилдисилазиду літію в тетрагідрофурані. Експеримент проводили із застосуванням 25 мг інгенол-5,20-ацетоніду. Таблиця 10 Синтез інгенол-5,20-ацетонід-3-ангелату із застосуванням метилангелату (AngОМе)3 Утворені продукти b Реагент Розчинник (Е)/(Z) а (вихід сирих продуктів) LiHMDS ТГФ I-5,20-А-3-Ang (7 %) 1:99 a, b 1 Вихід і відношення (Е)/(Z) оцінювали за даними H ЯМР і ТШХ. (Е)/(Z)=1:99 внаслідок вмісту 0,5-1 % TigOMe в AngОМе. Відношення (Е)/(Z) є відношенням I-5,20-A-3-Тig/I-5,20-A-3-Ang. с Отриманий додаванням по краплях розчину (триметилсиліл)діазометану в етиловому ефірі (2,0 М, 18,8 мл, 38 ммоль) протягом періоду 175 хвилин при 20 °C до розчину ангелікової кислоти (3,0 г, 30,0 ммоль), що перемішується в суміші дихлорметан/метанол=3:2 (30 мл). Реакційну суміш концентрували і метилангелат очищали вакуумною дистиляцією. Див. також J. Org. Chem. 1950, 15, 680-684. 1 H ЯМР (300 МГц, CDCl3) δ 6,06 (квкв, 1H), 3,74 (с, 3Н), 1,98 (дкв, 3Н), 1,89 (квінтет, 3H). b 20 25 Приклад 23 (загальна методика) Отримання інгенол-3-ангелату з інгенол-5,20-ацетонід-3-ангелату Інгенол-5,20-ацетонід-3-ангелат (15 мг, 35 мкмоль) розчиняли/суспендували в органічному розчиннику (331 мкл) при 20 °C. При перемішуванні додавали розчин каталізатора у воді (17 мкл), що приводило до досягнення концентрації 0,1 М відносно інгенол-5,20-ацетонід-3ангелату. Інгенол-5,20-ацетонід-3-ангелат розчиняли в суміші розчинники мурашина кислота/вода (95:5), оцтова кислота/вода (95:5) і трифтороцтова кислота/вода (95:5). 1 Моніторинг прогресу реакції проводили ТШХ і Н ЯМР-спектроскопією. Розподіл продуктів і умови реакції для прикладу 23 показані в таблиці 11А. Продукти показані в таблиці 11В. 27 UA 111827 C2 Таблиця 11А Каталіза-тор pKa Мол. відноb шення Розчинник Темп., С HCl -8,0 1 HCl -8,0 1 HCl -8,0 1 MSA -2,6 2 MSA -2,6 2 Катіонобм. смола AG 50WX2 TFA -2,6 2 ТГФ/Н2О 95:5 МеОН/Н2О 95:5 IPA/Н2О 95:5 ТГФ/Н2О 95:5 IPA/Н2О 95:5 IPA/Н2О 95:5 6,5 124 Н3РО4 0,25 0,25 2,12 НСООН 3,77 252 АсОН 4,76 166 IPA/Н2О 95:5 TFA/Н2О 95:5 IPA/Н2О 95:5 НСООН/ Н2О 95:5 АсОН/Н2О 95:5 TFA а 12 ( а а (Е)/(Z) після n днів (дні) Примітка 20 (Е)/(Z) при повному перетворенні (дні) 5:95 (4) 19:81 (11) Чистий 20 3:97 (4) 3:97 (>4) 20 N/А N/А Етерифіс кація d Розклад. 30 2:98 (7) 2:98 (10) Чистий 20 N/А N/А Розклад. 20 2:98 (>4) 2:98 (4) Етерифіс кація d 1 Відношення Е)/(Z) оцінювали за даними H ЯМР-спектроскопії. (Е)/(Z)2:98 внаслідок вмісту 1-2 % I-5,20-А-3-Tig в I-5,20-A-3-Ang. b Число молів каталізатора відносно I-5,20-A-3-Ang. с Утворення естеру реакцією між каталізатором і 20-положенням інгенолу. d Розкладання Відношення (Е)/(Z) є відношенням I-3-Tig/I-3-Ang. a Таблиця 11B Інгенол-3-ангелат 5 Інгенол-3-тиглат . Приклад 24 Інгенол-5,20-(ди(трет-бутил)силіленовий) етер (сполука 20) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюA method of producing ingenol-3-angelate
Автори англійськоюHogberg, Thomas, Grue-Sorensen, Gunnar, Liang, Xifu, Horneman, Anne, Marie, Petersen, Anders, Klarskov
Автори російськоюХегберг Томас, Груе-Серенсен Гуннар, Лян Сифу, Хорнеман Анне Мария, Петерсен Андерс Кларскоу
МПК / Мітки
МПК: C07C 67/08, C07D 319/08, C07C 67/297, C07C 69/533
Мітки: отримання, спосіб, інгенол-3-ангелату
Код посилання
<a href="https://ua.patents.su/37-111827-sposib-otrimannya-ingenol-3-angelatu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання інгенол-3-ангелату</a>
Попередній патент: Упаковка для приготування пінливого напою або харчового продукту
Наступний патент: Дробильний агрегат з гравітаційно-пневматичним електроприводом
Випадковий патент: Протизаплідний засіб