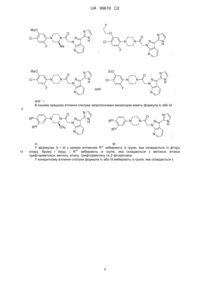
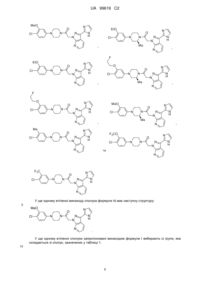
3-(імідазоліл)піразоло[3,4-b]піридини
Формула / Реферат
1. Сполука формули
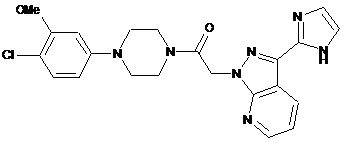
або її фармацевтично прийнятна сіль, гідрат або N-оксид.
2. Сполука за п. 1, яка має форму гідрату.
3. Сполука за п. 1, яка має форму фармацевтично прийнятної солі.
4. Фармацевтична композиція, яка містить сполуку за п. 1 і фармацевтично прийнятний ексципієнт або носій.
5. Спосіб одержання сполуки за п. 1, за яким сполуку формули
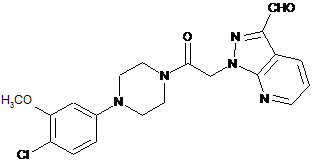
піддають взаємодії з імідазолутворюючим реагентом в умовах, достатніх для утворення зазначеної сполуки за п. 1.
6. Спосіб за п. 5, де зазначений імідазолутворюючий реагент обирають із групи, яка складається із гліоксалю або еквівалента гліоксалю.
7. Спосіб за п. 5, де зазначений імідазолутворюючий реагент є гліоксалем, і зазначена взаємодія відбувається в присутності ацетату амонію.
8. Спосіб одержання сполуки за п. 1, який включає наступні стадії, за якими:
(а) сполуку формули
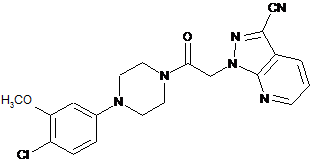
піддають взаємодії з етилендіаміном з утворенням імідазоліну; і
(b) проводять окиснення зазначеного імідазоліну з утворенням зазначеної сполуки за п. 1.
9. Спосіб за п. 8, де зазначене окиснення здійснюють за допомогою реагента, вибраного із групи, до якої входять: KМnО4, MnО2, PhІ(OAc)2, реагенти окиснення за Сверном та періодинан Дес-Мартіна.
10. Спосіб лікування захворювань або станів, при яких задіяні CCR1, за яким суб'єкту, який потребує допомоги, вводять терапевтично ефективну кількість сполуки за п. 1.
11. Спосіб за п. 10, де зазначене опосередковуване CCR1 захворювання або стан є запальним станом.
12. Спосіб за п. 10, де зазначене захворювання або стан, при якому задіяні CCR1, є імунорегуляторним розладом.
13. Спосіб за п. 10, де зазначене захворювання або стан, при якому задіяні CCR1, вибирають із групи до якої входять: ревматоїдний артрит, розсіяний склероз, відторгнення трансплантата, рестеноз, дерматит, екзема, кропивниця, васкуліт, запальне захворювання кишечнику, харчова алергія, астма, хвороба Альцгеймера, хвороба Паркінсона, псоріаз, червоний вовчак, остеоартрит, напад, рестеноз та енцефаломієліт.
14. Спосіб за п. 10, де зазначене введення є пероральним, парентеральним, ректальним, трансдермальним, сублінгвальним, назальним або місцевим.
15. Спосіб за п. 10, де зазначену сполуку вводять у поєднанні із протизапальним засобом, анальгетиком, антипроліферативним засобом, інгібітором метаболізму, інгібітором міграції лейкоцитів або імуномодулятором.
16. Спосіб за п. 10, де зазначена сполука є
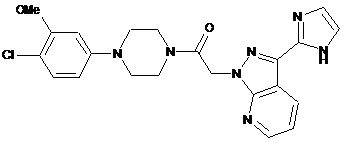 .
.
Текст
Реферат: Винахід стосується сполуки формули OMe N O Cl N N N N H N N або її фармацевтично прийнятної солі, гідрату або N-оксиду, що є сильним антагоністом рецептора CCR1 і характеризується in vivo протизапальною активністю; способу одержання цієї сполуки; фармацевтичної композиції на її основі та застосування у лікуванні захворювань, станів і розладів, в яких задіяні CCR1. UA 99619 C2 (12) UA 99619 C2 UA 99619 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої відноситься винахід Даний винахід відноситься до сполук, фармацевтичних композицій, які містять одну або декілька зазначених сполук або їх фармацевтично прийнятні солі, які є ефективними при інгібуванні зв'язування різних хемокінів, таких як MIP-1α, лейкотактин, MPIF-1 і RANTES, з рецептором CCR1. Як антагоністи або модулятори рецептора CCR1 сполуки та композиції придатні для лікування запальних і імунних розладів та захворювань. Попередній рівень техніки Здоров'я людини залежить від здатності організму виявляти та руйнувати чужорідні патогени, які в іншому випадку можуть відбирати життєві ресурси в індивідуума та/або викликати захворювання. Імунна система, яка включає лейкоцити (білі клітини крові (WBС): Т- і B-лімфоцити, моноцити, макрофаги, гранулоцити, NK-клітини, гладкі клітини, дендритні клітини та імунопохідні клітини (наприклад, остеокласти)), лімфоїдні тканини та лімфатичні судини, є захисною системою організму. Для боротьби з інфекцією білі клітини крові циркулюють по організму для виявлення патогенів. Як тільки патоген виявлений, природні імуноцити й, зокрема, цитотоксичні Т-клітини збираються в місці інфекції для руйнування патогена. Хемокіни діють як молекулярні знаки для збору та активації імуноцитів, таких як лімфоцити, моноцити та гранулоцити, ідентифікуючи ділянки, у яких існують патогени. Незважаючи на регуляцію патогенів імунною системою, може розвиватися деяка невідповідна передача сигналів хемокінами та зв'язуватися із провокацією або підтримкою запальних розладів, таких як ревматоїдний артрит, розсіяний склероз та інших. Наприклад, при ревматоїдному артриті нерегульоване нагромадження хемокінів у суглобах притягає та активує інфільтруючі макрофаги та Т-клітини. Активність таких клітин викликає проліферацію синовіальних клітин, що веде, щонайменше, частково, до запалення та можливої втрати кісткової та хрящової тканини (див. DeVries M.E. et al., Semin. Immunol., 11(2): 95-104 (1999)). Ознакою деяких демієлінізуючих захворювань, таких як розсіяний склероз, є хемокінопосередкований рекруітмент моноцитів/макрофагів або Т-клітин до центральної нервової системи (див. Kennedy et al., J. Clin. Immunol., 19(5): 273-279 (1999)). Рекруітмент хемокінів деструктивних WBC до трансплантатів залучається до їхнього наступного відторгнення. Див. DeVries M.E. et al., цит. вище. Оскільки хемокіни грають основні ролі в розвитку запалення та лімфоцитів, можливість специфічно маніпулювати їхньою активністю має величезне значення для зменшення симптомів і припинення захворювань, для яких у цей час немає задовільного лікування. Крім того, відторгнення трансплантата можна мінімізувати без генералізованих складних впливів, дорогих імунодепресивних фармацевтичних препаратів. Хемокіни - група з більш ніж 40 невеликих пептидів (7-10 кД) - лігують рецептори, експресовані головним чином на WBC або імунопохідних клітинах, і передають сигнали через каскади передачі сигналів, з'єднані з G-білком, для опосередкування їх хемоатрактантних і хемостимулюючих функцій. Рецептори можуть зв'язуватися з декількома лігандами; наприклад, рецептор CCR1 лігує хемокіни RANTES (регульовані на нормальних експресованих Т-клітинах активації), MIP-1α (макрофаговий білок зони запалення), MPIF-1/CKß8 і лейкотактин (серед інших з меншою афінністю). На сьогодні відомо 24 хемокінових рецептора. Існуючий ряд хемокінів, рецептори, які зв'язують різні ліганди, і різні профілі рецепторів на імуноцитах дають можливість для строго регульованих і специфічних імунних реакцій. Див. Rossi et al., Ann. Rev. Immunol., 18(1): 217-242 (2000). Активність хемокінів можна регулювати через модуляцію їхніх відповідних рецепторів, виліковуючи відповідні запальні та імунологічні захворювання та роблячи придатними трансплантати органів і тканин. Рецептор CCR1 і його хемокінові ліганди, наприклад, MIP-1α, MPIF-1/CKß8, лейкотактин і RANTES, є важливими терапевтичними мішенями (див. Saeki et al., Current Pharmaceutical Design, 9: 1201-1208 (2003)), оскільки вони пов'язані з ревматоїдним артритом, відторгненням трансплантата (див. DeVries M.E. et al., цит. вище) і розсіяним склерозом (див. Fischer et al., J. Neuroimmunol., 110(1-2): 195-208 (2000); Izikson et al., J. Exp. Med., 192(7): 1075-1080 (2000); і Rottman et al., Eur. J. Immunol., 30(8): 2372-2377 (2000)). Дійсно, виявлені блокуючі функції антитіла, модифіковані ліганди хемокінових рецепторів і низькомолекулярні органічні сполуки, з яких деякі, як було успішно показано, попереджають або лікують деякі хемокінопосередковані захворювання (огляд в Rossi et al., цит. вище). Наприклад, на експериментальній моделі ревматоїдного артриту розвиток захворювання слабшає, коли вводять ліганд модифікований RANTES, який блокує передачу сигналу (див. Plater-Zyberk et al., Immunol. Lett., 57(1-3): 117-120 (1997)). Хоча терапії з блокуючими функції антитілами та низькомолекулярними пептидами є багатообіцяючими, до їхніх недоліків належать небезпека деградації, досить короткі періоди напіввиведення, коли їх уводять, і надмірно високі витрати на розробку та виробництво, характерні для багатьох білків. Низькомолекулярні органічні сполуки є кращими, тому що вони 1 UA 99619 C2 5 10 часто мають більш тривалі періоди напіввиведення in vivo, вимагають менші дози для впливу, їх часто можна вводити перорально і, нарешті, вони дешевші. Деякі органічні антагоністи CCR1 описані раніше (див. Hesselgesser et al., J. Biol. Chem., 273(25): 15687-15692 (1998); Ng et al., J. Med. Chem., 42(22): 4680-4694 (1999); Liang et al., J. Biol. Chem., 275(25): 19000-19008 (2000); і Liang et al., Eur. J. Parmacol., 389(1): 41-40 (2000)). З урахуванням ефективності, показаної при лікуванні захворювань на тваринних моделях (див. Liang et al., J. Biol. Chem., 275(25): 1900019008 (2000)), триває пошук для ідентифікації інших сполук, які можна використовувати при лікуванні захворювань, спричинених передачею сигналів CCR1. Сутність винаходу Даний винахід належить до сполук формули I R2a N O R2c R2d N N (R1)m N N N R3 N 15 20 25 30 35 40 45 50 1 або їх фармацевтично прийнятних солей, гідратів або N-оксидів. У формулі I R є C1-42a 2с 2d алкілом або С1-4-галогеналкілом, і m дорівнює цілому числу від 0 до 1. R , R і R є замісниками, обраними, кожний незалежно, із групи, яка складається з водню, галогену, С 1-43 алкокси, С1-4-алкілу, С1-4-галогеналкілу та С1-4-галогеналкілу, і R є замісником, обраним із групи, яка складається з водню та С1-4-алкілу. Крім сполук, описаних у даному описі, винахід також відноситься до фармацевтичних композицій, які містять одну або декілька зазначених сполук, а також до способів застосування зазначених сполук, головним чином, для лікування захворювань, пов'язаних із сигнальною активністю CCR1, CCR2 та/або CCR3. Здійснення винаходу I. Абревіатури та визначення Термін «алкіл», як такий, або як частина іншого замісника позначає, якщо не зазначено інакшого, лінійний або розгалужений вуглеводневий радикал з визначеним числом атомів вуглецю (тобто, С1-4 позначає число атомів вуглецю від одного до чотирьох). Приклади алкільних груп включають метил, етил, н-пропіл, ізопропіл, н-бутил, трет-бутил, ізобутил і вторбутил. Термін «алкокси» використовується в його звичайному значенні та відноситься до алкільних груп, які приєднують до іншої частини молекули через атом кисню. Приклади алкоксигруп включають метокси, етокси, ізопропокси та подібні групи. Терміни «гало» і «галоген», як такі, або як частини інших замісників, позначають, якщо не зазначене інше, атоми фтору, хлору, брому або йоду. Також, терміни, такі як «галогеналкіл», мають значення, що включають моноалкіл і полігалогеналкіл. Наприклад, термін «С 1-4галогеналкіл» покликаний позначати трифторметил, 2,2,2-трифторетил, 4-хлорбутил, 3бромпропіл, тощо. Термін «захисна група» відноситься до групи, за винятком алкільних груп, яка, коли вона приєднана до реакційноздатної групи в рамках молекули, зменшує або пригнічує її реакційну здатність. Приклади захисних груп можна знайти у виданнях T.W. Greene and P.G.M. Wuts, rd Protective Groups in Organic Synthesis, 3 edition. John Wiley & Sons, New York, 1999, і Harrison and Harrison et al., Compendium of Synthetic Organic Methods, Vols. 1-8 (John Wiley and Sons, 1971-1996), включених до даного опису як посилання. Характерні гідроксизахисні групи включають ацильні групи, бензилову та третилову групи, які утворюють прості ефіри, тетрагідрофуратильну групу, яка утворює прості ефіри, триалкілсилільні та алільні групи, які утворюють прості ефіри. Характерні амінозахисні групи включають формільну, ацетильну, трифторацетильну, бензильну, бензилоксикарбонільну (CBZ), трет-бутоксикарбонільну (ВОС), триметилсилільну (TMS), 2-триметилсилілетансульфонільну (SES), тритильну та заміщену тритильну групи, алілоксикарбоніл, 9-флуоренілметилокси-карбоніл (FMOC), нітровератрилоксикарбоніл (NVOC), тощо. Термін «реагент амінокислотного сполучення» відноситься до реагенту, такого як HBTU (гексафторфосфат О-(бензотриазол-1-іл)-N,N,N',N'-тетраметилуронію) тощо, який буде взаємодіяти з карбоксильною групою амінокислоти з утворенням активованої проміжної 2 UA 99619 C2 5 10 15 20 25 30 35 4045 50 55 60 сполуки, яку можна використати для конденсації із широким рядом нуклеофілів, наприклад, амінами, спиртами та тіолами, для одержання ефірних, тіоефірних або амідних груп. Термін «фармацевтично прийнятні солі» покликаний охоплювати солі активних сполук, які одержують із відносно нетоксичними кислотами або основами, залежно від конкретних замісників, які перебувають у сполуках, описаних у даному описі. Коли сполуки запропоновані даним винаходом містять відносно кислотні функціональні групи, можна одержати солі приєднання основ за допомогою приведення в контакт нейтральної форми таких сполук з достатньою кількістю потрібної основи або в чистому вигляді або в придатному інертному розчиннику. Приклади солей, утворених з фармацевтично прийнятними неорганічними основами, включають солі алюмінію, амонію, кальцію, міді, заліза трьох- і двовалентного, літію, магнію, марганцю, калію, натрію, цинку, тощо. Солі, утворені з фармацевтично прийнятними органічними основами, включають солі первинних, вторинних і третинних амінів, у тому числі, заміщених амінів, циклічних амінів, амінів, які зустрічаються в природі, тощо, таких як аргінін, бетаїн, кофеїн, холін, N,N'-дибензилетилендіамін, діетиламін, 2-диетиламіноетанол, 2диметиламіноетанол, етаноламін, етилендиамін, N-етилморфолін, N-етилпіперидін, глюкамін, глюкозамін, гістидін, гідрабамін, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперадин, поліаміни, прокаін, пурини, теобромін, триетиламін, триметиламін, трипропіламін, трометамін, тощо. Коли сполуки запропоновані даним винаходом містять відносно основні функціональні групи, можна одержати солі приєднання кислот за допомогою приведення в контакт нейтральної форми таких сполук з достатньою кількістю потрібної кислоти або в чистому вигляді або в придатному інертному розчиннику. Приклади фармацевтично прийнятних солей приєднання кислот включають солі, утворені з неорганічними кислотами, такими як хлорводнева, бромводнева, азотна, вугільна, моногідрокарбонова, фосфорна, моногідрофосфорна, дигідрофосфорна, сірчана, моногідросірчана, йодоводнева або фосфориста кислоти та ін., а також солі, утворені з відносно нетоксичними органічними кислотами, такими як оцтова, пропіонова, ізоолійна, малонова, бензойна, бурштинова, суберова, фумарова, мигдальна, фталева, бензолсульфонова, п-толуолсульфонова, лимонна, винна, метансульфонова кислоти, тощо. Також включаються солі амінокислот, такі як аргінат та ін., і солі органічних кислот, подібних до глюкуронової або галактуронової кислот, тощо (див., наприклад, Berge S.M. et al., «Pharmaceutical Salts», Journal of Pharmaceutical Science, 1977, 66, 1-19). Деякі специфічні сполуки запропоновані даним винаходом містять як основні, так і кислотні функціональні групи, що дозволяє перетворювати сполуки на солі приєднання або основ або кислот. Нейтральні форми сполук можна регенерувати приведенням у контакт солі з основою або кислотою та добуванням вихідної сполуки звичайним способом. Вихідна форма сполуки відрізняється від різних сольових форм за деякими фізичними властивостями, такими як розчинність у полярних розчинниках, але в інших відношеннях для мети даного винаходу солі еквівалентні вихідній формі сполуки. Крім сольових форм даний винахід відноситься до сполук, які перебувають у формі проліків. Проліки сполук, описаних у даному описі, є сполуками, з якими легко відбуваються хімічні зміни у фізіологічних умовах з утворенням сполук запропонованих даним винаходом. Крім того, проліки можна перетворити на сполуки запропоновані даним винаходом хімічними або біохімічними способами в середовищі ex vivo. Наприклад, проліки можуть поступово перетворюватися на сполуки запропоновані даним винаходом, коли вони поміщені в резервуар трансдермального петчу з придатним ферментом або хімічним реагентом. Деякі сполуки запропоновані даним винаходом можуть існувати в несольватованих формах, а також у сольватованих формах, включаючи гідратовані форми. Як правило, сольватовані форми еквівалентні несольватованим формам і, як передбачається, охоплюються обсягом даного винаходу. Деякі сполуки запропоновані даним винаходом можуть існувати в декількох кристалічних або аморфних формах. Як правило, всі фізичні форми є еквівалентними для варіантів застосування, розглянутих у даному винаході, і, як передбачається, охоплюються обсягом даного винаходу. Деякі сполуки запропоновані даним винаходом включають асиметричні атоми вуглецю (оптичні центри) або подвійні зв'язки; рацемати, діастереомери, геометричні ізомери, регіоізомери та окремі ізомери (наприклад, окремі енантіомери), як передбачається, усі охоплюються обсягом даного винаходу. Сполуки запропоновані даним винаходом також можуть містити неприродні пропорції атомних ізотопів одного або декількох атомів, які складають такі сполуки. Наприклад, сполуки можуть бути мічені радіоактивними ізотопами, такими як, 3 125 14 наприклад, тритій ( Н), йод-125 ( I) або вуглець-14 ( С). Передбачається, що всі ізотопні варіації сполук запропонованих даним винаходом, чи є вони радіоактивними чи ні, охоплюються 3 UA 99619 C2 5 обсягом даного винаходу. II. Загальні положення Даний винахід заснований на відкритті того, що сполуки формули I діють як сильні антагоністи рецептора CCR1. Сполуки мають протизапальну активність in vivo і мають чудові фармакокінетичні властивості. Відповідно, сполуки, описані в даному описі, можуть бути застосовані у фармацевтичних композиціях, способах лікування захворювань, в яких задіяно CCR1, і як контроль в аналізах для ідентифікації конкурентних антагоністів CCR1. III. Сполуки В одному аспекті даний винахід відноситься до сполуки формули I 10 R2a N O R2c N N N N R3 N (R1)m R2d (R4)n N (I) 1 15 20 25 або її фармацевтично прийнятної солі, гідрату або N-оксиду. У формулі I R є С1-4-алкілом 2a 2с 2d або С1-4-галогеналкілом, і m дорівнює цілому числу від 0 до 1. У формулі I R , R і R є замісниками, обраними, кожний незалежно, із групи, яка складається з водню, галогену, С 1-43 алкокси, С1-4-алкілу, -О-С1-4-галогеналкілу та С1-4-галогеналкілу; R є замісником, обраним із 4 групи, яка складається з водню та С1-4-алкілу; і R є С1-4-алкілом, і n дорівнює цілому числу від 0 3 3 до 2. В одному втіленні R є воднем. В іншому втіленні R є воднем, і n дорівнює 0. В іншому 1 втіленні R у формулі I є метилом, трифторметилом або етилом, і m дорівнює 1. В іншому 2a 2с 2d втіленні m дорівнює 0. У ще одному втіленні R , R і R обрані, кожний незалежно, із групи, яка складається із фтору, хлору, брому, йоду, метокси, етокси, трифторметокси, метилу, етилу, 2a 2с 2d трифторметилу та 2-фторетокси. У ще одному втіленні R є воднем, і R і R обрані, кожний незалежно, із групи, яка складається із фтору, хлору, брому, йоду, метокси, етокси, трифторметокси, метилу, етилу, трифторметилу та 2-фторетокси. В одному кращому втіленні сполуки запропоновані винаходом мають формули Ia або Ib R2a R2c N N N N R2d R2a N O N O N H R2c N N N N CH3 N H R2d N N 30 35 Ia Ib. 2a 2с В одному втіленні R і R у формулі Ia або Ib обрані, кожний незалежно, із групи, яка 2d складається із фтору, хлору, брому і йоду; і R обраний із групи, яка складається з метокси, етокси, трифторметокси, метилу, етилу, трифторметилу та 2-фторетокси. У конкретному втіленні сполуки формули Ia або Ib вибирають із групи, яка складається з 4 UA 99619 C2 F MeO N O N Cl N N N MeO N F , N EtO N O N H N N , N N O Cl N H N N N Cl Me F N O N H N N O F N H N N F and N N N Cl . N аnd - і В іншому кращому втіленні сполуки запропоновані винаходом мають формули Iс або Id 5 N O R2c N N N N R2d R2c N N N N CH3 N H R2d N 10 N O N H N ; Ic Id. 2с У формулах Iс і Id у деяких втіленнях R вибирають із групи, яка складається із фтору, 2d хлору, брому і йоду; і R вибирають із групи, яка складається з метокси, етокси, трифторметокси, метилу, етилу, трифторметилу та 2-фторетокси. У конкретному втіленні сполуки формули Iс або Id вибирають із групи, яка складається з 5 UA 99619 C2 MeO N O N Cl N EtO N N O N H N N Cl N H N N N N Me , , N F EtO N O N Cl O N N O N H N N N H N N N Cl N N Me , , N F O N O N Cl N MeO N Cl Me N N H N Me , , N N O N N N N Cl N O N H N F3CO N H N N N N O Cl N N N N N N H and та N F3C N O N Cl N N H N N N У ще одному втіленні винаходу сполука формули Id має наступну структуру: 5 MeO N O Cl N N N N N N H . У ще одному втіленні сполуки запропоновані винаходом формули I вибирають із групи, яка складається зі сполук, зазначених у таблиці 1. 10 6 UA 99619 C2 Таблиця 1 1. 2. 3. 4. 5. 6. 7. 8. 9. 10 . 11 . 12 . 13 . 14 . 15 . 16 . 17 . 18 . 5 10 1-[4-(4-Хлор-3-метоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4b]піридин-1-іл]етанон 1-[4-(4-Хлор-3-етоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4b]піридин-1-іл]етанон 1-{4-[4-хлор-3-(2-фторетокси)феніл]піперазин-1-іл}-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон 1-[4-(4-Хлор-3-метоксифеніл)-2-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон 1-[4-(4-Хлор-3-метоксифеніл)-3-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон 1-[4-(4-Хлор-3-трифторметилфеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон 1-[4-(4-Хлор-3-метоксифеніл)піперазин-1-іл]-2-[3-(1-метил-1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл] етанон 1-[4-(4-Хлор-2-фтор-5-метоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон 1-{4-[4-хлор-3-(2-фторетокси)феніл]-2-метилпіперазин-1-іл}-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл] етанон 1-[4-(4-Хлор-3-метоксифеніл)-2-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон 1-[4-(4-Хлор-5-етокси-2-фторфеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон 1-[4-(4-Хлор-3-трифторметоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон 1-[4-(4-Хлор-2-фтор-5-метоксифеніл)-2-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл] етанон 1-[4-(4-Хлор-3-етоксифеніл)-2-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон 1-{4-[4-хлор-2-фтор-5-(2-фторетокси)феніл]піперазин-1-іл}-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл] етанон 1-[4-(4-Хлор-3-метоксифеніл)-3-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон 1-[4-(4-Хлор-3-метилфеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4b]піридин-1-іл]етанон 1-[4-(4-Хлор-2-фтор-5-метоксифеніл)-2-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл] етанон Одержання сполук Наведені нижче схеми показують деякі шляхи синтезу, якими можна йти для одержання деяких сполук запропонованих даним винаходом. Інші шляхи або модифікації шляхів, представлених нижче, можуть бути легко помітні для фахівців і охоплюються обсягом винаходу. Схема 1 ілюструє синтез 3-імідазолілзаміщених піразоло[3,4-b]піридинів. R’ є замісником, який не заважає, таким як, наприклад, захисна група, або карбоксиефірна група. Як видно на схемі 1, взаємодія NH2OH з 3-ціанопіразоло[3,4-b]піридином i буде давати результаті гідроксиламідин ii. Відновлення ii з використанням газу водню та каталізатора (наприклад, Pd/C або Pd(OH)2), буде давати амідин iii. Циклізація iii шляхом обробки хлорацетальдегідом буде давати імідазол iv. 7 UA 99619 C2 Схема 1 NH2OH N N R' N i H N HN CN HN OH N N N ii R' N iii O Cl N H NH2 H2, Ac2O, catalyst N N R' NH N N N iv R' 5 10 сatalyst – каталізатор Схема 2 ілюструє синтез 3-імідазолілзаміщених піразоло[3,4-b]піридинів. R’ є замісником, який не заважає, таким як, наприклад, захисна група, або карбоксиефірна група. На схемі 2 взаємодія 3-ціанопіразоло[3,4-b]піридину з етилендиаміном дає циклізований продукт імідазолін v, який після окислення буде утворювати імідазол vi. Схема 2 CN N H2N N NH2 R' N N R' N N N R' N Using reagents such as: KMnO4; or MnO2; or Swern; or Dess-Martin; or PhI(OAc)2; or DMSO; or Pd/C N i oxidation N H v N N H N vi 15 20 25 1 - окислювання 2 – З використанням таких реагентів, як KМnО4; або MnО2; або реагентів окислювання за Сверном; або реагенту окислювання Дес-Мартіна; або PhI(OAc)2; або ДМСО; або Pd/C Схема 3 ілюструє синтез 3-імідазолілзаміщених піразоло[3,4-b]піридинів. R’ є замісником, який не заважає, таким як, наприклад, захисна група, або карбоксиефірна група, або залишок сполуки формули I (див. також приклад 18). Як видно на схемі 3, з використанням процесу переметалювання 3-йодпіразоло[3,4-b]піридин vii можна перетворити на 3-формілпіразоло[3,4b]піридин viii, який після обробки гліоксалем циклізується з утворенням 3-імідазолілпіразоло[3,4b]піридину ix. Схема 3 I N N N vii R' 1) base 2) i-PrMgCl 3) DMF or 1-formylpiperidine O N H N N N viii R' 8 glyoxal or equivalent, NH4OAc N N N ix R' NH UA 99619 C2 5 10 1) основа 2) ізо-PrMgCl 3) ДМФА або 1-формілпіперидин 4) гліоксаль або еквівалентна сполука Процедура амінокислотного сполучення, яку можна використати для одержання сполук запропонованих винаходом, ілюструється схемою 4. На схемі 4 R і R” є замісниками, які не заважають. Сполуки запропоновані винаходом можна одержати, наприклад, сполученням карбокси- похідного 3-імідазолілпіразоло[3,4-b]піридину x з похідним піперазину xi з використанням будь-якого реагенту амінокислотного сполучення (наприклад, HBTU, HATU, pyBOP, тощо) з утворенням 3-імідазолілпіразоло[3,4-b]піридину (xii) за даним винаходом. Схема 4 N NR N N N NH HN N R" Amino acid coupling reagent N N N N O N N R" O OH x xii xi 15 20 25 30 35 40 45 50 1 - Реагент амінокислотного сполучення III. Фармацевтичні композиції Крім сполук, описаних вище, композиції для модуляції активності CCR1, CCR2 і CCR3 у людей і тварин типово будуть містити фармацевтичний носій або розріджувач. Передбачається, що термін «композиція», який використовується у даному описі, позначає продукт, який включає специфічні інгредієнти в певних кількостях, а також будь-який продукт, який є результатом, прямо або побічно, сполучення специфічних інгредієнтів у певних кількостях. Термін «фармацевтично прийнятний» означає, що носій, розріджувач або ексципієнти повинні бути сумісними з іншими інгредієнтами сполуки та не завдавати шкоди їхньому реципієнтові. Фармацевтичні композиції для введення сполук запропонованих даним винаходом звичайно можуть перебувати в стандартній лікарській формі та можуть бути отримані будь-яким зі способів, добре відомих в галузі фармації та доставки лікарських засобів. Всі способи включають стадію приведення активного інгредієнта в асоціацію з носієм, який складається з одного або декількох допоміжних інгредієнтів. Як правило, фармацевтичні композиції одержують за допомогою рівномірного та ретельного введення активного інгредієнта в суміш із рідким носієм або тонко подрібненим твердим носієм або тим і іншим, і наступним, за необхідності, наданням продукту форми бажаного препарату. У фармацевтичну композицію активну цільову сполуку включають у кількості, достатній для отримання бажаного впливу на хворобливий процес або стан. Фармацевтичні композиції, які містять активний інгредієнт, можуть перебувати у формі, яка є придатною для перорального застосування, наприклад, у вигляді пігулок, пастилок, коржів, водних або олійних суспензій, диспергованих порошків або гранул, емульсій і власне емульгованих композицій, описаних у патенті США № 6451339, твердих або м'яких капсул, сиропів, еліксирів, розчинів, букального петчу, перорального гелю, жуйки, жувальних пігулок, шипучого порошку або шипучих пігулок. Композиції, призначені для перорального застосування, можна одержати відповідно до будь-якого способу, відомого в техніці для одержання фармацевтичних композицій, і такі композиції можуть містити один або кілька засобів, обраних із групи, яка складається з підсолоджуючих агентів, коригентів, барвників, антиоксидантів і консервантів, для того, щоб одержати фармацевтично елегантні та приємні препарати. Пігулки містять активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними ексципієнтами, які є придатними для одержання пігулок. Такими ексципієнтами можуть бути, наприклад, інертні розріджувачі, такі як целюлоза, діоксид кремнію, оксид алюмінію, карбонат кальцію, карбонат натрію, глюкоза, маніт, сорбіт, лактоза, фосфат кальцію або фосфат натрію; речовини, які сприяють грануляції та розсипанню, наприклад, кукурудзяний крохмаль або альгінова кислота; зв'язуючі речовини, наприклад, PVP, целюлоза, ПЕГ (PEG), крохмаль, желатин або аравійська камедь, і змащувальні речовини, наприклад, стеарат магнію, 9 UA 99619 C2 5 10 15 20 25 30 35 40 45 50 55 60 стеаринова кислота або тальк. Пігулки можуть бути без покриття, або на них може бути нанесене покриття, ентеросолюбільне або інше, за допомогою чого забезпечується пролонгована дія протягом більш тривалого періоду. Наприклад, можна використати матеріал для відстрочки дії, такий як гліцерилмоностеарат або гліцерилдістеарат. Покриття на пігулки також можна наносити методами, описаними в пат. США №№ 4256108, 4166452 і 4265874, для формування осмотичних терапевтичних пігулок з регульованим вивільненням. Сполуки для перорального застосування також можуть бути представлені у вигляді твердих желатинових капсул, у яких активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або м'яких желатинових капсул, у яких активний інгредієнт змішаний з водою або олійним середовищем, наприклад, арахісовою олією, рідким парафіном або маслиновою олією. Крім того, можна одержати емульсії з інгредієнтом, який не змішується з водою, таким як олії і стабілізовані активними речовинами, такими як моногліцериди, ефіри ПЕГ, тощо. Водні суспензії містять активні матеріали в суміші з ексципієнтами, які придатні для одержання водних суспензій. Такими ексципієнтами є суспендуючі речовини, наприклад, натрійкарбоксиметилцелюлоза, метилцелюлоза, гідроксипропілметилцелюлоза, альгінат натрію, полівінілпіролідон, трагакантова смола та аравійська камедь; диспергуючі або змочуючі речовини можуть бути фосфатидами, такими як ті, що зустрічаються в природі, наприклад, лецитином, або продуктами конденсації алкіленоксиду з жирними кислотами, наприклад, поліоксиетиленстеаратом, або продуктами конденсації етиленоксиду із довголанцюговими аліфатичними спиртами, наприклад, гептадекаетиленоксицетанолом, або продуктами конденсації етиленоксиду з неповними ефірами, утвореними жирними кислотами та гекситом, такими як моноолеат поліоксиетиленсорбітолу, або продуктами конденсації етиленоксиду з неповними ефірами, утвореними жирними кислотами та ангідридами гекситу, наприклад, моноолеатом поліетиленсорбітану. Водні суспензії також можуть містити один або кілька консервантів, наприклад етил- або н-пропіл-п-гідроксибензоат, один або кілька барвників, один або декілька коригентів і одну або декілька підсолоджуючих речовин, таких як сахароза або сахарин. Олійні суспензії можна одержати суспендуванням активного інгредієнта в рослинній олії, наприклад, арахісовій олії, маслиновій олії, сезамовій олії або кокосовій олії, або в мінеральній олії, такій як рідкий парафін. Олійні суспензії можуть містити загущувач, наприклад, бджолиний віск, твердий парафін або цетиловий спирт. Можуть бути додані підсолоджуючі речовини, такі, як зазначені вище, і коригенти для одержання приємного перорального препарату. Такі композиції можуть зберігатися за рахунок додавання антиоксиданту, такого як аскорбінова кислота. Дисперговані порошки та гранули, які є придатними для одержання водної суспензії за допомогою додавання води, представляють активний інгредієнт у суміші з диспергуючою або змочуючою речовиною, суспендуючою речовиною та одним або декількома консервантами. Прикладами придатних диспергуючих або змочуючих речовин і суспендуючих речовин є речовини, уже зазначені вище. Також можуть бути присутніми інші ексципієнти, наприклад, підсолоджуючі речовини, коригенти та барвники. Фармацевтичні композиції запропоновані винаходом також можуть перебувати у формі емульсій олії у воді. Олійна фаза може бути рослиною олією, наприклад, маслиновою олією або арахісовою олією, або мінеральною олією, наприклад, рідким парафіном, або їхньою сумішшю. Придатними емульгаторами можуть бути смоли, такі як ті, що зустрічаються в природі, наприклад, аравійська камедь або трагакантова смола, фосфатиди, такі як ті, що зустрічаються в природі, наприклад, сої, лецитин та ефіри або неповні ефіри, утворені жирними кислотами та ангідридами гекситу, наприклад, моноолеат сорбітану, і продукти конденсації зазначених неповних ефірів з етиленоксидом, наприклад, моноолеат полоксиетиленсорбітану. Емульсії також можуть містити підсолоджуючі речовини та коригенти. Сиропи та еліксири можна одержувати з підсолоджуючими речовинами, наприклад, гліцерином, пропіленгліколем, сорбітом або сахарозою. Такі композиції також можуть містити засоби, які зменшують подразнення, консерванти та коригенти та барвники. Пероральні розчини можна одержати у поєднанні з, наприклад, циклодекстрином, ПЕГ і поверхнево-активними речовинами. Фармацевтичні композиції можуть перебувати у формі стерильної водної або олійної суспензії для ін'єкції. Така суспензія може бути отримана відповідно до відомого рівня техніки з використанням таких придатних диспергуючих або змочуючих речовин і суспендуючих речовин, які зазначені вище. Стерильний препарат для ін'єкції також може бути стерильним розчином або суспензію для ін'єкції в нетоксичному парентерально прийнятному розріджувачі або 10 UA 99619 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчиннику, наприклад, розчин в 1,3-бутандіолі. До числа прийнятних носіїв і розчинників, які можна використати, відносяться вода, розчин Рінгера та ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспензійне середовище звичайно використовують стерильні нелеткі олії. З цією метою можна використовувати будь-яку м'яко діючу нелетку олію, включаючи синтетичні моно- або дигліцериди. Крім того, при одержанні препаратів для ін'єкцій знаходять застосування жирні кислоти, такі як олеїнова кислота. Сполуки запропоновані даним винаходом також можна вводити у формі супозиторіїв для ректального введення лікарського засобу. Такі композиції можна одержати, змішуючи лікарський засіб з придатним ексципієнтом, який не викликає подразнення, та який є твердим за звичайних температур, але рідким за умов ректальної температури, і тому буде плавитися в прямій кишці, вивільняючи лікарський засіб. Такі матеріали включають олію какао та поліетиленгліколі. Крім того, сполуки можна вводити в очі у вигляді розчинів або мазей. Також ще можна здійснювати трансдермальну доставку зазначених сполук за допомогою петчей для іонофорезу та подібних засобів. Для місцевого застосування використовують креми, мазі, гелі, розчини або суспензії, тощо, які містять сполуки запропоновані даним винаходом. Термін «місцеве застосування», який використовується у даному описі також позначає застосування рідин для полоскання рота та горла. Сполуки запропоновані винаходом можна ввести до складу сполук для депонування в медичному пристрої, який може включати різні звичайні трансплантати, стенти, включаючи стент-трансплантати, катетери, балони, сітки, або інші пристрої, які можна розмістити або перманентно імплантувати у порожнину трубчастого органа. Як конкретний приклад, може бути бажаним мати пристрої та способи, які можуть доставляти сполуки запропоновані винаходом до ділянки тіла, яку лікують методом втручання. У прикладі втілення інгібуючий засіб запропонований даним винаходом можна депонувати в медичному пристрої, такому як стент, і доставити в місце лікування для лікування частини організму. Стенти використовують як носії для доставки терапевтичних засобів (тобто, лікарських засобів). Внутрішньосудинні стенти, як правило, перманентно імплантують у коронарні або периферійні судини. Конструкції стентів включають конструкції, описані в пат. США №№ 4733655 (Palmaz), 4800882 (Gianturco) або 4886062 (Wiktor). Такі конструкції включають як металеві, так і полімерні стенти, а також такі, що саморозширюються та стенти-баллони, які здатні розширюватися. Стенти також можна використати для доставки лікарського засобу в місце контакту із мережею судин, як описано, наприклад, у пат. США № 5102417 (Palmaz) і в міжнародних заявках №№ WO 91/12779 (Medtronic, Inc.) і WO 90/13332 (Cedars-Sanai Medical Center), пат. США № 5419760 (Narciso, Jr.) і пат. США № 5429634 (Narciso, Jr.). Стенти також використовують для доставки вірусів до стінки просвіту для генної доставки, як розкривається в заявці на патент США, рег. № 5833651 (Donovan et al.). Термін «депонування» означає, що інгібітор (інгібуючий агент) покритий, абсорбований, розміщений або іншим способом впроваджений у пристрій способами, відомими з рівня техніки. Наприклад, інгібітор може бути вбудований і вивільняється із («матричний тип») або оточений і вивільняється через («резервуарний тип») полімерні матеріали, які покривають або включають медичний пристрій. В останньому прикладі інгібітор може бути захоплений полімерними матеріалами або приєднаний до полімерних матеріалів з використанням одного або декількох методів генерації таких матеріалів, відомих з рівня техніки. В інших сполуках інгібітор може бути зв'язаний з поверхнею медичного пристрою без необхідності наносити покриття зв'язками, які можна розірвати, і вивільняється згодом, може бути вилучений активними механічними або хімічними процесами або перебувати в перманентно іммобілізованій формі, для доставки інгібітору в місце імплантації. В одному втіленні інгібітор може бути внесено з полімерними композиціями під час утворення біосумісних покриттів для медичних пристроїв, таких як стенти. Покриття, отримані з таких компонентів, типово однорідні та можуть бути застосованими для нанесення на ряд пристроїв, створених для імплантації. Полімер може бути або біологічно стійким або полімером, здатним біологічно поглинатися, залежно від потрібної швидкості вивільнення або потрібного ступеня стійкості полімеру, але для такого втілення кращим є полімер, здатний біологічно поглинатися, тому що, на відміну від біологічно стійкого полімеру, він не буде присутній тривалий час після імплантації та викликати яку-небудь шкідливу хронічну локальну реакцію. Полімери, здатні біологічно поглинатися, які можна використовувати, включають, але не обмежуються перерахованим, полі-L-молочну кислоту, полікапролактон, полігліколід (PGA), співполімер лактиду та гліколіду (PLLA/PGA), полігідроксибутират, співполімер гідроксибутирату та валерату, полідиоксанон (PDS), складний 11 UA 99619 C2 5 10 15 20 25 30 35 40 45 50 55 60 поліортоефір, поліангідрид, полігліколеву кислоту, полі-D-молочну кислоту, полі-D,L-молочну кислоту, полі(D,L-лактид) (PLA), полі-L-лактид (PLLA), співполімер гліколевої кислоти та триметиленкарбонату (PGA/PTMC), поліетиленоксид (РЕО), складний поліфосфоефір, поліфосфоефіруретан, поліамінокислоти, ціаноакрилати, політриметиленкарбонат, поліімінокарбонат, співполімери простих і складних ефірів (наприклад, РЕО/PLA), полалкіленоксалати, поліфосфазени та біомолекули, такі як фібрин, фібриноген, целюлоза, крохмаль, колаген і гіалуронова кислота, поліепсилонкапролактон, поліоксиолійна кислота, поліацетали, полідигідропірани, поліціаноакрилати, зшиті або амфіпатичні блокспівполімери гідрогелів та інші придатні полімери, здатні біологічно поглинатися, відомі з рівня техніки. Також можна використовувати біологічно стійкі полімери з відносно слабкою хронічною реакцією тканин, такі як поліуретани, силікони та складні поліефіри, а також можна використовувати інші полімери, якщо вони можуть розчинятися та затвердівати або полімеризуватися на медичному пристрої, такі як поліолефіни, поліізобутилен і співполімери етилену та альфа-олефінів; акрилові полімери та співполімери, полімери та співполімери вінілгалогенідів, такі як полівінілхлорид; полівінілпіролідон; прості полівінілові ефіри, такі як полівінілметиловий ефір; полівініліденгалогеніди, такі як полівініліденфторид і полівініліденхлорид; поліакрилонітрил, полівінілкетони; полімери вінілароматичних сполук, такі як полістирол, складні полівінілові ефіри, такі як полівінілацетат; співполімери вінілових мономерів один з одним і олефінами, такі як співполімери етилену та метилметакрилату, співполімери акрилонітрилу та стиролу, смоли ABS і співполімери етилену та вінілацетату; співполімери пірану; полігідроксипропілметакриламідфенол; полігідроксиетиласпартамідфенол; поліетиленоксид-полілізин, заміщений пальмітоіловими залишками; поліаміди, такі як найлон-66 і полікапролактам; алкідні смоли, полікарбонати; поліоксиметилени; полііміди; прості поліефіри; епоксидні смоли, поліуретани; гідратцелюлозне волокно; триацетат гідратцелюлози; целюлоза, ацетат целюлози, бутират целюлози; ацетатбутират целюлози; целофан; нітрат целюлози; пропіонат целюлози; прості ефіри целюлози та карбоксиметилцелюлоза. Полімери та напівпроникні полімерні матриці можна формувати у вироби, які мають форму, таку як клапани, стенти, трубки, протези, тощо. В одному втіленні винаходу інгібітор запропонований винаходом приєднують до полімеру або напівпроникної полімерної матриці, які формують у вигляді стента або стентатрансплантата. Зазвичай полімери наносять на поверхню імплантованого пристрою центрифугуванням, зануренням або розпиленням. З цією метою також можна використовувати інші способи, відомі з рівня техніки. Методи розпилення включають традиційні способи, а також методи мікроосадження за допомогою розподільника інжекторного типу. Крім того, полімер можна осадити на імплантований пристрій використовуючи фотошаблони для розміщення полімеру тільки на певних частинах пристрою. Таке покриття пристрою дає рівномірний шар на пристрої, що дає можливість поліпшеної дифузії різних досліджуваних речовин через покриття на пристрої. У кращих втіленнях винаходу інгібітор уводять до складу для вивільнення з полімерного покриття в навколишнє середовище, у якому розміщено медичний пристрій. Бажано інгібітор вивільняється регульованим способом протягом тривалого часу (наприклад, місяців) з використанням, щонайменше, одного з декількох добре відомих методів, які включають полімерні носії або шари для регульованої елюції. Деякі з таких методів описані раніше в заявці на патент США 20040243225А1. Більше того, як описано, наприклад, у патенті США № 6770729, реагентами та умовами взаємодії полімерних композицій можна маніпулювати таким чином, що можна регулювати вивільнення інгібітору з полімерного покриття. Наприклад, можна модулювати коефіцієнт дифузії одного або декількох полімерних покриттів для регулювання вивільнення інгібітору з полімерного покриття. У варіанті даного положення коефіцієнт дифузії одного або декількох полімерних покриттів можна регулювати для модуляції здатності досліджуваної речовини, яка присутня у навколишньому середовищі, у якому розміщено медичний пристрій (наприклад, досліджуваної речовини, яка полегшує розпад або гідроліз деякої частини полімеру), мати доступ до одного або декількох компонентів у полімерній композиції (і, наприклад, шляхом цього модулювати вивільнення інгібітору з полімерного покриття). Ще одне втілення винаходу включає пристрій з декількома полімерними покриттями, причому кожне має кілька коефіцієнтів дифузії. У таких втіленнях винаходу вивільнення інгібітору з полімерного покриття можна модулювати за рахунок декількох полімерних покриттів. У ще одному втіленні винаходу вивільнення інгібітору з полімерного покриття регулюють шляхом модуляції одного або декількох властивостей полімерної композиції, таких як 12 UA 99619 C2 5 10 15 20 25 30 35 40 45 50 55 60 присутність одного або декількох ендогенних або екзогенних сполук, або, з іншого боку, рН полімерної композиції. Наприклад, можна створювати деякі полімерні композиції для вивільнення інгібітору у відповідь на зниження рН полімерної композиції. З іншого боку, можна створювати деякі полімерні композиції для вивільнення інгібітору у відповідь на присутність пероксиду водню. IV. Способи лікування захворювань, модульованих CCR1, CCR2 і/або CCR3 У ще одному аспекті даний винахід відноситься до способів лікування станів або захворювань, в яких задіяні CCR1, CCR2 і/або CCR3, за допомогою введення суб'єктові, який має таке захворювання або стан, терапевтично ефективної кількості сполуки формули I, описаної вище. «Суб'єкт» у даному описі визначається як термін, що включає тварин, таких як ссавці, у тому числі, але без обмеження, примати (наприклад, люди), корови, вівці, кози, коні, собаки, кішки, кролики, пацюки, миші тощо. CCR1 надає мішень для перешкоди промотування специфічних аспектів функцій імуноцитів, або в більш загальному сенсі, функціям, пов'язаним з експресією CCR1 у широкому інтервалі типів клітин у ссавця, такого як людина. Сполуки, які інгібують CCR1, найбільш широко застосовуються в лікувальних цілях для модуляції функції моноцитів, макрофагів, лімфоцитів, гранулоцитів, NK-клітин, гладких клітин, дендритних клітин і деяких імунопохідних клітин (наприклад, остеокластів). Відповідно, даний винахід відноситься до сполук, які можуть бути застосованими при попередженні й/або лікуванні широкого ряду запальних і імунорегуляторних розладів і захворювань (див. Sacki et al., Current Pharmaceutical Design, 9: 1201-1208 (2003)). Наприклад, сполуку запропоновану даним винаходом, яка інгібує одну або кілька функцій CCR1, можна вводити для інгібування (тобто, ослаблення або попередження) запалення або клітинної інфільтрації, пов'язаної з імунним розладом. У результаті може бути інгібовано один або кілька запальних процесів, таких як еміграція або інфільтрація лейкоцитів, хемотаксис, екзоцитоз (наприклад, ферментів, гістаміну) або вивільнення медіаторів запалення. Наприклад, інфільтрацію моноцитів в область запалення (наприклад, уражений суглоб при артриті, або в ЦНС при MS) можна інгібувати відповідно способом запропонованим даним винаходом. Подібним чином, зазначену сполуку, яка промотує одну або кілька функцій CCR1, уводять для стимуляції (викликання або посилення) запальної реакції, такої як еміграція лейкоцитів, хемотаксис, екзоцитоз (наприклад, ферментів, гістаміну) або вивільнення медіаторів запалення. Наприклад, можна викликати приплив моноцитів для боротьби з бактеріальними інфекціями. Захворювання та стани, пов'язані із запаленням, імунними розладами та інфекцією, можна лікувати використовуючи спосіб запропонований даним винаходом. У кращому втіленні захворювання або стан є таким захворюванням або станом, при якому дії імуноцитів, таких як моноцити, макрофаги, лімфоцити, гранулоцити, NK-клітини, гладкі клітини, дендритні клітини та деякі імунопохідні клітини (наприклад, остеокласти), повинні бути інгібовані або промотовані для того, щоб модулювати запальну або аутоімунну реакцію. В одній групі втілень захворювання або стани, у тому числі, хронічні захворювання людей або інших видів можна лікувати модуляторами функції CCR1, CCR2 або CCR3. Такі захворювання або стани включають (1) алергійні захворювання, такі як системна анафілаксія або алергійні реакції, алергія на ліки, алергійні реакції на укуси комах і харчові алергії, (2) запальні захворювання кишківника, такі як хвороба Крона, неспецифічний виразковий коліт, ілеіт і ентерит, (3) вагініт, (4) псоріаз і запальні дерматози, такі як дерматит, екзема, атопічний дерматит, алергійний контактний дерматит, кропивниця та сверблячка, (5) васкуліт, (6) спондилоартропатії, (7) склеродермія, (8) астма та респіраторні алергійні захворювання, такі як астма, алергійна астма, алергійний риніт, алергійні хвороби легенів тощо, (9) аутоімунні захворювання, такі як фіброміалгія, склеродермія, анкілозуючий спондиліт, ювенільний RA, хвороба Стіла, ювенільний поліартрит, ювенільний олігоартрит, ревматоїдна поліміалгія, артрит Такуяси, ревматоїдний артрит, псоріатичний артрит, остеоартрит, поліартрит, розсіяний склероз, системний червоний вовчак, діабет типу I, діабет типу II, діабет типу I (на самому початку), ретробульбарний неврит, гломерулонефрит тощо, (10) відторгнення трансплантата, у тому числі, відторгнення алотрансплантата та гостра та хронічна хвороба «трансплантат проти хазяїна», (11) фіброз (наприклад, фіброз легенів (тобто, ідіопатичний фіброз легенів, інтерстицінальний фіброз легенів), фіброз, пов'язаний з кінцевою стадією хвороби нирок, фіброз, спричинений опроміненням, тубулоінтерстиціальний фіброз, субепітеліальний фіброз, склеродермія (прогресуючий системний склероз), фіброз печінки (у тому числі, фіброз, спричинений алкогольним або вірусним гепатитом), первинний і вторинний цироз), (12) гостре та хронічне запалення легенів (хронічна обструктивна хвороба легенів, хронічна бронхіт, респіраторний дистрес-синдром дорослих, респіраторний дистрес-синдром дітей, імунний комплексний альвеоліт) і (13) інші захворювання, при яких виникає потреба інгібувати небажані 13 UA 99619 C2 5 10 15 20 25 30 35 40 45 50 55 60 запальні реакції або імунні розлади, такі як серцево-судинні захворювання, включаючи атеросклероз, судинні запалення внаслідок пересадження тканин або під час рестенозу (у тому числі, рестеноз після ангіопластики й/або установки стента та інші), інші гострі та хронічні запальні стани, такі як міозит, нейродегенеративні захворювання (наприклад, хвороба Альцгеймера), енцефаліт, менінгіт, гепатит, нефрит, сепсис, саркоідоз, алергійний кон’юнктивіт, отит, синусит, синовіальне запалення, спричинене артроскопією, гіперуремія, травма, ішемічне реперфузійне ушкодження, назальний поліоз, прееклампсія, ротовий плоский лишай, синдром Гійєна-Баре, грануломатозні захворювання, стани, пов'язані із продукцією лептину, синдром Бехчета та подагра, і при застосуваннях для загоєння ран, (14) імуноопосередковані харчові алергії, такі як черевна хвороба. В іншій групі втілень винаходу захворювання або стани можна лікувати модуляторами функції CCR1. Приклади захворювань, які лікують модуляторами функції CCR1, включають онко захворювання (як первинні, так і метастазуючі) (наприклад, множинну мієлому; Hata H., Leukemia & Lymphoma, 2005, 46(7); 967-972), серцево-судинні захворювання, захворювання, при яких відіграють роль ангіогенез або неовасуляризація (неопластичні захворювання, ретинопатія та дегенерація жовтої плями), інфекційні захворювання (вірусні інфекції, наприклад, ВІЛ-інфекція, і бактеріальні інфекції) та імунодепресивні захворювання, такі як стани при пересадженні органів і стани при пересадженні шкіри. Термін «стани при пересадженні органів» означає, що включаються стани при пересадженні кісткового мозку та солідних органів (наприклад, нирки, печінки, легенів, серця, підшлункової залози або їхнього сполучення). Фармацевтичні композиції запропоновані даним винаходом також можуть інгібувати продукцію металопротеіназ і цитокінів у місцях запалення або прямо або побічно (як наслідок зниження клітинної інфільтрації), причому в такий спосіб досягається сприятлива дія при захворюваннях або станах, пов'язаних з такими цитокінами. Сполуки запропоновані даним винаходом відповідно можуть бути застосованими при попередженні та лікуванні самих різних запальних та імунорегуляторних розладів і захворювань. Залежно від захворювання, від якого лікують, і стану суб'єкта, сполуки запропоновані даним винаходом можна вводити пероральним, парентеральним (наприклад, внутрішньом'язовим, інтраперитонеальним, внутрішньовенним, ICV, інтрацистеральною ін'єкцією або інфузією, підшкірною ін'єкцією або імплантату) шляхом, інгаляцією спреєм, назальним, вагінальним, ректальним, сублінгвальним або місцевим шляхом введення та можна уводити до складу, одні або разом, придатних стандартних форм, які містять звичайні нетоксичні фармацевтично прийнятні носії, ад'юванти і середовища, які відповідають кожному способу введення. При лікуванні або попередженні станів, при яких потрібна модуляція, відповідний рівень дозування буде становити, як правило, приблизно 0,001-100 мг на кг маси тіла пацієнта на добу, які можна вводити в одноразовій дозі або декількох дозах. Бажано, рівень дозування буде становити від приблизно 0,01 до приблизно 25 мг/кг на добу, краще, від приблизно 0,05 до приблизно 10 мг/кг на добу. Придатний рівень дозування може становити приблизно 0,01-25 мг/кг на добу, приблизно 0,05-10 мг/кг на добу або приблизно 0,1-5 мг/кг на добу. У межах зазначеного інтервалу дозування може становити 0,005-0,05, 0,05-0,5 або 0,5-5 мг/кг на добу. Для перорального введення композиції бажано надають у формі пігулок, які містять 1,0-1000 міліграм активного інгредієнта, зокрема, 1,0, 5,0, 10,0, 15,0, 20,0, 25,0, 50,0, 75,0, 100,0, 150,0, 200,0, 250,0, 300,0, 400, 500,0, 600,0, 750,0, 800,0, 900,0 і 1000,0 міліграм активного інгредієнта для симптоматичного коректування дозування для пацієнта, якого лікують. Сполуки можна вводити за схемою прийому 1-4 рази на добу, бажано, один або два рази на добу. Однак варто уявляти, що конкретний рівень дози та частота дозування для будь-якого окремого пацієнта може змінюватися та буде залежати від ряду факторів, включаючи активність конкретного використаної сполуки, метаболічну стійкість і тривалість дії зазначеної сполуки, вік, масу тіла, спадкові властивості, загальний стан здоров'я, стать та харчування суб'єкта, а також спосіб і час введення, швидкість екскреції, поєднання лікарських засобів і важкість протікання певного стану суб'єкта, лікування якого проводять. Захворювання та стани, пов'язані із запаленням, імунним розладом, інфекцією та раком, можна лікувати або попереджувати за допомогою сполук, композицій і способів запропонованих даним винаходом. Сполуки та композиції запропоновані даним винаходом можна поєднувати з іншими сполуками та композиціями, близькими щодо застосування для попередження та лікування стану або захворювання, які представляють інтерес, такого як запальні або аутоімунні розлади, стани та захворювання, включаючи запальну хворобу кишківника, ревматоїдний артрит, остеоартрит, псоріатичний артрит, поліартрит, розсіяний склероз, алергійні захворювання, 14 UA 99619 C2 5 10 15 20 25 30 35 40 45 50 55 60 псоріаз, атопічний дерматит і астму та патології, зазначені вище. Наприклад, при лікуванні або попередженні запалення або аутоімунної реакції або, наприклад, артриту, пов'язаного із втратою кісткової маси, сполуки та композиції запропоновані даним винаходом можна використовувати в поєднанні із протизапальним або анальгезуючим засобом, таким як опіатний агоніст, інгібітор ліпоксигенази, такий як інгібітор 5-ліпоксигенази, інгібітор циклооксигенази, такий як інгібітор циклооксигенази-2, інгібітор інтерлейкіну, такий як інгібітор інтерлейкіну-1, антагоніст NMDA, інгібітор оксиду азоту або інгібітор синтезу оксиду азоту, нестероїдний протизапальний засіб або цитокінпригнічуючий протизапальний засіб, наприклад, з такою сполукою, як ацетамінофен, аспірин, кодеїн, фентаніл, ібупрофен, індометацин, кеторолак, морфін, напроксен, фенацетин, піроксикам, стероїдний анальгетик, суфентаніл, сунліндак, тенідап та подібні засоби. Подібним чином, сполуки та композиції запропоновані даним винаходом можна вводити з анальгетиками, зазначеними вище; потенціюючим засобом, таким як кофеїн, антагоністом Н2 (наприклад, ранітидином), симетиконом, гідроксидом алюмінії або магнію; засобом проти набряків, таким як фенілефрін, фенілпропаноламін, псевдоефедрин, оксиметазолін, ефінерфрин, нафазолін, ксилометазолін, пропілекседрин або леводезоксиефедрин; засобом проти кашлю, таким як кодеїн, гідрокодон, караміфен, карбетапентан або декстрометорфан; діуретиком і седативним або неседативним антигістамінним засобом. Подібним чином, сполуки та композиції запропоновані даним винаходом можна використовувати в поєднанні з іншими лікарськими засобами, які використовують при лікуванні, попередженні, пригніченні або ослабленні симптомів захворювання або станів, при яких можуть бути застосованими сполуки та композиції запропоновані даним винаходом. Такі інші лікарські засоби можна вводити способом і в кількості, які звичайно використовуються для них, одночасно або послідовно зі сполукою та композицією запропонованою даним винаходом. Коли сполуку або композицію запропоновану даним винаходом використовують одночасно з одним або декількома іншими лікарськими засобами, кращою є фармацевтична композиція, яка містить такі інші лікарські засоби на додачу до сполуки або композиції запропонованої даним винаходом. Відповідно, фармацевтичні композиції запропоновані даним винаходом включають композиції, які також містять один або кілька інших активних інгредієнтів або терапевтичних засобів крім сполуки або композиції запропонованої даним винаходом. Приклади інших терапевтичних засобів, які можна поєднати зі сполукою або композицією за даним винаходом або вводити окремо або в тих самих фармацевтичних композиціях, включають, але не обмежуються перерахованим, (а) антагоністи VLA-4, (b) кортикостероїди, такі як беклометазон, метилпреднізолон, бетаметазон, преднізон, преднізолон, дексаметазон, флутиказон, гідрокортизон, будезонід, триамцінолон, сальметерол, сальбутанол, форметерол; (с) імунодепресанти, такі як циклоспорин (циклоспорин А, сандиммун®, неорал®), такролірнус (FK506, програф®), рапаміцин (сиролімус, рапамін®) та інші імунодепресанти типу FK-506, і мікофенолат, наприклад, мікофенолат мофетил (CellCept®); (d) антигістамінні засоби (антагоністи Н1-гістаміну), такі як бромфенірамін, хлорфенірамін, дексхлорфенірамін, трипролідин, клемастин, дифенгідрамін, дифенілпіралін, трипеленамін, гідроксизин, метдилазин, прометазин, тримепразин, азатадин, ципрогептадин, антазолін, фенірамін, піриламін, астемізол, терфенадин, лоратадин, цетирізин, фексофенадин, дескарбоетоксилоратадин та подібні засоби; (е) нестероїдні протиастматичні засоби (наприклад, тербуталін, метапротеренол, фенотерол, ізоетарин, альбутерол, бітолтерол і пірбутерол), теофілін, кромоліннатрій, атропін, бромід іпратропію, антагоністи лейкотрієну (наприклад, зафмлукаст, монтелукаст, пранлукаст, іралукаст, побілукаст і SKB-106203), інгібітори біосинтезу лейкотрієну (зілейтон, BAY-1005); (f) нестероїдні протизапальні засоби (NSAID), такі як похідні пропіонової кислоти (наприклад, альмінопрофен, беноксапрофен, буклоксова кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флубіпрофен, ібупрофен, індопрофен, кетопрофен, рніропрофен, напроксен, оксапрозин, пірпрофен, пранопрофен, супрофен, тіапрофенова кислота та тіоксапрофен), похідні оцтової кислоти (наприклад, індометацин, ацеметацин, альклофенак, кліданак, диклофенак, фенклофенак, фенклозова кислота, фентіазак, фурофенак, ізоксепак, окспінак, суліндак, тіопінак, толметин, зидометацин і зомепірак), похідні фенамінової кислоти (наприклад, флуфенамінова кислота, меклофенамінова кислота, мелфенамінова кислота, ніфлумова кислота та толфенамінова кислота), похідні дифенілкарбонової кислоти (наприклад, дифлунізал і флуфінезал), оксиками (наприклад, ізоксикам, піроксикам, судоксикам і теноксикам), саліцилати (наприклад, ацетилсаліцилова кислота та сульфазалазин) та піразолони (наприклад, апазон, безпіперилон, фепразон, мофебутазон, оксифенбутазон і фенілбутазон); (g) інгібітори циклооксигенази-2 (СОХ-2), такі як целекоксиб (целебрекс®) і рофекоксиб (Vioxx®); (h) інгібітори фосфодіестерази 15 UA 99619 C2 5 10 15 20 25 30 35 40 45 50 55 60 типу IV (PDE IV); (i) сполуки золота, такі як ауранафін і ауротіоглюкоза, (j) етанерцепт (енбрел®), (k) терапевтичні антитіла, такі як ортоклон (ОКТ3), даклізумаб (зенапакс®), базиліксимаб (симулект®) і інфліксимаб (ремикад®), (l) інші антагоністи хемокінових рецепторів, особливо, CCR5, CXCR2, CXCR3, CCR2, CCR3, CCR4, CCR7, CX3CR1 і CXCR6; (m) змазувальні або пом'якшувальні речовини, такі як петролатум і ланолін, (n) кератолітичні засоби (наприклад, тазаротен), (о) похідні вітаміну D3, наприклад, кальципотреїн або кальципотріол (довонекс®), (р) PUVA, (q) антралін (дритрокрем®), (r) етретінат (тегізон®) і ізотретіноін, (s) терапевтичні засоби проти розсіяного склерозу, такі як інтерферон β-1β (бетазерон®), інтерферон β-1α (авонекс®), азатіопринк (імурек®, імуран®), глатирамерацетат (капоксон®), глюкокортикоїд (наприклад, преднізолон) і циклофосфамід, (t) DMARDS, такі як метотрексат, (u) інші сполуки, такі як 5-аміносаліцилова кислота та її проліки; гідроксихлороквін; D-пеніциламін; антиметаболіти, такі як азатіоприн, 6-меркатопурин і метотрексат; інгібітори синтезу ДНК, такі як гідроксисечовина, і засоби, які руйнують мікротрубочки, такі як колхіцин. Масове відношення сполуки запропонованої даним винаходом до іншого активного інгредієнта може змінюватися та буде залежати від ефективної дози кожного інгредієнта. Як правило, буде використовуватися ефективна доза кожного. Так, наприклад, коли сполуку запропоновану даним винаходом поєднують із NSAID, масове відношення сполуки запропонованої даним винаходом до NSAID, як правило, буде коливатися від приблизно 1000:1 до приблизно 1:1000, бажано, від приблизно 200:1 до приблизно 1:200. Поєднання сполуки запропонованої даним винаходом та інших активних інгредієнтів, як правило, також будуть перебувати в зазначеному інтервалі, але в кожному випадку варто використовувати ефективну дозу кожного інгредієнта. V. Приклади Наведені далі приклади призначені для пояснення, але не для обмеження заявленого винаходу. Вказані нижче використані реагенти та розчинники можна одержати з комерційних джерел, Н таких як Aldrich Chemical Co. (Milwaukee, Wisconsin, USA). 1 -ЯМР реєструють на ЯМРспектрометрі Varian Mercury, 400 МГц. Значимі піки одержують відносно ТМС і вносять у таблицю в порядку мультиплетності (с – синглет, д – дублет, т – триплет, кв – квартет, м – мультиплет) і число протонів. Результати мас-спектрометрії приводяться у вигляді відношення маси до заряду з наступним відносним вмістом кожного іона (у дужках). У таблицях приводиться одна величина m/e для М+Н (або, як вказано, М-Н) іона, який містить найбільш звичайні атомні ізотопи. Ізотопні картини відповідають передбачуваній формулі у всіх випадках. Масспектрометричний аналіз із іонізацією електронним розпиленням (ESI) проводять на масспектрометрі з електронним розпиленням Hewlett-Packard MSD з використанням НР1100 ВЕРХ, оснащеного колонкою Agilent Zorbax SB-C18, 2,1x50 мм, 5 мкм, для доставки зразка. Звичайно аналізовану речовину розчиняють у метанолі в концентрації 0,1 мг/мл, і 1 мкл уводять із розчинником для доставки в мас-спектрометр, який сканований від 100 до 1500 дальтон. Всі сполуки можна аналізувати при позитивному типі ESI з використанням суміші ацетонітрил/вода з 1% мурашиної кислоти як розчинник для доставки. Сполуки, представлені нижче, також можна аналізувати при негативному типі ESI з використанням 2 мМ розчину NH4OAc у суміші ацетонітрил/вода, як системи для доставки. В прикладах і в описі винаходу використовуються наступні абревіатури: ВЕРХ – високоефективна рідинна хроматографія; ДМФА – диметилформамід; ТФОК – трифтороцтова кислота; ТГФ – тетрагідрофуран; EtOAc – етилацетат; ВОС2О – ди-третбутилдикарбонат або ВОС-ангідрид; DIPEA – диізопропілетиламін; HBTU – гексафторфосфат О-(бензотриазол-1-іл)-N,N,N’,N’-тетраметилуронію; dpff – 1,1’-біс(дифенілфосфіно)фероцен; Pd2(dba)3 – трис(дибензиліденацетон)дипаладій(0); DMP - періодинан Дес-Мартіна; Me - метил; Et - етил; DCM - дихлорметан. Сполуки, які охоплюються даним винаходом можна синтезувати так, як це описано нижче, використовуючи різні реакції, відомі фахівцям у даній галузі техніки. Фахівці в даній галузі техніки легко з'ясують, які альтернативні способи можна використати для синтезу цільових сполук даного винаходу, і що підходи, описані в даному документі, не є вичерпними, але забезпечують широко прийнятні та практичні шляхи до сполук, які представляють інтерес. Деякі молекули, заявлені у даній заявці на патент, можуть існувати в різних енантіомерних і діастереомерних формах, і заявляються всі такі варіанти зазначених сполук. У даному тексті приводиться докладний опис експериментальних процедур, які використовуються для синтезу основних сполук, що приводять до сполук, які описані фізичними показниками, що їх ідентифікують, а також зображеннями структур, які до них відносяться. Фахівцям у даній галузі техніки також відомо, що під час виконання стандартних процедур органічної хімії часто використовують кислоти та основи. Іноді під час експериментальних 16 UA 99619 C2 5 процедур, описаних у даній заявці, одержують солі вихідних сполук, якщо сполуки характеризуються необхідною властивою їм кислотністю або лужністтю. Приклад 1 Синтез 1-[4-(4-хлор-5-етокси-2-фторфеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4b]піридин-1-іл]етанону K2CO3 t-BuO N + N Zn(CN)2 Pd2(dba)3 dppf I I N H DMF, heating N N N N t-BuO2C t-BuO2C ButO O O NH Ac2O, Pd, H2 OH N ButO O O ButO H N N N H N NH2 N N Cl NH N N H N NH2OH N N Cl O CN N N EtO N NH Cl O TFA N HO N N N 10 15 20 25 30 35 40 N N H F NH . 2HCl HBTU, iPr2NEt, DMF (Protocol A) O N EtO N Cl N N N F 1 - ДМФА, нагрівання 2 - (протокол А), TFA - ТФОК, DMF - ДМФА Стадія 1. Суміш 3-йод-7-азаіндазолу (25,50 г) і К2СО3 (41,4 г) у ДМФА (200 мл) нагрівають до о 85 С, і поступово додають трет-бутилхлорацетат (14,3 мл). Суміш перемішують за вказаної температури протягом 1 години (годину), охолоджують до кімнатної температури, і потім додають воду (300 мл). Фільтрація реакційної суміші дає трет-бутиловий ефір (3йодпіразоло[3,4-b]піридин-1-іл)оцтової кислоти. Стадія 2. В 250-мл колбу завантажують трет-бутиловий ефір (3-йодпіразоло[3,4-b]піридин-1іл)оцтової кислоти (15,0 г), PdCl2(dppf) (3,0 г), Zn(CN)2 (4,96 г), ДМФА (200 мл) і Н2О (14 мл). Колбу, яка містить отриману суспензію, знегазовують і знову заповнюють азотом протягом 5 хвилин, а потім до реакційної суміші додають Pd2(dba)3 (3,85 г). Реакційну суміш гріють в о атмосфері N2 при 90 С протягом 16 годин, охолоджують до кімнатної температури, розбавляють Н2О (800 мл) і фільтрують. Зібрану тверду речовину промивають толуолом (10 мл), і одержують трет-бутиловий ефір (3-ціанопіразоло[3,4-b]піридин-1-іл)оцтової кислоти у вигляді жовтої твердої речовини. стадія 3. Суміш трет-бутилового ефіру (3-ціанопіразоло[3,4-b]піридин-1-іл)оцтової кислоти, гідрохлориду гідроксиламіну (8,28 г) і Et3N (22,6 мл) в EtOH (120 мл) гріють протягом ночі в о атмосфері N2 при 65 С. Отриману суміш охолоджують до кімнатної температури, фільтрують, і зібрану тверду речовину промивають Н2О (100 мл) і Et2O (50 мл × 2), і одержують третбутиловий ефір [3-(N-гідроксикарбамімідоїл)піразоло[3,4-b]піридин-1-іл)оцтової кислоти. Стадія 4. Трет-бутиловий ефір [3-(N-гідроксикарбамімідоїл)піразоло[3,4-b]піридин-1іл)оцтової кислоти (6,17 г) завантажують в 100-мл флакон з АсОН (45 мл) і Ас2О (4,3 мл). Отриману суміш перемішують за кімнатної температури протягом 1 години, і за цей час вихідна суспензія стає прозорим розчином. До отриманого розчину додають Pd/C (10%, 900 мг) і перемішують в атмосфері Н2 з балона, і отриману суміш перемішують протягом ночі за кімнатної температури. Реакційну суміш фільтрують через шар целіту, промитий DCM/MeOH. Випаровування розчинника дає трет-бутиловий ефір (3-амідинопіразоло[3,4-b]піридин-1іл)оцтової кислоти, який використовують без додаткового очищення. стадія 5. Трет-бутиловий ефір (3-амідинопіразоло[3,4-b]піридин-1-іл)оцтової кислоти, отриманий вище, завантажують в 100-мл флакон із хлорацетилальдегідом (5,72 мл), диоксаном о (50 мл) і К2СО3 (12,42 г). Отриману суміш перемішують при 80 С протягом 4 годин, і додають ще хлорацетилальдегід (5,72 мл) і К2СО3 (12,42 г). Суміш перемішують ще протягом 1 години при о о 80 С і перемішують ще при 120 С протягом 1 години, охолоджують до кімнатної температури, розбавляють дихлорметаном (DCM), промивають розсолом, сушать (Na 2SO4), фільтрують і випаровують у вакуумі. Очищення флеш-хроматографією дає трет-бутиловий ефір 2-(3-(1Н 17 UA 99619 C2 5 10 15 20 імідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)оцтової кислоти у вигляді коричневого олії. стадія 6. трет-бутиловий ефір 2-(3-(1Н-імідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)оцтової кислоти (977 мг) розчиняють у трифтороцтовій кислоті (ТФОК) (10 мл) і перемішують за кімнатної температури протягом 1 години. Суміш випаровують у вакуумі, і одержують 2-(3-(1Німідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)оцтову кислоту у вигляді коричневого олії, яку використовують без додаткового очищення. Стадія 7. (Протокол А – процедура сполучення з HBTU). Розчин [3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]оцтової кислоти (0,30 М, 0,40 мл, 0,12 ммоль) переносять у флакон. У флакон додають дигідрохлорид 1-(4-хлор-5-етокси-2-фторфеніл)піперазину (48 мг, 0,14 ммоль), гексафторфосфат О-(бензотриазол-1-іл)-N,N,N’,N’-тетраметилуронію (55 мг, 0,14 ммоль) і з-Pr2NEt (0,30 мл), і суміш перемішують за температури навколишнього середовища. Через 30 хвилин аналіз РХ/МС показує утворення потрібного продукту та повну витрату вихідної карбонової кислоти. Суміш розбавляють EtOAc, промивають водою (1х) і розсолом (1х), сушать над Na2SO4 і випаровують. Залишок очищають хроматографією на силікагелі (1% - 8% МеОН в CH2Cl2), і одержують 1-[4-(4-хлор-5-етокси-2-фторфеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон у вигляді жовтувато-коричневої твердої речовини. 1 H NMR (CDCl3, 400 MHz) δ 8.79 (dd, 0.6 H, J = 8.4, 1.6 Hz), 8.66 (dd, 0.4 H, J = 8.0, 1.6 Hz), 8.57-8.55 (m, 1H), 7.29-7.26 (m, 1H), 7.22-7.16 (m, 1H), 7.09-7.05 (m, 2H), 6.50-6.45 (m, 2H), 5.45 (s, 0.6H), 5.43 (s, 1.4H), 4.07-4.01 (m, 2H), 3.81-3.69 (m, 4H), 3.17-3.13 (m, 1.6H), 3.08-3.02 (m, + 2.4H), 1.50-1.42 (m, 3H); LC/MS m/z (M+H) 484.4. Позначення тут і далі див. у Додатку. Приклад 2 Синтез 1-{4-[4-хлор-2-фтор-5-(2-фторетокси)феніл]піперазин-1-іл}-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанону 25 N NH O 30 35 40 O N N Cl F N N N F Названу в заголовку сполуку одержують, дотримуючись протоколу А. Як компоненти сполучення використовують дигідрохлорид 1-[4-хлор-2-фтор-5-(2-фторетокси)феніл]піперазину та [3-(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]оцтову кислоту. Сирий продукт реакції очищають хроматографією на силікагелі (2% - 3,5% МеОН в CH2Cl2), і одержують 1-{4-[4-хлор-2фтор-5-(2-фторетокси)феніл]піперазин-1-іл}-2-[3-(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1іл]етанон у вигляді жовтувато-коричневої твердої речовини. 1 H NMR (CDCl3, 400 MHz) δ 8.79 (dd, 0.6 H, J = 8.0, 1.8 Hz), 8.67 (d, 0.4 H, J = 6.4 Hz), 8.578.55 (m, 1H), 7.30-7.25 (m, 1H), 7.11-7.06 (m, 2H), 6.63 (d, 0.6H, J = 7.6 Hz), 6.57 (d, 0.4H, J = 7.6 Hz), 6.54 (d, 1H, J = 7.6 Hz), 5.45 (s, 0.7H), 5.43 (s, 1.3H), 4.83-4.80 (m, 1H), 4.71-4.68 (m, 1H), + 4.31-4.18 (m, 2H), 3.82-3.76 (m, 3H), 3.50 (t, 1H, J = 5.2 Hz), 3.23-3.04 (m, 4H); LC/MS m/z (M+H) 502.4. Приклад 3 Синтез 1-[4-(4-хлор-3-етоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4b]піридин-1-іл]етанону N O N H3C O N NH N N N Cl 45 Названу в заголовку сполуку одержують, дотримуючись протоколу А. Як компоненти сполучення використовують дигідрохлорид 1-(4-хлор-3-етоксифеніл)піперазину та [3-(1Німідазол-2-іл)піразоло[3,4-b]піридин-1-іл]оцтову кислоту. Сирий продукт реакції очищають хроматографією на силікагелі (4% - 15% МеОН в CH2Cl2), і одержують 1-[4-(4-хлор-3 18 UA 99619 C2 5 етоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]етанон у вигляді жовтувато-коричневої твердої речовини (25 мг). 1 H NMR (CDCl3, 400 MHz) δ 8.79 (dd, 0.6H), 8.66 (dd, 0.4H), 8.57-8.54 (m, 1H), 7.29-7.19 (m, 4H), 6.49-6.40 (m, 2H), 5.45 (s, 0.7H), 5.43 (s, 1.3 H), 4.10-4.04 (m, 2H), 3.81-3.69 (m, 4H), 3.23-3.16 + (m, 4H), 1.50-1.45 (m, 3H); LC/MS m/z (M+H) 466.4. Приклад 4 Синтез 1-[4-(4-хлор-2-фтор-5-метоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанону N O 15 20 N N Cl 10 O N N N H3C NH F Названу в заголовку сполуку одержують, дотримуючись протоколу А. Як компоненти сполучення використовують дигідрохлорид 1-(4-хлор-2-фтор-5-метоксифеніл)піперазину та [3(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]оцтову кислоту. Сирий продукт реакції очищають хроматографією на силікагелі (1% - 10% МеОН в CH2Cl2), і одержують 1-[4-(4-хлор-2-фтор-5метоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]етанон у вигляді жовтувато-коричневої твердої речовини (27 мг). 1 H NMR (CDCl3, 400 MHz) δ 8.79 (dd, 0.6H), 8.67 (dd, 0.4H), 8.57-8.55 (m, 1H), 7.31-7.20 (m, 2H), 7.12-7.06 (m, 2H), 6.49-6.45 (m, 1H), 5.45 (s, 0.6H), 5.43 (s, 1.4H), 3.86 (s, 0.9H), 3.85 (s, 2.1 + H), 3.81-3.75 (m, 4H), 3.15-3.08 (m, 4H); LC/MS m/z (M+H) 470.4. Приклад 5 Синтез 1-[(S)-4-(4-хлор-3-метоксифеніл)-2-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанону N O 25 30 35 O N N N H3C NH N N CH3 Cl Названу в заголовку сполуку одержують, дотримуючись протоколу А. Як компоненти сполучення використовують дигідрохлорид (S)-1-(4-хлор-3-метоксифеніл)-3-метилпіперазину та [3-(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]оцтову кислоту. Сирий продукт реакції очищають хроматографією на силікагелі (1% - 8% МеОН в CH2Cl2), і одержують 1-[(S)-4-(4-хлор-3метоксифеніл)-2-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]етанон у вигляді жовтувато-коричневої твердої речовини. 1 H NMR (CDCl3, 400 MHz) δ 8.79 (dd, 0.6H), 8.66 (dd, 0.4H), 8.57-8.55 (m, 1H), 7.29-7.19 (m, 4H), 6.44-6.39 (m, 2H), 5.42 (br. s, 2H), 4.83 (br. s, 0.3H), 4.49 (br. s, 0.3H), 4.30 (br. s, 0.3H), 3.89 (s, 1.2H), 3.88 (s, 1.8H), 3.83 (br. s, 0.3H), 3.72-3.69 (m, 1H), 3.54-3.52 (m, 1H), 3.38 (br. s, 1H), + 3.19-3.15 (m, 1H), 3.00 (br. s, 1H), 2.80 (br. s, 1H), 1.50-1.43 (m, 3H); LC/MS m/z (M+H) 466.4. Приклад 6 Синтез 1-[(S)-4-(4-хлор-2-фтор-5-метоксифеніл)-2-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанону 40 N O O N Cl N N N H3C NH N F CH3 19 UA 99619 C2 5 10 Названу в заголовку сполуку одержують, дотримуючись протоколу А. Як компоненти сполучення використовують дигідрохлорид (S)-1-(4-хлор-2-фтор-5-метоксифеніл)-3метилпіперазину та [3-(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]оцтову кислоту. Сирий продукт реакції очищають хроматографією на силікагелі (2% - 3% МеОН в CH2Cl2), і одержують 1-[(S)-4-(4-хлор-2-фтор-5-метоксифеніл)-2-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанон у вигляді жовтувато-коричневої твердої речовини (29 мг). 1 H NMR (CDCl3, 400 MHz) δ 8.79 (dd, 1H), 8.55 (dd, 1H), 7.27-7.21 (m, 3H), 7.07 (d, 1H), 6.43 (br. d, 1H), 5.46-5.37 (m, 2H), 4.83 (br. s, 0.3H), 4.51-4.48 (m, 0.6H), 4.28-4.21 (m, 0.6H), 3.86 (s, 0.9H), 3.85 (s, 2.1H), 3.79 (br. s, 0.3H), 3.67 (br. s, 0.3H), 3.33-3.21 (m, 2.5H), 2.95-2.93 (m, 0.9H), + 2.83-2.76 (m, 1.6H), 1.48-1.40 (m, 3H); LC/MS m/z (M+H) 484.4. Приклад 7 Синтез 1-[(R)-4-(4-хлор-3-метоксифеніл)-3-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанону N O 15 20 25 O N N N H3C NH N N CH3 Cl Названу в заголовку сполуку одержують, дотримуючись протоколу А. Як компоненти сполучення використовують (R)-1-(4-хлор-3-метоксифеніл)-2-метилпіперазин і [3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]оцтову кислоту. Сирий продукт реакції очищають хроматографією на силікагелі (1% - 7,5% МеОН в CH2Cl2), і одержують 1-[(R)-4-(4-хлор-3-метоксифеніл)-3метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]етанон у вигляді жовтувато-коричневої твердої речовини. 1 H NMR (CDCl3, 400 MHz) δ 8.76 (d, 0.6H), 8.66 (dd, 0.3H), 8.57-8.54 (m, 1H), 7.29-7.19 (m, 4H), 6.48-6.40 (m, 2H), 5.53-5.40 (m, 2H), 4.26 (br. d, 0.6H), 4.00 (br. d, 0.6H), 3.88 (s, 1.3H), 3.86 (s, 1.7H), 3.80-3.49 (m, 3.2H), 3.33 (br. s, 0.6H), 3.17-3.14 (m, 2H), 1.51-1.42 (m, 3H); LC/MS m/z + (M+H) 466.4. Приклад 8 Синтез 1-[(S)-4-(4-хлор-3-метоксифеніл)-3-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанону 30 N O N H3C O Cl 35 40 45 NH N N N N CH3 Названу в заголовку сполуку одержують, дотримуючись протоколу А. Як компоненти сполучення використовують (S)-1-(4-хлор-3-метоксифеніл)-2-метилпіперазин і [3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]оцтову кислоту. Сирий продукт реакції очищають хроматографією на силікагелі (1% - 7% МеОН в CH2Cl2), і одержують 1-[(S)-4-(4-хлор-3-метоксифеніл)-3метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]етанон у вигляді жовтувато-коричневої твердої речовини. 1 H NMR (CDCl3, 400 MHz) δ 8.77 (d, 0.6H), 8.66 (d, 0.3H), 8.57-8.54 (m, 1H), 7.30-7.19 (m, 4H), 6.48-6.40 (m, 2H), 5.54-5.36 (m, 2H), 4.25 (br. d, 0.6H), 4.00 (br. d, 0.6H), 3.88 (s, 1.3H), 3.86 (s, 1.7H), 3.82-3.48 (m, 3.2H), 3.36-3.29 (m, 0.6H), 3.17-3.13 (m, 2H), 1.51-1.43 (m, 3H); LC/MS m/z + (M+H) 466.4. Приклад 9 Синтез 1-[(R)-4-(4-хлор-3-метоксифеніл)-2-метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанону 20 UA 99619 C2 N O N N N H3C O NH N N CH3 Cl 5 10 15 Названу в заголовку сполуку одержують, дотримуючись протоколу А. Як компоненти сполучення використовують (R)-1-(4-хлор-3-метоксифеніл)-2-метилпіперазин і [3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]оцтову кислоту. Сирий продукт реакції очищають хроматографією на силікагелі (1% - 7,5% МеОН в CH2Cl2), і одержують 1-[(R)-4-(4-хлор-3-метоксифеніл)-2метилпіперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]етанон у вигляді жовтувато-коричневої твердої речовини. 1 H NMR (CDCl3, 400 MHz) δ 8.75 (d, 0.6H), 8.66 (dd, 0.4H), 8.57-8.54 (m, 1H), 7.29-7.18 (m, 4H), 6.44-6.39 (m, 2H), 5.42 (br. s, 2H), 4.82 (br. s, 0.3H), 4.45 (br. s, 0.3H), 4.33 (br. s, 0.3H), 3.88 (s, 1.2H), 3.87 (s, 1.8H), 3.83 (br. s, 0.3H), 3.73-3.67 (m, 1H), 3.54-3.52 (m, 1H), 3.38 (br. s, 1H), 3.17+ 3.13 (m, 1H), 2.99 (br. s, 1H), 2.80 (br. s, 1H), 1.50-1.42 (m, 3H); LC/MS m/z (M+H) 466.4. Приклад 10 Синтез 2-(3-(1Н-імідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)-1-((S)-4-(4-хлор-3етоксифеніл)-2-метилпіперазин-1-іл)етанону N O O N N N H3C NH N N CH3 Cl 20 25 30 Названу в заголовку сполуку одержують, дотримуючись протоколу А. У флакон, який містить дигідрохлорид (S)-1-(4-хлор-3-етоксифеніл)-3-метилпіперазину (70 мг, 0,21 ммоль), додають 2(3-(1Н-імідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)оцтову кислоту (51 мг, 0,21 ммоль), HBTU (81 мг, 0,21 ммоль), ДМФА (0,7 мл) і DIPEA (0,15 мл, 0,87 ммоль). Реакційну суміш витримують о при 30 С протягом 24 годин. Розчин розбавляють EtOAc (30 мл) і промивають 1 N HCl (2 × 10 мл) і насич. водн. розчином NaCl (2 × 10 мл). Органічну фазу сушать над MgSO 4 і концентрують у вакуумі. Отриманий залишок очищають препаративною ВЕРХ (градієнт 20 → 95 MeCN-H2O з 0,1% ТФК), чисті фракції ліофілізують, і одержують зазначену сполуку (11 мг, вихід 11%). МС + (ES), передбачається [M+H] 480,2, знайдено 480,5. 1 H NMR (CDCl3, 400 MHz) δ 9.94 (br s, 1H), 8.79 (dd, J = 1.6, 8.0, 1H), 8.55 (dd, J = 1.6, 4.4, 1H), 7.19-7.26 (m, 4H), 6.37-6.43 (m, 2H), 5.40 (br s, 2H), 2.78-4.81 (m, 10H), 4.07 (q, J = 6.8, 2H), 1.46 (t, J = 6.8, 3H). Приклад 11 Синтез 2-(3-(1Н-імідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)-1-(4-(3-(2-фторетокси)-4хлорфеніл)піперазин-1-іл)етанону N NH O N F 35 40 O N N N N Cl У флакон, який містить дигідрохлорид 1-(3-(2-фторетокси)-4-хлорфеніл)піперазину (70 мг, 0,21 ммоль), додають 2-(3-(1Н-імідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)оцтову кислоту (51 мг, 0,21 ммоль), HBTU (83 мг, 0,22 ммоль), ДМФА (0,7 мл) і DIPEA (0,20 мл, 1,2 ммоль). о Реакційну суміш витримують при 20 С протягом 24 годин. Розчин розбавляють EtOAc (30 мл) і промивають 1 N HCl (2 × 10 мл) і насич. водн. розчином NaCl (2 × 10 мл). Органічну фазу сушать над MgSO4 і концентрують у вакуумі. Отриманий залишок очищають препаративною 21 UA 99619 C2 5 ВЕРХ (градієнт 20 → 95 MeCN-H2O з 0,1% ТФК), чисті фракції ліофілізують, і одержують + зазначену сполуку (20 мг, вихід 20%). МС (ES), передбачається [M+H] 484,2, знайдено 484,4. 1 H NMR (CDCl3, 400 MHz) δ 9.94 (br s, 1H), 8.78 (dd, J = 1.2, 8, 1H), 8.55 (dd, J = 1.2, 4.6, 1H), 7.16-7.26 (m, 4H), 6.45-6.53 (m, 2H), 5.44 (s, 2H), 4.77 (dt, J = 4.0, 46.8, 2H), 4.26 (dt, J = 4.0, 26.8, 2H), 3.69-3.78 (m, 4H), 3.10-3.21 (m, 4H). Приклад 12 Синтез 2-(3-(1Н-імідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)-1-((S)-4-(3-(2-фторетокси)-4хлорфеніл)-2-метилпіперазин-1-іл)етанону 10 N O N N N O F NH N N CH3 Cl 15 20 25 У флакон, який містить дигідрохлорид (S)-1-(3-(2-фторетокси)-4-хлорфеніл)-3метилпіперазину (80 мг, 0,23 ммоль), додають 2-(3-(1Н-імідазол-2-іл)-1Н-піразоло[3,4-b]піридин1-іл)оцтову кислоту (51 мг, 0,21 ммоль), HBTU (81 мг, 0,21 ммоль), ДМФА (0,7 мл) і DIPEA (0,2 о мл, 1,2 ммоль). Реакційну суміш витримують при 30 С протягом 24 годин. Розчин розбавляють EtOAc (30 мл) і промивають 1 N HCl (2 × 10 мл) і насич. водн. розчином NaCl (2 × 10 мл). Органічну фазу сушать над MgSO4 і концентрують у вакуумі. Отриманий залишок очищають препаративною ВЕРХ (градієнт 20 → 95 MeCN-H2O з 0,1% ТФОК), чисті фракції ліофілізують, і + одержують зазначену сполуку (14 мг, вихід 13%). МС (ES), передбачається [M+H] 498,2, знайдено 498,4. 1 H NMR (CDCl3, 400 MHz) δ 9.95 (br s, 1H), 8.79 (dd, J = 1.6, 8.2, 1H), 8.55 (dd, J = 1.6, 4.4, 1H), 7.19-7.26 (m, 4H), 6.44-6.50 (m, 2H), 5.40 (br s, 2H), 4.77 (dt, J = 4.2, 47.2, 2H), 4.26 (dt, J = 4.2, 27.2, 2H), 2.78-4.42 (m, 10H). Приклад 13 Синтез 1-[4-(4-хлор-3-метилфеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4b]піридин-1-іл]етанону N O N N N H3C NH N N Cl 30 35 40 У флакон завантажують 2-(3-(1Н-імідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)оцтову кислоту (55 мг, 0,226 ммоль), HBTU (125 мг, 0,33 ммоль), дигідрохлорид 1-(4-хлор-3метилфеніл)піперазину (142 мг, 0,50 ммоль), безводний ДМФА (2,0 мл) і DIPEA (0,5 мл). Флакон о закривають кришкою, нагрівають до 45 С, і вміст перемішують протягом ночі. Наступного дня леткі речовини видаляють у вакуумі, і поділ препаративною ВЕРХ (обернена фаза, градієнт ацетонітрил-вода) дає 1-[4-(4-хлор-3-метилфеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2+ іл)піразоло[3,4-b]піридин-1-іл]етанон. МС (ES), [M+H] знайдено 436,4. Приклад 14 Синтез 1-[4-(4-хлор-3-трифторметилфеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанону N O N F3C N NH N N N Cl 22 UA 99619 C2 5 10 У флакон завантажують 2-(3-(1Н-імідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)оцтову кислоту (55 мг, 0,226 ммоль), HBTU (125 мг, 0,33 ммоль), дигідрохлорид 1-(4-хлор-3трифторметилфеніл)піперазину (170 мг, 0,50 ммоль), безводний ДМФА (2,0 мл) і DIPEA (0,5 мл). о Флакон закривають кришкою, нагрівають до 45 С, і вміст перемішують протягом ночі. Наступного дня леткі речовини видаляють у вакуумі, і поділ препаративною ВЕРХ (обернена фаза, градієнт ацетонітрил-вода) дає 1-[4-(4-хлор-3-трифторметилфеніл)піперазин-1-іл]-2-[3+ (1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]етанон. МС (ES), [M+H] знайдено 490,4. Приклад 15 Синтез 1-[4-(4-хлор-3-трифторметоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанону N O N N N F3CO NH N N Cl 15 20 У флакон завантажують 2-(3-(1Н-імідазол-2-іл)-1Н-піразоло[3,4-b]піридин-1-іл)оцтову кислоту (55 мг, 0,226 ммоль), HBTU (125 мг, 0,33 ммоль), дигідрохлорид 1-(4-хлор-3трифторметоксифеніл)піперазину (177 мг, 0,50 ммоль), безводний ДМФА (2,0 мл) і DIPEA (0,4 о мл). Флакон закривають кришкою, нагрівають до 45 С, і вміст перемішують протягом ночі. Наступного дня леткі речовини видаляють у вакуумі, і поділ препаративною ВЕРХ (обернена фаза, градієнт ацетонітрил-вода) дає 1-[4-(4-хлор-3-трифторметоксифеніл)піперазин-1-іл]-2-[3+ (1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]етанон. МС (ES), [M+H] знайдено 506,4. Приклад 16 Синтез 1-[4-(4-хлор-3-метоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4b]піридин-1-іл]етанону 25 I O N MeO HN CN N Zn(CN)2 Pd2(dba)3 dppf N N N O N MeO N O NH2OH N N N N MeO N NHOH N N N Cl Cl HN Cl NH2 N O O Ac2O, Pd, H2 N MeO N N Cl N NH H O N N MeO N N N N Cl Cl 30 35 Названу в заголовку сполуку одержують із 1-[4-(4-хлор-3-метоксифеніл)піперазин-1-іл]-2-[3йодпіразоло[3,4-b]піридин-1-іл]етанону (див. заявку на патент США, рег. № 11/474132, опубліковану як US 20070010524, включену до даного опису як посилання) відповідно до процедури, подібної до описаної на стадіях 2-5 у прикладі синтезу 1. 1 H NMR (CDCl3, 400 MHz) 10.22 (br, 1H), 8.82 (dd, 1H), 8.56 (dd, 1H), 7.20-7.30 (m, 3H), 7.11 ( (s, 1H), 6.47 (d, 1H), 6.42 (dd, 1H), 5.44 (s, 2H), 3.88 (s, 3H), 3.80 (m, 4H), 3.19 (m, 4H); MS (ES) M+H expect 452.2. Приклад 17 Синтез 1-[4-(4-хлор-3-метоксифеніл)піперазин-1-іл]-2-[3-(1-метил-1Н-імідазол-2іл)піразоло[3,4-b]піридин-1-іл]етанону 23 UA 99619 C2 N N O N N MeO Me N N N Cl 5 10 До розчину 1-[4-(4-хлор-3-метоксифеніл)піперазин-1-іл]-2-[3-(1Н-імідазол-2-іл)піразоло[3,4b]піридин-1-іл]етанону (50 мг, 0,11 ммоль, 1 екв.) у ТГФ додають 60% гідрид натрію (5,7 мг, 0,14 ммоль, 1,3 екв.) і перемішують протягом 1 години, а потім додають йодметан (25,8 мг, 0,16 ммоль, 1,5 екв.). Через 2 години РХМС показує, що головний пік відповідає бажаному продукту, і препаративна ВЕРХ (обернена фаза, градієнт ацетонітрил-вода) дає 1-[4-(4-хлор-3метоксифеніл)піперазин-1-іл]-2-[3-(1-метил-1Н-імідазол-2-іл)піразоло[3,4-b]піридин-1-іл]етанон. + МС (ES), [M+H] знайдено 465,2. Приклад 18 Step 1 HN Cl Cl N Cl NBoc N 95% NaOtBu, Pd2dba3 rac-BINAP, Toluene, 60 oC Cl Cl conc. HCl MeOH, 60 oC NBoc Br MeO Step 3 Step 2 K2CO3, DCM-H2O, ice bath . 2 HCl MeO MeO O NH 92% 93% Step 4 O Cl N Step 5 K2CO3, NaI DMF, 80 oC 97% N O O Cl N N Cl glyoxal trimer hydrate NH4OAc, AcOH, THF-MeOH 50 oC, 58% N N H MeO MeO N I N N N H O o-TolMgCl, THF; then iPrMgCl; then formylpiperidine all at 0 oC 73% N O H Cl N N N N H N N N MeO N H N Step 6 HCl 60% Step 7 N O Cl N N N N N H HCl MeO N о 15 1 – толуол, 60 С, 2 – конц. HCl, 3 – крижана баня, 4 – тример гідрату гліоксалю, 5 – о формілпіперидін, 6 – усе при 0 С; Step - Стадія, DMF - ДМФА, THF - ТГФ, then - потім. Стадія 1. трет-бутил-4-(4-хлор-3-метоксифеніл)піперазин-1-карбоксилат 24 UA 99619 C2 MeO Br + Cl 5 10 15 N 30 35 NaOt-Bu PhMe, 60 ºC 93% N Cl Boc conc. HCl N NH MeO N MeOH, 60 ºC • 2HCl Cl 95% Cl conc. HCl - конц. HCl В 4-л склянку, оснащену мішалкою, завантажують трет-бутил-4-(4-хлор-3метоксифеніл)піперазин-1-карбоксилат (500 г, 1,53 моль, 1, еквів.) і МеОН (1,50 л). При перемішуванні за кімнатної температури протягом 5 хв додають конц. 37% HCl (500 мл, 4 о еквів.). Внутрішня температура піднімається до 40 С, і розчин стає густим з випаданням осаду. о Через 15 хв. суміш нагрівають на плитці до внутрішньої температури 60 С. (Починається о виділення піни, коли суміш нагрівається до приблизно 50 С.) Після 2 годин витримування при 60 о о С розчин охолоджують до кімнатної температури та потім до 5 С у холодильнику. Продукт реакції збирають фільтрацією у дві партії. Кожну партію червоно-коричневого фільтрату промивають EtOAc (2 × 500 мл), і одержують ясно-жовту тверду речовину. Дві партії об’єднують, і одержують продукт (391, 3 г). Фільтрат концентрують до об'єму 300 мл у вакуумі та о о обробляють гарячим (50 С) МеОН (500 мл). Суміш охолоджують до 5 С у холодильнику протягом 24 годин. Отриману речовину, яка випала в осад, збирають фільтрацією та промивають EtOAc (2 ) 200 мл) , і одержують ще 44, 3 г продукту (усього 435, 6 г, вихід 95%). стадія 3. 2-хлор-1-(4-(4-хлор-3-метоксифеніл)піперазин-1-іл)етанон O NH MeO Cl 40 Boc rac - рац У тригорлу 5-л колбу Мортона, оснащену механічною мішалкою, перехідником для газу, нагрівальним кожухом і термометром, завантажують рац-BINAP (4,24 г, 0,005 еквів.) і Pd2(dba)3 (3,20 г, 0,0025 еквів.). Колбу відпомповують і заповнюють азотом. Додають толуол (100 мл) через канюлю. Суміш перемішують за кімнатної температури протягом 15 хв., і одержують пурпурний розчин. Потім додають толуол (2,0 л). Додають в один прийом 2-хлор-5-броманізол (300,3 г, 1,356 моль, 1 еквів.). Додають в один прийом Вос-піперазин (252,4 г, 1 еквів.). Додають в один прийом трет-бутоксид натрію (183,0 г, 1,4 еквів.). Колбу відпомповують і заповнюють о азотом. Потім суміш нагрівають до внутрішньої температури 60 С. Одержують гетерогенну світло-жовтогарячу суспензію. Через 1 годину суміш стає гомогенним коричневим розчином. Ще через 15 годин суміш охолоджують до кімнатної температури. До суміші перемішуючи додають EtOAc (2,0 л). Тверду речовину відфільтровують. Фільтрат промивають EtOAc (100 мл). Об'єднаний фільтрат промивають 10% водн. розчином К2СО3 (1 × 1 л), водою (1 × 1 л) і сушать над MgSO4. Розчинник видаляють у вакуумі, і одержують продукт реакції жовтогарячу тверду речовину (410,3 г, вихід 93%). стадія 2. Дигідрохлорид 1-(4-хлор-3-метоксифеніл)піперазину MeO 25 Boc HN N 20 N Pd2(dba)3 rac-BINAP MeO N • 2HCl Cl K2CO3 CH2Cl2, ice bath 92% O Cl N MeO Cl N Cl ice bath - крижана баня В 3-л колбу, оснащену механічною мішалкою, завантажують дигідрохлорид 1-(4-хлор-3метоксифеніл)піперазину (220 г, 0,73 моль, 1 еквів.), CH2Cl2 (1000 мл) і воду (1000 мл). о Двофазну суміш охолоджують до 5 С на крижаній бані, і до розчину при енергійному 25 UA 99619 C2 5 перемішуванні додають К2СО3 (506 г, 5 еквів.), частинами, для мінімізації виділення піни. Із краплинної лійки додають краплинами розчин хлорацетилхлориду (124,4 г, 1,5 еквів.) в CH 2Cl2 о (100 мл), підтримуючи внутрішню температуру нижче 8 С. Через 1 годину шари розділяють. Водну фазу екстрагують CH2Cl2 (2 × 300 мл), і об'єднані органічні шари сушать над сумішшю Na2SO4/K2CO3 3:1 (додавання K2CO3 допомагає фазі розчину стати прозорою). Після фільтрації фільтрат концентрують у вакуумі, залишок сушать протягом 16 годин у вакуумі, і одержують продукт реакції у вигляді не зовсім білої твердої речовини (410 г, вихід 92%). стадія 6. 7-азаіндазол-3-карбоксальдегід I N N 10 15 20 25 30 35 40 45 o-tolMgCl, THF; then i-PrMgCl; thenN-formylpiperidine CHO N 0 oC 73% N H N H N о-толMgCl2, ТГФ; потім з-PrMgCl; потім N-формілпіперидін В 5-л тригорлу колбу, оснащену цифровим термометром, 1-л краплинною лійкою та механічною мішалкою (весь скляний посуд перед використанням висушують у печі та охолоджують на повітрі протягом 30 хв.), завантажують 3-йод-7-азаіндазол (196,0 г, 0,80 моль) і 1 л безводного ТГФ (із сулії SureSeal від Aldrich, використовують як він є). Тверді речовини повністю розчиняються в ТГФ за кімнатної температури з утворенням темно-коричневого о розчину. Потім колбу охолоджують до -5 С на бані із сумішшю крига/NaCl і з помірним перемішуванням, і додають краплинами 1 М розчин о-толілмагнійхлориду (у ТГФ, 880 мл, 1,1 о о еквів.), зберігаючи внутрішню температуру від -5 С до -3 С (після додавання ~820 мл розчину о-толілмагнійхлориду температура більше не піднімається). Весь процес додавання займає 2 години 25 хв. Після закінчення додавання суміш утворює гомогенний темно-коричневий розчин. Ще через 1 годину додають краплинами розчин ізопропілмагнійхлориду (2М у ТГФ, 480 мл, о 1,2 еквів.), зберігаючи внутрішню температуру
ДивитисяДодаткова інформація
Назва патенту англійською3-(imidazolyl)-pyrazolo[3,4-b]pyridines
Автори англійськоюLi, Lianfa, Pennell, Andrew M.K., Zhang, Penglie
Назва патенту російською3-(имидазолил)пиразоло[3,4-b]пиридины
Автори російськоюЛи Лианфа, Пенел Эндрю М.К., Чжанг Пенгли
МПК / Мітки
МПК: C07D 401/00
Мітки: 3-(імідазоліл)піразоло[3,4-b]піридини
Код посилання
<a href="https://ua.patents.su/37-99619-3-imidazolilpirazolo34-bpiridini.html" target="_blank" rel="follow" title="База патентів України">3-(імідазоліл)піразоло[3,4-b]піридини</a>
Попередній патент: Похідні тетрагідрокарбазолу як ліганди рецепторів, сполучених з g-білком
Наступний патент: Піридилпіперидинові антагоністи рецептора орексинів
Випадковий патент: Іскробезпечне джерело живлення апаратури зв'язку